










Ansvarshavende: Cand. polit John Vabø
Journalist: Gordon Vahle gordon@sciencejournalist.dk
Redaktør
Cand. polit John Vabø Tlf. 39 90 80 00 Dir. 39 48 51 06/39 48 51 07 e-mail: john@vaboe.dk
Redaktionen: Professor, overlæge, dr. med. Sten Madsbad
Artikler, pressemeddelelser, produkt informationer m.v. modtages på e-mail: tina@vaboe.dk, og skal være redaktionen i hænde senest 3 uger før udgivelsestids punktet. Illustrationer, fotos mv. skal leveres som orginalmateriale eller elektronisk som PDF, JPG. Citat tilladt med kildeangivelse.
Abonnement: 4 udgaver (incl. moms): Kr. 240,-



Adresseændringer m.v. bedes mailet til info@vaboe.dk Ved henvendelse bedes abonnements nummer oplyst (otte cifre, påtrykt bag på magasinet).
e-mail: info@vaboe.dk
Kontakt: John Vabø, jv@vaboe.dk Tlf. +45 40 50 80 00
Udgiver: Vabø Publishing ApS Fjordternevej 16 4760 Vordingborg Tlf. 39 90 80 00 ISSN Nr. 0902-1787
Layout og tryk: Stibo Complete

Behandling af type 2 diabetes 5
AF PROFESSOR, OVERLÆGE, DR.MED. STEN MADSBAD

Farmakologisk behandling af hyperglykæmien ved type 2 diabetes 6
AF OVERLÆGE OLE SNORGAARD
Nye type 2 diabetes guidelines fra EASD –hvad er nyt især om vægt og livsstil? 10
AF PROFESSOR, OVERLÆGE DR. MED PETER ROSSING
Ny (og mere) medicin til type 2 diabetes – hvem skal have hvad og hvem skal ikke? 12
AF OVERLÆGE, DR.MED., SENIORFORSKER FREDERIK PERSSON
Den første hjertesvigtsudredning ved type 2 diabetes 14
AF OVERLÆGE DR. MED OG FORSKNINGS LEKTOR (KU) PER LAV MADSEN
Icodec – et basal insulin til administration én gang ugentligt 17
AF PROFESSOR, OVERLÆGE, DR.MED. STEN MADSBAD
Besøg www.cotedor.dk
Ferieboliger i Provence www.cotedor.dk
Igen i år har Temanummeret fokus på type 2 diabetes, hvor behandlingen i disse år ændres hurtigt via publikationerne af store kardiovaskulære endepunktsstudier.
Ole Snorgaard diskuterer de nye retningslinjer for behandlingen af hy perglykæmien. Der fokuseres nu i højere grad på ”organbeskyttelse” i relation til hjertet, herunder hjertesvigt og nyrerne. Hos patienter med klinisk hjertesygdom er metformin nu ikke længere førstevalgs præparat, men der anbefales en GLP-1 receptor agonist eller en SGLT-2-hæmmer. Hvis patienten er i farmakologisk behand ling, bør én af disse tillægges eller erstatte eksisterende behandling, uanset niveau af HbA1c. Ved hjertesvigt anbefales en SGLT-2-hæmmer, og ved diabetisk ny resygdom en SGLT-2-hæmmer, og hvis denne ikke tåles en GLP-receptor agonist. Endvidere er der kommet mere fokus på vægtreducerende behandling, hvor GLP-1 receptor agonisten semaglutid er at fore trække. De næste år vil vi få nye effektive farmaka til behandling af overvægt og derved ofte kunne opnå remission af type 2 diabetes.

Peter Rossing diskuterer de nye Euro pæiske guidelines i relation til vægt og livs stil. Årsagen til den større fokus på vægt tab er, at nye studier har vist, at et vægttab på 10-15 % ofte vil medføre remission af type 2 diabetes. Peter Rossing diskuterer de vigtigste vægttabsstudier. En sund livs stil med fokus på kost og fysisk aktivitet er fortsat en af hjørnestenene i behandlingen af personen med type 2 diabetes.
Frederik Persson tager os med rundt omkring nye kommende lægemidler til at opnå vægttab, samt diskussion af et nyt præparat til behandling af den diabetiske nyresygdom, nemlig finerenone. Finere
none (Kerendia®) har i store endepunkts studier reduceret kardiovaskulær sygdom med 14 % over en 3 års opfølgning og dia betisk nyresygdom med 23 %. Behandlin gen kan tillægges som 3. lægemiddel oven i behandlingen med en ACE hæmmer/ ARB og en SGLT-2-hæmmer.
Det er ofte vanskeligt at stille diagno sen hjertesvigt i den ambulante situation. Omkring 10-30 % af patienter med type 2 diabetes har hjertesvigt. Per Lav Madsen diskuterer, hvordan hjertesvigt opstår på grund af nedsat pumpefunktion, men pro blemet er at forstå, hvad er forklaringen på, at patienter med bevaret pumpefunk tion kan udvikle hjertesvigt. Hjertesvigt er associeret til øget mortalitet. Per Lav Madsen gennemgår hvordan anamnese, objektiv undersøgelse samt brugen af ProBNP og BNP kan benyttes i dagligdagen til at give mistanke om hjertesvigt og henvis ning til kardiologisk afdeling.
I den sidste artikel diskuterer under tegnede insulin Icodec til administration én gang om ugen. Icodec har fordele, da patienten kun skal tage 52 injektioner om året mod i dag mindst 356 injektion med basal insulin. Ulemperne er, at personalet og patienterne skal lære helt nye måder at dosere og at regulere på basal insulin, samt at en dag til dag ændring i den gluko sesænkende effekt ikke er muligt. Håbet med insulin Icodec er at det vil lette initi eringen af insulinbehandling, øge kompli ance og livskvaliteten.
Som tidligere år er der lagt vægt på, at artiklernes indhold i høj grad skal kunne bruges i den daglige klinik til at forbedre behandlingen af personer med diabetes mellitus.
Sten Madsbad
Siden 2011 har Dansk Selskab for Almen Medicinsk (DSAM) og Dansk Endokri nologisk Selskab (DES) haft en fælles retningslinje for den farmakologiske be handling af type 2 diabetes.
På grund af introduktionen af nye læge middelgrupper, som alle er gennemtestet for mulig effekt på risikoen for udvikling og progression af komplikationer og hjer tekarsygdom, er der til stadighed kommet ny evidens, som har nødvendiggjort hyp pige revisioner af retningslinjerne.
Nu er 2022 revisionen udkommet (1) , men allerede kort tid efter udkom den nye version af de internationale guidelines, som er en konsensus rapport fra det euro pæiske (EASD) og det amerikanske (ADA) diabetes selskab (2). De er heldigvis ikke væsentlige forskellige fra de danske, men der er et par ting, som allerede har givet anledning til ekstra revision af retningslin
jerne. I denne artikel er indholdet af denne supplerende revision inkluderet (3)
Der er generel enighed om, at man skal tilstræbe en individuel tilpasset tilgang til den samlede behandling af patienten med type 2 diabetes (figur 1), herunder at alle med type 2 diabetes bør tilbydes hjælp til livsstilsændring. Det vil sige, at det er vigtigt, at patienten tilbydes henvisning til kommunal ’rehabilitering’, som typisk er et samlet forløb med sygdomsuddannelse (’self-management education’), diætvej ledning, fysisk træning og evt. rygestop.
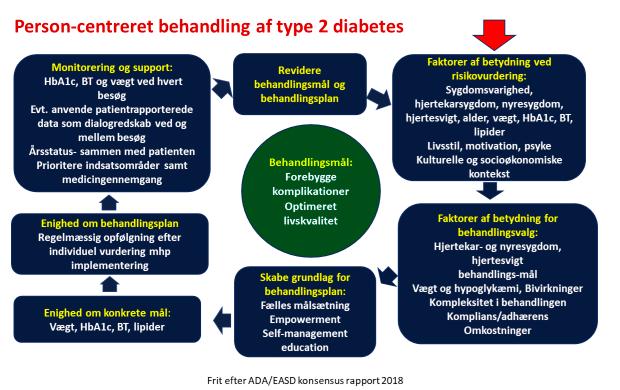
Som det fremgår af figur 1 er det væ sentligt, at der laves en grundig vurdering af patienten, og at der tages højde for eksisterende hjertekarsygdom, kompli kationer eller risikofaktorer i valget af behandling.
I den forbindelse er det i dialogen med patienten vigtigt at sætte fælles mål for øn
sket behandlingseffekt (HbA1c, blodtryk, LDL) og for den svært overvægtige patient med type 2 diabetes tillige at sætte mål for ønsket vægttab.
De vejledende retningslinjer for det valgte mål for HbA1c er følgende:
• HbA1c < 48 mmol/mol
Tilstræbes de første år efter diagnosen. Vigtigt for forebyggelsen af komplika tioner på lang sigt.
• HbA1c < 53 mmol/mol
Senere i forløbet sættes individuelle mål for behandlingen, hvor risikoen for hypoglykæmi opvejes overfor risikoen for mikrovaskulære kom plikationer
• HbA1c < 58 mmol/mol
Svingende glukose, tendens til hypo glykæmi, lang varighed af diabetes og makrovaskulære komplikationer: aggressiv medikamentel behandling af hyperglykæmien med flere lægemidler frarådes.
• HbA1c 58-75 mmol/mol Hos patienter, hvor det primære be handlingsmål er symptomfrihed.
Hos den overvægtige patient er be handlingsmålet størst muligt vægttab:
• Et vægttab på 5-10% vil have gunstig virkning på hyperglykæmien og de øv rige risikofaktorer
• Et vægttab >10% tidligt i sygdommen vil ændre naturhistorien således, at mange kan opnå medicinfri remission.
Farmakologisk behandling af hyperglykæmien
Metformin er forsat det første tidlige valg af farmakologisk behandling med mindre, der er kendt hjertekarsygdom, hjertesvigt eller nyresygdom (Figur 2, B). Evidensen for at anvende glukosesænkende læge midler med såkaldt organbeskyttende effekt er i den situation så stærk, at det ikke må forsinkes af eventuel opstart med metformin.
Har patienten med type 2 diabetes klinisk hjertekarsygdom er behandling med SGLT-2-hæmmer eller GLP-1-receptor agonist (GLP-1-RA) ledsaget af en re duceret dødelighed og lavere kardiova skulær risiko. Førstevalget er således en SGLT-2-hæmmer (Jardiance®, Forxiga®, Invokana®) eller en GLP-1-RA (Trulicity®, Victoza®, Ozempic®, Rybelsus®) med dokumenteret effekt. Ved igangværende farmakologisk behandling bør én af disse tillægges eller erstatte eksisterende be handling.
Er der hjertesvigt med både nedsat
Figur 2. DES/DSAIM’s fælles retningslinjer for behandling af type 2 diabetes. www.endocrinology.dk (3):
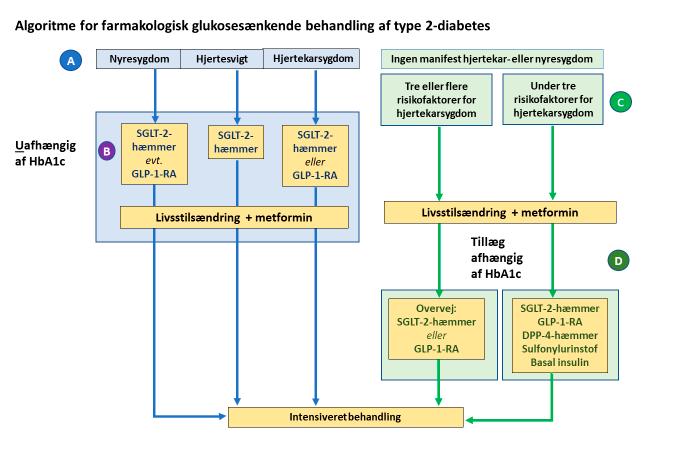
A. Hjertekarsygdom = iskæmisk hjertesygdom, cerebral iskæmi, perifer arteriel insufficiens. Hjertesvigt = både med nedsat og bevaret LVEF. Nyresygdom = nedsat nyrefunktion (eGFR) og/eller albuminuri (> 30 mg/g)
B. Behandlingen er organbeskyttende og uafhængig af HbA1c og må ikke afvente optitrering af metformin, som derfor kan være 2. valget.
C. Kardiovaskulære risikofaktorer: Alder > 60 år; Mandligt køn; Familiær disposition til tidlig debut af kardiovaskulær sygdom (<55 år for mænd, < 65 år for kvinder); Dysreguleret hyper tension > 130/80 mmHg trods behandling; Dyslipidæmi > 1,8 mmol/l trods behandling; Ryg ning > 10 pakkeår
D. 2. valget efter metformin hvis behandlingsmålet ikke kan opnås. Individuel vurdering ba seret på ønsket glukosesænkende effekt, potentiel vægt reducerende effekt (GLP-1-RA og SGLT-2-hæmmer), egen insulinproduktion (mål evt. C-peptid), potentielle bivirkninger, pris og patientens præferencer i øvrigt. Hverken DPP-4-hæmmer, sulfonylurinstoffer eller insulin medfører en øget kardiovaskulær risiko. Anvendelse af pioglitazon er en specialistopgave og er derfor ikke medtaget i figuren.
(<40%) eller bevaret LVEF reducerer behandling med SGLT-1-hæmmer døde ligheden og risikoen for indlæggelse for hjertesvigt. Her er første valget Jardiance® eller Forxiga®. Ved igangværende gluko sesænkende behandling tillægges SGLT2-hæmmer.
Er der nyresygdom med mikroalbu minuri forbygger SGLT-2-hæmmer og GLP-1-RA progressionen af albuminurien, og SGLT-2-hæmmerne forebygger pro gressionen af nyresygdommen, herunder nyresvigt og død.
Der er bedst evidens for denne effekt af SGLT-2-hæmmmer ved klassisk nefropati med makroalbuminuri og ved mikroalbu minuri med eGFR < 60 ml/min, hvorfor behandlingen i den situation bør gives. Der er imidlertid også gunstig effekt ved mikroalbuminuri med normal eGFR samt ved blot eGFR < 60 ml/min med normal albumin udskillelse, hvor behandling med SGLT-2-hæmmer skal overvejes SGLT-2-hæmmerne sænker ikke glu kose nævneværdigt, hvis eGFR< 45 ml/ min, men den nyrebeskyttende effekt er til
stede helt ned til eGFR på 25 ml/min, og det er nu en godkendt indikation.
Man skal være opmærksom på, at eGFR falder ca. 8% i forbindelse med start på SGLT-2-hæmmer, men falder langsom mere efterfølgende sammenlignet med placebo.
Disse klare og meget gunstige virk ninger er uafhængige af lægemidlernes glukosesænkende effekt, og de nye retningslinjer anbefaler således, at organ beskyttende behandling går forud for met formin (Figur 2), hvis patienten har hjerte karsygdom, hjertesvigt eller nyresygdom.
Den positive effekt ses i alle patient grupper, også hos ældre, men her er risi koen for ophør pga. bivirkninger større.
2. valget af glukosesænkende behand ling efter organbeskyttelse vil så være metformin og efterfølgende bør supple rende behandling tilbydes som skitseret nedenfor under ’Glukosesænkende be handling’.
Har patienten ikke hjertekar- eller nyresyg dom, men blot ophobede kardiovaskulære risikofaktorer, er metformin førstevalget, men behandling med GLP-1-RA eller SGLT-2-hæmmer skal overvejes
Er der ikke hjertekarsygdom, hjerte svigt, nyresygdom eller ≥ 3 risikofaktorer er førstevalget metformin, hvorefter den supplerende glukosesænkende behand ling skræddersys afhængig af det fastsatte behandlingsmål (HbA1c) og følgende faktorer:
• den ønskede glukosesænkende effekt
• ønske om vægttab ved overvægt
• egenproduktion af insulin (ved tvivl må les C-peptid og evt. GAD-antistoffer)
• risiko for hypoglykæmi
• risiko for andre bivirkninger
• patientpræferencer i øvrigt
• pris
Her er der ingen ændringer i den nye revi sion af retningslinjerne bortset fra, at evi densen for overvejelsen om at foretrække GLP-1-RA eller SGLT-2-hæmmer ved svær overvægt ikke har samme kliniske betyd ning og styrke som ved hjertekar- eller nyresygdom, og derfor ikke er medtaget i den danske algoritme (Figur 2).
Er der hjertekarsygdom, hjertesvigt eller nyresygdom hos patienter i igangværende farmakologisk behandling, bør man sikre at SGLT-2-hæmmer og/eller GLP-1-RA indgår.
Ved intensivering bør GLP-1-RA er statte evt. DPP-4-hæmmer og insulin er statte evt. sulfonylurinstof (SU).
Der vil således være følgende scenarier: • Metformin + GLP-1-RA kan suppleres med SGLT-2-hæmmer og/eller SU alter nativt basal insulin
• Metformin + SGLT-2-hæmmer kan sup pleres med DPP-4-hæmmer alternativt GLP-1-RA og/eller SU alternativt basal insulin
• Metformin + DPP-4 kan suppleres med SGLT-2-hæmmer og/eller SU alternativt basal insulin, eller DPP-1 kan skiftes til GLP-1-RA inden eventuel senere sup plering
• Metformin + SU kan suppleres med DPP-4-hæmmer eller GLP-1-RA, alter nativt skiftes SU ud med basal insulin inden senere supplering
Svær overvægt
• Sæt mål for vægttab og tilbyd livsstilsin tervention med hypokalorisk kost
• Farmakologisk behandling: Metformin er 1. valg GLP-1-RA og/eller SGLT-2-hæmmer er 2. og 3. valg. GLP-1-RA er ledsaget af op til 5-6 kg’s vægttab og SGLT2-hæmmere 2-3 kg. Den glukosesæn kende effekt størst med GLP-1-RA.
En dobbelt dosis semaglutide (Ozempic®) på 2 mg eller semaglutide (Wegovy®) 2,4 mg ugentlig giver yderligere vægttab, og den nye GIP/GLP-1-RA i pipeline (Tirze patide) giver endnu større vægttab. De 2 sidstnævnte er dog ikke markedsført endnu (november 2022).
DPP-4-hæmmere er vægtneutrale og ofte er den glukosesænkende effekt ikke stor. SU og insulin, især hurtigt virkende, er ledsaget af vægtstigning.
Aftagende betacelle funktion (C-peptid)
Det er ofte relativt slanke patienter med type 2 diabetes, der kan miste insulin produktionen og en del af disse kan i virkeligheden være type 1 patienter (LADA=Latent Autoimmune Diabetes of Adulthood) med initialt bevaret produk tion men med antistoffer, der er karakteri stisk ved type 1.
Behandling med SGLT-2-hæmmer øger glukagon og tendensen til at danne keton stoffer og tilfælde af ketoacidose udløst af SLGT-2-hæmmer ses.
C-peptid sammen med glukose bør måles ved tvivl om diabetestypen eller på
mistanken om faldende insulinproduk tion.
Den mest rationelle behandling vil være metformin (mindsker vægtstigning) og insulin, men er der hjertekar- eller nyre sygdom, bør behandling med den organ beskyttende effekt af SGLT-2-hæmmer eller GLP-1-RA opretholdes.
Vejledt af HbA1c-mål og glukose-moni torering suppleres basal insulin evt. med hurtigtvirkende insulin til måltiderne, som ved type 1 diabetes. Disse patienter vil typisk skulle følges i hospitalsregi
Den skrøbelige ældre eller multisyge patient med type 2 diabetes
Det glykæmiske behandlingsmål bør juste res og medicinen gennemgås regelmæs sigt. Der tages hensyn til risikoen for ud vikling eller progression af mikrovaskulære komplikationer inden for den estimerede restlevetid. Behandling der forbedrer den kardiovaskulære risiko bør så vidt muligt opretholdes vel vidende at behandlingen nogle gange må opgives pga. bivirkninger hos den ældre patient.
Der tages hensyn til aftagende nyre funktion: reduceret dosis/seponering af metformin, aftagende glukosesænkende effekt af SGLT-2-hæmmer under eGFR på 45 ml/min, seponering af SU og dosis reduktion af visse DPP-4-hæmmere ved eGFR < 30.
Risiko for hypoglykæmi: undgå SU og husk dosisreduktion og evt. seponering af insulin hos den småt-spisende patient.
1. Farmakologisk behandling af Type 2-diabetes. Fælles retningslinje fra Dansk Endokrinologisk Selskab (DES) og Dansk Selskab for Almen Medicin (DSAM), 2022. https://vejledninger.dsam.dk/fbv-t2dm/
2. Melanie J. Davies, Vanita R. Aroda, Billy S. Collins, Robert A. Gabbay, Jennifer Green, Nisa M. Maruthur, Sylvia E. Rosas, Stefano Del Prato, Chantal Mathieu, Geltrude Mingrone, Peter Rossing, Tsvetalina Tankova, Apostolos Tsapas and John B. Buse. Management of hyperglycaemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2022, https://doi.org/10.1007/s00125-022-05787-2
3. Dansk Endokrinologisk Selskab (DES) 2022 NBV: Type 2 diabetes. www.endocrinology.dk
~ Se Systembrugervejledningen - SmartGuard -funktionen. Nogen brugerinteraktion er påkrævet
*Sammenlignet med MiniMed™ 670G-systemet.

** En blodsukkermåling (BG) er nødvendig, når du går til SmartGuard™-funktionen. Hvis glukosealarmer og CGM-aflæsninger ikke matcher dine symptomer, så brug en BG-måler til at træffe beslutninger om behandling af din diabetes. Se Systembrugervejledningen - SmartGuard -funktionen. Nogen brugerinteraktion er påkrævet.
† Flere daglige injektioner (3 bolus og 1 basal insulin pr. dag) kræver 28 injektioner om ugen i forhold til et skift af infusionssæt hver anden til tredje dag.
Oplysningerne heri er ikke lægelig rådgivning og bør ikke bruges som et alternativ til at tale med din diabetesbehandler. Diskuter indikationer, kontraindikationer, advarsler, forholdsregler, potentielle bivirkninger og yderligere
I september 2022 kom nye anbefalinger for behandling af hyperglykæmi ved type 2 diabetes fra American Diabetes Asso ciation (ADA) og European Association for the Study of Diabetes (EASD). De nye anbefalinger lægger vægt på at skelne mellem den organbeskyttende effekt af nye lægemidler som SGLT2 hæmmere og GLP1 receptor agonister uafhængigt af deres effekt på blodglukose for at un derstrege vigtigheden af at de anvendes hos personer med type 2 diabetes og ateriosklerotisk hjertekarsygdom uanset blodglukosekontrol og metformin behand ling. Ligeledes er der fokus på at SGLT2 hæmmere anvendes ved hjertesvigt og kronisk nyresygdom ved diabetes og det anbefales at området hvor SGLT2 hæm mere kan anvendes udvides så alle med type 2 diabetes og kronisk nyresygdom (enten eGFR under 60 ml/min/1.73m2, el ler albumuminuri >30 mg/g kreatinin) dog således at jo højere albuminuri jo større risiko og gevinst ved behandlingen.
De nye ADA-EASD er allerede overve jet i den nylige opdatering af de danske behandlingsvejledninger for type 2 dia betes fra Danske Endokrinologisk Selskab som beskrevet af Ole Snorgaard i denne udgivelse på side 6.

I Dansk Diabetes Database (der fra 2023 afløser Dansk Voksendiabetes Data base som regionernes kvalitetsdatabase) er indført nye kvalitetsindikatorer der i tråd med de nye anbefalinger evaluerer om behandlingen implementeres hos dem med hjertekar og nyresygdom. Ingen tvivl om at det har været en udfordring for implementering at for eksempel SGLT2 hæmmere blev indført til behandling af hyperglykæmi og ikke var indicerede ved nedsat nyrefunktion hvor der ikke er ef fekt på blodglukose. Da SGLT2 hæmmere senere blev godkendt til behandling af hjertesvigt og nyresygdom også ved ned sat nyrefunktion hvor der stadig er gavnlig effekt på hjertesygdom og på bevarelse af nyrefunktion uafhængigt af blodglukose effekten.
En anden ny ting er mere fokus på vægttab som middel til remission af dia betes og ikke blot som middel til at opnå et bedre blodglukose niveau i forbindelse med kost, fysisk aktivitet og medicin. Dette har medført at et betydeligt vægttab i sig selv bliver et mål i behandlingen af type 2 diabetes ved betydelig overvægt.
I figur 1 illustrerer at behandlingen har 4 fokusområder. 1) glykæmisk kontrol, 2) vægtkontrol, 3) kontrol af kardiovaskulære risikofaktorer som blodtryk, lipider og rygning, og endelig den hjerte og nyre beskyttende effekt af SGLT2 hæmmere og GLP1 receptor agonister hos personer med iskæmiske hjertekarsygdom, hjer tesvigt, kronisk nyresygdom eller mange risikofaktorer for hjertekarsygdom. Derud over en lang række behandlingsprincipper der bør inkluderes i overvejelserne om behandling, herunder hensyn til psykolo giske og sociale faktorer der kan have stor betydning for valg og implementering af behandling, men også at behandlingsi nerti, altså forsinket optitrering af behand ling, bør undgås.
Baggrunden for det øgede fokus på anbefalingen af vægttab som et mål i sig selv, er nye studier der har vist at man ved vægttab på 10-15% opnået ved enten kostintervention i DiRect studiet, med medicin som høje doser GLP1 receptor agonister og de kommende dual agonister (som GLP1 og GIP-agonisten tirzepatid) eller ved bariatrisk kirurgi, mens man tidli gere typisk så vægttab på 5-10% der godt nok har positiv effekt på den metaboliske kontrol men sjældent fører til remission af diabetes.
I DiRect studiet randomiserede man til en struktureret kostintervention i primær sektoren som efter 1 år havde ført til at 46% var i diabetes remission og 24% havde opnået et vægttab på mindst 15 kg. Efter 24 måneder var det stadig 11% (vs 2% i kontrolgruppen) som havde tabt 15 kg og 36% (vs 3%) var i remission af diabetes (dvs HbA1c under 6.5% uden diabetes medicin).(1)
Medicinsk har man med GLP1 recep tor agonisten semaglutid 2,4 mg pr uge kombineret med livsstilsintervention set vægttab efter 68 uger på 9,6% mod 3,4% i placebo+livsstils gruppen (2). Endnu større effekter så man i SURPASS 2 studiet med dual glukose-afhængig insulinotropisk polypeptid (GIP) og GLP1 receptor ago nisten tirzepatide hvor man så vægttab på 13,1% med den højeste dosis og 36% tabte mindst 15% i vægt, sammenlignet med et gennemsnitligt vægttab på 6,7% med se maglutide 1 mg pr. uge.(3)
Til sammenligning så man med me tabolisk /bariatrisk kirurgi i en 10 års opfølgning af et randomiseret studie til medicinsk behandling, eller Roux-en-Y ga strisk bypass (RYGB), eller biliopancreatisk diversion (BPD) at 37.5% i den kirurgisk behandlede gruppe var i remission mod 5,5% i den medicinsk behandlede gruppe. Det opnåede vægttab efter 10 år var 4,2% i den medicinsk behandlede gruppe mod 29 og 28 % i de to kirurgiske grupper.(4)
En sund livsstil med fokus på kost, motion og rygning har i mange år været en grundsten i behandlingen af type 2 diabetes. I den seneste vejledning er der som vist i figur 2 fokus på flere detaljer udover at fysisk aktivitet er godt, herunder betydningen både styrke og aktivitet, og af at reducere tiden man sidder stille såle des at man hver 30 minut bør aktivere sig. Man har fundet at blot 500 ekstra skridt pr dag er forbundet med 2-9% reduceret risiko for hjertekarsygdom og død. Der anbefales >150 minutter pr uge med fysisk aktivitet med moderat intensitet eller >75
minutter høj intensitets fysisk aktivitet. Der er også anbefaling om at tænke på god søvn. Således anbefales 6-8 timers søvn, optimalt uforstyrret søvn, da afbrudt søvn er forbundet med dårligere risikofak tor profil. Der synes også at være en bedre risikoprofil hos personer som står tidligt op og går tidligt i seng sammenlignet med dem der går sent i seng og sover længe (forskellige kronotyper). Selvom der ikke er randomiserede studier ved diabetes af
disse faktorers betydning på endepunkter som hjertekarsygdom og død, er disse faktorer forbundet med en gavnlig meta bolisk profil.
Interessekonflikter: Peter Rossing har været medforfatter på de nye ADA EASD-anbefalinger. Har til Steno Diabetes Center Copenhagen modtaget honorar og forskningsstøtte fra Astra Zeneca, Bayer og Novo Nordisk, og honorarer for under visning og konsulentfunktion fra Astellas, Abbott, Boehringer Ingelheim, Eli Lilly, Gilead, Merck og Sanofi
1. Lean MEJ, Leslie WS, Barnes AC, Brosna han N, Thom G, McCombie L, et al. Dura bility of a primary care-led weight-manage ment intervention for remission of type 2 diabetes: 2-year results of the DiRECT open-label, cluster-randomised trial. Lancet Diabetes Endocrinol. 2019;7(5):344-55.


2. Davies M, Færch L, Jeppesen OK, Pak seresht A, Pedersen SD, Perreault L, et al. Semaglutide 2·4 mg once a week in adults with overweight or obesity, and type 2 diabetes (STEP 2): a rando mised, double-blind, double-dummy, placebo-controlled, phase 3 trial. Lancet. 2021;397(10278):971-84.
3. Frías JP, Davies MJ, Rosenstock J, Pérez Manghi FC, Fernández Landó L, Bergman BK, et al. Tirzepatide versus Semaglutide Once Weekly in Patients with Type 2 Dia betes. N Engl J Med. 2021;385(6):503-15.
4. Mingrone G, Panunzi S, De Gaetano A, Guidone C, Iaconelli A, Capristo E, et al. Metabolic surgery versus conventional medical therapy in patients with type 2 dia betes: 10-year follow-up of an open-label, single-centre, randomised controlled trial. Lancet. 2021;397(10271):293-304.
Der er sket meget når det gælder farma kologisk behandling af type 2 diabetes over de seneste to decennier. I en under søgelse af hvilke lægemidler personer med type 2 diabetes fulgt i praksis indløste i Københavnsområdet, fandt vi at over 50% var i behandling med SU-præparater (glimepirid, glipizid) i 2001 men i 2015 var dette tal faldet til 15%[1]. En række nye lægemidler og udvikling i guidelines har givet flere muligheder for at skabe individualiseret behandling, i de senere år også med fokus på organbeskyttelse efter at SGLT2-hæmmere og GLP-1 receptor agonister er vist at beskytte mod hjerte-og nyresygdom i højrisikopopulationer.
Men der sker fortsat ny udvikling på området. I den nærmeste tid bliver der introduktion af 3 nye slags lægemidler til behandling af type 2 diabetes, som vil indebære flere værktøjer i værktøjskassen. Det bliver samtidig endnu mere vigtigt at tilpasse behandlingen til hvert individ ud fra komorbiditet og kliniske variable.
Tirzepatid – en spændende kombination af to tarmhormoner

Det meget omtalte nye lægemiddel tirzepatid er en videreudvikling af det velkendte GLP-1 koncept. Her har man kombineret en GLP1 receptor agonist med en GIP (Glucose-dependent insulinotropic polypeptide) recepter agonist, som noget overraskende har vist større effekt på HbA1c og reduktion af vægt sammenlig net med konventionelle GLP-1 receptor agonister. Især er der set store vægttab i de indledende studier, og Eli Lilly søger også en indikation til behandling af svær overvægt. Bivirkningsprofilen synes at ligne GLP-1 receptor agonisterne, muligvis med højere forekomst af kvalme. Det skal bemærkes at der endnu ikke er evidens for at tirzepatid beskytter mod udvikling af hårde kardiovaskulære endepunkter, som det f.eks. er set for liraglutid, dulaglutid og semaglutid. Det vil et igangværende randomiseret studie afgøre. Tirzepatid er
godkendt af myndighederne i USA og EU til behandling af type 2 diabetes, og der har været så stor efterspørgsel efter lan cering i USA at det er svært for firmaet at følge med. Tirzepatid, med handelsnavnet Mounjaro, ventes snart introduceret på markedet i Danmark til behandling af type 2 diabetes. Pris og tilskud er endnu ikke afklaret.
Insulin 1 gang om ugen
Langtidsvirkende insulin til administration 1 gang ugentligt nærmer sig også en rea litet. Novo Nordisk tester for tiden icodec insulin i fase 3 studier hvor man f.eks. sammenligner med de langtidsvirkende basalinsuliner Tresiba og Toujeo. I et af studierne (ONWARDS 5) skriver Novo Nordisk i en pressemeddelelse at icodec efter 52 ugers behandling opnår bedre reduktion af HbA1c end de konventionelle langtidsvirkende basalinsuliner, uden at det giver højere frekvens af hypoglykæmi. Det er endnu ikke helt klart hvornår den nye type insulin bliver introduceret og hvem der vil have gavn af det. Man kan forestille sig at det bliver ud fra brugernes præferencer og at der kommer et kom binationspræparat med semaglutid. Det er også ganske givet at tilskud og pris vil have indflydelse på brugen i Danmark. I aktuelle temanummer diskuteres insulin Icodec mere detaljeret af Sten Madsbad
Fra oktober 2022 er der nu klausuleret tilskud til Kerendia (finerenone) som er et nyt lægemiddel til personer med type 2 diabetes og nyresygdom. Det drejer sig om en non-steroid mineralocorticoid receptor antagonist (MRA) som har en anden profil end de velkendte steroide MRAer spironolakton og eplerenon. Spi ronolakton er velkendt for mange som evidensbaseret behandling ved hjerte svigt, og hyppigt brugt ved levercirrose og
resistent hypertension, men der forelig ger ikke randomiserede studier indenfor kronisk nyresygdom ved type 2 diabetes. Finerenone binder sig med høj affinitet til mineralocorticoid receptoren, men har mindre diuretisk effekt og lavere fore komst af hyperkaliæmi end spironolakton. Gynækomasti forekommer heller ikke ved brug af Finerenone. Der er gennemført to store randomiserede kontrollerede studier indenfor type 2 diabetes og nyresygdom (FIDELIO-DKD[2] og FIGARO-DKD[3]) som i en samlet analyse viste reduktion af kar diovaskulære hændelser inklusive indlæg gelse for hjertesvigt, med 14% over 3 år, svarende til en Numbers Needed to Treat (NNT) på 46. Den sekundære analyse viste en 23% reduktion af nyresvigt (termi nal nyresvigt, fordobling af kreatinin eller nyredød) med en NNT på 60.
Hyperkaliæmi forekom med højere frekvens i den behandlede gruppe end ved placebo, så der vil fortsat være grund til at monitorere dette under behandling, f.eks. ved en opfølgning 4 uger efter op start og derefter regelmæssigt ved kliniske kontroller.
Et hyppigt spørgsmål er om finerenone behandling kan kombineres med GLP-1 receptor agonister eller SGLT2-hæmmere, som mange med type 2 diabetes og ny resygdom vil være i behandling med. I de to nævnte studier var der få procent af deltagerne der var i behandling med disse lægemidler, men efterfølgende analyser har ikke vist problemer med kombinatio nen, snarere end tendens til bedre effekt og færre tilfælde med hyperkaliæmi, men det er som nævnt små grupper[4, 5]
Der er klausuleret tilskud til Kerendia med følgende betingelser: • til behandling af voksne med 2-diabetes og diabetisk nyresyg dom med eGFR ≥25 – <60 ml/min og vedvarende albuminuri albumin/kreatinin-ratio på >30mg/g) trods behandling med de for patienten maksimalt tolerable doser af ACEhæmmer/ARB og SGLT2-hæmmer • Behandlingen skal være iværksat af eller konfereret med en speciallæge i nefro logi eller endokrinologi

Det betyder altså at man kan tilbyde be handling til personer med type 2 diabetes og vedvarende albuminuri over 30 mg/g, efter at man har optitreret ACE-hæmmer eller ARB og startet SGLT2-hæmmer. Det giver således en god mulighed for at individualisere behandlingen og tilbyde yderligere behandling til dem der fortsat er i høj risiko. Dette forudsætter kontrol målinger af urin albumin kreatinin ratio (UACR) som nemt og billigt gøres på en spotprøve, og som i forvejen er den del af
den faste diabeteskontrol. Bemærk at der skal konfereres med specialist, dette kan med fordel gøres med kort telefonopkald til nærmeste specialafdeling.
Personer med type 2 diabetes undrer sig ofte over de mange ordinerede præpa rater til en langvarig udramatisk og ofte asymptomatisk tilstand. Med de mange behandlingstilbud bliver det vigtigt at individualisere behandling efter vurderet risiko for hjertekarsygdom, tidlige tegn på nyresygdom, forventet restlevetid og øv rig komorbiditet. De senere års guidelines har prøvet at bevæge sig væk fra et ensi digt fokus på glykæmisk kontrol for i ste det at anbefale SGLT2i og/eller GLP1 ved tilstedeværelse af manifest kardiovaskulær sygdom. Nogle guidelines har endda anbefalet at de SGLT2i/GLP1 startes før metformin ved samtidig kardiovaskulær sygdom.
En forudsætning for at individualisere behandling er en god karakteristik af per sonen med type 2 diabetes der skal have behandling. Udover overvejelse om alder og økonomi bør man sikre sig viden om:
• Nyrefunktion (eGFR)
• Albuminuri (UACR i mg/g i spoturin)
• Komorbiditet: Har der været AMI, stroke, hjertesvigt?
Disse parametre kan bruges til at indivi dualisere behandlingen, og kombination af eGFR og UACR kan bruges til at vur dere risiko for progression af nyresygdom i den s.k. KDIGO Heat Map (se figur).
Således vil en ukompliceret tilstand uden tegn til nyrepåvirkning og uden kardio vaskulær komorbiditet klare sig med en simplere behandling. Derfor behøver en person med ukompliceret type 2 diabetes ikke også forebyggende antitrombotisk behandling med hjertemagnyl da gavn ikke vurderes større end mulige ulemper. Behov for magnyl kan vurderes nærmere ved at bruge appen Aspirin Guide, som på individuelle informationer vurderer NNT i forhold til NNH – Numbers Ne eded to Harm. På samme måde kan vi vurdere at en person med type 2 diabetes uden kendt hjertesygdom med et LDLkolesterol under 2,5 mmol/l ikke behøver forebyggende behandling med statin. Dog forholder det sig sådan at kun godt 50% af den danske type 2 diabetes popu lation indløser recepter på statiner, hvilket næppe svarer til det reelle behov.
I fremtiden vil der formentlig være yder ligere kliniske parametre og biomarkører der kan bruges til at vælge behandling til eller fra. Der arbejdes indenfor forsknin gen på at inddele type 2 diabetes i sub grupper der afspejler den underliggende patologi og prognose, og der er derudover meget fokus på dyberegående diagnostik ved undersøgelse af peptidmønstre i blod og urin. Det kan meget vel gøre valg af be handling mere kompleks men forhåbentlig kan det også føre til at vi undgår overbe handling og samtidig sikrer mere målrettet behandling og effekt.
Mens vi venter på fremtiden må vi bruge de muligheder vi har for individuali sering af behandling bedst muligt.
Fortsættes side 19
Hjertesvigt (HF) ses hos mellem 10-30% af alle patienter med type 2 diabetes (T2DM), og 30-40% af alle patienter med HF har T2DM (Seferovic et al., 2018). HF er dermed ikke blot blandt de alvorligste men også blandt de hyppigste komplika tioner til T2DM, og HF er ofte den første kardiovaskulære komplikation til T2DM (Birkeland et al., 2020). Prævalensen af klinisk erkendelig HF opgøres i de fleste registre til omkring 1-2%, men metaanalyser af screening-studier udført med ekkokardiografi viser en gennemsnitlig prævalens på 4,2%, hvorfor mange pa tienter fortsat ikke synes at blive opdaget (Groenewegen et al., 2020). I tillæg til alder, er overvægt, hypertension og nyre sygdom og som nævnt DM vigtige risiko faktorer for HF (Ho et al., 2013; Simmonds et al., 2020; Groenewegen et al., 2020) og der er derfor god grund til at være særligt opmærksom på patienter med T2DM. HF er ofte relateret til den signifikant øgede risiko for coronaratheromatose som DM er forbundet med, men HF der ikke er relateret til iskæmisk hjertesygdom (”noniskæmisk cardiomyopati”) er også mange gange øget hos patienter med DM. I nyere Svenske registerstudier viste man at selv ved god kontrol af hypertension og hyper kolesterolæmi vedblev risikoen for indlæg gelse med HF at være signifikant højere hos pt med T2DM end blandt aldersmat chede kontroller (hazard ratio, 1.45; 95% CI, 1.34 to 1.57; Rawshani et al., 2018). Irriterende nok kan HF hos patienter med T2DM være blandt de komplikationer, det kan være sværest at opdage i tide fordi mange HF-symptomer ofte er uspecifikke hos patienter med T2DM.
På baggrund af genese og behandlings muligheder deles hjertesvigt i to former. HF kan ses med svigtende systolisk funk tion af venstre hjertekammer (LVEF<40%; HFrEF) og hjertesvigt med bevaret eller kun let nedsat systolisk funktion af venstre hjertekammer (HFpEF (LVEF>50%) og HFmrEF (LVEF 41-49%)). HFrEF er særlig vigtig at opdage ikke mindst fordi denne
tilstand er associeret med en alvorlig både kort og langtidsprognose, men også fordi hurtig opdagelse og indsættelse af behandling kraftigt bedrer en ellers al vorlig prognose. Langt de fleste patienter med T2DM, der har udviklet HFrEF har samtidigt med T2DM udviklet koronar arteriesygdom med dertil relateret dårlig myokardie-gennemblødning, og ofte tidli gere eller nylige myokardieinfarkter. HF-billedet synes imidlertid at ændre sig over tid. HFpEF udgør nu omkring 50% af alle HF-patienter, og prævalensen af HFpEF er stigende (Owan et al., 2006). HFpEF bliver dermed den fremtidige mest hyppige form for HF i patienter med T2DM. Det er særligt HFrEF, der har alvorlig betydning for præmatur alvorlig sygdom og død, men et hjerte med nedsat relaxation og til sidst egentlig HFpEF er som minimum forbundet med signifikant nedsat livskvalitet inklusive indlæggelser med arytmier og hjertesvigtsymptomer, der kan være meget vanskelige at be handle når først de er manifeste. Nyere hjerte magnetisk resonans undersøgelser fortæller os, at man ved T2DM ser be gyndende stivgørelse af kredsløbet med nedsat relaksation af venstre ventrikel hos en stor del af patienter med T2DM forårsaget af nedsat myokardiegennem blødning (til ofte maksimalt 3-gange mulig øgning hvor det normale er 5-gange mulig øgning) og signifikant myokardiefibrose med tidvis endog egentlige ”fibroseøer” (Figur 1, Madsen PL, 2022; Madsen PL et al., 2022).
Vi kan alle genkende iskæmisk hjertesyg dom og hjertesvigt hos en patient, der længe har haft trykken for brystet og nu må ”sidde op og sove”, men langt de fle ste patienter har færre symptomer, og de almindelige symptomer som dyspnø ses hos mange patienter, der er overvægtige med T2DM. Det kan gøre det til lidt en udfordring at sidde overfor en patient med T2DM og opdage HF, og nogle få objektive håndgreb er gode at kende. At undgå HF hos patienten med T2DM, eller

Figur 1. Gadolinium-kontrast hjerte MRbilleder af fire patienter med T2DM og fibroseøer (hvide pile), der ikke kan relateres til tidligere blodpropper i hjertet da er placeret midt-myokardielt, hvor f.eks. et tidligere AMI ville være placeret sub-endocardielt (Fra Bojer AS et al., 2020).

opdage HF tidligt, vil være forbundet med stor relativ risikoreduktion ved intensiv behandling af risikofaktorer. Jeg vil i denne artikel forsøge kort at gennemgå HF hos patienter med T2DM og pege på de vig tigste anamnesepointer og fund, der hur tigt vil kunne pege på om en patient må mistænkes for HF.
De vigtigste umiddelbare tiltag er en fyldig anamnese særligt med hensyn til brystsmerter og dyspnø, samt EKG og stetoskopi. Ved tvivl vil de første tiltag være røntgenundersøgelse af thorax og para-klinik ofte kombineret med pro-BNP eller BNP (brain natriuretic peptide). Man bemærker sig kendt AMI eller signifikant dyspnø. Dansk Cardiologisk Selskab og Dansk Endokrinologisk Selskab anbefaler at udspørge til kardiovaskulære symptomer som minimum en gang årligt samt holde opmærksomhed på fund af uregelmæssig puls i forbindelse med blodtrykskontrol. Hos alle voksne patienter med DM anbe fales EKG på diagnosetidspunktet, ved kardiovaskulære symptomer og ved fund af uregelmæssig hjertefrekvens. HbA1c og blodtryk måles mindst 3-4 gange årligt.
Ved anamnesen spørger man ind til ”brysttrykken” ved fysisk aktivitet og kulde, men patienter med DM har oftere ukarakteristiske symptomer ved iskæmisk hjertesygdom. Hvis der er tale om uspe cifik brysttrykken i hvile (f.eks. kortvarige ”nåle- eller knivstik” i brystet) med stort tidsmæssigt interval mellem anfald, vil det næppe hidrøre fra iskæmisk hjerte sygdom. Klassisk angina pectoris kendes på den kun sjældent er forbundet med ”egentlig smerte”, – blot en ubehagelig trykken midt i brystet (evt. med udstråling til kæbe eller overekstremiteter), og næ sten altid med samtidig dyspnø. Klassisk angina pectoris forsvinder hurtigt hvis man stopper det fysiske gøremål, eller hvis
man forsøger nitroglycerin, og det vil ofte være en god ide at forsøge nitroglycerin ”diagnostisk” ved at udstyre patienten med en nitrospray og bede patienten teste om det hjælper inden næste gang man ser dem (husk at forklar det er i diagnostisk øjemed, ellers er der mange patienter, der kommer tilbage og med glæde fortæller de ikke har prøvet for ”så slemt har det jo ikke været”). Derefter spørger man ind til dyspnø og her kan det være vanskel ligt hos patienter med T2DM. Mange patienter med T2DM er overvægtige med lavt motionsniveau og vil derfor ofte være svære at vurdere i forhold til om forpustet hed er et tegn på HF, eller blot ”dårlig kon dition”. Her er det vigtigt, om der er sket nylige signifikante ændringer, og særligt vil tegn på ortopnø (forpustethed når man ligger ned) eller bendopnø (forpusthed særligt når man bøjer sig forover) kunne være tegn på HF. Man skal også være op mærksom på nylig vægtøgning, hvor mere end 5 kg over få uger med tegn på væske ophobning vil være et faretegn.
Af objektive undersøgelser er først EKG og stetoskopi vigtige. Ved stetoskopi be mærker man sig dæmpning og signifikant basal stasekrepitation; om hjertefrekven sen er regelmæssig; og om der er mislyde. Signifikante systoliske mislyde over aorta steder og i venstre axil kan være tegn på aortastenose eller mitralinsufficiens, de to hyppigste signifikante venstresidige kla psygdomme. Hjertesvigt (og især HFrEF) kan med stor sandsynlighed udelukkes ved et normalt 12-afledningers EKG. Et normal EKG havde i en nylig opgørelse en 99,3% negativ prædiktiv værdi for at udelukke HFrEF eller symptomløs LVEF <40% (Gregers et al., 2022). Det er de to former for HF, det er vigtigst at opdage, da prognosen her er dårligst og ”der er mest at vinde” ved rettidig HF-behandling. Man
skal være særlig opmærksom på venstre sidigt grenblok, patologisk Q-tak i flere afledninger og atrieflimren eller venstre ventrikel hypertrofi med ST-T-abnormitet. Rtg af thorax kan vise stase eller enddog pleuraeffusion, men kan sagtens være upåfaldende ved milde former af HF.
Den største udfordring er patienter, som har mindre oplagte tegn, men hvor anamnesen alligevel kunne give mistanke om HF. Tilstedeværelse af blot én af de ovenfor angivne markører give generelt indikation for henvisning til kardiologisk vurdering med transthorakal ekkokardio grafi, men ved tvivl vil man ofte kunne hjælpes af måling af biomarkører for HF, hvor pro-BNP og BNP (brain natriuretic peptide) er de bedst etablerede. De natriuretiske peptider frigøres fra atrier og ventrikler i forbindelse med stress og stræk og stiger derfor ved tegn på HF. ESC og ACC/AHA/HFSA guidelines fra hhv. 2021 og 2017 taler for at risikostratificere patienter med pro-BNP eller BNP for at identificere de, der er i risiko for at udvikle HF eller har udviklet HF og under alle om stændigheder vil profitere af kardiologisk vurdering for at iværksætte tidlig medicin optimering (McDonagh et al., 2021). Man kan på baggrund af pro-BNP eller BNP udelukke HF eller sandsynliggøre det, men det er endnu sådan at flere forhold kan påvirke biomarkørerne og man derfor ikke benytter dem som screeningsredska ber. Hazard ratio for hver 1-SD-øgning i pro-BNP for HF indenfor en 5-årig periode er 3,06 for proBNP, en sammenhæng, der ikke sikkert kan erkendes for troponin el ler inflammations-markører som IL-6 eller high-sensitive CRP (Ohkuma et al., 2017). Grænseværdierne for udelukkelse af hjer tesvigt ligger dog fortsat inden for normal området hos patienter over 50 år, så hvis man tester mange patienter, vil en stor del
have værdier over grænsen uden at have HF, så det er fortsat vigtigt at man i tillæg til måling af pro-BNP eller BNP kombinerer med ovenstående.
Værdier for pro-BNP og BNP angives i pg/mL eller pmol/l og mange studier har forsøgt at opstille sikre “cut-off points” for at definere HF. For ambulante patienter an giver Bozkurt et al. (2021) cut-off værdier for BNP og NT-proBNP på henholdsvis 35 and 125 pg/mL, men normalværdier er relateret til alder, idet 95%-percentilen for øvre normalgrænse stiger med alder (Jørgensen et al., 2022). Samlet kan man kort sige, at en værdi i normalområdet (for alder) udsiger en god prognose, og at en værdi lavt i normalområdet (for alder) med stor sikkerhed udelukker HF. Der eksisterer nogle faldgruber hos patienter med T2DM som det her er vigtigt at nævne. DM burde i sig selv ikke være et problem, men det kan hos patienter med svær overvægt være et problem, at man kan måle falsk lave værdier. Hos patienter med BMI>3035 kg/m2 skal man derfor mistænke HF selv ved værdier, der er 50% lavere end grænseværdierne hos patienter med la vere BMI. Omvendt kan man se forhøjede værdier hos patienter med e-GFR<60 ml/ min uden at det i sig selv med sikkerhed kan tilskrives HF. En patient med T2DM og åndenød og nogen grad af COPD og nærnormal vægt og normal e-GFR vil derfor kunne siges primært at have åndenød fra sin COPD ved en lav BNP eller pro-BNP. Omvendt vil en værdi >2-3 gange øvre normalgrænse for en af de to biomarkører tale kraftigt for at patienten har HF, og han/ hun foreslås under alle omstændigheder henvist til ekkokardiografi. Man vil se for højede værdier både ved HFrEF og også ved HF med nær-bevaret eller bevaret EF. I det store grænseområde herimellem stiger risikoen for HF, og man vil stå sig ved enten at konferere med speciallæge i kardiologi eller blot henvise direkte til ekkokardiografi ved tvivl (Jørgensen et al., 2022).
Den glukose-sænkende behandling, der initialt blev indført som behandling af T2DM kunne ikke i store studier alvor ligt reducere risikoen for HF, og det var primært – bl.a. med baggrund i STENO2 studierne – signifikant blodtryksreduktion og kolesterolnedsættende behandling, der bedrede prognosen. Og det har i høj grad været i form af at det hindrede athe rosclerose og dermed iskæmisk HF, altså HF forårsaget af hjerteiskæmi og AMI. For patienter med DM uden kendt hjerte karsygdom og uden øvrige risikofaktorer er behandlingsmålet en LDL-kolesterol <2,6 mmol/l (og mindst 50% reduktion fra baseline), mens det for patienter med do
kumenteret iskæmisk hjertesgydom eller symptomatisk perifer atherosclerose eller cerebral iskæmi (TIA)/iskæmisk apopleksi, hvor ultralyd af halskar har vist signifikant plaque) nu anbefales at søge at trykke LDL <1,4 mmol/l (og mindst 50% reduk tion fra baseline) med statin (f.eks. 80 mg atorvastatin) og evt. ezetemibe. Primær profylakse med acetylsalicylsyre anbefales ikke længere til patienten med DM uden iskæmisk hjertesgydom, men man vil til patienter med iskæmisk hjertesygdom el ler med meget høj risiko for dette (mikro albuminuri/nefropati) fortsat anbefale 75 mg acetylsalicylsyre dagligt.
GLP1 receptor agonister (liraglutid, semaglutid og dulaglutid) og SGLT2hæmmere (empagliflozin, dapagliflozin og canagliflozin) har begge højt potentiale for at nedsætte den HF i diabetespopula tionen, der ikke kun hidrører fra iskæmisk hjertesygdom og som nu tyder på at være og blive den mest hyppige årsag til HF blandt patienter med T2DM. Det bliver i de næste år interessant at se hvad de ny ligt introducerede vigtige anti-diabetika og vægttabsmidler vil gøre for udviklingen af den diabetiske hjertesygdom blandt andet forårsaget af høje blodsukre med nedsat gennemblødning og fibrose af hjertemu skulaturen (Lav Madsen, 2022; Lav Mad sen et al., 2022). Ved klinisk hjertekar sygdom er der allerede god evidens for, at behandling med SGLT-2-hæmmer eller GLP-1 receptor agonister sænker mor taliteten og den kardiovaskulære risiko. SGLT-2-hæmmere reducerer risiko for ho spitalisering for HF, især ved HFrEF og HF pEF med EF<60% men også i mindre grad blot ved kendt anden kredsløbssygdom. En SGLT-2-hæmmer eller GLP-1 receptor agonist foretrækkes derfor umiddelbart efter metformin uafhængig af individua liseret HbA1c mål. Især behandling med SGLT-2 hæmmer har stor betydning for CVD-relateret risikoreduktion hos patien ter med sendiabetiske nyrekomplikationer, og SGLT-2-hæmmere er nu også standard behandling ved HFrEF hos patienter uden DM. Ved HF eller risiko for dette, bør man derfor primært vælge en SGLT-2-hæmmer.
Birkeland KI, Bodegard J, Eriksson JW, et al. Heart failure and chronic kidney disease mani festation and mortality risk associations in type 2 diabetes: a large multinational cohort study. Diabetes Obes Metab. 2020;22(9):1607-18.
Bojer AS, Hansen KB, Egstrup K, et al. Diabetes og hjertesygdom. DCS Behandlingsvejledning, maj 2022.
Bojer AS, Sørensen MH, Vejlstrup N, et al. Distinct non-ischemic myocardial late gado linium enhancement lesions in patients with type 2 diabetes. Cardiovasc Diabetol. 2020 Oct 22;19(1):184.
Bozkurt B, Coats AJS, Tsutsui H, et al. Universal definition and classification of heart failure: A report of the Heart Failure society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Univer sal Definition of Heart Failure. J Cardiac Fail. 2021;27(4):387-413.
Goetze JP, Bruneau BG, Ramos HR, et al. Cardiac natriuretic peptides. Nat Rev Cardiol; 2020;17:698-717.
Gregers, M. C. T., Schou, M., Jensen, M. T. et al. Diagnostic and prognostic value of the elec trocardiogram in stable outpatients with type 2 diabetes, dec. 2022, I: Scandinavian Cardiova scular Journal. 56, 1, s. 256-263 8 s., 2095435.
Groenewegen A, Rutten FH, Mosterd A, Hoes AW. Epidemiology of heart failure. Eur J Heart Fail. 2020;22(8):1342-56.
Ho JE, Lyass A, Lee DS, et al. Predictors of newonset heart failure: differences in preserved versus reduced ejection fraction. Circ Heart Fail. 2013;6(2):279-86.
Jørgensen PG, Løgstrup BB, Pedersen CK, et al. Praktisk brug af natriuretiske peptider ved mis tanke om hjertesvigt i primær- og sekundærsek torerne. Ugeskr Læger 2022;184:V04210380.
Madsen PL. Biomarkers of myocardial fibrosis in diabetes, echocardiography, and magnetic resonance imaging. In Biomarkers in Diabetes. Eds. Patel VB, Preedy VR. Nature Springer Ver lag 2022a. p. 821-47.
Madsen PL, Bojer AS, Sørensen MH, Gaede P. MR-skanning af diabetisk kardiomyopati. Uge skr Læger 2022b;184:V04220237.
McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treat ment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2021;2:hea368.
Ohkuma T, Jun M, Woodward M, et al. Cardiac stress and inflammatory markers as predictors of heart failure in patients with type 2 dia betes: The ADVANCE Trial. Diabetes Care. 2017;40(9):1203-9.
Owan TE, Hodge DO, Herges RM, et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med. 2006;355(3):251-9.
Rawshani A, Rawshani A, Franzén S, et al. Risk factors, mortality, and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med. 2018;379(7):633-44.
Seferović PM, Petrie MC, Filippatos GS, et al. Type 2 diabetes mellitus and heart failure: a position statement from the Heart Failure Asso ciation of the European Society of Cardiology. Eur J Heart Fail. 2018;20(5):853-72.
Simmonds SJ, Cuijpers I, Heymans S, Jones EAV. Cellular and molecular differences bet ween HFpEF and HFrEF: a step ahead in an improved pathological understanding. Cells. 2020;9:1.
Wendelboe Nielsen O, Kjær Pedersen C, Godsk Jørgensen P, et al. Brain Natriuretic Peptide (BNP) ved hjertesvigt. DCS Holdnings papir, maj 2022.

De basale insuliner, vi benytter i dag, skal administreres 1-2 gange dagligt (detemir (Levemir®), glargin (Lantus®, Semglee®)), og har en varighed på 18-24 timer, kor test for Levemir®. Eller én gang i døgnet (glargin 300 enhed/ml (Toujeo®) eller degludec 100 enheder/ml eller 200 enhe der/ml (Tresiba®)), der har en varighed på henholdsvis omkring 30 timer og 42 timer. Hvilket for de to sidstnævnte insuliner medfører, at det normalt anbefales, at der skal gå 2-3 dage efter dosisændring før en ny ligevægt i den glukosesænkende effekt er opnået. Det er baggrunden for, at der kun bør ændres på dosis af Toujeo® eller på Tresiba® med f.eks. 3-6 dages interval.
Type 1 patienter, der f.eks. har veks lende fysisk aktivitet fra dag til dag, er ofte glade for Levemir® 2 gange i døgnet, hvor der kan ændres på insulindosis fra dag til dag, f.eks ved at tage en mindre dosis levemir om morgenen på dage med øget fysisk aktivet.
Type 2 diabetespatienten har en mere stabil glukoseregulation end type 1 dia betespatienten, og det er sjældent, at der ændres væsentligt på insulindosis, når den glykæmiske kontrol er indstillet. For type 2 diabetespatienten er Toujeo® eller Tresiba® et ideelt insulin, da de reducerer risikoen for hypoglykæmi sammenlignet med glar
gin (Lantus®), bl.a. på grund af den flade insulinprofil, og den lille variabilitet fra dag til dag i den glukosesænkende effekt.
Det er sjældent, at type 2 diabetespa tienten er begejstret for at initiere insulin behandling. Risikoen ved behandlingen er hypoglykæmi, vægtstigning, og regimet er mere kompleks end blot at skulle tage tabletter dagligt eller en GLP-1 receptor agonist én gang om ugen. Kompliance til insulinbehandlingen er ikke sjælden dår lig, hvor injektioner glemmes, hvilket fører til dårlig glykæmisk kontrol. Ovennævnte medfører, at type 2 diabetespatienten ofte kommer sent i gang med insulinbehand ling (klinisk inerti) og har været dysregule ret i længere tid.
Vi ved fra behandlingen med GLP-1 receptor agonister, at kompliance og til fredsheden med behandlingen er bedre for agonister, der doseres én gang ugent ligt end med de agonister, der doseres dagligt.
Gennem de senere år har Novo Nordisk gennemført et fase 3 udviklingsprogram omkring insulin Icodec, der skal admini streres én gang om ugen, således, at pa tienterne kan nøjes med 52 injektioner om
Figur 1 viser at den glukosesænkende effekt er i ligevægt ca. 3-4 uger efter opstart af insulin el ler dosisændring mens ligevægten er opnået 2-3 dage efter initiering af glargin.

året i modsætning til dag, hvor patienten skal tage som minimum 356 injektioner årligt.
Insulin Icodec har en halveringstid på 196 timer, og er derfor velegnet til dose ring én gang om ugen. Icodec er en insulin analog, hvor der er påsat en fedtkæde på det modificerede insulinmolekyle, hvilket medfører, at insulin bindes til albumin, hvorfra det efterfølgende frisættes til blodet og vævene, og derved opnås den lange halveringstid. Insulin Icodec er kon centreret i opløsningen, således er der 700 enheder insulin/ml, mod de sædvanlige 100 enheder/ml (dog 300 enheder/ml for Toujeo®, og 200 enheder/ml for Tresiba® 200).
Insulin Icodec har både fordele og ulemper, som diskuteret nedenfor. Pa tienten og sundhedspersonalet skal lære at dosere insulin på en ny måde, hvilket kræver undervisning.
Når Icodec initieres eller der justeres på dosis, varer det 3-4 uger, før der opnås li
gevægt i den glukosesænkende effekt. Se figur 1, hvor der er foretaget en matema tisk modellering af den glukosesænkende effekt af både Lantus® hvor ligevægten er opnået efter 2-3 dage, men først efter 3-4 uger med Icodec. Den lange halveringstid kan være et problem f.eks. i situationer, hvor personen spiser mindre, hvor det vil tage 1-2 uger før den glukosesænkende effekt er signifikant reduceret, når Icodec pauseres.
På grund af den lange halveringstid er den glukosesænkende profil fladere end for de aktuelle insuliner, men der ses dog nogen peak effekt 2-4 dage efter injek tionen, hvor risikoen for hypoglykæmi formentligt vil være størst.
Hvordan initieres og justeres på insulin Icodec?
Figur 2 viser den strategi for initiering af insulin Icodec, der blev benyttet i ON WARDS fase 3 programmet. Strategien
blev udviklet via fase 2 programmet, hvor flere doseringsstrategier blev afprøvet.
Hos den ikke insulinbehandlede patient fortsættes behandlingen med perorale antidiabetika og GLP-1 receptor agonist, dog anbefales ikke at fortsætte med sulfonylurinstof pga. risikoen for svær hypoglykæmi. SGLT2 inhibitor og GLP-1 receptor agonist behandling seponeres som anført ikke pga. af deres organbeskyt tende (hjerte og nyrer) effekt. Metformin reducerer insulindosis, og har en mindre vægttabseffekt.
Mod normalt at starte med f.eks. 10 en heder af basal insulin dagligt, startes med 70 enheder Icodec, dog gives der 140 enheder som første dosis (figur 2).
For patienten, der allerede er i behand ling med basal insulin, f.eks. 20 enheder dagligt, initieres med (20 enheder x 7) 140 enheder + 50 % ekstra svarende til første dosis (hos type 1 patienten + 100 %).


Der justeres på Icodec én gang om ugen. Der måles fasteblodglukose de sidste tre dage før injektion af Icodec, og der juste res ved et gennemsnitsblodglukose over 7.2 mmol/l med en øgning på 20 enheder af dosis (figur 3). Er én af de 3 fasteblod glukoser under 4.4 mmol/l reduceres do sis med 20 enheder. Ved et gennemsnits blodglukose på mellem 7.2 -4.4 fortsættes med aktuelle dosis. Til sammenligning er også i figur 3 vist hvordan insulin degludec eller glargin blev justeret i ONWARDS programmet.
Resultaterne fra ONWARDS fase 3 programmet
I alt 6 studier indgik i fase 3 programmet, hvoraf de 5 blev udført i type 2 diabetes patienter og et studie i patienter med type 1 diabetes. I type 2 patienterne blev in sulinbehandling initieret i 3 studier, mens i 2 af studierne var patienterne allerede i insulinbehandling, hvor der blev skiftet til Icodec (figur 4).
Resultaterne i type 2 diabetespa tienterne viste samme eller lidt større reduktion i HbA1c med Icodec, mens risikoen for hypoglykæmi ikke var forskel lig fra den, der sås ved sammenligningen med degludec og glargin. Der synes dog numerisk at være en større risiko for hypoglykæmi med Icodec, men HbA1c tenderede også til at være lavere i denne gruppe.
Figur 3 viser et forslag til justering af insulin Icodec ved hjælp af måling af fasteblodglukose de sidste tre dage før injektion af Icodec én gang om ugen. Til sammenligning er vist de samhø rende dosisændringer af degludec (Tresiba®).
I et enkelt studie (ONWARDS 4) blev Icodec sammenlignet med degludec i patienter med type 2 diabetes behandlet med basal-bolus terapi i form af hurtigtvir kende insulin før måltider og basal insulin éngang i døgnet. Reduktionen i Hba1c og
Figur 4 viser resultaterne fra ONWARDS fase 3 programmet. I ONWARDS 4, der er ikke vist i figur 4 blev Icodec sammenlignet med insulin degludec hos type 2 diabetespatienter behandlet med basal-bolus terapi, fandtes ingen forskel i reduktionen i HbA1c og risikoen for hypoglykæmi mellem de to insuliner.
risikoen for hypoglykæmi var ikke forskel lig i de to grupper.
I ONWARDS 6 blev type 1 diabetespa tienter behandlet basal-bolus terapi Icodec sammenlignet med degludec. Reduk tionen i HbA1c var ikke forskellig i de to grupper men risikoen for hypoglykæmi var signifikant større i Icodec gruppen.
Insulin Icodec er et interessant nyt insulin koncept, hvor den store fordel er de få injektioner (52 vs. 356 om året) sammen lignet med de aktuelle basale insuliner. Håbet er, at det kan lette initieringen af insulinbehandling ved specielt type 2 diabetes, samtidig med at kompliance og livskvaliteten forbedres. Der var i ON WARDS studierne ikke nogen klinisk rele vant forbedring af HbA1c sammenlignet med degludec og glargin, hvilket heller ikke kunne forventes med det design, der er benyttet, hvor der titreres til samme fa steblodglukose i grupperne. Det er i over ensstemmelse med retningslinjer fra FDA (Food and Drug Administration) omkring registreringsstudier for basal insulin. FDA foreslår at basale insuliner skal evalueres ved samme HbA1c med henblik på at kunne evaluere risikoen for hypoglykæmi.

I de fleste ONWARDS studier var der ingen klinisk relevant forskel på risikoen for hypoglykæmi, om end der var en ten dens til numerisk flere med Icodec. Icodec har en meget flad virkningsprofil og færre hypoglykæmier skulle forventes. Forklarin gen er måske, at insulinet blev optitreret én gang om ugen inden den glykosesæn kende effekt var i ligevægt (se figur 1).
Ulempen ved insulinet er, at det kræver oplæring af personalet, der behandler diabetes. Der er risiko for fejl på grund af doseringsalgoritmen, der er væsentlig for skellig fra den, der normalt anbefales, hvor det basale insulin justeres med 2-7 dages interval, og hvor helt andre daglige doser benyttes.
Et andet problem er ved sygdom med nedsat fødeindtagelse, hvor justering af den glukosesænkende effekt ikke kan opnås fra dag til dag, og først vil ses efter 1-2uger ved pause med Icodec injektioner.
Den ideelle patient til behandling med Insulin Icodec synes at være type 2 diabe tespatienten med en stabil glukosekontrol uden de store variationer i blodglukose fra dag til dag og hvor dosis er relativ kon stant. Den fysisk aktive person med type 1 diabetes, vil ofte foretrække et korttidsvir kende basal insulin, der administreres 1-2 gange i døgnet, og hvor en dosisændring derved også ændrer den glukosesæn kende effekt samme dag.
Insulin Icodec vil formentligt blive ind sendt til regulatorisk godkendelse i EU i 2023.
Det skal nævnes, at E Lilly aktuelt er ved at udvikle et langtidsvirkende basal insulin med en T½ på 17 dage.
Aktuelt er ingen af ONWARDS 3 studierne publiceres i peer reviewed tidsskrifter, og aktu elle artikel bygger på ”press releases” fra Novo Nordisk den 2. april 2022, 3. juni 2022, 29. juli 2022, 3. oktober 2022 (kan findes på NN hjemmeside) og præsentationer ved møder og kongresser.
Fortsat fra side 13



1. Heinrich NS, Kriegbaum M, Grand MK, Lind BS, Andersen CL, Persson F: Biochemical profiling, pharmacological management and clinical outcomes in type 2 diabetes in Danish primary care from 2001 to 2015 Prim Care Diabetes 2022, 16(6):818823.
2. Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, Kolkhof P, Nowack C, Schloemer P, Joseph A et al: Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes N Engl J Med 2020, 383(23):2219-2229.
3. Pitt B, Filippatos G, Agarwal R, Anker SD, Bakris GL, Rossing P, Joseph A, Kolkhof P, Nowack C, Schloemer P et al: Cardiovascu lar Events with Finerenone in Kidney Disease and Type 2 Diabetes N Engl J Med 2021, 385(24):2252-2263.
4. Rossing P, Filippatos G, Agarwal R, Anker SD, Pitt B, Ruilope LM, Chan JCN, Kooy A, McCafferty K, Schernthaner G et al: Finere none in Predominantly Advanced CKD and Type 2 Diabetes With or Without Sodium-Glucose Cotransporter-2 Inhibi tor Therapy Kidney Int Rep 2022, 7(1):3645.
5. Rossing P, Agarwal R, Anker SD, Filippatos G, Pitt B, Ruilope LM, Fonseca V, Umpierrez GE, Caramori ML, Joseph A et al: Finerenone in patients across the spectrum of chronic kidney disease and type 2 diabetes by glucagon-like peptide-1 receptor agonist use Diabetes Obes Metab 2022.

insulininjektioner, så de let kan deles digitalt med patientapps og kliniksystemer. Det giver et mere nøjagtigt billede af, hvordan patienternes injektionsadfærd påvirker blodsukkeret. Og det baner vejen for en mere individuel behandling, hvor du kan træffe beslutninger på basis af præcise injektionsdata.

penne kan gøre for dine patienter og dig. Scan QR-koden med din mobil eller læs mere på pro.novonordisk.dk/smartpen
