
71 minute read
5.3 De vloeibare biopsie: komt een bloedtest voor kanker dichterbij?
Symptomen, diagnose en prognose
in principe na een succesvolle behandeling een lagere waarde. Als de tumormerker (bijvoorbeeld PSA) langere tijd na de behandeling weer begint te stijgen, kan dat een aanwijzing zijn dat de kanker teruggekeerd is.
5.3 De vloeibare biopsie: komt een bloedtest voor kanker dichterbij?
Tumormerkers hebben alleszins een heel groot potentieel om de vroege diagnose van kanker te verbeteren. Verschillende studies onderzoeken of er via een eenvoudige bloedafname routinematig getest kan worden of een persoon al dan niet kanker heeft, en indien positief, welk type kanker dan aanwezig is. Tumormerkers zullen zo de komende jaren veel terrein winnen op het vlak van vroegopsporing en ze krijgen wellicht een prominente rol in dit domein. In deze paragraaf willen we deze vooruitgang toelichten aan de hand van een snel evoluerende techniek om kanker in het bloed van een patiënt op te sporen.
Het idee achter deze manier van vroege opsporing is de detectie van ‘circulerende tumorcellen’ of ‘circulerend tumorDNA’ in een bloedstaal van de patiënt. De meeste tumoren hebben de neiging om al in een vroeg stadium kankercellen ‘los te laten’, die vervolgens in de bloedbanen terecht komen en later aan de oorsprong kunnen liggen van metastasen ergens anders in het lichaam. Deze tumorcellen blijven een periode circuleren (ook vóór ze potentieel een metastase vormen), vandaar de naam ‘circulerende tumorcellen’ of afgekort ‘CTC’. Dit betekent dus dat een kankerpatiënt al in een heel vroeg stadium (vóór het optreden van symptomen) CTC’s in het bloed heeft en dat die in principe detecteerbaar zijn via een bloedafname. Alleen was de technologie om zeer lage aantallen in een bloedstaal te detecteren tot voor kort nog niet voorhanden. Er kan ruwweg gesteld worden dat er tientallen tot zelfs honderden CTC’s aanwezig moesten zijn in een standaard bloedstaal (een tube van 7,5 milliliter) om deze te kunnen opsporen in het laboratorium. Dergelijke grote aantallen wijzen echter meestal al op een kanker in een vergevorderd stadium, wat het nut van dergelijke test volledig tenietdoet. De laatste jaren zijn de technologieën voor bloedanalyse echter zo veel verbeterd, dat er nu testen ontwikkeld kunnen worden om slechts enkele CTC’s op te sporen in een bloedstaal. Terwijl het opsporen van CTC’s in een bloedstaal vroeger vergeleken kon worden met het zoeken naar een speld in een hooiberg, wordt dit dankzij de nieuwe hoogtechnologische opsporingsmethoden steeds meer haalbaar. In dezelfde beeldspraak kan gesteld worden dat de hooiberg rond de speld wordt weggebrand of dat de speld met sterke magneten uit de hooiberg wordt getrokken. In ieder geval: de speld wordt gevonden.
Naar analogie hiervan wordt ook onderzoek verricht naar de detectie van ‘circulerend tumor-DNA’ of afgekort ‘ct-DNA’ in het bloed. Tumoren ‘lekken’ vaak DNA, soms vanuit een levende kankercel, maar meestal omdat de kankercel afsterft en ze DNA vrijgeeft in
115
116
Hoofdstuk 6
de omgeving. Dat tumor-DNA komt vervolgens in de bloedcirculatie terecht en is daardoor ook op te sporen in een bloedstaal. De technieken om ct-DNA in lichaamsvloeistof op te sporen, staan op punt. Het is vandaag een kwestie van klinische validatie. Is hun plaats in de screening, de diagnostiek, de therapiepredictie …? Bovendien zijn deze detectietechnieken vaak minder omslachtig dan die voor de opsporing van CTC’s.
Deze detectietechnieken hebben bovendien nog een groot bijkomend voordeel. CTC’s of ct-DNA kunnen in het laboratorium geïsoleerd worden en het tumor-DNA kan vervolgens nauwkeurig in kaart gebracht worden. Zo wordt het mogelijk om de tumor (en de metastasen) genetisch te identificeren, door bijvoorbeeld typische mutaties aan te tonen. Als er te weinig tumor-DNA voor analyse aanwezig is, kan dit zelfs eerst vermenigvuldigd worden in het laboratorium tot er voldoende tumor-DNA beschikbaar is om meerdere testen uit te voeren. Het is als het ware een genetische ‘vingerafdruk’ van de tumor die gemeten wordt aan de hand van tumor-DNA uit een bloedstaal. Deze informatie stelt artsen in staat om veel nauwkeurigere (doelgerichte) geneesmiddelen toe te dienen bij de patiënt. Het hangt immers vaak af van de genetische code van een tumortype of een bepaald geneesmiddel voldoende efficiënt zal zijn of niet. Bovendien lijken tumoren vaak genetisch te wijzigen over een bepaalde tijd of terwijl een behandeling aan de gang is, waardoor een voortdurende analyse van tumor-DNA heel belangrijk wordt. Deze nieuwe opsporingstechnieken kunnen dus enerzijds gebruikt worden voor diagnostische doeleinden, maar anderzijds ook om de meest efficiënte behandelingskeuze te maken en de patiënt tijdens en na de behandeling nauwkeurig op te volgen.
Deze opsporingstechnieken groepeert men onder de noemer ‘vloeibare biopsieën’, of met de vaak gebruikte Engelse term ‘liquid biopsies’. Er wordt in dit geval geen omslachtige en potentieel riskante biopsie van de tumor zelf genomen, maar door de opsporing
primaire tumor
bloedvat circulerende tumorcellen circulerend normaal DNA
circulerend tumor DNA
Figuur 7 Circulerende tumorcellen en circulerend tumor-DNA
Symptomen, diagnose en prognose
van CTC’s of ct-DNA in het bloed wordt de tumor toch geïdentificeerd (omwille van de afname via een bloedstaal krijgt het de naam ‘vloeibare’ biopsie).
Naast de detectie in bloed wordt ook de opsporing in andere lichaamsvloeistoffen zoals bijvoorbeeld urine, hersenvocht of sputum onderzocht. Een aantal farmaceutische en technologische bedrijven zijn intussen bezig met de ontwikkeling van geautomatiseerde vloeibare biopsietesten, zodat eens de technieken volledig op punt staan, ze ook wel degelijk ingezet kunnen worden in ziekenhuizen of bij uitgebreide bevolkingsonderzoeken.
Detectie van EGFRmutaties in vloeibaar biopt
Een voorbeeld van genetisch testen op een vloeibaar biopt is de detectie van EGFRmutaties op tumorcellen. EGFR is de zogenaamde ‘epidermale-groeifactorreceptor’, die zich in overmaat aan de oppervlakte van bepaalde kankercellen bevindt, waardoor die cel ongecontroleerd deelt. Zoals in het hoofdstuk over behandeling zal blijken, is ‘cetuximab’ een van de nieuwe geneesmiddelen die de EGFR op kankercellen kan blokkeren. Het al dan niet aanslaan van deze anti-EGFR-behandeling hangt dus af van de EGFR-status van het tumortype. Dankzij genetische analyse van tumor-DNA kan via een vloeibare biopsie vooraf nagegaan worden of de patiënt baat zal hebben bij een dergelijke behandeling of niet. Zo kan de slaagkans van de (dure en ingrijpende) therapie op voorhand voorspeld worden. Het gaat hier dus om een predictieve biomerker. Voor de meeste doelgerichte (moleculaire) therapieën zou de vloeibare biopsie dus een belangrijke rol kunnen spelen.
Circulerend celvrij DNA
Er circuleert natuurlijk niet enkel tumor-DNA in het bloed, maar ook erfelijk materiaal van niet-tumorale cellen of celfragmenten. Het geheel duidt men aan als ‘circulerend celvrij DNA’ of afgekort ‘cf-DNA’ (van het Engels ‘cell-free DNA’). De detectiemethoden die men ontwikkelt zijn er dus ook op gericht om een duidelijk onderscheid te kunnen maken tussen niet-tumoraal en tumoraal DNA.
117
✓ Symptomen als gevolg van kanker kunnen ingedeeld worden in lokale symptomen, metastatische symptomen en verschijnselen die geen direct gevolg zijn van de lokale primaire of metastatische woekering (zoals vermoeidheid en afweerreacties).
✓ Het is belangrijk om symptomen te herkennen die als alarmsignaal beschouwd kunnen worden.
KERNPUNTEN
118
KERNPUNTEN
Hoofdstuk 6
✓ Het stellen van de diagnose gebeurt door anamnese en algemeen lichamelijk onderzoek, waarna verschillende klinische methoden toegepast worden om verdachte cellen in beeld te brengen en te identificeren. De belangrijkste methoden zijn − beeldvormingstechnieken; − endoscopische of chirurgische opsporing en; − pathologische onderzoeken en laboratoriumonderzoeken.
✓ De belangrijkste beeldvormingsonderzoeken zijn röntgenopnamen, angiografie, mammografie, CT-scan, MRI-scan, PET-scan en echografie.
✓ Bij pathologische onderzoeken neemt men enkele verdachte cellen of een stukje verdacht weefsel af voor onderzoek in een pathologielaboratorium.
Het afgenomen weefsel wordt een biopsie genoemd.
✓ Na de diagnosestelling bepaalt de oncoloog het stadium waarin een tumor zich bevindt. Het meest gebruikte model van deze stadiëring is de TNMclassificatie. Die classificatie beschrijft de lokale tumoruitbreiding (van de primaire tumor) (‘T’), metastasering in de regionale lymfeklieren (‘N’ van
‘lymphNode’) en metastasering op afstand (‘M’).
✓ Het verdere verloop van de ziekte, de respons op de behandeling en de overlevingskansen worden weergegeven met de term prognose. Een ‘goede prognose’ wijst op een hoge kans op genezing en overleving, terwijl een ‘slechte prognose’ vaak gerelateerd is aan een agressieve of vergevorderde kanker met minder goede vooruitzichten.
✓ De prognose van kanker wordt in de oncologie vaak uitgedrukt met de ‘vijfjaarsoverleving’. Die wordt uitgedrukt met een percentage x %, wat betekent dat er na vijf jaar statistisch gezien nog x % kans is om in leven te zijn.
✓ Voor (vroege) diagnostiek, prognostiek en opvolging van kanker kunnen, meestal in een bloedstaal, biomerkers of tumormerkers gedetecteerd worden. Dat zijn kenmerken van een tumor of producten die afkomstig zijn van een tumor en waarvan de aanwezigheid of het gehalte in het bloed een afspiegeling is van de in het lichaam aanwezige tumor.
✓ Tumormerkers vormen een heel groot potentieel voor de vroege diagnose van kanker en er wordt veelvuldig onderzocht of via een eenvoudige bloedafname (‘vloeibare biopsie’) routinematig kan getest worden of een persoon al dan niet kanker heeft, en indien positief, welk type kanker dan aanwezig is. Het idee achter deze manier van vroege opsporing is de detectie van zogenaamde
‘circulerende tumorcellen’ of ‘circulerend tumor-DNA’.
120
Hoofdstuk 7
1 Behandelingsmogelijkheden
De ideale behandeling van kanker richt zich op een complete verwijdering of vernietiging van de tumor – het gezwel en alle (circulerende) kankercellen – en eventuele metastasen. Bovendien moeten de gebruikte middelen zeer selectief zijn, d.w.z. dat ze in principe alleen kankerweefsel en geen normaal weefsel mogen beschadigen.
Uit de voorgaande hoofdstukken werd duidelijk dat kanker een ziekte is met verschillende verschijningsvormen, die verschillende organen van het lichaam kan treffen en dat zowel primair als via metastasen. Er bestaan meer dan honderd verschillende soorten tumoren, en hun oorzaken, symptomen en prognose verschillen van geval tot geval. Een uniek en direct volledig genezend geneesmiddel tegen alle kankertypes bestaat daarom niet. Maar dankzij jarenlang medisch, wetenschappelijk en technologisch onderzoek zijn er in de moderne geneeskunde zeer efficiënte behandelingsmogelijkheden voorhanden voor heel veel kankertypes.
Op dit moment kunnen gemiddeld genomen ruim 60 % van alle kankerpatiënten genezen worden. Voor de andere 40 % zijn er zeer goede behandelingsmogelijkheden beschikbaar die de patiënt meestal meerdere jaren ziektecontroleerbaar kunnen maken. De huidige en alsmaar groeiende inzichten in de mechanismen van kankerontwikkeling kunnen in de toekomst vertaald worden naar revolutionaire preventie- en behandelingsmethoden, waardoor het aandeel van volledige genezing zal blijven toenemen.
De drie belangrijkste en meest toegepaste behandelingsmogelijkheden op dit moment zijn:
1 Chirurgie: het operatief verwijderen van het kankerweefsel met bij voorkeur ook een deel omliggend tumorvrij weefsel. 2 Systemische therapie: het toedienen van geneesmiddelen. Systemische therapie is vooral bekend in de vorm van chemotherapie: het gebruik van geneesmiddelen die een toxisch effect hebben op delende kankercellen. Meer en meer zullen ook andere middelen, zoals hormonen (hormoontherapie) of nieuwe doelgerichte geneesmiddelen gebruikt worden. Het aandeel van nieuwe geneesmiddelen stijgt de laatste jaren significant, waardoor er steeds minder klassieke chemotherapeutica toegediend worden. De systemische behandelingen gaan zich niet alleen meer rechtstreeks richten op de kankercel, maar ook op de omliggende cellen, zoals de immuuncellen. Voor een aantal tumortypes is immuuntherapie routine geworden. 3 Radiotherapie: het bestralen en radiobiologisch doden van het groeiende kankerweefsel.
Naast deze drie klassieke of conventionele therapievormen bestaan nog een aantal andere therapieën die zich vaak nog in een meer experimenteel stadium bevinden.
Behandeling
Een overzicht van verschillende wetenschappelijk aanvaarde kankertherapieën geven we weer in tabel 1. Al deze therapievormen zullen we in dit hoofdstuk kort bespreken.
Chirurgie ‘Lokaal’ gerichte behandeling Systemische behandeling
• Primaire tumor • Radiotherapie • Chemotherapie o Intraveneus o Oraal
• Metastasen • Embolisatie o Radio-embolisatie o Chemo-embolisatie • Doelgerichte therapie
• Radiofrequentie-ablatie • Hormonotherapie • Immuuntherpaie Combinatie en/of sequentieel
Tabel 1 Verschillende kankertherapievormen
1.1 Bepalende factoren
Het zijn vooral het soort tumor, de lokale uitbreiding van het gezwel en de aanwezigheid van metastasen die de therapeutische mogelijkheden bepalen. De meeste therapieschema’s voor de behandeling van kanker zijn een combinatie van de conventionele behandelingsmethoden (bv. chirurgische verwijdering van de primaire tumor en bestraling van lymfeklieren).
1.2 De vorm van het behandelingsplan
Als na een heelkundige ingreep bestraling of systemische therapie volgt, spreken we over een adjuvante therapie. In sommige gevallen is een radiotherapeutische of systeemtherapeutische behandeling vóór chirurgie aangewezen (om bijvoorbeeld de tumor te verkleinen voor men goed kan opereren). In dat geval spreken we van een neoadjuvante therapie.
De opstelling van het behandelingsplan voor de individuele patiënt met kanker moet bij voorkeur in multidisciplinair oncologisch consult (MOC) gebeuren, waarbij een team van gespecialiseerde artsen van verschillende disciplines over de behandeling beslist. Dit team bestaat meestal uit een oncoloog, een patholoog-anatoom, een radioloog, een chirurg, een radiotherapeut-oncoloog en zal afhankelijk van het type en de plaats van de tumor aangevuld worden met bijvoorbeeld een gynaecoloog, een uroloog, een gastro-enteroloog of een pneumoloog.
Als er geen metastasering vastgesteld is, gaat de voorkeur meestal uit naar een plaatselijke behandeling (chirurgie, radiotherapie of een combinatie van beide). Bij tumoren die gevoelig zijn voor chemotherapie of doelgerichte behandeling kan een aanvullende (adjuvante) systemische therapie het risico op het latere ontstaan van metastasen
121
122
Hoofdstuk 7
reduceren. Bij gemetastaseerde ziekte zal bijna altijd systemische therapie toegepast worden, al dan niet in combinatie met chirurgie en radiotherapie.
1.3 Curatieve en palliatieve behandeling
Kankerbehandeling richt zich uiteraard in eerste instantie op genezing. Daarnaast bestaat de mogelijkheid dat de prognose van een gediagnosticeerde kanker dermate slecht is, dat kankerbehandeling niet meer op genezing gericht is, maar alleen nog dient om de ziekte zo lang mogelijk onder controle te houden en de levenskwaliteit van de patiënt te behouden. Wanneer de therapie als doel heeft genezing te bereiken, spreken we van een curatieve behandeling. Als genezing niet mogelijk is en als de verlichting van de klachten als gevolg van de voortwoekerende tumor het doel van de behandeling is, spreken we van een palliatieve behandeling. We spreken over ‘palliatieve zorg’; dat is een verzamelwoord voor elke vorm van zorg waarmee een terminale patiënt omringd wordt. Het is een vorm van totaalzorg, zowel geestelijk en lichamelijk, voor wie ongeneeslijk ziek is en binnen afzienbare tijd zal sterven. Niet meer de levensduur, maar wel de kwaliteit van het leven is hierbij het belangrijkste. Dergelijke patiënten worden bij voorkeur thuis behandeld, maar soms is een verblijf in een palliatieve eenheid van een ziekenhuis of een palliatief centrum meer aangewezen.
De huidige palliatieve behandelingen zijn veel meer geworden dan het bekomen van korstondige controle over de ziekte. Bij sommige kankertypes, bijvoorbeeld borstkanker, evolueert men van een ‘niet te genezen’ naar een ‘chronische’ ziekte. Enerzijds is er het effectief onder controle houden van de ziekte en anderzijds moet de levenskwaliteit bewaard blijven. Nevenwerkingen van ingestelde behandelingen moeten dan ook op korte en lange termijn door het multidisciplinair team onder controle gehouden worden.
2 Chirurgie
Figuur 1 Principe van chirurgie
Tumor + tumorvrije rand verwijderen
Behandeling
Chirurgie heeft als belangrijkste doel het kankergezwel operatief te verwijderen. Als het kan verwijdert men de tumor én een tumorvrije rand (normaal omliggend weefsel of een deel van een orgaan), om liefst geen enkele kankercel macroscopisch over te laten.
Uitgebreide chirurgie (met het wegnemen van een tumorvrije rand) in het menselijk lichaam is mogelijk omdat sommige organen (schildklier, bijnier) volledig misbaar of vervangbaar zijn door medicatie. In andere gevallen kunnen delen van organen weggenomen worden, terwijl er voldoende reservecapaciteit overblijft (nier, long, lever, darmen). We illustreren dit met enkele voorbeelden.
VOORBEELDEN
– Bij het chirurgisch behandelen van darmkanker wordt soms een groot deel van de dikke darm weggenomen; – bij leverkanker kan het nodig zijn om een groot stuk van de lever weg te nemen.
Belangrijk is erover te waken dat er voldoende functioneel leverweefsel overblijft. In geselecteerde situaties gaat men de volledige zieke lever wegnemen en doet men een levertransplantatie; – bij borstkanker kan het nodig zijn om een volledige borst te amputeren.
Het gebruik van prothesen maakt het mogelijk om sommige delen van het lichaam te vervangen (bot, bloedvaten). Uiteraard is het soms ook onmogelijk om een tumorvrije rand mee weg te nemen, zoals in het hersenweefsel.
Twee op de drie van alle nieuwe patiënten met een kankerdiagnose ondergaan een chirurgische ingreep. Chirurgie is daarom een van de belangrijkste therapiemogelijkheden voor kanker en heeft als grote voordelen dat de tumor radicaal verwijderd kan worden (indien chirurgisch-technisch mogelijk) en dat men altijd cellen of weefselmateriaal heeft (zowel van de tumor als van omliggende weefsels en/of klieren) voor verder onderzoek in het pathologielaboratorium (zie het hoofdstuk over symptomen, diagnose en prognose).
Minpunten zijn de blijvende vraag of effectief alle tumorcellen verwijderd werden, de mogelijke schade die toegebracht wordt aan omliggende weefsels en organen, de chirurgische beperkingen (bereikbaarheid, slechte algemene toestand van de patiënt) en de mogelijke (micro)metastasen of circulerende tumorcellen die niet mee verwijderd worden. Daarom zijn naast chirurgie aanvullende behandelingen zoals chemotherapie, hormonale therapie en radiotherapie nodig om de kans op herval te verminderen.
123
124
Hoofdstuk 7
De evolutie van de chirurgie
Chirurgie is ongetwijfeld de oudste methode om kanker te behandelen. Al in de oudheid werden gezwellen weggenomen met chirurgische methoden. De laatste jaren is er een enorme vooruitgang geboekt dankzij nieuwe ontwikkelingen in de robotchirurgie, de anesthesie, de kunstmatige beademing en bloedcirculatie, de verpleegkundige verzorging en de kinesitherapie. Daardoor zijn alsmaar ingewikkeldere en precieze operaties mogelijk. Chirurgie is in de oncologie ook vaak een manier om reconstructies na de behandelingen uit te voeren of om het lijden van de patiënt te verlichten (palliatie).
3 Chemo- en radiotherapie
Het principe van de chemo- en radiotherapie is eenvoudig. Deze behandelingsmethodes beschadigen of vernietigen de kankercellen, terwijl normale, gezonde cellen zo veel mogelijk gespaard moeten blijven. Om dat te kunnen realiseren is het noodzakelijk dat kankercellen en normale cellen verschillend zijn en op een andere manier op de therapie reageren. Een heel belangrijk verschil is de plaats van de tumor. Maar de manier waarop kankercellen groeien, vormt het grootste verschil. In het hoofdstuk over het ontstaan van kanker maakten we duidelijk dat kankercellen ongecontroleerd en veel sneller delen dan normale cellen. Dat is nu precies het aangrijpingspunt waarop radiotherapie en vooral chemotherapie werkzaam zijn. Deze therapieën zullen het celdelingsproces nadelig beïnvloeden of blokkeren. Omdat kankercellen veel celdelingen doormaken, zal de behandeling vooral die cellen blokkeren, beschadigen of vernietigen. Figuur 2 geeft de principiële werking van chemotherapie en (in beperktere mate) radiotherapie op de snelle kankerceldeling weer.
chemotherapie radiotherapie
snelle deling van kankercellen
Figuur 2 Principe van chemo- en radiotherapie
Behandeling
3.1 Systemische therapie - chemotherapie
Chemotherapie is een behandeling met geneesmiddelen die de celdeling op verschillende manieren tegenhouden of volledig blokkeren. We spreken van een cytostatische of cytotoxische werking (‘cyto’ staat voor cel, ‘statisch’ betekent stilleggen en ‘toxisch’ vergiftigen) en vaak krijgen deze geneesmiddelen de naam cytostatica. Na de toediening aan de patiënt, circuleren ze via de bloedbanen en oefenen ze hun therapeutische werking uit in het hele lichaam. Vandaar ook de term ‘systemische’ (chemo)therapie: verspreiding over het hele lichaamssysteem. Chemotherapie valt alle sneldelende cellen in het lichaam aan, waardoor ze trager delen, stoppen met delen of afsterven. Kankercellen worden op deze manier gestopt of vernietigd.
Soorten cytostatica
De klassieke cytostatica zijn gewoonlijk ingedeeld in alkylerende middelen, antimetabolieten, antitumorantibiotica, plantalkaloïden en overige.
1 Alkylerende middelen
De antitumorwerking van de alkylerende middelen berust op hun interactie met het cellulaire DNA, waarbij zowel bindingen tussen de beide DNA-strengen als aan eenzelfde DNA-keten gevormd worden. Dat leidt tot distorsies van de
DNA-molecule. Meer bepaald leidt dit tot een verstoring van de verdubbeling van het DNA tijdens de celdeling en de aflezing van DNA voor de vorming van messenger-RNA en dat verstoort de eiwitsynthese. Voorbeelden van dergelijke verbindingen zijn chloorambucil, cyclofosfamide, ifosfamide en melfalan.
Binnen deze groep van cytostatica nemen ook platinaverbindingen, zoals cisplatinum en carboplatinum, een belangrijke plaats in. Oxaliplatinum wordt voornamlijk toegepast bij de behandeling van darmkanker. De verschillende platinumverbindingen zijn niet altijd onderling uitwisselbaar. Het is bijvoorbeeld niet omdat een tumor gevoelig is voor cisplatinum dat hij automatisch ook gevoelig is voor oxaliplatinum. Ook de nevenwerkingen binnen de platinumgroep verschillen onderling. Cisplatinum is een van de meest werkzame verbindingen bij solide tumoren en de ontdekking ervan betekende een doorbraak voor de behandeling van een aantal belangrijke kankertypes, zoals teelbal-, baarmoeder- en longkanker. Carboplatinum is voortgekomen uit intensief onderzoek naar platinumverbindingen met een gunstiger toxiciteitsspectrum (minder nevenwerkingen) dan dat van cisplatinum.
2 Antimetabolieten
Dit zijn verbindingen die gesynthetiseerd zijn om essentiële biochemische processen te remmen, wat meestal leidt tot remming van de DNA- en RNA-synthese.
Voorbeelden van middelen uit deze groep zijn methotrexaat, fluoro-uracil, gemcitabine, cytarabine, mercaptopurine, thioguanine en fludarabine.
125
126
Hoofdstuk 7
3 Antitumorantibiotica
Antitumorantibiotica zijn verbindingen met antibiotische en cytotoxische werking die geïsoleerd zijn uit micro-organismen. De cytostatische werkzaamheid berust op een reactie met cellulair DNA, waardoor de replicatie verstoord wordt.
Bekende vertegenwoordigers van deze groep verbindingen zijn de antracyclinen, dactinomycine, bleomycine en mitomycine c.
4 ‘Plantaardige’ chemotherapie
Tot de uit planten geïsoleerde cytostatica behoren de vinca-alkaloïden, de taxoïden, de camptothecinen en de podofyllotoxinen. Tot de vinca-alkaloïden behoren onder andere vincristine en vinblastine. Deze verbindingen werden geïsoleerd uit de Catharanthus roseus, vroeger geclassificeerd als Vinca rosea (maagdenpalm). De taxoïden waarmee tot nu toe de meeste ervaring in de kliniek bestaat, zijn paclitaxel, een verbinding die oorspronkelijk geïsoleerd werd uit de schors van een taxusvariëteit (Taxus brevifolia) en docetaxel. Tegenwoordig kunnen beide middelen semisynthetisch geproduceerd worden uit de naalden van de struik Taxus baccata en wordt paclitaxel ook geproduceerd in celkweken afkomstig van taxusnaalden. Zowel de vinca-alkaloïden als de taxoïden ontplooien hun cytotoxische activiteit tijdens de mitose. Vinca-alkaloïden blokkeren cellen in mitose door de synthese van microtubuli te verstoren. Taxoïden binden zich eveneens aan microtubuli, maar deze reactie leidt tot de vorming van starre, niet-functionele microtubuli. Ook de podofyllotoxinen etoposide en teniposide behoren tot de groep van de plantalkaloïden. Ze werden oorspronkelijk geïsoleerd uit de Podophyllum pellatum (voetblad). Deze middelen remmen het enzym topo-isomerase II en reageren met cellulair DNA, waardoor de replicatie ervan verstoord wordt. De camptothecinen werden oorspronkelijk geïsoleerd uit de
Chinese boom Camptotheca acuminata. Deze groep middelen bleek het enzym topo-isomerase I te remmen. Onderzoek naar analogen met beter voorspelbare nevenwerkingen leidde tot de synthese van topotecan en irinotecan.
5 Overige cytostatica
Dit is een heterogene groep verbindingen waarvan het werkingsmechanisme niet volledig opgehelderd is. Voorbeelden die in deze restgroep gecatalogiseerd worden, zijn orthopara-DDD, L-asparaginase, hydroxycarbamide en thalidomide.
De evolutie van chemotherapie
Het eerste cytostaticum was stikstofmosterd, een verbinding die nauw verwant is aan mosterdgas. Tijdens de Tweede Wereldoorlog werd in de Verenigde Staten onderzoek verricht naar de remming van beenmergcellen die dit middel teweeg- bracht bij soldaten. Nadien volgde intensief onderzoek naar gelijkaardige middelen die ook kwaadaardige cellen konden remmen. Stikstofmosterd bleek een bruikbaar
Behandeling
middel voor de (palliatieve) behandeling van bepaalde kankerpatiënten. Vanaf de jaren vijftig werden meer cytostatica ontdekt, zoals aminopterine en methotrexaat. De belangrijkste cytostatica van de jaren zeventig waren cisplatinum en 5-fluorouracil. Waardevolle cytostatica van meer recente datum zijn de podofyllotoxinen, de taxoïden (taxanen), de topo-isomerase I-remmers en de orale fluoropyrimidines.
De combinatie van verschillende cytostatica – in het begin van de jaren zestig voor het eerst toegepast – bracht een belangrijke vooruitgang bij de behandeling van een aantal hematologische maligniteiten. In de loop van de jaren zeventig bleek dat een systemische therapie aansluitend aan de operatieve ingreep (bij niet-gemetastaseerde ziekte) de kans op het later ontstaan van uitzaaiingen kon verkleinen. Van meer recente datum is de combinatie van chemotherapie met radiotherapie, waarbij beide behandelingen elkaars antitumoreffect kunnen versterken (synergistisch effect). Er worden tot op vandaag nog steeds nieuwe (combinaties van) chemotherapeutische middelen onderzocht. Maar de aandacht van het klinisch wetenschappelijk onderzoek gaat nu veel meer in de richting van nieuwe doelgerichte geneesmiddelen (zie verder).
A Toediening
Chemotherapeutica worden intraveneus (via de bloedbaan), oraal (via de mond), intramusculair (in de spier) of subcutaan (onderhuids) toegediend. De manier waarop wordt bepaald door de kenmerken van het product, de veiligheid en de ervaring van het team.
De toediening gebeurt vaak in een daghospitaal. Bij (langdurige) toediening in de bloedvaten maakt men vaak gebruik van een ‘port-a-cath’ of poortkatheter, dat is een chirurgisch aangebracht injectiekamertje dat onder de huid geïmplanteerd wordt en verbonden is met dieper gelegen grotere bloedvaten. De chemotherapeutica komen via dit hulpmiddel rechtstreeks in de bloedbaan terecht zonder dat de patiënt altijd in een perifeer bloedvat (bijvoorbeeld in de arm) aangeprikt moet worden. Na de behandelingskuur kan deze poortkatheter verwijderd worden.
B Nevenwerkingen
Ook gezonde (sneldelende) cellen ondervinden hinder van de cytostatica die via de bloedbanen door het lichaam circuleren, zij het in mindere mate. Typische normale weefsels in het lichaam die ook uit sneldelende cellen bestaan, zijn het beenmerg (met het bloedvormende systeem), de weefsels van het maag-darmkanaal en de haarfollikels. De nevenwerkingen door chemotherapie op die normale weefsels worden veroorzaakt door de cytostatische werking van de toegediende geneesmiddelen.
127
128
Hoofdstuk 7
Als het beenmerg en het bloedvormende systeem vertraagd worden, maakt het lichaam minder rode en witte bloedcellen aan, waardoor de patiënt bloedarmoede kan krijgen, sneller vermoeid raakt en vatbaarder wordt voor infecties. Het beïnvloeden van de cellen van het maag-darmkanaal leidt tot misselijkheid, braken en diarree. Andere veelvoorkomende nevenwerkingen van cytostatica zijn onvruchtbaarheid en haaruitval. Dat laatste komt door de aantasting van de (sneldelende) cellen van de haarzakjes, van waaruit de haren groeien. Deze bijwerkingen zijn grotendeels reversibel. Als de toediening en de werking van de chemotherapie stoppen, verdwijnen ook de nevenwerkingen en herstelt het beschadigde normale weefsel zich meestal volledig (de misselijkheid verdwijnt en het haar komt terug). Afhankelijk van het type en de duur van de chemotherapie kan het herstelproces echter van lange duur zijn en soms kan er blijvende schade zijn. Patiënten die een chemotherapeutische behandeling ondergaan, krijgen ook bijkomende geneesmiddelen die de nevenwerkingen zo veel mogelijk tegengaan, bijvoorbeeld middelen die de misselijkheid verminderen of middelen die de regeneratie van het bloed versnellen.
De nevenwerkingen zijn verschillend van aard en intensiteit voor elk type chemotherapie en variëren van patiënt tot patiënt. Haaruitval doet zich bijvoorbeeld niet noodzakelijk bij elke chemotherapie voor. We willen opmerken dat er geen verband bestaat tussen de aanwezigheid of intensiteit van de nevenwerkingen en de doeltreffendheid van de behandeling. Als er bijvoorbeeld relatief weinig nevenwerkingen optreden, wil dat niet zeggen dat de chemotherapie niet efficiënt tegen de kankercellen werkt. De ernst van de nevenwerkingen hangt ook af van de algemene conditie van de patiënt, bijkomende ziekten of al aanwezige orgaanfunctiestoornissen. Daarnaast zijn farmacologische en therapeutische factoren, zoals dosis, dosisintensiteit en mate en snelheid van uitscheiding, van grote invloed op de ernst en duur van de nevenwerkingen. Vooral bij oudere patiënten en patiënten met een slechte conditie moet de dosering van de chemotherapie hierdoor soms verlaagd worden. Sommige cytostatica zijn specifiek toxisch voor bepaalde stelsels of organen, bijvoorbeeld voor het zenuwstelsel, de nieren, de longen, de lever of het hart. Het uiteindelijke resultaat van de behandeling wordt zowel bepaald door de gevoeligheid van het soort kanker voor een cytostatische behandeling als door de algemene conditie van de patiënt.
Resistentie tegen chemotherapie
Bij een aantal kankertypes ziet men een resistentie tegenover cytostatica optreden. Een aantal kankertypes zijn bij de diagnose al ongevoelig voor een cytostatische behandeling, zoals bijvoorbeeld niercelkanker, maligne melanoom en darmtumoren. Deze tumoren zijn kennelijk ‘primair resistent’ tegen cytostatica. Andere tumortypes, zoals borstkanker en longkanker, reageren aanvankelijk dikwijls gunstig op cytostatische behandeling, maar bij voortzetting van de therapie blijkt dit niet tot een verdere afname van de tumor te leiden of breidt de ziekte zich opnieuw uit. In die gevallen is
Behandeling
er sprake van een ‘verworven resistentie’. Kennelijk is er dan een populatie maligne cellen ontstaan die het vermogen heeft zich te beschermen tegen de schadelijke invloed van cytostatica, analoog aan het ontwikkelen van resistentie bij bacteriën.
De ontwikkeling van resistentie is een belangrijke hinderpaal bij het toedienen van effectieve chemotherapie en is onderwerp van veel onderzoek. De mechanismen waardoor een tumorcel resistent tegen cytostatica kan worden, kunnen berusten op:
1 een verminderde opname van het cytostaticum in de tumorcel; 2 een intracellulaire redistributie van het cytostaticum; 3 een verhoogde excretie van het middel vanuit het cytoplasma naar het extracellulair milieu; 4 een veranderde concentratie van doelwitenzymen van cytostatica waardoor deze onvoldoende geremd worden; 5 het benutten van alternatieve metabole wegen die niet door het cytostaticum worden beïnvloed, of; 6 mogelijkheden om beschadigd DNA beter te herstellen; 7 het niet-delende karakter van aanwezige kankerstamcellen (zie verder).
Tot nu toe zijn enkele geneesmiddelen in staat gebleken resistente tumorcellen opnieuw gevoelig te maken voor cytostatische behandeling. Hiertoe behoren de calciumantagonisten en de cyclosporinen. Deze middelen remmen p-glycoproteïne, een in het celmembraan gelokaliseerd eiwit dat toxische stoffen uit de cel pompt. Een verhoogde activiteit van dit eiwit is mogelijk verantwoordelijk voor de resistentie-ontwikkeling tegen natuurlijke cytostatica als de anthracyclines, podophyllotoxinen, vinca-alkaloïden en taxanen.
De klinische toepassing van bovengenoemde resistentie-modulerende stoffen bevindt zich in een onderzoeksfase. Een andere mogelijkheid om resistentie-ontwikkeling tegen te gaan is het combineren of afwisselend geven van verschillende cytostatica met ieder een verschillend aangrijpingspunt in de celcyclus.
Combinatiechemotherapie
In veel gevallen bestaat een behandeling uit een combinatie van verschillende cytostatica. Deze zogenaamde combinatiechemotherapie maakt gebruik van de relatieve verschillen in de effecten van de onderscheiden cytostatica op gezonde weefsels. Van veel cytostatica is de dosisbeperkende nevenwerking leukopenie of trombocytopenie (bloedarmoede), maar een aantal middelen kent andere orgaantoxiciteit als dosisbeperkende factor. Voorbeelden uit de laatstgenoemde groep zijn cisplatine, vincristine, bleomycine en de orale fluorpyrimidinen.
129
130
Hoofdstuk 7
De voorwaarden waaraan een goede combinatiechemotherapie moet voldoen zijn:
1 elk cytostaticum uit de combinatie moet werkzaam zijn tegen de tumor; 2 de middelen moeten in optimale dosering gebruikt worden; 3 er mag geen overlappende dosisbeperkende toxiciteit te zijn.
Regionale toediening van cytostatica
Regionale toediening van cytostatica heeft meestal als doel plaatselijk de blootstelling van de tumor aan cytostatica te verhogen zonder gelijktijdige toename van de systemische toxiciteit. Voorbeelden van regionale toediening van cytostatica zijn intravesicale (bijvoorbeeld in de blaas), intraperitoneale (in de buikholte), intrapleurale (binnen het borstvlies), intra-artheriële (in de slagaders) en intrathecale (binnen de hersen- of ruggemergvliezen) toediening. Lokale toediening van chemotherapie in de blaas en in de buikholte is alleen curatief bij zeer kleine tumoren, omdat de penetratie van het cytostaticum in de tumor voornamelijk op diffusie berust. Bij intraperitoneale toediening van chemotherapie vindt wel systemische absorptie plaats, maar die gebeurt geleidelijk en de concentratie in het bloed blijft lager dan wanneer eenzelfde dosis systemisch toegediend zou worden. Bij de intrathecale chemotherapie is de slechte penetratie van cytostatica in het zenuwweefsel als gevolg van de bloedhersenbarrière de voornaamste reden voor deze toedieningswijze. De indicatiestelling voor een regionale toediening van cytostatica vereist een gedegen kennis van het te verwachten biologische gedrag van de tumor en niet alle cytostatica zijn hiervoor even geschikt.
Een apart vermeldenswaardige vorm van lokale toediening van cytostatica is de regionale of geïsoleerde perfusie. Bij perfusie wordt de bloedcirculatie van een lidmaat (arm of been) of orgaan (long of lever) geïsoleerd en aangesloten op een circuit (bv. hart-longmachine) met zuurstofvoorziening en temperatuurregulatie. Vervolgens wordt het lidmaat of het orgaan ‘geperfuseerd’ met de beoogde chemotherapeutica en achteraf gespoeld. Door de isolatie kunnen de geneesmiddelen zeer hoog gedoseerd worden (tot tienmaal de systemisch te tolereren hoeveelheid) omdat het niet de vitale organen treft. De isolatie ondergaat een zorgvuldige controle zodat lekkage naar de systemische circulatie vermeden kan worden. Als indicatie voor geïsoleerde perfusie geldt uitgebreide tumorgroei in een lidmaat, of bijzondere vormen van lever- en longtumoren of -metastasen. Geïsoleerde perfusie wordt alleen in hooggespecialiseerde medische centra uitgevoerd, al dan niet in klinisch studieverband.
Behandeling
3.2 Radiotherapie
Naast chemotherapie wordt ook radiotherapie (bestraling) toegepast bij de behandeling van kanker. Radiotherapie gebruikt (radioactieve) straling om tumoren te bestrijden. Een stralingsbundel wordt precies gericht op de plaats waar het gezwel zich bevindt. De straling veroorzaakt beschadigingen in het DNA van de kankercellen, waardoor ze afsterven of niet meer kunnen delen. Om zo doeltreffend mogelijk te zijn en zo weinig mogelijk neveneffecten te veroorzaken moet de behandeling met veel precisie berekend en toegediend worden. De bestraling moet zo nauwkeurig mogelijk op de kankercellen gericht worden. Toch zullen ook hier omliggende normale cellen beschadigd worden, maar de cellen zullen het DNA proberen te herstellen. Kankercellen zijn iets minder goed in staat om de veroorzaakte DNA-schade te herstellen dan gezonde cellen. Dit verschil en de nauwkeurig gerichte bestraling maken het mogelijk om met radiotherapie kanker efficiënt te behandelen.
Het te bestralen gebied verschilt per patiënt, en ook de duur van de bestralingskuur, de intensiteit en het bestralingsschema (het aantal bestralingen) kunnen variëren. De bestraling kan van buitenaf komen (uitwendige bestraling) of van radioactief materiaal dat vlak bij of in de tumor gebracht wordt (inwendige bestraling).
A Uitwendige bestraling
Bij uitwendige bestraling komt de bestraling uit een radiotherapietoestel buiten het lichaam. Bij dit type bestraling is meestal geen ziekenhuisopname nodig en de bestraling op zich is pijnloos. Op figuur 3 zie je een bestralingstoestel. De stralingsbron bevindt zich op ongeveer een meter afstand van de patiënt en kan rond de patiëntentafel draaien, Figuur 3 Bestralingstoestel (lineaire versneller) (Iridium Netwerk) om zo nauwkeurig mogelijk te stralen op de plaats van de tumor. Tegenwoordig kan men het toestel rond de patiënt laten draaien en tegelijkertijd heel precies bestralen, waardoor het mogelijk wordt om de hoge dosis toe te dienen aan de tumor en tegelijkertijd de dosis op de omliggende normale weefsels zo laag mogelijk te houden.
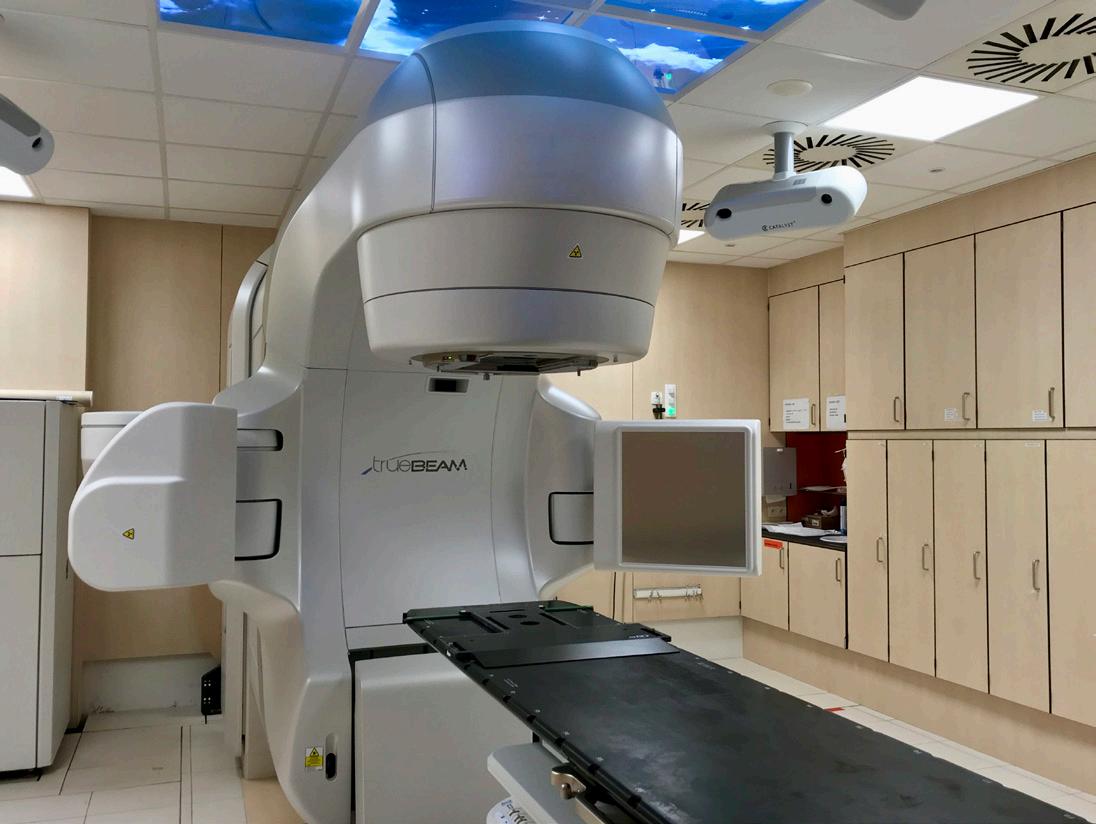
131
132
Hoofdstuk 7
Evolutie van de radiotherapie
Al kort na de ontdekking van de radioactieve röntgenstralen (1895) werd radiotherapie met succes toegepast bij kanker. Radiotherapie wordt alsmaar vaker gegeven. Dat komt omdat de resultaten alsmaar beter worden: betere genezingskansen en minder bijwerkingen. De verbetering is in de eerste plaats te danken aan technische verbeteringen. De eerste radiotherapietoestellen waren ‘orthovoltmachines’: die produceren röntgenstraling met kilovoltage-energie. Hiermee was men voor het eerst in staat tumoren te behandelen die dieper in het lichaam gelegen zijn. Door de hoge oppervlaktedosis waren er echter ook veel bijwerkingen. De ontwikkeling van kobaltapparaten en megavoltmachines in de jaren vijftig en zestig maakte het voor het eerst mogelijk om diep gelegen tumoren te bestralen zonder de huid te veel te belasten (huidsparend effect). In de jaren zeventig en tachtig kwamen de eerste CT- en MRI-scanners op de markt. Door de veel betere beeldvorming werd het mogelijk om de omliggende normale weefsels meer te sparen. In de laatste jaren is daar de PET-/CT-scan bijgekomen, waardoor niet alleen anatomische, maar ook metabole informatie voor de dosisplanning gebruikt kan worden.
Vóór de ontwikkeling van de computer werden de dosissen berekend op papier of met een rekenmachine, in het centrum van het bestralingsveld. Met de computer is precieze dosisberekening veel eenvoudiger geworden. Eerst waren dat 2D-computerplanningen: dat zijn berekeningen op een plat vlak, op een doorsnede of op een CT-coupe. Door de enorme ontwikkelingen in de computerwereld kwam er 3D-software. Voor het eerst was het mogelijk om dosisberekeningen op een volume te doen. De volgende logische stap was de introductie van beweging, variatie in tijd, de 4D-software, waarbij onder andere correcties voor ademhalingsbeweging tijdens de bestraling wordt toegepast. Op dit moment wordt hard gewerkt aan de ontwikkeling van zogenaamde adaptieve radiotherapie, waarbij geprobeerd wordt de variaties die optreden in de loop van de bestralingsbehandeling (de tijd) mee te betrekken in de dosisberekening. De laatste ontwikkelingen hebben betrekking op het gebied van de lineaire versnellers. De lineaire versneller is een toestel waarin elektronen versneld worden in een röntgenbuis totdat ze de gewenste energie bereikt hebben (zie figuur 3). Lineaire versnellers zijn nog steeds de werkpaarden van de radiotherapie. Daarnaast zijn er gespecialiseerde toestellen op de markt gekomen die hogeprecisieradiotherapie in een beperkt doelvolume kunnen realiseren, zoals de stereotactische linacs, tomotherapie, CyberKnife, MRI-linacs en intra-operatieve toestellen.
De laatste 2 decennia is er ook een snelle toename van het aantal deeltjesversnellers: toestellen die kunnen bestralen met protonen of carbon-ionen. Hiermee kan in specifieke situaties nog preciezer bestraald worden, hetgeen voor bepaalde indicaties een meerwaarde betekent.
Behandeling
B Inwendige bestraling
Naast de toepassing van uitwendige bestraling kan men de bestralingsbron ook in de patiënt zelf brengen. Hierbij worden radioactieve stoffen of deeltjes in de tumor gebracht. Deze techniek, brachytherapie genoemd, is onder meer bruikbaar bij de behandeling van baarmoederkanker, baarmoederhalskanker en huidtumoren (waar men de bron goed kan inbrengen in of nabij het aangetaste orgaan) of van prostaatkanker (waarbij men radioactieve ‘zaadjes’ in het kankerweefsel kan brengen). De bestraling is zeer hoog vlakbij de ingebrachte bron, maar neemt dan snel af op afstand van de bron. Op deze manier kan men de tumor een hoge dosis geven, terwijl de omgevende normale weefsels gespaard blijven.
Brachytherapie bij schildkliertumoren
Een speciale vorm van brachytherapie is de jodiumbehandeling bij schildkliertumoren. Hierbij maakt men gebruik van de speciale situatie dat de schildklier het enige orgaan in het lichaam is dat jodium opneemt. Door de patiënt een capsule te geven die met radioactief jodium gevuld is, ontstaat er een ophoping van deze radioactieve isotoop in alle cellen die van de schildklier afkomstig zijn, in de schildklier zelf of in eventuele uitzaaiingen op afstand. Het jodium blijft lang genoeg in de cel aanwezig om een hoge stralingsdosis af te kunnen geven.
C Nevenwerkingen
Net zoals bij chemotherapie kunnen er nevenwerkingen door radiotherapie optreden. Bij deze therapievorm worden (sneldelende en vooral omliggende) normale cellen mee beschadigd, ditmaal door de straling. Afhankelijk van de bestraalde plaats worden vaak huidcellen en cellen van het mondslijmvlies of maag-darmkanaal beschadigd, waardoor symptomen als irritatie, roodheid, blaren of diarree kunnen voorkomen. Op langere termijn kan ook vermoeidheid optreden. De radiotherapeut-oncoloog zorgt er wel voor dat de straling zo weinig mogelijk schade aan de gezonde weefsels berokkent. De meeste nevenwerkingen zijn ook tijdelijk en genezen achteraf snel en meestal volledig. De nevenwerkingen van bestraling komen specifiek voor in de delen van het lichaam die bestraald worden.
VOORBEELD
Bij bestraling van de hersenen bijvoorbeeld kunnen de hoofdhuid en de haarwortels beschadigd raken, waardoor hoofdhuidirritatie en haarverlies kunnen optreden. Bij een bestraling van bv. de borst zal het hoofdhaar niet uitvallen, maar kunnen er wel lokale nevenwerkingen zoals op de huid voorkomen.
133
134
Hoofdstuk 7
De intensiteit en duur van de nevenwerkingen variëren van persoon tot persoon. Soms zijn er vertraagde nevenwerkingen, maanden of jaren na het stopzetten van de behandeling. Het kan gaan om verkleuring van de huid of uitzetting van de kleine bloedvaatjes in de huid.
D Curatieve en palliatieve bestraling
Radiotherapie heeft zowel een plaats in de curatieve als in de palliatieve behandeling. Een derde van de patiënten krijgt radiotherapie als onderdeel van de curatieve therapie en ongeveer evenveel als palliatieve behandeling. Uiteindelijk krijgt ongeveer de helft van alle kankerpatiënten in de loop van zijn ziekte radiotherapie. Vaak bestaan behandelingen ook uit de combinatie van radiotherapie met chirurgie en systemische therapie.
Wordt een patiënt radioactief na een bestraling?
Na een uitwendige bestralingskuur wordt de bestraalde patiënt zelf niet radioactief. Het bestraalde weefsel wordt zelf geen bron van nieuwe stralen. De patiënt laat zijn omgeving dus geen gevaar lopen op radioactieve bestraling.
Bij brachytherapie is er een beperkte straling vanaf de ingebrachte bron naar buiten toe. De bestraling is hoog vlak bij de bron, maar neemt snel af op afstand van de bron, zodat ook hier de patiënt geen echt gevaar voor de omgeving vormt. Voor deze speciale behandelingen worden wel (tijdelijke) preventieve maatregelen genomen om de naasten en het verplegend personeel te beschermen. Zodra het radioactieve materiaal wordt weggenomen of is uitgewerkt, is geen enkele voorzorgsmaatregel meer nodig. Vaak worden patiënten die met brachytherapie worden behandeld tijdelijk in het ziekenhuis opgenomen, met een correcte medische controle.
4 Toediening van chemotherapie, radiotherapie of combinaties
Een belangrijk verschil tussen systemische behandeling en chirurgie of radiotherapie is de toediening. Terwijl systemische (chemo)therapie zich over het hele lichaam verspreidt, zijn chirurgie en de bestralingen heel lokaal en nauwkeurig gericht op het kankerweefsel. Door het systemische karakter kan chemotherapie dus nevenwerkingen veroorzaken in het hele lichaam. Maar chemotherapie heeft ook het grote voordeel dat eventuele circulerende kankercellen of metastasen in het lichaam mee bestreden worden.
Behandeling
Door de beschreven nevenwerkingen worden in de regel de radiotherapeutische en chemotherapeutische behandelingen met welbepaalde schema’s en periodes toegediend (bijvoorbeeld bestraling tijdens korte dagelijkse sessies, chemotherapietoediening met afwisselende behandelings- en rustfasen van enkele dagen). De achterliggende gedachte is het zoeken naar een evenwicht tussen het toebrengen van maximale schade aan het kankerweefsel en minimale schade aan het normale weefsel. Een eenmalige dosis chemotherapie die systemisch aangewend wordt, brengt schade toe aan de kankercellen, maar heeft ook invloed op normale weefsels in het lichaam. De herstelcapaciteit van de normale cellen is echter hoger dan die van de kankercellen, zodat dit therapeutisch uitgebuit kan worden. Als geneesmiddelen continu over een bepaalde periode toegediend zouden worden, zouden noch de kankercellen, noch de normale cellen kunnen recupereren, waardoor de schade aan kankerweefsel en delend normaal weefsel gelijklopend zou zijn. Als schema’s echter toegepast worden met afwisselende behandelings- en rustfasen, is het mogelijk om de zwakkere herstelcapaciteit van de kankercellen te gebruiken om de kankercellen finaal te vernietigen en normale cellen te laten voortbestaan. Tijdens de rustfasen kan het lichaam bovendien weer op krachten komen. De kankercellen die bij een eerste behandelingsfase niet vernietigd werden, kunnen bij een volgende behandeling wel getroffen worden.
De intervallen moeten zeer goed gekozen worden. Bij te korte intervallen bestaat het risico dat de normale cellen onvoldoende kunnen recupereren; te lange intervallen kunnen resulteren in een recuperatie en zelfs uitgroei van de kwaadaardige kankercellen. Op figuur 4 kun je zien dat bij een eenmalige, langdurige toediening zowel de kankercellen
A B
100%
normale cellen 100%
normale cellen
135
kankercellen kankercellen
Figuur 4 Gefractioneerde toediening van chemo- en radiotherapie
136
Hoofdstuk 7
als de (delende) normale cellen blijvend dalen in hun overleving (A). Als men echter een toediening in fracties toepast, met daartussen telkens een interval zonder toediening, kunnen de cellen zich tijdens deze intervallen voor een deel herstellen. Het sterkere effect van de chemo- en radiotherapie op de sneldelende kankercellen, samen met een verminderde herstelcapaciteit van deze kankercellen zal er idealiter voor zorgen dat de kankercellen na meerdere toedieningen volledig afsterven, terwijl de normale cellen volledig recupereren (B).
Er bestaan nog verschillende ingewikkelde variaties op de conventionele therapievormen. We herhalen daarbij dat chemotherapie slechts één vorm van systemische therapie is (maar wel de bekendste). Ook andere systemische therapieën, zoals hormoonbehandelingen, hebben hun nut al bewezen bij bepaalde kankertypes. Meer en meer worden ook nieuwe (doelgerichte) geneesmiddelen systemisch toegediend (zie verder).
Er kunnen ook combinaties van systemische (chemo)therapie en radiotherapie toegediend worden, waarbij de therapieën elkaar versterken. Sommige chemotherapeutische middelen zijn ‘radiosensitiserend’. Dat betekent dat ze de werking van de radiotherapie die op de chemotherapie volgt versterken. Een dergelijke combinatie kan bijgevolg een betere vernietiging van de kankercellen veroorzaken met lagere dosissen.
5 Specifieke therapievormen
Naast de klassieke of conventionele therapieën die we hierboven bespraken, zijn er nog een aantal andere, vaak nieuwe behandelingswijzen, die zich soms heel specifiek zijn voor een bepaald kankertype.
5.1 Doelgerichte (moleculaire) therapieën
Klassieke cytostatica zijn vergelijkbaar met een kanonkogel waarmee we kankercellen bestrijden. Ze zullen de kankercel wellicht raken, maar er zullen ook heel veel normale cellen geraakt of vernietigd worden. Dat laatste resulteert in ernstige nevenwerkingen die eerder beschreven werden. De beperking van chemotherapie is eigen aan het werkingsmechanisme van deze geneesmiddelen. Cytostatica remmen voornamelijk de celdeling, waardoor de getroffen cel stopt met delen of afsterft. Het is op zich prima als een kankercel afsterft, maar helaas deelt niet enkel de kankercel, maar ook een aantal normale celtypes relatief snel, waardoor die ook aangevallen worden door deze geneesmiddelen. Wat dat betreft zou je kunnen stellen dat chemotherapie ‘niet selectief genoeg’ werkt, vandaar de vergelijking met een kanonkogel. Dat is uiteraard niet de bedoeling, maar een gevolg van gelijkaardige celdelingseigenschappen bij kankercellen en (sneldelende) gezonde cellen.
Behandeling
Om dit te verhelpen moeten we op zoek gaan naar veel ‘selectievere’ of specifiekere geneesmiddelen, die liefst enkel de kankercellen aanvallen en de normale cellen zo veel mogelijk met rust laten. Geen kanon, maar een sluipschutter, zeg maar. Om dat te realiseren moeten we eerst veel meer kennis vergaren over de verschillen tussen kankercellen en normale cellen. De vaststelling dat kankercellen sneller delen dan normale cellen is zoals blijkt absoluut niet voldoende als onderscheidende eigenschap. We moeten veel meer (kleine) verschillen in kaart brengen waardoor we als het ware een ‘identiteitskaart’ van de kankercel kunnen maken en deze kunnen vergelijken met de eigenschappen van een normale cel. Op die verschillen kunnen we ons vizier dan richten om nieuwe geneesmiddelen te ontwikkelen. Om dit te illustreren lichten we eerst toe hoe een cel werkt vooraleer zij zich deelt.
Een belangrijk inzicht is dat het niet alleen om de tumorcel gaat, maar ook om de omgeving. Bloedvaten, het immuunsysteem, fibroblasten … spelen allemaal een rol in de tumorgroei.
A Nieuwe inzichten in de werking van een gezonde cel
Veel van onze (gezonde) cellen hebben langs de buitenkant een soort van ‘ontvangers’, die ervoor groeifactor kunnen zorgen dat bepaalde groeistoffen de cel be- receptorreiken zodat de cel kan delen of vernieuwen. Deze ontvangers noemen we ‘receptoren’, bijvoorbeeld signaalgroeifactorreceptoren. Zodra een groeifactor transductie zich aan de receptor bindt, start er een heel mechanisme met verschillende stappen binnenin celkern de cel, tot de cel uiteindelijk erfelijk materiaal begint bij te maken om te vermenigvuldigen. Die stappen krijgen de wetenschappelijke naam Figuur 5 Cel met receptor en signaaltransductie ‘signaaltransductie’, waarmee bedoeld wordt dat een signaal (bijvoorbeeld een groeifactor die zich bindt aan een groeifactorreceptor) ‘getransduceerd’ of in stappen doorgegeven wordt aan celorganellen (bijvoorbeeld aan de celkern om DNA-vermenigvuldiging in gang te zetten). Uiteraard is dit heel strikt gereguleerd. Afhankelijk van de noodzaak, kunnen de receptoren minder of meer tot expressie gebracht worden op de cel (eenvoudig gesteld: meer en gevoeligere ontvangers op de celwand zorgen ervoor dat de cel sneller kan reageren op aanwezige groeifactoren waardoor ze ook sneller kan vermenigvuldigen). Ook het hele signaaltransductiemechanisme binnenin de cel kan verschillen, waardoor het mogelijk is om de mate waarin de cel meer of minder deelt te beïnvloeden.
B Kankercellen manipuleren op basis van nieuwe inzichten
De laatste jaren is via uitgebreid moleculairbiologisch en genetisch onderzoek ontdekt dat bepaalde kankercellen aan de buitenkant een overmaat aan receptoren of
137
138
Hoofdstuk 7
overgevoelige receptoren tot expressie brengen. Daarnaast volgen kankercellen vaak andere signaaltransductiewegen dan gezonde cellen.
Antilichamen
VOORBEELD
Een aantal cellen brengt een specifieke groeifactorreceptor tot expressie, de zogenaamde ‘epidermale-groeifactorreceptor’ of afgekort EGFR (van de Engelse term Epidermal Growth Factor Receptor). Bepaalde groeifactoren (zoals de epidermale groeifactor) kunnen aan deze receptor binden en zo via signaaltransductie de cel de opdracht geven om te delen. Dit gebeurt zo in ons lichaam onder volstrekt normale omstandigheden. Maar sommige kankercellen, onder andere die van een aantal types dikkedarm- en longkanker, blijken veel te veel van dergelijke EGFR te vertonen (men spreekt hierbij van een ‘overexpressie’). Vaak is die receptor ook gemuteerd, waardoor de receptor een blijvend signaal doorstuurt naar de celkern om te delen, zelfs al is er geen groeifactor aan gebonden. Daardoor gaan deze kankercellen overmatig en ongecontroleerd delen en vormen ze een snelgroeiende tumor.
Door wetenschappelijk en farmaceutisch onderzoek is men erin geslaagd om een ‘remmende’ stof voor deze receptor te produceren. Dat is een synthetisch of biologisch gemaakte stof die heel erg lijkt op de groeifactor die normaal aan EGFR bindt, maar die geen signaal doorgeeft. Als deze stof zich bindt aan de receptor, zal ze deze receptor blokkeren en ervoor zorgen dat er geen signalen meer doorgegeven worden om te delen. Het gevolg is dat de kankercellen die (te) veel EGFR tot expressie brengen en die behandeld worden met deze remmer, onderdrukt worden en niet langer kunnen delen. Dat gebeurt dus heel specifiek op de kankercel die EGFR in overmaat tot expressie brengt.
In dit voorbeeld is de remmende stof een antilichaam (zie het hoofdstuk over tumorgroei), een soort ‘antistof’ tegen de receptor. Het antilichaam blokkeert de receptor waardoor groeifactoren zich niet meer kunnen binden op de kankercel. Nieuwe geneesmiddelen zoals deze krijgen ook een herkenbare naam. In dit geval wordt het remmende antilichaam voor de EGFR ‘cetuximab’ genoemd. Het suffix ‘ ab’ komt van de afkorting van het Engelse woord voor antilichaam, namelijk ‘antibody’. Intussen worden meer en meer van dergelijke antilichamen als nieuw geneesmiddel ontwikkeld.
groeifactor blokkeren receptor
Figuur 6 Blokkering van een receptor
Behandeling
Monoklonale antilichamen
Men kan antilichamen aanmaken in een laboratorium. Antilichamen zijn gericht tegen een bepaald antigeen. Hiervoor gebruikt men afweercellen van één bepaald type (of een ‘kloon’) gericht tegen een specifiek antigeen. Daarom spreekt men over ‘monoklonale’ antilichamen. De ontwikkeling van monoklonale antilichamen vindt zijn oorsprong in de jaren zeventig, maar was toen nog gebaseerd op muizenexperimenten. De eerste monoklonale antilichamen waren muisantilichamen en daardoor niet direct bruikbaar voor humane therapieën. Intussen heeft men deze antilichamen al dan niet volledig kunnen vervangen door humane antilichamen. Men spreekt over ‘chimere’ antilichamen als zij deels muis, deels humaan zijn en over ‘gehumaniseerde’ antilichamen als zij (zo goed als) volledig humaan zijn gemaakt. Dit weerspiegelt zich ook in de naamgeving van de therapeutische antilichamen. Producten eindigend op ‘-omab’ zijn afkomstig van een muis, eindigend op ‘-ximab’ zijn chimeer en eindigend op ‘-zumab’ en ‘-umab’ zijn gehumaniseerd. Meer informatie over deze naamgeving vind je in de volgende uitdiepingskader.
Inhibitoren
Wetenschappers zijn er intussen in geslaagd om ook door te dringen tot het mechanisme van signaaltransductie. Ook hierbij worden stoffen ontwikkeld die een of enkele stapjes van het signaaltransductieproces weten te remmen. Laten we bij hetzelfde voorbeeld van EGFR blijven om dit te verduidelijken.
VOORBEELD
Stel dat we de receptor op de celwand niet (kunnen) blokkeren met een antilichaam, dan kunnen we wel de stappen van de signaaltransductie afremmen. Als we dit doen, geraakt het signaal van de groeifactor ook niet tot bij de celkern die de deling inzet en zal de cel bijgevolg ook niet verder delen.
De remmende stoffen zijn in dit geval meestal geen antilichamen maar heel kleine ‘inhiberende’ of onderdrukkende moleculen die synthetisch aangemaakt worden. Deze stoffen krijgen een naam die eindigt op ‘ ib’, afkomstig van ‘inhibitor’. Bijvoorbeeld, ‘erlotinib’ is een geneesmiddel dat bepaalde stappen van het signaaltransductieproces van EGFR-binding inhibeert.
139
140
groeifactor receptor
signaaltransductie Hoofdstuk 7
celkern
Figuur 7 Inhibitie van signaaltransductiewegen
Tyrosinekinaseinhibitoren
Vaak zijn deze inhibitoren gericht tegen een specifiek enzym dat een heel belangrijke rol speelt in het signaaltransductieproces, namelijk ‘tyrosinekinase’. Dit enzym zet de signaaltransductie binnenin de cel in gang, dus als dit enzym doelgericht geblokkeerd wordt in de kankercel, worden er geen signalen meer doorgegeven en zal de celdeling stilvallen. De inhiberende doelgerichte geneesmiddelen die dit enzym blokkeren noemt men ‘tyrosinekinase-remmers’ of ‘tyrosinekinase-inhibitoren’, soms afgekort als ‘TKI’s’. Voorbeelden hiervan zijn het hierboven vermelde erlotinib en imatinib.
Als we chemotherapie vergelijken met een kanon, kunnen we deze nieuwe geneesmiddelen dus beter vergelijken met een sluipschutter omdat ze heel specifiek op een kleine gewijzigde eigenschap van de kankercel inwerken.
Naamgeving
De naamgeving van de doelgerichte (moleculaire) geneesmiddelen lijkt ingewikkeld, maar heeft wel een logische structuur. Eerder werd beschreven dat de naam eindigt op ‘ (m)ab’ of op ‘ ib’, afhankelijk of het (monoklonale) antilichamen of moleculaire inhibitoren betreft. Voor de antilichamen wordt het suffix verder uitgebreid als ‘-omab’, ‘-ximab’, ‘-zumab’ of ‘-umab’ naargelang hun oorsprong (zie hoger). Het middelste deel van de naam wijst op het systeem dat ze blokkeren: ‘-tu-‘ is gericht op een specifiek tumordoel, ‘-tin-‘ wordt gebruikt voor tyrosinekinase-inhibitoren, ‘-zom-‘ voor proteasoom-inhibitie (proteasomen spelen in de cel een belangrijke rol bij de controle van eiwitafbraak en celgroei) en ‘-ci-‘ wanneer het doel zich bevindt in het ‘circulatoir’ of bloedsomloopsysteem (zie ook verder bij de anti-angiogene therapie) of in het celcyclus-systeem.
Behandeling
Enkele voorbeelden zijn:
– cetuximab (chimeer antilichaam tegen EGFR dat tot overexpressie komt bij tumorcellen); – imatinib (specifieke tyrosinekinase-inhibitor); – bortezomib (proteasoom-inhibitor); – seliciclib (inhibitor van de celcyclus).
C Combinatietherapieën en geïndividualiseerde kankertherapie
De toepassing van doelgerichte (moleculaire) therapieën gebeurt meestal in combinatie met andere (klassieke) therapievormen zoals chirurgie en chemotherapie. Vaak worden ook verschillende soorten doelgerichte geneesmiddelen gecombineerd. Wetenschappers, artsen en farmaceutische bedrijven ontwikkelen voortdurend nieuwe (moleculaire) geneesmiddelen die welbepaalde kankercellen kunnen aanvallen en vernietigen. We verwachten de komende jaren een aanhoudende vooruitgang in dit onderzoek zodat we in de nabije toekomst wellicht zeer geïndividualiseerde therapieen kunnen toepassen bij welbepaalde kankertypes en bij individuele patiënten. Men spreekt in dit verband over ‘geïndividualiseerde’ of ‘gepersonaliseerde’ kankertherapie. Deze persoonlijke therapie is gebaseerd op enerzijds de genetische achtergrond van de patiënt zelf en anderzijds het genetische profiel van zijn individuele tumor. Dankzij deze tactiek zal in de (nabije) toekomst wellicht elke patiënt zijn eigen specifieke, gerichte therapie krijgen, met veel hogere genezingskansen tot gevolg. De nood aan combinatiebehandelingen is er ook gekomen door betere inzichten in (het) resistentiemechanisme(n) tegen doelgerichte behandelingen. Het blokkeren van de pathway op verschillende niveau’s is een mogelijkheid. Een voorbeeld hiervan is de combinatie van een HEC-inhibitor met een BRAF-blokker bij BRAF-gemuteerde melanoma. De rol van predictieve biomerkers is hier groot. Vroeger was deze statistisch. Nu wordt deze meer en meer dynamisch. Een tumor kan met andere woorden initieel wild-type RAS zijn en later onder druk van therapie RAS-mutant worden.
5.2 Anti-angiogene therapie
Een andere bijzondere therapievorm is de anti-angiogene therapie. Deze therapievorm wordt al enkele jaren toegepast in de oncologische kliniek, wat de ‘nieuwheid’ van deze therapievorm ietwat relativeert. Toch bespreken we deze therapie in dit hoofdstuk omdat het een doelgerichte therapie is, waarnaar ook vandaag nog heel wat baanbrekend wetenschappelijk onderzoek verricht wordt.
141
142
Hoofdstuk 7
Om deze behandelingswijze toe te lichten, keren we ook hier even terug naar het hoofdstuk over tumorgroei. Daar beschreven we hoe groeiende tumoren in staat zijn bloedvaten naar zich toe te trekken, om zo zuurstof en voedingsstoffen tot bij alle kankercellen te laten komen (‘angiogenese’). Het doel van de anti-angiogene therapie is precies om deze bloedvatvorming naar de tumor tegen te gaan. Naast de impact op de zuurstofvoorziening voor de tumor is er ook een ‘normaliserend’ effect op de bloedvaten van de tumor. Hierdoor kan chemotherapie die in combinatie gegeven wordt, de tumor beter bereiken. Onlangs zijn enkele geneesmiddelen ontwikkeld die angiogenese kunnen afremmen door de vorming van cellen van de bloedvatwanden te verhinderen. Als dit gerealiseerd kan worden, zullen er minder bloedvaten naar de tumor groeien en worden de tumorcellen als het ware uitgehongerd en worden ze niet langer voorzien van zuurstof. Het resultaat is dat de tumorcellen stoppen met delen of sterven en dat de tumor verkleint. Anderzijds focust recent onderzoek ook op het proberen normaliseren van de bloedvaten in plaats van deze te vernietigen. Bloedvaten blijven immers belangrijk voor de aanvoer van geneesmiddellen en antitumorimmuuncellen. In het kader van anti-angiogene therapie kan ook VEGF als specifiek doel beschouwd worden (meer uitleg over VEGF vind je in het hoofdstuk over tumorgroei). Als we een geneesmiddel kunnen toedienen dat de werking van VEGF afremt, zullen er geen nieuwe bloedvaten naar de tumor gelokt worden, of kan er bloedvatnormalisatie bekomen worden, afhankelijk van de mate van afremming. Daarvoor zijn er intussen ook therapeutische antilichamen ontwikkeld die specifiek op VEGF binden en het blokkeren (zie figuur 9).
anti-angiogene therapie
Figuur 8 Principe van antiangiogene therapie
VOORBEELD
Een voorbeeld is ‘bevacizumab’, dat is een anti-VEGF-gericht monoklonaal antilichaam dat klinisch gebruikt wordt bij de behandeling van bepaalde kankers. Intussen synthetiseerde men ook al kleine inhiberende moleculen die de signaaltransductiecascade na binding van VEGF blokkeren. Voorbeelden hiervan zijn ‘sorafinib’ en ‘sunitinib’. De toediening van deze geneesmiddelen remt ook de angiogenese in de tumor zelf af.
Behandeling
Anti-angiogene middelen zullen meestal gebruikt worden in combinatie met conventionele kankertherapieën zoals chemotherapie. Deze geneesmiddelen moeten uiteraard wel met de nodige omzichtigheid gebruikt worden, omdat ook andere normale weefsels soms nieuwe bloedvaten nodig hebben.
Meer zuurstoftoevoer naar de tumor om kanker te bestrijden?
De anti-angiogene therapie blijft onderwerp van veel onderzoek. De eerder aangehaalde studie over zuurstoftekort bij tumoren (zie het hoofdstuk over tumorgroei) zal zeker zijn weerslag hebben hierop. Recent werd aangetoond dat tumorcellen een agressievere epigenetische vorm kunnen aannemen wanneer er onvoldoende zuurstof (en dus onvoldoende bloedvaten) aanwezig zijn. Verder onderzoek zal moeten uitwijzen of bepaalde kankertypes dan net wel of net niet aan bloedvatremming moeten onderworpen worden.
143

VEGF
Figuur 9 Blokkering van VEGF
5.3 Immunotherapie
Immunotherapie is gericht op het helpen of versterken van het eigen immuunsysteem van de patiënt om kankercellen af te weren en te vernietigen. In het hoofdstuk over tumorgroei bespraken we hoe het immuunsysteem sommige kankercellen kan herkennen en probeert te vernietigen. De herkenning gebeurt dankzij de aanwezigheid van specifieke tumorantigenen op de kankercellen. Als deze tumorantigenen herkend worden, kan het immuunsysteem op gepaste wijze reageren door de kankercellen rechtstreeks aan te vallen of door antistoffen aan te maken die de kankercellen vernietigen. Bij kankerpatiënten werkt dit systeem helaas onvoldoende, anders zouden alle kankercellen in het lichaam van de patiënt geëlimineerd worden. Bovendien bleek de laatste jaren dat het immuunsysteem ook beïnvloed kan worden door de kankercellen, doordat de tumor bijvoorbeeld bepaalde cellen van het afweersysteem weet te verzwakken of zelfs uit te schakelen.
144
Hoofdstuk 7
Het achterliggende idee van immunotherapie is tweeledig:
1 enerzijds is het de bedoeling om het immuunsysteem te versterken en; 2 anderzijds wil immunotherapie de tumorcellen verzwakken door ze bijvoorbeeld beter zichtbaar te maken voor de cellen van het immuunsysteem.
Beide strategieën zijn erop gericht om de afweer tegen kankercellen efficiënter te maken. Men heeft in klinische studies veelbelovende resultaten geboekt door speciale medicatie, die het afweersysteem specifiek versterken, te gebruiken of door het toedienen van een bepaalde vorm van vaccins tegen kankercellen. Omdat deze therapievorm gebruikmaakt van een bestaand lichaamssysteem, het afweersysteem, zijn de nevenwerkingen verschillend van de klassieke behandelingen. Er zijn verschillende strategieën mogelijk om immunotherapie klinisch te realiseren. De belangrijkste en meest veelbelovende manieren zijn het gebruik van ‘monoklonale antilichamen’, gemanipuleerde cellen en van ‘cytokinen’. In wat volgt worden de verschillende strategieën meer in detail besproken.
A Immunotherapeutische monoklonale antilichamen
Binnen de immunotherapeutische antilichamen maakt men een onderscheid tussen:
− antilichamen tegen tumorantigenen op de kankercel en; − antilichamen tegen antigenen op bepaalde cellen van het immuunsysteem.
Het gebruik van antilichamen tegen tumorantigenen wordt op verschillende manieren toegepast.
Naakte antilichamen
De eerste groep antilichamen binden zich meteen aan de tumorantigenen van de kankercel. Eenmaal gebonden, fungeren deze antilichamen als een soort ‘vlag’ op de kankercel waardoor die gemakkelijker herkend kan worden door ons immuunsysteem. Zo maken deze antilichamen de kankercel meer zichtbaar en als gevolg hiervan worden ze efficiënter door ons afweersysteem, meer bepaald door de NK-cellen, vernietigd. Dit principe heet ‘antigeen-gemedieerde cellulaire cytoxiciteit’, afgekort ADCC.
gelabeled antilichaam antigeen
kankercel
Figuur 10 Naakt antilichaam
Behandeling
Geconjugeerde antilichamen en heteroconjugaten
Een bijkomende mogelijkheid is het koppelen van toxische, chemotherapeutische of radioactieve stoffen aan antilichamen tegen gekende tumorantigenen. Als deze gekoppelde antilichamen toegediend worden bij de patiënt, zullen ze de tumor(antigenen) opzoeken en zich eraan binden, waardoor de aanhangende stoffen de kankercellen vernietigen. Men spreekt over ‘geconjugeerde’ ‘chemogelabelde’ of ‘radiogelabelde’ antilichamen. Het voordeel van deze behandelingswijze is dat de chemotherapeutische of radioactieve stof dicht bij de kankercellen komt te zitten. Dit vermindert de schade aan normale cellen in andere delen van het lichaam.
Het is ook mogelijk om een antilichaam aan een tumorantigeen te koppelen met een ander antilichaam, gericht tegen een antigeen op een cel van het afweersysteem. Dergelijk ‘dubbelantilichaam’ noemt men ook een ‘heteroconjugaat’ en dat kan een kankercel efficiënt koppelen aan een cel van het afweersysteem, waarbij die laatste cel dan de kankercel vernietigt.
Om in het laboratorium antilichamen te maken die gericht zijn tegen tumorantigenen, is het natuurlijk noodzakelijk dat men de tumorantigenen kent en goede antigenen kiest met zo weinig mogelijk kans op ‘immune escape’-varianten, wat wil zeggen dat de tumorcellen zich ontdoen van dit antigeen om te kunnen ontsnappen aan het afweersysteem. Helaas kunnen tumorantigenen op het oppervlak van tumorcellen sterk verschillen van patiënt tot patiënt, zelfs van tumorcel tot tumorcel. De moeilijke zoektocht naar geschikte antigenen is een belangrijke beperking in de toepassing van deze geneesmiddelen voor verschillende kankertypes. toxine + antilichaam antigeen
kankercel
Figuur 11 Geconjugeerd antilichaam
afweercel
antilichamen antigeen
kankercel
Figuur 12 Heteroconjugaat
De tweede groep therapeutische antilichamen zijn niet gericht tegen tumorantigenen, maar tegen antigenen op bepaalde cellen van het immuunsysteem. De therapeutische werking hiervan is iets minder voor de hand liggend en vereist enige toelichting vooraf.
145
146
Hoofdstuk 7
Immuuncheckpointinhibitoren
Ons immuunsysteem is heel strikt gereguleerd en onze afweercellen moeten uiteraard zeer selectief te werk gaan: vreemde cellen moeten aangevallen en vernietigd worden, terwijl gezonde lichaamseigen cellen niet aangevallen mogen worden. Bovendien moeten actieve cytotoxische lymfocyten terug tot rust gebracht kunnen worden als een aanval niet meer nodig is. Daarvoor hebben de afweercellen een soort schakelaar. Die schakelaar staat op ‘actief’ als de afweercel moet aanvallen en staat op ‘niet-actief’ als ze dat niet mag doen. Mocht die schakelaar er niet zijn, dan bestond er het risico dat de afweercellen constant geactiveerd waren en zo misschien lichaamseigen gezonde cellen zouden aanvallen. In wetenschappelijke termen noemen we deze schakelaars de ‘immuuncheckpoints’.
Bij kanker merken we dat de checkpoints op de afweercellen deze cellen te veel op ‘non-actief’ zetten, zodat de tumorcellen onvoldoende aangevallen worden. Bovendien kan de kankercel zelf een negatieve invloed uitoefenen door via immuuncheckpoints de afweercellen op non-actief te zetten. Deze kankercellen hebben als het ware de ‘achilleshiel’ van onze afweercellen gevonden, om een aanval te vermijden. Als we therapeutisch kunnen ingrijpen ter hoogte van de checkpoints, kunnen we de afweercellen toch activeren om kankercellen te vernietigen. Dat kan intussen door therapeutische antilichamen die men in het laboratorium aanmaakt en die zich specifiek binden aan de checkpoints om ze uit te schakelen als ze een afweerreactie onderdrukken. Deze antilichamen noemen we ‘immuuncheckpointinhibitoren’. Ook dit zijn doelgerichte geneesmiddelen. Ze krijgen een naam met suffix ‘-ab’ omdat om het antilichamen gaat.
PD1 en CTLA4: veelbelovende immuuncheckpoints
Een bijzonder en vermeldenswaardig immuuncheckpoint is PD-1 (de afkorting van ‘programmed cell death protein 1’). Dit is een immuuncheckpoint dat aanwezig is op afweercellen (in het bijzonder T- en NK-cellen) en ervoor zorgt dat een immuunantwoord tot rust gebracht kan worden. Het PD-1-eiwit is een receptor voor de liganden PD-L1 en PD-L2. Wanneer de binding tussen PD-1 en een van de liganden plaatsvindt, dan zal activatie van de afweercel onderdrukt worden. Helaas hebben een aantal kankercellen grote hoeveelheden van het PD-L1-eiwit, waardoor ze een aanval van T- en NK-cellen kunnen ontwijken. Zowel PD-1 als PD-L1 zijn doelwitten van blokkerende geneesmiddelen. Therapeutische blokkerende antilichamen, gericht tegen ofwel PD-1 ofwel PD-L1, verhinderen de binding tussen deze eiwitten en kunnen zo de afweer tegen kankercellen stimuleren. Zij worden sinds kort volop gebruikt in de kliniek voor de behandeling van verschillende kankers. Voorbeelden van PD-1-inhibitoren zijn ‘nivolumab’ en ‘pembrolizumab’. Voorbeelden van inhibitoren tegen PD-L1 zijn ‘durvalumab’ en ‘atezolizumab’.
Behandeling
Een ander vermeldenswaardig checkpoint dat in het vizier komt bij deze doelgerichte immunotherapie, is CTLA-4. Ook dit is een belangrijke schakelaar die de T-cellen uitzet en die gemanipuleerd kan worden door therapeutische antilichamen, zoals bijvoorbeeld ‘ipilimumab’ en ‘tremelimumab’. Een behandeling met dit antilichaam activeert de T-cellen en stimuleert de afweer tegen kankercellen.
In 2018 werden de ontdekkers van deze eiwitten en van het principe van immuunonderdrukkende immuuncheckpoints gehonoreerd met de Nobelprijs voor Geneeskunde. Inhibitoren van deze beide immuuncheckpoints vinden in steeds meer kankertypes een goedgekeurde klinische toepassing en verder onderzoek is gaande hoe dit behandelingsprincipe voor nog meer kankerpatiënten een doorbraak kan zijn.
B Cellulaire immunotherapie
Bij cellulaire immunotherapie maakt men gebruik van (al dan niet gemanipuleerde) cellen van de tumor of van het afweersysteem om de afweerreactie tegen kanker te verbeteren. De belangrijkste vormen van cellulaire immunotherapie zijn ‘T-celtherapie’ en ‘dendritische celtherapie’. Ook naar ‘NK-celtherapie’ wordt tegenwoordig veel wetenschappelijk onderzoek verricht.
Tceltherapie
Om de werking van T-celtherapie te illustreren, is het nuttig om het beginsel van de tumorimmunologie en de immunotherapie even opnieuw toe te lichten. Een van de belangrijke spelers van ons afweersysteem zijn de T-cellen of ‘T-lymfocyten’. Deze cellen zorgen voor een rechtstreekse aanval op en afweer van vreemde indringers of cellen in ons lichaam. Ze kunnen vergeleken worden met de soldaten van ons afweersysteem. Om een vreemde indringer of cel te herkennen en deze efficiënt te kunnen aanvallen, is het belangrijk dat een T-cel perfect functioneert. Daar knelt bij kanker soms het schoentje.
In het geval van een groeiende tumor reageren de T-cellen te traag en/of niet direct genoeg tegen de kankercel, omdat ze bijvoorbeeld de tumorantigenen op een kankercel onvoldoende herkennen of omdat de T-cellen uitgeput zijn. Bij T-celtherapie worden T-cellen afgenomen bij de kankerpatiënt en via complexe laboratoriumtechnieken buiten het lichaam vermenigvuldigd en ‘getraind’ om actiever te worden tegen kankercellen. Als die getrainde T-cellen daarna opnieuw worden ingespoten bij de patiënt, zullen ze kankercellen efficiënter aanvallen en vernietigen. Deze T-cellen kunnen in het labo via genetische methoden o.a. uitgerust worden met een zogenaamde CAR, een ‘chimere antigeenreceptor’. Deze CAR is in staat om specifieke antigenen op de tumorcellen te binden, waardoor de CAR-T-cellen de tumor veel efficiënter kunnen vinden en vernietigen. Er hebben intussen zeer hoopgevende klinische studies plaatsgevonden met deze vormen van immunotherapie, die spectaculaire resultaten opleveren bij de behandeling van B-celtumoren met CAR-T-cellen die CD19 als doelwit hebben. Deze
147
148
Hoofdstuk 7
celtherapieproducten zijn ondertussen goedgekeurd voor gebruik in de kliniek buiten studieverband. Wetenschappers wereldwijd schakelen vandaag een versnelling hoger om deze therapievorm verder te ontwikkelen, ook voor andere kankertypes. Naast T-cellen is het ook zeer interessant om NK-cellen in te zetten bij celtherapie. Net zoals bij antilichaamtherapie tegen tumorantigenen, is het ook hier de moeilijkheid om de juiste antigenen te vinden op het oppervlak van tumorcellen (die op zoveel mogelijk tumorcellen van zoveel mogelijk kankerpatiënten aanwezig zijn) en om te zorgen dat de bewerkte afweercellen hun weg vinden naar de tumor.
Dendritische celtherapie
Dendritische cellen zijn cellen die dode celdeeltjes opsporen in het lichaam, opnemen en de antigenen erin presenteren aan T-cellen, die dan op hun beurt een directe aanval kunnen inzetten. Als we de T-cellen vergelijken met soldaten, dan vergelijken we de dendritische cellen best met generaals die speurwerk doen en opdrachten geven aan de soldaten. Wetenschappelijk onderzoek van de laatste jaren heeft uitgewezen dat het belang van deze dendritische cellen heel groot is. Deze cellen blijken supergespecialiseerd te zijn in het presenteren van antigenen en bepalen mee de gevoeligheid van ons afweersysteem. Helaas falen ook deze cellen vaak bij kanker. Enerzijds omdat ze de tumorantigenen in het lichaam van een kankerpatiënt onvoldoende opnemen en anderzijds omdat ze ‘corrupt’ gemaakt zijn door de tumor, waardoor ze de tumorantigenen onvoldoende presenteren aan de T-cellen en de tumor niet aangevallen wordt. Om dit therapeutisch te verhelpen, moeten de dendritische cellen dus gemanipuleerd worden, zodat ze getraind worden tot betere generaals. Dendritische celtherapie is vergelijkbaar met T-celtherapie, maar in plaats van de T-cellen worden nu de dendritische cellen therapeutisch onder handen genomen (of in beeldspraak: niet de soldaten, maar de generaals worden getraind). Men spreekt in dit geval van ‘dendritische celvaccinatie’. Dit soort immunotherapie verloopt als volgt.
Men neemt bepaalde witte bloedcellen af bij de patiënt, uit het bloed of uit het beenmerg. Uit die cellen kan men in het laboratorium met complexe en strikt gecontroleerde technieken dendritische cellen opkweken. Daarna brengt men deze gecultiveerde dendritische cellen in contact met tumorcellen of tumorcelfragmenten van de patiënt zelf. Ook dit gebeurt buiten het lichaam, in het laboratorium, zodat men er zeer nauwkeurig op kan toezien dat de dendritische cellen de tumorantigenen van de kankercellen opnemen en presenteren. De dendritische cellen worden zo getraind om de tumorantigenen heel deskundig te presenteren op een manier dat de T-lymfocyten actief worden. De getrainde dendritische cellen worden nadien terug ingespoten bij de patiënt (daarom spreekt men van ‘therapeutische vaccinatie’) en zullen in het lichaam op een zeer efficiente manier de tumorantigenen presenteren aan de T-cellen van de patiënt, die op hun beurt een snelle aanval inzetten tegen nog aanwezige kankercellen.
Behandeling
dendritische cellen (DC)
149
colontumor
individuele tumorcellen
DC*
Figuur 13 Voorbeeld van dendritische-cel-vaccinatie
Het afnemen, kweken en manipuleren van T-cellen of dendritische cellen van de patiënt gebeurt in zogenaamde ‘cleanrooms’ in gecertificeerde celtherapiecentra. Cleanrooms zijn speciale laboratoriumruimten die uitermate steriel gehouden worden om de kans te minimaliseren dat gekweekte cellen besmet geraken met ziektekiemen. De gemanipuleerde cellen worden immers nadien terug ingespoten bij de patiënt, waarbij elk risico op besmetting met bijkomende ziekten vermeden moet worden.
C Andere vormen van immunotherapie
Kankervaccinatie
Net zoals je een vaccin kan ontwikkelen tegen een infectieziekte, kan je een vaccin maken tegen kanker. Een vaccin is een combinatie van bepaalde antigenen met een adjuvans of immuunstimulerende stof. In het geval van kankervaccins gaat men het afweersysteem in het lichaam ‘aanleren’ om tumorantigenen aan te vallen, door tumorantigenen samen met een adjuvans in te spuiten bij de patiënt, zonder dat hij hiervan ziek kan worden. Zo wordt het afweersysteem in het lichaam geprikkeld om precies tegen die tumorantigenen een afweerreactie in te zetten. Als er dan in het lichaam van de patiënt tumorcellen aanwezig zijn met een of meerdere van die tumorantigenen, zal er een snelle respons komen van het immuunsysteem en is de kans veel groter dat de kankercellen volledig vernietigd worden. Het gaat hierbij om ‘therapeutische’ (kanker) vaccins, met het oog op genezing van een bestaande ziekte. Dendritische celtherapie is ook een vorm van kankervaccinatie, waarbij de dendritische cel zelf het adjuvans (de immuunstimulator) is die de tumorantigenen draagt.
150
Hoofdstuk 7
Als vaccins worden gebruikt als behandeling, spreekt men van therapeutische vaccinatie. De meeste andere gekende vaccins worden toegediend vóór een eventuele ziekte optreedt, dit zijn ‘profylactische’ of preventieve vaccins (zoals het vaccin tegen griep of het baarmoederhalskankervaccin dat in het hoofdstuk over oorzaken en preventie werd toegelicht).
Nieuwe technieken voor kankervaccinatie
Vandaag verricht men wereldwijd veel onderzoek om deze vorm van kankervaccinatie te verbeteren, in de hoop een ‘universeel’ kankervaccin tegen meerdere soorten kankertypes te kunnen ontwikkelen. Men gebruikte aanvankelijk dode kankercellen of kankercelfragmenten, maar sinds kort maakt men ook gebruik van ‘nanodeeltjes’. Dat zijn extreem kleine deeltjes (vergelijkbaar met minuscule capsules) van bijvoorbeeld vet, waarin men een genetische code van kanker aanbrengt en die men vervolgens inspuit bij de patiënt. Deze deeltjes gaan in het lichaam bijvoorbeeld naar de milt, waar de afweercellen ‘getraind’ worden. Ze worden aangeleerd om cellen met deze genetische kankercode aan te vallen. Men vergelijkt dit met het inbrengen van een ‘paard van Troje’ tegen tumoren. De resultaten die voortkomen uit proefdierstudies zijn hoopvol, maar klinische studies moeten nog uitgebreid worden. De voordelen van dit type vaccinatie zouden zijn dat het vaccin snel en relatief goedkoop aangemaakt kan worden en dat potentieel zowat elk antigeen van tumoren op deze manier gecodeerd kan worden.
Cytokinen
Er zijn nog enkele andere vormen van immunotherapie die vandaag in de oncologische kliniek geïntroduceerd of gebruikt worden. Een daarvan is het therapeutisch toedienen van zogenaamde ‘cytokinen’. Dit zijn stoffen die ook in het lichaam voorkomen en die het afweersysteem ‘boosten’ en het zo actiever maken. Cytokinen kunnen daarbij de aanmaak van afweercellen stimuleren en/of de activiteit van de afweercellen versterken. Het gaat hierbij over een algemene stimulatie van het afweersysteem die niet specifiek gericht is op de afweer van kankercellen. Men spreekt daarom van een ‘nietspecifieke’ vorm van immunotherapie. Cytokinen worden meestal niet als enige behandeling gebruikt om kanker te bestrijden, maar hebben een ondersteunende werking voor andere (immuno)therapievormen. Veelgebruikte cytokinen zijn interleukines en interferonen (vooral interferon-alfa). Zo zorgt bijvoorbeeld Interleukine-2 ervoor dat T-cellen zich snel kunnen vermenigvuldigen en heel actief worden. Recent onderzoek heeft aangetoond dat interleukine-15 diezelfde eigenschappen heeft, maar met minder
Behandeling
bijwerkingen. Bovendien heeft men nu ook ‘superagonisten’ van interleukine-15, die betere farmaceutische eigenschappen hebben en dus nog krachtiger werken. Interferon-alfa verhoogt dan weer de activiteit van afweercellen, terwijl het de groei van kankercellen kan afremmen.
Naast cytokinen, die ook natuurlijk in het lichaam voorkomen, worden er ook klinische testen uitgevoerd met synthetisch aangemaakte stoffen die het afweersysteem ‘boosten’. Men spreekt over ‘immuunmodulerende’ geneesmiddelen. Soms gebruikt men ook een bepaalde bacterie, de zogenaamde ‘Bacillus Calmette-Guérin (BCG)’. Dat is een bacterie die al eerder bekend was in de context van vaccinatie tegen tuberculose. Ook bij de immunotherapeutische behandeling van kanker kan deze bacterie gebruikt worden om het immuunsysteem niet-specifiek te stimuleren. Ook andere moleculen worden onderzocht die leiden tot immuunstimulatie en een grote, lokale productie van immuunstimulerende cytokinen.
Oncolytischevirustherapie
Een andere bijzondere vorm van immunotherapie is de ‘oncolytische-virus-therapie’. Die maakt gebruik van genetisch gemodificeerde virussen die geïnjecteerd worden in de tumor. Het virus vermenigvuldigt zich in de kankercellen, doet ze openbarsten en trekt afweercellen richting het gezwel aan. Deze therapie werd al met succes toegepast bij onder andere sommige vormen van huidkanker.
D Microbioom
Het belang van de darmflora in heel wat fysiologische en pathologische aangelegenheden wordt steeds meer erkend. In het domein van kanker leggen recente ontdekkingen een link tussen de darmflora en de respons op therapie, alsook de toxiciteit tengevolge daarvan. Zo zou de aanwezigheid van bepaalde bacteriestammen in de darm gunstig zijn voor het therapeutisch effect van immuuncheckpointinhibitoren, terwijl andere stammen net de bijwerkingen ervan zouden minimaliseren. Naast immuuntherapie zijn er ook links gevonden met chemotherapie en met allogene stamceltransplantatie. Hoewel dit onderzoek nog in zijn kinderschoenen staat, dienen zich enkele interessante opportuniteiten aan. Als ze worden gevalideerd door toekomstig onderzoek, zouden niet-invasieve behandelingen met probiotica of doelgerichte antibiotica bestaande therapiën kunnen ondersteunen in hun effectiviteit en in het verminderen van bijwerkingen.
151
152
Hoofdstuk 7
5.4 Gentherapie
Gentherapie heeft strikt genomen als doel het ingrijpen op het genetisch niveau van de kankercel en/of het corrigeren van genetische defecten. In het hoofdstuk over het ontstaan van kanker zagen we dat een kankercel ontstaat wegens een genetisch defect van specifieke genen (oncogenen en tumorsuppressorgenen). Een van de strategieën van de gentherapie is het herstellen van dit genetisch defect, bijvoorbeeld door een correct gen in de kankercel in te brengen.
Aan het corrigeren van gendefecten door het gebruik van gentherapie zijn uiteraard heel wat voorwaarden en beperkingen verbonden. Ten eerste moet het exacte gen dat ontspoord is in de kankercel gekend zijn, anders kan men het defecte gen uiteraard niet vervangen door een correct gen. Ten tweede is het zeer moeilijk om een gen te vervangen in een cel. Het gen moet binnengebracht worden in de microscopisch kleine cel en moet vervolgens op de juiste chromosomale plaats het defecte gen vervangen.
Een ietwat andere strategie die men experimenteel onderzoekt binnen het domein van de gentherapie is het inbrengen van een ‘zelfmoordgen’, dat de kankercel van binnenuit vernietigt. Als dit gen ingebouwd wordt in het genetisch materiaal van de kankercel, vernietigt die cel zichzelf. Zo zouden kankercellen geëlimineerd kunnen worden.
Figuur 14 illustreert twee van de belangrijkste strategieën van de gentherapie; het corrigeren van een defect gen en het inbrengen van een ‘zelfmoordgen’.
Gentherapie kent helaas nog heel wat beperkingen, onder andere het risico van foutieve genvervangingen of de aantasting van normale gezonde cellen. Gentherapie als behandelingsmethode van kanker bevindt zich daardoor meestal nog in een experimentele fase en het zal nog geruime tijd duren vooraleer deze behandelingswijze een gelijkwaardig alternatief vormt voor andere kankertherapieën.
Naast gentherapie, gebeuren er natuurlijk binnen andere therapievormen (zoals immunotherapie) ook genetische manipulaties van kankercellen of afweercellen. Strikt genomen catalogeren we deze vormen niet onder gentherapie, maar ze zorgen ook wel voor belangrijke doorbraken bij de nieuwe therapievormen.
corrigerend gen
kankercel
zelfmoordgen normale cel
kankercel dode kankercel
Figuur 14 Strategieën van gentherapie
Behandeling
CRISPRCas9genmodificatie
Sinds de introductie van het CRISPR-Cas9-systeem, afgeleid van het antivirale afweersysteem van bacteriën, maakt het domein van genmodificatie de laatste jaren een revolutie door. CRISPR staat voor ‘clustered regularly interspaced short palindromic repeats’, een vorm van DNA-sequenties, terwijl het Cas9-enzyme de genetische schaar wordt genoemd. Dit CRISPR-Cas9-systeem zal immers een dubbelstrengige DNA-breuk introduceren, waarbij – afhankelijk van de applicatie – een gen vernietigd kan worden of nieuwe geninformatie kan worden ingebracht. Dit laatste omvat ook het aanpassen van een enkele base, bijvoorbeeld voor het herstel van een puntmutatie. Een voordeel van dit systeem ten opzichte van het gebruik van virussen voor genetische modificatie, is dat men precies weet waar de aanpassing in het genetisch materiaal gebeurt. Maar de moeilijkheid om selectief tumorcellen te bereiken – zowel bij de eerst aanwezige tumor als op de plaats van uitzaaiingen – en de algemene risico’s verbonden aan gentherapie bestaan hier nog steeds. Met het oog op gebruik in de kliniek staat men met deze techniek het verst wat betreft het aanpassen van T-lymfocyten voor celtherapie.
5.5 Beenmerg- en stamceltherapie
We vermelden hierbij ook de therapievorm beenmerg- en stamceltransplantatie die in het bijzonder toegepast kan worden bij patiënten met leukemieën en lymfomen. Bij deze patiënten zijn bepaalde (bloedvormende) cellen uit het beenmerg ontregeld of ontspoord (zie het hoofdstuk over tumorgroei), waardoor het transplanteren van gezonde beenmergcellen een zeer goede behandelingsoptie is. Anderzijds kan ook het beenmerg van kankerpatiënten ernstig beschadigd raken door zeer intensieve behandelingen (voornamelijk hoge dosis chemotherapie). Hier is een beenmergtransplantatie een goede optie om beschadigde beenmergcellen te vervangen. Eenvoudig gesteld wordt het zieke beenmerg dan vervangen door gezond beenmerg. Chemotherapie en bestraling vernietigen eerst gedeeltelijk of volledig het zieke beenmerg. Een beenmergtransplantatie kan plaatsvinden met (gezond) beenmerg van een donor, een zogeheten ‘allogene beenmergtransplantatie’, of met beenmerg van de patiënt zelf, een zogeheten ‘autologe beenmergtransplantatie’. Bij voorkeur gebruikt men volkomen gezond beenmerg van een donor. Dergelijk beenmerg is echter alleen te gebruiken als de donor ‘weefselidentiek’ is aan de patiënt, dat wil zeggen dat het beenmerg dezelfde weefselkenmerken heeft als dat van de patiënt. Een weefselidentieke donor vindt men haast alleen onder broers en zussen. Als de patiënt niet over een donor beschikt, kan in een beenmergbank gezocht worden naar een niet-verwante passende donor. Het is soms ook mogelijk om voor de transplantatie het beenmerg van de patiënt zelf te gebruiken. Het beenmerg wordt dan afgenomen op het moment dat de ziekte in remissie
153
154
Hoofdstuk 7
is (als de patiënt ziektevrij is). Tot het moment van transplantatie wordt het beenmerg ingevroren.
Tegenwoordig gebruikt men meestal niet het volledige beenmerg, maar worden alleen de stamcellen uit het beenmerg getransplanteerd. Zoals we al kort bespraken in het hoofdstuk over tumorgroei, ligt vaak een ontregeling van de bloedvormende stamcel aan de basis van bloedkanker. Bijgevolg is het eveneens een optie om deze stamcellen te vervangen door gezonde stamcellen van een donor of van de patiënt zelf. Stamcellen kunnen verschillende typen bloedcellen maken en zorgen voor herstel van het beenmerg. De stamcellen van de donor bevinden zich voornamelijk in het beenmerg, maar met een eenvoudige behandeling kunnen we deze stamcellen mobiliseren tot in het perifere bloed. We kunnen ze dan voor transplantatie uit het bloed halen, wat voor de donor veel minder belastend is dan het afnemen van beenmerg.
5.6 Hormonale therapie
Enkele soorten tumoren, zoals prostaat-, baarmoeder- en borstkanker zijn voor hun groei dikwijls afhankelijk van hormonen. Een verandering van de hormonale invloeden kan dan een tijdelijke afname van de tumorgroei bewerkstelligen. Op grond van de geringere toxiciteit van hormonale therapie wordt hieraan de voorkeur gegeven bij hormoongevoelige tumoren, terwijl chemotherapie in deze gevallen eerder aangewend kan worden voor patiënten bij wie de ziekte niet (meer) op deze hormonale behandeling reageert.
Hormonale of endocriene therapie bij kanker beïnvloedt de interactie tussen groeistimulerende hormonen en de receptoren. Voorbeelden van hormoongevoelige tumoren zijn prostaatkanker bij mannen en borstkanker en endometriumcarcinoom bij vrouwen. Het effect kan bekomen worden door hormoondepletie, receptorantagonisten of receptor-desensibilisatie. Bij borstkanker bijvoorbeeld zal men de aanwezigheid van oestrogeen en progesterone receptoren bekijken alvorens de behandeling in te stellen. Een voorbeeld van antihormonale therapie is tamoxifen bij borstkanker. Hormonale behandeling kan zowel in de adjuvante als in de metastatische setting gebruikt worden.
Ook hormonale behandeling heeft nevenwerkingen. Voorbeelden hiervan zijn opvliegers, libidoverlies, osteoporose, onvruchtbaarheid, haargroei …
5.7 Zijn de nieuwe therapievormen een gouden sleutel?
Het optimisme met betrekking tot de nieuwe therapieën is heel groot. Dankzij de doelgerichtheid waarmee deze middelen als een ‘sluipschutter’ werken, worden kankercellen veel efficiënter aangevallen terwijl de normale cellen meer onaangeroerd blijven, wat een groot verschil is met bijvoorbeeld de klassieke chemotherapie. Dat doet geen
Behandeling
afbreuk aan het nut van de conventionele therapieën: chemotherapie wérkt wel degelijk, maar soms onvoldoende en de ‘collateral damage’ is te groot. Het is daar dat de nieuwste generaties doelgerichte therapieën een antwoord kunnen bieden.
Tien jaar geleden was maar veertig tot vijftig procent van de kankerpatiënten na vijf jaar nog in leven, vandaag is dat meer dan zestig procent. Dankzij onder andere de nieuwe behandelingen zal dat cijfer de komende jaren in een snel tempo stijgen. We zitten de kankercel op de hielen.
Is er een ‘maar’? Helaas wel en in feite is die er zelfs tweemaal. Ook de doelgerichte therapieën en immunotherapieën blijken nevenwerkingen te veroorzaken, hoewel die anders zijn dan bij klassieke chemotherapie. Bovendien lijkt de kankercel sommige nieuwe therapieën sneller af te zijn. Meer en meer wordt duidelijk dat sommige kankercellen ‘resistent’ kunnen worden tegenover de doelgerichte therapeutica, waardoor ze na verloop van tijd minder gevoelig worden aan deze geneesmiddelen.
A Nevenwerkingen
De nevenwerkingen van de doelgerichte geneesmiddelen zijn grotendeels afhankelijk van het doel waarop ze inwerken. Sommige geneesmiddelen richten zich specifiek op eigenschappen die bijna uitsluitend of in ieder geval veel vaker op kankercellen voorkomen, maar die toch ook te vinden zijn bij gezonde cellen (bv. huidcellen). De meest voorkomende nevenwerkingen worden waargenomen ter hoogte van de huid, het haar en de nagels (bv. huiduitslag), het maag-darmkanaal (bv. diarree), het hart en het bloed (bv. hoge bloeddruk) en het immuunsysteem (bv. auto-immuunreacties of grieperig gevoel bij immunotherapie). Er wordt vandaag ook zeer veel onderzoek gedaan naar deze nevenwerkingen en naar hoe ze vermeden kunnen worden.
B Resistentie
De reden waarom sommige kankercellen resistentie ontwikkelen tegenover doelgerichte therapieën is tweeledig. Soms verandert het ‘doel’, door bijvoorbeeld een mutatie van de kankercel, waardoor de specifieke therapie minder efficiënt wordt. Of in het andere geval neemt de kankercel een andere signaaltransductieweg dan diegene die geblokkeerd wordt door de therapie.
De op dit moment meest voor de hand liggende oplossing voor deze resistentie is een combinatietherapie, waarbij meerdere doelen en meerdere signaaltransductiewegen tegelijk geblokkeerd worden. Doelgerichte geneesmiddelen worden bovendien ook vaak gecombineerd met chemotherapeutische middelen. Combinatietherapieën worden op dit moment uitgebreid bestudeerd in een klinische context om resistentie te vermijden en om kanker nog efficiënter te kunnen bestrijden en genezen.
155
156
Hoofdstuk 7
C Kostprijs
Eigenlijk is er nog een derde ‘maar’, hoewel die buiten het strikte domein van de geneeskunde valt. Het toepassen van doelgerichte therapieën en immunotherapie heeft een ontzettend hoge kostprijs, die kan oplopen tot meer dan honderdduizend euro per patiënt per jaar. Om een idee te geven: een chemokuur kost tussen de honderd en tienduizend euro, terwijl de kostprijs van immunotherapie kan oplopen tot honderdtwintigduizend euro. Dit komt niet door een verschil in productieprijs, wel door het systeem van patenten, waarbij voor nieuwe therapieën concurrerende producenten gedurende een bepaalde tijd uit de markt geweerd kunnen worden. Hoeveel de maatschappij kan en wil besteden aan dit soort onderzoek en aan deze nieuwe therapievormen is vandaag dan ook voer voor debat. Het is uiteraard een heel belangrijke maatschappelijke discussie, waarbij het belang voor elke individuele patiënt prioritair hoort te blijven.
In ieder geval is het terecht om onze hoop te blijven richten op deze nieuwe therapievormen. De winst die we daarmee zullen boeken betreffende genezingskansen voor kankerpatiënten is zeer hoog en zal het mondiale kankersterftecijfer de komende jaren flink naar beneden halen. Meer en meer wordt duidelijk dat wetenschap de ziekte inhaalt.
6 Alternatieve behandelingen
Voor de meeste van de zogenaamde alternatieve behandelingen, zoals kruidentherapie, homeopathie, acupunctuur en een aantal andere niet-erkende therapieën, is geen algemeen aanvaard wetenschappelijk bewijs van geneeskundige effectiviteit geleverd. Deze therapieën zijn geen evenwaardig alternatief voor de klassieke en wetenschappelijk aanvaarde behandelingen. Toch kunnen sommige alternatieve behandelingen wel van betekenis zijn voor de oncologische patiënt, al gaat het daarbij soms om een psychologisch effect of een placebo-effect. Een absolute voorwaarde voor het ondergaan van een alternatieve behandeling is dat ze de klassieke behandeling niet mag vervangen, uitsluiten of tegenwerken. Als een patiënt een alternatieve therapie wil proberen, is het uiterst belangrijk dat hij dat in zeer goed overleg doet met zijn behandelend arts (oncoloog). De arts moet er in ieder geval van op de hoogte zijn, om zeker te zijn dat ze niet gevaarlijk is en dat het de andere behandelingen niet verstoort.
Behandeling
157
✓ De klassieke of conventionele kankerbehandelingen zijn − chirurgie; − systemische therapie (vooral gekend in de vorm van chemotherapie); − radiotherapie. ✓ Chirurgie heeft als belangrijkste doel het kankergezwel zo veel mogelijk operatief te verwijderen. Chirurgie heeft als grote voordelen dat de tumor radicaal verwijderd kan worden en dat men altijd cellen of weefselmateriaal heeft voor pathologisch onderzoek. Minpunten zijn de blijvende vraag of effectief alle tumorcellen verwijderd werden, de mogelijke schade die toegebracht wordt aan omliggende weefsels en organen, de chirurgische beperkingen en de mogelijke (micro)metastasen of circulerende tumorcellen die niet mee verwijderd worden. ✓ Chemotherapie is een behandeling met geneesmiddelen, ook cytostatica genoemd, die de kankerceldeling op verschillende manieren tegenhoudt of volledig blokkeert. Ook gezonde cellen kunnen hinder ondervinden van de cytostatica, waardoor chemotherapie vaak aanzienlijke nevenwerkingen met zich meebrengt. ✓ Radiotherapie gebruikt (radioactieve) straling om tumoren te bestrijden.
De straling veroorzaakt DNA-beschadigingen in de kankercellen, waardoor ze niet meer kunnen delen of afsterven.
✓ Voor een optimale werking met zo weinig mogelijk nevenwerkingen worden in regel chemotherapie en radiotherapie gefractioneerd toegediend. ✓ Vandaag vinden nieuwe therapievormen hun intrede in de oncologische kliniek. Het zijn ‘doelgerichte’ therapieën, omdat ze inwerken op een specifiek doel (bv.een betere afweer van tumoren). De nieuwere therapievormen (al dan niet in een experimenteel stadium) zijn specifieke doelgerichte moleculaire therapieën, immunotherapie, gentherapie en antiangiogene therapie. ✓ Specifieke doelgerichte moleculaire therapieën bestaan enerzijds uit blokkerende antilichamen of anderzijds uit inhibitoren van de signaaltransductiewegen. ✓ Immunotherapie is gericht op het helpen of versterken van het eigen afweersysteem van de patiënt, om kankercellen op te ruimen. Dit wordt gerealiseerd door het gebruik van ‘monoklonale antilichamen’ en ‘cytokinen’.
Daarnaast bestaat ook de cellulaire immunotherapie, die (al dan niet gemanipuleerde) cellen van de tumor of van het afweersysteem inzet om een afweerreactie tegen kanker te verbeteren. De twee belangrijkste vormen van cellulaire immunotherapie zijn ‘(CAR-)T celtherapie’ en ‘dendritische celtherapie’.
KERNPUNTEN
158
KERNPUNTEN
Hoofdstuk 7
✓ Gentherapie heeft als doel het ingrijpen op het genetische niveau van de kankercel en/of het corrigeren van genetische defecten, bijvoorbeeld door een correct gen in te brengen bij de kankercel. ✓ Het principe van de antiangiogene therapie is om de nieuwbloedvatvorming naar de tumor tegen te gaan. Er worden daarbij geneesmiddelen gebruikt die de angiogenese remmen, vaak door de werking van VEGF te blokkeren. ✓ Om een zo efficiënt mogelijke therapierespons te verkrijgen, krijgen patiënten bijna altijd een combinatie van conventionele en/of nieuwe therapievormen.


