8 minute read
Immunterapi ved behandling af bryst kræft, set fra patologens synspunkt Elisabeth Specht Stovgaard, Anne-Vibeke Lænkholm
Immunterapi ved behandling af brystkræft, set fra patologens
synspunkt
Brystkræft rammer 4.700 kvinder årligt. Check point-inhibitorer har vist overbevisende responsrater ved behandling af patienter med lokalfremskreden og metastaserende østrogen- og HER2-receptor negativ brystkræft. Aktuelt anvendes PDL1 som markør for behandling med check point-inhibitorer, men der er behov for mere præcise biomarkører, der også kan bidrage med information om resistensmekanismer.
ELISABETH SPECHT STOVGAARD er uddannet cand.med. og er i dag ph.d.-studerende ved Patologiafdelingen på Herlev og Gentofte Universitetshospital. ANNE-VIBEKE LÆNKHOLM er overlæge ved Patologiafdelingen, Sjællands Universitetshospital, Roskilde. Hun er desuden klinisk forskningslektor ved Institut for Klinisk Medicin på Københavns Universitet.
Brystkræft er en heterogen sygdom, der årligt rammer 4.700 kvinder i Danmark. Brystkræft har været opfattet som en primært non-immunogen sygdom, men igennem de senere år har resultater fra flere fase I- og II-studier vist overbevisende responsrater ved behandling af patienter med metastaserende østrogenreceptor (ER)- og HER2-receptor negativ sygdom med check point-inhibitorer. 1
Check point-inhibitorer blokerer interaktionen mellem proteiner, der hæmmer immunsystemets respons over for cancercellerne, således at det immunologiske respons genetableres. Grundet de seneste resultater fra det dobbeltblindede fase III-studie Impassion130 er behandling med Atezolizumab i kombination med kemoterapi nu en integreret del af den onkologiske strategi for patienter med lokalfremskreden eller metastaserende ER- og HER2-negativ sygdom. 2,3
I forbindelse med denne målrettede behandling hæmmes interaktionen mellem programmed cell death 1 (PD-1) og programmed death ligand 1 (PD-L1), og PD-L1, påvist ved immunhistokemisk analyse, vurderes som prædiktiv faktor for behandlingseffekt. Modsat andre organsystemer aflæses den positive reaktion af PD-L1 ved brystkræft i immuncellerne og ikke i tumorcellerne. Årsagen hertil kan blandt andet forklares ved, at det diagnostiske assay, der anvendtes i Impassion130-studiet, har en dokumenteret lavere sensitivitet over for tumorceller, sammenlignet med andre PD-L1-assays. 4
KEYNOTE-355 Ved det netop afholdte ASCO 2020 virtuelle møde blev data fra KEYNOTE-355-studiet præsenteret. 5 Der er tale om et randomiseret dobbeltblindet fase III-studie, hvor patienter med lokalfremskreden eller metastaserende ER- og HER2-negativ sygdom blev randomiseret til Pembrolizumab (PD-1 hæmmer) + kemoterapi versus placebo + kemoterapi.
Median follow-up var 17,5 måneder. Studiet viste en median progressionsfri overlevelse på 9,7 måneder i pembrolizumab-gruppen versus 5,6 måneder i placebogruppen (HR: 0,65 [95%
CI: 0,49 - 0,86]). Overlevelsesdata foreligger ikke på nuværende tidspunkt. I dette studie blev der anvendt et andet PD-L1-assay, hvor aflæsningen er baseret på vurdering af den PD-L1-positive reaktion i tumorceller, immunceller og makrofager, og med en anden cut off-værdi, sammenlignet med PD-L1-vurdering i forbindelse med allokering af patienter til Atezolizumab.
Udfordring Mammapatologerne kan således formentlig på et tidspunkt komme i den situation, at PD-L1-aflæsningen skal udføres med forskellige assays og med forskellige aflæsningsmetoder, afhængigt af, hvilken PD-1- eller PD-L1- hæmmer onkologen vælger til sin patient.
Den situation er ikke hensigtsmæssig, og der pågår derfor både nationalt (via det videnskabelige udvalg for patologi i regi af Den Danske Brystkræft Gruppe) og internationalt (via The international Immuno-Oncology Biomarker in Breast Cancer Working Group) studier med henblik på standardisering og harmonisering af assays (figur 1 og 2).
Kunstig intelligens i patologien Som anført ovenfor kan den immunhistokemiske evaluering af PD-L1 være vanskelig, og der er i studier påvist ganske betydelig interobservatør-variation. 6 Som følge heraf har muligheden for anvendelse af kunstig intelligens inden for patologien fået stigende opmærksomhed igennem de seneste år.
Der er stor interesse fra både nationale og internationale firmaer for at udvikle programmer til evaluering af digitalt indscannede vævssnit, blandt andet også PD-L1-immunhistokemiske farvninger. Håbet er, at digital analyse vil være tidsbesparende og vil kunne føre til en mere ensartet evaluering af immunhistokemiske farvninger ved at eliminere interobservatør-va riationen, der kan ses ved bedømmelse af visse immunfarvninger, som for eksempel PD-L1.
En udfordring ved udviklingen af programmer til automatiseret billedanalyse er, at programmet skal bruge store mængder af materiale til at lære, hvordan for eksempel en celle, der er positiv for PD-L1, ser ud. Det vil sige, at en eller gerne flere patologer skal evaluere digitalt indscannede slides og så manuelt markere (annotere) hundrede- til tusindvis af celler, der har den egenskab, som programmet skal kunne identificere.
Programmet skal også have anvist de faldgruber, der kan være – for eksempel nekrose eller celletyper, der ikke skal evalueres. Dette arbejde er meget tidskrævende for den enkelte patolog. For at undgå, at der sidder mange små grupper over hele verden og udfører det samme tidskrævende arbejde, anvendes konceptet ”crowd-sourcing” i stigende grad. Her udnyttes det, at store dele af patologens arbejde nu kan foretages digitalt.
Derved kan patologer fra hele verden annotere vævssnit on-line for at skabe samlinger af indscannede og annoterede vævssnit, som vil kunne udnyttes af flere grupper, der arbejder med samme område, til at udvikle kunstig intelligens-løsninger til patologien. 7
PD-L1-evaluering på mange forskellige typer af væv Et andet område, som vi har fokus på i patologien, er det væv, vi tester biomarkører på. I kliniske forsøg samt i nyligt udgivne kliniske retningslinjer for behandling med PD-L1-hæmmere kan PD-L1-ekspression enten vurderes på patientens primærtumor eller på en senere metastase. Men betyder det egentlig noget, om vi tester på en metastase, som patienten har nu, eller en primærtumor, der ligger længere tilbage?
I Impassion130-studiet, der ligger til grund for godkendelsen af PD-L1-hæmmere til ER- og HER2-negativ brystkræft, påviste man i en mindre subgruppe ingen forskel i behandlingsrespons, alt efter om der blev testet på primærtumor eller på metastase. Andre studier har dog vist, at PD-L1-status ofte ikke er den samme i primærtumor og efterfølgende metastase. 8,9
Betydningen af denne forskel i forbindelse med behandlingsrespons er endnu ikke afgjort, men som patologer vil vi som udgangspunkt foretrække at teste en dynamisk markør som PD-L1 på det mest nyligt udtagne materiale. Hvor ofte der er forskel på primærtumor og metastase for en lang række immunoonkolo gi-biomarkører, er emnet for et igangværende forskningsprojekt udgående fra Patologiafde lingen, Herlev og Gentofte Hospital. Her undersøges markører med betydning for nuværende og fremtidige behandlingsmuligheder i både ER- og HER2-negative og ER-positive tumorer.
PD-L1 er en markør, der kan være heterogent udtrykt i den enkelte tumor. Det kan derfor også have en betydning, hvor stort et udsnit af en tu -
mor vi som patologer har at vurdere ekspressionen på. Behandling med neoadjuverende immunterapi testes nu i flere kliniske forsøg.
Ved neoadjuverende behandling foregår præ-terapeutisk evaluering af biomarkører på den diagnostiske nålebiopsi i modsætning til operationspræparatet ved adjuverende behandling. Dette betyder, at vi ser på en meget mindre del af tumor, end vi gør ved adjuverende behandling, hvilket kan have stor betydning, når man har med en heterogent udtrykt markør at gøre.
I et studie af, hvilken betydning mængden af undersøgt væv har hos patienter med ER- og HER2-negativ brystkræft, er det påvist, at op mod hver femte patient, der ville have fået et negativt svar på et mindre udsnit af tumor, ville have været positiv, hvis man havde vurderet et større udsnit af tumor. 10 Dette stemmer overens med internationale resultater. Konsekvensen kan være, at det kan være nødvendigt at teste PD-L1-ekspression på flere biopsier ved et negativt svar for at undgå, at patienter, der kunne have haft gavn af behandlingen, bliver overset.
Perspektiv Aktuelt anvendes, som beskrevet, PD-L1 som prædiktiv markør for behandling med check point-inhibitorer. Der pågår dog intens forskning for at identificere andre og mere præcise biomarkører for det immunologiske respons.
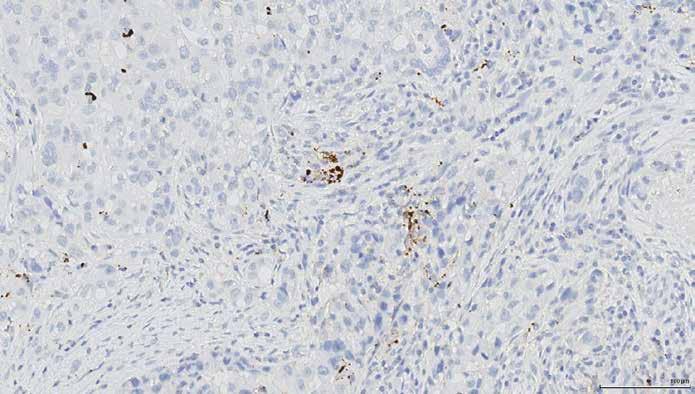
Figur 1
Ved farvning med PD-L1, assay SP142 ses en punktformet, brunlig reaktion i immuncellerne.
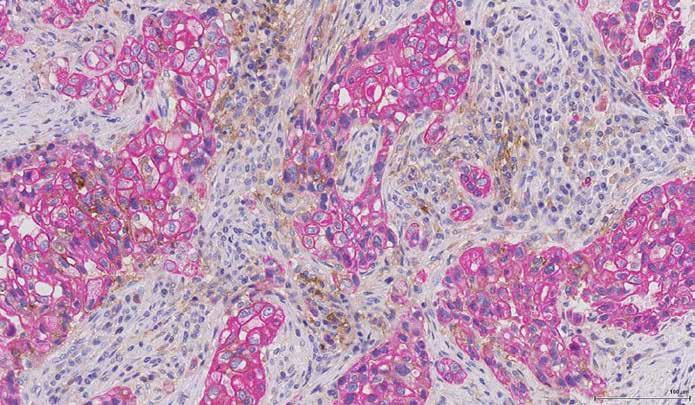
Her vises en dobbeltfarvning med cytokeratin (rød), der farver tumorcellerne og PD-L1-assay 22C3, der således ses tydeligt i immuncellerne (brun).
En simpel, lettilgængelig metode, der undersøges, er PD-L1-positivitet i kombination med omfanget af tumorinfiltrerende lymfocytter, vurderet på et standard histologisk snit.
Der er ligeledes behov for biomarkører, der kan bidrage med information om resistensmekanismer – ligesom der fortsat er usikkerhed vedrørende den ovenfor skitserede problemstilling af test på primær tumor versus metastase.
Referencer:
1. Wein L, Luen SJ, Savas P, Salgado R, Loi S. Checkpoint blockade in the treatment of breast cancer: current status and future directions. Br J Cancer. 2018;119(1): 4-11. 2. Schmid P, Chui SY, Emens LA. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. Reply. N Engl J Med. 2019;380(10): 987-988. 3. Schmid P, Rugo HS, Adams S, Schneeweiss A, Barrios CH, Iwata H, et al. Atezolizumab plus nab-paclitaxel as first-line treatment for unresectable, locally advanced or metastatic triple-negative breast cancer (IMpassion130): updated efficacy results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2020;21(1): 44-59. 4. Martinez-Morilla S, McGuire J, Gaule P, Moore L, Acs B, Cougot D, et al. Quantitative assessment of PD-L1 as an analyte in immunohistochemistry diagnostic assays using a standardized cell line tissue microarray. Lab Invest. 2019. 5. Cortes J, Cescon DW, Rugo HS, et al. KEYNOTE-355: Randomized, double-blind, phase III study of pembrolizumab + chemotherapy versus placebo + chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer. Abstract ASCO. 2020. 6. Rimm DL, Han G, Taube JM, et al. A prospective, multi-institutional, pathologist-based assessment of 4 immunohistochemistry assays for PD-L1 expression in non-small cell lung cancer. JAMA Oncol. 2017;3: 1051-1058. 7. Amgad M, Stovgaard ES, Balslev E, et al. Report on computational assessment of Tumor Infiltrating Lymphocytes from the International Immuno-Oncology Biomarker Working Group. npj Breast Cancer. 2020;6. 8. Cimino-Mathews A, Thompson E, Taube JM, et al. PD-L1 (B7-H1) expression and the immune tumor microenvironment in primary and metastatic breast carcinomas. Hum. Pathol. [Internet]. 2016 [cited 2019 May 6];47: 52-63. http://www.ncbi.nlm. nih.gov/pubmed/26527522. 9. Manson QF, Schrijver W, ter Hoeve ND, et al. Frequent discordance in PD-1 and PD-L1 expression between primary breast tumors and their matched distant metastases. Clin. Exp. Metastasis. 2019;36: 29-37. 10. Stovgaard ES, Bokharaey M, List-Jensen K, et al. PD-L1 diagnostics in the neoadjuvant setting: implications of intratumoral heterogeneity of PD-L1 expression in triple negative breast cancer for assessment in small biopsies. Breast Cancer Res. Treat. 2020;181: 553-560.
INTERESSEKONFLIKTER: Elisabeth Specht Stovgaard og Anne-Vibeke Lænkholm har begge fået kongresdeltagelse sponsoreret af Roche.