7 minute read
Präoperative Abklärung vor nicht kardialen Operationen
Christian Schmied, Jens Hellermann, Donat Spahn und Thomas F. Lüscher
Advertisement
Notfall Operation
Nein Ja
Patientenspezifische und chirurgische Faktoren diktieren die Strategie und erlauben keine weiteren kardialen Abklärungen.
Akute oder instabile Herzkrankheit Tab. 1
Nein Ja Diskussion im interdisziplinaren Team. Patientenspezifisches Vorgehen.
Operationsrisiko Tab. 2
Mittel/Hoch
Körperliche Leistungsfähigkeit Tab. 3
≤4 METs
Operationsrisiko Tab. 2
Hoch
Klinische Risikofaktoren Tab. 4
≥3
Nichtinvasive Ischämietest Gering
>4 METs
Mittel
≤2
Nichtrelevante Ischämie
Relevante Ischämie Ruhe EKG Optimierung der medikamentösen Therapie (z.B. Betablocker bei KHK und/oder myokardialer Ischämie. ACEI/ARB bei systolischer Herzinsuffizienz. Statine insbesondere vor Gefässeingriffen)
Zusätzlich zu den oben genannten Massnahmen: Nichtinvasiven Ischämietest erwägen. Echokardiographie/Biomarker zur Bestimmung der LVFunktion
Obengenannte Massnahmen erwägen Operabilität gegeben
Individuelles perioperatives Management empfohlen, (z.B. Koronarangiographie)
Ballonangioplastie: OP nach >2 Wochen, Aspirin weiterführen
Baremetal Stents: OP nach >4 Wochen Duale Plättchenhemmung für mindestens 4 Wochen Drugeluting Stents: Oldgeneration: OP nach >12 Monaten New generation: OP nach >6 Monat ACBP
Instabile Angina pectoris, Angina pectoris CCS III–IV Dekompensierte Herzinsuffizienz Hämodynamisch wirksame Rhythmusstörungen Symptomatische Herzklappenerkrankung ACS oder Myokardinfarkt <30 Tage und residuelle Ischämie
Operationsrisiko1
Geringes Risiko <1% Mittleres Risiko 1–5% Mamma Abdominal, Laparatomien
Hoher Risiko >5% Aorta und grosse Gefässe Zähne Carotis Periphere Gefässe Endokrin: Schilddrüse Periphere arterielle Angioplastie Leber-/Lungen-Tx Auge Endovaskuläre Aneurysma Reparation Darmperforation Gynäkologie Kopf- und Hals Pneumektomie Rekonstruktiv Neurologisch/Orthopädisch – gross Zystektomie (z.B. Hüfte, Wirbelsäule) Orthopädie – klein (z.B. Knie) Nierentransplantation Ösophagektomie Gyn/ Urologie klein Gyn/ Urologie – gross (z.B. Prostata) Duedenopankreatische OP
1 30-Tage Ereignisrate für kardialer Tod und Herzinfarkt
Körperliche Leistungsfähigkeit
Exzellent > 7 METs Moderat 4–7 METs Schlecht <4 METs Schwere Gartenarbeit, Umzug Leichte Gartenarbeit Essen, Anziehen, Baden Tennis, Schwimmen ≥2 Treppenetagen gehen Schreiben Joggen, Skifahren Velofahren Gehen in der Wohnung Bergwanderung Kurze Strecke rennen In der Ebene gehen MET= metabolisches Äquivalent
Ischämische Herzerkrankung, früherer Herzinfarkt (Q-Welle im EKG), Ischämienachweis, Angina Herzinsuffizienz, unter Medikamenten «kompensiert» Schlaganfall, transistorisch-ischämische Attacke Diabetes mellitus, Insulin-pflichtig Niereninsuffizienz, Dialyse (Kreatinin >170 µmol/L oder Kreatininclearance <60ml/min/1.73 m2
Das Ziel der präoperativen Abklärung vor nichtkardialen Operationen ist die Senkung der perioperativen Komplikationen und Verbesserung der längerfristigen Prognose. Die European Society of Cardiology hat 2014 Richtlinien für das perioperative Risiko veröffentlicht2 . Dabei wird zunächst entschieden, ob eine Notfalloperation vorliegt. In der Folge werden dann anhand des Risikos der Operation selber, der körperlichen Leistungsfähigkeit und der Komorbiditäten, Empfehlungen über die kardiologischen Abklärungsschritte oder therapeutische Entscheide dargestellt. Perioperative Koronarinterventionen haben entscheidenden Einfluss auf das Management und viele Entscheide sollten interdisziplinär (Chirurgie, Anästhesie, Kardiologie, Intensivmediziner etc.) getroffen werden. Bei Patienten mit bekannter koronarer Herzkrankheit sollte ein Betablocker perioperativ weitergeführt und nur bei Hochrisikopatienten neu eingesetzt werden. Auch Statine sollten perioperativ nicht abgesetzt werden und insbesondere bei Gefässoperationen auch neu eingesetzt werden (spätestens 2 Wochen präoperativ). ACEHemmer und ARBs sollten insbesondere bei systolischer Herzinsuffizienz unter akkuratem Monitoring eingesetzt werden (spätestens 1 Woche präoperativ).
2 TheJoint Task Force on non-cardiac surgery: cardiovascularassessment and management of the European Society of Cardiology(ESC) and the European Society of Anaesthesiology (ESA). 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. European Heart Journal, 2014; 35: 2383–2431.
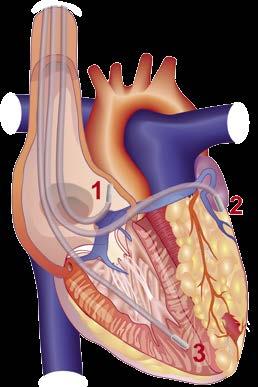
Perioperatives Management von Thrombozytenhemmern bei Nicht-Kardiochirugischen Eingriffen
Problem: Duale Thrombozytenhemmung ist nach Stentimplantation je nach Patient für 3–12 Monate zwingend
7 COX1 Hemmer ASS (Aspirin®) i.R. lebenslang 7 P2Y12 Adenosin Diphosphat (ADP) Rezeptor Hemmer • Bei stabiler Angina: Clopidogrel (Plavix®; 3–6 Monate, nur in
Ausnahmefällen 1 Monat) • Bei akutem Koronarsyndrom unabhängig von Stentart DAPT für ≥12 Monate postinterventionell – bei STEMI: Prasugrel (Efient®) – bei NSTEMI: Ticagrelor (Brilique®) Siehe auch Kapitel «Antithrombotische Therapie bei akutem Koronarsyndrom», Seite 85.
Generell
7 ASS immer weitergeben (Ausnahmen: intrakranielle und intraspinale Neurochirurgie, OP in hinterer Augenkammer). 7 ADP Rezeptor Hemmer wird nur bei hohem Blutungsrisiko abgesetzt und so rasch wie möglich wieder gestartet (<48 Std.). 7 Abwägung von Nutzen eines früheren Operationszeitpunkts, perioperatives Blutungsrisiko vs. thrombotisches Risiko (abh. von Stentart/lokalisation, Zeitdauer nach PCI, ACS vs. stabile
Angina) 7 Idealerweise Rücksprache mit behandelnden, interventionellen
Kardiologen 7 Interdisziplinäre RisikoNutzenAbwägung 7 Wenn immer möglich Operation erst nach Abschluss der empfohlenen DAPTDauer durchführen. 7 Falls vorzeitige Sistierung der DAPT, idealerweise Durchführung der Operation in Zentrum mit Herzkatheterlabor
Dringlichkeit und Zeitpunkt des Eingriffs im Verhältnis zu Stent-PCI1
hohes Risiko einer arteriellen Thrombose bzw. Stentthrombose (>0,5 %) niedriges Risiko einer arteriellen Thrombose (<0.5%)
koronare Stents innerhalb der ersten sechs Monate nach Implantation (bei «drug eluting stents» vor allem in den ersten 3 Monaten, bei «bare metal stents» insbesondere in den ersten 4 Wochen nach Stentimplantation)*1 koronare Herzkrankheit (KHK) ohne die neben genannten Umstände
Zustand nach akutem Koronarsyndrom (STEMI und NSTEMI) innerhalb der ersten zwölf Monate Primär- und Sekundärprophylaxe des nicht kardio-embolischen Schlaganfalls
* Es bestehen erhebliche Unterschiede abhängig von der Stentgrösse, -lokalisation und -art sowie den einzelnen medikamentösen Beschichtungen. Daher ist in Risikokonstellationen eine interdisziplinäre Entscheidung mit den behandelnden Kardiologen sinnvoll. 1 modifiziert nach ESC Guidelines on Non-Cardiac Surgery. Eur. Heart J. 2014; 35: 2383–2431
Blutungsrisiko Hohes Blutungsrisiko
Operation in geschlossenem Raum (intrakranielle und spinale Eingriffe, hintere Augenkammer) oder Eingriffe mit massiver Blutung und schwieriger Hämostase, extensive (Tumor)Chirurgie. Bei diesen Operationen wird der ADP Hemmer abgesetzt und je nach Zeitpunkt seit der Stenteinlage und dem Stentthrombose und Cardiac Risk ein Bridging durchgeführt (siehe unten).
Niedriges Blutungsrisiko
Duale Thrombozytenaggregationshemmung wird perioperativ weitergeführt.
Stentthrombose- und Cardiac-Risk
7 >50% vom Myokard von Stents abhängig (Hauptstammstents, 3 Gefässstenting, Komplexes Stenting) 7 Status nach Stentthrombose 7 längeres, gestentetes Segment Stents 7 Patienten mit Tumorhyperkoagulabilität 7 Niereninsuffizienz oder niedriger kardiale Auswurffraktion (EF <40%).
Bridging >6 Monate nach Stenteinlage:
In der Regel nicht erforderlich, ADP Rezeptor Antagonist kann perioperativ gestoppt werden.
1–6 Monate nach Stenteinlage:
Bridging bei ≥1 Risikofaktor von Stentthrombose und CardiacRisk (siehe oben, Punkt 3) und in Abhängigkeit StentTyp, interdisziplinäre Entscheidung mit behandelndem Kardiologen
Im ersten Monat nach Stenteinlage:
Bridging mit IIaIIIbInhibitor
Absetzen von P2Y12-ADP Rezeptor Hemmern
7 Clopidogrel 5–7 Tage vor OP 7 Ticagrelor 5 Tage vor OP 7 Prasugrel 7 Tage vor OP
Intravenöse Plättchen-Hemmung (Bridging)
Glykoprotein IIb/IIIa Inhibitor Eptifibatide (Integrillin®) Schema für Eptifibatide: 7 3 Tage vor OP Beginn mit Epifibatide Dauerinfusion 2 mcg/kg/Min. (1 mcg/kg/Min. bei Niereninsuffizienz), keine Ladedosis. ASS weiter. 7 Eptifibatide 22:00 Uhr am Vorabend der OP stoppen. 7 Operationstag, kein ADP Hemmer, kein ASS. 7 Erster postoperativer Tag Wiederbeginn mit ADP Hemmung und ASS ohne Ladedosis.
Ausserdem
7 Für resorbierbare Stents liegen wenig Daten vor, jedoch scheinen diese eher thrombosegefährdeter als DES. 7 Bei Notfalleingriffen ist der Abstand zwischen der letzten Einnahme und des Eingriffs entscheidend. Die Thrombozytenfunktion ist nach 24h noch mindestens 50% gehemmt, zirkulierende
Medikamente können auch transfundierte Thrombozyten hemmen (bei Ticagrelor besonders bedeutsam).
Perioperatives Management Antikoagulation
Vollantikogulation mit Vitamin K Antagonisten (Marcoumar®) Identifizierung von Hochrisikopatienten:
7 Vorhofflimmen mit CHA2DS2Vasc ≥5 7 Mechanische Herzklappe (insbesondere Mitralklappe) 7 Mitralklappenrekonstruktion <3 Monate 7 Venöser Thromboembolismus <3 Monate 7 Thrombophilie
Vitamin K Antagonisten (Marcoumar®)
7 Nur Pausieren bei Operationen mit hohem Blutungsrisisko 7 3–5 Tage vor Operation absetzen 7 Falls dringliche Operation (>6–12h): 2.5–5 mg i.v. oder per os Vitamin K (Konakion®) 7 Bei sofortiger Operation → FFP oder Prothrombinkomplex 7 INR ≤1.5: sichere Durchführung der Operation möglich 7 INR <2.0: Beginn Bridging mit unfraktioniertem Heparin (UFH) oder niedermolekularem Heparin (NMWH) bei Hochrisikopatienten 7 Bridging Stopp vor OP: UFH 4 Stunden, NMWH 8 Stunden 7 Wiederbeginn 1–2 Tage nach OP in Abhängigkeit von
Hämostase
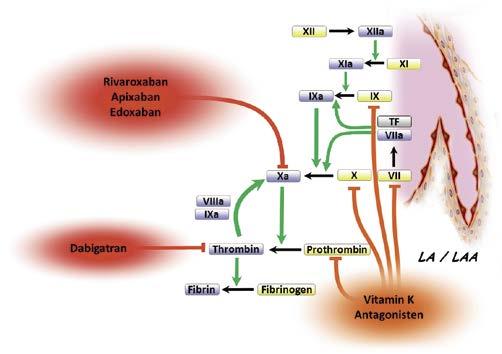
Nicht-Vitamin K Antogonisten (NOAK)
7 Kein Bridging mit UFH/ NMWH notwendig für VHF Patienten! 7 Vorgehen abhängig vom Blutungsrisiko und Nierenfunktion 7 Bei Interventionen ohne Unterbrechung der NOAK (s. Tab. 1) → Durchführung der Intervention bei Talspiegel (d.h. 12h oder 24h nach letzter Einnahme) 7 Wiederbeginn in Abhängigkeit von Hämostase und Blutungsrisiko • Nach 6–8h bei vollständiger Hämostase • Nach 48–72h bei erhöhtem Blutungsrisiko
Interventionen ohne Unterbrechung NOAK
Zahneingriffe3 Extraktion 1–3 Zähne Paradontale Chirurgie Abzessinzision Implanatatpositionierung Niedriges Blutungsrisiko (selten +/− geringe Konsequenzen)
Hohes Blutungsrisiko (häufig +/− gravierende Konsequenzen Endoskopie mit Biopsie Thorax-/Abdomenchirurgie
Katarakt/Glaukomeingriffe Prostata- oder Blasenbiospie Grosse orthopädische OP Endoskopie (ohne Biopsie) Elektrophysiologische Unter- Nieren-/Leberbiopsie suchung (Rechtsseitige SVT)
Oberflächliche Chirurgie (z.B. Abzessinzision, dermatolog. Exzisionen etc.) Nicht-koronare Angiographie Spinal-/Epiduralanästhesie
Schrittmacher-/ ICD-Implantation TURP
Extrakorporale Schockwellen Lithotripsie Katheterablation von einfachen linksseitigen SVTs (z.B. WPW)
3 evtl. Mundspülung mit 10 ml Transexamsäure 5% 4×/d für 5 Tage erwägen
Tab. 2 Letzte NOAK-Einnahme vor Elektiveingriffen2
Dabigatran
ApixabanEdoxabanRivaroxaban Blutungsrisikoa Blutungsrisikoa niedrig hoch niedrig hoch GFR ≥80ml/Min. ≥24h ≥48h ≥24h ≥48h GFR 50–80ml/Min. ≥36h ≥72h ≥24h ≥48h GFR 30–50ml/Min. ≥48h ≥96h ≥24h ≥48h GFR 15–30ml/Min. kontraindiziert ≥36h ≥48h GFR <15ml/Min. kontraindiziert
a gemäss Tabelle 1; GFR = Glumeruläre Filtrationsrate
1 Kristensen SD, Knuuti J, Saraste A, et al. [2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment andmanagement]. Eur. Heart J. 2014;35: 1383–2431. 2 Heidbuchel H, Verhamme P, Alings M, et al. EHRA practical guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation: executive summary.
Eur Heart J. 2013;34:2094–2106.