12 minute read
Arterielle Hypertonie
Thomas F. Lüscher, Felix Beuschlein und Isabella Sudano
Definition
Advertisement
Der Blutdruck ist essentiel für die Durchblutung der Organe, aber gleichzeitig ein wichtiger Risikofaktor für Herzinfarkt, Hirnschlag, Nieren und Herzinsuffizienz und Tod (Abb. 1)
32
Hirnschlag Mortalität
(n =1233)
32
Koronare Mortalität
(n=11,149)
Relatives Risiko für ein tödliches Ereignis 16
4
2
1 16
4
2
1
>120 125 135 148 168
120 125 135 148 168 systolischer BD (mm HG)
Abbildung 1: Blutdruck und Sterblichkeit für Hirnschlag (links) und Herzinfarkt (rechts; modifiziert aus MRFIT Trial)
Primäre Hypertonie (95% aller Hypertonien)
7 Kein pathologischer Organbefund diagnostizierbar, allerdings funktionelle Störungen von Sympathikus, Barorezeptor und neurohumoraler Systeme 7 Nicht beeinflussbare Faktoren: Genetik, Alter, Geschlecht 7 Beeinflussbare Risikofaktoren: Übergewicht, Bewegungsmangel, übermässiger Kochsalz und Alkoholkonsum, Medikamente, Hormone, Lakritze
Sekundäre Hypertonie
7 Renovaskuläre, renalparenchymatöse oder endokrine Erkrankungen oder Aortenisthmusstenose, Obstruktive Schlafapnoe
Blutdruck-Messung
7 Sitzend (nach ≥3 Minuten Ruhe), 3 Messungen an mindestens 2 Tagen auf 2 mmHg ablesen (2. und 3. Messung mitteln).
«Unattended recording» mit automatischem Gerät am genauesten (siehe Seite 4) 7 Stehend orthostatische Hypotonie ausschliessen (>20 mmHg systolischer BDAbfall; vor allem bei älteren und herzinsuffizienten Patienten) 7 Manschettenbreite an Armumfang anpassen, oberhalb Ellenbeuge (>33 cm = grosse Manschette) 7 Dekompression 2 mmHg/Sekunden; Apparat eichen 7 Systolischer Blutdruck: • Erstmaliges Auftreten der Korotkoff Töne 7 Diastolischer Blutdruck: • Phase V (Verschwinden der Korotkoff Töne) • Phase IV (Leiserwerden der Korotkoff Töne) nur in speziellen
Fällen (Schwangere u.a.) • Cave: Auskultatorische Lücke
Definitionen und Klassifikation der Blutdruckwerte (mmHg)1
Kategorie Ideal Systolisch Diastolisch <120 <80
Normal Hochnormal2
Grad 1 Hochdruck (leicht) Grad 2 Hochdruck (mässig) Grad 3 Hochdruck (schwer) Isolierter systolischer Hochdruck 120–129 80–84 130–139 85–89 140–159 90–99 160–179 100–109 ≥180 ≥110
≥140 <90
1 Mittelwert 3 Messungen an verschiedenen Tagen; Weisskittelhypertonie: Erhöhter Blutdruck nur in der Praxis; Maskierte Hypertonie: Erhöhter Blutdruck nur ausserhalb der Praxis 2 Die 2017 erschienenen U.S. Hypertension Guidelines (Hypertension 2018; online) haben einen systolischen Blutdruck von <120/80 mmHg als normal, 120–129 mmHg als erhöht und 130–139/80–89 mmHg als Stadium 1 Hypertonie und ≥140/90 mmHg als Stadium 2 Hypertonie klassifiziert. Die 2018 ESC Guidelines on Hypertension (Eur. Heart J. 2018; online) haben dies nicht nachvollzogen.
Der SPRINT Studie (Systolic blood PRessure INtervention Trial) (The SPRINT Research Group. N Engl J Med 2015; 373: 2103–16). wurde im September 2015 vorzeitig abgebrochen, da der primäre Endpunkt (Akutes Koronarsyndrom, Schlaganfall, Herzinsuffizienz oder Tod infolge einer kardiovaskulären Erkrankung) in der Gruppe mit Zielblutdruck <120 mmHg gegenüber der Gruppe mit Zielblutdruck <140 mmHg um 25% reduziert wurde. Auch die sekundären Endpunkte Herzinsuffizienz (−38%), kardiovaskulärer Tod (−43%), Gesamtsterblichkeit (−27%) traten in der Therapiegruppe mit Zielblutdruck < 120 mmHg signifikant seltener auf.
Insgesamt legen die Ergebnisse von SPRINT nahe, dass durch eine strikte Blutdruckeinstellung mit einem Zielwert von <120 mmHg systolisch bei den meisten Hypertonikern ohne Diabetes eine Verbesserung der Prognose erreicht werden kann. Allerdings war die intensive Blutdrucksenkung auch mit Nebenwirkungen assoziiert: So traten in der intensiven Therapiegruppe Hypotonien, Synkopen (allerdings ohne Verletzungsfolge) und Elektrolytstörungen, akute Nierenschädigungen bzw. ein akutes Nierenversagen zwar insgesamt selten (<4%), aber doch signifikant häufiger auf als in der Standardtherapiegruppe.
Von Bedeutung ist die Art der Messung des Blutdruckes, die in SPRINT gebraucht wurde: es erfolgte in einem ruhigen Raum ohne Anwesenheit eines Arztes oder einer Pflegeperson mit einem Blutdruckmessgerät, welches auf eine fünfminütige Wartezeit vor der ersten Messung programmiert war. Es wurden drei konsekutive automatisierte Messungen durchgeführt. Neuere Studien zeigen allerdings – entgegen ersten Kritiken –, dass die Unterschiede zur üblichen Messung geringer sind als ursprünglich angenommen (Bauer et al. Hypertension 2017). Entsprechend haben die neuen U.S. Guidelines 2017 (J. Amer. Coll. Cardiol. 2017; online) neue Empfehlungen herausgegeben und einen Zielwert von systolisch 130 mmHg empfohlen. Es ist zu erwarten, dass die ESC Guidelines 2018 weiterhin 140/90 mmHg empfehlen werden.
Blutdruck (mmHg) Risikofaktoren Normal HochSyst.BD normal 120–129 Syst.BD oder Diast. 130–139 BD 80–84 oder Diast. BD 85–89 Grad 1 Syst.BD 140–159 oder Diast. BD 90–99 Grad 2 Syst.BD 160–179 oder Diast. BD 100–109 Grad 3 Syst.BD ≥180 oder Diast. BD ≥110
Keine anderen Risikofaktoren
Durchschnittl. Risiko 1–2 Risikofaktoren 10-JahresRisiko <10% Durchschnittl. Risiko 10-JahresRisiko <10% 10-JahresRisiko <10% 10-JahresRisiko 10–19% 10-JahresRisiko 10–19% 10-JahresRisiko 10–19% 10-JahresRisiko 20% 10-JahresRisiko >20%
3 oder mehr Risikofaktoren, metabolisches Syndrom, Endorganschaden oder Diabetes Kardiovaskuläre oder Nieren Erkrankungen 10-JahresRisiko 10–19% 10-JahresRisiko 20% 10-JahresRisiko 20% 10-JahresRisiko 20% 10-JahresRisiko >20%
10-JahresRisiko >20% 10-JahresRisiko >20% 10-JahresRisiko >20% 10-JahresRisiko >20% 10-JahresRisiko >20%
Die Prognose beeinflussende Faktoren
Risikofaktoren für kardiovas kuläre Erkrankung
Endorganschäden • Höhe des systolischen und diastolischen BD • Männer >55 Jahre • Frauen >65 Jahre • Rauchen • Dyslipidämie (Gesamt-Cholesterin >6.5 mmol/l, >250 mg/dl oder
LDL-Cholesterin >4,0 mmol/l, >155 mg/dl oder HDL-Cholesterin M <1,0,
W <1,2 mmol/l, M <40, F <48 mg/dl), Triglyzeride >1.7 mmol/L, 150 mg/dl • Abdominale Fettleibigkeit (abdominaler Umfang bei M ≥102 bei F ≥88 cm) • Familiengeschichte von vorzeitiger kardiovaskulärer Erkrankung (im Alter <55 Jahren bei Männern, <65 Jahren bei Frauen) • Linksventrikuläre Hypertrophie (Elektrokardiogramm: Sokolow-Lyon >38 mm;
Cornell Produkt >2440 mV.ms; Echokardiogramm: Linksventrikulärer Massen
Index M ≥125, F ≥110 g/m2) • Carotid IMT (Intima-Media-Dicke) ≥0,9 mm oder atherosklerotische Plaque • Pulse Wave Velocity >12 m/s • Ankle-brachial-Index (ABI) <0.9 • Erhöhtes Serumkreatinin (M 115–133, F 107–124 mmol/l; M 1,3–1,5, F 1,2–1,4 mg/dl) • Reduzierte Glomeruläre Filtrationsrate (<60 ml/min/1.73 m2) • Mikroalbuminurie (30–300 g/24 Std., Albumin-Kreatinin Verhältnis bei M ≥22, bei F ≥31 mg/dl; bei M ≥2,5, F ≥3,5 mmol/L)
Diabetes mellitus
Associated clinical conditions (ACC) • Plasmaglukose nüchtern >7,0 mmol/l (126 mg/dl) bei wiederholter Messung • Post-Belastung Plasmaglukose >11,0 mmol/l (198 mg/dl) 2 Std. nach 75mg
Glukose • Hämoglobin A1c > 5% • Ischaemischer Schlaganfall, transiente ischämische Attacke (siehe Kapitel
«Transiente ischämische Attacke und Hirnschlag», Seite 109) • Angina, PCI oder ACBP, akutes Koronarsyndrom oder Herzinsuffizienz (siehe
Kapitel Seite 73, 79 bezw. 184) • Diabetische Nephropathie, Niereninsuffizienz (Serumkreatinin bei M >133, bei F >124 mmol/l; bei M >1,5, bei F >1,4 mg/dl), Proteinurie (>300 mg/24 Std.) • Periphere arterielle Verschlusskrankheit (siehe Kapitel «Periphere Arterielle
Verschlusskrankheit», Seite 122) • Retinopathie mit Blutungen oder Exsudate, Papillenödem
Anamnese
Familienanamnese
7 Arterielle Hypertonie (Verwandte 1. Grades) 7 Nierenerkrankungen 7 Diabetes mellitus 7 Herzinfarkt, Hirnschlag (bei Vater <55 bei Mutter <65 Jahren) 7 Dyslipidämie 7 Hirnschlag 7 Morbus Recklinghausen 7 Primärer Hyperaldosteronismus 7 Phäochromozytom
Patientenanamnese
7 Nierenerkrankungen, Ödeme (renale Hypertonie) 7 Anfallsartige Hautblässe, Schweissausbrüche, Tachykardien (Phäochromozytom) 7 Muskelschwäche, Krämpfe, Rhythmusstörungen, Polyurie (ConnSyndrom) 7 Vollmondgesicht, Büffelnacken, Muskelschwäche an Extremitäten, Striae abdominalis (CushingSyndrom) 7 Gewichtsabnahme, Diarrhoe, Unruhe oder Schlafstörungen, Tremor und Tachykardien und/oder Vorhofflimmern (Hyperthyreose) 7 Medikamente (Nasentropfen, Ovulationshemmer, Steroide,
Cyclosporin A, NonSteroidal Antiinflammatory Drugs, Paracetamol, Erythropoietin, u.a.m.)
7 Nahrungsmittel (Lakritze, Alkohol, übermässiger Salzkonsum) 7 Blutdruck und Gewichtsverlauf (inkl. Blutdruck in Schwangerschaft) 7 Lebensstil: Rauchen, Alkoholkonsum, körperliche Aktivität/
Sport, berufliche und private Belastung 7 Schnarchen, Apnoen, Tagesmüdigkeit (Obstruktive Schlafapnoe) 7 Kardiovaskuläre Risikofaktoren und Komplikationen (siehe Kapitel «Das kardiovaskuläre Globalrisiko»; siehe Seite 60) 7 Nierenerkrankung 7 Antihypertensiva 7 Pressorische Substanzen: Sympathikomimetika, Kokain,
Anabolika
Diagnostik
Basisdiagnostik
7 Allgemeiner klinischer Status 7 Blutdruckmessung an beiden Arm und am Bein, Gefässgeräusche?
Klinische Untersuchung
7 CushingSyndrom, auch iatrogen (siehe «Patientenanamnese»,
Seite 6) 7 Gewicht, Grösse, BMI, Bauchumfang
BMI = Body-Mass-Index = Körpergewicht in kg (Körpergrösse in m)2 kg/m2
7 BDMessung: 3mal sitzend, 1mal stehend, rechts und links • Systolische BDDifferenz an Arm und Bein → Aortenisthmusstenose 7 Herz • Puls → Extrasystolen, Vorhofflimmern • Herztöne und geräusche 7 Gefässe inkl. Nierenarterien: Strömungsgeräusche? 7 Lungenstauung 7 Extremitäten • Periphere Pulse • Strömungsgeräusche • Ödeme • Temperatur • Hauttrophik
7 Augenfundus • Veränderungen der Retina und/oder Papille (Ödeme, Exsudate, Blutungen) → ggf. ophthalmologisches Konsilium 7 Schilddrüsenpalpation: Struma?
Laboruntersuchungen
7 RoutineTests • Plasmaglukose, Hämoglobin A1c • LDLCholesterin (Serum; nicht zwingend nüchtern) • HDLCholesterin (Serum) • Triglyceride (Serum; nüchtern) • Harnsäure (Serum) • Kreatinin und Berechnung der GFR (Serum) • Kalium (Serum) • Hämoglobin und Hämatokrit • Harnuntersuchung (Urinstix, Harnsediment) • Elektrokardiogramm 7 Empfohlene Tests • Echokardiogramm • Ultraschall Halsschlagader (und Oberschenkel) • Mikroalbuminurie (unbedingt bei Diabetikern) • Quantitative Proteinurie (falls Urinstix positiv) 7 Abklärung Sekundäre Hypertonie • Messung von Aldosteron/ReninQuotient (Indikation siehe
Seite 9), HyperkortisolismusDiagnostik (je nach Anfangsverdacht: freies Kortisol im 24h Sammeluring, Speichelkortisol um 23:00 Uhr und/oder niedrig dosierter Dexamethason
Hemmtest), Metanephrine im Plasma oder 24h Sammelurin,
Ultraschall von Nieren und Nebennieren (siehe Abb. 2, Seite 10)
Blutbild Serum-Kalium Polyglobulie, Polyzythämie (selten) Primärer/Sekundärer Hyperaldosteronismus? DD: Diuretika
Serum-Kreatinin Hämoglobin A1c Total-Cholest. HDL, LDL, Triglyceride Serum-Kalzium Serum-Harnsäure Nierenerkrankung? Diabetes mellitus? Dyslipidämie?
Hyperparathyreoidismus? Assoziiert mit metabolischem Syndrom
Urin-Streifentest
Makroproteinurie? Urin-Sediment Renoparenchymatöser Schaden? (glomeruläre Erythrozyten) Spoturin auf Albumin Glomeruläre Schaden (Mikroalbuminurie als Endorganschaden, Albumin-Kreatinin Quotient) 12-Ableitungs-EKG Linksventrikuläre Hypertrophie? Niedrigere Sensivität als Echokardiographie
Erweiterte Untersuchungen
Kreatinin-Clearance Bestätigung/Ausmass einer Niereninsuffizienz TSH, ggf. T3/T4 Hypo-/Hyperthyreose-Screening Echokardiographie Hohe Sensivität für LVH; muss aber bei unkomplizierter Hypertonie initial nicht vorgenommen werden
24-Std.-Urin-EiweissAusscheidung Bestätigung/Ausmass des renalen Endorganschadens
Aldosteron-Renin-Quotient Abklärung bei Verdacht auf primären Hyperaldosteronismus (Beeinflussung des Quotienten durch Antihypertensiva beachten)
Metanephrine in angesäurten 24h Sammelurin und/oder Plasma-Metanephrine Abklärung bei Verdacht auf Phäochromozytom
24-Std.-Blutdruck-Messung Mittlerer 24-Std.-BD >130/80 mmHg Mittlerer Tages-BD >135/85 mmHg Fehlender BD-Abfall nachts <15% der Tagesphase («non-dipper»)
LVH = linksventrikuläre Hypertrophie
Abklärung bei Verdacht auf sekundäre Hypertonie
7 Junger Patient mit neu aufgetretener Hypertonie 7 Verschlechterung einer guten BDEinstellung 7 Fehlende BDSenkung nachts im ABDM («nondipper») 7 Signifikante BDDifferenzen obere: untere Extremitäten (Aortenisthmusstenose) 7 BDKrisen (Phäochromozytom) 7 Therapieresistenz (BD >140/90 mmHg trotz 3 Antihypertensiva inklusive Diuretikum)
Verdacht auf Nierenarterienstenose
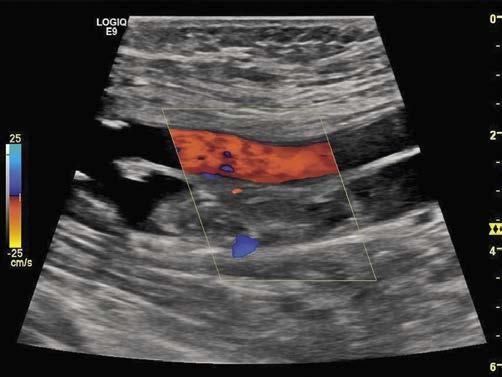
1. Schritt Screening Duplexsonographie der Nierenarterien (Abb. 2)
2. Schritt Erhärtung der Diagnose (fakultativ) Reninplasma-Aktivität im peripheren Blut (im Liegen, Plasma sofort einfrieren); gleichzeitig 24-Std.-Natriumausscheidung und Auswertung mit Nomogramm
3. Schritt Bestätigung Renale Arteriographie (Abb. 3) und ggf. perkutane transluminale Ballondilatation (Abb. 4)
Schritt 2 nicht zwingend
Abbildung 2: Duplex Ultraschallbefund bei Nierenarterienstenose mit hohen Geschwindigkeiten im befallenen Segment. (NA = Nierenarterie; ABG. PROX. NA = Abgang proximal der Nierenarterie)
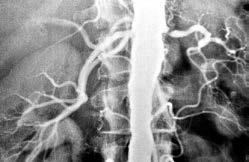
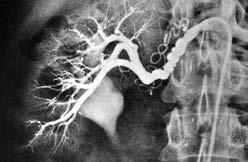
Abbildung 3: Arteriosklerotische typischerweise proximal gelegene Nierenarterienstenose links (Pfeil) bzw. fibromuskuläre Nierenarterienstenose rechts mit typischem «Perlenkettenbild».
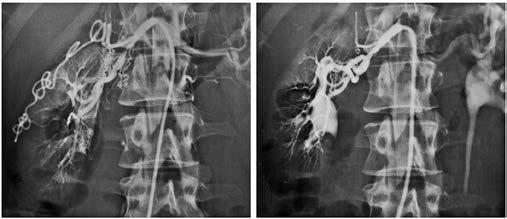
Abbildung 4: Perkutane transluminale Dilatation einer Nierenarterienstenose (vorher: links; nachher: rechts)
Verdacht auf primären Hyperaldosteronismus
Indikation zur Screening (% Wahrscheinlichkeit der Diagnose): 7 Moderate (Stadium 2, >160/100 mmHg) Hypertonie (8%) 7 Schwere (Stadium 3, >180/110 mmHg) Hypertonie (13%) 7 Therapierefraktäre Hypertonie (17–23%) 7 unter 4 Antihypertensiva kontrollierte Hypertonie 7 Hypertonie + spontane (oder Diuretika induzierte) Hypokaliämie 7 NebennierenInzidentalom und Hypertonie (1–10%) 7 Hypertonie und Schlafapnoe (ein Drittel aller neu diagnostizierten Patienten) 7 Patienten mit erstgradigen Verwanden mit primärem Hyperaldosteronismus oder positive Familienanamnese für frühzeitig auftretende Hypertonie
1. Schritt Screening Bestimmung des Aldosteron-Renin-Quotienten (Beeinflussende Antihypertensiva beachten; Umstellung von RAAS-Hemmern auf Calcium-Antagonisten und/oder Alpha-Blocker)
2. Schritt Erhärtung der Diagnose Bestätigungstest: NaCl-Infusionstest, Captopril-Test oder Fludrocortison-Test (selten eingesetzt)
3. Schritt Differential- / Lokalisationsdiagnostik Schnittbildgebung (zum Ausschluss des seltenen Nebennierenrinden-Karzinoms) und Nebennierenvenenkatheter (bei potentiellen OP-Kandidaten ; Abb. 5)
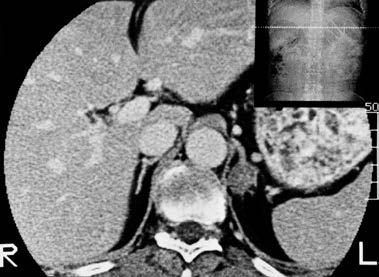
Abbildung 5: Nebennierenadenom bei einem Hypertoniker im CT (Pfeil): DD: Endokrin inaktives Adenom bei essentieller Hypertonie; primärer Hyperaldosteronismus; adrenales Cushingsyndrom (Aufarbeitung durch endokrine Diagnostik)
Verdacht auf Phäochromozytom
1. Schritt Screening Metanephrine in Plasma (nach 20 Minuten in Ruhe um falsch positive Ergebnisse zu vermeiden) oder Metanephrine im angesäuertem 24h Sammelurin 2. Schritt Erhärtung der Bei unklaren erhöhten Katecholaminen: Diagnose Clonidin-Hemmtest (selten erforderlich) 3. Schritt Lokalisation: Lokalisations-Diagnostik: Schnittbidlgebung mit CT oder MRI, meist in Kombination mit funktioneller Bildgebung (DOPA-PET oder MIBGSzintigraphie)
Begleiterkrankungen, Risikofaktoren, Zusatzkriterien bestimmen ggf. bevorzugte Auswahl der Antihypertensiva
Subklinische Organschäden Linksventrikuläre Hypertrophie ACE-Hemmer, Ca-Antagonisten AII-Antagonisten
Asymptomatische Atherosklerose ACE-Hemmer, (Ca-Antagonisten)
Mikroalbuminurie ACE-Hemmer, AII-Antagonisten Nierenkrankheiten ACE-Hemmer, AII-Antagonisten Klinische Ereignisse Hirnschlag Alle Antihypertensiva Myokardinfarkt Betablocker, ACE-Hemmer, (AII-Antagonisten) Angina pectoris Betablocker, Ca-Antagonisten
Herzinsuffizienz
Vorhofflimmern Paroxysmal ACE-Hemmer, AII-Antagonisten, Diuretika, Betablocker, Aldosteron-Antagonisten ACE-Hemmer, AII-Antagonisten, Betablocker
Dauerhaftes Vorhofflimmern Betablocker, nicht-dihydropyridin Ca-Antagonisten ESRD/Proteinurie ACE-Hemmer, AII-Antagonisten, Schleifendiuretika Periphere arterielle Ca-Antagonisten Verschlusskrankheit Isolierte systolische Hyper- Diuretika, Ca-Antagonisten tonie Metabolisches Syndrom ACE-Hemmer, AII-Antagonisten, Ca-Antagonisten Diabetes mellitus ACE-Hemmer, AII-Antagonisten Schwangerschaft Dihydropyridin Ca-Antagonisten, Methyldopa, Betablocker Cyclosporin-bedingte Ca-Antagonisten Hypertonie Tremor Betablocker Migräne Betablocker Osteoporose Thiazide Prostatahyperplasie Alphablocker
AII = Angiotensin II; ACE = Angiotensin Converting Enzyme; Ca-Antagonisten = Kalziumantagonisten; ESRD = Nierenerkrankung im Endstadium («endstage renal disease»)
Nicht-medikamentöse Massnahmen vor/mit Pharmakotherapie
7 Nikotinabstinenz 7 Alkoholeinschränkung (höchstens 1–2 Drinks pro Tag) 7 Vermeiden von Salzexzessen (<9 g NaCl/Tag = 24Urin Na+ <150 mmol) 7 Reichlich Früchte und Gemüse (DASH Diet) 7 Körperliches Training 7 Gewichtsabnahme (2/1mmHg Reduktion pro kg Körpergewicht)
Pharmakotherapie der Hypertonie (Abb. 6)
ACE-Hemmer AngII-Antagonist Ca++-Antagonist
Reninhemmer Antihypertensiva erster Wahl
β-Blocker Diuretikum Antihypertensiva für alternative Initialthearapie
Abbildung 6: Empfohlene antihypertensive Therapie (ESH/ESC Guidelines for the Management of Arterial Hypertension. European Heart Journal, (2013) 34; 2159 und 2017 U.S. High Blood Pressure Clinical Practice Guideline. Hypertension 2017; online)
Bluthochdruck Grad 1 oder 2 (Systolische BD 140–179)
Bewertung der übrigen Risikofaktoren, Diabetes, Begleiterkrankungen
Massnahmen bezüglich Lebensstil, Verbesserung anderer Risikofaktoren oder Erkrankungen
Stratifizierung des absoluten Risikos
Sehr hoch Hoch Moderat
Medikamente Medikamente Beobachtung während 3 Monaten Niedrig
Beobachtung während 3 Monaten
Initiierung der blutdrucksenkenden Behandlung
Bluthochdruck Grad 3 (Syst. BD >180)
Sofortiger Beginn der medikamentösen Behandlung
Bewertung der anderen Risikofaktoren, Diabetes, Begleiterkrankungen
Zusätzliche Massnahmen bezüglich Lebensstil Korrektur anderer Risikofaktoren oder Begleiterkrankungen
Nierennervenablation bei therapieresistenter Hypertonie
Die Nierenenervenablation beruht auf der Beobachtung in den 50er Jahren, dass einen chirurgische Sympathektomie eine deutliche BDSenkung und Senkung der Mortalität bewirkt. Nach anfänglichen Erfolgen wurde die Wirkung der katheterbasierten Nierennervenablation in der Symplicity HTN3 Studie (N Engl J Med. 2014;370:1393) in Frage gestellt. Die Symplicity HTN3 Studie wies aber viele Mängel auf, insbesondere eine zu geringe Anzahl von Ablationen. Neuere Studien haben die BDSenkung durch eine Nierennervenablation allerdings wieder belegt. (Lancet 2015;385: 1957; Lancet. 2017;390:2160).
Indikationen
7 Blutdruck ≥140/90 mmHg (bzw. >130/80 mmHg bei Diabetikern oder Patienten mit Nierenerkrankungen) trotz 3 Antihypertensiva inklusive einem Diuretikum 7 Blutdruck ≥140/90 mmHg und multiple Medikamenten Unverträglichkeit 7 Ausschluss von sekundären Hypertonieformen
Kontraindikationen
7 Behandelbare sekundäre Hypertonie 7 Mehrere Nierenarterien oder einzelne Nierenarterien mit einem
Durchmesser <4 mm 7 Signifikante Nierenarterienstenose, vorheriges Stenting 7 GFR <30 ml/min/1.73 m2
Prinzip
7 Partielle Zerstörung der afferenten und efferenten sympathischen Nerven mit Radiofrequenzenergie 7 Lokal verabreichte Radiofrequenzenergie (jeweils 1 bis 8 Watt) an 6–8 Stellen unterhalb jeder Nervenarterie (siehe Abb. 7 Seite 17)
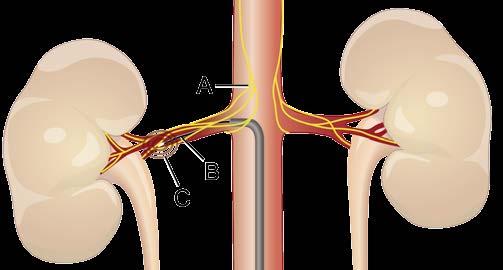
Abbildung 7: Prinzip der Ablation von Nierennerven bei therapie-resistenter Hypertonie A = Nierennerven; B = Katheter; C = Radiofrequenzenergie
Wirkung
7 Die Nierennervenablation führt über 3–12 Monate zu einem
Abfall des Blutdrucks von im Mittel 15–25/5–10 mmHg
Komplikationen
7 Die Intervention verursacht keine schwerwiegenden Komplikationen. 7 Gering lokale Blutungen an der Punktionstellen, selten Pseudoaneurisma 7 Vasospasm, meist transient 7 Selten Nierenarteriendissektion bei Intubation mit Führungskatheter, welche mittels Stenting behandelbar ist.
Eine Nierenarterienablation soll in erfahrenen Spitalzentren, wie z.B. Hypertension Excellence Centers durchgeführt werden (ESH Position Paper, J Hypertension 2012 30(5):837–41).