
Quaderno 3


Quaderno 3
HER2
Caso clinico 1
Carcinoma mammario HER2 positivo con metastasi scheletriche: trattamento di seconda linea
Chiara Ancona 2
Caso clinico 2
Efficacia del trattamento con trastuzumab deruxtecan in paziente con tumore della mammella HER2 positivo con metastasi encefaliche disseminate
Antonio D’Ambrosio 7
Caso clinico 3
Carcinoma mammario HER2 positivo con episodio di scompenso cardiaco in corso di trastuzumab deruxtecan post-TDM1
Filippo Merloni 11
Caso clinico 4
Seconda linea con trastuzumab deruxtecan in paziente con metastasi cerebrali e intramidollari da neoplasia mammaria HER2 positiva
Alice Muzzarelli 17
Caso clinico 5
Carcinoma mammario HER2 positivo: integrazione tra trastuzumab deruxtecan e terapia loco-regionale in seconda linea
Simona Pisegna, Andrea Botticelli 21
Caso clinico 6
Trastuzumab deruxtecan nel carcinoma mammario metastatico HER2 low con metastasi encefaliche, in linee di terapia avanzate
Federico Sottotetti 24
Caso clinico 7
Seconda linea con trastuzumab deruxtecan in carcinoma della mammella avanzato HER2 positivo: efficacia rapida e lunga durata della risposta
Beatrice Tedesco 28
Chiara Ancona
Casa di cura La Maddalena, Palermo.
Introduzione
Il carcinoma mammario HER2 positivo rappresenta circa il 15-20% di tutti i tumori mammari ed è caratterizzato da una prognosi sfavorevole. Le terapie mirate ed in particolare i farmaci anti-HER2 hanno cambiato la storia del carcinoma della mammella metastatico. Nell’ultimo decennio, gli anticorpi farmaco coniugati sono entrati nell’algoritmo terapeutico di molteplici neoplasie e grazie alla loro capacità di veicolare l’agente citotossico direttamente nelle cellule neoplastiche massimizzano l’effetto della chemioterapia ma riducendone l’esposizione sistemica e la tossicità ad essa correlata1. Trastuzumab deruxtecan è un anticorpo farmaco coniugato (ADC) costituito da un anticorpo monoclonale umanizzato anti-HER2 legato a un inibitore della topoisomerasi I tramite un linker scindibile tetrapeptidico che presenta un meccanismo d’azione altamente selettivo a livello delle cellule tumorali che iperesprimono HER2. Lo studio registrativo DESTINYBreast03 ha confrontato testa a testa i due anticorpi coniugati disponibili dopo trattamento di I linea ovvero T-DXd e trastuzumab-emtansine (TDM-1), evidenziando un vantaggio in PFS di 28,8 mesi contro i 6,8 mesi del TDM-1 (HR 0,33, p<0,0001), stabilendo il ruolo del T-DXd nella seconda linea del carcinoma mammario HER2 positivo2.
Caso clinico
Si descrive il caso clinico di una paziente di 72 anni; in anamnesi viene riportata ipertensione arteriosa in
trattamento farmacologico, ben controllata da combisartan 160/25 una cp die, sindrome ansioso depressiva trattata con anafranil 25 una cp die; in menopausa fisiologica all’età di 53 anni.
Nel mese di Giugno 2018 giunge alla nostra osservazione dopo il riscontro autopalpatorio di una nodulazione mammaria sinistra, trascurata dalla paziente.
Alla valutazione radiologica eseguita con mammografia ed ecografia si evidenziava area ipoecogena di 3,5 cm al QSE di sinistra.
Alla fine di Ottobre 2018 veniva sottoposta ad agobiopsia mammaria di sinistra che evidenziava presenza di carcinoma infiltrante B5 secondo le linee europee. Assetto recettoriale ed indice di proliferazione:
Ricerca recettori intranucleari per estrogeno (clone SP1): presenti nel 95% delle cellule neoplastiche.
Ricerca recettori intranucleari per Progesterone (clone 1E2): presenti nel 10% delle cellule neoplastiche.
Moderata e completa immunoreattività di membrana per HER2/neu (anticorpo monoclonale 4B5) in più del 10% delle cellule neoplastiche.
Indice di proliferazione della popolazione neoplastica (Ki-67) (clone 30-9): 80%.
Gene HER2: presenza di amplificazione del gene HER2.
Con la scintigrafia ossea e la TC eseguite ad Ottobre del 2018 si evidenziavano plurime captazioni alla colonna vertebrale nel tratto dorsale e nell’articolazione sacro-iliaca sx e linfonodi aumentati di volume in sede sovraclaveare dx. Addensamento nodulare di circa 4 cm alla mammella sx.
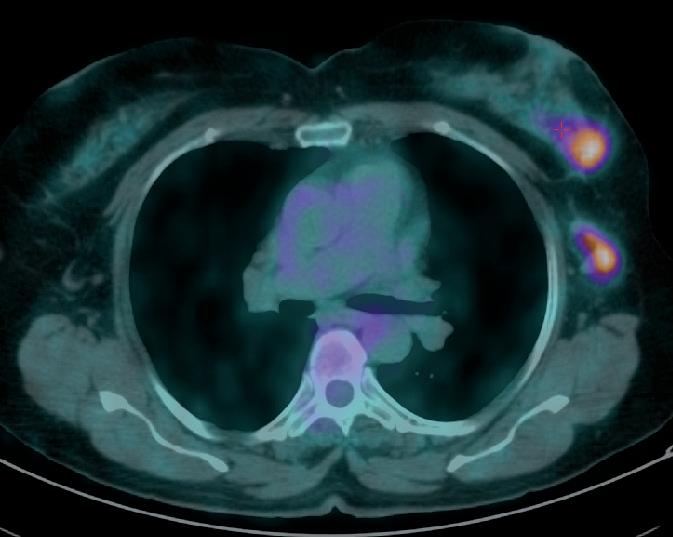
La PET (figura 1) metteva in evidenza la presenza di accumulo del tracciante metabolico in corrispondenza della formazione ovalare posta nel quadrante inferoesterno della mammella di sinistra (SUV massimo pari a 5,6). In in sede ascellare monolaterale, ulteriore grossolano linfonodo caratterizzato da analoga attività metabolica (SUV massimo pari a 5,1). Si segnalano inoltre, la presenza di alcune focalità di accumulo del tracciante metabolico di pertinenza scheletrica poste nel soma di D2, D11 e nell’emisacro di sinistra.
Pertanto dal 30/11/2018 al 8/04/2019, avvia terapia di prima linea secondo schema docetaxel, pertuzumab e trastuzumab per 6 cicli in associazione a denosumab (dopo il primo ciclo il docetaxel è stato sotituito con il paclitaxel per avvenuta reazione allergia). Dopo i primi
3 cicli di trattamento, alla PET di Febbraio 2019 (figura 2) si è dimostrata una sensibile regressione della lesione mammaria che presenta un SUV massimo pari a 2,9 vs 5,6 del precedente controllo; in sede ascellare di sinistra, apprezzabile sovracentimetrico linfonodo, modestamente captante il tracciante metabolico (SUV massimo pari a 1,7). Per quanto concerne le lesioni scheletriche descritte nel corso del precedente test, permane caratterizzato da modesta attività metabolica, esclusivamente un’unica lesione posta nel soma di D2. Non si risconoscono aree di accumulo di nuova comparsa.
La paziente ha proseguito la terapia per ulteriori tre cicli con discreta tolleranza (modesta astenia e mialgie), ottenendo al successivo controllo PET stabilità della malattia. Dopo 6 cicli di trattamento, la paziente ha proseguito il mantenimento con il doppio blocco in associazione a terapia ormonale con Letrozolo con periodiche rivalutazioni della malattia.
La PET di Luglio 2019 rilevava una ulteriore riduzione dell’attività metabolica della lesione mammaria di sinistra che presenta un SUV massimo pari a 2,2 vs 3,9 del precedente controllo. Analogo andamento presentano le due lesioni scheletriche modestamente captanti nel precedente controllo. La paziente veniva quindi sottoposta nel mese di Settembre 2019 ad intervento di mastectomia radicale sn sec. Madden con esame istologico di carcinoma duttale infiltrante, Metastasi linfonodali di carcinoma in 3 linfonodi. Indenni da metastasi i rimanenti linfonodi esaminati. Presenza di embolizzazione neoplastica vascolare perilinfonodale.
Assetto recettoriale ed indice di proliferazione:
Ricerca recettori intranucleari per Estrogeno (clone SP1): presenti nel 95% delle cellule neoplastiche.
Ricerca recettori intranucleari per Progesterone (clone 1E2): presenti nel 5% delle cellule neoplastiche.
Moderata e completa immunoreattività di membrana per HER2/neu (anticorpo monoclonale 4B5) in più del 10% delle cellule neoplastiche.
Indice di proliferazione della popolazione neoplastica (Ki-67) (clone 30-9): 60%.
La PET di Ottobre 2019 evidenziava caratterizzate da minima attività metabolica le lesioni scheletriche descritte nel corso dei precedenti controlli. È apprezzabile esclusivamente modesta attività metabolica in corrispondenza dell’emisoma sinistro di D11.
1. PET Ottobre 2018.
2. PET dopo 3 cicli di ct con TXT trastuzumab e pertuzumab.
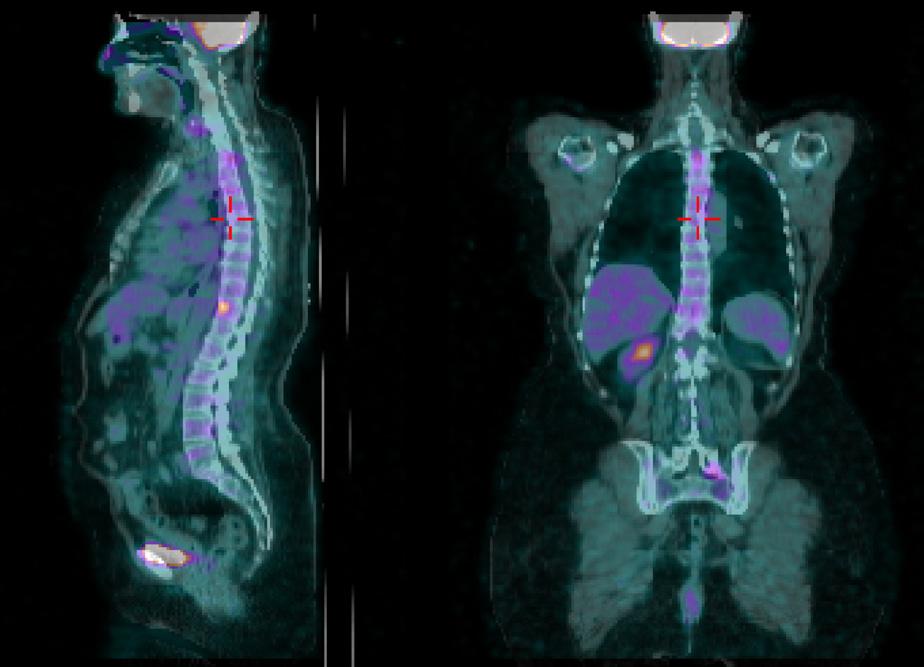

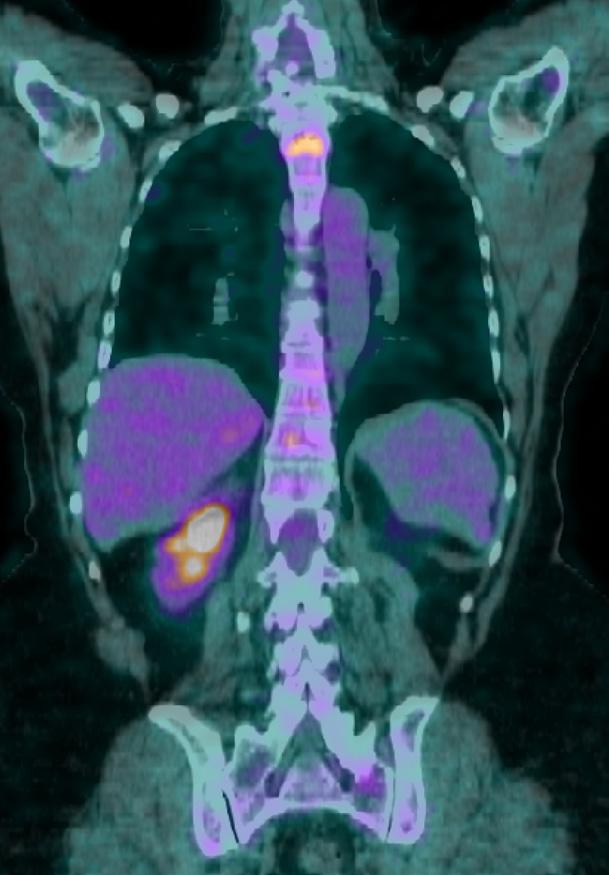
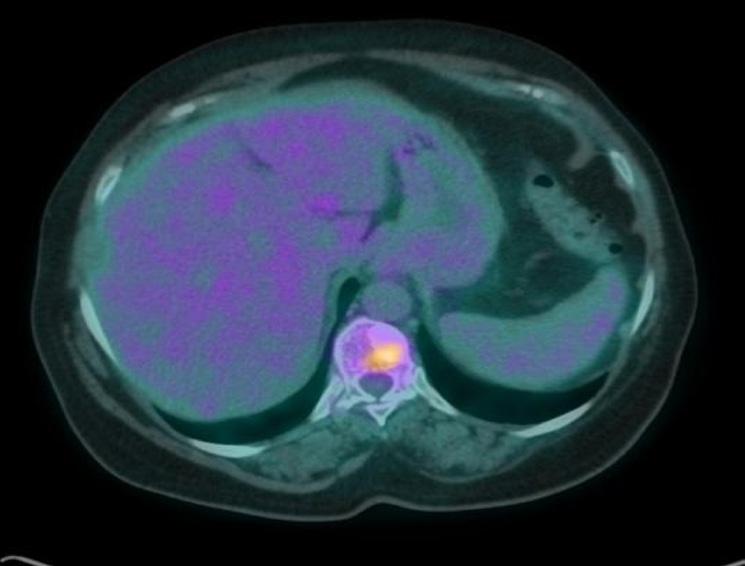
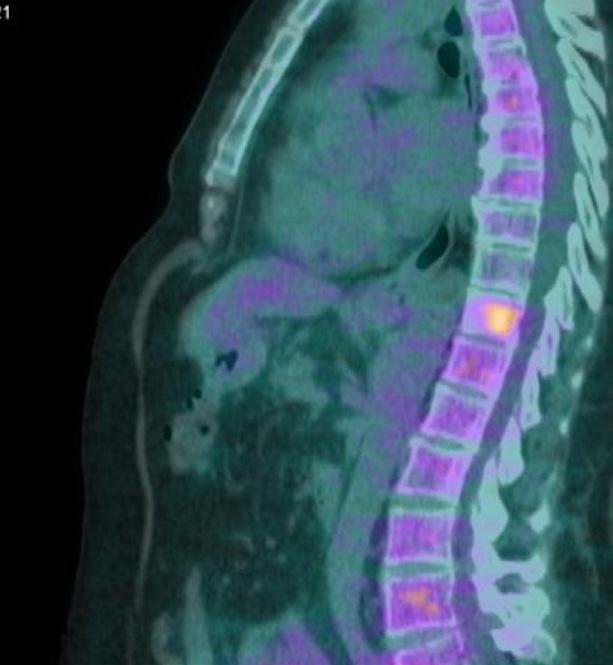
Figura 4. PET Novembre 2021.

Figura 5. PET Agosto 2022.


Figura 6. PET Novembre 2022.

La paziente proseguiva pertanto il doppio blocco con ottimo controllo della malattia.
La PET del mese di Febbraio 2021 (figura 3) evidenzia progressione di malattia a carico di D11 per cui la paziente esegue trattamento radioterapico stereotassico su unica sede di progressione e prosege il trattamento con doppio blocco.
Alla PET di Novembre 2021 (figura 4) si evidenzia ulteriore PD scheletrica su D9 e osso sacro per cui dal 17/12/2021 al 04/01/2022 è stata sottoposta a trattamento RT i salvataggio su (D9- Sacro ) con tecnica 30 Gy. La paziente prosegue con il doppio blocco fino al mese di Luglio 2022 (56° ciclo di pertuzumab e trastuzumab).
In seguito ad ulteriore progressione scheletrica riscontrata nel mese di Agosto 2022 (figura 5) la paziente ha pertanto avviato una seconda linea di trattamento con T-DXd 5,3 mg/kg nell’ambito del programma a uso nominale, ottenendo una risposta completa di malattia alla PET di Novembre 2022 (figura 6) dopo soli 3 cicli di trattamento. Dal 02/01/2023 prosegue a terapia ridotta al I livello 4,4 mg/kg per quadro di tossicità gastrointestinale con nausea G2, vomito, diarrea G2 e inappetenza. Dal secondo ciclo abbiamo potenziato la premedicazione antiemetica con desametasone per os per 3 giorni. Nonostante ciò la paziente ha riportato nausea G2 per i primi sette giorni dopo l’infusione e nausea G1 per i successivi 14 giorni. Da quando abbiamo ridotto la dose al I livello la paziente non lamenta alcun disturbo, in questo modo c’è stato un miglioramento dei sintomi, con conseguente prosecuzione della terapia con T-DXd senza interruzioni e con una ottima qualità della vita. Ottobre 2023 riscontro clinico di fini crepitii alle basi polmonari bilateralmente, no aree di ottusità alla percussione, parametri vitali nella norma. Si esegue HRTC, visita cardiologica con ecocardio e valutazione della FEVs ed indici di flogosi PCR e procalcitonina per escludere eziologia infettiva. La paziente nega disturbi, porta in visione gli indici di flogosi e visita cardiologica che risultano nella norma, la HRTC (figura 7) rileva la comparsa di ispessimenti interstiziali subpleurici bilateralmente; coesistono alterazioni a vetro smerigliato. La strategia intrapresa è stata quella di interrompere il trattamento con T-DXd ed iniziare una terapia con prednisolone 1 mg/kg per 20 giorni con graduale riduzione della dose e ripetizione della HRTC
Figura 7. HRTC Ottobre 2023: si rileva la comparsa di ispessimenti interstiziali subpleurici bilateralmente; coesistono alterazioni a vetro smerigliato.
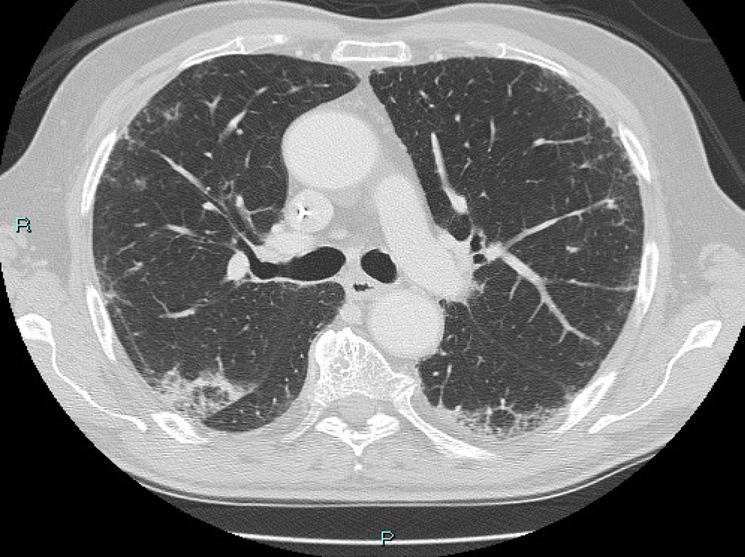
Figura 8. HRTC Novembre 2023 dopo 3 settimane di trattamento.
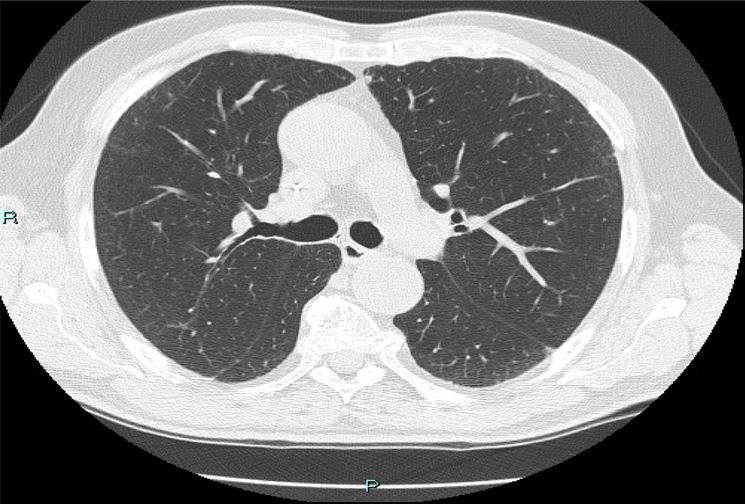
dopo 3 settimane di trattamento (figura 8) che evidenziava risoluzione completa delle manifestazioni polmonari precedentemente segnalate. Dopo un’approfondita e articolata discussione multidisciplinare, si decide di riprendere il trattamento con T-DXd allo stesso dosaggio (risoluzione entro i 28 giorni) e con stretto monitoraggio clinico strumentale. Alla PET di Ottobre 2024 dopo 36 cicli di terapia con T-DXd la paziente si mantiene tuttora libera da malattia.
Per quanto riguarda la scelta della terapia di prima linea, secondo le linee guida la scelta è caduta sull’impiego del doppio blocco in associazione a taxano. Lo studio clinico randomizzato CLEOPATRA ha valutato l’aggiunta di pertuzumab a T-DXd. In questo studio
che ha arruolato 808 pazienti, l’aggiunta del pertuzumab ha determinato un significativo incremento delle risposte obiettive (ORR), della sopravvivenza libera da progressione e della sopravvivenza globale, con un vantaggio rispettivamente di circa 6 e circa 16 mesi3 Quanto invece alla seconda linea, la prima approvazione di T-DXd da parte della Food and Drug Administration (FDA) nel setting di terza linea per le pazienti con carcinoma mammario metastatico erano basate sui risultati del DESTINY-Breast01, studio di fase 2 che confermava una sopravvivenza dibera da progressione (PFS) mediana di 16,4 mesi4.
Il DESTINY-Breast03 è lo studio registrativo che ha mostrato un miglioramento statisticamente significativo della sopravvivenza del T-DXd rispetto a trastuzumabemtansine (TDM-1), evidenziando un vantaggio in PFS di 28,8 mesi contro i 6,8 mesi del TDM-1 (HR 0,33, p<0,0001), stabilendo il ruolo del T-DXd nella seconda linea del carcinoma mammario HER2 positivo5 Nello studio DESTINY-Breast03 il numero di pazienti con eventi avversi di grado 3 o superiore farmacospecifici era simile nei due gruppi. La maggior parte degli eventi avversi emersi dal trattamento con T-DXd era di natura gastrointestinale o ematologica, nausea e vomito tra i più frequenti. La nausea è l’evento avverso più frequentemente osservato in corso di terapia con T-DXd. La nausea in corso di T-DXd è solitamente di grado 1 o 2 ma spesso protratta per molti giorni durante il ciclo, influenzando negativamente la qualità della vita. Un regime a due farmaci (desametasone e antagonisti del recettore 5HT3) può essere efficace in molti modi6. In caso di scarso controllo della sintomatologia dopo il primo ciclo di terapia, è raccomandato un pronto potenziamento della profilassi passando a un regime a 3 farmaci, aggiungendo quindi un antagonista del recettore NK17. In caso di nausea e vomito particolarmente refrattari, si può valutare l’aggiunta di olanzapina, che agisce come antiemetico ad ampio spettro, interagendo con recettori dopaminergici, serotoninergici, con il recettore adrenergico alfa1 e il recettore H1 dell’istamina, come consigliato per i farmaci a elevato potere emetogeno 6 . Altro evento avverso farmaco relato al T-DXd aumentato dall’11 al 15% nella seconda analisi provvisoria della sopravvivenza globale (cut-off dei dati al 25 Luglio 2022) era la malattia interstiziale, o polmonite, con un tempo mediano alla comparsa dell’evento di 8,1 mesi nel gruppo
con T-DXd e 11,7 mesi nel gruppo con TDM1. Tuttavia, tutti i nuovi casi erano di basso grado (grado 1 o 2)8 anche in seguito all’mplementazione delle linee guida per un’adeguata gestione della malattia polmonare interstiziale attuando un monitoraggio proattivo dei pazienti per segni e sintomi precoci e il trattamento immediato9.
Il caso clinico presentato conferma i dati di attività ed efficacia di T-DXd come terapia di seconda linea nel carcinoma mammario metastatico HER2 positivo. È inoltre esemplificativo di come le pazienti, se ben supportate, possano proseguire con il trattamento con T-DXd mantenedo una buona qualità della vita.
1. Criscitiello C, Morganti S, Curigliano G. Antibody-drug conjugates in solid tumors: a look into novel targets. J Hematol Oncol 2021; 14(1):20.
2. Cortès J, Kim S-B, Chung W-P, et al. Trastuzumab deruxtecan versus tratstuzumab emtansine for breast cancer. N Engl J Med 2022; 386(13):1193-1205.
3. Swain SM, Baselga J, Kim SB, et al.; Cleopatra Study Group. Pertuzumab, trastuzumab, and docetaxel for HER2 positive metastatic breast cancer. N Engl J Med 2015; 372(8):724-734.
4. Modi S, Saura C, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020; 382(7):610-621.
5. Hurvitz SA, Hegg R, Chung WP, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patents with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial. Lancet 2023; 401(10390):18231834.
6. Herrstedt J, Clark-Snow R, Scottè F, Ruhlmann A, Molassiotis I. 2023 MASCC and ESMO guideline update for the prevention of chemotherapy-induced nausea and vomiting. ESMO Open 2024; 9(1):102146.
7. Bianchini G, Arpino G, Pappagallo G, et al. Emetogenicity of antibody-drug conjugates (ADCs) in solid tumors with a focus on trastuzumab deruxtecan: insights from an Italian expert panel. Cancers (Basel) 2022; 14(15):3691.
8. Soares LR, Vilbert M, Rosa VDL, et al. Incidence of interstitial lung disease and cardiotoxicity with trastuzumab deruxtecan in breast cancer patients: a systematic review and single-arm meta-analysis. Clin Breast Cancer 2023; 23(1):16-24.
9. Swain SM, Nishino M, Lancaster LH, et al. Multidisciplinary clinical guidance on trastuzumab deruxtecan (T-Dxd)- related interstitial lung disease/ pneumonitis: focus on proactive monitoring, diagnosis, and management. Cancer Treat Rev 2022; 107:102401.
trattamento con trastuzumab deruxtecan in paziente con tumore della mammella HER2 positivo con metastasi encefaliche
Antonio D’Ambrosio
UOSD Oncologia, Presidio Ospedaliero San Luca, Vallo della Lucania.
Introduzione
Le metastasi encefaliche da tumore mammario rappresentano la seconda causa di metastasi encefaliche, con un’incidenza aumentata negli ultimi anni alla luce del miglioramento in sopravvivenza delle pazienti con tumore mammario metastatico.
Tali lesioni colpiscono approssimativamente circa il 20-25% delle pazienti con carcinoma mammario, impattando significativamente sulla sopravvivenza e sulla qualità di vita.
Il sottotipo di malattia HER2+, così come quello triplo negativo, sono maggiormente associati a sviluppare metastasi encefaliche 1
Nonostante un armamentario terapeutico sempre più ricco, la prognosi di queste pazienti resta sfavorevole, rappresentando così una sfida per il clinico.
La barriera emato-encefalica (BEE), infatti, risulta scarsamente permeabile a molti farmaci. Inoltre tali pazienti sono spesso esclusi dagli studi clinici, limitando così il livello di evidenze disponibili. In aggiunta, mancano dati prospettici robusti sul trattamento multimodale che combina strategie locoregionali e sistemiche.
Il trattamento di questo sottogruppo di pazienti dipende dalla sede delle metastasi, dalla presenza di sintomi, dalle caratteristiche biologiche del tumore e dal controllo della malattia sistemica 2-3 .
Attualmente nuovi farmaci anti-HER2 sono disponibili nella pratica clinica o sono in fase di sperimentazione con l’obiettivo di prolungare la sopravvivenza di questi pazienti 4 .
Caso clinico
Si riporta il caso di una paziente di 34 anni, nullipara, non fumatrice e non etilista, stile di vita sano, anamnesi patologica remota muta e familiarità oncologica negativa, affetta da carcinoma mammario HER2+ in risposta intracranica completa mantenuta dopo trattamento con radioterapia panencefalica e T-DXd.
A Maggio 2023, per comparsa di malessere generale e ittero, si reca in PS.
All’esame obiettivo evidenza di formazione occupante gran parte del QIE della mammella sx con retrazione del capezzolo e contestuale linfoadenopatia ascellare omolaterale dolente, fissa sui piani sottostanti e pericentimetrica. All’approfondimento ecografico tali lesioni sono fortemente sospette e pertanto si procede a un’agobiopsia della neoformazione mammaria. L’esame istologico depone per carcinoma infiltrante NST sec WHO 2019 G2/G3 ER 90% PgR 40% Ki67 70% HER 2 3+.
La TC total body con mdc effettuata per stadiazione oncologica, evidenzia fegato pressoché sostituito da lesioni ipodense tendenti alla confluenza di significato secondario, con multiple focali alterazioni della struttura ossea a carico del bacino, vertebre toraciche e lombari, sterno e coste.
Eseguita vertebroplastica su D12 e L1, è stata poi effettuata radioterapia su sedi ossee dolenti e contestualmente avviato un trattamento con bifosfonati per prevenzione eventi scheletrici secondari.
Gli esami ematochimici praticati in basale mostrano rialzo di tutti i marker tumorali analizzati (CEA, CA 125, CA 15-3, TPA) e un quadro di insufficienza epatica severa con ipertransaminasemia G3 e iperbilirubinemia G3.
Dopo discussione multidisciplinare, considerando la giovane età e l’assenza di comorbilità, in presenza di
crisi viscerale e co-espressione dei recettori ormonali, si decide di iniziare un trattamento con trastuzumab (6 mg/kg) + pertuzumab (420 mg) q21 in associazione a trattamento ormonale con inibitore steroideo dell’aromatasi + agonista LHRH.
La prima rivalutazione strumentale effettuata a Settembre 2023 con TC, dopo 4 cicli di trattamento, registra una risposta iniziale in sede epatica, una completa normalizzazione degli indici di funzionalità epatica così come dei marcatori tumorali e una stabilità strumentale della formazione mammaria e ascellare. Quindi, incoraggiati da un quadro clinico-laboratoristico drasticamente migliorato, si aggiunge paclitaxel 80 mg/m2 q7 al trattamento anti-HER2, sulla scorta dei dati dello studio di fase IIIB PERUSE.
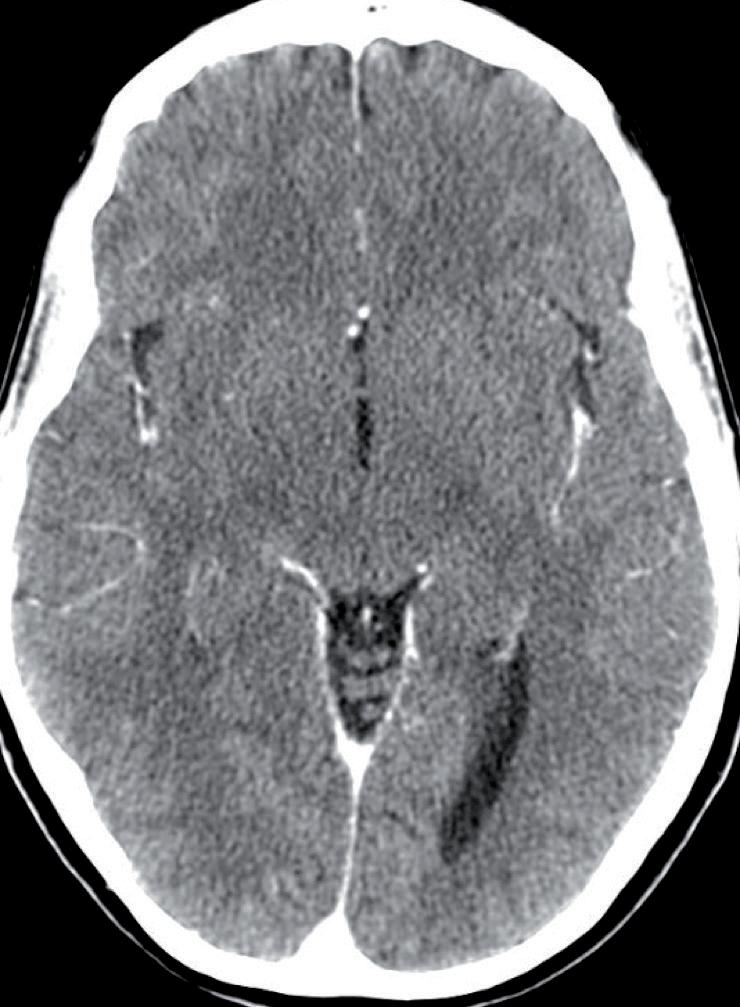
Tuttavia, nonostante la buona risposta iniziale, la TC total body con mezzo di contrasto del 28/12/2023 (figura 1) evidenzia progressione epatica ed encefalica con un quadro radiologico che mostra sovvertimento encefalico diffuso caratterizzato da numerose lesioni secondarie (almeno 10) a netta impregnazione contrastografica a sede sia cerebrale che cerebellare, prevalentemente subcentimetriche, la maggiore di 13 mm in nucleo-capsulare sx con nucleo necrotico e modesto alone edemigeno perilesionale.
La paziente, asintomatica sul piano neurologico e con marcatori tumorali negativi, viene sottoposta previo consulto multidisciplinare, a radioterapia panencefalica con risparmio dell’ippocampo con tecnica IMRT (30 Gy in 10 frazioni) e candidata poi a trattamento di II linea con T-DXd (5,4 mg/kg) q21, supportati dai dati di efficacia riportati dal DESTINY-Breast03, dalle analisi di sottogruppo degli studi DESTINY-Breast01, -02, -03 e dagli incoraggianti risultati preliminari degli studi DEBBRAH e TUXEDO-1.
La rivalutazione strumentale effettuata dopo 4 cicli di trattamento (figura 2) ha mostrato risposta intracranica completa ed epatica parziale. Lo studio della regione mammaria e ascellare con ecografia mammaria e mammografia ha mostrato assenza di lesioni infiltrative con presenza in sede retroareolare sx di un cluster di microcalcificazioni in assenza di linfoadenopatie ascellari. Lo studio tomografico con finestra per osso ha confermato la sovrapponibilità delle lesioni ossee rispetto alla precedente TC, in assenza di fratture patologiche. La paziente tuttora non ha mai manifestato eventi scheletrici secondari né riferisce dolore.

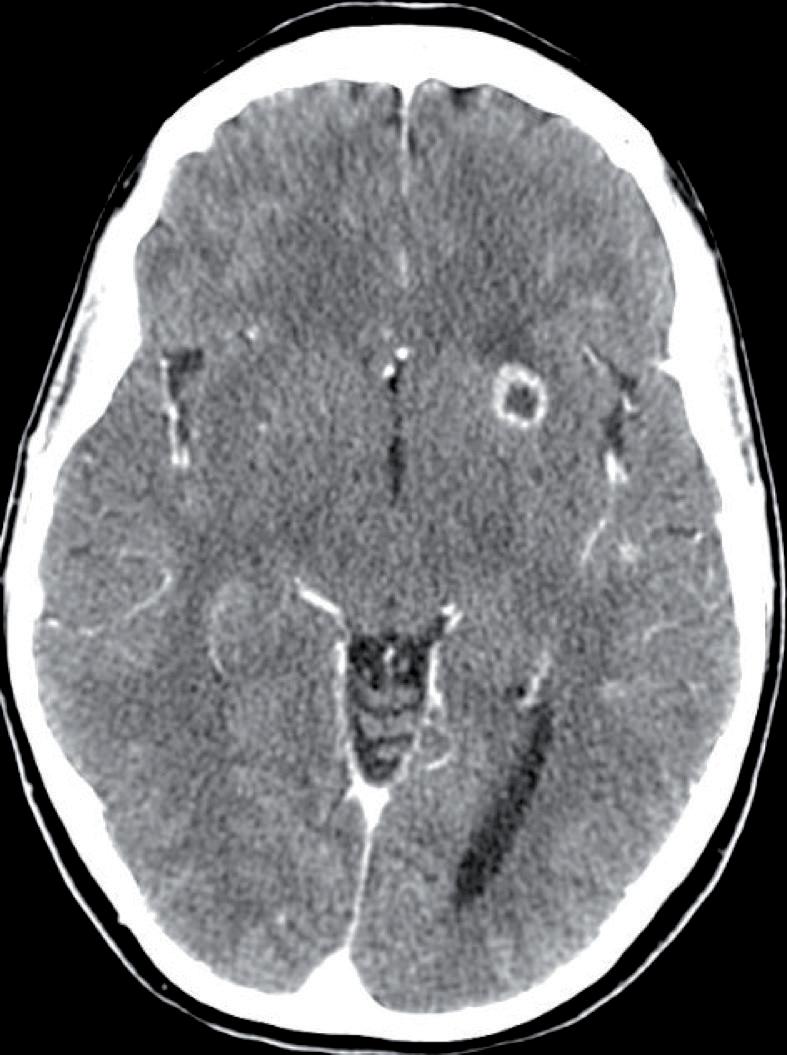
L’ottima risposta strumentale al T-DXd si è mantenuta alle successive rivalutazioni con un quadro clinico-laboratoristico nei limiti della norma. La paziente ad oggi prosegue il trattamento al massimo dosaggio, mantenendo un’ottima qualità di vita e riportando occasionalmente piastrinopenia e ipertransaminasemia G1, ben gestiti con sola terapia di supporto, senza richiedere interruzioni del trattamento o modifiche della dose.
Come profilassi antiemetica, considerata la giovane età e il sesso femminile, si è impostato un trattamento a due farmaci con desametasone + antagonisti del recettore 5-HT3. Tuttavia, per insorgenza di nausea e vomito G2 insorti a circa 6 settimane dal trattamento, è stato aggiunto un antagonista del recettore NK1 al regime a 2 farmaci, ottenendo così un controllo otti-
male della nausea e del vomito. Al momento della stesura di questo articolo, la paziente ha praticato 17 somministrazioni del farmaco.
Attualmente il trattamento raccomandato in I linea nella malattia metastatica HER2+ è rappresentato dalla combinazione taxano + trastuzumab + pertuzumab5. Il paclitaxel settimanale è una valida alternativa al classico schema con docetaxel, riportando una minore incidenza di neutropenia G3 e neutropenia febbrile6. Una generale migliore tollerabilità e la possibilità di monitorare più frequentemente la paziente, sono stati i fattori che hanno influenzato la scelta del tipo di chemioterapico da associare al doppio blocco anti-HER2. Alla diagnosi la paziente presentava una funzionalità epatica severamente compromessa, pertanto, consi-
derando la controindicazione alla chemioterapia, confortati dai dati di efficacia relativi alla combinazione doppio blocco anti-HER2+ inibitore dell’aromatasi in I linea (anche se studiata in una popolazione di pazienti differente), si è deciso di iniziare questo tipo di trattamento, valutando l’aggiunta della chemioterapia sulla base della risposta 7 .
La scelta della seconda linea di trattamento è stata condizionata dalle caratteristiche farmacologiche del T-DXd, dalla letteratura medica a supporto nonché dalla disponibilità dei trattamenti approvati dal nostro ente regolatorio a progressione da trastuzumab + pertuzumab.
A differenza di altri anticorpi farmaco-coniugati come T-DM1, T-DXd possiede un effetto bystander che gli consente di esercitare l’attività antitumorale anche su cellule HER2 negative circostanti, per cui il farmaco citotossico è rilasciato dalla cellula target nello spazio extracelluare, inducendo così danno cellulare. Inoltre, T-DXd ha un elevato rapporto farmaco-anticorpo, con 8 molecole di payload su ciascuna molecola di Ab. Lo studio DESTINY-Breast03, che ne ha consentito l’approvazione, ha dimostrato un vantaggio del T-DXd in PFS mediana di 28,8 mesi vs 6,8 mesi, con una mediana di sopravvivenza non raggiunta e una riduzione del rischio di morte del 36% rispetto al T-DM1 in pazienti progrediti a trastuzumab (con o senza pertuzumab) e taxano. Il vantaggio in sopravvivenza globale è risultato essere presente in tutti i sottogruppi, inclusi i pazienti con metastasi encefaliche (erano esclusi dallo studio i pazienti con metastasi encefaliche attive) 8 . Evidenze preliminari promettenti sull’efficacia intracranica del T-DXd sono derivate dall’analisi retrospettiva di sottogruppo del DB-01, -02 e -03. Tale analisi esploratoria ha mostrato una risposta intracranica del 45% sia nei pazienti con metastasi encefaliche stabili che attive. Tuttavia, questi studi differiscono nei criteri di arruolamento. DESTINY-Breast01 ha arruolato pazienti pesantemente pretrattati, trattati con solo T-DXd. Nel DESTINY-Breast02 tutti i pazienti sono stati precedentemente pretrattati con T-DM1 e randomizzati a T-DXd vs terapia a scelta dello sperimentatore. Nel DESTINY-Breast03 erano inclusi pazienti che avevano ricevuto un precedente trattamento con trastuzumab e taxano e randomizzati a T-DXd o T-DM1. Infine, i pazienti con metastasi encefaliche attive erano pochi nel DB-02 e DB-03 e assenti nel DB-019.
TUXEDO-1 e DEBBRAH, invece, sono studi di fase II a singolo braccio che hanno dimostrato un’ottima risposta intracranica del T-DXd anche in pazienti con metastasi encefaliche attive, pur presentando il limite di essere piccoli studi prospettici 10-11 . DESTINY-Breast12 è il più grande studio prospettico sul T-DXd che ha incluso anche pazienti con metastasi encefaliche attive. Questo studio non comparativo di fase 3b/4 ha valutato l’efficacia e la sicurezza di T-DXd in pazienti con tumore mammario metastatico HER2+ in due coorti separate di pazienti, con o senza metastasi encefaliche al basale. Tutti i pazienti sono stati trattati con una o più linee di trattamento antiHER2 e ricevevano T-DXd. Su un totale di 504 pazienti arruolati, 263 avevano metastasi encefaliche al basale di cui 106 pazienti con metastasi encefaliche attive. Nella coorte di pazienti con metastasi encefaliche, la PFS a 12 mesi (endpoint primario in questa coorte) era 61,6% con una CNS PFS a 12 mesi del 57,8% e 60,1% nei pazienti con metastasi encefaliche stabili e attive, rispettivamente 12 .
Il caso riportato testimonia l’elevata attività intracranica ed extracranica di T-DXd in una paziente con metastasi encefaliche stabili da carcinoma mammario HER2+.
Recenti dati prospettici mostrano un ottimo controllo intracranico di malattia in pazienti con metastasi encefaliche stabili o attive trattati con T-DXd.
Pertanto, ad oggi, T-DXd costituisce una valida opzione di trattamento in pazienti con carcinoma mammario metastatico HER2+ a progressione da trastuzumab e taxano anche in presenza di metastasi encefaliche attive, con la possibilità di differire il trattamento locale e quindi eventuali tossicità ad esso correlate in questo sottogruppo di pazienti a prognosi sfavorevole.
1. Darlix A, Louvel G, Fraisse J, et al. Impact of breast cancer molecular subtypes on the incidence, kinetics and prognosis of central nervous system metastases in a large multicentre real‐life cohort. Br J Cancer. 2019;121(2):991‐1000.
2. Sperduto PW, Mesko S, Li J, et al. Estrogen/ progesterone receptor and HER2 discordance between primary tumor and brain metastases in breast cancer and its effect on treatment and survival. Neuro Oncol. 2020;22(9):1359-1367.
3. Costa R, Carneiro BA, Wainwright DA, et al. Developmental therapeutics for patients with breast cancer and central nervous system metastasis: current landscape and future perspectives. Ann Oncol. 2017;28(1):44-56.
4. Simmons C, Rayson D, Joy AA, et al. Current and future landscape of targeted therapy in HER2-positive advanced breast cancer: redrawing the lines. Ther Adv Med Oncol. 2022 Jan 9;14:17588359211066677.
5. Swain SM, Miles D, Kim SB, et al.; CLEOPATRA study group. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study. Lancet Oncol. 2020 Apr;21(4):519-530.
6. Miles D, Ciruelos E, Schneeweiss A, et al.; PERUSE investigators. Final results from the PERUSE study of first-line pertuzumab plus trastuzumab plus a taxane for HER2-positive locally recurrent or metastatic breast cancer, with a multivariable approach to guide prognostication. Ann Oncol. 2021 Oct;32(10):12451255.
7. Rimawi M, Ferrero JM, de la Haba-Rodriguez J, et al. First-line trastuzumab plus an aromatase inhibitor, with or without pertuzumab, in human epidermal growth factor receptor 2-positive and hormone receptor-positive metastatic or locally advanced breast cancer (PERTAIN): a randomized, open-label phase II trial. J Clin Oncol. 2018;36(28):2826-2835.
8. Hurvitz SA, Hegg R, Chung WP, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial. Lancet. 2023 Jan 14;401(10371):105-117. doi:10.1016/S01406736(22)02420-5. Erratum in: Lancet. 2023 Feb 18;401(10376):556.
9. André F, Cortés J, Curigliano G, et al. A pooled analysis of trastuzumab deruxtecan in patients with human epidermal growth factor receptor 2 (HER2)-positive metastatic breast cancer with brain metastases. Ann Oncol. 2024 Dec;35(12):1169-1180.
10. Bartsch R, Berghoff AS, Furtner J, et al. Final outcome analysis from the phase II TUXEDO-1 trial of trastuzumab-deruxtecan in HER2-positive breast cancer patients with active brain metastases. Neuro Oncol. 2024 Dec 5;26(12):2305-2315.
11. Pérez-García JM, Vaz Batista M, Cortez P, et al. Trastuzumab deruxtecan in patients with central nervous system involvement from HER2-positive breast cancer: The DEBBRAH trial. Neuro Oncol. 2023 Jan 5;25(1):157-166.
12. Harbeck N, Ciruelos E, Jerusalem G, et al.; DESTINYBreast12 study group. Trastuzumab deruxtecan in HER2-positive advanced breast cancer with or without brain metastases: a phase 3b/4 trial. Nat Med. 2024 Dec;30(12):3717-3727. doi:10.1038/s41591-024-03261-7. Erratum in: Nat Med. 2024 Dec;30(12):3780.
Filippo Merloni Medical Oncology, Breast & GYN Unit, IRCCS Istituto Romagnolo per lo Studio dei Tumori (IRST) “Dino Amadori”, Meldola, Italy.
Introduzione
Il carcinoma mammario HER2 positivo costituisce circa il 15-20% dei tumori al seno ed è associato a una maggiore aggressività biologica e ad una prognosi sfavorevole. L’aspettativa di vita delle pazienti con carcinoma mammario metastatico HER2 positivo è tuttavia migliorata nel tempo grazie allo sviluppo di farmaci mirati contro la proteina HER2. L’utilizzo combinato di una chemioterapia a base di taxani con trastuzumab e pertuzumab, due anticorpi monoclonali umanizzati diretti contro epitopi differenti di HER2, ha dimostrato un tasso di sopravvivenza globale a 8 anni del 37% e rappresenta attualmente la terapia standard di prima linea in questa popolazione di pazienti1. Tra i farmaci anti-HER2 attualmente a disposizione si annoverano anche molecole dotate di attività inibitoria nei confronti del dominio tirosin-chinasico della porzione intracellulare di HER2 (es. tucatinib e lapatinib) e gli anticorpi farmaco-coniugati (es. TDM e trastuzumab deruxtecan), una nuova classe di farmaci, composti da un anticorpo umanizzato anti-HER2 combinato ad un agente citotossico. Il trastuzumab deruxtecan ( T-DXd) ha dimostrato un beneficio in sopravivvenza sia in un setting di pazienti ampiamente pre-trattate con farmaci anti-HER2 negli studi DESTINY-Breast01 e DE -
STINY-Breast02, che in seconda linea di trattamento, mostrando un vantaggio statisticamente e clinicamente significativo rispetto al TDM-1 (28,8 mesi contro 6,8 mesi rispettivamente)2.
Le terapie mirate contro HER2 sono accomunate dal rischio di cardiotossicità, che si può manifestare come una riduzione della frazione di eiezione ventricolare sinistra (FEVS), seppur con diversi tassi di incidenza. Nel caso di trastuzumab la riduzione asintomatica della FEVS e lo scompenso cardiaco presentano un tasso di incidenza rispettivamente di circa il 5-19% e del 1-4%. Tale tossicità è dose-dipendente e generalmente reversibile. Il principale meccanismo d’azione attraverso cui il trastuzumab può provocare tale effetto cardiotossico è l’incremento dello stress ossidativo a carico dei cardiomiociti con conseguente alterata funzionalità degli stessi ed alterata contrattilità cardiaca3. Per tale motivazione è raccomandato un monitoraggio della frazione di eiezione ventricolare sinistra in corso di terapia con farmaci anti-HER2.
Caso clinico
Si descrive il caso di una paziente di 68 anni, non fumatrice, con performance status ECOG 0. In anamnesi un intervento di splenopancreasectomia nel 2011 per un carcinoma pancreatico ed una fibrillazione atriale parossistica diagnosticata nel 2016. Come terapia a domicilio si segnala assunzione di dabigatran e flecainide in relazione alla suddetta comorbilità cardiologica. In seguito al riscontro autopalpatorio di nodularità alla mammella sinistra, effettua approfondimenti strumentali con ecografia mammaria e mammografia, seguiti da agobiopsia con riscontro di carcinoma mammario duttale infiltrante di origine mammaria. Viene pertanto sottoposta nel 2016 a mastectomia sinistra con biopsia del linfonodo sentinella. All’esame istologico si descrive un carcinoma mammario duttale infiltrante con recettori ormonali positivi (ER 90% PgR 10%), HER2 1+ con un Ki-67 del 20%. Dopo l’intervento chirurgico veniva impostata una terapia endocrina con letrozolo per una durata teorica di 5 anni. A Maggio 2020, quindi ancora in corso di letrozolo, la paziente riscontra un nodulo parasternale all’autopalpazione. Viene pertanto richiesta una TC di stadiazione che conferma la presenza del nodulo parasternale di 21 mm di diametro massimo ed un linfonodo ascellare sinistro di 14 mm. Eseguiva quindi una biopsia ecogui-
data sulla formazione parasternale che riconfermava caratteristiche compatibili a quelle del carcinoma mammario precedentemente operato. Esame istologico: ER 100%, PgR 1%, HER2 2+ (FISH non amplificata), Ki-67 35%. Ad Agosto 2020 avviava una prima linea di trattamento con fulvestrant (500 mg ogni 28 giorni, con dose addizionale solo al primo ciclo) + ribociclib (600 mg al giorno per 21 giorni seguiti da una settimana di pausa).
Dopo soli 4 mesi, alla prima rivalutazione con TC Totalbody, si evidenziava una progressione epatica di malattia. Alla luce della rapida progressione si decideva di effettuare una nuova ricaratterizzazione di malattia tramite biopsia di lesione epatica. L’esame istologico deponeva per carcinoma duttale infiltrante ER 95%, PgR 15%, Ki-67 45%, HER2 positivo (IHC 3+).
Si candidava pertanto la paziente ad una prima linea di trattamento standard per malattia metastatica HER2 positiva, ovvero con pertuzumab (420 mg) + trastuzumab (6 mg/ kg) q21 + paclitaxel (80 mg/mq) q7 1. Dopo circa 6 mesi di trattamento secondo tale schema, in considerazione del buon controllo di malattia ottenuto (risposta parziale di malattia a livello epatico), veniva sospeso il trattamento chemioterapico, proseguendo una terapia di mantenimento con pertuzumab + trastuzumab in associazione ad inibitore dell’aromatasi. A Dicembre 2021, dopo soli 3 mesi di terapia di mantenimento, si evidenziava una progressione epatica ed ossea alla TC Total-body di rivalutazione. Si candidava pertanto la paziente ad una ulteriore linea di trattamento con il farmaco TDM-1 (3,6 mg/kg q21), che, al momento di tale decisione terapeutica, rappresentava la terapia standard di seconda linea nel carcinoma mammario metastatico HER2 positivo 4. A Marzo 2022, dopo soli 3 mesi di trattamento, la TC total-body di rivalutazione evidenziava una progressione dimensionale e numerica delle lesioni a livello epatico, incremento dimensionale della lesione sternale e dei linfonodi della catena mammaria interna sinistra. Siamo ad inizio 2022, ed il nostro studio di riferimento in questo setting è il DESTINYBreast015. La paziente veniva pertanto avviata a trattamento con trastuzumab deruxtecan 5,4 mg/kg endovena q21. Tuttavia, dopo 2 cicli di terapia con T-DXd, la paziente veniva ricoverata per iniziale scompenso cardiaco (comparsa di edemi declivi e lieve dispnea). All’ecocardiogramma di controllo si evidenziava una

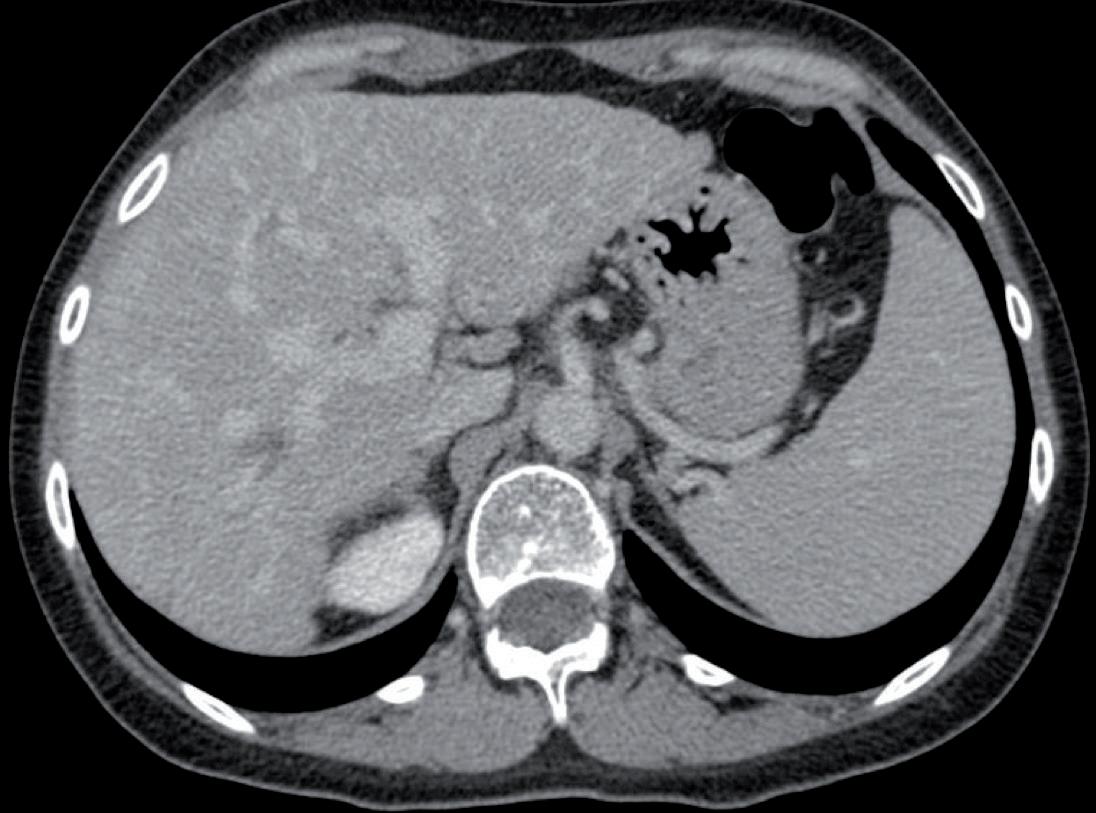
normale attività contrattile cardiaca, sovrapponibile ai precedenti controlli, ma si riscontrava un quadro di insufficienza mitralica. Veniva dunque impostata terapia diuretica (furosemide) e la paziente veniva dimessa. Veniva contestualmente richiesta una rivalutazione strumentale di malattia che mostrava una importante risposta di malattia a livello epatico (figura 1), linfondale e della lesione sternale. Alla luce della rapida risposta al trattamento con T-DXd, discusso il caso con gli specialisti di cardioncologia che hanno considerato l’episodio di scompenso cardiaco come non imputabile alla terapia anti-HER2, si è deciso di riprendere il trattamento con T-DXd, impostando un follow-up cardiologico con ecocardiogramma ogni 3 mesi e dosaggio di pro-BNP e troponina ogni 3 mesi, aggiungendo inoltre bisoprololo alla terapia domiciliare della paziente con finalità cardioprotettiva. La paziente proseguiva quindi T-DXd sempre alla dose di 5,4 mg/kg, con mantenimento di una normale funzionalità cardiaca, in assenza di alterazione nei valori laboratoristici di troponina e pro-BNP. Le uniche tossicità riportate sono state astenia G1 e anemia G1. Purtroppo, la TC di Settembre 2023 ha mostrato una progressione di malattia, sia a livello epatico che a livello osseo. La paziente è stata successiva trattata con la combinazione di capecitibina (1000 mg/mq BID consecutivamente per 14 giorni q21) + tucatinib (300 mg 2 volte al giorno continuativamente) + trastuzu -
mab (6 mg/kg q21) sulla scorta dei dati dello studio HER2CLIMB6 con una PFS di 4 mesi e successivamente con la combinazione di eribulina (gg 1-8) e trastuzumab q21 con una PFS di 6 mesi.
La paziente attualmente presenta condizioni cliniche in progressivo scadimento (ECOG 3) per progressione di malattia a livello epatico, osseo e linfonodale per cui non è stata candidata ad ulteriori trattamenti attivi e proseguirà solo con best supportive care.
Il primo spunto di discussione relativo al caso clinico presentato riguarda la necessità di ricaratterizzazione di malattia in caso di malattia metastatica metacrona. Non esistono chiare indicazioni in tal senso, pertanto in caso di recidiva a distanza, può essere proposto sia un trattamento basato sulle caratteristiche immunistochimiche del tumore primitivo operato, che una biopsia del sito metastatico. Quest’ultima alternativa non solo consente di confermare la natura della metastasi ma può avere importanti implicazioni terapeutiche. Uno studio retrospettivo francese ha confrontato il fenotipo della metastasi con quello del tumore primitivo in 1677 pazienti, evidenziando che, seppur sia generalmente più probabile una concordanza, nel caso ad esempio di primitivo con positività dei recettori ormonali HER2 negativo, avviene un cambiamento fenotipico nel 16% dei casi7. Questo cambiamento
può essere dovuto ad una perdita di espressione dei recettori ormonali o, più raramente, all’acquisizione della positività di HER2. Nel caso in oggetto è stata effettuata una ricaratterizzazione di malattia all’esordio della malattia metastatica che ha confermato la presenza di malattia Luminal B HER2 low. Vista la rapida progressione in sede epatica dopo soli 4 mesi dall’inizio di terapia con fulvestrant + ribociclib, si è deciso di effettuare una ulteriore ricaratterizzazione di malattia con biopsia epatica, che ha mostrato, questa volta, una malattia LuminalB/HER2-positiva, con conseguente completa modifica della strategia terapeutica a favore di una combinazione di paclitaxel con pertuzumab e trastuzumab sulla base dello studio
CLEOPATRA1
Dopo una iniziale risposta a tale combinazione la paziente ha manifestato una progressione di malattia in corso di terapia di mantenimento con pertuzumab e trastuzumab. Il TDM-1 utilizzato nella successiva linea di trattamento non ha dimostrato alcuna efficacia. È stata pertanto candidata a terapia con T-DXd sulla base dello studio DESTINY-Breast01, studio di riferimento al momento della decisione terapeutico. Studio di Fase 2 a braccio singolo che ha valutato attività ed efficacia di T-DXd in una popolazione di pazienti metastatiche HER2-positive pretrattate con TDM-1, mostrando un overall response rate del 61% e una PFS di 16,4 mesi5. Il beneficio in corso di T-DXd è stata si è mantenuto da Aprile 2022 a Settembre 2023, ovvero per un totale di 18 mesi, in linea con i risultati degli studi DESTINY-Breast01 e 025,8 . Inoltre, anche la rapidità di risposta, evidenziata dopo soli 2 somministrazioni di T-DXd, risulta compatibile con i risultati dello studio DESTINY-Breast01 in cui il tempo mediano di risposta è risultato essere di 1,6 mesi. Durante il trattamento con T-DXd si è verificato tuttavia un episodio di scompenso cardiaco che avrebbe potuto portare ad una sospensione definitiva di tale trattamento. Nello studio DESTINY-Breast01 sono stati riportati 4 casi di riduzione della FEVS, 1 solo dei quali di grado 3, e 2 casi di scompenso cardiaco di grado 1 e 25 Nello studio DESTINY-Breast02 l’incidenza di riduzione della FEVS è stata del 4,5 % nel braccio del T-DXd (0,5% gli eventi di grado 3), contro un 1,5% del braccio di controllo8. Nello studio DESTINY-Breast03, è stata riportata un’incidenza del 2,7% di riduzione della FEVS nel braccio T-DXd, in assenza di eventi di grado 39.
Una metanalisi pubblicata nel 2023 ha valutato l’incidenza e la severità della malattia interstiziale polmonare e della cardiotossicità da T-DXd. Sono stati considerati 15 studi per un totale di 1970 pazienti e l’incidenza complessiva della riduzione della FEVS è risultata essere dell’1,95%. I tassi d’incidenza più alti sono riportati negli studi osservazionali (5,0%), che rappresentavano però la minoranza degli studi, e negli studi di fase 3 (3,9%)10 . Complessivamente quindi tassi di incidenza di riduzione della FEVS bassi ma comunque non trascurabili. Nel caso clinico riportato, la valutazione cardiologica ha permesso di identificare la causa dello scompenso cardiaco, ovvero un’insufficienza valvolare con frazione di eiezione ventricolare sinistra conservata. Dato che l’azione cardiotossica del trastuzumab consiste nella riduzione della contrattilità cardiaca, il quadro di scompenso cardiaco non è stato ritenuto imputabile al T-DXd. La ripresa del trastuzumab deruxtecan in una paziente con numerose comorbiditià cardiologiche, tra cui un recente scompenso cardiaco, rappresenta comunque una sfida in pratica clinica. Non ci sono dati in merito all’utilizzo di T-DXd in pazienti con numerosi fattori di rischio cardiologico. Sono stati pubblicati due piccoli studi, ovvero il SAFETY trial ed il SAFE-HEaRt trial, condotti su un numero ridotto di pazienti (rispettivamente 20 e 27)11,12 . Le pazienti arruolate, che avevano un’alterata FEVS al baseline, sono state trattate con farmaci anti -HER2 abbinati però ad una terapia cardioprotettiva con Beta bloccanti ed ACE inibitori. In entrambi gli studi il 90% delle pazienti ha effettuato il trattamento senza problematiche cardiologiche.
La nostra paziente momento dell’avvio del T-DXd la paziente oltre ad avere più di 65 anni, era affetta anche da fibrillazione atriale parossistica. Secondo le linee guida della Società Europea di Cardiologia (ESC) la paziente era a rischio moderato per l’utilizzo di farmaci anti-HER2. Dopo il riscontro di valvulopatia e di scompenso cardiaco la paziente risulta essere a rischio cardiovascolare molto alto per l’utilizzo di farmaci anti-HER2 secondo le linee guida ESC (figura 2). Sulla base delle linee guida della società europea di cardiologia (figura 3) veniva impostato un follow-up cardiologico con ecocardiogramma ogni 3 mesi e dosaggio di pro-BNP e troponina ogni 3 mesi e veniva aggiunto bisoprololo alla terapia domiciliare della paziente con finalità cardioprotettiva. In accordo con i colleghi
Figura 2. Valutazione
basale del rischio cardiovascolare in pazienti Oncologici secondo le linee guida ESC 2022.



dell’ambulatorio di cardioncologia a cui è stata fatta valutare la paziente, veniva ripreso T-DXd senza ulteriori riscontri clinici, laboratoristici o strumentali di cardiotossicità.
La ricaratterizzazione di malattia in caso di recidiva a distanza o in presenza di rapida progressione in corso di terapia sistemica per malattia avanzata permette di adeguare il trattamento sistemico della paziente. Tuttavia, l’attuale disponibilità di trastuzumab deruxtecan anche in caso di malattia HER2 low potrebbe portarci a posticipare una ricaratterizzazione di malattia in certi casi.
Il caso descritto dimostra come il trastuzumab deruxtecan possa garantire l’attività e l’efficacia attese anche in pazienti con una scarsa risposta alle linee di
terapia precedenti (nel caso in oggetto paclitaxel + trastuzumab + pertuzumab e TDM-1).
La cardiotossicità in corso di trastuzumab deruxtecan ha una bassa incidenza, ma l’entità e le cause di tale tossicità andrebbero sempre contestualizzate in ambito multidisciplinare. Una superficiale definizione di un evento cardiaco come lo scompenso potrebbe portare ad un’interruzione precoce di un farmaco altamente efficace.
L’impostazione di un follow-up cardiologico ed una eventuale terapia cardioprotettiva adeguati al rischio cardiovascolare della paziente dovrebbero essere effettuati da esperti di cardioncologia.
Conflitto di interessi: l’autore segnala rapporti di collaborazione con Novartis, Lilly, Astrazeneca e Roche negli ultimi tre anni.
Figura 3. Protocollo di sorveglianza laboratoristicostrumentale sulla base del rischio cardiovascolare in corso di terapia antiHER2 secondo le linee guida ESC 2022.




































1. Swain SM, Miles D, Kim SB, et al.; Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebocontrolled, phase 3 study. Lancet 2020; 372: 724-34.
2. André F, Park YH, Kim SB et al.; Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer. N Eng J Med 2022; 386(12):1143-1154.
3. Zhang L, Wang Y, Zhao W, et al.; Cardiac safety analysis of anti-HER2-targeted therapy in early breast cancer. Sci Rep 2022; 12(1):14312.
4. Diéras V, Miles D, Verma S, et al. Trastuzumab emtansine versus capecitabine plus lapatinib in patients with previously treated HER2-positive advanced breast cancer (EMILIA): a descriptive analysis of final overall survival results from a randomised, open-label, phase 3 trial. Lancet Oncol 2017; 18: 732-42.
5. Modi S, Saura C, Yamashita T, et al.; DESTINY-Breast01 Investigators. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020; 382: 610-21.
6. Lin NU, Borges V, Anders C, et al. Intracranial efficacy and survival with tucatinib plus trastuzumab and capecitabine for previously treated HER2-positive breast cancer with brain metastases in the HER2CLIMB trial. J Clin Oncol 2020; 38: 2610-9.
7. Grinda T, Joyon N, Lusque A, et al. Phenotypic discordance between primary and metastatic breast














cancer in the large-scale real-life multicenter French ESME cohort. NPJ Breast Canc 2021; 7(1):41.
8. André F, Park YH, Kim SB et al.; Trastuzumab deruxtecan versus treatment of physician’s choice in patients with HER2-positive metastatic breast cancer (DESTINYBreast02): a randomised, open-label, multicentre, phase 3 trial Lancet 2023; 401(10390):1773-1785.
9. André F, Park YH, Kim SB et al.; Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer. N Eng J Med 2022; 386(12):1143-1154.
10. Soares LR, Vilbert M, Rosa VDL et al.; Incidence of interstitial lung disease and cardiotoxicity with trastuzumab deruxtecan in breast cancer patients: a systematic review and single-arm meta-analysis. ESMO Open 2023 8(4):101613.
11. Leong DP, Cosman T, Alhussein MM et al.; Safety of Continuing Trastuzumab Despite Mild Cardiotoxicity: A Phase I Trial. JAAC CardioOncol 2019 1(1):1-10).
12. Lynce F, Barac A, Geng X et al.; Prospective evaluation of the cardiac safety of HER2-targeted therapies in patients with HER2-positive breast cancer and compromised heart function: the SAFE-HEaRt study. Breast Cancer Res Treat 2019 175(3):595-603.
Alice Muzzarelli
Azienda Ospedaliero-Universitaria di Verona
Introduzione
Il tumore mammario costituisce la prima neoplasia nelle donne per frequenza e per mortalità, con circa 55.000 nuove diagnosi e 12.500 morti in Italia nel 2020. Il 15-20% dei tumori mammari presenta iperespressione del fattore di crescita epidermico (HER-2), condizione correlata ad una particolare aggressività biologica e ad una prognosi più sfavorevole. Negli ultimi anni, tuttavia, l’avvento di terapie mirate anti-HER2 ha profondamente modificato la storia di questo sottotipo di carcinoma mammario, rivoluzionandone l’algoritmo terapeutico sia nel setting precoce che in quella avanzato ed incrementando sensibilmente l’aspettativa di vita delle pazienti. Le strategie di trattamento target anti-HER2 comprendono ad oggi anche gli anticorpi farmaco coniugati (antibody-drug-conjugate, ADC), capaci di combinare l’efficacia delle terapie a bersaglio molecolare e il potenziale citotossico della chemioterapia. Al tempo stesso, tali farmaci, liberando l’agente citotossico solo a livello delle cellule tumorali presentanti l’antigene bersaglio, consentono di limitare la tossicità sistemica, migliorando il profilo di tollerabilità. L’attuale standard di cura di seconda linea nel carcinoma mammario HER2 positivo metastatico è rappresentato proprio da un ADC: trastuzumab deruxtecan (T-DXd), nato dall’unione di un anticorpo mono -
clonale umanizzato anti-HER2 e di un inibitore della topoisomerasi I, legati in modo covalente da un linker scindibile tetrapeptidico. Lo studio registrativo di trastuzumab deruxtecan, DESTINY-Breast03, ha evidenziato un vantaggio statisticamente significativo in sopravvivenza nelle pazienti trattate con T-DXd rispetto alla controparte che ha ricevuto trastuzumab-emtansine (TDM-1), l’altro anticorpo farmaco coniugato anti-HER2 disponibile. Con un netto vantaggio in PFS (28,8 versus 6,8 mesi, con HR 0,33, p <0,0001) e una riduzione del rischio di morte pari al 36%, trastuzumab deruxtecan è entrato ufficialmente nell’algoritmo terapeutico delle pazienti con neoplasia mammaria avanzata pretrattata con taxano ed agenti anti-HER2 nel setting di malattia metastatico o recidivata precocemente dopo terapia (neo)adiuvante.
Caso clinico
Si descrive il caso di una paziente di 62 anni affetta da metastasi encefaliche e midollari da neoplasia mammaria HER2 positiva. La sua storia oncologica ha inizio ad Ottobre 2018, quando un’ecomammografia di screening mette in evidenza la presenza di un’opacità a margini spiculati di 25 mm al quadrante supero-esterno della mammella sinistra. Una successiva risonanza magnetica (RM) di approfondimento mostrava altresì multiple adenopatie ascellari, retroclaveari e nella regione mammaria interna, nonché un’iniziale quadro di mastite. Si eseguiva pertanto agobiopsia, che deponeva per carcinoma duttale infiltrante scarsamente differenziato (G3), HER-2 positivo e non ormonoresponsivo, ovvero: ER 0, PgR O, HER-2 score 3+, ki67 25%. La stadiazione sistemica risultava negativa, con stadio clinico cT2N3M0 (IIIC). La paziente avviava quindi trattamento neoadiuvante con combinazione di chemioterapia (EC 90 per 4 cicli e a seguire paclitaxel settimanale per 12 cicli) e terapia target (trastuzumab), che proseguiva fino all’intervento chirurgico di mastectomia e dissezione ascellare, il cui esame istologico definitivo mostrava risposta patologica completa in sede mammaria e linfonodale. Proseguiva trastuzumab adiuvante fino alle 18 infusioni complessive. Eseguiva inoltre radioterapia su parete toracica, regione claveare e catena mammaria interna, con somministrazione di 50 Gy in 25 frazioni. Tuttavia, a soli 7 mesi dal termine del trattamento adiuvante, per insorgenza improvvisa di vomito e instabilità della marcia, la pa-
Figura 1. Pre-trattamento.
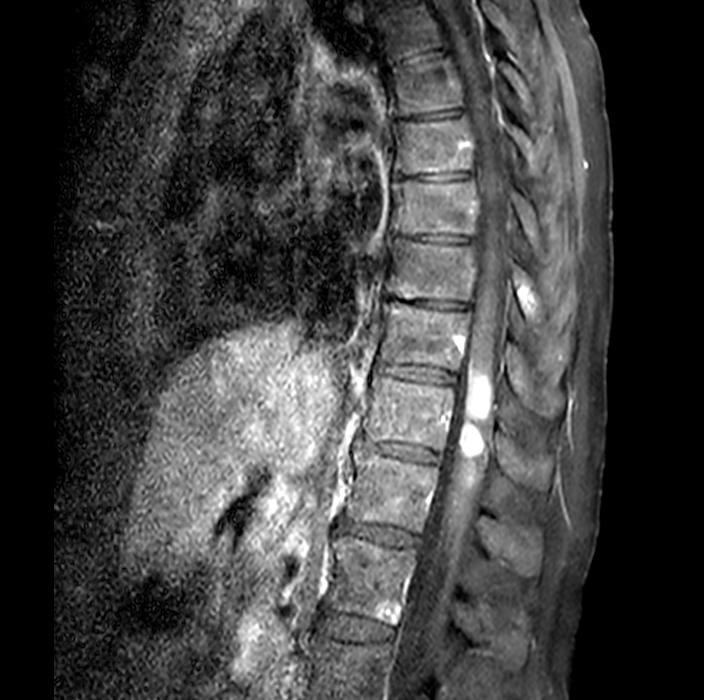
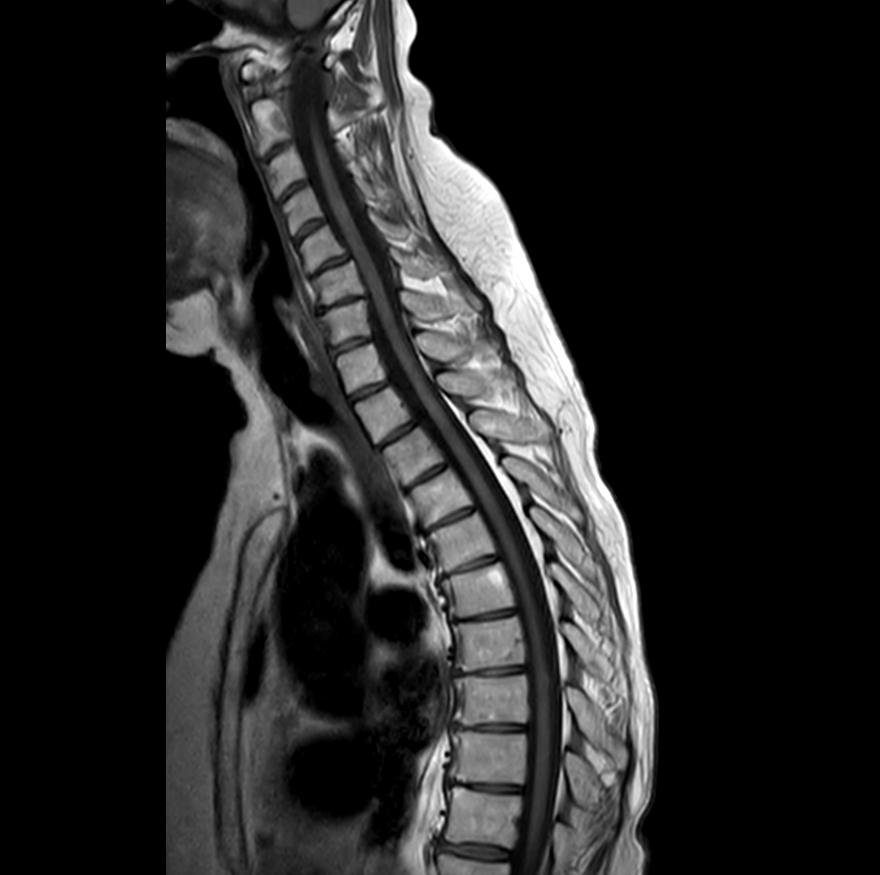
Figura 2. Post-trattamento.
ziente accedeva in Pronto Soccorso, ove una risonanza magnetica dell’encefalo riscontrava multiple lesioni secondarie cerebrali. La paziente veniva quindi sottoposta a radioterapia panencefalica. Si avviava trattamento eziologico sistemico con trastuzumabemtansine (TDM-1), proseguito da Novembre 2020 per 28 mesi, ottenendo stabilità di malattia e buona tolleranza (episodica piastrinopenia G1). A Maggio 2024 la paziente lamentava ricomparsa di instabilità della marcia ed ipostenia degli arti superiori e inferiori, evolutisi nell’arco di 72 ore in completa impossibilità alla deambulazione, alla quale si associavano incontinenza urinaria e fecale. Recatasi in Pronto Soccorso, la
paziente veniva sottoposta a tomografia assiale computerizzata (TC) dell’encefalo, non dimostrativa, e a RM encefalo e rachide, la quale deponeva per disseminazione liquorale olo-cordica di neoplasia nota in anamnesi e multiple localizzazioni intraventricolari. Previa discussione multidisciplinare, si avviava trattamento di seconda linea con trastuzumab deruxtecan 5,4 mg/kg endovena ogni 21 giorni. La prima rivalutazione radiologica (20/08/2024) ha evidenziato la pressoché completa regressione delle lesioni ripetitive intra-midollari ed intraventricolari precedentemente descritte (figure 1 e 2). Permanevano riconoscibili unicamente due piccole lesioni focali all’altezza del passaggio T2-T3 e del passaggio T7-8, entrambe in riduzione dimensionale. Attualmente la paziente sta proseguendo il trattamento, con beneficio clinico ed iniziale ripresa della mobilità.
Il 30-50% dei carcinomi mammari con iperespressione di HER2 conduce nella sua storia naturale a sviluppo di metastasi a carico del sistema nervoso centrale. Nonostante le notevoli innovazioni terapeutiche affermatisi negli ultimi decenni, questo sottogruppo di pazienti rappresenta ancora oggi un’importante sfida per gli oncologi medici, per varie cause: fisiopatologiche (la limitata diffusione dei farmaci attraverso la barriera emato-encefalica), cliniche (il rapido decadimento delle condizioni generali) e scientifiche (il ridotto numero di evidenze e la frequente esclusione dei pazienti con ripetitività nel SNC da studi prospettici). Tuttavia i dati disponibili in letteratura ci hanno confortato nella scelta di avviare seconda linea di trattamento con T- DXd. Infatti il già citato trial di fase III DESTINY-Breast03 ha mostrato vantaggio in PFS in tutti i sottogruppi di pazienti (figura 3), compresi quelli affetti da malattia encefalica, con un tasso di risposte intracraniche del 63,9% (versus il 33,4% ottenuto con TDM-1). Anche nello studio di fase II DEBBRAH, T- DXd ha determinato un tasso di risposta pari al 66,7% (96% CI 41,0-86,7) su lesioni intra- ed extracraniche, con vantaggio in sopravvivenza mediana e miglioramento della sintomatologia neurologica. TUXEDO-1, studio prospettico di fase II, in aperto, a braccio singolo, ha arruolato 15 pazienti con impegno encefalico da carcinoma mammario HER2 positivo di nuova diagnosi o in progressione a trattamento con trastuzumab e pertuzumab. L’ORR
Figura 3. DESTINY-Breast03.
ottenuta ha superato il 70% (IC 95%; 48,1.89,1%), con PFS mediana di 14 mesi e OS non raggiunta ad un follow-up di 12 mesi. Dati incoraggianti derivavano anche da DESTINY-Breast07 e dalla revisione multicentrica ROSETBM. Le evidenze finora citate hanno ricevuto ulteriore conferma ad ESMO 2024, con la presentazione di DESTINY-Breast12, il più ampio studio prospettico effettuato sull’attività intracranica di trastuzumab deruxtecan. Tra il Giugno 2021 e il Febbraio 2024 sono stati analizzati 504 pazienti, con metastasi centrali inattive ed attive. La progression free survival (PFS) rappresentava l’endpoint primario; a 12 mesi era del 61,6% (95% CI 51,9-65,3) nella coorte con localizzazioni cerebrali attive e del 58,9% (95% CI 51,9-65,3) nel sottogruppo con secondarismi del SNC. Nella coorte con malattia extra-SNC l’endpoint primario era invece l’objective response rate (ORR) secondo RECIST v1.1, risultata del 62,7% (95% CI 56,5-68,8). Il profilo di tossicità non ha mostrato differenze nei pazienti con impegno encefalico o midollare. Infine, va sottolineato come le metastasi intramidollari in particolare siano localizzazioni di estrema rarità e ad evoluzione infausta, sulle quali le evidenze in letteratura sono particolarmente scarse, soprattutto in termini di valutazione di efficacia dei
trattamenti. Teshima M. et al nel 2023 hanno riportato il caso clinico di una donna di 44 anni con metastasi intramidollari da neoplasia mammaria HER-2 positiva trattata con successo con T- DXd.
Il presente caso è esemplificativo dell’attività di T- DXd sul sistema nervoso centrale, anche quando si tratta di localizzazioni più rare e a prognosi peggiore, come la malattia intramidollare, in linea con i recenti dati di letteratura, che confermano una forte attività del farmaco su metastasi cerebrali stabili e attive. Tale dato riveste una particolarmente importanza nella malattia HER-2 positiva, caratterizzata da uno spiccato tropismo per il sistema nervoso centrale, quadro di notevole gravità clinica e dalle limitate opzioni terapeutiche, soprattutto se la paziente è già stata sottoposta in passato a trattamenti locoregionali.
Simona Pisegna, Andrea Botticelli Oncologia Medica, Policlinico Umberto I Sapienza Università di Roma
Introduzione
Tra i carcinomi mammari, il 15-20% presenta un’aumentata espressione del recettore per il fattore di crescita epidermico umano 2 (HER2)1. Questa caratteristica molecolare ha reso possibile negli anni lo sviluppo di terapie mirate, in particolare i farmaci anti-HER2, che hanno rivoluzionato la gestione del carcinoma mammario metastatico. Tali trattamenti hanno difatti significativamente migliorato la prognosi, garantendo una maggiore sopravvivenza delle pazienti affette da carcinoma mammario HER2 positivo.
Tra le innovazioni terapeutiche più recenti si annovera il trastuzumab deruxtecan (T-DXd), un anticorpo farmaco coniugato (ADC) dotato di elevata specificità e selettività. Questo composto combina un anticorpo monoclonale umanizzato anti-HER2 con un inibitore della topoisomerasi I, connesso tramite un linker scindibile tetrapeptidico2. La struttura dell’ADC consente un’azione mirata alle cellule tumorali con iperespressione di HER2, riducendo al minimo gli effetti collaterali sistemici e migliorando la tollerabilità del trattamento. Lo studio registrativo DESTINY-Breast03 ha rappresentato un punto di svolta nella terapia di seconda linea per il carcinoma mammario HER2 positivo metastatico3. Confrontato con il trastuzumab emtansine (T-DM1), già considerato uno standard terapeutico per le pazienti pretrattate con taxani e trastuzumab,
il T-DXd ha dimostrato una riduzione significativa del 36% nel rischio di morte e un aumento della sopravvivenza a due anni (77,4% vs 69,9%). Il beneficio in termini di sopravvivenza libera da progressione (PFS) è stato ancora più marcato, passando da una mediana di 6,8 mesi con T-DM1 a oltre 28,8 mesi con T-DXd.
Alla luce dei risultati clinici altamente significativi e del profilo di tossicità accettabile emersi dallo studio DESTINY-Breast03, il T-DXd si configura ad oggi come il nuovo standard di cura di seconda linea per il carcinoma mammario HER2 positivo.
Oltre ai trattamenti sistemici, un ruolo ulteriore è rivestito dai trattamenti locoregionali, che, pur essendo tradizionalmente utilizzati nelle fasi iniziali di malattia, stanno acquisendo crescente rilevanza anche nella malattia metastatica Tecniche quali la radioterapia mirata o l’approccio chirurgico selettivo possono contribuire a un controllo locale della malattia, riducendo sintomi e complicanze, e potenzialmente sinergizzando con le terapie sistemiche per prolungare la sopravvivenza globale 4 .
L’integrazione di tali terapie con strategie locoregionali potrebbe ulteriormente migliorare gli outcome delle pazienti, rappresentando una frontiera promettente nella gestione di questa patologia complessa.
La paziente è una donna di 38 anni, stato premenopausale, nullipara, BRCA non mutata. Non presenta familiarità di rilievo per patologia oncologica. In anamnesi non comorbilità internistiche di rilievo e non assume farmaci in terapia domiciliare, ad eccezione di quelli correlati alla terapia oncologica.
La storia clinica inizia nel Novembre 2019 quando la paziente nota comparsa e progressivo incremento dimensionale di tumefazione a carico della mammella e complesso areola-capezzolo di sinistra, associata a lesioni papulari papulo-eritematose cutanee a rapida evoluzione ulcerativa (figura 1). La valutazione clinica e le indagini eco-mammografiche eseguite evidenziano pressochè completo sovvertimento mammario per la presenza di multiple lesioni eteroformate, associato a multiple linfoadenopatie secondarie al cavo ascellare omolaterale. La biopsia mammaria eseguita depone per carcinoma infiltrante NST G3 ER 0 PgR 0, HER2 3+, Ki67 50%. Viene eseguito anche campionamento cutaneo che conferma infiltrazione della cute da carcinoma
Figura 1. Presentazione clinica al baseline.
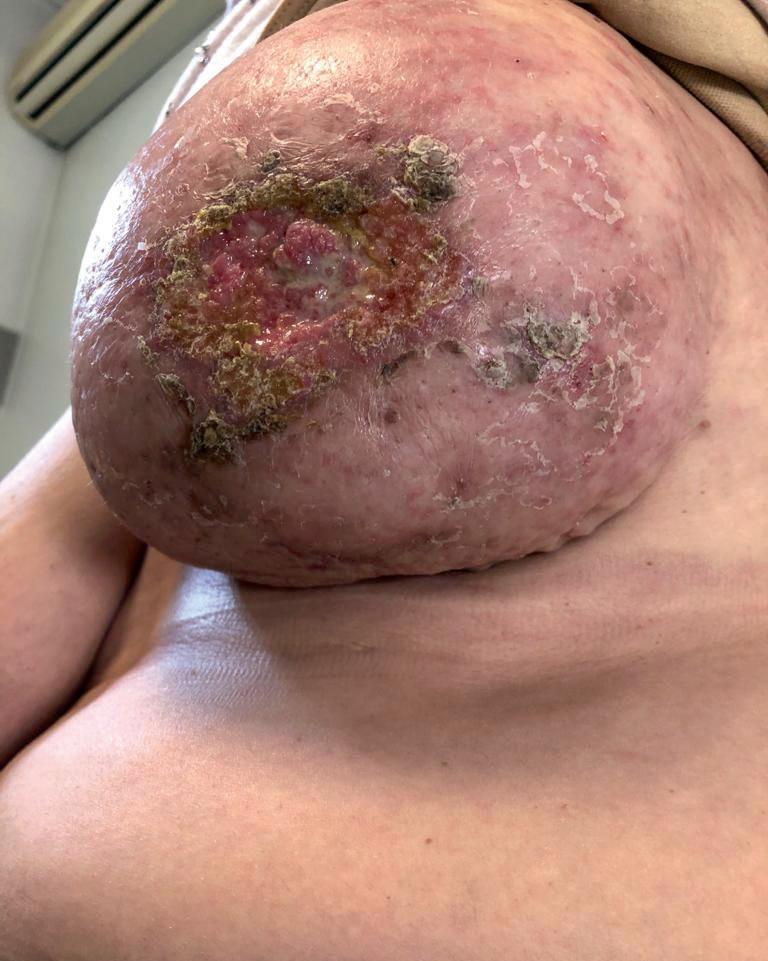
Figura 2. Risposta clinica ottimale in corso di T-DXd.

mammario con profilo biologico sovrapponibile a quello bioptico. In relazione alla stadiazione clinica ed alle caratteristiche biologiche di malattia, la paziente esegue TC total body di stadiazione che non evidenzia presenza di lesioni secondarie in altri organi e apparati. Alla luce dell’evidenza di coinvolgimento cutaneo, delle caratteristiche biologiche e dei dati presenti in letteratura, a Gennaio 2020 la paziente avvia trattamento di prima linea con docetaxel – pertuzumab –trastuzumab q21 come da studio CLEOPATRA2. Dopo i primi 6 mesi di trattamento, l’esame clinico e la TC di rivalutazione evidenziano globale risposta parziale (RP), con importante riduzione dimensionale delle note lesioni eteroformate a carico della mammella sinistra e delle linfoadenopatie ascellari. Il trattamento viene discretamente tollerato ove si eccettui nausea
G1 ed iniziale neuropatia periferica acrolocalizzata agli arti inferiori. In relazione all’ottimale RP conseguita, la paziente prosegue trattamento di mantenimento di I linea con pertuzumab – trastuzumab trisettimanale con buona tolleranza. Le rivalutazioni cliniche e strumentali successive confermano l’ottimale risposta clinico-strumentale ottenuta. A Gennaio 2022 si rileva progressione clinica di malattia per aumento dimensionale delle note lesioni cutanee secondarie. Nuovamente, le indagini strumentali eseguite non evidenziano presenza di malattia a distanza. Viene pertanto valutato, in relazione ai dati dallo studio DB03 di candidare la paziente a seconda linea di trattamento con trastuzumab deruxtecan 5,4 mg/kg ev. La paziente intraprende trattamento suddetto a Gennaio 2022. Già dopo 3 somministrazioni si rileva importante riduzione clinica delle lesioni cutanee (Fig. 2). Il trattamento viene pertanto proseguito con buona tolleranza. Vengono riportati come eventi avversi alopecia G1, astenia G1 e nausea G2. In relazione alla tossicità sperimentata, viene ottimizzato il trattamento antiemetico attuando triplice teapia (anti 5HT3, anti-NK1, steroide), con immediato beneficio clinico sulla sintomatologia riferita. trastuzumab deruxtecan viene quindi proseguito per ulteriori 31 mesi con tolleranza ottimale. Non vengono riportati ulteriori eventi avversi degni di nota. La valutazione clinica permette di rilevare una risposta pressoché completa della malattia a livello cutaneo, mammario e linfonodale. Il dato clinico viene confermato da TC ed ecografia mammaria di ristadiazione eseguite. In particolare, a Settembre 2024 a carico della mammella sinistra risulta ecograficamente apprezzabile singola lesione ipoecogena di 15 mm in assenza di tumefazioni linfonodali ascellari sospette. Inoltre, le lesioni cutanee appaiono nel complesso non più apprezzabili, come per risposta completa a trattamento. La TC total body non evidenzia coinvolgimento a distanza.
In considerazione dell’ottimale risposta ottenuta in corso di seconda linea con T-DXd, del lungo controllo su sedi note di malattia, dell’età e delle condizioni cliniche della paziente, si condivide il caso in sede multidisciplinare per eventuale integrazione con trattamento loco-regionale chirurgico e/o radioterapico.
Viene dunque eseguita una RM mammaria con mdc che conferma il quadro precedentemente evidenziato da valutazione ecografica e, dopo lunga discussione, si esplora la possibilità di valutazione chirurgica chirurgico di mastectomia sinistra e sampling linfonodale ascellare omolterale (BLS).
L’esame istologico definitivo mostra residuo di carcinoma infiltrante NST di 14 mm a carico del parenchima mammario ER0, PgR0, Ki65 12%, HER2 2+, FISH amplificata. Non elementi neoplastici nei 4 linfonodi esaminati [stadiazione finale ypT1c, ypN0 (0/4)]. In relazione alla presenza di malattia cutanea iniziale, viene valutato ed eseguito trattamento radioterapico adiuvante su parete toracica e linfonodi sovraclaveari.
Alla valutazione attuale, la paziente ha ripreso terapia sistemica con T-DXd, è libera da malattia e non sono state riscontrate ulteriori tossicità correlate al trattamento.
Discussione e conclusioni
Il caso clinico ci permette di considerare alcuni punti critici di interesse. In primo luogo, conferma l’elevata efficacia di T-DXd in pratica clinica come opzione di seconda linea, avvalorando i dati dello studio registrativo. Inoltre, il caso descritto sottolinea il potenziale beneficio dell’approccio combinato tra terapie sistemiche altamente efficaci ed interventi locoregionali nel trattamento del carcinoma mammario metastatico. Ad oggi è noto che alcuni pazienti potrebbero trarre beneficio dalla resezione chirurgica della lesione primaria, ma esiste una importante difficoltà nell’individuazione e definizione uniforme di questa categoria di pazienti. Diversi studi retrospettivi, sebbene limitati da bias selettivi, suggeriscono che una terapia locale nel carcinoma mammario metastatico potrebbe offrire benefici in termini di sopravvivenza e controllo locale in questi pazienti. Tuttavia, queste evidenze non sono ad oggi chiaramente confermate da studi prospettici e/o di fase III. Pertanto, la valutazione del singolo caso in sede multidisciplinare resta punto cruciale per la valutazione di questi pazienti. Nel caso specifico, una giovane paziente sottoposta a terapia con T-DXd ha mostrato una significativa risposta al trattamento sistemico, rendendo possibile un intervento chirurgico su lesione primitiva complicata da coinvolgimento cutaneo. L’utilizzo del T-DXd ha permesso non solo di ottenere un controllo efficace della malattia sistemica, ma anche
di ridurre il carico tumorale locale, favorendo le condizioni per una strategia chirurgica potenzialmente curativa o volta a migliorare la qualità della vita della paziente. Questo risultato sottolinea il valore di un trattamento personalizzato e multidisciplinare che integri terapie innovative con procedure locoregionali. L’approccio chirurgico nella malattia metastatica impone comunque un’attenta valutazione che tenga conto delle condizioni cliniche della paziente, della risposta al trattamento sistemico e degli obiettivi terapeutici. Tuttavia, questo caso rafforza l’evidenza emergente che la chirurgia, in selezionati pazienti con malattia metastatica ben controllata, può contribuire a migliorare sia gli esiti clinici che la qualità di vita. In conclusione, l’esperienza riportata mette in luce l’importanza di una gestione integrata e multidisciplinare per il carcinoma mammario metastatico HER2 positivo e sottolinea l’elevata efficacia di T-DXd nel setting di II linea. Studi futuri saranno necessari per definire meglio il ruolo della chirurgia e dei trattamenti locoregionali nell’era delle terapie mirate di ultima generazione.
1. Onitilo AA, Engel JM, Greenlee RT, Mukesh BN. Breast cancer subtypes based on ER/PR and Her2 expression: comparison of clinicopathologic features and survival. Clin Med Res 2009;7:4-13.
2. Ogitani Y, et al. DS-8201a, a novel HER2-targeting ADC with a novel DNA topoisomerase I inhibitor, demonstrates a promising antitumor efficacy with differentiation from T-DM1. Clin Cancer Res 2016;22:5097-5108.
3. Hurvitz SA, Hegg R, Chung WP, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomized openlabel, phase 3 trial. Lancet 2023;401:105-117.
4. Swain SM, Baselga J, Kim SB, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 2015;372(8):724-734.
5. Patel G, Kishore Reddy BV, Patil P. Is Surgical Management of Primary Beneficial in Metastatic Breast Cancer? Indian J Surg Oncol 2021 Jun;12(2):421-427.
Federico Sottotetti
UO Oncologia medica, IRCCS Maugeri, Pavia.
Introduzione
Il carcinoma mammario HER2 low viene definito sulla base di una bassa espressione immunoistochimica HER2 (IHC 1+ o IHC 2+) o da FISH negativa. L’introduzione di trastuzumab deruxtecan (T-DXd), un anticorpo coniugato che combina il trastuzumab con un potente inibitore della topoisomerasi I, rappresenta una rilevante opportunità terapeutica per donne affette da malattia metastatica HER2 low (CMM). Grazie al “bystander effect”, l’egente citotossico è inoltre in grado di diffondersi alle cellule tumorali, indipendentemente dall’espressione diretta di HER2, rendendo questo agente particolarmente efficace in tumori eterogenei come il CMM.
Il caso clinico che verrà presentato di seguito si riferisce ad una donna con neoplasia mammaria HER2 low con metastasi cerebrali, con una lunga storia di malattia e di successive linee terapeutiche. Le metastasi cerebrali costituiscono un’evenienza di grave rilievo clinico nelle donne affette da CMM, specialmente nelle pazienti con sottotipi HER2 positivi o triplo negativi. Fino ad un passato recente, le opzioni terapeutiche erano limitate a radioterapia, chirurgia e chemioterapia, quest’ultima caratterizzata da scarsa capacità di penetrazione della barriera ematoencefalica (BEE). Studi recenti hanno evidenziato la capacità di trastuzumab deruxtecan di attraversare la BEE e ottenere risposte significative nelle metastasi cerebrali HER2 low. Sul
versante clinico, il trial DEBBRAH ha valutato l’attività di T-DXd in pazienti con metastasi cerebrali attive o leptomeningee da carcinoma mammario HER2 low. I dati preliminari hanno mostrato una risposta intracranica significativa, con una sopravvivenza libera da progressione (PFS) migliorata rispetto alle terapie standard 1. Un altro studio multicentrico ha analizzato l’efficacia di T-DXd in combinazione con radiochirurgia stereotassica (SRS), dimostrando risposte intracraniche prolungate e controllo della malattia a lungo termine, suggerendo un potenziale sinergismo tra ADC e terapie locoregionali 2. Infine, il trial clinico HER2CLIMB-04 ha valutato l’uso di T-DXd nelle pazienti con metastasi cerebrali attive, mostrando un tasso di risposta intracranica del 45% e una riduzione delle dimensioni delle lesioni cerebrali in una percentuale significativa di pazienti 3 .
Il caso clinico che viene qui discusso riguarda una donna di 55 anni, casalinga, senza storia oncologica familiare. Nel 2006, all’età di 37 anni, le viene diagnosticato un carcinoma duttale infiltrante della mammella destra, scarsamente differenziato (G3, ER+ 70%, PgR+ 60%, Ki67 15%), con invasione vascolare e stato HER2 negativo (IHC 2+, FISH non indicativa di amplificazione c-erbB2 neu). Dopo l’intervento di mastectomia radicale destra con dissezione ascellare e inserimento di espansore mammario, la paziente ha ricevuto chemioterapia adiuvante secondo schema CEF per 6 cicli, in associazione ad analogo LHRH, seguiti da ormonoterapia adiuvante con tamoxifene per 5 anni. Nel Maggio 2011, a distanza di circa cinque anni dall’avvio dell’ormonoterapia, gli esami di rivalutazione evidenziano una progressione di malattia con coinvolgimento linfonodale mediastinico e ilare destro, ispessimento pleurico, lesioni ossee e polmonari, oltre a una millimetrica lesione epatica. Inizia quindi bevacizumab 10 mg/ kg + paclitaxel settimanale, con stabilità della malattia per circa 10 mesi. Tale terapia è stata mantenuta fino a Maggio 2014, quando è stata osservata una progressione ossea (colonna vertebrale e bacino), trattata con nab-paclitaxel (28 cicli, 2014-2016), con risposta iniziale seguita da nuova progressione polmonare nel 2015, gestita temporaneamente con fulvestrant per tre cicli prima di riprendere la chemioterapia. Segue un lungo percorso di trattamenti sistemici, tra cui: gemcitabina
+ carboplatino (2016, 7 cicli) con buon controllo di malattia. Vinorelbina + acido folinico + 5-FU (2016-2017, 13 cicli) con stabilità della malattia. Palbociclib + letrozolo (2017-2018, 16 cicli), con buona risposta parziale. Fulvestrant in monoterapia (2018-2019, 10 cicli), con mantenimento della risposta. Nel 2019 viene effettuato ritrattamento con nab-paclitaxel (2019, 11 cicli), con stabilità della malattia ossea e lieve risposta polmonare. In ultimo, nel 2020, capecitabina + vinorelbina (2020, 13 cicli), ben tollerata con stabilità della malattia. Nel 2020 compare una lesione cerebrale temporo-occipitale sinistra (10x11 mm), trattata con radioterapia stereotassica (VMAT-RapidArc, 18 Gy in singola seduta).
Dal 2020 al 2022, la paziente riceve eribulina (30 cicli), con stabilità encefalica e toracica, ma progressione epatica nel Maggio 2022. Nel Luglio 2022 si aggiunge una nuova lesione cerebellare sinistra (18 mm), trattata con radioterapia stereotassica (36 Gy in 6 frazioni).
Nel 2022-2024, la paziente riceve chemioterapia secondo schema TEX (epirubicina, docetaxel, capecitabina) per 4 cicli, per poi proseguire con docetaxel + capecitabina fino a Gennaio 2024 (21 cicli totali). Durante il trattamento si osserva risposta parziale in tutte le sedi note di malattia, con successiva progressione cerebrale documentata da RMN nel Febbraio 2024. Nel Febbraio 2024, a seguito della progressione encefalica evidenziata da RMN – con la comparsa di multiple lesioni cerebellari, parietali e occipitali sinistre (figura 1) – viene avviato il trattamento con trastuzumab deruxtecan (T-DXd) alla dose di 5,4 mg/kg ogni 21 giorni. La scelta terapeutica si basa sulla confermata espressione HER2 low del tumore primitivo, identificata all’esordio e successivamente confermata tramite biopsia della malattia metastatica. Fin dalle prime somministrazioni, la paziente mostra una buona tolleranza al trattamento. Dopo i primi due cicli, non vengono riferiti effetti collaterali rilevanti, e il quadro clinico si mantiene stabile. Con il progredire della terapia, dopo quattro cicli, si osserva l’insorgenza di una sindrome mano-piede di grado 1-2, gestita con terapia sintomatica senza necessità di modifiche posologiche.
Alla prima valutazione strumentale dopo sei cicli, la TC documenta una stabilità dei secondarismi encefalici e ossei, accompagnata da una buona risposta epatica, suggerendo un’efficacia precoce del trattamento. Parallelamente, la paziente mantiene un buon perfor-
mance status (ECOG PS 0), senza riferire sintomi di rilievo. Dopo otto cicli, pur in buone condizioni generali, compaiono sporadici episodi di nausea di grado 1-2, che non influenzano la qualità di vita e vengono controllati con terapia di supporto.
La stabilità encefalica persiste anche dopo dieci cicli, con una riduzione parziale delle lesioni epatiche, segno di un beneficio clinico duraturo. Dopo dodici cicli, il trattamento continua a essere ben tollerato: non emergono eventi avversi significativi, e la funzione cardiaca risulta conservata, con una frazione di eiezione (FE) del 67%.
Alla quattordicesima somministrazione, la rivalutazione mediante TC mostra una sostanziale stabilità della malattia epatica e ossea (figura 2). Tuttavia, la RMN encefalica evidenzia un incremento dimensionale della lesione cerebellare sinistra, associata a edema perilesionale (figura 3). Pur in assenza di sintomi neurologici, si decide di avviare una terapia corticosteroidea a scalare per il controllo dell’edema.
Nel Gennaio 2025, dopo quindici cicli di trattamento, la paziente mantiene un’eccellente qualità di vita, con un controllo globale della malattia in tutti i distretti, ad eccezione della singola lesione cerebellare in lieve progressione. La tolleranza alla terapia rimane ottimale, senza necessità di riduzioni di dose e con una tossicità sistemica minima, permettendo alla paziente di proseguire il trattamento in sicurezza.
Figura 1. A livello emisferico cerebellare a destra lesione puntiforme di circa 1 mm.
In sede paravermiana superiore a destra lesione di circa 9 mm.
Negli ultimi anni, l’introduzione di trastuzumab deruxtecan (T-DXd) ha modificato in modo significativo il panorama terapeutico del carcinoma mammario metastatico HER2 low, offrendo nuove opportunità terapeutiche anche per pazienti in stadio avanzato e con metastasi encefaliche. Le metastasi cerebrali rappresentano una sfida clinica nel carcinoma mammario avanzato, specialmente nelle pazienti HER2 low, storicamente escluse dalle terapie anti-HER2 tradizionali. L’attività intracranica osservata con T-DXd ha tuttavia aperto prospettive promettenti. Il farmaco, grazie alla sua elevata capacità di penetrare la barriera ematotumorale e alla capacità di diffondere il payload chemioterapico anche alle cellule tumorali vicine a quelle esprimenti HER2, ha dimostrato una significativa efficacia nel controllo della malattia cerebrale, anche in
Figura 2. Risposta a livello delle lesioni epatiche (Febbraio 2024 – Dicembre 2024).
pazienti precedentemente sottoposte a multiple linee di trattamento e a radioterapia panencefalica. Studi retrospettivi e case series hanno documentato stabilità o riduzione delle metastasi cerebrali in pazienti trattate con T-DXd, suggerendo un ruolo nel trattamento delle lesioni encefaliche attive. Inoltre, il trial DESTINY-Breast06 (DB-06), che ha dimostrato l’efficacia di T-DXd in pazienti con carcinoma mammario metastatico HR+/HER2 low (IHC 1+ o 2+/ISH-) e HER2 ultra-low (IHC >0 ma <1+), ha espanso ulteriormente il potenziale utilizzo del farmaco. I risultati preliminari indicano un beneficio significativo rispetto alla chemioterapia tradizionale in termini di sopravvivenza libera da progressione e risposta tumorale, suggerendo che anche un’espressione minima di HER2 possa costituire un target terapeutico efficace. Le pazienti con carcinoma mammario metastatico HR+ spesso ricevono numerose linee di trattamento endocrino e chemioterapico, data la possibilità di un controllo prolungato della malattia. L’integrazione di T-DXd nelle fasi avanzate della storia terapeutica di queste pazienti si giustifica per la sua elevata attività anche dopo molteplici trattamenti. Nel caso clinico descritto, l’utilizzo di T-DXd ha in effetti permesso un controllo della malattia encefalica ed epatica, con una tossicità accettabile. La gestione delle metastasi ce -
Figura 3. A livello emisferico cerebellare a destra lesione puntiforme di circa 1 mm, stazionaria. In sede paravermiana superiore a destra lesione di circa 7 mm.
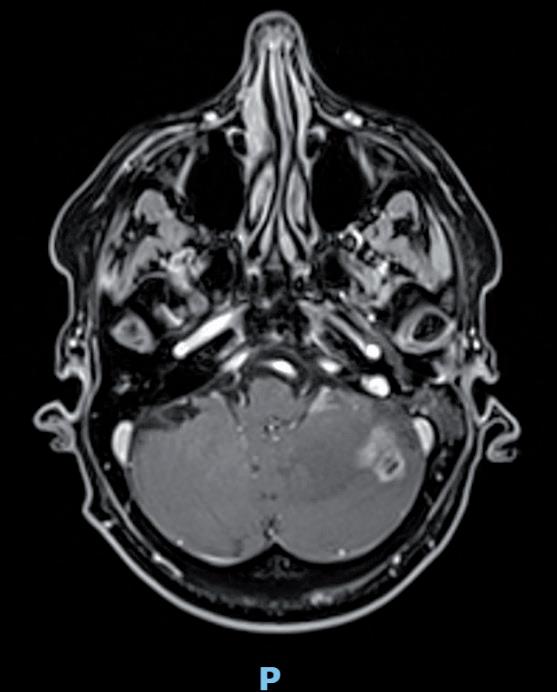
rebrali nel CMM HER2 low rappresenta una sfida clinica significativa, soprattutto in pazienti sottoposte a radioterapia. La valutazione dell’efficacia terapeutica e della progressione di malattia nel contesto encefalico è complicata dalla possibilità di pseudoprogressione, ovvero un aumento transitorio del volume delle lesioni dovuto a fenomeni infiammatori postradioterapici piuttosto che a una vera progressione tumorale. Questo fenomeno, descritto in letteratura nel 10-30% dei pazienti trattati con radioterapia stereotassica (SRS) o whole-brain radiotherapy (WBRT), può rendere difficile l’interpretazione delle immagini di follow-up, portando a decisioni terapeutiche non ottimali 4,5
Uno degli approcci per distinguere pseudoprogressione e progressione reale è l’uso di corticosteroidi, i quali possono ridurre l’edema associato a pseudoprogressione senza influenzare significativamente la crescita tumorale. Tuttavia, l’impiego prolungato di steroidi è gravato da effetti collaterali sistemici significativi, tra cui iperglicemia, osteoporosi e immunosoppressione. Per tale motivo, quando la risposta agli steroidi non è sufficiente o la loro sospensione risulta difficoltosa, il bevacizumab può rappresentare un’opzione terapeutica efficace. Studi recenti hanno dimostrato che l’uso di bevacizumab, un inibitore del VEGF, riduce l’edema perilesionale e migliora i sintomi clinici nei pazienti con pseudoprogressione o radionecrosi, con un tasso di risposta radiologica fino all’80%6,7 . Nel caso descritto, la comparsa di un incremento dimensionale della lesione cerebellare sinistra associato a edema perilesionale ha richiesto una gestione attenta per discriminare tra progressione reale e pseudoprogressione. La decisione di avviare una terapia corticosteroidea a scalare ha permesso di ridurre l’edema e di posticipare una eventuale ulteriore terapia regionale o sistemica.
Infine, il caso presentato evidenzia come, in un setting di paziente fortemente pretrattata, la strategia terapeutica debba essere orientata non solo all’efficacia oncologica ma anche alla gestione ottimale della tossicità e delle complicanze della malattia. La possibilità di impiegare multipli approcci terapeutici in sequenza, combinando trattamenti sistemici e locoregionali, è essenziale per mantenere il controllo di malattia e garantire la migliore qualità di vita possibile.
Il trattamento con T-DXd rappresenta un avanzamento terapeutico per il carcinoma mammario metastatico HER2 low e ultra-low, specialmente nelle pazienti con metastasi encefaliche. I dati emergenti dai trial clinici, inclusi quelli di DESTINY-Breast06, suggeriscono un ampliamento delle indicazioni, con benefici significativi anche in linee tardive di trattamento.
1. Batista MV, Pérez-García JM, Cortez P, Garrigós L, et al. Trastuzumab deruxtecan in patients with previously treated HER2-low advanced breast cancer and active brain metastases: The DEBBRAH trial. ESMO Open 2025;10(1):102268.
2. Mestres-Villanueva MA, Yarlagadda S, Khatri VM, et al. Multi-institutional report of trastuzumab deruxtecan and stereotactic radiosurgery for HER2-positive and HER2-low breast cancer brain metastases. Breast Cancer 2024;31(2):292-300.
3. Podder V, Ranjan T, Bardhan M, et al. Survival analysis of patients with HER2-low and HER2-positive metastatic breast cancer with or without brain metastases treated with trastuzumab deruxtecan. J Clin Oncol 2024;42(16_suppl):e12519.
4. Meixner E, Hörner-Rieber J, Lischalk JW, et al. Radiation-induced contrast enhancements following radiotherapy for brain metastases: clinical and radiological impact of bevacizumab and corticosteroids. Transl Radiat Oncol 2023;1:100067.
5. Li J, He J, Cai L, et al. Bevacizumab as a treatment for radiation necrosis following stereotactic radiosurgery for brain metastases: clinical and radiation dosimetric impacts. Ann Palliat Med 2021;10(6):687-696.
6. Parvez K, Parvez A, Zadeh G. The diagnosis and treatment of pseudoprogression, radiation necrosis and brain tumor recurrence. Int J Mol Sci 2014;15(5):8206-8226.
7. Hörner-Rieber J, et al. Clinical management of radiation-induced edema in patients with brain metastases. Clin Transl Radiat Oncol 2022;32:1-7.
Beatrice Tedesco Dirigente UOC Oncologia Medica – Azienda Ospedaliera Regionale “San Carlo”, Potenza.
Introduzione
Il carcinoma della mammella HER2 positivo è caratterizzato dall’amplificazione del gene per HER2 e\o dall’espressione sulla superficie delle cellule tumorali della proteina HER2. Rispetto agli altri sottotipi, il tumore della mammella HER2 positivo presenta una maggiore aggressività in termini di rapida crescita e capacità di metastatizzazione. Tuttavia, proprio la presenza di HER2 ha aperto la strada a terapie mirate che hanno significativamente migliorato la prognosi di questi sottotipi. Le terapie sono ormai consolidate come quelle con gli anticorpi monoclonali pertuzumab e trastuzumab o con l’anticorpo coniugato TDM-1. Gli anticorpi coniugati sono farmaci innovativi che riconoscono specificatamente recettori di superficie e rilasciano all’interno delle cellule molecole di chemioterapici. Il capostipite è stato il TDM-1, il primo anticorpo-coniugato ad essere utilizzato nei pazienti con carcinoma mammario HER2 positivo metastatico dopo aver fallito una prima linea di trattamento con pertuzumab e trastuzumab. Tuttavia il TDM-1 è stato attualmente superato dal Trasuzumab-deruxtecan (T-DXd), nuovo anticorpo-coniugato in indicazione in seconda linea di terapia nei tumori HER2 positivi. Trastuzumab deruxtecan (T-DXd) è un anticorpo coniugato che ha dimostrato di migliorare in manie -
ra consistente l’efficacia di TDM-1 in termini di sopravvivenza libera da progressione e tasso di risposta. Infatti, in tutto il mondo il T-DXd è approvato per pazienti con cancro mammario metastatico HER2 positivo dopo progressione a taxani e trastuzumab o in pazienti che presentino una precoce ricaduta, entro 6 mesi, dalla conclusione della terapia neoadiuvante\adiuvante.
Caso clinico
Si descrive il caso clinico di una paziente di 64 anni affetta da carcinoma della mammella metastatico HER2 positivo, trattato in seconda linea con trastuzumab deruxtecan.
La paziente ha una buona qualità della vita, svolge ancora il suo lavoro. Il suo unico problema di salute in anamnesi è un’importante coxartrosi dell’anca destra. Durante l’estate del 2020, riferisce di aver avvertito una tumefazione a carico dei quadranti inferiori della mammella destra ma non ha eseguito nessun controllo. Nel mese di Novembre dello stesso anno la tumefazione mammaria va incontro ad ulcerazione cutanea, a quel punto la paziente decide di sottoporsi a mammografia con ecografia mammaria (figura 1) che mostrano una grossolana lesione della mammella infiltrativa, occupante il QIE destro, coesistono linfoadenopatie ascellari omolaterali.
La biopsia mammaria mostra infiltrazione da carcinoma di origine mammaria Ki67 15% ER 7% PgR 0 HT 3+. La successiva TC total body con mdc evidenzia multiple ed ubiquitarie lesioni polmonari oltre la nota lesione mammaria destra. Definita, pertanto, in IV stadio nel mese di Novembre 2020 inizia la terapia di I linea trisettimanale standard con docetaxel associato a pertuzumab e trastuzumab. Dopo i primi tre mesi dall’inizio del trattamento la lesione della mammella va incontro a rimarginazione. Alla TC total body di controllo del mese di Agosto 2021 (figura 2) si osservava netta risposta con riduzione della lesione mammaria e scomparsa delle metastasi polmonari. A partire dal mese di Marzo 2022 la paziente inizia a presentare noduli sottocutanei e linfangite mammaria controlaterale con ricomparsa della nota ulcera mammaria.
Al controllo strumentale successivo (figura 3) si conferma la netta progressione, per cui dal mese di Aprile 2022 avvia terapia con trastuzumab deruxtecan (T-DXd), come da indicazione.
1. Mammografia Novembre 2020.
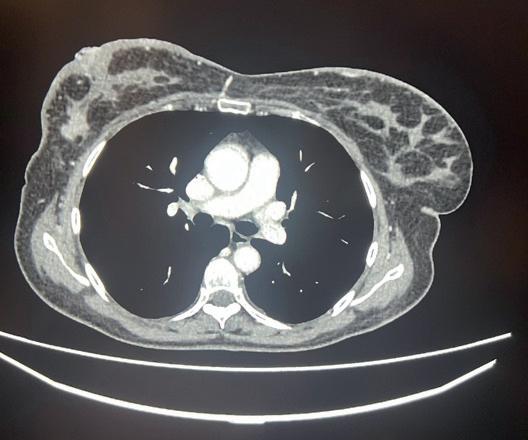
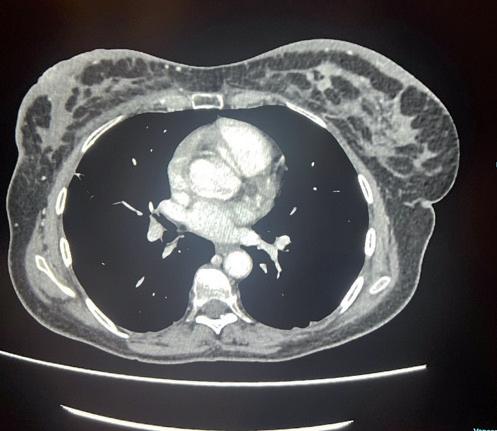
Già dal secondo mese di terapia si osserva una riduzione del numero dei noduli sottocutanei, la scomparsa della linfangite e la riparazione dell’ulcera.
La TC di Agosto 2022 (figura 4) mostra una risposta patologica completa.
Dall’ottavo ciclo di terapia si procede ad una riduzione di dose (4,4 mg/mq) per piastrinopenia (G2) persistente con pronto recupero dei valori di crasi ematica. Per riferita nausea (G2) con inappetenza è stata incrementata la terapia ancillare del giorno della somministrazione di T-DXd con nepupitant/polonosetron 300/0,5 mg p.o. e desametasone 8 mg ev e nei 3 giorni successivi è stato prescritto desametasone 4 mg p.o., con beneficio.
Ad oggi la paziente è in trattamento con T-DXd, mantenendo la risposta patologica completa (ultima PETTC Settembre 2024 – figura 5), con una PFS di 34 mesi.
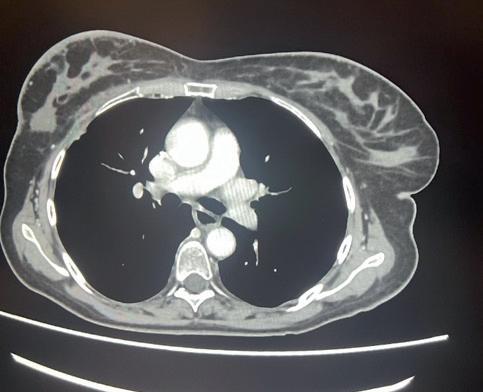
Figura 6. a PFS b PFS2 c OS - Le analisi aggiornate di efficacia e sicurezza dello studio DESTINYBreast03; Nature Medicine 2024.
Questo caso clinico conferma che il T-DXd è un’opzione terapeutica efficace e sicura. La risposta al trattamento si è ottenuta rapidamente e mantenuta nel tempo. Il ruolo del T- Dxd è ampiamente dimostrato e anche le analisi aggiornate di efficacia e sicurezza dello studio DESTINY- Breast 03 recentemente pubblicate su Nature Medicine, confermano la superiorità del trastuzumab- deruxtecan (T-DXd) rispetto al trastuzumab-emtansine (T-Dm1) nei pazienti con carcinoma mammario metastatico già trattati con taxani, pertuzumab e trastumab. Infatti, i nuovi dati, ad un follow up mediano di 41 mesi, dimostrano che con T-DXd rispetto a T-DM1 la sopravvivenza libera da progressione di malattia è stata di 29 mesi rispetto a 7,2 mesi, circa 4 volte più lunga; a 3 anni più del 45 % dei pazienti è libero da progressione (45,7% rispetto a 12,4%).
La mediana di sopravvivenza globale è stata di 52,6 rispetto a 42,7 mesi, un miglioramento di circa 10 mesi con più di un terzo dei pazienti ancora vivo a 3 anni. Anche il tasso di risposta globale è nettamente a favore di T-DXd rispetto a T-DM1 con il 78,9 % versus 36,9%.
La durata mediana della risposta è di 30,5 mesi verso 17 mesi. Gli eventi avversi connessi al trattamento sono risultati coerenti con le analisi precedenti e non si è osservata nessuna tossicità cumulativa.
1. Hanna WM, Kennecke H. Human epidermal growth factor receptor 2 (HER2) in cancer: overexpression and therapeutic implications. Exp Mol Pathol. 2017;103(1):1-10.
2. Iqbal N, et al. HER2 molecular pathway and trastuzumab resistance in breast cancer. Mol Biol Int. 2014;2014:852748.
3. National Cancer Institute. SEER Cancer Stat Facts: Female Breast Cancer Subtypes. National Cancer Institute. seer.cancer.gov/statfacts/html/breastsubtypes.html. Published 2017. Accessed June 13, 2025.
4. Kim HY, Im SA, Lee KH, et al. Clinical significance of microinvasive breast cancer across the different subtypes and human epidermal growth factor receptor 2 expression levels. Cancer Res Treat. 2020;52(1):198-208.
5. Lee SY, Yoo TK, Kim JE, et al. Long-term outcomes of HER2-low breast cancer: a real-world study. Breast Cancer Res Treat. 2023;200(1):47-61.
6. Swain SM, Miles D, Kim SB, et al.; CLEOPATRA study group. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomized,
placebo-controlled, phase 3 study. Lancet Oncol. 2020 Apr;21(4):519-530.
7. Swain SM, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a doubleblind, randomized, placebo-controlled, phase 3 study. Lancet Oncol. 2020 Apr;21(4):519-530.
8. Verma S, Miles D, Gianni L, et al.; EMILIA Study Group. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med. 2012 Nov 8;367(19):17831791. doi:10.1056/NEJMoa1209124. PMID:23020162.
9. Barok M, et al. Trastuzumab emtansine: mechanisms of action and drug resistance. Breast Cancer Res. 2014;16(2):209.
10. Ogitani Y, et al. A novel anti-human epidermal growth factor receptor 2 antibody-drug conjugate, in tumors with human epidermal growth factor receptor 2 heterogeneity. Cancer Sci. 2016;107(8):1039-1046.
11. Nakada T, et al. The latest research and development into the antibody-drug conjugate, [fam-]trastuzumab deruxtecan (DS-8201a), for HER2 cancer therapy. Chem Pharm Bull. 2019;67(3):173-185.
12. Cortes J, et al. Trastuzumab deruxtecan versus trastuzumab emtansine for breast cancer. N Engl J Med. 2022;386(13):1143-1154.
13. Hurvitz SA, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomized open-label, phase 3 trial. Lancet. 2023;401(10371):105-117.
14. Cortes J, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in HER2-positive metastatic breast cancer: long-term survival analysis of the DESTINY-Breast03 trial. Nat Med. 2024 Jun;30(6):22082215.
