ATTUALITÀ
Verso la nuova legislazione farmaceutica Ue
MACCHINE Una linea oftalmica conforme all’Annex 1
RIVISTA DELL’
APPROFONDIMENTI
microRNA: una scoperta da Premio Nobel

ATTUALITÀ
Verso la nuova legislazione farmaceutica Ue
MACCHINE Una linea oftalmica conforme all’Annex 1
RIVISTA DELL’
APPROFONDIMENTI
microRNA: una scoperta da Premio Nobel




Col nostro costante impegno verso gli standard distributivi e di servizio più elevati, siamo qui per offrirti ogni giorno soluzioni personalizzate e all’avanguardia, sia nella sintesi farmaceutica che nella .
Esperienza, qualità, sicurezza. Scegli Qores, il partner con cui condividere un futuro di successi.










Editoriale L’industria chimica chiede più coraggio all’Europa
8
Storia di copertina Un partner completo per il settore Life Sciences

14
Attualità Industria chimica: un settore cardine esposto a tante criticità

22
Attualità
24
Attualità Verso la nuova legislazione farmaceutica europea

32
Appuntamenti Nasce la fiera per le apparecchiature da laboratorio

36
Industria chimica
38 Industria farmaceutica
Applicazioni medicali
Una cabina di diagnostica a supporto della medicina personalizzata

42
Ricerca
Supercalcolo per chiarire i meccanismi del Parkinson


Macchine Linea oftalmica conforme all’Annex 1 48
Macchine Service e filtrazione: così Atlas Copco si rafforza in Italia

Componenti Giunti rotanti adattabili a diverse applicazioni
Strumentazione
Automazione
Sicurezza
Transizione digitale Ecco i trend che trasformeranno la farmaceutica

“I risultati che abbiamo ottenuto con l’uso delle biotecnologie computazionali rappresentano un passo importante nella comprensione dei complessi meccanismi cellulari che sono alla base di molte gravi patologie, tra cui il Parkinson. Queste tecnologie, insieme all’intelligenza artificiale, stanno emergendo come una delle frontiere più promettenti per lo studio e la cura di malattie complesse”. Caterina Arcangeli, ricercatrice del Laboratorio Biotecnologie RED di Enea, pagina 42
Approfondimenti
MicroRNA, l’importanza del DNA non codificante

72
Elenco inserzionisti Colophon








di Alessandro Bignami
L’Europa è stata colta clamorosamente impreparata dalle prime dichiarazioni e decisioni della presidenza Trump. Si attende ora che emetta qualche segnale di esistenza politica che vada oltre il piano di riarmo dei singoli 27 paesi e che possa consentirle, quantomeno un giorno non troppo lontano, di parlare allo stesso tavolo delle grandi potenze mondiali da cui si è trovata improvvisamente esclusa. Ma non è questo il luogo di analisi geopolitiche, ormai dilaganti su ogni quotidiano o talk show televisivo. Ci interessa invece concentrarci su un’iniziativa comunitaria che interessa l’industria e che cerca di dare qualche risposta alle grandi sfide attuali e alla crisi che sta attraversando il sistema manifatturiero continentale: a un anno dalla Dichiarazione di Anversa, che delineò la richiesta di dieci azioni concrete per rafforzare la competitività produttiva europea, la presidente della Commissione Ue Ursula von der Leyen ha incontrato nella stessa città 400 esponenti dell’industria per illustrare il Clean Industrial Deal, che punta a reindustrializzare l’Europa in modo sostenibile attraverso tecnologie e prodotti puliti. Il piano ha finora ottenuto reazio-
ni positive, pur con qualche qualche critica. L’industria chimica, per voce del Cefic, ha mostrato apprezzamento per l’iniziativa, insistendo però sulla necessità che la Ue si muova senza ritardi e che la sua leadership agisca in modo coraggioso, portando avanti iniziative concrete che anzitutto puntino a garantire la sicurezza e l’indipendenza dell’Europa. A preoccupare la presidente di ICCA e Cefic, Ilham Kadri, sono i numeri in calo per il mercato e la produzione chimica europea, numeri che richiedono a suo avviso azioni urgenti e determinate. Anche alla luce del fatto che l’industria chimica è alla base di quasi tutte le filiere della manifattura.
Cefic ha dunque riconosciuto positivamente il fatto che nove delle dieci richieste espresse nella Dichiarazione di Anversa del 2024 siano state affrontate nel Clean Industrial Deal. Ma, di fronte alla crescente chiusura di stabilimenti e alla conseguente perdita di posti di lavoro di qualità, l’organizzazione dell’industria chimica del vecchio continente ha anche sollecitato le autorità europee a passare dalle parole ai fatti. E a farlo in fretta.








Ellab acquisisce PharmaProcess e si rafforza
nel suo ruolo di end-to-end provider per l’industria farmaceutica e biotecnologica, aggiungendo la divisione Engineering. Abbiamo parlato con i protagonisti di questa operazione strategica.
di Alessandro Bignami
Ellab ha compiuto un ulteriore passo verso l’obiettivo di porsi come partner completo per l’erogazione di servizi al settore life sciences. Lo ha fatto acquisendo la società italiana PharmaPro-
cess Srl e la consociata svizzera PharmaProcess GmbH, che formano una realtà specializzata nella consulenza sul processo farmaceutico, protagonista di una rapida crescita dalla fondazione del 2018 ad oggi. Ellab, che fa par-
te dal 2023 di Novo Holdings, può così rafforzare i suoi servizi di convalida, monitoraggio e taratura, e persino ampliarli con i servizi di Engineering. Per avere qualche dettaglio in più sull’operazione, abbiamo incontrato nella sede di Ellab Italia a Pero (MI) la Country Manager Alessandra Ferrari e i due fondatori di PharmaProcess, che ora fanno parte del leadership team del Gruppo: Marco Alberio, Direttore Commerciale dei Servizi, e Renato Picchi, Direttore dei Servizi.
Qual è il valore strategico di questa operazione?
Alessandra Ferrari: “Si tratta anzitutto di un nuovo passo del gruppo Ellab verso l’obiettivo di crescere e affermarsi come uno dei principali partner internazionali per il settore life sciences, nell’ambito dei servizi e dei prodotti. Con l’acquisizione di PharmaProcess, Ellab conferma questa ambizione, ampliando il proprio raggio di azione ai servizi di engineering. La azienda italo-svizzera porta dunque nel gruppo competenze nuove e complementari alle nostre, come l’ingegneria. E al contempo rafforza quelle in comune, relative per esempio alla Computer Validation System, alla Commissioning & Validation e alla Quality & GMP Compliance”.
Qual è lo sguardo peculiare che PharmaProcess porterà nel gruppo?
Marco Alberio: “PharmaProcess si è posta l’obiettivo di poter offrire servizi per coprire il V-Model, ben noto nel nostro ambito, offrendo un servizio che può partire dallo sviluppo strategico e concettuale di un progetto fino all’avvio di un intero stabilimento farmaceutico o di un reparto produttivo. Grazie a una profonda conoscenza del processo, aiutiamo il cliente a raggiungere i suoi obiettivi di produzione fin dall’impostazione del progetto e lo accompagniamo passo-passo in tutte le fasi: dalla progettazione alla supervisione della co-

struzione, fino alla convalida, supportando i nostri clienti anche nell’emissione delle procedure per gestire il nuovo impianto, oltre che nelll’esecuzione di process validation e tech transfer di prodotti, il tutto nel pieno rispetto della compliance GMP”.
Renato Picchi: “Non solo. Il nostro servizio prosegue anche oltre la conclusione dei FAT/SAT, dell’avvio dell’impianto e dell’iter autorizzativo. Le aziende farmaceutiche sono infatti chiamate a lavorare sempre in conformità a precisi e costanti standard qualitativi e devono prepararsi a visite ispettive. Noi restiamo accanto al cliente nella gestione dei controlli di routine, nelle riqualifiche o dopo eventuali modifiche impiantistiche. La continuità è un aspetto chiave del nostro lavoro: ci dà una maggiore autorevolezza poiché il cliente si affida a noi come a un partner a tutti gli effetti, ben più quindi di un fornitore di singoli servizi”.
Questo approccio completo all’impianto, che include gli aspetti ingegneristici, appare pregno di novità per Ellab…
Ferrari: “Sì, e non solo per la Country Italia, ma anche a livello di Gruppo. In questo senso, mi spingo a definire quella di PharmaProcess una acquisizione ‘pilota’. Ellab non era mai entrata in mo-
do deciso nell’ambito dell’engineering, avendo preferito finora concentrarsi sul proprio know how. Questa operazione segna una svolta, mostrando che la nostra società sta comprendendo la valenza strategica di proporsi al fianco dell’azienda farmaceutica a partire dallo sviluppo delle sue nuove idee e dalla stesura dei primi progetti. Ciò significa non solo apprendere meglio la genesi e gli obiettivi di un nuovo reparto da allestire, ma anche, attraverso la porta aperta dall’engineering, poter mettere subito a disposizione anche gli altri nostri servizi di punta: dalla convalida termica ai sistemi di monitoraggio, fino alla strumentazione. Intervenire già in fase di engineering ci consente infine di ottenere maggiori e più precoci informazioni sugli investimenti in nuovi impianti farmaceutici”.
Si tratta di una sinergia potenzialmente stimolante anche per le altre countries del Gruppo, ma immagino che inizialmente punterete sulle richieste dei mercati italiano e svizzero…
Alberio: “Sì, benché effettivamente le richieste ci arrivino anche da paesi lontani, per esempio dagli Stati Uniti. È un altro aspetto che arricchisce di senso il nostro ingresso in Ellab. Se prima le nostre dimensioni non ci consen-
Alessandra Ferrari: “Con l’acquisizione di PharmaProcess, Ellab aggiunge i servizi di engineering e conferma l’ambizione di affermarsi come un end-to-end provider per il settore life sciences”
tivano di accontentare tutte le richieste, ora siamo all’interno di una struttura potente e ramificata, che estende il nostro sguardo e le possibilità di intervento nel mondo”.
Il vostro è un approccio completo al processo farmaceutico, ma sempre con un taglio dedicato ai servizi e non alla costruzione di tecnologie e manufatti. Volete chiarire meglio questo concetto?
Alberio: “Certo. È giusto fare chiarezza su questo. Noi non facciamo construction, non realizziamo impianti chiavi in mano. Il nostro business è interamente orientato ai servizi. Crediamo che ognuno debba dedicarsi a ciò che sa fare meglio. Detto questo, l’esperienza e la conoscenza del mercato ci consentono di fornire pareri e informazioni utili a clienti che chiedono di essere supportati nella ricerca di fornitori tecnologici all’altezza e specifici per una determinata applicazione”.
Facciamo un passo indietro: da dove viene PharmaProcess e come si evolve?
Picchi: “Marco Alberio e io abbiamo
Il laboratorio di taratura, nella sede di Pero (MI), è un fiore all’occhiello di Ellab Italia

Marco Alberio: “Ora PharmaProcess è in una struttura potente e ramificata, che le consente di estendere lo sguardo e le possibilità di intervento nel mondo”

Ellab ha da poco cambiato il proprio logo e i colori aziendali: una trasformazione iconografica che accompagna l’evoluzione del gruppo da fornitore di apparecchiature e software di convalida a partner di conformità end-to-end per soluzioni complete
fondato l’azienda nell’agosto 2018. Siamo entrambi esperti di processo farmaceutico. Io vengo da una lunga esperienza nella consulenza e Marco era mio cliente presso una società svizzera. Ci siamo confrontati e abbiamo messo a fuoco alcune idee, infine sfociate nella nascita della società. L’avventura ha preso subito il volo, tanto che siamo in breve passati da 2 a oltre 30 addetti, pur attraversando in pieno il periodo del

Abbiamo incontrato nella sede di Ellab Italia a Pero (MI) la Country Manager Alessandra Ferrari e i due soci fondatori di PharmaProcess, che è entrata a far parte del Gruppo danese: Renato Picchi, Direttore dei Servizi (a sinistra), e Marco Alberio, Direttore Commerciale dei Servizi
Covid. Siamo partiti assumendo persone di alto profilo, già note sul campo, in modo da trasmettere subito al mercato la credibilità e la solidità del nostro progetto. Attorno a questo nocciolo duro, abbiamo aggiunto figure junior desiderose di imparare dai più esperti. Fondata in Italia, la società ha aperto dopo due anni una sede in Canton Ticino in modo da poter lavorare da vicino e senza limiti anche presso i tanti clienti in Svizzera”.
Alberio: “La sede elvetica resterà attiva anche con il passaggio in Ellab, perché ha saputo sviluppare un nucleo di competenze ingegneristiche di alto livello, che oggi rappresenta per noi un prezioso riferimento”.
A che punto è l’integrazione con Ellab Italia?
Picchi: “È molto avanzata, il personale proveniente da PharmaProcess si è già ambientato bene nella sede di Pero. Sono stato piacevolmente colpito dal clima di intesa che si è immediatamente percepito fra i due team, quasi lavorassero già da tempo assieme”.
Ferrari: “È un passaggio che, dopo il
closing di fine novembre 2024, stiamo conducendo rapidamente. Anche perché il trasloco non riguarda strutture o apparecchiature, ma solo postazioni di lavoro. Ora Ellab Italia, includendo la sede staccata di Latina, impegna circa 90 addetti”.
Picchi: “Tengo ad aggiungere che la fusione fra PharmaProcess ed Ellab non è solo una somma o uno scambio di competenze tecniche, ma anche la condivisione dei valori di fondo, che entrambe le società ritengono imprescindibili nel loro approccio lavorativo: tra questi, la serietà, la qualità, la trasparenza, il senso di appartenenza, la voglia di arrivare fino in fondo per raggiungere la soluzione. Può sembrare scontato e retorico, ma non è così, soprattutto quando a unire le forze sono due realtà dalla taglia così diversa, da una parte una piccola società di consulenza, dall’altra un grande gruppo internazionale. Ci ha dunque entusiasmato il fatto che una azienda molto più grande della nostra condivida la stessa attenzione alla persona, alla relazione umana. D’altronde il cuore del nostro servizio risiede proprio nella persona. In Ellab abbiamo ri-
trovato lo stesso spirito, per altro perfettamente rappresentato da una grande iniziativa dedicata alla formazione come Ellab Academy”.
Ferrari: “Il personale è il vero tema. Per chi fa servizi come noi è il patrimonio più prezioso. Ricordo che per Ellab è un valore essenziale non solo la soddisfazione del cliente, ma anche quella del proprio dipendente, che teniamo costantemente monitorata anche con l’aiuto di questionari di soddisfazione”.
Cos’è la Ellab Academy?
Ferrari: “È un’iniziativa della divisione del Gruppo che si occupa della formazione del personale e dei clienti. Il progetto dell’Academy vuole portare il tema della formazione a un livello superiore, proponendosi come una sorta di università interna, dove i nuovi assunti provenienti da ogni filiale internazionale possono affinare le proprie competenze in contesti applicativi specifici: per esempio la convalida di un’autoclave, di un liostato o di una cella frigorifera. Un edificio da poco costruito in Irlanda, interamente dedicato all’Academy, ospiterà impianti e laboratori, oltre che riproduzioni di reparti farmaceutici, creando un ambiente ideale per esercitarsi dal vivo e apprendere le modalità operative di Ellab. Proprio come in università, i corsi si concluderanno con un esame. È un grande investimento che spiega bene quanto Ellab creda nelle persone e nella loro formazione”.
Il tema della carenza di personale è sempre più cruciale, ancora di più in settore ad alto tasso tecnico come il vostro. Come affrontate questa sfida?
Ferrari: “Ci muoviamo su più fronti: collaborando con gli istituti tecnici, conducendo ricerche su piattaforme web o anche ricorrendo al semplice passaparola. Non è semplice, anche perché per fare questo lavoro servono non solo competenze tecniche, ma anche atti-
tudine. Sulle prime in azienda ci si può lavorare, ma l’attitudine riguarda più le caratteristiche personali ed è meno facile da insegnare”.
Picchi: “A complicare la ricerca è la necessità, insita nel nostro lavoro, di visitare gli stabilimenti e di essere spesso in trasferta. Non tutti sono disposti a spostarsi”.
Ferrari: “Alcuni lo accettano all’inizio ma poi si rendono conto di non riuscire a mantenere delle relazioni personali stabili. Stiamo cercando delle soluzioni, per dare l’opportunità di vivere anche dei periodi più stanziali. In Italia abbiamo deciso di aprire una sede a Latina, proprio al fine di seguire i tanti clienti locali senza dover spostare le persone dal Nord Italia. In questa logica, stiamo pensando di aprire degli uffici anche nel Triveneto. Per contro, chi è interessato a fare anche lunghe esperienze in altre sedi Ellab nel mondo, dalla sede centrale danese fino agli Usa, trova sempre la massima disponibilità da parte del Gruppo”.
Alberio: “Va anche considerato che proponiamo di imparare un lavoro altamente qualificato, con ottime prospettive di crescita e con la possibilità di lavorare su diversi aspetti del processo. Ci interessa formare dei consulenti di alto profilo”.
Quali obiettivi vi siete posti per il 2025 come Ellab Italia, oltre ad alzare l’asticella del fatturato?
Ferrari: “Certamente l’obiettivo è crescere, però su più livelli. Non solo quindi in termini di fatturato, ma anche come numero e importanza dei progetti acquisiti. È importante per noi essere coinvolti in commesse a lungo termine, perché ci consentono di mostrare meglio l’efficacia del nostro lavoro, di sviluppare il rapporto con il cliente e di avere un maggiore ritorno grazie alla fidelizzazione e all’aggiunta di altri incarichi connessi. Un’altra meta strategica di quest’anno è la piena integra-
Renato Picchi: “La fusione fra PharmaProcess ed Ellab non è solo una somma o uno scambio di competenze tecniche, ma include la condivisione dei valori di fondo, come la serietà, la qualità, la trasparenza, il senso di appartenenza, la voglia di arrivare fino in fondo per raggiungere la soluzione”

zione delle varie business unit, che devono essere tutte in grado di operare in maniera indipendente e al contempo osmotica, in un continuo scambio di informazioni e competenze”.
In Italia quali sono le divisioni più attive del Gruppo?
Ferrari: “Siamo molto forti nella convalida termica, che rappresenta il nostro core business. Altri servizi di punta sono la consulenza, la vendita e il noleggio dei sistemi, soprattutto per la convalida termica e il monitoraggio ambientale, e infine il laboratorio di taratura, un vero e proprio fiore all’occhiello. Nel 2025 quest’ultimo comprenderà l’accreditamento per la misurazione della velocità dell’aria, che ci aiuterà a differenziarci ulteriormente. Si pensi infatti che per questa grandezza in Italia sono accreditati solo quattro laboratori e nessuno nella bassa velocità, range su cui saremo focalizzati. Tutti questi passi vanno nella medesima direzione: aggiungere servizi dedicati al mondo delle life sciences, nei confronti del quale vogliamo affermarci sempre di più come un end-to-end provider”.
Il monitoraggio ambientale è fra i servizi di punta di Ellab
Il ministro delle Imprese e del Made in Italy Adolfo Urso ha sottoscritto lo scorso 11 marzo il ‘non paper’ sulla chimica europea, assieme a Francia, Repubblica Ceca, Romania, Slovacchia, Spagna, Ungheria e Paesi Bassi, contribuendo a dar vita all’Alleanza per il rilancio del settore chimico in Europa.
L’annuncio della sottoscrizione è stato dato da Urso nel corso di una videocall con il ministro francese dell’In-

dustria e dell’Energia, Marc Ferracci, e con gli omologhi di Germania, Romania, Slovacchia, Belgio e Austria, in vista del Consiglio Competitività che si è tenuto a Bruxelles il giorno dopo.
“L’Europa non può fare a meno della chimica di base, che rappresenta il pilastro di ogni filiera industriale”, ha dichiarato il ministro Urso. “Oggi ci troviamo di fronte a un paradosso: produrre in Europa è spesso meno conveniente che importare prodotti chimici dall’estero. Questa tendenza va invertita. Dobbiamo rilanciare la competitività del nostro sistema industriale, accompagnando la transizione green con pragmatismo e determinazione. È questo l’impegno preso anche al Tavolo Versalis, con le organizzazioni sindacali e le Regioni interessate. Difendere la capacità produttiva europea significa rafforzare l’autonomia strategica del nostro continente nella transizione green, un obiettivo che noi
Riforma degli appalti, nuove regole su aiuti di Stato e misure finanziarie dedicate ai progetti strategici per la produzione di farmaci critici in UE, solidarietà sulle riserve strategiche di medicinali: questi gli ingredienti principali della ricetta definita dalla Commissione Ue nella proposta di Critical Medicines Act, adottata rispettando l’impegno formulato da Ursula von der Leyen di un intervento in materia nei primi cento giorni del suo secondo mandato.
Il Critical Medicines Act si aggiunge alla revisione della legislazione farmaceutica europea affrontando le cause economiche e industriali delle carenze di medicinali in linea con i recenti studi della Commissione e con il rapporto strategico della Critical Medicines Alliance. In particolare, il documento prevede:
• una riforma delle regole per le gare farmaci includendo i criteri Meat (offerta economicamente più vantaggiosa) e le gare multi-aggiudicatario insieme a proposte di riforma dei mercati nazionali per far sì che la sicurezza dell’approvvigionamento sia premiata nelle politiche di prezzo e acquisto;
• maggiore flessibilità degli aiuti di Stato e delle norme IPCEI per supportare gli investimenti degli Stati membri nella produzione di medicinali e principi attivi farmaceutici (API),
• sburocratizzazione delle autorizzazioni e dei permessi per nuovi siti di produzione e investimenti mirati;
• solidarietà UE sulle riserve strategiche, per garantire che in caso di carenza di medicinali l’accesso dei pazienti ai medicinali abbia la precedenza sull’accumulo di
condividiamo, come dimostra anche il piano di riconversione industriale dell’azienda dell’Eni”. Il documento sottoscritto chiede alla Commissione europea di realizzare un “EU Critical Chemicals Act” che, analogamente al “Critical Raw Material Act”, definisca una lista di molecole strategiche per i settori della chimica e le industrie collegate (automotive, edilizia, farmaceutica, agroalimentare, green tech), riconoscendo anche la criticità di quelle con forti squilibri commerciali e dipendenza da paesi extra-UE. Si suggeriscono poi misure di incentivazione, modernizzazione e decarbonizzazione degli impianti esistenti, oltre a interventi per il reshoring delle produzioni perdute. Inoltre, si sottolinea la necessità di incentivare l’innovazione e la ricerca di alternative sostenibili e lo sviluppo di nuove piattaforme produttive (biocarburanti, bioplastiche, riciclo della plastica, batterie), garantendo l’accesso competitivo alle materie prime essenziali.
scorte a livello nazionale;
• maggiori possibilità per la Commissione, in situazioni di crisi, di effettuare appalti congiunti su richiesta degli Stati membri;
• un riferimento alla necessità di nuove partnership internazionali con paesi terzi per la sicurezza dell’approvvigionamento di medicinali.
“Il Critical Medicines Act promuove il rilancio e la ri-localizzazione della produzione farmaceutica all’interno dell’UE, così da ridurre la dipendenza extra-UE e rafforzare la sicurezza degli approvvigionamenti in tutti i Paesi assieme, però, a concrete riforme sulle politiche di prezzo e acquisto dei farmaci essenziali”, commenta Stefano Collatina, presidente di Egualia. “Ora serve rendere operativo il piano prima che sia troppo tardi”.



Il Rapporto “Facts & Figures 2024” indaga la situazione dell’industria chimica europea che, pur mostrando ottimi risultati, deve lottare con gli elevati costi dell’energia, delle normative, del lavoro e delle materie prime, oltre che con la concorrenza dei paesi extra-UE.
a cura di Eva De Vecchis
Dai petrolchimici ai prodotti farmaceutici specializzati, la chimica è un elemento fondamentale della vita quotidiana: agricoltura, alimenti, edilizia, trasporti, pro-
dotti di consumo, elettrodomestici e attrezzature industriali, ingredienti per farmaci, cosmetici e profumi. La maggior parte dei beni industriali contiene sostanze chimiche.
A parlarne è il rapporto Facts & Figures 2024 di Cefic secondo il quale, nel 2023, il settore chimico eu-
ropeo ha registrato un fatturato di circa 655 miliardi di euro e un valore aggiunto di 165 miliardi di euro. Il settore si articola in tre segmenti principali: upstream (materie prime chimiche di base), intermedi (polimeri e prodotti chimici di transizione) e downstream (prodotti chi-
mici specializzati). Questa struttura riflette la complessità dell’industria chimica e la sua importanza per numerosi settori, dalle applicazioni industriali ai beni di consumo.
L’industria chimica rappresenta il 5-7% del fatturato industriale totale e impiega oltre 1,2 milioni di lavoratori diretti, generando da 3 a 5 volte più posti di lavoro indiretti. Circa 31.000 aziende operano nel settore chimico europeo, il 97% delle quali sono piccole e medie imprese (PMI). Gli impianti chimici sono diffusi in tutto il territorio dell’UE e svolgono un ruolo cruciale nelle economie locali. Il settore è particolarmente importante in Germania (33% del valore aggiunto chimico europeo), Francia (17%), Italia (9%), Paesi Bassi (7%), Spagna (7%) e Belgio (6%).
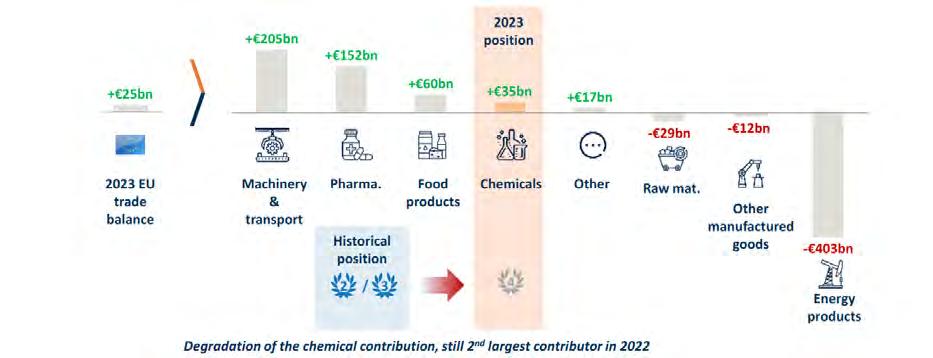
Inoltre, l’industria chimica è un settore chiave per l’export europeo, con un saldo commerciale positivo di 35 miliardi di euro nel 2023. L’industria chimica è fondamentale per la riduzione dell’impronta di carbonio dei materiali utilizzati nei prodotti manifatturieri. Inoltre, questa è anche essenziale per l’economia circolare, perché permette di sviluppare materiali riciclati, bio-based e biodegradabili. L’Europa è leader nella produzione di plastica riciclata (21% del totale) e di plastiche bio-based e biodegradabili (27%) e le aziende chimiche europee sono
all’avanguardia nelle soluzioni di riciclo chimico.
Le criticità del settore
L’industria chimica europea svolge quindi un ruolo indispensabile nell’economia della regione, non solo come importante contributore alla produzione industriale, ma anche come motore chiave dell’innovazione e della circolarità in una vasta gamma di settori. Con un portafoglio diversificato che spazia dai prodotti chimici di base ai materiali altamente specializzati, il settore supporta applicazioni in numerosi ambiti. Il suo contributo alla bilancia commerciale europea, all’occupazione e all’ecosistema dell’innovazione sottolinea la sua importanza strategica.
Nonostante ciò, l’industria chimica in Europa sta anche affrontando tre impatti combinati:
• domanda debole, dovuta alla riduzione della produzione manifatturiera, al calo del consumo di beni durevoli e all’aumento delle importazioni;
• eccesso di offerta, a causa dell’incremento delle capacità produttive globali e della forte pressione competitiva in alcune catene del valore;
• pressioni sulla competitività, derivanti da costi energetici e delle materie prime più alti in Europa, costi normativi e ambientali più elevati e un quadro politico più complesso.
In questo contesto, la politica industriale europea si è rivelata insufficiente e si contrappone nettamente alle politiche molto più incentivanti adottate da altre regioni.
L’Europa continua perciò trovarsi in una posizione di svantaggio competitivo rispetto a Stati Uniti, Cina e Medio Oriente a causa anche degli elevati costi dell’energia, delle normative, del lavoro e delle materie prime. Questo è esemplificato dal fatto che la produzione di etilene in Europa nel 2023 è stata 3,2 volte più costosa rispetto agli Stati Uniti. L’elevata competitività del mercato chimico globale, insieme alla crescita limitata della domanda e agli alti investimenti in altre regioni, mette l’Europa in una posizione difficile. Il tasso di utilizzo della capa-
Bilancia commerciale manifatturiera europea.
Fonti: Eurostat, con aggiustamenti di Cefic (riduzione di 10 miliardi di euro rispetto alla bilancia commerciale dei prodotti chimici di Eurostat 2023, con un impatto totale di -10 miliardi di euro sulla bilancia commerciale manifatturiera)
Il settore farmaceutico upstream è un esempio tipico di un’area in cui l’Europa mantiene una forte conoscenza e posizione


Dati sul commercio di prodotti chimici Cefic.
L’industria chimica è essenziale per raggiungere la neutralità climatica, sia in termini di emissioni dirette che di soluzioni per altri settori. La maggior parte delle tecnologie evidenziate nel Net Zero Industry Act (NZIA) dipende dalla chimica e dall’innovazione chimica per prosperare.
cità produttiva dell’UE27 oscilla intorno al 75%, ben al di sotto della media storica. L’Europa, quindi, mantiene un saldo commerciale positivo ma le esportazioni non crescono allo stesso ritmo del mercato globale.
Lo sviluppo di prodotti innovativi: il caso dell’industria farmaceutica Non solo, l’industria chimica è determinante per lo sviluppo di prodotti innovativi in diversi settori, tra questi le batterie per veicoli elettrici, carburanti a basse emissioni, energia rinnovabile e il farmaceutico. Le sostanze chimiche sono fondamentali nella produzione di principi attivi farmaceutici (API), che sono composti fondamentali utilizzati nei medicinali, inoltre, sviluppa polimeri avanzati per i sistemi di rilascio dei farmaci, migliorando l’efficienza dell’assorbimento del farmaco nell’organismo. Inoltre, materiali specializzati vengono impiegati nella produzione di impianti e confezionamenti specificamente progettati per proteggere i farmaci e preservarne la potenza, garantendo così l’efficacia e la sicurezza dei prodotti farmaceutici.
Il settore dei prodotti chimici farmaceutici è un esempio della forte interconnessione dell’industria. Si tratta di una catena del valore altamente frammentata, in cui atto-
ri specializzati partecipano alla produzione di intermedi e principi attivi farmaceutici (API). Dall’upstream al downstream, sono necessari collegamenti strategici per garantire flessibilità, sicurezza ed efficienza della catena del valore farmaceutica. Dalle sostanze chimiche di base, la catena del valore farmaceutica avanza verso composti intermedi che possono richiedere oltre dieci fasi di lavorazione e il coinvolgimento di diverse CDMO. Ogni CDMO è specializzata in percorsi chimici e tecnologici specifici. Alcuni passaggi, in particolare quelli di maggiore rilevanza strategica, sono gestiti dalle aziende farmaceutiche e da CDMO specifiche in Europa, mentre le fasi più standardizzate sono già esternalizzate a livello globale (soprattutto in Cina e India). Le principali aziende farmaceutiche si occupano della distribuzione e delle attività di marketing, di parte della produzione (in particolare la fabbricazione dei farmaci finiti) e di una parte della ricerca e sviluppo.
Il divario di competitività: i segmenti downstream e upstream L’industria chimica europea ha generato circa 165 miliardi di euro di valore aggiunto nel 2023, all’interno di una catena del valore complessa e diversificata.
A monte della catena del valore, il livello più esigente in termini di energia e capitale, sono stati analizzati tre segmenti: etilene/propilene (prodotti chimici organici), ammoniaca (prodotto chimico inorganico), cloro-alcali (prodotti chimici inorganici). A livello di polimeri e intermedi, sono stati selezionati tre segmenti: siliconi, PVC, direttamente legato alla catena del valore del cloro-alcali, biopolimeri.
A valle della catena del valore, sono stati analizzati tre mercati, ciascuno dei quali include la produzione e combinazione di diversi ingredienti: cura della persona, salute e nutrizione animale, settore farmaceutico.
Il segmento downstream include una rete molto densa di aziende chimiche, grandi e piccole, in Europa. In generale, i prodotti chimici downstream hanno un valore più elevato. Possono essere molecole complesse prodotte attraverso reazioni in piccoli reattori a lotti (per esempio farmaci specialistici) e/o formulazioni complesse con ingredienti miscelati (per esempio cosmetici formulati o vernici e rivestimenti). Questi prodotti sono generalmente più esigenti in termini di manodopera e meno dipendenti dall’energia e dal capitale. L’industria chimica europea è ben posizionata nella maggior parte dei
Fonti: Eurostat, European Commission, Advancy analysis s s s
degli asset e la produttività con HxGN EAM!
| Scopri di più su

s s s

settori verticali della chimica downstream. Tre mercati specifici mostrano sia la forza dell’Europa che le sfide future: additivi per mangimi, cura della persona e settore farmaceutico, dove l’Europa mantiene un forte posizionamento in aree specializzate della catena del valore, ma è sempre più dipendente dalle importazioni per le fasi più semplici della produzione e, in misura crescente, anche per quelle più complesse.
In conclusione, per il settore upstream è forte l’impatto della competitività energetica e delle nuove regolamentazioni. Per il settore downstream, invece, emergono i rischi di esternalizzare eccessivamente la produzione, con conseguenti carenze nelle catene del valore integrate e nelle politiche industriali.
Le aziende chimiche europee si trovano a competere su un campo di gioco non equo rispetto ad altre regioni, che ricevono più sostegno e affrontano minori oneri amministrativi. Queste politiche aggressive di altri paesi mettono ulteriormente sotto pressione la competitività dell’industria chimica europea.
Il settore farmaceutico upstream
Il settore farmaceutico upstream, ovvero la produzione di intermedi e precursori dei prodotti farma-
ceutici, è un esempio tipico di un’area in cui l’Europa mantiene una forte conoscenza e posizione. Tuttavia, con l’esternalizzazione delle fasi meno complesse, nel tempo l’Europa ha perso terreno e competenze, trovandosi ora ad affrontare una crescente concorrenza nelle fasi più complesse e problemi critici di approvvigionamento.
L’Europa è ancora presente nella produzione di Principi Attivi Farmaceutici (API) e Forme di Dosaggio Finite (FDF), meno sensibili alla concorrenza sui prezzi e sempre più guidate dall’innovazione. Nonostante ciò, una parte significativa delle prime fasi della catena del valore si è spostata in Asia.
Il mercato globale di piccole molecole, API e intermedi, è stato valutato a circa 60 miliardi di euro nel 2023. Negli ultimi dieci anni, una trasformazione strutturale ha spostato una quota considerevole della produzione di API e intermedi di piccole molecole verso l’Asia, in particolare Cina e India, per ottimizzare i costi di produzione. Di conseguenza, oggi l’Europa è la seconda regione globale in questo mercato, dietro l’Asia.
Questo spostamento ha reso l’Europa fortemente dipendente dalle importazioni, con oltre il 74% della
catena del valore farmaceutica che dipende da fornitori non europei. La rilocalizzazione della produzione in regioni più competitive sui costi ha ridotto il costo complessivo degli API, ma ha anche introdotto rischi significativi:
• Ritardi nelle forniture: tempi di consegna più lunghi a causa della distanza geografica e delle catene di approvvigionamento complesse.
• Rischi normativi: chiusure improvvise per mancata conformità alle Good Manufacturing Practices (GMP) dopo le ispezioni.
• Interruzioni nella catena di approvvigionamento: vulnerabilità alle chiusure imposte dai governi, in particolare per cambiamenti normativi o ambientali nei paesi produttori. Questi rischi evidenziano la fragilità della catena di approvvigionamento europea per API e intermedi, essenziale per garantire la produzione continua di farmaci e l’indipendenza strategica dell’Europa.
L’estrema dipendenza dalle importazioni è evidente soprattutto nelle fasi upstream e più standardizzate della catena del valore farmaceutica:
• Regulatory Starting Materials (RSMs): le sostanze chimiche iniziali utilizzate nella produzione di API devono rispettare gli standard GMP. La stragrande maggioranza degli RSM è
s s s






Quota di mercato europea nel mercato farmaceutico di base.
Fonti: Company data, IQVIA, Advancy s s s

importata da regioni più competitive sui costi, in particolare Cina e India.
• Intermedi conformi agli standard GMP: negli ultimi anni, l’Europa ha importato sempre più intermedi da fornitori asiatici conformi ai regolamenti, poiché queste regioni hanno rapidamente sviluppato le competenze necessarie.
• API semplici: le molecole semplici provengono principalmente dall’Asia per motivi di costo, mentre l’Europa mantiene capacità di produzione locale per API brevettati e più complessi, dove l’innovazione, la conoscenza normativa e la vicinanza al mercato rappresentano ancora vantaggi competitivi.

Negli ultimi anni, in Europa oltre 800 molecole hanno subito carenze a causa di problemi nella catena di approvvigionamento, legati all’assenza di una strategia industriale completa rispetto ad altre regioni globali. Questo ha reso l’Europa fortemente dipendente dalla produzione esterna e dalle politiche di paesi terzi.
I prossimi passi per cogliere nuove occasioni di crescita
Come evidenziato dal rapporto, l’industria chimica europea si trova a un bivio. Ha subito un rallentamento netto, più marcato rispetto all’economia generale, a causa della ri-
duzione della domanda e della perdita di competitività. La tendenza alla sovraccapacità strutturale, dovuta a investimenti eccessivi, si riflette nel basso tasso di utilizzo dell’industria, che negli ultimi nove trimestri è stato solo del 75%. La profondità e la durata di questo rallentamento sono senza precedenti. La competitività dell’Europa è compromessa dai costi elevati di energia e materie prime rispetto ai concorrenti globali, nonché dall’aumento dei costi normativi e ambientali. Inoltre, il contesto degli investimenti è sempre più complesso e l’incertezza sulla domanda cresce. Senza misure proattive per creare un ambiente favorevole alle imprese, che consenta loro di sfruttare i propri punti di forza e raggiungere gli obiettivi europei, il settore chimico rischia di perdere il proprio vantaggio competitivo rispetto a Stati Uniti, Cina e altre regioni, in particolare nei settori upstream e polimeri & intermedi. Eventuali interruzioni nelle fasi upstream e nei polimeri potrebbero avere un effetto domino sulla filiera a valle, con conseguenze come: meno investimenti, minore affidabilità della fornitura per la riduzione dei fornitori, maggiore dipendenza dalle importazioni e una forza lavoro me -
no qualificata.
L’incertezza attuale ha spinto mol te aziende chimiche a rivedere la propria presenza industriale. Per il biennio 2023-2024 sono già stati annunciati piani di chiusura per cir ca 11 milioni di tonnellate di capa cità produttiva in Europa, con l’im patto su 21 grandi impianti. Questo rappresenta una perdita del 2-4% dell’industria chimica e dei polime ri europea.
L’industria chimica europea af fronta rischi, ma anche opportuni tà. Nel breve termine, il ripristi no della competitività e il sostegno alla ripresa della domanda sono fondamentali per mantenere il proprio posizionamento e cogliere nuove occasioni di crescita nel medio termine. Senza misure politiche urgenti e una ripresa del mercato, si stima che fino all’8% del valore aggiunto del settore chimico possa essere ulteriormente compromesso.

Allo stesso tempo, il settore chimico europeo è essenziale per l’innovazione e la sostenibilità, contribuendo alla decarbonizzazione e alla transizione verso un’economia circolare. Se riuscirà a riconquistare competitività, potrà continuare a sfruttare queste opportunità nel medio termine.


Specializzata nella distribuzione di materie chimiche, OQEMA è consapevole di quanto sia fondamentale il suo ruolo nei settori farmaceutico e nutraceutico. L’industria Life Science, che include queste due aree cruciali, è in costante evoluzione, e l’azienda è pronta a guidare questa trasformazione. Le nuove tecnologie, la crescente attenzione alla sostenibilità e l’adattamento a una rete di approvvigionamento globalizzata sono solo alcune delle dinamiche che plasmeranno il futuro della distribuzione. La domanda di soluzioni su misura sta aumentando, in particolare nel campo dei nutraceutici, dove la formulazione dei prodotti deve rispondere a bisogni nutrizionali sempre più specifici. Per questo è oggi necessario affidarsi a fornitori strategici di materie prime. Con OQEMA Italia c’è la possibilità di valutare soluzioni personalizzate che supportino lo sviluppo di nuovi prodotti, con una consulenza tecnica che va oltre la semplice fornitura ed è in grado di adattarsi alle specifiche necessità dei clienti e alle tendenze di mercato.
Un aspetto fondamentale è la conformità alle normative, che regolano la produzione e la distribuzione di materie chimiche nel settore far-

maceutico e nutraceutico. L’azienda, con quartier generale ad Assago (MI), ha come missione la garanzia che tutte le materie prime distribuite siano conformi agli standard internazionali, non solo per quanto riguarda la qualità e la sicurezza, ma anche per le normative ambientali. Per questo motivo, vengono adottate procedure rigorose di controllo qualità e certificazioni che permettono di soddisfare pienamente i requisiti legali, assicurando ai clienti prodotti sicuri e di alta qualità.
La globalizzazione ha reso le reti di approvvigionamento più complesse, ma anche più interconnesse. Gestire flussi di materie prime
Antares Vision Group fornirà un sistema di tracciabilità dei farmaci alla Guinea-Bissau
Antares Vision Group, multinazionale italiana esperta nella tracciabilità e nel controllo qualità, ha firmato un accordo con il Ministero della Salute della Guinea-Bissau, sotto la guida del Ministro Pedro Tipote, per la fornitura delle soluzioni rfxcel Traceability Hub (rTH) e rfxcel Government (rGOV). L’iniziativa sosterrà la trasformazione digitale del Paese nella gestione della Sanità pubblica, migliorando la tracciabilità dei farmaci, la conformità alle normative e l’integrità della supply chain.
Nell’ambito del contratto pluriennale siglato, Antares Vision Group istituirà un sistema di tracciabilità e verifica dei farmaci a livello nazionale, garantendo più visibilità e sicurezza lungo la catena di fornitura. La registrazione obbligatoria per tutti i partecipanti alla supply chain prenderà il via a partire dalla metà del 2025.
Con questa iniziativa, la Guinea-Bissau istituisce il primo Sistema nazionale di verifica e autenticazione dei farmaci endto-end nell’Africa occidentale. Questa so-

provenienti da diverse parti del mondo richiede oggi una logistica sofisticata e una pianificazione precisa. Per OQEMA, l’efficienza della supply chain è fondamentale. La capacità di garantire una consegna tempestiva e sicura delle materie chimiche rende la multinazionale un partner indispensabile per le aziende farmaceutiche e nutraceutiche che intendono ottimizzare i processi produttivi.
La trasformazione del settore offre nell’immediato futuro grandi opportunità. La digitalizzazione, la sostenibilità, la personalizzazione e l’innovazione nella logistica sono solo alcuni degli aspetti che stanno cambiando il modo di distribuire materie chimiche. OQEMA è pronta ad affrontare queste sfide e a proporsi come un partner affidabile, mantenendo al centro delle attività la qualità, la sicurezza e l’attenzione alle normative.
luzione permetterà: il miglioramento della sicurezza e dell’affidabilità della catena di approvvigionamento farmaceutico; la trasmissione di informazioni in tempo reale agli enti regolatori per monitorare la disponibilità e la distribuzione dei farmaci; l’accesso da parte del paziente alla verifica digitale dei prodotti e ai foglietti illustrativi, promuovendo la trasparenza e la fiducia nell’assistenza sanitaria.
“Antares Vision Group è orgogliosa di guidare questa trasformazione e rimane impegnata a fornire soluzioni digitali per le scienze della vita nella regione”, dichiara Gianluca Mazzantini, Ceo e direttore generale di Antares Vision Group.
agisca senza ritardi”
Un anno dopo il lancio della Dichiarazione di Anversa, 400 esponenti dell’industria si sono riuniti ad Anversa per discutere il Clean Industrial Deal appena approvato, insieme alla presidente della Commissione, Ursula von der Leyen. L’industria chiede ora ai capi di stato dell’UE di agire con urgenza in tutti i paesi membri, senza ritardi.
“Apprezziamo il fatto che la presidente della Commissione abbia dedicato del tempo per presentarci il Clean Industrial Deal”, commenta Ilham Kadri, presidente di ICCA e Cefic, e Ceo di Syensqo. “Dobbiamo trasformare l’ambizione dell’Europa ad ‘essere’ in una determinazione a ‘fare’. Ogni giorno, l’Europa si allontana dai suoi obiettivi e sta perdendo posti di lavoro di qualità per le generazioni attuali e future. In questi tempi turbolenti, abbiamo
bisogno di un’azione coraggiosa da parte della leadership europea”.
Le industrie europee stanno affrontando sfide storiche: calo della domanda, investimenti bloccati, riduzione della capacità produttiva e prezzi del gas nell’UE da 4 a 5 volte superiori rispetto a quelli dei concorrenti. Per l’industria chimica – “l’industria delle industrie” – un recente studio di Cefic ha evidenziato la gravità della situazione, con oltre 11 milioni di tonnellate di capacità annunciate in chiusura tra il 2023 e il 2024, coinvolgendo 21 grandi siti produttivi.

Per superare queste sfide, nel febbraio 2024, 73 leader aziendali hanno presentato alla presidente della Commissione la Dichiarazione di Anversa, che definisce 10 azioni concrete per ristabilire la redditività degli investimenti, attuare le ambizioni di sostenibilità e salvaguardare posti di lavoro di qualità nel continente. Ad oggi, è stata firmata da oltre 1300 sostenitori.


Procedono le attività di messa a punto del pacchetto di revisione della legislazione farmaceutica dell’Ue.
Le modifiche ai testi della Commissione proposte dal Parlamento sono già state approvate in prima lettura ad aprile 2024, mentre si è ancora in attesa dell’approvazione delle modifiche in prima lettura del Consiglio europeo.
di Filippo Neri
Gli ultimi aggiornamenti ufficiali sul processo per la revisione della legislazione Ue in campo farmaceutico sono quelli del Consiglio europeo “Occupazione, politica sociale, salute e consumatori” (EPSCO) del 3 dicembre 2024. La proposta di Critical Medicines Act, an-
nunciata a marzo, si pone in modo complementare alla revisione della legislazione farmaceutica e la tratteremo in modo più approfondito sui prossimi numeri di ICF. I ministri dei vari paesi UE che hanno partecipato ai lavori hanno preso visione del Progress report sui progressi fatti nella revisione pubblicato dal Consiglio il 18 novembre 2024 [1]. Ne riassumiamo i contenuti principali.
Come procede il pacchetto europeo sulla farmaceutica
Il Progress report del Consiglio europeo fa il punto sulle valutazioni in corso delle proposte di nuova direttiva e regolamento in tema di sviluppo e autorizzazione dei medicinali (il cosiddetto “pacchetto farmaceutico”, box 1), pubblicate dalla Commissione europea il 26 aprile 2023.

Pharmaceutical Strategy for Europe - 25 novembre 2020
Basata su quattro pilastri: 1) accesso a medicinali economicamente sostenibili e attenzione ai bisogni medici insoddisfatti; 2) supporto all’innovazione, competitività e sostenibilità del comparto farmaceutico UE; 3) miglioramento dei meccanismi di preparazione e risposta, con attenzione alle supply chain e alle carenze di medicinali; 4) forte presenza della voce europea a livello globale, con promozione di standard elevati di qualità, sicurezza ed efficacia.
Proposta di regolamento 2023/0131(COD) - 26 aprile 2023
Stabilisce le procedure dell’Unione per l’autorizzazione e la sorveglianza dei medicinali per uso umano, definisce le norme che disciplinano l’Agenzia europea per i medicinali, modifica i regolamenti (CE) 1394/2007 (terapie avanzate) e (UE) 536/2014 (sperimentazione clinica di medicinali per uso umano) e abroga i regolamenti (CE) 726/2004 (procedure comunitarie per l’autorizzazione e la sorveglianza dei medicinali per uso umano e vete-
Più in particolare, il nuovo regolamento è volto ad aggiornare la normativa europea in tema di autorizzazione e supervisione dei medicinali per uso umano, comprese le norme che regolano il funzionamento dell’Agenzia europea dei medicinali. La revisione della direttiva, invece, è intesa aggiornare il codice europeo sullo sviluppo dei medicinali per uso umano (box 2). Obiettivo portante dell’intera opera di revisione della legislazione farmaceutica è giungere a una semplificazione complessiva e all’adattamento dell’attuale normativa in campo regolatorio, continuando ad assicurare la qualità, sicurezza ed efficacia dei medicinali e permettendo una maggiore armonizzazione del mercato interno europeo. Le proposte della Commissione puntavano, nel solco delle più ampie politiche europee, anche a migliorare l’innovazione e la competitività del comparto farmaceutico grazie a una maggiore flessibilità, riduzione dell’impatto
rinario e istituzione di EMA), (CE) 141/2000 (medicinali orfani) e (CE) 1901/2006 (medicinali per uso pediatrico).
Proposta di direttiva 2023/0132 (COD) - 26 aprile 2023
Codice dell’Unione relativo ai medicinali per uso umano, con abrogazione delle direttive 2001/83/CE (precedente codice comunitario) e 2009/35/CE (sostanze che possono essere aggiunte ai medicinali ai fini della loro colorazione).
Comunicazione della Commissione COM(2023) 190 final - 26 aprile 2023
Riforma della legislazione farmaceutica e misure volte a contrastare la resistenza antimicrobica.
Raccomandazione del Consiglio COM (2023) 191 final - 26 aprile 2023
Potenziamento delle azioni dell’UE per combattere la resistenza antimicrobica con un approccio “One Health”. (fonte: Commissione europea)
ambientale delle produzioni, miglioramento dell’accesso dei pazienti a medicinali innovativi ed economicamente sostenibili e maggiori garanzie per la sicurezza delle catene di fornitura. Il processo di valutazione delle proposte di direttiva e regolamento da parte del Parlamento europeo ha già visto l’approvazione della posizione finale contenuta nel rapporto del comitato Ambiente, Salute pubblica e Sicurezza alimentare (ENVI), votata a grande maggioranza dall’assemblea plenaria in prima lettura già il 10 aprile 2024. Tra le principali modifiche apportate dal Parlamento europeo figura la richiesta di portare la durata minima del periodo di protezione dei dati per i nuovi medicinali a sette anni e mezzo (dai sei proposti dalla Commissione), più due anni di protezione di mercato. L’esclusività di mercato potrebbe arrivare fino a 11 anni per i farmaci rari e orfani rivolti a “elevati bisogni medici insoddisfatti” [2].
Più indietro è il processo di revisione da parte degli stati membri riuniti nel Consiglio europeo, che ha visto finora l’adozione di un’opinione da parte del Comitato economico e sociale europeo (EESC) nell’ottobre 2023, e di quelle provenienti da varie istituzioni di diversi paesi europei, tra cui la Camera dei Deputati e il Senato per l’Italia. Nel momento in cui scriviamo, non si è ancora giunti all’adozione delle proposte di modifica in prima lettura da parte del Consiglio europeo. Le varie presidenze di turno che si sono succedute negli ultimi semestri hanno organizzato varie riunioni del Gruppo di lavoro “Prodotti farmaceutici e dispositivi medici” per esaminare le proposte della Commissione ed elaborare le proprie modifiche.
Tra i temi più caldi al centro delle discussioni, come riporta il Progress report, figurano i “cluster di incentivi”, gli incentivi per i farmaci pediatrici e orfani, le cosiddette “regulatory sand-
2 - Alcuni atti già approvati che s’interfacciano con il pacchetto farmaceutico
- Comunicazione della Commissione su come affrontare le carenze di medicinali nell’UE - COM(2023) 672 final, 23 ottobre 2023. Le linee guida di EMA sulla prevenzione, mitigazione e gestione delle carenze sono disponibili sulla pagina web dedicata dell’Agenzia.
- Regolamento delegato (UE) 1701/2024, in vigore dal 1 gennaio 2025, che modifica il Regolamento 1234/2008/ CE relativo all’esame delle variazioni dei termini delle AIC di medicinali per uso umano (regolamento “Variazioni”).
- Regolamento (EU) 2024/568, in vigore dal primo gennaio 2025, che stabilisce il quadro legale per il pagamento delle tariffe per le procedure regolatorie applicate dall’Agenzia europea dei medicinali (regolamento “Tariffe”).
Il Progress report del Consiglio europeo fa il punto sulle valutazioni in corso delle proposte di nuova direttiva in tema di sviluppo e autorizzazione dei medicinali
boxes” e altri adattamenti del quadro regolatorio. Altri macrotemi al centro degli incontri organizzati dall’ultima presidenza ungherese, conclusasi a fine 2024, hanno compreso tra gli altri anche la revisione delle norme relative alle autorizzazioni all’immissione in commercio (AIC), sia a livello nazionale che centralizzato, e le autorizzazioni temporanee necessarie per gestire le emergenze sanitarie (TEMA).
Le osservazioni emerse da questo confronto sono state inserite nel quinto testo di compromesso sulla proposta di revisione, preparato a novembre 2024 dalla presidenza ungherese del Consiglio e che copre circa i due terzi degli articoli facenti complessivamente parte del pacchetto farmaceutico.

Le principali modifiche apportate sotto la presidenza ungherese Secondo quanto riportato dal Progress report, il quinto testo di compromesso del Consiglio europeo ha puntato ad adattare la modulazione della prote-
- Lancio della Critical Medicines Alliance, che riunisce gli stakeholder industriali, da parte della Health Emergency Preparedness and Response Authority (HERA), 24 aprile 2024.
- Adozione da parte del Consiglio europeo dell’Internal Market Emergency and Resilience Act (IMERA), 26 settembre 2024.
- Regolamento (UE) 2024/2865, revisione del regolamento (CE) 1272/2008 sulla classificazione, etichettatura e imballaggio delle sostanze chimiche e delle miscele, 23 ottobre 2024 (in vigore dal 10 dicembre 2024).
- Pre-lancio della European Shortages Monitoring Platform (ESMP) da parte di EMA, 28 novembre 2024, seguita dal lancio della versione completa il 2 febbraio 2025. (fonti: Commissione europea, EMA)
zione dei dati per meglio supportare l’innovazione basata sugli effettivi bisogni di salute, con contemporanea riduzione della complessità del sistema proposto e con un limite temporale per il periodo di protezione.
In tema di sicurezza delle forniture, è stata introdotta la possibilità per gli stati membri di richiedere ai titolari AIC di rendere disponibili in modo continuativo i medicinali sui propri mercati. Tale proposta prevede anche sanzioni e la non applicazione della protezione di mercato nel caso in cui tali richieste non trovino risposta da parte delle aziende produttrici. La presidenza ungherese ha anche lavorato per migliorare la trasparenza sui periodi di protezione dei dati e del mercato e per chiarire le condizioni specifiche che si applicano ai prodotti per bisogni medici insoddisfatti (con rimozione del concetto di “elevato bisogno medico disatteso” proposto dalla Commissione), nonché quelle per l’applicazione della cosiddetta Bolar exemption (esenzione dalla protezione dei diritti di proprietà intellettuale che permet-
te ai produttori di farmaci generici e biosimilari di avviare con un anticipo di alcuni mesi le attività necessarie per sviluppare e autorizzare nuovi prodotti, in vista di un lancio al day-1 di scadenza dell’esclusiva di mercato).
Sono state anche introdotte misure per monitorare l’effettiva efficacia dei voucher per lo sviluppo di antimicrobici prioritari previsti dalla proposta della Commissione europea. Proposta centrata sul concetto di Estensione trasferibile dell’esclusività (TEE), uno dei punti più dibattuti del pacchetto farmaceutico, secondo cui le aziende che sviluppino nuovi agenti antimicrobici potrebbero usufruire di un voucher che estenda il periodo di esclusività di uno a scelta degli altri farmaci dell’azienda fino a nove-dodici mesi. Secondo la proposta della Commissione, il voucher potrebbe anche essere ceduto a un’altra azienda, così da remunerare la ricerca nei nuovi antimicrobici. In tema di autorizzazioni regolatorie, la revisione del pacchetto farmaceutico finora compiuta dal Consiglio europeo ha puntato a chiarire vari aspetti






5211 Jointex® Red
Giuntura in lastra di alta qualità, costituita da PTFE caricato con quarzo e pigmentato. Materiale innovativo sostitutivo delle tenute in amianto e dei convenzionali prodotti in PTFE. Il suo speciale processo produttivo fa sì che le guarnizioni Jointex® abbiano un’eccellente resistenza al creep e capacità di tenuta in un ampio range di temperatura e pressione. Altre caratteristiche sono l’ottima resistenza chimica e una buona compressione, resiste alle deformazioni e non è soggetto a invecchiamento.
5212 Jointex® Blue
Giuntura in lastra di alta qualità, costituita da ptfe vergine caricato con fibra di vetro e pigmentato. Materiale innovativo ottimo sostitutivo delle tenute in amianto e dei convenzionali prodotti in PTFE. Il materiale presenta valide proprietà meccaniche che permettono di realizzare e conservare nel tempo una tenuta elevata. Ha un’ottima resistenza chimica e una buona compressione, non è soggetto a invecchiamento.
5213 Jointex® White
Giuntura in lastra di alta qualità, costituita da PTFE modificato caricato al 25% con fibre di vetro. Materiale innovativo ottimo sostitutivo delle tenute in amianto e dei convenzionali prodotti in PTFE. Il materiale presenta valide proprietà meccaniche che permettono di realizzare e conservare nel tempo una tenuta elevata. Ha un’ottima resistenza chimica e una buona compressione, non è soggetto a invecchiamento.
5700 Guarnizioni a busta in PTFE
Sono costituite da un involucro, comunemente chiamato busta, che può essere realizzato sia nel più comune PTFE vergine che in PTFE caricato (silice, grafite o altro). Lo spessore della busta è abitualmente di 0,6 mm; ciò rende la guarnizione particolarmente adatta per l’industria chimica, farmaceutica e alimentare. L’involucro può essere fornito in diverse realizzazioni. L’inserto interno può essere scelto tra giunture in fibra aramidica, grafite, tessuto con fibra ceramica, elastomeri, PTFE modificati, anelli in AISI 316 ondulato e, a richiesta, alette di massa a terra.
I lavori del Consiglio EPSCO del 3 dicembre 2024 hanno visto i ministri impegnati anche nel confronto sull’Unione europea della salute, alla luce delle raccomandazioni contenute nel rapporto Draghi sulla competitività dell’UE del settembre 2024. Già a giugno 2024 il Consiglio aveva pubblicato le proprie conclusioni sulla European Health Union, con richiesta alla Commissione di mantenere la salute tra le priorità del nuovo mandato. Tali conclusioni sono state ora comparate con le raccomandazioni del rapporto Draghi, con valutazione dell’impatto potenziale sia a livello di sistemi sanitari nazionali che di Unione europea della salute. Sono anche state discusse le modalità con cui gli stati membri e la Commissione potrebbero coor-
La legislazione farmaceutica punta a una semplificazione complessiva e all’adattamento dell’attuale normativa, continuando ad assicurare la qualità, sicurezza ed efficacia dei medicinali e permettendo una maggiore armonizzazione del mercato interno europeo
s s s
mirati a semplificare le procedure per i farmaci innovativi e per quelli generici e biosimilari. Altri punti considerati includono la digitalizzazione dei processi regolatori, gli studi clinici con organismi geneticamente modificati e l’allineamento del regime delle autorizzazioni, comprese quelle condizionali e temporanee per le emergenze.
Le autorizzazioni TEMA, in particolare, dovrebbero venire prontamente sostituite con un’autorizzazione completa o condizionale non appena siano disponibili sufficienti dati a supporto. È stato rivisto anche il testo riguardante procedure nazionali di autorizzazione, con inclusione, tra gli altri, di disposizioni sulle traduzioni delle infor-

dinare l’implementazione delle raccomandazioni. La salute cardiovascolare sarà l’oggetto delle nuove iniziative europee volte a migliorare la prevenzione, diagnosi precoce, trattamento e riabilitazione delle malattie cardiache (che costituiscono una delle principali cause di morte nell’UE), sul modello di quanto già fatto con lo Europe’s Beating Cancer Plan. Il Consiglio EPSCO ha approvato le sue conclusioni a riguardo, con richiesta alla Commissione di rafforzare le attività di prevenzione primaria, condivisione delle buone pratiche e alfabetizzazione sanitaria.
Il Consiglio ha anche approvato le conclusioni per aumentare le donazioni di organi e i trapianti.
(fonte: Consiglio europeo)
mazioni sul prodotto e chiarimenti sulle condizioni in cui mancanze nel condurre la valutazione di rischio ambientale (ERA), obbligatoria nella proposta della Commissione, potrebbe compromettere in parte o in tutto la concessione di un’autorizzazione nazionale. Il tema della valutazione del rischio ambientale rientra anche nelle modifiche proposte per le autorizzazioni post-marketing, le restrizioni e le variazioni. In particolare, il Consiglio ha chiarito che l’ERA non fa parte del sistema di gestione del rischio. Il problema delle carenze di medicinali è stato affrontato dalla presidenza ungherese introducendo nel testo proposto chiarimenti sulle deroghe possibili e migliorando la definizione dello sco-
po dei Piani di prevenzione delle carenze (SPP), prevenendo al contempo una frammentazione degli approcci a livello nazionale. I piani di prevenzione delle carenze, suggerisce il testo di compromesso, dovrebbero poter venire applicati solo a quei medicinali identificati come critici da parte delle autorità nazionali competenti, sulla base della metodologia europea. Per gli altri medicinali dovrebbero venire applicate le raccomandazioni del Medicines Shortages Steering Group (MSSG). Più in particolare, dove il ricorso a un piano di prevenzione non sia necessario, il titolare AIC dovrebbe condurre valutazioni del rischio regolari e documentate a livello delle catene di fornitura.
[1] Council of the European Union, Pharmaceutical package […] - Progress report, 18 November 2024, https://data. consilium.europa.eu/doc/document/ST-14955-2024-INIT/ en/pdf
[2] European Parliament, Legislative Train 12.2024 - Revision of the EU’s basic pharmaceutical legislation, including medicines for children and for rare diseases - Q4 2022, https://www.europarl.europa.eu/legislative-train/carriage/revision-of-the-pharmaceutical-legislation/report?sid=8701


La nostra passione per la setacciatura nasce al termine degli anni ’70
Ci caratterizzano da sempre l’intuizione e l’entusiasmo, grazie ai quali siamo riusciti ad affermarci nel mondo della setacciatura.
La nostra struttura è contraddistinta da una forte flessibilità, la quale ci permette di ottenere significativi immediati risultati
Il contatto diretto con le problematiche del cliente stimola costantemente la nostra progettualità
Offriamo una garanzia assoluta di qualità, e garantiamo da sempre il miglior funzionamento del vibrovaglio realizzato ad personam
Siamo un’azienda 100% Made in Italy; ogni nostro vibrovaglio viene interamente realizzato all’interno della nostra azienda.
I nostri vibrovagli sono in grado di affrontare setacciature molto difficoltose, e portate orarie elevate, grazie agli speciali motovibratori installati, progettati per funzionare in continuo 24 ore su 24 per 365 giorni l’anno.

EMILOS srl
Via della Costituzione, 6 42025 Cavriago (RE) - Italy
Tel. 0522 575010
E-mail: info@emilos.it www.emilos.it



Il neo-ad (a sinistra) con il presidente
Maurizio Marchesini
Marchesini Group ha nominato un nuovo amministratore delegato, l’ingegner Valerio Soli, che è entrato in carico lo scorso 20 gennaio. Soli, bolognese, classe 1964, laurea in Ingegneria meccanica all’Universi-
tà di Bologna, proviene da una lunga esperienza al Gruppo Coesia e da oltre 5 anni ricopre il ruolo di presidente di Ipack Ima, manifestazione di riferimento dedicata al confezionamento, ai materiali e alle tecnologie. Vanta quindi una significativa conoscenza del settore del packaging e del mercato internazionale.
“Forte di una pluriennale esperienza nel mondo delle macchine automatiche e dei processi, siamo certi che l’ingegner Valerio Soli supporterà e aiuterà la nostra crescita, nel pieno rispetto dei valori che da sempre contraddistinguono la nostra storia d’impresa”, commenta Maurizio Marchesini, presidente di Marchesini Group.
“Non abbiamo mai avuto dubbi sulla necessità di un Ceo esterno alla famiglia, capace di portare freschezza, competenze, visione. Nel 2024, Mar-
Steriline, azienda altamente specializzata nella produzione di linee complete per il confezionamento asettico di prodotti iniettabili e oftalmici destinate alle aziende farmaceutiche su scala globale, ha nominato Paolo Pozzi come Chief Service Officer (CSeO), con l’obiettivo di guidare e accrescere l’area After Sales.
Pozzi, professionista nel settore degli impianti per il confezionamento e gli imballaggi, vanta un’esperienza più che ventennale durante la quale ha ricoperto differenti ruoli con responsabilità crescenti. Dopo qualche anno trascorso nella posizione di responsabile R&D su nuovi materiali e processi, dal 2005 inizia a gestire teams di Customer Service, prima nel settore della produzione del-
la carta, poi nel mondo del packaging farmaceutico presso importanti aziende multinazionali, con focus su aspetti sia operativi che di cultura aziendale, ottenendo miglioramenti significativi, misurabili nei numeri, a livello di reattività e proattività del servizio post-vendita.
“L’ingresso di Paolo Pozzi in azienda rientra nella nostra strategia di ampliare il team manageriale, nell’ottica di continuare il nostro percorso di crescita, così come era stato anticipato lo scorso autunno, quando era stato ufficializzato il nuovo assetto dirigenziale”, afferma Ilaria Fumagalli, Ceo di Steriline. “Siamo molto contenti che Paolo sia entrato a far parte del nostro team, la sua esperienza e le sue capacità
chesini Group ha confermato un andamento stabilmente positivo, con una chiusura dell’ordinato in crescita e una quota di export ancora superiore all’80%.
Tendenze che ci fanno pensare a buone basi per il 2025”, conclude il presidente Marchesini.
“Sono felice di entrare a far parte della grande famiglia Marchesini, sia perché si tratta di una realtà imprenditoriale d’eccellenza, sia per i valori che la identificano, nei quali mi riconosco appieno” sottolinea Soli. “Nel mio primo giorno, ho avuto la possibilità d’incontrare circa 60 ragazzi e ragazze neoassunti negli ultimi mesi, in occasione del loro Welcome Day in azienda. Molto bello, anche dal punto di vista simbolico, che questo nuovo capitolo sia iniziato tra i giovani, guardando al futuro insieme”.
saranno di grande aiuto per sviluppare l’area After Sales e fornire il miglior supporto alla clientela”. Laureato in fisica all’università di Bologna, sua città di origine, Poz-

zi è una persona metodica, determinata ed empatica. Gli piace viaggiare per conoscere nuove culture e, in ambito professionale, per verificare in prima persona le necessità dei clienti. “Sono molto orgoglioso di essere entrato nella famiglia Steriline, azienda che ho sempre ammirato per la sua serietà e la sua costante crescita nel corso del tempo”, afferma Pozzi. “Sono sicuro che insieme al team oggi presente e con le nuove figure che andremo a inserire, faremo un ottimo lavoro, sviluppando processi e strumenti per fornire il massimo valore ai clienti, forti delle soluzioni, delle competenze e delle tecnologie che sono alla base del successo di Steriline”.
L’Agenzia europea per le sostanze chimiche (Echa) ha aggiornato le sue statistiche annuali sui progressi nella valutazione. Tra il 2009 e il 2024, ha verificato la conformità di 15.500 registrazioni, pari al 23% di tutti i dossier di registrazione presentati e coprendo 3.200 sostanze. Per quanto riguarda le sostanze chimiche ad alto volume, registrate in quantità pari o superiori a 100 tonnellate all’anno, il 34% è stato sottoposto a verifica. Questo contribuisce a garantire che i dati sulla sicurezza delle sostanze chimiche siano aggiornati, proteggendo le persone e l’ambiente dai loro pericoli. Sulla base delle valutazioni effettuate, l’Echa ha aggiornato le sue raccomandazioni ai dichiaranti su come migliorare i propri dossier.
Nel 2024, l’Agenzia ha effettuato 313
controlli di conformità, coprendo quasi 2.000 registrazioni e riguardando 272 sostanze individuali. Questi controlli si sono concentrati sui dossier di registrazione che potevano presentare lacune nei dati. Di conseguenza, l’Echa ha inviato 208 decisioni alle aziende, richiedendo dati aggiuntivi per chiarire gli effetti a lungo termine delle sostanze chimiche sulla salute umana o sull’ambiente.
L’Echa ha inoltre esaminato 161 proposte di test e inviato 92 decisioni, affrontando i test proposti dall’industria per garantire un uso sicuro delle sostanze. Per seguire le richieste di informazioni inviate alle aziende, l’Echa verifica se le informazioni fornite siano conformi ai requisiti del regolamento Reach. Nel 2024, questa valutazione è stata conclusa per 241 sostanze. Nel 70% circa



















dei casi, le aziende hanno fornito all’Agenzia le informazioni richieste. Il restante 30% è stato segnalato agli Stati membri per l’applicazione delle misure di conformità e sarà oggetto di ulteriori verifiche.
La valutazione è un’attività congiunta dell’Echa e delle autorità degli Stati membri per garantire che l’industria rispetti i propri obblighi e fornisca i dati necessari nei dossier di registrazione. Inoltre, mira a identificare le sostanze che richiedono ulteriori interventi normativi per garantirne l’uso sicuro.
Nel 2019, l’Echa e la Commissione europea hanno adottato un piano congiunto per migliorare la conformità delle registrazioni Reach. Le attività previste dal piano si sono concluse nel 2024 e l’Echa seguirà ora le sue raccomandazioni.


La soluzione per la tua conformità agli
standard internazionali


Strumenti completi ed intuitivi per misure online e portatili di TOC, conducibilità ed ozono.
Conformità Globale e Standard Internazionali
• Rispettano le normative FDA 21 CFR Part 11, EMA Allegato 1 e 11, e farmacopee internazionali (USP, Ph. Eur., ChP, JP).
• Progettati secondo GMP, GAMP ® , ASTM, ISO, e ISPE per soddisfare le più alte aspettative del settore.
Dati Sicuri e Gestione Sempli cata
• Gestione multilivello degli utenti con rme elettroniche.
• Storico completo e metadati secondo i principi ALCOA+.
• Controllo a prova di manomissione per la sicurezza dei processi.

Swan Analitica Srl ∙ IT-16167 Genova www.swananalitica.it ∙ swan@swananalitica.it


Il Simposio AFI, che si svolgerà a Rimini dall’11 al 13 giugno 2025, ospiterà nel pomeriggio del primo giorno, dalle 15.15 alle 18.45, una sessione dedicata al tema “energia e sostenibilità” e una al tema “innovazione”.
Nella prima sessione si discuterà di nuovi adempimenti e casi reali nella sostenibilità del mondo farmaceutico, tra sfide e opportunità. La sostenibilità nel settore farmaceutico è infatti un percorso sfidante in continua evoluzione,
che richiede impegno continuo per integrarne gli aspetti nelle operazioni: dalla ricerca e sviluppo alla produzione di API e di formulati, fino alla distribuzione attraverso, il coinvolgimento di tutta la filiera.
Nell’incontro verranno approfonditi gli adempimenti normativi che le aziende farmaceutiche dovranno applicare e i tempi richiesti sia a livello nazionale che internazionale, mentre nella seconda parte della giornata saranno illustrati dei casi reali relativi ad esperienze sul
campo e verranno analizzate le metodologie impiegate e i risultati raggiunti.
La seconda sessione traccerà una linea guida e porterà alcuni esempi pratici con l’intento di gettare un po’ di luce nel complicato passaggio dal 4.0 al 5.0.
Per fare chiarezza su una serie di tecnologie oggi disponibili anche per la gestione di processi relativi al settore farmaceutico, il Gruppo di Studio “Innovazione tecnologica” ha pensato di elaborare una sin-
tetica linea guida che illustri i possibili vantaggi derivanti dall’utilizzo di alcune delle tecnologie più rilevanti, affrontando anche i temi della cyber security e data protection nonché quella di una innovativa modalità di convalida dei sistemi (GAMP 5 second edition).
Saranno presentati alcuni esempi di applicazione di nuove tecnologie e chiuderà la sessione una tavola rotonda per dibattere sugli argomenti toccati nelle presentazioni.
Koeln Parma Exhibitions, la joint venture tra Koelnmesse e Fiere di Parma, lancia la prima edizione di


Labotec, una nuova manifestazione interamente dedicata alle tecnologie, soluzioni e innovazioni per il settore dei laboratori e delle analisi che si terrà a Parma il 28 e 29 ottobre 2025.
In particolare, Labotec si propone come la prima fiera italiana interamente dedicata alla community dei laboratori, dell’analisi e della ricerca, ovvero: produttori e distributori di tecnologie e soluzioni per laboratori, startup, enti sanitari pubblici e privati, università, istituti di ricerca e laboratori dell’industria manifatturiera, ovvero aziende agroalimentari, farmaceutiche, chimiche e cosmetiche, imprese di costruzioni e attive nel comparti delle biotecnologie, life sciences, tessile, elettronica e mineraria.
L’evento nasce dalla visione strategica e dall’esperienza internazionale di KPE di creare format fieristici sempre più specializzati, con un occhio attento alle nuove sfide tecnologiche
e scientifiche che interessano l’industria globale.
La fiera offre una piattaforma unica per presentare le ultime innovazioni in ambito analitico, strumentazione tecnologica e soluzioni avanzate per il controllo qualità e la ricerca. Il concept di Labotec è stato pensato per rispondere alle esigenze sempre più specifiche del mercato e degli operatori del settore, unendo alla componente espositiva un ricco programma di workshop e incontri tematici, dove esperti e aziende leader avranno l’opportunità di presentare le tecnologie più all’avanguardia. Labotec affronterà tematiche cruciali come, per esempio, la digitalizzazione dei processi di laboratorio, l’automazione, l’intelligenza artificiale applicata alle analisi e la sostenibilità nei processi produttivi. Saranno presenti espositori nazionali e internazionali, pronti a offrire soluzioni innovative e a confrontarsi con le sfide del futuro.


È in programma il 16 aprile alla Fiera di Bergamo mcT Oil&Gas, evento verticale per i professionisti impegnati nel settore del petrolchimico, oil&gas e dell’industria di processo, sicurezza, ATEX e idrogeno. L’appuntamento si propone come una vetrina per scoprire tec-

OMC MED Energy
8-10 aprile 2025
Ravenna www.omc.it
CPHI Japan 9-11 aprile 2025 Tokyo, Giappone www.cphi.com/japan/en/home.html
Pharmap Congress
14-15 aprile 2025 Berlino, Germania www.pharmap-congress.com
International Powder and Bulk Solids 29 aprile - 1 maggio 2025 Rosemont, Illinois, Usa www.powderandbulkshow.com
Packaging Première & PCD Milan 13-15 maggio 2025
Milano www.packagingpremiere.it
nologie e soluzioni, per conoscere le prospettive del settore, con il petrolchimico e l’oil&gas che possono supportare la transizione energetica, sulla strada della sostenibilità.
La transizione energetica resta il focus principale di ogni appuntamento tecnologico legato all’energia, e la giornata mcT oil&gas è un punto d’incontro privilegiato per gli operatori del settore, per aggiornarsi, confrontarsi con personalità di spicco, entrare in contatto con i maggiori player, conoscere le migliori tecnologie e soluzioni del settore, con approfondimenti su ATEX e safety, sicurezza industriale, certificazioni, aggiornamenti normati-
vi, fino agli approfondimenti su vettori energetici innovativi come l’idrogeno.
L’evento in programma alla Fiera di Bergamo si svolge seguendo la formula consolidata che prevede, oltre alla sessione plenaria, una ricca area espositiva, in cui saranno presenti i protagonisti del settore, e una serie di workshop tecnico-applicativi curati dalle stesse aziende partecipanti, risultando un momento ideale per la formazione (CFP garantiti per gli ingegneri) e l’aggiornamento grazie ai contributi di massimi esperti, associazioni e big player del settore che offriranno scambi di esperienze e best practice, con l’obiettivo di sviluppare nuove
opportunità e business. mcT è organizzato da EIOM in collaborazione con CEI (Comitato Elettrotecnico Italiano), CTI (Comitato Termotecnico Italiano Energia e Ambiente) e con il patrocinio di ANIPLA (Associazione Nazionale Italiana per l’Automazione), GISI (Associazione Imprese Italiane di Strumentazione), ADACI (Associazione Italiana Acquisti, Supply Management), oltre al supporto della “Guida Oil&Gas”. La giornata mcT si svolgerà in concomitanza con SAVE Bergamo (automazione, strumentazione, sensori, IA, 4.0 e 5.0) e MCMA Bergamo (manutenzione industriale e asset management, IA per la manutenzione).
SPS Italia 13-15 maggio 2025 Parma www.spsitalia.it
Emerson Exchange Americas 19-22 maggio 2025
San Antonio, Usa www.emerson.com/en-us/automation/events/emerson-exchange/2025
CPHI Americas 20-22 maggio 2025 Philadelphia, Usa www.cphi.com/americas/en/home.html
Ipack-Ima 27-30 maggio 2025
Milano www.ipackima.com/it
Pharmintech 27-30 maggio 2025 Milano www.pharmintech.it
Chemspec Europe 4-5 giugno 2025 Colonia, Germania www.chemspeceurope.com
Simposio AFI 11-13 giugno 2025 Rimini simposio.afiscientifica.it
PCI Days 11-13 giugno 2025
Varsavia, Polonia www.pcidays.pl
Ilmac 16-18 settembre 2025 Basilea, Svizzera www.ilmac.ch/en
Annex 1 - One year after 18-19 settembre 2025 Firenze www.newaurameeting.it
Powtech Technopharm 23-25 settembre 2025
Norimberga, Germania www.powtech.de/en
AchemAsia 14-16 ottobre 2025 Shanghai, Cina www.achemasia.de/en
Labotec 28-29 ottobre 2025
Parma www.labotec.one/it/home/index.php
CPhI Frankfurt 28-30 ottobre 2025
Francoforte, Germania www.cphi.com
Solids Parma 11-12 febbraio 2026
Parma www.solids-parma.de/it
Appuntamenti
Emerson, player internazionale in tecnologie e software per l’automazione, organizza l’Emerson Exchange Americas, che si terrà dal 19 al 22 maggio 2025 presso l’Henry B. Gonzalez Convention Center di San Antonio, in Texas.
Il 63° Simposio AFI, il convegno che da oltre 60 anni coinvolge gli interlocutori del settore farmaceutico a livello internazionale, è stato un appuntamento importante per definire le linee guida su cui proseguire la costruzione della nuova edizione di Pharmintech powered by Ipack Ima, in programma dal 27 al 30 maggio 2025 a Fiera Milano - Rho, in concomitanza con Ipack-Ima. Nel corso dello steering committee, si sono condivise le traiettorie strategiche di Pharmintech, per delineare un percorso sempre più vocato all’internazionalità e all’alta specializzazione per offerta espositiva e incoming di visitatori e buyer.
Con il tema “Accelerating Innovation”, l’evento Emerson Exchange 2025 riunirà più di 3.100 professionisti provenienti da oltre 300 aziende e 50 paesi che giungeranno a San Antonio con l’intenzione di condividere conoscenze, esplorare nuove tecnologie e promuovere preziose connessioni nel settore. La conferenza prevede quasi 300 sessioni, con una ricca agenda che comprende roadmap per i prodotti, case study per gli utenti, forum “Meet the Experts” (incontri con gli esperti), workshop interattivi e opportunità di formazione pratica. Il portafoglio di soluzioni e servizi di Emer-
La sinergia tra Pharmintech e il mercato farmaceutico è testimoniata dal patrocinio dell’Associazione farmaceutici industria, che ha assunto il coordinamento tecnico-scientifico dei convegni di manifestazione. “La collaborazione con Pharmintech è ormai più che decennale – afferma Giorgio Bruno, presidente di AFI – con interscambio e condivisione costanti tra AFI, Simposio e l’organizzazione della fiera. Tra i focus strategici da qui ai prossimi anni spiccano la legislazione europea sul mondo farmaceutico, la digitalizzazione e la serializzazione, temi di forte attualità che proporremo tra i contenuti della fiera”.
son sarà al centro dell’attenzione, con l’irrinunciabile inclusione della visione Boundless Automation per le architetture di automazione di nuova generazione. Gli esperti presenteranno anche i progressi più recenti in intelligenza artificiale per le strumentazioni industriali, sistemi di gestione degli asset, valvole e innovazioni nel controllo di fluidi di processo, software aziendali, strumentazione di misura e altro ancora, con un programma completo di presentazioni tecniche e tavole rotonde.
I relatori illustreranno argomenti per una vasta gamma di settori, tra cui energia alternativa, sostanze chimiche, biotecnologie, oil & gas, food & beverage, metalli ed estrazione mineraria, carta e cellulosa. I partecipanti avranno la possibilità di discutere direttamente con gli esperti di Emerson, apprendere da reali storie di succes-
“Il packaging e il processing far-
SONO LA NOSTRA MIGLIORE PUBBLICITÀ”
Nuova Guseo da oltre 100 anni, grazie a innovazione tecnologica e a una struttura organizzativa orientata alla piena soddisfazione del cliente, è un punto di riferimento nella progettazione e realizzazione di impianti di macinazione, micronizzazione e contenimento per il settore chimico farmaceutico.
Pronti a ogni nuova sfida, affrontiamo il futuro su basi solide, mettendo a disposizione KNOW HOW, AFFIDABILITÀ ed EFFICIENZA, maturate nel corso della nostra lunga storia aziendale.
so, interagire con demo di prodotti dal vivo e collaborare con i colleghi.
L’Expo delle tecnologie, un punto di forza della conferenza, consentirà di approfondire le conoscenze sulle recenti innovazioni dei marchi leader di Emerson, come DeltaV™, Rosemount™, Fisher™ e Micro Motion™, oltre alle soluzioni di partner terzi strategici.
maceutico vantano numeri importanti a livello mondiale che da qui al 2027 si stima raggiungeranno nella loro totalità i 17,6 miliardi di euro di giro d’affari”, afferma Simone Castelli, CEO di Ipack Ima. “Performance che si riflettono nell’ottimo andamento dell’attività di incoming: a un anno data dall’inizio della manifestazione, abbiamo ad oggi oltre il 60% della superficie espositiva già occupata e il 35% di nuovi brand presenti in fiera. E le novità non sono finite, con un ricco calendario di incontri scientifici di straordinaria quali-
tà garantiti da partner qualificati come AFI capaci di rendere l’avvicinamento all’edizione 2025 di Pharmintech un percorso di sempre maggiore successo”.
“Emerson Exchange è molto più di una conferenza tecnica: è una piattaforma per la collaborazione, l’ispirazione e l’innovazione”, ha dichiarato Ron Martin, presidente Americhe di Emerson. “Il tema di quest’anno intende sottolineare il nostro costante impegno nell’aiutare le aziende a vincere le sfide poste dal panorama odierno in rapida evoluzione dell’automazione e realizzare una trasformazione significativa nei settori critici”.
“Oggi possiamo dire che Pharmintech rappresenterà l’intera filiera Life Science, dal processing al packaging, dalla componentistica alle camere sterili, dalle applicazioni per la gestione dell’impianto alle tecnologie digitali per la governance dei dati, ai materiali di confezionamento”, conclude Domenico Lunghi, direttore manifestazioni Food & Beverage di BolognaFiere.


Nuova Guseo Srl - Via Dante 8 Cap 29010 Villanova sull’ Arda


Italia - Tel : 0523 837149 Per informazioni contattaci via Mail : ufficio.commerciale@nuovaguseo.eu www.nuovaguseo.eu www.nuovaguseo.eu
Leonardo Lifescience Group, gruppo indipendente nel settore chimico in Italia, presenta Vebi PRO, un marchio dedicato al settore Cleaning e Ho.Re.Ca.. Forte di un’esperienza consolidata e di un know-how decennale, il brand nasce per offrire ai professionisti soluzioni all’avanguardia per la cura e la protezione degli ambienti dedicati alla convivialità. L’expertise di Vebi Istituto Biochimico, marchio storico nel settore della cura e protezione degli ambienti domestici, civili e industriali, con Vebi PRO ha portato a un’evoluzione naturale nel percorso di innovazione del Gruppo, che valorizza la competenza e l’affidabilità di Leonardo Lifescience Group, mantenendo un approccio focalizzato sulle esigenze di alberghi, ristoranti e strutture ricettive. La linea di prodotti Vebi Pro coniuga efficacia, sicurezza e

ricerca, con un design moderno e funzionale, per garantire ambienti sani, puliti e profumati.
“Always there, always reliable” è il payoff scelto per il nuovo brand e ne racchiude l’essenza. Richiama il concetto di affidabilità, di orientamento al risultato attraverso soluzioni all’avanguardia. Vebi PRO trasforma la complessità tecnica – necessaria per fornire risultati al top – in soluzioni chiare, efficaci e semplici.
Un nuovo marchio per Diachem, azienda italiana produttrice di agrofarmaci, agronutrienti e soluzioni per l’agricoltura biologica. Nel nuovo brand Diachem, confluiscono le esperienze complementari di Chimiberg, specializzata in agrofarmaci, e Diagro, legata allo sviluppo di agronutrienti.
“Inizia una nuova era”, ha spiegato Francesca Dubbini, strategy & planning lead di Diachem. “Siamo un’azienda italiana, familiare, attiva da oltre 70 anni nella protezione delle colture, e io rappresento la quarta generazione. Con il rebranding abbiamo unificato i nostri marchi in Diachem. Alla base di questa decisione c’è un approccio integrato in cui agrofarmaci e agronutrienti rappresentano la soluzione all’insegna della
Vebi PRO si sviluppa attraverso quattro principali famiglie di prodotto dando vita ad un’offerta completa e d’eccellenza: detergenza professionale, igiene della persona, profumazione degli ambienti e protezione professionale. L’attenzione alla qualità si riflette anche nell’impegno verso un supporto tecnico e commerciale altamente qualificato, che accompagna i professionisti nella scelta delle migliori soluzioni per il
sostenibilità per le colture, che ci permette di unire la nostra anima produttiva all’anima commerciale”.
“Abbiamo indagato soprattutto ‘il perché’ esistiamo, ci siamo interrogati sui nostri valori ed abbiamo compreso che vogliamo produrre agrofarmaci ed agronutrienti per garantire un’alimentazione sana”, sottolinea Milena Crotti, communication manager. Diachem è oggi presente “in 30 paesi, in Europa, Nord Africa, Turchia, e dal 2020 Brasile. Mercati raggiunti direttamente o attraverso le acquisizioni, come nel caso di Pireco che ci ha aperto le porte di Belgio ed Olanda”, ha spiegato Leonardo Dubbini, international business lead.
Il lancio del nuovo brand si accompagna
proprio business. Vebi PRO rappresenta un ulteriore passo avanti nella costante ricerca di soluzioni che garantiscano benessere, protezione e cura degli ambienti. Con Vebi PRO, Leonardo Lifescience Group rafforza il proprio impegno nel settore, coniugando una lunga tradizione di competenza e sperimentazione nel settore del cleaning per la protezione e l’igiene degli ambienti professionali.
anche ad uno sviluppo del sito produttivo di Caravaggio: “Siamo orgogliosi di essere una società produttiva, che vive il mercato sia attraverso la distribuzione dei propri prodotti, sia attraverso la realizzazione per conto di altri brand o distributori. Copriamo con i nostri impianti produttivi ogni tipologia di esigenza e presidiamo l’intero processo, dalla formulazione al packaging. Siamo un interlocutore affidabile per molte aziende del settore. E il nuovo progetto di sviluppo del sito di Caravaggio darà ulteriore slancio alla nostra azienda”, ha affermato Luca Dubbini, operation & roll manufacturing mkt lead.




Arriva in Italia lebrikizumab, anticorpo monoclonale indicato per il trattamento della dermatite atopica da moderata a severa negli adulti e negli adolescenti. Il nuovo farmaco è commercializzato in Europa da Almirall, azienda farmaceutica spagnola focalizzata in dermatologia.
Nel nostro paese soffrono di dermatite atopica circa 4 milioni di persone adulte, di cui circa la metà con una forma da moderata a severa .
“Lebrikizumab rappresenta un passo significativo per chi soffre di dermatite atopica, una patologia debilitante troppo spesso sottovalutata”, ha dichiarato, nella conferenza stampa convocata a Milano per la presentazione del farmaco, Paolo Ferri, direttore medico di Almirall. “Per Almirall,
lebrikizumab rappresenta un nuovo significativo traguardo. Questo lancio, che avviene immediatamente dopo la celebrazione degli 80 anni dalla fondazione di Almirall, è un motivo di grande orgoglio”.
“La dermatite atopica, soprattutto nelle forme più gravi – ha affermato il professor Giuseppe Argenziano, presidente di SIDeMaST (Società italiana di dermatologia e delle malattie sessualmente trasmesse) – può limitare le attività quotidiane: quasi il 90% dei pazienti affetti da dermatite atopica dichiara che la malattia compromette almeno in parte la propria capacità di affrontare la vita; il 50% dei pazienti ha affermato di avere un prurito insopportabile”.
Lebrikizumab è un anticorpo monoclonale che si lega
con elevata affinità all’interleuchina 13 (IL-13), neutralizzandola. La citochina IL13 è una proteina che svolge un ruolo chiave nello sviluppo della DA. Nelle persone affette da questa patologia, l’IL-13 agisce come principale motore dell’infiammazione, che può portare a irritazione cutanea, prurito intenso, lesioni e altri problemi legati alla pelle. Nella pelle affetta da DA, l’IL-13 è sovra espressa e i suoi livelli sono correlati alla gravità e alla cronicità della malattia, il che significa che livelli più elevati sono correlati a una malattia più grave. “L’efficacia di questo farmaco nella cura della dermatite atopica è stata confermata in numerosi studi. Già dopo due settimane i pazienti hanno ottenuto sollievo dal prurito e un miglioramento

delle lesioni cutanee”, ha dichiarato Giampiero Girolomoni, professore ordinario di Dermatologia, Università di Verona. Alla conferenza stampa è intervenuto anche il professor Lorenzo Mantovani, direttore di Scuola di specializzazione, Università di Milano-Bicocca: “Il recente via libera alla rimborsabilità del farmaco per la dermatite atopica severa avrà anche un impatto di budget vantaggioso per il sistema sanitario nazionale”.
CSL Seqirus, azienda di CSL e player internazionale nella prevenzione dell’influenza, ha annunciato l’approvazione del suo vaccino antinfluenzale quadrivalente prodotto su coltura cellulare a partire dai sei mesi di età.
Dopo il parere positivo del Comitato per i medicinali per uso umano (CHMP) dell’EMA a dicembre 2024 e l’approvazione della Commissione Europea (CE), il vaccino su coltura cellulare potrà essere impiegato già a partire dai sei mesi di età, contribuendo a migliorare la protezione contro l’influenza stagionale nella fascia di età tra 6 mesi e 2 anni.
A causa della mancanza di immunità pregressa, i bambini di età inferiore ai due anni sono infatti soggetti a un aumentato rischio di sviluppare serie complicanze correlate all’influenza come polmonite, disfunzioni cerebrali e, in rari casi, addirittura la morte.
I vaccini su coltura cellulare, come quello di CSL Seqirus, sono progettati per corrispondere esattamente ai ceppi virali influenzali stagionali selezionati dall’OMS ed evitare così le mutazioni derivanti dal processo di adattamento alle uova osservate nei vaccini tradizionali, migliorando l’efficacia dell’immunizzazione contro l’influen-
za stagionale.
“Dati dimostrano che i vaccini su coltura cellulare possono offrire una protezione maggiore rispetto ai vaccini prodotti su uova. Ciò è particoralmente importante per i soggetti più vulnerabili, come i bambini piccoli”, afferma Marco Salvatore, Medical Head CSL Seqirus.
“Il vaccino antinfluenzale cell-based è progettato per riprodurre fedelmente i ceppi influenzali selezionati dall’OMS per la produzione di vaccini, eliminando il fenomeno dell’adattamento alla crescita su uova –una forma di mismatch – che riduce l’efficacia dei vaccini stagionali“.
Evotec SE ha annunciato che, insieme all’Università di Yonsei e alla società biotecnologica coreana Zymedi, riceverà una sovvenzione di 4,5 milioni di dollari dal Korea Institute of Advanced Technology (KIAT). Il finanziamento del KIAT sosterrà lo sviluppo di terapie biologiche innovative per il trattamento di malattie polmonari, tra cui l’asma e la fibrosi polmonare idiopatica (IPF). Il progetto si concentrerà sullo sviluppo preclinico di nuovi anticorpi antinfiammatori e anti-fibrotici diretti contro le sintetasi tRNA, una classe emergente di bersagli terapeutici per il trattamento di malattie con un elevato bisogno medico non soddisfatto.
“Siamo entusiasti di collaborare con il professor Sunghoon Kim e i nostri colleghi di
Zymedi e dell’Università di Yonsei per portare avanti un approccio promettente nello sviluppo di nuovi trattamenti a base di anticorpi per l’asma e l’IPF”, ha dichiarato il dottor Thomas Hanke, vicepresidente esecutivo e responsabile delle partnership accademiche di Evotec. “Le sinergie tra le tre parti, supportate dalla sovvenzione del KIAT, dimostrano come le collaborazioni internazionali possano accelerare lo sviluppo di nuove terapie per malattie con un alto bisogno medico insoddisfatto. Il laboratorio del dottor Kim presso l’Università di Yonsei è riconosciuto a livello globale come leader nel campo delle sintetasi tRNA, avendo scoperto le loro diverse attività regolatorie per l’omeostasi dell’organismo. Zymedi è un’azienda coreana emergente che
sta trasformando l’associazione patologica delle sintetasi tRNA in nuovi farmaci. Evotec metterà a disposizione le sue tecnologie di sviluppo, ingegneria e produzione di anticorpi di livello mondiale, insieme alle sue piattaforme integrate di R&S preclinica per la scoperta e lo sviluppo di farmaci contro la fibrosi e le malattie polmonari”. “La biologia delle sintetasi tRNA, finora poco esplorata, offre una via versatile per lo sviluppo di nuovi farmaci. Sono molto entusiasta di avviare questo progetto con Evotec per sviluppare nuovi anticorpi terapeutici mirati alle attività patologiche di questi enzimi”, ha dichiarato Sunghoon Kim, professore e direttore dell’Istituto di intelligenza artificiale e ricerca biomedica presso l’Università di Yonsei.
Ti interessa?
Richiedi ora il tuo campione gratuito



Il progetto Diana, che punta a semplificare gli esami clinici e a monitorare l’efficacia delle terapie, nasce dalla sinergia tra Antares Vision Group, Isinnova e il Centro Nazionale di Ricerca “Sviluppo di terapia genica e farmaci con tecnologia a RNA”.
Diana (Diagnostica intelligente per analisi non invasiva avanzata) è il risultato della collaborazione tra Antares Vision Group, multinazionale italiana leader nella tracciabilità e nel controllo qualità, e Isinnova, PMI bresciana che abilita e rende accessibile l’innovazione tecnologica, con il supporto strategico del Centro Nazionale di Ricerca “Sviluppo di terapia genica e farmaci con tecnologia a RNA” finanziato dal PNRR.
Diana è una cabina che combina tecnologie avanzate non invasive, e che rappresenta un passo concreto verso la medicina personalizzata, orientata a migliorare la qualità delle cure e la vita dei pazienti.
L’obiettivo è accelerare e semplificare la diagnosi, monitorare in tempo reale l’efficacia delle terapie e supportare lo sviluppo di farmaci su misura per il paziente, offrendo una piattaforma diagnostica in grado di effettuare più di 60 esami non invasivi in soli 15 minuti. Gli esami, che includono test su attività elettrica-encefalica, attività cardiaca, composizione sanguinea, composizione corporea, attività elettrica-muscolare e capacità pol-
monare, consentono di ottenere un quadro completo e personalizzato dello stato di salute del paziente, riducendo tempi e costi delle analisi tradizionali.
“Per la realizzazione di questo progetto abbiamo utilizzato tecnologie già note o in fase sperimentale e le abbiamo unite, compattandole nella realizzazione di Diana, grazie al lavoro del nostro team di esperti”, affermano Cristian Fracassi e Marco Silvestri di Isinnova, rispettivamente CEO e responsabile del progetto Diana. “L’obiettivo della cabina, di cui vorremmo creare più versioni a seconda delle varie branche d’impiego, non è quello di sostituirsi al medico, ma velocizzare il lavoro dei professionisti della sanità”.
“Accorceremo i tempi di ricerca e potremo trovare cure più precise” “Le potenzialità di Diana abbinate ai protocolli di terapia genica possono aiutarci a monitorare in tempo reale l’efficacia dei farmaci con tecnologia RNA che come Centro nazionale di ricerca stiamo sviluppando”, sostiene il professor Ro-
sario Rizzuto, presidente della Fondazione Centro Nazionale per lo sviluppo di terapia genica e farmaci con tecnologia a RNA. “Supportare una tecnologia come quella di Diana significa accorciare i tempi di ricerca, semplificare i passaggi diagnostici, ma soprattutto trovare delle cure sempre più precise e sostenibili”. “Diana rappresenta un cambio di paradigma e apre la strada a una medicina sempre più rapida, efficiente e soprattutto personalizzata, centrata sul paziente”, spiega Alberto Albertini, Innovation Center Director di Antares Vision Group.
“Questo grazie alla tecnologia, che rende possibile l’applicazione concreta della ricerca scientifica a beneficio della salute di tutti. La collaborazione tra i tre attori coinvolti nel progetto, inoltre, dimostra come la sinergia tra enti di ricerca, aziende e Università possa tradursi in soluzioni concrete per il progresso medico e tecnologico”.
Il primo prototipo di Diana, denominato Diana-ATMP, sarà pronto a metà del 2025 e verrà utilizzato presso il Centro Nazionale RNA & Genetherapy per monitorare pazienti sottoposti a terapie geniche e farmacologiche avanzate.
Fondamentale sarà il contributo di Diana nella fase di raccolta dati, velocizzando il processo di acquisizione e integrazione delle informazioni in tempi ravvicinati, ad alta qualità, anche in contesti sanitari remoti rispetto ai grandi centri di ricerca medica. La tecnologia consentirà di combinare diverse fonti in un unico sistema integrato, semplificando l’accesso e l’analisi dei dati per i medici. Questo approccio, insieme alla possibilità di personalizzare i piani di trattamento in base alle caratteristiche specifiche di ogni paziente, permetterà di offrire cure più mirate ed efficaci, oltre a creare un archivio più completo per lo studio di determinate malattie.
Antares Vision Group collabora con Isinnova nell’industrializzazione di soluzioni innovative e dal 2022 ha rilevato una quota pari al 15% del capitale sociale della PMI bresciana.

Dove la sicurezza non è un’opzione: ambienti su misura per il pharma con un controllo della contaminazione assicurato

Engineering | Design | Planning | Construction & Commissioning
Equipment & Validation | Turnkey | Utilities | Equipment
Cables & Piping | Support & Maintenance
Uno studio di un gruppo di ricercatori Enea mette in evidenza un possibile meccanismo molecolare alla base della malattia di Parkinson, una patologia ancora senza cure specifiche che colpisce i neuroni nel cervello. La ricerca si è avvalsa del supercalcolatore Enea Cresco per condurre simulazioni avanzate con le quali poter predire e comprendere l’impatto delle mutazioni genetiche sulla malattia e individuare i possibili bersagli terapeutici.
Lo studio, pubblicato sulla rivista International Journal of Molecular Science, è stato coordinato da Caterina Ar-

cangeli del Laboratorio Biotecnologie RED di Enea, affiancata da un team di ricercatori.
“I risultati che abbiamo ottenuto rappresentano un passo importante nella comprensione dei complessi meccanismi cellulari che sono alla base di molte gravi patologie, tra cui il Parkinson”, spiega Caterina Arcangeli di Enea. “E tutto questo è stato possibile grazie all’impiego delle biotecnologie computazionali che, insieme all’intelligenza artificiale, stanno emergendo come una delle frontiere più promettenti per lo studio e la cura di malattie complesse”.
Al centro dello studio vi è una specifica mutazione genetica di un enzima cruciale per il metabolismo dei lipidi (grassi) nelle cellule. “Si tratta di una mutazione che, attraverso meccanismi non ancora del tutto chiariti, contribuisce a danneggiare le cellule e in particolare quelle del cervello deputate al controllo del movimento. Quando questi neuroni sono danneggiati o muoiono, si sviluppano i sintomi della malat-
tia di Parkinson come tremori, rigidità muscolare e difficoltà nei movimenti”, prosegue Arcangeli.
Per superare le attuali lacune nella conoscenza di questa mutazione genetica, i ricercatori hanno utilizzato simulazioni di dinamica molecolare come “microscopio virtuale” per replicare su scala nanometrica l’ambiente cellulare che sperimenta l’enzima. Grazie a queste simulazioni è stato scoperto che la mutazione genetica altera la struttura dell’enzima, compromettendone la stabilità e le interazioni con altre biomolecole all’interno della cellula.
“Gli approcci computazionali utilizzati sono capaci di riprodurre fedelmente i processi di interazione che avvengono nelle cellule”, sottolinea Arcangeli.
“Queste tecnologie non solo migliorano la comprensione dei meccanismi alla base delle patologie, ma si candidano a essere strumenti predittivi. Grazie al potere delle simulazioni al computer, come quelle realizzate in questo studio, sarà possibile approfondire il ruolo di specifiche mutazioni genetiche e progettare approcci terapeutici più efficaci”, conclude la ricercatrice Enea.
BioVersys AG, un’azienda biofarmaceutica multi-asset in fase clinica, specializzata nella ricerca e nello sviluppo di nuovi prodotti antibatterici per infezioni gravi e potenzialmente letali causate da batteri multiresistenti (MDR), ha annunciato lo scorso febbraio che il suo programma BV500 NTM ha raggiunto il suo secondo traguardo, ovvero la “identificazione di fino a 5 composti guida ottimizzati”, nell’ambito dell’accordo CF AMR Syndicate Collaborative Discovery Programme (CDP). Sostenuta dai finanziamenti di LifeArc, BioVersys sta sviluppando nuove piccole molecole mirate al trattamento delle malattie polmonari da micobatteri non tubercolari (NTM-LD), particolarmente difficili da trattare, nei pazienti affetti da fibrosi cistica (CF). Il programma BV500 NTM nasce dalla piattaforma proprietaria di chimica Ansamicina, attraverso la quale il team di ricerca ha identificato e sta sviluppando diversi candidati orali avanzati
e altamente potenti della classe delle ansamicine. Questi composti mostrano un ampio spettro di attività anti-NTM sia in vitro che in vivo, senza presentare resistenza crociata con altre classi terapeutiche.
“Siamo molto soddisfatti dei progressi del nostro programma BV500, il quarto di una serie di iniziative di successo nella nostra pipeline, focalizzate sui bisogni medici insoddisfatti legati alla resistenza antimicrobica (AMR)”, ha dichiarato Nawaz Khan, responsabile della ricerca presso BioVersys. “In collaborazione con i nostri partner del CF AMR Syndicate (LifeArc, Medicines Discovery Catapult e Cystic Fibrosis Trust), continuiamo a dimostrare come le partnership strategiche possano offrire soluzioni concrete per i pazienti affetti da NTM-LD, una patologia difficile da trattare, combinando competenze complementari e sinergiche”.



IL REMOTE I/O IS1+
ORA DOPPIAMENTE PIU’ EFFICIENTE
IS1+ rimane il punto di riferimento per le aree con pericolo d’esplosione. Il nuovo Remote I/O per Zona 1 ora supporta il doppio dei segnali rispetto a prima. Questo rende le installazioni in Zona 1 e Zona 2 configurabili allo stesso modo – con lo stesso spazio richiesto. Per saperne di più consultate r-stahl.com/remoteio



Federico Bella
e Laura Fabris
sono docenti
presso il Dipartimento di Scienza
Applicata e TecnologiaDISAT
Due gruppi di ricerca dell’ateneo hanno ricevuto dalla Ue un finanziamento di 150mila euro per sviluppare progetti innovativi sulla sostenibilità dei processi chimici e sulla diagnosi precoce dei tumori.
Due progetti di ricerca del Politecnico di Torino sono stati premiati con i finanziamenti ERC Proof of Concept, un’iniziativa dell’European Research Council volta a sostenere l’applicazione pratica e la valorizzazione dei risultati di progetti di ricerca di frontiera.
I vincitori del prestigioso riconoscimento sono Federico Bella e Laura Fabris, entrambi docenti presso il Dipartimento Scienza Applicata e Tecnologia-DISAT. Lo schema ERC Proof of Concept si rivolge ai ricercatori e alle ricercatrici che hanno già ottenuto un finanziamento ERC, offrendo un supporto economico di 150mila euro per trasformare idee innovative in soluzioni concrete pronte per il mercato. Questi fondi permettono di verificare la fattibilità commerciale e tecnica delle tecnologie sviluppate, costruire strategie di protezione intellettuale e preparare il terreno per una futura commercializzazione.
Produrre ammoniaca in modo più efficiente ed economico
Federico Bella ha ottenuto il finanziamento dall’Unione Europea per lo sviluppo del progetto GINNY (Glycerol and nItrogeN conversioN through electrochemistrY) che affronta una delle principali sfide della crisi climatica: rendere più sostenibile la produzione di ammonia-
ca. L’ammoniaca è essenziale per la creazione di fertilizzanti e si configura al contempo come un importante vettore energetico: è infatti in grado di veicolare l’energia da una forma ad un’altra, energia che viene accumulata al suo interno per essere poi rilasciata al bisogno. Oggi il composto viene prodotto con il processo Haber-Bosch, estremamente energivoro e inquinante. GINNY propone quindi un approccio differente, basato su una reazione elettrochimica che sfrutta elettroliti innovativi e l’elemento potassio come mediatore, eliminando così dal processo l’uso del litio e di altre materie prime critiche. Sarà inoltre possibile, adottando tale approccio, convertire il glicerolo, un sottoprodotto dell’industria del biodiesel, trasformandolo in composti di alto valore come l’acido glicerico e il diidrossiacetone, utilizzati in farmaceutica e in chimica fine. Il progetto GINNY ha quindi il potenziale di rivoluzionare la produzione di ammoniaca e di prodotti chimici, con un sistema più efficiente, economico e a basso impatto ambientale.
“Questo finanziamento è un valido riconoscimento per l’attività svolta dalle e dai giovani del mio gruppo di lavoro, con i quali nell’ultimo triennio abbiamo inaugurato due nuove linee di ricerca”, commenta il professor Bella. “Si tratta di
ricerche di significativo impatto (produzione di ammoniaca e dispositivi a base potassio), ma anche molto complesse da studiare e implementare”.
Diagnosi precoce del tumore alla prostata
Il progetto Stellar (SERS-based Technology for EarLy Liquid biopsy Analysis and Recognition), portato avanti da Laura Fabris, permetterà invece di diagnosticare precocemente il tumore alla prostata, e successivamente molti altri tumori, sfruttando tecnologie avanzate come la spettroscopia Raman potenziata (SERS) e l’intelligenza artificiale. Obiettivo del progetto è di rilevare frammenti di microRNA (miRNA) tumorali attraverso semplici analisi del sangue, offrendo quindi un metodo non invasivo, accessibile e straordinariamente preciso per identificare biomarcatori specifici del cancro e conseguentemente diagnosticare precocemente i tumori. L’ambizione di Fabris e del suo gruppo di ricerca è di superare le attuali limitazioni della diagnostica oncologica, eliminando la necessità di esami dolorosi e invasivi, riducendo costi e tempi di analisi, e rendendo quindi la tecnologia alla portata di un numero maggiore di pazienti. Il progetto prevede lo sviluppo di un sistema completo, che combina una piattaforma di rilevamento basata su substrati potenziati da nanoparticelle d’argento e algoritmi di AI per analizzare i dati. Un sistema che aprirà a nuove prospettive per la medicina personalizzata e per i dispositivi medici integrati con l’intelligenza artificiale. “Si tratta di un riconoscimento importante che ci consentirà di sviluppare una tecnologia che potrebbe potenzialmente trasformare come vengono diagnosticati precocemente i tumori andando a beneficiare, in primis, i pazienti”, dichiara la professoressa Fabris. “Siamo entusiasti di collaborare in questo progetto con i colleghi e le colleghe dell’Ospedale Molinette e dell’IIGM di Candiolo”.



La nuova regolamentazione sulla produzione sterile ha spinto il settore oftalmico a puntare su partner tecnologici di grande esperienza. Per questo, nel suo stabilimento di Pomezia, Content Group ha scelto Steriline per il riempimento di flaconi in vetro e plastica, sia per colliri che per prodotti liofilizzati.
Steriline, produttore europeo di linee standard e robotiche per la lavorazione asettica di farmaci iniettabili, ha concluso lo scorso anno consolidando la propria presenza anche nel settore oftalmico, mercato a cui l’Annex 1 ha richiesto un miglioramento consisten-
te delle tecnologie. Grazie alla sua più che trentennale esperienza nel riempimento di farmaci iniettabili in ambiente sterile, Steriline è stata scelta da Tubilux Pharma, parte di Content Group. Le avanzate tecnologie presenti negli stabilimenti del gruppo unite alle ampie competenze professionali e alle
qualità umane fanno di Content Group una solida realtà farmaceutica dedicata allo sviluppo, alla produzione, al riempimento e al confezionamento in conto terzi. Con un fatturato di 97,8 milioni di euro nel 2023, il gruppo si colloca tra i principali player oftalmici europei, con clienti in tutto il mondo e con prospet-

tunitense, grazie all’approvazione FDA del sito di Tubilux Pharma, di Pomezia. Con l’aggiornamento dell’Annex 1, tutte le aziende che producono o lavorano farmaci hanno dovuto adeguarsi ed attenersi alle nuove regole. Anche il settore oftalmico ha dovuto tenere conto, quindi, di un nuovo modo di trattare il farmaco, introducendo un approccio differente, molto simile a quello della lavorazione dei farmaci iniettabili, settore in cui Steriline opera da ormai 30 anni. In conformità con l’Annex 1, le linee di Steriline espongono al flusso di aria laminare il prodotto e tutto ciò che è in contatto con esso, consentendo il caricamento dei consumabili ed il montaggio dei componenti a contatto con il prodotto in condizioni asettiche. “La continua innovazione e l’esperienza maturata dall’azienda sulle macchine per iniettabili sterili ci porta oggi ad essere identificati e scelti anche per il riempimento e la gestione di farmaci oftalmici”, afferma Filippo Parini, Sales Area Mana-
ger di Steriline. “Ci impegniamo a sviluppare apparecchiature che non solo soddisfino le esigenze dell’industria farmaceutica odierna, ma che siano anche in grado di contribuire a un futuro più sostenibile per l’industria farmaceutica stessa”.
La decennale esperienza maturata da Steriline nella produzione e messa a punto di macchine standard e robotiche per la lavorazione di iniettabili sterili ha consentito all’azienda di produrre linee adeguate e aderenti alla recente normativa anche per il mondo oftalmico. Alla base di questa nuova conquista stanno i concetti di quality by design, first air, montaggio dei componenti a contatto diretto con il prodotto e caricamento dei componenti consumabili in condizioni asettiche, sistemi di sterilizzazione in situ CIP (Clean-In-Place) - SIP (Sterilization-In-Place) i controlli di processo.
Tubilux Pharma ha scelto la linea oftalmica di Steriline per il riempimento di flaconi in vetro e plastica, sia per colliri sia per prodotti liofilizzati, con l’obiettivo di aumentare la capacità produttiva, essere pienamente conforme all’Annex 1 e in linea con le migliori pratiche del settore (GMP). La linea scel-

ta presenta una grande flessibilità nel
mi di chiusura per formulazioni multidose senza conservanti), al flacone in vetro con tappo lyo.
“Dopo una prima fase di scouting con tre possibili partner, la scelta è caduta su Steriline, che ha saputo illustrarci i vantaggi e le opportunità di business che la loro linea era in grado di offrirci,
La linea Steriline scelta da Tubilux Pharma (Content Group) processa differenti tipologie di contenitori con un cambio formato snello: dai classici flaconi plastici abbinati a sistemi di chiusura differenti fino al flacone in vetro con tappo lyo

risolvendo il problema legato alla conformità all’Annex 1, fornendoci una linea innovativa e compatta per il confezionamento sterile adatta al settore oftalmico e incrementando la capacità di realizzazione dei prodotti liofilizzati”, afferma Andrea Piersigilli Site Director di Tubilux Pharma. Dopo il collaudo e l’installazione, la linea sarà definitivamente pronta per la produzione nella seconda metà del 2025. Macchine
Intervista al General Manager della filiale italiana: “La filtrazione di processo è un’estensione strategica della nostra offerta, volta a fornire soluzioni per migliorare l’efficienza energetica e la sostenibilità delle imprese, oltre la sala compressori”.

Juan Manuel Tejera, General Manager di Atlas Copco
Italia - Divisione Compressori

a cura di Alessandro Bignami
Nel 2024 Atlas Copco ha concluso due acquisizioni sul mercato italiano, mostrando un forte interesse a seguire da vicino il nostro tessuto industriale. Con l’ingresso nel
Gruppo di Baraghini Compessori Srl e Easy Filtration Srl, la filiale italiana della società svedese punta sul service nell’ambito dell’aria compressa e sulle soluzioni per la filtrazione di processo. Il filo conduttore continua a essere l’efficienza energetica, con l’offerta di soluzioni globali, che in-
cludono servizi di assistenza e manutenzione. Abbiamo analizzato questi e altri aspetti, con particolare riferimento alle opportunità offerte alle industrie di processo e alimentari italiane, insieme a Juan Manuel Tejera, che dal 2017 è General Manager di Atlas Copco Italia - Divisione Compressori.
Juan Manuel Tejera, in quali direzioni, anche alla luce delle recenti acquisizioni, state diversificando la vostra offerta e come cambierà la presenza sul territorio italiano?
“In quest’ultimo anno abbiamo completato due operazioni in Italia per la Business Area Compressor Technique, rilevando Baraghini Compessori e Easy Filtration.
L’acquisizione di Baraghini rappresenta un altro passo verso il nostro obiettivo di essere più vicini ai clienti dell’aria compressa, aggiungendo un’azienda attiva a Cesena da oltre 50 anni e con una riconosciuta capacità di service.
L’operazione relativa a Easy Filtration è invece significativa per mostrare al mercato il percorso di sviluppo che abbiamo iniziato più di tre anni fa. Vogliamo fornire ai clienti soluzioni complete per migliorare l’efficienza dei loro processi produttivi, come Atlas Copco fa già in altre Business Area. Con Easy Filtration stiamo assorbendo know-how sui processi di filtrazione per molte applicazioni diverse: questa azienda rappresenterà una risorsa preziosa per estendere la nostra presenza nel mercato”.
Perché avete scelto di rafforzarvi nel settore della filtrazione di processo? Vi interessa in particolar modo aumentare la vostra penetrazione nell’industria farmaceutica e alimentare?
“La filtrazione di processo è un’estensione strategica della nostra offerta, con l’obiettivo di fornire soluzioni in grado di migliorare l’efficienza energetica e la sostenibilità delle imprese oltre la sala compressori. La maggior parte dei potenziali clienti conosce già le soluzioni e i servizi Atlas Copco nel Pharma e Food&Beverage, così come in molti altri settori industriali. Essendo in grado di estendere ulteriormente la nostra offerta per l’industria

alimentare e farmaceutica, andiamo ancora più avanti nel nostro obiettivo di fornire al cliente un’esperienza completa nella gestione dei fluidi”.
Qual è la strategia che il gruppo porterà avanti nei prossimi anni sul mercato italiano?
“Il mercato industriale italiano è stato fondamentale per la nostra crescita nell’area EMEA negli ultimi decenni.
In Italia abbiamo già investito in tutte le nostre Business Area, acquisendo stabilimenti di produzione per fornire prodotti localmente e all’estero, ma abbiamo anche investito nell’ampliamento del nostro modo di commercializzare (way to market).
Consideriamo ancora l’industria italiana una fonte di opportunità per il futuro. Le soluzioni di filtrazione di processo, raffreddamento e conversione dell’energia sono parte integrante della nostra offerta e un esempio dei prodotti innovativi che intendiamo introdurre nel Paese”.
Qual è il filo conduttore dei diversi servizi che proponete al cliente, anche in funzione di fidelizzarlo e approfondire sempre di più la relazione con lui?
“Il nostro scopo è trasformare il futuro, consentendo ai clienti di crescere
e far progredire la società. Con questo obiettivo, e grazie alla capacità di portare innovazione sul mercato, continueremo ad offrire i nostri prodotti principali con miglioramenti costanti sull’efficienza energetica, e ci concentreremo sempre di più su un approccio di soluzione globale. Inizieremo ad offrire manutenzione preventiva tramite le nostre soluzioni di connettività. Puntiamo a garantire tempi di attività (uptime) per la produzione industriale, predisponendo un contratto di assistenza. Infine, vogliamo convertire il calore di scarto dell’aria compressa in energia che possa aiutare i clienti a progredire nel percorso verso le zero emissioni di CO2“.
Il tema dell’efficienza energetica è attuale per tanti aspetti e in Italia viene enfatizzato dal piano Transizione 5.0. Qual è la vostra proposta in tal senso, soprattutto pensando alle esigenze delle aziende di processo?
“Conoscendo le radici di Atlas Copco, è facile capire che fa parte del nostro
Compressore per CO2
“In Italia abbiamo investito in tutte le Business Area: continua a essere un mercato industriale fondamentale per la nostra crescita nell’area EMEA”

Sopra, filtri di processo.
A fianco, refrigeratori industriali
DNA impegnarci per creare il futuro del settore attraverso soluzioni sostenibili. Con questo obiettivo ci muoviamo in tre direzioni:
• la prima è rappresentata dal nostro tradizionale approccio innovativo secondo cui ogni nuova generazione di prodotti ha grandi funzionalità di efficientamento energetico;
• la seconda è quella di far funzionare insieme e nel modo più efficiente i diversi elementi di una sala compressori; il nostro approccio, infatti, va oltre il coordinamento dei compressori e prevede anche la connessione con l’applicazione del cliente per ottimizzare l’intera installazione;
• la terza direzione, infine, è rappresentata dalla conversione dell’energia di scarto prodotta nel processo di compressione in calore, freddo ed energia.
Vorrei anche sottolineare la nostra attività nel settore delle energie rinnovabili con soluzioni per la compres-
“Le nostre soluzioni consentono di convertire l’energia inutilizzabile in energia termica di qualità e totalmente fruibile, ottimizzando i costi e migliorando la sostenibilità ambientale”

sione di biogas, H2 (idrogeno) e CO2, quest’ultima finalizzata al recupero e stoccaggio dell’anidride carbonica. Ancora una volta, si tratta di soluzioni per supportare le aziende industriali nel loro percorso volto a raggiungere zero emissioni”.
In cosa consiste la vostra proposta tecnologica per la “conversione energetica” e quali risultati vi sta dando in ambito industriale?
“Siamo in grado di fornire soluzioni complete per utilizzare l’energia di scarto dei processi produttivi e migliorare l’efficienza energetica delle imprese. In questo modo, è possibile convertire l’energia inutilizzabile in energia termica di qualità e totalmente fruibile, ottimizzando i costi industriali e migliorando la sostenibilità ambientale. La trasformazione in calore si basa sui sistemi di recupero energetico e sulle pompe di calore. Per la conversione in freddo utilizziamo apparecchiature di assorbimento. Ultimo, ma non meno importante nel nostro obiettivo finale di produrre energia, siamo in grado di fornire compressori di vapore ed espansori”.
Come sta andando la vostra attività al servizio della refrigerazione industriale?
“Le nostre soluzioni di raffreddamento industriale stanno funzionando nel mercato come ci eravamo prefissati. Ci siamo concentra-



ti innanzitutto sulla diffusione del nostro attuale portafoglio di chiller attraverso i nostri canali di vendi ta tradizionali. E parallelamente ab biamo sviluppato la prima parte di una nuova gamma di apparecchia ture di raffreddamento da collega re a compressori raffreddati ad ac qua, in grado di regolare la modali tà di lavoro in base alle esigenze del compressore. In questo modo siamo in grado di ridurre drasticamente il consumo di energia, ma soprattut to il consumo di acqua, che diven terà una risorsa preziosa nei decen ni a venire”.






Che spunti vi ha dato l’ultima edi zione di Ecomondo?
“Siamo molto soddisfatti delle rela zioni che abbiamo creato a Ecomon do 2024. Abbiamo incontrato molti appaltatori e clienti interessati alle nostre soluzioni per la compressione del biogas, generatori in loco di azo to e ossigeno. Siamo stati contatta ti anche per molte altre applicazioni, sempre con l’obiettivo dell’efficienza energetica. Vedremo come l’Italia af fronterà il suo percorso verso le ener gie rinnovabili e il traguardo delle ze ro emissioni, un obiettivo ambizioso ma essenziale per il futuro del nostro pianeta. In Atlas Copco, siamo orgo gliosi di disporre delle soluzioni tec nologiche più avanzate per accompa gnare le industrie in questa trasfor mazione”.
































































































Le soluzioni R-RH di Johnson-Fluiten sono utilizzabili per una vasta gamma di macchinari e al contempo ottengono prestazioni tipiche di un prodotto personalizzato, grazie a poche e semplici modifiche.
Le applicazioni dei giunti rotanti nell’industria sono molteplici: convogliare un fluido verso un elemento che ruota, spesso a velocità elevata, è un’esigenza comune nei processi produttivi di svariati settori, inclusi il chimico-farmaceutico e l’alimentare.
Come selezionare il giunto rotante ideale per un macchinario? Non tutti i segmenti produttivi hanno le stes-
se esigenze: il tipo di fluido utilizzato e la temperatura che raggiunge nelle condizioni operative di processo possono variare sensibilmente. Non occorre però dotarsi di un giunto diverso per ogni macchinario: esiste la possibilità di adottare componenti versatili, adatti alla maggior parte degli utilizzi, con caratteristiche facilmente modificabili per renderli ottimali in condizioni specifiche. Quali sono questi componenti e che

vantaggi apportano? Lo abbiamo chiesto a Luigi Rolfini, Sales Manager Industry di Johnson-Fluiten, azienda che da oltre vent’anni progetta e produce giunti rotanti per l’industria.
Luigi Rolfini, quali caratteristiche devono avere i giunti rotanti per svolgere al meglio la loro funzione nei diversi processi produttivi?
“La tenuta e la robustezza sono fondamentali in un giunto rotante: l’affidabilità del processo, la sicurezza dell’impianto e l’efficienza della produzione non possono prescindere da queste caratteristiche. Il giunto deve convogliare il fluido senza perdite, con precisione, nelle quantità necessarie e al punto giusto; pur trattandosi di componenti soggetti a usura, è anche importante che non richiedano frequenti interventi di manutenzione e che, nel caso l’esigenza si verifichi, gli impianti possano riprendere a funzionare pienamente in tempi rapidi. Queste caratteristiche sono presenti nei nostri giunti R-RH: robusti e versatili, trovano applicazione in tutti i segmenti industriali per il raffreddamento e il riscaldamento, gestendo temperature elevate e funzionando ottimamente con diversi media. Oltre alla versatilità che ne permet-

te l’utilizzo in diversi macchinari, l’altra caratteristica che rende questi giunti apprezzati dalle industrie è la capacità di adattarsi a svariati processi produttivi, semplicemente cambiando la tenuta: un’operazione che, grazie agli appositi kit da noi forniti, può essere svolta in pochissimo tempo senza dover smontare il giunto dalla macchina e minimizzando quindi i tempi di interruzione del processo produttivo”.
Quali tipi di tenuta può scegliere il cliente per il giunto rotante R-RH in modo da avere un componente ottimale per il suo processo?
“I giunti rotanti R-RH sono forniti con una configurazione di base (B3) in cui le tenute comprendono, fra l’altro, un anello di grafite resistente e con proprietà autolubrificanti, un robusto controanello in carburo di silicio resistente alla corrosione e una guarnizione in Viton, un elastomero a base gomma fluorata dall’elevata resistenza al calore. Nella configurazione B3, il giunto rotante R-RH può operare con temperature fino a 120°C e funzionare con acqua e aria. Con poche semplici operazioni, il cliente può sostituire la configurazione B3 con un’am-
pia gamma di tenute: B4, dove, rispetto alla B3, l’elastomero Viton è rimpiazzato dal copolimero Aflas, resistente, oltre che al calore, anche agli agenti chimici aggressivi, ottenendo così una versione heavy duty del giunto utilizzabile con temperature fino a 180°C e molto apprezzato nel settore alimentare; C3, dove l’anello anziché in grafite è in carburo di tungsteno, offrendo una tale resistenza all’usura da poter essere utilizzato in applicazioni con particelle in sospensione o abrasivi e rendendo il giunto ideale per applicazioni nell’industria chimico-farmaceutica; C4, versione potenziata della C3 con guarnizione in Aflas, adatta ad applicazioni con temperature fino a 180°C; T4, in cui l’anello in carburo di tungsteno della C4 è sostituito da uno in bronzo in modo da poter essere utilizzato con olio diatermico fino a 180°C in una varietà di settori – tra cui il farmaceutico – dove le applicazioni sono particolarmente gravose”.
La tenuta meccanica è il solo aspetto dei giunti R-RH che può essere variato su richiesta?
“La tenuta meccanica è l’elemento che offre la possibilità di personalizzazione più evidente, anche perché il cliente stesso può in molti casi attuarla in autonomia: i nostri giunti R-RH sono infatti progettati con il sistema Quick Replacement Design (QRD), che consente una rapida sostituzione della tenuta meccanica senza dover rimuovere il componente dalla macchina e senza che siano richieste competenze particolari. Ma la tenuta non è la sola parte personalizzabile, nei giunti rotanti R-RH anche i componenti quali il rotore, il corpo e la testa possono essere forniti al cliente in più versioni. Sono generalmente forniti in acciaio inox, la versio-
ne più richiesta dai settori farmaceutico o alimentare, e sono molto apprezzati in applicazioni dove gli stringenti requisiti di igiene comportano pulizia con detergenti aggressivi (standard FDA) e in settori dove esiste il rischio di esplosioni (standard ATEX). L’acciaio inox non è peraltro l’unica opzione: queste parti possono essere fornite in lega Hastelloy 22, una lega nichel-cromo-molibdeno versatile e fra le più resistenti alla corrosione, utilizzata in applicazioni speciali quali le turbine eoliche. Il corpo dei giunti rotanti R-RH è disponibile anche in ottone, lega molto apprezzata per la sua capacità di mantenersi a lungo inalterata anche in ambienti umidi e salini. Esiste infine la possibilità di scegliere giunti rotanti R-RH con corpo in alluminio, un metallo resistente alla corrosione ma noto soprattutto per la sua leggerezza; questa permette di utilizzare una minor quantità di energia per movimentare le parti con le quali è realizzato, conseguendo anche un risparmio energetico”.
Un giunto “universale” dalle applicazioni “sartoriali”: che vantaggi offre questa combinazione?
“Le aziende che producono una vasta gamma di macchinari possono standardizzare progetti e ordinativi utilizzando nella maggior parte dei casi i nostri giunti R-RH, e allo stesso tempo garantire prestazioni ottimali e differenziate per ciascun macchinario, modificando la tenuta a seconda del processo produttivo di destinazione. Questo riduce la necessità di tenere a magazzino numerosi tipi di giunti diversi e consente di avere sempre a disposizione il giunto ideale gestendo solo i vari tipi di tenuta, con un immobilizzo finanziario e un’occupazione di prezioso spazio in magazzino notevolmente inferiori”. Componenti
Luigi Rolfini, Sales Manager Industry di Johnson-Fluiten
Dal 1981 FluorTecno è specializzata nella produzione di guarnizioni e articoli in PTFE di alta qualità per l’industria chimica e farmaceutica. La forza dell’azienda sta nella sua capacità di uscire dagli standard, creando articoli e soluzioni su misura con materiali ad alte prestazioni per ambienti sterili e corrosivi. Sviluppando soluzioni personalizzate per rispondere alle esigenze specifiche dei propri clienti, negli anni ha arricchito le sue competenze e i materiali lavorati, introducendo in gamma gli elastomeri e Kaflon® FFKM – perfluoroelastomero di ultima generazione. FluorTecno è presente nel settore farmaceutico, con una specializzazione nel design di soluzioni per connessioni sanitarie TriClamp. Produce guarnizioni per raccordi e compensatori (soffiet-
ti) progettati per garantire connessioni Tri-Clamp sicure e performanti, essenziali nei processi CIP e SIP. Dove l’igiene e l’affidabilità sono fondamentali l’azienda risponde con una gamma di materiali completa, tra cui PTFE Medical Grade certificato FDA e USP Classe VI, che assicurano la massima compatibilità con le normative sanitarie internazionali. Inoltre, l’azienda ha sviluppato Guaflon SS Metal Detectable, un innovativo compound conforme FDA che garantisce la rilevabilità al metal detector per evitare il rischio di contaminazione nei processi produttivi.
FluorTecno vanta un’ampia gamma di articoli per il settore pharma, progettati per garantire i più alti standard di qualità, pulizia e prestazioni. Realizziamo guar-

nizioni per raccordi, guarnizioni a labbro, O-Ring incapsulati FEP+Silicone Bianco, O-Ring in Kaflon 620W FDA, compensatori e soffietti, anelli e componenti su misura. Dove sono richieste resistenza chimica e conoscenza applicativa, siamo in grado di assistervi per trovare la soluzione che fa al caso vostro, utiliz-
zando solo materiali certificati. FluorTecno dispone di una gamma completa di articoli e soluzioni per l’industria di processo, produce guarnizioni per raccorderia, profili in gomma, soffietti, compensatori, impiantistica PTFE e una vasta selezione di articoli specifici per la manutenzione degli impianti.
Il nuovo Sistema di Interfaccia Modulare (MIS) di icotek è una soluzione innovativa per il collegamento di connettori industriali e di gestione dei cavi. Il sistema combina l’ingresso cavi divisibile con la possibilità di integrare i connettori 3A o 4A direttamente nel telaio. Sono adatti a questo scopo gli inserti 3A e 4A di icotek e di molti altri produttori. Il passacavo consente l’ingresso, la sigillatura e lo scarico della trazione di cavi con e senza connettori, con diametri da 1 a 15 mm, in conformità alla norma DIN EN 62444. I connettori industriali 3A o 4A vengono inseriti direttamente nel telaio. Il sistema completo è costituito da un telaio con alloggiamento aggiuntivo per l’inserto della presa, un co-
perchio, due viti e un elemento di bloccaggio. Il set comprende anche la controparte, una custodia per l’inserto 3A/4A e un pressacavo (M20 per 6-12 mm o M25 per 13-18 mm). Il telaio è conforme alla normativa CE e compatibile con numerosi produttori, tra cui Harting, Ilme, Phoenix Contact, TE Connectivity, Weidmüller, Lapp, Amphenol, Molex e RS Pro. Tra i vantaggi si possono annoverare:
• Risparmio di spazio: la combinazione di connettori industriali e ingresso cavi evita tagli aggiuntivi, risparmiando spazio.
• Elevato grado di protezione: il grado di protezione IP65 è ottenuto grazie alla guarnizione iniettata sul retro. Il grado di protezione IP54 si ottiene con il coperchio di protezione

disponibile come accessorio.
• Installazione semplice: i gommini passacavi vengono inseriti nel telaio. Una volta assemblato, il coperchio viene avvitato; il connettore viene innestato e bloccato in posizione con una clip.
• Flessibilità: compatibile con un’ampia gamma di produttori e adatto a diverse applicazioni industriali. Dettagli tecnici: diametri dei cavi: 115 mm; pressacavi: M20 (6 - 12 mm), M25 (13 - 18 mm); taglie dei connettori industriali: 3A, 4A; classi di protezione: IP65, IP54 opzionale; standard: UL Tpe 12, DIN EN 62444. I connettori non utilizzati possono essere coperti con un coperchio di protezione opzionale per garantire la protezione IP54.




SAVE Bergamo, la giornata verticale dedicata a strumentazione, sensoristica, automazione prosegue il proprio percorso di crescita alla Fiera di Bergamo, per beneficiare dell’indotto industriale del territorio e ampliare gli spazi a disposizione dei partecipanti.
SAVE Bergamo dà appuntamento in aprile a tutti gli operatori qualificati con una giornata dedicata ai prodotti e alle soluzioni per intelligenza artificiale, strumentazione smart, Big Data, industria 4.0, sensoristica, test & measurement, condition monitoring, asset management, efficienza energetica, raccolta dati e analisi ecc.
Il programma prevede:
✔ quattro sessioni plenarie
✔ una parte espositiva con più di cento aziende partecipanti
✔ workshop, seminari, corsi di formazione
✔ coffee-break e buffet offerti dagli sponsor
✔ in esclusiva gratuitamente tutti i contenuti in PDF




Appuntamento anche a Verona
8-9 ottobre
Supported by

Organizzato da
Partner ufficiale
Registrazione gratuita per gli operatori professionali




La tecnologia SATO PJM legge in tempi rapidissimi e con il 100% di accuratezza le etichette sulle sacche di sangue e sulle provette, garantendo massima sicurezza nel percorso dal donatore all’utente finale, che sia un paziente o un’azienda farmaceutica che produce plasmaderivati.
Il sangue è una risorsa preziosa, fondamentale per salvare vite umane e per realizzare gli emoderivati, medicinali prodotti dal plasma umano usati per trattare patologie emorragiche o immunologiche. Il sangue è anche una risorsa pubblica: raccolto attraverso donazio-
ne volontaria, periodica, responsabile, anonima e gratuita, raggiunge, dopo un percorso sicuro, affidabile ed efficiente, il destinatario finale, che può essere un paziente oppure a una casa farmaceutica che utilizza il plasma per la produzione di farmaci. La tecnologia RFID PJM di SATO, in grado di legge-
re in tempi rapidissimi e con il 100% di accuratezza le etichette sulle sacche di sangue e sulle provette anche se impilate o imballate molto strettamente, garantisce un tracciamento automatico ed efficiente senza possibilità di errori umani.
Di seguito una breve sintesi del per-
Stampante PJM

corso del sangue dal donatore all’utente finale. Il processo inizia dai Punti di Raccolta dove il sangue viene donato, raccolto in apposite sacche e in provette opportunamente etichettate, e poi inviato ai Centri di lavorazione/ qualificazione dei servizi trasfusionali, che si occupano di associare al codice univoco di ogni sacca i risultati degli esami diagnostici di validazione, quindi della trasformazione del sangue nei tre componenti fondamentali: globuli rossi, piastrine e plasma. È un processo che segue norme e procedure rigorose per garantire la qualità e la sicurezza del sangue, compresa la sua corretta conservazione.
I numeri in gioco sono significativi: da uno studio SIMTI (Società Italiana di Medicina Trasfusionale e Immunoematologia), realizzato per analizzare l’uso clinico del sangue in Italia, è emerso che in una giornata feriale(*)
sono stati trasfusi almeno 4.356 pazienti, dei quali 3.850 hanno ricevuto 6.309 unità di globuli rossi. Nello stesso giorno sono state somministrate 560 unità di piastrine a 520 persone e 194 pazienti hanno ricevuto, complessivamente, 654 unità di plasma fresco congelato. A questo si aggiunge che il Decreto del 20 giugno 2024 “Programma di autosufficienza nazionale del sangue e dei suoi prodotti per l’anno 2024” (**), riporta che nel 2023 sono state prodotte 2.518.040 unità di globuli rossi concentrati, delle quali 2.405.492 sono state trasfuse, quindi 6.500 al giorno, e che all’industria di plasmaderivazione sono stati inviati più di 900.000 kg di plasma. Per garantire la sicurezza dei pazienti la ISBT (International Society of Blood Transfusion) ha definito le linee guida che devono essere rispettate da tutti coloro che testano, modificano, distri-
Marina Scrobogna (SATO Europe): “Rispetto alla tecnologia
RFID tradizionale, PJM permette la lettura massiva di etichette molto vicine posizionate in modo casuale, ed è compatibile con i processi di centrifugazione e le tecniche di sterilizzazione a raggi X, Gamma o E.beam”
buiscono, spediscono e utilizzano prodotti medici di origine umana, ambito nel quale rientrano oltre al sangue anche cellule, tessuti, latte umano e organi. Fra i dati ritenuti indispensabili da raccogliere e mantenere aggiornati grazie ai processi di tracciamento ci sono numero identificativo della donazione, codice prodotto, provenienza, centro di distribuzione e data di registrazione.
Precisione garantita anche in caso di tag sovrapposti
L’adozione della tecnologia PJM di SATO per il tracciamento in questi processi permette di migliorarne l’efficienza, grazie alla lettura massiva e simultanea, ma soprattutto ne garantisce precisione e sicurezza, mettendo a riparo da possibili errori umani. Si tratta infatti di una tecnologia RFID HF (tecnologia di identificazione au-



tomatica in alta frequenza) che, grazie a un campo di lettura tridimensionale, garantisce assoluta precisione e certezza del dato nel tracciamento di sangue e di emocomponenti. Al valore aggiunto della tecnologia in radiofrequenza, per cui ciascun tag è associato a una memoria che si arricchisce
automaticamente con tutte le informazioni legate al processo, si aggiunge che le etichette sono lette senza errori a prescindere da orientamento e posizione reciproca delle une rispetto alle altre. Inoltre, i tag sono dotati di un sistema anticollisione radio che permette ai lettori di leggere fino a 32.000 tag simultaneamente. In questo modo non è necessario predisporre accuratamente le sacche di sangue etichettate prima di posizionarle nel lettore o nella frigo-emoteca, è infatti garantita una precisione del 100% anche in caso di tag letteralmente sovrapposti l’uno all’altro.
SATO detiene il brevetto sui lettori tridimensionali per PJM, unica tecnologia RFID menzionata dalla ISBT, e rispondente al pubblico standard ISO 18000-3 Mode 2 ed è l’unico fornitore che produce tutti i componenti ne-
SATO è stata una pioniera nel mondo della marcatura: nel 1962 produceva la prima etichettatrice manuale al mondo, nel 1981 la prima stampante termica e nel 2003 la prima stampante basata sulla tecnologia RFID. Negli anni si è specializzata nell’etichettatura: oggi produce stampanti ad alte prestazioni e offre soluzioni combinate hardware/software studiate su misura e al passo con i più recenti requisiti tecnici e ambientali. Grazie all’integrazione tra hardware, software e consumabili, SATO
cessari al suo utilizzo: oltre ai tag e alle stampanti, anche i tunnel di lettura, importanti nella fase iniziale del processo di tracciamento, i lettori desktop per le provette e i retrofit kit per le frigo-emoteche utilizzate all’interno degli ospedali per la conservazione delle sacche di sangue.
“Sviluppata da ricercatori australiani oggi parte del gruppo di ricerca e sviluppo di SATO, PJM è diventato uno standard in Australia, dove è stata scelta da diversi ospedali per gestire i processi di accettazione e di reso dei materiali necessari per gli interventi di protesi ortopedica. Rispetto alla tecnologia RFID tradizionale permette la lettura massiva di etichette molto vicine posizionate in modo casuale, ed è compatibile con i processi di centrifugazione e le tecniche di sterilizzazione a raggi X, Gamma o E.beam”, afferma Marina Scrobogna, European Blood Market Development Manager in SATO Europe. ”Confidiamo che a breve si affermerà anche in Europa e in Italia, considerato il grande interesse che abbiamo riscontrato dopo la partecipazione al Congresso ISBT (International Society of Blood Transfusion) che si è tenuto a Barcellona a giugno 2024”.
(*) sondaggio 10 aprile 2019: al sondaggio hanno risposto 153 strutture su 237 invitate. Le 153 rappresentano circa l’80% dell’attività trasfusionale nazionale in Italia (**) pubblicato in Gazzetta Ufficiale il 6/8/2024
è in grado di connettere persone, prodotti e informazioni al mondo dell’IoT. Nel 2013 ha acquisito Magellan Technology Pty Ltd, azienda australiana che ha sviluppato la tecnologia PJM: Magellan ha preso quindi il nome di SATO Vicinity ed è diventata il centro mondiale di Ricerca e Sviluppo PJM. I prodotti SATO sono utilizzati con successo nei settori alimentare, manifatturiero, sanitario oltre che nella GDO, nell’HO.RE.CA e nella logistica.
Dräger Italia, filiale italiana della multinazionale tedesca attiva nel settore della tecnologia medica e della sicurezza industriale, ha intrapreso nel 2024 un importante percorso di certificazione, testimoniando il proprio impegno verso la responsabilità sociale, la parità di genere e l‘inclusione. Seguendo l’esempio dell‘headquarter, l’azienda ha avviato un processo strutturato che porterà al conseguimento delle certificazioni entro il primo semestre del 2025.
Dräger considera questo percorso un passo fondamentale per rafforzare il proprio ruolo di azienda responsabile e innovativa. In particolare, è impegnata nell’ottenimento della certificazione SA 8000, che garantisce il rispetto dei diritti umani e delle condizioni di lavoro lungo tutta la filie-
ra, della UNI/PdR 125:2022, che promuove la parità di genere nelle organizzazioni e della UNI ISO 30415 che delinea metodi pratici per integrare diversità e inclusione nel luogo di lavoro.
“In un’epoca in cui la responsabilità sociale e l’inclusione rappresentano valori imprescindibili per il progresso della società, Dräger Italia conferma la sua volontà di contribuire attivamente a un futuro migliore”, ha commentato Annamaria Sicari, HR Manager responsabile del progetto di certificazione. “L’adesione a un percorso di certificazione non è per noi solo un traguardo, ma un punto di partenza per continuare a migliorare e a rispondere alle sfide del nostro tempo”.
Dräger si impegna a integrare pratiche responsabili e inclusive in ogni
aspetto della sua attività, contribuendo alla creazione di un ambiente di lavoro equo, sicuro e rispettoso delle risorse. Questo percorso conferma la volontà dell’azienda di mantenere standard elevati e di essere un punto di riferimento nel settore.

Per eliminare olio, grasso o inchiostro dai macchinari, l’industria, le autofficine e le tipografie utilizzano i panni. Ma cosa fare quando questi, dopo l’uso, risultano impregnati di sostanze facilmente infiammabili? Mewa offre una soluzione “a

prova di incendio”: i panni sporchi vengono raccolti in appositi contenitori di sicurezza per poi essere ritirati, lavati e riconsegnati puliti. Le aziende che operano in modo professionale sono consapevoli dei pericoli che i residui chimici presenti nei panni sporchi possono rappresentare per le persone e per l’ambiente. In particolare, la carta o i panni impregnati di sostanze facilmente infiammabili possono reagire con l’ossigeno presente nell’aria e prendere fuoco. Per questo motivo i panni Mewa vengono stoccati in appositi contenitori di sicurezza a chiusura ermetica, che sono parte integrante del servizio Mewa a 360 gradi e vengono utilizzati per lo stoccaggio e il trasporto sicuro e a norma di legge dei panni sporchi.
Il contenitore di sicurezza è a chiu-
sura ermetica, richiede poco spazio grazie al suo design compatto e può essere impilato in modo ottimale. Le ruote e le maniglie integrate ne facilitano la movimentazione e il trasporto.
Realizzato in plastica HDPE (polietilene ad alta densità), è particolarmente sicuro e robusto. Soddisfa i requisiti della normativa ADR per il trasporto di merci pericolose su strada, è testato dal TÜV e omologato dall’Istituto Federale Tedesco per la Ricerca e il Collaudo dei Materiali. Essendo una soluzione certificata per lo stoccaggio e il trasporto sicuro dei panni sporchi, risponde anche alle esigenze dei responsabili della logistica. Il contenitore è stato progettato dal fornitore di servizi tessili B2B Mewa e viene prodotto in Germania da una società del gruppo.

Geopolitica, cybersecurity, efficienza (più che crescita), IA e carenza di competenze digitali: sono le sfide cruciali che le industrie farmaceutiche dovranno affrontare nel 2025. di Paolo Amodeo*
Per le aziende industriali, il 2025 sarà un anno complesso da prevedere e affrontare, e il settore farmaceutico non fa eccezione. Oltre alle ten-
sioni internazionali e ai nuovi requisiti normativi, l’industria sta attraversando cambiamenti radicali. Le aziende devono produrre terapie sempre più complesse e personalizzate, integrare
tecnologie avanzate come l’intelligenza artificiale nella produzione e nella logistica e adattarsi a una forza lavoro in trasformazione. Queste sfide, se affrontate con le giu-

Per gestire con successo i tanti cambiamenti in corso, le aziende dovranno adottare strategie più agili, investire in tecnologie avanzate e rafforzare la resilienza operativa
ste strategie, possono trasformarsi in opportunità per migliorare efficienza, innovazione e sostenibilità. Ma quali sono le tendenze chiave che guideranno il settore nei prossimi mesi?
Trend #1 - Le tensioni geopolitiche ridisegnano le catene di fornitura e il rischio operativo Il 2025 sarà segnato dai rischi geopolitici, con impatti diretti sulle catene di approvvigionamento. La pandemia di COVID-19 ha riportato in auge dinamiche
da Guerra Fredda, con blocchi economici in competizione per sviluppare i propri vaccini e ridurre le vulnerabilità della supply chain globale. Come già visto nel 2024, le tensioni tra blocchi economici continueranno a intensificarsi, spingendo i governi a rafforzare la sicurezza delle catene di fornitura attraverso normative come il Drug Supply Security Act statunitense e il regolamento UE 2024/1860. In questo contesto, la parola chiave sarà agilità: per affrontare barriere commerciali, dazi e leggi come il Biosecure Act degli Stati Uniti, che vieta la collaborazione con fornitori legati a “avversari stranieri” (leggasi: Cina), le aziende dovranno continuamente adattare le proprie strategie. A differenza di altri settori, tuttavia, l’industria farmaceutica non sta seguendo un modello di de-globalizzazione o un forte spostamento verso la produzione locale. Invece, le aziende stanno adottando strategie di crescita graduale, puntando su fusioni, acquisizioni e scambi di asset. Con la crescita globale degli investimenti Capex in fase di stabilizzazione (CAGR Europa 5,4%, USA 15,4%), l’attenzione si sta spostando dalla costruzione di nuovi impianti all’ottimizzazione e all’espansione di quelli esistenti. Un altro elemento chiave per la resilienza è la collaborazione intersettoriale. Le partnership tra aziende consentono di condividere risorse e migliorare l’efficienza, ma possono anche creare nuove complessità normative. Per gestire queste sfide, strumenti come le supply chain towers (centri di controllo avanzati della supply chain) stanno diventando indispensabili per garantire maggiore visibilità e controllo sui processi globali.
Trend #2 - Aumento degli attacchi informatici su larga scala L’interconnessione crescente tra le aziende farmaceutiche offre vantaggi
in termini di efficienza, ma aumenta l’esposizione agli attacchi informatici. Nel 2025, la cybersecurity rimarrà una priorità assoluta per il settore. L’adozione di strumenti digitali come il monitoraggio remoto e l’analisi dei big data ha ampliato le vulnerabilità, soprattutto quando questi strumenti vengono combinati con sistemi obsoleti. Inoltre, la natura interconnessa delle catene di approvvigionamento amplifica gli effetti di una violazione, con conseguenze che si ripercuotono su tutta la filiera.
L’attacco informatico del 2024 contro Cencora, che ha compromesso le operazioni di 11 grandi aziende, ha evidenziato i rischi concreti di queste minacce. In risposta, le autorità competenti stanno inasprendo le normative sulla sicurezza. La direttiva europea NIS2, in vigore da fine 2024, impone standard di cybersecurity più rigorosi per produttori farmaceutici e strutture sanitarie.
Nonostante questi interventi, restano ancora molte lacune. In Europa, ad esempio, il 10% delle aziende del settore non dispone di un piano di gestione delle vulnerabilità, mentre quasi un quarto concentra le proprie strategie solo sulla sicurezza IT, trascurando la protezione delle tecnologie operative (OT). Colmare queste lacune richiede un cambiamento strutturale a livello di settore, con un rafforzamento della sicurezza informatica OT e una gestione più efficace di inventari e vulnerabilità.
Trend #3 - La tecnologia è sempre più orientata all’efficienza piuttosto che alla crescita Nel 2025, le aziende farmaceutiche cercheranno di sfruttare al massimo le opportunità offerte da nuove modalità terapeutiche. La crescente domanda di farmaci a base di RNA/DNA, terapie cellulari e geniche e coniugati anticorpo-farmaco sta mettendo sot-

to pressione la produzione, con sfide legate alla gestione di lotti più piccoli, processi più complessi e costi in aumento.
Questa trasformazione potrebbe coincidere con una fase di difficoltà economica. Tassi di interesse elevati, finanziamenti governativi incerti e politiche di austerità in Europa stanno spingendo molte aziende a dare priorità all’efficienza piuttosto che all’espansione.
Uno degli ambiti con il maggiore margine di miglioramento è la gestione delle informazioni. Le attività di documentazione assorbono fino al 30% del tempo del personale, a causa della necessità di numerosi inserimenti manuali. Inoltre, molte aziende lottano per digitalizzare e integrare fonti di dati fondamentali, come i registri di manutenzione e gli input dei dispositivi IoT.
Per affrontare questa sfida, aziende come Bayer stanno adottando sempre più i Digital Twin come punto di riferimento unico per la gestione delle informazioni. I vantaggi sono numerosi: decisioni più rapide, migliore organizzazione dei dati ed eliminazione dei silos informativi tra le diverse operazioni. Nel 2025, si prevede che un numero crescente di aziende utilizzerà questi strumenti anche per misu-
rare le proprie emissioni e monitorare i progressi verso gli obiettivi di carbon neutrality.
L’industria ripone inoltre grandi speranze nell’intelligenza artificiale e nel machine learning per generare valore dai precedenti investimenti in cloud e digitalizzazione. Il machine learning si sta rivelando promettente in molte applicazioni, dall’ottimizzazione dell’inventario alla gestione della qualità. Un’area in forte crescita è la manutenzione predittiva, che consente di prevenire malfunzionamenti nei sistemi produttivi prima che si verifichino.
Trend #4 - L’invecchiamento della forza lavoro
L’invecchiamento della popolazione globale sta alimentando la domanda di farmaci, ma riflette anche un problema interno al settore: la forza lavoro farmaceutica sta invecchiando. Negli Stati Uniti, oltre un terzo dei dipendenti del settore ha più di 50 anni, e la quota di lavoratori sopra i 60 è triplicata negli ultimi otto anni.
A peggiorare la situazione, il tasso di abbandono è in aumento: dal 2021, il 40% dei lavoratori ha preso in considerazione l’idea di lasciare il proprio impiego.
La carenza di competenze digitali è
un altro punto critico. Il settore affronta un divario del 14% tra il numero di offerte di lavoro e il numero di candidati qualificati. Per colmare questa lacuna, le aziende stanno aumentando gli investimenti in programmi di formazione, lavoro flessibile e iniziative per il trasferimento delle conoscenze.
Molte imprese stanno inoltre adottando strumenti digitali, come interfacce in linguaggio naturale e piattaforme di gestione delle procedure, per catturare e preservare il know-how aziendale, semplificando il percorso di apprendimento per i nuovi assunti. Queste tecnologie saranno fondamentali per evitare che le competenze critiche vadano perdute con il pensionamento dei lavoratori più esperti.
Un partner per affrontare le sfide Per navigare con successo questi cambiamenti, le aziende dovranno adottare strategie più agili, investire in tecnologie avanzate e rafforzare la resilienza operativa. È qui che soluzioni innovative come quelle offerte da Hexagon Asset Lifecycle Intelligence possono fare la differenza. Strumenti come HxGN EAM, aiutano le imprese a migliorare l’efficienza, la tracciabilità e la manutenzione predittiva, garantendo operazioni più agili e sostenibili.

Nell’industria, la misura di livello nei serbatoi diventa particolarmente interessante. Esistono diversi metodi per misurare il peso o pesare: il livello di riempimento può essere determinato otticamente, idrostaticamente, tramite ultrasuoni, microonde e radar, meccanicamente, capacitivamente, tramite dissipazione del calore, spostamento e resistenza oppure, gravimetricamente.
Secondo Wika, questa tipologia di misura offre numerosi vantaggi. Uno dei più significativi è che i trasduttori di forza utilizzati per la misura gravimetrica sono posizionati all’esterno del serbatoio, evitando il contatto diretto con il prodotto. Inoltre, non è necessario aprire o modificare i serbatoi, eliminando il rischio di contaminazione e semplificando la pulizia. È possibile ottenere misure estremamente precise: un
errore di linearità relativa dello 0,02% del carico nominale non è raro. Ciò consente anche di effettuare dosaggi accurati, ad esempio per il confezionamento di alimenti, garantendo che la quantità specificata venga rispettata. Un altro vantaggio è che il prodotto non influenza la misura. Il riempimento può essere determinato gravimetricamente per qualsiasi contenuto. Inoltre, la misura non viene falsata dalla presenza di vuoti o distribuzioni irregolari all’interno del silo o del serbatoio, poiché viene pesato l’intero contenuto. I moduli di montaggio adeguati non solo garantiscono che la forza peso venga trasmessa correttamente ai trasduttori, ma semplificano anche l’installazione. I moduli e i trasduttori di forza hanno un’altezza ridotta e un piccolo volume d’installazione. Tuttavia, se i serba-
toi sono già installati in modo permanente l’installazione può essere problematica e richiedere un grande sforzo. In tal caso, è consigliabile fissare i trasduttori di deformazione ai supporti. Questi trasduttori determinano la compressione dei supporti causata dal peso del contenuto, consentendo di pesare gravimetricamente anche serbatoi non mobili.
Gli svantaggi della misura gravimetrica del livello di riempimento dipendono dall’applicazione. Infatti, i risultati possono essere distorti principalmente quando non si riesce a evitare deviazioni di forza. Idealmente, il serbatoio dovrebbe essere meccanicamente disaccoppiato. Tuttavia, nella pratica può succedere che, ad esempio, siano necessari rinforzi strutturali, la cui influenza dipende dalla loro capacità di supporto. Più il pe-
Che si tratti di serbatoi o sili, di liquidi, materiali sfusi o singoli oggetti: la misurazione universale del livello e della distanza mediante ultrasuoni funziona in modo affidabile e preciso. Tuttavia, anche se non c’è un contatto diretto con il fluido, i vapori e i fumi aggressivi possono compromettere gravemente il funzionamento e la durata d’uso di un sensore. Ciò non vale per il nuovo sensore a ultrasuoni, interamente in metallo, di ifm. Dalla membrana al connettore, il sensore presenta un design robusto in acciaio inossidabile (AISI 316L). Per questo, il sensore è resistente alle influenze esterne con conseguente aumento della vita utile. Questo lo rende ideale per l’impiego in settori con elevate esigenze igieniche. IO-Link consente di trasmettere il valore della distanza in forma digitale o di impostare il campo di rilevamento. Grazie alla
so del serbatoio è basso rispetto al prodotto, più la misura gravimetrica è accurata. Infine, serbatoi esterni autoportanti possono essere influenzati da fattori naturali, come il vento o la neve, che possono alterare significativamente il peso.
Le celle di carico a single point sono comunemente utilizzate per le bilance. Offrono un costo contenuto e un’elevata precisione, oltre a garantire una misura affidabile del peso, indipendentemente dalla posizione sulla piattaforma. Per un’ottimale introduzione della forza, sotto serbatoi, silos o contenitori montati su supporti vengono generalmente installati celle di carico a flessione o a taglio con i relativi moduli di pesatura. Per determinare il carico nominale di questi trasduttori, si divide il peso totale del serbatoio per il numero di supporti.

risposta sulla qualità dell’eco, è possibile ottimizzare l’allineamento del sensore durante l’installazione e monitorare la sicurezza funzionale in modo costante.

Gli ecosistemi interconnessi offrono ampie opportunità all’ingegneria impiantistica. È in questo quadro che si colloca il nuovo strumento di progettazione RiPower – il successore di Power Engineering – di Rittal: grazie a flussi di lavoro semplificati, il configuratore accelera la progettazione e costruzione dei quadri elettrici in bas-
sa tensione, migliorando la collaborazione su piattaforma cloud. Progettisti e costruttori di quadri elettrici ricevono un supporto diretto per progettare i propri sistemi, con un’integrazione digitale diretta ai prodotti e alle soluzioni software consolidate di Rittal ed Eplan. RiPower è uno strumento semplice con cui gli utenti possono non solo effettuare il progetto del loro sistema in modo rapido e semplice, ma anche ottenere il massimo comfort di progettazione, grazie alla gestione dei dati garantita dalle soluzioni Rittal e dai software Eplan. Questo rende molto più semplice la gestione dei sistemi di distribuzione dell’energia e dei componenti per barre collettrici. RiPower è facile da utilizzare e user-friendly. Con un
Probiotical, specialista italiana nella produzione di probiotici, ha scelto Syscons Industries, parte del Gruppo Impresoft, e gli strumenti di Rockwell Automation al fine di accelerare la propria trasformazione digitale. Per rispondere alla rapida e crescente richiesta di prodotti naturali e all’esigenza di incrementare la capacità produttiva dello stabilimento, Probiotical ha intrapreso il percorso di trasformazione digitale nel 2022. La scelta del software ThingWorx IIoT, parte della soluzione FactoryTalk® InnovationSuite sviluppata da PTC è risultata
semplice clic del mouse, gli utenti possono selezionare il configuratore RiPower da una serie di applicazioni con lo stesso design, come Eplan Data Portal, eStock o RiTherm. Questo strumento consente la configurazione non solo dei sistemi Ri4Power ma anche di RiLine e dei nuovi sistemi RiLineX. RiPower genera automaticamente il progetto del quadro elettrico, grazie a un sistema di query intelligenti. Sistemi conformi agli standard garantiscono la protezione delle persone e degli impianti e con RiPower è impossibile effettuare una progettazione errata. Gli utenti beneficiano della creazione automatica della documentazione e delle verifiche di progetto in conformità alla norma IEC 61439-1; inoltre, possono creare le verifiche di
aderente alle necessità espresse dal cliente. La soluzione ThingWorx IIoT, in particolare, ha consentito l’interconnessione tra diversi macchinari, dai fermentatori alle linee di confezionamento, integrando i dati di produzione con le informazioni transazionali provenienti dal sistema ERP. Grazie a questo approccio, Probiotical è ora in grado di monitorare indicatori chiave di prestazione (KPI), analizzare l’efficienza complessiva delle apparecchiature (OEE) e interpretare tendenze in tempo reale per ottimizzare le operazioni quoti-
progetto utilizzando un format dedicato. Una volta completata la configurazione, RiPower genera istruzioni di assemblaggio che consentono un’installazione rapida e conforme agli standard. Su richiesta, il sistema può essere preassemblato presso il Rittal Application Center. Oltre a generare la documentazione di progetto, con un semplice click, gli utenti possono ordinare i componenti direttamente dal Rittal online shop o richiedere un’offerta dettagliata. RiPower si integra perfettamente nell’ecosistema esistente di Rittal ed Eplan: i dati generati dal configuratore, come le distinte base, possono essere ulteriormente elaborati in Eplan P8 o AutoCAD, ed è anche possibile collegare le macchine utensili del Rittal Automation System per la lavorazione del rame.
diane e andare incontro alla crescente domanda di mercato.
“Cercavamo una soluzione completa, supportata da partner competenti in grado di affiancarci lungo il percorso”, ha dichiarato Gianmaria Camanna, COO di Probiotical. “Abbiamo riconosciuto il valore del software FactoryTalk® InnovationSuite e apprezzato l’assistenza fornita dal system integrator locale, Syscons Industries, parte del gruppo Impresoft”. Infine, Pierpaolo Russo, responsabile Smart Manufacturing presso Syscons Industries, che ha guidato l’implementazione della piattaforma IIoT per Probiotical, ha evidenziato l’importanza della collaborazione per il successo del progetto.
Schneider Electric sta introducendo una nuova tecnologia di cablaggio nelle sue gamme di pulsanteria Harmony XB4 e XB5. Grazie al suo know how nell’innovazione delle interfacce uomo-macchina, l’azienda amplia e modernizza la sua offerta in modo da semplificare la vita agli utenti. Gli elementi di contatto e LED universali in versione push-in compatti sono un esempio di questo approccio e diventeranno, probabilmente, un nuovo standard per il futuro. Nelle varie gamme di unità di comando e segnalazione oggi sul mercato − che si differenziano tra loro per la tecnologia di installazione − si adottano diver-
si metodi di cablaggio rapido, accomunati da una caratteristica comune: la possibilità di non usare attrezzi per collegare i cavi elettrici. L’utilizzo di connettori Faston o a innesto è molto comune in applicazioni specializzate, ma in molte applicazioni di uso generale oggi si impiegano connettori con morsetto a molla. In questo caso, il componente è di facile utilizzo: azionando una levetta, il morsetto si apre lasciando spazio sufficiente a inserire uno o più fili in ogni terminale. Riportando la levetta alla posizione iniziale, il morsetto si chiude sul cavo, che viene quindi efficacemente bloccato per assicurare la continuità elettrica
Gli encoder Baumer del marchio “Hübner-Berlin” sono da 70 anni il punto di riferimento per le applicazioni HeavyDuty. Con la nuova serie HOG800, Baumer presenta la generazione di questi modelli con una migliore protezione contro cablaggi errati, le correnti parassite, le sovratensioni e le sollecitazioni meccaniche. L’azienda ha reso disponibili le funzioni intelligenti della sua completa piattaforma di encoder industriali per applicazioni HeavyDuty. Ciò include la parametrizzazione intelligente della risoluzione, del livello di uscita, del senso di rotazione e l’integrazione nel software Baumer Sensor Suite. Sono inoltre disponibili nuove funzioni di monitoraggio dello stato del sensore, della temperatura e del tempo di funzionamento. La serie HOG800 comprende encoder ad alte prestazioni per applicazioni esigenti che richiedono i massimi standard di affidabilità e precisio-

quando i contatti vengono aperti o chiusi utilizzando un elemento di comando tipo pulsante.
Tra le aree di miglioramento c’è l’impossibilità fisica di sovrapporre contatti su più livelli, che
ne. Questi encoder HeavyDuty, particolarmente robusti, sono adatti per l’impiego in motori asincroni, gru, paranchi e laminatoi a freddo. Grazie al design compatto e versatili funzioni di protezione, la serie HOG800 è la scelta ideale per il rilevamento della velocità nei motori asincroni in ambienti difficili.
Le funzioni intelligenti della serie HOG800 semplificano notevolmente la messa in servizio e la manutenzione: il software Baumer Sensor Suite permette di leggere ed etichettare facilmente le targhette elettroniche, parametrare la risoluzione e il circuito di uscita e interrogare i messaggi di stato. Il sistema di monitoraggio controlla continuamente lo stato del sensore, le uscite, la temperatura e la durata di vita permettendo così di rilevare tempestivamente eventuali malfunzionamenti.
La serie HOG800 convince anche per il
può essere un ostacolo se il pulsante esercita più funzioni combinate.
Questo metodo di cablaggio è già oggi utilizzato per vari prodotti quali morsetti e basi relè: è una tecnologia matura per essere integrata anche nella gamma di blocchi contatto e lampade spia Harmony XB4 e XB5.
Il principale vantaggio che offre è che gli utenti dovranno connettere solo i cavi verso il blocco installati dietro la testa del pulsante.
Passando quindi da un connettore a molla a una connessione push-in, la gamma Schneider Electric a connessione rapida ottiene anche un altro vantaggio significativo: il risparmio di spazio.

suo design salvaspazio, con custodia di soli 84 mm. Il montaggio in campo, sigillato e facile da usare, consente un’installazione semplice anche in condizioni difficili. Un altro vantaggio è l’unità di rilevamento incapsulata che durante l’installazione della morsettiera protegge da sporco e polvere in conformità alla classe di protezione IP40. Inoltre, la morsettiera con terminali push-in garantisce un cablaggio semplice e sicuro. Il guidafili separa i fili della morsettiera dall’asse per evitare che i cavi si incastrino o si danneggino.
L’encoder incrementale HeavyDuty HOG860 della serie HOG800 installato in un motore di grandi dimensioni. Copyright: Baumer

I premi Nobel 2024 per la Fisiologia e Medicina hanno scoperto i microRNA, piccole sequenze di oligonucleotidi presenti nelle parti non codificanti del DNA umano, che svolgono un ruolo essenziale nella regolazione dell’espressione genica a livello post-traslazionale.
di Filippo Neri
Avevamo citato i microRNA tra le diverse tipologie di acido ribonucleico (RNA) che possono essere utilizzate per mettere a punto farmaci innovativi ad azione mirata sul materiale genetico del paziente, nell’articolo pubblicato sul numero di aprile/maggio 2024 di ICF.
L’importanza di questa tipologia di molecole di RNA è stata pienamente riconosciuta con l’assegnazione,
nell’ottobre 2024, del premio Nobel per la Fisiologia e la Medicina a Victor Ambros e Gary Ruvkun, i due scienziati americani che hanno per primi scoperto i microRNA. Ritorniamo quindi sull’argomento per approfondire più nel dettaglio di cosa si tratta quando di parla di microRNA e le possibili applicazioni di questa nuova tecnologia.
Piccole molecole di RNA che regolano l’espressione genica Il termine microRNA si riferisce a una
nuova classe di piccole molecole di acido ribonucleico con lunghezza di 20-35 nucleotidi e che sono coinvolte nei processi di regolazione genica. Tali processi svolgono un’importanza fondamentale per il corretto funzionamento dell’organismo e, di conseguenza, per il mantenimento dello stato di salute. È proprio grazie alla regolazione genica, infatti, che i diversi tipi di cellule riescono ad attivare in modo selettivo un determinato insieme di geni finalizzato alla messa in atto di un
certo processo fisiologico. Diventa così possibile, a partire dal DNA comune a tutte le cellule, esprimere in modo selettivo gli RNA messaggeri (mRNA) che partecipano al processo di trascrizione, che conduce a sua volta alla sintesi diverse proteine da parte dei diversi tipi di cellule. Cellule che differiscono tra loro anche per forma, funzioni, presenza di certi cammini di segnale o metabolici ecc. Fin qui tutto normale, sono cose che si imparano fin dai banchi delle scuole medie.
Fino all’ultimo trentennio, invece, un grande “buio” caratterizzava la comprensione del ruolo delle parti non codificanti del DNA, che ne costituiscono in realtà la maggior parte. Le ricerche premiate nel 2024 con il Nobel per la Fisiologia e la Medicina hanno iniziato a far luce su tale comprensione. È stato gra-
zie al lavoro di Victor Ambros e Gary Ruvkun, infatti, che si è pienamente compreso il ruolo che il migliaio e più di geni che codificano corte sequenze di RNA non codificante (i microRNA) all’interno del genoma (umano e non solo) svolgono a livello della regolazione genica. La banca dati miRBase che raccoglie i geni codificanti i microRNA comprende attualmente le sequenze di oltre 38 mila precursori della forcella (hairpin precursors) e di più di 48 mila geni microRNA maturi relativi a 271 diversi organismi [1].
Le ricerche premiate col Nobel L’attenzione di Victor Ambros e Gary Ruvkun si è focalizzata, già nel 1993, su un mutante del nematode Caenorhabditis elegans (C. elegans) recante difetti genetici derivanti da alterazioni dei loci geni-
ci lin-4 e lin-14. Il fenotipo corrispondente al gene lin-4 mutante, in particolare, corrisponde a un verme mancante di molti tipi di cellule e strutture morfologiche, mentre lin-14 presenta difetti temporali di sviluppo [2].
Victor Ambros ha per primo dimostrato che il gene lin-4 codifica un corto oligonucleotide di RNA (solo 22 residui), le cui funzioni sono state poi approfondire dal laboratorio di Ruvkun: lin-4, in partico-
Il termine microRNA si riferisce a una nuova classe di piccole molecole di acido ribonucleico con lunghezza di 20-35 nucleotidi e che sono coinvolte nei processi di regolazione genica. Tali processi sono fondamentali per il corretto funzionamento dell’organismo e quindi per il mantenimento della salute

La presenza di specifiche mutazioni nei geni microRNA o nei componenti del cammino di biogenesi è stata legata alla comparsa di numerose malattie
lare, regola l’altro gene lin-14 mediante vari elementi presenti nella regione non tradotta al terminale 3’(3’UTR). La proteina nucleare derivante da lin-14 è caratterizzata da espressione specifica in ogni stadio dello sviluppo (elevata nello stadio L1) e risulta alterata nei mutanti.
I due scienziati americani hanno inoltre evidenziato una parziale complementarietà nella sequenza del microRNA non codificante lin-4 e gli elementi 3’UTR di lin-14. Ruvkun ha anche rilevato come la delezione di elementi 3’UTR non abbia effetti sulla sequenza della proteina, portandolo a ipotizzare l’esistenza di un meccanismo post-trascrizionale che agisca sulla stabilità del mRNA, sull’export nucleare o sulla traduzione. Nel 1993 sono stati pubblicati due articoli su Cell [3,4] che contengono la dimostrazione di quanto fin qui descritto.
La ricerca è proseguita con la scoperta, nel 2000, del microRNA let7 (21 nucleotidi) altamente conservato e a partire dal quale sono stati individuati e clonati una vasta se-
rie di microRNA omologhi in molte specie animali (sia invertebrati che vertebrati) e nell’uomo.
È stato così possibile determinare che i microRNA rappresentano un vasto gruppo di regolatori che controllano l’espressione dei geni codificanti proteine. Questo raffinato meccanismo svolge compiti importanti nello sviluppo dell’organismo e nel funzionamento dei tessuti adulti.
Come funzionano i microRNA
Sulla base di questi primi risultati, gli anni 2000 hanno segnato un crescendo della ricerca. Tra i principali risultati figura la comprensione che molti geni microRNA rappresentano unità indipendenti posizionate nelle regioni non codificanti del DNA (intergenic-derived microRNA), che possiedono regioni promotrici uniche e possono venire trascritti dagli enzimi RNA polimerasi II e III. Altri si collocano invece all’interno degli introni dei geni codificanti per le proteine, sono con esse coespressi e vengono trascritti solo dalla RNA polimerasi II (intragenic-derived microRNA) [5].
I cosiddetti microRNA primari canonici (pri-microRNAs), inoltre, sono trascritti dall’enzima RNA polimerasi e sono caratterizzati dalla presenza di una sequenza con struttura a forcella, necessaria per il loro processamento all’interno del nucleo da parte di un enzima endonucleasi. Si viene così a formare il microRNA precursore (pre-microRNA), composto da 60-70 nucleotidi, che viene quindi trasportato nel citoplasma della cellula, dove viene processato ad opera dell’endonucleasi Dicer, con formazione di un duplex. A questo punto, il filamento efficace viene caricato nel complesso silenziatore dalle proteine “argo-
naute”, formando il miR-induced silencing complex (miRISC) e diventa così in grado di esercitare la sua funzione di regolazione. Il secondo filamento viene invece degradato. Il complesso silenziatore è alla base anche di meccanismi di silenziamento genico che vedono coinvolti altre tipologie di RNA (siRNA, piRNA, rasiRNA), complessivamente noti come interferenza dell’RNA (RNAi). A differenza degli RNAi, che rappresentano soprattutto un meccanismo difensivo contro le infezioni virali e contro attività indesiderate di elementi genomici mobili, i microRNA esercitano un controllo post-trascrizionale sugli RNA messaggeri lungo tutto l’arco dello sviluppo e delle varie tipologie di cellule adulte.
La presenza di specifiche mutazioni nei geni microRNA o nei componenti del cammino di biogenesi è stata legata alla comparsa di numerose malattie. La sindrome Dicer1, ad esempio, è una malattia rara che predispone alla comparsa di vari tipi di tumori. Altre mutazioni sono legate, tra gli altri, alla perdita progressiva di capelli (miRNA-96), alla comparsa di una malattia rara degli occhi, la sindrome Edict (miRNA-184) o a problematiche scheletriche congenite (miRNA-140-5p).
Le applicazioni diagnostiche e terapeutiche
Il processo dell’interferenza dell’RNA si è rivelato presto un target interessante per la messa a punto di nuovi approcci diagnostici e terapeutici. La capacità dei microRNA di regolare cammini di segnale comuni o diversi indirizzando, ad esempio, la trascrizione genica verso processi di repressione, rottura o degradazione dell’RNA messaggero ren-
sono i vincitori
Il premio Nobel 2024 per la Medicina è stato assegnato ai due scienziati che hanno scoperto le molecole di microRNA. Si tratta degli americani Victor Ambros e Gary Ruvkun. Il primo, nato nel 1953, ha conseguito un PhD presso il Massachusetts Institute of Technology (MIT), dove ha operato fino al 1985. È stato docente presso la Dartmouth Medical School (1992-2007) ed è attualmente Silverman Profes-
de queste molecole interessanti per modulare varie funzioni cellulari. I nuovi approcci terapeutici che sfruttano tecnologie microRNA sono ancora in massima parte in fase di sviluppo clinico [5,6]. Uno sviluppo che pone in realtà molte sfide, in quanto le modifiche chimiche apportate e le tecnologie di delivery utilizzate per migliorare la stabilità ed efficacia possono dar luogo ad alterazioni della struttura degli oligonucleotidi sintetici rispetto a quelli naturali, con possibili effetti off-target e impatto sull’attività biologica e sulla sicurezza per il paziente. I microRNA possono venire utilizzati, ad esempio, quali antagonisti atti a inibire o reprimere l’espressione o la funzione del gene target (anti-miRNA), ovvero per rimpiazzarlo. Il primo approccio potrebbe essere utilizzato, in modo particolare, nel caso di patologie che presentino una sovra-espressione di taluni geni, come succede spesso nei tumori. Il secondo, invece, può rappresentare una terapia sostitutiva in grado di ripristinare le funzioni di geni di-
sor di Scienze Naturali alla University of Massachusetts Medical School.
Gary Ruvkun è nato nel 1952 e si è dottorato presso l’Università di Harvard, per poi operare come post-doc al MIT (19821985). Divenuto nel 1985 Principal Investigator presso il Massachusetts General Hospital e la Harvard Medical School, insegna Genetica presso la stessa università.
(fonte: Fondazione Nobel)
fettosi o mancanti. Gli approcci microRNA, inoltre, potrebbero consentire di agire anche nei confronti di target non altrimenti raggiungibili da altre tipologie più tradizionali d’intervento. Non scendiamo oltre nei dettagli tecnologici dei microRNA, rimandando i lettori interessati alla bibliografia citata.
Riportiamo, invece, qualche esempio recente tra la gran mole di studi sui possibili utilizzi di queste molecole, con particolare attenzione a ciò che si sta sviluppando in Italia. Uno studio di fase I pubblicato nel 2023 nel Journal of Hematology & Oncology ad opera del gruppo di ricerca guidato da Pierfrancesco Tassone (Università della Magna Grecia di Catanzaro) ha investigato miR-21, un microRNA la cui sovra-espressione è stata associata alla comparsa di diversi tipi di tumori [7,8]. I dati della sperimentazione first-in-human in pazienti oncologici in fase avanzata e non responsivi ai trattamenti tradizionali appaiono indicare risultati incoraggianti per il proseguo della ricerca.


Il fatto che un microRNA possa legarsi a diversi geni è stato sfruttato anche per la messa a punto di test diagnostici basati sull’utilizzo di questi oligonucleotidi quali biomarcatori. Il progetto miRNA-disEASY, ad esempio, è stato condotto con fondi europei e ha visto lo sviluppo di un test ad alta risoluzione (base singola) con utilizzo di un sensore biofotonico per il rilevamento dei microRNA. È stato così possibile profilare i microRNA direttamente da biopsia liquida e valutare l’applicabilità del metodo a varie tipologie di tumore polmonare [9].
Sempre nel campo della diagnostica, porta la firma dei ricercatori dell’Istituto Italiano di Medicina Genomica uno studio pubblicato su Gastroenterology [10] nel quale sono stati identificati cinque diversi microRNA che hanno permesso di distinguere i pazienti affet-
Victor Ambros e (sotto) Gary Ruvkun hanno ricevuto il premio Nobel per la medicina nel 2024, grazie alla scoperta delle molecole di microRNA
ti da carcinoma del colon-retto da persone sane. Il metodo potrebbe venire ulteriormente sviluppato per lo screening non invasivo di campioni fecali, hanno indicato i ricercatori, nell’ambito della prevenzione precoce di questo tipo di tumore. Un gruppo di ricerca dell’Istituto superiore di sanità ha invece utilizzato nanoparticelle di chitosano funzionalizzate per veicolare il microRNA miR126, identificato quale possibile agente oncosoppressore nel trattamento del melano -
ma metastatico e di alte tipologie di tumori. I test in vitro e in vivo su modelli animali hanno visto la somministrazione delle nanoparticelle in combinazione con un inibitore PI3K/AKT, con riduzione della crescita tumorale e della formazione di metastasi a fegato e polmoni [11].
I microRNA possono essere anche veicolati mediante vettori virali, come ad esempio nel caso di AMT130, prodotto in sviluppo da parte dell’azienda olandese uniQure che ha ricevuto designazione a farma -
[1] miRBase: the microRNA database the archive for microRNA sequences and annotations, https://www.mirbase.org/
[2] Rickard Sandberg, Scientific background 2024. For the discovery of microRNA and its role in post-transcriptional gene regulation, Nobelförsamlingen, Nobel Foundation, https:// www.nobelprize.org/uploads/2024/10/advanced-medicineprize2024-2.pdf
[3] Lee, R.C., Feinbaum, R.L. and Ambros, V. (1993), The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14, Cell, 75(5), pp. 843–854. https://doi.org/10.1016/00928674(93)90529-y
[4] Wightman, B., Ha, I. and Ruvkun, G. (1993), Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans, Cell, 75(5), pp. 855–862. Available at: https://doi.or g/10.1016/0092-8674(93)90530-4
[5] Gavin M. Traber and Ai-Ming Yu , RNAi-Based Therapeutics and Novel RNA Bioengineering Technologies, J Pharmacol Exp Ther 384:133–154, January 2023, dx.doi.org/10.1124/ jpet.122.001234
[6] Momin, M.Y.; Gaddam, R.R.; Kravitz, M.; Gupta, A.; Vikram, A. The Challenges and Opportunities in the Development of MicroRNA Therapeutics: A Multidisciplinary Viewpoint. Cells 2021, 10, 3097. https://doi.org/10.3390/cells10113097
[7] Tassone et al. Journal of Hematology & Oncology (2023) 16:68, https://doi.org/10.1186/s13045-023-01468-8
[8] Enrico Orzes, La ricerca italiana scommette sugli inibitori di microRNA contro il cancro, Osservatorio terapie avanzate, 13 Settembre 2023
co orfano per il trattamento della malattia di Huntington da parte dell’Agenzia europea dei medicinali e quella di Regenerative Medicine Advanced Therapy (RMAT) da parte di FDA. Il prodotto è attualmente in fase I/II di sviluppo clinico, con dati preliminari incoraggianti [12,13]. Ci sarebbero tanti altri esempi possibili, ma lo spazio è terminato. Includiamo in bibliografia qualche ulteriore riferimento per chi desideri approfondire oltre questo complesso argomento [14-16].
[9] microRNA biomarkers in an innovative biophotonic sensor kit for high-specific diagnosis, portale Cordis, https:// cordis.europa.eu/article/id/418023-small-but-mighty-harnessing-micrornas-for-lung-cancer-diagnosis/it
[10] Pardini B. et al., A Fecal MicroRNA Signature by Small RNA Sequencing Accurately Distinguishes Colorectal Cancers: Results From a Multicenter Study. Gastroenterology. 2023 Sep;165(3):582-599.e8., https://doi.org/10.1053/j.gastro.2023.05.037
[11] M.B. Arasi et al., MiR126-targeted-nanoparticles combined with PI3K/AKT inhibitor as a new strategy to overcome melanoma resistance, Molecular Therapy Vol. 32 No 1 January 2024, https://doi.org/10.1016/j.ymthe.2023.11.021
[12] Silencing the mutant huntingtin gene, uniQrue, https:// www.uniqure.com/programs-pipeline/huntingtons-disease
[13] uniQure Announces Positive Interim Data Update Demonstrating Slowing of Disease Progression in Phase I/II Trials of AMT-130 for Huntington’s Disease, https://uniqure.gcs-web. com/news-releases/news-release-details/uniqure-announces-positive-interim-data-update-demonstrating
[14] A. AIta et al., I micro-RNA quali potenziali biomarcatori per la diagnosi e la prognosi del cancro del pancreas: scelte metodologiche e criticità, Biochimica clinica, 2021, vol. 45, n. 1, 26-34, doi…
[15] Ho, P.T.B.; Clark, I.M.; Le, L.T.T. MicroRNA-Based Diagnosis and Therapy. Int. J. Mol. Sci. 2022, 23, 7167. https:// doi.org/10.3390/ijms23137167
[16] Seyhan, A.A. Trials and Tribulations of MicroRNA Therapeutics. Int. J. Mol. Sci. 2024, 25, 1469. https://doi. org/10.3390/ijms25031469


questo
In nero sono indicate le inserzioni pubblicitarie:
RIVISTA DELL’
DIRETTORE RESPONSABILE: Simone Ghioldi REDAZIONE: Alessandro Bignami (a.bignami@interprogettied.com), Eva De Vecchis (e.devecchis@interprogettied.com)
HANNO COLLABORATO: Paolo Amodeo, Filippo Neri
INTERPROGETTI EDITORI S.R.L.
via Roggia Borromea, 16 - 22060 Carugo (CO) Redazione, vendite e abbonamenti Tel./fax +39 031 3665163 www.interprogettied.com
DIRETTORE COMMERCIALE: Marika Poltresi
VENDITE: Simone Ghioldi (vendite@interprogettied.com) Michela Ghioldi (estero, michela@interprogettied.com)
AMMINISTRAZIONE: amministrazione@interprogettied.com
SEGRETERIA COMMERCIALE: Raffaella Sepe (raffaella@interprogettied.com)
©Copyright Interprogetti Editori Srl
Le rubriche e le notizie sono a cura della redazione. È vietata la riproduzione, anche parziale, di testi, fotografie e disegni senza autorizzazione scritta.
TARIFFE ABBONAMENTI:
Italia: spedizione ordinaria € 45,00, contrassegno € 48,00
Estero: spedizione ordinaria € 60,00, spedizione prioritaria Europa € 70,00
Spedizione prioritaria Africa, America, Asia € 85,00
Spedizione prioritaria Oceania € 100,00
Una copia: € 10,00
L’Iva sugli abbonamenti nonché sulla vendita dei fascicoli separati è assolta dall’editore ai sensi dell’art. 74 primo comma lettera C del 26/10/72 n. 633 e successive modificazioni e integrazioni. Pertanto non può essere rilasciata fattura.
Registrazione Tribunale di Milano n. 259 in data 07/05/2010 - Iscrizione al ROC nr. 19882
Direttore Responsabile: Simone Ghioldi
Finito di stampare il 20/3/2025 presso Litogi, Milano
Informativa ai sensi dell’art. 13 d. leg. 196/2003. I dati sono trattati, con modalità anche informatiche, per l’invio della rivista e per svolgere le attività a ciò connesse. Titolare del trattamento è Interprogetti Editori S.r.l. - via Maggiolino 34F - 23849 Rogeno (LC). Le categorie di soggetti incaricati al trattamento dei dati per le finalità suddette sono gli addetti alla registrazione, modifica, elaborazione dati e loro stampa, al confezionamento e spedizione delle riviste, al call center, alla gestione amministrativa e contabile. Ai sensi dell’art. 7 d. leg. 196/2003 è possibile esercitare i relativi diritti tra cui consultare, modificare, aggiornare e controllare i dati, nonché richiedere elenco completo ed aggiornato, rivolgendosi al titolare al suddetto indirizzo. Informativa dell’editore al pubblico ai sensi del decreto legislativo 30 giugno 2003, n° 196 e dell’art. 2 comma 2 del Codice deontologico relativo al trattamento dei dati personali nell’esercizio dell’attività giornalistica. Interprogetti Editori - titolare del trattamento - rende noto che presso i propri locali siti in Rogeno (LC) vengono conservati gli archivi personali e di immagini fotografiche cui i giornalisti, praticanti e pubblicisti e altri soggetti (che occasionalmente redigono articoli o saggi) che collaborano con il predetto titolare attingono nello svolgimento della propria attività giornalistica per le finalità di informazione connesse allo svolgimento della stessa.
I soggetti che possono conoscere i predetti dati sono esclusivamente i predetti professionisti, nonché gli addetti preposti alla stampa ed alla realizzazione editoriale della testata. Ai sensi dell’art. 7 d. lgs. 196/2003 si possono esercitare i relativi diritti, tra cui consultare, modificare, cancellare i dati od opporsi al loro utilizzo, rivolgendosi al predetto titolare. Si ricorda che, ai sensi dell’art. 138 d. lgs. 196/2003, non è esercitabile il diritto di conoscere l’origine dei dati personali ai sensi dell’art. 7, comma 2, lettera a), d. lgs. 196/2003, in virtù delle norme sul segreto professionale, limitatamente alla fonte della notizia.








La tecnologia è l’espressione delle persone che la sviluppano. Il nuovo sensore di livello radar VEGAPULS 6X è il risultato dell’impegno di circa 1800 preziosi collaboratori, di oltre 60 anni di esperienza nel campo della tecnica di misura e dei valori a cui si ispira VEGA. VEGA. HOME OF VALUES. www.vega.com/radar
