256 • Kapittel 7
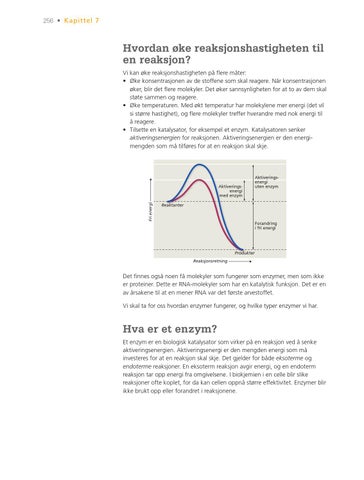
Hvordan øke reaksjonshastigheten til en reaksjon? Vi kan øke reaksjonshastigheten på flere måter: • Øke konsentrasjonen av de stoffene som skal reagere. Når konsentrasjonen øker, blir det flere molekyler. Det øker sannsynligheten for at to av dem skal støte sammen og reagere. • Øke temperaturen. Med økt temperatur har molekylene mer energi (det vil si større hastighet), og flere molekyler treffer hverandre med nok energi til å reagere. • Tilsette en katalysator, for eksempel et enzym. Katalysatoren senker aktiveringsenergien for reaksjonen. Aktiveringsenergien er den energi mengden som må tilføres for at en reaksjon skal skje.
Fri energi
Aktiveringsenergi med enzym
Aktiveringsenergi uten enzym
Reaktanter
Forandring i fri energi
Produkter Reaksjonsretning
Det finnes også noen få molekyler som fungerer som enzymer, men som ikke 0531_Aktiveringsenergi.pdf er proteiner. Dette er RNA-molekyler som har en katalytisk funksjon. Det er en av årsakene til at en mener RNA var det første arvestoffet. Vi skal ta for oss hvordan enzymer fungerer, og hvilke typer enzymer vi har.
Hva er et enzym? Et enzym er en biologisk katalysator som virker på en reaksjon ved å senke aktiveringsenergien. Aktiveringsenergi er den mengden energi som må investeres for at en reaksjon skal skje. Det gjelder for både eksoterme og endoterme reaksjoner. En eksoterm reaksjon avgir energi, og en endoterm reaksjon tar opp energi fra omgivelsene. I biokjemien i en celle blir slike reaksjoner ofte koplet, for da kan cellen oppnå større effektivitet. Enzymer blir ikke brukt opp eller forandret i reaksjonene.