Il virus respiratorio sinciziale: strategie di prevenzione per la protezione di tutti gli infanti
Supplemento N°4 a MTD - Dicembre 2022 - Anno 7 - N°4
Trimestrale Gratuito di divulgazione Medico-Scientifica
Pubblicazione registrata al Tribunale di Napoli n°49 del 17 ottobre 2016
Editore Improve Communications
Via Diomede Carafa, 58 - Palazzo Geranio - 80124 - Napoli
Direttore Responsabile Gianluca Passaretti
Direttore Scientifico
Prof.ssa Maria Triassi
Professore Ordinario di Igiene e Medicina Preventiva Direttore Dipartimento di Sanità PubblicaUniversità degli Studi di Napoli Federico II - Direttore del DAI di Sanità Pubblica e Farmacoutilizzazione - AOU Federico II - Presidente Commissione Vaccini Regione Campania
Coordinatore del Comitato Scientifico
Andrea Simonetti - Professore a contratto Università Degli Studi Di Napoli Federico II - Già Direttore Sep Asl Na 1 Centro
Comitato Scientifico:
› Sandro Cinquetti - Direttore del Servizio Igiene e Sanità Pubblica -Direttore ad interim del Servizio di Medicina Legale Dipartimento di Prevenzione - Azienda ULSS 2 Marca trevigiana
› Ivan Gentile - Professore Associato di Malattie Infettive - Direttore Unità Operativa Complessa di Malattie Infettive - Università Degli Studi Di Napoli Federico II
› Ilaria Loperto - Dipartimento di Sanità Pubblica - Università Degli Studi Di Napoli Federico II
› Rosanna Ortolani - Responsabile Sep Asl Na 1 Centro
› Raffaele Palladino - Ricercatore di Igiene generale e applicata - Università Degli Studi Di Napoli Federico II
› Mariagrazia Panico - Commissione Vaccini Regione Campania
› Rocco Russo - Pediatra U.O. Materno Infantile Asl Benevento
› Marina Silvia Scamardo - Specialista Igiene e Medicina Preventiva Università Degli Studi Di Napoli Federico II
› Massimo Valsecchi - Ex Direttore Dipartimento Prevenzione Ulss 20 Verona
Direzione e redazione
Via Diomede Carafa, 58 - Palazzo Geranio - 80124 - Napoli tel: 081 0100952 e-mail: info@improvecommunications.it web: www.improvecommunications.it
Direzione grafica ed impaginazione: Alessia Di Maio
Diffusione: Periodico Telematico | Service Provider ARUBA S.P.A. Loc. Palazzetto, 4 - 52011 Bibbiena (AR)
In questo numero di Prevenzione e Sanità Pubblica
IL VIRUS RESPIRATORIO SINCIZIALE: STRATEGIE DI PREVENZIONE PER LA PROTEZIONE DI TUTTI GLI INFANTI
Virologia
Il virus respiratorio-sinciziale umano (RSV) è un virus a RNA a singolo filamento della famiglia Paramyxoviridae, il cui genoma comprende 10 geni che codificano per 11 proteine. Due proteine di superficie, la proteina F (fusione) e la proteina G (glicoproteina di attacco), sono i principali antigeni virali e svolgono un ruolo critico nella virulenza dell’RSV. Un antigene è una sostanza in grado di essere riconosciuta dal sistema immunitario come estranea o potenzialmente pericolosa. Il sistema immunitario cerca di neutralizzare qualsiasi antigene che riconosca come estraneo e potenzialmente dannoso. La proteina G media l’attacco di RSV alla cellula ospite, poi la proteina F consente la fusione dell’ospite e delle membrane plasmatiche virali per consentire il passaggio del virus nella cellula. La proteina F promuove anche l’aggregazione delle cellule multinucleate attraverso la fusione delle loro membrane plasmatiche, producendo i sincizi, che danno il nome al virus, e consente la trasmissione del virus da cellula a cellula. Le proteine F e G inducono risposte anticorpali neutralizzanti protettive. Una risposta immunitaria efficace e tempestiva
contro la proteina F può prevenire gravi manifestazioni dell’infezione.(1) Inoltre, la proteina F è caratterizzata da una notevole conservazione inter-ceppo, che la rende un bersaglio eccellente per potenziali vaccini e anticorpi monoclonali (mAbs).(2) La proteina G è importante per l’induzione di anticorpi protettivi e la modulazione dell’immunità dell’ospite.(2) RSV ha 2 sottotipi antigenici distinti, A e B, che di solito sono presenti nelle comunità durante le epidemie stagionali. Resta controverso se il sottotipo A sia più fortemente associato ad una malattia grave.
Epidemiologia e Fattori di Rischio A livello globale, l’RSV è la principale causa infettiva di morbilità e mortalità per patologia respiratoria nei bambini di età inferiore ai 5 anni. Ogni anno, ci sono circa 33 milioni di episodi di infezione acuta delle vie aeree inferiori associata a RSV, 3,2 milioni di ricoveri e 59.600 decessi in ospedale.(3) L’RSV è anche la causa più comune di mortalità infantile postnatale in tutto il mondo dopo la malaria.(4) Inoltre, l’infezione da RSV è una causa importante di morbilità negli adulti, in particolare negli individui
immunocompromessi e negli anziani.(5)
Le stime globali dell’Organizzazione Mondiale della Sanità (OMS) indicano che l’RSV rappresenta complessivamente la causa del 60% delle infezioni respiratorie acute nei bambini. Inoltre, è responsabile
di oltre l’80% delle infezioni del tratto respiratorio inferiore nei neonati di età inferiore a 1 anno durante il picco della stagione virale. In sintesi, l’RSV è di gran lunga la causa più frequente di bronchiolite e polmonite pediatriche (Fig. 1).
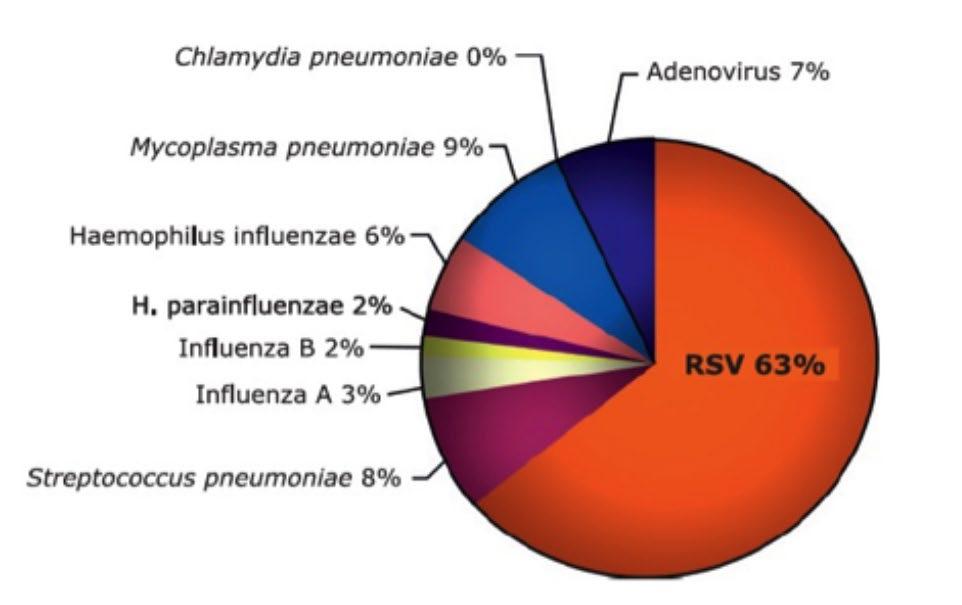
Figura 1. Eziologia delle infezioni respiratorie acute nei bambini. [Piedimonte et al.]
Sebbene la malattia da RSV si presenti in tutte le età (6, 7), colpisce in modo sproporzionato i bambini di età inferiore a 2 anni.(3)
Quasi tutti i bambini vengono infettati almeno una volta prima dei 2 anni, ma il picco di incidenza si stanzia tra i 2 e i 3 mesi, periodo che corrisponde al nadir delle concentrazioni di IgG materne protettive trasferite al feto attraverso la placenta. Focolai stagionali si verificano ogni anno in tutto il mondo, anche se l’insorgenza, il picco e la durata variano da un anno all’altro. Negli Stati Uniti, le epidemie annuali di solito iniziano a novembre, raggiungono il
picco a gennaio o febbraio e terminano a maggio. Tuttavia, l’epidemiologia dell’RSV differisce ampiamente a seconda di latitudini e condizioni meteorologiche. Ad esempio, in siti con temperature persistentemente calde ed umidità elevata, l’attività di RSV tende ad essere continua durante tutto l’anno, con un picco in estate e all’inizio dell’autunno. Nei climi temperati, l’attività di RSV è massima durante l’inverno e si correla con temperature più basse. Nelle aree in cui le temperature rimangono più fredde durante tutto l’anno, l’attività di RSV diventa nuovamente quasi continua.
Pertanto, l’attività di RSV nelle comunità è influenzata sia dalla temperatura ambiente che dall’umidità assoluta, forse riflettendo combinazioni meteorologiche che consentono una maggiore stabilità di RSV negli aerosol.(8) Sostanzialmente, si può asserire che i tassi di incidenza sono più alti durante la stagione fredda nei climi temperati e durante la stagione delle piogge nei climi tropicali.(9)
Un recente articolo di Barbati et al. si pone l’obiettivo di valutare retrospettivamente, in Italia, per un periodo di 5 anni (settembre 2014 - agosto 2019), una popolazione di bambini ospedalizzati di età compresa tra
0 e 6 anni con una diagnosi di laboratorio confermata di infezione da RSV. Sono stati valutati i fattori di rischio, la stagionalità dell’infezione da RSV, la distribuzione in base all’età, i casi di co-infezione e reinfezione e i casi che necessitano di terapia intensiva. (10)
Il risultato più importante di tale studio riguarda il trend stagionale del virus in Italia. In particolare, il periodo epidemico di RSV inizia nel tardo autunno (novembre), ha un picco in inverno (gennaio) e ha una fine variabile all’inizio della primavera (aprile). (Fig. 2)
Figura 2. Andamento stagionale dell’infezione da virus respiratorio sinciziale (RSV) in Toscana in ogni singolo anno di studio e numero cumulativo di casi nel periodo di studio di 5 anni [adatt. da Barbati et al.]

Lo studio ha anche mostrato un progressivo aumento del numero di casi positivi registrati durante le cinque stagioni esaminate parallelamente al progressivo aumento del numero di indagini richieste dai clinici per l’analisi eziologica dell’ILI (Influenza Like Illness). La morbilità e la mortalità della malattia da RSV sono più elevate nei neonati prematuri e nei bambini con malattia polmonare cronica (Displasia broncopolmonare, fibrosi cistica e malattie polmonari interstiziali) o cardiopatia congenita emodinamicamente significativa. Poiché i neonati pretermine non completano, in parte o completamente, la finestra del terzo trimestre, durante la quale avviene il trasferimento di IgG materne al feto, nascono con una protezione umorale ridotta contro le infezioni e raggiungono concentrazioni più basse di IgG materne. Ciò è aggravato dalle risposte inefficaci mediate dalle cellule T, poiché anche le cellule T maturano principalmente durante l’ultimo trimestre di gravidanza.(8) Recenti studi e revisioni confermano che i principali fattori di rischio per l’ospedalizzazione dovuta a infezione da RSV sono l’età <1 anno e la nascita appena prima o durante la stagione endemica. I bambini nati sani a termine senza fattori di rischio noti rappresentano fino all’85% dei bambini ospedalizzati a causa di RSV. (11, 12) Ulteriori fattori di rischio sono la prematurità e la presenza di comorbilità, come cardiopatie congenite, malattie respiratorie croniche e immunodeficienza. Altri fattori
che aumentano il rischio di infezione da RSV e complicanze correlate includono la convivenza con fratelli maggiori, basso peso alla nascita, esposizione al fumo di sigaretta e mancanza di allattamento al seno.(13)
La mortalità, tuttavia, nei paesi ad alto reddito, permane trascurabile anche se nel mondo la polmonite da RSV è la seconda causa di morte infantile postnatale dopo la malaria, causando 137.000 morti ogni anno (pari al 6,7% di tutte le morti neonatali).(14) Per quanto riguarda l’ospedalizzazione, negli Stati Uniti, ogni inverno, il tasso di ospedalizzazione per RSV è pari all’1-2% nei bambini di età inferiore a 2 anni. Dati abbastanza simili sono registrati in Europa. RSV provoca più ricoveri ospedalieri dell’influenza anche nei bambini più grandi. Negli Stati Uniti, si stima che ogni anno 1 bambino su 13, di età inferiore a 5 anni, richieda assistenza medica a causa di un’infezione da RSV. Negli Stati Uniti esiste un sistema di sorveglianza che monitora le ospedalizzazioni correlate all’RSV. La rete di sorveglianza dell’ospedalizzazione da virus respiratorio sinciziale (RSV-NET) fa parte della rete di sorveglianza dell’ospedalizzazione da virus respiratori (RESP-NET), progettata per condurre la sorveglianza basata sulla popolazione per i ricoveri da COVID-19, RSV e influenza confermati in laboratorio. RSV-NET raccoglie dati di sorveglianza sui ricoveri associati a RSV, compresi quelli che hanno portato al ricovero in terapia intensiva o alla morte, tra bambini e adulti.
I dati vengono raccolti e segnalati da una rete di ospedali per acuti in 58 contee in 12 Stati durante la stagione dal 1° ottobre al 30 aprile di ogni anno. In alcuni anni vengono raccolti dati relativi ad ulteriori mesi.
In Figura 3 sono presentati i tassi di ospedalizzazione per RSV stratificati per anno. È facile notare come l’andamento delle stagioni 2020-2021 e 2021-2022 sia
stato fortemente influenzato dalla contemporanea circolazione di COVID-19 e dalle conseguenti misure di prevenzione applicate. È, tuttavia, abbastanza preoccupante il picco della stagione attuale. Stratificando il dato per classe di età, emerge che tale eccesso di ospedalizzazione è da imputare quasi esclusivamente ai soggetti con età compresa tra 0 e 4 anni.

Diversi articoli hanno sollevato alcune preoccupazioni sul possibile verificarsi di un cosiddetto “picco tardivo” di RSV che colpisce una popolazione di neonati in
gran parte naïve per RSV, un’ipotesi che sembra essere supportata da dati di una coorte australiana descritta da Foley et al.(15)
Figura 4. Tasso di Ospedalizzazione per 100.000 per RSV in USA – Stagione 2022-2023 stratificata per classe di età
Durante la pandemia globale della malattia da coronavirus 2019, dunque, l’epidemiologia dell’RSV e dell’influenza sembra essere cambiata radicalmente. In Australia e Nuova Zelanda, è stata osservata una significativa diminuzione sia dell’influenza che della bronchiolite durante le normali stagioni di picco. I dati dei primi mesi delle stagioni invernali in Europa mostrano tendenze simili. Questo scenario attuale impone una riconsiderazione del paradigma secondo cui
i bambini e i giovani scolari sono i principali motori delle epidemie stagionali di RSV e delle epidemie respiratorie in generale.(16) Il cambio di trend epidemiologico registrato in altre parti del mondo sembra essersi verificato anche in Italia. Uno studio di Kuhdari et al. ha riportato i tassi di ospedalizzazione per RSV in Italia, traendoli dalle SDO (schede di dimissione ospedaliera).(14) Nel periodo 2001-2014, il tasso di ospedalizzazione nei bambini

di 0-2 anni era pari a 224,8/100.000 per bronchiolite da RSV, a 9,6/100.000 per polmonite da RSV e a 4,6/100.000 per infezione da RSV non altrimenti
specificata. Tale studio riporta anche il tasso di ospedalizzazione stratificato per classe di età, confermando che i bambini al di sotto dell’anno sono più a rischio (Fig. 5).
Figura 5. Tasso di ospedalizzazione (per 100.00) stratificato per classe di età [adatt. da Khudari et al.]

Uno studio più recente, condotto sempre in Italia, riporta una brusca discesa del numero di ricoveri per RSV.(17) Lo scopo di questo articolo era chiarire come le misure adottate per fronteggiare la pandemia da COVID-19 possano aver influenzato l’epidemiologia della bronchiolite, esplorando le possibili spiegazioni. Sono stati studiati 342 bambini ricoverati per bronchiolite in quattro diverse
stagioni epidemiche (ottobre-aprile 20172018, 2018-2019, 2019-2020 e 2020-2021). Il tasso di ospedalizzazione di marzo-aprile, l’infezione da RSV, l’ammissione all’unità di terapia intensiva pediatrica (PICU) e i dati sulla somministrazione di ossigenoterapia sono stati confrontati tra diverse stagioni per delineare eventuali cambiamenti durante l’epidemia di SARS-CoV-2.
Come evidenziato in Figura 6, a marzoaprile, 30 (23,1%), 28 (24,6%) e 5 (5,1%) neonati sono stati ricoverati per bronchiolite, rispettivamente, nel 2017-2018, 2018-2019 e 2019-2020, con un tasso inferiore a marzoaprile 2020 (p <0,001). Durante la stagione epidemica 2020-2021 non si sono verificati ricoveri per bronchiolite. Non sono state
evidenziate differenze significative nelle infezioni da RSV, nella somministrazione di ossigenoterapia e nei ricoveri in PICU tra le stagioni. In conclusione, è possibile segnalare una importante diminuzione dei ricoveri per bronchiolite durante l’intero focolaio di SARS-CoV-2 piuttosto che solo durante i periodi di lockdown.
Figura 6. Numero e % di soggetti con RSV ospedalizzati nelle stagioni 2017-2018, 2018-2019, 2019-2020 e 2020-2021 [da Hall. et al.]

Potremmo ipotizzare che questo fenomeno sia da ascrivere principalmente alla minore circolazione di agenti infettivi, RSV in primis, secondaria all’adozione di semplici misure profilattiche come l’igiene delle mani e mascherine facciali. Sono necessarie ulteriori prove per confermare
e quantificare meglio questa tendenza, poiché l’adesione attenta e sistematica a queste semplici norme di igiene potrebbe svolgere un ruolo ancora maggiore di quanto si pensasse nel controllo delle epidemie di bronchiolite negli anni a venire.
Modalità di trasmissione e Sintomatologia
L’RSV è altamente contagioso, provoca frequenti reinfezioni nei bambini –anche più volte nella stessa stagione – e si trasmette generalmente per contatto diretto o indiretto con le secrezioni orali o nasofaringee.(18) I sintomi clinici di solito iniziano dopo un periodo di incubazione che varia da 4 a 6 giorni con congestione nasale, rinorrea, tosse, voce rauca o febbre. In alcuni pazienti, il decorso della malattia può progredire verso le vie aeree inferiori causando respiro sibilante, tachipnea, retrazioni giugulari e intercostali, ipossiemia o difficoltà respiratoria che necessita di ricovero ospedaliero.(19, 20)
Nei neonati e nei bambini di età inferiore ai 2 anni, il quadro clinico può evolvere in bronchiolite, la sindrome clinica più comune associata a grave infezione da RSV. (13)
La bronchiolite è un’infiammazione delle piccole vie aeree dei polmoni che si manifesta dopo l’insorgenza della rinite e si associa a tosse e dispnea; i bambini più piccoli possono anche manifestare febbre, difficoltà di alimentazione e irritabilità.(21) Nei neonati e in particolare nei lattanti, l’infezione da RSV può essere associata ad altre manifestazioni cliniche, come polmonite e respiro sibilante (cioè fischio durante la respirazione).(22)
La disfunzione polmonare correlata all’infezione da RSV può durare per molti anni; asma, respiro sibilante cronico e riduzione delle funzioni respiratorie
sono stati riscontrati in bambini con anamnesi di ricovero a causa di RSV.(23) È ormai noto che la morbilità da RSV si estende oltre l’episodio acuto; le infezioni da RSV che si verificano durante il primo anno di vita, comprese quelle che non richiedono il ricovero, sono associate ad un aumentato rischio di wheezing ricorrente e allo sviluppo di asma.(24) Uno studio scozzese condotto su oltre 740.000 neonati seguiti fino all’età di 18 anni ha rivelato che i bambini ospedalizzati per infezioni da RSV durante i primi 2 anni di vita avevano un rischio tre volte più elevato di ospedalizzazione per asma e utilizzavano una quantità significativamente maggiore di farmaci antiasmatici rispetto ai controlli.(25) Non è chiaro se questa associazione sia dovuta a danno polmonare persistente causato da RSV o se una condizione polmonare sottostante predisponga i bambini sia all’infezione da RSV che all’insorgenza di altri disturbi respiratori; tuttavia, evitare la morbilità respiratoria cronica dovrebbe essere considerato tra i potenziali vantaggi delle strategie per prevenire le infezioni da RSV nei gruppi di età neonatale e pediatrica.(26)
Diagnosi
La diagnosi di bronchiolite acuta dovrebbe basarsi esclusivamente sulla storia clinica e sui risultati dell’esame obiettivo, e non richiede studi radiografici o di laboratorio. L’infezione da RSV deve essere sospettata nei neonati e nei bambini piccoli con
bronchiolite o polmonite durante il periodo epidemico dell’RSV. Dato che la terapia antivirale non è raccomandata, una diagnosi di laboratorio specifica è inutile per la gestione del paziente. Tuttavia, la diagnosi di laboratorio può facilitare il controllo dell’infezione negli ospedali suggerendo l’isolamento dei pazienti infettati dallo stesso virus. Test antigenici rapidi caratterizzati da alta sensibilità per l’RSV e per altri virus respiratori sono disponibili per l’uso pediatrico; vengono applicati su lavaggi nasali o tamponi. Questi test sono meno sensibili negli adulti. Saggi diagnostici molecolari quali la PCR (reazione a catena della polimerasi) con trascrittasi inversa real time hanno migliorato la sensibilità e sono generalmente disponibili come test singolo o pannelli multipli.
Terapia
Ad oggi non è disponibile alcun trattamento specifico o vaccino per le infezioni da RSV. I casi più gravi richiedono una terapia di supporto, come l’ossigenazione e l’idratazione e, meno frequentemente, la ventilazione assistita. L’unico agente antivirale autorizzato per il trattamento di gravi infezioni da RSV è la Ribavirina in aerosol, agente antivirale ad ampio spettro. Tuttavia, l’uso della Ribavirina è stato limitato ai pazienti immunocompromessi a causa del costo del trattamento, della potenziale tossicità, degli effetti teratogeni in gravidanza e della necessità di ricovero ospedaliero per una somministrazione prolungata dell’aerosol. A causa della mancanza di una terapia efficace, la riduzione della morbilità e della mortalità da RSV deve basarsi su misure preventive.
(7, 27)
Controllo e prevenzione: raccomandazioni e vaccini disponibili
Le precauzioni per il contatto (lavarsi le mani, guanti, isolamento) sono importanti, soprattutto negli ospedali.
Il Palivizumab, un anticorpo monoclonale IgG1 umanizzato, è attualmente una valida strategia protettiva approvata nei neonati ad alto rischio di grave malattia da RSV. (28) Il Palivizumab viene somministrato mensilmente durante la stagione dell’RSV, ma il suo uso è attualmente approvato solo per un sottogruppo di neonati ad alto rischio a causa degli elevati costi del trattamento. La profilassi passiva con Palivizumab riduce la frequenza di ospedalizzazione per RSV nei lattanti a rischio. È possibile somministrarlo nelle seguenti categorie di pazienti: soggetti che hanno < 1 anno e una cardiopatia congenita emodinamicamente significativa o una malattia polmonare cronica del prematuro, nati a < 29 settimane di gestazione e con < 1 anno di età all’inizio della stagione dell’RSV, soggetti con una malattia polmonare cronica del prematuro nel 2° anno di vita e che hanno ricevuto un trattamento (trattamento cronico con corticosteroidi o con diuretici o continua necessità di ossigenoterapia) entro 6 mesi dalla stagione dell’RSV. La profilassi può essere considerata anche per
neonati con malformazioni anatomiche polmonari tali da alterare la capacità di mantenere efficacemente pulite le vie aeree superiori, lattanti con malattie neuromuscolari e bambini < 24 mesi affetti da immunodepressione grave.
La prima dose di Palivizumab viene somministrata immediatamente prima dell’abituale inizio della stagione dell’RSV.
Le dosi successive vengono somministrate ad intervalli di 1 mese per tutta la durata della stagione epidemica dell’RSV, solitamente per un totale di 5 dosi.
Le linee guida prevedono la gestione della bronchiolite basata sull’evidenza.
La profilassi passiva è un modo sicuro ed efficace per proteggere i bambini a rischio di malattia da virus respiratorio sinciziale grave ma non è costo-efficace. Una volta stabilita l’infezione, il pilastro dell’attuale terapia rimane la terapia di supporto perché al momento non esistono prove scientifiche concrete a supporto dell’uso di alcun agente farmacologico convenzionale o sperimentale. Per il futuro, si stanno studiando promettenti molecole antivirali e anticorpi monoclonali umanizzati di nuova generazione e la biologia strutturale potrebbe superare le
sfide che finora hanno impedito lo sviluppo di un vaccino contro l’RSV sicuro ed efficace. Gli sforzi di ricerca e sviluppo del vaccino RSV sono progrediti significativamente negli ultimi anni, con circa diciannove vaccini e due anticorpi monoclonali di nuova generazione. È possibile che un vaccino materno RSV per prevenire l’infezione da RSV nei neonati sia autorizzato nei prossimi anni.
Nella Figura 7, aggiornata ad agosto 2022, sono presentati i vaccini e gli anticorpi monoclonali in studio e la relativa fase di sviluppo. L’infografica è sviluppata da PATH, un team globale di innovatori che lavorano per accelerare l’equità sanitaria, collaborando con istituzioni pubbliche, aziende, gruppi di base e investitori per risolvere le sfide sanitarie più urgenti.(29)
Figura 7. Istantanea del panorama tecnologico del vaccino dell’RSV (vaccini ed anticorpi monoclonali in sviluppo)

È evidente, dunque, che la comunità scientifica stia prestando particolare attenzione allo sviluppo di nuovi vaccini e anticorpi monoclonali. Lo sviluppo di vaccini o mAbs contro RSV, infatti, è stato inserito tra le priorità dell’Organizzazione Mondiale della Sanità (OMS). I nuovi approcci attualmente in fase di sperimentazione includono vaccini per donne in gravidanza per proteggere i neonati durante i primi mesi di vita
attraverso il trasferimento transplacentare di anticorpi materni; mAb per fornire protezione immediata fino a 5 mesi dopo la somministrazione, per l’uso in tutti i neonati e lattanti durante i primi mesi di vita; e vaccini pediatrici che potrebbero essere somministrati ai bambini pochi mesi dopo la nascita per fornire un’immunità più duratura.(30, 31)
I principali approcci attualmente studiati e sviluppati sono riassunti nella Tabella 1.
TIPO POPOLAZIONE TARGET E CARATTERISTICHE PRINCIPALI
Vaccinazione delle donne in gravidanza per proteggere i neonati attraverso il trasferimento transplacentare di anticorpi materni
Protezione del neonato dalla nascita
Vaccini Materni
Durata equivalente alla vita degli anticorpi materni (cioè 2-4 mesi)
Vaccini pediatrici
Neonati e lattanti
Inizio immediato della protezione
Può immunizzare solo i bambini nati poco prima e durante la stagione dell’epidemia di RSV e che sono nati a termine mAbs con emivita estesa
Durata fino a 5 mesi, per tutta la stagione RSV
Può immunizzare tutti i bambini, alla nascita se nati durante la stagione RSV e su appuntamento se nati prima della stagione
Bambini, prima infanzia
Nessuna protezione durante i primi mesi di vita
Protezione duratura (anni) per tutta l’infanzia
Tabella 1. Caratteristiche dei vaccini e degli mAbs contro RSV nel contesto epidemiologico italiano [adatt. da Azzari et al. Italian Journal of Pediatrics (2021)(32)]
A Novembre 2022, tuttavia, c’è stato un importante avanzamento sulla questione poiché la Commissione Europea ha autorizzato nirsevimab come forma di prevenzione della malattia da RSV nei neonati e bambini.(33) Nirsevimab, dunque, si configura come il primo anticorpo monoclonale anti-RSV raccomandato dal CHMP di EMA (Committee for Medicinal Products for Human Use) e autorizzato dalla Commissione Europea come prima e unica forma di protezione dall’RSV in singola somministrazione per tutti i neonati e bambini, sia nati a termine che pretermine, sani o con specifiche condizioni di salute. La Commissione Europea è il primo ente regolatorio ad aver approvato nirsevimab. L’approvazione si basa sui risultati del programma di sviluppo clinico che ha valutato nirsevimab, compresi gli studi di Fase 3 MELODY, Fase 2/3 MEDLEY e Fase 2b. Nirsevimab è un anticorpo a lunga durata d’azione destinato a tutti i neonati e bambini come forma di protezione contro la malattia da RSV, indicato dalla nascita fino alla prima stagione RSV, con una singola dose. La grande novità introdotta da nirsevimab consiste nella possibilità di essere somministrato a tutti i neonati fornendo loro una protezione diretta contro l’RSV. Gli anticorpi monoclonali non richiedono l’attivazione del sistema immunitario e contribuiscono a offrire una protezione tempestiva, rapida e diretta contro la malattia.
Nirsevimab ha dimostrato di essere sicuro ed efficace nella protezione contro le infezioni del tratto respiratorio inferiore (LRTI) causate da RSV, raggiungendo i seguenti risultati:(34-36)
• 80% di efficacia nella riduzione dell’incidenza delle infezioni da RSV che richiedono assistenza medica;
• 77% di efficacia nella riduzione dell’incidenza delle infezioni da RSV che richiedono ospedalizzazione;
• sicurezza e tollerabilità dimostrata in tutti i trial clinici;
• singola somministrazione in dosaggio fisso e siringa pre-riempita;
• durata di protezione di almeno 5 mesi, sovrapponibile all’intera durata di una stagione di RSV.
In seguito all’approvazione della Commissione Europea, a breve prenderà avvio il processo regolatorio a livello locale in AIFA, affinché nirsevimab possa rappresentare la prima forma di prevenzione come immunizzazione passiva pensata per l’intera popolazione di neonati e bambini alla loro prima stagione di RSV.
Conclusioni
L’RSV è una delle principali sfide rimaste nelle malattie infettive e una delle principali cause di ricovero in ospedale tra i bambini piccoli, in particolare nei neonati pretermine. Le principali sfide per il futuro consistono soprattutto nella messa a punto di nuovi vaccini e di anticorpi monoclonali per potenziare la fase preventiva evitando,
così, ospedalizzazioni e complicanze. In particolar modo, considerando il grande numero di strategie preventive in fase di sviluppo o recentemente approvate, è necessario pensare ad una riorganizzazione del sistema di prevenzione dell’RSV. Sarebbe auspicabile una strategia che riesca a combinare i diversi tipi di agenti disponibili e sfruttarne le loro caratteristiche intrinseche. Ad esempio, i vaccini potrebbero essere somministrati a tutte le donne in gravidanza per proteggere i neonati sin dal primo momento. I vaccini pediatrici, invece, potrebbero trovare spazio nell’immunizzazione durante l’infanzia in maniera tale da raggiungere una protezione di lunga durata e limitare la circolazione stessa dell’RSV.
Non di rado, infatti, sono proprio i fratelli più grandi a essere “portatori” del virus infettando inconsapevolmente i fratelli più piccoli sprovvisti di adeguata protezione immunitaria.
Inoltre, la recente approvazione di nirsevimab impone la possibilità di immunizzare tutti i nuovi nati subito prima o durante la stagione di picco dell’RSV in modo tale da ridurre il numero di infezioni e di complicanze a breve, medio e lungo termine. La strategia di prevenzione auspicabile, dunque, dovrebbe basarsi sulla combinazione di vaccini materni, mAb alla nascita per tutti i bambini precedentemente alla loro prima stagione RSV e vaccini pediatrici nella prima infanzia con l’obiettivo di aumentare la durata della protezione e ridurre la circolazione del virus.
Bibliografia
1. Aranda SS, Polack FP. Prevention of Pediatric Respiratory Syncytial Virus Lower Respiratory Tract Illness: Perspectives for the Next Decade. Front Immunol. 2019;10:1006.
2. Drysdale SB, Barr RS, Rollier CS, Green CA, Pollard AJ, Sande CJ. Priorities for developing respiratory syncytial virus vaccines in different target populations. Sci Transl Med. 2020;12:eaax2466.
3. Li Y, Wang X, Blau DM, Caballero MT, Feikin DR, Gill CJ, et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in children younger than 5 years in 2019: a systematic analysis. The Lancet. 2022;399:2047–64.
4. Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. The Lancet. 2012;380:2095–128.
5. Rezaee F, Linfield DT, Harford TJ, Piedimonte G. Ongoing developments in RSV prophylaxis: a clinician’s analysis. Curr Opin Virol. 2017;24:70–8.
6. Falsey A. Respiratory Syncytial Virus Infection in Adults. Semin Respir Crit Care Med. 2007;28:171–81.
7. Hall CB, Weinberg GA, Iwane MK, Blumkin AK, Edwards KM, Staat MA, et al. The Burden of Respiratory Syncytial Virus Infection in Young Children. N Engl J Med. 2009;360:588–98.
8. Piedimonte G, Perez MK. Respiratory Syncytial Virus Infection and Bronchiolitis. Pediatr Rev. 2014;35:519–30.
9. Simoes EA. Respiratory syncytial virus infection. The Lancet. 1999;354:847–52.
10. Barbati F, Moriondo M, Pisano L, Calistri E, Lodi L, Ricci S, et al. Epidemiology of Respiratory Syncytial Virus-Related Hospitalization Over a 5-Year Period in Italy: Evaluation of Seasonality and Age Distribution Before Vaccine Introduction. Vaccines. 2020;8:15.
11. Bont L, Checchia PA, Fauroux B, Figueras-Aloy J, Manzoni P, Paes B, et al. Defining the Epidemiology and Burden of Severe Respiratory Syncytial Virus Infection Among Infants and Children in Western Countries. Infect Dis Ther. 2016;5:271–98.
12. Murray J, Bottle A, Sharland M, Modi N, Aylin P, Majeed A, et al. Risk Factors for Hospital Admission with RSV Bronchiolitis in England: A Population-Based Birth Cohort Study. PLoS ONE. 2014;9:e89186.
13. Lanari M, Prinelli F, Adorni F, Di Santo S, Vandini S, Silvestri M, et al. Risk factors for bronchiolitis hospitalization during the first year of life in a multicenter Italian birth cohort. Ital J Pediatr. 2015;41:40.
14. Kuhdari P, Brosio F, Malaventura C, Stefanati A, Orsi A, Icardi G, et al. Human respiratory syncytial virus and hospitalization in young children in Italy. Ital J Pediatr. 2018;44:50.
15. Foley DA, Yeoh DK, Minney-Smith CA, Martin AC, Mace AO, Sikazwe CT, et al. The Interseasonal Resurgence of Respiratory Syncytial Virus in Australian Children Following the Reduction of Coronavirus Disease 2019–Related Public Health Measures. Clin Infect Dis. 2021;73:e2829–30.
16. Binns E, Koenraads M, Hristeva L, Flamant A, Baier‐Grabner S, Loi M, et al. Influenza and respiratory syncytial virus during the COVID‐19 pandemic: Time for a new paradigm? Pediatr Pulmonol. 2022;57:38–42.
17. Stera G, Pierantoni L, Masetti R, Leardini D, Biagi C, Buonsenso D, et al. Impact of SARS-CoV-2 Pandemic on Bronchiolitis Hospitalizations: The Experience of an Italian Tertiary Center. Children. 2021;8:556.
18. Janet S, Broad J, Snape MD. Respiratory syncytial virus seasonality and its implications on prevention strategies. Hum Vaccines Immunother. 2018;14:234–44.
19. Smith DK, Seales S, Budzik C. Respiratory Syncytial Virus Bronchiolitis in Children. Am Fam Physician. 2017;95:94–9.
20. Tregoning JS, Schwarze J. Respiratory Viral Infections in Infants: Causes, Clinical Symptoms, Virology, and Immunology. Clin Microbiol Rev. 2010;23:74–98.
21. Barr R, Green CA, Sande CJ, Drysdale SB. Respiratory syncytial virus: diagnosis, prevention and management. Ther Adv Infect Dis. 2019;6:204993611986579.
22. Takeyama A, Hashimoto K, Sato M, Sato T, Tomita Y, Maeda R, et al. Clinical and epidemiologic factors related to subsequent wheezing after virus-induced lower respiratory tract infections in hospitalized pediatric patients younger than 3 years. Eur J Pediatr. 2014;173:959–66.
23. Blanken MO, Rovers MM, Molenaar JM, Winkler-Seinstra PL, Meijer A, Kimpen JLL, et al. Respiratory Syncytial Virus and Recurrent Wheeze in Healthy Preterm Infants. N Engl J Med. 2013;368:1791–9.
24. Baraldi E, Bonadies L, Manzoni P. Evidence on the Link between Respiratory Syncytial Virus Infection in Early Life and Chronic Obstructive Lung Diseases. Am J Perinatol. 2020;37 S 02:S26–30.
25. Coutts J, Fullarton J, Morris C, Grubb E, Buchan S, Rodgers‐Gray B, et al. Association between respiratory syncytial virus hospitalization in infancy and childhood asthma. Pediatr Pulmonol. 2020;55:1104–10.
26. Driscoll AJ, Arshad SH, Bont L, Brunwasser SM, Cherian T, Englund JA, et al. Does respiratory syncytial virus lower respiratory illness in early life cause recurrent wheeze of early childhood and asthma? Critical review of the evidence and guidance for future studies from a World Health Organization-sponsored meeting. Vaccine. 2020;38:2435–48.
27. Welliver RC. Immunologic mechanisms of virus-induced wheezing and asthma. J Pediatr. 1999;135 2 Pt 2:14–20.
28. COMMITTEE ON INFECTIOUS DISEASES and BRONCHIOLITIS GUIDELINES
COMMITTEE, Brady MT, Byington CL, Davies HD, Edwards KM, Jackson MA, et al. Updated Guidance for Palivizumab Prophylaxis Among Infants and Young Children at Increased Risk of Hospitalization for Respiratory Syncytial Virus Infection. Pediatrics. 2014;134:e620–38.
29. PATH. RSV Vaccine and mAb Snapshot. 2022.
30. Biagi C, Dondi A, Scarpini S, Rocca A, Vandini S, Poletti G, et al. Current State and Challenges in Developing Respiratory Syncytial Virus Vaccines. Vaccines. 2020;8:672.
31. Rocca A, Biagi C, Scarpini S, Dondi A, Vandini S, Pierantoni L, et al. Passive Immunoprophylaxis against Respiratory Syncytial Virus in Children: Where Are We Now? Int J Mol Sci. 2021;22:3703.
32. Azzari C, Baraldi E, Bonanni P, Bozzola E, Coscia A, Lanari M, et al. Epidemiology and prevention of respiratory syncytial virus infections in children in Italy. Ital J Pediatr. 2021;47:198.
33. European Medicine Agency. Beyfortus - nirsevimab Authorisation. 2022.
34. Domachowske J, Madhi SA, Simões EAF, Atanasova V, Cabañas F, Furuno K, et al. Safety of Nirsevimab for RSV in Infants with Heart or Lung Disease or Prematurity. N Engl J Med. 2022;386:892–4.
35. Griffin MP, Yuan Y, Takas T, Domachowske JB, Madhi SA, Manzoni P, et al. Single-Dose Nirsevimab for Prevention of RSV in Preterm Infants. N Engl J Med. 2020;383:415–25.
36. Hammitt LL, Dagan R, Yuan Y, Baca Cots M, Bosheva M, Madhi SA, et al. Nirsevimab for Prevention of RSV in Healthy Late-Preterm and Term Infants. N Engl J Med. 2022;386:837–46.
Supplemento N° 4 alla rivista MTD N° 4 di Dicembre 2022 - Anno 7
Con il contributo non condizionante di


