
Hvmani Corporis Educacional Patologia Geral












Conceitos fundamentais

Proliferação celular:
População de células resultante da multiplicação mitótica de uma ou várias células, fomentada por estímulos fisiológicos ou patológicos.
Tumoração/tumor:
Classicamente, qualquer aumento localizado de volume observado em um órgão ou segmento corporal, em geral decorrente de proliferações celulares ou do acúmulo de fluidos.

Modernamente, o termo tumor tem sido mais especificamente aplicado à designação de massas oriundas de proliferações celulares, em particular as de natureza neoplásica, objetos de interesse da oncopatologia (gr. onkos, massa/tumor).


Conceitos fundamentais
Neoplasia (gr. neos, novo; lat. plasia, proliferação):
Proliferação autônoma (não submetida à regulação do organismo) e monoclonal de células atípicas, capaz de sustentar-se mesmo após cessados os estímulos que lhe deram origem (não é reversível). Sempre um fenômeno patológico.
Displasia (lat. dis, diferente):
Genericamente, qualquer proliferação de células atípicas, resultando em perda da uniformidade celular e desorganização da arquitetura tecidual.




Considerações gerais:
- designam alterações no aspecto das células de um tecido, que podem ser discretas ou grosseiras, temporárias ou persistentes, em decorrência de uma diferenciação celular incompleta ou defeituosa;
- células atípicas tendem a ser disfuncionais na medida de sua excentricidade e a não compor estruturas bem organizadas (resultando em atipias arquiteturais/arquiteturas displásicas);
- atipias persistentes caracteristicamente sinalizam contexto patológico (e provavelmente neoplásico).



Divisão celular
Célula genitora
Expressão de genes neuro-específicos
Célula nervosa
Diferenciação celular
Célula epitelial
Expressão de genes epitélio-específicos
Diferenciação celular consiste na aquisição, durante o processo de amadurecimento de uma célula, de características morfofuncionais específicas (especializações celulares).



Principais alterações à microscopia óptica:
- cito/cariomegalia, pleomorfismo celular/nuclear, bi/multinucleação, distopia nuclear, discromasia nuclear (arranjos anômalos da cromatina), dobramentos membranares, vacuolizações citoplasmáticas, mitoses aberrantes e/ou distópicas.
- proliferações que exibem pouca ou nenhuma diferenciação são ditas anaplásicas.




Principais alterações à microscopia óptica




Atipias celulares (incluindo mitoses distópicas) em proliferação neoplásica do epitélio ectocervical (à esquerda; à direita, ectocérvice normal para comparação).




A apreciação das atipias cito e histológicas exibidas por uma proliferação celular é fundamental no diagnóstico das neoplasias.
A intensidade das atipias celulares/arquiteturais de uma neoplasia, como regra, se correlaciona com seu comportamento.


Comportamento biológico de uma neoplasia
Considerações gerais:
- uma proliferação neoplásica pode permanecer restrita ao seu sítio de origem (comportamento benigno) ou invadir tecidos adjacentes e órgãos próximos ou distantes (comportamento maligno);
- a invasão de tecidos alheios requer a capacidade de transposição de barreiras (p. ex., membrana basal) e de sobrevivência em ambientes distintos do original;
- uma neoplasia pode ser "hábil" na invasão de tecidos/órgãos circunjacentes, mas não na disseminação à distância (metastatização).




Comportamento biológico de uma neoplasia
Considerações gerais:
- o principal determinante da letalidade de uma neoplasia consiste na sua capacidade de disseminação a órgãos distantes;
- crescimento rápido sugere agressividade, mas não necessariamente implica em comportamento maligno (invasor);
- neoplasias "funcionantes" tendem a agregar morbidade mediante a produção de substâncias diversas (hormônios, citocinas).




Considerações gerais:
- o fenômeno neoplasia se traduz em um amplo espectro de entidades nosológicas, que podem associar-se a diferentes fatores causais, incidências (raras numa população e comuns em outra) e prognósticos (algumas raramente letais, outras, frequentemente);
- identificar um tumor com especificidade permite estimar seu comportamento com maior acuidade e planejar estratégias terapêuticas mais eficazes.




Considerações gerais:
- a identificação de uma neoplasia baseia-se principalmente nas suas características anatômicas microscópicas (sua apresentação macroscópica em geral é pouco específica);
- o estudo do fenótipo molecular, do cariótipo e do genótipo da neoplasia pode auxiliar na definição ou refinamento diagnóstico.




O exame histopatológico é fundamental para a identificação inequívoca de uma neoplasia e representa o padrão-ouro para o diagnóstico oncológico.





A imunofenotipagem por imuno-histoquímica (à esquerda) ou por citometria de fluxo (à direita) são importantes métodos auxiliares na identificação de algumas neoplasias.







A pesquisa de anormalidades cromossômicas e/ou gênicas específicas pode auxiliar na identificação de algumas neoplasias.



Considerações gerais:
- baseia-se primordialmente no seu comportamento biológico (benigno ou maligno);
- a presença de invasão tecidual (locorregional ou remota) é o mais inequívoco indicador de malignidade de uma neoplasia;
- o exame histopatológico constitui o principal recurso norteador.




Neoplasias benignas:
- comportamento biológico de crescimento local (expansivo, porém não invasivo);
- macro e microscopicamente homogêneos e bem delimitados;
- aspecto microscópico semelhante (por vezes indistinguível), do ponto de vista cito e histológico, ao de um tecido normal (células bem diferenciadas, arquitetura organizada).




Neoplasias benignas:
- é típica a presença de uma pseudocápsula (compressão microvascular, levando à hipóxia do tecido circunjacente, com subsequente deposição fibrosa local);
- morbidade variável conforme a topografia, dimensões e status funcional do tecido neoplásico, sendo, em geral, raramente letais.




Neoplasias benignas

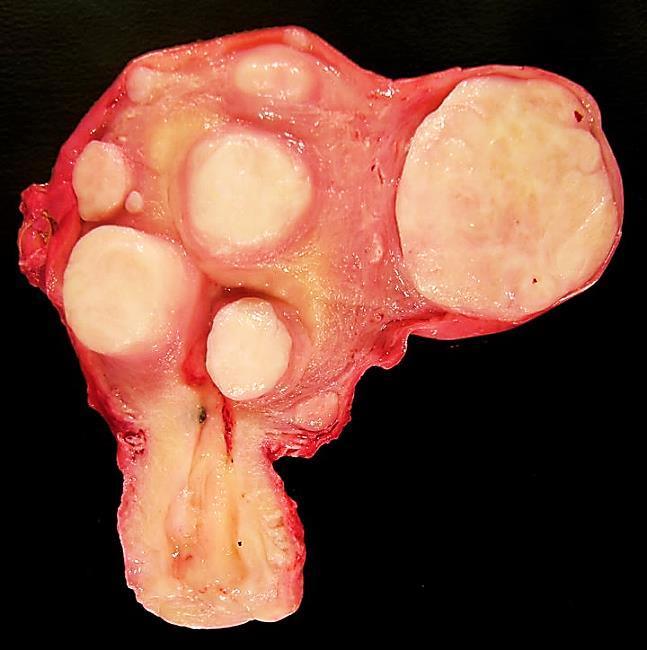

Neoplasias benignas exibem contornos bem definidos e microscopicamente se assemelham a um tecido bem diferenciado.



Neoplasias benignas



Neoplasia benigna com diferenciação adiposa, de aspecto indistinguível do seu correspondente normal.



Neoplasias benignas




O impacto clínico de uma neoplasia benigna em geral depende da sua localização e tamanho.


Neoplasias malignas:
- comportamento biológico invasivo (local, regional e/ou sistemicamente);
- disseminação à distância em geral por via linfática e/ou hemática, mas também por precipitação direta em cavidades corporais (via transcelômica);
- em geral contornos irregulares, com limites que podem ser difíceis de identificar (mesmo ao microscópio);
- pela ancoragem aos tecidos adjacentes, compõem massa tumoral caracteristicamente imóvel.




Neoplasias malignas





O aspecto infiltrativo das neoplasias malignas justifica a referência histórica à ideia de um caranguejo (do latim cancer) agarrando-se firmemente, com suas patas e garras, ao órgão doente.


Neoplasias malignas



Lúmen
Neoplasia maligna do epitélio esofágico invadindo profundamente a parede do órgão.
Epitélio normal
Lâmina própria
Submucosa
Muscular própria
Adventícia


Neoplasias malignas



Fragmentos tumorais podem migrar para tecidos distantes através da circulação linfática e/ou sanguínea, a partir da invasão de vasos locais.



Neoplasias malignas



Linfonodos invadidos por metástases tumorais.



Neoplasias malignas



Pulmões e fígado são os órgãos que mais comumente recebem metástases.



Neoplasias malignas

Vesícula biliar Fígado


Estômago

Disseminação neoplásica por meio de implantes peritoneais (videolaparoscopia).


Neoplasias malignas



O exame citológico efusões ou lavados cavitários pode ser útil no diagnóstico de neoplasias malignas.



Neoplasias malignas:
- aspecto microscópico em geral vagamente semelhante (por vezes irreconhecível) ao de um tecido normal (células pouco diferenciadas [muito atípicas], arquitetura desorganizada);
- células em mitose, muitas vezes aberrantes, são comuns;
- áreas necróticas e hemorrágicas são frequentes (crescimento rápido e desordenado, comprometendo a própria perfusão).



Neoplasia maligna do tecido muscular liso (à esquerda) em comparação com uma neoplasia benigna do mesmo tecido.



Neoplasias malignas



Neoplasias malignas podem exibir acentuado pleomorfismo.



Neoplasias malignas



Mitoses atípicas são achados comuns em proliferações celulares malignas, traduzindo quantidades anormais de cromossomos (aneuploidia) em decorrência de mecanismos defeituosos de divisão.



Neoplasias malignas



Um aspecto geral heterogêneo, com presença de áreas necro-hemorrágicas, é comum nos tumores malignos.



Neoplasias malignas:
- morbidade conforme topografia, dimensões, status funcional e extensão anatômica (magnitude da invasão/disseminação);
- mortalidade pode ser acentuada e se dar em curto período, a depender de variáveis intrínsecas ao tumor e condições clínicas do indivíduo;
- o tempo e acurácia do diagnóstico se correlaciona estreitamente com a sobrevida do paciente;
- recidivas são comuns (prazo variável).




Classificação histopatológica e nomenclatura das neoplasias
Considerações gerais:
- baseadas na semelhança morfológica com os tecidos normais;
- proliferações neoplásicas podem surgir em qualquer tecido, em relação ao qual podem exibir muita, alguma ou nenhuma similaridade (proporcional ao grau de diferenciação das células neoplásicas);
- neoplasias com aspecto inespecífico ou indiferenciadas (histogênese incerta) são classificadas com base em características moleculares e/ou genéticas.




histopatológica e nomenclatura das





A Organização Mundial da Saúde (OMS), por meio da International Agency for Research on Cancer (IARC), regularmente atualiza a classificação das neoplasias com base nos avanços dos recursos diagnósticos e conhecimento das doenças neoplásicas.



histopatológica e nomenclatura das




Listagem das neoplasias linfo-hemáticas conforme a classificação mais recente da OMS/IARC.



Classificação histopatológica e nomenclatura das neoplasias
Neoplasias benignas:
- em geral identificadas pelo sufixo oma, em adição ao termo que designa o tecido a que remetem (lipoma, leio/rabdomioma, condroma, osteoma, fibroma);
- tumores que formam arranjos glanduloides ou papilares (origem epitelial) nomeiam-se primariamente adenomas ou papilomas, respectivamente;
- termos descritivos complementares agregam especificidade (p. ex., adenoma tubular ou viloso).




Aspecto microscópico de um adenoma colorretal (à esquerda) e de um papiloma orofaríngeo.


Classificação histopatológica e nomenclatura das neoplasias
Neoplasias malignas:
- em geral identificadas como carcinomas (quando de origem epitelial) ou sarcomas (tumores sólidos de origem mesenquimal); - aos tumores da medula óssea (origem mesenquimal, porém não sólidos) aplica-se o termo leucemia; - exceções (importantes) às regras podem favorecer interpretações equivocadas (melanoma, linfoma, mesotelioma, seminoma).




Classificação histopatológica e nomenclatura das neoplasias
Neoplasias malignas:
- carcinomas que formam arranjos glanduloides são em geral denominados adenocarcinomas; - os sarcomas em geral são especificados por prefixo que designa o tecido ao qual remetem (lipossarcoma, leio/rabdomiossarcoma, condrossarcoma, osteossarcoma, fibrossarcoma);
- termos descritivos complementares agregam especificidade (carcinoma folicular ou papilar, adenocarcinoma seroso ou mucinoso, leucemia linfoide ou mieloide).




Aspecto microscópico de um adenocarcinoma gástrico (à esquerda) e de um carcinoma papilar tireoidiano.


Classificação histopatológica e nomenclatura das neoplasias
Neoplasias malignas:
- os carcinomas que exibem-se (à ocasião do diagnóstico)
restritos ao epitélio de origem (isto é, ainda não extrapolaram a membrana basal) são denominados in situ.



Neoplasias epiteliais que exibem características morfológicas de malignidade, porém, sem indícios de invasão da membrana basal e além, são interpretadas como carcinomas in situ.



Considerações gerais:
- um mesmo tipo histopatológico de tumor pode apresentar diferentes graus de atipias cito/histológicas;
- um maior grau de atipia das células neoplásicas reflete sua menor diferenciação (e organização);
- células neoplásicas bem diferenciadas (baixo grau de atipia) são mais parecidas (inclusive em organização) com as células que lhe deram origem (ou que tentam imitar).



Adenocarcinoma gástrico de baixo grau (bem diferenciado, à esquerda) e de alto grau (pouco diferenciado).



Considerações gerais:
- o grau tumoral correlaciona-se com o comportamento biológico (quanto maior o grau, maior a agressividade), representando importante fator prognóstico; - os critérios específicos variam para cada neoplasia (baseados na magnitude das atipias nucleares, da desordem arquitetural e, por vezes, da atividade mitótica).




Considerações gerais:
- um mesmo tipo histopatológico de tumor, com o mesmo grau, pode associar-se a diferentes prognósticos conforme, em especial, a magnitude da sua extensão no organismo;
- determinar o estádio de uma neoplasia (localizá-la dentro de um espectro evolutivo) tem fundamental importância no planejamento terapêutico;
- tradicionalmente baseado no sistema "TNM" de classificação da extensão dos tumores, adotado pela Union for International Cancer Control (UICC) e pelo American Joint Committee on Cancer (AJCC).







Características gerais do sistema TNM:
- baseado na apreciação da extensão tumoral em 3 patamares fundamentais (divididos em categorias e subcategorias hierarquizadas):
-- sítio de origem (T: T0, Tis, T1-T4);
-- linfonodos regionais (N: N0-N3);
-- órgãos distantes (M: M0-M1).
- os critérios exatos para a categorização do tumor em cada patamar variam conforme as particularidades do órgão considerado.

Lâmina própria
Muscular da mucosa
Submucosa
Muscular própria
Suberosa/serosa



Órgão adjacente


A categoria T (e respectivas subcategorias) no contexto dos tumores gástricos (AJCC, 2018).


Características gerais do sistema TNM:
- a especificação da extensão anatômica de um tumor é o mais importante elemento norteador para seu estadiamento; - variáveis adicionais, como dosagem de marcadores séricos, podem ser relevantes no estadiamento de alguns tumores; - definem-se 5 estádios principais, sendo 0 para o tumor in situ (quando aplicável) e IV, em geral, para metástases à distância.



Estadiamento dos tumores gástricos (AJCC, 2018).


Considerações gerais:
- importante causa global de morbidade, sendo a segunda maior causa de óbitos no mundo (impacto social e econômico);
- pode haver significativa variação na incidência conforme a idade, sexo, herança genética, geografia, condição social, ocupação profissional, hábitos e comorbidades.






Incidência por 100.000

Incidência mundial estimada do câncer (qualquer tipo) no ano de 2020 (gco.iarc.fr).





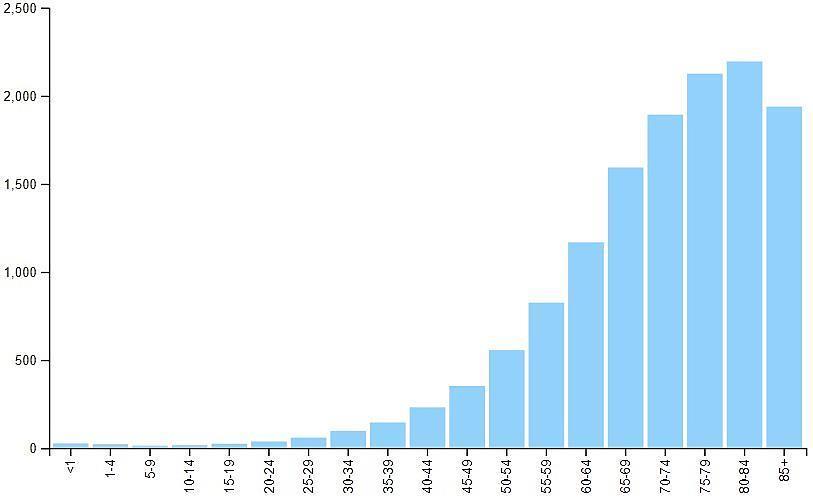
Incidência do câncer (para cada 100 mil pessoas) nos EUA, por idade, em 2018 (USCS/CDC).






Incidência e mortalidade mundiais por câncer no sexo feminino, conforme o sítio primário, em 2020 (IARC/OMS).







Incidência e mortalidade mundiais por câncer no sexo masculino, conforme o sítio primário, em 2020 (IARC/OMS).







Incidência e mortalidade mundiais por câncer (ambos os sexos), conforme o sítio primário, em 2020 (IARC/OMS).




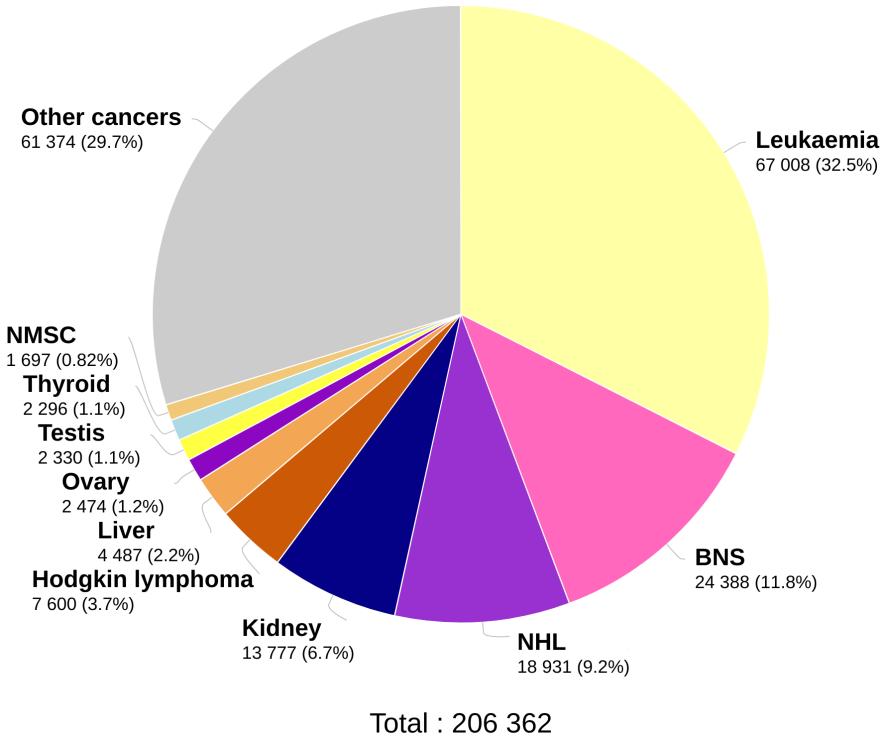


Incidência e mortalidade mundiais por câncer (ambos os sexos) dos 0-14 anos, conforme o sítio primário, em 2020 (IARC/OMS).






Novos casos (2022): ~ 630 mil; Óbitos (2022): ~ 280 mil.

Números globais do câncer no Brasil em 2022 (IARC/OMS).



feminino


masculino


Incidência do câncer no Brasil, conforme o sítio primário, em 2023 (Ministério da Saúde/INCA).





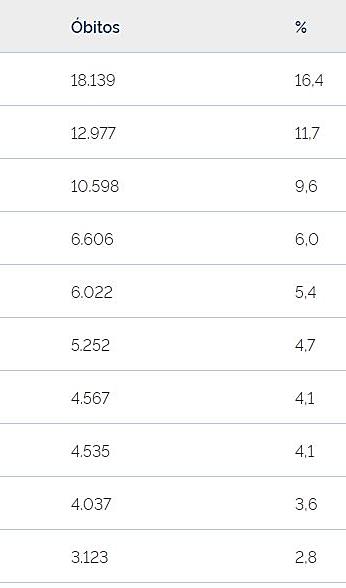


por câncer no Brasil, conforme o sítio primário, em 2021 (Ministério da Saúde/INCA).



Princípios moleculares da oncogênese
Considerações gerais:
- a oncogênese é um processo complexo e gradual, dependente de um acúmulo de alterações gênicas específicas;
- as alterações gênicas devem ser não-letais e favoráveis à expansão clonal (proliferação a partir de um único precursor);
- os principais sítios de alterações pró-neoplásicas são os genes promotores e os inibidores da proliferação celular, bem como os reguladores da apoptose e da integridade genômica.




Célula mutante
Toda neoplasia surge a partir de uma célula cujo DNA sofreu modificações que favorecem sua sobrevivência e proliferação anormais.
Expansão clonal


Princípios moleculares da oncogênese
Considerações gerais:
- a cronologia das mutações oncogênicas pode variar conforme o tipo do tumor e permanece em geral desconhecida;
- as proliferações neoplásicas, inicialmente homogêneas, estão sujeitas à seleção darwiniana, que assegura o prevalecimento de ocasionais subclones mais aptos a sobreviver e multiplicar-se.




As proliferações neoplásicas compõem-se por diferentes subclones, que estão sujeitos aos princípios da seleção natural.


Princípios moleculares da oncogênese
Aspectos fundamentais da proliferação neoplásica:
- é autossustentada (1) e insensível a mecanismos inibitórios (2);
- alterações metabólicas nas células neoplásicas viabilizam rápido acesso a subcomponentes necessários à proliferação (3);
- a capacidade de replicação das células neoplásicas é ilimitada (4);
- as células neoplásicas têm a habilidade de evitar mecanismos apoptóticos (5) e imunológicos (6), bem como de induzir angiogênese (7);
- a colonização progressiva de novos territórios (neoplasias malignas) é assegurada pela capacidade de invasão e metastatização (8).


Sendo as neoplasias proliferações celulares anormais, é esperado que defeitos na regulação da divisão celular constituam uma condição fundamental na sua patogênese.


Princípios moleculares da oncogênese
Aspectos fundamentais da proliferação neoplásica


Metabolismo favorável à proliferação
Evasão da apoptose
Indução da angiogênese
Proliferação autossustentada

Insensibilidade a mecanismos inibitórios
Evasão da resposta imune
Capacidade ilimitada de replicação
de invasão
As "marcas registradas" do câncer segundo Hanahan e Weinberg.


Princípios moleculares da oncogênese
Proliferação autossustentada:
- assegurada pela atuação de oncoproteínas, que promovem divisão celular mesmo na ausência de estímulos/mediadores convencionais (atuam independentemente de comandos fisiológicos);
- oncoproteínas são codificadas por oncogenes, resultantes de alterações sofridas por genes envolvidos na regulação da divisão/proliferação celular (proto-oncogenes).




Princípios moleculares da oncogênese
Proliferação autossustentada:
- principais mecanismos:
-- síntese autônoma de fatores de crescimento (como TGF-α, FGF, HGF) com ação autócrina (proto-oncogenes TGFA, FGF3, HGF);
-- expressão de receptores anormais de fatores de crescimento (protooncogenes ALK, ERBB2/HER2, KIT), cuja ativação independe de sinalização;
-- proteínas G transdutoras de sinais de proliferação celular defeituosas (em especial mutações do K-RAS, H-RAS e N-RAS), que resultam na ativação contínua das vias intracelulares subsequentes (PI3K/AKT/mTOR e B-RAF/MAPK).




Mutações da família RAS representam a mais comum anormalidade ligada a proto-oncogenes observada nas neoplasias, que em geral exibem defeitos em ao menos um dos componentes desta via sinalizatória.


Princípios moleculares da oncogênese
Proliferação autossustentada:
- principais mecanismos: -- quinases integrantes das cascatas relacionadas à proliferação celular (em especial PI3K e B-RAF) podem exibir-se intrinsecamente ativadas (proto-oncogenes PIK3CA e BRAF); -- fatores de transcrição de genes promotores da proliferação celular (em especial o fator MYC) podem exibir-se persistentemente ativos (alterações do proto-oncogene MYC).




Princípios
Proliferação autossustentada


Fator de crescimento
Receptor
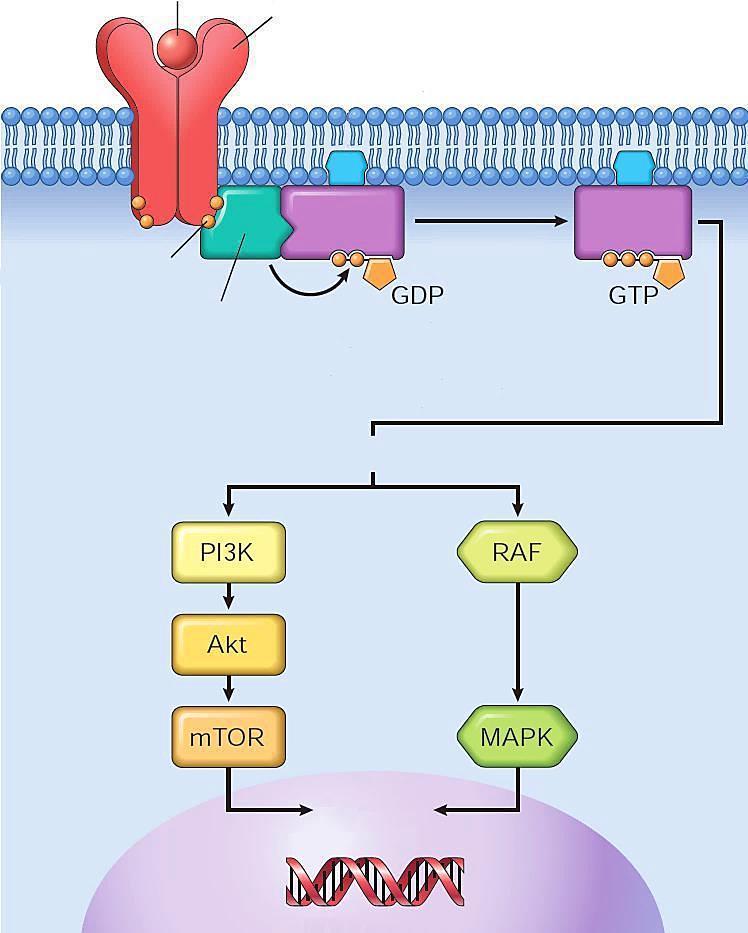
Fosforilação
Ativação Ligante
Cascata de quinases
Hidrólise (inativação)
Ativação de fatores de transcrição
Genes reguladores da proliferação celular
Esquema simplificado das principais etapas e vias de sinalização implicadas na proliferação autossustentada das neoplasias.


Princípios moleculares da oncogênese
Insensibilidade a inibidores de proliferação:
- assegurada por defeitos em genes supressores de tumor (que inibem a proliferação de células anormais);
- as anormalidades podem manifestar-se em qualquer etapa dos mecanismos inibitórios (da recepção/transdução de sinais à transcrição gênica e processos adjuvantes).


Mecanismos de supressão tumoral intactos não permitem que oncogenes promovam proliferações neoplásicas.


Princípios moleculares da oncogênese
Insensibilidade a inibidores de proliferação: - principais mecanismos: -- defeitos na regulação da sinalização mitogênica (como prejuízos à inativação da RAS, por mutações do gene NF1, ou perda da inibição da PI3K, por alterações do gene PTEN);
-- defeitos na regulação do ciclo celular, em especial por disfunções das proteínas pRB e p53.


Duplicação cromossômica
Ponto de checagem (danos de DNA)
Crescimento pós-mitótico
Quiescência

Crescimento pré-mitótico
Ponto de checagem (danos de DNA, erros de duplicação)
Mitose
Defeitos na regulação do ciclo celular favorecem a proliferação celular anormal. Citocinese


Princípios moleculares da oncogênese
Insensibilidade a inibidores de proliferação: - principais mecanismos:
-- a pRB inativa (mutações do gene RB1, inativação viral ou por complexos ciclina-CDK alterados ou, ainda, não inibidos pela p16 [mutações do gene
CDKN2A] deixa de inibir fatores de transcrição (família E2F) necessários à progressão do ciclo celular (favorecendo proliferações anormais).


Ciclina-CDK (inativado) p16
pRB ativa (hipofosforilada)
Histona metiltransferase
Histona deacetilase
E2F inativo
Ciclina-CDK (ativado) Fatores de crescimento

E2F ativo
pRB inativa (hiperfosforilada)
Genes da fase S Genes da fase S
Transcrição bloqueada
Transcrição acionada
A maioria das proliferações neoplásicas exibe mau funcionamento da pRB, reguladora do ciclo celular, que pode se dar por múltiplos fatores.


Insensibilidade a inibidores de proliferação: - principais mecanismos: -- a p53 inativa (mutações do gene TP53, inativações virais), deixa de inibir a divisão celular na vigência de danos do DNA ou "estresse oncogênico", viabilizando a proliferação de células anormais.



O gene TP53, o mais frequentemente mutado nas neoplasias, codifica um fator de transcrição (p53) que regula genes implicados no controle do ciclo celular e apoptose.


Princípios moleculares da oncogênese
Metabolismo favorável à proliferação:
- as células neoplásicas têm grande avidez por glicose, que alimenta um metabolismo energético adulterado, baseado na fermentação (mesmo tendo acesso ao oxigênio);
- apesar do menor saldo energético, a fermentação rende subprodutos carbonados que servem à proliferação celular (matéria-prima para a síntese de biomoléculas).




Metabolismo favorável à proliferação: - principais mecanismos: -- a via de quinases PI3K (em geral anormalmente ativa) e a atuação anormal de fatores de transcrição (em geral o MYC) intensificam a glicólise e favorecem rotas anabólicas; -- alterações em proto-oncogenes e genes de supressão tumoral repercutem sobre o metabolismo celular, otimizando-o.




Princípios moleculares da oncogênese
Capacidade ilimitada de replicação:
- a capacidade mitótica das células neoplásicas não se perde com o tempo (como nas células normais, que se tornam senescentes);
- a manutenção da capacidade replicativa parece dever-se, ao menos em parte, à disfunção das proteínas p53 e pRB (comum nas neoplasias);
- a perpetuação das células neoplásicas associa-se à capacidade de expressão da enzima telomerase, que assegura a integridade dos cromossomos após sucessivas replicações.




Princípios moleculares da oncogênese
Evasão da apoptose:
- a apoptose representa importante mecanismo de prevenção de proliferações neoplásicas, ao evitar que células com DNA alterado sobrevivam (e se repliquem);
- mecanismos (parcialmente esclarecidos) envolvem disfunção da proteína p53 e superexpressão de proteínas anti-apoptóticas (família BCL, que regula a via intrínseca).




Princípios moleculares da oncogênese
Evasão da resposta imune:
- sendo anômalas, as células neoplásicas têm o potencial de invocar uma reação imune ao expressar antígenos estranhos ao organismo, ao superexpressar antígenos próprios ou ao deixar de expressá-los; - a sobrevivência de uma neoplasia requer a habilidade de evasão das respostas defensivas do organismo (imunossuprimidos são, com efeito, mais susceptíveis a diversos tipos de câncer).




Princípios moleculares da oncogênese
Evasão da resposta imune:
- principais mecanismos:
-- seleção dos subclones menos imunogênicos (supressão ou expressão reduzida de antígenos ou do MHC);
-- expressão de ligantes (como o PD-L1) que inibem a ativação de linfócitos T (principais agentes da resposta antitumoral);
-- síntese de mediadores imunossupressores (tipicamente o TGF-β);
-- expressão de moléculas indutoras da apoptose (PD-L1) nos linfócitos T.

Célula neoplásica
Antígeno tumoral

Resposta padrão Supressão antigênica Supressão do MHC Ligante inibitório Receptor inibitório



Imunossupressores Expressão de ligantes e secreções inibitórias Exemplos de mecanismos de evasão neoplásica da resposta imune.



Princípios moleculares da oncogênese
Indução de angiogênese:
- a possibilidade de nutrição de um tecido (normal ou neoplásico) por difusão limita-se a distâncias de até 1-2 mm;
- a capacidade de induzir a formação de neovasos permite que uma proliferação neoplásica se avolume;
- estima-se que a maioria dos tumores adquire habilidade angiogênica apenas tardiamente ao longo do seu desenvolvimento.




Princípios moleculares da oncogênese
Indução de angiogênese: - principais mecanismos:
-- a hipóxia constitui estímulo à atuação de fatores de transcrição (HIF-1) de genes que codificam mediadores angiogênicos (VEGF, FGF); -- mutações da RAS, MYC e p53 favorecem a expressão de moléculas pró-angiogênicas, enquanto inibem a de antiangiogênicas;
-- proliferações de endoteliócitos resultam em brotos vasculares que gradualmente se alongam e eventualmente se interconectam, formando uma trama tipicamente desorganizada.


neoplásicas

A formação de neovasos é essencial para o crescimento das neoplasias.


Princípios moleculares da oncogênese
Capacidade de invasão:
- a capacidade de invadir outros tecidos requer a aquisição de múltiplas "habilidades" (produtos de mutações) pelas células neoplásicas;
- a magnitude da invasão (extensão tumoral) é o principal determinante da morbimortalidade nas neoplasias.




Capacidade de invasão: - principais mecanismos: -- a perda de coesão intercelular é evento primordial, o qual favorece o destacamento de implantes celulares; -- a degradação da matriz extracelular/membrana basal é assegurada por proteases sintetizadas pelas células tumorais ou inflamatórias/fibroblastos sob comando neoplásico.




Princípios moleculares da oncogênese
Capacidade de invasão: - principais mecanismos: -- a atividade proteolítica sobre a matriz expõe sítios de ligação com afinidade a receptores das células neoplásicas; -- mediadores de movimento (autócrinos e parácrinos) promovem um movimento de catraca que mobiliza a célula desgarrada através da matriz degradada.

Células neoplásicas
Moléculas adesivas Fibra colágena
Laminina Receptores
Membrana basal

Perda da adesão

Metaloproteinase Colagenase

Clivagem do colágeno

Etapas elementares do processo de invasão neoplásica. Degradação da matriz
de motilidade autócrino
Migração e invasão


Princípios moleculares da oncogênese
Capacidade de invasão: - principais mecanismos: -- os subclones que invadem a circulação precisam sobreviver às forças de cisalhamento e ataques imunológicos antes de colonizar sítios secundários; -- a formação de aglomerados favorece a sobrevivência e "implantabilidade" das células invasoras.


Membrana basal
Célula neoplásica em proliferação

Neovasos Subclone invasor
Infiltração local Intravasão Aglomerados tumorais Extravasão Metástase tumoral
Principais eventos do processo de metastatização neoplásica.


Princípios moleculares da oncogênese
Capacidade de invasão:
- principais mecanismos:
-- a invasão de vasos sanguíneos e/ou linfáticos dá às células neoplásicas acesso à virtualmente qualquer localidade no corpo;
-- pela via linfática, os linfonodos regionais são, como regra, os primeiros a receber células invasoras;
-- pela via hemática, os aglomerados tumorais em geral embolizam as primeiras malhas capilares que encontram;
-- alguns tumores exibem certo tropismo por determinados sítios secundários (p. ex., ossos, no carcinoma em mama ou próstata).




Princípios
Capacidade de invasão: - principais mecanismos: -- após invadir um sítio secundário, as células neoplásicas o tornam mais "habitável" ao modular (citocinas, fatores de crescimento) a atividade das células estromais locais (mecanismos a esclarecer); -- algumas metástases podem permanecer "dormentes", sem exibir crescimento significativo, uma vez estabelecidas num sítio secundário.




Principais agentes oncogênicos
Considerações gerais:
- as alterações gênicas que favorecem a oncogênese podem ser hereditárias ou adquiridas;
- as alterações adquiridas (exposições ambientais) são preponderantes;
- a exposição a agentes químicos (inclusive endógenos), físicos e/ou biológicos, por seu caráter potencialmente modulável, torna-se alvo de estratégias de prevenção;
- mais de 120 agentes cancerígenos já foram identificados e centenas de outros, potencialmente cancerígenos, encontram-se em investigação.



Classes de agentes conforme sua carcinogenicidade, segundo a IARC/OMS.


Principais agentes oncogênicos
Agentes químicos:
- agentes iniciadores causam alterações gênicas pró-neoplásicas direta ou indiretamente (por meio de metabólitos; via mais comum);
- em geral metabolizados por enzimas polimórficas (como a citocromo P450, cuja atividade pode variar muito entre indivíduos), em parte justificando diferentes susceptibilidades;
- presentes em substâncias diversas (algumas amplamente consumidas), incluindo tabaco, álcool, agrotóxicos e medicamentos;
- radicais livres são exemplos de agentes endógenos potencialmente genotóxicos (inflamação crônica).




Agentes químicos:
- agentes promotores não são capazes de causar alterações gênicas, mas intensificam a proliferação tumoral, uma vez iniciada; - agentes endógenos, como fatores de crescimento (reparo tecidual associado à inflamação crônica) e hormônios (p. ex., estrogênios), podem atuar como promotores.




Principais agentes oncogênicos
Agentes físicos:
- destacam-se as radiações eletromagnéticas de alta frequência (UV, X, γ);
- a radiação UV pode provocar ligações entre bases nitrogenadas pirimídicas adjacentes, distorcendo moléculas de DNA das células expostas (em geral da epiderme, favorecendo neoplasias cutâneas);
- radiações ionizantes (α, β, X, γ) causam danos diretos ou indiretos (radicais livres) ao DNA e associam-se a múltiplos tipos de câncer (em especial da medula óssea, tireoide, mama e pulmões).





Principais agentes oncogênicos
Agentes biológicos:
- destacam-se os vírus, como o HPV (colo uterino, faringe), EBV (órgãos linfáticos), HTLV (medula óssea), HBV e HCV (fígado);
- proteínas virais podem interferir nas vias pró-crescimento das células infectadas e na expressão de genes reguladores do ciclo celular e apoptose, além de prejudicar mecanismos de reparo de DNA (favorecendo mutações e proliferações anormais);
- a integração do vírus ao DNA das células infectadas pode adulterar a estrutura cromossômica, eventualmente levando a alterações de genes ligados à oncogênese.




Considerações gerais:
- incluem qualquer condição (herdada ou adquirida), ocupação ou comportamento que proporcione exposição (ou demasiada exposição) a agentes oncogênicos ou potencialize seus efeitos; - destacam-se (IARC/OMS) o tabagismo, etilismo, dieta, excesso de peso, sedentarismo e exposição solar excessiva (fatores tipicamente moduláveis).




Considerações gerais:
- condições mórbidas adquiridas, como inflamação crônica e certas proliferações/alterações celulares, representam "terreno fértil" para a carcinogênese; - algumas alterações gênicas herdáveis podem aumentar significativamente a predisposição à carcinogênese.




Principais fatores de risco para o câncer
Tabagismo:
- 1,1 bilhão de fumantes no mundo;
- associação causal com o câncer em pelo menos 20 diferentes sítios, incluindo pulmões (80% dos casos), laringe, cavidade oral, faringe, esôfago, bexiga, fígado, estômago, retocolo e medula óssea;
- carcinogênese pela ação de agentes iniciadores e promotores oriundos da queima do tabaco, corroborados pela inflamação crônica paralela;
- dentre os agentes destacam-se hidrocarbonetos policíclicos aromáticos, nitrosaminas e aminas aromáticas.




A queima do tabaco produz milhares de subprodutos, dentre os quais 70 carcinógenos já foram identificados.


Etilismo:
- associação causal com o câncer no esôfago, retocolo, fígado, mamas, cavidade oral, faringe e laringe; - carcinogênese (parcialmente compreendida) envolve metabólitos genotóxicos (acetaldeído) e subprodutos (radicais livres) do metabolismo do etanol, corroborados pela inflamação crônica paralela;
- capaz de potencializar os efeitos carcinogênicos do tabaco.



O etilismo foi primeiramente correlacionado com o câncer em 1910 e hoje é considerado um de seus grandes fatores de risco (o álcool é classificado como carcinogênico pela IARC/OMS).



Dieta:
- hábitos alimentares podem favorecer o câncer ao:
-- expor o indivíduo a agentes cancerígenos próprios do alimento ou sob a forma de aditivos e/ou contaminantes;
-- proporcionar substratos à síntese endógena de agentes cancerígenos;
-- fomentar inflamação crônica;
-- não proporcionar em suficiência fatores potencialmente protetores (micronutrientes, fibras);
-- gerar sobrepeso/obesidade (excesso de ingesta calórica).



O consumo regular de vegetais associa-se a incidências consideravelmente reduzidas de câncer (em particular no tubo digestório), provavelmente, em parte, por suas propriedades antioxidantes e anti-inflamatórias.



Dieta:
- carnes vermelhas ou processadas ("embutidos") estão associadas ao câncer no retocolo (principal), pâncreas e próstata;
- o consumo de 100g de carne vermelha (ou 50g de processada) por dia aumenta em mais de 20% o risco de câncer colorretal;
- a carcinogênese provavelmente envolve a atuação genotóxica de compostos nitrosos derivados do heme (formados endogenamente e/ou gerados pelo preparo em altas temperaturas), como as nitrosaminas.



Carnes vermelhas e carnes processadas estão classificadas pela IARC/OMS como "provavelmente carcinogênicas" e "carcinogênicas", respectivamente, desde 2015.



Dieta:
- a utilização de compostos nitrosos como aditivos (conservantes) nas carnes processadas incrementa seu potencial genotóxico;
- fatores adjuvantes podem incluir a atuação cito/genotóxica de subprodutos da fermentação bacteriana intestinal e a toxicidade direta do heme sobre o epitélio cólico, corroborados pela inflamação crônica;
- a impregnação por fumaça contendo hidrocarbonetos policíclicos aromáticos (queima da gordura, óleos, carvão) favorece a carcinogênese.



O potencial cancerígeno da carne vermelha pode ser ampliado conforme seu processamento ou forma de preparo.



Sobrepeso/obesidade:
- condição observada em 40% da população adulta mundial;
- a adiposidade excessiva têm sido fortemente associada ao câncer em uma ampla variedade de sítios, em especial mamas, endométrio, retocolo, rins, pâncreas, esôfago e fígado; - mecanismos (parcialmente esclarecidos) incluem efeitos da hiperinsulinemia (↑ IGF-1, ativador da via PI3K) e estrogênios (síntese periférica), potenciais agentes promotores, corroborados pelo persistente estado pró-inflamatório (adipocinas, ác. graxos livres) associado ao tecido adiposo em excesso.




O excesso de adiposidade é reconhecido pela IARC/OMS como um importante fator de risco para o câncer.


Sedentarismo:
- o exercício físico regular está fortemente associado à redução da incidência do câncer, em especial no retocolo, mamas, endométrio, bexiga, rins, esôfago e estômago; - os benefícios do exercício provavelmente se devem a múltiplos fatores (que se interconectam), incluindo a modulação favorável de mediadores inflamatórios, fatores de crescimento e hormônios.




Conforme a OMS, os benefícios do exercício físico em relação ao câncer requerem a realização de pelo menos 150 min. de atividade moderada ou 75 min. de atividade intensa por semana.


Exposição solar excessiva:
- associação causal com o câncer na pele;
- carcinogênese pela ação genotóxica da radiação UVB, favorecida nas exposições excessivas, ainda que esporádicas (em especial indivíduos de pele clara), corroborada pela inflamação crônica paralela;
- câmaras de bronzeamento artificial associam-se a risco igual ou maior.



Estima-se que mais de 90% dos cânceres de pele poderiam ser prevenidos por medidas fotoprotetoras.



Inflamação crônica:
- a associação entre câncer e inflamação já era defendida por Virchow no séc. XIX e tem se fortalecido nas últimas décadas;
- a inflamação pode consistir numa condição prévia ao surgimento da neoplasia ou por ela deflagrada;
- os mecanismos da interação inflamação-neoplasia são complexos e apenas parcialmente esclarecidos.




Inflamação crônica:
- a produção persistente de radicais livres (potencial genotóxico) associada ao reparo tecidual frustro (estímulo persistente à proliferação celular) pode favorecer o ocasional surgimento de mutações oncogênicas;
- o ambiente inflamatório é rico em mediadores (incluindo fatores de crescimento implicados no reparo tecidual associado) que podem ser aproveitados a serviço da proliferação, angiogênese e invasão neoplásicas.




Proliferações/alterações potencialmente precursoras:
- algumas proliferações hiperplásicas ou neoplásicas benignas associam-se a maior risco de malignização, bem como alguns cenários de metaplasia;
- a transformação maligna é incerta (sendo mais provável na vigência de displasia acentuada) e se dá em intervalos de tempo variáveis;
- não raramente há inflamação crônica associada.




Instabilidade genômica hereditária:
- alterações herdáveis de genes reparadores de DNA, como MLH1, MSH2, MSH6 ou PMS2 (síndrome de Lynch), BRCA1 ou BRCA2, embora não oncogênicas por si, conferem maior risco para neoplasias diversas; - mecanismos defeituosos de correção de erros de duplicação do DNA favorecem a ocorrência de mutações com maior frequência;
- uma alta frequência de mutações (instabilidade genômica) eleva as probabilidades de surgimento daquelas com efeitos oncogênicos.




Considerações gerais:
- variável conforme localização, tamanho relativo e extensão do tumor (muitas vezes traduzem quadro já avançado da doença);
- neoplasias em órgãos endócrinos podem cursar com hiperfunção (tumores funcionantes) ou hipofunção (pela destruição tecidual) hormonal;
- manifestações clínicas/laboratoriais e outros eventos patológicos que podem integrar o quadro (e inclusive inaugurá-lo), sem dever-se diretamente à localização anatômica da neoplasia, configuram diversas síndromes paraneoplásicas (10% dos casos).




Caquexia do câncer:
- o avanço do câncer é tipicamente acompanhado por perda de massa corporal (muscular e adiposa), fraqueza, anorexia e anemia (caquexia); - mecanismos permanecem pouco compreendidos, envolvendo incremento do metabolismo basal (induzido por fatores sintetizados pelas células neoplásicas) e da atividade inflamatória sistêmica.




A caquexia é uma importante repercussão fisiopatológica do câncer.


Considerações gerais:
- a presença de metástases é importante fator de morbimortalidade (9:10 óbitos por neoplasia decorrem de doença metastática);
- infecções (em geral pneumonia), falências de órgãos (em geral por invasão tumoral) e eventos tromboembólicos ou hemorrágicos são os principais mediadores do óbito;
- a sobrevida varia conforme o tipo histopatológico, estadiamento (momento do diagnóstico) e comorbidades, dentre outros.




Considerações gerais:
- objetivam a detecção de lesões precursoras ou do câncer em fase inicial de evolução (maior chance de cura);
- aplicáveis especialmente aos tumores em mamas, próstata, colo uterino, retocolo e pulmões;
- idealmente baseados em métodos com altas sensibilidade e especificidade;
- a confirmação diagnóstica sempre requer exame histopatológico.




O exame anatomopatológico nas doenças neoplásicas
Considerações gerais:
- representa o principal recurso diagnóstico;
- visa, incialmente, responder às perguntas: (1) se há processo neoplásico, (2) se é benigno ou maligno e (3) qual o tipo histopatológico (e o grau, quando aplicável);
- o exame de peças cirúrgicas objetiva, em adição, definir a extensão tumoral (para o estadiamento).


A interpretação dos achados anatomopatológicos é sempre favorecida pelo contexto clínico, sendo dever do médico que diretamente assiste o paciente transmiti-lo ao patologista.


Laudo anatomopatológico






Laudo anatomopatológico







AKT
Sigla/abreviatura Significado
Ak murine Thymoma (Ak: identificação da cepa estudada)
ALK Anaplastic Lymphoma receptor tyrosine Kinase
BCL B Cell Lymphoma
B-RAF Rapidly Accelerated Fibrosarcoma-B
BRCA1/2 BReast CArcinoma 1/2
CDK Cyclin Dependent Kinases
E2F
ERBB2 (ou HER2)
E2 transcription Factor (E2: identificação ordinal da família de fatores de transcrição)
ERythroBlastic leukemia viral oncogene homolog B2 (ou Human Epidermal growth factor Receptor 2)
FGF3 Fibroblast Growth Factor 3
HGF Hepatocyte Growth Factor
HIF1 Hypoxia-Inducible Factor 1
KIT v-KIT feline sarcoma viral oncogene homolog
MAPK Mitogen Activated Protein Kinase

Função de interesse
Proteína quinase. Integra cascata regulatória da proliferação celular.
Proto-oncogene (2p23). Codifica receptor de fator de crescimento.
Família de proteínas implicadas na regulação da apoptose.
Proteína quinase. Integra cascata regulatória da proliferação celular. Codificada pelo proto-oncogene BRAF (7q34).
Genes (17q21/13q12) que codificam proteínas implicadas no reparo de erros de duplicação do DNA.
Família de proteínas quinase. Formam complexos com ciclinas e regulam a atividade da pRB.
Família de fatores de transcrição. Regulam a expressão de genes promotores da proliferação celular.
Proto-oncogene (17q2). Codifica receptor envolvido na sinalização por fator de crescimento.
Proto-oncogene (11q13). Codifica fator de crescimento (FGF-3).
Proto-oncogene (7q21). Codifica fator de crescimento (HGF).
Fator de transcrição. Regula a expressão de genes que codificam mediadores angiogênicos.
Proto-oncogene (4q12). Codifica receptor de fator de crescimento.
Proteína quinase. Integra cascata regulatória da proliferação celular.



Sigla/abreviatura
MLH1 Mut L (protein) Homolog 1
MSH2/6 Mut S (protein) Homolog 2/6
mTOR mechanistic Target Of Rapamycin
MYC avian MYeloCytomatosis virus homolog
NF1 NeuroFibromin 1
p16
PI3K
protein 16 (16: massa molecular da proteína, em kDa)
PhosphatidylInositol 3-Kinase
Função de interesse
Gene (3p22) que codifica proteína implicada no reparo de erros de duplicação do DNA.
Genes (2p21/2p16) que codificam proteínas implicadas no reparo de erros de duplicação do DNA.
Proteína quinase. Integra cascata regulatória da proliferação celular.
Proto-oncogene (8q24). Codifica fator de transcrição (homônimo) que regula a expressão de genes promotores da proliferação celular.
Gene supressor tumoral (17q11). Codifica proteína que inativa a RAS
Proteína inibidora de complexos ciclina-CDK (que regulam a atividade da pRB). Codificada pelo gene supressor tumoral CDKN2A (9p21).
Proteína quinase. Integra cascata regulatória da proliferação celular. Parcialmente codificada pelo proto-oncogene PIK3CA (3q26).
PMS2 PostMeiotic Segregation increased 2 Gene (7p22) que codifica proteína implicada no reparo de erros de duplicação do DNA.
PTEN
Phosphatase and TENsin homolog
RAS (N-RAS, H-RAS, K-RAS) RAt Sarcoma virus (N- Neuroblastoma; H- Jennifer Harvey; K- Werner Kirsten)
RB1 RetinoBlastoma 1
TGFA Transforming Growth Factor Alpha
TP53
Tumor Protein 53 (53: massa molecular da proteína codificada, em kDa)
Gene supressor tumoral (10q23). Codifica proteína que inibe a atividade da PI3K.
Proto-oncogenes (N- 1p13, H- 11p15, K- 12p12). Codificam proteínas G associadas a vias que regulam a proliferação celular.
Gene supressor tumoral (13q14). Codifica proteína (pRB) que regula fatores de transcrição (E2F) de genes envolvidos na progressão do ciclo celular.
Proto-oncogene (2p13). Codifica fator de crescimento (FGF-α).
Gene supressor tumoral (17p13). Codifica fator de transcrição (p53) que regula a expressão de genes implicados no controle do ciclo celular e apoptose.



Referências bibliográficas
Gerais:
1. Kumar V, Abbas A, Aster J. Robbins & Cotran: Pathologic basis of disease. 9th ed. Elsevier; 2016.
2. O'Dowd G, Bell S, Wright S. Wheather's Pathology: A text, atlas and review of histopathology. 9th ed. Elsevier; 2020.
3. Klatt E. Robbins & Cotran: Atlas of pathology. 3rd ed. Elsevier; 2015.
4. Buja L, Krueger G. Netter's Illustrated human pathology. 2nd ed. Elsevier; 2011.
5. Goldblum J, et al. Rosai & Ackerman's Surgical pathology. 11th ed. Elsevier; 2017.
Específicas:
1. Weinberg RA. The biology of cancer. 2nd ed. Garland Science; 2014.
2. International Agency for Research on Cancer. World cancer report. IARC; 2020.
3. Union for International Cancer Control. TNM classification of malignant tumors. 8th ed. Wiley Blackwell; 2017.
4. American Joint Committee on Cancer. Cancer staging manual. 8th ed. Springer; 2018.
5. American Cancer Society. The cancer atlas. 3rd ed. ACS; 2019.
6. U.S. National Library of Medicine. National Center for Biotechnology Information [internet]. Disponível em www.ncbi.nlm.nih.gov/gene




Referências bibliográficas
Complementares:
1. Sociedade Brasileira de Anatomia. Terminologia Anatômica. Manole; 2001.
2. Federative International Committee on Anatomical Terminology. Terminologia Histologica. LWW; 2008.
3. Ovalle WK, Nahirney PC. Netter: Bases da histologia. Elsevier; 2008.
4. Ross MH, Pawlina W. Histologia texto e atlas. 6ª ed. Guanabara Koogan; 2012.
5. Mills S. Histology for pathologists. 4th ed. LWW; 2012.
6. Alberts B, et al. Biologia molecular da célula. 6ª ed. Artmed; 2017.
7. Standring S. Gray's Anatomia: a base anatômica da prática clínica. 40ª ed. Elsevier; 2011.
8. Schunke M, Schulte E, Schumacher U. Prometheus: Atlas de anatomia. Guanabara Koogan; 2007.
9. Netter FH. Atlas de anatomia humana. 7ª ed. Elsevier; 2018.
10.Jansen JT, Netter FH. Netter's Clinical anatomy. 4nd ed. Elsevier; 2019.
11.Moore KL, Persaud PVN. Embriologia clínica. 10ª ed. Elsevier; 2016.
12.Boron W, Boulpaep E. Medical Physiology. 3rd ed. Elsevier; 2017.
13.Coico R, Sunshine G. Immunology. 7th ed. Wiley Blackwell; 2015.
14.Porto C, Porto A. Semiologia médica. 8ª ed. Guanabara Koogan; 2019.
15.Longo DL, Fauci AS, Kasper DL, et al. Medicina interna de Harrison. 18ª ed. Artmed; 2013.















"A vida inteligente de um planeta atinge a maioridade no momento em que compreende pela primeira vez a razão da sua própria existência".