Spi S treści SZ c ZEG ó ŁOW y
O reakcjach między atomami decydują elektrony ich zewnętrznej powłoki
Wiązania kowalencyjne powstają przez wspólne użytkowanie elektronów
Niektóre wiązania kowalencyjne powstają w wyniku wspólnego użytkowania więcej niż jednej pary elektronów
Elektrony w wiązaniach kowalencyjnych są często użytkowane nierównomiernie
Wiązania kowalencyjne są wystarczająco silne, aby przetrwać warunki wewnątrz komórki
Wiązania jonowe powstają przez przyjęcie i oddanie elektronów
Wiązania wodorowe są ważnymi wiązaniami niekowalencyjnymi w wielu cząsteczkach biologicznych
Cztery rodzaje słabych wiązań umożliwiają oddziaływanie cząsteczek w
zawierają cztery główne rodziny małocząsteczkowych związków
Reakcje katalizowane przez enzymy zależą od szybkich zderzeń cząsteczek
Oddziaływania niekowalencyjne umożliwiają enzymom wiązanie specyficznych cząsteczek
Stała równowagi odzwierciedla siłę niekowalencyjnych oddziaływań wiążących
Aktywowane nośniki a biosynteza
Powstawanie aktywowanych nośników jest sprzężone z reakcją energetycznie korzystną
ATP jest aktywowanym nośnikiem najczęściej wykorzystywanym w komórce
Energia magazynowana w ATP jest często wykorzystywana do łączenia dwóch cząsteczek
i NADPH są aktywowanymi nośnikami elektronów
i NADH odgrywają różne role w komórkach
Komórki wykorzystują wiele innych aktywowanych nośników
Synteza biopolimerów wymaga dostarczenia
rOzDział 4
przestrzenną białek określa ich sekwencja aminokwasowa
Białka zwijają się do konformacji o najniższej energii
Białka wykazują wielką różnorodność skomplikowanych struktur przestrzennych
α i harmonijka β to powszechnie występujące sposoby zwijania się białka
Helisy to uprzywilejowany motyw konstrukcyjny struktur biologicznych
Harmonijki β to motyw konstrukcyjny sztywnego rdzenia wielu białek
Białka nieprawidłowo zwijające się mogą tworzyć struktury amyloidowe o działaniu
mają kilka poziomów organizacji
Białka zawierają także odcinki o stosunkowo niewielkiej strukturalizacji
Tylko nieliczne z wielu możliwych łańcuchów polipeptydowych to funkcjonalne białka
Cząsteczki większych białek zawierają często więcej niż jeden łańcuch polipeptydowy
Białka mogą układać się w filamenty, arkusze lub kule
Niektóre rodzaje białek mają kształt wydłużonych włókien
Białka zewnątrzkomórkowe są często stabilizowane przez poprzeczne wiązania kowalencyjne
Wszystkie białka wiążą się z innymi cząsteczkami
Przeciwciała wiążą się ligandami z niezwykłą swoistością
Enzymy przekształcają chemicznie ligandy, z którymi się wiążą
zasadniczo zwiększają szybkość reakcji chemicznych
ilustruje pracę enzymu
niektórych białek wymaga ścisłego wiązania małych cząsteczek
allosteryczne mają dwa lub więcej miejsc wiążących oddziałujących ze sobą
Fosforylacja może kontrolować aktywność białka, wywołując zmianę konformacyjną 162
Modyfikacje kowalencyjne białek także kontrolują lokalizację białek i oddziaływania między nimi 163
Białka regulatorowe wiążące GTP są regulowane w wyniku cyklicznego uzyskiwania i utraty grupy fosforanowej 164
Hydroliza ATP pozwala białkom motorycznym wytwarzać w komórce ukierunkowany ruch
164
Białka często tworzą duże kompleksy, które działają jak maszyny białkowe 165
Kompleksy białkowe tworzą się dzięki rusztowaniom
Oddziaływania pomiędzy makrocząsteczkami mogą wytwarzać w komórkach duże, biochemicznie zróżnicowane podprzedziały 167
Białka można oczyszczać z komórek lub tkanek
Określenie struktury białka rozpoczyna się od poznania jego sekwencji aminokwasowej 170
Metody eksperymentalne i obliczeniowe pozwalają na przekształcenie sekwencji aminokwasów w struktury białek
Pokrewieństwo między białkami ułatwia przewidywanie ich struktury i funkcji
Techniki inżynierii genetycznej umożliwiają masową produkcję, analizę i projektowanie białek
replikacji i segregacji chromosomów wymagane są wyspecjalizowane sekwencje
interfazowe występują w jądrze w sposób zorganizowany
Podstawowymi jednostkami struktury chromosomu eukariotycznego są nukleosomy
Chromosomy interfazowe są następnie organizowane w pętle przez duże pierścienie białkowe
ChROmOSOmóW
Chromosomy interfazowe zawierają zarówno skondensowane, jak i rozluźnione formy chromatyny
Białka w widełkach replikacyjnych współpracują, tworząc aparat replikacyjny
Telomeraza umożliwia replikacje końców chromosomów eukariotycznych
Długość telomerów jest różna dla różnych typów komórek i zależy od ich wieku
NAPRAWA DNA
W komórkach ciągle dochodzi do uszkodzeń DNA
Komórki dysponują licznymi mechanizmami naprawy DNA
System naprawy źle dopasowanych par zasad usuwa błędy replikacji DNA, które uniknęły korekty
Naprawa dwuniciowych pęknięć DNA wymaga odrębnej strategii
Rekombinacja homologiczna potrafi bezbłędnie naprawiać dwuniciowe pęknięcia DNA 239
Problemy z naprawą uszkodzeń DNA mogą mieć poważne konsekwencje dla komórki lub organizmu
Zapis dokładności replikacji i naprawy DNA jest zachowany w sekwencjach genomowych
rOzDział 7
Od DNA do białek: Jak komórki odczytują swój genom?
Odcinki sekwencji DNA są przepisywane na RNA
Podczas transkrypcji powstaje RNA komplementarny wobec jednej z nici DNA
W komórkach powstają różne rodzaje RNA
Sygnały w DNA pokazują polimerazie RNA miejsca początku i końca transkrypcji 253
Inicjacja transkrypcji genów eukariotycznych jest złożonym procesem 255
Eukariotycznej polimerazie RNA niezbędnie potrzebne są liczne białka pomocnicze
Cząsteczki eukariotycznego mRNA dojrzewają w jądrze komórkowym
U eukariontów geny kodujące białka są przerywane sekwencjami niekodującymi nazywanymi intronami
Introny są usuwane z cząsteczek pre-mRNA w procesie splicingu
Synteza i dojrzewanie RNA zachodzą w przedziałach jądra komórkowego, które nie są ograniczone błonami
Dojrzałe cząsteczki eukariotycznego mRNA są eksportowane z jądra komórkowego
Cząsteczki mRNA ostatecznie ulegają degradacji w cytoplazmie
OD RNA DO BIAłKA
Informacja w sekwencji mRNA jest zakodowana w postaci zestawów trójek nukleotydów
Cząsteczki tRNA dopasowują aminokwasy do kodonów mRNA
Swoiste enzymy łączą cząsteczki tRNA z właściwymi aminokwasami
Informacja zawarta w mRNA jest odczytywana w rybosomach
Rybosom jest rybozymem
Specjalne kodony mRNA informują rybosom o tym, gdzie zacząć i gdzie skończyć syntezę białka
Białka powstają na polirybosomach
Inhibitory syntezy białka u prokariontów są stosowane jako antybiotyki
Kontrolowany rozkład białek pomaga w regulacji ilości każdego białka w komórce
Droga od DNA do białka obejmuje wiele etapów
RNA może przechowywać informację oraz katalizować reakcje chemiczne
RNA jest uważany za starszy ewolucyjnie niż DNA
256
258
259
260
264
265
265
267
267
268
273
273
276
Różne typy komórek organizmu wielokomórkowego zawierają ten sam DNA
Różne typy komórek produkują odmienne zestawy białek
Komórka może zmieniać ekspresję swoich genów w odpowiedzi na sygnały zewnętrzne
Ekspresja genów może być regulowana na różnych etapach ścieżki prowadzącej od DNA przez RNA do białka
JAK REgulOWANA JEST TRANSKRyPCJA
Regulatory transkrypcji wiążą się z regulatorowymi sekwencjami DNA
Przełączniki transkrypcji pozwalają komórkom reagować na zmiany środowiskowe
Represory wyłączają geny, a aktywatory je włączają
Operon Lac jest kontrolowany przez aktywator i represor
Eukariotyczne regulatory transkrypcji kontrolują ekspresję genów na odległość
Eukariotyczne regulatory transkrypcji wspomagają inicjację transkrypcji, rekrutując białka modyfikujące chromatynę
Organizacja chromosomów w wypętlone domeny pozwala kontrolować sekwencje wzmacniające
WySPECJAlIZOWANyCh TyPóW KOmóREK
Geny eukariotyczne są kontrolowane przez kombinację regulatorów transkrypcji
Jedno białko może koordynować ekspresję różnych genów
Kontrola kombinatoryczna prowadzi do powstawania różnych typów komórek
Pojedynczy regulator transkrypcji może doprowadzić do powstania całego narządu
299
301
Regulatory transkrypcji mogą być wykorzystywane do ukierunkowanego doświadczalnie wytwarzania specyficznych typów komórek w hodowli 312
Komórki zróżnicowane zachowują swoją tożsamość
zawierają sekwencje, które kontrolują ich translację
Małe interferujące
wykorzystują małe niekodujące RNA do obrony przed wirusami
Tysiące różnych cząsteczek długich niekodujących
także mogą regulować aktywność genów ssaków
organizmach rozmnażających
Geny mogą być wymieniane między organizmami w wyniku horyzontalnego transferu genów
REKONSTRuKCJA RODOWEgO DRZEWA żyCIA
Zmiany genetyczne, które zapewniają przewagę selekcyjną, prawdopodobnie zostaną zachowane
Genomy blisko spokrewnionych gatunków są podobne zarówno pod względem organizacji, jak i sekwencji 338
Funkcjonalnie ważne rejony genomu to wyspy konserwowanych sekwencji DNA 339
Analizy porównawcze genomów wskazują na to, że genomy kręgowców szybko zyskują i tracą DNA 341
Konserwacja sekwencji pozwala śledzić nawet najbardziej odległe pokrewieństwo ewolucyjne
RuChOmE ElEmENTy gENETyCZNE I WIRuSy
Ruchome elementy genetyczne kodują składniki, których potrzebują do przemieszczania się
Genom człowieka zawiera dwie główne rodziny sekwencji transpozycyjnych
Wirusy mogą przemieszczać się pomiędzy komórkami i organizmami
Koronawirusy takie jak SARS-CoV-2 do kopiowania swojego genomu RNA używają specjalnej replikazy
Retrowirusy odwracają normalny przepływ informacji genetycznej
BADANIE gENOmu CZłOWIEKA
Sekwencje nukleotydowe ludzkich genomów pokazują, jak rozmieszczone są nasze geny
Różnice w regulacji genów pomagają w wyjaśnieniu, dlaczego zwierzęta o podobnych genomach
Genom wymarłych neandertalczyków wiele mówi o tym, co czyni nas ludźmi
Zmienność genomów przyczynia się do naszej indywidualności, ale w jaki sposób?
Enzymy restrykcyjne rozcinają cząsteczki DNA w swoistych miejscach
żelowa umożliwia rozdział fragmentów DNA różniących się długością
Klonowanie DNA rozpoczyna się od uzyskania rekombinowanego
Rekombinowany DNA może być kopiowany w komórkach bakteryjnych
Cały genom może być zawarty w bibliotece DNA
Hybrydyzacja jest czułą metodą wykrywania swoistych sekwencji nukleotydowych
Metoda PCR może być stosowana do wytwarzania określonych fragmentów DNA w probówce
Metoda PCR może być wykorzystana w diagnostyce i medycynie sądowej
Sekwencjonowanie metodą dideoksy polega na analizie łańcuchów DNA, których synteza zatrzymywana jest w każdej pozycji
Techniki sekwencjonowania następnej generacji umożliwiają szybsze i tańsze sekwencjonowanie genomów
Analizy porównawcze genomów umożliwiają identyfikację genów i określenie ich
Hybrydyzacja in situ może ujawnić, kiedy i gdzie zachodzi ekspresja określonego genu
Profilowanie rybosomów ujawnia, które mRNA w komórce ulegają translacji do białek
Geny reporterowe umożliwiają śledzenie swoistych białek w żywych komórkach
Badanie mutantów może pomóc w odkrywaniu funkcji genu
Interferencja RNA (RNAi) hamuje aktywność określonych genów
Znany gen można usunąć lub zastąpić go zmienioną wersją
Geny można edytować z wielką precyzją przy użyciu bakteryjnego systemu CRISPR
Mutanty mogą być użytecznymi modelami chorób człowieka
Rośliny transgeniczne znajdują zastosowanie zarówno w biologii komórki, jak i w rolnictwie
Klonowanie DNA umożliwia wytwarzanie dużych ilości dowolnego białka
W ią ZA ni A FO s FORA n OWE O W ys O ki EJ E n ER gii
ZA sil AJ ą PRO c E sy k OM ó R k OWE
Komórki wymagają ciągłego przepływu energii, by tworzyć i utrzymywać stan uporządkowania, pozyskując materiały, których potrzebują do przeżycia, wzrostu i rozmnażania. Ale do 1921 roku niewiele wiedziano o tym, jak energia, którą komórki zwierzęce uzyskują z rozkładu pożywienia, jest biochemicznie przekształcana, przechowywana i uwalniana w celu wykonania pracy w komórce. Poradzenie sobie z tym fundamentalnym problemem wymagało wysiłku grupy biochemików, z których wielu pracowało z Otto Meyerhofem, pionierem w dziedzinie metabolizmu komórkowego. Zaczęło się od mięśni
Meyerhof miał praktykę lekarską w Heidelbergu, w Niemczech, i głównie interesował się chemią fizjologiczną; szczególnie zastanawiał się nad przekształcaniem energii podczas reakcji chemicznych w komórkach. Wiedział, że duża część energii pomiędzy początkowym etapem wejścia do organizmu w postaci pożywienia a ostatecznym jej uwolnieniem w postaci ciepła musi zostać przekształcona w formę dostępną dla wielu pośrednich etapów przemian chemicznych, które pozwalają komórce lub organizmowi utrzymywać się w stanie dynamicznej równowagi.
Aby wyjaśnić, jak te tajemnicze transformacje chemiczne zasilają pracę wykonywaną przez komórki, Meyerhof skupił swoją uwagę na mięśniu. Tkankę mięśniową można izolować ze zwierząt, na przykład z żaby, i stymulować do skurczu pulsem elektrycznym. Skurcz takiego mięśnia wspaniale demonstrował przekształcenie energii do postaci użytecznej, energii mechanicznej.
Gdy Meyerhof zaczynał swoje doświadczenia, o chemii skurczu wiedziano tylko tyle, że w tkance aktywnego mięśnia kończy się tlen i tworzy się kwas mlekowy. Pierwszym zadaniem Meyerhofa było zademonstrowanie, że kwas mlekowy pochodzi z rozkładu glikogenu, rozgałęzionego polimeru cząsteczek glukozy, który służy w komórce zwierzęcej jako magazyn energii, szczególnie w mięśniach (patrz panel 2.4, s. 82). Podczas gdy Meyerhof skupił się na stronie chemicznej, angielski fizjolog Archibald Vivian Hill stwierdził, że pracujący mięsień dostarcza ciepło zarówno podczas skurczu, jak i rozkurczu; następnie odkrył, że ilość ciepła koreluje z intensywnością pracy mięśnia. Hill i Meyerhof zaproponowali, że ciepło uwalniane podczas rozkurczu mięśnia jest związane z resyntezą glikogenu. Po serii skurczów mięśnia następuje okres regeneracji, w którym przywracany jest poziom tlenu, a część kwasu mlekowego powstałego podczas skurczu mięśnia zostaje całkowicie utleniona do CO 2 i wody. Energia uwolniona w wyniku tego oksydacyjnego (utleniającego) rozkładu może następnie zostać wykorzystana do przekształcenia
pozostałego kwasu mlekowego z powrotem do glikogenu (ryc. 3.27). Przekształcenie glikogenu do kwasu mlekowego i z powrotem stanowiło pierwszy dowód cyklicznego przekształcania energii w komórkach. W 1922 roku Meyerhof i Hill otrzymali Nagrodę Nobla.
glikogen
ryc. 3.27. Uważano, że „cykl kwasu mlekowego” dostarcza energii potrzebnej do skurczu mięśnia. Preparaty wyizolowanego mięśnia żaby stymulowano do skurczu. Takiemu powtarzanemu kurczeniu, który prowadził do wyczerpania mięśniowej rezerwy tlenu, towarzyszył rozkład glikogenu i produkcja kwasu mlekowego. Uważano, że energia uwalniania podczas takiego procesu rozkładu glikogenu w jakiś sposób zasila skurcz mięśnia. W miarę jak mięsień powoli się regenerował, przywracany poziom tlenu umożliwiał rozkład poprzez utlenienie części kwasu mlekowego do CO2 i H2O. Energia uwolniona w wyniku tego rozkładu kwasu mlekowego napędzała przekształcenie pozostałego kwasu mlekowego z powrotem do glikogenu. Ciepło wytwarzane jest zarówno w fazie skurczu, jak i regeneracji glikogen
Pocztą
glukoza
kwas mlekowy
uwalniana energia jest wykorzystywana do sz ybkiego kurczenia mięśnia: O2 nie jest wymagany
kwas mlekowy glukoza
powolny proces wypocz ynku mięśnia potrzebuje nakładu energii uwalnianej w reakcjach wymagających O2
Czy przekształcenie glikogenu w kwas mlekowy bezpośrednio zasila pracę mechaniczną podczas skurczu mięśnia? Meyerhof tak myślał do 1927 roku, kiedy to otrzymał list od duńskiego fizjologa Einara Lundsgaarda. W liście tym Lundsgaard poinformował Meyerhofa o zaskakujących wynikach pewnych eksperymentów, które przeprowadził z izolowanymi mięśniami oraz z żywymi królikami i żabami. Lundsgaard wstrzykiwał do mięśni jodooctan, związek hamujący enzym zaangażowany w rozkład glukozy (omówiony w rozdz. 13). W efekcie w mięśniach tych zablokowana została fermentacja i nie powstawał kwas mlekowy. Lundsgaard odkrył, że zatrute mięśnie nadal się kurczyły. W rzeczy samej, jak to opisał Fritz Lipmann (biochemik pracujący w laboratorium Meyerhofa), zwierzęta ze wstrzykniętym jodooctanem początkowo „zachowywały się normalnie”. Jednak po kilku minutach przewracały się wskutek zesztywnienia mięśni. Jeśli utlenienie kwasu mlekowego nie dostarczało energii dla pracy mięśni, to co ją dostarczało? Pracując dalej, Lundsgaard wykazał, że źródłem energii
dla skurczu w zatrutych mięśniach może być właśnie odkryta cząsteczka nazwana fosfokreatyną. Kiedy tworzenie kwasu mlekowego było blokowane przez jodooctan, kurczenie mięśni zasilała hydroliza fosfokreatyny. Po wyczerpaniu zapasu fosfokreatyny mięśnie na stałe odmawiały posłuszeństwa.
Odkrycie to wywołało spore zamieszanie w laboratorium Meyerhofa, gdyż zaprzeczało teorii Meyerhofa, że kwas mlekowy zasila kurczenie się mięśni. Odkrycie to nie tylko wskazywało na alternatywną cząsteczkę, ale także prowadziło do całkowicie nowej idei, że niektóre wiązania fosforanowe, po hydrolizie, mogą dostarczać energii. Lipmann pisał: „Lundsgaard odkrył, że maszyneria mięśniowa może być napędzana przez energię wiązań fosforanowych i sprytnie domyślił się, że ten typ energii znajduje się «bliżej», jak to sam określił, przekształcenia energii metabolicznej w energię mechaniczną niż na etapie kwasu mlekowego”.
Meyerhof nie był wściekły, tylko zaprosił Lundsgaarda do swojego laboratorium w Heidelbergu, gdzie kierował Instytutem Fizjologii im. Cesarza Wilhelma. Lundsgaard wykonał tam bardzo dokładne pomiary pokazujące, że rozkład fosfokreatyny i ciepło wówczas wydzielane ściśle odpowiadają wielkości napięcia generowanego przez nienaruszony mięsień.
Bezpośrednia konkluzja, do której prowadzą te obserwacje, jest taka, że hydroliza fosfokreatyny dostarcza energii, która zasila kurczenie się mięśnia. W jednej z publikacji z 1930 roku Lundsgaard ostrożnie wskazał inną możliwość, że w normalnym mięśniu zarówno tworzenie kwasu mlekowego, jak i hydroliza fosfokreatyny przekazują energię do trzeciego systemu, który musi być jeszcze odkryty. I tutaj pojawił się ATP.
Zawijas przy P
Nawet przed pouczającymi obserwacjami Lundsgaarda Meyerhof interesował się ilością energii w różnych związkach metabolicznych, szczególnie tych, które zawierają fosforan. Uważał, że źródła energii metabolicznej można zidentyfikować poprzez znalezienie naturalnie występujących cząsteczek, które w czasie hydrolizy uwalniają dużą ilość ciepła. Jednym z tych związków była fosfokreatyna, innym – ATP, odkryty w 1929 roku przez asystenta Meyerhofa, chemika Karla Lohmanna, i jednocześnie przez biochemików pracujących w Ameryce, Cyrusa Fiske i Yellapragada Subbarowa.
W 1935 roku Lohmann zademonstrował, że hydrolityczny rozkład fosfokreatyny przebiega z przeniesieniem grupy fosforanowej na ADP, co tworzy ATP. I właśnie hydroliza ATP służy jako bezpośrednie źródło energii dla kurczenia się mięśni. Fosfokreatyna stanowi rezerwuar grup fosforanowych o wysokiej energii, które regenerują ATP i utrzymują potrzebny stosunek ATP do ADP (ryc. 3.28).
W 1941 roku Lipmann opublikował 63-stronicową pracę przeglądową w inauguracyjnym numerze
Advances in Enzymology. Artykuł zatytułowany „Metaboliczne wytwarzanie i wykorzystanie energii wiązania fosforanowego” po raz pierwszy wprowadził symbol ~P („zawijas przy P”) na oznaczenie bogatego w energię wiązania fosforanowego, a więc takiego, którego hydroliza dostarcza wystarczającej ilości energii do zasilenia reakcji i procesów energetycznie niekorzystnych (ryc. 3.29).
Chociaż kilka cząsteczek zawiera takie wiązanie fosforanowe o wysokiej energii („wysokoenergetyczne”) (patrz panel 3.1, s. 104), to hydroliza ATP dostarcza energii napędzającej większość reakcji wymagających nakładu energii w żywych organizmach, w tym kurczenie się mięśni, transport substancji w poprzek błon oraz syntezę makrocząsteczek, takich jak białka, kwasy nukleinowe czy węglowodany. We wspomnieniu opublikowanym po śmierci Meyerhofa w 1951 roku
Lipmann pisze: „Odkrycie ATP było kluczem, który otworzył bramy do zrozumienia mechanizmów przekształcania energii metabolicznej”. Lipmann wkrótce otrzymał swoją Nagrodę Nobla (1953) za pracę nad innym aktywowanym nośnikiem, koenzymem A.
kreatyna~P kreatyna gdy stężenie ATP jest duże gdy stężenie ATP jest małe kreatyna kreatyna~P
ATP ADP (AMP~P)(AMP~P~P)
ryc. 3.28. Fosfokreatyna służy jako magazyn energii pełniący rolę pośrednika. Enzym, kinaza kreatynowa, przenosi grupę fosforanową z fosfokreatyny na ADP, kiedy stężenie ATP jest małe. Gdy stężenie ATP jest duże, ten sam enzym może katalizować odwrotną reakcję odtwarzającą pulę fosfokreatyny. Na rycinie wiązania fosforanowe o wysokiej energii zostały oznaczone symbolem ~P. AMP to adenozynomonofosforan (patrz ryc. 3.41)
ZBĘDNE PRODUK TY ~ P ATP P błona komórkowa fosforan „koło metaboliczne”
POŻY WIENIE (PALIWO)
UTLENIANIE CZĄSTECZEK POKARMU ENERGIA ZASILA JĄCA REAKCJE KOMÓRKOWE
ryc. 3.29. wiązania fosforanowe o wysokiej energii wytwarzają „strumienie energii” (czerwone), które zasilają reakcje komórkowe. Ten schemat, opracowany na podstawie ryciny opublikowanego w artykule Lipmanna z 1941 roku w Advances in Enzymology, pokazuje, jak energia uwalniana podczas utleniania cząsteczek pożywienia (zaprezentowane jako „koło metaboliczne”) jest przechwytywana i przekształcana do postaci wiązań fosforanowych o wysokiej energii (~P) cząsteczki ATP, które są wykorzystywane do napędzania wszystkich innych reakcji komórkowych. Po hydrolizie wiązań o wysokiej energii uwalniana grupa fosforanowa (nazywana także fosforanem, w skrócie P) znowu wchodzi w cykl i jest ponownie wykorzystana, jak przedstawiono na rycinie
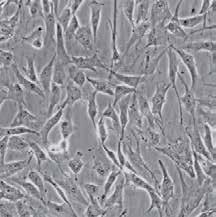


ryc. 1.40. Komórki w hodowli ujawniają często właściwości, które odzwierciedlają ich pochodzenie. Te mikrografie, uzyskane w mikroskopie z kontrastem fazowym, ukazują kilka typów komórek w hodowli. (A) Fibroblasty z ludzkiej skóry w hodowli wydzielają białka macierzy zewnątrzkomórkowej. (B) Ludzkie neurony w hodowli tworzą połączenia między sobą. (C) Komórki nabłonkowe z ludzkiej szyjki macicy w hodowli tworzą zwartą warstwę komórek (mikrografie dzięki uprzejmości ScienCell Research Laboratories, Inc.)
Choć nie jest to prawdą dla wszystkich typów komórek, wiele komórek, w tym komórki pobrane od ludzi, w trakcie hodowli wykazuje cechy różnicowania charakterystyczne dla ich typu i pochodzenia; fibroblasty, główny typ komórek tkanki łącznej, dalej wydzielają białka, które tworzą matriks zewnątrzkomórkową; umieszczone na szalce embrionalne komórki mięśnia sercowego kurczą się spontanicznie; komórki nerwowe wydłużają aksony i tworzą połączenia funkcjonalne z innymi komórkami nerwowymi; komórki nabłonka łączą się ze sobą w celu utworzenia ciągłej warstwy, tak jak to czynią we wnętrzu ciała ( ryc. 1.40 ). Ponieważ hodowane komórki są utrzymywane w kontrolowanym środowisku, można je wykorzystać do badań, które często nie byłyby możliwe in vivo. Komórki w hodowli można, na przykład, wystawić na działanie hormonów lub czynników wzrostu, a następnie dość łatwo zbadać, jak obecność tych cząsteczek sygnałowych wpływa na kształt czy zachowanie komórek. Co ciekawe, niektóre ludzkie komórki embrionalne można nakłonić do różnicowania się w różne typy komórek, które następnie mogą składać się w struktury podobne do organów, przypominające normalny narząd, taki jak oko czy mózg. Te organoidy można wykorzystać do badania procesów rozwojowych oraz obserwowania tego, jak zbaczają z głównych szlaków w pewnych chorobach genetycznych ludzi (omówione w rozdz. 20).
Poza badaniem ludzkich komórek w hodowli ludzie badani są również bezpośrednio w klinikach. Dużą część studiów nad biologią człowieka napędza zainteresowanie ludzkim zdrowiem, a baza danych medycznych gatunku ludzkiego jest olbrzymia. Choć naturalnie występujące mutacje, które wywołują chorobę, w dowolnym genie człowieka są rzadkie, to ich konsekwencje zostały dobrze udokumentowane. Dzieje się tak dlatego, że ludzie – w odróżnieniu od zwierząt – zgłaszają i zapisują swoje własne osobliwości medyczne i genetyczne; u żadnego innego gatunku miliardy osobników nie są tak intensywnie rozpoznawane, opisywane i badane. b adania genetyczne koronawirusa s AR s - c oV-2 doprowadziły w rekordowym czasie do opracowania szczepionek
Nawet jeśli tysiące biologów pracują nieustannie, badając ten sam zbiór organizmów modelowych, to postęp naukowy następuje w swoim własnym mozolnym tempie: ukształtowanie naszego zrozumienia podstaw
SARS-CoV-2

procesów biologicznych na podstawie określonego odkrycia czy obserwacji może zająć dziesięciolecia, a uświadomienie sobie, jak to odkrycie wpłynie na poprawę ludzkiego zdrowia – nawet jeszcze dłużej. Jednak w rzadkich przypadkach badania podstawowe mogą zostać wykorzystane do zastosowań klinicznych w rekordowo krótkim czasie. Spektakularnym przykładem takiego szybkiego sukcesu nauki było uruchomienie zasobów do badań SARS-CoV-2, sprawcy pandemii COVID-19. Wirusy są szczególnie groźnymi przeciwnikami, gdyż wnikają one nie tyle do naszych organizmów, co do naszych komórek. Gdy znajdą się w środku, to przejmują naszą maszynerię komórkową do powielania siebie, wytwarzając ogromne armie wirusowe, które mogą przenikać do innych komórek, a dalej do innych ludzi, włączając w to naszych przyjaciół, rodziny i wszystkich innych, z którymi mieliśmy bliski kontakt. Gdy odkryto pierwsze przypadki zachorowań na COVID-19 naukowcy wyizolowali wirusa odpowiedzialnego za nie i określili sekwencją nukleotydową jego genomu. Uzyskane informacje ujawniły, że wirus należy do rodziny koronawirusów, nazywanych tak dlatego, że obrzeża białek wyłaniających się z powierzchni otoczki tych wirusów wyglądają jak korona słoneczna (ryc. 1.41). Koronawirusy używają tych „kolczastych” (S; ang. spike) białek powierzchniowych do przyłączenia się, a później do wniknięcia do komórek, które wyściełają nasz układ oddechowy; te białka S stanowią zatem doskonały cel do udaremnienia infekcji wirusowej.
Po opublikowaniu sekwencji genomowej SARS-CoV-2 firmy biotechnologiczne mogły zidentyfikować gen, który koduje białko wypustek i w ciągu kilku dni zaprojektować kilka potencjalnych szczepionek. Te nowe szczepionki, pierwsze w swoim rodzaju, zawierały informacyjny RNA (mRNA; ang. messenger RNA), który stał się instrukcją dla komórek ludzkiego ciała do wytwarzania kopii białka wypustek, a te, wydzielone na zewnątrz, miały aktywować silną odpowiedź immunologiczną. W ciągu dwóch miesięcy od diagnozy pierwszego przypadku COVID-19 rozpoczęto testowanie szczepionek mRNA w próbach klinicznych; niecały rok później na całym świecie podano już ponad miliard dawek szczepionki. Możliwość szybkiego określenie sekwencji nukleotydowej SARS-CoV-2 w próbkach pobranych od zarażonych osobników, poza tym, że była kołem napędowym szybkiego opracowania szczepionek, dała również bardzo czułe narzędzie do badania wirusa. Doprowadziła również do lepszego zrozumienia sposobu działania SARS-CoV-2. Porównując próbki SARS-CoV-2 zebrane w szpitalach i domach opieki badacze byli w stanie stwierdzić, że wirus może być roznoszony przez ludzi, którzy nie wykazują objawów choroby. To odkrycie stało się podstawą do wydania rekomendacji do noszenia maseczek i utrzymywania dystansu społecznego
ryc. 1.41. sars-CoV-2 należy do rodziny koronawirusów. (A) Mikrografia elektronowa ukazuje wirusy SARS-CoV-2 przyczepione do powierzchni hodowanej komórki małpy (widocznej w dolnej części zdjęcia). Białka wypustek, które wystają ponad powierzchnię SARS-CoV-2 umożliwiają wirusom rozpoznanie białek na powierzchni komórki gospodarza, a także nadają koronawirusom ich charakterystyczny wygląd. Ponieważ białko wypustek jest kluczowe dla rozpoznania i infiltracji komórek gospodarza, jest ono również głównym celem dla wszystkich szczepionek, które zostały zaprojektowane tak, by zablokować infekcje SARS-CoV-2. (B) Rycina przekrojowa wirusa SARS-CoV-2 pokazuje kilka jego najważniejszych składników, w tym białka wypustek, które wystają z jego powierzchni (zielone) oraz ten rodzaj białka (purpurowe), które pomaga upakować genom wirusa (niebieski) – utworzony z RNA, a nie z DNA – do nowych cząstek wirusowych. Opisujemy cykl życiowy wirusa oraz to, w jaki sposób powiela się on we wnętrzu komórki gospodarza w rozdziale 9 (z: M. Lauer i in., Morphometry of SARS-CoV and SARS-CoV-2 particles in ultrathin plastic sections of infected Vero cell cultures, Scientific Reports, 11, 2021, 3515; za zgodą Cold Spring Harbor Laboratory Press)
Naukowcy dostosowują również system CRISPR do włączania i wyłączania wybranych genów. W tym przypadku katalitycznie nieaktywne białko Cas9 można połączyć z aktywatorem lub represorem transkrypcji. Następnie taki hybrydowy regulator transkrypcji może zostać skierowany do docelowego genu za pomocą odpowiedniego korygującego RNA (ryc. 10.33C i D).
Przeniesienie systemu CRISPR z bakterii do praktycznie wszystkich innych organizmów eksperymentalnych, w tym myszy, danio pręgowanego, nicienia, muszki owocowej, ryżu i pszenicy, zrewolucjonizowało badanie funkcji genów. Podobnie jak wcześniejsze odkrycia enzymów restrykcyjnych i RNAi, ten niewiarygodny przełom był skutkiem pracy naukowców, którzy badali fascynujące zjawisko biologiczne bez początkowego uświadomienia sobie, jak ogromny będzie wpływ tego odkrycia na wszystkie aspekty biologii, w tym zagadnienia związane ze zdrowiem człowieka. Takie nieplanowane zastosowanie podkreśla fundamentalne znaczenie badań podstawowych.
Mutanty mogą być użytecznymi modelami chorób człowieka
W przyszłości podejścia transgeniczne, takie jak CRISPR, mogą być wykorzystywane do zmiany genów w ludzkich komórkach somatycznych –na przykład zastąpienie genów, które zostały wyłączone przez mutację. Takie działania obecnie próbuje się stosować w leczeniu chorób takich jak anemia sierpowata (patrz ryc. 6.32). Jest to jednak nadal podejście eksperymentalne i wymaga ono dodatkowych badań w celu zwiększenia jego skuteczności – oraz dalszej dyskusji w celu zapewnienia jego etycznego zastosowania.
Obecnie technologie transgeniczne są wykorzystywane do tworzenia zwierzęcych modeli ludzkich chorób, w których główną rolę odgrywają zmutowane geny. Wraz z eksplozją technologii sekwencjonowania DNA, badacze mogą szybko przeszukiwać genomy ludzi w poszukiwaniu mutacji, które powodują lub znacznie zwiększają ryzyko choroby (omówione w rozdz. 19). Wykryte mutacje można następnie wprowadzić do zwierząt, takich jak myszy, które można badać w laboratorium. Otrzymane zwierzęta transgeniczne, u których często występują pewne cechy fenotypowe odpowiadające objawom choroby u ludzi, mogą być wykorzystane do zbadania komórkowych i molekularnych podstaw choroby i do poszukiwania leków, które potencjalnie mogłyby być stosowane w celach terapeutycznych.
Zachęcającym przykładem jest zespół łamliwego chromosomu X, choroba neuropsychiatryczna związana z upośledzeniem umysłowym, zaburzeniami neurologicznymi i często autyzmem. Choroba jest spowodowana mutacją, która powoduje nadmierną produkcję licznych białek w synapsach – połączeniach, za pomocą których komunikują się ze sobą komórki nerwowe (patrz ryc. 12.41). Myszy zmodyfikowane pod kątem tej mutacji, wykazują wiele takich samych nieprawidłowości neurologicznych i behawioralnych, jakie można zaobserwować u osób z zespołem łamliwego chromosomu X. Wiele objawów choroby u mutantów myszy można odwrócić, stosując leki przywracające syntezę białek synaptycznych do prawidłowego poziomu. Wstępne badania sugerują, że co najmniej jeden z tych leków może przenieść korzyści również ludziom cierpiącym z powodu tej choroby.
Rośliny transgeniczne znajdują zastosowanie zarówno w biologii komórki, jak i w rolnictwie
Chociaż zwykle myślimy o technologii DNA w kategoriach biologii zwierząt, techniki te wpłynęły równie znacznie na badania roślin. Rzeczywiście, niektóre cechy roślin sprawiają, że są one szczególnie podatne na metody rekombinacji DNA.
Jeżeli fragment tkanki roślinnej będzie hodowany na sterylnej pożywce, zawierającej składniki odżywcze i odpowiednie regulatory wzrostu, to po pewnym czasie wiele komórek zacznie się nieprzerwanie dzielić w sposób niezorganizowany, wytwarzając masę niezróżnicowanych komórek, nazywaną kalusem. Odpowiednie manipulowanie składnikami odżywczymi i regulatorami wzrostu może doprowadzić do wytworzenia pędów w obrębie kalusa, a u wielu gatunków z takich pędów można zregenerować całe nowe rośliny. W przypadku wielu roślin, takich jak tytoń, petunia, marchew, ziemniak czy Arabidopsis (rzodkiewnik pospolity), pojedyncza komórka pobrana z kalusa może dać początek małej grupie komórek, z których zostanie zregenerowana cała roślina (patrz ryc. 8.2B). Tak jak w wyniku manipulacji genetycznej przeprowadzonej na hodowanych zarodkowych komórkach macierzystych można uzyskać mutanta myszy, tak samo w wyniku transfekcji hodowanych komórek roślinnych mogą powstać roślinny transgeniczne (ryc. 10.34).
Możliwość otrzymywania roślin transgenicznych znacznie przyspieszyła postęp w wielu obszarach biologii komórek roślinnych. Odegrała ważną rolę na przykład w identyfikacji receptorów dla regulatorów wzrostu, analizie mechanizmów morfogenezy i ekspresji genów w roślinach. Techniki te stworzyły również wiele nowych możliwości w rolnictwie, które mogą przynieść korzyści zarówno rolnikom, jak i konsumentom. Umożliwiły na przykład modyfikacje proporcji lipidów, skrobi i białek w nasionach, pozwoliły roślinom zyskać odporność na szkodniki i wirusy oraz umożliwiły stworzenie zmodyfikowanych roślin, które tolerują ekstremalne
krążki wycięte z liścia tytoniu
krążki liściowe inkubowane przez 24 godziny z genetycznie mody kowanymi bakteriami Agrobacterium
DODANIE POŻY WKI
INDUKUJĄCEJ PĘDY
PRZENIESIENIE PĘDU NA POŻY WKĘ INDUKUJĄCĄ KORZENIE
pożywka selekcyjna umożliwiająca podziały tylko tym komórkom roślinnym, które pobrały DNA od bakterii
WZROST UKORZENIONEJ SADZONKI
dojrzała roślina zawierająca transgen, któr y wyjściowo znajdował się w plazmidzie bakter yjnym
ryc. 10.34. za pomocą technik rekombinacji DNa dostosowanych do roślin można stworzyć rośliny transgeniczne. Krążek wycięty z liścia inkubuje się w hodowli bakterii Agrobacterium, które zawierają rekombinowany plazmid z markerem selekcyjnym i wprowadzanym do rośliny genem zmodyfikowanym genetycznie. Uszkodzone komórki na krawędzi krążka uwalniają substancje przyciągające bakterie i stymulujące je do wprowadzenia DNA do tych komórek. Tylko te komórki roślinne, które przyjęły odpowiedni DNA i wykazują ekspresję genu markera selekcyjnego, przeżyją i wytworzą kalus. Manipulując czynnikami wzrostu dodawanymi do pożywki, można przeprowadzić indukcję kalusa do wytworzenia pędów, które następnie się ukorzenią i wyrosną w dojrzałą roślinę zawierającą genetycznie zmodyfikowany gen
