Spis treści
3.1. Podstawowe właściwości błony komórkowej
3.1.1. Podstawowe składniki błony komórkowej
3.1.2. Struktura i topografia lipidów błony komórkowej
3.1.3. Fizykochemiczne właściwości lipidów błonowych
3.1.4. Białkowe składniki błony komórkowej
3.1.5. Cukrowe składniki
3.2. Specjalizacja i wytwory błony komórkowej
3.2.1. Polaryzacja strukturalno-czynnościowa
3.2.2. Połączenia międzykomórkowe (zamykające, ścisłe, przylegające i szczelinowe)
4.1. Przedziały wewnątrzkomórkowe – kompartmentacja
4.2.
4.2.6.
4.2.8. Zwielokrotnienie (amplifikacja) genu rybosomalnego
4.3. Siateczka
4.3.1. Siateczka śródplazmatyczna ziarnista (reticulum
4.3.2. Siateczka śródplazmatyczna gładka (reticulum cytoplasmaticum agranulosum)
4.3.3. Składniki błon siateczki śródplazmatycznej
4.3.4. Rola siateczki śródplazmatycznej w procesie syntezy białek
5.1.
4.3.5.
4.3.6. Glikozylacja białek w siateczce
4.3.7.
4.3.8.
4.4.1.
4.4.2. Procesy biochemiczne zachodzące w aparacie
4.4.3. Udział aparatu Golgiego w dojrzewaniu form
4.4.5.
4.5.1.
5.2.
5.2.1.
5.2.2.
5.3. Udział układu lizosomowego w prawidłowym funkcjonowaniu
5.4. Proteasomowa
5.5. Autofagia – rola w degradacji białek i organelli .
5.5.1. Makroautofagia .....................................
5.5.2. Mikroautofagia
5.5.3. Autofagia zależna od białek opiekuńczych
5.5.4. Selektywna degradacja składników komórkowych
Rozdział 6: Transformatory energii (mitochondria i chloroplasty) ......................................
6.1. Struktura mitochondriów ..................................
6.1.1. Formy i topografia mitochondriów
6.1.2. Ultrastrukturalna organizacja mitochondrium
6.1.3. Główne procesy metaboliczne przebiegające
6.1.4. Mechanizmy transportu przez błony
6.1.6. Komunikacja
6.1.7. Mitochondria jako jednostki samoreplikujące się
6.2. Chloroplasty jako
6.2.1. Zarys
7.1.
7.2.
7.4.
7.5.
8.2.
8.1.2.
8.4.
8.4.1.
8.5.
9.3.
9.4.
9.5.2.
9.5.3. Miozyna – białko motoryczne filamentów aktynowych
9.5.4. Procesy regulujące formowanie się filamentów miozynowych
9.6. Wyspecjalizowane układy aktynowo-miozynowe – mięśnie poprzecznie prążkowane ...................................
9.6.1. Geneza i organizacja sarkomeru mięśni poprzecznie prążkowanych .......................................
9.6.2. Białka regulujące skurcz sarkomeru ....................
9.6.3. Siateczka sarkoplazmatyczna i kanaliki systemu T a skurcz sarkomeru
9.6.4. Etapy wyzwalające skurcz sarkomeru ...................
9.7. Wyspecjalizowane układy aktynowo-miozynowe – mięśnie gładkie ..................................................
9.7.1. Struktura miocytu gładkiego ..........................
9.7.2. Struktura i regulacja aparatu kurczliwego miocytów
9.8. Filamenty pośrednie – struktura ............................
9.8.1. Białka filamentów pośrednich .........................
9.8.2. Białka towarzyszące filamentom pośrednim
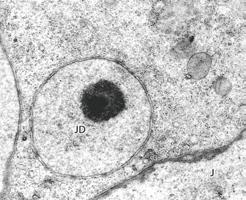
Strukturalnie wyższą klasą od ciałek jądrowych są jądra dodatkowe. Po raz pierwszy opisał je Friedrich Blochmann w roku 1886 w cytoplazmie oocytów mrówek i os. Jądra dodatkowe znajduje się również w innych grupach stawonogów: owadów (Insecta), wijów (Myriapoda) i skorupiaków (Crustacea), a także nicieni (Nematoda). Pod koniec ubiegłego stulecia jądra dodatkowe opisano także w oocytach i blastomerach ssaków. Jądra dodatkowe są zamknięte w osłonce jądrowej zawierającej pory jądrowe. Wewnątrz znajdują się kuliste ciała elektronowo gęste, tzw. pseudojąderka, zbudowane z ziarnistego materiału zawierającego RNA i białka.
Jądra dodatkowe powstają przez pączkowanie z jądra komórkowego wraz z jego osłonką jądrową. Obecność wewnętrznej, białkowej wyściółki podosłonkowej zbudowanej z lamin nie jest wyraźnie zaznaczona. Po uformowaniu lokalizują się w pobliżu błony cytoplazmatycznej oocytu, a materiał pseudojąderek pod koniec oogenezy ulega rozrzedzeniu i jest transportowany do cytoplazmy otaczającej jądra dodatkowe.
Trudno na obecnym etapie badań wskazać zadania jąder dodatkowych w oocytach. Przypuszcza się, że mogą uczestniczyć w procesie gromadzenia materiałów zapasowych – żółtka, ale być może odgrywają rolę w syntezie osłon
jajowych lub w ustaleniu kierunku osi zarodka (przód–tył). Obecność w pseudojąderkach tzw. białek srebrnochłonnych i białka p80-koiliny upodabnia je do opisanych wyżej ciał jądrowych zwiniętych i mogą być ich homologami (ryc. 4.2.16). Badania nad jądrami dodatkowymi szkoły krakowskiej profesora Szczepana Bilińskiego sugerują, że mogą one służyć jako przenośnik cząsteczek snRNP pod powierzchnię oocytu, gdzie gromadzą się duże ilości czynników związanych z dojrzewaniem RNA.
4.2.7. Jąderko
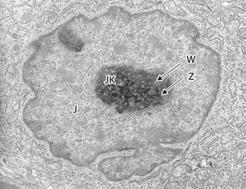
Jąderko jest, obok chromatyny skondensowanej, drugą wyraźnie zaznaczoną strukturą w jądrze interfazowym (ryc. 4.2.17). Pierwsze opisy jąderka datują się na koniec XVIII wieku i pochodzą z obserwacji N. Fontany (1781), natomiast swoją nazwę zawdzięcza Gabrielowi G. Valentinowi (1839). Jąderko występuje powszechnie w jądrach wszystkich komórek eukariotycznych, z wyjątkiem plemników i dojrzałych erytrocytów ptaków. Wielkość jąderek zależy od zaangażowania komórek w intensywną syntezę białek, co jest związane z nasileniem transkrypcji genu rDNA. Jądra komórek intensywnie syntetyzujących białka charakteryzują się obecnością dużych jąderek, których
RYC. 4.2.16. Elektronogram z mikroskopu elektronowego transmisyjnego fragmentu oocytu Eomencanthus stramineus (wszoły, Mallophaga) z jądrem dodatkowym (JD) zlokalizowanym w pobliżu jądra głównego (J). Kolisty, silnie skondensowany twór widoczny w jądrze dodatkowym reprezentuje tzw. pseudojąderko. Osłonka jądrowa jądra dodatkowego zawiera liczne pory jądrowe, natomiast niewidoczna jest białkowa wyściółka podosłonkowa, charakterystyczna dla osłonki jądrowej jądra głównego (obraz dzięki uprzejmości prof. Szczepana Bilińskiego).
objętość może dochodzić do 25% objętości jądra (ryc. 4.2.17). Jądra komórek, które nie prowadzą aktywnej syntezy białek, posiadają bardzo małe lub w ogóle niewidoczne jąderka. Zadaniem jąderka jest synteza prekursorowego rybosomowego RNA (rRNA; 45S), a następnie formowanie podjednostek tworzących rybosomy.
Jąderka są integralną częścią chromatyny chromosomów jąderkowych, których może być kilka par, dlatego ich liczba nie przekracza liczby chromosomów jąderkowych, a konkretnie liczby organizatorów jąderka, obecnych na tych chromosomach. W różnych komórkach można zaobserwować jedno lub kilka jąderek w zależności od fazy cyklu, w której znajduje się komórka. W komórkach człowieka może występować do 10 jąderek, co wiąże się z liczbą chromosomów jąderkowych, których człowiek posiada pięć par. Zazwyczaj w jądrze interfazowym liczne jąderka zlewają się w jedno duże i dlatego ich liczba nie odpowiada liczbie chromosomów jąderkowych. W komórkach charakteryzujących się wysoką aktywnością transkrypcyjną rRNA (oocyty płazów) liczba jąderek może dochodzić do kilkuset, a nawet powyżej tysiąca (1400). Jest to wynik amplifikacji genów kodujących rRNA. Obecność RNA w jąderku została po raz pierwszy opisana przez Jeana Bracheta w roku 1940, dzięki zastosowaniu specyficznego bar-
RYC. 4.2.17. Elektronogram z mikroskopu elektronowego transmisyjnego jądra komórkowego (J) fibrosarkomy 4437 szczura. Duże, centralnie położone jąderko (JK) wykazuje wyraźne zróżnicowanie na dwie komponenty: ziarnistą (Z) i włóknistą (W).
wienia pyroniną i zielenią metylową (odczynnik Bracheta). Obserwacje te zostały potwierdzone w roku 1952 przez Waltera Vincenta metodą biochemiczną, a dalsze badania w tym kierunku pozwoliły na ustalenie jego zasadniczych składników. Jąderko zbudowane jest głównie z białek, które stanowią 80–90% jego masy, 3–13% RNA i 3–18% DNA. Bogactwo białek jąderkowych jest olbrzymie; opisano około 200 rodzajów, z których najważniejsze to: 1) polimeraza RNA I odpowiedzialna za proces transkrypcji rDNA w prekursorowe pre-rRNA,
2) wielofunkcyjna nukleolina, która aktywizuje proces transkrypcji DNA i bierze udział w tworzeniu podjednostek rybosomowych oraz w dekondensacji chromatyny jąderkowej, 3) fibrylaryna uczestnicząca w dojrzewaniu prekursorowego rRNA, 4) rybocharyna biorąca udział w dojrzewaniu dużych podjednostek rybosomowych (60S).
Obserwacje jąderka w mikroskopie elektronowym zapoczątkował w roku 1950 Clemente Estable i Roberto J. Sotelo, a następnie podjął je w cztery lata później Edward M. De Robertis. Intensywne badania nad strukturą jąderka zawdzięcza się czeskiemu badaczowi Karelowi Smetanie. Jąderko składa się z trzech
Pierwotne utleniacze – peroksysomy
Peroksysomy nazywane są często, ale nie zawsze słusznie, mikrociałami. Występują niezbyt licznie w komórkach wszystkich eukariotów. Pierwszy raz zostały opisane przez Christiana De Duve’a i Pierre’a Baudhuina w 1966 roku. Mają postać otoczonych pojedynczą błoną pęcherzyków o średnicy 0,1 do 1,0 μm i nie zawierają własnego materiału genetycznego. Funkcjonalnie i fizycznie są związane z wieloma organellami, przede wszystkim z mitochondriami i chloroplastami, a także z kroplami lipidowymi. Ziarnista macierz peroksysomów może zawierać krystaliczny rdzeń – nukleoid, który zależnie od gatunku i rodzaju tkanki może przybierać rozmaite formy (ryc. 7.1.1). Peroksysomy odgrywają w komórkach rolę organelli utleniających, podobnie jak mitochondria, z tą jednak różnicą,

że nie syntetyzują ATP. System oksydacyjny organelli utlenia znaczną ilość różnych substratów, produkując dużą ilość wolnych rodników tlenowych (ROS) oraz nadtlenek wodoru (H2O2). H2O2 jest z kolei rozkładany do wody i tlenu (równanie 1) lub użyty jako substrat dla przeprowadzenia kolejnej reakcji utleniania (równanie 2). Pozbywanie się nadtlenku wodoru zachodzi przy udziale m.in. katalaz i peroksydaz
RH2 +O2 R+H2O2 H2O2+H2O2 2H2O+O2 (1)
H 2O2+ RH2 R+2H2O (2)
Proces utleniania katalizowany przez enzymy peroksysomów jest szczególnie ważny w komórkach wątroby lub nerek, w których
RYC. 7.1.1. Elektronogram z mikroskopu elektronowego transmisyjnego przedstawiający peroksysom (P) (mikrociało) komórki wątroby szczura. Peroksysom otoczony jest pojedynczą błoną białkowo-lipidową, a w macierzy organelli znajduje się nukleoid – krystaliczny rdzeń o kubicznym kształcie (strzałka). Wokół peroksysomu widoczne kanaliki siateczki śródplazmatycznej gładkiej (SG). Skala: 250 nm.
zachodzi intensywne odtruwanie wszelakiego rodzaju trucizn. Dotyczy to np. alkoholu, który zostaje utleniony do acetylaldehydu. Organelle prowadzą również reakcje β-oksydacyjne, utleniając średniowęglowe (C8) i długołańcuchowe kwasy tłuszczowe (powyżej C22) przy udziale peroksysomowej oksydazy acetylo-CoA. Prowadzą również charakterystyczne dla siebie reakcje α-oksydacji kwasów tłuszczowych rozgałęzionych (kwas fitanowy), aby doprowadzić je do cząsteczek liniowych. Podczas powyższych reakcji wytwarza się m.in. wspomniany wcześniej nadtlenek wodoru. Kompleks prowadzący proces β-oksydacji kwasów tłuszczowych sprowadza je do optymalnej długości, ośmiowęglowych (C8) cząsteczek, które są następnie transportowane do mitochondriów i tam utleniane dalej (patrz rozdział 6.1.3. Główne procesy metaboliczne przebiegające w mitochondriach).
Peroksysomy zawierają około 200 rodzajów białek, w tym ponad 50 różnych enzymów zaangażowanych w typowych dla nich proce-
sach metabolicznych. Należą do nich oksydoreduktazy, w skład których wchodzą trzy podstawowe podgrupy: 1) enzymy metabolizujące nadtlenek wodoru, 2) enzymy katalizujące puryny i 3) enzymy cyklu glioksalanowego, występujące tylko w peroksysomach roślinnych, glioksysomach. Ponadto peroksysomy zawierają enzymy, które biorą udział w syntezie plazmalogenów i kwasów żółciowych.
Liczba peroksysomów zmienia się w zależności od stanu metabolicznego komórki, głównie stresu komórkowego wywołanego nadmiarem wolnych rodników, obecnością metali ciężkich lub w przypadku roślin – nadmiarem światła. Peroksysomy dzielą się, ale podział jest poprzedzony wydłużaniem się peroksysomu przy udziale specyficznych dla organelli białek – peroksyn (PEX). Główną rolę w wydłużaniu się peroksysomu (tubulacji) odgrywa PEX11, a ostateczne rozdzielenie pojedynczej organelli na potomne przebiega dzięki białkom DRP (ang. dynamin-related proteins) i FIS1 (ang. fission protein 1). FIS1
RYC. 7.1.2. Uproszczony schemat przedstawiający drogę powstawania peroksysomów de novo z preperoksysomów (A) oraz w wyniku podziału już istniejących organelli (B). Biogeneza mikrociał obejmuje odłączanie pęcherzyków od siateczki śródplazmatycznej i mitochondriów, które niosą kilka peroksyn (np. PEX3 i PEX14) umożliwiających rekrutację białek peroksysomów (PEX), w tym enzymów, oraz białek integralnych błon (PMP). Pęcherzyki – preperoksysomy, łączą się ze sobą, a po wypełnieniu swoistymi dla organelli białkami stają się dojrzałą jednostką. W przypadku podziału już istniejący peroksysom przyjmuje formę rurkowatą (tubularną) dzięki nagromadzeniu PEX11, a białka FIS1 oraz DRP zaciskają pierścień wokół „rurki” organelli, doprowadzając do rozdziału na dwie potomne struktury.
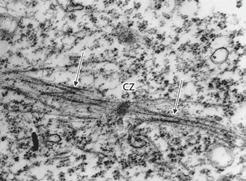
Filamenty aktynowe, którym towarzyszą białka regulatorowe, tropomiozyna i troponiny, kotwiczą się do dysku Z za pośrednictwem białka α-aktyniny. Ich wolne, ostre końce znajdujące się w prążku A sarkomeru są zablokowane białkiem tropomoduliną, która zapobiega wydłużaniu się filamentów. Natomiast ich „tępe” końce zakotwiczone w dysku Z są zablokowane białkiem CapZ, stabilizującym filamenty i zapobiegającym ich depolimeryzacji oraz nebuliną. W pierwszym okresie formowania się sarkomerów komórki mięśniowe syntetyzują dwie isoformy aktyny, α-aktynę naczyniową (naczyń krwionośnych) i α-aktynę szkieletową. W późniejszych stadiach rozwoju zarodka myszy (12–13 somitów) w komórkach mięśni szkieletowych przeważa już α-aktyna szkieletowa, podczas gdy w miocytach sercowych α-aktyna sercowa, będąca głównym składnikiem filamentów aktynowych w komórkach mięśnia sercowego.
9.6.2. Białka regulujące skurcz sarkomeru
Skurcz mięśnia jest wynikiem skurczu jego elementarnych jednostek – sarkomerów. W czasie maksymalnego skurczu sarkomeru filamenty aktynowe są wciągane między filamenty miozynowe, w głąb prążka A. W następ-
RYC. 9.6.8. Elektronogram przekroju przez mioblast mięśnia poprzecznie prążkowanego z mięśni szkieletowych zarodków królika, wykonany w mikroskopie elektronowym transmisyjnym. Obraz ilustruje wczesne stadium formowania się sarkomerów. Widoczne są tzw. ciałka Z (CZ) wiążące filamenty aktynowe do ułożonych między nimi filamentów miozynowych (strzałki).
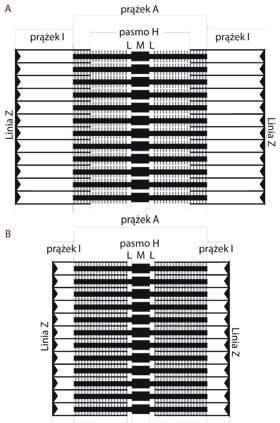
stwie tego maleje szerokość prążka H oraz I. Natomiast w czasie maksymalnego rozkurczu filamenty aktynowe wysuwają się spomiędzy filamentów miozynowych, dzięki czemu wzrasta maksymalnie szerokość prążka H oraz prążka I. Szerokości prążków A, M i strefy L pozostają natomiast bez zmian. Proces wślizgiwania i wyślizgiwania się filamentów aktynowych spomiędzy filamentów miozynowych powstaje w wyniku interakcji między cząsteczkami miozyny, a dokładniej ich głowami, oraz monomerami G-aktyny, budującymi filamenty aktynowe. Skurcz wielu sarkomerów wywołuje skurcz całego mięśnia (ryc. 9.6.9).
W czasie powstawania kompleksu aktynowo-miozynowego zachodzi hydroliza ATP i wyzwolenie energii potrzebnej do wykonania pracy (skurczu). Zjawisko skurczu mięśnia jest regulowane poziomem jonów wapnia (Ca2+), który jest magazynowany w błoniastych cysternach siateczki sarkoplazmatycznej. W cyklu skurczowo-rozkurczowym Ca2+ są cyklicznie uwalniane i ponownie internalizowane w cysternach siateczki.
Mięśnie wszystkich kręgowców i większości bezkręgowców, z wyjątkiem mięczaków, posiadają system regulujący skurcz przy pomocy białek związanych z filamentami aktynowymi. System ten składa się z dwóch grup białek, które odgrywają kluczową rolę w procesie powstawania i rozpadu kompleksu
aktynowo-miozynowego; są to tzw. białka regulujące, troponina i tropomiozyna
W mięśniach mięczaków, które nie posiadają troponiny, powstawanie kompleksu aktynowo-miozynowego jest regulowane jonami Ca bezpośrednio współdziałającymi z miozyną. Jest to system regulacji skurczu mięśni na poziomie miozyny.
Regulatorowe białko tropomiozyna jest dimerem i składa się z dwóch łańcuchów polipeptydowych: α o masie 34 kD i β – 36 kD. Łańcuchy są splecione helikoidalnie ze sobą. Całość cząsteczki ma więc postać filamentu o długości około 40 nm i grubości 2 nm. Tropomiozyna jest zlokalizowana w rowkach helisy filamentów aktynowych i każda jej c ząsteczka wiąże się z siedmioma monomera-
RYC. 9.6.9. Schemat ilustrujący wzajemne stosunki przestrzenne między filamentami aktynowymi i miozynowymi w sarkomerach będących w różnych fazach skurczu. (A) Sarkomer w fazie fizjologicznego rozkurczu; filamenty aktynowe są zakotwiczone do linii Z. W środku sarkomeru jest wyraźnie zaznaczone pasmo H i prążek M z leżącymi obok strefami L. Na filamentach miozynowych narysowano umownie główki miozyny oraz został pogrubiony fragment środkowy filamentu, który tworzy prążek M. (B) Sarkomer w fazie fizjologicznego skurczu; filamenty aktynowe zostały wciągnięte przez główki miozyny w kierunku środka sarkomeru. W efekcie zmniejszyła się szerokość prążka I oraz pasma H. Szerokość prążka A i prążka M pozostała bez zmian.
mi G-aktyny. W stanie spoczynku cząsteczki tropomiozyny przysłaniają miejsca wiązania główek miozynowych do filamentów aktynowych. Tropomiozyna jest białkiem charakterystycznym dla określonego gatunku zwierzęcia, typu włókna mięśniowego, a nawet stopnia zróżnicowania mięśnia. Występujące typy tropomiozyny różnią się stosunkiem ilościowym między łańcuchami obu białek tego dimeru.
Drugą grupą białek regulujących jest troponina, która składa się z trzech białek: troponiny C (TnC), I (TnI) i T (TnT). Jedna cząsteczka troponiny C wiąże się z jedną cząsteczką tropomiozyny w dwóch miejscach, przez troponinę T i troponinę I. Każde z tych trzech białek spełnia odrębną funkcję w procesie regulacji skurczu sarkomeru. Troponina C,