Spis treści
Struktura
Problem 1.1.4
Które ze struktur przedstawionych na poniższym schemacie są chiralne?
Problem 1.1.5
Które ze struktur przedstawionych na poniższym schemacie są achiralnymi stereoizomerami mezo?
Problem 1.1.6
Wskaż, które z poniższych związków występują w postaci stabilnych enancjomerów?
Problem 1.1.7
Opisz relację stereochemiczną pomiędzy strukturą A i ka żd ą z pozostał ych: B, C, D i E. Które ze zwią zków są optycznie aktywne?
Problem 1.1.8
Lindan to jeden z izomerów heksachlorocykloheksanu, stosowany w rolnictwie i leśnictwie jako pestycyd do zwalczania szkodników oraz jako substancja owadobójcza. Czy lindan jest optycznie aktywny? Narysuj konformery krzesłowe lindanu.
Problem 1.1.9
Adrenalina, zwana też epinefryną, jest chiralną katecholaminą, hormonem aktywującym receptory adrenergiczne. Która z poniższych struktur przedstawia jej endogenny enancjomer – (R)-adrenalinę?
Problem 1.1.10
Pod koniec XVI wieku zauwa żono, że owoce cytrusowe zapobiegają szkorbutowi. Dzisiaj wiemy, ż e dzieje się to za sprawą witaminy C, substancji niezbędnej do prawid łowego funkcjonowania człowieka. Witaminę C wyizolowa ł w 1928 roku wę gierski biochemik Albert Szent-Györgyi, z kolei w 1933 roku brytyjski chemik Walter Norman Haworth przyczynił się do ustalenia jej struktury. W 1937 obu naukowcom za badania nad witaminą C przyznano Nagrody Nobla – Szent-Györgyi otrzymał ją w dziedzinie fi zjologii lub medycyny, a Haworth w dziedzinie chemii. Witamina C występuje naturalnie jako zwią zek o kon figuracji S wę gla w ła ńcuchu bocznym i kon figuracji R wę gla przy pierścieniu furanowym. Która z poniższych struktur przedstawia witaminę C? Pozostałe izomery to kwas D -askorbinowy oraz 1.1. Aspekty
1. Struktura i fi zykochemiczne w ł a ś ciwo ś ci leków decyduj ą ce o wch ł anianiu
Wyobra ź my sobie, ż e 100 mg pewnego zwią zku wprowadzamy do 500 mL mieszaniny wody i n-oktanolu w stosunku objętościowym 1:1 umieszczonych w rozdzielaczu. Po dok ładnym wytrząsaniu i rozdziale warstw okazuje się, że w stanie równowagi 95 mg zwią zku pozostało w warstwie organicznej, a 5 mg w wodzie. Wobec tego możemy obliczyć współczynnik podziału P:
95 /250 19 1,28 5 /250 mgmL P logP mgmL
W załączniku D przedstawiono wartości log P dla szeregu zwią zków biologicznie aktywnych.
W rzeczywistości wartość log P wyliczoną z powyższego wzoru można stosować tylko wówczas, gdy analizowany zwią zek nie ulega jonizacji w pH eksperymentu. Jeśli zwią zek jest słabym kwasem bąd ź słabą zasad ą, a większość leków posiada taki charakter, to dysocjacja do form zjonizowanych w znaczącym stopniu zaburzy profi l rozpuszczalności. Zjonizowane formy b ęd ą znacznie lepiej rozpuszczalne w wodzie niż niezjonizowane, dlatego wartość log P w du ż ym stopniu zależ y od pH, w którym wykonywane jest oznaczenie. Aby wyznaczyć jednoznacznie wartość log P, należy tak dobrać warunki eksperymentalne, aby związek występował w formie niezjonizowanej. Oznacza to, że log P dla kwasów powinien być oznaczany w niskim pH, a dla zasad odwrotnie – przy wysokich wartościach pH, aby zapobiec jonizacji. Często jednak operuje się współczynnikiem dystrybucji D, który mierzy się dla wszystkich form substancji (zjonizowanej i niezjonizowanej) w ka żdej z faz. Aby zmierzyć współczynnik dystrybucji D, to pH fazy wodnej buforujemy do specyficznej wartoś ci pH, tak aby nie by ła ona zmieniona przez obecność badanego zwią zku. Log D zależ y od pH fazy wodnej.
Dlog log
[c]oktanol woda (forma niezjon) [c] woda (forma zjon) [c]
Za łóż my teraz, ż e chcemy wyznaczyć współczynnik D dla zwi ą zku, który w wodzie ulega jonizacji. Podobnie jak poprzednio dysponujemy 100 mg zwią zku, który wprowadzamy do 500 mL mieszaniny wody i n-oktanolu w stosunku objętościowym 1:1. Załóżmy, że woda jest buforowana i zwią zek uległ jonizacji, wobec tego w warstwie wodnej mamy obie formy zwią zku: zjonizowaną i niezjonizowaną Dzięki jonizacji w warstwie wodnej st ęż enie zwi ą zku jest tym razem większe. Na przedstawionym diagramie w stanie równowagi 10 mg zwi ą zku pozosta ło w warstwie organicznej, a 90 mg znajduje się w wodzie, z czego 5 mg jest w formie
niezjonizowanej, a 85 w formie zjonizowanej. Wobec tego możemy obliczyć współczynnik dystrybucji D:
Dla substancji nieulegających jonizacji współczynnik dystrybucji równy jest współczynnikowi podziału. Zależność między współczynnikami P i D można wyrazić za pomoc ą wzoru:
gdzie fniezjon oznacza stopień niezjonizowania zwią zku przy danym pH.
Ze wzoru wynika, że gdy zwią zek jest w formie niezjonizowanej (f niezjon = 1), to D = P. Na przyk ład na rysunku 1.15 przedstawione są krzywe zależności współczynnika log D od pH dla słabego kwasu (kwasu acetylosalicylowego) i słabej zasady (fenmetrazyny). Z wykresu możemy odczytać wartości log P dla obu związków: 1,19 i 1,79, odpowiednio dla kwasu acetylosalicylowego i fenmetrazyny.
Kwas acetylosalicylowy (słaby kwas)
= 1,19
(słaba zasada)
Rysunek 1.15. Zależność wspó łczynnika dystrybucji D od pH. A. Kwas acetylosalicylowy. B. Fenmetrazyna (do predykcji wspó łczynnika D zastosowano ChemAxon 20.11.0: https://www.chemaxon.com)
2. Oddzia ł ywanie leków z obiektami docelowymi
W chemii medycznej jako miarę sił y działania leków podaje się różne parametry, w tym K D (stała dysocjacji), K i (stała inhibicji), IC50 (ang. inhibitory concentration, IC) i EC 50 (ang. effective concentration, EC). Defi nicje tych parametrów s ą róż ne i powinny być odpowiednio stosowane.
K i odnosi się do stałej inhibicji, podczas gdy K D oznacza stałą dysocjacji. Oba terminy są u ż ywane do opisania powinowactwa, które ligand ma do enzymu lub receptora. Różnica polega na tym, że K D jest terminem bardziej ogólnym, obejmującym różnego typu kompleksy. Stała inhibicji K i to również stała dysocjacji, ale dla wią zania inhibitora z enzymem.
IC 50 oznacza st ęż enie inhibitora, które obni ż a aktywno ść enzymu o 50%. Poniewa ż podczas wyznaczania wartości IC50 nie mierzy się bezpośrednio równowagi dysocjacji kompleksu enzym–inhibitor, IC 50 jest mniej precyzyjne ni ż K i lub K D. Co wa żne, uzyskane wartości są w du ż ym stopniu zależne od warunków pomiaru i mechanizmu hamowania. Wartości K i i IC50 można porównywać ze sobą tylko w szczególnym przypadku, gdy mamy do czynienia z niekompetycyjnym mechanizmem inhibicji.
EC50 odnosi się do stężenia leku, przy którym osią ga się 50% jego maksymalnego efektu biologicznego. Termin jest dość ogólny i ma zastosowanie niezależnie od tego, czy lek wzmacnia, czy osłabia efekt biologiczny. W przypadkach, gdy lek niemalże całkowicie hamuje aktywność biologiczną w wysokich dawkach, wartości EC50 i IC50 są identyczne. Jednak niektóre leki powodują tylko częściowe osłabienie aktywności biologicznej, nawet przy wysokich stęż eniach. W takim przypadku wartości IC50 mogą wprowadzać w błąd co do si ł y dzia łania leku. Za łóżmy np., że inhibitor zmniejsza aktywność enzymu co najwyżej do 60%. Tu wartość IC50 by łaby nieokre ślona, poniewa ż 50% hamowanie nigdy nie zosta ło osi ą gnię te. Wartości EC50 umożliwiają ilościowe przedstawienie efektu biologicznego w zależności od dawki.
Wszystkie wymienione parametry: Ki, K D, IC50, i EC50, są stężeniami aktywnego zwi ą zku (liganda), a zatem rozwa ż ają c równowagi przedstawione powy ż ej, można powiedzieć, że im niższą wartość przyjmują te parametry, tym większe jest powinowactwo zwią zku do makrocząsteczki, czyli zwią zek jest bardziej aktywny. Szczegółowe informacje na temat kompleksów z białkami enzymatycznymi można znaleźć w repozytorium Brenda (https://www.brenda-enzymes.org).
Warto wspomnieć, ż e w farmakologii istnieją jeszcze defi nicje si ł y dzia łania i skuteczności leków. Siła działania odnosi się do dawki leku potrzebnej do uzyskania pewnego wymiernego efektu biologicznego, podczas gdy skuteczność określa wielkość maksymalnego efektu. Dlatego leki o du ż ej sile dzia łania mają niskie wartości EC50, ale niekoniecznie niskie wartości IC50. Ponadto bardzo skuteczne leki mają podobne wartości IC50 i EC50 niż leki mniej skuteczne.
Aby dokonać analizy oddział ywa ń w kompleksie białko–ligand musimy pozyskać strukturę przestrzenną (3D) takiego kompleksu. Struktury 3D makrocząsteczek biologicznych pozyskane z bada ń eksperymentalnych są deponowane w bazie
Donepezil
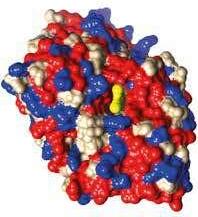
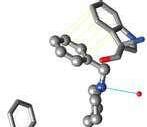
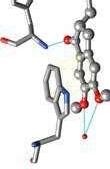
Rysunek 2.1. Oddzialywania donepezilu z acetylocholinoesteraz ą na podstawie kompleksu PDB ID 4EY7. A. Powierzchnia molekularna: kolor czerwony aminokwasy hydrofobowe, kolor niebieski aminokwasy hydro fi lowe, kolor ż ó ł ty donepezil. B. Donepezil w projekcji ball and stick , kolory atomów: w ę giel szary, tlen czerwony, azot niebieski; oddzia ł uj ą ce reszty aminokwasów w projekcji stick , wi ą zania wodorowe niebieskie linie, oddzia ł ywania π –π ż ó ł te linie. C. Diagram z oddzia ł ywaniami: (a) oddzia ł ywania π –π , (b) wi ą zania wodorowe (A i B przygotowano w programie Chimera UCSF)
