SPIS TREŚCI
C zęść I – wstępna ................. 7
1. WSTĘP DO WYDANIA DRUGIEGO (Z. GŁOWACIŃSKI) 9
2. ZAŁOŻENIA METODYCZNE (Z. GŁOWACIŃSKI) ................... 11
2.1. Podstawa kartograficzna ......... 11
2.2. Lokalizacja stanowisk na mapach .. 11
2.3. Rozkład danych w przedziałach czasowych .................... 12
2.4. Źródła danych ................. 12
2.5. Oceny ilościowe ................ 15
3. ZMIANY W NAZEWNICTWIE I SYSTEMATYCE (P. SURA) 18
C zęść II – główna , opIsowa ....... 21
4. WYKAZ GATUNKÓW ................. 23
5. OPISY I MAPY ROZMIESZCZENIA GATUNKÓW 24
5.1. Płazy – opracowania autorskie (19 gatunków) .................... 24
5.2. Gady – opracowania autorskie (10 gatunków) .................... 87
5.3. Gatunki obce i nowe w faunie Polski (P. Sura i B. Najbar) ............. 115
C zęść III – uzupełnIająC a .......... 123
6. PALEONTOLOGICZNE TŁO HERPETOFAUNY POLSKI (Z. SZYNDLAR) 125
6.1. Najstarsze płazy i gady ........... 125
6.2. Płazy i gady neogenu i czwartorzędu 126
7. OCHRONA PŁAZÓW I GADÓW W POLSCE (Z. GŁOWACIŃSKI) ................... 131
7.1. Współczesne zagrożenia krajowej herpetofauny .................. 131
7.2. Formy ochrony płazów i gadów w Polsce 133
7.3. Czynna ochrona krajowych płazów i gadów, programy wdrożeniowe ... 135
8. UPROSZCZONE MAPKI W SYSTEMIE UTM (G. POŁCZYŃSKA-KONIOR) .............
8.1. Rozmieszczenie płazów ..........
8.2. Rozmieszczenie gadów
9. PODSUMOWANIE I UWAGI KOŃCOWE (Z. GŁOWACIŃSKI) 148
10. KLUCZE DO OZNACZANIA PŁAZÓW POLSKI (M. RYBACKI)
10.1. Klucz do oznaczania jaj ..........
10.2. Klucz do oznaczania larw ........
10.3. Klucz do oznaczania osobników dorosłych ..................... 162
10.4. Uwagi praktyczne do klucza do oznaczania płazów (M. Pabijan) ... 171
11. KLUCZE DO OZNACZANIA GADÓW KRAJOWYCH I UWAGI PRAKTYCZNE (Z. SZYNDLAR) ...................... 175
11.1. Tropienie gadów ................ 175
11.2. Chwytanie gadów .............. 176
11.3. Korzystanie z k lucza podstawowego 176 11.4. Klucz do oznaczania węży na podstawie wylinek .............. 180
12. LITERATURA
uzupełniająca do map, niecytowana .....
WYKAZ WSPÓŁPRACOWNIKÓW
1. INTRODUCTION
2. METHODS
2.1.
2.3.
3. CHANGES
4. CHECKLIST
5. SPECIES
8. DISTRIBUTION
7. CONSERVATION
11. KEYS TO THE REPTILES OF POLAND AND PRACTICAL REMARKS
Występuje w górach, gdzieniegdzie też na niżu, zwykle na terenach lesistych z dominacją lasów liściastych. W polskiej części areału preferuje cieniste i wilgotne lasy liściaste i mieszane, zwłaszcza na terenach obfitujących w strumienie i młaki. W głębi areału geograficznego trafia się również na obszarach bezleśnych, prawdopodobnie jako relikt po faunie istniejących tam niegdyś lasów (Veith 1997). W Polsce występuje na pogórzach i w pasmach Karpat i Sudetów od wysokości 250 m n.p.m., najczęściej w granicach 400–750 m n.p.m., w pasie regla dolnego. W Tatrach polskich należy do rzadkości i dochodzi do 1125 m (Polana Kopieniec), rzadko wyżej (Świerad 1988, 2003).
Gatunek lądowy (poza okresem larwalnym), filopatryczny; salamandry są silnie przywiązane do
swoich miejsc rozrodu i nie oddalają się zbytnio od zajmowanych przez siebie kryjówek, chociaż ich terytoria mogą zajmować od 78 m 2 aż do ok. 2,3 ha (Schulte et al. 2007). Prowadzi skryty, głównie wieczorny i nocny tryb życia. Szczególnie silnie zależna jest od temperatury powietrza i wilgotności środowiska. W dżdżyste i niezbyt chłodne dni (optymalna temp. powietrza 10–15°C) aktywna także w porze dziennej. Podczas letnich deszczów, zwłaszcza po dłuższej suszy, pojawia się najliczniej, w tym również w dzień, i intensywnie żeruje. Poluje na drobne zwierzęta dna lasu, głównie stawonogi (owady, skorupiaki, pajęczaki), mięczaki i skąposzczety (Juszczyk 1987a; Zakrzewski 2007). Zimę spędza w kryjówkach ziemnych i innych, często w pobliżu strumieni, w których się rozmnaża. Z zimowego le-
targu budzi się z końcem marca, w kwietniu i maju samice rodzą od 30 do 70 larw, które mają wykształcone skrzela i obie pary kończyn. Rozwój larwalny przebiega w średnio zimnych (optymalna temperatura wody 10–20 o C) strumykach, źródłach i innych zbiornikach z wodą przepływową. Trwa on zwykle 3 miesiące, a przeobrażenie następuje w lipcu i sierpniu (Zakrzewski 1990, 2007). Brak wyraźnie zaznaczonego dymorfizmu płciowego. Gatunek cechuje wysoka zmienność układu i kształtu plam na ciele, które są cechą osobniczą, mało użyteczną do wydzielania populacji (fot. 1). Testy immunologiczne, oparte na przeszczepach fragmentów skóry, wskazują na wyraźne różnice fizjologiczne między osobnikami z populacji oddzielonych wododziałami (Płytycz i Ślęzak 1981). Jednak badania genetyczne, oparte na analizie mikrosatelitarnego DNA, nie wykazały różnic pomiędzy populacjami lokalnymi zarówno w Sudetach, jak i w Karpatach, z wyjątkiem izolowanych populacji znajdujących się na skraju zasięgu gatunku (Najbar A. et al. 2015; Konowalik et al. 2016). Z mapy rozmieszczenia gatunku wynika, że w kraju osiąga on dość zwarty zasięg w paśmie karpackim i bardziej porozrywany w Sudetach, zwłaszcza na Przedgórzu Sudeckim i w rejonie Gór Opawskich oraz na Pogórzu Karpackim (Najbar A. i Najbar B. 2015). W Karpatach polskich duże populacje utrzymują się w Bieszczadach, Beskidzie Niskim i Beskidzie Sądeckim, dość liczebne są też niektóre wyspowe populacje w Beskidzie Śląsko-Żywieckim, włącznie z masywami Pilska i Babiej Góry. Pod koniec XX wieku z samych Beskidów Zachodnich podano salamandrę z nieco ponad 50. stanowisk rozrodczych (Zakrzewski et al. 1999), jak też z licznych spotkań przypadkowych. Warto dodać, że salamandry mogą utrzymywać się w dobrym stanie również wewnątrz dużych aglomeracji miejskich, czego dobrym przykładem jest Bielsko-Biała. Jednak populacja ta, jak i inne miejskie, jest ostatnio silnie zagrożona zanieczyszczeniami i rosnącą siecią dróg (Najbar A. et al. 2017).
W paśmie sudeckim najliczniejsze są populacje w Górach Bardzkich i Górach Złotych (rejon Złotego Stoku), w Parku Krajobrazowym „Chełmy” (Muchów, Wąwóz „Lipa”), w Górach Stołowych w rejonie Darnkowa (populacja liczna, lecz izolowana). Stosunkowo bogatą i najwyraźniej wyspową populację wykazano w Ślężańskim Parku Krajobrazowym (Ogrodowczyk et al. 2010). Natomiast silnie przerzedzone są populacje m.in. w zachodnich Gorcach, Kotlinie Podhalańskiej i w rejonie Wałbrzycha. Wygasły, bądź wygasają populacje śląskie, w większości podsudeckie, podane przez Paxa (1925) i wcze-
śniejszych badaczy tego regionu (Ogrodowczyk et al. 2010). Badania zmienności mikrosatelitarnego DNA salamander karpackich wykazały (tak jak można było się spodziewać) obniżoną zmienność genetyczną populacji najbardziej peryferyjnych, rozlokowanych na Pogórzu Karpackim, co wiązane jest z silnym oddziaływaniem dryfu genetycznego (Najbar A. et al. 2015).
Ostatnio nie potwierdzono występowania salamandry na Roztoczu Środkowym podawanej przez Tenenbauma (1913), a na przełomie lat 60. i 70. XX w. przez K. Izdebskiego (niepubl.). Pod koniec lat 70. XX w. uczniowie Zwierzynieckiego Technikum Przemysłu Drzewnego niefortunnie (zapewne w dobrej intencji, ale wbrew zasadom reintrodukcji) sprowadzili w obręb Roztoczańskiego Parku Narodowego (uroczysko Bukowa Góra, Czerkies, rejon stawów „Echo”) kilkadziesiąt osobników z Bieszczadów (Głowaciński 1992), po których na terenie objętym introdukcją nie pozostał żaden ślad. Niespełna dwie dekady temu jedno stwierdzenie salamandry niewiadomego pochodzenia zostało odnotowane po lewej stronie Wisły, w Bielanach pod Krakowem (W. Harmata, 1997, inf. ustna). Jednak później gatunek ten nie został w tych okolicach potwierdzony. Ponadto dość nieoczekiwanie stwierdzono salamandrę w okolicach Wrocławia i po prawej stronie Odry w rejonie Wzgórz Trzebnickich (B. Konca, M. Rak, A. Witkowski, niepubl); jednak jej obecności nie potwierdzono tam w ostatnich latach, jak też na północno-zachodnim skraju Wyżyny Wieluńskiej (Zieliński i Hejduk 1995). Na stanowiskach tych nigdy nie stwierdzono form larwalnych, jest zatem podejrzenie, że wykazane tam osobniki dorosłe zostały introdukowane. Osobniki odnotowane w dolinie Odry pod Wrocławiem najprawdopodobniej pojawiły się w wyniku częstych w obszarze sudeckim powodzi (np. wielka powódź w 1997 r.).
Jeszcze bardziej zastanawiające są stare i nowsze wiadomości o stwierdzeniu dorosłych (wyłącznie) osobników salamandry na Warmii i Mazurach (Pagast 1941; Zaręba 1974; Paluch i Profus 2004; M. Wawirowicz, inf. korespond. 2014). Najprawdopodobniej gatunek ten w ostatnich stuleciach nie tworzył w tej części kraju populacji autochtonicznej, lecz został tu – jak twierdzą też inni autorzy (np. Thiesmeier i Grossenbacher 2004) – w nieznanych okolicznościach introdukowany. Podobnie zaskakujące są sporadyczne doniesienia o pojedynczych dorosłych osobnikach salamandry spotkanych na Kaszubach (m. Gołubie, 09Cd: A. Kasiński, inf. korespond. 2014). Jeśli tylko nie były to
8A. Pakiet o średnicy po złożeniu >3 cm, średnica otoczki jajowej >5 mm ....................... 9
9. Samica składa zwykle 1 pakiet, rzadziej 2, pakiet kształtu regularnego, owalnego ................ 10
9A. Samica składa kilka pakietów różnej wielkości i kształtu, pakiety są przyklejone do roślin podwodnych, mniej owalne (ryc. 3.F), często nieregularne, górny biegun jaja bezpośrednio po złożeniu ciemnobrązowy, dolny białawy lub żółtawy
żaba śmieszka Pelophylax ridibundus, żaba jeziorkowa P. lessonae, żaba wodna P. esculentus
10. Pakiety składane pod wodą, nie przyklejone do roślin, po pewnym czasie wypływają na powierzchnię, gdzie z czasem tworzą duże, luźne, plackowate skupiska jaj, o grubości 1 komórki jajowej, przy czym pakiety wielu samic często sklejają się ze sobą
żaba trawna Rana temporaria
10A . Pakiety przyklejone zwykle do roślin podwodnych 11
11. Pakiety przyklejone pojedynczo do roślin, korzeni, gałęzi podwodnych, 5–30 cm pod powierzchnią wody, średnica otoczki jajowej >8 mm, jasna plamka na dolnym biegunie jaja wyraźnie zaznaczona
żaba zwinka Rana dalmatina
11A . Pakiety przyklejone do roślin podwodnych lub nieprzyklejone (ryc. 3.F), także składane na dnie, po pewnym czasie wypływają na powierzchnię, gdzie z czasem tworzą duże, luźne, plackowate skupiska jaj, o grubości 1 komórki jajowej, przy czym pakiety wielu samic często sklejają się ze sobą, średnica otoczki jajowej <8 mm, jasna plamka na dolnym biegunie jaja niewyraźna
żaba moczarowa Rana arvalis
10.2. Klucz do oznaczania larw Key to larvae
1. Ciało wydłużone, na przekroju +– cylindryczne, podzielone na głowę, tułów i ogon; po bokach głowy trzy pary zewnętrznych skrzeli widocznych przez cały okres rozwoju larwalnego; aparat gębowy bez szczęk rogowych i bez skórnych ząbków wargowych: płazy ogoniaste Caudata 2
1A. Ciało na przekroju jajowate, podzielone na głowotułów i ogon; skrzela zewnętrzne obecne tylko krótko po wylęgu z jaja; aparat gębowy ze szczękami rogowymi – dolną i górną oraz z licznymi skórnymi ząbkami wargowymi ułożonymi w kilku rzędach: płazy bezogonowe Anura ........................... 6
2 . Płetwa ogonowa kończy się na grzbiecie pomiędzy kloaką a środkiem tułowia, jej zakończenie jest zaokrąglone; pysk z przodu (widziany z góry) szeroki, płaski; żółta plamka na grzbietowej stronie nasady wszystkich czterech kończyn; długość do 60 mm (ryc. 1)
salamandra plamista Salamandra salamandra

2A . Płetwa ogonowa kończy się na grzbiecie pomiędzy środkiem tułowia a głową, jej zakończenie jest zwężone, często szpiczaste; pysk z przodu (widziany z góry) zwężony, zaokrąglony; brak żółtej plamki u nasady kończyn – traszki z rodzaju Triturus, Lissotriton, Ichthyosaura 3
3. Górny i dolny brzeg płetwy ogonowej biegną prawie równolegle do siebie, jej zakończenie jest owalne; ogon kończy się krótkim wyrostkiem, który wychodzi poza płetwę; długość do 40 mm (ryc. 2) traszka górska Ichthyosaura alpestris

Ryc. 2 . Larwa traszki górskiej – Ichthyosaura alpestris (ryc. Heidemarie C. Grillitsch)
3A. Górny i dolny brzeg płetwy ogonowej nie biegną równolegle, są łukowato wysklepione, w tylnej części ogona płetwa zwęża się i jest ostro zakończona – traszki z rodzaju Triturus i Lissotriton ............ 4
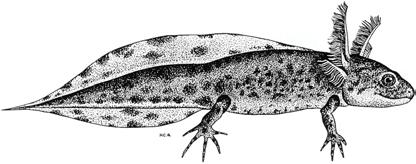
4. Płetwa ogonowa na odcinku kloaka-środek ogona jest mocno wysklepiona na górze i na dole, a następnie zwęża się wyraźnie i przechodzi w długi, nitkowaty wyrostek; ciało pokryte dużymi, ciemnymi plamami, szczególnie widocznymi na płetwie; palce wszystkich kończyn cienkie i długie; długość do 80 mm (ryc. 3) traszka grzebieniasta Triturus cristatus
4A. Płetwa ogonowa słabo wysklepiona, zwęża się równomiernie od tylnej części tułowia, jej zakończenie przypomina czubek ostro zakończonego noża, bez nitkowatego wyrostka; ciało z drobnymi plamkami lub marmurkowane; palce grube i krótkie; długość do 50 mm (ryc. 4) traszka zwyczajna Lissotriton vulgaris, traszka karpacka Lissotriton montandoni*,
* Larwy traszki zwyczajnej i karpackiej są bardzo podobne i prawie nie do odróżnienia w terenie.
