9 minute read
Approbations récentes de Santé Canada en 2025
par Brigitte Leonard, Ph.D.
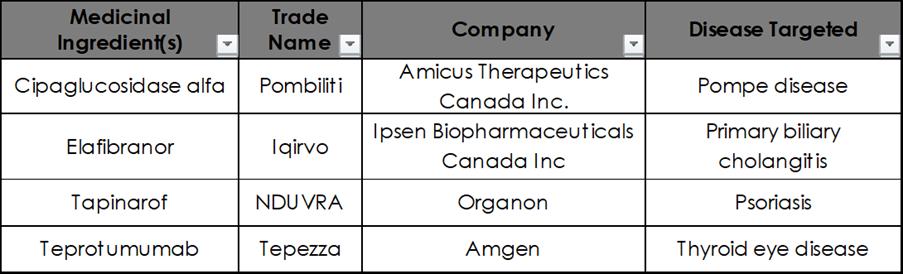
Santé Canada a approuvé de quatre nouveaux médicaments innovateurs depuis le dernier numéro d’E3 Advocacy publié en avril 2025 (Table 1).
Une nouvelle option pour les canadien-ne-s atteinte de la maladie de Pompe
La maladie de Pompe est un trouble génétique rare qui endommage le muscle et les cellules nerveuse tout à travers le corps. La maladie de Pompe se doit à des mutations du gène (GAA) responsable de la production d’un enzyme (alpha-glucosidase acide) qui décompose le glycogène afin que celui-ci devienne du glucose au sein de la cellule.
Les glucides supplémentaires que nous consommons sont stockées dans notre corps sous forme de glycogène dans notre foie ainsi que dans nos cellules musculaires. Le glycogène sera décomposé, devenant ainsi du glucose afin de fournir de l’énergie sur mesure. Les personnes atteintes de la maladie de Pompe n’ont pas accès à cette réserve d’énergie et l’accumulation du glycogène mène à une faiblesse musculaire progressive, particulièrement dans le cœur, dans le muscle squelettique, dans le foie et dans le système nerveux Sans traitement efficace, la maladie de Pompe pourrait mener à des complications mortelles

Santé Canada a approuvé du traitement innovateur par Amicus Therapeutics, Pombiliti (Cipaglucosidase alfa), en avril 2025. Pombiliti est une thérapie enzymatique substitutive pouvant être suivie en combinaison avec le miglustat afin de pouvoir traiter la maladie de Pompe. L’approbation de Pombiliti fut fondée sur un essai clinique de phase III nommé PROPEL. Pombiliti plus miglustat offrent des améliorations d’une potentielle importance clinique au niveau des facultés motrices et de la fonction respiratoire, comparé-e-s au standard thérapeutique actuel (alglucosidase alfa plus placebo) tout en gardant un profil de sécurité comparable.
Un espoir renouvellé chez les canadien-ne-s atteint-e-s de cholangite biliaire primitive (CBP) La cholangite biliaire primitive (CBP) est une maladie auto-immune du foie rare, chronique et progressive qui affecte principalement les femmes. Le CBP est dû à des anticorps qui attaquent les cellules du canal biliaire, détruisant progressivement les petits canaux biliaires du foie et entravant ainsi le flux de bile. La bile s’accumule dans le foie, provoquant des dommages, de la fibrose et de la cirrhose. La cirrhose augmente le risque de complications, dont l’insuffisance hépatique et le besoin potentiel de subir une greffe.

Les symptômes comprennent une démangeaison sévère, un sentiment de faiblesse, de la fatigue, des yeux secs et une bouche sèche, un déconfort abdominal, de l’ostéoporose, un cholestérol élevé et la jaunisse L’efficacité actuelle du traitement se limite au traitement des symptômes et au ralentissement de la progression L’UDCA, un acide biliaire hydrophile tertiaire, est le médicament principale approuvé pour les patient-e-s atteint-e-s de CBP ; toutefois, 40% des patient-e-s ne répondent pas adéquatement et font face à des effets indésirables considérables La greffe du foie est une procédure extrême sujette à plusieurs limitations L’acide obéticholique, un agoniste sélectif du récepteur X des farnésoïdes, est approuvé comme traitement secondaire Néanmoins, moins de 50% des patient-e-s parviennent à une réponse biochimique L’acide obéticholique peut aggraver les démangeaisons [1] Ces limitations des options de traitement présentement disponibles soulignent le besoin pressant d’une thérapie efficace et mieux tolérable s’addressant aux patient-e-s atteint-e-s de CBP.
Santé Canada a approuvé du traitement innovateur par Ipsen Pharmaceutical, Iqirvo (elafibranor), en avril 2025. Igirvo est un traitement oral s’attaquant à deux formes d’une molécule appelée PAPR. Igirvo permet la réduction en production d’acide biliaire et l’amélioration du flux de bile, ce qui aide à soulager l’endommagement du foie. L’approbation d’Igirvo fut fondée sur essai clinique de phase III intitulé ELATIVE. Igirvo fournit une amélioration considérable en réponse biochimique chez les patient-e-s atteint-e-s de CBP ayant une réponse inadéquate ou une intolérance à l’UDCA. Igirvo est une option essentielle pour aider à réduire l’activité de la maladie et soulager les symptômes. Néanmoins, nous attendons toujours certaines données afin de vérifier si celles-ci se traduisent à des bienfaits de santé à long-terme grâce aux preuves de vraie-vie et à l’essai de phase III intitulé ELFIDENCE
Introduction d’une nouvelle option de traitement pour les canadien-ne-s atteint-e-s de psoriasis
Le psoriasis est une maladie de la peau courante à long-terme qui provoque une éruption cutanée caractérisée par des plaques squameuses, se trouvant le plus souvent sur les genoux, les coudes, le tronc et le cuir chevelu Lors du psoriasis, le cycle de vie des cellules de peau est accéléré de manière considérable, menant à un empilage de cellules mortes sur la surface de l’épiderme Cela peut être douloureux, interférer avec le sommeil et rendre difficile la concentration La condition a tendance a fluctuer en cycles avec des périodes de poussées durant quelques semaines ou quelques mois, suivies de périodes de recul durant un bout de temps. Certains éléments déclencheurs courant chez les personnes ayant une prédisposition génétique au psoriasis sont les infections, les coupures ou les brûlures et quelques médicaments. Des traitements sont disponibles afin de vous aider à gérer vos symptômes. Vous pouvez aussi essayer des habitudes reliées au mode de vie et des stratégies d’adaptation afin de vous aider à gérer le psoriasis de façon plus directe.
Approbations récentes de Santé Canada en 2025 (suite)

Toutefois, les taux d’échec reliés au traitement du psoriasis peuvent être relativement élevés, allant de 48% à 75% dépendamment du type de traitement et defacteursindividuelschezlespatient-es, soulignant un besoin d’options supplémentaires.SantéCanadaapprouva la crème innovatrice par Organon, NDUVRA (tapinarof), en avril 2025. L’approbation de NDUVRA fut fondée sur deux études pivotales de phase III intituléesPSOARING1etPSOARING2
NDUVRA fût particulièrement efficace selon plusieurs mesures des résultats rapportés par les patient-e-s lorsqu’il en vint à réduire la démangeaison, démontrant des améliorations rapides, statistiquement considérables et cliniquement significatives. La proportion élevée de patient-e-s ayant atteint la cible de traitement consistant d’un état sans démangeaisons dès la semaine 12 (50%) est un résultat clinique notable pour une crème topique non-stéroïdienne par rapport au traitement du psoriasis en plaque de niveaux léger à sévère.
Et, qu’en est-il de la maladie oculaire thyroïdienne?
La maladie oculaire thyroïdienne, aussi connue sous le nom de maladie oculaire de Graves', est un trouble auto-immun capable d’affecter les tissus et les muscles autour des yeux, provoquant souvent des yeux enflés et boursouflés, ainsi que d’autres problèmes de vision Il ne s’agit pas directement d’une maladie de la glande thyroïde elle-même, s’apparentant comme-ci, comme-ça à une réponse immunitaire anormale
Le corps produit des autoanticorps (typiquement contre les récepteurs TSH les récepteurs primaires qui contrôlent l’activité de la glande thyroïde mais, d’autres composantes pourraient être impliquées) Ces autoanticorps et les cellules immunitaires s’y apparentant attaquent les tissus faisant partie du socle oculaire (l’orbite)
Les traitements conventionnels contre la maladie oculaire thyroïdienne se concentraient sur la réduction de l’inflammation ainsi que sur le soulagement des symptômes tout en préservant la vision. Ils variaient entre des gouttes oculaires et des lubrifiants, des médicaments anti-inflammation, des chirurgies et de la radiothérapie Bien que les traitements actuels puissent réduire l’activité de la maladie et améliorer les symptômes, reste l’important besoin non-satisfait de thérapies plus efficaces, moins envahissantes et personnalisées, particulièrement lorsqu’il en vient à la gestion de maladies chronique, à la prévention de maladies et à l’amélioration de la qualité de vie par rapport à la santé.
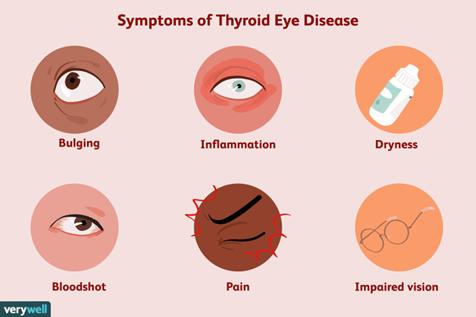
Santé Canada a approuvé d’une thérapie innovatrice par Amgen, Tepezza (teprotumumab), en avril 2025 Tepezza est prescrite chez les adultes afin de traiter la maladie oculaire thyroïdienne active de niveaux modéré à sévère Il s’agit d’un anticorps qui s’attaque à l’insulin-like growth factor-1 receptor (IGF-1R) sur les tissus orbitaux, perturbant ainsi l’inflammation et l’enflement des tissus provoqués par la maladie oculaire thyroïdienne L’approbation de Tepezza fut fondée sur deux essais cliniques de phase III nommés OPTIC et OPTIC-J Le teprotumumab améliora considérablement le ballonnement des yeux comparé à un placébo face à une maladie oculaire thyroïdienne à basse-inflammation de longue-date, démontrant de l’efficacité indépendamment de la duration ou du niveau d’activité de la maladie. Le profil de sécurité fut semblable à celui ayant été rapporté précédemment.
Brigitte Leonard, Ph.D.
Brigitte a le privilège de travailler en pharma depuis plus de 20 ans, contribuant ainsi à l’introduction aux patient-e-s de traitements bouleversants et sous un standard éthique parmi les plus stricts. Présentement, elle voudrait partager son savoir et utiliser ses compétences scientifiques, stratégiques et en communication afin d’aider la communauté des patient-e-s. Elle obtint son Ph.D. en sciences biomédicales de l’Université de Montréal en 2003. Sa recherche doctorale fut entretenue au centre de recherche de l’Hôpital Maisonneuve-Rosemont Elle développa un essai diagnostic quantitatif en lymphome non hodgkinien et évalua la pertinence de ce marqueur lorsqu’il en vint aux résultats chez la personne patiente


par Brigitte Leonard, Ph.D
L’Agence des médicaments du Canada (l’AMC) est un organisme indépendant à but non lucratif qui fournit des évaluations fondées sur les faits aux médicaments, aux appareils médicaux et aux technologies médicales afin de soutenir la prise de décision informée au sein du système des soins de la santé du Canada. L’AMC collabore avec des gouvernements fédéraux, provinciaux et territoriaux (à l’exception du Québec) afin d’en évaluer les efficacités clinique et financière ainsi que l’impact plus général d’interventions de santé qu’elles soient nouvelles ou préexistantes En entreprenant une Évaluation des technologies de la santé [Health Technology Assessment (HTA)], en fournissant des recommandations de remboursement et en développant des rapports d’orientation, l’AMC joue un rôle essentiel à la formation de politiques des soins de la santé, s’assurant ainsi que les patient-e-s, que les fournisseurs des soins de la santé et que les décideur-euse-s politique aient accès à des informations fiables et axées sur la science afin d’améliorer les résultats médicaux et d’optimiser l’allocation des ressources https://www.healcanada.org/empowering-voice-podcast/

Des nouvelles excitantes de Heal Canada! Nous sommes ravi-e-s d’annoncer le lancement de notre nouvelle série de podcasts, Empowering Voices, dédiée à l’amplification du vécu et des perspicacités de patient-e-s, de professionnel-le-s des soins de la santé, et de revendicateur-ice-s au nom de communautés atteint-e-s de troubles sanguins et de maladies rares. Chaque épisode présentera des conversations valables sur les expériences des patient-e-s, la recherche émergente et l’évolutif paysage des revendications pertinentes aux services des soins de la santé. Par le biais d’Empowering Voices, nous visons à éduquer, à inspirer et à entraîner le changement en amenant les perspectives de vraie-vie aux premières lignes. Soyez à l’affût de notre premier épisode, à venir—parce que chaque voix compte!











