

Las farmacéuticas siguen innovando
Enfocadas en Enfermedades No Transmisibles

DARIDOREXANT
Molécula del mes
Finerenona amplía tratamiento
Aprobación de la FDA
Avances en Oncología
China Lidera Desarrollos
Extractos naturales contra obesidad
La botánica como aliado

DARIDOREXANT
Es un antagonista dual de los receptores de orexina tipo 1 y tipo 2 (OX1 y OX2) (DORA) de administración oral, desarrollado para el tratamiento del insomnio. Se seleccionó de un grupo de fármacos candidatos con base en una duración esperada del efecto de aproximadamente 8 h a una dosis de 25 mg con una vida media destinada a minimizar los efectos residuales que podrían afectar el funcionamiento diurno. Basándose en los resultados de dos ensayos pivotales de fase III.
Daridorexant fue creado por Actelion
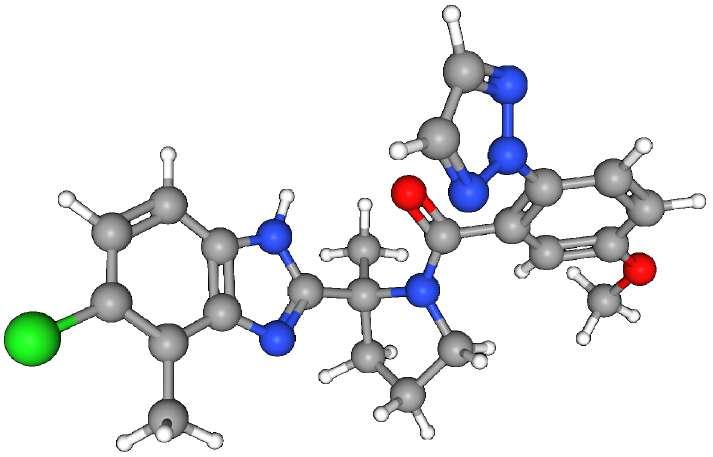

Pharmaceuticals Ltd. En junio de 2017, tras la adquisición de Actelion por parte de Johnson &
Nombres alternativos
Nombre IUPAC
Clase
Mecanismo de acción
Ruta de administración
Farmacodinámica
Farmacocinética
Efectos adversos
Código ATC
compañía biofarmacéutica suiza, Idorsia Pharmaceuticals Ltd.
Características y propiedades de Daridorexant
ACT 541468, nemorexant
(S)-(2-(5-cloro-4-metil-1H-benzo[d]imidazol-2-il)-2-metilpirrolidin-1-il)(5metoxi-2-(2H-1,2, 3-triazol-2-il)fenil)metanona hidrocloruro
Benzimidazoles, hidrocarburos clorados, cetonas, pirrolidina, terapias para desórdenes del sueño, molécula pequeña, triazoles
Antagonista de los receptores tipo 1 y tipo 2 de receptor Orexina
Oral
Constante de inhibición (Kb) of 0.52 nM y 0.78 nM para receptores humanos OX1 y OX2 respectivamente.
Tmax 1–2 h, t½ ≈ 8 h
Nasofaringitis, Dolor de cabeza, fatiga, nausea, mareo, somnolencia.
N05CJ03, N05 Psicolépticos
Daridorexant recibió su primera aprobación el 7 de enero de 2022 para el tratamiento de pacientes adultos con insomnio caracterizado por dificultades para conciliar el sueño o mantenerlo en EE.UU. además ha sido aprobado en varios países, como Gran Bretaña, la Unión Europea (UE), Suiza y Canadá. También se le ha concedido una licencia exclusiva para su desarrollo y comercialización en la región de la Gran China.
La dosis recomendada de daridorexant en EE. UU. es de 25 a 50 mg una vez por noche, tomada dentro de los 30 minutos previos a

acostarse, con al menos 7 horas restantes antes del despertar planificado.
La información de prescripción en EE.UU. contiene advertencias sobre la posibilidad de efectos depresores del SNC y alteración diurna (que aumenta cuando daridorexant se toma con otros depresores del SNC), posible empeoramiento de la depresión o ideación suicida, parálisis del sueño, alucinaciones hipnagógicas/hipnopómpicas y síntomas similares a la cataplejía.
Fuente: https://link.springer.com/article/10.1007/s40265-022-01699-y

El nuevo uso del medicamento es para pacientes con insuficiencia cardiaca (IC) con fracción de eyección preservada (ICFEp) o fracción de eyección ligeramente reducida (ICFEmr).
La FDA ha anunciado la ampliación de las indicaciones de finerenona, el antagonista selectivo no esteroideo de los receptores de mineralocorticoides (ARM), de Bayer, para incluir el tratamiento de pacientes con dos tipos de insuficiencia cardíaca (IC): en pacientes con IC con fracción de eyección preservada (ICFEp) o fracción de eyección ligeramente reducida (ICFEmr).



izquierdo (FEVI). Aquellos con una FEVI entre el 40% y el 50% tienen ICFEmr. Aquellos con una FEVI superior al 50% tienen ICFEp. En estos pacientes, el músculo cardíaco se contrae correctamente, pero los ventrículos no se relajan.
Finerenona no ha sido aprobado para pacientes con una FEVI inferior al 40%. Estos pacientes tienen una fracción de eyección reducida (ICFEr), lo que significa que el músculo cardíaco no se contrae correctamente.

El organismo regulador estadounidense aprobó originalmente finerenona hace cuatro años para reducir el riesgo de deterioro de la función renal, insuficiencia renal, muerte cardiovascular, infartos de miocardio no mortales y hospitalización por insuficiencia cardíaca en adultos con enfermedad renal crónica (ERC) asociada a diabetes tipo 2. Esta nueva autorización permite administrar finerenona a pacientes con IC que no presentan ERC asociada a diabetes tipo 2.
Los pacientes con IC se clasifican según la capacidad de su corazón para llenarse de sangre y bombearla. El método de medición es la fracción de eyección del ventrículo

Bayer proyecta que las ventas anuales máximas de finerenona alcancen los 3.000 millones de dólares. El medicamento actúa como diurético, disminuyendo la reabsorción de sodio en los riñones, lo que provoca una mayor excreción de agua y provoca una disminución de la presión arterial y la reducción del líquido alrededor del corazón.
En el ensayo de fase 3 Finearts-HF, los pacientes recibieron el tratamiento o placebo además del tratamiento estándar. Finerenona mostró una reducción del 16% en el riesgo de muerte cardiovascular o un evento de IC en comparación con placebo. Los resultados del estudio fueron consistentes en todos los subgrupos preespecificados.
Fuente: https://www.diariomedico.com/farmacia/industria/libre-fda-indicaciones-kere ndia-insuficiencia-cardiaca.html?check_logged_in=1
Las farmacéuticas siguen innovando
En la actualidad se calcula que hay más de 12,900 medicamentos en distintas fases de desarrollo clínico en todo el mundo, de los cuales el 75% (más de 9,600 medicamentos) se centran en posibles tratamientos para las enfermedades no transmisibles (ENT).
Según un informe realizado por International Federation of Pharmaceutical Manufacturers and Associations (IFPMA), esto incluye más de 4,700 para el cáncer, 1,100 para las enfermedades cardiovasculares, casi 500 para la diabetes y más de 2.800 para la salud mental y las enfermedades neurológicas Además, en los últimos 10 años se han lanzado 1,408 medicamentos para este conjunto de patologías.
Con casi 2,500 medicamentos de la Lista de Medicamentos Esenciales de la OMS enfocados en las ENT, lo que representa alrededor del 40% del total, se advierte que las “compañías farmacéuticas siguen invirtiendo en innovación, traduciendo los avances científicos en la próxima generación de medicamentos y vacunas para ayudar a conseguir un futuro más saludable para las personas de todo el mundo”.






Enfocadas en Enfermedades No Transmisibles
Para la IFPMA, fomentar un ecosistema de innovación saludable y mejorar la concienciación y la adopción de la innovación médica para abordar la carga mundial de las ENT y la salud mental es crucial. Del mismo modo, considera que comprometerse a invertir de forma más eficaz en el fortalecimiento de los sistemas sanitarios y a disponer de planes de financiación concretos y viables para las ENT y la salud mental también lo es.

Por otra parte, cree necesario trabajar en políticas que garanticen un acceso equitativo a la prevención, el tratamiento y la atención de las ENT para todos. Fortalecer los sistemas nacionales de salud mediante la integración de la detección precoz, el diagnóstico, la vacunación, las opciones de tratamiento integral y los programas de rehabilitación que lleguen y aborden eficazmente las necesidades de las personas que viven con ENT y enfermedades mentales.
Fuente: https://enfarma.lat/index.php/noticias





La Administración Nacional de Productos Médicos (NMPA) de China aprueba cuatro nuevos fármacos, incluyendo el primer inhibidor dual HDAC/PI3K global, consolidando al país como un centro clave de innovación farmacéutica y de desarrollo de medicamentos "first-in-class".
La Administración Nacional de Productos Médicos (NMPA) de China ha otorgado la aprobación a cuatro nuevos fármacos desarrollados por compañías biofarmacéuticas locales. Entre estas aprobaciones destaca ifupinostat (BEBT-908) de BeBetter Med, un medicamento para el linfoma difuso de células B grandes (LDCBG) en pacientes que han recibido al menos dos líneas de terapia previas. Ifupinostat es el primer inhibidor dual HDAC/PI3K aprobado a nivel mundial. Aunque su tasa de respuesta general (ORR) en el ensayo pivotal fue del 33.8% (o 53.6% ajustada), mostró un 67% de ORR en pacientes que fallaron a terapias CAR-T y anticuerpos biespecíficos. Además, como fármaco de molécula pequeña, se espera que sea significativamente más económico que las terapias CAR-T. Otras aprobaciones oncológicas incluyen tibremciclib de Betta Pharma para cáncer de mama y suvemcitug de Simcere para cáncer de ovario.
es ivonesimab de Akeso, el primer anticuerpo biespecífico PD-1xVEGF aprobado globalmente. Fuera de la oncología, la NMPA también aprobó firsekibart (anteriormente genakumab) de Changchun GeneScience Pharmaceutical para ciertas exacerbaciones agudas de gota. La capacidad de China para producir innovaciones ha atraído acuerdos multimillonarios de licencia con grandes farmacéuticas como Merck, Bristol Myers Squibb y Pfizer, centrados en candidatos desarrollados en el país.

Fuente: https://www.acobur.es/noticia-36015--128640-china-aprueba-4-nuevos-far macos-incluido-un-innovador-para-linfoma




Extractos naturales contra obesidad
Extractos naturales contra obesidad
Dos extractos botánicos patentados se asociaron con aumentos significativos en los niveles sanguíneos de GLP-1 y una pérdida de peso significativa en 90 sujetos con sobrepeso u obesidad.
Un estudio aleatorizado, doble ciego y controlado con placebo descubrió que dos ingredientes como suplementos independientes, el extracto de Dyglomera
Dichrostachys glomerata y el extracto (CQR-300) de Cissus quadrangularis, aumentaron significativamente los niveles endógenos de GLP-1. El GLP-1 es una hormona peptídica que estimula la liberación de insulina en respuesta a las comidas, lo que promueve niveles estables de azúcar en sangre, reducción del hambre y saciedad. El mecanismo para elevar el GLP-1, para cada uno de los dos ingredientes, pareció ser la inhibición de la dipeptidil peptidasa-4 (DPP-4), la enzima responsable de la descomposición del GLP-1
El estudio involucró a 90 participantes con sobrepeso asignados para tomar 300 mg de CQR-300, 400 mg de Dyglomera o un placebo diariamente durante 12 semanas. Las mediciones de IMC, porcentaje de grasa corporal, niveles de GLP-1, lípidos en sangre y glucosa en sangre en ayunas se evaluaron al inicio y en las semanas cuatro, ocho y doce.
Los niveles de GLP-1 aumentaron significativamente en el grupo de Dyglomera
(68%) y CQR-300 (56%) en comparación con el grupo de placebo que vio un aumento del 15%.
Ambos extractos inhibieron la actividad de la DDP-4 durante el estudio: Dyglomera redujo los niveles de DDP-4 en un 59% y CQR-300 en un 54%. Los participantes del grupo placebo experimentaron un aumento del 129% en la actividad de la DPP-4. También se observaron disminuciones significativas en la cantidad de calorías consumidas en los grupos Dyglomera (24%) y CQR-300 (20%).
Los participantes del grupo Dyglomera experimentaron una disminución promedio del 17% en su peso corporal, mientras que el grupo CQR-300 experimentó una disminución del 14%. La pérdida promedio de peso corporal en el grupo placebo fue del 1,67%.
Los grupos de tratamiento también experimentaron reducciones significativas de grasa corporal del 31% con Dyglomera y del 27% con CQR-300, mientras que el grupo placebo solo experimentó una reducción del 1% en la grasa corporal. El IMC disminuyó un 17% en el grupo Dyglomera y un 14% en el grupo CQR300, en comparación con solo un 2% en el grupo placebo.
CQR-300 y Dyglomera ofrecen una alternativa natural novedosa y prometedora a las terapias con agonistas de GLP-1.
Fuente: https://nutraceuticalbusinessreview.com/gateway-health-alliancesweight-management-ingredients-boosts-glp


