Mirogabalina
Molécula del mes

5 enfermedades autoinmunes
Invima aprueba medicamentos

Mirogabalina
Molécula del mes

5 enfermedades autoinmunes
Invima aprueba medicamentos
Ahora, un enfoque preventivo
nirmatrelvir/ritonavir con registro sanitario Cofepris autoriza comercialización
VaxThera obtiene patente Vacuna Universal contra el COVID-19


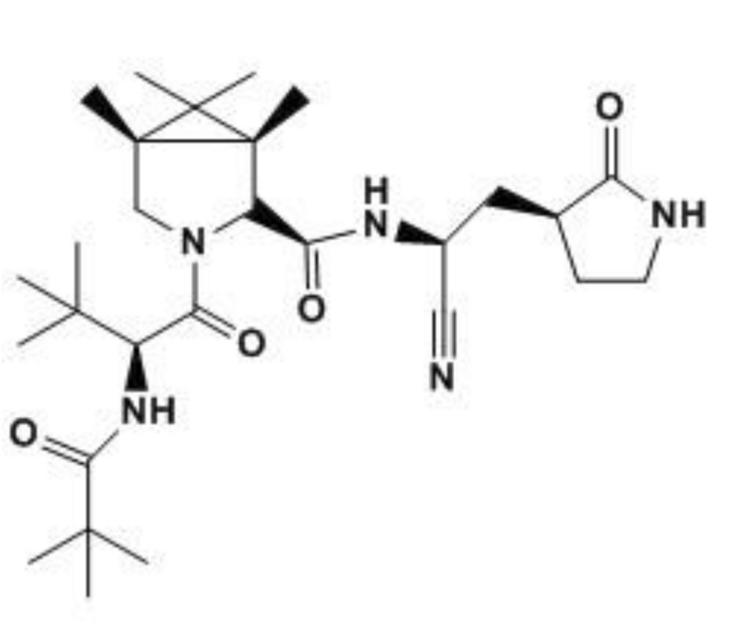
Mirogabalina besilato (en adelante mirogabalina) [Tarlige®] es un gabapentinoide administrado por vía oral, desarrollado por Daiichi Sankyo para el tratamiento del dolor neuropático periférico (DNP), incluyendo el DNP diabético y la neuralgia posherpética. El fármaco se une y modula la subunidad α2δ-1 de los canales de calcio dependientes de voltaje, ampliamente encontrados en el sistema nervioso en áreas que median la transmisión y procesamiento del dolor. La mirogabalina tiene un perfil de unión único y una larga duración de acción. El medicamento está aprobado en Japón para el tratamiento del DNP y está en desarrollo clínico para esta indicación en otras partes de Asia.
Nombres alternativos
Clase
Mecanismo de acción
Ruta de administración
Farmacodinámica
Farmacocinética
Efectos adversos
Código ATC
Nombre químico
DS 5565; Tarlige
El dolor neuropático puede ser debilitante, llevando a problemas de sueño y a una reducción en la calidad de vida. Puede tener diversas causas subyacentes y, dependiendo de la ubicación del daño causante, puede ser periférico (por ejemplo, neuropatía diabética, neuralgia posherpética (NPH), cáncer/quimioterapia, cirugía) y/o central (por ejemplo, accidente cerebrovascular, lesión cerebral traumática). Los gabapentinoides son componentes clave en el manejo del dolor neuropático [2–4], proporcionando analgesia principalmente al reducir la sensibilidad del cuerno dorsal a través de mecanismos que incluyen el bloqueo de los canales de calcio dependientes de voltaje (VGCC).
propiedades
Ácidos γ-aminobutíricos, Analgésicos, Compuestos bicíclicos, Moléculas pequeñas
Modulador de la proteína α2δ-1
Oral
Se une selectivamente a las subunidades α2δ-1 y α2δ-2 de los canales de calcio dependientes de voltaje humanos, pero se disocia más rápidamente de α2δ-2. Muestra efectos analgésicos en modelos animales de dolor neuropático y alivia comportamientos relacionados con la ansiedad en un modelo de fibromialgia en ratas. Absorbido rápidamente después de la administración oral; tiempo mediano hasta la concentración plasmática máxima de 0,5 a 1,5 horas. Somnolencia, mareos y aumento de peso
Código ATC de la OMS: A10 (fármacos utilizados en diabetes); G04B (urológicos); N02 (analgésicos)
Código ATC la EphMRA: A10 (fármacos utilizados en diabetes); G4X (todos los demás productos urológicos); N2 (analgésicos)
[(1R,5S,6S)-6(-Aminometil)-3-etilbiciclo [3.2.0] hept-3-en-6-il] ácido acético monobenzenesulfonato
Fuente: https://pubmed.ncbi.nlm.nih.gov/30778848/


El Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) ha dado luz verde para que el medicamento Upadacintib sea empleado en el tratamiento de cinco nuevas patologías en Colombia. Este desarrollo permite a los profesionales de la salud contar con una alternativa efectiva para tratar a pacientes con artritis psoriásica, espondiloartritis axial no radiográfica, espondilitis anquilosante, colitis ulcerativa y dermatitis atópica.
El fármaco, que podrá adquirirse bajo prescripción, mejora la calidad de vida de los pacientes al tratar enfermedades inmunomediadas. Estas patologías tienen repercusiones psicológicas y sociales significativas, tales como depresión, ansiedad, baja autoestima y problemas laborales como presentismo y ausentismo.
A pesar de que aún no se ha descubierto una cura para estas enfermedades, la aprobación de Upadacintib se añade a la lista de tratamientos disponibles en Colombia, brindando una nueva esperanza para mejorar la calidad de vida de quienes las padecen.
La colitis ulcerativa y la dermatitis atópica crónica tiene un impacto considerable en la vida de los pacientes y genera altos costos de salud. Los pacientes con colitis ulcerativa controlada pierden aproximadamente un 10% de su tiempo laboral debido a la enfermedad, mientras que aquellos con la enfermedad no
controlada pueden perder hasta un 20%. Según un estudio reciente los pacientes con dermatitis atópica crónica pierden un promedio de 5.8 días de trabajo cada seis meses a causa de su enfermedad. Estos costos laborales son significativos y reflejan la necesidad de tratamientos efectivos para manejar la enfermedad y mejorar la calidad de vida de los afectados.
¿Cuál es el mecanismo de acción del medicamento aprobado?
El medicamento desarrollado por Abbvie, conocido también como Rinvoq, es un inhibidor selectivo de JAK que se investiga en diversas enfermedades inflamatorias mediadas por el sistema inmunitario. A través de ensayos enzimáticos y celulares, RINVOQ ha demostrado una mayor potencia inhibitoria para JAK-1 en comparación con JAK-2, JAK-3 y TYK-21.
En mayo de 2023, por ejemplo, la FDA aprobó su uso en adultos con enfermedad de Crohn moderada a severamente activa que no han respondido adecuadamente o tienen intolerancia a uno o más bloqueadores del factor de necrosis tumoral. El medicamento es el primer producto oral aprobado disponible para tratar la enfermedad de Crohn moderada a severamente activa

Fuentes: https://consultorsalud.com/invima-medicamento-upadacintib-enf -autoinmunes/
Los dos tipos principales de terapia para las personas con migraña son: (1) terapia aguda o abortiva (cuando se desarrolla un dolor de cabeza, se trata) y (2) terapia preventiva. La terapia preventiva se utiliza típicamente cuando el paciente tiene dolores de cabeza durante 4 o más días al mes y tiene como objetivo reducir la frecuencia y la gravedad de los dolores de cabeza. Alrededor del 40% de los pacientes con migraña califican para la terapia preventiva, pero solo una minoría la recibe.


Según la Sociedad Estadounidense de Cefaleas (AHS) "Las terapias dirigidas a los péptidos relacionados con el gen de la calcitonina son una opción de primera línea para la prevención de la migraña" que se centra en las terapias dirigidas a los péptidos relacionados con el gen de la calcitonina (CGRP).
migraña. Esta es una buena noticia, porque los BRA son una clase de fármacos con los que tenemos mucha experiencia, son fáciles de usar y podrían ser una excelente opción para las personas con hipertensión concomitante o enfermedad renal crónica. Los inhibidores de la recaptación de serotonina y

El arsenal terapéutico para la prevención de las migrañas no había cambiado en mucho tiempo hasta ahora. La terapia preventiva de primera línea ha consistido tradicionalmente en tres clases de agentes: betabloqueantes, antidepresivos tricíclicos y topiramato. Estos medicamentos se desarrollaron con diferentes fines terapéuticos, pero funcionan para las migrañas. Estos medicamentos pueden tener efectos no deseados que pueden hacer que sean difíciles de tolerar
Según nuevas evidencias, el candesartán, un bloqueador del receptor de angiotensina (BRA), es ahora también un fármaco de primera línea para la





noradrenalina (venlafaxina y duloxetina) también se consideran agentes de primera línea para el tratamiento de la migraña. En la nueva declaración de posición de la AHS, las dos principales clases de medicamentos son los antagonistas del receptor CGRP de moléculas pequeñas y los anticuerpos monoclonales.
El papel del neuropéptido CGRP en la migraña se descubrió originalmente tras encontrar que los niveles de CGRP en sangre aumentaban durante los ataques de migraña condujo al descubrimiento de agentes que bloqueaban el CGRP, tratamiento agudo de la migraña y luego como terapia preventiva

Nombre Genérico
Rimegepant
Atogepant

clínicos muestran que las terapias dirigidas al CGRP son tan efectivas o incluso más que los agentes tradicionales de primera línea para reducir la cantidad de días de migraña por mes.
La eficacia y seguridad de estos agentes se ha demostrado tanto en ensayos aleatorizados como en estudios en el mundo real. Otros resultados positivos importantes incluyen menos días de migraña, menor uso de medicamentos agudos y mejoras en muchos resultados de calidad de vida. Los estudios también han demostrado que las terapias dirigidas al CGRP son bien toleradas y seguras, con muy pocos eventos adversos graves.
El Dr. Neil Skolnik sugiere tener en cuenta las siguientes terapias para combatir la migraña:
Antagonistas del receptor CGRP de moléculas pequeñas
Costo[a]
Qulipta


Nombre Genérico
Erenumab
Fremanezumab
Galcanezumab
Eptinezumab
Nombre Comercial
Aimovig
Ajovy
Emgality
Vyepti
75 mg PO día de por medio
60 mg PO diarios
Anticuerpos monoclonale
75-140 mg SQ una vez al mes
225 mg SQ una vez al mes
120 mg SQ una vez al mes
100 mg IV cada 3 meses
1 paquete de dosis (8 Tabs) - USD $920
No está Disponible

Costo[a]
USD $661 al mes
USD $656 al mes
USD $650 al mes
USD $4597 cada 3 meses
En cumplimiento del compromiso total con la salud de la población mexicana, la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) autorizó el registro sanitario a Paxlovid (nirmatrelvir/ritonavir), del laboratorio Pfizer, indicado para tratamiento de COVID-19 en adultos que no requieren oxígeno suplementario y que presentan mayor riesgo de progresión a COVID-19 grave
La decisión se fundamenta en la evaluación del Comité de Moléculas Nuevas (CMN) y el riguroso análisis técnico realizado por el equipo especializado de la agencia, quienes determinaron que el medicamento cumple los requisitos de calidad, seguridad y eficacia, de acuerdo con la información presentada en el expediente técnico. Gracias a estos resultados, se autoriza la comercialización abierta del primer medicamento para prevenir hospitalizaciones y mortalidad por COVID-19, con lo cual Cofepris se convierte en una de las primeras agencias regulatorias en autorizar a Paxlovid un registro sanitario de este tipo.
Este medicamento ya cuenta con aprobación de autoridades regulatorias destacadas, como la Administración de Alimentos y Medicamentos de Estados Unidos (FDA),
Health Canada, la Agencia Europea de Medicamentos (EMA), así como entidades en Latinoamérica como la Agencia Nacional de Vigilancia Sanitaria de Brasil (Anvisa) y la Agencia Nacional de Medicamentos de Chile (Anamed). La autorización en México permitirá seguir avanzando en la lucha contra COVID-19.
La administración de nirmatrelvir/ritonavir requiere prescripción médica. Los profesionales de la salud deben evaluar los factores de uso y riesgo detallados en el oficio de autorización para evitar el mal uso, la automedicación y la venta irregular.

El registro sanitario de nirmatrelvir/ritonavir es resultado de un amplio trabajo de regulación proactiva por parte de esta agencia sanitaria, además de la colaboración con el laboratorio fabricante, con el fin de ampliar las opciones de tratamiento disponibles para COVID-19.
Cofepris se suma al llamado internacional para recordar a la población que este tratamiento no sustituye a las vacunas autorizadas contra COVID-19 y que no debe utilizarse sin indicación médica.
Fuente: https://www.gob.mx/cofepris/articulos/cofepris-se-convierte-en-una-de-l as-primeras-agencias-regulatorias-en-autorizar-comercializacion-abiert a-de-paxlovid?state=published
VaxThera, empresa colombiana de biotecnología enfocada en el desarrollo de vacunas y biológicos que aportan a la soberanía sanitaria del país y la región, anunció que la Oficina de Patentes y Marcas de los Estados Unidos (USPTO) concedió la patente de su vacuna universal contra el coronavirus. Ésta comprende una proteína en mosaico que permite tener una amplia cobertura de protección contra diferentes coronavirus, así como de sus distintas variantes.
La obtención de esta patente refuerza el posicionamiento y experiencia de VaxThera como compañía de biotecnología que busca transformar la ciencia, la investigación y el desarrollo, en beneficios que contribuyan a mejorar la calidad de vida de los colombianos y latinoamericanos y ofrecer a la región la independencia sanitaria que necesita para afrontar futuras enfermedades. Cabe destacar que, desde el año 1998, en Colombia no se producen vacunas y aunque el Programa Ampliado de Inmunizaciones (PAI) contempla 21 vacunas que protegen contra 26 enfermedades, ninguna se produce localmente.
economía, a través del empleo, la generación de recursos por la exportación de biológicos y la disminución de los costes para quienes la distribuyan.

En un contexto global de creciente demanda de soluciones médicas innovadoras, la propiedad intelectual se convierte en un pilar fundamental para el avance y la competitividad de la industria de vacunas en Colombia. La obtención de patentes incentiva la inversión en investigación y desarrollo, asegurando que las empresas puedan aprovechar sus inventos en beneficio de la comunidad. Asimismo, fomenta la colaboración entre instituciones, facilitando el acceso a tecnologías avanzadas y mejorando la capacidad del país para responder a desafíos sanitarios.

Con la producción local se aporta a la recuperación de la industria farmacéutica nacional, pues además de que se establece una distribución equitativa, eficaz y eficiente para todo el país, se mejora el acceso a productos dirigidos a la prevención de enfermedades que impactan la salud pública. Todo esto representa un aporte para la

VaxThera, como empresa colombiana que cuenta con Seguros SURA como socio fundador, está trabajando con capacidades propias, redes colaborativas, tecnología de vanguardia y expertos nacionales e internacionales que ayudarán a fortalecer la transferencia de conocimiento para lograr la autonomía de vacunas y así estar preparados para futuras pandemias. La patente otorgada le permite a la Compañía la posibilidad de tener exclusividad sobre la invención por 20 años y continuar así en el camino de la reindustrialización del sector salud produciendo localmente vacunas y biológicos.
Fuente: https://consultorsalud.com/vaxthera-patente-vacuna-universal-covid-19/

