
DORAVIRINA
Molécula del mes
trámites represados en el Invima trámites represados en el Invima NEWS
registros sanitarios
Guía para realizar modi caciones
Medicamento con doble propósito Previene caída del pelo y cardiopatías
Los Medicamentos más esperados
3 aprobaciones en la farmaindustria


Reportes de avances en la atención
Reportes de avances en la atención
EDICIÓN 22 • MARZO 2024

DORAVIRINA
En agosto de 2018, la FDA de EE. UU. aprobó la doravirina (en combinación con otros agentes antirretrovirales) y doravirina/lamivudina/tenofovir disoproxil fumarato (como régimen completo) para el tratamiento de la infección por VIH-1 en adultos sin experiencia previa con antirretrovirales.
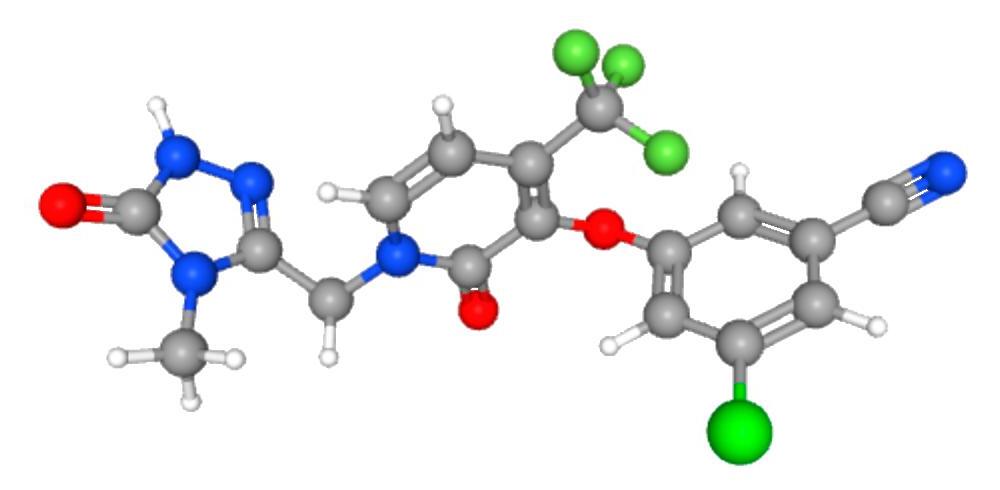
Doravirina es un inhibidor no nucleósido de la transcriptasa inversa (NNRTI) desarrollado por Merck & Co para el tratamiento de Infección por VIH-1. El medicamento está aprobado en los EE. UU. como tableta de agente único (Pifeltro™) y como combinación de dosis fija tableta con los nucleosidos inhibidores de la transcriptasa inversa lamivudina y tenofovir disoproxil fumarato (Delstrigo™).
Nombres alternativos
Clase
Mecanismo de acción
Ruta de administración
Farmacodinámica
Características y propiedades de Doravirina
Pifeltro™ (doravirina tabletas) and Delstrigo™ (doravirina/lamivudina/tenofovir disoproxil fumarato tabletas)
Antiretrovirales, nitrilos, piridonas, molécula pequeña, triazoles
Inhibidor de la transcriptasa reversa no-nucleosido
Oral
Farmacocinética
Efectos adversos
Código ATC
Nombre químico

Activo contra cepas de VIH-1 de tipo salvaje, incluida una variedad de subtipos del grupo M. Activo contra varias cepas mutantes de VIH-1 asociadas con otros inhibidores de la transcriptasa inversa no nucleósidos
Se absorbe rápidamente, se une al 76 % de las proteínas plasmáticas y se metaboliza principalmente a través de CYP3A.
Náuseas, dolor de cabeza, fatiga, diarrea, mareos.
J05A-G06 (doravirina)
3-Cloro-5-[[1-[(4,5-dihidro-4-metil-5-oxo-1H-1,2,4-triazol-3-yl)metil]-1,2-dihidro-2-oxo-4(trifuorometil)-3-piridinil]oxi]-benzonitrilo
Está disponible como tableta de agente único (Pifeltro™) y como tableta combinada de dosis fija con lamivudina y tenofovir disoproxil fumarato (Delstrigo™). Cada formulación contiene 100 mg de doravirina, y el comprimido de FDC también contiene 300 mg de lamivudina y tenofovir disoproxil fumarato. La dosis recomendada para cada formulación es una tableta por vía oral una vez al día, con o sin alimentos. Doravirina/lamivudina/tenofovir disoproxil fumarato lleva un recuadro de advertencia relacionado con la exacerbación aguda grave de la hepatitis B en pacientes coinfectados con VIH-1 y virus de la hepatitis B que suspenden lamivudina o tenofovir disoproxil fumarato.

Merck tiene una patente estadounidense que cubre doravirina y doravirina/lamivudina/tenofovir disoproxil fumarato, cuya expiración se prevé en 2031. Las dos formulaciones también recibieron una opinión positiva en la UE en septiembre de 2018 para el tratamiento de la infección por VIH-1 en adultos sin antecedentes o presentan resistencia a los NNRTI o, (en el caso de las tabletas combinadas de dosis fija) a lamivudina o tenofovir disoproxil fumarato y están bajo revisión regulatoria para el tratamiento de la infección por VIH-1 en Canadá.
Fuente: https://link.springer.com/article/10.1007/s40265-018-0993-4
www.gaffel.com.co | 02 G A F F E L N E W S
registros sanitarios Guía para realizar modi caciones
De acuerdo con lo estipulado en el Decreto 334 de 2022 el Invima publicó la guía ASS-RSA-GU82 para realizar modificaciones a los registros sanitarios con impacto en la calidad de medicamentos de síntesis química de acuerdo con el nivel de riesgo.
En el numeral 9.5 se especifican los aspectos a tener en cuenta y los documentos soporte que se deben radicar para solicitar cambios en el proceso manufactura. Para el caso particular de la adición o sustitución del fabricante del principio activo empleado en el producto terminado que se clasifica dentro de un nivel de riesgo menor que requiere notificación de novedad, se debe considerar lo siguiente:
1. No deben presentarse cambios en las especificaciones de calidad.
2. Garantizar que se mantienen las mismas características de las materias primas: estructura, conformación, tamaño y forma de la partícula, el cambio no debe afectar la biodisponibilidad, estabilidad y/o especificaciones del producto terminado.
3. Si se generan cambios en la composición, especificaciones, métodos de análisis u otros, se debe presentar la modificación establecida para cada caso.
4. Presentar estudios de estabilidad natural con el producto terminado en cual se haya empleado materias primas del nuevo proveedor.
5. Los estudios de estabilidad deberán estar en concordancia con guías internacionales.
6. Entiéndase proveedor como fabricante de
las materias primas.
7. Para nuevos proveedores deberá realizarse la calificación acorde al SGC de la compañía.
Los documentos de soporte que se deben presentar son los siguientes:
1. Comparativo de especificaciones del fabricante propuesto y el actualmente aprobado.
2. Especificaciones y certificado de análisis del fabricante propuesto.
3. Informe de análisis y evaluación de riesgos del perfil de impurezas del producto terminado después del cambio según farmacopeas o guías internacionales.
4. Descripción y análisis de datos en tres lotes consecutivos a escala piloto y/ comercial que incluya cuadro comparativo de resultados de controles en proceso.
5. Datos estabilidad natural o acelerada de al menos tres lotes que permitan proyectar y sustentar la vida útil solicitada.
Como proveedor de soluciones, siempre será su aliado estratégico para soportar los procesos de homologación de principios activos que generen valor y representen beneficios para sus procesos internos.
Fuentes: Decreto 334 (ASS-RSA-GU82) GUIA PARA REALIZAR MODIFICACIONES A LOS REGISTROS SANITARIOS CON IMPACTO EN LA CALIDAD DE MEDICAMENTOS SÍNTESIS
www.gaffel.com.co | 03 G A F F E L N E W S
QUÍMICA, GASES MEDICINALES Y RADIOFARMACOS
Somos el Corazón de los Medicamentos

trámites represados en el Invima trámites represados en el Invima


trámites entre el 1 y el 31 de enero de 2024, resultado del avance del plan de trabajo para la atención de trámites represados, como lo ordenó el Tribunal Administrativo de Cundinamarca. Entre el 1 de noviembre de 2023 y el 31 de enero de 2024 van 10.114 trámites evacuados, lo que representa un avance del 38.8%.
Es así que el Invima además de cumplir con el plan de trabajo de evacuación de trámites represados, construye estrategias que permiten transformar los procesos y procedimientos de cara a mejorar la gestión, para ello propone implementa las siguientes acciones:


Creación de la Mesa Técnica Estratégica de Alto nivel.
Mesas Técnicas de Trabajo: donde se tratarán temas como Guías de calidad Decreto 334 de 2022, estudios clínicos, unificación de conceptos salas especializadas, licencia y trámites para cannabis y fitoterapéuticos, Buenas Prácticas de Manufactura para suplementos dietarios y actualizaciones en farmacovigilancia de medicamentos.


Registro Nacional de Expertos de las Salas Especializadas del Invima (RNEI).
Desabastecimiento. En acciones conjuntas


www.gaffel.com.co | G A F F E L N E W S
04


Reportes de avances en la atención Reportes de avances en la atención
con el Ministerio de Salud y Protección Social se verifica de acuerdo con estudio de mercado y seguimiento a los titulares de registro sanitario la necesidad de priorizar los trámites.
En el listado de abastecimiento publicado por el Invima, con corte a 31 de enero de 2024 se relacionan 24 medicamentos desabastecidos y 14 medicamentos en riesgo muy latente de desabastecimiento, cuyos trámites se están gestionando para finalizar a 29 de febrero de 2024. Así mismo, se está realizando monitoreo a 216 medicamentos con el fin de evitar que entren en riesgo de desabastecimiento o se declaren desabastecidos.
En este contexto para el caso del principio activo “misoprostol”, el monitoreo indica que actualmente se cuenta con cuatro (4) registros sanitarios (tres de ellos vigentes, uno temporalmente no comercializado). Dentro del listado de abastecimiento y desabastecimiento de medicamentos publicado en febrero de 2024, se encuentra en monitorización las tabletas de misoprostol 200 µg y tableta vaginal de misoprostol 50 µg ya que se considera están en riesgo de desabastecimiento.
Fuente:
https://www.invima.gov.co/sala-de-prensa/comunicados/reporte-de-avanc e-del-plan-de-trabajo-para-la-atencion-de-tramites-represados-en-el-invim a-de-acuerdo-lo-ordenado-por-el-honorable-tribunal-administrativo-de-cu ndinamarca
www.gaffel.com.co | 05 G A F F E L N E W S
Medicamento con doble propósito
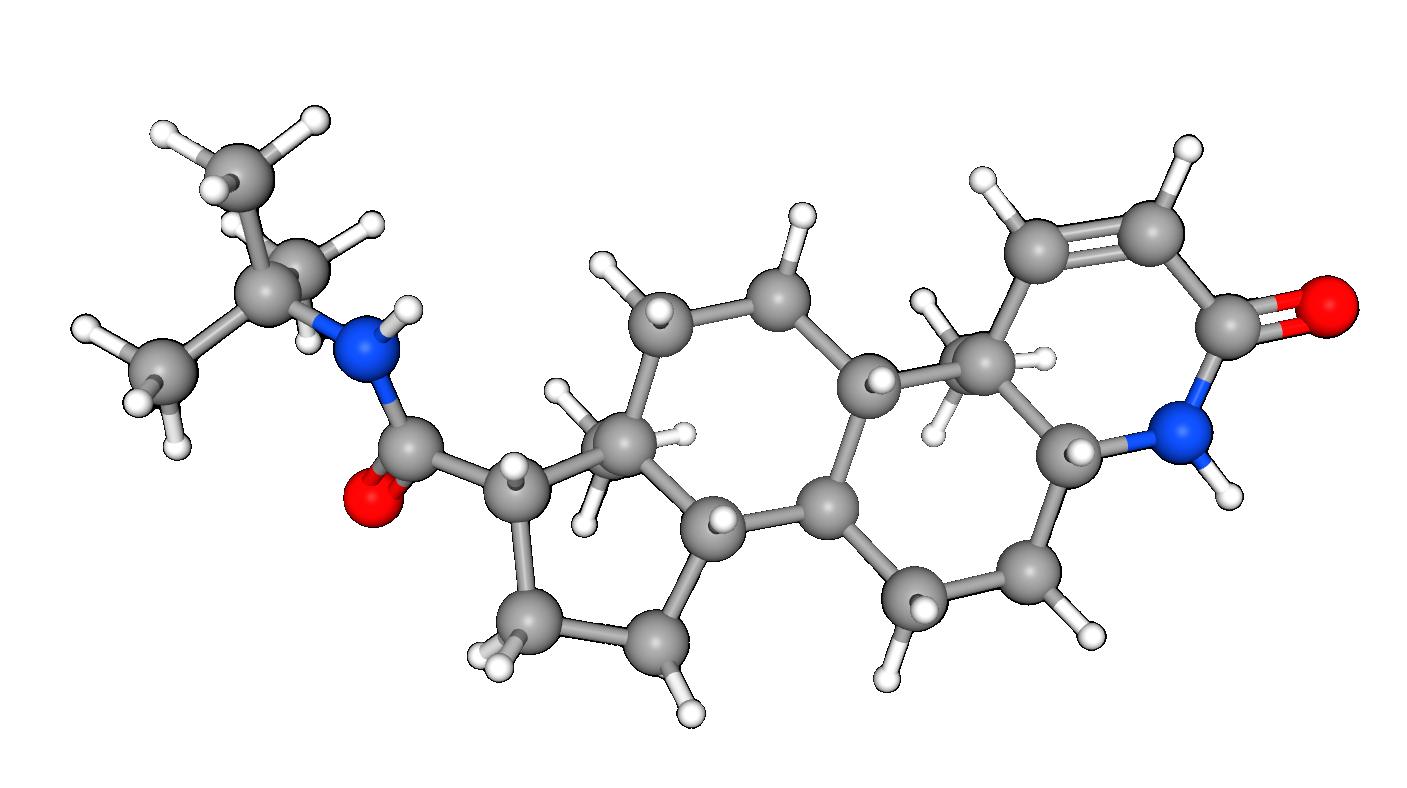
Un estudio de la Universidad de Illinois-Champaign publicado en la revista especializada Journal of Lipid Research, indicó que el fármaco finasterida que se utiliza para la caída del cabello, conocido como Propecia o Proscar, también ayuda a reducir el colesterol y el riesgo general de tener afecciones cardiovasculares.
Los científicos encontraron una relación significativa entre el uso de finasterida y los niveles más bajos de colesterol en un trabajo que relevó a hombres durante 7 años.
Por otra parte, también testearon en ratones y descubrieron retraso de la aterosclerosis y menos inflamación del hígado.

"Un día estaba leyendo sobre este medicamento y comencé a notar que no había muchos estudios a largo plazo sobre sus implicaciones. Al principio, era solo mi propia curiosidad, basada en el hecho de que se sabe que los niveles hormonales aumentan la aterosclerosis, la caída del cabello y los problemas de próstata. Así que decidimos profundizar en ello", explicó el autor.
¿Por qué la finasterida ayuda a evitar los ataques cardíacos?
La finasterida actúa bloqueando una proteína que se encuentra en los folículos pilosos y la glándula prostática que activa la testosterona. El hilo conductor, la testosterona, fue suficiente para despertar el interés del profesor Amengual de la Universidad de Illinois.
Luego de ver los primeros avances, el referente a cargo del trabajo pidió al estudiante de doctorado Donald Molina Chaves observar si el patrón se mantenía en animales. El académico concluyó: "Los ratones que recibieron una dosis alta de finasterida mostraron niveles más bajos de colesterol tanto en el plasma como en las arterias".
www.gaffel.com.co | 06 G A F F E L N E W S Fuente: https://www.edicionesvr.com/notas.php?id=4846
LOS MEDICAMENTOS MÁS ESPERADOS
Este es el top de los 3 lanzamientos de medicamentos que tendrán en vilo a los actores sectoriales y proveedores durante este año. La información fue recopilada por Evaluate:
Medicamento
Xanomeline-Trospium
Fabricante
Karuna Therapeutics
Agonista de los receptores muscarínicos M1/M4 y el primero en su tipo. Esta opción terapéutica, en espera de aprobación, se ha creado como tratamiento para la esquizofrenia, una condición que no cuenta con un único tratamiento en el mercado actual. Según Evaluate, este fármaco es el que tiene el mayor potencial de ventas hasta 2028.
Fabricante ResmiteromMedicamento
Madrigal Pharmaceuticals
Medicamento para tratar una enfermedad hepática. Madrigal ofrece un fármaco para la esteatohepatitis no alcohólica (EHNA). La enfermedad es el resultado de la acumulación de grasa en el hígado y se asocia con enfermedades como la obesidad o ciertos tipos de diabetes.
La esteatohepatitis no alcohólica puede desencadenar daño hepático, producido por fibrosis o cirrosis. Hasta ahora, los fármacos que se han desarrollado para evitar su progresión o erradicarla no han sido exitosos. Para Madrigal Pharmaceuticals, los resultados podrían ser distintos con la evaluación del resmetirom, un agonista de THR-β que tuvo una valoración positiva en diciembre de 2022.
Lilly Fabricante Donanemab Medicamento
Medicamento para el tratamiento del Alzhéimer. Para expertos, es mejor recibido por el mercado en comparación con Aduhelm (Aducanumab de Biogen) y que fue retirado por completo. De acuerdo con datos provistos por Lilly, el uso de donanemab retrasó el deterioro cognitivo en un 35% y tuvo un riesgo 39% menor en el avance de la enfermedad. Sin embargo, en comparación con otros medicamentos, tuvo una tasa más elevada de ARIA, un efecto secundario que tiene un valor reducido en su competencia directa: Leqembi (Lecanemab)
Fuente: https://consultorsalud.com/top-3-de-medicamentos-esperad-2024/

0% 100%

¿Ya te registraste?

SUSCRIBETE
c o r p o r a t i v o @ g a f f e l . c o m . c o G a f f e l M e x i c o G a f f e l C o l o m b i a W W W . G A F F E L . C O M . C O
















