

Je oude smartphone is goud waard
Hoeveel gsm’s of smartphones heb jij thuis liggen?
Hoeveel van deze toestellen worden niet meer gebruikt?

Bekijk de reportage van Koppen op het archief voor onderwijs.
Welke kostbare zuivere stoffen zijn terug te vinden in een toestel?
Markeer de stoffen in het periodiek systeem.
Over welke groep stoffen gaat het?
Waarom is het noodzakelijk om oude toestellen te laten recycleren?
Welke nieuwe voorwerpen kunnen gemaakt worden uit de gerecycleerde stoffen?
Vul het stappenplan van de verwerking aan.
1 2 3 4
Hoeveel ton toestellen hebben ze nodig om 1 kg goud te maken?
Zoek online de actuele waarde op van 1 kg goud.
Wat gebeurt er met het gerecycleerd goud?
In de elektronicawereld zijn grondstoffen duur en zeldzaam. Welke acties ken je om in deze wereld duurzaam om te gaan met grondstoffen?
1 Fysische en chemische verschijnselen

Je leerde in de 1ste graad dat stoffen (materie) zijn opgebouwd uit kleine deeltjes die nog alle fysische en chemische eigenschappen van die stof bevatten.
In deze module ontdekken we dat een chemisch proces de chemische eigenschappen verandert en dat er door een chemisch proces nieuwe stoffen gemaakt worden.
Zeewater
Zeewater heeft een typische smaak en geur. In het zeewater is een verbinding van de stof chloor aanwezig.
Gaat het om een stof of een mengsel? Schrap wat niet past.

NaCl + H2O zeewater (stof/mengsel)
1 scheiden van mengsel

NaCl zout (stof/mengsel)
2 ontbinden van zout

Na natrium (stof/mengsel)

Cl2 chloorgas (stof/mengsel)
3 niet verder ontleedbaar

H2O water (stof/mengsel)
2 ontbinden van water


H2 waterstofgas (stof/mengsel)
fysisch proces
Zeewater wordt gezuiverd.
O2 zuurstofgas (stof/mengsel) chemisch proces
3 niet verder ontleedbaar
Via een fysisch proces wordt het mengsel gescheiden in twee stoffen. De zuivere stof water (H2O) en de zuivere stof zout (NaCl). Vervolgens ondergaan de twee stoffen een chemisch proces waarbij ze omgevormd worden in stoffen die bestaan uit 1 soort atomen.

Fysisch proces
In module 2 hebben we geleerd dat we pas kunnen spreken van een ‘zuivere’ chemische stof als alle verontreinigingen verwijderd zijn. Dit doen we met behulp van scheidingstechnieken. Deze scheidingstechnieken zijn fysische processen waarbij de aard van de zuivere stof hetzelfde is gebleven. Met andere woorden: de chemische en fysische eigenschappen van de bedoelde stof zijn niet veranderd door de stof te zuiveren.
We kennen allemaal de smaak van zout en de fysische eigenschappen van water. Deze eigenschappen zijn samen aanwezig in zoutwater. Als we via een fysisch proces zout en water van elkaar scheiden dan blijven de eigenschappen van zout en de eigenschappen van water behouden.
1.1 Analysereactie
Chemisch proces
De nieuwgevormde stoffen na het chemisch proces hebben totaal andere chemische en fysische eigenschappen als de stof waaruit ze ontstaan zijn.
• NaCl (natriumchloride) is een witte kristallijne stof die goed oplosbaar is in water.
• Na (natrium) is een zilverwit metaal dat zeer hevig reageert met water.
• Cl2 (chloorgas) is een licht geel/groen giftig gas met sterke geur.
Na het chemisch proces is zoutwater ontleed tot de kleinste bestanddelen.
De kleinste of enkelvoudige bestanddelen die nog alle chemische en fysische eigenschappen van een stof bevatten noemt men atomen.






Elk atoom krijgt een ander kleur in het molecuulmodel.
Welke verschillende atomen herken je in het schema?
Een fysisch proces is een proces waarbij een mengsel gezuiverd wordt zodat de bestanddelen van het mengsel afzonderlijk overblijven. Je kan de oorspronkelijke stoffen terugbekomen door het omgekeerde proces toe te passen.
Een chemisch proces (chemische reactie) is een proces waarbij de oorspronkelijke stof na het proces niet meer terug te vinden is. De oorspronkelijke stof is ontbonden in andere stoffen met andere chemische en fysische eigenschappen.
Een chemische reactie waarbij een samengestelde stof omgezet wordt in meerdere enkelvoudige stoffen is een analyse of ontledingsreactie.
AB → A + B
Het ontleden onder invloed van warmte noemen we thermolyse.
Het ontleden onder invloed van licht noemen we fotolyse
WIST-JE-DAT
Het ontleden onder invloed van elektrische stroom noemen we elektrolyse. Suiker krijgt bij hevig verwarmen een bruine kleur. Verwarm je suiker nog verder, dan verkrijg je pure koolstof.
Met behulp van licht kun je zilverchloride omzetten in zilver en chloorgas.
Elektrolyse
Het ontbinden van water in twee stoffen gebeurt in een daarvoor speciaal ontworpen toestel, het toestel van Hoffman. Er ontstaan twee gassen waarbij er dubbel zoveel waterstofgas wordt gevormd als zuurstofgas. Op
Aan de negatieve pool wordt waterstofgas (H2) gevormd.






Aan de positieve pool wordt zuurstofgas (O2) gevormd.
Uit twee deeltjes water (samengestelde stof) worden 2 deeltjes waterstofgas (wit) gevormd en 1 deeltje zuurstofgas (rood). Dit zijn enkelvoudige stoffen
Door elektrolyse van water kunnen we waterstofgas en zuurstofgas scheiden. Voor de productie van groene waterstof hebben we elektrische energie nodig. Deze elektrische energie is nodig voor de elektrolyse van water. Als energiebron gebruiken we wind- en zonneenergie. Het geproduceerde waterstofgas kan na productie gebruikt worden als brandstof voor zwaar vrachtvervoer. We spreken over ‘groene’ waterstof omdat de energie voor de ontleding van water een milieuvriendelijke energiebron is.
1.2 Verklaring
Uit het voorbeeld van zeewater weten we dat er een onderscheid kan gemaakt worden tussen stoffen. Enerzijds zijn er stoffen die bestaan uit verschillende deeltjes (atomen): de samengestelde stoffen. Anderzijds zijn er stoffen die bestaan uit één soort deeltjes: de enkelvoudige stoffen
Het verschil tussen beide soorten stoffen kan je verklaren aan de hand van het deeltjesmodel Stoffen zijn opgebouwd uit moleculen. Dit zijn microscopisch kleine deeltjes met een grootteorde van 1 nm (een miljardste deel van een meter). Moleculen zijn zelf ook opgebouwd uit nog kleinere deeltjes die chemisch aan elkaar verbonden zijn. Deze allerkleinste deeltjes noemen we atomen. De grotere deeltjes noemen we moleculen. Zodra er minstens twee atomen aan elkaar verbonden zijn, spreken we van een molecule.
Bij de elektrolyse van water worden 2 moleculen water chemisch omgevormd in 2 moleculen waterstofgas en 1 molecule zuurstofgas. De molecule zuurstofgas bestaat uit 2 zuurstofatomen.
2 H2O → 2 H2 + O2
SS ES ES
De chemische reactie geeft aan dat water een samengestelde stof is. De watermolecule bestaat uit 2 soorten atomen. Waterstofgas en zuurstofgas zijn enkelvoudige stoffen: ze bestaan uit 1 soort atomen. Alle stoffen bestaan uit atomen. Je kunt stellen dat atomen de kleinste deeltjes zijn waaruit alle materie is opgebouwd.
Stoffen die bestaan uit meerdere soorten atomen zijn samengestelde stoffen (SS).
Dit zijn stoffen die verder ontleed kunnen worden.
Stoffen die bestaan uit 1 atoomsoort zijn enkelvoudige stoffen (ES). Dit zijn stoffen die niet verder ontleed kunnen worden.
2 Begrijp jij de chemische taal?
2.1 Chemische symbolen
Zoek op Wikipedia naar informatie over goud. Zowel in het Nederlands, Italiaans als in het Engels.
Vaststelling:
De naam is in elk taal
Het symbool voor goud is in alle talen identiek.
Zoek de naam van de gegeven elementen in volgende talen op.
NEDERLANDS stikstof zwavel waterstof ijzer koolstof
FRANS
ENGELS
We schrijven in chemie de symbolen voor chemische elementen in een universele symbolentaal.
Zo wordt in iedere taal het element ‘koolstof’ aangeduid met C, terwijl N staat voor het element stikstof.
Het symbool voor sommige elementen bestaat uit 1 letter: H, O, N, S ...
Het symbool voor andere elementen bestaat uit 2 letters: Au, Pt, Cu, Fe …
Als het symbool van een chemisch element bestaat uit 2 letters, dan is de eerste letter altijd een hoofdletter en de tweede letter een kleine letter.
Vb. goud: Au en niet AU of au
We maakten al kennis met enkele elementen en hun symbolen. Om de chemische taal beter te begrijpen, leer je best de symbolen van de elementen op de volgende pagina uit het hoofd.
ijzer (ferrum)
koper
zink
tin (stannum)
lood
cadmium
zilver (argentum)
goud (aurum)
METALEN
NIET-METALEN
Fe zuurstof (oxygenium) O
Cu stikstof (nitrogenium) N
Zn waterstof (hydrogenium) H
Sn zwavel (sulfur) S
Pb koolstof (carboneum) C
Cd fosfor (phosphorus) P
Ag jood (Iodium) I
Au silicium Si
platina Pt boor (borium) B
nikkel
Ni arseen (arsenicum) As
kobalt Co fluor F
kwik (hydragyrum)
Hg chloor Cl
aluminium Al broom Br
chroom Cr
mangaan Mn
calcium Ca helium He
barium Ba neon Ne
lithium Li argon Ar
natrium Na krypton Kr
kalium K xenon Xe
uraan (uranium) U radon Rn
Oefen de elementen en hun symbolen in en verbeter jouw score.
Je kent de volgende moleculen al: H2O, H2, O2, Cl2 en NaCl. Welke atomen zijn in deze stoffen met elkaar gebonden? Noteer ook steeds of de molecule een enkelvoudige stof (ES) of samengestelde stof (SS) is.
MOLECULE





IS OPGEBOUW UIT …
ES
SS
2.2 Chemische modellen
Je kan moleculen voorstellen aan de hand van molecuulmodellen. In deze modellen zijn de atomen voorgesteld door ‘bolletjes’ met een bepaalde kleur. De kleuren zijn universeel bepaald.
ELEMENT KLEURCODE
waterstof (H) wit
koolstof (C) zwart
zuurstof (O) rood
stikstof (N) blauw
chloor (Cl) groen
broom (Br) roodbruin
jood (I) paars
zwavel (S) geel
fosfor (P) oranje
Een molecuulmodel is een sterk vergrote 3D-voorstelling van een molecule. Deze voorstelling kan vervaardigd worden in verschillende materialen zoals plastic, metaal, hout of glas. Je kan molecuulmodellen ook digitaal voorstellen door gebruik te maken van een tekenapplet.
H2O H2 O2 Cl2 NaClWelke molecuulvoorstelling hoort bij water, ammoniak, propaan, alcohol, suiker (sugar)?
Maak gebruik van de applet ‘Molview’. Kies bij model voor ‘Ball and Stick’ en bij Engine ‘ChemDoodle’.





2.2.1 Molecuulmodellen in 3D
Een molecule kan via een 3D model op drie verschillende manieren voorgesteld worden:
• het bolstaafmodel,
• het bolkapmodel,
• het staafmodel.
Hier zie je de molecule butaan C4H10.



bolstaafmodel bolkapmodel staafmodel
Bolstaafmodel
Een bolstaafmodel is een driedimensionale voorstelling van een molecule. De atomen zijn voorgesteld door bollen die aan elkaar verbonden zijn via staafjes (= de bindingen tussen de atomen).




 O2 dizuurstof (zuurstofgas)
H2O water
CO2 koolstofdioxide
NH3 ammoniakgas
C2H6O ethanol
O2 dizuurstof (zuurstofgas)
H2O water
CO2 koolstofdioxide
NH3 ammoniakgas
C2H6O ethanol
Bolkapmodel
Een bolkapmodel is eveneens een driedimensionale voorstelling van de molecule. De staafjes, bindingen tussen de atomen, zijn verdwenen. De bollen, atomen, zitten gedeeltelijk in mekaar en je ziet alleen de bolkappen van de atomen, vandaar de benaming.






Staafmodel
Een 3D-staafmodel is de meest vereenvoudigde manier om een molecule in een model weer te geven. De bollen voor de atomen worden niet getekend, alleen de verbindingen tussen de atomen worden ruimtelijk weergegeven met behulp van staafjes.
Deze voorstelling wordt meestal gebruikt om grote complexe moleculen, die bestaan uit meerdere atomen, voor te stellen.

geranylacetaat (CH3COOC10H17)
geurstof in rozenolie

paracetamol (C8H9NO2)
actieve stof als pijnstiller in dalfalgan
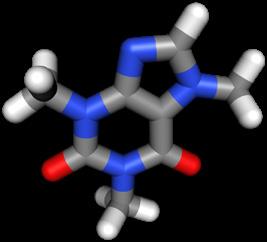
cafeïne (C8H10N4O2)
de actieve stof in koffie
water (H2O) methaan (CH4) etheen (C2H4) koolstofdioxide (CO2) ammoniakgas (NH3) zwaveltrioxide (SO3)WIST-JE-DAT
Schakelmoleculen catenaan en olympiadaan.

Een groep complexe moleculen zijn catenanen: ze hebben een moleculaire structuur die bestaat uit twee of meer ringen (rode en blauwe) die in mekaar haken zoals schakels van een ketting. De naam van de stof is afgeleid van het latijnse woord catena = ketting.
Olympiadaan, behoort tot de groep catenanen, is een molecule waarin 5 ringen (bestaande uit hoofdzakelijk koolstofatomen) in elkaar gehaakt zijn. De formule is C228H236F72N12O30P12.
De onderstaande voorstelling is een skeletstructuur en geen moleculevoorstelling.
De naam van deze stof verwijst naar de olympische vlag die bestaat uit 5 in elkaar gehaakt ringen.

2.2.2 Moleculen in 2D
Moleculen kunnen ook in een vlakke, tweedimensionale voorstelling weergegeven worden. Het is een tekening van de molecule waarbij men de atomen die tot de molecule behoren, voorstelt door cirkels die elkaar raken.
Vervolledig de tabel.
BOLVOORSTELLING
SAMENGESTELDE STOF (SS) OF ENKELVOUDIGE STOF (ES)
AANTAL MOLECULEN AANTAL ATOMEN PER MOLECULE TOTAAL AANTAL ATOMEN3 Enkelvoudige stoffen
In het heelal en op de aarde zijn er slechts een 90–tal elementen op een natuurlijke manier ontstaan. Ze vormen de basis van de lucht, oceanen, aarde, planeten, gesteenten, sterren, levende wezens … Alle andere elementen zijn op een kunstmatige manier door de mens gemaakt met behulp van kernreacties.
Een enkelvoudige zuivere stof of enkelvoudige stof is een zuivere stof, waarin slecht één element voorkomt. Het zijn dus stoffen die zijn opgebouwd uit één soort atomen. Op basis van hun eigenschappen kunnen we drie categorieën van enkelvoudige stoffen onderscheiden: metalen, niet-metalen en edelgassen. De verschillende elementen kan je terugvinden in het Periodiek Systeem der Elementen (PSE).

In module 5 zal je dieper ingaan op de rangschikking van alle elementen in het PSE (periodiek systeem). Alle elementen die bestaan, worden in het PSE gerangschikt op een welbepaalde manier. Deze rangschikking leidt ertoe dat je alle natuurlijke elementen kan onderverdelen in drie grote groepen: de metalen, de niet-metalen en de edelgassen. Deze indeling is niet toevallig maar is gebaseerd op de chemische eigenschappen van deze elementen. Elementen die tot eenzelfde groep behoren hebben analoge eigenschappen. Dit wordt verder besproken in thema 5.
Het element nr 92 (= uranium) is het laatste natuurlijk ontstane element. Alle elementen vanaf 93 tot nr 118 zijn op een kunstmatige manier, via kernreacties, ontstaan. Deze groep noemt men de transuraanelementen.
3.1 Metalen
Alle metalen komen bij kamertemperatuur voor in vaste vorm, behalve kwik dat vloeibaar is. Ze komen in vaste toestand voor in roosters (thema 6) waar ze in chemische reactievergelijkingen monoatomisch worden voorgesteld. Dit betekent dat de metalen als één atoom worden genoteerd. ‘Mono’ komt van het Latijn en betekent één.


Het symbool Cu heeft verschillende betekenissen. Het kan betekenen: het element koper, 1 atoom koper, de stof koper of kopermetaal.
Het symbool Fe heeft verschillende betekenissen: de stof ijzer: ijzer wordt gebruikt in metaalconstructies omdat het zware lasten kan dragen, een aantal atomen ijzer: ijzer reageert met zuurstofgas en zo ontstaat roest, een atoom ijzer: ijzer verbindt zich met een zuurstofatoom tot ijzeroxide.
3.1.1 Metalen in legeringen
In het dagelijks leven worden metalen zelden als zuiver metaal gebruikt. Meestal gebruikt men mengsels van verschillende metalen, beter gekend als legeringen. Soms bevatten deze legeringen ook niet-metalen. In legeringen ontstaan nieuwe stofeigenschappen die niet gelden voor de afzonderlijke elementen.
Enkele gekende legeringen uit het dagelijks leven:
• Brons: een legering van koper en tin. Het wordt gebruikt door kunstenaars om beelden in te gieten omdat het door inwerking van het weer een groen patina krijgt.
• Euromunten: 1 en 2 euro bestaan uit een zilverkleurig gedeelte, legering van 75% Cu en 25% Ni, alsook een goudkleurig gedeelte, legering van 75% Cu, 20% Zn en weinig Ni.
• Legering van ijzer:
- smeedijzer is een legering van ijzer en koolstof (0,2% tot 0,6%),
- gietijzer is een legering van ijzer en koolstof (2,885 tot 6.7 %),
- inox: roestvrij staal bevat naast ijzer ook 18% chroom en 8% nikkel.
• Goud 18 karaat dat gebruikt wordt in sieraden is een legering waarin goud aanwezig is en nog een ander edelmetaal (Ag, Pd).
• Messing is een legering van koper en zink.




bronzen beeld gietijzeren pan euromunten messing -T-stuk
Een legering is een homogeen mengsel, verkregen door het versmelten van metalen.
Het mengsel krijgt nieuwe eigenschappen die de afzonderlijke metalen niet hebben.

In module 2 leerde je dat een legering een homogeen mengsel was van verschillende metalen.
In deze module leer je dat een legering de eigenschappen van de metalen verandert.
Deze voorbeelden geven aan dat classificatie in de chemie niet altijd eenduidig en eenvoudig is. Legeringen kan je enerzijds indelen bij de homogene mengsels en anderzijds bij de heterogene mengsels want de oorspronkelijke eigenschappen blijven niet behouden.
3.1.2 Metalen in het dagelijks leven
De metalen hebben heel wat toepassingen in het dagelijks leven. Weet jij waarvoor ze gebruikt worden?
Kom meer te weten over de metalen met behulp van de QR-code. Ga voor ieder onderstaand metaal op zoek naar een toepassing als enkelvoudige stof en een mogelijke toepassing als samengestelde stof.
Klik het metaal aan. Er verschijnt een korte samenvatting.







3.2 Niet-metalen
Een aantal niet-metalen komen in de natuur monatomisch voor, zoals de elementen (S) en fosfor (P). Er zijn ook niet-metalen die als enkelvoudige stof voorkomen in de vorm van een molecule opgebouwd uit meerdere identieke atomen. Ze zijn polyatomisch. ‘Poly’ komt van het Latijn en betekent ‘veel’.
3.2.1 Niet-metalen in het dagelijks leven
De niet-metalen hebben heel wat toepassingen in het dagelijks leven.
Waarvoor worden volgende niet-metalen gebruikt? Scan de QR-code.
Som minimum 2 toepassingen op.







Het gebruik van belangrijke (niet-)metalen in samengestelde stoffen wordt uitvoerig behandeld in het 4de jaar.
WIST-JE-DAT
Zuurstof is het meest voorkomende element op aarde. In onder andere de atmosfeer, aardlagen en oceanen komt heel wat zuurstof voor. Het maakt ongeveer de helft (in massa-%) van de aardkorst uit.
Steenkool, aardgas, aardolieproducten, rubber, koolhydraten, eiwitten, vetten... zijn allemaal producten die uit de aardbodem of uit levende wezens gehaald worden. In de chemische indeling van de stoffen gaat men deze groep van moleculen in een afzonderlijke verzameling onderbrengen: de koolstofverbindingen Koolstofverbindingen zijn de grondstoffen voor plastiek of kunststoffen. Meer hierover in het 4de jaar.
Ga online op zoek naar ‘de Hindenburgramp’ in 1937.
Wat was de Hindenburg?
Naar wie was dit voorwerp genoemd?


Welke stof werd origineel gebruikt en waarom?
Wat veroorzaakte de ramp?
3.3 Edelgassen
Een afzonderlijke groep zijn de 6 (7) edelgassen. Ze reageren niet met andere stoffen. Het zijn inerte gassen die bestaan uit losse atomen. Ze komen als 1 atoom voor en zijn dus monoatomisch. Zoals bij metalen draagt de stof de naam van het element.
Het symbool Ar heeft dus verschillende betekenissen. Het kan:
• het element argon betekenen,
• 1 atoom argon betekenen,
• de stof (edelgas) argon betekenen,
Ook hier is de context om te begrijpen wat er bedoeld wordt belangrijk.

De 6 gekende edelgassen zijn: helium, neon, argon, krypton, xenon en radon. Het laatste kunstmatig gemaakte element en het zwaarste van allemaal: oganesson. Het heeft atoomnummer 118 en bevindt zich helemaal rechts onderaan in het PSE. Het staat in de groep van de edelgassen en wordt voorlopig onder deze groep gerangschikt.
3.3.1 Edelgassen in het dagelijks leven
De Edelgassen hebben ook heel wat toepassingen in het dagelijks leven.
Waarvoor worden volgende edelgassen gebruikt? Scan de QR-code. Som minimum 2 toepassingen op.






WIST-JE-DAT
In juni 2016 heeft de IUPAC de naam ‘oganesson’ aanvaard voor het voorlopig laatste, nieuw gecreëerde element met behulp van een kernreactie. In de naam wordt de nog levende RussischeArmeense wetenschapper Joeri Oganesjan geëerd. Dit element krijgt de uitgang -on naar analogie met de namen van de edelgassen in de groep 18, groep VIII, van het periodiek systeem.
De International Union of Pure and Applied Chemistry is de wereldautoriteit voor chemische naamgeving van atomen en moleculen, klassering van elementen in het periodiek systeem, standaardisering van wetenschappelijke metingen en bepalen van atoommassa’s. Dankzij de inspanningen van IUPAC is er wereldwijd een gestandaardiseerde manier voor systematische naamgeving van moleculen.
3.4 Naamgeving
3.4.1 Index
Metalen komen in de natuur voor in metaalroosters (zie 4de jaar). In reactievergelijkingen stellen we ze monoatomisch voor. Ook de elementen S (zwavel), P (fosfor) worden in reactievergelijkingen altijd monoatomisch voorgesteld, tenzij expliciet anders vermeld wordt. Een ander deel van de niet-metalen komt als enkelvoudige stof voor als een molecule bestaande uit meerdere atomen. Ze zijn polyatomisch en de enkelvoudige stoffen zijn moleculen.
De wetenschappelijk naam van een molecule, systematische naam, wordt gevormd door gebruik te maken van een Grieks voorvoegsel Het Griekse voorvoegsel verwijst naar het indexgetal. In de naam van de stof wordt dit indexgetal voor de naam van het element geschreven.
1 mono 5 penta 9 nona
2 di 6 hexa 10 deca
3 tri 7 hepta
4 tetra 8 octa
Sommige enkelvoudige stoffen bestaan uit meerdere atomen en komen voor als een molecule. Het aantal atomen waaruit de molecule is opgebouwd, wordt in de chemische formule aangeduid met een index. Dit getal, rechtsonder het symbool, duidt aan uit hoeveel atomen een molecule is opgebouwd.
Naam enkelvoudige stof = Grieks voorvoegsel (zie index) + naam element.
chemische formule
H2
symbool chemisch element index
systematische naam diwaterstof
Bv. Naast een systematische naam heeft een enkelvoudige stof ook een triviale naam. De triviale naam of gebruiksnaam is de naam die de stof in de loop van de geschiedenis gekregen heeft. Vaak is dit naar aanleiding van een bepaalde toepassing.
Vb. H2 met gebruiksnaam waterstofgas
Index 1 noteer je niet.
Grieks voorvoegsel
De triviale naam legt geen enkel verband met de chemische formule van de stof. Je moet de gebruiksnamen dus best memoriseren.
Vul de systematische naam aan.
FORMULE SYSTEMATISCHE NAAM
GEBRUIKSNAAM (TRIVIALE NAAM)
H2 diwaterstof waterstofgas
N2 stikstofgas
O2 zuurstofgas
O3 ozon
F2 fluorgas
Cl2 chloorgas
Br2 broomgas
I2 moleculair jood
P4 witte fosfor
S8 octazwavel
3.4.2 Coëfficiënt
Als we meerdere moleculen van eenzelfde soort stof willen voorstellen dan schrijven we dat met behulp van een (Arabisch) cijfer voor de formule. Dit voorgetal noemen we een coëfficiënt
Voorbeeld: 3 N2



Betekenis: 3 moleculen distikstof, elk bestaande uit 2 atomen stikstof. Totaal aantal atomen: 6
Vervolledig het kader.


Keer terug naar pagina 11 om de kleurcode van de elementen in een 3D-weergave op te zoeken.
3D-VOORSTELLING FORMULE BETEKENIS AANTAL ATOMEN4 Samengestelde stoffen
4.1 Formulevorming en naamgeving
Enkelvoudige stoffen (ES) zijn stoffen die bestaan uit één atoomsoort. Sommige enkelvoudige stoffen komen monoatomisch (één atoom) voor, andere polyatomisch.
Vb. monoatomisch ES: P (= fosfor) → één fosforatoom polyatomisch ES: P4 (= tetrafosfor) → vier fosforatomen

Samengestelde stoffen (SS) zijn moleculen die bestaan uit meer dan één atoomsoort.
De chemische formules van samengestelde stoffen bevatten indices, om aan te geven hoeveel atomen er per atoomsoort aanwezig zijn in één molecule.
Vb. SS: Al2O3 (= dialuminiumtrioxide) → de molecule bestaat uit twee aluminiumatomen en drie zuurstofatomen

Som de gelijkenissen en de verschillen op tussen volgende moleculen.
GELIJKENISSEN
VERSCHILLEN
In de formule wordt soms ook weergegeven hoe bepaalde atomen groeperen in de molecule en subgroepen vormen. Deze subgroepen worden in de formule tussen haakjes geschreven.
voorbeeld: Al(OH)3

Het aluminiumatoom, of beter gezegd aluminiumion, zit centraal in de molecule en is omgeven door drie subgroepen die elk bestaan uit een -OH groep.
Je kan als formule voor deze stof ook schrijven: AlO3H3
Werken met subgroepen geeft meer informatie over de stof en de stofeigenschappen. Daarom dat de formule met de subgroepen meer gebruikelijk is. Meer hierover in het 4de jaar.
Een samengestelde stof wordt voorgesteld met behulp van een chemische formule
Voor gekende eenvoudige chemische formules gebruiken we de brutoformule: deze geeft aan hoeveel atomen van elke soort in de molecule voorkomen. We schrijven de symbolen van de elementen die in de stof voorkomen na mekaar, de volgorde van de elementen heeft geen belang: water H2O, OH2, HOH, OHH, HHO al deze formules zijn goed men gebruikt meestal H2O (conventie).
De formule wordt zo kort mogelijk geschreven door gebruik te maken van een index (uit het latijn indicare = aanwijzen).
De coëfficiënt geeft aan hoeveel moleculen aanwezig zijn.
Subgroepen worden tussen haakjes geplaatst.
Vb
4 Ba(OH)2
coëfficiënt subgroep index
Tellen van het aantal atomen in een molecule doe je als volgt:
1 Tel het aantal atomen van elk element.
2 Is er een subgroep? Vermenigvuldig het aantal atomen in de subgroep met het indexgetal.
3 Vermenigvuldig de som van het aantal atomen met de coëfficiënt.
Vb. 3 Al2(SO4)3
3
Vervolledig de tabel.
51
STOF AANTAL MOLECULEN
Mg(NO3)2
4 Al2O3
AANTAL SOORTEN SUBGROEPEN
WELKE SUBGROEP?
TOTAAL AANTAL ATOMEN
x (2 + ((1 + 4) x 3)) =5 Verder oefenen
Fysische
en chemische verschijnselen
Hieronder wordt suikerwater afgebeeld.
Duid aan of het gaat om een stof of mengsel.
Duid met een accolade aan waar het gaat om een fysisch proces of een chemisch proces.
suikerwater




Koolstof
Water
/

Zuurstofgas


Waterstofgas






Zet een kruisje als het gaat om een fysisch proces of chemische proces.
VERSCHIJNSEL
Koken van water.
Koken van een ei.
Verwijderen van een inktvlek met een inktgom.
Verwijderen van een inktvlek met tintenkiller.
Opzuigen van water met een rietje.
Malen van graankorrels tot meel.
Afbranden van verf.
Roesten van ijzer.
Rotten van fruit.
Drogen van linnen aan de wasdraad.
Bakken van brood.
Smelten van ijs.
Roosteren van vlees.
Glas maken met zand, soda en krijt.
Alcohol maken bij de productie van bier en wijn.
Reukstoffen halen uit bloemen.
Drinkwater tappen uit bronnen.
Suiker halen uit suikerriet.
Ijzer halen uit ijzererts.
Plastiek maken met aardolie.
In het Midden-Oosten wordt drinkwater gemaakt uit zeewater door ontzilting. Dit proces is echter zeer milieuvervuilend. Is er hier sprake van een fysisch of chemisch proces?
FYSISCH CHEMISCH

Begrijp jij de chemische taal?
Zoek het chemisch symbool van de volgende elementen.
NAAM SYMBOOL NAAM SYMBOOL NAAM SYMBOOL silicium fosfor mangaan
aluminium zuurstof helium broom chloor neon koper zwavel calcium zilver goud jood
Vul het symbool of de naam van het chemisch element in.
NAAM SYMBOOL NAAM SYMBOOL NAAM SYMBOOL barium
Zoek volgende elementen op in het periodiek systeem.
NAAM SYMBOOL polonium W antimoon Ti
BOLKAP-MODEL AANTAL ATOMEN PER MOLECULE







TOTAAL AANTAL ATOMEN AANTAL MOLECULEN

SAMENGESTELDE STOF (SS) OF ENKELVOUDIGE STOF (ES)
I told a chemistry joke

there was NO reaction
Vervolledig de tabel. Welke elementen zitten verstopt in de uitspraken van chemistry cat? OMgmy name is


He is a real CuTe
In het periodiek systeem zijn er elementen die vernoemd zijn naar de plaats waar ze zijn ontdekt of naar een bekend wetenschappelijk persoon. Ga op zoek in de tabel naar deze elementen.
FeLiNeSuikerwater bestaat uit tafelsuiker (C12H22O11) en water.




Hoeveel moleculen water zijn hier afgebeeld?
Hoeveel moleculen tafelsuiker zijn hier afgebeeld?
Hoeveel waterstofatomen staan hier afgebeeld?
Hoeveel atomen worden hier in totaal afgebeeld?
Marie Curie heeft twee radioactieve elementen ontdekt?
Zoek deze elementen op in het periodiek systeem met hun symbolen.




Enkelvoudige stoffen
Rangschik volgende enkelvoudige stoffen in de juiste categorie. Vermeld achter ieder element de systematische naam.
Au, B, Cl, Xe, Pt, H, Mg, Na, He, Ne, I, C, Ar, K, Al
13
Verbind de toepassing met het bijhorende element. Kleur metalen in het rood, niet-metalen in het blauw en edelgassen in het groen.
Gas in ballonnen. K
Tracer in geneeskunde. Xe
Wapening voor beton. He
Bereiding van ozon. O
Absorberen van neutronen bij de bestraling van diverse vormen van kanker in de experimentele radiotherapie.
Ouderdomsbepaling van mineralen.
Ar
Fe
Controle van de echtheid van bankbiljetten. B
Vloeistof in oude thermometers. Hg
Samengestelde stoffen
14 stoffen
15
Plaats volgende stoffen onder de juiste categorie. O2, He, NaCl, KOH, CO2, H2, NH3, N2, H2O, Cl2, Xe, CH4
samengesteld enkelvoudig
Geef de brutoformule van de onderstaande moleculen (bolkapmodel/ bolstaafmodel).

Ethanol, alchohol aanwezig in bier en wijn.


Butaangas, brandstof te koop in gasflessen.


Komt voor in uitlaatgassen van auto's die benzine als brandstof gebruiken.
 Het gas dat we nodig hebben om te leven.
Veelvuldig gebruikt oplosmiddel.
Het gas dat we uitademen.
Het gas dat we nodig hebben om te leven.
Veelvuldig gebruikt oplosmiddel.
Het gas dat we uitademen.
Bekijk de 2D-afbeeldingen van onderstaande moleculen. Beantwoord de vragen in de tabel.
H H H H C
aantal atomen C aantal atomen H
totaal aantal moleculen
CH4 samengesteld of enkelvoudige stof
aantal atomen C
aantal atomen O
totaal aantal moleculen
2 CO2 samengesteld of enkelvoudige stof
H H H N H aantal atomen H aantal atomen N
H H N H H H N
totaal aantal moleculen
3 NH3 samengesteld of enkelvoudige stof
aantal atomen H
H Cl H Cl
H Cl H Cl
aantal atomen Cl
totaal aantal moleculen
4 HCl samengesteld of enkelvoudige stof
Vervolledig de tabel.
Vervolledig het schema door te kiezen uit volgende begrippen: metaal, legering, enkelvoudige stof, materie, homogeen mengsel, heterogeen mengsel, mengsel, zuiver stof, samengestelde stof.
koperen theepot bakpoeder thee vijgen 19
Malachiet is een mineraal dat als edelsteen wordt gebruikt.
Het wordt gebruikt bij sieraden.
- het aantal waterstofatomen 18
Het heeft als chemische formule is Cu2CO3(OH)2.
Het wordt in de natuur veelal samen gevonden met
het verwante mineraal azuriet met chemische formule
Cu3(CO3)2(OH)2
Geef voor elk mineraal:
- totaal aantal atomen
- het aantal zuurstofatomen
- het aantal koolstofatomen
- het aantal koperatomen

Recyclagepark: een bron aan stoffen
In een recyclagepark ligt een bron aan stoffen die opnieuw kan gebruikt worden. Ga met de klas op bezoek in een recyclagepark.
ORIËNTATIE
ONDERZOEKSVRAAG
Welke stoffen kunnen hergebruikt worden na recyclage?
HYPOTHESE
VOORBEREIDING
Notitieblok
Schrijfmateriaal
UITVOERING
WAARNEMING
Plaats in de tabel hoe materialen worden gesorteerd en welke elementen we eruit kunnen halen om opnieuw te gebruiken.
REFLECTIE
BESLUIT
Geef een antwoord op de onderzoeksvraag.
Welke aanpassingen zouden aan een recyclagepark kunnen gemaakt worden om zoveel mogelijk stoffen opnieuw te kunnen gebruiken?
STUDIEWIJZER
ik kan het!
Het onderscheid tussen een fysische en chemische reactie voorwoorden en herkennen.
Het verschil opsommen tussen een analysereactie met licht, warmte en elektriciteit.
Chemische elementen met naam en symbool terugvinden in het periodiek systeem.
De chemische elementen met symbool kennen.
De molecuulmodellen: bolstaaf-, bolkap- en staafmodel herkennen.
Het verschil tussen metalen, niet-metalen en edelgassen verwoorden en aanduiden in het periodiek systeem.
Toepassingen opsommen van metalen, niet-metalen en edelgassen uit het dagelijks leven.
De naam kunnen geven van een enkelvoudige stof.
Aan de hand van een molecuulmodel het aantal verschillende atomen bepalen.
Aan de hand van een chemische formule het aantal atomen en moleculen bepalen met behulp van de index en de coëfficiënt.
paginanummer
5-8
7
9-10
10
12-13
15-20
17-20
21-22
23-24
23-24
Colofon
Auteurs Ann Gilis – Noortje Duysters
Eerste druk 2024
SO 2024/0037
Bestelnummer 65 900 0910 (module 3 van 6)
ISBN 978 90 4865 005 7
KB D/2024/0147/246
NUR 126
Thema YPMP3
Verantwoordelijke uitgever die Keure, Kleine Pathoekeweg 3, 8000 Brugge
RPR 0405 108 325 - © die Keure, Brugge
Die Keure wil het milieu beschermen. Daarom kiezen wij bewust voor papier dat het keurmerk van de Forest Stewardship Council® (FSC®) draagt. Dit product is gemaakt van materiaal afkomstig uit goed beheerde, FSC®-gecertificeerde bossen en andere gecontroleerde bronnen.
