MEDLEMSBLAD FOR NORSK ONKOLOGISK FORENING // ÅRGANG 23
Dødshjelp: ønskedrøm og virkelighet
IMPACT-studien
49

Rekruttering til onkologien, fra en tillitsvalgts perspektiv
Fokus på munnhelse og kreft

MEDLEMSBLAD FOR NORSK ONKOLOGISK FORENING // ÅRGANG 23
Dødshjelp: ønskedrøm og virkelighet
IMPACT-studien
49

Rekruttering til onkologien, fra en tillitsvalgts perspektiv
Fokus på munnhelse og kreft

For behandling av voksne pasienter med fremskreden hormonsensitiv prostatakreft2
ADT= Androgen Deprivation Therapy
*Behandling av avansert hormonavhengig prostatakreft. Refusjonskoder: ICPC Y77: Ondartet svulst i prostata. ICD C61 Ondartet svulst i blærehalskjertel. Vilkår 9: Behandlingen skal være instituert i sykehus, sykehuspoliklinikk eller av spesialist i vedkommende disiplin.


Referanser: 1. Shore ND, et al. N Engl J Med. 2020;382(4):2187–2196. 2. Preparatomtale Orgovyx (relugoliks), seksjon 4.1 og 5.1. www.felleskatalogen.no.
Dette legemidlet er underlagt særlig overvåking. Orgovyx (relugoliks) 120 mg filmdrasjerte tabletter, ATC-nr.: L02BX04, Reseptgruppe: C. Reseptbelagt. Indikasjon: Behandling av voksne pasienter med fremskreden hormonsensitiv prostatakreft. Dosering og administrasjonsmåte: Behandling med Orgovyx skal startes og overvåkes av spesialleger med erfaring innen medisinsk behandling av prostatakreft. Behandling med Orgovyx skal innledes med en startdose på 360 mg (tre tabletter) på den første dagen, etterfulgt av en dose på 120 mg (én tablett) som tas én gang daglig på omtrent samme tid hver dag. Orgovyx kan tas med eller uten mat. Tablettene bør tas med litt væske etter behov, og skal svelges hele. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Advarsler og forsiktighetsregler: Androgen deprivasjonsterapi kan forlenge QT-intervallet. Hos pasienter med en historie med eller risikofaktorer for QT-forlengelse samt hos pasienter som samtidig får legemidler som kan forlenge QT-intervallet, må man nøye evaluere samtidig bruk av Orgovyx med legemidler kjent for å forlenge QT-intervallet, eller legemidler som kan indusere torsades de pointes, slik som klasse IA (f.eks. kinidin, disopyramid) eller klasse III (f.eks. amiodaron, sotalol, dofetilid, ibutilid) antiarytmika, metadon, moksifloksacin, antipsykotika osv. Hjerte- og karsykdom slik som myokardinfarkt og slag har blitt rapportert for pasienter som fikk androgen deprivasjonsterapi. Derfor bør alle risikofaktorer for hjerte- og karsykdom tas med i beregningen. Redusert bentetthet kan forekomme. Redusert bentetthet, hos pasienter med ytterligere risikofaktorer, kan føre til osteoporose og økt risiko for benfraktur. Overvåkning av leverfunksjon hos pasienter med kjent eller mistenkt leversykdom er tilrådelig under behandling, da det er observert lette forbigående økninger i ALAT og ASAT. Forsiktighet ved alvorlig nedsatt nyrefunksjon. Eksponeringen for relugoliks hos pasienter med alvorlig nedsatt nyrefunksjon kan være økt med opptil 2 ganger. Det må utvises forsiktighet hos pasienter med alvorlig nedsatt nyrefunksjon ved administrasjon av en 120 mg dose med relugoliks én gang daglig. Effekten av Orgovyx skal overvåkes via kliniske parametere og nivåer av prostataspesifikt antigen (PSA) i serum. Interaksjoner: P-gp-hemmere: Samtidig administrasjon av Orgovyx og orale P-gp-hemmere anbefales ikke. Legemidler som er orale P-gp-hemmere inkluderer visse legemidler mot infeksjon (f.eks. azitromycin, erytromycin, klaritromycin, gentamicin, tetracyklin), antimykotika (ketokonazol, itrakonazol), antihypertensiva (f.eks. karvedilol, verapamil), antiarytmika (f.eks. amiodaron, dronedaron, propafenon, kinidin), antianginale legemidler (f.eks. ranolazin), cyklosporin, humant immunsviktvirus (hiv)- eller hepatitt C-virus (HCV)-proteasehemmere (f.eks. ritonavir, telaprevir). Hvis samtidig administrasjon med orale P-gp-hemmere én eller to ganger daglig er nødvendig, skal Orgovyx tas først og den orale P-gp-hemmeren tas 6 timer senere, og pasientene skal overvåkes hyppigere for bivirkninger. Alternativt kan behandling med Orgovyx avbrytes i opptil 2 uker for en kort behandlingsperiode med en P-gp-hemmer. Hvis behandling med Orgovyx avbrytes i mer enn 7 dager, skal administrasjon av Orgovyx gjenopptas med en startdose på 360 mg på den første dagen etterfulgt av 120 mg én gang daglig. Kombinerte P-gp- og sterke CYP3A-induktorer: Samtidig administrasjon av Orgovyx med kombinerte P-gp- og sterke CYP3A-induktorer anbefales ikke. Legemidler som er kombinerte P-gp- og sterke CYP3A4-induktorer inkluderer den androgene reseptorinduktoren apalutamid, visse antikonvulsiva (f.eks. karbamazepin, fenytoin, fenobarbital), legemidler mot infeksjon (f.eks. rifampicin, rifabutin), johannesurt (Hypericum perforatum), hiv- eller HCV-proteaseinduktorer (f.eks. ritonavir) og ikke-nukleoside reverstranskriptaseinduktorer (f.eks. efavirenz). Hvis samtidig administrasjon er nødvendig, skal Orgovyx-dosen økes. Etter seponering av den kombinerte P-gp- og sterke CYP3A-induktoren skal den anbefalte dosen Orgovyx gjenopptas én gang daglig. Fertilitet, graviditet og amming: Legemidlet er ikke indisert for kvinner i fertil alder. Det skal ikke brukes hos kvinner som er eller kan være gravide eller som ammer. Bivirkninger: Noen mindre vanlige bivirkninger kan være alvorlige, og lege kontaktes umiddelbart dersom symptomer på urtikaria eller angioødem utvikles (kan forekomme hos opptil 1 av 100 personer). De vanligste bivirkningene under behandling med relugoliks er fysiologiske effekter av testosteronsuppresjon, inkludert hetetokter (54 %), muskel- og skjelettsmerter (30 %) og fatigue (26 %). Andre svært vanlige bivirkninger inkluderer diaré og forstoppelse (12 % hver). Svært vanlige: Karsykdommer: hetetokter. Gastrointestinale sykdommer: diaré, forstoppelse. Sykdommer i muskler, bindevev og skjelett: muskel- og skjelettsmerter. Generelle lidelser og reaksjoner på administrasjonsstedet: fatigue. Vanlige: Sykdommer i blod og lymfatiske organer: anemi. Endokrine sykdommer: gynekomasti. Psykiatriske lidelser: insomni, depresjon. Nevrologiske sykdommer: svimmelhet, hodepine. Gastrointestinale sykdommer: kvalme. Hud- og underhudssykdommer: hyperhidrose, utslett. Lidelser i kjønnsorganer og brystsykdommer: redusert libido. Undersøkelser: vektøkning, økt glukosed, økt triglyserid, økt blodkolesterol. Mindre vanlige: Hjertesykdommer: myokardinfarkt. Hud- og underhudssykdommer: urtikaria, angioødem. Sykdommer i muskler, bindevev og skjelett: osteoporose/ osteopeni. Undersøkelser: økt aspartataminotransferase, økt alaninaminotransferase. Ikke kjent frekvens: Hjertesykdommer: forlenget QT-tid. Pakningsstørrelser og pris: Orgovyx Filmdrasjert tablett, 120 mg: 30 stk. flaske: 1674,6 kr. Blå resept: Ja. Refusjonsberettiget bruk: Behandling av avansert hormonavhengig prostatakreft. Refusjonskoder: ICPC Y77: Ondartet svulst i prostata. ICD C61 Ondartet svulst i blærehalskjertel. Vilkår 9: Behandlingen skal være instituert i sykehus, sykehuspoli-klinikk eller av spesialist i vedkommende disiplin. Basert på SPC godkjent av DMP/EMA: 13.06.2025. Innehaver av markedsføringstillatelse: Accord Healthcare S.L.U., World Trade Center, Moll de Barcelona, s/n, Edifici Est 6ª planta, 08039 Barcelona, Spania. Tel: +34 93 301 00 64. Les preparatomtale (SPC) for ytterligere informasjon, se www.felleskatalogen.no NO-Onc-Org-01454

HOVEDREDAKSJONEN
Eva Hofsli
Spesialist i onkologi
Førsteamanuensis NTNU St. Olavs hospital eva.hofsli@ntnu.no
Hanne Tøndel
Spesialist i onkologi, ph.d. St. Olavs hospital hanne.tondel@stolav.no
Christina Power Sjo
Spesialist i onkologi
Oslo universitetssykehus, Radiumhospitalet chpsjo@ous-hf.no
MEDVIRKENDE REDAKTØRER
Jarle Jakobsen
Lege i spesialisering Tromsø universitetssykehus jarle.jakobsen@unn.no
Meetali Kakad
Lege i spesialisering, ph.d. Akershus universitetssykehus meetali.kakad@ahus.no
Emil Graff Ramsli
Lege i spesialisering
Haukeland universitetssjukehus emil.graff.ramsli@helse-bergen.no
STYRET I NORSK ONKOLOGISK FORENING
Daniel Heinrich, leder
Hanne Astrid Eide, nestleder
Kristin Loge Aanestad, sekretær
Dalia Dietzel, økonomiansvarlig/kasserer
Marie Søfteland Sandvei, nettredaktør Andreas Ullern, nettredaktør
SPESIALITETSKOMITÉEN I ONKOLOGI
Mirjam Alsaker, St. Olavs hospital
Cecilie Nordstrand, Ålesund sykehus
Olav Engebråten, Oslo Universitetssykehus
Silje Songe-Møller, Sykehuset i Østfold, Kalnes Kjersti Ødegaard, Stavanger Universitetssykehus (varamedlem)
Jarle Jakobsen, Tromsø Universitetssykehus (LIS-medlem)
ÆRESMEDLEMMER
Prof. Herman Høst
Prof. Sophie Dorothea Fosså
Prof. Olav Dahl
Prof. Olbjørn Klepp
Prof. Stein Olav Kvaløy
Prof. Erik Wist
Prof. Øyvind Bruland
Prof. Steinar Aamdal
Prof. Terje Risberg
Prof. Stein Sundstrøm
Dr. Kirsten Sundby Hall
Dr. Harald Holte
Prof. Marit Slaaen
Prof. Olav Mella
Prof. Hans Petter Eikesdal (†2023)
Prof. Bjørn Naume
Norsk onkologisk forening ble stiftet i 1986
Antall medlemmer: 742 ordinære medlemmer og 42 assosierte medlemmer
Innlegg bes sendt elektronisk i word-format til hanne.tondel@stolav.no
LAYOUT, PRODUKSJON OG ANNONSESALG
Apriil Media
E-post: media@apriil.no Tlf. 988 19 348
ved førstelinje NSCLC PD-L1 ≥ 50 %1
kan gi fordeler for pasienter, helsepersonell og helsevesen2-5
Pasienter

Raskere administrering med SUBKUTAN TECENTRIQ som tar ca. 7 minutter, mens intravenøs administrering tar 30 til 60 minutter2,5

Helsepersonell
Flertallet (75-90 %) mener
SUBKUTAN TECENTRIQ kan spare tid, er veldig enkel eller ganske enkel å administrere og er veldig fornøyd eller fornøyd med behandlingen5
Pasienten skal overvåkes for immunmedierte bivirkninger2

Helsevesen
Subkutane formuleringer kan gi besparelser i kostnader og tidsbruk, og kan gi pasientene behandlingsalternativer utenfor sykehus*3,4
SUBKUTAN TECENTRIQ (atezolizumab) er førstevalg i onkologianbefalingene fra 1. oktober 2025 til 30. september 2026 ved førstelinje NSCLC PD-L1 ≥ 50 % , utbredt SCLC, adjuvant NSCLC PD-L1 ≥ 50 % og TNBC i kombinasjon med kjemoterapi. Se full indikasjonstekst under og onkologianbefalinger for detaljer 1
Utvalgt produkt- og sikkerhetsinformasjon SUBKUTAN TECENTRIQ2
INDIKASJONER:
Ikke-småcellet lungekreft (NSCLC) i tidlig stadium: Som monoterapi til adjuvant behandling, etter fullstendig reseksjon og platinabasert kjemoterapi, av voksne med NSCLC med høy risiko for tilbakefall der tumor har PD-L1-ekspresjon i ≥ 50 % av tumorcellene og som ikke har EGFR-mutant eller ALK-positiv NSCLC.
Avansert NSCLC: I kombinasjon med bevacizumab, paklitaksel og karboplatin til førstelinjebehandling av voksne med metastatisk ikke-plateepitel NSCLC. Ved EGFR-mutant eller ALK-positiv NSCLC er Tecentriq, i kombinasjon med bevacizumab, paklitaksel og karboplatin, kun indisert etter at egnede målrettede behandlinger har mislyktes. I kombinasjon med nab-paklitaksel og karboplatin til førstelinjebehandling av voksne med metastatisk ikke-plateepitel NSCLC som ikke har EGRF-mutant eller ALK-positiv NSCLC. Som monoterapi til førstelinjebehandling av voksne med metastatisk NSCLC med tumorer som har PD-L1-ekspresjon i ≥ 50 % TC eller i ≥ 10 % tumorinfiltrerende immunceller (IC) og som ikke har EGFR-mutant eller ALK-positiv NSCLC. Som monoterapi til førstelinjebehandling av voksne med avansert NSCLC som er uegnet for platinabasert behandling. Som monoterapi til behandling av voksne med lokalavansert eller metastatisk NSCLC etter tidligere kjemoterapi. Pasienter med EGFR-mutant eller ALK-positiv NSCLC bør også ha mottatt målrettede behandlinger før de mottar Tecentriq.
Småcellet lungekreft (SCLC): I kombinasjon med karboplatin og etoposid til førstelinjebehandling av voksne med utbredt småcellet lungekreft (ES-SCLC).
Hepatocellulært karsinom (HCC): I kombinasjon med bevacizumab til behandling av voksne med avansert eller inoperabel HCC som ikke tidligere har fått systemisk behandling.
Urotelialt karsinom (UC): Som monoterapi til behandling av voksne med lokalavansert eller metastatisk UC etter tidligere platinaholdig kjemoterapi, eller som ikke anses som egnet for cisplatin, og hvor tumor har et PD-L1-ekspresjon ≥ 5 %.
Trippel-negativ brystkreft (TNBC): I kombinasjon med nab-paklitaksel til behandling av voksne med inoperabel lokalavansert eller metastatisk TNBC som har tumorer med PD-L1-ekspresjon ≥ 1 %, og som ikke tidligere er behandlet med kjemoterapi for metastatisk sykdom.
DOSERING OG ADMINISTRERING:
Anbefalt dose er 1875 mg hver 3. uke. Gis s.c. i låret over ca. 7 minutter.
FORSIKTIGHETSREGLER:
Immunmedierte bivirkninger: Kan påvirke flere kroppssystem. Pasienten bør overvåkes for pneumonitt, hepatitt, kolitt, endokrinopatier, meningitt/encefalitt, motorisk og sensorisk nevropati, myelitt, akutt pankreatitt, myokarditt, endringer i nyrefunksjon, myositt, perikardiale sykdommer, hemofagocytisk lymfohistiocytose, SCARs og andre immunmedierte bivirkninger. ASAT, ALAT, bilirubin og tyreoideafunksjon bør overvåkes. Infusjonsrelaterte reaksjoner: Grad 1/2: Redusert injeksjonshastighet eller pause. Grad 3/4: Permanent seponering.
BIVIRKNINGER:
Monoterapi: De vanligste bivirkningene (> 10 %) er fatigue, nedsatt appetitt, utslett, kvalme, diaré, pyreksi, hoste, artralgi, dyspné, kløe, asteni, ryggsmerter, oppkast, urinveisinfeksjon og hodepine.
Kombinasjonsterapi: De vanligste bivirkningene (≥ 20 %) er anemi, nøytropeni, kvalme, fatigue, alopesi, utslett, diaré, trombocytopeni, forstoppelse, nedsatt appetitt og perifer nevropati.
Se SPC for fullstendig informasjon om dosering, forsiktighetsregler og bivirkninger. PAKNING, PRIS OG REFUSJON:
Injeksjonsvæske, oppløsning 1875 mg: 15 ml (hettegl.) kr 52 886,80.Subkutan formulering av atezolizumab (TECENTRIQ) innføres til bruk ved alle indikasjoner der atezolizumab er besluttet innført for intravenøs behandling.6 Reseptgruppe C.
REFERANSER:
1. https://www.sykehusinnkjop.no/avtaler-legemidler/onkologi/
2. TECENTRIQ SPC avsnitt 4.1, 4.2, 4.4 og 4.8, datert 16.06.2025.
3. McCloskey C, Ortega MT, Nair S, et al. A Systematic Review of Time and Resource Use Costs of Subcutaneous Versus Intravenous Administration of Oncology Biologics in a Hospital Setting. Pharmacoecon Open. 2023;7:3-36.
4. Bittner B, Richter W, Schmidt J et al. Subcutaneous Administration of Biotherapeutics:An Overview of Current Challenges and Opportunities. BioDrugs 2018;32(5):425–440.
5. Burotto M, Zvirbule Z, Alvarez R, et al. Brief Report: Updated Data From IMscin001 Part 2, a Randomized Phase III Study of Subcutaneous Versus Intravenous Atezolizumab in Patients With Locally Advanced or Metastatic NSCLC. Journal of Thoracic Oncology 2024; Vol. 19 No. 10: 1460–1466.
6. https://www.nyemetoder.no/metoder/id2023_105/
*TECENTRIQ skal initieres og overvåkes av lege med erfaring innen kreftbehandling.






Min opprinnelige plan var å bli barnelege. Etter flere uketjenester ved barneavdelingen på UNN Tromsø (som den gang het RiTø) kjente jeg at jeg måtte endre kurs. Små barn med alvorlige diagnoser ble for tøft. Gode og interessante uketjenester ved kreftavdelingen i Tromsø åpnet mine øyne for onkologi, et fag jeg ikke hadde tenkt så mye på frem til da. Etter endt turnustid sendte jeg søknad til både kreftklinikken og øyeavdelingen ved St. Olavs hospital. Jeg fikk jobb på kreftklinikken og startet der, men etter tre måneder kom det også et jobbtilbud fra øyeavdelingen. Da var det tilbake i tenkeboksen nok en gang og jeg bestemte meg for at jeg måtte prøve øyefaget også.
Jeg var ikke særlig høy i hatten da jeg troppet opp på min daværende sjefs kontor for å fortelle at jeg skulle slutte så fort. Hva ville hun si?
Jeg glemmer aldri sjefens ord: «Hvis dette kjennes riktig ut for deg, så skal du prøve øyeavdelingen. Og når det blir kjedelig, så ringer du meg og kommer tilbake hit!» sa hun, med et godt glimt i øyet.
Det var jo akkurat det som skjedde! Øyefaget hadde sine fordeler og jeg traff masse fine folk der, men helheten og alt det andre spennende med onkologi-faget manglet. Så etter noen måneder tok jeg en telefon til min kloke sjef på kreftklinikken og fikk komme tilbake.
Veien til god rekruttering handler ikke bare om politiske tiltak og høyere lønn.
Rekruttering kan begynne allerede i studietiden med god undervisning og interessante uketjenester. Små kommentarer fra overordnede eller mer erfarne kolleger tidlig i karrieren kan være avgjørende for videre valg (ville jeg våget å komme tilbake til onkologien dersom sjefen reagerte på en annen måte?). God supervisjon og veiledning kan også bidra til at leger forblir i et fag, men effekten av det er ikke alltid så lett å måle i vår drifts-baserte klinikk-hverdag.
I denne utgaven av OnkoNytt kan du lese mer om rekruttering. I tillegg kan du lese om dødshjelp, tarmscreening, tannhelse, PallSoft-studien og flere interessante reisebrev fra mottakere av NOFs fagstipend.
Vår nye faste spalte «Norge rundt» anbefales også, hvor vi i tillegg til ny stripe fra Tegnehanne og kryssord (denne gang med gavekort som premie), har innslag fra «Onkologiske sommerleker» i Trondheim, boktips fra Oslo og bildestafett fra Ålesund.
På side 66 finner du også et intervju med forfatter og fastlege Ingvild Skølt som har skrevet boka «Du vil kjenne eit lite stikk» som forfatteren omtaler som «ein slags moderne og alternativ legeroman, der eg forsøkjer å skildre korleis det eigentleg kjennest på innsida av den kvite frakken».
God høst og god lesning! På vegne av redaksjonen
Hanne Tøndel
Cabometyx «kabozantinib» filmdrasjerte tabletter
Reseptgruppe C
Indikasjoner: Voksne: Som monoterapi ved behandling av avansert nyrecellekarsinom (RCC) som førstelinjebehandling ved intermediær eller dårlig prognose, og/eller etter tidligere vaskulær endotelvekstfaktor (VEGF)-rettet behandling. I kombinasjon med nivolumab til førstelinjebehandling av avansert RCC. Som monoterapi ved behandling av hepatocellulært karsinom (HCC) etter tidligere sorafenibbehandling. Som monoterapi ved behandling av lokalt avansert eller metastatisk differensiert tyreoideakarsinom (DTC) hos voksne, som er refraktære eller ikke kvalifisert for behandling med radioaktivt jod og har progrediert under eller etter tidligere systemisk behandling. Behandling av voksne med ikke-operable eller metastatiske, veldifferensierte ekstrapankreatiske (epNET) og pankreatiske (pNET) neuroendokrine tumorer som har utviklet seg etter minst én tidligere systemisk behandling med unntak av somatostatinanaloger.
Dosering: Monoterapi: 60 mg 1 gang daglig. Bør fortsettes så lenge klinisk nytte sees eller til uakseptabel toksisitet. Kombinasjon med nivolumab: 40 mg 1 gang daglig i kombinasjon med nivolumab i.v. enten 240 mg hver 2. uke eller 480 mg hver 4. uke. Behandling fortsettes inntil sykdomsprogresjon eller uakseptabel toksisitet. Se SPC for dosering av nivolumab.
Dosejustering: Midlertidig avbrudd og/eller dosereduksjon kan være påkrevd ved mistenkte bivirkninger, se SPC for mer informasjon.
Spesielle pasientgrupper: Ikke anbefalt ved alvorlig nedsatt leverfunksjon (Child-Pugh C) og/eller alvorlig nedsatt nyrefunksjon.
Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Forsiktighetsregler: Hepatotoksisitet: Unormale leverfunksjonstester er hyppig sett. Leverfunksjonstester anbefales før behandlingsstart, samt nøye regelmessig overvåkning under behandling. Ved forverrede leverfunksjonstester bør anbefalte doseendringer følges. Sjeldne tilfeller av vanishing bile duct-syndrom er sett. Immunologiske sjekkpunkthemmere ble gitt, enten før eller samtidig med kabozantinib i alle tilfeller. Leverencefalopati: Overvåkning anbefales for tegn/ symptomer på leverencefalopati. Perforeringer og fistler: Alvorlige GI-perforeringer og fistler, av og til fatale, er sett. Bør seponeres ved gastrointestinal perforasjon eller fistler som ikke lar seg behandle adekvat. Gastrointestinale sykdommer: Behandlingsavbrudd, dosereduksjon eller permanent seponering bør vurderes ved vedvarende eller gjentatte signifikante GI-bivirkninger. Tromboemboliske hendelser: Venøs og arteriell tromboembolisme (inkl. fatal) er sett. Brukes med forsiktighet ved risiko for, eller tidligere tromboembolisme. Bør seponeres ved utvikling av akutt myokardinfarkt eller klinisk signifikante tromboemboliske komplikasjoner. Blødning: Alvorlige blødninger (inkl. fatale) er sett. Ved tidligere alvorlige blødninger bør pasienten vurderes nøye før behandlingsstart. Bør ikke gis ved alvorlig blødning eller risiko for dette. Aneurismer og arteriedisseksjoner: Kan fremme dannelsen av aneurismer og/eller arteriedisseksjoner. Før oppstart bør risikoen vurderes nøye ved risikofaktorer som hypertensjon eller aneurisme i anamnesen. Trombocytopeni: Er sett. Blodplatenivå bør overvåkes under behandling, og dose endres iht. alvorlighetsgrad av trombocytopeni. Komplikasjoner med sårtilheling: Er sett. Behandling bør stoppes minst 28 dager før planlagt kirurgi hvis mulig. Hypertensjon (inkl. hypertensiv krise): Er sett. Blodtrykk bør være velkontrollert før oppstart. Blodtrykket skal overvåkes tidlig og regelmessig, og egnet antihypertensiv behandling gis etter behov. Ved vedvarende hypertensjon til tross for antihypertensiv behandling, bør kabozantinibdosen midlertidig seponeres til blodtrykket er under kontroll. Deretter kan kabozantinib gjenopptas med redusert dose. Bør seponeres ved alvorlig og vedvarende hypertensjon, til tross for antihypertensiv behandling og reduksjon i kabozantinibdosen, samt ved hypertensiv krise. Kjeveosteonekrose (ONJ): Er sett. Munnhuleundersøkelse bør utføres før og med jevne mellomrom under behandling. Behandling bør om mulig stoppes minst 28 dager før planlagt dentalkirurgi/ invasiv tannbehandling. Forsiktighet utvises ved bruk av legemidler forbundet med ONJ, f.eks. bisfosfonater. Seponeres ved ONJ. Palmar plantar erytrodysestisyndrom (PPES): Er sett. Ved alvorlig PPES bør det vurderes å avbryte behandlingen. Kan gjenopptas med lavere dose når PPES er gått tilbake til grad 1. Proteinuri: Er sett. Urinprotein bør måles regelmessig under behandling. Bør seponeres ved utvikling av nefrotisk syndrom. Posterior reversibelt encefalopati-syndrom (PRES): Er sett. Behandlingen bør seponeres ved PRES. Forlenget QT-intervall: Brukes med forsiktighet ved tidligere QT-forlengelse, ved bruk av antiarytmika eller ved relevant eksisterende hjertesykdom, bradykardi eller elektrolyttforstyrrelser. Regelmessig EKG-overvåkning og elektrolyttmåling bør vurderes. Tyreoideadysfunksjon: Måling av tyreoideafunksjonen anbefales ved baseline, samt nøye overvåkning for tegn/symptomer under hele behanlingen. Behandling iht. vanlig medisinsk praksis. Unormale biokjemiske laboratorietester: Økt forekomst av elektrolyttforstyrrelser er sett og tilfeller av leverencefalopati ved HCC kan tilskrives dette. Hyppigere frekvens og/eller økt alvorlighetsgrad av hypokalsemi, inkl. grad 3 og 4, er sett hos pasienter med tyreoideakarsinom sammenlignet med pasienter med andre krefttyper. Overvåkning av biokjemiske parametre anbefales. Behandlingsavbrudd, dosereduksjon eller permanent seponering bør vurderes ved vedvarende eller gjentatte signifikante avvik.
Graviditet, amming og fertilitet: Graviditet: Skal ikke brukes under graviditet, hvis ikke klinisk tilstand nødvendiggjør behandling. Amming: Skal opphøre under og i minst 4 måneder etter endt behandling. Fertilitet: Kan reduseres.
Bivirkninger: Monoterapi: Svært vanlig: Blødning (inkl. epistakse), hypoalbuminemi, perifert ødem, smerter i ekstremitet, artralgi. Vanlig: Gastrointestinal perforasjon, gastroøsofageal, reflukssykdom, hepatisk encefalopati, hyperglykemi, hypokalsemi, lymfopeni, nøytropeni, pankreatitt, proteinuri, venetrombose, økt kreatinin. Kombinasjon med nivolumab: Svært vanlig: Artralgi, hyperglykemi, hypertyreoidisme, hypokalsemi, leukopeni, lymfopeni, muskel-skjelettsmerter, nøytropeni, proteinuri, ødem, økt ALP, økt kreatinin, øvre luftveisinfeksjon. Vanlig: Akutt nyreskade, artritt, atrieflimmer, binyreinsuffisiens, eosinofili, epistakse, gastritt, hepatitt, nyresvikt, overfølsomhet (inkl. anafylaktisk reaksjon), pleuraeffusjon, pneumonitt, takykardi, trombose. Felles for monoterapi og kombinasjon med nivolumab: Svært vanlig: Abdominalsmerter, diaré, dysfoni, dysgeusi, dyspepsi, dyspné, fatigue, forstoppelse, hodepine, hoste, hypertensjon, hypokalemi, hypomagnesemi, hypotyreoidisme, kvalme, oppkast, PPES, stomatitt, trombocytopeni, utslett, økt ALAT, økt ASAT. Vanlig: Lungeembolisme, perifer nevropati, pneumoni. For mer informasjon, se Felleskatalogen eller preparatomtalen (SPC).
Innehaver av markedsføringstillatelse: Ipsen Pharma, 70 rue Balard, 75015 Paris, Frankrike. Tlf.: 00 46 8 451 60 00. E-post: info.se@ipsen.com
Basert på SPC godkjent av DMP: 23.07.2025
Pakninger og priser per 04.08.2025: 20 mg: 30 stk. (boks) kr 63654,50. 40 mg: 30 stk. (boks) kr 63654,50. 60 mg: 30 stk. (boks) kr 63654,50.
Refusjon: H-resept: Refusjonsberettiget bruk: Rekvirering skal gjøres i tråd med nasjonale handlingsprogrammer for kreft og føringer fra RHF/LIS spesialistgruppe. Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist.
Dato: 04.08.2025


Indikasjoner



60% of aRCC patients don’t reach 2L* 2,3


*Across three real-world studies, only 35-45% of patients received 2L. 2,3
Keep time on their side 4
Voksne: CABOMETYX® er indisert som monoterapi ved avansert nyrecellekarsinom – som førstelinjebehandling av voksne pasienter med intermediær eller dårlig prognose, og/eller etter tidligere vaskulær endotelvekstfaktor (VEGF)-rettet behandling. I kombinasjon med nivolumab til førstelinjebehandling av avansert nyrecellekarsinom.
1. Cabometyx SmPC. ATC-nr.: L01X E26/felleskatalogen.no. 2. Shah N, et al. Eur Urol. 2023;49:110–118. 3. Lai G-S, et al. PLoS One. 2023;18(11):e0294039. 4. Final analysis of nivolumab plus cabozantinib for advanced renal cell carcinoma from the randomized phase III CheckMate 9ER trial, Annals of Oncology (2025), doi: https://doi.org/10.1016/j.annonc.2025.09.006.
Institut Produits Synthèse (IPSEN) AB, Färögatan 33, SE-164 51 Kista, Sweden

I krefttallene for 2024 ser vi fortsatt en utflating eller nedgang i forekomst av flere store kreftgrupper. Et særlig lyspunkt var det historisk lave antallet tilfeller av livmorhalskreft.

INGER KRISTIN LARSEN, PH.D.
Seksjonssjef, Seksjon for analyse og forskning Kreftregisteret
Redaktør Cancer in Norway.

ELISABETH JAKOBSEN
Kommunikasjonsleder Kreftregisteret
I2024 ble det diagnostisert 38 811 nye krefttilfeller blant 37 814 personer i Norge.
De fire største kreftformene er prostatakreft (5 550 tilfeller), tykk- og endetarmskreft (4 995 tilfeller), brystkreft blant kvinner (4 215 tilfeller), og lungekreft (3 435 tilfeller). Til sammen utgjør disse kreftformene 47 % av alle ny-diagnostiserte tilfeller.
For å si noe om hvordan risikoen for kreft har endret seg over tid må vi se på insidensratene, altså antall krefttilfeller per 100 000 personer.
For menn ser vi en nedgang i ratene for både prostata-, tarm- og lungekreft de siste 10 til 15 årene. Sammenligner vi insidensratene i siste fem-årsperiode (2020–2024) med den forrige (2015–2019), ses en nedgang på 3,5 % for all kreft totalt blant menn, og den største reduksjonen finner vi for lungekreft, med en nedgang på 10,2 %.
Blant kvinnene har det vært en liten økning i insidensen av all kreft samlet, og ratene for siste fem-årsperiode har økt med 1,8 % sammenlignet med den forrige. Ratene for lungekreft ser endelig ut til å endre retning, og ratene i siste femårsperiode er nå 5,3 % lavere
enn i forrige fem-årsperiode. Det har også vært en liten nedgang i ratene for tykktarmskreft (-2,0 %), mens raten for endetarmskreft er stabil og ratene for brystkreft har økt (5,4 %).
Insidensen av hudkreft, både melanom og ikke-melanom, har økt betydelig for begge kjønn over flere tiår, og til sammen utgjør disse kreftformene 15 % av alle tilfellene i 2024.
REKORDLAVE INSIDENSTALL FOR LIVMORHALSKREFT
I 2024 ble det diagnostisert 269 nye tilfeller av livmorhalskreft. Dette er den laveste forekomsten som noen gang er registrert i Kreftregisteret, målt i både antall og rater. Livmorhalskreft utgjorde 1,5 % av alle tilfellene blant kvinner i 2024, og er en relativt sjelden kreftform, men er den tredje største kreftformen blant kvinner i alderen 25 til 49 år.
Det har vært en spesielt stor nedgang blant kvinner under 30 år, og HPVvaksinen antas å forklare mye av denne reduksjonen. HPV-vaksinen ble tatt inn i barnevaksinasjonsprogrammet for jenter i 7. klasse (født i 1997) fra skoleåret 2009/10, og alle jenter og kvinner i alderen 13–27 år har dermed fått tilbud om vaksinen.

Livmorhalskreft er en av få kreftformer som kan elimineres, og Verdens helseorganisasjon har som mål å redusere insidens til 4 tilfeller per 100 000 kvinner ved at1:
• 90 % av alle jenter vaksineres med HPV-vaksine innen de fyller 15 år
• 70 % av kvinner screenes med en høykvalitetstest ved alder 35 og 45 år
• 90 % av kvinner med livmorhalskreft får behandling
I Norge ligger vi godt an for å nå disse målene:
I 2023 var dekningen av HPVvaksineringen for 16 år gamle jenter på 93 %2
Ferske tall fra Livmorhalsprogrammet viser at 390 000 kvinner fortsatt ikke har tatt HPV-test som tilbys i programmet, og 180 000 har ikke sjekket seg på ti år eller mer3, men screeningdeltakelsen for kvinner i aldersgruppen 34–54 år er på 75 % i 20244
Tall fra årsrapporten fra Nasjonalt kvalitetsregister for gynekologisk kreft viser at 96 % av pasientene ble operert eller fikk strålebehandling i 20245
Forutsetningene er altså gode for at vi på sikt kan nå en insidensrate på 4 tilfeller per 100 000 kvinner. I 2024 var ratene nede på 7,1 tilfeller per 100 000 kvinner (aldersstandardisert med verdens standardbefolkning).
ANTALL NYE TILFELLER PER ÅR VIL ØKE
For mange kreftformer går utviklingen i riktig retning. Likevel venter vi at antall krefttilfeller per år vil øke i de kommende årene på grunn av en økende befolkning og økende andel eldre. Bare i løpet av det siste tiåret (2015–2024) har antallet nye tilfeller økt med 20 %, og framskrivinger viser at innen 2038 kan antall nye krefttilfeller per år overstiger 50 0006. Denne framskrivingen er basert på utviklingen i andel eldre, og vekst i befolkningsstørrelse alene, og modellen tar ikke hensyn til eventuelle livsstilsendringer i befolkningen som øker eller reduserer kreftrisikoen.

Egne framskrivinger for ulike kreftformer eller områder kan gjøres på de nordiske kreftregistrene sin nettside (https://nordcan.iarc.fr/en).
Slike framskrivinger treffer aldri perfekt, og blir mer usikre jo lengre tidsperiode vi ønsker å predikere. Til tross for en viss usikkerhet må vi, helsetjenesten og alle som er involvert i kreftbehandling belage oss på at antallet krefttilfeller vil stige betydelig.
Samtidig øker overlevelsen, og ved utgangen av 2024 var det nær 348 000 personer i live i Norge som har eller har hatt kreft. Det er 100 000 flere enn i 2014.
KREFT BLANT UNGE
Kreft forekommer relativt sjelden blant unge. I Norge rammes rundt 250 barn og unge (0–19 år) av kreft årlig, noe som tilsvarer rundt 20 tilfeller per 100 000.
Blant unge voksne (20–49 år) er forekomsten litt høyere med 3460 nye tilfeller årlig, og raten per 100 000 er 206 blant unge kvinner og 114 blant unge menn. Til sammenligning er den aldersspesifikke insidensraten blant de over 70 år på 2 310 per 100 000 kvinner og 3 520 per 100 000 menn.
Flere internasjonale studier har vist en økning i forekomsten blant unge.
Det har vært særlig fokus på økningen av tarmkreft, og dette er en kreftform hvor Norge ligger på verdenstoppen, også blant unge7
I Norge har ratene for all kreft samlet gått ned med 5 prosent blant unge menn (20–49 år) når vi sammenligner den siste femårsperioden med den forrige. Nedgang i ratene ses også for de vanligste kreftformene, bortsett fra for tykk- og endetarmskreft hvor ratene har økt med 15 prosent mens det har vært en nedgang blant middelaldrende (50–69 år) og eldre (70 år og eldre).
Blant unge kvinner har ratene vært stabile, når en ser på all kreft samlet.
Det har vært en nedgang i ratene for kreft i sentralnervesystemet, melanom i hud, og spesielt stor nedgang ses for livmorhalskreft. For brystkreft, tykkog endetarmskreft og skjoldbruskkjertelkreft er det imidlertid en økning i ratene, og for de to sistnevnte kreftformene er det en økning blant de unge, mens det er en nedgang blant de eldste kvinnene.
I dag overlever 78 % av pasientene sin kreftdiagnose i fem år eller mer. Forskjellene mellom kreftformene er imidlertid store. De høyeste overlevelsestallene ser vi for testikkelkreft med fem-års relativ overlevelse (RO) på 99 %, etterfulgt av prostatakreft på 96 %.
Blant kvinner ses de høyeste overlevelsestallene for melanom (96 % fem-års RO), annen hudkreft (94 % fem-års RO) og brystkreft (93 % femårs RO).
På den andre siden av skalaen er fremdeles pankreaskreft (uten neuroendokrine svulster) hvor 5-års RO er 8,5 % blant menn og 9,9 % blant kvinner.
Et lyspunkt er den betydelige økningen i RO for magesekkreft og lungekreft. Fem-års RO for lungekreft har i løpet av de siste 20 årene økt fra 8,3 til 28,4 % for menn, og fra 11,9 til 35,8 % for kvinner. Dette er en meget gledelig utvikling som skyldes flere faktorer. Årsrapporten fra Nasjonalt kvalitetsregister for lungekreft trekker blant annet fram bedre utredning. Korrekt staging og molekylærbiologiske
undersøkelser gir grunnlaget for mer persontilpasset behandling, spesielt innenfor medikamentell behandling. I tillegg har økt bruk av radiologi gjort at flere tilfeller oppdages i et tidligere stadium8. I dag er andelen lungekreftpasienter som diagnostiseres i lokalisert stadium ved diagnose på 24 %, og dette er en betydelig økning fra begynnelsen av 2000-tallet hvor andelen var 14 %.
I 2017 startet Kreftregisteret et pilotprosjekt om helse og livskvalitet blant prostatakreftpasienter. Ordningen ble permanent fra 2020, og alle pasienter som kan nås via en digital postkasse blir nå invitert til å delta i Befolkningsundersøkelser om helse og livskvalitet, dersom de blir diagnostisert med en av følgende kreftformer:
• prostatakreft
• brystkreft
• tykk- og endetarmskreft,
• lungekreft
• gynekologisk kreft (eggstokk, livmor og livmorhals)
• melanom
• myelomatose
• lymfom
Undersøkelsen benytter EORTC
QLQ-C30 og kreftspesifikke skjemaer fra EORTC. I tillegg blir pasientene spurt om arbeidsevne og erfaring med helsevesenet. For hver kreftform inviteres det en kontrollgruppe, uten den spesifikke kreftformen, til å svare på de samme spørsmålene.
I årets utgave av Cancer in Norway er spesialutgaven viet til temaet
Livet etter kreftdiagnosen, med resultater fra til sammen 23 406 kreftpasienter og 14 497 kontrollpersoner. Spørreskjemaet var fylt ut omtrent ett år etter diagnose, med unntak av lungekreftpasienter som svarte 6 måneder etter diagnosen, og brystkreftpasienter som svarte 14 måneder etter diagnose.
Fysisk funksjon var det området som flest pasienter rapporterte problemer med, og blant pasienter med lungekreft, eggstokkreft og beinmargskreft oppga mer enn 60 % at de hadde problemer med fysisk funksjon. Dette var også blant de funksjonsområdene hvor flest i kontrollgruppen oppga å ha problemer.
Det var variasjon i andelene pasienter som rapporterte om problemer med funksjon og symptomer mellom de ulike kreftformene, og hvor mye de skilte seg fra kontrollgruppe, men pasienter med melanom i hud lå generelt sett nærmere nivåene til kontrollgruppen enn de andre kreftformene.
Pasientene hadde gjennomgående en høyere andel som rapporterte om problemer med funksjon og symptomer, bortsett fra når det gjelder smerte. Her så vi flere tilfeller der den øvrige befolkningen rapporterte minst like store utfordringer med smerter som kreftpasientene.
Egne analyser der resultatene ble justert for alder, kjønn, stadium eller behandling viste at andelen pasienter som meldte om problemer økte med mer utbredt sykdom og mer behandling. I tillegg var det for de
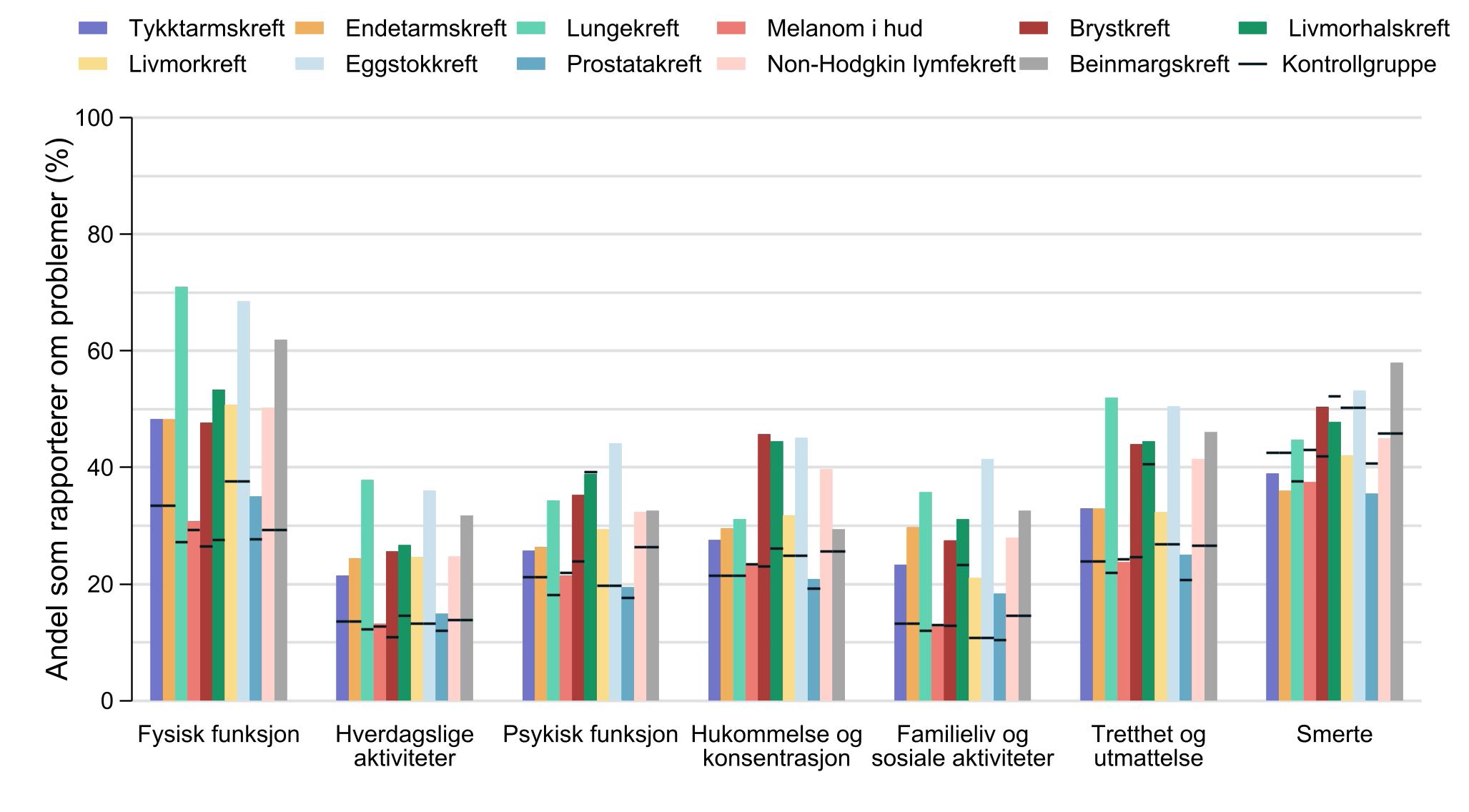

Figur 3: Selvrapporterte problemer knyttet til helse og livskvalitet ett år etter kreftdiagnose. 23 406 kreftpasienter og 14 497 personer uten kreft som har deltatt i befolkningsundersøkelse om helse og livskvalitet, 1.1.2022–31.3.2025. Lungekreftpasientene har svart seks måneder etter diagnose, mens brystkreftpasienter har svart 14 måneder etter diagnose. Figuren er publisert i Cancer in Norway – Special issue 2024 – Life after cancer diagnosis 9 Gjengitt med tillatelse fra Kreftregisteret.]
fleste kreftformene større forskjeller mellom pasient- og kontrollskår blant de yngste (18–66 år) sammenlignet med den eldste aldersgruppen (67 år og eldre).
I disse undersøkelsene var svarprosenten rundt 50 % blant pasientene (lavest for lungekreftpasienter med 39 % og høyest blant prostatakreftpasienter med 54 %). I kontrollgruppen var svarprosenten rundt 30 %
(lavest for kontrollene til livmorhalspasientene med 28 %, og høyest for kontrollene til prostatakreftpasientene med 35 %). Til tross for mulige skjevheter i utvalget, og eventuell underrepresentativitet av enkelte grupper, ligger det et stort potensial i dataene. Framover kommer vi til å fortsette å jobbe med å få opp svarprosenten enda mer, gjerne i samarbeid med de som er tettest på pasientene.
Målet er at disse besvarelsene skal kunne gi mer kunnskap om livet etter kreft, og bidra til å forbedre kreftomsorgen.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
YESCARTA® (axicabtagene ciloleucel) is the only treatment to demonstrate a significant OS benefit vs SoC in 2L DLBCL R/R ≤12 months1,b
55 % 17 – OF PATIENTS ARE ALIVE AT 4 YEARS vs 46% FOR SOC 1,b
DAYS MEDIAN TIME FROM APHERESIS TO PRODUCT RELEASE IN RWD 4


Indikasjon
Dosering
Kontraindikasjoner
Utvalgt sikkerhetsinformasjon
Utvalgte bivirkninger
▼
ZUMA-7 was a phase 3, randomised, open-label, multicentre, pivotal trial in 359 adult patients with R/R LBCL. Patients were randomised 1:1 to YESCARTA (N=180) and salvage chemotherapy +/- HDT+ASCT (N = 179), a current SoC (defined as 2 to 3 cycles of standard chemoimmunotherapy [R-ICE, R-DHAP or R-DHAX, R-ESHAP, or R-GDP] followed by high-dose therapy [HDT] and ASCT in those with disease response). The primary endpoint was EFS.2
a. Primary endpoint: HR: 0.398 (95% CI, 0.308–0.514); p<0.0001 at a median follow-up of 24.0 months. YESCARTA® mEFS 8.3 months (95% CI, 4.5–15.8) vs SoC mEFS 2.0 months (95% CI, 1.6–2.8).2 b. Secondary endpoint: HR: 0.726 (95% CI, 0.540–0.977); p = 0.03. Est. OS at 4 yrs 54.6% (95% CI, 47.0–61.6) with YESCARTA® vs. 46.0% (95% CI, 38.4–53.2) with SoC with a median follow-up of 47.2 months (range, 39.8–60.0).1 c. Definition of manufacturing success rate: Percent of batches dispositioned in the time period useable product (i.e., dispositioned as “released”, “released for clinical review”, and “physician’s release”).
References: 1. Westin J.R. et al., N Engl J Med 2023;389:148–57. 2. Locke F.L. et al, N Engl J Med 2022;386:640–54. 3. Kite Manufacturing process. Kite Analytics Platform, manufacturing data collected Q4 2017 through Q3 2022. 4. Kite Manufacturing process: Kite Analytics Platform, manufacturing data collected Q2–Q3 2024.
Behandling av voksne pasienter med diffust storcellet B-cellelymfom (DLBCL) og høygradig B-cellelymfom (HGBL) som får tilbakefall innen 12 måneder etter fullføring av, eller som er refraktære overfor, førstelinje kjemoimmunterapi. Behandling av voksne pasienter med residivert eller refraktær (r/r) DLBCL og primært mediastinalt storcellet B cellelymfom (PMBCL), etter to eller flere linjer med systemisk behandling.
Behandling skal administreres ved et kvalifisert behandlingssenter av en lege med erfaring i behandling av maligne blodsykdommer og opplæring innen administrasjon av Yescarta. Før infusjon må ≥1 dose tocilizumab til bruk i tilfelle cytokinfrigjøringssyndrom (CRS) og akuttutstyr være tilgjengelig.
Overfølsomhet for innholdsstoffene eller overfor gentamicin (mulig spor av reststoff). Kontraindikasjoner for lymfodepleterende kjemoterapi må vurderes.
Grunner til å utsette behandlingen: er pågående alvorlige bivirkninger. Pasientene må overvåkes daglig de første 7 dagene etter infusjon for tegn/symptomer på CRS, nevrologiske hendelser og annen toksisitet, og leger skal vurdere sykehusinnleggelse ved første tegn/symptom på CRS og/eller nevrologiske hendelser. Etter de 7 første dagene overvåkes pasientene etter legens skjønn.
Svært Vanlige
Hematologiske Uspesifiserte patogeninfeksjoner, virusinfeksjon, bakterieinfeksjon, febril nøytropeni, nøytropeni, lymfopeni, leukopeni, anemi, trombocytopeni, reduserte immunglobuliner CRS Cytokine Release Syndrom Neurologiske Delirium, encefalopati
Dette legemidlet er underlagt særlig overvåking.
YESCARTA® (aksikabtagenciloleucel (CAR-positive levedyktige T-celler)) 0,4 – 2 × 108 celler, infusionsvæske, dispersjon. ATC kode: L01XL03. Indikasjoner: Behandling av voksne pasienter med diffust storcellet B-cellelymfom (DLBCL) og høygradig B-cellelymfom (HGBL) som får tilbakefall innen 12 måneder etter fullføring av, eller som er refraktære overfor, førstelinje kjemoimmunterapi. Behandling av voksne pasienter med residivert eller refraktær (r/r) DLBCL og primært mediastinalt storcellet B cellelymfom (PMBCL), etter to eller flere linjer med systemisk behandling. Behandling av voksne pasienter med r/r follikulært lymfom (FL), etter tre eller flere linjer med systemisk behandling. Dosering og administrasjonsmåte: Behandling skal administreres ved et kvalifisert behandlingssenter av en lege med erfaring i behandling av maligne blodsykdommer kvalifisert for administrasjon av Yescarta. Før infusjon må ≥1 dose tocilizumab til bruk i tilfelle cytokinfrigjøringssyndrom (CRS) og akuttutstyr være tilgjengelig. Behandlingssenteret skal ha tilgang til 1 ytterligere dose av tocilizumab ≤8 timer etter hver foregående dose. 1 enkeltdose inneholder en infusjonsvæske, dispersjon av CAR-positive levedyktige T-celler i 1 infusjonspose. Måldosen er 2 × 106 CAR-positive levedyktige T-celler/kg kroppsvekt (maks. 2 × 108 celler for pasienter som veier ≥100 kg). Til autolog bruk. Gis ved i.v. infusjon, se SPC. Kontraindikasjoner: Overfølsomhet for innholdsstoffene eller overfor gentamicin (mulig spor av reststoff). Kontraindikasjoner for lymfodepleterende kjemoterapi må vurderes. Advarsler og forsiktighetsregler: Grunner til å utsette behandlingen: Pågående alvorlige bivirkninger (spesielt lungereaksjoner, hjertereaksjoner eller hypotensjon) inkl. fra tidligere kjemoterapi, aktiv ukontrollert infeksjon, aktiv transplantat-mot-vert-sykdom (GvHD). Alvorlig CRS og/ eller nevrologiske hendelser, inkl. livstruende og dødelige reaksjoner, er svært vanlig. Pasientene må overvåkes daglig de første 7 dagene etter infusjon for tegn/symptomer på CRS, nevrologiske hendelser og annen toksisitet, og leger kan vurdere sykehusinnleggelse ved første tegn eller symptom på CRS og/eller nevrologiske hendelser. Etter de 7 første dagene overvåkes pasientene etter legens skjønn. Pasientene skal instrueres til å oppholde seg i nærheten av et kvalifisert behandlingssted i minst 4 uker etter infusjon og å søke umiddelbar legehjelp ved tegn eller symptomer på CRS eller nevrologiske bivirkninger. For gradering og behandlingsveiledning, se SPC. Pasientene må overvåkes for symptomer på infeksjon før, under og etter infusjon og behandles hensiktsmessig. Interaksjoner: Levende virusvaksiner anbefales ikke ≤6 uker før oppstart med lymfodepleterende kjemoterapi, under behandlingen og frem til restituering av immunsystemet etter behandling. Graviditet og amming: Ikke anbefalt til fertile kvinner som ikke bruker prevensjon. Graviditetsstatus må undersøkes før oppstart av behandling. Gravide eller ammende kvinner må informeres om mulig risiko for fosteret. Bivirkninger: Svært vanlige: Uspesifiserte patogeninfeksjoner, virusinfeksjon, bakterieinfeksjon, febril nøytropeni, nøytropeni, lymfopeni, leukopeni, anemi, trombocytopeni, CRS, reduserte immunglobuliner, hyponatremi, hypofosfatemi, hyperurikemi, hyperglykemi, nedsatt appetitt, delirium, søvnløshet, encefalopati, tremor, hodepine, svimmelhet, takykardi, arytmi, hypotensjon, hypertensjon, hoste, oppkast, diaré, forstoppelse, magesmerter, kvalme, økte transaminaser, utslett, motorisk dysfunksjon, muskel- og skjelettsmerter, feber, ødem, fatigue, frysninger. Pakninger og priser: 1 stk (Infusjonspose) 402302, 3984723.80 kr. Ingen refusjon. Reseptgruppe: C. Innehaver av markedsføringstillatelsen: Kite Pharma EU B.V. Science Park 408, 1098 XH Amsterdam, Nederland. Ytterligere informasjon: Kontakt lokal representant: Gilead Sciences, tlf. +46
For mer informasjon, se preparatomtale. Basert på preparatomtale 07/2025.
I forrige utgave av OnkoNytt intervjuet vi grunnleggerne av Common Sense Oncology (CSO) (1). CSO har som mål å få onkologer og beslutningstakere til å prioritere behandlinger som gir klinisk meningsfull nytte for kreftpasienter. I denne artikkelen gis en kort introduksjon til et verktøy for å bedømme meningsfull nytte (2). Presise vurderinger av meningsfull nytte krever kliniske studier av høy kvalitet gjennomført i representative pasientpopulasjoner. Derfor presenteres også CSOs prinsipper for design, analyse og rapportering av kliniske studier (3).

MEETALI
Lege i spesialisering, onkologisk avdeling Akershus universitetssykehus
HVORDAN DEFINERES
MENINGSFULL NYTTE?
I Norge brukes tre prioriteringskriterier for å vurdere hvilke nye medisiner som skal innføres i spesialisthelsetjenesten: nytte, ressursbehov og alvorlighet (4). Kriteriene brukes på tvers av fagområder. Kvalitetsjusterte leveår (QALYs) ble tidligere mye brukt til å kvantifisere helsegevinst og beregne kostnadseffektivitet. Markedsføringstillatelser gis imidlertid i økende grad basert på data fra tidligfase kliniske studier med mindre robuste studiedesign og kortere oppfølgingstid. Dette kan føre til raskere tilgang til legemidler, men innebærer større usikkerhet om effekt og toksisitet – noe som også gjør beregning av QALYs vanskeligere. Hvordan kan klinikere og myndigheter navigere i dette usikre landskapet når de skal bestemme hvilke legemidler som bør prioriteres? Hvordan får vi til reelt samvalg hvis kunnskapsgrunnlaget er mangelfullt?
Å kunne kvantifisere nytte på en meningsfull og presis måte er særlig viktig i behandlingen av pasienter med avansert kreft. Målet ved behandling av denne pasientgruppen er å forlenge totaloverlevelse (OS), lindre symptomer og/eller forbedre helserelatert livskvalitet (health-related quality of life,
HRQoL). Nye behandlingsalternativer kan gi en beskjeden økning i overlevelse, men samtidig medføre betydelig toksisitet, med negativ innvirkning på både symptombyrde og livskvalitet. Dessuten er studiedata ofte basert på yngre pasienter uten betydelig komorbiditet (ECOG 0–1). Dette utfordrer klinikere, som må forsøke å oversette funn fra ikke-representative studiepopulasjoner til den eldre, mer skrøpelige pasienten de har foran seg.
ESMOS VERKTØY FOR MENINGSFULL BEHANDLINGSNYTTE
I 2015 utviklet ESMO et verktøy for kvantifisering av meningsfull nytte av kreftbehandlinger: ESMO Magnitude of Clinical Benefit Scale (ESMO-MCBS) (2). Intensjonen var å hjelpe klinikere og beslutningstakere til å navigere “hypen” rundt nye terapier ved å tilby en strukturert og rettferdig tilnærming. Det opprinnelige verktøyet gjaldt solide tumores, men i 2023 ble det videreutviklet til også å omfatte hematologiske maligniteter.
ESMO-MCBS tar hensyn til OS, progresjonsfri overlevelse (PFS), sykdomsfri overlevelse (DFS), hazard ratio, molekylær responsrate, livskvalitet, prognose og toksisitet. Verktøyet for solide tumores
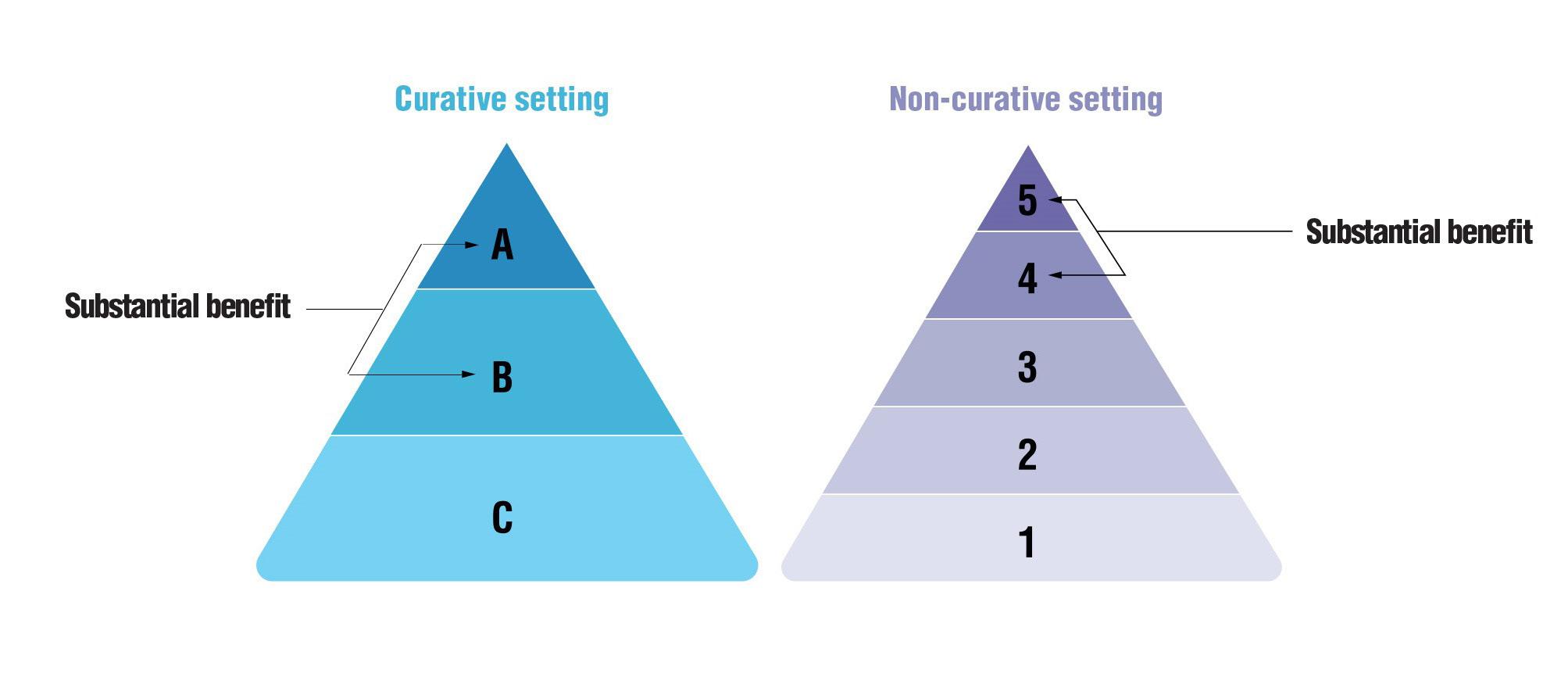
består av et evalueringsskjema og et tilleggsskjema for skåring av livskvalitet. Det finnes fem ulike evalueringsskjemaer avhengig av setting (kurativ eller palliativ), primært endepunkt (OS, PFS eller alternative endepunkter) samt om det gjelder sjeldne sykdommer (orphan disease) eller tilstander med stort udekket behov. For hematologiske maligniteter finnes det egne skjemaer.
For behandling rettet mot avansert kreft strekker skalaen seg fra 1 (minimal eller ingen klinisk nytte) til 5 (høyest klinisk nytte). For kurative tiltak varierer skalaen fra A til C. Intervensjoner som bedrer HRQoL gis høyere skår. Meningsfull behandlingsnytte defineres som skår på A eller B, alternativt 4 eller 5, og regnes som tilskrekkelig evidens for rask innføring. Dette er imidlertid ikke så vanlig. En systematisk oversikt over 277 randomiserte kontrollerte forsøk (RCT) innen brystkreft, kolorektal kreft, pankreaskreft og ikke-småcellet lungekreft viste at kun 31 % av studier med statistisk signifikante funn oppfylte ESMOs kriterier for meningsfull behandlingsnytte (5). ESMO-MCBS inkluderes ikke konsekvent i metodevurderinger
av nye kreftmedisiner som behandles av Beslutningsforum, til tross for at det kan bidra til mer effektiv saksbehandling og beslutninger (6).
PRINSIPPER FOR DESIGN, ANALYSE OG RAPPORTERING AV FASE 3-STUDIER
ESMO-MCBS anvendes retrospektivt på publiserte RCT-er. Mange holder høy metodologisk kvalitet, men enkelte studier har svakheter i studiedesign, statistisk analyse eller rapportering. Til tross for metodiske svakheter kan signifikante resultater med stor nok oppmerksomhet drive frem kliniske endringer.
For å bidra til økt studiekvalitet lanserte CSO et sett av prinsipper for design, analyse og rapportering av fase 3-studier. Disse skal fungere som metodologiske standarder og sikre at endepunkter som er viktige for pasientene, bl.a. livskvalitet, inkluderes. På denne måten vil kunnskapsgrunnlaget som brukes i klinisk øyemed og i policyutforming styrkes. Under følger en kortfattet beskrivelse av prinsippene. For mer informasjon anbefales den nylig publiserte artikkelen i Lancet Oncology (3).
Innenfor studiedesign fokuseres det på inklusjonskriterier, valg av kontrollgruppe, statistisk analyseplan, studiedesign, toksisitetsvurdering, målinger av helserelatert livskvalitet, sensurering, subgruppeanalyser og behandling etter sykdomsprogresjon. Forfatterne understreker også behovet for pasientinvolvering i utforming og planlegging av studier.
Inklusjonskriterier: Kreftstudier er ofte begrenset til pasienter med ECOGskår 0–1 og uten komorbiditet. Dette gir lite representative data. CSO anbefaler brede inklusjonskriterier, med biomarkørbaserte eksklusjoner kun der dette er begrunnet og spesifisert på forhånd. Kontrollgrupper skal alltid gis best tilgjengelige standardbehandling.
Utvalgsstørrelse: Utvalgsstørrelsen må være tilstrekkelig stor for å kunne avdekke klinisk signifikante forskjeller.
Endepunkter: OS og HRQoL er foretrukne endepunkter. PFS og DFS brukes mer og mer, men korrelerer ofte svakt med OS og kan lett misforstås av pasientene. CSO erkjenner at deres
synspunkt er kontroversielt, og åpner for at PFS kan brukes som primært endepunkt ved langsomt progredierende sykdommer. De anbefaler at studier med PFS som primært endepunkt bør ha tilstrekkelig statistisk styrke til å påvise store forskjeller i PFS, samtidig som HRQoL også måles.
Toksisitet: Detaljert toksitetsrapportering bør inkludere alvorlige bivirkninger (grad 3–5), kroniske lavgradige bivirkninger og toksisitetsrelatert frafall. Common Terminology Criteria for Adverse Events (CTCAE) foretrekkes, men supplerende pasientrapporterte data anbefales. Leger underrapporterer ofte bivirkninger sammenlignet med pasientens egen vurdering (7).
HRQoL: Måling og rapportering bør skje i henhold til internasjonale standarder.
Sensurering: Informativ sensur er frafall som fører til sensurering som ikke er tilfeldig. Det kan føre til bias. Studiefrafall bør minimeres, og årsaker dokumenteres. Sensitivitetsanalyser anbefales for å modellere effekten av sensurering.
Subgruppeanalyse: Subgruppeanalyser skal prespesifiseres. Positive resultater fra post hoc-analyser må bekreftes i egne studier.
Behandling etter progresjon: Ny kreftbehandling testes ofte hos pasienter med avansert sykdom som har progrediert under standardbehandling. Ved positive funn kan den prøves ut ved sykdom i tidlig fase eller i adjuvant setting. Det er hensiktsmessig å sammenligne effekt og toleranse av legemidlet i disse ulike settingene
for å avgjøre når det bør tilbys. CSO anbefaler at randomiserte kontrollerte studier som tester ut slike legemidler i tidligfase sykdom, tillater at pasienter i kontrollarmen får intervensjonen dersom sykdommen progredierer. Dette vil også redusere bias som favoriserer tidligere bruk av legemidlet. Det foreslås at studiesponsoren bør dekke kostnadene ved kryss-overbehandling. Data om behandling etter sykdomsprogresjon bør innhentes som en del av rutinemessig oppfølging.
ANALYSE OG RAPPORTERING
Prinsippene skissert over vil styrke kvaliteten på publiserte studier. CSO har utviklet to sjekklister som vil bistå forskere, artikkelforfattere og tidsskriftredaktøreri å ta i bruk prinsippene. CSO anbefaler bruk av CONSORT-sjekklisten ved rapportering av RCT-resultater (8). Ytterligere forslag finnes i Lancet Oncology-artikkelen.
DISKUSJON
Fremtiden er fortsatt lys for innovative kreftbehandlinger. Antallet kreftlegemidler og deres indikasjoner øker. Flere kliniske studier viser «statistisk signifikante funn», men ikke alle funn har klinisk betydning og studiekvaliteten kan variere. Å navigere i dette landskapet er en utfordring.
CSO-prinsippene har som mål å styrke kvaliteten på kliniske studier og kunnskapsgrunnlaget tilgjengelig for klinikere og pasienter. ESMO-MCBS er et verktøy for å tolke studieresultater – om en behandling faktisk forbedrer både levetid og livskvalitet.
Det er naturlig å se dette i sammenheng med Kloke valg-kampanjen
(Choosing Wisely), som har som mål å redusere undersøkelser og behandlinger som ikke gir klinisk nytte eller som kan skade (9). Kampanjen ble startet i USA i 2012 og drives i Norge av Legeforeningen. Det er et flott og viktig initiativ, men anbefalingene er overordnede og dermed vanskelig å implementere. Studier som bygger på CSO-prinsippene og ESMO-MCBS kan hjelpe onkologer til å ta kloke valg sammen med deres pasienter.
Ved å utvide inklusjonskriterier til også å omfatte pasientgrupper som sjelden deltar i dagens kliniske studier vil vi kunne fremskaffe viktig informasjon om dose-respons, dose-toksisitet og livskvalitet. Det vil øke kvaliteten i pasientbehandling og redusere skade. Vi trenger flere forskerinitierte studier dersom legemiddelindustrien ikke prioriterer utvidede inklusjonskriterier, detaljert toksisitetsrapportering eller de-eskaleringsstudier. Forskningsrådet og regionale helseforetak som finansierer studier kan kreve at CSOprinsippene og ESMO-MCBS benyttes i fremtidige studier. Det samme gjelder i metodevurderingene og beslutningsprosesser som ligger til grunn for innføring av nye metoder.
Det er all grunn til å tro at legemiddelutviklingen vil skyte fart i årene fremover, særlig innenfor onkologi. Med et økende antall kreftpasienter og stadig knappere helseressurser vil fokuset på meningsfull nytte bli stadig mer avgjørende.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no


Elrexfio (elranatamab) er indisert som monoterapi til behandling av voksne pasienter med tilbakevendende og refraktær myelomatose, som har mottatt minst tre tidligere behandlinger, inkludert et immunmodulerende legemiddel, en proteasomhemmer og et anti-CD38-antistoff, og har vist sykdomsprogresjon under siste behandling2
Elrexfio (elranatamab)
Indikasjon: Elrexfio er indisert som monoterapi til behandling av voksne pasienter med residiverende og refraktær my-elomatose som har fått minst tre tidligere behandlinger, inkludert et immunmodulerende legemiddel, en proteasomhem-mer og et anti CD38 antistoff, og har vist sykdomsprogresjon under siste behandling. Dosering: De anbefalte dosene er opptrappingsdoser på 12 mg på dag 1 og 32 mg på dag 4, etterfulgt av en full behandlingsdose på 76 mg per uke fra uke 2 til uke 24. Hos pasienter som har fått minst 24 ukers behandling og som har oppnådd respons, bør doseringsintervallet gå over til annenhver uke..Hos pasienter som har fått minst 24 ukers behandling annenhver uke og som har vedvarende respons, bør doseringsintervallet gå over til hver fjerde uke. Advarsler og forsiktighetsregler: Behandling skal initieres og overvåkes av leger med erfaring innen behandling av myelomatose. Alvorlig eller livstruende cytokinfrigøringssyndrom (CRS), nevrologiske toksisiteter, inkludert immuneffektorcelle-assosiert nevrotoksisitetssyndrom (ICANS), infeksjoner, nøytropeni, samt hypogamma-globulinemi kan forekomme under behandling med Elrexfio. Egnet medisinsk utstyr for å håndtere alvorlige reaksjoner, inkludert cytokinfrigjøringssyndrom (CRS) og immuneffektorcelle-assosiert nevrotoksisitetssyndrom (ICANS) skal være tilgjengelig. Se preparatomtalen for informasjon om behandling av CRS, ICANS, hematologiske og ikke-hematologiske bivirkninger. Elrexfio har en merkbar effekt på evnen til å kjøre bil og bruke maskiner. Komplett blodstatus skal utføres før oppstart av behandlingen, og enhver mulighet for aktive infeksjoner og/eller graviditet hos kvinner i fertil alder skal utelukkes. Pasienter bør premedisineres som angitt i preparatomtalen. Elrexfio skal administreres via subkutan injeksjon av helsepersonell, som har fått tilstrekkelig opplæring. Interaksjoner: Ingen interaksjonsstudier har blitt utført med Elrexfio.
Pakninger, priser og refusjon: Elrexfio injeksjonsvæske 44 mg/1,1 ml kr 43.855,- (hettegl.), Elrexfio injeksjonsvæske 76 mg/1,9 ml kr 75.758,10 (hettegl.) Reseptgruppe C. For ytterligere informasjon vennligst se SPC. Beslutningforum beslutning 23.09.24: «Følgende maksimal dosering skal brukes: • Første syklus (28 dager): Step-up-doser første uken, og deretter 76 mg ukentlig. • Andre til fjerde syklus (28 dager): 76 mg ukentlig. • Femte syklus og videre: 76 mg hver 28. dag.»
Referanser:
1 https://www.nyemetoder.no/metoder/elranatamab-elrexfio, lest 05.10.2025
2 Elrexfio SPC, kap 4.1

I PallSoft (Palliative radiotherapy in symptomatic pelvic Soft tissue tumors) sammenligner vi den symptomlindrende effekten av to palliative fraksjoneringsregimer. Alle landets stråleterapiavdelinger deltar, og pasienter med plager fra bløtvevssvulster i bekkenet utgående fra gastrointestinal, urologisk eller gynekologisk kreftsykdom kan vurderes for inklusjon.
MAREN SYNNØVE ØRVIK
Stipendiat og lege i spesialisering, avdeling for kreft- og blodsykdommer
Sykehuset Telemark
HARALD BULL RAGNUM
Overlege, avdeling for kreftog blodsykdommer
Sykehuset Telemark
KJERSTI ØVRUM SKIPAR
Overlege, avdeling for kreftog blodsykdommer
Sykehuset Telemark kjeski@sthf.no.
Bløtvevssvulster i bekkenet er ofte symptomgivende, typisk i form av smerter, blødninger eller plager fra tarm, urinveier eller underlivet. Disse symptomene kan påvirke pasientenes livskvalitet i stor grad (1). Fra tidligere studier og klinisk praksis vet vi at palliativ strålebehandling gir effektiv symptomlindring (2, 3). Det optimale stråleterapiregimet, som hensyntar både behov for palliativ effekt og kort behandlingstid, er imidlertid mindre klart. Tidligere studier er primært retrospektive og vanskelige å sammenligne siden ulike fraksjoneringsregimer er benyttet

(4-6). Dermed er det stor variasjon i klinisk praksis på tvers av krefttype og behandlende sykehus.
I PallSoft-studien sammenligner vi to fraksjoneringsregimer hos pasienter med symptomatiske bløtvevssvulster i bekkenet utgående fra gastrointestinal, urologisk og gynekologisk kreft (7). Alle sykehus i Norge som tilbyr strålebehandling deltar, og studien illustrerer derfor potensialet for nasjonalt samarbeid innen stråleterapiforskning. Resultatene fra studien vil forhåpentligvis kunne bidra til en mer enhetlig pasientbehandling, både nasjonalt og internasjonalt.
STUDIEDESIGN OG METODE
PallSoft (ClinicalTrials ID: NCT06398314) er en prospektiv, randomisert, open-label, noninferiority fase III-studie (figur 1) med finansiering fra KLINBEFORSK. 200 pasienter planlegges inkludert over en periode på 2–4 år. Studien har et pragmatisk design, hvor vi ønsker et pasientutvalg som representerer en usortert populasjon i en klinisk hverdag. Pasientene definerer sitt hoved-

Figur: Skjematisk oversikt over studien PallSoft. Pasienter med symptomatisk bløtvevssvulst i bekkenområdet utgående fra gastrointestinal, urologisk eller gynekologisk kreftsykdom randomiseres til å motta enten 8 Gy x 1–2 eller 5 Gy x 5. Studiens endepunkter inkluderer symptomlindring, helseøkonomi, overlevelse, bivirkninger, pasienttilfredshet og helserelatert livskvalitet. Videre vil prognostiske biomarkører for overlevelse, samt prediktive biomarkører for stråleterapieffekt bli undersøkt.
symptom ut fra fem kategorier (gastrointestinal, urologisk eller vaginal dysfunksjon, smerte eller blødning) og graderer symptomet på en skala fra 0–10. Pasientene randomiseres så 1 : 1 mellom to stråleterapiregimer; henholdsvis 8 Gy x 1–2 (arm A) eller 5 Gy x 5 (arm B).
Randomiseringen er stratifisert på symptomene smerte og blødning for å sikre lik fordeling mellom armene.
Pasientene i arm A tilbys i første omgang en engangsfraksjon på 8 Gy, men kan ved utilstrekkelig effekt, vurdert etter definerte kriterier, tilbys en ny tilsvarende behandling etter fire uker. Denne behandlingen planlegges gitt på samme behandlingsplan såfremt det er god overenstemmelse med avbildningen på behandlingsapparatet. Total tumordose beregnet i 2 Gy-ekvivalent dose er på 12/24 Gy i arm A og 31,3 Gy i arm B, gitt en alfa/beta-ratio på 10. Begge fraksjoneringsregimene er etablerte i dagens kliniske praksis på gjeldende indikasjon og er erfaringsmessig effektive og godt tolererte. Valg av fraksjoneringsregime i de to behandlingsarmene er grundig diskutert i en nasjonalt sam-
mensatt studiegruppe og forsøker å forene behandlingspraksis på tvers av ulike krefttyper og sykehus, samtidig som etiske prinsipper hos en sårbar pasientgruppe ivaretas.
Det primære endepunktet for studien er å undersøke om 8 Gy x 1–2 er like bra som 5 Gy x 5 med hensyn til pasientrapportert symptomlindring, vurdert etter 12 ukers oppfølging. Symptomlindring vil i tillegg bli vurdert etter 4, 8 og 26 uker for å få en dynamisk vurdering av effekt.
Sekundære endepunkter er legerapportert blære- og tarmtoksisitet etter 4, 12 og 52 uker, samt totaloverlevelse i de to behandlingsarmene. Eksplorative endepunkter inkluderer all relevant toksisitet, helserelatert livskvalitet, prognostiske modeller for overlevelse og helseøkonomiske aspekter. Molekylærbiologiske og radiologiske analyser planlegges utført på tumorbiopsier og MR-bilder tilgjengelig fra tidligere utredning og behandling, med det formål å identifisere prediktive markører for stråleterapirespons. Relevante stråleterapidata vil bli undersøkt med tanke på dose-respons-sammenhenger.
Palliativ strålebehandling gir effektiv symptomlindring ved symptomatiske bløtvevssvulster i bekkenet, men vi mangler evidens fra randomiserte studier som kan styre fraksjoneringsvalg i dagens kliniske praksis. PallSoft er en nasjonal, randomisert stråleterapistudie som har som overordnet mål å bidra til en mer enhetlig strålebehandling på tvers av diagnoser og sykehus. Studien vil i tillegg gi viktig informasjon om toksisitet og livskvalitet, og vil kunne gi prognostiske og prediktive verktøy som kan være nyttige for behandlingsvalg hos den enkelte pasient. Positive resultater vil også kunne bidra til bedre utnyttelse av helseressurser, sett i lys av en stadig aldrende befolkning og økende kreftinsidens og -prevalens. Et pragmatisk studiedesign og den nasjonale deltagelsen vil kunne bidra til at resultatene enklere kan implementeres i klinisk praksis.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
Det internasjonale SISAQOL-IMI-prosjektet, finansiert av EU og IMI, har utviklet konsensusbaserte retningslinjer for design, analyse, tolkning og presentasjon av PRO-data som kan hjelpe deg.

CECILIE DELPHIN AMDAL
Overlege, ph.d., forskningsgruppeleder hud- og hode-halskreft avdeling for kreftbehandling
Oslo universitetssykehus
Leder
PROMiNET, Regional forskningsstøtte, Helse Sør-Øst
Målet med kreftbehandling er å helbrede pasienter, forlenge livet, og/eller å sikre best mulig livskvalitet under og etter behandling. Det er enighet om at helse-relatert livskvalitet (health-related quality of life, HRQoL) er et konsept som rapporteres best av pasientene selv og derfor inngår i samlebegrepene pasientrapporterte utfall eller pasientrapporterte utfallsmålinger (patientreported outcomes, PROs).
Selv om det er anerkjent at PROs er viktige i kliniske kreftstudier for å vurdere fordeler og ulemper ved ulike kreftbehandlinger og for å legge grunnlag for best mulig pasientsentrert kreftomsorg, har det likevel vært vanskelig å implementere PROs og resultater fra tidligere studier i klinisk praksis. Det har også vært krevende å få PROs integrert i beslutningsprosesser hos regulatoriske myndigheter som det Europeiske legemiddelbyrået (EMA) og Mat- og legemiddeladministrasjonen i USA (FDA) selv om de har lagt økende vekt på PROs de siste årene. I tillegg ser vi begrenset bruk av PROs i metodeutvikling og i politiske helsebeslutninger (1).
Skepsis til data fra studier med PROs kan skyldes at de ofte måles, analyseres og presenteres på ulik måte avhengig av forskningsgruppe og tradisjon. I litteraturen finnes flere eksempler der ulike analysemetoder, brukt på data fra samme randomiserte studie, har gitt tilsynelatende motstridende resultater. Dette er godt illustrert i en artikkel av Bottomley et al. (2). Inkonsistens i analyse, tolkning og rapportering av klinisk relevans gjør det vanskelig å sammenligne PRO-resultater på tvers av kliniske studier og hindrer implementering i kliniske retningslinjer og i regulatoriske beslutningsprosesser. I tillegg er mangelfull rapportering av hvordan manglende PRO-data og hendelser underveis i studien håndteres en betydelig utfordring.
Planlegging av studier med bruk av PROs innebærer en rekke metodologiske valg som påvirker studiens konklusjon om pasientenes HRQoL. Selv om det finnes retningslinjer for hvordan PROs bør inkluderes i studieprotokoller (SPIRIT-PRO), rapporteres i vitenskapelige artikler (CONSORT-PRO) og presenteres grafisk (3-5), mangler det en felles metodologisk standard. Det er behov for konsensus blant alle relevante

aktører og beslutningstakere for en enhetlig og akseptert tilnærming for analyse, tolkning og presentasjon av PRO-data. En slik konsensusbasert standard er nødvendig for å sikre at dataene kan benyttes på en pålitelig måte i beslutningsprosesser.
Slike utfordringer har ledet «Setting International Standards in Analysing Patient-Reported Outcomes and Quality of Life endpoints – Innovative Medicines Initiative» (SISAQOL-IMI) til å utvikle konsensusbaserte internasjonale retningslinjer for analyse, tolkning og presentasjon av PRO-data i kliniske kreftstudier. Disse retningslinjene er nå klare for publisering. På SISAQOL-IMIs nettside www.sisaqolimi.org/ finnes lenke til SISAQOLIMI-håndboken, interaktiv tabell, ordbok, sjekkliste for brukerrepresentanter og publiserte resultater (6).
METODE Organisering
SISAQOL-IMI er et offentligprivat samarbeidsprosjekt, etablert i 2021 under Innovative Health Initiative (tidligere kjent som Innovative Medicines Initiative (IMI)),
og finansieres av EU og samarbeidende industripartnere. Prosjektet ledes av European Organisation for Research and Treatment of Cancer (EORTC) og Boehringer Ingelheim. For å etablere konsensusbaserte anbefalinger var det nødvendig å samle en rekke ulike aktører. SISAQOL-IMIkonsortiet består av 41 organisasjoner med 185 medlemmer fra 15 land. Akademia, industrien, regulatoriske myndigheter (FDA og EMA), pasientrepresentanter, ideelle organisasjoner / kreftorganisasjoner, små og mellomstore bedrifter og helseøkonomiske vurderingsorganer har deltatt. I Norge har Oslo universitetssykehus HF (K. Bjordal, R.S. Falk, K.L. Joseph, G.L. Astrup, C.D. Amdal) og Direktoratet for medisinske produkter (A. Schiel) deltatt.
Utarbeidelse av nye retningslinjer i arbeidspakkene Arbeidet har vært organisert i åtte arbeidspakker (AP) (figur 1).
Tre tverrgående arbeidspakker har hatt ansvar for styring og koordinering (AP1), konsensusprosessen og utarbeidelse av sluttproduktene
(AP7) og pasientinvolvering, kommunikasjon og læringsverktøy (AP8). De fire vitenskapelige arbeidspakkene (AP2, AP3, AP4 og AP6) har utarbeidet nye anbefalinger i henhold til fire prioriteringsområder:
a) Håndtering av PROs i randomiserte kontrollerte studier
b) Håndtering av PROs i enarmede intervensjonsstudier eller observasjonsstudier
c) Presentasjon og visualisering av PRO-resultater i studier
d) Definisjon av klinisk relevante terskler for forskjeller og endringer i PRO-skårer. Tolkning av klinisk relevans eller meningsfullhet i endringer og forskjeller i PROskårer er nødvendig, men utfordrende. Dette skyldes variasjon i hvordan slike begreper defineres, samt inkonsistens i både terminologi og metodologi.
Preliminære retningslinjer ble deretter pilottestet (AP5).
Hver av de fire vitenskapelige arbeidspakkene brukte samme fremgangsmåte for utvikling av anbefalingene

1. Litteraturgjennomgang
2. Diskusjon og kartleggingsundersøkelse i arbeidsgruppen
3. Inklusjon av preliminære anbefalinger i konsensusundersøkelsen i konsortiet
4. Revisjon av preliminære anbefalinger på bakgrunn av resultater fra konsensusundersøkelsen og diskusjon i arbeidsgruppen og i konsortiet
5. Revisjon av preliminære anbefalinger etter pilottesting i AP5
6. Harmonisering av anbefalingene mellom arbeidspakkene
Konsensusprosessen:
Målet med konsensusprosessen var at det skulle oppnås så høy grad av enighet som mulig. Flertall for en anbefaling var ikke nok. Hvis det var motstand mot et forslag til tekst ble teksten modifisert basert på innspill fra partnerne, og stemt over inntil tre ganger for å oppnå høyest mulig konsensus.
Dette foregikk på følgende måte: Ved slutten av hvert år i en treårsperiode meldte de vitenskapelige arbeids-
pakkene inn forslag til anbefalinger innen sitt område. Forslagene ble vurdert av en gruppe klinikere, pasientrepresentanter og statistikere for å sikre at de var forståelige og relevante. Arbeidspakkelederne fikk deretter mulighet til å revidere teksten basert på innspillene fra gruppen før inklusjon i den årlige konsensusundersøkelsen. Første avstemning foregikk digitalt. De 41 medlemsorganisasjonene hadde én stemme hver, og organisasjonene diskuterte internt før de avga stemme. Fra OUS var vi 5–15 personer som deltok i diskusjonen før vi avga vår stemme.
Et forslag til anbefaling ble godkjent dersom minst to tredjedeler støttet det og det ikke var spesifikke interessegrupper som stemte imot eller hadde kommentarer av alvorlig karakter. Alle andre forslag til anbefalinger ble diskutert på det etterfølgende konsensusmøtet før de ble stemt over på nytt. Dersom anbefalingen ikke oppnådde konsensus i andre avstemningsrunde, ble det enten en ny runde diskusjon og
avstemning på møtet eller revidering av forslaget for inklusjon i neste års konsensusundersøkelse.
Pasientrepresentanter var involvert i alle deler av SISAQOL-IMI-arbeidet, inkludert utvikling, gjennomgang og diskusjon av forslag til anbefalinger.
Uavhengig validering og pilottesting
Ulike uavhengige, eksterne råd innen etikk og vitenskapelig metode kontrollerte SISAQOL-IMI-arbeidet. Rådene deltok på konsensusmøtene og ga tilbakemelding underveis til arbeidspakkene. I tillegg var det en egen arbeidsgruppe som intervjuet eksterne PRO-eksperter om deres mening angående de preliminære anbefalingene og organiserte pilottesting hvor uavhengige eksterne eksperter fikk i oppdrag å bruke de preliminære anbefalingene i utarbeidelse av en demo-protokoll og i en demo-statistisk analyse-plan. Arbeidspakkelederne brukte tilbakemeldingene fra intervjuene og pilottestingen til å justere anbefalingsteksten.

Parallelt med utviklingen av de nye retningslinjene pågikk arbeidet med å lage en ordbok med definisjoner og forklaringer på ord og uttrykk. Det ble både laget en versjon med vitenskapelig språk og en med folkelig språk.
SISAQOL-IMI har utviklet retningslinjer med totalt 146 anbefalinger for bruk av PROs i klinisk kreftforskning. Hver anbefaling består av en anbefalingstekst med forklaring og eksempler. Retningslinjene er organisert i henhold til et analytisk rammeverk som består av estimandrammeverket (7) og fire tilleggspunkter (tolkning av PRO-skårer, vurdering av design, datakvalitet, analyse og presentasjon av PRO-resultater).
Det er laget fire ulike verktøy/dokumenter som er tilgjengelig på nettsiden til SISAQOL-IMI [www.sisaqol-imi.org/]: 1) en interaktiv tabell 2) en håndbok 3) en ordliste
4) instruksjonsvideoer og sjekklister for pasienter og brukerrepresentanter
I tillegg er resultatene under publisering (6).
Bruk av SISAQOL-IMIs interaktive tabell
Den interaktive tabellen er godt egnet for forskere som planlegger en studie med PROs. Før start må studiedesign, formål med studien og PROvariabelen man er interessert i være på plass. Eksempler på PRO-variabel av interesse kan være størrelse på endring i PRO-skår ved et gitt tidspunkt, andel pasienter med bedring i PRO-skår etter en bestemt tid osv. I tillegg må man ha valgt et validert PRO-måleinstrument som er egnet til å svare på forskningsspørsmålet.
Figur 2 viser et bilde av tabellen, man klikker på aktuell rute og får opp de relevante anbefalingene i henhold til design og formål. I eksemplet som vises i figur 2 har en randomisert kontrollert studie som formål å undersøke om pasientene i intervensjonsgruppen har bedre PRO-endringsskårer på et bestemt tidspunkt enn standardgruppen. PRO-anbefalingene gir svar på hva man må tenke gjennom før man starter studien, håndtering av hendelser underveis i studien, håndtering av manglende resultater, vurdering av analyse av PRO-data, hvilken type figurer som er best egnet til å presentere resultatene med templater for disse, samt anbefalinger for vurdering av klinisk signifikans eller grenseverdier for tolkning av PRO-skårer.
1) Bruk av SISAQOLIMI-håndboken
Håndboken er godt egnet for forskere og stipendiater som ønsker kunnskap om hvordan retningslinjene skal brukes. Den inneholder informasjon om bakgrunnen for retningslinjene, metode og betraktninger rundt arbeidet. I håndboken er også retningslinjene listet opp slik at de kan ses samlet på ett sted, samt er tilgjengelige for forskere uten internettilgang. Håndboken finnes i HTML- og PDF-versjoner (figur 3) på SISAQOLhjemmesiden www.sisaqol-imi.org/.
2) Bruk av SISAQOLIMI-ordlisten
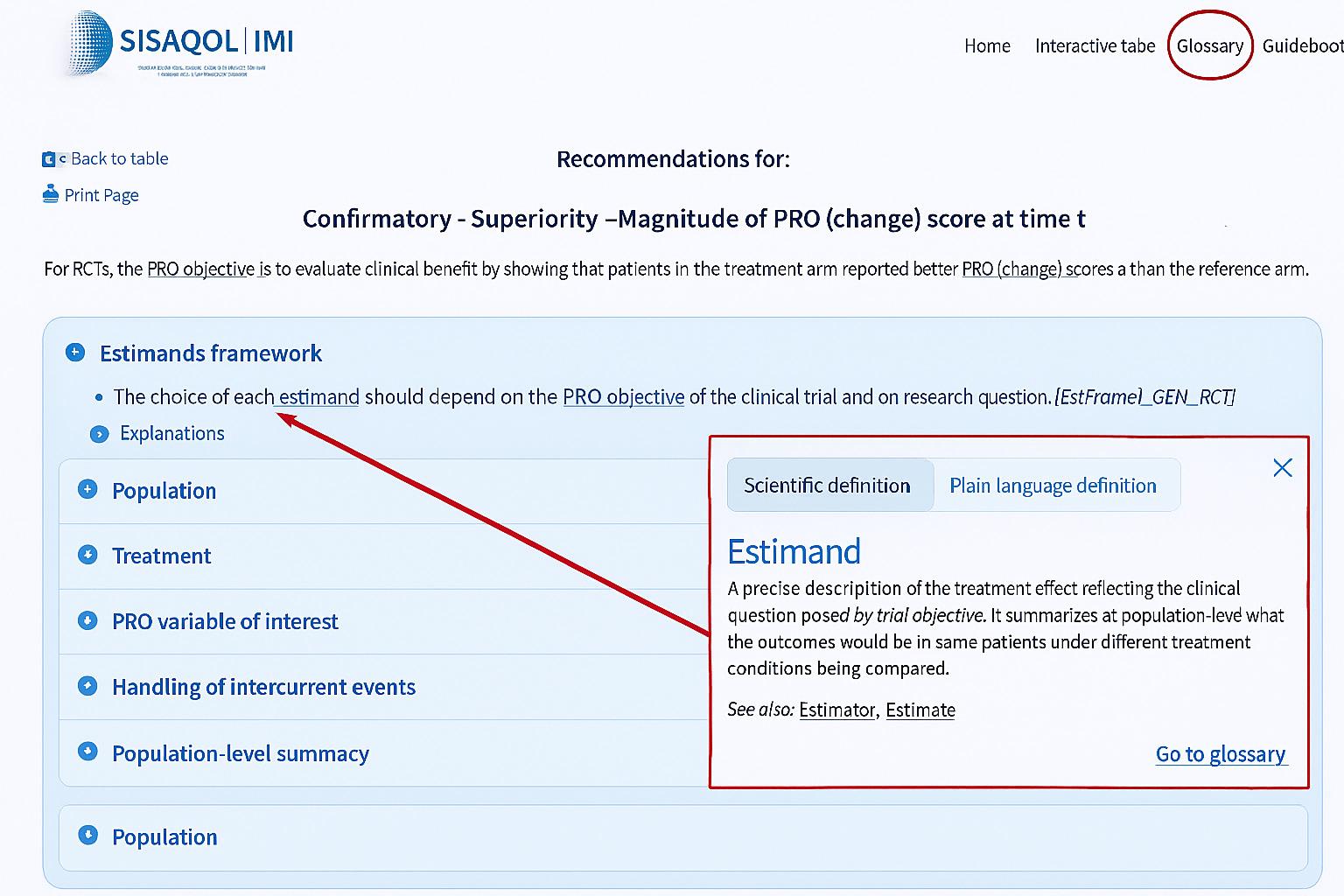
SISAQOL-IMI-ordlisten inneholder definisjonen på 227 ord og utrykk. Den finnes både som et selvstendig verktøy, i den interaktive tabellen og i HTML-versjonen av håndboken. Ved å trykke på ord med stiplet understrekning popper det opp en forklaring på ordet. Det er mulig å velge om man vil se den vitenskapelige eller den folkelige forklaringen (figur 4).
3) Bruk av pasientmateriale
SISAQOL-IMI-pasientrepresentanter har i samarbeid med klinikere, statistikere og arbeidspakkeledere i konsortiet laget sjekklister som brukerrepresentanter eller annet helsepersonell kan bruke ved planlegging eller presentasjon av PROresultater. Sjekklistene kan brukes for å se at forskergruppen har svart ut de PRO-punktene som er spesielt viktige for pasientene. I tillegg er det laget en rekke videoer som er publisert på hjemmesiden som forklarer begreper og prosessen.
Figur 4: Illustrasjon av integrert ordliste i SISAQOL-IMIs interaktive tabell. Ved å trykke på den stiplete linjen for «estimand» kommer definisjonen av begrepet opp i eget vindu. Øverst til høyre kan man klikke seg inn på ordlisten som selvstendig dokument.
SISAQOL-IMI-prosjektets suksess bygger på enighet mellom et bredt spekter av aktører. Denne konsensusen ble oppnådd gjennom konstruktivt og målrettet samarbeid som resulterte i retningslinjer med bred aksept. Slike internasjonale konsensusprosesser som involverer mange ulike interessegrupper er svært krevende, men også veldig lærerikt. Entusiasmen og arbeidsviljen blant verdensledende eksperter, mange med flere tiårs erfaring i utvikling av PRO-metoder og -retningslinjer har vært givende. Sterk deltakelse fra pasientrepresentanter og brukerorganisasjoner var et nøkkelaspekt som sikrer at retningslinjene er relevante og forhåpentligvis lettere å iverksette.
SISAQOL-IMI-retningslinjene fremhever betydningen av estimandtilnærmingen, som sikrer at resultatene gjenspeiler studiens spesifikke PRO-relaterte forskningsspørsmål. Ved å styrke standardene for design, analyse, visualisering og tolkning
av PRO-data, legger retningslinjene til rette for mer robuste og pålitelige funn. Retningslinjene er uavhengige av hvilke validerte spørreskjema som brukes. Selv om retningslinjene er utviklet for kliniske kreftstudier er prinsippene for håndtering av PROs sannsynligvis gyldig på tvers av sykdomsgrupper. Dette må imidlertid verifiseres.
Det neste trinnet er å sikre at retningslinjene tas i bruk. Internasjonalt er de blitt presentert på ulike konferanser og den endelige publikasjonen er tilgjengelig. I Norge vil PROMiNET (www. prominet.no) integrere retningslinjene i PRO-introduksjons- og fordypningskursene som holdes årlig. I tillegg planlegges arbeidsseminarer o.l.
Den brede enigheten og felles forståelsen som er oppnådd gjennom konsensusprosessene i SISAQOLIMI-prosjektet gjennom balansering av ulike behov, krav og perspektiver blant involverte aktører, øker sannsynligheten for at de nye retnings-
linjene vil bli tatt i bruk. Ved å bruke disse retningslinjene vil vi bidra til høyere kvalitet på de statistiske metodene og en mer ensartet tilnærming til analyser av PRO-data. Dette vil gi mer pålitelige funn og bedre tolkbarhet av resultatene i kliniske kreftstudier – noe som er avgjørende for at resultatene skal kunne anvendes i praksis. I tillegg legger retningslinjene til rette for tydeligere kommunikasjon av PRO-data, ved å standardisere hvordan funn rapporteres og visualiseres.
Vi mener SISAQOL-IMI-retningslinjene gir et bedre grunnlag for bruk av PRO-data i regulatoriske godkjenninger, HTA-vurderinger og delt beslutningstaking mellom klinikere og pasienter – og kan dermed bidra til forbedret pasientomsorg.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
INKLUDERT I ANBUD 2507 FRA
1. OKTOBER 2025

TIL DINE PASIENTER MED ØVRE-GI CANCER
er inkludert som FØRSTEVALG i anbud 2507 fra 1. oktober ved følgende 1. linjesbehandlinger1
• Spiserørkreft (plateepitelkarsinom) i kombinasjon med kjemoterapi
• Kreft i gastroøsofageal overgang (GEJ) (adenokarsinom) i kombinasjon med kjemoterapi
• Kreft i ventrikkelen (adenokarsinom) i kombinasjon med kjemoterapi
Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Tevimbra (tislelizumab)
Antineoplastiske midler, monoklonale antistoffer og antistoff-legemiddelkonjugater. ATC-nr: L01FF09. Utleveringsgruppe C. Reseptbelagt legemiddel.
KONSENTRAT TIL INFUSJONSVÆSKE, oppløsning, 100 mg.
Indikasjoner: Ikke småcellet lungekreft (NSCLC): Tevimbra, i kombinasjon med platinabasert kjemoterapi som neoadjuvant behandling, etterfulgt av monoterapi som adjuvant behandling, er indisert til behandling av voksne pasienter med operabel NSCLC med høy risiko for tilbakefall. Tevimbra i kombinasjon med pemetreksed og platinabasert kjemoterapi er indisert til førstelinjebehandling av voksne pasienter som har ikke plateepitel NSCLC hvis svulster har PD-L1-uttrykk på ≥ 50 % av tumorceller, med ingen EGFReller ALK-positiv mutasjon, og som har: lokalavansert NSCLC og ikke er kandidater for kirurgisk reseksjon eller platinabasert radiokjemoterapi, eller metastatisk NSCLC. Tevimbra i kombinasjon med karboplatin og enten paklitaksel eller nab paklitaksel er indisert til førstelinjebehandling av plateepitel NSCLC hos voksne som har: lokalavansert NSCLC og ikke er kandidater for kirurgisk reseksjon eller platinabasert radiokjemoterapi, eller metastatisk NSCLC. Tevimbra som monoterapi er indisert til behandling av voksne pasienter med lokalavansert eller metastatisk NSCLC etter tidligere platinabasert terapi. Pasienter med EGFR-mutasjon eller ALK-positiv NSCLC bør også ha gjennomgått målrettet behandling før de behandles med tislelizumab. Småcellet lungekreft (SCLC): Tevimbra, i kombinasjon med etoposid og platinabasert kjemoterapi, er indisert som førstelinjebehandling hos voksne pasienter med SCLC i omfattende stadium. Gastrisk eller gastroøsofageal junction (G/GEJ) adenokarsinom: Tevimbra, i kombinasjon med platina- og fluoropyrimidinbasert kjemoterapi, er indisert som førstelinjebehandling hos voksne pasienter med HER-2-negative lokalt avansert inoperabelt eller metastatisk gastrisk eller gastroøsofagealt (G/GEJ) adenokarsinom med tumorer som uttrykker PD-L1 med en tumorområdepositivitet (TAP)-score ≥ 5 %. Øsofagealt plateepitelkarsinom (OSCC): Tevimbra, i kombinasjon med platina-basert kjemoterapi, er indisert som førstelinjebehandling hos voksne pasienter med inoperabel, lokalt avansert eller metastatisk OSCC med tumorer som uttrykker PD_L1 med en TAP-score på ≥ 5 %. Tevimbra som monoterapi er indisert til behandling av voksne pasienter med inoperabelt, lokalavansert eller metastatisk OSCC etter tidligere platinabasert kjemoterapi. Nasofaryngealt karsinom (NPC): Tevimbra, i kombinasjon med gemcitabin og cisplatin, er indisert som førstelinjebehandling hos voksne pasienter med tilbakevendende, ikke egnet for kurativ kirurgi eller strålebehandling, eller metastatisk NPC. Kontraindikasjoner: Overfølsomhet overfor virkestoffet(ene) eller overfor (noen av) hjelpestoffet(ene). Dosering: Hvis spesifisert i indikasjonen skal pasientutvelgelse for behandling med Tevimbra basert på tumorekspresjonen av PD-L1 bli vurdert av en CR-merket IVD med det tilsvarende tiltenkte formålet. Hvis den CD-merkede IVD ikke er tilgjengelig, skal en alternativ, validert test brukes. Anbefalt dose av Tevimbra er 200 mg administrert som en intravenøs infusjon hver 3. uke som monoterapi eller i kombinasjon med kjemoterapi. For operabel NSCLC er den anbefalte dosen i den adjuvante behandlingsfasen 400 mg administrert via intravenøs infusjon hver 6. uke. Når Tevimbra og kjemoterapi administreres på samme dag, skal Tevimbra administreres før kjemoterapi. Behandle med Tevimbra inntil sykdomsprogresjon eller uakseptabel toksisitet. For den neoadjuvante og adjuvante behandlingen av operabel NSCLC bør pasienter behandles med neoadjuvant Tevimbra (200 mg hver 3. uke) i kombinasjon med kjemoterapi i 3 eller 4 sykluser eller inntil sykdomsprogresjon som forhindrer definitiv kirurgi eller uakseptabel toksisitet, etterfulgt av adjuvant behandling med Tevimbra (400 mg hver 6. uke) som monoterapi i opptil 8 sykluser eller inntil tilbakefall av sykdom, metastase eller uakseptabel toksisitet. Forsiktighetsregler: Det er rapportert immunrelaterte bivirkninger, også fatale tilfeller, under behandling og etter siste dose. I de fleste tilfeller gikk bivirkningene tilbake ved avbrudd i behandlingen med tislelizumab, administrering av kortikosteroider og/eller støttebehandling. Immunrelatert pneumonitt, hepatitt, kolitt, endokrinopatier og nefritt med nedsatt nyrefunksjon har vært rapportert. Pasientene skal overvåkes med tanke på tegn og symptomer på immunrelaterte bivirkninger. Alvorlige infusjonsrelaterte reaksjoner (inkl. anafylaksi) har vært rapportert. Pasienten bør overvåkes med tanke på tegn og symptomer på infusjonsrelaterte reaksjoner. Tevimbra har liten påvirkning på evnen til å kjøre bil og bruke maskiner. Graviditet og amming: Graviditet: Skal ikke brukes under graviditet, hvis ikke den kliniske tilstanden til kvinnen gjør behandling med tislelizumab nødvendig. Amming: Kvinner må rådes til ikke å amme under behandlingen og ikke amme i minst 4 måneder etter siste dose av Tevimbra. Bivirkninger: Monoterapi: De vanligste bivirkningene er anemi, forhøyet aspartataminotransferase, fatigue og forhøyet alaninaminotransferase. Kombinasjon med kjemoterapi: De vanligste bivirkningene er nøytropeni, anemi, trombocytopeni, kvalme, fatigue, redusert appetitt, forhøyet alaninaminotransferase, forhøyet aspartataminotransferase, utslett og diaré. Se SPC for fullstendig liste. Pakninger og priser: 10 ml (hettegl.), 25027.70 kr. Refusjon: Nei. Basert på SPC godkjent av DMP/EMA 17.09.2025. Innehaver av markedsføringstillatelsen: BeOne Medicines Ireland Limited. Lokal kontakt: BeOne Medicines Sweden AB, Gävlegatan 16, 113 30 Stockholm, Sverige. Les felleskatalogtekst eller preparatomtalen (SPC) for mer informasjon, se www.felleskatalogen.no Sist endret: 30.09.2025
Referanser: 1. Sykehusinkjøp - Anbefaling onkologiske og kolonistimulerende legemidler, www.sykehusinnkjop.no/avtaler-legemidler/onkologi/, lest 09.10.2025. 1025-TEV-PRC-003, Date of preparation October 2025
BeOne Norway • c/o TMF Norway AS • Hagaløkkeveien 26 • 1383 Asker
Oncotype DX®-testen er tilgjengelig i Norge for å veilede beslutninger om cellegiftbehandling for pasienter med HR+ eller HER2- brystkreft i tidlig stadium.7-11
Oncotype DX testen går utover kliniske og patologiske faktorer ved å vise både prognostisk og prediktiv nytte.1-11

For ytterligere informasjon, vennligst kontakt Glenn Gundersen pr_ggundersen@exactsciences.com +47 952 29 513


KRISTIN RANDEL
Lege ph.d, avdelingsdirektør Tarmscreeningavdelingen, Kreftregisteret, FHI

ANNA LISA SCHULT
Overlege, ph.d Tarmscreeningavdelingen, Kreftregisteret, FHI
Overlege
Gastromedisinsk avdeling, Bærum sykehus, Vestre Viken HF.

STINE VEDVIK, Kommunikasjonsrådgiver FHI
Tarmscreeningprogrammet startet i 2022 og ble landsdekkende i 2024. Det er Norges tredje nasjonale kreftscreeningprogram, og det første som omfatter både kvinner og menn. Alle inviteres ved fylte 55 år til å teste seg for blod i avføringen. Tilbudet gjentas annethvert år frem til 65 års alder.
Innbyggere i målgruppen identifiseres gjennom Folkeregisteret og inviteres til å delta, med unntak av personer som har hatt kolorektal kreft (CRC)-diagnose de siste ti årene eller har bedt om ikke å bli invitert.
Ved fylte 55 år vil man motta et digitalt brev med informasjon om tarmscreening. Deretter får man et prøvesett i posten med bruksanvisning og frankert returkonvolutt. Deltageren sender selv prøven til analyse. Alle prøver analyseres ved laboratoriet på Akershus universitetssykehus med immunkjemisk analyse for okkult blod i feces (immunochemical fecal occult blood test, iFOBT). Deltagerne inviteres på nytt annethvert år, inntil fem ganger (figur 1).
Kreftregisteret har det overordnede ansvaret for drift, administrasjon og monitorering av Tarmscreeningprogrammet. Dette innebærer blant annet utsending av brev og invitasjoner, informasjonsarbeid, forvaltning av IT-løsninger, innsamling og bearbeiding av data og rapportering.
Dersom deltagerens prøve viser blod over grenseverdi, sender Tarmscreeningprogrammet en henvisning til helseforetaket, som kaller inn til koloskopi. Alle helseforetakene har etablert screeningsentre for oppfølgende koloskopi. I noen helseforetak er det også opprettet mer enn ett senter på bakgrunn av lang reisevei. Per september 2025 finnes det 24 screeningsentre (figur 2). Helseforetakene har ansvar for å utføre koloskopiene, analysere vevsprøver og sørge for nødvendig utredning, behandling og oppfølging av pasientene.
Så langt har nær 300 000 personer mottatt invitasjon til Tarmscreeningprogrammet, hvorav litt over halvparten har deltatt. Den samlede deltagelsen er 53 %, med en tydelig kjønnsforskjell: 58 % av kvinnene deltar, mot 49 % blant menn. Kvinners erfaring fra andre screeningprogrammer, som Mammografiprogrammet og Livmorhalsprogrammet, kan være én forklaring på høyere deltagelse.
Deltakerflyt i Tarmscreeningprogrammet
Prøvesett sendes i posten ved 55-års alder. Prøven tas hjemme og sendes inn til analyse. Deltaker får svar uansett prøvesvar.
Negativt prøvesvar
Etter 2 år får man tilsendt nytt prøvesett.
Invitasjoner sendes ut til sammen 5 ganger, så lenge prøvesvaret er negativt.
Etter fylte 65 år, vil man ikke lenger få invitasjoner til å delta i Tarmscreeningprogrammet
Positivt prøvesvar
Deltakeren blir
til koloskopi ved nærmeste screeningsenter.

Etter koloskopien vil man ikke få tilbud om å sende inn flere avføringsprøver. Sykehuset følger opp videre ved behov.
1: Deltagerflyt i Tarmscreeningprogrammet
Resultater fra de første invitasjonsrundene viser at:
• Omtrent 6 % av deltagerne får påvist blod i avføringen og henvises til koloskopi.
• Seks måneder etter positiv prøve har 92 % gjennomført oppfølgende koloskopi. Over 9000 koloskopier er så langt utført i programmet.
• Blant dem som gjennomgår koloskopi, har 52 % adenomer, og 3,6 % får påvist CRC.
Disse tallene samsvarer med erfaringene fra pilotprosjektet i Helse Sør-Øst (2012–2023), og bekrefter at programmet identifiserer mange tilfeller av CRC og mulige forstadier.
For mer informasjon se tarmscreening.no
KVALITET OG UTVIKLING AV SCREENINGPROGRAMMET
Screening innebærer alltid en avveining mellom fordeler og ulemper –både for deltagerne og for samfunnet. Tilbudet retter seg mot personer som ellers anser seg som friske, og som ikke selv har oppsøkt helsetjenesten. Koloskopi er en invasiv prosedyre med komplikasjonsrisiko, og aksepten for slik risiko er gjerne lavere enn hos pasienter som undersøkes på grunn av symptomer. Dette understreker betydningen av kontinuerlig kvalitetsoppfølging av programmet.
Kreftregisteret ved FHI har i oppdrag å monitorere og overvåke kvaliteten i programmet, inkludert koloskopi-
og patologitjenesten. For å sikre høy kvalitet på tilbudet er det utarbeidet en omfattende kvalitetsmanual som inneholder retningslinjer, prosedyrer og krav til de involverte i programmet. Den beskriver også kvalitetsindikatorer som legges til grunn for å vurdere og overvåke kvaliteten på sentrale deler av screeningprogrammet. Eksempler på slike indikatorer er deltagelse, andel som får utført koloskopi, andel komplette koloskopier (cøkum-intubasjonsrate), deteksjonsrater for ulike typer polypper og CRC, komplikasjoner og smerteopplevelse ved koloskopi.
Kreftregisteret leverer kvalitetsdata på koloskopier og patologitjenesten
til helseforetakene. Foreløpig skjer dette via halvårlige rapporter, men en ny løsning er under utvikling. Den vil gi ledere og skopører tilgang til løpende kvalitetsdata, både på foretaksnivå og for den enkelte skopør. Helseforetakene oppfordres til å bruke disse dataene aktivt i sitt kvalitetsarbeid.
Kvalitetsdata fra de første årene viser at måltallene for de viktigste indikatorene i stor grad oppnås. Det er likevel variasjon mellom sentrene, noe som peker på behov for lokale forbedringstiltak. Målet er å oppnå best mulig kvalitet på undersøkelsene i hele landet. Vi ser allerede en forbedring i koloskopikvaliteten ved flere sentre, noe som tyder på at iverksatte tiltak har hatt effekt.
OPPLÆRING OG
FERDIGHETSTRENING FOR ENDOSKOPIPERSONELL
Endoskopiskolen, som er etablert i tilknytning til Tarmscreeningprogrammet, har en nøkkelrolle i å sikre lik kvalitet på koloskopiundersøkelser over hele landet. Skolen har som mål å heve kompetansen blant endoskopipersonell, og utdanner dem til å kunne tilby effektiv utdanning lokalt. Kursene dekker koloskopiteknikk, instruktøropplæring og fokus på polypper og polyppfjerning.
Et ferdighetssenter for avansert polyppfjerning er også under etablering. Behovet har oppstått fordi screening avdekker et økende antall store, avanserte polypper og polypper med tidlig kreft, som ofte egner seg for avansert endoskopisk behandling. Dette er teknikker som krever spesiali-
sert kompetanse og forutsetter ferdighetstrening. Formålet med treningssenteret er å bidra til at tilbudet som etableres for avansert polyppfjerning holder høy kvalitet. Dette vil kunne redusere bruk av kirurgi for benigne polypper og sikre adekvat endoskopisk behandling av avanserte lesjoner.
VALG AV TESTMETODE I TARMSCREENINGPROGRAMMET
Innføringen av et nasjonalt screeningprogram for CRC har vært planlagt i lang tid. Målet er å redusere forekomst og dødelighet av sykdommen og kunne tilby mer skånsom behandling når kreft oppdages i tidlig stadium.
Testen som brukes i screeningprogrammet er en kvantitativ immunkjemisk test for okkult blod i avføring (iFOBT), i tråd med anbefalingene fra EU.1 Denne testen benyttes i de fleste europeiske land som tilbyr tarmscreening i dag. Ved funn av blod over grenseverdi (15 µg hemoglobin/g feces) anbefales koloskopi.
Randomiserte studier har vist at guaiac-baserte avføringstester (gFOBT) reduserer dødelighet av CRC.2 Screening med iFOBT gir høyere deltagelse og har bedre sensitivitet for kreft og avanserte adenomer sammenlignet med gFOBT.3, 4 Derfor antas det at iFOBT vil kunne ha større effekt enn gFOBT.
En nylig publisert studie som sammenligner iFOBT med koloskopiscreening fant ingen forskjell mellom screeningmetodene når det gjelder effekt på forekomst og dødelighet av CRC.5 En annen randomisert studie
hvor koloskopi ble sammenliknet med ingen screening, viste omtrent 20 % reduksjon i insidens, men ingen signifikant reduksjon i CRC-relatert mortalitet etter ti års oppfølging.6
Tarmscreeningprogrammet ble opprinnelig planlagt med gradvis overgang til koloskopi som primær screeningmetode når kapasiteten var tilstrekkelig. Kapasitetsutfordringer i helseforetakene gjør imidlertid at dette ikke lar seg gjennomføre på kort sikt og eventuell oppstart av primær koloskopiscreening er utsatt til 2028.7
Det er usikkerhet om koloskopi samlet sett gir bedre helse i befolkningen enn iFOBT. Helsedirektoratet har fått i oppdrag å vurdere fremtidig valg av screeningmetode på bakgrunn av oppdatert kunnskapsgrunnlag.
FOREKOMST AV CRC
CRC er en av de hyppigst diagnostiserte kreftformene globalt, det er kun lungekreft som forårsaker flere dødsfall.8 Norge har en av de høyeste forekomstene av CRC, inkludert verdens høyeste insidens blant kvinner.9
Årlig får opp mot 5000 personer i Norge diagnosen CRC, og rundt 1600 dør av sykdommen. Femårsoverlevelsen for CRC er cirka 70 %, men den er så høy som 96 % når sykdommen oppdages tidlig, uten metastaser eller innvekst i omkringliggende strukturer. Derimot synker overlevelsen til nærmere 20 % for tilfeller med fjernmetastaser.10
Kun et fåtall tilfeller av CRC skyldes arvelige syndromer og bare rundt 20 % av de som får diagnosen har en positiv familiehistorie. Personer med en



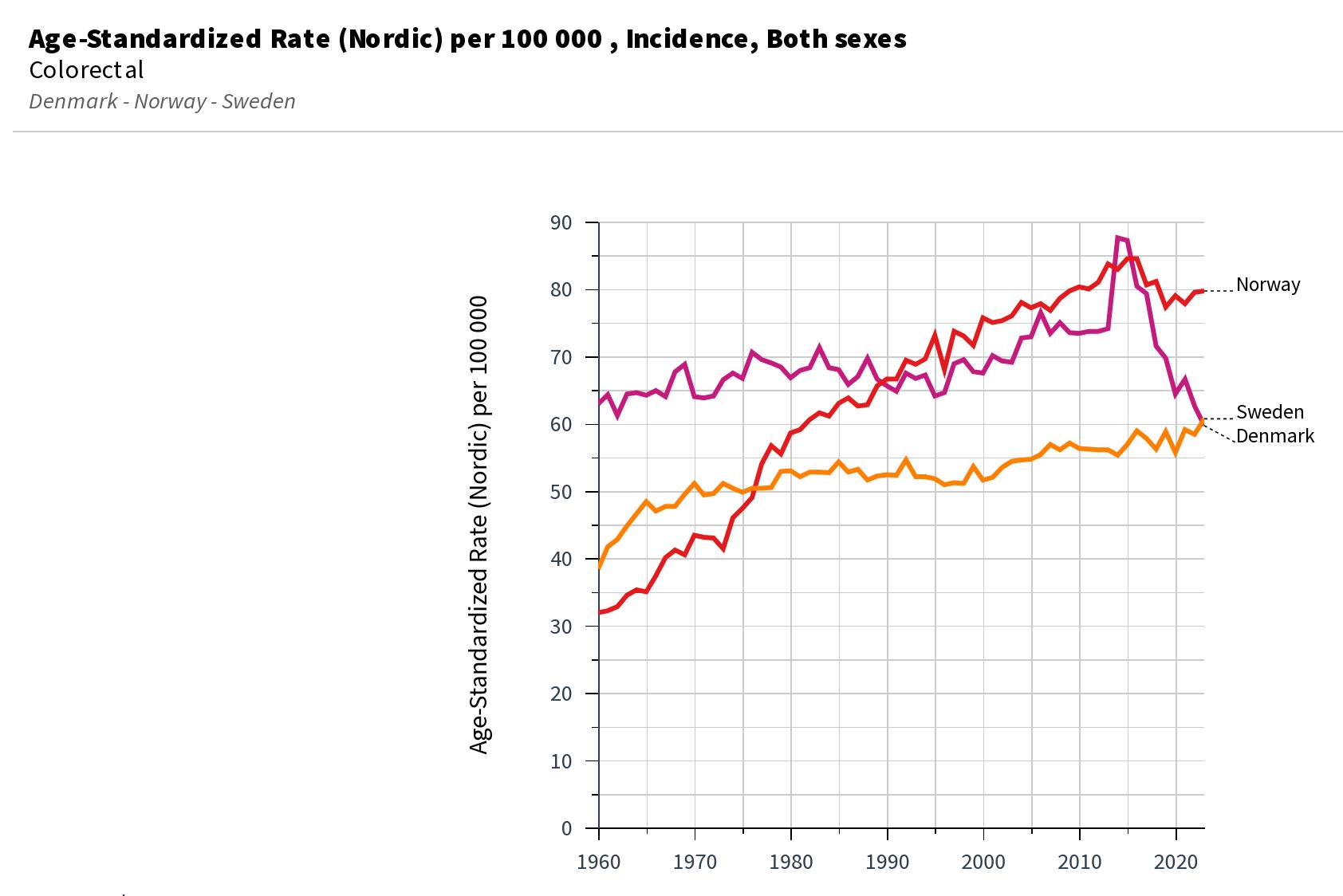
økt risiko skal følges i egne kontrollopplegg i tråd med handlingsprogrammet for kreft i tykk- og endetarm11. Det betyr samtidig at flertallet av CRCtilfellene, omtrent 80 %, oppstår hos personer med gjennomsnittlig risiko som ikke får oppfølging gjennom spesielle overvåkningsprogrammer. Det er disse personene, med gjennomsnittlig risiko, som screeningprogrammet ønsker å nå.
CRC utvikler seg gradvis fra polypper, en prosess som vanligvis tar mange år og ofte gir få og diffuse symptomer. Dette fører til at CRC gjerne oppdages sent. De siste årene har under en fjerdedel av CRC-tilfellene blitt diagnostisert i lokalisert stadium.10 Med innføring av tarmscreening forventer man en initial økning i insidenstall som resultat av forskjøvet diagnosetidspunkt.
Danmark innførte sitt nasjonale tarmscreeningprogram i 2014 for aldersgruppen 50–74 år, og man kan se en sammenfallende økning
i CRC-insidens i de første årene (figur 3). En studie som undersøkte effekten av innføringen av det danske programmet fant at insidensen i målgruppen nesten var doblet blant de som hadde blitt invitert sammenliknet med de som ennå ikke hadde mottatt invitasjon.12 I Norge forventes det at det tar lengre tid før vi kan observere en tilsvarende effekt på forekomst, siden man har startet med en snevrere målgruppe for Tarmscreeningprogrammet og at opptrapping av programmet skjer gradvis med ett nytt årskull som inviteres per år.
VEIEN VIDERE
Erfaringene fra de første årene viser at implementeringen av Tarmscreeningprogrammet har gått som planlagt. Programmet er fortsatt i en oppbyggingsfase, og hele alderskohorten vil først være inkludert i 2031.
En hovedprioritet fremover er å øke deltagelsen, særlig blant menn. For å
oppnå dette arbeides det kontinuerlig med å øke kjennskapen til programmet og sikre at informasjonen når ut til hele målgruppen.
Programmet vil følges tett gjennom systematisk kvalitetskontroll, og det oppfordres til forskning i tilknytning til programmet. Dette er avgjørende både for å oppnå ønsket effekt og for å videreutvikle programmet, slik at befolkningen sikres et screeningprogram med høy kvalitet og størst mulig nytte.
• Tarmscreening.no
• Endoskopiskolen.no
• Tarmscreening.no/kvalitetsmanual
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no


Beslutning i Beslutningsforum for nye metoder (23.05.2022):
Lorlatinib (Lorviqua) innføres til behandling av voksne pasienter med ALK-positiv avansert ikke-småcellet lungekreft (NSCLC) som ikke tidligere har blitt behandlet med en ALK-hemmer.2

Indikasjoner
Beslutning i Beslutningsforum for nye metoder (14.12.2020):
Lorlatinib (Lorviqua) innføres til behandling av ALK-positiv avansert ikke-småcellet lungekreft (vNSCLC) i andre eller senere behandlingslinjer.3
For oppdatert informasjon om forventet effekt og sikkerhet for Lorviqua i de ulike behandlingslinjene, se Pfizer sine hjemmesider på https://www.pfizerpro.no/ legemiddel/lorviqua-lorlatinib.
Ved å scanne QR-koden til venstre med telefonen din, tas du også direkte til hjemmesiden.
Monoterapi til behandling av voksne med anaplastisk lymfomkinase (ALK)-positiv avansert ikke-småcellet lungekreft (NSCLC) som ikke tidligere har blitt behandlet med en ALK-hemmer. Monoterapi til behandling av voksne med ALK-positiv avansert NSCLC der sykdommen har progrediert etter alektinib eller ceritinib som første behandling med ALK-tyrosinkinasehemmer (TKI) eller krizotinib og minst 1 annen ALK-TKI.
Viktig sikkerhetsinformasjon:
LORVIQUA® (lorlatinib): filmdrasjerte tabletter (25mg og 100mg).
Kontraindikasjoner: Samtidig bruk av sterke CYP3A4/5-induktorer. Advarsler/Forsiktighetsregler: Vær oppmerksom på følgende før og under behandling: Hyperlipidemi, CNS effekter, atrioventrikulær blokk, reduksjon i venstre ventrikkels ejeksjonsfraksjon, økning i lipase og amylase, interstitiell lungesykdom/pneumonitt, hypertensjon og hyperglykemi. Forsiktighet ved bilkjøring og bruk av maskiner da CNS-påvirkning kan forekomme.
Dosering: Anbefalt dose er 100 mg 1 gang daglig. Behandlingen bør fortsette til sykdomsprogresjon eller uakseptabel toksisitet. Dosejusteringer kan være påkrevd basert på individuell sikkerhet og tolerabilitet. Se preparatomtale for informasjon om dosejusteringer
Bivirkninger: De hyppigst rapporterte bivirkningene er hyperkolesterolemi, hypertriglyseridemi, ødem, perifer nevropati, fatigue, vektøkning, artralgi, kognitive effekter, diaré og stemningseffekter. Pakninger, priser og refusjon: 25 mg x 90 (blister) 70 161,30,- H-resept, Reseptgruppe C 100 mg x 30 (blister) 70 161,30,- H-resept, Reseptgruppe C.
For fullstendig informasjon, se preparatomtale for LORVIQUA på legemiddelsok.no
Referanser:
1. Solomon BJ, Liu G, Felip E, et al. Lorlatinib Versus Crizotinib in Patients with Advanced ALK-Positive Non–Small Cell Lung Cancer: 5-Year Outcomes from the Phase III CROWN Study. Journal of Clin Oncol. 2024 In press.
2. https://nyemetoder.no/metoder/lorlatinib-lorviqua-indikasjon-ii, sist lest 13. august 2025
3. https://nyemetoder.no/metoder/lorlatinib-lorviqua, sist lest 13. august 2025

IMFINZI er per 28/04/2025 godkjent i Beslutningsforum ved begrenset småcellet lungekreft (LS-SCLC)1
IMFINZI som monoterapi er indisert til behandling av begrenset småcellet lungekreft (LS-SCLC) hos voksne med sykdom som ikke har progrediert etter platinabasert kjemoradiasjon (CRT). Fase III-studien ADRIATIC viser en median overlevelse på 55.9 måneder hos pasienter behandlet med IMFINZI sammenlignet med 33.4 måneder i placebo-gruppen. (HR=0.73; 95% CI, 0.57-0.93; P=0.0104)3.
IMFINZI er også godkjent i kombinasjon med etoposid og enten karboplatin eller cisplatin som førstelinjebehandling hos voksne med utbredt småcellet lungekreft (ES-SCLC)2.
I studien ADRIATIC var forekomst av bivirkninger maksimum grad 3 eller 4 24.4% hos pasienter behandlet med IMFINZI og 24.2% ved placebo. Bivirkninger som ledet til seponering var 16.4% vs 10.6% og som ledet til død var 2.7% vs 1.9%. Pneumonitt eller strålingspneumonitt med maksimum grad 3 eller 4 forekom hos 3.1% av pasientene behandlet med IMFINZI og hos 2.6% ved placebo3.
De vanligste (> 10 %) bivirkningene av Imfinzi som monoterapi basert på samlede data fra ulike tumortyper var hoste/produktiv hoste, diaré, utslett, artralgi, pyreksi, abdominalsmerter, øvre luftveisinfeksjoner, pruritus og hypotyreose.

Referanser:
1. Nye metoder, https://www.nyemetoder.no/aktuelt/beslutningsforum-28.-april-2025. 2. IMFINZI
3.
4. Paz-Ares L, Chen Y, Reinmuth N, et al. ESMO Open 2022;7(2):1-8 https://doi.org/10.1016/j.esmoop.2022.100408
VIKTIG INFORMASJON - IMFINZI® (durvalumab)
Durvalumab binder programmert celledød-ligand-1 (PD-L1) og blokkerer interaksjonen mellom PD- L1 og reseptorene for programmert celledød-1 (PD-1) og B7-1. Blokkerer selektivt interaksjonen mellom PD-L1 og PD-1 og B7-1. Selektiv blokkering forsterker immunsystemets antitumorrespons og øker T-celleaktivering. Induserer ikke antistoffavhengig cellemediert cytotoksisitet (ADCC).
DOSERING OG ADMINISTRASJONSMÅTE: Behandlingen må startes opp og overvåkes av en lege med erfaring i kreftbehandling. IMFINZI administres som en intravenøs infusjon i løpet av 1 time. Pasienter med en kroppsvekt på 30 kg eller lavere må få vektbasert dosering, se fullstendig preparatomtale.
Dosering: LS-SCLC: 1500 mg hver 4 uke. Behandlingsvarighet: Inntil sykdomsprogresjon, uakseptabel toksisitet eller i maksimalt 24 måneder.
ES -SCLC: 1500 mg i kombinasjon med kjemoterapi hver 3. uke (21 dager) i 4 sykluser, etterfulgt av 1500 mg hver 4. uke som monoterapi.
Behandlingsvarighet: Inntil sykdomsprogresjon eller uakseptabel toksisitet.
UTVALGT SIKKERHETSINFORMASJON.
Immunmedierte bivirkninger: Ved mistanke om immunmedierte bivirkninger, bør det utføres tilstrekkelig evaluering for å bekrefte etiologien. Retningslinjer for håndtering av immunmedierte bivirkninger er beskrevet i preparatomtalen. Følgende immunmedierte bivirkninger har blitt observert hos pasienter som har blitt behandlet med IMFINZI: Pneumonitt, hepatitt, kolitt, hypotyreose, hyperthyreose, tyreoiditt, binyrebarksvikt, diabetes mellitus type 1, hypofysitt/ hypopituitarisme, nefritt, utslett eller dermatitt, myokarditt, myasthenia gravis, transvers myelitt, myositt, polymyositt, meningitt, encefalitt, Guillain-Barrés syndrom, immunologisk trombocytopeni, immunmediert artritt, uveitt og ikke-infeksiøs cystitt. Stråleindusert pneumonitt er ofte sett ved stråleterapi mot lungene, og pasienten bør overvåkes for tegn på pneumonitt eller stråleindusert pneumonitt. Graviditet, amming og fertilitet: Durvalumab anbefales ikke under graviditet og til fertile kvinner som ikke bruker sikker prevensjon under og i minst 3 måneder etter behandling. Risiko for diende barn kan ikke utelukkes.
PRIS OG FORSKRIVNINGSREGLER.
Pakninger og priser (AUP) Konsentrat til infusjonsvæske. Hetteglass: 2,4 ml (120 mg): kr 8269,90. 10 ml (500 mg): kr 33794,30
Reseptgruppe C. Markedsføringsinnehaver: AstraZeneca AS, Karvesvingen 7, 0579 Oslo, tel. 21006400. NO-13988-04-25-ONC Før forskrivning av IMFINZI, se FK-tekst eller SPC på www.felleskatalogen.no


WOLFGANG LILLEBY
Overlege dr.med.
Radiumhospitalet, OUS, Oslo
Prostatakreft er den hyppigste formen for kreft hos menn med rundt 5258 nye tilfeller i 2023 (Kreftregisteret). Det store flertallet av disse diagnostiseres med sykdommen i potensielt kurabelt stadium. Pasienten bør få balansert sykdomsinformasjon og man bør tilstrebe best mulig behandling enten via nye teknikker som robotassistert kirurgi eller strålebehandlingsmetoder som begrenser skade mot omkringliggende frisk vev og samtidig er effektiv nok til å drepe kreftcellene.
Det er en trend mot bruk av færre fraksjoner ved strålebehandling av prostatakreft i kurativ setting (Widmark A. et al. 2019). Selv om ultrahypofraksjonerte behandlingsregimer har vist ekvivalens i utfall og langtidsbivirkninger er den strålebiologiske effekten og eventuell stråleresistens lite beskrevet (Lilleby W. et al. 2022)
Til å avsette ultrahypofraksjonerte doser med høypresisjonsstråling har vi i mange år brukt kortrekkevidde strålebehandling (brakyterapi, BT). BT er en teknikk som avsetter høyenergetisk stråling i svulsten og samtidig gir lite stråling mot frisk vev. Dermed kan man gi høyere stråledoser enn hva som ofte er forsvarlig og teknisk mulig med ekstern strålebehandling. Radiumhospitalet er nasjonalt
behandlingssenter for høy-dose-ratebrakyterapi (HDR-BT). HDR-BT gis ofte i kombinasjon med ekstern strålebehandling (external beam radiation therapy, EBRT). Vi har hatt god nytte av vårt REK-godkjente kvalitetsregister for HDR-BT som har vært på plass siden første pasient fikk behandling i Norge i 2004. I tillegg til kjernedata om pasientens sykdom registreres også opplysninger om behandlingsutfall, både i form av sykdomskontroll og bivirkninger. Dataene ble analysert i et nylig avsluttet ph.d.-prosjekt. Vi fant at HDR-BT i kombinasjon med EBRT trygt kan benyttes i behandling av aggressive svulster, med gode utfallsdata og uten økt toksisitet for pasientene (Wedde T.B. et al. 2019, 2023). En mer grundig omtale leveres ved en senere anledning.
Avhengig av stadium kan opp mot 40 % av kurativt behandlede prostatakreftpasienter få tilbakefall (Philipson R.G. et al. 2021). Det er altså en fin balansegang mellom klinisk effekt og uforholdsmessige bivirkninger på kort og lang sikt. Selv om modell-baserte stråletoleransekrav er grunnleggende verktøy i stråleterapien, kan disse være utilstrekkelige ut fra kliniske observasjoner på individnivå.
Vi har tidligere sett på genetiske faktorer som kan bidra til strålebivirkninger (Kishan A.U. et al. 2023). Vi har startet
FRUZAQLA som monoterapi er indisert til behandling av voksne pasienter med metastaserende kolorektalkreft (mCRC) som tidligere er behandlet med tilgjengelige standardbehandlinger, inkludert fluorpyrimidin-, oksaliplatinog irinotekanbasert kjemoterapi, anti-VEGFmidler og anti-EGFR-midler, og som har hatt sykdomsprogresjon eller er intolerante mot behandling med enten trifluridintipiracil eller regorafenib.
FRUZAQLA VISTE EN BETYDELIG SAMLET ØKT OVERLEVELSE1
En forbedring på nesten 3 måneder i median OS
Median OS hos pasienter med tidligere behandlet mCRC

MED ORAL FRUZAQLA ÉN GANG DAGLIG1
Behandling én gang daglig
Den anbefalte dosen av FRUZAQLA er 5 mg én gang daglig i 21 dager, etterfulgt av 7 dager uten behandling for hver syklus på 28 dager.

Pasienter i faresonen
BSC= Best standard of care
Grafen er utarbeidet av Takeda basert på referanse
UTVALGT SIKKERHETSINFORMASJON1:
Bivirkninger: De vanligste bivirkningene er hypertensjon, anoreksi, proteinuri, PPES, hypotyreose, dysfoni, diaré og asteni. De vanligste bivirkningene av grad ≥ 3 er hypertensjon og PPES.
De vanligste alvorlige bivirkningene er gastrointestinal blødning, pneumoni, og gastrointestinal perforasjon
Med eller uten mat
Kapsler (5 mg og 1 mg) skal svelges hele.
Omtrent samme tid hver dag
Pasienter bør ta en glemt dose hvis <12 timer har passert siden den glemte planlagte dosen.
Pasienter bør ikke ta 2 doser på samme dag for å ta igjen en glemt dose.
et samarbeid med ph.d.-kandidat
Una Ryg (hovedveileder professor Knut Håkon Hole, OUS) og professor Amar Kishan (UCLA, USA) for å utforske predisponerende faktorer til stråleresistens og -toksisitet. Det er to artikler i støpeskje om a) radiologisk bedømt mønster av tilbakefall og b) genomiske data som forklaringsmodell for stråleresistens. Sistnevnte arbeid ble presentert på ESTRO 2025 i Wien av undertegnede (abstract nr. E25-4644).
Kort fortalt utførte vi målrettet DNAsekvensering (ved UCLAs kjernefasilitet) og RNA-uttrykksanalyse (via Decipher GRID-plattformen)

på biopsibekreftede lokale tilbakefall av prostatakreft. Pasientene ble behandlet enten ved UCLA eller OUS. Vi sammenlignet målrettede DNA-sekvenseringsdata med de novo prostatakreftdata fra TCGA (The Cancer Genome Atlas), og RNA-uttrykksdata med de novo prostatakreftdata fra Decipher GRID-databasen. De målrettede sekvenseringsdataene viste økning i PI3K-bane-alterasjoner (PTEN og PIK3CA), BRCA1, PTCH1, MSH3 og STAG3. Prøver fra pasienter med lokalt tilbakefall hadde også høyere Decipher-risikoscore, hovedsakelig basal undertype og lavere androgenreseptoraktivitetsskår. Samlet sett
tyder disse dataene på at flere av disse mutasjonene er assosiert med aggressiv sykdom, og mer generelt ser man et betydelig endret genomisk/transkriptomisk landskap ved tilbakefall. Så vidt vi vet, er dette den største (n = 41) analysen av denne typen pasienter med tilbakefall etter definitiv strålebehandling. Det planlegges ferdigstilling av et manuskript.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
Dosereduksjon kan hjelpe til med å håndtere bivirkinger1
Dosenivå FRUZAQLA-dose
Anbefalt dose 5 mg oralt én gang daglig
Første dosereduksjon 4 mg oralt én gang daglig
Andre dosereduksjon 3 mg oralt én gang daglig
Avslutt FRUZAQLA permanent hos pasienter som ikke tåler 3 mg oralt daglig
Referanser
1.FRUZAQLA. SPC, 02.06.25, Tilgjengelig på legemiddelsok.no
2.FRUZAQLA. FK-tekst, Tilgjengelig på felleskatalogen.no
Les produktinformasjon(SPC) for utfyllende informasjon om Fruzaqla
Skann QR-kode for å booke møte med meg.

Frode Vik-Johansen
Brand and customer manager
Rare diseases and oncology. frode vik-johansen@takeda.com
Forskrivning,pakninger og priser2:
Pakninger og priser: 1 mg: 21 stk. (boks) 14935,50 5 mg: 21 stk. (boks) 59633,30. Finansiering: H-Resept. Fruzaqla er godkjent av beslutningsforum for bruk fra 01.08.25 Reseptgruppe C


For en del år siden initierte jeg en diskusjon i Aftenposten (1) om hvorvidt Heisenbergs usikkerhetsrelasjon (HU) (2) var av betydning hva angikk forutsigbarhet av klimavariasjon, noe jeg mente den ikke var. Etter hvert fikk jeg meningsfeller og hyggelig hilsen med takk fra Ingolf Kanestrøm som var professor i geofysikk ved UiO.

JAN FOLKVARD EVENSEN
Onkolog Nesodden jan.f.evensen@gmail.com
En annen form for usikkerhet er den som behandles i kaos-teori, det at oppførselen til et system er så kritisk avhengig av begynnelsestilstanden at man i praksis ikke kan forutsi systemets utvikling. Utviklingen kan ikke skilles fra et tilfeldig hendelsesforløp, selv om den i prinsippet har en deterministisk karakter. Kaos-teori har intet med HU å gjøre, snarere tvert imot. Kaos beskriver uforutsigbarhet i deterministiske systemer Kaotiske systemer oppfører seg ikke-lineært, og det forklarer noe av vanskelighetene med å varsle vær.
De litt eldre som har sin utdannelse fra UiO vil kanskje huske lesesalen i Vilhelm Bjerknes’ hus på Blindern, nå Realfagbiblioteket. Hvem var Vilhelm Friman Koren Bjerknes (1862–1951)? Kort fortalt, han var den moderne meteorologiens far. Før Vilhelm Bjerknes’ tid ble værvarslingen stort sett utført på grunnlag av erfaring. Det var Bjerknes som innførte matematikk og fysikk i meteorologien. I perioden 1917 til 1926 var han professor i geofysikk i Bergen. Her skapte han «Bergensskolen» med metoder som ble adaptert av meteorologer over hele verden. Bjerknes
avsluttet sin karriere som professor i mekanikk og matematisk fysikk ved UiO. Han gikk av i 1932.
En annen viktig person i meteorologiens historie er Edward Norton Lorenz (1917–2008, (fig. 1)). Allerede som ungdom hadde han vært interessert i vær og førte bl.a. nøyaktige tabeller over maksimum- og minimimstemperatur utenfor huset hvor han bodde med sine foreldre i West Hartford, Connecticut. Mer opptatt var han av matematikk, spesielt den rene matematikk. Han ble bachelor i matematikk ved Dartmouth i 1938 og master i matematikk ved Harvard i 1940. Under andre verdenskrig varslet han vær for United States Army Air Forces. Etter krigen valgte han å


fortsette med meteorologi ved MIT. Han fordypet seg i dens teorier og perfeksjonerte dens matematikk med master- og doktorgrad i meteorologi som resultat (3). Han etablerte det teoretiske grunnlaget for vær- og klimavarsling, så vel som grunnlaget for computerassistert atmosfærefysikk og meteorologi. Hele sin vitenskapelige karriere tilbrakte han ved MIT.
På 1950-tallet ble han opptatt av numerisk prediksjon av vær. I 1960 gikk han til anskaffelse av en datamaskin, LGP-30 (fig. 2). Maskinen jobbet langsomt med maksimalt 60 operasjoner i sekundet, langt mindre enn en smartklokke i dag. Innledningsvis kom resultatene ut som en tallrekke som krevde ekspertise for å tolkes. Etter hvert greide Lorenz å få maskinen til å skrive ut primitive grafer eller kurver ved hjelp av tomme anslag etterfulgt av bokstaven «a» (3).
UiO fikk sin første moderne datamaskin, en CDC 3300, i 1967 (fig. 3).
Bruken eksploderte da databehandling ble introdusert for studenter samme år.
Selv lærte jeg å programmere Fortran
på maskinen i 1969. CDC 3300 var virksom i nesten ti år.
Lorenz’ utgangspunkt var determinisme, et prinsipp som sier at dersom vi kjenner posisjoner og hastigheter til alle partikler i universet i et bestemt øyeblikk, og kjenner alle krefter som til enhver tid virker på partiklene, så kan vi forutsi alle fremtidige (og fortidige) tilstander til ethvert fysisk system i universet. Dette ble spissformulert av Pierre-Simon Laplace (1749–1827), som hevdet at en «kalkulator» med ubegrenset kapasitet, som fikk all informasjon om universets tilstand nå og om de krefter som virker, vil kunne forutsi hele fremtiden: «Vi bør betrakte den nåværende tilstand av universet som virkningen av den foregående tilstand og som årsaken til den etterfølgende tilstand».
Lorenz barket løs på problemet med Newtons lover og 12 ikke-lineære differensiallikninger med 12 variabler som temperatur, trykk, luftfuktighet, vindhastighet etc. Differensiallikninger beskriver hvordan systemer kontinuerlig endrer seg over tid. Med
Newtons lover kunne man forutsi planetenes baner, så hvorfor ikke skyer og vind? Etter hvert reduserte han antall likninger til tre. De tre likningene (fig. 1), med tre ukjente, er en meget forenklet modell av bevegelser av luft i en tredimensjonal boks (Lorenz-likningene). To av de ukjente representerer temperaturgradienter i hhv. x- og y-retning og den tredje konveksjonsgradient i z-retning (luftstrøms hastighet). Likningene har ingen analytisk løsning (ikke to streker under svaret), kun numerisk og fremstilles som linjer (trajektorier/integrallinjer) i et 3D abstrakt rom (faserommet/tilstandsrommet). Her ligger forbindelsen mellom kaos og fraktaler.


Integrallinjene samler seg (konvergerer) i hva som kalles en attraktor (fig. 4). Lorenz spurte seg selv, hva er attraktorens underliggende geometri? Hans genialitet var å vise at attraktoren hadde en ikke-heltallig dimensjon, med andre ord en fraktal (4).
I januar 1961 gjorde Lorenz et forsøk. Han ville gjenta en værsimulering han hadde gjennomført tidligere, men i stedet for å starte forfra startet han halvveis ut i forløpet med de samme numeriske verdier han fant halvveis i den første simuleringen. Han forventet at resultatet skulle bli det samme, gitt at de øvrige betingelser var like. Han ble svært overasket da han fant avvik. Jo lenger frem beregningene skred, jo større ble væravviket (fig. 5). Først trodde han at det var noe galt med datamaskinen, men etter hvert fant han at maskinens minne opererte med seks desimaler mens han selv bare hadde inngitt tre. Et avvik på en tusendedel eller mindre ga økende avvik etter hvert som beregningen skred frem (3).
Senere, ved et møte i American Association for the Advancement of Science, stilte Edward Lorenz spørsmålet: “Does the flap of a butterfly’s wings in Brazil set off a tornado in Texas?”, herav navnet sommerfugleffekt (fig. 6). Effekten fikk etter hvert det tekniske navnet: sensitive dependence on initial conditions.
Kaosteori omfatter studier av dynamiske systemer som er svært følsomme for startverdiene (initialverdiene). Ordet kaos kommer fra gresk mytologi, hvor verden opprinnelig var et tomt mørkt uordnet rom, khaos Kaotiske systemer var tidligere berørt i det såkalte tre-legeme-problemet med utgangspunkt i celest mekanikk, adressert av Joseph-Louise Lagrange (1736–1813) og Henri Poincaré (1854–1912). For dette vant sistnevnte en konkurranse opprettet av den svenske matematikeren Gösta MittagLeffler i anledning kong Oscar IIs 60-årsdag i 1889 (5). Premien var en gullmedalje og 2500 svenske kroner. Kaosteori tok imidlertid først skikkelig
av med Lorenz’ observasjon, mye av forutsetningen var jo regnekraft.
Kaosteori er en egen disiplin innen matematikk, men også i høy grad aktuell innen fysikk. Rent matematisk dreier det seg om ikke-lineære funksjoner, funksjoner som ikke lar seg fremstille som rette linjer. Fenomenet illustreres ofte med vekst av populasjoner. Hvis vi f.eks. ved tidspunkt t har x kaniner og ved neste generasjon (tid = t + 1) har 5x kaniner, vil man ved neste generasjon (tid = t + 2) ha 5 5x = x 52, og ved neste generasjon (tid = t + 3) ha 5 5 5x = x 53, osv. Man ender opp med eksponentiell vekst. Slik er det jo ikke i virkeligheten, antallet vil flate ut grunnet diverse forhold som næringstilgang, sykdom, rovdyr etc.
Når en beregnet verdi av en funksjon brukes som argument i neste beregning av samme funksjon kalles det iterasjon: f(x); f[f(x)]; f{f[f(x)]}; etc.
Eksempelet med kaniner kan skrives xt+1 = 5xt. For å kompensere for metningseffekter er en mye brukt likning xt+1 = r · x t (1 - xt) hvor r er en konstant
ligning. Med økende r-verdi dobles antallet x-verdier flere ganger inntil resultatene blir kaotiske, det mørke området til høyre i figuren.
(0 ≤ r ≤ 4) og xt er en populasjon med valgt enhet slik at 0 ≤ Xt ≤1. Ideen er å redusere vekstraten når x t blir stor. Likningen ble introdusert av PierreFrançois Verhulst (1804–1849) i 1845 og har fått navnet den logistiske likning
Man må ofte følge et system over en betydelig tid med et stort antall iterasjoner for å få fram de typiske trekkene ved kaotiske system (6). Dette ble først mulig ved hjelp av datamaskiner.
For lineære systemer vil det for enhver x-verdi finnes én og bare én y-verdi. Ved ikke-lineære systemer kan én x-verdi relateres til to eller flere y-verdier, og vice versa. Situasjonen blir uklar. Når én enkelt x-verdi korresponderer med to eller flere y-verdier vil denne formen for uklarhet under noen betingelser resultere i kaos.
Den logistiske likning kan skrives xt+1 = r x t – r x t 2 og har en lineær og en ikke-lineær komponent, men er i sum ikke-lineær. Rent matematisk er jo likningen enkel, men kan gi overraskende løsninger.
I fig. 7 er x-verdien fremstilt som funksjon av r (etter 100 iterasjoner per r).
Når r = 2,4 er det bare ett likevektsnivå for populasjonen. Dette nivået øker gradvis med økende r-verdi, men hele tiden bare ett nivå. Ved r = 3 splittes kurven i to, ved r = 3,45 i fire og ved r = 3,57 går periodisiteten over i kaos. Dette kalles et bifurkasjondiagram.
FRAKTALER
Fraktalbegrepet ble introdusert av Benoît Mandelbrot (1924–2010, fig. 8) i 1975. Ordet kommer fra det latinske fractus eller ”brutt”. Mandelbrot var en polskfødt fransk-amerikansk matematiker og samfunnsøkonom. Familien emigrerte til Frankrike i 1936. Ved begynnelsen av andre verdenskrig flyttet de fra Paris pga. sin jødiske bakgrunn. Mandelbrot returnerte til Paris i 1944 hvor han bl.a. studerte ved École Polytechnique. Fra 1947 til 1949 studerte han ved Caltech, for så å ta sin ph.d. i matematikk ved universitetet i Paris i 1952. Etter diverse forskningsoppdrag i Frankrike, USA og Sveits endte han opp ved MIT i 1958, hvor han ble i 35 år. I perioder foreleste

han ved Harvard. Han avsluttet sin karriere som professor ved Yale. Han var for øvrig medlem av Det Norske Videnskaps-Akademi og skrev forordet i Jens Feders bok «Fractals». Boken ble til med utgangspunkt i Feders forskning omkring aggregering av immunglobuliner og bevegelse av væske i porøse medier (7). Feder var en av mine tidligere lærere i fysikk.
I Wikipedia er en fraktal definert som «et geometrisk objekt som er ru eller uregelmessig i alle målestokker og som framstår ’oppstykket’ på et radikalt vis». I Store norske leksikon defineres den som «en geometrisk form som kjennetegnes ved stor kompleksitet og detaljrikdom, dessuten ofte en struktur som er uforandret når målestokken endres». Ofte nevnes: self-similarity (egenlikhet), scaling (fraktaler fremstår like, uavhengig av skalering (skalainvarians)) og dimensjoner (fraktal dimensjon: FD) som ikke er heltall. I mange tilfeller kan en fraktal frembringes ved et gjentagende mønster gjennom en typisk rekursiv eller iterativ prosess (fig. 9), ikke helt ulikt kaos.

Fraktaler er geometriske fremstillinger av kaosdynamikk, et slags fingeravtrykk til kaos. Fraktaler er kaosteoriens geometri.
Fraktal dimensjon (FD) er noe vanskelig «å få tak i». FD er et ikke-heltall som beskriver den indre struktur av et objekt. Den er relatert til forholdet mellom brukt metrikk (avstandsfunksjon) og anvendt skala.
I Euklids geometri, som vi alle kjenner fra videregående, har et punkt, en linje, en flate og en kube hhv. dimensjonene 0, 1, 2 og 3. Fraktaler kan ha dimensjoner (FD) som ligger mellom disse verdier, f.eks. 1,50 eller 2,33 – en fraksjonal romlig dimensjon. FD er et kvantitativt mål for morfologisk kompleksitet. Ved å måle en spesiell egenskap ved et objekt i forskjellig skala og plotte punktene i et diagram
(egenskap versus skala) fremkommer en rett linje hvis vinkelkoeffisient er et estimat for objektets FD. Det finnes flere måter å beregne FD. Det viktige nå er å få standardisert algoritmene for beregning av FD.
Benoît Mandelbrot formulerte i 1967 problemstillingen: «How long is the coast of Britain? Statistical selfsimilarity and fractional dimensions» Overført til norske forhold: Lengden av Norges kyst avhenger av hvilken målestokk vi bruker, den har ikke en veldefinert lengde. Lengden er avhengig av lengden av målestaven, og lengden blir uendelig med en infinitisemal målestav. Videre, kysten er egenlik. Det vil si at et forstørret kart over et lite område minner om kartet over hele området (8). Fordi lengde ikke er noe meningsfylt begrep for fraktaler, brukes FD til å kvantifisere hvordan en fraktal fyller rommet.
Et begrep som ofte går igjen i tolkning av bilder, det være seg i radiologi eller patologi er lacunarity Det er et begrep som i geometrien refererer til et mål på hvordan mønstre, spesielt fraktaler, fyller rommet, der mønstre som har flere eller større gap generelt har høyere lakunaritet. Lakunaritet kan kvantifiseres, ikke helt ulikt fraktal dimensjon (9).
KAOS OG KREFT
Gjennom årene har jeg holdt en del forelesninger om tumorbiologi og vekstkinetikk. Jeg har gjerne vektlagt forskjellen mellom eksponentiell og Gompertziansk vekst. Vekstkurven til en tumor har gjerne en sigmoid form, vel beskrevet ved Gompertz’ funksjon. Vekstraten avtar med
økende størrelse av tumor. I 1964 demonstrerte A.K. Laird at vekst av flere tumormodeller kunne fint beskrives ved Gompertziansk kinetikk (10). Funksjonen ble utviklet i 1825 av en britisk matematiker og aktuar, Benjamin Gompertz (1779–1865), for å beskrive mortalitet hos mennesker. Gompertz’ og Verhulsts arbeider har som felles anliggende å beskrive den sigmoide form på vekstkurver om enn med noe forskjellig utgangspunkt (11)
I ovennevnte matematiske tilnærming ser man isolert på kreftcellen. En mer realistisk tilnærming er å inkludere flere komponenter. Debbouche og medarbeidere (12) tar utgangspunkt i Lorenz-likningene med tre ukjente, hvor x(t), y(t) og z(t) representerer hhv. antall tumorceller, antall friske vertsceller og antall immunologisk aktiverte celler ved tidspunkt t. Likningene løses numerisk med attraktorer og bifurkasjonsdiagram som resultat. Modellen kan forklare enkelte dynamiske trekk ved tumorvekst. Under gitte betingelser viser modellen hvordan interaksjon mellom tumorceller, friske celler og immunceller kan resultere i invasiv vekst.
I tillegg til de tre ukjente opererer modellen med tre parametre som reflekterer de respektive cellepopulasjoners vekstrater. Disse blir inngitt ut fra kliniske data.
Det har også vært forslag om et tidimensjonalt «kreft-faserom», hvor de ti komponenter er «the hallmarks of cancer» (13, 14). Det bringer tanken hen til strengteori, teorien som forener gravitasjon og kvantemekanikk (15). Her opererer man med både ti
og elleve dimensjoner. Matematisk er det uproblematisk. Derimot er det vanskelig å forestille seg dimensjoner over den fjerde – tiden. Disse dimensjonene er skjult, eller kompaktifisert som det heter på fagspråket. Teorien er sannsynligvis ikke verifiserbar og har fått noe mindre «vind i seilene» den senere tid.
Matematisk modellering av kreft er ikke noe nytt, det går 50–60 år tilbake i tid, men har stort sett vært ignorert av biologer. Nyere matematiske metoder har gjort det mer aktuelt, det blir spennende å se utviklingen videre. Matematikeren i meg synes dette er fascinerende og gjør meg nysgjerrig, klinikeren undrer seg.
FRAKTALER OG KREFT
Fraktaler i radiologi
Det finnes flere fraktale mønstre i organismen: kransarteriene, chordae tendineae, hjertets ledningssystem, samlerør i nyrer, tynntarmens overflate, og andre. En av de mest kjente fraktale strukturer i biologien er lungen, som angitt av Mandelbrot i 1982 (9). Bronkialtreets og karenes fraktale struktur fasiliterer lungenes ventilasjon.
Digitalisering av radiologiske bilder muliggjør fraktal analyse. Tidlig ble fraktale algoritmer brukt til å bedre avgrensning av ben mot tenner i dentale røntgenbilder (16).
Miwa og medarbeidere har vist at FD-analyse av FDG-opptak i PETundersøkelser muliggjør differensiering mellom benigne og maligne noduli i lunger. Heterogenitet i FDGopptak målt som FD var signifikant
lavere i ikke-småcellet lungekreft enn i benigne noduli (17).
Etter en gjennomgang av flere eksempler hvor FD er brukt for å karakterisere lungekreft konkluderer Lennon og medarbeidere at det mest interessante er bruk av FD til å evaluere respons på behandling (18). For eksempel har man registrert endringer i FD før endringer i tumorvolum.
Avslutningsvis skal nevnes at fraktaler kan anvendes for lagring av bilder (CT, PET, MRI). Ved fraktal analyse av digitaliserte bilder søker man skalainvarians og egenlikhet, noe som muliggjør at høy-oppløselige bilder kan lagres og overføres ved såkalt fractal compression. Fordelen er betydelig redusert lagringsplass. Enn så lenge er det nok dette som har størst potensiale når det gjelder fraktaler. En ulempe er tiden det tar å komprimere hvert bilde (19).
Fraktaler i patologi
Det er en påfallende likhet mellom progresjon av et kaotisk system og kreft. Som vi har sett skyldes det uforutsigbare i kaotiske systemer tap av informasjon gjennom iterative prosesser, ikke helt ulik utvikling av kreft hvor genetiske og epigenetiske endringer akkumuleres over en rekke celledelinger. Her kan man trekke paralleller til cervikal intraepitelial neoplasi. På mikroskopisk grunnlag graderes tilstanden fra CIN 1 til CIN 3. Fabrizii og medarbeidere så på forholdet mellom CIN-grad og FD. De fant at FD er en objektiv parameter for gradering av cervikal intraepitelial neoplasi (20).
Tilsvarende er det gjort fraktal analyse av Gleason-score. Waliszewski og medarbeidere fant at FD muliggjør både en objektiv og kvantitativ gradering av prostatakreft (21).
Kreft karakteriseres ofte som kaotisk ukontrollert vekst. Den gjennomgående uregelmessige strukturen av kreftcellen, tumors karforsyning og tumors avgrensning kan være vanskelig å beskrive med tradisjonell Euklids geometri som ofte baseres på glatte former. Fraktal geometri derimot er velegnet til å karakterisere svulsters morfologi, det være seg den uregelmessige avgrensning mot normalt vev og den tilsynelatende tilfeldige karstruktur.
FD har vært brukt til å differensiere mellom adenokarsinom og plateepitelkarsinom i lungen. Lee og medarbeidere fant at adenokarsinomer hadde statistisk signifikant lavere FD enn plateepitelkarsinomer. Videre fant de positiv korrelasjon mellom FD og overlevelse, om enn ikke statistisk signifikant (22). I beste fall kan vevs FD være en brukbar biomarkør i histologisk klassifisering av lungekreft og ev. en prognostisk indikator.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
41 % av T3-pasienter som gjennomgår nefrektomi ved nyrecellekarsinom får tilbakefall innen 5 år. 74,8 % av disse får metastaser.1
54 % av pasienter som gjennomgår kurativ intendert kirurgi opplever frykt for tilbakefall.2
KEYTRUDA® som monoterapi er indisert til adjuvant behandling av voksne med nyrecellekarsinom ved økt risiko for tilbakefall etter nefrektomi eller etter nefrektomi og reseksjon av metastatiske lesjoner.

REFERANSER:
1. Bencina G, Billeskov R, Bak R, et al. Recurrence patterns following nephrectomy for renal cell carcinoma in a Danish nationwide cohort. BJUI Compass. 2024;5(8):791-798
2. Decat Bergerot C et al. Fear of cancer recurrence in patients with localized renal cell carcinoma. JCO Oncol Pract. 2020;16(11):1264-e1271.
PRODUKTINFORMASJON: KEYTRUDA, konsentrat til infusjonsvæske, oppløsning (25 mg/ml, 4 ml hetteglass): 40 782 NOK (Apotek utsalgspris). Reseptgruppe: C, Refusjon: H-resept. KEYTRUDA er inkludert i anbud for kreftlegemidler (LIS 2307) og selges med rabattert pris. Indikasjonen er godkjent i Beslutningsforum.
ADVARSLER OG FORSIKTIGHETSREGLER: Immunmedierte bivirkninger, inkludert alvorlige og fatale tilfeller, har forekommet hos pasienter behandlet med KEYTRUDA. Pasienten må derfor overvåkes for tegn/symptomer på immunmedierte bivirkninger. Pasienter med pre-eksisterende autoimmun sykdom kan ha økt risiko for immunmedierte bivirkninger eller oppblussing av den underliggende autoimmune sykdommen, etter behandling med immunsjekkpunkthemmere.
VIKTIGE INTERAKSJONER: Bruk av systemiske kortikosteroider eller immunsuppressiva før oppstart av KEYTRUDA bør unngås på grunn av deres potensielle interferens med den farmakodynamiske aktiviteten og effekten til KEYTRUDA.


Skann her
Les mer på www.msdinsight.no


DOSERING OG ADMINISTRASJONSMÅTE: Behandling må initieres og overvåkes av lege med erfaring i kreftbehandling. Anbefalt dose av KEYTRUDA hos voksne er enten 200 mg hver 3. uke eller 400 mg hver 6. uke administrert som intravenøs infusjon over 30 minutter.
Pasienter behandlet med KEYTRUDA må få tildelt pasientkort og bli informert om risikoen ved bruk av KEYTRUDA.
Konsulter KEYTRUDA SPC før forskrivning eller bruk for komplett informasjon om dosering, kontraindikasjoner, advarsler og forsiktighetsregler, interaksjoner og bivirkninger.
Keytruda SPC, Felleskatalogen

MSD (Norge) AS, PO box 1579 Vika, 0118 Oslo, tlf. 32 20 73 00. E-post: msdnorge@msd.no Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved. NO-RCC-00047 11/2025
Dødshjelp har det siste året fått økt oppmerksomhet i Norge, både politisk og i media. Internasjonalt er det kreftpasienter som utgjør den største gruppen som får innvilget dødshjelp, så norske onkologer bør ha satt seg inn i problemkomplekset. Hvorfor rykker spørsmålet om legalisering av dødshjelp stadig nærmere, og hva kan vi lære av andre lands erfaringer?

DAGNY FAKSVÅG HAUGEN
Pensjonert onkolog med godkjenning i kompetanseområde palliativ medisin, professor em. i palliativ medisin Universitetet i Bergen
Vårt samfunn og lovverk er basert på en grunnleggende forståelse av livet som det største gode, og at staten skal verne og beskytte borgernes liv (1). Retten til liv står i norsk lovverk sterkere enn retten til selvbestemmelse, og samfunnet har en nullvisjon for selvmord. Er dødshjelp forenlig med dette synet på livets verdi? Hvordan har tanken om at staten skal ta liv, fått innpass i vestlige, liberale demokratier?
På engelsk heter dødshjelp «assisted dying» (2). Vi har ingen god oversettelse av substantivet «dying» på norsk, men det betegner at personen er i ferd med å dø. «Assisted dying» plasseres dermed i døden, og ikke i livet, som hjelp med å dø. Voluntary Assisted Dying (Australia), Medical Assistance in Dying (MAID) (Canada), Medical Aid in Dying (USA) (3) og de norske, nylig lanserte uttrykkene «assistert livsavslutning» og «selvbestemt assistert livsavslutning» (4) gir uttrykk for det samme. I både britisk og canadisk litteratur argumenteres det med at dødshjelp «ikke handler om et valg mellom liv og død, men om hvordan en døende person velger å dø» (5,6). Med dødshjelp plassert inn i døden, kan det lett oppfattes som en plikt og
et gode å lindre lidelse og styrke den døendes selvbestemmelse.
Dødshjelp er en samlebetegnelse for eutanasi og assistert selvmord. Eutanasi er definert som «at helsepersonell forårsaker personens død med hensikt, ved å injisere dødbringende medikamenter, på personens forespørsel» (7). Assistert selvmord er i realiteten det samme, bare at pasienten administrerer de dødbringende medikamentene selv, etter at legen har skaffet dem til veie. Denne definisjonen er likevel ikke fullt ut dekkende for realitetene, for ikke noe sted i verden kan hvem som helst som ber om det, få innvilget dødshjelp. Følgende tillegg fra det britiske parlamentet bør derfor tas inn i definisjonen: «… og i tråd med vedtatte inklusjonskriterier og sikkerhetsforanstaltninger» (8). I land som har åpnet for dødshjelp er det kriterier og avgrensninger nedfelt i lovverket som skal styre praksis. At dette kan være et minefelt viste den norske TV-dokumentaren «Dødsenglene», med sine eksempler på gråsoner og flytende grenser mellom selvmord, dødshjelp og drap (9).
De to prinsipielle hovedargumentene for legalisering av dødshjelp er barmhjertighet, altså å lindre lidelse, og autonomi – den enkeltes rett til å bestemme over egen kropp og eget liv (7). De andre argumentene som fremmes av forkjemperne for dødshjelp er mer pragmatiske, men gjør at spørsmålet om legalisering rykker stadig nærmere; andre land i Europa innfører dødshjelp, et flertall i befolkningen støtter legalisering, norske borgere bør slippe å dra til Sveits for å få dødshjelp, og dødshjelp er et naturlig svar på overbehandling i helse- og omsorgstjenestene (10).
Nederland og Canada er fremtredende eksponenter for de to hovedargumentene barmhjertighet og autonomi. La oss se litt på deres dødshjelplover og utviklingen i praksis etter lovenes innføring.
NEDERLAND: DØDSHJELP
SOM SVAR PÅ «UUTHOLDELIG LIDELSE»
Nederland vedtok sin dødshjelplov i 2001, med ikrafttredelse året etter (11). Loven slår fast at dødshjelp er en kriminell handling, men det kan gjøres unntak fra straffeforfølgelse dersom handlingen utføres av en lege som følger anvisningene gitt i loven, se tekstboks side 47. Dødshjelp er altså ingen rettighet for pasienten eller plikt for legen, men en mulighet i situasjoner med «uutholdelig lidelse uten utsikt til bedring» (uhelbredelig sykdom eller kort forventet levetid er ikke med i lovteksten) (12).
En viktig begrunnelse for loven var at rapporter dokumenterte at dødshjelp allerede ble praktisert i Nederland,
med eutanasi ved 1,8 % av alle dødsfall i 1990 (13). Da praksis holdt seg under dette nivået de første årene etter innføring av den nye loven, ble legaliseringen ansett som vellykket og formålstjenlig. Men fra 2006 begynte tallet å stige, til nesten 10 000 rapporterte tilfeller – 5,8 % av alle dødsfall – i 2024 (14). Det reelle tallet er sannsynligvis høyere; undersøkelser har vist at omtrent hvert femte tilfelle ikke rapporteres (15).
Fra utgangspunktet «barmhjertighet ved utålelig lidelse ved livets slutt», hadde ved siste nasjonale evaluering i 2021 19 % av pasientene estimert forventet levetid mer enn seks måneder (lengste mulige tidsangivelse i statistikken) (15), og de gruppene som øker mest, er personer med demens og unge kvinner med psykiatrisk sykdom (14). Det er ikke lenger noen aldersgrense for dødshjelp i Nederland, eutanasi kan gis ut fra forhåndserklæring og tilgangen er blitt mer strømlinjeformet, også med mange omreisende team. De aller fleste tilfellene av dødshjelp skjer i allmennpraksis (14).
KREFTPASIENTER: EUTANASI
ELLER LINDRENDE SEDERING? Kreftpasienter utgjør fortsatt den største gruppen blant dem som får dødshjelp i Nederland: 62 % i 2021 og 54 % i 2024 (14, 15). Andelen kreftdødsfall med dødshjelp er derfor høyere enn den generelle statistikken viser: 12,9 % i 2021 (16), og enda høyere i visse deler av landet (17). Med økningen i dødshjelp har det også skjedd en endring i synet på hvordan man nærmer seg den naturlige døden. Lindrende sedering til døende økte fra 8 % av alle dødsfall i 2005, til 23 % av alle døds-
fall i 2021 (15). Andelen er også her høyere hos kreftpasienter; forskere i Nederland forteller at pasienter og pårørende nå oppfatter det nærmest som en rettighet å kunne velge enten eutanasi eller lindrende sedering ved kreftdødsfall (18). Selvbestemmelsen tillegges altså mye mer vekt enn tidligere, mens legens vurdering i henhold til loven får en mindre rolle (15). Mens eutanasi krever grundig planlegging og papirarbeid, er lindrende sedering ansett som en normal medisinsk prosedyre (19) – så vanlig at en anerkjent, nederlandsk lærebok om omsorg til døende stiller spørsmålet om lindrende sedering har blitt «dødshjelp i forkledning» (20).
En annen, parallell utviklingstendens er utføring av medisinske drap uten forespørsel, med 517 tilfeller i 2021, ved siste nasjonale evaluering (15,16). Rapporten viser at tilfellene omfattet pasienter med kreft, hjertekar-sykdom, demens, uhelbredelig syke nyfødte og personer med andre typer nevrologiske sykdommer eller tilstander.
CANADA: RETTEN TIL SELV Å DEFINERE LIDELSE
Loven i Canada har en annen bakgrunn. Den ble til etter en prosess i rettsapparatet som endte med en kjennelse fra Høyesterett om at et absolutt forbud mot dødshjelp var imot den canadiske grunnloven og borgernes rett til å bestemme over eget liv (21). Parlamentet fikk i oppgave å utarbeide et lovforslag, og loven om Medical Assistance in Dying (MAID) trådte i kraft i 2016 (22), se tekstboks side 47. Loven setter flere kriterier enn den nederlandske, men disse er samtidig
nokså vagt formulert, med stor vekt på den enkeltes selvbestemmelse. Det opprinnelige kriteriet om at naturlig død måtte være «rimelig nær forestående», ble opphevet i 2021 ved at det ble innført et «spor 2» til MAID, uten dette kravet (23). Dødshjelp er definert som en del av den canadiske helsetjenesten, og alle innbyggere som ønsker det, er garantert å få en vurdering for MAID.
Ikke noe land i verden har hatt en så bratt stigning av antall dødshjelptilfeller som Canada, fra omtrent 1000 tilfeller i 2016 til 15 000 tilfeller i 2023 (24) (statistikk for 2024 foreligger ikke per september 2025). Andelen dødsfall med dødshjelp er nå nesten på linje med Nederland, og innvilgelsesprosenten er høy. De to viktigste grunnene som pasientene oppgir for å søke dødshjelp, er «tap av evne til å delta i meningsfulle aktiviteter» og «tap av evne til å utføre dagliglivets aktiviteter». «Utilstrekkelig smertelindring eller frykt for dette» – slått sammen til en felles kategori – ble i 2023 oppgitt av 54,4 % i «spor 1» og 58,5 % i «spor 2» (hver person kan oppgi flere grunner). Nesten halvparten av dem som fikk dødshjelp i «spor 2», oppga «følelse av å være til byrde» og «isolasjon eller ensomhet» som grunn for ønske om dødshjelp (24).
VERDIG DØD ELLER
VERDIG LIV?
Fra Canada kommer det nå i økende grad rapporter med bekymring for hvordan praktiseringen av MAID har utviklet seg (25). Personer med funksjonshemming vil som regel oppfylle de objektive sykdomskriteriene for
MAID. Blir da den fysiske tilstanden inngangsbilletten til dødshjelp, mens den reelle lidelsen er sosial isolasjon, ensomhet og/eller manglende tilrettelegging for meningsfull livsutfoldelse? Blir dødshjelp i en del tilfeller statsassistert selvmord? Canadiske medier har rapportert om at tilgangen til MAID kan være enklere enn tilgang til vurdering i spesialisthelsetjenesten, rehabilitering, økonomiske støtteordninger eller tilrettelagt bolig. De funksjonshemmedes organisasjoner hevder at stigma og diskriminering av både funksjonshemmede og andre svake grupper har økt parallelt med økningen av MAID, og har tatt saken til rettssystemet (26).
EUTANASI VERSUS ASSISTERT SELVMORD
I den norske dødshjelpdebatten gjøres det et poeng av forskjellen mellom eutanasi og assistert livsavslutning, selv om dette både juridisk og etisk vurderes likt. Legens intensjon er i begge tilfeller å ta livet av pasienten (27). I både Nederland og Canada er eutanasi fullstendig dominerende (14, 24). Det viser seg i praksis mye vanskeligere å ta sitt eget liv, dessuten kan peroralt inntak av dødelige medikamenter både gi svært ubehagelige bivirkninger (28) og ha usikker effekt (i Nederland måtte i 2024 18 av 187 tilfeller av assistert selvmord suppleres med eutanasi) (14).
De amerikanske statene som har innført dødshjelp, har begrenset dette til assistert selvmord med peroral tilførsel for personer med dødelig sykdom og maksimalt seks måneders forventet gjenværende levetid (29). Økningen i antall tilfeller har her vært mye slakere
enn i land som tillater eutanasi, men de siste par årene har flere stater endret lovgivningen for å bedre tilgangen, blant annet ved å gi legeoppgaver til spesialutdannede sykepleiere og korte ned lovpålagt betenkningstid (30).
I Australia ble dødshjelp innført som «frivillig assistert livsavslutning», men jo flere stater som har innført legalisering, jo mindre restriktive er kriteriene. I november 2025 får Australian Capital Territory en dødshjelplov med fritt valg mellom eutanasi og assistert selvmord, og ikke noe krav om begrenset forventet levetid (31).
I Sveits er eutanasi forbudt, men medikamentene gis der som en infusjon som settes i gang av pasienten selv (32). Sveits er eneste land som tar imot utlendinger til dødshjelp. Antall tilfeller av dødshjelp til sveitsiske innbyggere økte med 71% fra 2017 til 2023 (33).
HVA KAN VI LÆRE AV ANDRE LANDS ERFARINGER?
Utviklingen i både Nederland, Canada og Australia, og andre land som ikke er omtalt her, viser tydelig hvor komplisert det er å lage et lovverk som samfunnet oppfatter som rettferdig og entydig, og som hindrer utglidning. Erfaringen viser at legalisering krever en struktur og en forvaltning, som igjen fører til en institusjonalisering av praksis og dermed en normalisering (7). Indikasjonene utvides, det blir svakere praktisering av sikkerhetsforanstaltningene og det kommer krav fra nye grupper. Dødshjelp endres mer og mer fra hjelp med å dø til hjelp til å dø.
Loven påvirker holdninger i samfunnet. Et liv som kvalifiserer for dødshjelp kan lett bli mindre verd å bekrefte, beskytte og bevare. Det paradoksale er at innføring av dødshjelp ikke bare ser ut til å svekke respekten for selve livet, men også øke fremmedgjøringen av døden. Økt bruk av lindrende sedering i livets sluttfase vitner om en distansering fra naturlig død (34). Det er heller ikke vist at innføring av dødshjelp gir færre ikke-assisterte selvmord (35).
Etter et langt yrkesliv som onkolog og palliativmedisiner er det lett å forstå at noen pasienter kan ønske å fremskynde døden. Vi har alle sett pasienter med stor lidelse, og erfart hjelpeløshet som hjelpere. Samtidig er erfaringen at de fleste pasientene holder fast ved livet og klarer å finne håp og mening midt i sykdommen. Dette kan vi bidra til ved å ta kloke valg sammen med pasientene og ved å gi god palliasjon. De gangene et ønske om dødshjelp fremmes, forstummer dette ofte med god smerte- og symptomlindring. Og som leger, og onkologer spesielt, har vi et ansvar for å forebygge og redusere overbehandling gjennom trygge behandlingsavklaringer og forhåndssamtaler.
Å bidra til god lindring og forsoning ved livets slutt er noe av det mest meningsfulle man kan gjøre som lege. For meg ble mine nederlandske kollegers leting etter tidspunktet for «uutholdelig lidelse» i kreftpasientens siste tid (20) det motsatte av vårt eget fokus på lindring og livskvalitet: å gjøre hver dag så god som mulig, helt til siste dag.
Kriterier for at dødshjelp kan tillates i Nederland og
For å unngå straffeforfølgelse for et tilfelle av dødshjelp, må legen (11)
- fastslå at pasienten har fremmet en frivillig og veloverveid forespørsel
- fastslå at pasientens lidelse er uutholdelig, uten utsikt til bedring
- ha informert pasienten om situasjonen og utsiktene
- ha drøftet saken med pasienten og kommet til den konklusjon at det ikke er noe rimelig alternativ i pasientens situasjon
- ha drøftet pasienten med en kollega
- ha avsluttet pasientens liv eller bidratt til selvmord med forsvarlig medisinsk behandling og oppfølging
- ha rapportert tilfellet
Personer som ønsker å få dødshjelp (Medical Assistance in Dying, MAID) i Canada, må oppfylle alle følgende kriterier (23):
- være minst 18 år gammel og beslutningskompetent
- ha rett til offentlige helsetjenester i Canada
- fremme en frivillig forespørsel som ikke er et resultat av ytre press
- gi informert samtykke til å motta MAID, dvs. at personen har samtykket til å motta MAID etter å ha mottatt all informasjon som er nødvendig for å ta en slik beslutning
- ha en alvorlig og uhelbredelig fysisk sykdom, tilstand eller funksjonsnedsettelse
- være i langtkommet stadium av funksjonstap, uten utsikt til bedring
- ha varig og uutholdelig fysisk eller psykisk lidelse som ikke lar seg lindre med tiltak som personen selv kan godta
Referanser:
Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
Kriteriet «naturlig død rimelig nær forestående» er siden 2021 ikke lenger noe krav, men sikkerhetsforanstaltningene er utvidet for personer som ikke oppfyller dette kriteriet.
Bevelled drainage holes To prevent occlusions

Catheter
Made from biocompatible silicone with integrated microsilver for biofilm reduction
Polyester cuff
Grows into the subcutaneous tissue and provides a barrier to infection
Integrated barium sulfate strip serves as X-ray contrast
High patient safety thanks to the lock and key principle, which prevents air from entering & unwanted leaking of effusion
Det tunnelerte kateteret muliggjør gjentatt drenasje hos pasienter med tilbakevendende pleuraeffusjoner eller ascites på sykehus og i hjemmet.
Indikasjon
• Malign pleuraeffusjon
• Benign pleuraeffusjon
• Malign ascites
• Benign ascites
Fordeler
• Rask og effektiv lindring av symptomer
• Reduksjon av infeksjoner
• Høy frekvens av spontan pleurodese
• Få episoder med spontan bakteriell peritonitt (SPB)
• Reduksjon i antall sykehusopphold og reinnleggelser
• Lavere kostnader for helsevesenet

Anne-Mette Rafn Sales Director Scandinavia info.dk@ewimed.com +45 22 27 05 02
Last ned brosjyre

NIENKE DE GLAS
Overlege ph.d Kreftavdelingen, Helse Førde

SIRI ROSTOFT
Overlege ph.d i geriatri
Geriatrisk avdeling, Oslo universitetssykehus
Professor i geriatri
Universitetet i Oslo
Hvert år øker antallet eldre pasienter med kreft i Norge1. Eldre med kreft er en heterogen gruppe, med store forskjeller mellom pasienter når det gjelder funksjonsnivå, skrøpelighet og komorbiditet2. Disse faktorene kan i stor grad påvirke utfallet av kreftbehandling. Eldre med skrøpelighet har en økt risiko for bivirkninger av kreftbehandling, og disse kan påvirke livskvalitet og funksjonsnivå3. Flere studier har vist at slike pasienter ofte ikke kommer tilbake til samme funksjonsnivå etter gjennomgått kreftbehandling4
Eldre pasienter er sterkt underrepresentert i kliniske studier av kreftmedisiner5. Det betyr at retningslinjer har svært begrenset kunnskapsgrunnlag når det gjelder eldre pasienter, spesielt eldre pasienter med skrøpelighet. Dessverre er det kjent fra flere studier at onkologer ofte ikke fanger opp pasientens skrøpelighet. De overvurderer ofte de fysiske reservene pasienter har, noe som kan føre til overbehandling6. Samtidig finnes det retningslinjer som setter aldersgrenser på noen typer behandling, og dette kan føre til underbehandling
eksempel ved å velge en redusert dose fra start, å velge monoterapi cellegift i stedet for kombinasjoner, eller å velge å avstå helt fra behandling9. I tillegg kan skrøpelighet i noen tilfeller reverseres, med for eksempel fysioterapi, ernæringstiltak eller psykologisk støtte7
Internasjonale retningslinjer anbefaler å utføre en geriatrisk screening og en geriatrisk kartlegging hos selekterte pasienter før oppstart av kreftbehandling2,10,11. Våren 2025 ble det publisert en nasjonal veileder om eldre pasienter med kreft på nettsiden metodebok.no, hvor en ekspertgruppe har definert anbefalinger for hvordan dette kan implementeres i Norge12. Veilederen er godkjent av Norsk onkologisk forening, Norsk kirurgisk forening, Norsk forening for geriatri og Norsk anestesiologisk forening.
Kontaktinformasjon
NIENKE AAFKE DE GLAS
Overlege Kreftavdelingen Helse Førde Svanehaugvegen 2
6812 Førde
nini.aafke.de.glas@helse-forde.no Tlf: 94055976
Flere randomiserte studier har vist at en grundig geriatrisk kartlegging før oppstart av kreftbehandling fører til bedre tilpasset behandling, mindre bivirkninger og bedre livskvalitet7,8. Dette forklares med at den geriatriske vurderingen gjør det mulig å tilpasse behandlingen, for
Implementering av nye tiltak eller behandlinger er ofte utfordrende i praksis. Studier har vist at det i gjennomsnitt tar 17 år å innføre nye tiltak i den medisinske verden. Implementering av et geriatrisk tilpasset forløp for kreftpasienter har vært utfordrende på grunn av manglende ressurser og prioritering i mange europeiske land13. Derfor har vi utviklet en stor implementeringsstudie, hvor vi skal forske på hvordan vi innføre et tilpasset forløp for eldre pasienter med kreft i klinisk praksis. Våren 2025 fikk vi 9,6 millioner kroner i forskningsmidler fra Helse Vest for å starte opp dette prosjektet, som skal vare i tre år.
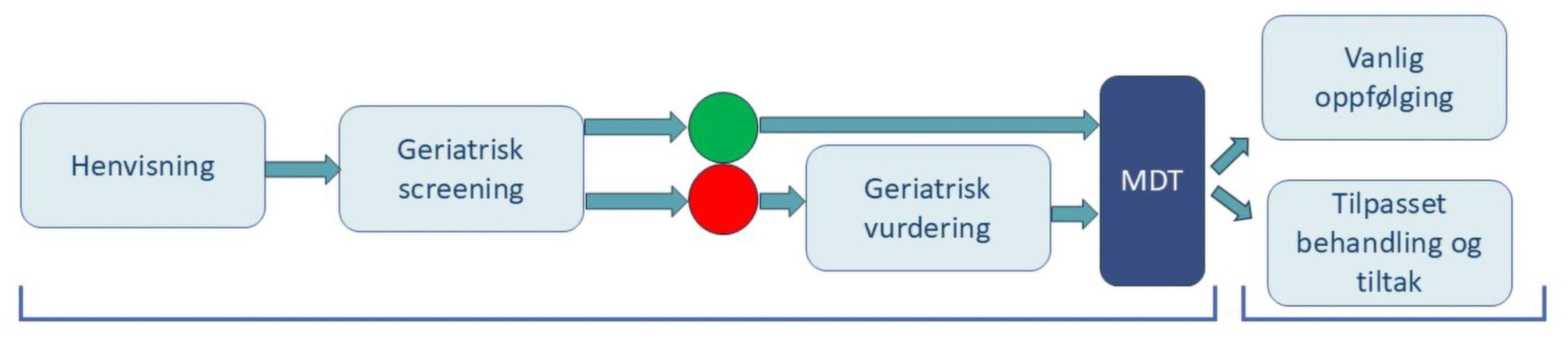
IMPACT-studien (IMplementation of Patient-CenTered Care in older patients with cancer) er en implementeringsstudie. Det betyr at man ikke forsker på om en intervensjon er effektiv, men heller hvordan man kan implementere intervensjonen i klinisk praksis. Prosjektet utføres i Helse Førde-regionen (Sogn og Fjordane) og tilknyttede kommuner. I tillegg har vi en nasjonal referansegruppe med klinikere fra Bergen, Oslo og Trondheim og brukerrepresentanter som skal hjelpe oss til å utvikle strategier til framtidig nasjonal implementering.
Intervensjonen (figur 1) består av en geriatrisk screening av alle nyhenviste pasienter med en ny kreftdiagnose, eller nye metastaser fra en tidligere kreftdiagnose. Vi skal bruke Clinical Frailty Scale14 , og alle pasienter med en score på 4 eller høyere skal henvises til en geriatrisk kartlegging utført av en geriatrisk sykepleier. Pasienter som er spreke ifølge Clinical Frailty Scale (score 1–3) får vanlig behandling og oppfølging.
Under en geriatrisk kartlegging ser vi på funksjonsnivå, komorbiditet, medisinbruk, kognitiv funksjon, ernæringstilstand, sosialt nettverk og hjelpebehov. I tillegg kartlegger vi pasientens preferanser slik at de
kan tas i betraktning i samtale med kreftbehandleren.
Resultatene av denne kartleggingen tas opp i MDT-møter, slik at behandlingsplanen kan tilpasses. I tillegg samarbeider vi med kommunene for å lage en individuelt tilpasset oppfølgingsplan, for eksempel med ekstra oppfølging av ressurssykepleiere eller andre kommunale helsetjenester. Ved behov kan palliativt team kobles på i et tidlig stadium.
Prosjektet bruker både kvalitative og kvantitative metoder. Før implementering av intervensjonen skal vi kartlegge hvordan man i dag jobber ved de forskjellige avdelingene som behandler kreftpasienter, og hvordan utfallet av behandling av eldre pasienter med kreft ved sykehuset er. I tillegg utfører vi intervjuer med helsepersonell og pasienter for å identifisere hemmere og fremmere av utviklingen av en god implementeringsstrategi. Gjennom implementeringsprosessen måler vi opptak av intervensjonen, men også effekten på livskvalitet, innleggelser og bruk av ressurser både på sykehus og i kommunene. Prosjektet bruker et kjent implementeringsrammeverk som heter RE-AIM (Reach, Effectiveness, Adoption, Implementation, Maintenance). Vi skal utarbeide metoder for å gjøre kartleggingen på mest effektive måte
(for eksempel ved bruk av digitale verktøy), og god kommunikasjon mellom helsepersonell, kommunene og kreftbehandlere er essensielt for en vellykket intervensjon.
FORVENTET EFFEKT
AV PROSJEKTET
Det forventes at dette prosjektet skal identifisere nye strategier for å implementere tilpasset kreftbehandling hos eldre pasienter som kan brukes ved norske sykehus i framtiden. Det forventes at dette vil ha stor verdi for pasienter fordi det vil føre til bedre livskvalitet og færre innleggelser. I tillegg forventer vi at prosjektet skal føre til bedre bruk av ressurser, ettersom vi forventer at innleggelser reduseres og at pasienter beholder sitt funksjonsnivå, slik at det blir mindre behov for bruk av kommunale helsetjenester.
KONKLUSJON
Eldre pasienter med kreft trenger ofte tilpasset behandling og oppfølging. Geriatrisk vurdering og medfølgende tilpasset behandling og oppfølging kan forbedre utfallet av behandlingen. Prosjektet vårt skal bidra til økt livskvalitet og bedre bruk av helseressurser.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
Zejula er godkjent og refundert i 1L behandling ovariekreft uavhenging av BRCA og HRd** status.1-5

Sluttanalyse for PRIMA-studien hos høyrisikopasienter i 1L:6
Andel pasienter som oppnådde 5 års PFS* (deskriptiv ad hoc analyse):
• 35 % i niraparibgruppen mot 16 % i placebogruppen hos HRd** pasienter
• 22% i niraparibgruppen mot 12 % i placebogruppen i totalpopulasjonen
*Progression-free survival, **Homologous recombination deficient PRIMA-studien møtte ikke sekundære endepunktet for total overlevelse (OS)6
6 års sikkerhetsdata i PRIMA bekrefter kjent sikkerhetsprofil, hvor de mest alvorlige bivirkningene var trombocytopeni og anemi6
Indikasjoner
Monoterapi til vedlikeholdsbehandling av voksne med avansert (FIGO stadium III eller IV) høygradig ovariekreft, kreft i eggleder eller primær peritonealkreft, med respons (fullstendig eller delvis) etter fullføring av førstelinje platinabasert kjemoterapi. Monoterapi til vedlikeholdsbehandling av voksne med tilbakefall av platinasensitiv, høygradig serøs kreft i ovarieepitel eller eggleder eller primær peritonealkreft, med respons (fullstendig eller delvis) på platinabasert kjemoterapi.
Kontraindikasjon
Amming Forsiktighetsregler
Hematologiske bivirkninger (trombocytopeni, anemi, nøytropeni) er rapportert hos pasienter behandlet med Zejula. Pasienter med lav kroppsvekt eller lave trombocyttverdier ved baseline kan ha økt risiko for trombocytopeni av grad 3+. Ukentlig overvåkning av komplett blodstatus 1. behandlingsmåned er anbefalt, deretter månedlig i 10 måneder, og deretter regelmessig. Grunnet risikoen for trombocytopeni, bør antikoagulantia og legemidler som er vist å redusere trombocyttverdiene brukes med forsiktighet. Tilfeller av myelodysplastisk syndrom/akutt myelogen leukemi (MDS/AML) har blitt
For å lese PRIMAstudien scan QR-koden
observert hos pasienter som ble behandlet med Zejula som monoterapi eller kombinasjonsterapi i kliniske studier og etter markedsføring. Hypertensjon, inkludert hypertensiv krise, er rapportert med bruk av Zejula. Blodtrykket bør overvåkes minst ukentlig i to måneder, etterfulgt av månedlig overvåking i det første året og deretter regelmessig under behandling med Zejula. Posterior reversibel encefalopati-syndrom (PRES) er en sjelden, reversibel nevrologisk sykdom som kan oppstå med raskt utviklende symptomer, inkludert hypertensjon. Det anbefales å seponere Zejula ved PRES og behandle spesifikke symptomer. Graviditet, amming og fertilitet, Skal ikke brukes under graviditet eller hos fertile kvinner som ikke ønsker å bruke veldig sikker prevensjon under behandlingen og i 6 måneder etter siste dose. Graviditetstest bør utføres på alle fertile kvinner før oppstart av behandling. Se preparatomtalen om bivirkningshåndtering og full informasjon før forskrivning av Zejula. Ved uønskede medisinske hendelser, kontakt GSK på telefon 22 70 20 00.
Pakninger og priser: Maksimalpriser: 56 stk. (blister) kr 48.623,00. 84 stk. (blister) kr 72.916,30. Zejula inngår i onkologianbudet til rabattert pris. Refusjon: H-resept: L01X X54_1 Niraparib. Zejula er per i dag godkjent for offentlig finansiering ved førstelinjebehandling av BRCA-positive pasienter og andrelinjebehandling av BRCA-negative og BRCApositive pasienter. Refusjonsberettiget bruk: Rekvirering skal gjøres i tråd med nasjonale handlingsprogram for kreft og føringer fra RHF/LIS spesialistgruppe. Vilkår: (216) Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist. Reseptgruppe C.
or licensed to the GSK group of companies. PM-NO-NRP-ADVR-240001, Oktober 2024 Referanser: 1. ZEJULA (niraparib). Summary of Product Characteristics. 2. https://nyemetoder.no/metoder/niraparib-zejula-indikasjon-iv 3. https://nyemetoder.no/metoder/niraparib-zejula-indikasjon-iirevurdering 4. https://nyemetoder.no/metoder/niraparib-zejula-indikasjon-iii 5.https://nyemetoder.no/Documents/Beslutninger/Beslutningsforum%2012122022_Protokoll.pdf 6. Monk BJ, Barretina-Ginesta MP, Pothuri B, Vergote I, Graybill W, Mirza MR, et al. Niraparib first-line maintenance therapy in patients with newly diagnosed advanced ovarian cancer: final overall survival results from the PRIMA/ENGOT-OV26/ GOG-3012 trial. Ann Oncol. 2024; doi: 10.1016/j.annonc.2024.08.2241.
Hvordan kan vi få flere leger til å innse at de bør (for)bli onkologer? For å styrke rekrutteringen til faget bør vi skape fleksibilitet, undersøke eget rykte og involvere ansatte i samtaler om arbeidsmiljøet. Vi må utforske ulike rekrutteringsarenaer, jobbe med mestring av usikkerhet, og ikke minst må vi lære av hverandre både faglig og organisatorisk.

TOBIAS SOLLI IVELAND
Overlege, ph.d., konstituert seksjonsoverlege for LIS Akershus universitetssykehus
Nylig avtroppet nestleder Ylf og sentralstyremedlem Dnlf. Like etter blitt prosjektleder i Gjør kloke valg-kampanjen.
Denne kronikken skriver jeg med bakgrunn i flere år som foretakstillitsvalgt og styremedlem i Yngre legers forening. Jeg kan med en gang si at det ikke finnes noen fasit på akkurat hva som må gjøres for å bedre rekruttering på en spesifikk arbeidsplass. Noen steder fungerer et tiltak, andre steder vil ikke det samme tiltaket ha noen effekt. Det er også mange arbeidsplasser som tilsynelatende gjør alt rett, hvor det er vanskelig å sette fingeren på hvorfor de sliter med å rekruttere og beholde leger. Det er en del tilfeldigheter som spiller inn, men jeg forsøker å komme med noen tanker og ideer til tiltak som kanskje kan legge til rette for bedre rekruttering til faget på sikt.
Legeforeningen deler årlig ut en lederpris. Refleksjonen jeg gjør meg etter å ha lest både nominasjoner og tildelinger er at der en har oppnådd et sterkt arbeidsmiljø har det vært jobbet målrettet i flere år i forkant. Det har ofte vært et sterkt faglig fokus og det har blitt iverksatt flere tiltak hvor kontinuerlig medvirkning og dialog med de ansatte har stått helt sentralt. Dette har til slutt resultert i en flokkmentalitet, en opplevelse av å høre til og å være stolt over arbeidet man gjør,
hvor ansatte jobber sammen og det spres videre et godt rykte avdelingen.
Rekrutteringen til sykehusspesialiteter og onkologien starter først og fremst med de som er til stede på arbeidsplassen i dag. Man kan få flere søkere på en utlyst stilling ved å dele annonser flittig på sosiale medier eller lage en rekrutteringsvideo som skaper oppmerksomhet. Slike tiltak fungerer ikke nødvendigvis for å beholde legene på sikt. Legemiljøene i Norge er mindre enn man skulle tro, og rykter spres raskt blant medisinstudenter på universitetene og LIS på kurs, samt på andre sosiale arenaer hvor leger møtes. Enda verre enn mangelen på et godt rykte er det å få et dårlig rykte. Et nyttig forbedringsarbeid kan starte med nysgjerrighet på hvorfor noen slutter og på hvilket rykte som spres om sin avdeling.
Det er en klart økende trend i antall utdannede onkologer (figur 1). De aller fleste distrikter har omtrent like mange spesialister som LIS (figur 2). Universitetssykehusområdene Oslo, Trondheim (Sør-Trøndelag) og Tromsø (Troms) har en klart høyere andel spesialister. Dette er dog ikke
tilfellet for Akershus eller Bergen (Hordaland).
Basert på en uformell spørreundersøkelse til tiårs-gjenforening fra mitt medisinkull på NTNU jobbet rundt 50 % i den spesialiteten de hadde sett for seg under studiet. Mange hadde under LIS1-tjenesten sett en avdeling som det virket gøy å jobbe på, og søkt seg dit. Andre ville til en spesifikk by og søkte seg til en tilfeldig ledig stilling der. Men mitt kull møtte en annerledes rekrutteringssituasjon enn den som finnes i dag. Å bli LIS3 krevde ofte erfaring fra tidligere vikariater. Nå står mange LIS3-stillinger vakante eller er fylt av medisinstudenter, også i sentrale strøk. Den nye generasjonen leger, både menn og kvinner, kan i større grad velge spesialitet enn tidligere, noe som inkluderer hensyn til jobb-/livsbalanse. RHF-direktør i Helse Sør-Øst uttalte nylig at det må bli mer autonomi og fleksibilitet i sykehusene, men hvordan skal man konkret få til dette, og hvordan kan vi få potensielle onkologer til å søke seg til faget?
Onkologien er vanligvis ikke en rotasjonsplass for LIS1, noe som er en god rekrutteringsarena for medisin, kirurgi og psykiatri. Finnes det likevel muligheter for å invitere onkologer inn på internundervisninger for akuttmottak og i opplæringsuker for LIS1? Eller kanskje tilby et program for hospitering for nysgjerrige LIS1 når de har ledig tid? Mange fremtidige onkologer møter en onkologisk avdeling i løpet av studiet eller som sommervikar. Å behandle disse ryktebærerne godt er en selvfølge for dem som på sikt ønsker å rekruttere disse og/eller deres venner til onkologien. Som tillitsvalgt har jeg sett at medisinstudenter har blitt satt til oppgaver de ikke hadde kompetanse til eller forutsetninger for å klare, og det kan medføre at de mister motivasjonen for faget. I tillegg kan en overdreven bruk av lavere kompetanse for å erstatte behovet for hender føre til en relativ uthuling av faget. Onkologi er ikke lett, og det er derfor uklokt å bare tenke hender, og ikke være bevisst at kompetanse må til for å håndtere onkologiens usikkerhetsmoment.
ULEMPER OG USIKKERHETSMOMENTER
Alle spesialiteter har sine fordeler og ulemper. Onkologer møter pasienter med alvorlig sykdom, hvor behandlingen betyr mye for utfallet. Det er meningsfullt å jobbe med slike pasienter, og rask vitenskapelig utvikling av faget er motiverende. Jeg har tidligere påstått at de positive sidene av legeyrket kan bli de negative sidene, under visse omstendigheter (Iveland, 2025) og jeg mener dette også stemmer for onkologien. For samtidig som den raske kunnskapsutviklingen og nye medikamenter gir pasientene lengre levetid, så får retningslinjer kortere og kortere levetid. Det er derfor naturlig å kjenne seg usikker på om man har fått med seg de siste studiene og oppdateringene av handlingsprogram. Spesielt vaktgående LIS har måttet følge med på utviklingen i flere fagfelt. Usikkerhet om man har avdekket alle muligheter for pasienten, eller om man var på rett boks i et voksende flytskjema av undergrupper, kan være ubehagelig.
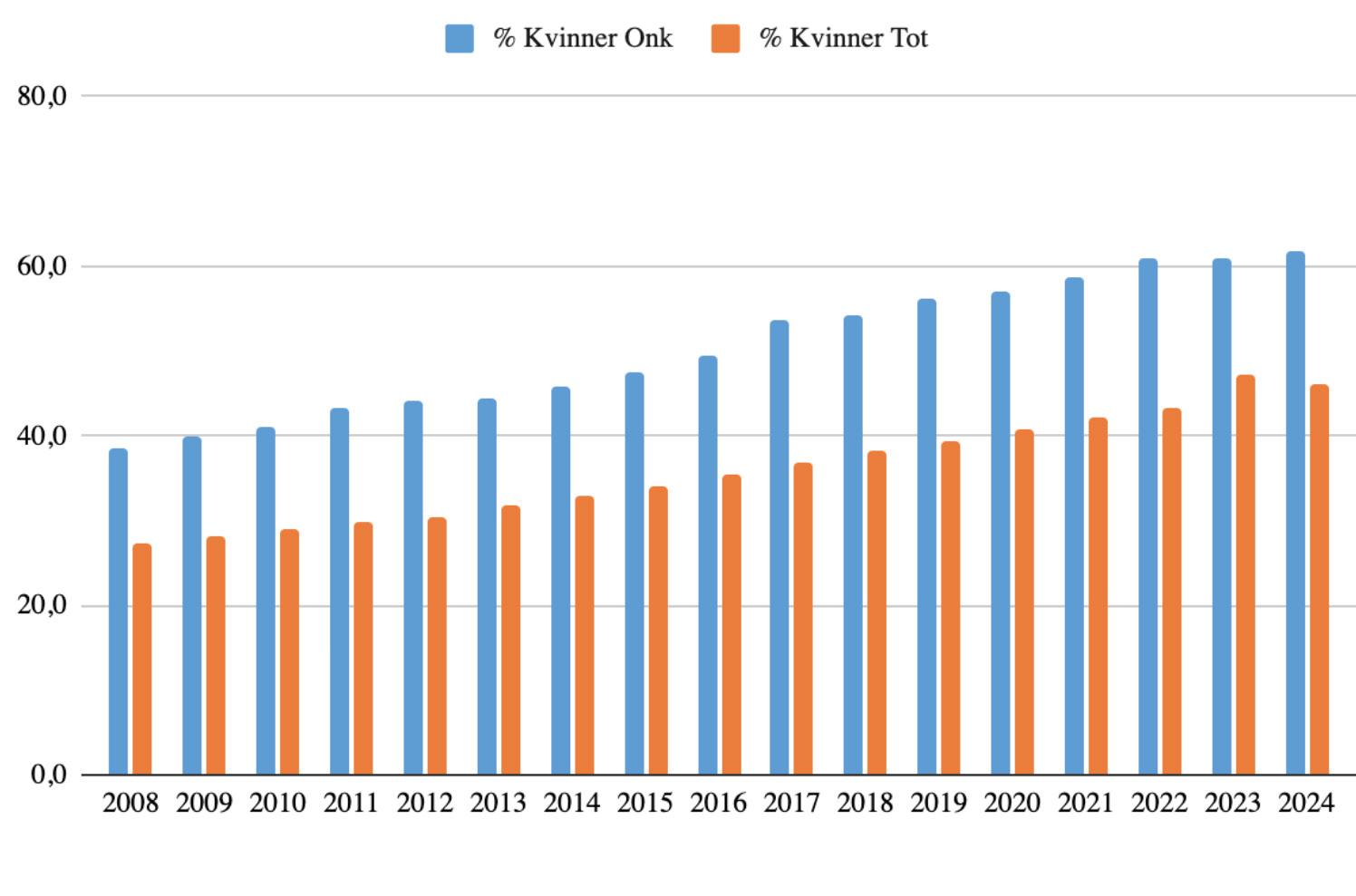
Høsten 2025 har det vært flere artikler i Tidsskriftet om usikkerhet blant medisinstudenter og nyutdannede leger. Medisinstudenter er kanskje ikke godt nok forberedt på at legeyrket handler mye om sannsynlighetsvurderinger og avveininger (Eliassen et al., 2025; Gulbrandsen et al., 2025).
Det er sjelden to streker under svaret og vi vet at usikkerhet påvirker alle trinn i diagnostiske prosesser (Helou et al., 2020) og forverres av høy arbeidsbelastning og/eller opplevd stress (Grady et al., 2022). Det er ikke vanskelig å anbefale EC-90 og taksaner til en pasient med høy risiko for tilbakefall og som tåler behandlingen. Men, hva med grensetilfellene? Hva skjer hos en LIS som spør én overlege som er tydelig på at pasienten bør avslutte adjuvant behandling, mens den neste overlegen i gangen sier utsett kur i to dager og den tredje overlegen sier utsett i en uke og reduser til 70 % dose?
Det er utviklet fjellvettregler for å jobbe med usikkerhet, da usikkerhet synes å være både en driver for over-
behandling av pasienter og utbrenthet blant leger (Ofstad et al., 2025). Kanskje kan arbeid med kloke valg kombineres med arbeid med usikkerhet? Våren 2025 startet vi en tverrfaglig kontinuerlig forbedringsgruppe: «Kloke valg, innovasjon og kvalitetsgruppen» (KVIK) på onkologisk avdeling på Akershus universitetssykehus. KVIK-gruppen er satt sammen av sykepleiere, LIS, overleger og merkantilt ansatte, og forsøker å bryte ned siloer. Vi prøver å skape en kultur for jevnlig å avdekke hindringer for kloke valg, hva som har opplevdes unødvendig tungvint i pasientflyt og hva som har fungert #Råbra. Fokuset på det som går #Råbra vil også føre til at det ikke skal være bare «No news is good news» i LIS-utdanningen, eller i kollegiet for øvrig. På sikt håper vi å bygge en kultur for faglige prioriteringer og reduksjon av usikkerhet. Dette kan vise seg gjennom bedre interne retningslinjer, bedre kommunikasjonstiltak eller å tørre å tenke nytt om organisering eller pasientoppfølging.
Et tiltak for å redusere usikkerhet blant onkologer er å øke kontinuitet i pasientmøtene. Dette reduserer konfereringsbehov og behov for «å lese seg opp». I tillegg skaper det større utvikling i legerollen å møte samme pasient, inkludert erfaring av om kommunikasjonen med pasienten har fungert. LIS er tradisjonelt bare seks måneder på hver faggruppe og det tillater ikke et helt løp fra svar på henvisning til f.eks. avsluttet EC-90 og taksan. Kan vi tillate å følge enkelte pasienter fra forrige fagfelt selv om man har rotert til et nytt? Å velge ut egne pasienter å følge selv gir mestring og følelse av autonomi og kontroll over egen hverdag.
TILRETTELEGGING, ARBEIDSMILJØ OG TRYGG LÆRINGSARENA
Rekrutteringsvansker og mangel på helsepersonell er et faktum i 2025, og vil ikke bli bedre med årene om det ikke fylles på i bunn. Andelen kvinner i onkologi har ligget 10–15 % over gjennomsnittet for legegruppen som helhet i mange år (figur 3). Det er en selvfølge at onkologien da må ha en
god plan for å tilrettelegge for svangerskap og for livet som småbarnsforeldre.
Flere avdelinger har lyktes med å skape fleksibilitet ved å se kritisk på aktivitetene på starten og slutten av dagen. Vaktrapporter for alle legene på morgenen og slutten av dagen kan skiftes ut med mer utvalgt og spisset rapport. Noen avdelinger har samlet opp internundervisning til enkelte undervisningsdager i måneden, eller andre tidspunkt på dagen. Dette kan også tilrettelegge for at sengepostarbeid kommer i gang tidligere og man slipper avvik på for sene utskrivelser.
Arbeidsmiljøet påvirkes av flere faktorer. Legeforeningen har laget en veileder som kan være verdt å se på (QR 1). Blant annet foreslås fadderordning, medarbeidersamtaler og fokus på transparent og rettferdig ledelse, noe som er viktig i ansettelser og bestemmelser av rotasjonsrekkefølger.
Det er mange pliktoppfyllende leger, fra LIS1 til overleger, som ikke vet helt hva som forventes. Med stor dokumentasjonsbyrde burde vi ha tydelige maler for hva som skal være med i notater med tanke på kvalitet og mengde. Det er av alles interesse at notater blir godkjent etter konsultasjon og det er tidvis stor variasjon, men både for korte og for lange notater kan være «feil». Tryggheten i en god mal kan videre redusere behovet for administrasjon før og etter pasientmøter. Det bør være rom for litt personlig påvirkning av dokumentasjonen, men spesielt supervisører må være bevisst hva man selv bringer av preferanser. Det er ikke lett å bli
trygg beslutningstaker som LIS hvis det pirkes på småting eller gis motstridende tilbakemeldinger fra forskjellige overleger. Det er også viktig at vi snakker med og ikke om hverandre, selv om det kan være ubehagelig å få, eller gi, tilbakemeldinger.
I faget vårt utføres det få prosedyrer. Som en god kollega sier, «Poliklinikken er min operasjonssal». Det kan være viktig med noen avbrekk i direkte pasientrettet arbeid og spesielt for de som ikke tegner strålefelt. Er det mulighet å dyrke LIS-enes personlige interesser? For eksempel åpne for bidrag inn i kliniske studier, forskning eller andre forbedringsprosjekt? Kanskje har en LIS interesse for immunterapibivirkninger og er motivert for å lage veiledninger for oppfølging, eller kan en LIS med erfaring fra et annet fagfelt bruke sin kunnskap og sitt nettverk til å etablere en mer effektiv flyt for enkle biopsier?
FORUM FOR Å SPRE TILTAK?
Vi har verdens dyktigste arbeidsflokk og det er mange onkologer og leger i dette landet som har tenkt på og implementert tiltak som vi alle kan lære av. Medisinsk avdeling på Haraldsplass har laget en app som tilrettelegger for fleksibilitet og har bidratt til å sikre rekruttering (QR 2). Ikke alle avdelinger er kyndige nok til å drive apputvikling, men jeg tror vi står bedre rustet til å møte fremtiden om vi blir enda flinkere til å dele verktøy og suksesshistorier, slik at ikke hver avdeling må finne opp kruttet selv. Det er bare å ta kontakt for å høre mer om KVIK, hvis noen ble interessert! Kanskje kan OnkoNytt være en arena for å dele suksesshistorier og ideer
som kommer både pasienter, leger og arbeidsmiljøet til gode?
Å klare å skape innovative arbeidsmiljø, som også jobber med den uunngåelige usikkerheten som kommer med legeyrket, vil på sikt gjenspeiles i beholdning og rekruttering i et av fremtidens viktigste fag. Tusen takk til alle gode kolleger jeg har og har hatt!

QR 1 www.legeforeningen.no/ om-oss/publikasjoner/veiledere/ veileder-arbeidsmiljo-for-leger-isykehus/?chapter=2

QR 2 dagensmedisin.no/ arbeidsliv-haraldsplass-diakonalesykehus-lis-leger-i-spesialisering/ haraldsplass-prosjekt-gir-okt-trivselfor-lis/680805
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no

Forstoppelse skal forebygges og kan behandles1
Rizmoic® (naldemedin) for behandling av opioidindusert forstoppelse (OIC) hos voksne pasienter som tidligere har blitt behandlet med et laksativ
Kan tas med eller uten mat, anbefalt samme tid hver dag.
En 200 µg filmdrasjert tablett, daglig uten behov for dosejustering av opioiddosen
Rizmoic® kan brukes med eller uten laksantia.
-både for pasienter med kreftrelaterte smerter og ikke kreftrelaterte smerter
Utvalgt sikkerhetsinformasjon:

Kontraindikasjoner: Pasienter med kjent eller mistenkt gastrointestinal obstruksjon eller perforasjon og pasienter med økt risiko for tilbakevendende obstruksjon, grunnet fare for gastrointestinal perforasjon.
Forsiktighetsregler: Forsiktighet utvises hos pasienter med tilstander som kan medføre redusert integritet i GI-traktus. Pasienter skal rådes til å rapportere eventuelle sterke, vedvarende eller forverrede symptomer på gastrointestinale bivirkninger. Bruk av naldemedin anbefales ikke til pasienter med alvorlig nedsatt leverfunksjon.
Behandling innledes med forsiktighet hos pasienter > 75 år. Pasienter med alvorlig nedsatt nyrefunksjon overvåkes innledningsvis.
Vanlige bivirkninger hos pasienter med kroniske, ikke-kreftrelaterte smerter og opioidindusert forstoppelse: diaré, abdominalsmerter, kvalme, oppkast. Hos pasienter med kreft og opioidindusert forstoppelse: svært vanlige bivirkninger diaré og vanlige bivirkninger abdominalsmerter.
Pakninger og priser: 30 tabl. kr 765,30, 100 tabl. kr 2 326,90. Refusjonsberettiget bruk: Behandling av opioidindusert forstoppelse hos voksne pasienter når respons på vanlig avførende behandling ikke har vært tilstrekkelig.
Refusjonskoder: ICPC/ICD-75 OIC hos pasienter som kun kan oppnå tilstrekkelig e ekt av opioidreseptorantagonist, vilkår 221 og ICPC/ICD -90 Palliativ behandling i livets sluttfase, vilkår 136, 200. Vilkår:136: Refusjon ytes selv om legemiddelet skal brukes i mindre enn tre måneder. 200: Refusjon ytes kun til pasienter som ikke har tilstrekkelig e ekt av vanlig avførende behandling. 221: Forstoppelse skal være indusert av et opioid som pasienten får dekket etter refusjonskode -71.

Referanse: 1. Regional kompetansetjeneste i lindrende behandling i Nord-Norge, Medikamentell smertebehandling, Opioider. https://metodebok.no/index.php?action=topic&item=LcnRJqmD Lest 20.01.2025
God kvalitet på spesialistutdanningen er sammen med et godt og inkluderende arbeidsmiljø med rom for å ta mange gode, noen dårlige og flest kloke valg, viktig for å rekruttere og beholde spesialister i faget vårt!

MIRJAM D. ALSAKER
Spesialistkomiteen: Overlege, ph.d. Kreftklinikken, St. Olavs.
OG VÅRE OPPGAVER
Spesialitetskomiteen i onkologi består, som alle spesialitetskomiteene, av fem faste medlemmer og tre varamedlemmer. Ett fast og ett varamedlem skal være LIS. Hvert medlem oppnevnes for en periode på fire år med mulighet for re-oppnevnelser. Det er fagstyret i Legeforeningen som oppnevner medlemmer etter innstilling fra Norsk onkologisk forening.
Våre oppgaver inkluderer vurdering av læringsmål og læringsaktiviteter i LISutdanningen, oppfølging av kvalitet på utdanningen ved de enkelte utdanningsinstitusjonene og godkjenning av obligatoriske kurs innen LISutdanningen. Videre har vi en rådgivende rolle overfor Helsedirektoratet (Hdir), Legeforeningen (Dnlf) og andre instanser i spørsmål som omhandler vår spesialitet, f.eks. godkjenning av utdanningsinstitusjoner og godkjenning av utenlandske spesialister. I praksis vil alle endringer som handler om kvalitet av spesialistutdanningen komme en tur innom komiteen før Hdir tar en beslutning.
Onkologer og LIS flest kjenner oss nok best fra våre oppfølgingsbesøk ved utdanningsinstitusjonene hvor formålet er å evaluere utdanningskvaliteten. Besøkene er det mest givende ved arbeidet i komiteen. Vi får møtt nye
og erfarne onkologkollegaer og kommende stjerner. Det er åpenbart noen ulikheter, men kanskje flere likheter mellom små og store institusjoner og vi erkjenner at det finnes mer enn en vei for å få frem gode kliniske onkologer i Norge!
Vi skal i utgangspunktet besøke hver institusjon hvert fjerde år, men de siste årene har besøkene funnet sted omtrent hvert femte år pga. pandemien, samt ny spesialistordning fra 2019 med behov for besøk ved alle institusjoner for godkjenning i henhold til ny ordning.
Etter en litt famlende start hvor ansvarfordelingen mellom spesialitetskomiteene og Hdir var litt uklar, er det nå etablert et godt samarbeid mellom oss. Vi har det siste året vært i flere samarbeidsmøter med Hdir og ser klare fordeler med dagens løsning.
Under våre besøk avdekker vi av og til forhold ved LIS-utdanningen som behøver forbedring. De siste årene har vi sett behov for ekstra oppfølging ved flere av våre største utdanningsinstitusjoner. Vi ser det gjennomgående har vært lettere å implementere ny utdanningsstruktur på mindre steder enn på de «store, tunge institusjonene». Pga. det store antallet LIS som utdannes ved våre største institusjoner er det ekstra viktig at
opplæringen her holder tilstrekkelig standard. Vi ønsker at utdanningsinstitusjonene skal være like stolte av sin spesialistutdanning som av andre oppgaver de har!
OG ANBEFALTE LÆRINGSAKTIVITETER
I år har vi startet arbeidet med en etterlengtet revidering av læringsmålene for LIS. Arbeidet vil fortsette gjennom resten av 2025 og til utpå nyåret før forslag til endringer kan sendes til høring. I et fag som er i så rask utvikling som vårt er slike regelmessige revideringer høyst nødvendig. Samtidig må læringsmålene være utformet på en måte slik at de kan gjennomføres ved institusjoner med stor variasjon i pasientomfang og lokale prosedyrer.
I forbindelse med dette arbeidet har vi fått inntrykk av at mange ikke har oversikt over forskjellen på læringsmål og læringsaktiviteter, samt hva som er de anbefalte nasjonale målene og aktivitetene. Vi har fått mange tilbakemeldinger med ønsker om endringer av læringsaktiviteter i Kompetanseportalen. I mange tilfeller er dette aktiviteter som er bestemt lokalt, og som ikke vil gjenfinnes i Kompetanseportalen til en LIS fra en annen utdanningsinstitusjon. En hovedregel er at nasjonalt anbefalte læringsaktiviteter må være tellbare, eksempelvis vurdere 5 brystkreft-henvisninger eller planlegge strålebehandling for 20 prostatakreftpasienter. Andre læringsaktiviteter, som f.eks. “Delta på internundervisning” er bestemt lokalt og kan endres lokalt, de faller altså ikke inn under komiteens revisjonsarbeid.

Fra komiteens besøk ved kreftavdelingen ved Ålesund sjukehus. Fra venstre: Mirjam D. Alsaker, Olav Engebråten, Silje Songe-Møller, Jarle Jakobsen, Cecilie S. Nordstrand.
Videre virker det å være en utbredt misforståelse at alle læringsaktiviteter må være gjennomført for at et læringsmål kan godkjennes. Dette stemmer ikke. Det er kun læringsmålene i seg selv som må være oppfylt. Læringsaktivitetene (både lokale og nasjonale) kan dog være nyttige verktøy for å vurdere om dette er tilfelle.
NY LEDER
Undertegnede rykket tidligere i år opp etter mange år som nestleder da Olav Engebråten uttrykte ønske om å trappe ned sin virksomhet i komiteen. Olav blir sittende ut sin periode. Han
har gjort en flott jobb som leder siden 2019 og loset oss gjennom hele implementeringen av ny spesialistordning i onkologi! Takk for godt samarbeid! Min jobb blir nok å fortsette det gode arbeidet Olav har startet og ha et enda skarpere blikk på utdanningen i stråleterapi.
På vegne av spesialitetskomiteen i onkologi, Mirjam D. Alsaker

THE ONLY ADC TO SIGNIFICANTLY IMPROVE OVERALL SURVIVAL (OS) ACROSS HER2− mBC (INCLUDING HER2-LOW AND HER2 0)1


From 2L mTNBCa
mTNBC: OS 11.8 months with TRODELVY vs. 6.9 months with physician’s choice of single agent chemotherapy.1,b
a. TRODELVY as monotherapy is indicated for the treatment of adult patients with unresectable or metastatic triple-negative breast cancer (mTNBC) who have received two or more prior systemic therapies, including at least one of them for advanced disease.1
Dosering Administreres av helsepersonell med erfaring i bruk av kreftlegemidler. Komplett utstyr for gjenopplivning skal være tilgjengelig. Voksne: 10 mg/kg/uke gitt som i.v. infusjon på dag 1 og dag 8 i behandlingssykluser på 21 dager, til sykdomsprogresjon eller uakseptabel toksisitet. Forebyggende behandling: Før hver dose anbefales forebyggende behandling mot infusjonsrelaterte reaksjoner og kjemoterapi-indusert kvalme og oppkast (CINV), se SPC. Primær forebyggende behandling med granulocyttkolonistimulerende faktor (G-CSF) med oppstart i 1. syklus bør vurderes ved økt risiko for febril nøytropeni, se SPC. Dosereduksjonsplan og anbefalte doseendringer ved bivirkninger: Se SPC for doseringsveiledning.
Kontraindikasjoner Overfølsomhet for innholdsstoffene.
Utvalgt sikkerhetsinformasjon Nøytropeni: Alvorlig/livstruende nøytropeni kan opptre, inkl. dødelige infeksjoner. Primær forebyggende behandling med G-CSF med oppstart i 1. behandlingssyklus bør vurderes ved økt risiko for febril nøytropeni (se SPC). Absolutt nøytrofiltall (ANC) skal overvåkes. Skal ikke gis hvis ANC er <1500/mm3 på dag 1 eller <1000/mm3 på dag 8 i en syklus. Gis ikke ved nøytropen feber.
▼
b. HR: 0.51 [95% CI: 0.41–0.62]; p=<0.0001. ASCENT was an international, open-label, randomized, phase 3 multicenter study of patients with unresectable locally advanced or metastatic TNBC (N=529).1
Reference: 1. TRODELVY SmPC 06/2025.
Pga. nøytropeni eller febril nøytropeni kan doseendringer være påkrevd. Nøytropeni skal behandles med G-CSF, og forebyggende behandling vurderes i etterfølgende sykluser som klinisk indisert. Diaré: Kan forårsake kraftig diaré, ev. dehydrering og akutt nyreskade. Loperamidbehandling og ytterligere støttetiltak kan benyttes. Ved for sterk kolinerg respons på behandling kan egnet behandling gis ved etterfølgende behandlinger. Overfølsomhet: Anafylaktiske reaksjoner er sett. Premedisinering før infusjon anbefales. Kvalme/oppkast: Antiemetisk forebyggende behandling anbefales. Pasienter skal gis legemidler de kan ta med hjem. Redusert UGT1A1-aktivitet: SN-38 metaboliseres via UGT1A1. Pasienter med kjent nedsatt UGT1A1-aktivitet skal overvåkes nøye for bivirkninger. Natrium: Daglig totalt natriuminntak fra alle kilder skal vurderes.
Utvalgte bivirkninger Svært Vanlige Hematologiske: Anemi, leukopeni, lymfopeni, nøytropeni. Gastrointestinale: Abdominalsmerter, diaré, forstoppelse, kvalme, oppkast. Andre: Fatigue, alopesi, overfølsomhet, urinveisinfeksjon, øvre luftveisinfeksjon, dyspné, hoste, artralgi, ryggsmerter, hodepine, svimmelhet, insomni, hypokalemi, hypomagnesemi, redusert appetitt.
Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig.
Trodelvy «sacituzumabgovitekan» pulver til konsentrat til infusjonsvæske, oppløsning
Reseptgruppe C
Indikasjon: - Monoterapi hos voksne med inoperabel eller metastatisk trippelnegativ brystkreft (mTNBC) som har fått 2 eller flere tidligere systemiske behandlinger, hvorav minst 1 for avansert sykdom. - Monoterapi hos voksne med inoperabel eller metastatisk hormonreseptor (HR)-positiv, HER2-negativ brystkreft som har fått endokrinbasert behandling og minst 2 ytterligere systemiske behandlinger i avansert setting. Spesielle pasientgrupper: Nedsatt leverfunksjon: Sikkerhet ikke fastslått ved moderat/ alvorlig nedsatt leverfunksjon. Nedsatt nyrefunksjon: Ikke undersøkt ved alvorlig nedsatt nyrefunksjon eller terminal nyresvikt. Eldre: Begrensede data hos eldre ≥75 år. Tilberedning/Håndtering: Skal tilberedes av helsepersonell med erfaring i håndtering av kreftbehandling. Se pakningsvedlegget for instruksjoner. Administrering: Gis som i.v. infusjon. Se SPC. Interaksjoner: UGT1A1-hemmere eller -induktorer kan potensielt hhv. øke eller redusere SN-38-eksponering. Forsiktighet utvises ved samtidig bruk. Graviditet og amming: Graviditet: Teratogenisitet og/eller embryoføtal dødelighet kan oppstå. Skal ikke brukes under graviditet hvis ikke klinisk tilstand gjør det nødvendig. Kvinner i
fertil alder må bruke sikker prevensjon under og i 6 måneder etter avsluttet behandling. Mannlige pasienter med fertile kvinnelige partnere må bruke sikker prevensjon under og i 3 måneder etter avsluttet behandling. Amming: Amming skal opphøre under og i 1 måned etter behandling. Vanlige och mindre vanlige bivirkninger: Vanlige: Febril nøytropeni, trombocytopeni, abdominal distensjon, dyspepsi, gastroøsofageal reflukssykdom, kolitt, nøytropen kolitt, stomatitt, øvre abdominalsmerter, frysninger, smerter, bronkitt, influensa, nasofaryngitt, oral herpes, pneumoni, sepsis, sinusitt, hypotensjon, epistakse, muskelkramper, muskel-skjelettsmerter i brystet, dysgeusi, angst, dehydrering, hyperglykemi, hypofosfatemi, hypokalsemi, hyponatremi, redusert vekt. Mindre vanlige: Enteritt, infusjonsrelatert reaksjon.
For mer informasjon, se felleskatalogen eller preparatomtalen (SPC) Basert på SPC godkjent av SLV/EMA: 06/2025 Innehaver av markedsføringstillatelsen: Gilead Sciences Ireland UC, Irland. For informasjon, kontakt lokal representant: Gilead Sciences Nordic, Sverige: Telefon: + 46 8 505 71 800. E-post: nordics.medinfo@gilead.com Pakninger og priser per 15.02.2022 : 1 stk. (hettegl.) kr. 12311,20 (priser og ev. refusjon oppdateres hver 14. dag). Refusjon: - Dato: 30.06.2025
Munnen er en del av kroppen. Munnhelsen påvirker den generelle helsen og omvendt. Vi lever lenger, og med aldring kommer sykdommer og behandlinger som påvirker munnhelsen og oralhelserelatert livskvalitet. Kreft og kreftbehandling kan føre til orale bivirkninger og komplikasjoner på kort og lang sikt (1-13). God munnhelse før, under og etter kreftbehandling kan forebygge og redusere risiko for orale utfordringer som i verste fall kan føre til at kreftbehandlingen må pauseres eller avsluttes (14).
Nyere kreftbehandlingsformer som målrettet terapi og immunterapi representerer utfordringer når det gjelder diagnostisering og håndtering av orale bivirkninger, og vil fremover kreve samarbeid og forskning på tvers av helsedisipliner der tannhelsepersonell bør være en integrert part (15-17).

BENTE BROKSTAD HERLOFSON
Professor, fagleder, spesialist i oral kirurgi og oral medisin
Universitetet i Oslo
Overtannlege
Tann- og kjeve, Avdeling for øre-nese-hals
Rikshospitalet, Oslo universitetssykehus

KRISTINE EIDAL TANEM
Spesialtannlege, ph.d., spesialist i oral kirurgi og oral medisin
Tann- og kjeve, Avdeling for øre-nese-hals
Rikshospitalet, Oslo universitetssykehus
TkØ – Tannhelsetjenestens kompetansesenter Øst
MUNNEN OG MUNNHELSE
Munnen er så mye mer enn tenner. Den omfatter slimhinner, tunge, smaksløker, spytt og spyttkjertler, den orale mikroflora, kjever og kjeveledd. Munnen har sentrale funksjoner knyttet til ernæring, fordøyelse, respirasjon, immunforsvar, kommunikasjon og sanseopplevelser. Den utgjør også en viktig del av individets selvbilde og livskvalitet.
MUNNHELSE OG KREFTBEHANDLING
Ubehandlede sykdommer i munnhulen kan komplisere kreftbehandling og føre til behandlingspauser eller avbrudd som igjen kan påvirke behandlingsforløpet og, i verste fall, pasientoverlevelse (18). Orale bivirkninger og komplikasjoner er hyppige følger av kreftbehandling. Munnens slimhinner blir direkte og indirekte påvirket av alle former for kreftbehandling. Klassiske cytotoksiske regimer som strålebehandling og kjemoterapi kan føre til skade på normalt vev med mukositt som den vanligste og mest ødeleggende akutte orale bivirkning. Når det gjelder målrettet terapi og immunterapi unngås DNA-skade,
men deres biologiske effekt muliggjør utvikling av en rekke slimhinneforandringer som klinisk kan likne på ikke-iatrogene patologiske tilstander. Et eksempel her er orale ulcerasjoner assosiert med mTOR-hemmere som er umulig å skille fra residiverende aftøs stomatitt (15-17). I flere norske nasjonale handlingsprogram for kreft (hode-hals-, myelomatose, de som skal behandles med allogen stamcelletransplantasjon eller høydose antiresorptiva) står det at pasientene skal gjennomgå en grundig systematisk oral undersøkelse hos tannlege før behandlingsoppstart. Dette innebærer sanering av orale infeksjonsfokus og tenner med dårlig prognose. Videre skal pasienten få informasjon om mulige orale bivirkninger, forebyggende tiltak og nødvendigheten av god munnhygiene. Den negative innvirkningen sykdom i munnhulen kan ha, gjør at egentlig alle kreftpasienter bør få undersøkt munnhelsen før behandlingsstart slik at orale utfordringer underveis minimeres (19).
Behandlende kreftteam bør være oppmerksomme på orale bivirkninger under behandlingsforløpet, og kreft-
pasienter må oppfordres til å kontakte behandlende lege eller tannlege hvis orale symptomer oppstår. Dårlig munnhelse og mangelfull håndtering av kreftpasienters munnhelse kan forlenge sykehusopphold, øke morbiditet, hindre pasienter i å motta nødvendig kreftbehandling, og i verste fall påvirke pasientoverlevelse (18).
Etter kreftbehandling anbefales tett oppfølging hos tannlege/tannpleier for å forebygge eller redusere risiko for orale seneffekter (14). Dette er spesielt viktig for pasienter som har fått strålebehandling mot hode-halsområdet der orale infeksjoner i tenner og kjever kan føre til alvorlige komplikasjoner som for eksempel osteoradionekrose (ORN) (20).
ORALE BIVIRKNINGER VED
Tabell 1 viser orale bivirkninger assosiert med forskjellige kreftbehandlingsformer. Mange av dem kan gi betyde-
lige utfordringer for pasientene og vil kreve helsepersonell med kunnskap om og kompetanse i diagnostisering og håndtering av disse. Akutte bivirkninger omfatter blant annet mukositt, trismus, transplantat-motvert-sykdom (GVHD), munntørrhet, dysfagi, endret smak- og luktesans samt økt infeksjonsrisiko (21,22, 1, 23, 5). Disse kan gi betydelige smerter som ofte krever sterke analgetika, og i mange tilfeller sondeernæring. Seneffekter (definert som bivirkninger som oppstår > 3 måneder etter behandling) inkluderer blant annet vedvarende trismus, kronisk GVHD, redusert spyttproduksjon, ulcerasjoner, økt kariesrisiko og osteoradionekrose (24, 5, 20). Støttebehandling i form av antiresorptiva gir risiko for utvikling av medikamentrelatert osteonekrose i kjeven (figur 1) (26, 27). Kreftoverlevere har dessuten økt risiko for ny primær munnhulekreft, og risikoen stiger med tiden etter endt behandling (27).
Barn er en spesielt sårbar gruppe da behandling under vekst kan forstyrre tanndannelse og kjeveutvikling. Alvorlige konsekvenser som agenesi og kraniofaciale vekstforstyrrelser er dokumentert, og foresatte bør informeres tidlig for å sikre tett oppfølging (3, 7).
SPØR PASIENTENE
OM MUNNHELSE FØR
BEHANDLING
Behandlende lege anbefales før behandlingsstart å danne seg et bilde av pasientens munnhelse.
Disse fem spørsmålene kan bidra til dette:
• Har du en fast tannlege/tannpleier?
• Går du jevnlig til tannlege/ tannpleier?
• Når var du sist hos tannlege/ tannpleier?
• Har du problemer med tenner, kjever eller munnhule for øvrig?
Kreftbehandling
Kirurgi – hode-halskreft -
Eksempler på type medikamenter
Strålebehandling – hode-halskreft -
Taxan-baserte (docetaksel, paclitaksel)
Alkylerende (cyklofosfamid)
Kjemoterapi (cellegift)
Antimetabolitter (fluorouracil, metotreksat, kapecitabin)
Antrasyklin-baserte (doksorubicin, daunorubicin)
Platinum-baserte (cisplatin, karboplatin)
Allogen stamcelletransplantasjon -
Hormonbehandling
Målrettet terapi
Immunterapi
Støttebehandling –samtidig behandling med antiresorptiva
1ORN- osteoradionekrose
Antiøstrogener (tamoksifen), aromatasehemmere (anastrozol, eksemestan), antiandrogener (bikalutamid, leuprorelin)
Tyrosinkinasehemmere (imatinib, dabrafenib, enkorafenib)
Monoklonale antistoffer (trastuzumab, rituksimab, bevacizumab, cetuksimab), EGFR-hemmere (erlotinib)
Sjekkpunkthemmere (nivolumab, pembrolizumab), ipilimumab, atezolizumab, durvalumab, avelumab) bispesifikke antistoffer (teklistamab, blinatumomab, talkvetamab)
Cellulær immunterapi (CAR-T)
Orale bivirkninger assosiert med kreftbehandling
Tannlegetilsyn før oppstart?
Funksjonelle, estetiske og psykologiske utfordringer, tap av tenner og kjeveben Ja
Mukositt, munntørrhet, spyttkjerteldysfunksjon, karies, smaksforandringer, infeksjoner, trismus, smerter, svelgproblemer, periodontal sykdom, ORN1 i kjeven, dentale og skeletale utviklingsforstyrrelser (barn og unge) Ja
Mukositt, stomatitt, munntørrhet, spyttkjerteldysfunksjon, karies, smaksforandringer, infeksjoner, reaktivering av herpes simplex-virus, gingivale blødninger, ulcerasjoner, dentale utviklingsforstyrrelser (barn og unge)
Ved høy dose / intensiv behandling
Oral GVHD2 , infeksjoner, ulcerasjoner, munntørrhet, spyttkjerteldysfunksjon, smaksforandringer Ja
Munntørrhet, BMS3
Mukositt, infeksjoner, munntørrhet, ulcerasjoner, lichenoide reak sjoner, hyperkeratotiske forandringer, munntørrhet, spyttkjerteldysfunksjon, gingivale blødninger, hyperpigmentering, geografisk tunge, MRONJ4
Mukositt/stomatitt, smerter, smaksforandringer, munntørrhet, spyttkjerteldysfunksjon, svelgproblemer, oral lichen planus/oral lichenoid reaksjon, pemfigoid-liknende sykdom, erytema multiforme, brennende følelse i slimhinner
Hvis det samtidig skal igangsettes antiresorptiv behandling
Hvis det samtidig skal igangsettes antiresorptiv behandling
Henvise til tannlege ved orale bivirkninger
Zoledronsyre, denosumab MRONJ4 Ja
2GVHD - transplantat-mot-vert sykdom (graft-versus-host disease)
3BMS - brennende munn-syndrom
4MRONJ - medikamentrelatert osteonekrose i kjeven
Slik kan legen fange opp sårbare pasienter som faller utenfor tannhelsetjenesten og bidra til hjelp for plager og smerter i munnen. Etter avsluttet kreftbehandling bør pasienter raskt følges opp hos tannlege/tannpleier for å etablere en referansestatus. Kommunikasjon mellom tannhelsetjenesten og helsetjenesten for øvrig er så å si fraværende og dette skaper risiko for feilbehandling. Manglende informasjon om for eksempel strålefelt eller bruk av benmodulerende medikamenter kan gi alvorlige konsekvenser som osteonekrose i kjeven selv ved enklere tannbehandling. Et strukturert og forbedret samarbeid mellom helseinstanser er nødvendig for å forebygge alvorlige komplikasjoner.
MUNNHELSE ETTER KREFTBEHANDLING
Tannhelsetjenesten i Norge er delt mellom privat og offentlig sektor, og kreftoverlevere har per i dag ikke et enhetlig oppfølgingstilbud. Dette gjør mange pasienter ansvarlige for selv å oppsøke tannlege/tannpleier og må dekke mesteparten av kostnadene selv, noe som øker risikoen for manglende oppfølging blant sårbare grupper.
Det er et økende fokus på forskning om orale komplikasjoner og bivirkninger på kort og lang sikt ved kreftbehandling. Det er svært viktig at munnhelse adresseres ved implementering av nye behandlingsmodaliteter slik som målrettet terapi, immunterapi og protonstråling. Fremtidige tverrfaglige forskningsprosjekter på bivirkninger etter kreftbehandling bør inkludere studier på orale og dentale
seneffekter for å øke kunnskapen og skape mer bevissthet, særlig når det gjelder utsatte pasientgrupper.
Det er behov for bedre og mer forutsigbar dialog mellom behandlende kreftteam og tannhelsetjenesten, ikke bare før kreftbehandling, men også under pasientforløpet. Økt kunnskap hos pasienter, leger og tannhelsepersonell om hvordan kreftbehandling kan påvirke munnhelsen vil være med på å forebygge og redusere risiko for bivirkninger og komplikasjoner i munnhulen på kort og lang sikt. Det bør etableres nasjonale evidensbaserte retningslinjer for hvordan munnhelse bør ivaretas før, under og etter kreftbehandling. Dette krever samarbeid på tvers av fag, disipliner, kommune, spesialisthelsetjeneste og tannhelsetjeneste. Inntil disse foreligger er det viktig at alle kreftpasienter oppfordres til å ha jevnlig kontakt med tannlege/tannpleier som kan bidra til god munnhelse hos pasientene gjennom livet med eller etter kreft.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no
Pamorelin «triptorelin» pulver og væske til depotinjeksjonsvæske, suspensjon. Reseptgruppe C
Indikasjoner: Alle styrker: Behandling av lokalavansert eller metastaserende, hormonavhengig prostatacancer. Behandling av høyrisiko lokalisert eller lokalavansert, hormonavhengig prostatacancer, i kombinasjon med strålebehandling. 3,75 mg: Adjuvant behandling i kombinasjon med tamoksifen eller en aromatasehemmer ved hormonreseptorpositiv brystkreft i tidlig stadium hos kvinner med høy risiko for tilbakefall, som er bekreftet premenopausale etter fullført kjemoterapi. 22,5 mg: Behandling av sentral pubertas precox (SPP) hos barn ≥2 år med inntreff av SPP før 8 år hos jenter og før 10 år hos gutter.
Anbefalt dosering: Prostatacancer: 1 hetteglass à 3,75 mg 1 gang hver 4. uke, 1 hetteglass à 11,25 mg hver 3. mnd. eller 1 hetteglass à 22,5 mg hver 6. mnd. Anbefalt varighet er 2-3 år. Brystkreft: 1 hetteglass à 3,75 mg 1 gang hver 4. uke som i.m. injeksjon i kombinasjon med tamoksifen eller en aromatasehemmer etter fullført kjemoterapi og bekreftet premenopausalstatus og minst 6-8 uker før start med aromatasehemmer. Anbefalt behandlingsvarighet er opptil 5 år. Pubertas precox (<8 år hos jenter og <10 år hos gutter): 1 hetteglass à 22,5 mg hver 6. mnd. som én i.m. injeksjon. Behandling avbrytes ved pubertetsalder hos gutter og jenter, og ved benmodning (jenter: >12-13 år, gutter: >13-14 år).
Kontraindikasjoner: Alle styrker: Overfølsomhet for GnRH, dets analoger eller for innholdsstoffene. Graviditet og amming. 3,75 mg: Premenopausal brystkreft: Oppstart av aromatasehemmer før adekvat ovariesuppresjon med triptorelin er oppnådd.
Forsiktighetsregler: Kan gi nedsatt benmineraltetthet. Samtidig bruk av bisfosfonat kan redusere benmineraltap. Utvis ekstra forsiktighet ved tilleggsrisiko for osteoporose. Behandling kan avdekke ukjente gonadotrope hypofyseadenomer. Økt risiko for depressive episoder (inkl. alvorlige). Krampeanfall er sett ved bruk av GnRH-analoger, spesielt hos kvinner og barn. Enkelte hadde risikofaktorer for anfall (som historikk med epilepsi, intrakraniale svulster eller samtidig bruk av legemidler som øker anfallsrisikoen), men det er også sett uten slike risikofaktorer. Prostatacancer: Gir forbigående økt serumtestosteron, og kan gi forbigående symptomforverring med økte urineringssymptomer og forbigående økt metastatisk smerte. Forverring av ryggmargskompresjon og urinveisobstruksjon kan oppstå. Langtidsbruk kan føre til osteoporose og økt risiko for benbrudd, som kan gi ukorrekt diagnose av benmetastaser. Kan forlenge QT-intervallet. Nytte-/risiko, inkl. risiko for torsades de pointes, bør vurderes. Metabolske endringer eller økt kardiovaskulær sykdomsrisiko kan oppstå. Gir suppresjon av hypofyse-gonadesystemet som ofte normaliseres etter behandlingsstopp. Pga. androgen deprivasjon kan behandling med GnRH-analoger øke risikoen for anemi. Denne risikoen bør vurderes og overvåkes på hensiktsmessig måte. Økt lymfocyttall er sett. Brystkreft hos kvinner: Kan gi en reduksjon i benmineraltetthet. Nytte må oppveie risiko. Ovariesuppresjon må oppnås før start med aromatasehemmer. Høy osteoporoserisiko ved Triptorelin med tamoksifen eller aromatasehemmer. Benmineraltetthet evalueres før oppstart. Nytte-/risikovurdering ved HR+ brystkreft i tidlig stadium ved triptorelin med tamoksifen eller aromatasehemmer. Risiko for muskelskjelettlidelser ved triptorelin med aromatasehemmer eller tamoksifen. Risiko for diabetes ved triptorelin med eksemestan eller tamoksifen. Depresjon er sett ved triptorelin med tamoksifen eller eksemestan. Sentral pubertas precox hos barn: Nytte/risikovurdering ved progressive hjernetumorer. Perifer pubertas precox og gonadotropinuavhengig pubertas precox bør utelukkes. 1. måneds vaginalblødning er sett. Behandlingen er langvarig og justeres individuelt. Epiphysiolysis capitis femoris kan sees etter avsluttet behandling. Idiopatisk intrakraniell hypertensjon (pseudotumor cerebri/IIH): Er sett hos barn. Pasienter bør advares om tegn og symptomer på IIH, inkl. alvorlig eller tilbakevendende hodepine, synsforstyrrelser og tinnitus. Seponering bør vurderes ved IIH.
Interaksjoner: Antikoagulantiabehandling, legemidler som påvirker hypofyseutskillelsen av gonadotropiner og legemidler som forlenger QT-intervallet eller som kan indusere torsades de pointes.
Graviditet, amm ing og fertilitet: Skal ikke brukes ved graviditet og amming.
Bivirkninger: Prostatacancer: Svært vanlige: Hetetokter, hyperhidrose, erektil dysfunksjon, ryggsmerter, parestesi i nedre lemmer, nedsatt libido, asteni. Vanlige: Munntørrhet, kvalme, hypertensjon, overfølsomhet, bekkensmerter, muskelskjelettsmerter, smerte i ekstremitet, svimmelhet, hodepine, tap av libido, depresjon, humørforandringer, vektøkning, reaksjon på injeksjonsstedet (inkl. erytem, betennelse og smerte), ødem. Andre: Anafylaktisk reaksjon.
Kvinner ved ulike triptorelinformuleringer og andre indikasjoner enn brystkreft, og klasseeffekt av GnRH-agonister: Svært vanlige/vanlige: Hetetokter, akne, hyperhidrose, seborré, brystlidelse, dyspareuni, genital blødning, ovarial hyperstimuleringssyndrom, ovarial hypertrofi, bekkensmerter, vaginal tørrhet, hodepine, søvnforstyrrelse, humørforstyrrelser, redusert libido, asteni, kvalme, magesmerte, magebesvær, overfølsomhet, brystsmerter, artralgi, muskelspasme, smerte i ekstremitet, svimmelhet. depresjon, nervøsitet, vektøkning, reaksjon ved injeksjonsstedet, perifert ødem. Andre: Anafylaktisk sjokk. Brystkreft (kombinasjonsbehandling): I tillegg til bivirkninger hos menn og kvinner nevnt ovenfor. Svært vanlige/vanlige: Kvalme, hetetokter, hypertensjon, hyperhidrose, dyspareuni, vaginal tørrhet, muskuloskeletale forstyrrelser, osteoporose, urininkontinens, insomni, redusert libido, depresjon, fatigue, diabetes mellitus, hyperglykemi, overfølsomhet, embolisme, benbrudd, reaksjon ved injeksjonsstedet. Andre: Myokardial iskemi, cerebral iskemi, CNS-blødning.
Sentral pubertas precox: Svært vanlige/vanlige: Vaginal blødning, abdominalsmerte, hetetokter, akne, overfølsomhet, hodepine, vektøkning, reaksjon på injeksjonsstedet. Andre: Nedsatt syn, anafylaktisk sjokk, idiopatisk intrakraniell hypertensjon. For mer informasjon, se felleskatalogen eller preparatomtalen (SPC)
Basert på SPC godkjent av DMP/EMA: 3,75 mg og 22,5 mg: 16.01.2025. 11,25 mg: 04.04.2025. Innehaver av markedsføringstillatelsen: Institut Produits Synthèse (IPSEN) AB.
Kontakt: Telefon: +46 8 451 60 00. E-post: info.se@ipsen.com
Pakninger og priser per 12.05.2025: 3,75 mg: 1 sett kr 1190,10. 11,25 mg: 1 sett kr 2977,70. 22,5 mg: 1 sett kr 5759,70. 1 sett = hettegl. + amp.
Refusjon: Kan forskrives på blå resept: Refusjonsberettiget bruk: Behandling av lokalavansert eller metastaserende, hormonavhengig prostatacancer. ICPC: Y77: Ondartet svulst prostata. ICD-10: C61 Ondartet svulst i blærehalskjertel. Behandlingen skal være instituert i sykehus, sykehuspoliklinikk eller av spesialist i vedkommende disiplin. Dato: 12.05.2025.
TRI-NO-000091 / 2025
< 0,35 nmol/L hos over 96 % av mennene, noe som er assosiert med forbedret totaloverlevelse*1




















Til behandling av lokalt avansert eller metastaserende, hormonavhengig prostatakreft

Dette bygger på post-hoc-analyser, der data ble samlet fra tre prospektive fase III-studier med 9–12 måneders monoterapi med triptorelin hos pasienter med fremskreden prostatakreft.
Hensikten med analysen var å vurdere om lav nadir-testosteron under behandling med triptorelinpamoat, en luteiniserende hormonfrigjørende hormon (LHRH)-agonist, er assosiert med bedre klinisk utfall hos pasienter med fremskreden prostatakreft, basert på en retrospektiv analyse av kliniske studiedata.
* Triptorelinpamoat 3,75 mg IM (ITT, n = 301), triptorelinpamoat 11,25 mg IM (ITT, n = 171), triptorelinpamoat 22,5 mg IM (ITT, n = 120).
1. Klotz L. et al. BJUI Compass. 2024; Volume 5, issue 3, 392-402, https://doi.org/10.1002/bco2.318.
Institut Produits Synthèse (IPSEN) AB, Färögatan 33, SE-164 51 Kista, Sweden
TRI-NO-000091 / 2025 10











HANNE TØNDEL
Onkolog
St. Olavs hospital

INGVILD SKØLT
Alder: 34 år
Familie: Gift med lege og
bassist i Finnmarksbandet
Moillrock, ei jente på 5 år og to gutter på 2 år
Bosted: Honningsvåg, opprinnelig fra Hemsedal
Studert: i Oslo, ferdig 2018
Turnustid: Mosjøen sykehus og Honningsvåg kommune
Jobber nå: som fastlege i Honningsvåg
Aktuell med: boka «Du vil kjenne eit lite stikk», utgitt februar 2025
FRA BAKSIDEN AV BOKA:
«Eigentleg har alt gått på skinner for Hanne så langt i livet. Dei gode karakterane frå vidaregåande har ho veksla inn i seks år på medisinstudiet. Ho har lyse utsikter, gode intensjonar og altfor stor kvit frakk, men det viser seg å vere langt frå lesesal til akuttmottak. Det kan umogleg halde i lengda.
Det er ikkje noko som er meir vaksent enn å vere doktor på ordentleg. På gode dagar reddar ein liv, men døden kjem vel så ofte. Hanne prøver hardt å vere flink lege, medan ho manøvrerer mellom trøytte bakvakter, rasande pårørande og ei overhengande frykt for å gjere feil. Så skjer det som ikkje skal skje. Hanne si verd ramlar saman, og ho byrjar å tvile på sin eigen verdi både med og utan stetoskopet kring halsen.
Du vil kjenne eit lite stikk er ei forteljing om skuld, straff og forsoning - og om å møte den rette i livet».
Etter å ha vært innom opptil flere bokhandlere i Trondheim på jakt etter Ingvild Skølts debutroman, har jeg endelig fått tak i den. Nå er jeg klar for en uke med rolig strandliv og god tid til å lese. Boka «Du vil kjenne eit lite stikk» ble utgitt i februar i år og gikk rett inn på tredjeplass på de offisielle bestselgerlistene, kun slått av Jo Nesbø og Jojo Moyes, og jeg har gledet meg til å lese den.
Boka treffer meg med en gang. Ikke bare heter hovedpersonen Hanne, men hun, som meg, setter seg på sjefens stol første dag. Hun får samtidig vaktcallingen hvor test av alarmen går og hun tror det er stansalarm på ekte. Det er ukjente koder, både sosiale og medisinske, som man ikke behersker,
og mens jeg leser kjenner jeg at ikke bare sola, men også skamfølelsen man opplevde som fersk lege plutselig er tilbake og brenner i kinnene.
– Det er veldig fint å høre at jeg treffer lesere så godt. «Har du vært på mitt sykehus?» har mange spurt, men Granmo sykehus, der Hanne er LIS1, er et fiktivt sted. Det er stort spenn i både alder, geografi og typer av leger som har gitt tilbakemelding om at de kjenner seg godt igjen i boka og det forteller meg at mange opplever turnustiden som ganske kjip til tider. Under skriveprosessen har jeg hatt to redaktører som innimellom har spurt: Er det virkelig så drøyt på sykehuset? Jeg har nok vært den strengeste selv for at boka ikke skal bli karikert. Det har vært viktig for meg

at helsepersonell kan kjenne seg igjen og at boka fremstår realistisk.
Jeg leser videre. Det er fine og morsomme skildringer av dagliglivet som LIS1. Små finurligheter som å forberede seg til rapport på morgenmøte for bare å bli avfeid med at det ikke er så viktig å rapportere («Det er bare å gå videre. Dette er ingenting å bry seg om, bare funksjonelle greier. Pasienten skal hjem i dag.»), stressende møter med sinte pårørende som truer med avisoppslag og nære pasientmøter med alvorlig syke mennesker.
Ekstra sårt er det å lese kapitlene som omhandler det katastrofale som skjer på Hannes vakt. Innimellom må
jeg legge bort boka og puste litt. Jeg har skjønt at dette blir en slags indre debrifing av min egen turnustid, cirka 25 år etter at den ble gjennomført.
– Hvis denne boka kan være med på å gjøre slik at en LIS1 som sitter alene et sted kan føle seg litt mindre ensom og forlatt, så har den hatt en verdi. Når det skjer alvorlige feil i helsevesenet, stilles det ofte spørsmål om hvem sin feil det er. Ofte er det noe som kunne vært endret, men det kan også være en rekke av tilfeldigheter som fører til at det skjer noe katastrofalt. I denne boka legger Hanne all skyld på seg selv, og systemet rundt henne gir henne ikke den hjelpen hun kunne ha trengt.
Jeg tenker tilbake på min egen tid som turnuslege og den tøffeste opplevelsen jeg hadde i løpet av denne perioden. Ingen formelle feil ble begått, men et ungt liv gikk tapt og det var skjellsettende for oss som var involvert i hendelsen. Som i de fleste situasjoner kunne nok utfallet også vært annerledes dersom dette ble håndtert på en annen måte. Jeg ble heldigvis godt ivaretatt av mine turnuslege-kolleger. Ingen overordnede leger eller ledere snakket med meg om hendelsen. Var det fordi ingen formelle feil hadde skjedd og at man derfor tenkte at det ikke var et behov for en debrifing rundt dette?
«Eg ønskjer å vise fram eit meir realistisk og oppdatert bilete av legen, og kva som skjer når medisinsk usikkerheit glir over i destruktiv utryggheit. Eg har forsøkt å setje ord på den sårbarheita som så mange skjuler og skammar seg over»
Hva ville gjort LIS1-tiden bedre for Hanne etter din mening?
– Jeg håper at både unge leger og folk som jobber med organisering av norske sykehus leser denne boka. Det er mer regelen enn unntaket at unge leger opplever LIS1-tiden som ordentlig kjip i perioder og at dette går utover livskvaliteten deres. Men så går det som oftest bra til slutt og man kommer styrket ut i den andre enden.

Omslagsdesign: Rune Mortensen
Systemet rundt leger er ofte for dårlig rigget og enkle grep kunne gjort dette bedre. Omvisning og god mottakelse av nye ansatte, gode rutiner for debriefing ved alvorlige hendelser, veiledning og oppfølging av LIS er strukturelle grep som kunne bedret tilværelsen. Selv har jeg opplevd veiledningsgruppene under spesialisering i allmennmedisin som helt essensielle i min legejobb. Og så må vi bli flinkere til å prate om de vonde situasjonene som skjer, både uformelt og mer satt i system som nevnt. Alle kan gå i seg selv og tenke at man kan være en god kollega og støtte nye LIS. Jeg har selv erfaring med at en bakvakt ringte meg privat i min LIS1-tjeneste etter en hendelse på jobb for å si at dette var greit og ingen alvorlig feil. Dette gjorde at helgen min ble helt annerledes.
Boka krydres av en nydelig kjærlighetshistorie underveis hvor Hanne møter Kim og etter hvert skjønner at han er den rette.
– Kjærlighetshistorien er nok den som har endret seg mest underveis i
denne skriveprosessen. Kim blir redningen for Hanne og er med på å understreke hvor viktig det er å ha flere bein å stå på i livet. Om det så er kor, løping eller andre hobbyer.
Har du andre bokprosjekter på gang?
– Det har tatt fem år, tre barn og minst sju ulike bostedsadresser å skrive denne boka. Per nå har jeg ikke noen nye bokprosjekter på gang, men jeg har lyst til å skrive mer.
Jeg er ved bokas slutt. Når jeg tenker tilbake på min egen tid som turnuslege er det aller mest gode minner og fine opplevelser. Jeg fikk flere venner for livet, jeg møtte min mann og jeg lærte fort hvor viktig det var å holde seg inne med de flinke sykepleierne. Det ble starten på en lang legekarriere og en periode med bratt læringskurve som jeg aldri ville vært foruten.
Boka anbefales på det varmeste. Jeg har allerede spurt Ingvild om å få bruke sitater fra boka i neste undervisning som jeg skal holde for LIS1 ved St. Olavs hospital med tema kommunikasjon. Den burde absolutt vært en del av deres pensum.
For behandling av nmCRPC og mHSPC

NUBEQA har vist både effekt og tolerabilitet i kliniske studier1-4
I ARANOTE viser NUBEQA + ADT en signifikant forbedring av rPFS med en 46% reduksjon i risiko for progresjon eller død, samt færre behandlingsavbrudd sammenlignet med placebo + ADT ved mHSPC (6,1% vs 9,0%)*4

Sikkerhetsinformasjon1
• Overvåk nøye for bivirkninger hos pasienter med alvorlig nedsatt nyre- eller leverfunksjon.
• Seponer Nubeqa permanent ved unormale leverfunksjonsprøver som tyder på idiosynkratisk legemiddelindusert leverskade.
• Sikkerhet ved kardiovaskulær sykdom siste 6 månedene er ikke fastslått; behandle klinisk signifikante tilfeller iht. retningslinjer, og vurder nytte-/risikoforhold ved QT-forlengelse før oppstart med Nubeqa.
• Svært vanlige bivirkninger (≥10 %): nmCRPC og mHSPC behandlet med darolutamid: fatigue/astenitilstander, redusert antall nøytrofile, økt bilirubin, økt ALAT og ASAT.
mHSPC behandlet med darolutamid og docetaksel: hypertensjon, utslett, redusert antall nøytrofile, økt bilirubin, økt ALAT og ASAT.
• Vanlige bivirkninger (≥1/100, <1/10): nmCRPC og mHSPC behandlet med darolutamid: iskemisk hjertesykdom, hjertesvikt, utslett, smerter i ekstremiteter, frakturer.
mHSPC behandlet med darolutamid og docetaksel: frakturer, gynekomasti
Se felleskatalogtekst for mer informasjon, merk spesielt kontraindikasjoner, forsiktighetsregler, interaksjoner og bivirkninger. Basert på SPC: 07/2025.
ARi, androgenreseptorinhibitor; mHSPC, metastatisk hormonsensitiv prostatakreft; nmCRPC, ikke-metastatisk kastrasjonsresistent prostatakreft; ADT, androgen deprivasjonsbehandling; rPFS, radiologisk progresjonsfri overlevelse
* ARANOTE-studien: Menn med metastatisk hormonsensitiv prostatakreft (mHSPC) ble behandlet med NUBEQA + ADT (n=446) sammenlignet med placebo + ADT (n=223). Det primære effektmålet var radiologisk progresjonsfri overlevelse (rPFS). Antall pasienter med hendelser var 128 av 446 (28,7%) i NUBEQA-gruppen og 94 av 223 (42,2%) i placebogruppen. Median rPFS var NE for NUBEQA sammenlignet med 25,0 måneder for placebo + ADT (HR: 0,54; 95% CI: 0,41-0,71; p<0,0001). 27 av 445 (6,1%) av pasientene i darolutamidarmen avsluttet behandling pga behandlingsrelaterte bivirkninger mot 20 av 221 (9,0%) i placeboarmen.
Referanse: 1. NUBEQA SPC 07/2025, 2. Smith MR, Hussain M, Saad F, et al. ARASENS Trial Investigators. Darolutamide and survival in metastatic, hormone-sensitive prostate cancer. N Engl J Med. 2022;386(12):1132-1142. 3. Fizazi K, Shore N, Tammela TL, et al. Nonmetastatic, castration-resistant prostate cancer and survival with darolutamide. N Engl J Med. 2020;383(11):1040-1049. 4. Saad F, Vjaters E, Shore N, et al. Darolutamide in combination with androgen-deprivation therapy in patients with metastatic hormone-sensitive prostate cancer from the phase III ARANOTE trial.J Clin Oncol. 2024;42(36):4271-4281.
NUBEQA® (darolutamid) 300 mg filmdrasjerte tabletter. ATC-nr: L02B B06.
Indikasjoner: Nubeqa er en androgenreseptorhemmer indisert til behandling av voksne menn med: 1. ikke-metastatisk kastrasjonsresistent prostatakreft (nmCRPC) som har høy risiko for å utvikle metastatisk sykdom; 2. metastatisk hormonsensitiv prostatakreft (mHSPC) i kombinasjon med androgen deprivasjonsbehandling; 3. metastatisk hormonsensitiv prostatakreft (mHSPC) i kombinasjon med docetaksel og androgen deprivasjonsbehandling (ADT). Dosering: Anbefalt dose er 600 mg (2 tabletter à 300 mg) 2 ganger daglig, tilsv. total daglig dose 1200 mg. Medisinsk kastrasjon med GnRHanalog skal fortsette under behandling hos pasienter som ikke er kirurgisk kastrert. Kontraindikasjoner: Overfølsomhet for virkestoffet eller noen av hjelpestoffene (laktose). Kvinner som er eller kan bli gravide. Forsiktighetsregler: Lever/nyre: Pasienter med alvorlig nedsatt nyrefunksjon eller moderat/alvorlig nedsatt leverfunksjon skal overvåkes nøye mht. bivirkninger pga. forhøyet eksponering. Tilgjengelige data for pasienter
Refusjon Nubeqa, LIS anbud 2507 Onkologi: H-resept nmCRPC: Førstevalg til pasienter som har høy risiko for å utvikle metastatisk sykdom. mHSPC som ikke er aktuelle for kjemoterapi: Andrevalg, i kombinasjon med ADT. mHSPC, trippelbehandling, uegnet for abirateron: I kombinasjon med docetaksel og ADT. Vilkår: Gjelder pasienter med komorbiditet som dårlig regulert eller ukontrollert diabetes, vanskelig regulerbar hypertensjon eller levertoksisitet under abirateronbehandling.
PP-NUB-NO-0287-1, 10.2025
med alvorlig nedsatt nyrefunksjon samt pasienter med moderat svekket leverfunksjon er begrenset. Darolutamid er ikke undersøkt hos pasienter med alvorlig svekket leverfunksjon. Behandlingen med darolutamid skal seponeres permanent ved unormale resultater av leverfunksjonsprøver som tyder på idiosynkratisk legemiddelindusert leverskade. Hjerte/ kar: Sikkerhet er ikke fastslått ved kardiovaskulær sykdom de siste 6 månedene. Ved forskrivning skal pasienter med klinisk signifikant kardiovaskulær sykdom behandles for disse tilstandene iht. fastsatte retningslinjer. Ved risikofaktorer for QT-forlengelse i anamnesen og ved samtidig bruk av legemidler som kan forlenge QT-intervallet, skal nytte-/risikoforholdet vurderes, inkl. potensialet for torsades de pointes, før oppstart med darolutamid. Bruk av sterke CYP3A4- og P-gp-induktorer ved behandling med darolutamid kan redusere plasmakonsentrasjonen av darolutamid og anbefales ikke med mindre det ikke finnes andre behandlingsalternativer. Bruk av et annet legemiddel med mindre potensial for induksjon av CYP3A4 eller P-gp, skal vurderes ved samtidig administrering. Pasienter skal overvåkes med hensyn til bivirkninger av BCRP-, OATP1B1- og OATP1B3substrater, fordi samtidig administrering av darolutamid kan øke plasmakonsentrasjonen av disse substratene. Samtidig administrering av rosuvastatin bør unngås, med mindre det ikke finnes andre behandlingsalternativer. Bivirkninger: 1 og 2. Hos pasienter med nmCRPC og mHSPC behandlet med darolutamid: Svært vanlige (≥ 1/10): fatigue/ astenitilstander, redusert antall nøytrofile, økt bilirubin, ALAT og ASAT. Vanlige (≥ 1/100, < 1/10): iskemisk hjertesykdom og hjertesvikt, utslett, smerter i ekstremiteter samt frakturer. 3. Hos pasienter med mHSPC behandlet med darolutamid i kombinasjon med docetaksel: Svært vanlige (≥ 1/10): hypertensjon, utslett, redusert antall nøytrofile, økt bilirubin, ALAT og ASAT. Vanlige (≥ 1/100, < 1/10): frakturer, gynekomasti. Basert på SPC godkjent av DMP/EMA: 07/2025. Konsulter preparatomtalen (SPC) for mer informasjon. Pakninger og priser: 112 stk. (blister), AUP 46.636,30 NOK, Varenr: 063426. R.gr. C, H-resept. Se felleskatalogtekst for mer informasjon: www.felleskatalogen.no. Kontaktinformasjon: Bayer AS, Drammensveien 288, NO-0283 OSLO, Postboks 193, 1325 Lysaker. Tlf: +47 23 13 05 00, Faks: +47 23 13 05 01, www.bayer.no
MA-NUB-NO-0005-7, 08.2025

Interessen min for legeyrket springer ut fra et sterkt ønske om å hjelpe andre mennesker. I juli 2023
fullførte jeg medisinstudiet ved UiT – Norges arktiske universitet og på høsten fikk jeg muligheten til å starte i LIS1-tjeneste ved Universitetssykehuset Nord-Norge (UNN) i Tromsø.

INGVILD MYRNES
LIS3
Kreftavdelingen, Universitetssykehuset Nord-Norge, Tromsø
Da jeg startet som LIS1 hadde kreftavdelingen nylig opprettet en rullering i tredelt LIS1tjeneste der, og jeg ble første LIS1 som fikk tilbringe fire måneder på avdelingen. Møtet med pasientene var svært givende, og jeg ble raskt tatt imot av et arbeidsmiljø med stor takhøyde og varme kolleger. Gjennom vaktarbeid som ansvarlig lege på sengeposten og for øyeblikkelig hjelp-pasienter som kom inn på natt fikk jeg tidlig muligheten til å jobbe selvstendig. Samtidig var terskelen lav for å kontakte bakvakt for veiledning og støtte. Dette bidro til at jeg raskt følte meg tryggere i beslutningsprosesser og i legerollen, samtidig som det ga rom for faglig refleksjon sammen med mer erfarne kolleger.
Allerede under medisinstudiet ble min interesse for onkologien vekket –spesielt gjennom det såkalte ”kreftkurset” på siste studieår, som kombinerer teoretisk undervisning med praktisk klinisk læring. Flere av foreleserne der er i dag mine kolleger. I tillegg var min mentor under studietiden en engasjerende onkolog som også jobber ved avdelingen. I LIS1 var det inspirerende å arbeide i et kollegium som kombinerer høy faglig kompetanse med medmenneskelighet og omsorg. Kombinasjonen av disse erfaringene og tjenesteperioden under LIS1 gjorde
at jeg ønsket å gå videre med spesialisering i onkologi ved kreftavdelingen i Tromsø.
Arbeidshverdagen som LIS3 er variert og meningsfull, og preges av både poliklinikk og sengepost. Jeg har opplevd et tett og godt samarbeid mellom ulike faggrupper, noe som bidrar til helhetlig pasientbehandling og gir rom for støtte og kompetansedeling på tvers av disipliner. Det er krevende og emosjonelt utfordrende å møte alvorlig sykdom hver dag, men samtidig også fint og svært meningsfullt å få være til stede for pasienter og pårørende i kanskje deres livs største krise.
Kreftavdelingen fortsetter med LIS1 i rullering, og mitt inntrykk er at de som har rullert til avdelingen har vært svært fornøyde. Det blir spennende å se om også de blir onkologer.
Jeg ser frem til å utvikle meg videre som lege ved kreftavdelingen i Tromsø – i et fagfelt og et arbeidsmiljø som både utfordrer og inspirerer meg hver eneste dag. Erfaringen som LIS1 ga meg et klart bilde av hva pasientnær kreftomsorg innebærer, og ga meg innsikt og trygghet i valget om å fortsette i LIS3.
LYNPARZA ER INNFØRT AV
BESLUTNINGSFORUM FOR BEGGE mCRPC-INDIKASJONENE1

Lynparza
Lynparzas indikasjoner innen prostatakreft:
• Som monoterapi til behandling av voksne med metastatisk kastrasjonsresistent prostatakreft (mCRPC) og BRCA1/2 mutasjoner (kimbane og/eller somatiske) som har progrediert etter tidligere behandling som inkluderte et nytt hormonlegemiddel.2
• I kombinasjon med abirateron og prednison eller prednisolon til behandling av voksne pasienter med mCRPC, der kjemoterapi ikke er klinisk indisert.2
VIKTIGE BIVIRKNINGER: De hyppigste observerte bivirkningene på tvers av kliniske studier hos pasienter som fikk Lynparza som monoterapi (≥ 10 %) var kvalme, oppkast, diaré, dyspepsi, fatigue/asteni, hodepine, dysgeusi, nedsatt appetitt, svimmelhet, hoste, dyspné, anemi, nøytropeni, og leukocytopeni. Bivirkninger førte til doseavbrudd og/ eller dosereduksjon hos 50,7% av pasientene ved bruk i kombinasjon med abirateron. Bivirkningene som oftest førte til doseavbrudd og/eller dosereduksjon, var anemi (17,1%), fatigue/asteni (5,5%), kvalme (4,1%) og nøytropeni (3,4%).
*og prednison/prednisolon
Skann QR-koden for å lære mer om Lynparza
BRCAm=BRCA-mutated mCRPC=metastatic castration-resistant prostate cancer rPFS=radiographic progression-free survival NR=not reached.
LYNPARZA®(olaparib) VIKTIG INFORMASJON
VIRKESTOFF: LYNPARZA®(olaparib) er en potent hemmer av humane poly (ADP-ribose) polymerase (PARP-1, PARP-2 og PARP-3)- enzymer. Hemmer veksten av selekterte tumorcellelinjer in vitro og tumorvekst in vivo, enten som eneste behandling eller i kombinasjon med etablerte kjemoterapier. Prostatakreft: Som monoterapi til behandling av voksne med metastatisk kastrasjonsresistent prostatakreft (mCRPC) og BRCA1/2 mutasjoner (kimbane og/eller somatiske) som har progrediert etter tidligere behandling som inkluderte et nytt hormonlegemiddel. I kombinasjon med abirateron og prednison eller prednisolon til behandling av voksne pasienter med mCRPC, der kjemoterapi ikke er klinisk indisert (se pkt 5.1 i SPC).
DOSERING OG ADMINISTRASJONSMÅTE
Behandling med Lynparza bør initieres og overvåkes av lege med erfaring i bruk av legemidler til kreftbehandling.
Dosering: Lynparza er tilgjengelig som tabletter à 100 mg og 150 mg. Anbefalt dose av Lynparza som monoterapi eller i kombinasjon med med abirateron og prednison eller prednisolon for prostatakreft eller med endokrin behandling er 300 mg (to tabletter à 150 mg) som skal tas to ganger daglig, tilsvarende en daglig dose på totalt 600 mg. Tablett à 100 mg er tilgjengelig for dosereduksjon. Hvis teksten/saken omhandler kombinasjonsbehandling så skal det legges til doseringsinformasjon om det aktuelle kombinasjonspreparatet: Lynparza i kombinasjon med endokrin behandling: Behandling med gonadotropinfrigjørende hormon (GnRH)-analog skal fortsettes under behandling av alle pasienter, eller pasientene skal ha gjennomgått bilateral orkiektomi før behandlingen. Se den fullstendige produktinformasjonen for legemidler som brukes til endokrin behandling i kombinasjon med Lynparza (GnRH-analog), for informasjon om anbefalt dosering. Ved bruk av Lynparza i kombinasjon med abirateron til behandling av pasienter med mCRPC er abiraterondosen 1000 mg peroralt én gang daglig (se pkt. 5.1 i SPC). Abirateron skal gis sammen med prednison eller prednisolon 5 mg peroralt to ganger daglig. Behandling med gonadotropinfrigjørende hormon (GnRH)-analog skal fortsettes under behandling av alle pasienter, eller pasientene skal ha gjennomgått bilateral orkiektomi før behandlingen. Se preparatomtalen for abirateron.
UTVALGT SIKKERHETSINFORMASJON
FORSIKTIGHET UTVISES VED: Hematologisk toksisitet: Blodtelling før behandlingsoppstart og deretter månedlig, er anbefalt de første 12 månedene av behandlingen og periodevis etter dette tidspunktet for å overvåke klinisk signifikante endringer av verdiene under behandling. Myelodysplastisk syndrom/akutt myelogen leukemi: Dersom MDS og/eller AML blir diagnostisert under behandling med Lynparza, skal Lynparza seponeres og pasienten skal få hensiktsmessig behandling. Venøse tromboemboliske hendelser: Pasientene skal overvåkes med tanke på kliniske tegn og symptomer på venetrombose og lungemboli og behandles på medisinsk hensiktsmessig måte. Pneumonitt: Hvis pasienten får nye, eller en forverring av respiratoriske symptomer som dyspné, hoste og feber, eller et unormalt radiologisk funn observeres i brystet, bør behandling med Lynparza avbrytes og utredning igangsettes raskt. Levertoksisitet: Dersom det
1. Beslutningforum for nye Metoder ID2022_061, ID2020_008. www.nyemetoder.no.
2. Lynparza SmPC, 3. Akeega SmPC, 4. Talzenna SmPC AZ og MSD er i en allianse for å utvikle og markedsføre Lynparza.
©2025 AstraZeneca. All rights reserved.
utvikles kliniske symptomer eller tegn som tyder på levertoksisitet, må klinisk vurdering av pasienten og måling av leverfunksjonsprøver utføres raskt. Dersom det mistenkes legemiddelutløst leverskade (DILI), skal behandlingen avbrytes. Fertilitet, graviditet: Mannlige pasienter må bruke kondom og deres fertile kvinnelige partnere skal bruke sikker prevensjon under behandling og i 3 måneder etter å ha fått siste dose av Lynparza (se pkt. 4.6 i SPC). Se pkt. 4.4 i SPC for mer informasjon om advarsler og forsiktighetsregler.
VIKTIGE INTERAKSJONER: Samtidig administrering av Lynparza med kraftige eller moderate CYP3A-hemmere eller CYP3A-induktorer anbefales ikke. Se pkt. 4.2 og 4.5 i SPC for mer informasjon dersom en kraftig eller moderat CYP3A-hemmer eller CYP3A-induktor likevel må administreres samtidig med Lynparza. Se pkt 4.5 i SPC for mer informasjon om andre former for interaksjoner.
VIKTIGE BIVIRKNINGER: De hyppigste observerte bivirkningene på tvers av kliniske studier hos pasienter som fikk Lynparza som monoterapi (≥ 10 %) var kvalme, oppkast, diaré, dyspepsi, fatigue/asteni, hodepine, dysgeusi, nedsatt appetitt, svimmelhet, hoste, dyspné, anemi, nøytropeni, , og leukocytopeni. Bivirkninger førte til doseavbrudd og/eller dosereduksjon hos 50,7% av pasientene ved bruk i kombinasjon med abirateron. Bivirkningene som oftest førte til doseavbrudd og/eller dosereduksjon, var anemi (17,1%), fatigue/ asteni (5,5%), kvalme (4,1%) og nøytropeni (3,4%).
PRIS, REFUSJON OG FORSKRIVNINGSREGLER
Pakninger og priser: Tabletter: 100 mg: 56 stk. kr 27754,60. 150 mg: 56 stk. kr 27754,60. Reseptgruppe C. Refusjon: H-resept.
Refusjonsberettiget bruk: Der det er utarbeidet nasjonale handlingsprogrammer/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. De regionale helseforetakenes anbefalinger: Onkologi og kolonistimulerende legemidler Vilkår: (216) Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist.
Beslutning i Beslutningsforum for nye metoder (19.06.2023): Olaparib (Lynparza) innføres som monoterapi til behandling av voksne pasienter med metastatisk kastrasjonsresistent prostatakreft og BRCA1/2-mutasjoner (kimbane og/eller somatiske) som har progrediert etter behandling med nye hormonelle legemidler og hvor behandling med docetaksel, kabazitaksel og radium-223 har gitt utilstrekkelig effekt eller ikke er egnet.
Beslutning i Beslutningsforum for nye metoder (22.01.2024): Olaparib (Lynparza) og abirateron i kombinasjon med prednison eller prednisolon innføres til behandling av voksne pasienter med metastatisk kastrasjonsresistent prostatakreft (mCRPC), der kjemoterapi ikke er klinisk indisert.
Markedsføringsinnehaver: AstraZeneca AS, Karvesvingen 7, 0579 Oslo, tel. 21006400
NO-13051-10-24-ONC
Før forskrivning av LYNPARZA, se FK-tekst eller SPC på www.felleskatalogen.no
Melanom er en av kreftformene i Norge med størst økning i insidens de siste tiårene. Samtidig har behandlingsmulighetene utviklet seg raskt, særlig innen immunterapi. I Nasjonalt kvalitetsregister for melanom ble det i 2024 registrert 3 250 nye tilfeller av melanom i Norge: 3 129 hudmelanom, 84 øyemelanom og 37 slimhinneformer [1]. Hudmelanom utgjør altså klart flest tilfeller, mens slimhinne- og øyemelanom fortsatt er sjeldne diagnoser.

ANNA K. WINGE-MAIN
Overlege
Avdeling for kreftbehandling, Radiumhospitalet, Oslo universitetssykehus
Leder
Norsk melanomgruppe
Som vist i figur 1 har insidensen av melanom økt markant over tid [2]. Per 2024 lever over 36 000 personer i Norge med eller etter en melanomdiagnose. Femårs tilbakefallsfri overlevelse blant pasienter med melanom lokalisert kun i hud, dvs. stadium I og II er svært god, hele 82,6 %. Selv om kirurgi kurerer de fleste ser vi at hele 326 personer døde av melanom i 2024, et tall som utgjør hele 10 % av antallet nydiagnostiserte tilfeller.
GLOBOCAN 2022 viser at Norge ligger på femteplass i verden når det gjelder insidens av melanom, og tredjeplass når det gjelder dødelighet [3]. Dette understreker at melanom utgjør en betydelig kreftbyrde i Norge, både målt i forekomst og mortalitet.
Et av de viktigste fremskrittene i behandlingen av melanom de siste årene vises i resultatene fra CheckMate 067-studien. I den nylig publiserte 10-årsoppfølgingen rapporteres median totaloverlevelse på 71,9 måneder med nivolumab + ipilimumab, 36,9 måneder med nivolumab alene og 19,9 måneder med ipilimumab alene [4]. Dette tilsvarer
en seks års median totaloverlevelse, sammenlignet med kun 6–9 måneder i dakarbazin-æraen, da dette var ansett som gullstandard. [5]. Det mest bemerkelsesverdige gjennombruddet ligger likevel i de melanomspesifikke overlevelsestallene (MSS). Blant pasientene med komplett respons som var residivfrie tre år etter behandlingsstart var 96 % i kombinasjonsarmen og 97 % i nivolumab-armen fortsatt i live etter ti år [4] (figur 3). Dette representerer et fundamentalt skifte i vår forståelse av sykdommen og viser at det finnes mulighet for kurasjon for pasienter med metastatisk melanom.
Parallelt har nye kombinasjoner vist seg klinisk betydningsfulle. RELATIVITY-047 sammenlignet nivolumab + relatlimab med nivolumab alene hos ubehandlede pasienter med avansert melanom. Median overlevelse var 51,0 måneder i kombinasjonsarmen mot 34,1 måneder med monoterapi [6]. Kombinasjonen fremstår dermed som et sterkere alternativ enn PD-1-hemming alene, og med et bivirkningsnivå betydelig lavere enn ved ipilimumab + nivolumab, 21 % grad 3–4 behandlingsrelaterte
bivirkninger mot 59 % [6, 4]. Denne balansen mellom effekt og toksisitet gjør behandlingen til et viktig supplement i arsenalet, men det er verdt å merke seg at kombinasjonen kun er godkjent i Norge for dem med PD-L1uttrykk < 1 %. Å teste for PD-L1uttrykk blir dermed en viktig tilleggsoppgave for våre hudpatologer.
For pasienter med melanom stadium III har neoadjuvant behandling fått en sentral plass. KEYNOTE-054 viste at 18 kurer adjuvant pembrolizumab reduserte risikoen for tilbakefall etter kirurgi [7]. SWOG S1801 bygget videre på dette ved å flytte 3 av de 18 kurene til før operasjonen, mens de resterende 15 ble gitt adjuvant. Tilnærmingen ga en toårs hendelsesfri overlevelse på 72 %, sammenlignet med 49 % hos pasientene som fikk alle 18 kurer adjuvant [8]. Studien illustrerer på en elegant måte hvordan tidspunktet for når immunterapien introduseres kan være avgjørende for langtidsutfallet. Erfaringene fra neoadjuvante studier som SWOG S1801 og NADINA har fått konsekvenser for klinisk praksis i Norge. Det er samtidig viktig å presisere at neoadjuvant immunterapi ikke er indisert for alle pasienter med stadium III-sykdom. Den aktuelle målgruppen er pasienter med klinisk påvisbar sykdom, og neoadjuvant behandling med PD-1hemmer tilbys i dag til dem som oppfyller disse kriteriene.
Resultater fra de adjuvante studiene
KEYNOTE-716 [9] og CheckMate 76K [10] viste at adjuvant pembrolizumab eller nivolumab økte residivfri overlevelse sammenlignet med placebo hos pasienter med resektabel
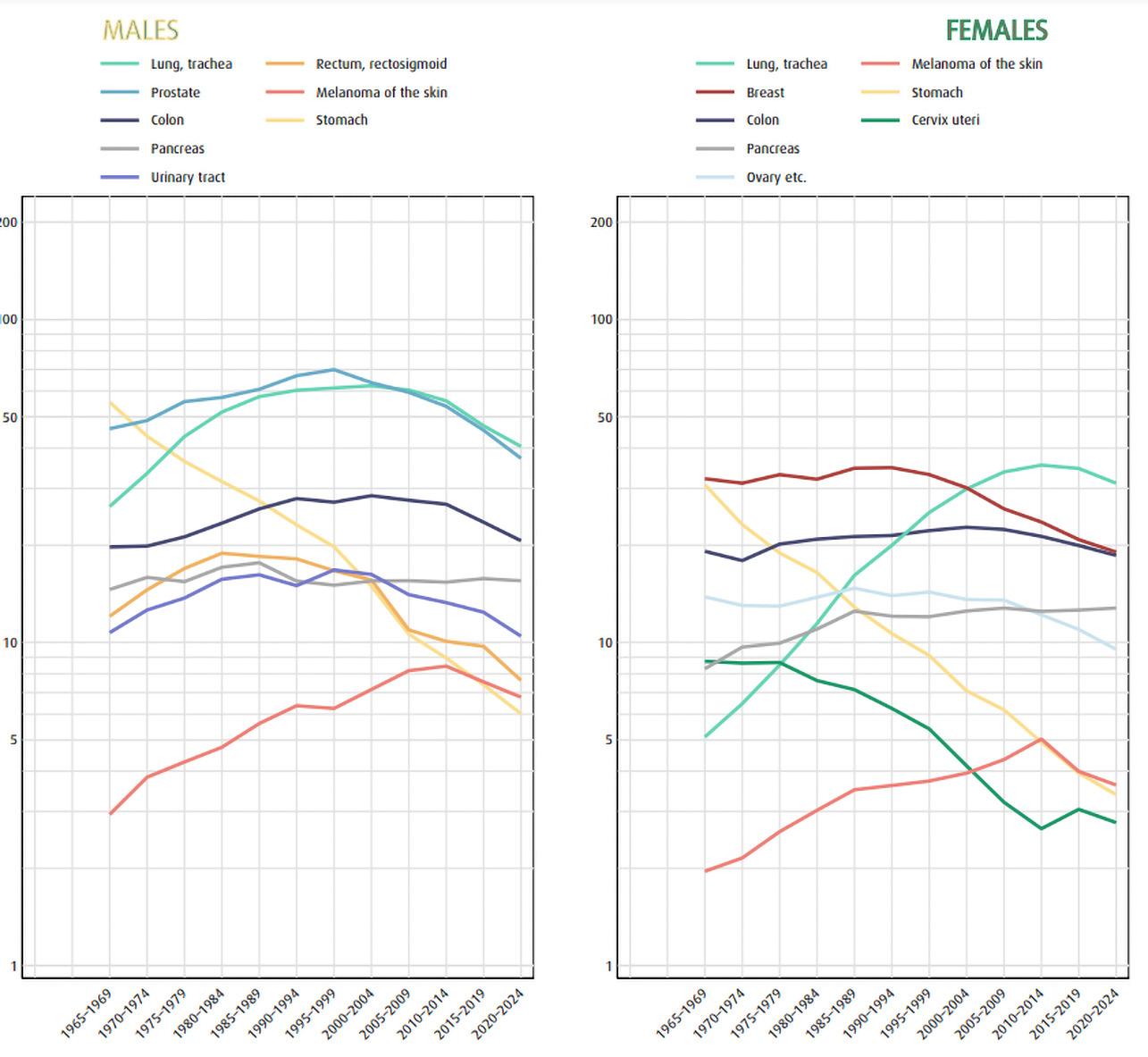



stadium IIB- og IIC-sykdom. I den nye versjonen av Nasjonalt handlingsprogram for melanom anbefales adjuvant behandling med nivolumab for stadium IIC, men ikke for stadium IIB. Begrunnelsen ligger blant annet i en mer beskjeden effekt av adjuvant behandling i denne gruppen, kombinert med gode overlevelsestall for stadium IIB og innføringen av skrøpelighetsvurdering som beslutningsstøtte i nasjonale retningslinjer. For denne relativt store pasientgruppen, hvor mange også er eldre, vurderes det som riktig å avstå fra adjuvant behandling.
Norge har fortsatt en høy forekomst og dødelighet av melanom. Samtidig
representerer de siste årenes fremskritt innen immunterapi et paradigmeskifte, med kombinasjonsbehandlinger, hemming av nye kontrollpunkter og innføring av neoadjuvant behandling som nå gir mulighet for både livsforlengelse og kurasjon hos enkelte pasienter. Kontinuerlig datainnsamling i kvalitetsregistrene og revisjon av nasjonale handlingsprogrammer er ressurskrevende, men avgjørende for å sikre at pasientene alltid tilbys behandling basert på beste tilgjengelige kunnskap. Skal dette arbeidet videreføres er det et klart behov for at det settes av tilstrekkelige ressurser og tid til fagmiljøene som bærer ansvaret.
Dere annonsører bidrar til at Onkonytt holder høy kvalitet og kan distribueres i private postkasser 2 ganger i året.
Håper dere blir med i 2026!
Se mediaplan på onkonytt.no (nederst på siden)
Kontakt: Ragnar Madsen Tlf. 928 48 402 ragnar.madsen@apriil.no for tilbud og nærmere informasjon
Årets melanomhøydepunkt finner sted i november i Tromsø. Norsk melanomgruppe arrangerer ikke eget faggruppemøte under Onkologisk Forum, men er i stedet vertskap for Nordic Melanoma Meeting 2025 den 10.–12. november [11]. Konferansen samler internasjonalt ledende eksperter og tilbyr tre dager viet til melanomforskning, behandling og samarbeid på tvers av landegrenser.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no



Innført av Beslutningsforum* 1 og godkjent av EMA for behandling av Muscle
IMFINZI® (durvalumab) er godkjent til behandling av voksne med resekterbar MIBC; I kombinasjon med gemcitabine og cisplatin som neoadjuvant behandling, etterfulgt av durvalumab som monoterapi som adjuvant behandling etter radikal cystektomi (MIBC-T2-T4aN0/1M0)2
*IMFINZI inngår i helseforetakenes anbefaling for onkologiske legemidler og rekvirering skal gjøres i tråd med disse: https://www.sykehusinnkjop.no/avtaler-legemidler/onkologi/

Neoadjuvant fase
Kirurgi (RC)
Adjuvant fase

Hvis du vil lese mer om studiedataene, kan du skanne QR-koden for å få tilgang til publikasjonen.
IMFINZI® - Viktig informasjon
Dosering og administrasjonsmåte: Behandlingen må startes opp og overvåkes av en lege med erfaring i kreftbehandling. Neoadjuvant fase: 1 500 mg i kombinasjon med kjemoterapi hver 3. uke i 4 sykluser før operasjon, etterfulgt (adjuvant fase) av 1 500 mg hver 4. uke som monoterapi i opptil 8 sykluser etter operasjon. MIBC-pasienter med en kroppsvekt på 30 kg eller lavere må få vektbasert dosering av IMFINZI basert på 20 mg/kg. Behandlingsvarighet: Neoadjuvant fase: inntil sykdomsprogresjon som utelukker definitiv operasjon, eller uakseptabel toksisitet. Adjuvant fase: inntil tilbakefall, uakseptabel toksisitet, eller maksimalt 8 sykluser etter operasjon.
Forsiktighetsregler: Ved mistanke om immunmedierte bivirkninger bør adekvat evaluering utføres for å bekrefte etiologi eller for å utelukke alternative etiologier. Retningslinjer for håndtering av immunmedierte bivirkninger er beskrevet i preparatomtalen. Pasienter bør overvåkes for tegn og symptomer på infusjonsrelaterte reaksjoner.
Bivirkninger: De vanligste bivirkningene med IMFINZI® i kombinasjon med platinabasert kjemoterapi var nøytropeni, anemi, kvalme, fatigue, forstoppelse, nedsatt appetitt, trombocytopeni, alopesi, utslett, diaré, oppkast, abdominalsmerter, perifer nevropati, leukopeni, pyreksi, pruritus, hypotyreose, artralgi, hoste/ produktiv hoste, og økt ASAT/ALAT. Immunmedierte bivirkninger: Pneumonitt, hepatitt, kolitt, hypotyreose, hyperthyreose, tyreoiditt, binyrebarksvikt, diabetes mellitus type 1, hypofysitt/hypopituitarisme, nefritt, utslett eller dermatitt, myokarditt, myasthenia gravis, transvers myelitt, myositt, polymyositt, meningitt, encefalitt, Guillain-Barrés syndrom, immunologisk trombocytopeni, immunmediert artritt, uveitt og ikke-infeksiøs cystitt.
Graviditet, amming og fertilitet: Durvalumab kan skade fosteret, og anbefales ikke under graviditet og til fertile kvinner som ikke bruker sikker prevensjon under og i minst 3 måneder etter behandling. Amming skal opphøre eller behandling med durvalumab skal avsluttes/avstås fra.
Pakninger og priser (AUP): Konsentrat til infusjonsvæske, Hetteglass: 2,4 ml (120 mg): kr 8207,90. 10 ml (500 mg): kr 33743,30
Markedsføringsinnehaver: AstraZeneca AS, Karvesvingen 7, 0579 Oslo, tel. 21006400 NO-14796-09-2025-ONC
Før forskrivning av IMFINZI, se FK-tekst eller SPC på www.felleskatalogen.no
Referanser: 1. Beslutningsforum for nye metoder (25.08.2025), https://www.nyemetoder.no/metoder/id2025_021/ 2. IMFINZI® (durvalumab) PREPARATOMTALE, www.felleskatalogen.no
Norsk forum for gynekologisk onkologi (NFGO) har mandat fra Helsedirektoratet om å drifte handlingsprogrammet og organisere fagmøter for å fremme kunnskap og samarbeid om gynekologisk kreft.

KATHARINA BISCHOF
Overlege Seksjon for kreftkirurgi, OUS, Radiumhospitalet, På vegne av styret i NFGO
NFGO teller i dag 30 medlemmer og består av leger med særlig interesse for gynekologisk kreft. Det sitter representanter fra alle helseregionene i styret, og vi har digitale styremøter flere ganger i året. I tillegg har vi to fysiske møter i året, et vintermøte og et møte i forbindelse med Onkologisk Forum. Da arrangerer vi også et fagmøte for alle interesserte, etterfulgt av generalforsamling.
NFGO har ambisjon om å fremme et helhetlig og likeverdig behandlingstilbud for alle pasientene i Norge og har derfor et formål om å tilby utdanning til kolleger i mindre spesialiserte sykehus.
FAGLIG UTVIKLING
Både diagnostikken og behandlingen av gynekologisk kreft har gjort store fremskritt, og det er dermed et fagfelt i rivende utvikling. Minimal-invasiv kirurgi har gjort sitt inntog i gynonkologisk kirurgi, og vi håndterer nå et økende antall pasienter med denne metoden, noe som gir kortere rekonvalesens og færre komplikasjoner.
I løpet av det siste tiåret har fagfeltet opparbeidet seg en økt forståelse for
den molekylære sammensetningen av ulike gynekologiske krefttyper. Det har vist seg at den biologiske kompleksiteten krever persontilpasset behandling, hvor både tumorprofil, pasientens alder, komorbiditet og individuelle preferanser vektlegges.
Systembehandlingen skjer i økende grad molekylært styrt, og dette forutsetter at vi har en standardisert og harmonisert infrastruktur for presisjonsdiagnostikk. Retningslinjer for utførelse av molekylær diagnostikk er nylig utarbeidet og publisert av gynkreft-prosjektgruppen til NorPreM (Nasjonalt kompetansenettverk for persontilpasset medisin) i 2023/24.
Bruken av moderne målrettet behandling med PARP-hemmere og immunsjekkpunkthemmere har endret behandlingslandskapet betydelig og forbedret utsiktene for mange kvinner med gynekologisk kreft. Det er imidlertid fortsatt slik at pasienter under og etter behandling for gynekologisk kreft kan leve med bivirkninger som i ulik grad påvirker livskvaliteten. Slike bivirkninger kan være infertilitet, hormonelle ubalanser eller psykososiale utfordringer. Forbedret pasientbehandling og helhetlig opp-
følging av eventuelle senskader er derfor også et viktig fokusområde innen gyn-kreftomsorgen.
Handlingsprogrammet, som representerer nasjonale faglige retningslinjer, krever regelmessige oppdateringer som følge av den faglige utviklingen. I år ble dette gjennomført for kapitlene om behandling av livmorkreft og eggstokk-, eggleder- og bukhinnekreft. Styret ønsker å benytte anledningen til å takke alle dyktige aktører innen fagfeltet for deres viktige og engasjerte innsats.
Årsrapporten fra Kreftregisteret1 presenteres tradisjonelt under fagmøtet i november. I 2024 ble det registrert en historisk lav forekomst av livmorhalskreft, med kun 269 nye tilfeller i hele landet. Dette skyldes hovedsakelig den forebyggende effekten av HPV-vaksinasjon og et velfungerende screeningprogram. Det ble også registrert en moderat nedgang i
dødelighet av eggstokk-, eggleder- og bukhinnekreft, noe som trolig gjenspeiler forbedringer i behandlingslandskapet, særlig etter innføring av PARP-hemmerne. Det er verdt å merke seg at den femårs relative overlevelsen for ovarialkreft har økt betydelig i Norge siden 1980, fra om lag 30 % til over 50 %. Insidensen av livmorkreft fortsetter dessuten å øke grunnet kjente livsstil-assosierte risikofaktorer som fedme. Denne trenden gjør behandlingsinnovasjoner som minimal-invasiv kirurgi og bruk av immunsjekkpunkthemmere i avanserte eller residivsituasjoner stadig mer relevante.
QUO VADIS, NORSK
GYNEKOLOGISK ONKOLOGI?
I tiden fremover vil vi som gynekologer bli utfordret til å holde tritt med betydelige endringer innen medikamentell behandling av gynekologisk kreft. Det finnes flere spennende og lovende fremskritt innen fremtidens behandlingsmodaliteter for morgendagens pasienter, og behandlingen vil i enda større grad basere seg på individuelle tilnær-
Tabell 1 Medlemmer i NFGOs interimstyre gjeldende fra 17.12.24
minger. Et godt eksempel er bruk av antistofflegemiddelkonjugater, som kan tilpasses hver enkelt pasients tumorprofil.
Det forventes også at den kirurgiske behandlingen vil forbedres ytterligere, og at behandling av sjeldne gynekologiske svulster vil bli mer sentralisert for å sikre høy kvalitet og kompetanse i behandlingstilbudet.
NFGO vil aktivt støtte og veilede kolleger gjennom denne overgangen, samtidig som vi jobber for å opprettholde den brede kompetansen som norske fagmiljøer besitter.
Alt i alt står vi foran en ny æra innen gynonkologi – hvor persontilpassede og målrettete behandlingsformer preger både kirurgiske og medisinske strategier.
Referanser:
1. Cancer Registry of Norway. Norwegian Institute of Public Health. Cancer in Norway 2024 - Cancer incidence, mortality, survival and prevalence in Norway. Oslo: Cancer Registry of Norway, 2025.
Nytt styre vedtas på årsmøtet 2025 etter oppdatering av vedtektene i desember 2024.
Leder Ingvild Vistad Sørlandet sykehus, Kristiansand
Nestleder og webredaktør Alda Birgisdottír Oslo universitetssykehus, Radiumhospitalet
Kasserer Elise Sletten Kvinneklinikken, Universitetssykehuset Nord-Norge
Sekretær Bente Vilming Oslo universitetssykehus, Radiumhospitalet
Helse Midt Merethe Ravlo Kvinneklinikken, St. Olavs hospital
Guro Aune Kvinneklinikken, St. Olavs hospital
Helse Nord Martin Lindblad Kvinneklinikken, Universitetssykehuset Nord-Norge
Helse Vest Elisabeth Berge Nilsen Kvinneklinikken, Stavanger universitetssjukehus
Line Bjørge Haukeland universitetssjukehus, Universitet i Bergen Tone Skeie-Jensen Kvinneklinikken, Haukeland universitetssjukehus
Helse Sør-Øst Katharina Bischof Oslo universitetssykehus, Radiumhospitalet
AI-løsninger har de siste årene vært fremme i mediebildet og nå kommer også forskningen på bruken av disse løsningene i helsetjenesten. Som all annen teknologi i helsevesenet møter AI utfordringer knyttet til kompleksitet og spesifisitet. I denne kronikken vil jeg kort redegjøre for dagens status med onkologiske øyne formet av et ledende forskningsmiljø på helseteknologi ved University of Edinburgh.

EIVIND STORAAS
Ph.d.-stipendiat implementeringsvitenskap og e-helse, assisterende avdelingsleder Avdeling for kreftbehandling, OUS
KORT FORTALT, HVA ER DET FOR NOE?
Kunstig intelligens (AI, artificial intelligence, eller KI) er et bredt begrep som dekker en rekke teknologier. Det vi mennesker egentlig tenker på som kunstig intelligens, «artificial general intelligence», finnes ikke. For enkelthets skyld vil jeg i denne kronikken bruke «AI» om disse løsningene som helhet, selv om mye klassifiseres bedre som maskinlæring, algoritmer og språkmodeller.
MAKROBILDET:
EUROPA LIGGER BAK.
De fleste AI-løsninger er bygget på en åpen plattform som OpenAI, Google Gemini og Microsoft Copilot. Felles for alle de ledende løsningene er at de ikke er europeiske. Dermed åpnes for problemstillinger innen datasikkerhet og jus, for eksempel hvor trygge serverne er og hvordan modellene påvirkes av vertslandets lovgivning. Det pågår en kraftsamling ledet av Tyskland i å bygge EuroStack, en
europeisk OpenAI-løsning. I Norge har universitetene gått sammen om Keenious, et referanseverktøy, og ved Universitetet i Oslo har forskere tilgang til en GPT-løsning på en trygg server. Denne ligger som regel noen måneder bak siste versjon av ChatGPT.
Et alternativ til de åpne løsningene er å lage seg interne rom som en språkmodell så arbeider med, forkortet til «RAGs» på teknolog-språket. Dette er altså lukkede «rom» med dokumenter en institusjon selv legger inn, som språkmodellen så jobber med basert på sin opptrening og de aktuelle dokumentene. Man kan tenke seg at en «RAG» for alle e-håndboksdokumenter i et sykehus kunne vært nyttig. Andre nyttige bruksområdet for en «RAG» kunne være å samle alle dataene for en forskningsgruppe, eller å samle alle Norges studieprotokoller for raskt å kunne finne aktuelle studier for en pasient.
Halamka et al. [1] skriver i sin ikke enda utgitte bok «Transform – the Mayo Clinic Platform and The Digital Future of Health» edruelig om fordeler og utfordringer med den raske digitale utviklingen. Det pekes på det store potensialet i AI, men også den foreløpig nokså begrensede faglige bruken (min tolkning).
IMPLEMENTERINGSUTFORDRINGENE
Det er anslått at om lag 85 % av AI-prosjekter feiler [2]. Det er sannsynlig at trenden er lik i helsevesenet. Historien i sykehus er ofte at man innfører en løsning for gratis pilotering i ett år, klinikerne er fornøyde, men løsningen tas ikke inn videre i klinisk drift. Det beskrives en økende uro hos AI-leverandører for om markedet virkelig er der [3].
Årsaken til dette kan man foreløpig bare spekulere i. Noe kan ligge i kvaliteten på selve løsningen og i den høye spesifisiteten i ulike deler av helsevesenet. Men noe av årsaken ligger nok også i helsevesenets IKTstruktur som helhet. AI-løsninger må innlemmes teknologisk, organisatorisk og i arbeidsrutiner på lik linje med andre IKT-verktøy. Man får ikke økt effektivitet eller bedre kvalitet på pasientbehandlingen kun av å anskaffe et nytt IKT-verktøy. Teknologien og infrastrukturen som nye løsninger skal inn i er nemlig ikke designet fra bunn av, men bygget lag på lag gjennom utviklingens gang. I tillegg kommer organisatoriske elementer i en kompleks helsetjeneste. La meg gi et eksempel. Et selskap presenterer et flott nytt AI-verktøy for analyse av biopsier. I tillegg til å gi en prognostisk
verdi sies det at den kutter analysetiden med hele fire timer. Det gis flotte presentasjoner til ledergruppen på sykehuset og ordene «revolusjon» og «fremtidens løsning» brukes hyppig. Men ved å vurdere helheten ser vi fort problemet. For hva om biopsimaterialet først må transporteres fra A til B? Og hva om en satsning på bedrede vilkår for transporttjenesten gjør at de kan kjøre hele uken, tiltak på laben gjør at de kan få preparatene i løsning før helgen, og at man dermed kan kutte den totale svartiden med for eksempel fire dager til en brøkdel av kostnaden for den aktuelle AI-løsningen?
Eksempelet mitt viser også utfordringene med investeringer. Den enkle (vanskelige) måten å få handlingsrom i helsevesenet på er å ta ned bemanning. Men hvilke institusjoner ønsker å gjøre spesialistmiljøet sitt mindre sterkt om man ikke absolutt må? Høyspesialisert kompetanse er svært verdifullt. Drift, forskning og utdanning skal gjennomføres og ferier avvikles. Og som i dette eksempelet med en AI-løsning for biopsier: Det må uansett være en til to spesialister som signerer ut en kreftdiagnose. Da kan det kanskje være mer fristende å se på løsninger i kjeden frem til et biopsisvar, og ikke bare de mulig sparte timene ved bruk av AI i enden av den. Jeg har løftet frem dette eksempelet til entusiastiske AI-tilhengere, uten at noen kan gi meg et godt svar.
Jeg tviler derfor på om smale AI-løsninger som løser et enkelt problem som spesialister vanligvis løser vil bli tatt inn bredden av vår komplekse kliniske hverdag. Innen
radiologisk bildebeskrivelse er det mer nyansert, dog vet alle onkologer hvor vanskelig radiologi kan være. Og noen (les: et menneske) vil alltid måtte gå god for og signere ut svaret til slutt. Flyene vi flyr har kunnet lette og lande siden 1990-tallet, det finnes fremdeles piloter. I Vestre Viken har man forsket på AI-analyser av brudd i akuttmottak. Overraskende nok gav det ingen tidsbesparelse for radiologer, men sparte titusenvis av ventetimer for pasientene. Dette viser hvordan nye AI-verktøy inngår i den helheten som er helsetjenesten vår, og hvor nytten kommer er ikke alltid gitt på forhånd.
Unntaket er språkmodellene. Dette ble bekreftet av miljøet ved digital helsetjenesteforskning i Edinburgh som jeg besøkte i tre måneder i vår. Takk til NOF for reisestipendet! Forskerne der har blant annet evaluert den nasjonale AI-laben i NHS (National Health Service) og var svært interessert i hvor godt språkmodellene ble mottatt av klinikere. Hvor innføring av ny IKTverktøy vanligvis ble møtt av motstand og skepsis, var historien for språkmodellene tvert om. Samtidig sa disse forskerne at «Vi er alle i en læringsfase nå», og helhetlige evalueringer er nødvendige for å tilgjengeliggjøre erfaringer.
En språkmodell er som regel trent på millioner, noen ganger milliarder, «ekte» tekstkilder og anslår med sannsynlighet i et nettverk av «noder» hva som er neste ord. Den gjetter med andre ord. Noen ganger lyver den, eller «hallusinerer» som teknologene liker å kalle det. Jeg vil anbefale alle onkologer å be ChatGPT 5.0 om å oppsummere et fagfelt man
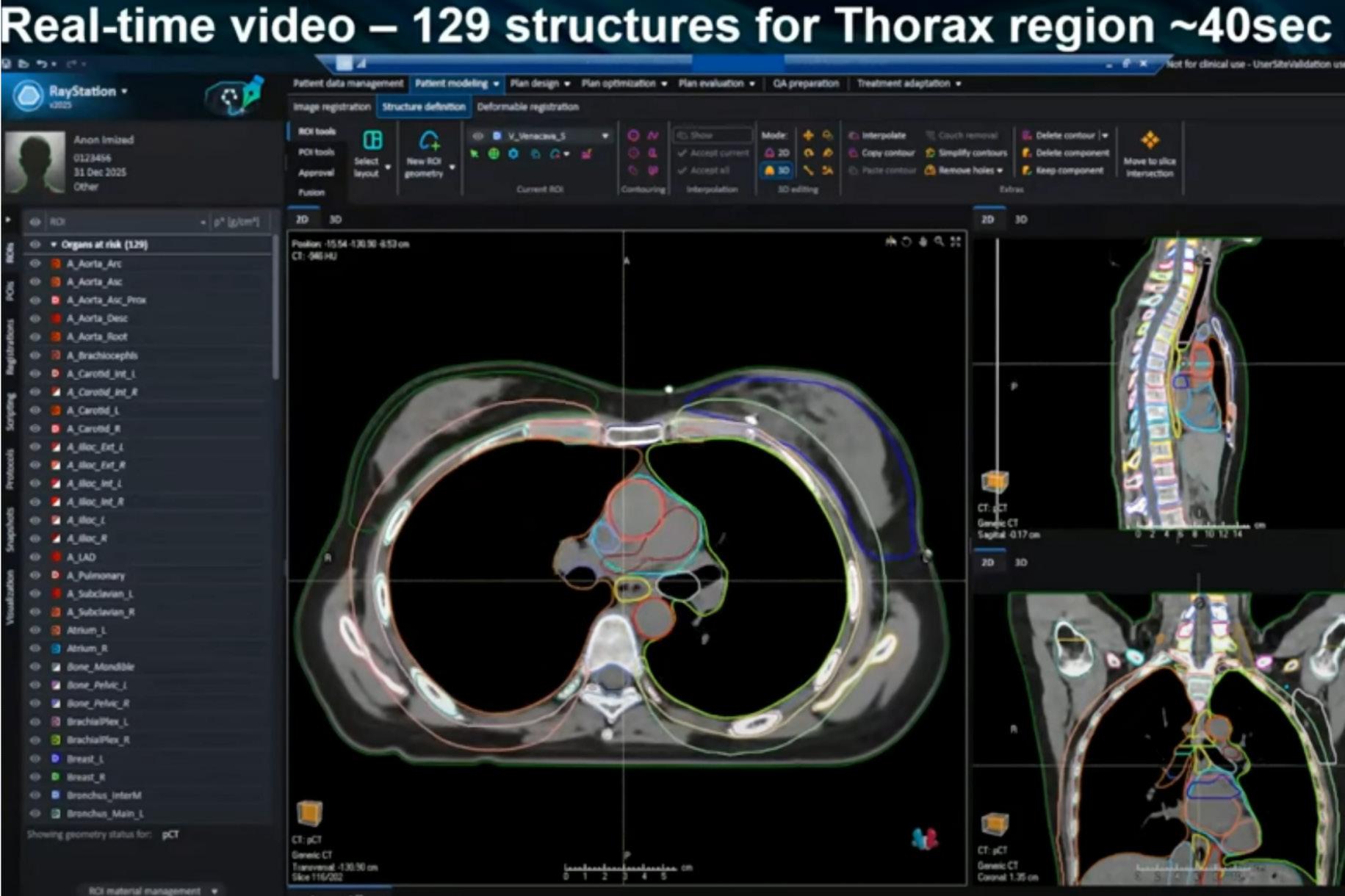
selv er høykompetent i. Man vil fort se at nyansene glipper. Den er ikke intelligent som sådan, den oppsummerer tilgjengelig tekst. Pasientene våre kommer til å gjøre det samme og utfordre oss i konsultasjonene våre. Det kreves god fagkompetanse for å imøtekomme bekymringer eller innspill som pasientene får fra disse språkmodellene.
ChatGPT 5.0 er litt bedre enn den forrige versjonen, 4.5, men fremdeles ikke pålitelig i kontekst av å utøve medisin eller fag mener jeg. Mange forskere beskriver hvordan referanser eller forfattere, eller begge deler, plutselig er diktet opp når de spør om en litteraturliste eller et saksfelt. ChatGPT er også koblet til det åpne internett og blir utfordret av mengden ikke-menneskelig generert tekst som internett mer eller mindre flyter
over av. Et anslag er at nærmere 90 % av alt innhold på nettet i løpet av kort tid vil være generert eller prosessert av maskinmodeller.
ChatGPT er i all hovedsak ikke en søkemotor, men et tekstverktøy. Best brukes den til å endre eksisterende tekst, for eksempel et brev eller en informasjonstekst. Det er svært viktig at man gir den et godt «prompt» eller instruks om hvordan du vil ha teksten behandlet. En professor i Norge har pålagt sine stipendiater til å få utkast til kappen sin i GTP. Dette er et eksempel som bruker disse språkmodellene til hva de faktisk er gode til; å arbeide med eksisterende tekst for noen som har svært god kjennskap til hva teksten handler om. Noen AI-løsninger til klinisk bruk transkriberer først tale til tekst, for så å utsette teksten for det trente materialet for å kondensere og
summere den til ønsket grad. I Norge har primærhelsetjenesten tatt disse kliniske løsningene i bruk. Enkelt fortalt vil løsningene lytte til konsultasjonen før den produserer et sammendrag. Dette er formulert anonymt i en nettleser og limes direkte inn i journalen. Andre språkmodeller kan enkelt brukes i nettleser eller app for å generere brev eller henvisninger. Hvordan det står til med informasjonssikkerheten til pasientene oppi dette er jeg usikker på, men jeg antar det er vurdert.
På sykehus er det meg bekjent kun pilotering av slike løsninger. Teknologien for å lese journal for å autogenere sammendrag til epikriser og henvisninger finnes. Jeg tror flere av disse løsningene vil komme inn i vår hverdag. Disse vil integreres i journalsystemet etter hvert som juristene
blir enige med seg selv om beskyttelse av pasientdataene. Totalt sett vil nok dette gi oss en enklere hverdag i møtet med den informasjonsflommen som er moderne medisin.
– ET FØR OG ETTER?
Jeg har sannsynligvis snart tegnet mitt siste risiko-organ, (organ at risk, OAR). RaySearch sitt seminar i juni 2025 om AI-løsninger som auto-genererer både OAR og feltplanlegging med optimalisering, var imponerende. Eksempelvis skapte den 129 OAR i toraks på 40 sekunder. Ikke visste jeg det var så mange OAR i toraks.
Noen elektive felt ble også presentert. På planlegging og feltoptimalisering viste RaySearch hvordan tre til fire timers arbeid nå ble gjort på ett til tre minutter. Disse løsningene må teknisk og organisatorisk tilpasses lokale forutsetninger ved hvert strålesenter, et arbeid som er i gang ved OUS. RaySearch anbefaler også plan for både validering og evaluering per senter. Evalueringen av et strålesenter i NHS viste at uten en helhetlig tilnærming til pasientforløpet ga ikke autogenererte felt mer effektive forløp for pasientene. Markedssjefen i RaySearch anga også i seminaret at autogenererte tumorvolum var for komplisert for AI i overskuelig fremtid. Skal man inkorporere tumorbiologi, strålefysikk, evidens (og svakheter ved den), pasientens sykdomshistorie, antatt toleranse og preferanser, pasientlogistikk, tilgjengelighet på maskin, og ikke minst behandlingsintensjon, ja, så blir mangel på gode data inn i AI-modellene skrikende åpenbart. For som min klinikk-
leder Sigbjørn Smeland sa i et møte med brukerorganisasjonen her på Radiumhospitalet: «AI er ikke behandling». RaySearch planlegger å rulle ut «OAR Hippocampus» på et tidspunkt i fremtiden. Jeg håper at den onkologen som skal behandle meg, skulle jeg mot all formodning bli pasient og trenge det, har god kompetanse fra før av når vedkommende signerer ut et slikt autogenerert volum.
En fersk MIT-studie [4] viste tydelig hva som skjer med menneskehjernen når vi får mer hjelp enn vi trenger. Deltakerne ble delt i tre grupper hvorav en kun brukte analoge metoder for å skrive essays, en gruppe brukte Google og en gruppe brukte siste versjon av ChatGPT. Gruppen som brukte ChatGPT hadde på bare fire måneder dårligere formuleringsevne enn gruppen som skrev analogt, synlig på funksjonelle MR-serier. En like interessant studie ved OUS [5] viste at kompetanse hos endoskopører raskt falt etter innføringen av et AI-støtteverktøy.
Utfordringen blir altså å sikre kompetanse både i drift og ikke minst i utdanningen av fremtidens stråleonkologer. Alle AI-genererte OAR vil måtte sees over av kyndige øyne, også i fremtiden. Dagens stråleonkologer har vært med på hele utviklingen fra direkteinnstilling av kappefelt til pustestyrt behandling og nå AI. Selv var jeg heldig som fikk med meg direkteinnstilling på apparat da jeg var LIS, hvor jeg forsøkte å påvirke noen lymfomer i hud. Jeg vet ikke hvor bra det ble, men det gav meg en forståelse av hva det egentlig handler
om, og hvordan de fine linjene når jeg tegner på PC-stasjonene til syvende og sist er plater som påvirker strålens utgangspunkt i maskinarmen. LIS som begynner i onkologien i dag vil ikke nødvendigvis få slike forutsetninger i den kliniske tjenesten. En utdanningsstrategi med bred faglig tilslutning vil bli avgjørende for å sikre at fremtidens stråleonkologer får nødvendige forutsetninger og kompetanse.
Oppsummert har AI-løsninger potensiale for å forbedre hverdagen til oss onkologer. Ved helhetlig tilnærming i innføringen kan nytte som økt effektivitet og kvalitet i behandlingen skapes, men dette kommer ikke nødvendigvis av seg selv. Jeg har ikke gått inn på AI i forskningen her, men kort fortalt tror jeg det er en revolusjon på gang, og at korrekt og etterprøvbar bruk blir helt vesentlig.
Onkologien kommer ikke nødvendigvis til å bli enklere i møtet med AI, kanskje tvert om, og kompetanse innen AI-løsninger vil være nødvendig for oss onkologer i fremtiden.
Referanser: Red.anm.: På grunn av tidsskriftets omfang har vi besluttet å ikke trykke referanselisten i papirutgaven. Den finner du i den elektroniske versjonen av artikkelen på www.onkonytt.no


Overlege
Avdeling for kreftbehandling, Oslo Universitetssykehus, Radiumhospitalet
Årets PTCOG (Particle Therapy Cooperative Group)konferanse ble arrangert i Buenos Aires 2.–7. juni. Etter en lang reise som inkluderte 13 timer i luften fra Schiphol landet vi endelig i SørAmerikas Paris, klare for både faglig påfyll og kulturelle opplevelser.
Heldigvis reiste jeg sammen med en aktiv gjeng, noe som gjorde at vi fikk utnyttet tiden godt. Vi fikk med oss både graven til Eva Perón, et ekte
argentinsk tango-show, vandringer i de fargerike gatene – og ikke minst de møre biffene som Argentina er berømt for. Et høydepunkt var besøket i det flotte Teatro Colón, hvor vi fikk oppleve både klassisk og moderne ballett. Vi tok også turen over elven til Colonia del Sacramento i Uruguay – en sjarmerende liten by med brosteinsgater og kolonihistorie.
Konferansen i seg selv opplevdes mer intim enn ESTRO-konferansen, og

minnet litt om hvordan ESTRO var «i gamle dager». Programmet 4.–6. juni rommet alt fra klinisk praksis og adaptiv planlegging til FLASHeffekter, biologiske forskjeller mellom partikkeltyper og kombinasjoner med legemidler, inkl. immunterapi.
Blant de mest spennende innleggene var siste nytt om rotasjonsbehandling med protoner og hvordan man skal forholde seg til RBE-problematikk. Et annet høydepunkt var da den amerikanske Frank-studien på orofarynkskreft ble presentert: Pasientene ble randomisert til enten foton- eller protonbehandling. Protonarmen hadde færre bivirkninger som behov for sondeernæring eller
vekttap – og overraskende nok antydet foreløpige analyser en uforklarlig økt overlevelse i protonarmen, til tross for lik dose til tumor. Resultatene er ennå ikke publisert, men vekker stor interesse.
Konferansen ble rundet av med en omvisning på Sør-Amerikas første protonsenter som snart åpner dørene for pasienter.
Alt i alt – en reise med en perfekt kombinasjon av tango, biff og banebrytende partikkelterapi.
Hasta luego fra Buenos Aires og vi sees på neste års konferanse i Normandie og Deauville!



Verdenskongressen for tyreoideasykdommer ble i år arrangert i Rio de Janeiro, Brasil. Kreft i skjoldbruskkjertelen er en sjelden sykdom, og derfor er det ekstra viktig med internasjonalt samarbeid for å tilby best mulig diagnostikk, behandling og oppfølging til denne pasientgruppen.

Overlege, ph.d. Kreftklinikken, St.Olavs hospital, Trondheim
Hvert femte år arrangeres det verdenskongress for tyreoideasykdommer, og i år ble kongressen holdt i Rio de Janeiro hvor den latin-amerikanske tyreoideaorganisasjonen var vertskap for over 3000 deltagere fra hele verden. Det er ti år siden sist møtet ble avholdt fysisk,
siden møtet i 2020 ble holdt digitalt under pandemien. Målgruppen for kongressen er endokrinologer, endokrinkirurger, onkologer og patologer. Innholdet omhandler sykdommer relatert til skjoldbruskkjertelen, med stor vekt på karsinomer.


Kongressen ble arrangert i bydelen
Barra da Tijuca, som er et av Rios nyeste områder med byens lengste sandstrand i umiddelbar nærhet. Temperaturen var som ved en god trøndersk sommerdag. Utsikten fra fjellet Corcovado med Kristusstatuen var flott, og var vel verdt gåturen opp.
Møtet var i hovedsak lagt opp i bolker med egne sesjoner med systematisk gjennomgang av prognostiske faktorer, molekylær testing, endringer i kirurgisk og medikamentell behandling av tyreoideakreft de siste fem årene, diskusjoner rundt vanskelige kliniske vurderinger og presentasjon av nye forskningsresultater. Kongressen er en fin anledning til å delta i diskusjoner om vanskelige pasientkasuistikker, samt å få bekreftet at vi tilbyr samme

behandling i Norge som i andre deler av verden.
I likhet med andre kreftformer er det også ved tyreoideakreft fokus på presisjonsmedisin. Ved avansert sykdom anbefales generelt molekylærtesting ved alle undergrupper for best mulig tilpasset behandling. Eksempelvis viser en fase II-studie ved Zafereo et al. forlenget overlevelse ved å gi neoadjuvant immunterapi i kombinasjon med dabrafenib og trametinib ved anaplastisk tyreoideakreft stadium IVB og IVC hvor BRAF V600E-mutasjon er påvist. Et annet tema som ble diskutert var aktiv overvåkning ved lav-risiko tyreoideakreft. En studie ved Sugitani et al. inkluderte 650 pasienter med papillært tyreoideakarsinom stadium T1a og T1b, hvor
man etter åtte års oppfølging fant at progresjon under aktiv overvåkning forekom hos 12 % av pasientene.
Disse funnene vil mest sannsynlig være med på å danne grunnlaget for nye retningslinjer som vil bli publisert i løpet av året. For øvrig er forskning på tyreoideakreft i stor grad retrospektive studier, og således er det behov for flere prospektive studier fremover.
Dette var en veldig fin og nyttig kongress å delta på. Tusen takk til NOF for reisestøtte. Neste ITC er planlagt i 2030.
Det var med litt blandede følelser jeg aksepterte invitasjonen til å snakke om seneffekter etter testikkelkreft ved årets ASCO-kongress i Chicago. Det var en stor ære å bli invitert til å snakke om et viktig tema på verdens største kreftkongress med 44 000 deltagere – men blandet fordi jeg vurderte det som litt problematisk å skulle reise til USA slik verdensbildet er akkurat nå. Jeg kom imidlertid frem til at det i år var viktigere enn noen gang å reise til USA for å støtte opp om fag og forskning, men lar i det videre politikken ligge. I denne artikkelen vil jeg fokusere på faglighet med en oppsummering fra sesjonen der jeg holdt innlegg, samt beskrive noen utvalgte høydepunkter fra kongressen. Som litt krydder til slutt kommer et kort reisebrev fra Chicago og delstaten Michigan.
EDUCATION SESSION:
HEGE SAGSTUEN HAUGNES
Onkolog og professor
Kreftavdelingen UNN/UiT
Norges arktiske universitet
REFINING TREATMENT FOR PATIENTS WITH METASTATIC GERM-CELL TUMORS
Jeg var invitert til å snakke om seneffekter etter testikkelkreft
på en såkalt Education Session. Denne sesjonen fant sted mandag 2. juni i hall D2 på McCormick Place, det enorme kongress-senteret som huser det årlige ASCO-møtet. Hall D2 har plass til 5300 tilhørere, så det å stå på podiet der gir en viss følelse av hvordan det kan være å være rockestjerne. For de som ønsker å lære mer om testikkelkreft er detaljer fra denne sesjonen publisert i en review (1).
Sesjonen ble ledet av urolog Aditya Bagrodia fra San Diego, som holdt et flott innlegg om oppdatert behandling av stadium 2-seminomer, med søkelys på de-eskalerende behandling der kirurgi i økende grad brukes fremfor kjemoterapi ved begrenset metastatisk sykdom. For pasienter med begrensede retroperitoneale
metastaser fra seminom har 3–4 kurer med cisplatin-basert kjemoterapi i mange år vært standard behandling. Cisplatin-basert kjemoterapi fører til høy overlevelse, men gir risiko for flere potensielt alvorlige seneffekter. Endringen i behandlingsvalg for denne gruppen fra kjemoterapi til primær kirurgi i form av retroperitonealt lymfeknutetoilette (RPLND) skyldes økende kunnskap om seneffekter etter cisplatin-basert kjemoterapi. Cisplatin-basert kjemoterapi er fortsatt førstevalget for pasienter med mer avansert metastatisk seminom, samt for pasienter med metastatisk non-seminom.
Legendariske Lawrence (Larry) Einhorn fra Indianapolis holdt en glitrende forelesning om fallgruver i håndteringen av pasienter med metastatisk germinalcelle-cancer, der han i en alder av 83 år delte av sin unike erfaring. Og for de som ikke kjenner Einhorns plass i onkologien – dette er mannen som innførte

cisplatin i behandlingen av metastatisk testikkelkreft på slutten av 1970-tallet. Introduksjonen av cisplatin førte til en dramatisk bedring av overlevelsen for menn med metastatisk testikkelkreft. Han snakket blant annet om viktigheten av korrekt fortolkning av forhøyede tumormarkører. Marijuana, nylig gjennomgått mononukleose eller kryss-reaksjon med LH kan gi falskt forhøyet nivå av humant chorion-gonadotropin (hCG). Det er videre viktig å være klar over at hCG kan ha en bifasisk utskillelse, der hCG kan falle langsommere etter tredje behandlingssyklus. Han snakket også om behandling i henhold til risikogrupper, og fokuserte på viktigheten av å holde oppe behandlingsintensiteten.
Lucia Nappi fra Vancouver var tredje foredragsholder i denne sesjonen, og hun ga en god oversikt over håndtering av gjenværende lesjoner post-kjemoterapi ved metastatisk testikkelkreft. Til tross for at de fleste
pasienter med metastatisk testikkelkreft oppnår remisjon etter cisplatinbasert kjemoterapi, vil omtrent 30 % av pasienter med non-seminom og 90 % av pasienter med seminom ha gjenværende lesjoner etter avsluttet kjemoterapi. For seminom-pasienter er det sjeldent viabelt kreftvev i gjenværende lesjoner. For lesjoner under 3 cm i diameter er kun videre oppfølging anbefalt. For seminom-pasienter med gjenværende lesjoner større enn eller lik 3 cm anbefales tverrfaglig diskusjon, og de fleste pasienter får utført FDGPET. En negativ FDG-PET utelukker nærmest tilstedeværelsen av viabelt kreftvev, mens en positiv FDG-PET ikke nødvendigvis betyr tilstedeværelse av viabelt kreftvev, og videre radiologisk oppfølging anbefales vanligvis. For non-seminom-pasienter med restlesjoner i retroperitoneum større enn eller lik 1 cm anbefales RPLND, samt kirurgi av øvrige gjenværende lesjoner utenfor retroperitoneum.
Sist ut var undertegnede, som snakket om seneffekter etter behandling for testikkelkreft. Til tross for at overlevelsen ved testikkelkreft er svært høy og over 95 % i mange land, har flere nylige studer vist en økt risiko for prematur død av andre årsaker enn testikkelkreft, der særlig forekomst av sekundær kreft bidrar til økt dødelighet (2). Både stråleterapi og cisplatin-basert kjemoterapi kan gi økt risiko for sekundær kreft mange år etter behandling. Cisplatin-basert kjemoterapi og sannsynligvis også stråleterapi gir økt risiko for hjertesykdom, der en i tillegg til cisplatineksponering også må vurdere klassiske risikofaktorer som røyking, hypertensjon, overvekt og dyslipidemi. Andre seneffekter som kan forekomme hos testikkelkreft-overlevere uavhengig av behandling er hypogonadisme, seksuell dysfunksjon, redusert fertilitet og psykososial uhelse i form av angst og fatigue. Etter cisplatin-basert kjemoterapi kan perifer nevropati, hørselsproblemer og Raynauds fenomen


oppstå. Til tross for at noen menn opplever varige helseutfordringer etter kurasjon for testikkelkreft, vil de fleste testikkelkreft-overlevere oppleve livskvalitet som er på nivå med normalbefolkningen (3). I Norge har vi gjennom SWENOTECA-samarbeidet et omfattende program for utredning, behandling og oppfølging av menn med testikkelkreft, som inkluderer overføring til fastlege etter endt onkologisk oppfølging (4).
NOEN UTVALGTE NYHETER
FRA ASCO 2025
Som forsker og uro-onkolog med interesse for seneffekter var det primært presentasjoner innen uroonkologi og survivorship som ble prioritert i mylderet av presentasjoner på årets ASCO. I år var det totalt 5483 presentasjoner og 2700 postere, og jeg opplevde McCormick Place som enda mer hektisk enn tidligere. Det var mange glitrende foredragsholdere som inspirerte til videre kvalitets-
fremmende arbeid i klinikken og som ga nye forskningsideer.
Prostatakreft: Fra Johns Hopkins ble det presentert data fra en randomisert studie som hadde inkludert 745 pasienter med intermediær- og høy risiko lokalisert prostatakreft. Alle pasientene fikk ekstern stråleterapi med eller uten androgen deprivasjonsterapi (ADT), og de ble randomisert 2:1 til enten et nytt medikament (CAN-2409) sammen med valaciklovir som et prodrug, eller placebo + valaciklovir. CAN-2409 ble gitt som tre intraprostatiske injeksjoner, og er en form for onkolytisk-viral terapi. Dette medikamentet ga 30 % bedring i sykdomsfri overlevelse, og var god tolerert. Her trengs videre studier som kartlegger dette medikamentets rolle i konteksten av endokrin terapi og moderne stråleterapi. Videre ble data fra IRONMAN-registeret presentert, og her har norske sentre bidratt med data. Hovedbudskapet fra dette real-
world-registeret var at PSA-fall til under 0,2 (helst under 0,1) etter 6–12 måneders behandling med ADT pluss androgen-reseptor-hemmer (androgen receptor pathway inhibitor, ARPI) for menn med hormonsensitiv metastatisk prostatakreft har god prognose, og her kan en vurdere de-eskalering. Real-world-data har dermed bekreftet den prognostiske verdien av PSA som en har sett i flere randomiserte studier som ligger til grunn for godkjenning av ARPI i hormonsensitiv fase. Flere presentasjoner dreide seg om å intensivere behandlingen av pasienter med BRCA-mutasjoner, der PARPhemmere ble kombinert med enten abirateron (hormonsensitiv sykdom) eller radium-223 (kastrasjonsresistent sykdom).
Innen blære- og nyrekreft var det flere presentasjoner som ga en oppdatering fra tidligere publiserte data. I Norge fikk vi 1. juli godkjent bruk av enfortumabvedotin + pembro-
lizumab (EV + P) som førstelinjes behandling ved metastatisk urotelialt karsinom. Det var betryggende å få servert oppdaterte data fra EV-302 studien, som viste at pasienter som oppnådde komplett remisjon (CR) på EV + P hadde 74 % sannsynlighet for vedvarende CR etter 24 måneder. Respondere på EV + P hadde ikke høyere forekomst av bivirkninger enn den totale studiepopulasjonen til tross for at de hadde blitt behandlet med flere sykluser. Utfordringer knyttet til EV + P er vurdering av dosejusteringer og håndtering av bivirkninger, blant annet i form av nevropati, utslett, hyperglykemi og tørre øyne. Og hvor lenge skal behandlingen fortsette hos pasienter med komplett respons?
An andre presentasjoner var det CHALLENGE-studien som imponerte meg mest (5). Denne randomiserte fase 3-studien inkluderte 889 pasienter som hadde fullført adjuvant kjemoterapi etter kirurgi for tykktarmskreft. Halvparten ble randomisert til strukturert trening, halvparten til en enkelt økt med helse-edukasjon. Etter åtte år hadde treningsgruppen bedret residiv-fri overlevelse og totaloverlevelse, med totaloverlevelse på 90,3 %, sammenlignet med 83,2 % i helse-edukasjonsgruppen, med HR på 0,63 (95 % KI 0,43–0,94). Denne studien burde ha vært på Presidential Session, men det var den altså ikke, og det er dessverre kanskje illustrerende for faget vårt at det er nye medikamenter som trekkes frem på kongresser. Denne studien var så vidt jeg vet den første randomiserte treningsstudien som har hatt overlevelse som primært endepunkt. Vi vet også at fysisk aktivitet kan gi redusert forekomst av en rekke bivirkninger
under og etter behandling, samt reduserer risikoen for en rekke ikkekreftrelaterte sykdommer. Vi som jobber innen kreftfaget, både leger og sykepleiere, bør oppfordre alle kreftpasienter og overlevere til regelmessig trening. Det er sannelig bra at stadige flere norske sykehus har fått Pusterom!
CHICAGO OG DELSTATEN
MICHIGAN
Chicago er en fantastisk by med 2,7 millioner innbyggere i selve byen. Byen ligger i delstaten Illinois, og over halvparten av innbyggerne i denne delstaten (9.6 millioner innbyggere) bor i Chicago og dens «metropolitan area». Selv om dette er en storby med massive høyhus, er det nærhet til vannet og flotte turstier både langs Lake Michigan og langs Chicago-elven som renner gjennom sentrum av byen. For en nordboer som meg er arkitekturen helt imponerende! Vi var på et arkitektur-cruise på Chicago-elven en solrik ettermiddag, og det er imponerende å se hvordan de har klart å bygge på en utrolig innovativ og arkitektonisk lekker måte, og samtidig sørge for å ivareta gamle bygg og sørge for gode friarealer.
Etter fire intense og lærerike dager på McCormic Place dro mannen min og jeg på en liten rundtur i delstaten Michigan. Det var kult å bli plukket opp utenfor kongress-senteret i en lekker leid rød Jeep, forlate Chicago og «hit the road». Vi hadde valgt ut østkysten av Michigan-sjøen for vår fire dagers rundtur – dette området kalles også for Gullkysten på grunn av de vakre, lange, gylne sandstrendene. Første stopp var lunsj i Saugatuck, en superkoselig liten by sør på østkysten.
Vi kjørte videre til Muskegon, hvor vi overnattet på et koselig hotell rett ved vannet. Påfølgende dag kjørte vi småveier gjennom utrolig vakre landbruksområder, der høydepunktet var å besøke Sleeping Bear Dunes nasjonalpark, et område med enorme sanddyner.
Vi hadde to dager i Traverse City nokså langt nord i Michigan, og bodde på et hotell på stranden med vakre solnedganger og nærhet til byen med gode restauranter og områder med vakre skoger. Vi brukte en dag på å utforske Old Mission Peninsula i nærheten av Traverse City, og det var en stor og gledelig overraskelse at det her, langt nord, var mange vingårder. For en vin-nerd som meg var det stor stas å dra innom flere vingårder og smake vin produsert i Michigan, men kvaliteten på vinene er ikke helt som i Europa eller California – enda. Vingårdene i Michigan er nokså nyetablerte, og hvem vet hvordan kvaliteten på vinen herfra er om ti år! Overalt hvor vi reiste var folk utrolig imøtekommende og nysgjerrige på hvor vi kom fra, og det var tydeligvis ikke vanlig med europeiske turister i denne delen av USA. Siste stopp før retur hjem til Norge var South Haven, sørover langs kysten, en liten perle av en ferieby med koselig bebyggelse og endeløse sandstrender.
Fulle av nye opplevelser – en herlig blanding av faglig påfyll, storbykaos, landsbygd i Michigan og strandliv –dro vi fornøyde hjem til Norge. ASCO og Chicago er definitivt fortsatt verdt å besøke for norske onkologer, selv i en turbulent verden.
Jeg var førsteårsstudent i Krakow da Grey’s Anatomy kom på skjermen for første gang. Vi satt tett i tett og så nedlastede episoder med Dr. Bailey, Dr. 007 og ikke minst McDreamy. Min ikke så hemmelige drøm var alltid å bli Dr. Montgomery-Shepard, gynekologen med høye hæler og rak rygg, som reddet babyer i mors mage. At jeg skulle bli gynekolog var det aldri noen tvil om. At jeg siden havnet i onkologien var mer tid og sted kombinert med et fristende ph.d.-prosjekt. At jeg en dag også skulle befinne meg i det amerikanske systemet og jobbe som lege virket helt urealistisk, men her er jeg nå (bilde 1).

PERNILLE BJERRE TRENT
MD ph.d., Overlege
Kreftkirugisk avdelingen, seksjon for gynekologisk kreft, Oslo Universitetssykehus, Oslo, Norge
For tiden fellow ved Memorial Sloan Kettering Cancer Center, New York, USA
VEIEN TIL AMERIKA
Takket være en motiverende og støttende veileder og mentor, Ane Gerda Eriksson, som selv har vært fellow ved Memorial Sloan Kettering Cancer Center (MSKCC), ble jeg oppfordret til å søke på det internasjonale fellowshipet til MSKCC. Da tilbudet om plass kom, var betenkningstiden på cirka null sekunder. Med en støttende ektefelle var det ingen tvil om at vi skulle begi oss ut på eventyr. Foran meg ventet
ett år med lesing for å bestå obligatoriske eksamener. For å jobbe klinisk i USA må man ha gjennomført «the United States Medical Licensing Examination» (USMLE). USMLE består av tre eksamener og en språkprøve for ikke-engelsktalende. Det ble et dypdykk, godt hjulpet av “First Aid for the USMLE” (ja, den finnes for step 1, 2 og 3), YouTube, kommersielt tilgjengelige question banks og podcaster. Jeg var på det tidspunktet i en fordypningsstilling, og fleksibel


arbeidstid under ph.d.-skriving lot seg kombinere med å lese til USMLE til alle døgnets tider. Selve papirmøllen for lisens, visum og arbeidstillatelse har til tider virket uoversiktlig og evigvarende, men nå er vi her og den er et glemt kapittel.
Jeg skriver dette med en vakker utsikt over Upper East Side og East River, fra leiligheten vår i 28. etasje, kun fem minutters gange fra min nye arbeidsplass. Solnedgangen over vestlige Manhattan farger himmelen i blått og rosa, og temperaturen har nettopp falt under 30 grader (sommeren i New York er varm – utendørs vel å merke, inne er det aircondition som gjelder). Jeg er hjemme etter en lang dag på operasjonsstuen. Ved siden av meg ligger callingen. Jeg har ansvar for egne pasienter døgnet rundt på hverdager, så skulle noe oppstå får jeg en calling fra residenten (LIS) som har tilstedevakt.
OM MEMORIAL SLOAN
KETTERING CANCER CENTER MSKCC ble grunnlagt som New York Cancer Hospital i 1884 som den første
2: Fun fact: visitt kalles “rounds” fordi man fra gammelt av trodde bakterier levde i hjørner, og ved å eliminere hjørner i rommet kunne man også redusere antall infeksjoner. På bildet ser man at den originale MSKCC-bygningen på Upper West Side var rund.
institusjonen i USA dedikert utelukkende til kreftbehandling. Det første sykehuset lå på Upper West Side (bilde 2). Sykehuset skiftet senere navn til General Memorial Hospital for the Treatment of Cancer and Allied Diseases. I 1948 ble Sloan Kettering Institute etablert av Alfred P. Sloan og Charles F. Kettering. I 1980 fusjonerte Memorial Hospital og Sloan Kettering Institute og dannet MSKCC.
Flertallet av fasilitetene ligger på Upper East Side på Manhattan, men klinikker finnes også på andre steder i New York og New Jersey. Den aller nærmeste lokalisasjonen ligger like over veien fra hvor vi bor. Der utføres dagkirurgiske inngrep med høy effektivitet.
MSKCC er blant verdens ledende institusjoner innen kreftbehandling. Nylig ble MSKCC kåret til verdens beste kreftsykehus av Newsweek.
I 2021 hadde sykehuset 24 000 pasientinnleggelser, over 732 000 polikliniske besøk og over 1900 pågående kliniske studier. Det tilbys over 100 kliniske utdanninger, inkl. fellowship-
programmet jeg nå er en del av. I 2021 ble det donert over 600 millioner USD til MSKCC for kreftbehandling, forskning og utdanning.
GYNEKOLOGISK KREFT VED MSKCC
Avdelingen har 15 overleger (attendings) som alle opererer. All medikamentell behandling styres av onkologer. Avdelingen har totalt 14 fellows (se under). Seks fellows på første- og andreåret, og åtte på tredjeog fjerdeåret. Jeg er ansatt som fellow på lik linje med mine amerikanske co-fellows. I avdelingen er det også ti faste physician assistants (PAs) og rundt 5–7 residents som roterer hver måned fra ulike universiteter i USA.
HVA ER EN FELLOW?
En fellow er under subspesialisering, og har allerede fullført sin spesialitet (residency), i mitt tilfelle fødselshjelp og kvinnesykdommer (gynekolog). Fellowship har ulik lengde, men innenfor gynekologisk kreftkirurgi på MSKCC er det på fire år. Tre nye fellows begynner hvert år. På tredjeåret utvides antall fellows med én
person når den internasjonale fellowen ankommer. I år er dette meg. De første to årene er dedikert forskning og kjemoterapi, mens de to siste er dedikert kirurgisk trening. Formålet med fellowshipet er at man skal utdannes til selvstendig gynekologisk kreftkirurg.
Det er derfor alltid totalt åtte kliniske fellows som roterer på ulike kirurgiske team. Hvert team består av en gruppe overleger som har ulike operasjonsdager, slik at fellowen kan assistere dem på sine operasjonsdager. Mens hver overlege opererer rundt to dager i uken, opererer fellows minst dobbelt så mye (avhengig av om det er to eller tre overleger per team, og hvor ofte disse opererer). På denne måten eksponeres fellows for et stort volum på kort tid. Man opererer da sammen med gitte overlege, og det er en konstant mester-svenn-opplæring.
Det er forventet at man kan gjøre det meste av gynekologisk kreftkirurgi selvstendig ved fullført fellowship.
Vi roterer mellom ulike team og hver rotasjon varer én måned. De fleste rotasjoner er innenfor gynekologisk kreft, men vi roterer også til kolorektal-kirurgi og stråleterapi, i tillegg til to årlige “electives” dedikert til fordypning innen valgfritt emne.
Vi har ansvar for pasientene vi har operert frem til utskrivelse. Vi går daglig visitt på teamets operasjonspasienter, noe som sikrer kontinuitet og forhindrer at vi mister viktige opplysninger. Som jeg skrev innledningsvis, har vi selv ansvar for egne pasienter på ukedager. Skulle noe oppstå på natten tar residenten kontakt med
gitte fellow for vurdering. I helgene er det et turnussystem og man dekker hele avdelingen, og fellows på gynkreft har 4–5 vakthelger i året.
Overlegene følger opp sine egne pasienter på poliklinikken, ofte i samarbeid med onkologene som administrerer kjemoterapi. Hvis pasienten senere skulle få tilbakefall, kommer hun tilbake til den samme overlegen som hun først ble behandlet av. Pasient-lege-forholdet er sterkt og varig for mange.
Overlegene følger opp egne pasienter, pasienter som er henvist direkte til dem eller som er henvist til sykehuset og havner hos dem via en rotasjon mellom overleger. Når operasjonsindikasjonen er etablert, settes pasienten opp til operasjon hos respektive overlege. Alle overlegene har faste operasjonsdager og poliklinikkdager.
MSKCC har ikke eget spesialiseringsprogram for residents; disse roterer fra ulike institusjoner i hele USA, én måned av gangen. Til tross for at man kunne frykte at rotasjonene ville medføre lite kontinuitet, er residents som kommer meget motivert og de ønsker ofte å gå videre til et gyn-kreftfellowship. De avlaster resten av teamet, særlig fellows og gjør det meste av papirarbeidet og daglige bestillinger, samt henvendelser til andre spesialiteter. Etter sin rotasjon blir de vurdert basert på prestasjonen under rotasjonen, noe som er viktig for vurderingen når de senere skal søke fellowship. De ønsker derfor å være på tilbudssiden og å gjøre en god jobb.
Ved MSKCC utføres alle typer gynekologisk kreftkirurgi, og sykehuset er kjent for å være innovativt. De fleste overlegene gjør de fleste inngrep selv, med varierende støtte fra andre spesialister. Det utføres rundt 3000 kirurgiske inngrep per år innen gynekologisk kreft ved MSKCC, til sammenligning har vi cirka 700 innenfor gynekologisk kreft ved Radiumhospitalet.
Dagene begynner alltid med rounds (visitt) sammen med PA og resident. Etter rounds sendes en skriftlig oppdatering til teamet på innlagte pasienter.
Deretter trilles første pasient inn rundt kl. 07.30, og man opererer til dagens program er fullført. Dette medfører at operasjonsdagene er lengre enn jeg er vant til hjemme. Jeg vil anslå at vi opererer dobbelt så mange på en dag som vi gjør ved Radiumhospitalet. Dette
fordi man utnytter operasjonsstuene bedre med tanke på tidsrommet de er i bruk. Har man en ø-hjelp må de tas innimellom det elektive programmet, noe som sjelden er populært. Man opererer til man er ferdig med dagens program, noe som kan variere fra tidlig ettermiddag til over midnatt dersom inngrepene trekker ut, men som regel et sted midt imellom. Anestesi og operasjon stiller med personale. Det er ofte én kontordag i uken hvor man forbereder seg på kommende ukes kasus (bilde 3).
Operasjonene utføres ved to forskjellige beliggenheter: hovedsykehuset har 22 operasjonsstuer, ni av dem med robot, mens Josie Robertson har 13 operasjonsstuer, hvorav fire med robot. I forkant av alle inngrep må fellows sørge for at alle nødvendige opplysninger om pasienten er klargjort før inngrepet (f.eks. CT, patologi, medisinsk tilsyn ved behov). Fellows tilser også de fleste pasienter preoperativt operasjonsdagen. På operasjonsstuen hjelper legene til med forberedelser, og det er da heller ikke rom for klager på dårlig dekking eller posisjonering.
Det avholdes ukentlig internundervisning og MDT-møter. Oppmeldte pasienter presenteres av førsteårsfellows, som også skal komme med et forslag til videre behandling basert på en litteraturgjennomgang de har gjort på forhånd. Det quizzes fra overlegene i salen for å sikre at evidensen holder mål. Det er også regelmessige møter innad i de ulike diagnose-spesifikke gruppene, i tillegg til journal clubs og generell forskningsundervisning. Sykehuset har et stort bibliotek for ansatte.
Det er et privilegium å få jobbe og lære her. Men det er også et privilegium å vite at man skal hjem til norske arbeidstider etter endt tjeneste. Staten New York tillater opp til 80 timers arbeidsuker, med minst åtte timer hvile i døgnet. Hvis man går hjem kl. 22, kan man være tilbake kl. 06 neste morgen for rounds. Og sånn går dagene.
Arbeidskulturen er annerledes enn hjemme og moralen er høy. Tross lange dager har jeg til gode å oppleve at noen klager. Folk vil jobbe her og er stolte av arbeidsplassen sin. Samtidig vet arbeidsgiver å sette pris på sine ansatte i form av f.eks. frokostmøter og hyggelige kveldssamlinger. Mange har jobbet hardt og lenge for å få jobb nettopp her, det er en stor ære, og det gir mange muligheter å jobbe her.
Vi er heldige i Norge som har våre sosiale rettigheter, spesielt sykelønn og foreldrepermisjon. Amerikanske kolleger jobber frem til fødsel, og begynner vanligvis å jobbe igjen etter 8–10 uker når barnepasser eller barnehage tar over. Jeg har ikke hørt om noen som f.eks. er sykmeldt, heller ikke under graviditet (og ja, det fødes barn under fellowship).
Jeg har blitt overveldet over velkomsten vi har fått. Alle er svært interesserte i hvem vi er og hvor vi kommer fra. I tillegg har alle vært svært hjelpsomme med diverse praktiske utfordringer. Allerede første helgen var det en 4. julifeiring hos en av overlegene. Det var et hyggelig familiearrangement med baseball og vannballonger for barna,
samt fyrverkeri over Hudson-elva på kvelden.
Det finnes flere strender innen rekkevidde for en dagstur fra New York, og vi har fått mulighet til å utforske flere av dem. I tillegg er Central Park ikke langt fra leiligheten, med flere lekeplasser og løpetilbud. New York har uendelig med muligheter innenfor kulturliv og kulinariske opplevelser, så her er det heller tid og lommeboken som setter grenser snarere enn fantasien.
Så hvordan er det å jobbe som kirurg i USA sammenlignet med Grey’s Anatomy? Kanskje ikke så veldig likt, tonen er veldig respektfull og ingen kjefter og smeller. Men legene jobber definitivt mye og skiftetiden mellom inngrep kan være imponerende kort. Det er stort fokus på utdanning og det stilles høye krav til kunnskap generelt (quiz på operasjonsstuen må man forvente). Det er mye støttepersonell som gjør slik at leger kan gjøre lege-oppgaver.
Oppholdet vårt har så vidt begynt. Vi trives veldig godt, og gleder oss til tiden fremover. MSKCC er et stort maskineri med stort kirurgisk volum og faglig meget høyt nivå. Jeg gleder meg til å utvikle meg som kirurg i de to årene som kommer, før jeg returnerer hjem til Radiumhospitalet og det norske kreftmiljøet. Vi er gode i Norge, men vi har også mye å lære. Samtidig vil jeg benytte anledningen til å takke Norsk onkologisk forening for støtten jeg har mottatt i forbindelse med reisen hit. Tusen takk!

HANNE TØNDEL
Onkolog
St. Olavs hospital
Hvert år siden 1992 deles Kong Olav Vs kreftforskningspris ut til en kreftforsker eller en forskergruppe som har bidratt til å fremme den norske kreftforskningens kvalitet og omfang. Prisen er på én million kroner og deles ut av H.M. Kong Harald i en høytidelig markering. Prisvinneren holder også et innlegg ved Onkologisk Forum i november samme år.
(FRA KREFTFORENINGENS
NETTSIDE):
«Karl-Johan Malmberg (53), er en pioner innen celleterapi, med betydelige bidrag både nasjonalt og internasjonalt. Han har vært avgjørende i å utvikle en komplett pipeline fra grunnforskning til klinisk implementering av nye celleterapier i Norge. Som hematolog har han gjort banebrytende oppdagelser innen NK-cellebiologi, noe som allerede har påvirket behandlingen av 600 pasienter. Malmberg leder flere internasjonale samarbeid og har sikret betydelige tilskudd. Han har en imponeren-
de publikasjonshistorikk og er anerkjent som en leder i NK-samfunnet. I Norge har han styrket forskningsmiljøet og veiledet mange ph.d.-studenter og postdoktorer. Han leder også Precision Immunotherapy Alliance (PRIMA) og er vitenskapelig direktør for Center for Advanced Cell and Gene Therapy.”
Vi har tatt en prat med årets prisvinner som for tiden befinner seg i Frankrike hvor han har et forskningsopphold ved CIML, Centre D’immunologie Marseille-Luminy, et av de ledende immunologiske laboratorier i Europa.
Karl-Johan Malmberg studerte medisin ved Karolinska Institutet i Stockholm og ble spesialist i hematologi ved Karolinska universitetssykehus. Før medisin studerte han også til sammen to år med matematikk, astronomi og filosofi i Gøteborg og biomedisin i Uppsala. Han tok sin ph.d. i 2003 ved Karolinska Institutet med tittel: «Mechanisms of Immune Escape – Implications for Immumotherapy Against Cancer»
Malmberg har jobbet i Norge siden 2012 og vært tilknyttet avdeling for kreftimmunologi ved Institutt for kreftforskning ved OUS. Han har hatt sitt professorat ved Institutt for klinisk medisin, UiO siden 2012 og hvor han nå har sin hovedstilling i rollen som leder for Precision Immunotherapy Alliance (PRIMA).
I vår samtale kan han røpe at det var de flotte skisporene i nærheten av Oslo som lokket ham til Norge i sin tid og karakteriserer seg selv som sportsgal. Nå er det mest tennis i tillegg til orientering og seiling. Han er gift med Jenny-Ann som er fysiker og forsker. Han forteller at de også har jobbet sammen i perioder hvor hun utviklet matematiske modeller for hvordan NK-cellenes repertoar dannes. Nå jobber hun i et nytt og spennende firma i Oslo. Sammen har de tre barn på 14, 17 og 17 år. Dette året tilbringes i Frankrike (Aix-en-Provence) hvor barna går på en internasjonal skole, og med mål om at hele familien skal lære seg litt fransk. «Min farmor Yolande var från Rennes, Bretagne så på ett sätt kan man säga att vi söker lite rötter» forteller Karl-Johan.
Nye prosjekt på gang?
”Alltid! En ny spännande utveckling i labbet är att försöka förstå de underliggande cellbiologiska mekanismer som gör att immunceller kan ladda

om och döda fler cancerceller. Hur kan vi få NK-cellerna att bibehålla sin funktion när de angriper tumörceller och utsätts för den suppressiva mikromiljön i tumören. Här använder vi en kombination av genetisk manipulation och avancerad mikroskopi. Och
så är vi givetvis väldigt spända på hur potenta våra framodlade NK-celler är i de kliniska studier som startar tidigt nästa år”.
Vi gratulerer prisvinneren!

KRONISK LYMFATISK LEUKEMI
• I kombinasjon med venetoklaks med eller uten obinutuzumab til behandling av voksne pasienter med tidligere ubehandlet kronisk lymfatisk leukemi (KLL).
MANTELCELLELYMFOM
• I kombinasjon med bendamustin og rituksimab (BR) til behandling av voksne pasienter med tidligere ubehandlet mantelcellelymfom (MCL) som ikke er kvalifiserte for autolog stamcelletransplantasjon (ASCT).
• Som monoterapi er indisert til behandling av voksne pasienter med residiverende eller refraktær (RR) MCL som ikke tidligere har fått behandling med en BTK-hemmer.
INNFØRT AV BESLUTNINGSFORUM FOR NYE METODER (25.08.2025) FOR2
KRONISK LYMFATISK LEUKEMI
• I kombinasjon med venetoklaks med eller uten anti-CD20-antistoff, til behandling av 1. linje KLL.
MANTELCELLELYMFOM
• Som monoterapi til behandling av voksne pasienter med RR MCL som ikke tidligere har fått behandling med en BTK-hemmer.
H-resept finansiering kun etter resept fra sykehuslege eller avtalespesialist. Calquence inngår i Helseforetakenes anbefaling for onkologiske legemidler og rekvirering skal gjøres i tråd med disse.3
Viktig informasjon om Calquence (akalabrutinib)
Indikasjoner: Som monoterapi, eller i kombinasjon med obinutuzumab, til behandling av voksne pasienter med tidligere ubehandlet kronisk lymfatisk leukemi (KLL). Som monoterapi til behandling av voksne pasienter med KLL som har fått minst én tidligere behandling. I kombinasjon med venetoklaks med eller uten obinutuzumab til behandling av voksne pasienter med tidligere ubehandlet KLL. I kombinasjon med bendamustin og rituksimab (BR) til behandling av voksne pasienter med tidligere ubehandlet mantelcellelymfom (MCL) som ikke er kvalifiserte for autolog stamcelletransplantasjon (ASCT). Som monoterapi til behandling av voksne pasienter med residiverende eller refraktær MCL som ikke tidligere har fått behandling med en BTK-hemmer. Dosering: Behandling med dette legemidlet skal igangsettes og følges opp av lege med erfaring i bruk av legemidler mot kreft. Voksne: Anbefalt dose som monoterapi eller i kombinasjon er 100 mg 2 ganger daglig. Behandling bør fortsette inntil sykdomsprogresjon, uakseptabel toksisitet eller til det er fullført 14 behandlingssykluser (hver syklus er på 28 dager) når kombinert med venetoklaks. Forsiktighetsregler: Alvorlige blødninger, inkl. blødning i CNS og gastrointestinal blødning er sett. Pasienter som bruker antitrombotiske midler kan ha økt risiko for blødning og forsiktighet skal utvises ved bruk. Warfarin eller an-dre vitamin K-antagonister skal ikke gis samtidig med akalabrutinib. Atrieflimmer/flutter forekom hos pasienter med hematologiske maligniteter både ved monoterapi og i kombinasjon med obinutuzumab. Overvåk for symptomer på atrieflimmer og atrieflutter og foreta EKG om nødvendig. Ved høy risiko for tromboembolisk sykdom, skal nøye kontrollert behandling med antikoagulanter og andre be¬handlingsalternativer vurderes. Tumorlysesyndrom (TLS) har blitt rapportert ved behandling med Calquence. Pasienter som anses å ha risiko for TLS (f.eks. med stor tumormasse ved baseline) bør vurderes for mulig risiko for TLS og overvåkes nøye som klinisk indisert. Interaksjoner: Samtidig bruk av sterke CYP3A-hemmere eller CYP3A-induktorer skal unngås; kan gi hhv. økt og redusert eksponering for akalabrutinib. Bivirkninger: Monoterapi: Vanligste bivirkninger(≥ 20 %): Infeksjon, diaré, hodepine, muskel- og skjelettsmerter, blåmerker, hoste, artralgi, fatigue, kvalme og utslett. Kombinasjonsbehandling: Vanligste bivirkninger (≥ 20 %): Infeksjon, muskel- og skjelettsmerter, diaré, hodepine, blåmerker, leukopeni, nøytropeni, trombocytopeni, anemi, hoste, fatigue, artralgi, kvalme, utslett, svimmelhet, oppkast og forstoppelse. Pakninger og priser: 60 stk. (blister) kr 69.842,20. Reseptgruppe C. For mer info om Calquence, se www. felleskatalogen.no eller godkjent SPC.
NO-14484-08-25-ONC
Referanser: 1. Calquence® (acalabrutinib), Summary of Product Characteristics, www.ema.europa.eu 2. Beslutningsforum for Nye Metoder ID2024_073, ID2025_042, www.nyemetoder.no/sok/?q=akalabrutinib 3. www.sykehusinnkjop.no/avtalerlegemidler/onkologi/

www.astrazeneca.no
Kreftavdelingen i Helse Førde er en selvstendig avdeling som ligger under medisinsk klinikk og behandler pasienter med kreft i Sogn og Fjordane, med 110 000 innbyggere. Avdelingen har en egen sengepost med ti senger, og en poliklinikk med ti kreftsykepleiere. Avdelingen har vokst mye de siste årene, og har nå fire overlegestillinger i onkologi, tre i hematologi, én i palliasjon, og fem LIS (tre i onkologi og to i hematologi).
NIENKE DE GLAS
Overlege og forsker
MATHIAS HVIDSTEN LIS i onkologi
KNUT ERIK FOLLAND
Avdelingssjef
Avdelingen behandler de fleste krefttyper, og har et tett samarbeid med Helse Bergen med flere felles MDT-møter hver uke. Poliklinikken blir drevet i Førde, men vi samarbeider med infusjonspoliklinikker på Nordfjord sykehus og Lærdal sykehus. Aktiviteten på kreftpoliklinikken har økt i stor grad de siste årene. Antallet intravenøse behandlinger har økt med 44 % i Førde på kun fem år (figur 1). På Lærdal og Nordfjord sykehus har aktiviteten tredoblet seg på fem år, til 1700 kurer i 2024. Dette har ført til en travel hverdag og en voksende avdeling med flere nye stillinger de siste årene.
Det økende presset på avdelingen har vært en av grunnene til at vi har jobbet med et omfattende forbedringsprosjekt, som vi kaller «Prosjekt VISJON». I dette prosjektet har vi delt oss i fem grupper (poliklinikk, sengepost, veiledning, palliativt team og forskning). Vi har utarbeidet nye rutiner og fokusert på effektivisering og oppgaveglidning mellom leger, sykepleiere og sekretærer. Det har skapt et godt miljø der alle på avdelingen kan bidra og gi innspill til forbedringspotensial i arbeidsflyten. I tillegg deltar avdelingen i et Helse Vest-prosjekt hvor det skal implementeres en app for kartlegging av kreftpasientene fra avstand.
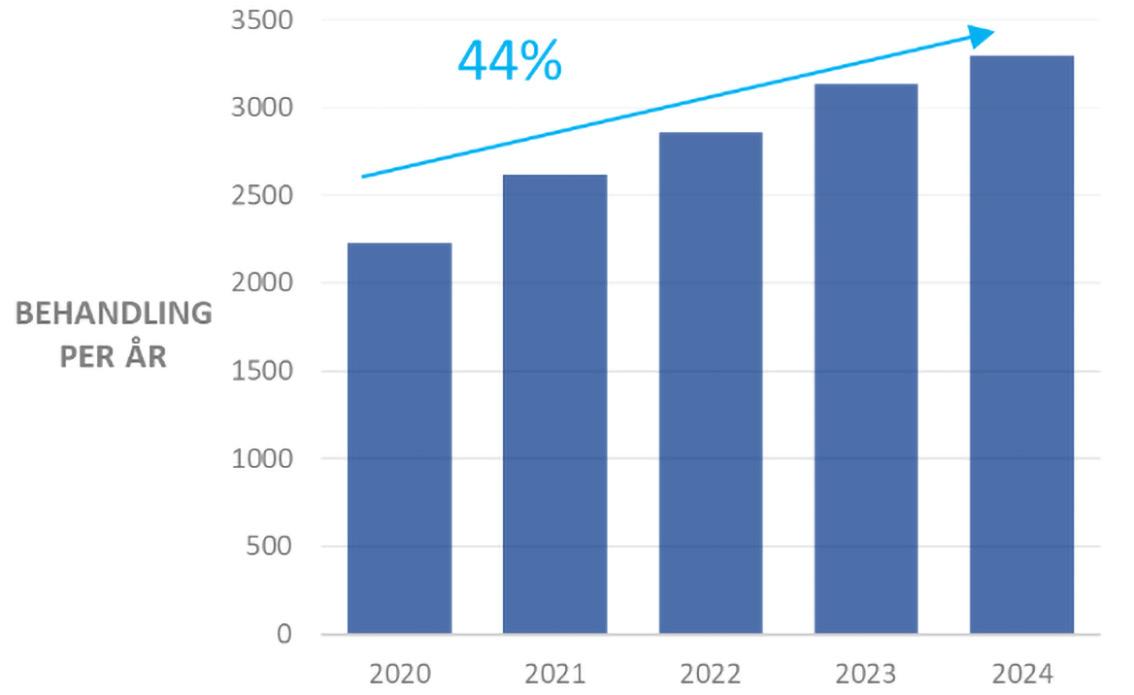

Ettersom avdelingen er relativt liten og legene behandler mange forskjellige krefttyper, er det viktig for oss å ha et miljø hvor vi har en lav terskel for å konferere pasienter med hverandre. Derfor har vi et poliklinikkmøte to ganger hver uke der overleger og LIS diskuterer kompliserte pasienter. Vi har et åpent arbeidsmiljø og samarbeider godt med hverandre. Det skal være lav terskel for at LIS kan konferere om pasientene sine.
Avdelingen har en detaljert opplærings- og veiledningsplan for LIS med rullering mellom tumorgrupper og de forskjellige delene innenfor onkologi og hematologi. Hver uke har vi en stor visitt på sengeposten hvor LIS presenterer de innlagte pasientene til alle overleger. Deretter diskuterer vi pasientene i plenum og LIS får dermed
mye læring og kvalitetssikring ut av de forskjellige problemstillingene.
Avdelingen satser på klinisk forskning. Vi deltar i forskjellige nasjonale og internasjonale kliniske studier. I tillegg leder vi et eget omfattende prosjekt hvor vi implementerer et pasienttilpasset forløp hos eldre pasienter med kreft (viser også til artikkel om IMPACTstudien i dette tidsskriftet). En av overlegene har en 40 % forskningsstilling, og LIS og sykepleiere får mulighet til å delta i forskning dersom de ønsker det. I tillegg har avdelingen to ph.d.-stipendiater.
Tilpasset behandling hos eldre pasienter med kreft er et område som avdelingen satser på, både i forskningssammenheng og i klinikken. Avdelingen har en egen geriatrisk
sykepleier som utfører geriatrisk screening hos eldre pasienter med kreft, slik at behandlingen kan tilpasses ut fra skrøpelighetsnivå. Vi samarbeider også med kommunene rundt oss for å forsterke oppfølgingen lokalt. Mange pasienter har lang reisevei til vårt sykehus, så et tett samarbeid med lokale ressurser er viktig for oss.
Avdelingen ønsker å være en attraktiv arbeidsplass for alle våre ansatte og legger vekt på et positivt arbeidsmiljø. Vi drar nytte av å være et mindre sykehus hvor vi har et tett tverrfaglig samarbeid med andre avdelinger. Målet framover er å videreutvikle gode og trygge utdanningsløp for våre LIS, forsterke forskningsmiljøet og å bygge videre på effektivisering og digitalisering av våre tjenester.


Finansiering over Helseforetak for indikasjonen JEMPERLI er indisert i kombinasjon med karboplatin og paklitaksel for førstelinjebehandling av voksne pasienter med primær fremskreden eller tilbakevendende endometriekreft og som er kandidater for systemisk behandling.1,3
*dMMR= Deficient mismatch repair **pMMR= Proficient mismatch repair
UTVALGT SIKKERHETSINFORMASJON / FORSIKTIGHET UTVISES VED: Immunrelaterte bivirkninger, som kan være alvorlige eller fatale, kan oppstå hos pasienter som behandles med antistoffer som blokkerer veien for det programmerte celledødprotein-1 / programmerte dødsligand 1 (PD-1/PDL1), herunder Jemperli. Immunrelaterte bivirkninger oppstår vanligvis under behandling, men symptomer kan også dukke opp etter at behandlingen er seponert. Pasienter skal overvåkes for symptomer og tegn på immunrelaterte bivirkninger. Se preparatomtalen kap 4.4 og kap 4.8 for ytterligere informasjon om immunrelaterte bivirkninger og håndteringen av disse, samt andre bivirkninger.
Referanser: 1. Jemperli preparatomtale. 2. https://www.nyemetoder.no/metoder/id2024_060/. 3. Mirza MR, et al. N Engl J Med. 2023;388(23):2145-2158
GlaxoSmithKline AS, Drammensveien 288, 0283 Oslo, Tlf. 22702000. ©2025 GSK Group of Companies. Trade marks are owned by or licensed to the GSK Group of Companies. All rights reserved. PM-NO-DST-ADVR-240001, Februar 2025.
Sikkerhetsprofil ved kombinasjonsbehandling1 JEMPERLI ble permanent seponert på grunn av bivirkninger hos 38 (6,3%) av pasienter med primær fremskreden eller tilbakevendende endometriekreft, hvor de fleste var immunrelaterte hendelser.1 Bivirkningene var alvorlige hos 11,2 % av pasientene; de alvorligste bivirkningene var immunrelaterte bivirkninger.1
Alle som forskriver JEMPERLI, skal dele ut og informere pasientene om pasientkortet samt forklare hva de skal gjøre hvis de opplever symptomer på immunrelaterte bivirkninger. Reseptgruppe C Pakning og maksimalpris: Hettegl 500 mg 92 318,20 kr.
Se preparatomtalen for full informasjon før forskrivning av Jemperli. Ved uønskede medisinske hendelser, kontakt GSK på telefon 22 70 20 00

Denne gang med innslag fra:
• Trondheim
• Oslo
• Ålesund
Hvem er du?
Rosilin Melve-Varughese, LIS3 ved lungeonkologisk seksjon, Radiumhospitalet.
Hva leser du nå?
Greven av Monte Cristo av Alexandre Dumas.
Hva handler den om?
Greven av Monte Cristo er en episk historie om forræderi, hevn og rettferdighet. Edmond Dantès er en ung, lovende sjømann som blir uskyldig fengslet etter at han blir forrådt av folk han trodde var venner. Han mister alt – sin frihet, sin forlovede, og sitt liv som han kjente det. Når han endelig en dag rømmer etter 14 år har han bare ett mål i sikte: hevn!
Hva blir neste bok?
Jeg har blitt anbefalt å lese "Humankind – A Hopeful History" (norsk tittel: «Folk flest er gode: en ny fortelling om menneskenaturen») av Rutger Bregman og tenkte jeg måtte prøve meg på den!
Onkologiske sommerleker ble første gang arrangert i juni 2024 i Trondheim og det ble i all beskjedenhet såpass vellykket at vi besluttet å gjøre det til en fast tradisjon ved vår klinikk. Her inviteres alle leger tilknyttet vår avdeling i en eller annen prosentstilling til fest og moro hjemme i Torgrim sin hage (som har vist seg å være en perfekt lokasjon på flere måter). Torgrim brygger også eget øl for anledningen som har fått det klingende navnet "Hematuripa". Vi koser oss med mat og drikke først før de offisielle Onkologiske sommerlekene starter. Alle blir delt inn i lag som konkurrerer mot hverandre og vi kan melde om stort konkurranseinstinkt hos mange og topp innsats fra samtlige deltakere.
Lekene gjenspeiler vårt dagligliv (om enn en smule fritt tolket) og omhandler bl.a. kommunikasjon, å holde seg innenfor rammene, høreprøver og hvordan man slipper kreftbomba. En egen variant av stol-leken er også en del av konkurransen og har blitt en snakkis i miljøet!
Begge årene har været vært helt fantastisk og det er slett ikke en selvfølge i Trøndelag.
Festkomiteen som består av Torgrim, Maja og Hanne synes dette har vært en superartig fest å arrangere og vi gleder oss allerede til neste års leker.
Hanne Tøndel


Aust for Kreftbygget ved Ålesund sjukehus står tre japanske kirsebærtre. Dette er ikkje fruktberande tre, men prydtre som er kjende for vakker bløming. Trea blømer før dei får særleg med blad, og det er fantastisk å stå under trea og sjå opp i dei tette, rosa blomane. Trea er til stor glede både for tilsette og pasientar og kvar vår snakker vi om at no nærmar bløminga seg. Etter bløminga kjem blada meir fram og treet blir grønt og fint, og bakken under trea blir for ei stund dekt av rosa kronblad.

Å oppleve vakre ting veit vi kan redusere stress og ha positiv påverknad på menneske. Det kan vekke kjensler og styrke fellesskap når ein deler det vakre med andre. Eg vil derfor slå eit slag for sjukehushagen- han kan være ein viktig ressurs for helse og livskvalitet.
Eg sender biletstafetten vidare sørover langs kysten, til Bergen og min gode kollega Christian Ekanger
Bjørg Yksnøy Aksnessæther, onkolog Ålesund sjukehus
Hanne Sigbjørnsen (f. 1989), kjent som Tegnehanne, er utdannet sykepleier og begynte sin populære tegneserieblogg i 2010. Med en etter eget utsagn «naiv, barnslig og veldig ærlig strek,» har hun både illustrert andres bøker og utgitt en rekke egne bøker, bl.a. Blod, svette og tress-is, Bare vent» og Tegnehanne blir mamma. Tegnehanne går fast i Pondus, og sammen med Therese G. Eide, Noor Eckhoff og Nora Dåsnes står hun bak Tusjkollektivet som går fast i Aftenposten.




OPDIVO in combination with YERVOY is indicated for the first-line treatment of adult patients with unresectable or metastatic mismatch repair deficient (dMMR) or microsatellite instability-high (MSI-H) colorectal cancer (CRC)1
CheckMate 8HW
72 % of patients were alive and progression-free at 2 years 1,3
adverse events3 *
*Data shown for patients who received at least one dose of the assigned treatment. All events between the first dose of treatment and 30 days after the last dose of treatment were reported. For patients who crossed over from the chemotherapy group to OPDIVO + YERVOY (the crossover group), data collected on or after the date that the patient received the first dose of OPDIVO + YERVOY were excluded, except for the number of deaths; †TRAEs leading to death were reported regardless oftime frame. Treatment-related deaths in the group that received OPDIVO + YERVOY were from myocarditis and pneumonitis (one patient each). In the chemotherapy group, one death (from acute myocarditis) occurred after the patient crossed over from chemotherapy to OPDIVO + YERVOY and was not related to chemotherapy.
1 OPDIVO SmPC.
2 www.nyemetoder.no
3 T. Andre et al. Nivolumab plus Ipilimumab in Microsatellite-Instability–High Metastatic Colorectal Cancer. N Engl J Med 2024;391:2014-2026.
VIKTIG SIKKERHETS- OG FORSKRIVNINGSINFORMASJON OPDIVO® (nivolumab)
Reseptbelagt legemiddel. Reseptgruppe C. Indikasjoner «Mismatch repair deficient» (dMMR) eller «microsatellite instability-high» (MSI-H) kolorektal kreft (CRC): I kombinasjon med ipilimumab til behandling av voksne pasienter med dMMR eller MSI-H kolorektal kreft til førstelinjebehandling av inoperabel eller metastatisk kolorektal kreft eller behandling av metastatisk kolorektal kreft etter tidligere fluoropyrimidinbasert kombinasjonskjemoterapi. For fullstendig oversikt over godkjente indikasjoner, fullstendig forskrivningsinformasjon se preparatomtale for Opdivo (nivolumab) og Yervoy (ipilimumab) på www.felleskatalogen.no. Bivirkninger og frekvensen av dis-
Scan to read more
se er avhengig av krefttype, dosering og eventuell kombinasjon med andre legemidler mot kreft, se preparatomtale. Advarsler og forsiktighetsregler: Immunrelaterte bivirkninger: Som for all immunterapi kan immunrelaterte bivirkninger oppstå i alle kroppens organer både under og etter avsluttet behandling. Immunrelaterte bivirkninger som påvirker mer enn ett system i kroppen, kan oppstå samtidig. Ved kombinasjonsbehandling med Opdivo og Yervoy (ipilimumab) kan immunrelaterte bivirkninger oppstå tidligere og i flere organsystemer samtidig sammenliknet med Opdivo monoterapi. Les mer om bivirkninger i preparatomtalene for Opdivo og Yervoy. Alt helsepersonell som forskriver immunterapi må ha kunnskap om behandlingsalgoritmer for immunrelaterte bivirkninger og hvordan disse klassifiseres. Tidlig identifisering og håndtering av immunrelaterte bivirkninger er viktig, og pasienter som behandles med immunterapi skal ha tett oppfølging både under og i etterkant av behandling. Andre viktige advarsler: Kan øke risikoen for transplantatavstøtning hos mottakere av solide organer. Alvorlige infusjonsreaksjoner er rapportert. Interaksjoner: Bruk av systemiske kortikosteroider og andre immunsuppressiva ved baseline skal unngås. Pasientkort finnes tilgjengelig på www.felleskatalogen.no eller ved å kontakte BMS. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning på elektronisk meldeskjema: www.dmp.no/meldeskjema. Bivirkninger bør også meldes til BMS på telefon 23 12 06 37. Opdivo gis som intravenøs infusjon eller subkutan injektion og doseres ulikt avhengig av tumortype og hvorvidt behandlingen gis i monoterapi eller i kombinasjon med andre legemidler mot kreft, se preparatomtalen. Pakninger, priser, refusjon Opdivo: Konsentrat til infusjonsvæske, oppløsning 10 mg/ml 4 ml (hettegl) 6 426,70 kr 10 ml (hettegl) 16 004,10 kr 12 ml (hettegl) 19 197,70 kr 24 ml (hettegl) 38 359,20 kr, Injeksjonsvæske, oppløsning 600 mg 38 359,20 kr. Yervoy: 5 mg/ml 10 ml (hettegl) 46 294,30 kr 40 ml (hettegl) 185 068,60 kr. LIS anbud 2025/2026 PD1/PD-L1 hemmer og legemidler i kombinasjon med disse. For fullstendig oversikt over godkjente indikasjoner inkludert restriksjoner innført av Beslutningsforum for nye metoder se link www.nyemetoder.no.
Bristol Myers Squibb Norge, Lysaker Torg 35
Versjon 17
Returadresse: Den Norske Legeforening Pb 1152 Sentrum 0107 Oslo

10.1
mPFS var 10,1 måneder (N=331, 95 % KI 9,5–11,5) med ENHERTU vs. 5,4 måneder (N=163, 95 % KI 4,4–7,1) med kjemoterapi*2,3 måneder mPFS3**
49%
risikoreduksjon 3
ENHERTU reduserte risikoen for sykdomsprogresjon eller død vs. kjemoterapi † med 49 % (N=494, HR 0,51; 95 % KI 0,40–0,64; P<0,001) 2,3
ENHERTU gav signifikant lengre progresjonsfri overlevelse og økt total overlevelse hos pasienter med HER2-lav mBC2,3
Dosering:
Anbefalt dose brystkreft: 5,4 mg/kg. Gis som iv. infusjon (ikke som støtdose eller bolus) 1 gang hver 3. uke (21-dagerssyklus) frem til sykdomsprogresjon eller uakseptabel toksisitet.
Før hver dose bør pasientene premedisineres med et kombinasjonsregime av 2 eller 3 legemidler (f.eks. deksametason med enten en 5-HT3-reseptorantagonist og/eller en NK1-reseptorantagonist, samt andre legemidler som indisert) til forebygging av kjemoterapiindusert kvalme og oppkast.
Vi anbefaler at du leser preparatomtalen før oppstart av behandling. Det er utarbeidet risikohåndteringsmateriell og pasientinformasjon for ENHERTU. Dette finner du på www.felleskatalogen.no eller ved å kontakte oss. Se preparatomtalen (SPC) for utfyllende informasjon om ENHERTU.
Reseptgruppe: C.
Pakninger, priser og refusjon:
Maksimal utsalgspris fra apotek: 100mg: 1 stk. (hetteglass) 22341,00 NOK. Se felleskatalogen ENHERTU «Daiichi Sankyo» ENHERTU inngår i anbefalinger fra RHF spesialistgruppe, og rekvirering skal gjøres i tråd de regionale helseforetakenes anbefalinger: Onkologi og kolonistimulerende legemidler 5
* BICR: Blinded Independent Central Review ** mPFS = median progresjonsfri overlevelse. mOS = median totaloverlevelse.
† Brukt kjemoterapi var eribulin (51.1%), kapecitabin (20.1%), nab-paklitaksel (10.3%), gemcitabin (10.3%), paklitaksel (8.2%) i henhold til legens valg.
Daiichi Sankyo Nordics ApS, Amagerfælledvej 106, 2300 København S • T: +45 88 44 45 45 • www.nordics.daiichi-sankyo.eu AstraZeneca AS, Karvesvingen 7. 0759 Oslo • T: +47 21 00 64 00 • www.astrazeneca.no
NO/ADC/07/25/0002
1. Cortes J et al., Enhertu longterm OS, Nature Medicine June 2024 2. ENHERTU® (trastuzumabderukstekan) preparatomtale EMA/SLV pkt. 4.1. 3. Modi S, Jacot W, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med. 2022;387(1):9-20. 4. https://www.nyemetoder.no/metoder/?q=Enhertu 5. https://www.sykehusinnkjop.no/avtaler-legemidler/onkologi
Studieresultater med ENHERTU hos pasienter med HR+/HER2-lav metastatisk brystkreft: måneder mOS3**
23.9
mOS var 23.9 måneder (N=331, 95 % KI 20.8-24.8) med ENHERTU vs. 17.5 måneder (N=163, 95 % KI 15.2-22.4) med kjemoterapi† (HR 0,64; 95 % KI 0,48-0,86; P=0,003) 2,3
INDIKASJON: ENHERTU som monoterapi til behandling av voksne pasienter med inoperabel eller metastaserende HER2-lav brystkreft som har fått tidligere kjemoterapi ved metastaserende sykdom eller fått sykdomstilbakefall under eller innen 6 måneder etter fullført adjuvant kjemoterapi.1
Utvalgt sikkerhetsinformasjon:
Utvalgt sikkerhetsinformasjon: Skal forskrives av lege og administreres under tilsyn av helsepersonell med erfaring innen bruk av kreftlegemidler. For å forebygge feilmedisinering skal hetteglassene sjekkes for å sikre at legemidlet som tilberedes og administreres er Enhertu (trastuzumabderukstekan) og ikke trastuzumab eller trastuzumabemtansin.
Interstitiell lungesykdom (ILD)/pneumonitt: Pasienter skal monitoreres for tegn og symptomer på ILD/pneumonitt og umiddelbart utredes ved mistanke om dette.
Nøytropeni: Komplett blodtelling skal foretas før oppstart av behandling og før hver dose, og som klinisk indisert.
Venstre ventrikkeldysfunksjon: Standard hjertefunksjonsundersøkelse (EKG eller MUGA skanning) skal foretas for å vurdere LVEF før oppstart av behandling og regelmessig under behandling som klinisk indisert.
Graviditet: Kan forårsake fosterskade.
Nedsatt nyrefunksjon: En høyere insidens av ILD/pneumonitt grad 1 og 2 (som medførte økt forekomst av seponering), og en høyere insidens av alvorlige bivirkninger, er sett ved moderat nedsatt nyrefunksjon. Pasienter med moderat eller alvorlig nedsatt nyrefunksjon skal monitoreres nøye for bivirkninger, inkl. ILD/ pneumonitt.
Bivirkninger:
De vanligste bivirkningene var kvalme, fatigue og oppkast. Behandling av bivirkninger kan kreve midlertidig avbrudd, dosereduksjon eller seponering av behandling.