Tarmens mikrobiota og emfysem s. 8

Binyreinsidentalomer s. 12


Trender for alvorlige betahemolytiske streptokokkinfeksjoner s. 20



Tarmens mikrobiota og emfysem s. 8

Binyreinsidentalomer s. 12


Trender for alvorlige betahemolytiske streptokokkinfeksjoner s. 20

Faktorer som kan øke risiko for residiv er1:
• Immunsvikt
• Tidligere CDI
• Sykehusopphold siste 3 måneder
• Protonpumpehemmer
• Høy alder

Utvalgt produkt- og sikkerhetsinformasjon DIFICLIR (fidaksomicin) 200 mg tabletter og granulat til mikstur, 40 mg/ml
Indikasjoner: For behandling av Clostridioides difficile-infeksjoner (CDI), også kjent som C. difficile-assosiert diaré (CDAD).
Tabletter: Hos voksne og pediatriske pasienter med en kroppsvekt på minst 12,5 kg. Granulat: Hos voksne, ungdom og barn 0 - < 18 år. For både tabletter og granulat skal det tas hensyn til offisielle retningslinjer for korrekt bruk av antibakterielle midler.
Vanligste bivirkninger: Vanlige: Forstoppelse, kvalme, oppkast.
Vanligste alvorlige bivirkninger: Overfølsomhetsreaksjoner inkl. alvorlig angioødem.
Interaksjoner: Forsiktighet utvises ved samtidig bruk av potente P-gp-hemmere.
Kontraindikasjoner: Overfølsomhet for innholdsstoffene.
Forsiktighetsregler: Fidaksomicin bør brukes med forsiktighet ved kjent allergi mot makrolider. Hvis det oppstår en alvorlig allergisk reaksjon, skal legemidlet seponeres og egnede tiltak igangsettes. Bør brukes med forsiktighet ved pseudomembranøs kolitt eller fulminant eller livstruende CDI, ved nedsatt lever- og nyrefunksjon. Granulat bør brukes med forsiktighet hos spedbarn < 6 måneder/< 4 kg.
Graviditet, amming og fertilitet: Graviditet: Det anbefales å unngå bruk under graviditet. Amming: Det må tas en beslutning om amming skal opphøre eller behandling avstås fra, basert på nytte-/risikovurdering. Fertilitet: Dyrestudier indikerer ingen effekt på fertilitet.
Dosering: Tabletter: Voksne og barn >12,5 kg: Standard dosering: Anbefalt dose er 200 mg (1 tablett) administrert 2 ganger daglig (1 tablett hver 12. time) i 10 dager. Utvidet pulsdosering: 200 mg tabletter administreres to ganger daglig for dag 1–5 (ingen tablett på dag 6) og deretter én gang daglig annenhver dag for dag 7–25. Hvis en dose blir glemt, skal den glemte dosen tas så snart som mulig, men hvis det snart er tid for neste dose, skal tabletten hoppes helt over. Granulat: Voksne: Anbefalt dose er 200 mg (5 ml) 2 ganger daglig (5 ml hver 12. time) i 10 dager. Ungdom og barn 0 - < 18 år: Anbefalt dose baseres på kroppsvekt og tas 2 ganger daglig (1 dose hver 12. time) i 10 dager.
Administrering: Tabletter: Kan tas med eller uten mat. Svelges hele sammen med et glass vann.
Granulat: Rekonstitueres av farmasøyt eller helsepersonell. Tas peroralt, eller via sonde.
Pakninger og priser: Tabletter 20 stk. (blister) kr 18 099,90. Granulat til mikstur: 1 stk. (glassflaske) kr 18 288,90.
Reseptgruppe C.
Basert på SPC godkjent av SLV/EMA: 12.12.2022.
PM-DG-NO-00003
For utfyllende informasjon om dosering, forsiktighetsregler, interaksjoner og bivirkninger – se felleskatalogen.no
Referanse: 1. https://www.helsedirektoratet.no/retningslinjer/antibiotika-i-sykehus/infeksjoner-i-abdomen#clostridioides-difficile-infeksjon. Sist faglig oppdatert 01.03.2022.
Tillotts Pharma AB | Gustavslundsv. 135, 167 51 Bromma, Sverige | Tel: +46 8-704 77 40 | nordicinfo@tillotts.com | www.tillotts.se
Styret i Norsk indremedisinsk forening:
Trond Vartdal
Leder
Knut Lundin
Nestleder
Cecilie H Nordmo
Styremedlem
Runa Andreassen
Styremedlem
Hamza Nahoui Leder NYI
Redaktører:
Stephen Hewitt
(ansvarlig redaktør)
OUS Aker
stehewi@online.no
T: 913 72 199
Ole Kristian H. Furulund (assisterende redaktør)
Kommuneoverlege i Bærum
Fagredaktører:
Bernt Aarli (Lungemedisin)
Haukeland universitetssykehus
Eystein Husebye (Endokrinologi)
Haukeland universitetssykehus
Gunnar Einvik (Lungemedisin) Akershus universitetssykehus/NTNU
Indremedisineren er et fagtidsskrift rettet mot norske leger som arbeider innen fagomådet indremedisin, med dets ulike retninger. Indremedisineren sendes ut til alle medlemmer av Norsk indremedisinsk forening (Nif), som for tiden er ca 3 400, samt til andre med interesse for faget.
Indremedisineren vil presentere
Forsidebilde
Foto: Steinar Skrede
Utgivelsesplan
Stephen Hewitt Redaktør Indremedisineren
Maria Seferowicz Høstmøtetkomitéen
Andrea Dobloug Spesialitetskomiteen
Rune Eilertsen Vara
Anita Suntharalingam Vara NYI
Maya Bass
Akuttmottaket, Bærum sykehus, mctbass@hotmail.com
Tone Svilaas OUS Aker tosvil@ous-hf.no
Trine Finnes (Endokrinologi) Sykehuset Innlandet/OUS
Guri Hagberg (Geriatri) OUS Ullevål
Camilla Hem (Geriatri) Diakonhjemmet
relevant faglig og fagpolitisk stoff fra norske miljøer, samt noe internasjonalt rettet stoff av allmen interesse. Vi ønsker å legge til rette for at terskel og takhøyde gir rom for en allment engasjert indremedisiner å ytre seg. Reproduksjon av materiale fra Indremedisineren må skje etter
Bestillingsfrist/ Levering Forfatterfrister Materiellfrist annonsører Posten Nr. 4 1/11 11/11 10/12
Annonsepriser 2025
Bakside 24.500,Omslagsside 22.000,-
Helside 20.500,1/2 side liggende 14.500,-
Årsavtale
Med fire innrykk oppnås min. 20% rabatt.
Annonseformat
Bredde x Høyde
1/1 side 210 mm x 297 mm + 5 mm
1/2 side liggende 210 mm x 148,5 mm + 5 mm
1/2 side stående 105 mm x 297 mm + 5 mm
Bakside 210 mm x 230 mm + 5 mm
Annonsemateriell
Høyoppløste PDF-filer, der fonter og høyoppløste bilder er inkludert.
Layout, produksjon og annonsesalg
Apriil Media AS
E-post: ragnar.madsen@apriil.no www.apriil.no



Disclaimer






• Informasjon, meninger og synspunkter som utgis i Indremedisineren tilhører forfatterne, og ikke nødvendigvis Norsk indremedisinsk forening eller redaksjonen.
• Publisering av artikler, annonser eller annen informasjon, betyr ikke nødvendigvis støtte eller aksept for disse.







• Redaksjonenen og utgiver gjør sitt beste for å sikre at legemiddeldoser og andre kvantiteter presenteres nøyaktig, men vi anbefaler leserne å bruke legemidler i samsvar med Felleskatalogen/Norsk legemiddelhåndbok.
• Indremedisineren og/eller utgiver kan ikke holdes ansvarlig for evt. feil eller konsekvenser som oppstår som følge av bruk av informasjon i tidsskriftet.
• Redaksjonen og utgiver anstrenger seg for ikke å publisere unøyaktige eller misvisende data, men forfatterne må selv ta ansvar for data, uttalelser og meninger som blir utgitt på deres vegne.
I en tid preget av økende geopolitisk uro og sikkerhetspolitiske spenninger, har behovet for solid helseberedskap fått ny aktualitet. Denne artikkelen skrives mens flere flyplasser i Norden er stengt eller driver med redusert kapasitet på grunn av droneangrep, cyberangrep og krenking av nasjonalt luftrom. Fredelige Norge er i rask endring.
Dette gjør at helsevesenet står overfor en kompleks utfordring: Hvordan sikre tilstrekkelig kapasitet og kompetanse til å håndtere kriser og krig, samtidig som den daglige driften opprettholdes? Svaret kan ligge i et styrket sivilt-militært samarbeid. Den offentlige helsetjenesten yter helsehjelp til både sivilbefolkning og militært personell. Dette gir gode muligheter for samhandling, men også sårbarheter. Forsvaret har begrenset kapasitet til avansert behandling og rehabilitering, og er derfor avhengig av det sivile helsevesenet ved større hendelser. Samtidig er mange militære sanitetspersonell ansatt i sivile helseforetak, noe som gir en naturlig kobling mellom sektorene (1). Gjennom avtaler mellom Forsvaret og helseforetakene, samarbeides det om utdanning, øvelser og kompetanseutvikling. Dette er en del av totalforsvarskonseptet, som omfatter gjensidig støtte mellom sivile og militære aktører i hele krise spekteret – fra fredstid til væpnet konflikt.

Fordelene ved et velfungerende sivilt-militært samarbeid er mange: Rask mobilisering av personell og ressurser ved masseskadehendelser; Felles
situasjonsforståelse og koordinering; Effektiv evakuering og behandling av både sivile og militære pasienter og Bedre utnyttelse av kompetanse og infrastruktur (1). I tillegg gir samarbeidet mulighet for felles øvelser og simuleringer, som styrker beredskapen på taktisk nivå. Erfaringer fra helseforetak som Vestre Viken viser at kontinuerlig samvirke med Forsvaret gir økt trygghet og operativ evne (2).
Samarbeidet er imidlertid ikke uten utfordringer. En av de største sårbarhetene er mangelen på helsepersonell – både sivilt og militært. Ved mobilisering vil Forsvaret trekke personell fra det sivile helsevesenet, noe som kan svekke kapasiteten i en allerede presset sektor. Dessuten vil helsepersonell som ressurs ofte være registrert som nettopp det –både militært og sivilt. Om f.eks. en anestesisykepleier har hovedstilling i et sykehus og en bistilling i Forsvaret, vil sykepleieren kunne fremstå som to ressurser. Men kan kun arbeide på én av arbeidsgiverne om gangen. Videre er det behov for tydeligere rolle avklaringer, bedre kommunikasjonslinjer og fleksible planer som kan tilpasses ulike krisescenarier. Helsedirektoratet og Forsvarets sanitet har påpekt at det haster å styrke den samlede helseberedskapen, og at dagens planer ikke er tilstrekkelige for å håndtere en fullskalakrig eller større katastrofer (3).
I denne sammenhengen blir breddekompetanse blant helsepersonell en strategisk ressurs. Leger og sykepleiere med bred klinisk erfaring – særlig innen akuttmedisin,
generell indremedisin, kirurgi og intensivbehandling – er avgjørende når systemene settes under press. I krisesituasjoner er det ikke spesialisering, men evnen til å håndtere det uforutsette, som avgjør kvaliteten på helsehjelpen. Breddekompetanse gir også større fleksibilitet i bemanning og oppgaveløsning, og kan bidra til å dempe effekten av personellmangel. Det bør derfor være et mål å bevare og styrke denne kompetansen i sykehusene. Både gjennom utdanning, praksis og øvelser.
Sivilt-militært samarbeid er ikke bare en teknisk øvelse – det er en tillitserklæring mellom sektorer som må fungere når samfunnet er som mest sårbart. I en tid der kriser ikke lenger er hypotetiske, men reelle, må helsevesenet være rustet – både i fred og i krig. Som en av flere strålende forelesere på årets høstmøte skal Jørn Einar Rasmussen (2) utdype sine erfaringer og tanker om sivilt-militært samarbeid på årets høstmøte. Det er et strålende program og jeg håper å treffe mange av dere på årets høstmøte. Vi sees der!
Hilsen
Trond Vartdal
Leder, Norsk Indremedisinsk forening
Kilder:
1 Helsedirektoratet (2024). Ber helsetjenesten legge planer for å kunne håndtere krig. ( https://www. helsedirektoratet.no/nyheter/ber-helsetjenestenlegge-planer-for-a-kunne-handtere-krig)
2 Rasmussen, J.E. (2022). Helseberedskap som sivilt-militært samarbeid. Tidsskrift for Den norske legeforening.( https://tidsskriftet.no/2022/10/leder/ helseberedskap-som-sivilt-militaert-samarbeid )
3 Helse Sør-Øst RHF (2022). Regional plan for siviltmilitært samarbeid. ( https://www.helse-sorost. no/siteassets/documents/helsefaglig/beredskap/ dokumenter/regional-plan-for-sivilt-militartsamarbeid.pdf )
I skrivende stund ser vi de mange høsttegn. Samtidig står våre høstmøter for tur, med nytt faglig påfylli arbeid, møter og forskning. I denne utgaven av Indremedisineren møter vi bredt og engasjerende fagstoff fra ulike deler av vårt fag – fra mikrobiota, emfysem, tilfeldige binyrefunn, hudinfeksjoner samt diverse annet faglig. Artiklene bygger på forskning og praktisk erfaring – og utfordrer oss til å forbedre oss - både når det gjelder under- og overbehandling.
Vi åpner med to solide fagartikler.
Anders Rotevatn og Rune Nielsen fra lungemedisinen presenterer ny forskning om tarmens mikrobiota, og sammenheng med kols og emfysem. Studien viser hvordan mikroorganismer i tarmen kan henge sammen med utvikling av emfysem, og reiser viktige spørsmål om en mulig tarm–lunge-akse som terapeutisk mål. Mikrobiotafeltet fremstår spennende på så mange felter innen våre indremedisinske fag.
Fra endokrinologien skriver Grethe Ueland og medforfattere om binyreinsidentalomer. Økende bruk av bildediagnostikk gjør dette temaet stadig mer relevant. Hva gjør vi når vi finner bildeforandringer på binyrene? Artikkelen omtaler dette temaet og gir anbefalinger om hvordan dette bør vurderes og følges opp.
Temadelen er denne gangen viet hud- og bløtdelsinfeksjoner som vi ser ved sykehusinnleggelser. Under ledelse av infeksjonsmedisiner Steinar Skrede som tema redaktør, presenteres fagartikler fra bakteriologi og resistensutvikling til diagnostikk og behandling – inkludert vurdering av pasienter med erysipelas og cellulitt, nekrotiserende bløtdelsinfeksjoner og bruk av hyperbar oksygenbehandling. Vi viser til egen introduksjon ved Steinar Skrede.
Vi bringer også stemmer fra spesialitetsforeningene. Kristian Løvås redegjør for arbeidet med å utvikle en ny nasjonal Norsk endokrinologisk journal, et spennende faglig initiativ. Trine Finnes omtaler nytt styre i Norsk endokrinologisk forening, som er inne i en god og strukturert fase.
Kristian Tonby, avgående leder i Norsk Forening for Infeksjonsmedisin, omtaler deres nyutviklede Nasjonal Metodebok for Infeksjonsmedisin. Denne er tilgjengelig for landets indremedisinere i web-versjon.
Fra nyremedisinen refererer Ivar Eide fra de nylig avholdte Nordiske nyredager i Oslo. Møtet samlet kolleger fra hele Norden. Eide redegjør for


stor faglig bredde, og han viste hvor sterkt nyremedisinen står i et tverrfaglig og internasjonalt fellesskap. En konklusjon etter møtet var at det nordiske fellesskapet må styrkes.
I tillegg har vi vært så heldige å kunne intervjue Legeforeningens president, Anne-Karin Rime. Som indre medisiner og anestesiolog deler hun sine perspektiver på faget, helsetjenesten og fremtiden for indremedisin og medisinen generelt. Hun peker på faglig identitet, breddekompetanse og helhetlig pasientforståelse som viktige kjerneverdier for vår profesjon.
Og husk! Årets Indremedisinske høstmøte 2025 går av stabelen 17.-18. oktober. Programmet presenteres med eget oppslag i dette nummer – og det er all grunn til å glede seg. Her kan vi møtes på tvers av spesialiteter og generasjoner. Vi håper å se mange av dere der!
Med vennlig hilsen Redaksjonen



Det nærmer seg årets høstmøte. Vi samles på Hotel Bristol 16. og 17. oktober. En gylden mulighet for faglig påfyll, treffe gode kollegaer og besøke utstillingene. Vi er veldig stolte av årets program, med flere kjente navn og spennende og nyttig faglig innhold.
På årets høstmøte blir det noe for enhver smak, fra forskjellige deler av indremedisinen. Vi vil blant annet få høre innlegg om både indremedisinere i krig og hva vi må forberede oss på i en ny verden, inkludert antibiotikautfordringer. Det blir også innlegg om blant annet blodplatesykdommer, akutt leversvikt, vurderinger rundt intensivbehandling hos eldre og implementering av «gjør kloke valg».
Det er enda noen plasser igjen, meld deg på i dag. Gratis for yrkesaktive medlemmer i Norsk indremedisinsk forening, inkludert lunsj begge dager. Bindende påmelding sikrer plass og riktig matbestilling.
Vi ses på Hotel Bristol!
Vennlig hilsen
Høstmøtekomiteen

Torsdag 16. oktober 2025
Tid Aktivitet/Tema
09:00 - 09:40 Når blodplatene sviktar: Frå ITP til VITT – Ei reise i forkortingar Håkon Reikvam
09:40 - 10:20 Hyperkalsemi
Runa Andreassen
10:20 - 10:50 Pause og utstillere
10:50 - 11:30 Årsmøte Indremedisinsk forening
11:30 - 12:30 Lunsj
12:30 - 13:10 Stressmestring Ingunn Amble
13:10 - 13:50 E-sigaretter: Er det et godt alternativ til tobakk? Astrid Gjervold Lunde
13:50 - 14:10 Pause og utstillere
14:10 - 14:50 Akutt leversvikt- diagnostikk og behandling Tom Hemming Karlsen
14:50 - 15:30 En ny verden- hva må vi forberede oss på? Espen Nakstad
15:30 - 15:40 Pause
15:40 - 16:00 Industrisymposium 1

Fredag 17. oktober 2025
Tid Aktivitet/Tema
09:00 - 09:40 Indremedisinere i krig
Jørn Rasmussen
09:40 - 10:20 Erfaringer med en heldigital, tverrfaglig intervensjon rettet mot kroniske, sammensatte helseplager
Eirik Søfteland og Gerd Kvale
10:20 - 10:50 Utstillere og pause
10:50 - 11:30 Eldre på intensiv
Anne-Karin Rime
11:30 - 12:30 Lunsj
12:30 - 13:10 Antibiotikautfordringer i fremtiden
Oddvar Oppegaard
13:10 - 13:50 Implementering av kloke valg Andreas Aas -Engstrøm
13:50 - 14:10 Pause og utstillere
14:10 - 14:50 Spirometri og blodgass – med utgangspunkt i kasuistikke
Morten Melsom
14:50 - 15:30 Hjertesykdommer hos gravide
Mette Elise Estensen
15:30 - 15:40 Pause
15:40 - 16:00 Industrisymposium 2



Mikroorganismene i og rundt menneskene (mikrobiota) påvirker en rekke sykdommer. Relasjonen mellom tarmens mikrobiota og kronisk obstruktiv lungesykdom (kols) er i ferd med å bli kartlagt. Ved Lungeavdelingen, Haukeland Universitetssykehus og Universitetet i Bergen har vi påvist sammenheng mellom tarmens mikrobiota og emfysem. Videre forskning trengs for å utforske det terapeutiske potensialet av behandling rettet mot emfysem-relatert dysbiose i tarm.
Anders Ørskov Rotevatn, overlege og phd. stipendiat og Rune Nielsen, overlege professor, begge Lungeavdelingen, Haukeland universitetssykehus og Universitetet i Bergen.
Bakgrunn
Kronisk obstruktiv lungesykdom (kols) er den 3. vanligste dødsår saken på verdensbasis (1). Det kliniske bilde er heterogent, bestående av forskjellige fenotyper. Patogenesen er kompleks med flere interagerende mekanismer. Å identifisere biomarkører assosiert med spesifikke fenotyper vil hjelpe i utviklingen av nye forebyggende eller terapeutiske strategier (2).
En potensiell biomarkør er tarmens mikrobiota, som kan defineres som samlingen av mikrober som finnes i tarmen. Tarmens mikrobiota er korrelert med mange lidelser, fra inflammatorisk tarmsykdom til kreft og depresjon (3). Det finnes indikasjoner på at både lungenes og tarmens mikrobiota påvirker utviklingen av astma, både fenotype og alvorlighetsgrad (4). Tarmmikrobiomets rolle ved kols er mindre undersøkt, det er ikke tatt høyde for de ulike fenotypene ved kols og studiene er gjort med stor metodisk ulikhet (5-7).
MikroKOLS-studien har tarmmikrobiota-prøver fra en norsk kohort med både kols-pasienter og kontroller uten kols (8). Omfattende kliniske data muliggjorde å klassifisere fenotyper som emfysem, eosinofil kols, kols med hyppige forverringer, og kols-pasienter med høy symptombyrde. I en nylig publisert artikkel utforsket vi sammenhengen mellom tarmmikrobiota, kols og kols fenotyper (9). De mest interessante resultatene knyttet seg til subanalyser av
tarmmikrobiota ved emfysem, som vi presenterer her.
MikroKOLS er en kasus-kontroll studie fra Haukeland Universitetssykehus. Datainnsamlingen ble utført fra 2013 til 2015. Ettersom tobakkeksponering er en nærmest obligat risikofaktor i den norske populasjonen, sammenlignet vi avføringsprøver fra pasienter med kols og kontroller som har røykt (både nåværende og tidligere). For å vektlegge klinisk relevant kols ble pasienter med FEV1 over 80% av forventet ekskludert. DNA ble ekstrahert fra avføringsprøver, og V3V4-regionen av det bakterielle 16S-rRNA-genet ble sekvensert. Sekvensene ble så bearbeidet for å fjerne sekvenseringsfeil og sørge for riktig taksonomisk klassifisering (med utgangspunkt i referansedatabasen Silva versjon 138.1). Emfysem ble definert basert på maskintolket CT thorax med emfysem definert som ≥10% lavt attenuerte områder (LAA) bedømt ved -950 Hounsfield-enheter (Hu), mens sikkert fravær av emfysem var definert som <10% LAA bedømt ved -910 Hu. Statistiske analyser av forskjellene i mikrobiota ble utført ved å sammenligne alfa- og betadiversitet, som beskriver den komplekse sammensetningen innad i og mellom prøvene, og såkalt «differential abundance» som sammenligner den relative mengden av hver enkelt mikrobe mellom grupper. På grunn av strukturen på mikrobiotadata, som er ikke-normale, tall med høy spredning og mange nuller, brukes spesialiserte
statistiske tester. Vi brukte ANCOMBC som er en slik test, og som skiller seg fra andre lignende tester ved å ta høyde for at fravær av en mikrobe i en gruppe kan være biologisk betydningsfullt. For mer detaljert beskrivelse av metode henvises det til originalartikkelen med tilhørende supplement.
Studien ble utført i henhold til Helsinki- deklarasjonen og var godkjent av REK Nord 2011/1307. Alle deltakerne gav informert samtykke.
Resultater
Avføringsprøver ble hentet fra 118 røykende (tidligere og nåværende) deltakere. Av disse hadde 62 kols og 49 var uten lungesykdom. I alt 12 deltakere, alle med kols, hadde CT-verifisert emfysem. Det var 55 deltakere uten tegn til emfysem, 19 av disse var klassifisert som kols-pasienter. 51 deltakere møtte hverken kriteriene for sikker emfysem (>10% LAA ved -950Hu) eller sikkert ikke emfysem (<10% LAA ved -910Hu) (figur 1).
Betadiversiteten, men ikke alfadiversiteten, var endret ved emfysem.
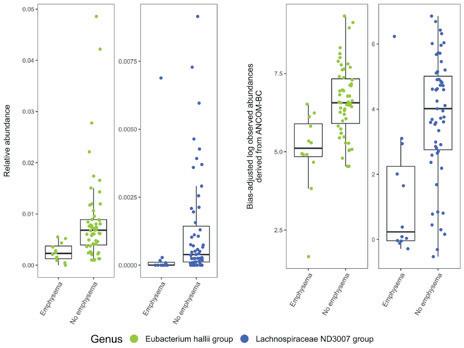
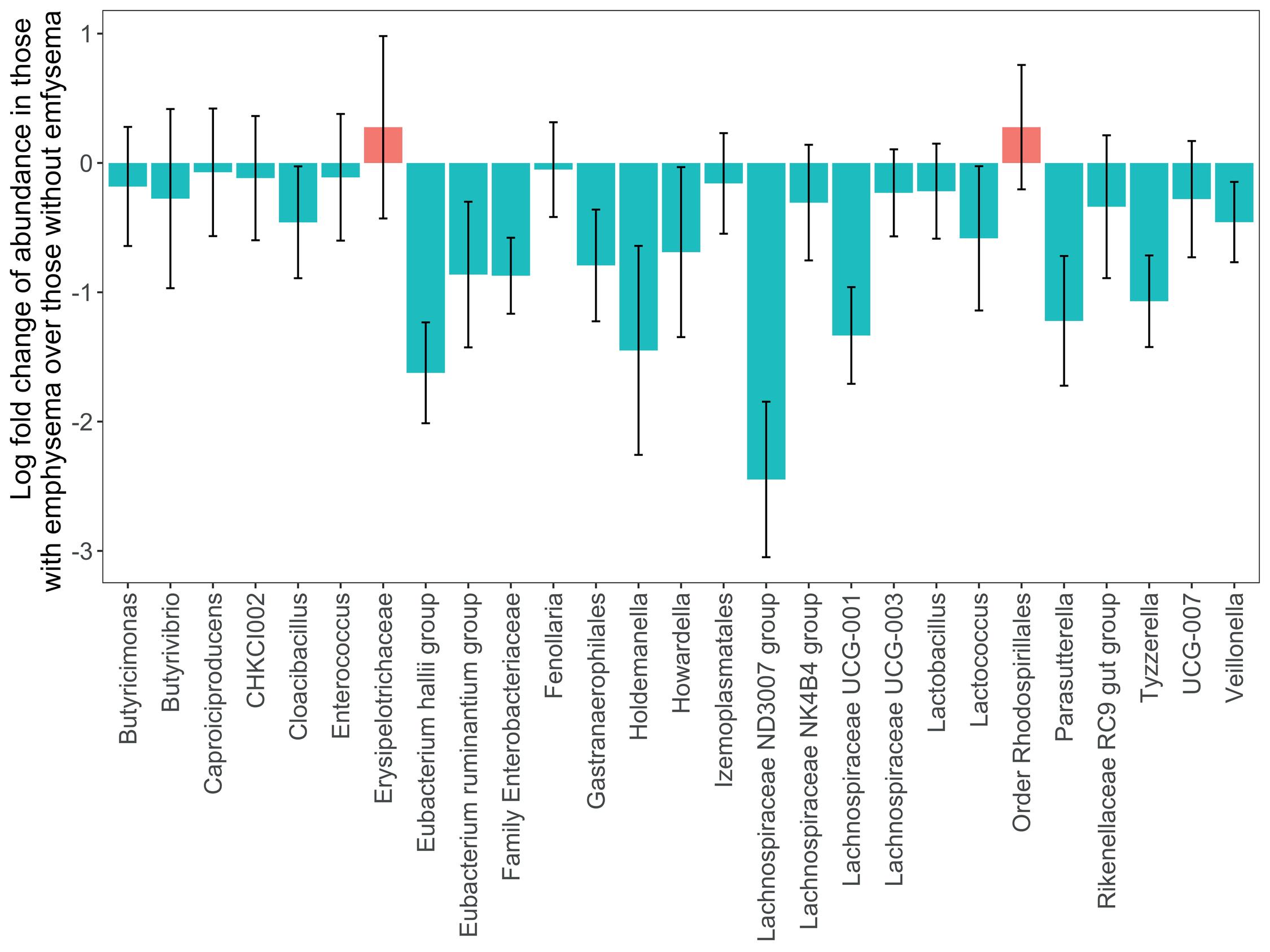
Av 159 identifiserte mikrobeslekter, identifiserte vi forskjeller i 27 mikrobe-slekter mellom deltakerne med og uten emfysem (figur 2). Alle bortsett fra 2 av disse slektene var forskjellige basert på sannsynlig nullforekomst i ene gruppen. Disse 2 slektene, Lachnospiraceae ND3007 group og Eubacterium hallii group,
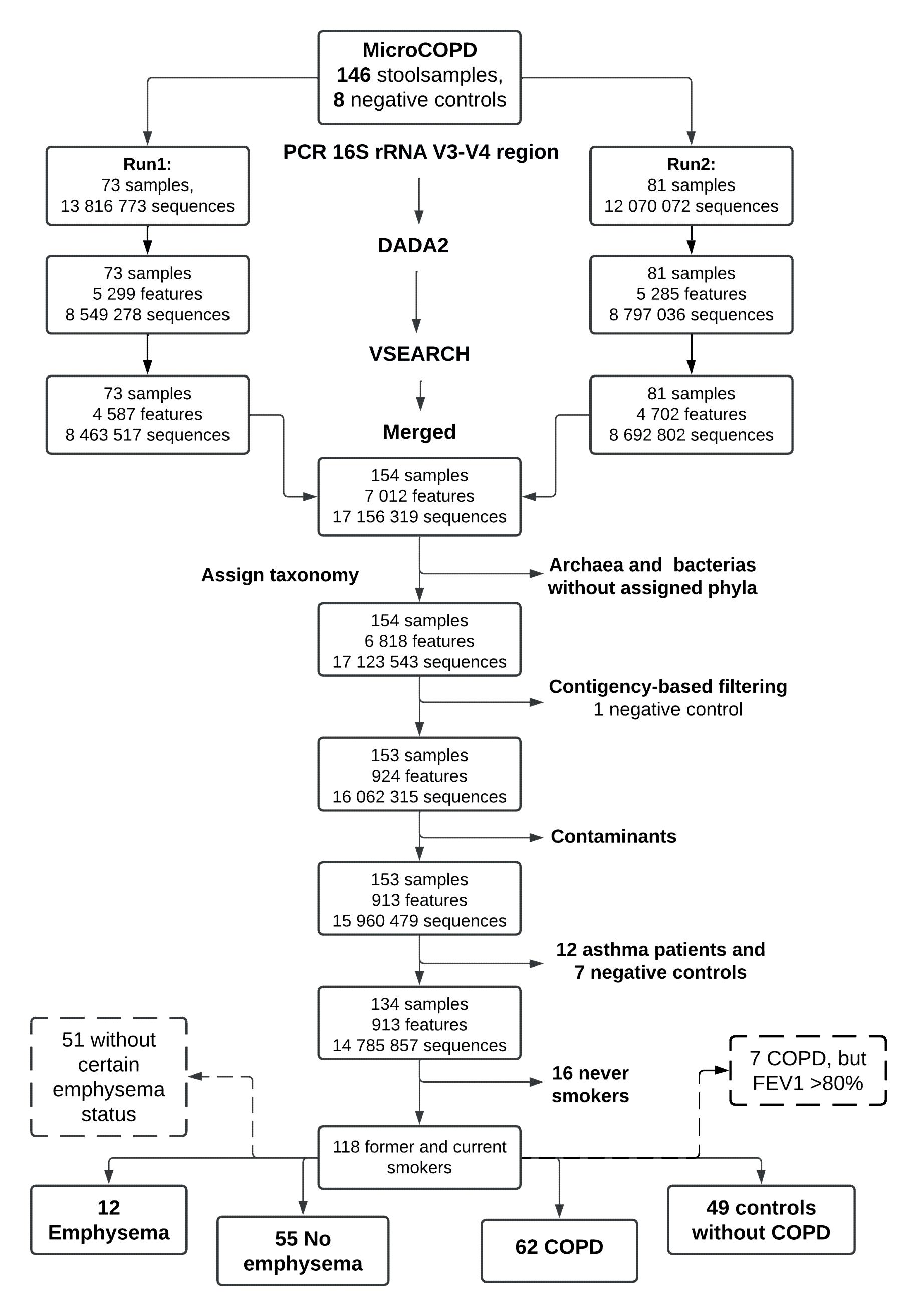
Figur 1. Flytskjema som viser arbeidsflyten fra sekvensering, bioinformatisk prosessering og filtrering, samt gruppering i features (dvs. amplicon sequence variants, ASVs – her forstått som en gruppe lignende sekvenser som representerer samme mikrobielle organisme). DADA2: Divisive Amplicon Denoising Algorithm versjon 2. VSEARCH: Vectorized Search.
Figur 2. Vannfallsplott som viser logfoldforskjell og standardfeil for alle genera med signifikant forskjellig forekomst ved sammenligning av prøver fra deltakere med og uten emfysem. En negativ logfoldforskjell betyr at de aktuelle genera er mindre utbredt hos deltakere med emfysem.
Figur 3. Den relative, biaskorrigerte mengden av LachnospiraceaeND3007gruppen og Eubacterium halliigruppen var forskjellig hos deltakere med emfysem sammenlignet med deltakere uten emfysem. Biaskorrigert mengde er beregnet ved hjelp av Analysis of Composition of Microbiomes with Bias Correction (ANCOMBC).

hadde lavere nivåer hos pasienter med emfysem (figur 3). De tilhører familien Lachnospiraceae, det samme gjør 7 av de andre slekter som var forskjellig hos emfysempasientene også.
Diskusjon
Tarmens mikrobiota har, så vidt vi er klar over, ikke tidligere vært undersøkt i relasjon til CT-verifisert emfysem hos mennesker. Lachnospiraceae ND3007-gruppen og Eubacterium hallii-gruppen, som begge var signifikant redusert hos pasienter med emfysem, er kjente produsenter av kortkjedete fettsyrer, og har blitt funnet redusert i andre sykdomskontekster (10-12). Kortkjedete fettsyrer, og særlig butyrat, er potente regulatorer av immunfunksjon.
Sammenhengen mellom tarmmikrobiota og emfysem støttes av studier på musemodeller. Lipopolysakkarid (LPS) ekstrahert fra celleveggen til bakterier, er vist å kunne bremse utvikling av kols og emfysem ved tobakkeksponering hos mus (13). Fekal mikrobiota-transplantasjon (FMT) fra pasienter med kols til mus, gav økt betennelse i lungene, sammenlignet med FMT fra friske kontroller (7). Når musene så ble eksponert for røyk, var fall i lungefunksjon, emfysemutvikling, luftveisremodellering og økt slimsekresjon mer uttalt hos musene som hadde fått sin FMT fra pasienter med kols (7). Høyt fiberinnhold i kosten kan gi endringer i tarmmikrobiota, som igjen fører til redusert emfysemutvikling og reduserte inflammatoriske responser på
Referanser
1. WHO. The top 10 causes of death 2020 [updated 9th desember 2020. Available from: https://www.who.int/ news-room/fact-sheets/detail/the-top-10-causes-ofdeath.
2. Agustí A, Hogg JC. Update on the Pathogenesis of Chronic Obstructive Pulmonary Disease. New England Journal of Medicine. 2019;381(13):1248–56.
3. Gilbert JA, Blaser MJ, Caporaso JG, Jansson JK, Lynch SV, Knight R. Current understanding of the human microbiome. Nat Med. 2018;24(4):392–400.
4. Barcik W, Boutin RCT, Sokolowska M, Finlay BB. The Role of Lung and Gut Microbiota in the Pathology of Asthma. Immunity. 2020;52(2):241–55.
5. Bowerman KL, Rehman SF, Vaughan A, Lachner N, Budden KF, Kim RY, et al. Disease-associated gut microbiome and metabolome changes in patients with chronic obstructive pulmonary disease. Nature Communications. 2020;11(1):5886.
6. Lai T, Luo C, Yuan Y, Fang J, Wang Y, Tang X, et al. Promising Intestinal Microbiota Associated with Clinical Characteristics of COPD Through Integrated Bioinformatics Analysis. Int J Chron Obstruct Pulmon Dis. 2024;19:873–86.
7. Li N, Dai Z, Wang Z, Deng Z, Zhang J, Pu J, et al. Gut microbiota dysbiosis contributes to the development of chronic obstructive pulmonary disease.
eksponering for tobakksrøyk i musemodeller (14). Metabolitter fra tarmens mikrobiota er påvist i lungevev fra mennesker, alveolære makrofager har reseptorer for slike metabolitter, og disse metabolittene kan påvirke den lokale immunresponsen hos mus (15).
Til sammen beskriver disse funnene en potensiell mekanisme for hvordan emfysemutvikling kan påvirkes av endringer i tarmens mikrobiota, og er med på å sannsynliggjøre betydningen av de påviste endringene av tarmens mikrobiota ved emfysem.
Lachnospiraceae
Både i vår studie og i en australsk kols-kohort (5) var flere medlemmer av familien Lachnospiraceae betydelig redusert. Lachnospiraceae er en familie av obligate anaerobe mikrober, hvis medlemmer er blant de viktigste produsentene av kortkjedete fettsyrer (16). Tobakkeksponering kan gi økning i Lachnospiraceae hos mus (17). Deres innvirkning på vertens fysiologi er inkonsekvent på tvers av ulike studier, men Lachnospiraceae ser ut til å være økt ved metabolsk syndrom, overvekt og diabetes (16). De sprikende resultatene kan også forklares med en betydelig genetisk og funksjonell heterogenitet både mellom og innad forskjellige species i Lachnospiraceae -familien (18).
Vi observerte en lavere prevalens av noen Lachnospiraceae hos pasienter med emfysem. Imidlertid hadde emfysempasientene røkt mer enn pasientene uten emfysem
Respiratory Research. 2021;22(1):274.
8. Gronseth R, Haaland I, Wiker HG, Martinsen EM, Leiten EO, Husebo G, et al. The Bergen COPD microbiome study (MicroCOPD): rationale, design, and initial experiences. Eur Clin Respir J. 2014;1.
9. Rotevatn AØ, Mikal ET, Solveig T, Reksten HG, Kristoffer O, and Nielsen R. Gut microbiota in chronic obstructive pulmonary disease varies by CT-verified emphysema status. European Clinical Respiratory Journal. 2025;12(1):2470499.
10. Nishiwaki H, Ito M, Ishida T, Hamaguchi T, Maeda T, Kashihara K, et al. Meta-Analysis of Gut Dysbiosis in Parkinson’s Disease. Movement Disorders. 2020;35(9):1626–35.
11. Udayappan S, Manneras-Holm L, Chaplin-Scott A, Belzer C, Herrema H, Dallinga-Thie GM, et al. Oral treatment with Eubacterium hallii improves insulin sensitivity in db/db mice. npj Biofilms and Microbiomes. 2016;2(1):16009.
12. Misera A, Kaczmarczyk M, Łoniewski I, Liśkiewicz P, Podsiadło K, Misiak B, et al. Comparative analysis of gut microbiota in major depressive disorder and schizophrenia during hospitalisation - the casecontrol, post hoc study. Psychoneuroendocrinology. 2025;171:107208.
13. Lai H-C, Lin T-L, Chen T-W, Kuo Y-L, Chang C-J, Wu T-R, et al. Gut microbiota modulates
og inkluderte en høy prosentandel av tidligere røykere. Om sammenhengen mellom Lachnospiraceae og emfysem er avhengig av røyking, kan ikke utledes fra våre data. Uansett mener vi at sammenhengene mellom Lachnospiraceae og emfysem bør utforskes nærmere.
Vår studie har begrensinger i design og utvalg som gjør at vi ikke kan konkludere sikkert om assosiasjoner, og spesielt ikke årsaksforhold. Endringer i tarmens mikrobiota kan gi endring i systemisk konsentrasjon av metabolitter fra tarmmikrobiota, som igjen kan påvirke lungehelse gjennom den postulerte tarm-lunge-aksen. Denne aksen kan være angrepspunkt for mikrobiomtrettede intervensjoner som for eksempel prebiotika, probiotika, fekal mikrobiota-transplantasjon eller eventuelt presist rettede antimikrobielle behandlinger.
Konklusjon
Vi fant forskjeller i tarmmikrobiota hos pasienter med CT verifisert emfysem sammenlignet med pasienter uten emfysem. Funnene understøtter betydningen av en tarm-lunge-akse ved emfysem.
Originalartikkel: Rotevatn, A. Ø., Eagan, T. M., Tangedal, S., Husebø, G. R., Ostridge, K., & Nielsen, R. (2025). Gut microbiota in chronic obstructive pulmonary disease varies by CT-verified emphysema status. European Clinical Respiratory Journal, 12(1). https://doi.org/10.1080/ 20018525.2025.2470499
COPD pathogenesis: role of anti-inflammatory <em>Parabacteroides goldsteinii</em> lipopolysaccharide. Gut. 2022;71(2):309–21.
14. Jang YO, Kim O-H, Kim SJ, Lee SH, Yun S, Lim SE, et al. High-fiber diets attenuate emphysema development via modulation of gut microbiota and metabolism. Scientific Reports. 2021;11(1):7008.
15. Liu Q, Tian X, Maruyama D, Arjomandi M, Prakash A. Lung immune tone via gut-lung axis: gut-derived LPS and short-chain fatty acids’ immunometabolic regulation of lung IL-1β, FFAR2, and FFAR3 expression. American Journal of Physiology-Lung Cellular and Molecular Physiology. 2021;321(1):L65–L78.
16. Vacca M, Celano G, Calabrese FM, Portincasa P, Gobbetti M, De Angelis M. The Controversial Role of Human Gut Lachnospiraceae. Microorganisms. 2020;8(4):573.
17. Allais L, Kerckhof F-M, Verschuere S, Bracke KR, De Smet R, Laukens D, et al. Chronic cigarette smoke exposure induces microbial and inflammatory shifts and mucin changes in the murine gut. Environmental Microbiology. 2016;18(5):1352–63.
18. Sorbara MT, Littmann ER, Fontana E, Moody TU, Kohout CE, Gjonbalaj M, et al. Functional and Genomic Variation between Human-Derived Isolates of Lachnospiraceae Reveals Inter- and Intra-Species Diversity. Cell Host Microbe. 2020;28(1):134–46.e4.





Binyreinsidentalom – definert som tilfeldig oppdagede ekspansjoner i binyrene på minst én centimeter – har blitt et stadig vanligere funn de siste 10–20 årene grunnet økt bruk av CT og MR. Norske anbefalinger for diagnostikk, behandling og oppfølging av binyreinsidentalom kom i 2015, De første Europeiske retningslinjene kom i 2016 og ble oppdatert i 2023.
Utviklingen går mot raskere avklaring og færre kontroller, spesielt CT kontroller for å unngå overdiagnostisering og overbehandling. De fleste lesjoner er godartede, men hormonell overaktivitet må utelukkes og mistenkelige radiologiske funn må følges opp.
Grethe Ueland, Overlege, PhD. Medisinsk klinikk, seksjon for hormonsjukdommar, Haukeland Universitetssykehus, Bergen Daniel Hannisdal, Lege i spesialisering. Medisinsk avdeling Bærum sykehus, Vestre Viken HF Trine Finnes, Overlege, PhD, Endokrinologisk seksjon, Gjøvik, Sykehuset Innlandet. Avdeling for Endokrinologi, sykelig overvekt og forebyggende medisin, Aker, Oslo Univeristetssykehus
Ingrid Nermoen, Overlege, PhD, førsteamanuensis. Endokrinologisk avdeling, Akershus Universitetssykehus og Universitetet i Oslo
Ansgar Heck, Overlege, PhD, Seksjon for spesiell endokrinologi, Rikshospitalet, Oslo Universitetssykehus
Binyreinsidentalom er et svært vanlig bifunn i moderne billeddiagnostikk. Med økende bruk av computertomografi (CT) og magnetisk resonanstomografi (MR) i helsevesenet blir slike funn stadig hyppigere, spesielt hos eldre, hvor prevalensen kan nærme seg ti prosent for personer over 80 år. Hos yngre under 50 år er forekomsten lavere, rundt tre prosent, og insidentalomer er sjelden hos personer under 30 år. Tilstanden er i de aller fleste tilfeller ufarlig, men det er likevel viktig å ha en rasjonell og systematisk tilnærming til utredning og oppfølging for å sikre at de få alvorlige tilfellene ikke overses.
Binyrelesjoner oppdaget i forbindelse med utredning eller oppfølging av kreftsykdom er per definisjon ikke insidentalom, men omtales kort i nasjonal veileder endokrinologi, de europeiske retningslinjer og her.
Radiologisk utredning
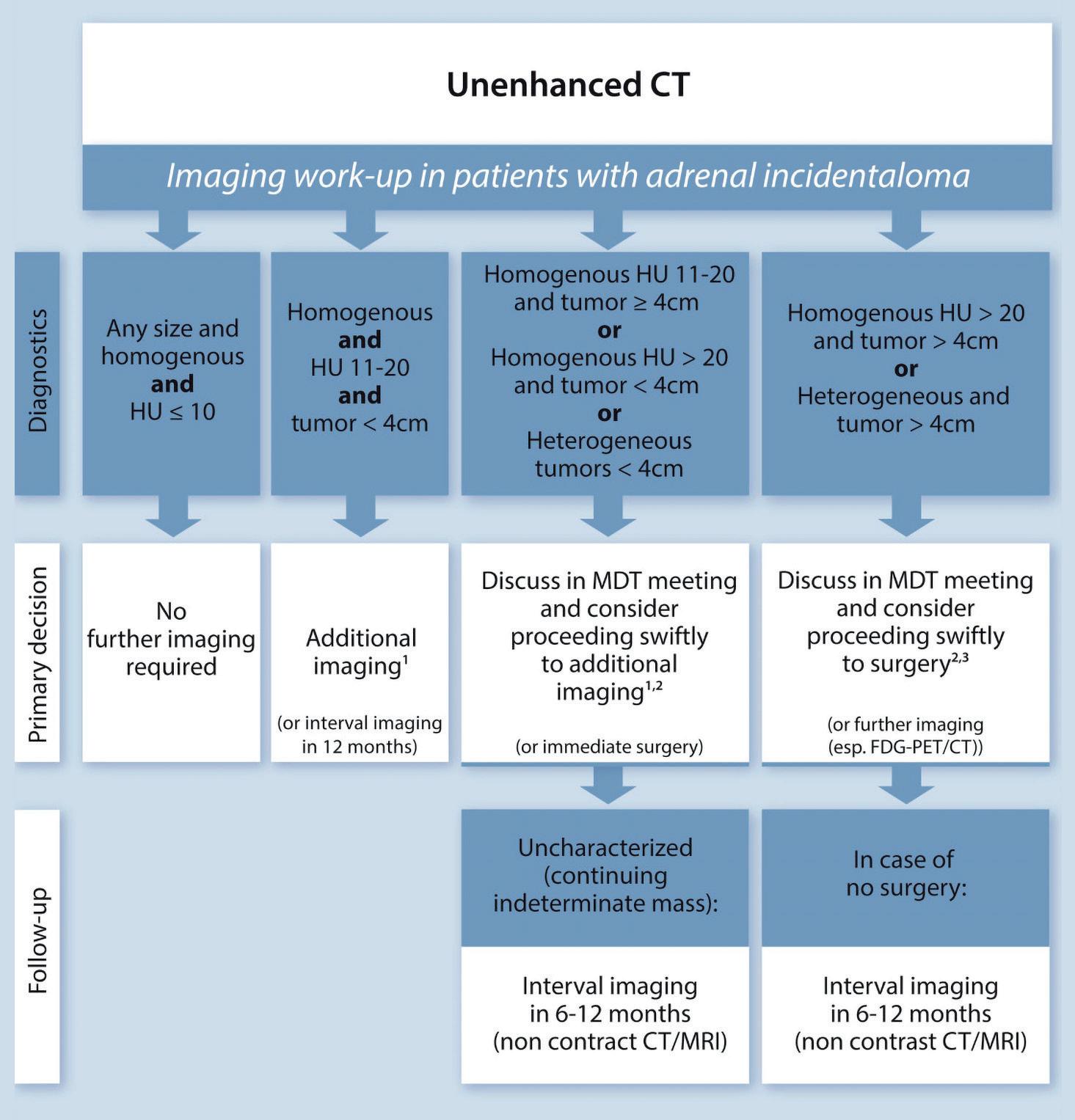
Utredningen starter ofte med en CTundersøkelse av binyrene uten kontrast, en såkalt tomfase-CT. Tettheten målt i Hounsfield-enheter (HU) avgjør hvordan lesjonen skal vurderes videre (Figur 1). I mange tilfeller er utredningen av binyreinsidentalom ukomplisert, men såkalte gråsonekasus trenger oftest supplerende utredning eller oppfølging.
Lesjoner med en tetthet på 10 HU eller lavere er nesten alltid fettrike og godartede, forutsatt at lesjonen er
velavgrenset og homogen (Figur 2). Godartede adenomer trenger ingen videre radiologisk oppfølging eller utredning, uavhengig av størrelse. Dette er et viktig poeng for klinikere; slike lesjoner kan trygt betraktes som godartede, og unødvendige radiologiske kontroller bør unngås.
Lesjoner med tetthet mellom 11 og 20 HU og størrelse < 4cm har lav risiko for malignitet, men det anbefales oppfølging med annenlinjes bildemodalitet, for eksempel CT med kontrastutvasking («wash-out»), MR eller flurodeoksyglukose-positronemisjonstomografi kombinert med CT (FDG-PET/CT), eller ny CT etter ca. 1 år.
Ved høytette (> 20 HU), store (> 4 cm), eller heterogene lesjoner kan ikke tomfase-CT alene gi en sikker diagnose, og det anbefales derfor å supplere med en annenlinjes bildemodalitet for å sikre korrekt klassifisering eller at pasienten henvises til adrenalektomi etter tverrfaglig vurdering. Ved mistanke om malignitet bør pasienten diskuteres i tverrfaglig møte med tanke på videre utredning og eventuell kirurgi. Se figur 1 for en oversikt over anbefalt utredningsforløp.
CT med kontrast og beregning av kontrastutvasking («wash-out») er blant de mest brukte annenlinjemodalitetene. Her injiseres kontrast,
og man måler hvor raskt kontrasten forsvinner fra lesjonen. En relativ utvasking på over 58 % etter 10-15 minutter taler sterkt for en godartet lesjon. Hvis kontrastutvaskingen ligger mellom 40 og 58 %, er det fortsatt mest sannsynlig at lesjonen er benign, men det er en gråsone hvor man må vurdere hvert enkelt tilfelle individuelt. Dersom det fortsatt er usikkerhet, kan man vurdere å gjenta CT etter seks til tolv måneder, eller supplere med andre modaliteter.
En annen viktig modalitet er FDGPET/CT, som kan brukes for å avdekke økt metabolsk aktivitet i lesjonen, noe som er typisk for maligne svulster. Benigne lesjoner har som regel lavt eller fraværende opptak av FDG-tracer, mens maligne har økt opptak. FDG-PET/CT kan også være nyttig for å avdekke metastaser andre steder i kroppen. Ulempen med denne undersøkelsen er dårligere tilgjengelighet og høyere kostnad, så den bør reserveres til tilfeller hvor det er særlig mistanke om malignitet eller ved kjent cancersykdom.
MR-undersøkelse av binyrene kan også være aktuelt, særlig ved graviditet, hos barn eller ved allergi mot røntgenkontrast. MR kan bidra til å differensiere mellom fettrike og ikke-fettrike lesjoner gjennom såkalt «chemical shift»-teknikk, hvor man ser etter tap av signalintensitet ut
av fase. Dette er typisk for lipidrike adenomer.
Biopsi av binyrelesjonen frarådes som hovedregel, spesielt ved mistanke om feokromocytom eller binyrebarkkreft, men kan vurderes ved mistanke om metastase eller lymfom, særlig hvis pasienten har en nåværende eller tidligere malign sykdom. Ved bilaterale lesjoner bør hver lesjon vurderes individuelt, og man bør være oppmerksom på risikoen for binyrebarksvikt ved store, bilaterale tumormasser.
Hormonell utredning
Feokromocytom, Cushing syndrom og primær hyperaldosteronisme påvises sjelden ved insidentalom, men hormonell utredning bør (nesten) alltid gjennomføres, uavhengig av radiologiske funn, for å avdekke eventuell hormonell overproduksjon.
Hyperaldosteronisme skal utelukkes hos pasienter med hypertensjon og/eller hypokalemi. Anbefalte screeningprøver er aldosteron og renin, med beregning av aldosteron/ renin ratio (ARR). Dersom pasienten bruker medikamenter som kan påvirke aldosteron eller renin-nivået anbefalers medikamentomlegging etter egne retningslinjer før ARR beregnes.
Dersom binyrelesjonen har tetthet over 10 HU anbefales biokjemisk utredning for feokromocytom. Initial prøvetaking er plasma metanefrin og normetanefrin. Ved lett til moderat forhøyde verdier kan prøvetakingen gjentas under standardiserte betingelser, og dersom verdiene fremdeles er høye skal pasienten utredes etter retningslinjer for feokromocytom.
Et binyreinsidentalom er en sjelden årsak til adrenokortikotropt hormon (ACTH)-uavhengig Cushing syndrom, med fenotypiske trekk som måneansikt, tykke lilla striae og proksimal myopati. For å avklare dette tas blodprøver for kortisol og ACTH. Ved Cushing syndrom forårsaket av et binyreadenom vil kortisol typisk være normal eller høy og ACTH lav eller helt supprimert. Er det klinisk mistanke bør det i tillegg utføres en 1 mg deksametason-hemningstest, måling av kortisol i spytt på kveldstid,

Mild autonom kortisolsekresjon er ofte asymptomatisk, men kan gi økt risiko for metabolske komplikasjoner som høyt blodtrykk, diabetes, fedme og beinskjørhet.
eller måling av kortisol i døgnurin for å undersøke om det foreligger hyperkortisolisme.
Langt vanligere enn Cushing syndrom avdekkes såkalt mild autonom kortisolsekresjon (MACS). MACS forekommer hos 5 til 30 prosent av pasienter med binyreinsidentalom, hyppigst hos kvinner og er definert som serum-kortisol over 50 nmol/L etter kort deksametason-hemningstest (1 mg deksametason gitt kl. 23 om kvelden med måling av fastende kortisol neste morgen før klokken ni. MACS er ofte asymptomatisk, men kan gi økt risiko for metabolske komplikasjoner som høyt blodtrykk, diabetes, fedme og beinskjørhet. Screening for MACS anbefales for alle, men man bør bruke skjønn om påvisning av tilstanden vil få praktisk betydning for pasienten, spesielt hos eldre pasienter. Kortisolnivået etter kort deksametason test, dvs. graden av ikke-suppresjon, kan korrelere med alvorligheten av tilstanden. Positiv test bør bekreftes med en ny deksametason-hemningstest for å sikre at resultatet ikke skyldes tilfeldigheter eller andre faktorer som f.eks. østrogenbehandling, legemidler, alkoholisme annen akutt sykdom. Videre bør ACTHuavhengighet verifiseres, for eksempel ved lavt eller supprimert ACTH i morgenprøve, for å utelukke at hyperkortisolismen skyldes hypofysær årsak. Ved MACS uten symptomer eller metabolsk byrde kan pasienten følges opp av fastlegen, mens de med stor metabolsk byrde kan vurderes for kirurgi
Ved bilaterale binyreinsidentalom eller bilateral hyperplasi må man tenke på muligheten for at det kan
foreligge medfødt binyrebark hyperplasi. Som ledd i utredning for dette bør 17-hydroksyprogesteron måles (17-OHP).
Behandling
Indikasjon for adrenalektomi foreligger først og fremst ved mistanke om primær binyrecancer, ved solitære metastaser (der onkolog vurderer), eller ved endokrint aktive svulster som feokromocytom, primær hyperaldosteronisme eller ACTHuavhengig Cushing syndrom.
Binyrelesjoner som ikke lar seg avklare som sikkert benigne kan vurderes tverrfaglig for kirurgi. Faktorer som trekker i retning av kirurgi er høy tettet, ung alder med behov for mange kontroller fremover, lav operasjonsrisiko og pasientønske etter samvalgssamtale. Ved MACS bør muligheten for kirurgi diskuteres med pasienten, spesielt hvis det foreligger flere assosierte metabolske tilstander og pasienten har lang forventet levetid. Beslutningen bør tas i samarbeid med pasienten, og det må tas hensyn til alder, komorbiditet, grad av hyperkortisolisime og assosierte tilstander.
Oppfølging
Ved sikker benign lesjon uten hormonelle funn er det ikke nødvendig med videre oppfølging. Oppfølgingen av øvrige pasienter bør tilpasses individuelt. Ved MACS bør pasienten følges opp i primærhelsetjenesten med årlig kontroll av blodtrykk, HbA1c og lipidstatus samt eventuell oppfølging av beintetthet. Ved utvikling eller forverring av assosierte tilstander bør indikasjonen for kirurgi revurderes.
Samlet sett gir denne tilnærmingen en rasjonell og sikker utredningen av binyreinsidentalom der målet er å avklare om lesjonen er benign eller malign og om det foreligger overproduksjon av hormoner. Fokus er å unngå unødvendige kontroller og å identifisere de få pasientene som trenger spesialisert behandling eller oppfølging.
Faktaboks
- Binyreinsidentalomer vanlig hos personer over 50 år, men sjelden hos yngre der man bør være ekstra årvåken for om lesjonen kan være malign.
- En rund og homogen tumor med tetthet under 10 HU trenger ikke videre radiologisk kontroll, uansett størrelse
- Mild autonom kortisolsekresjon (MACS) er vanlig, og assosiert med det metabolske syndrom. De fleste med tilstanden skal håndteres konservativt, men de med stor metabolsk byrde kan vurderes for adrenalektomi
- Fulminant hormonell overproduksjon fra binyreinsidentalom er sjelden, men må ikke overses
Referanser 1. Fassnacht M, Tsagarakis S, Terzolo M, Tabarin A, Sahdev A, Newell-Price J, Pelsma I, Marina L, Lorenz K, Bancos I, Arlt W, Dekkers OM. European Society of Endocrinology clinical practice guidelines on the management of adrenal incidentalomas, in collaboration with the European Network for the Study of Adrenal Tumors.Eur J Endocrinol. 2023 Jul 20;189(1):G1-G42. doi: 10.1093/ejendo/ lvad066. PMID: 37318239. https://doi.org/10.1093/ ejendo/lvad066 2. Veileder I endokninologi ( Binyreincidnetalom), https://metodebok.no/emne/cEiJbn5n/binyreinsidentalom/endokrinologi-(nef)

KRONISK LYMFATISK LEUKEMI
• I kombinasjon med venetoklaks med eller uten obinutuzumab til behandling av voksne pasienter med tidligere ubehandlet kronisk lymfatisk leukemi (KLL).
MANTELCELLELYMFOM
• I kombinasjon med bendamustin og rituksimab (BR) til behandling av voksne pasienter med tidligere ubehandlet mantelcellelymfom (MCL) som ikke er kvalifiserte for autolog stamcelletransplantasjon (ASCT).
• Som monoterapi er indisert til behandling av voksne pasienter med residiverende eller refraktær (RR) MCL som ikke tidligere har fått behandling med en BTK-hemmer.
INNFØRT AV BESLUTNINGSFORUM FOR NYE METODER (25.08.2025) FOR2
KRONISK LYMFATISK LEUKEMI
• I kombinasjon med venetoklaks med eller uten anti-CD20-antistoff, til behandling av 1. linje KLL.
MANTELCELLELYMFOM
• Som monoterapi til behandling av voksne pasienter med RR MCL som ikke tidligere har fått behandling med en BTK-hemmer.
H-resept finansiering kun etter resept fra sykehuslege eller avtalespesialist. Calquence inngår i Helseforetakenes anbefaling for onkologiske legemidler og rekvirering skal gjøres i tråd med disse.3
Viktig informasjon om Calquence (akalabrutinib)
Indikasjoner: Som monoterapi, eller i kombinasjon med obinutuzumab, til behandling av voksne pasienter med tidligere ubehandlet kronisk lymfatisk leukemi (KLL). Som monoterapi til behandling av voksne pasienter med KLL som har fått minst én tidligere behandling. I kombinasjon med venetoklaks med eller uten obinutuzumab til behandling av voksne pasienter med tidligere ubehandlet KLL. I kombinasjon med bendamustin og rituksimab (BR) til behandling av voksne pasienter med tidligere ubehandlet mantelcellelymfom (MCL) som ikke er kvalifiserte for autolog stamcelletransplantasjon (ASCT). Som monoterapi til behandling av voksne pasienter med residiverende eller refraktær MCL som ikke tidligere har fått behandling med en BTK-hemmer. Dosering: Behandling med dette legemidlet skal igangsettes og følges opp av lege med erfaring i bruk av legemidler mot kreft. Voksne: Anbefalt dose som monoterapi eller i kombinasjon er 100 mg 2 ganger daglig. Behandling bør fortsette inntil sykdomsprogresjon, uakseptabel toksisitet eller til det er fullført 14 behandlingssykluser (hver syklus er på 28 dager) når kombinert med venetoklaks. Forsiktighetsregler: Alvorlige blødninger, inkl. blødning i CNS og gastrointestinal blødning er sett. Pasienter som bruker antitrombotiske midler kan ha økt risiko for blødning og forsiktighet skal utvises ved bruk. Warfarin eller an-dre vitamin K-antagonister skal ikke gis samtidig med akalabrutinib. Atrieflimmer/flutter forekom hos pasienter med hematologiske maligniteter både ved monoterapi og i kombinasjon med obinutuzumab. Overvåk for symptomer på atrieflimmer og atrieflutter og foreta EKG om nødvendig. Ved høy risiko for tromboembolisk sykdom, skal nøye kontrollert behandling med antikoagulanter og andre be¬handlingsalternativer vurderes. Tumorlysesyndrom (TLS) har blitt rapportert ved behandling med Calquence. Pasienter som anses å ha risiko for TLS (f.eks. med stor tumormasse ved baseline) bør vurderes for mulig risiko for TLS og overvåkes nøye som klinisk indisert. Interaksjoner: Samtidig bruk av sterke CYP3A-hemmere eller CYP3A-induktorer skal unngås; kan gi hhv. økt og redusert eksponering for akalabrutinib. Bivirkninger: Monoterapi: Vanligste bivirkninger(≥ 20 %): Infeksjon, diaré, hodepine, muskel- og skjelettsmerter, blåmerker, hoste, artralgi, fatigue, kvalme og utslett. Kombinasjonsbehandling: Vanligste bivirkninger (≥ 20 %): Infeksjon, muskel- og skjelettsmerter, diaré, hodepine, blåmerker, leukopeni, nøytropeni, trombocytopeni, anemi, hoste, fatigue, artralgi, kvalme, utslett, svimmelhet, oppkast og forstoppelse. Pakninger og priser: 60 stk. (blister) kr 69.842,20. Reseptgruppe C. For mer info om Calquence, se www. felleskatalogen.no eller godkjent SPC. NO-14484-08-25-ONC
Referanser: 1. Calquence® (acalabrutinib), Summary of Product Characteristics, www.ema.europa.eu 2. Beslutningsforum for Nye Metoder ID2024_073, ID2025_042, www.nyemetoder.no/sok/?q=akalabrutinib 3. www.sykehusinnkjop.no/avtalerlegemidler/onkologi/

www.astrazeneca.no
KRONISK NYRESYKDOM
• FORXIGA reduserte risikoen for det redusert eGFR ≥ 50 %, terminal nyresvikt,
• KUN FORXIGA, blant SGLT2-h, har sekundære endepunktet død uansett
HJERTESVIKT
HJERTESVIKT
DIABETES TYPE 2
• FORXIGA reduserte risikoen for det og forverring av hjertesvikt.*1
• KUN FORXIGA, blant SGLT2-h, reduserer alene, uavhengig av ejeksjonsfraksjon.
DIABETES TYPE 2
• FORXIGA reduserte risikoen for det eller sykehusinnleggelse for hjertesvikt UTEN kjent hjerte- og karsykdom.
• FORXIGA økte ikke risikoen for det MACE.*1
• FORXIGA reduserte risikoen for det primære endepunktet vedvarende redusert eGFR ≥ 50 %, terminal nyresvikt, renal eller CV død.*1
• KUN FORXIGA, blant SGLT2-h, har vist å redusere risikoen for det sekundære endepunktet død uansett årsak.**1,3
KRONISK
• FORXIGA reduserte risikoen for det primære endepunktet CV død og forverring av hjertesvikt.*1
• KUN FORXIGA, blant SGLT2-h, reduserer risikoen for CV død alene, uavhengig av ejeksjonsfraksjon.**1,3
KRONISK NYRESYKDOM
• FORXIGA reduserte risikoen for det primære endepunktet CV død eller sykehusinnleggelse for hjertesvikt hos pasienter MED og UTEN kjent hjerte- og karsykdom.*1
• Forxiga 10 mg skal ikke brukes ved T1D, hos gravide eller ammende.
• FORXIGA økte ikke risikoen for det andre primære endepunktet MACE.*1
• Behandlingen skal avbrytes midlertidig hos pasienter innlagt på sykehus for større kirurgiske inngrep eller ved akutte, alvorlige medisinske sykdommer
•
Referanse: 1. Felleskatalogen.no (20.nov. 2024) 2. Forxiga SPC pkt. 4.1, 4.2, 4.4
det primære endepunktet vedvarende nyresvikt, renal eller CV død.*1
INDIKASJONER:
har vist å redusere risikoen for det uansett årsak.**1,3
Praktisk informasjon:
• Behandling av utilstrekkelig kontrollert diabetes mellitus type 2 (T2D) hos voksne og barn ≥10 år, som tillegg til diett og fysisk aktivitet: Som monoterapi når metformin er uhensiktsmessig pga. intoleranse eller som tillegg til andre legemidler til behandling av T2D.
komplikasjonene ved 1
det primære endepunktet CV død
10 mg 1 TABLETT
Forxiga 10 mg skal ikke brukes ved T1D, hos gravide eller ammende. Brukes med forsiktighet ved økt risiko for diabetisk ketoacidose.
• Behandling av kronisk nyresykdom hos voksne.
• Behandling av symptomatisk kronisk hjertesvikt hos voksne.
eduserer risikoen for CV død ejeksjonsfraksjon.**1,3
REFUSJONSBERETTIGET BRUK:
DIABETES TYPE 2
det primære endepunktet CV død hjertesvikt hos pasienter MED og karsykdom.*1
det andre primære endepunktet
Behandlingen skal avbrytes midlertidig hos pasienter innlagt på sykehus for større kirurgiske inngrep eller akutte, alvorlige medisinske sykdommer.
• Som tillegg til annen blodsukkersenkende behandling ved diabetes type 2 (unntatt GLP-1analoger). Refusjonskoder: ICPC: T90 Diabetes type 2. ICD: E11 Diabetes mellitus type 2. Vilkår 264: Refusjon ytes i kombinasjon med metformin til pasienter som ikke oppnår glykemisk kontroll på behandling med metformin. Pasienter med etablert hjerte- og karsykdom og/eller nyresykdom kan starte med SGLT2 hemmer i kombinasjon med metformin som førstevalg.
KRONISK NYRESYKDOM
DOKUMENTERT EFFEKT2
Refusjonskoder
Vilkår
• Behandling av pasienter med kronisk nyresykdom med bekreftet albuminuri (eGFR 25-75 mL/ min/1.73m² og albumin/kreatinin-ratio i urin over 20 mg/mmol). Refusjonskoder: ICPC: U99 Nyresvikt kronisk. ICD: N18 Kronisk nyresykdom.Vilkår 260: Refusjon ytes kun i kombinasjon med optimalisert behandling med RAAShemmer, enten ved bruk av ACE-hemmer eller angiotensin II-reseptorblokker (ARB).
HJERTESVIKT
Praktisk informasjon:
Forxiga 10 mg skal ikke brukes ved T1D, hos gravide eller ammende.
• Behandling av symptomatisk kronisk hjertesvikt hos voksne. Refusjonskoder: ICPC: K77. Hjertesvikt. ICD: I50 Hjertesvikt.
T2D og etablert hjerte- og karsykdom og/eller nyresykdom*
Brukes med forsiktighet ved økt risiko for diabetisk ketoacidose.
Metformin
FORXIGA reduserte risikoen for det primære endepunktet vedvarende redusert eGFR ≥ 50 %, terminal nyresvikt, renal eller CV død.*1
FORXIGA + metformin T2D
CKD med min/1.73m uAKR
Behandlingen skal avbrytes midlertidig hos pasienter innlagt på sykehus for større kirurgiske inngrep eller akutte, alvorlige medisinske sykdommer.
Anbefalt dosering: 10 mg 1 gang daglig. Det er ikke anbefalt å starte behandling ved GFR < 25 ml/min. Ved GFR < 45 ml/min skal ekstra glukosesenkende behandling vurderes hos T2D pasienter med behov for ytterligere glykemisk kontroll.
Ved alvorlig nedsatt leverfunksjon er anbefalt startdose 5 mg.
Utvalgt sikkerhetsinformasjon:
• Brukes med forsiktighet ved økt risiko for diabetisk ketoacidose.
KUN FORXIGA, blant SGLT2-h, har vist å redusere risikoen for det sekundære endepunktet død uansett årsak.**1,3
• Pasienter med albuminuri kan ha mer nytte av behandling med Forxiga. Ingen erfaring med behandling av kronisk nyresykdom hos pasienter uten diabetes som ikke har albuminuri.
• Begrenset erfaring med Forxiga i NYHA-klasse IV.
FORXIGA
• Forsiktighet utvises der Forxiga-indusert blodtrykksfall kan utgjøre risiko.
Praktisk informasjon:
2. linje behandling
(Dersom man ikke oppnår glykemisk kontroll med metformin alene)
Forxiga 10 mg skal ikke brukes ved T1D, hos gravide eller ammende.
• Kan gi økt nyreutskillelse av litium. Pasienten skal henvises til forskrivende lege for overvåking av serumkonsentrasjon.
FORXIGA reduserte risikoen for det primære endepunktet CV død og forverring av hjertesvikt.*1
• Kan gi økt hematokrit. Pasienter med uttalte økninger i hematokrit skal overvåkes og undersøkes for underliggende hematologisk sykdom.
Bivirkninger: Svært vanlige: Hypoglykemi (når brukt med sulfonylurea (SU) eller insulin)). Vurder en lavere dose av insulin/ SU for å redusere denne risikoen ved T2D. Vanlige: Genitale infeksjoner, urinveisinfeksjoner. Mindre vanlige: Volumdeplesjon inkl. hypotensjon. Sjeldne bivirkninger: Diabetisk ketoacidose (ved T2D). Svært sjeldne: Fourniers gangren.
Reseptgruppe C.
KUN FORXIGA, blant SGLT2-h, reduserer risikoen for CV død alene, uavhengig av ejeksjonsfraksjon.**1,3
Refusjonskoder Vilkår
T90, E11 264 1. linje behandling
Pakninger og priser: 10 mg: 28 stk. kr 450. 98 stk. kr 1432,30. For mer info. om Forxiga, les FK tekst på www.felleskatalogen.no eller SPC
NO-12728-08-24-CVRM
FORXIGA reduserte risikoen for det primære endepunktet CV død eller sykehusinnleggelse for hjertesvikt hos pasienter MED og UTEN kjent hjerte- og karsykdom.*1

Skann QR-koden for å registrere din e-post slik at du kan motta invitasjoner til møter, e-læringsprogrammer og mer digitalt.
FORXIGA økte ikke risikoen for det andre primære endepunktet MACE.*1
Brukes med forsiktighet ved økt risiko for diabetisk ketoacidose.
Behandlingen skal avbrytes midlertidig hos pasienter innlagt på sykehus for større kirurgiske inngrep eller akutte, alvorlige medisinske sykdommer.

Reaching Deeper Lung Regions. With a small outer diameter of 5.9 mm, the BF-UCP190F expands the accessibility to deeper lung regions, reaching significantly farther in most segmental bronchi, including left and right upper and middle lobes, compared to the BF-UC190F.1 This enables pulmonologists to extend their diagnostic reach while maintaining procedural simplicity for efficient lung cancer diagnosis.
Contact your Olympus representative for more details.
www.olympus.no
* Takashima Y, Shinagawa N, Shoji T, et al. Evaluating the Efficacy of Thin Convex-probe Endobronchial Ultrasound Bronchoscope in Cadaveric Models. J Bronchology Interv Pulmonol. 2025;32(3):e01015. Published 2025 May 21.doi:10.1097/LBR.0000000000001015
I dette nummeret av Indremedisineren har vi forfattet et knippe tema artikler om hud- og bløtdelsinfeksjoner som krever innleggelse i sykehus. Vi har også med en artikkel om betahemolytiske streptokokker, som er viktigste etiologi ved både de hyppigste og alvorligste av disse infeksjonene. Ved Haukeland Universitets sjukehus (HUS) og Universitetet i Bergen har vi i en årrekke utført forskning innen områdene ikke-purulente hud- og bløtdelsinfeksjoner og alvorlig streptokokksykdom (The Streptococcal Interest Group (Beta-SIG) | UiB), og er takknemlige for oppdraget med å utforme denne temautgaven. Artiklene her bygger på internasjonal forskning over mange år og i tillegg norske og skandinaviske erfaringer og studier. Studier dokumenterer både behov for og muligheter til forbedring innen områdene, og vi deler her enkelte tema vi har arbeidet med lokalt.
Vi har tilstrebet å dekke klinikerperspektivet i artiklene våre. Først ut er Oddvar Oppegaard, som gir en introduksjon til hva indremedisinere har nytte av å vite om betahemolytiske streptokokker som etiologi ved invasive infeksjoner og om relevante endringer i tiden. Vi kjenner mikrobene som årsak til et mangfold av alvorlige infeksjoner som håndteres i sykehus av ulike indremedisinske spesialiteter. Likheter og særegenheter ved de tre betahemolytiske streptokokkene S. pyogenes (gruppe A streptokokker; GAS), S. agalactiae (gruppe B streptokokker; GBS) og S. dygalactiae (gruppe C og G streptokokker; SD) presenteres. Mikrobene er nært beslektet, de overlapper noe med hensyn til infeksjonene de forårsaker, men de har også unike trekk. Et poeng i artikkelen er den stille, men formidable økningen som pågår i forekomst av SD-infeksjoner. Arten er ikke strikt humanpatogen, ulikt GAS, og resistensforhold avviker noe fra sistnevnte. For tiden pågår det globalt en klonal spredning av
en særlig virulent sekvenstype av SD, som bidrar til at vi ser alvorlige infeksjoner stadig oftere.
Media har for tiden søkelys på den enorme kraften og hastigheten i den politiske transformasjonen mot autokrati som foregår i USA. For tiden pågår det harde politiske angrep på CDC, U.S. Centers for Disease Control and Prevention. CDC er en viktig formidler og utgir blant annet journalen EID, Emerging Infectious Diseases. Oddvar var førsteforfatter på en artikkel der for en liten tid siden (1), og etter det publiserte EID egen podkast om S. dysgalactiae, med ham som gjest Public Health Media Library. Jeg anbefaler denne på det varmeste, av flere grunner. God stemningen i studio er det også!
Den påfølgende artikkelen handler om vurdering og håndtering av de tallrike pasientene i sykehus med erysipelas og cellulitt, der betahemolytiske streptokokker er viktigste mikrobe årsaker. Trond Bruun formidler kunnskaper som foreligger, men som viser seg vanskelig å omsette i daglig praksis. Overbehandling av enklere infeksjoner i hud og bløtdeler er snarere regelen enn unntaket, noe som er godt vist i studier. Det tilbys evidensbasert informasjon og råd som gjelder diagnostikk, vurderinger og behandling som er i tråd med nasjonale retningslinjer. I artikkelen legges det vekt på praktiske tilnærminger og foretrukne løsninger.
Der overbehandling er svært vanlig ved de mindre alvorlige hudinfeksjonene, er underbehandling en av mange store utfordringer ved de livstruende nekrotiserende bløtdelsinfeksjonene (NSTI). Et av de aller viktigste spørsmålene vi har ved første vurdering av pasienten er: «Skal pasienten opereres, eller er det tilstrekkelig med konservative tiltak?» Tidsaspektet betyr svært mye for behandlingsresultatene. I denne sammenhengen
betyr lengre tid økt risiko for tap av liv eller lemmer. I denne tredje artikkelen i serien går Steinar Skrede gjennom tiltak og praktisk støtte til tidlige vurderinger, der indremedisinere har viktige roller. Samtidig slås det et slag for tidlig kirurgisk eksplorasjon og behandling.
Mens dette arbeidet etterlyser studier av adjuvant behandling ved NSTI, presenterer den fjerde og siste artikkelen en av de mer omdiskuterte behandlingene, hyperbar oksygenbehandling (HBO) - der en studie av effekt av HBO er rett rundt hjørnet. Anestesioverlege og forskningssjef i Kirurgisk serviceklinikk i HUS, Torbjørn Nedrebø gir en introduksjon til hva vi behøver vite om HBO. Det kommer en multisenter internasjonalt randomisert studie av HBO ved NSTI av alle kategorier, ledet av Rigshospitalet i København. Studien HOT-NSTI har oppstart i verden allerede høsten 2025 og skal pågå i 5 år, der HUS og Oslo universitetssykehus Ullevål deltar. I HUS har vi tradisjonelt behandlet restriktivt og primært pasienter med mistenkt anaerob mikrobeetiologi, men egne data fra verdens største studie av NSTI med prospektiv inklusjon, INFECT, har fått oss til å stille spørsmålstegn ved vår egen praksis. Vi har gått gjennom lokale registerdata og finner enda sterkere grunn for gjennomgang av indikasjoner for HBO, så vi har stort behov for resultatene en slik studie vil kunne gi. At det tar lang tid før slike data er tilgjengelige, er ingen grunn til å vente på hvordan utfallet blir for dette ene tiltaket.
Vi utfordrer kontinuerlig egen praksis og håper vi viser frem eksempler på områder for forbedringer som kan studeres lokalt, i ethvert sykehus. Vi håper du har glede og nytte av stoffet!
Referanser: 1. Oppegaard O, et al. Streptococcus dysgalactiae Bloodstream Infections, Norway, 1999-2021. Emerg Infect Dis. 2023;29:260

Tema: Hud- og bløtdelsinfeksjoner
Infeksjoner forårsaket av betahemolytiske streptokokker er vanlige kontaktårsaker både på sykehus og i allmennpraksis. Det kliniske bildet varierer fra milde overfladiske hudinfeksjoner til invasive tilstander med høy dødelighet. Tradisjonelt har Streptococcus pyogenes vært den dominerende mikroben, både med tanke på insidensrater og spalteplass i lærebøker og media. Det siste tiåret har det imidlertid vært store, viktige endringer i det epidemiologiske bildet for betahemolytiske streptokokker. Vi presenterer en oversikt over de viktigste sykdomsmanifestasjonene og tidsaktuelle trendene for disse mikrobene, samt potensielle implikasjoner dette har for oss indremedisinere.
Oddvar Oppegaard, overlege og spesialist i infeksjonssykdommer, Haukeland Universitetssjukehus
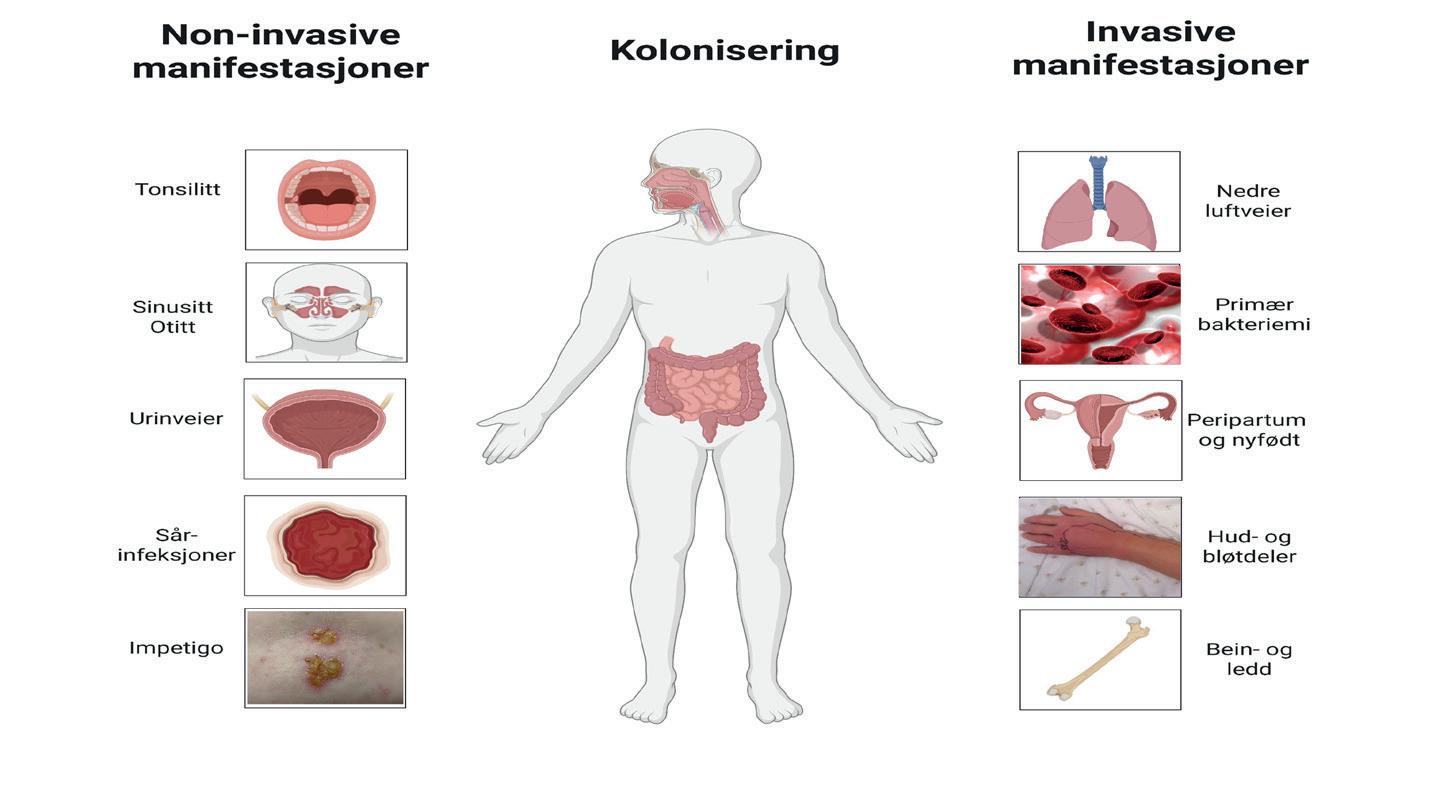



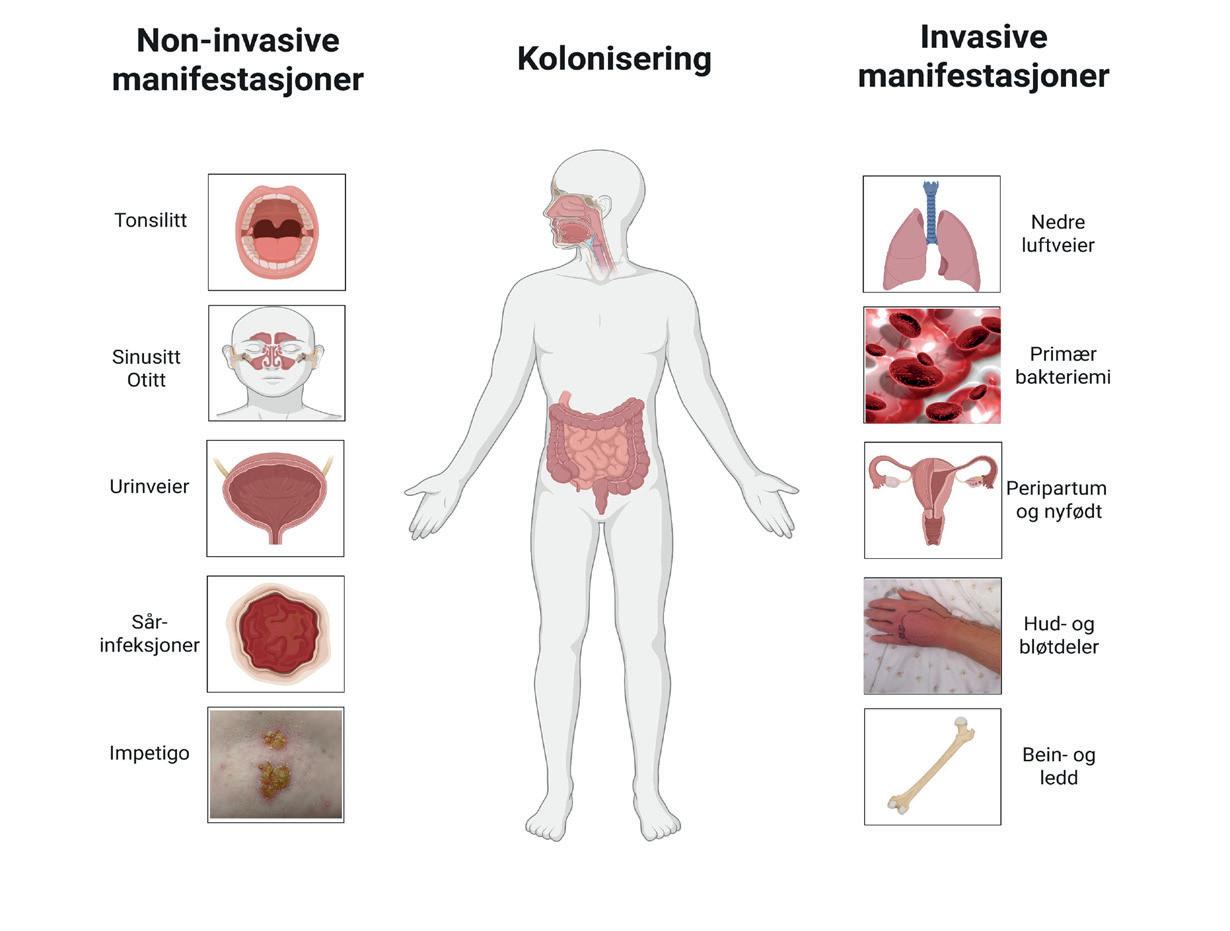



Figur 1: Kliniske manifestasjoner av betahemolytiske streptokokk-infeksjoner. Oversikt over anatomiske predileksjonssteder for kolonisering og infeksjoner assosiert med GAS, GBS og SD. Antall prikker indikerer om tilstanden er henholdsvis sjelden, vanlig eller hyppig forekommende. Det forekommer også tilfeller med meningitt, endokarditt og intraabdominale infeksjoner. SSTI, skin- and soft tissue infections (erysipelas og cellulitt); NSTI, necrotizing soft-tisue infections (nekrotiserende bløtdelsinfesjoner). Adaptert fra (2, 3, 5), figurer fra BioRender.
type II infeksjoner i INFECT-studien (8 %). Videre observeres stadig oftere alvorlige manifestasjoner som
streptokokk toksisk sjokk og endokarditt forårsaket av SD (5, 7, 8). En gjennomgang av det svenske endokardittregisteret beskrev et akutt og aggressivt sykdomsforløp ved SD endokarditt, og omfang av embolisering og behov for kirurgi på linje med Staphylococcus aureus endokarditt (9). SD har således absolutt potensiale for virulent adferd.
GBS forbindes av mange primært med peripartum-infeksjoner, herunder sepsis og meningitt hos nyfødte, samt maternell bakteriemi. Mikroben forårsaker imidlertid også infeksjoner hos ikke-gravide voksne, men da i hovedsak hud- og bløtdelsinfeksjoner (30 %), bein- og leddinfeksjoner (25 %) og primær bakteriemi (30 %) (10).
Epidemiologi
Historisk har GAS hatt størst epidemiologisk fotavtrykk, og det er estimert at mikroben globalt forårsaker minst 2 millioner tilfeller av alvorlig sykdom og 500 000 dødsfall per år (11). Tilsvarende er det anslått at GBS er assosiert med 650 000 alvorlige sykdomstilfeller og 175 000 dødsfall på verdensbasis (12, 13). I tillegg kommer sykdomsbyrden fra non-invasive og overfladiske infeksjoner. På bakgrunn av deres store påvirkning av folkehelsen, er systemiske infeksjoner med GAS og GBS under epidemiologisk overvåkning i mange land, og er tilsvarende klassifisert som meldepliktige til MSIS i Norge. Systematisk kartlegging av kliniske SD infeksjoner er derimot lite utbredt. I Norge har vi likevel data på alle mikrober påvist i blodkultur ved landets mikrobiologiske laboratorier siden 2004, og en oversikt publiseres årlig i NORMrapporten (Figur 2) (14).
Blant de epidemiologiske trendene for betahemolytiske streptokokker, har det har vært betydelig fokus på det store postpandemiske oppsvinget av alvorlige GAS-infeksjoner (15, 16). I Norge har vi hatt relativt stabile insidensrater for GAS bakteriemi mellom 3 – 4 / 100 000 per år, men de siste to årene har man observert en dobling av forekomsten (Figur 2). Årsaksforholdene er trolig kompliserte, men en redusert flokk-immunitet som følge av få GAS-tilfeller under COVID-nedstengingen trekkes fram som en viktig komponent (17).
Bakteriemi forårsaket av betahemolytiske streptokokker i Norge
Figur 2: Bakteriemi forårsaket av betahemolytiske streptokokker i Norge. Indidensrater for GAS, GBS og SD i Norge i perioden 2004 – 2023. Tall på forekomst hentet fra NORM-rapporter, befolkningsdata er hentet fra Statistisk sentralbyrå og representerer folketall ved inngangen til hvert år. Stiplede linjer er trendkurver generert i Microsoft Excel.
I perioden fra 2004 til 2023 har det vært en seksdobling av alvorlige SDinfeksjoner i Norge, og forekomsten overstiger nå med god margin også den postpandemiske toppnoteringen for GAS (Figur 2). I Helse Bergen fant vi at SD nå er den 5. vanligste mikroben som påvises i blodkultur i regionen (18). Paradoksalt har den dramatiske økningen av SD-bakteriemier fått svært lite oppmerksomhet.
Situasjonen er på ingen måte unik for Norge. I Finland har de hatt en enda kraftigere stigning, og der rapporteres nå insidens-tall på 17 / 100 000 per år (19). Tilsvarende utvikling observeres i flere land i Europa, samt i Canada og i Japan (3, 20).
Også GBS utviser en stigende insidensrate, både i Norge og internasjonalt, men langt mindre uttalt enn for SD (3, 10, 21, 22).
Men hvorfor har de betahemolytiske streptokokkene så ulik epidemiologisk profil? Årsaken er sannsynligvis multifaktoriell, og involverer både vertsfaktorer, mikrobiell genetikk og patogenetiske mekanismer.
Vertsfaktorer
Noe av forklaringen til det epidemiologiske bildet kan relateres til at GAS, GBS og SD er assosiert med hver sin unike demografiske profil (Figur 3).
GBS har en topuklet aldersdistribusjon og rammer de nyfødte og de eldste, mens SD tilsynelatende har spesialisert seg på eldre mennesker.
GAS har derimot en overraskende jevn aldersfordeling, og kan tilsynelatende ramme unge mennesker uten åpenbar komorbiditet eller pre disposisjon for infeksjon.
I tråd med dette fant CoutureCossette en mye lavere median Charlsons Comorbidity Index (CCI) blant pasienter med GAS bakteriemi (median CCI 0), enn blant dem med GBS-bakteriemi (median CCI 2) eller SD-bakteriemi (median CCI 3) (3). En stor studie fra Finland kartla risikofaktorer litt nærmere, og sammenliknet personer med SD bakteriemi (n = 217) med friske kontroller (n = 10 000) (23). De fant at SD-sykdom var helt klart assosiert med komorbiditet i form av diabetes (OR 4.6, p < 0.001), hjerte/karsykdom (OR 3.1, p < 0.001) og overvekt (OR 2.1, p < 0.001).
GBS-bakteriemier har som nevnt en svakt stigende trend i Norge. Hvis man dissekerer insidenskurven finner man likevel at forekomsten blant nyfødte og mødre er relativt stasjonær (21). Antallet tilfeller blant ikke-gravide voksne, hovedsakelig eldre, er derimot sterkt økende (22). Tilsvarende utvikling er rapportert
Figur 3: Alders- og kjønnsfordeling av invasive betahemolytiske streptokokkinfeksjoner i Helse Bergen. Alders- og kjønnsfordeling for alle identifiserte tilfeller av bakteriemi forårsaket av GAS (n= 129), GBS (n = 267) og SD (n = 239) i Helse Bergen i perioden 2011 – 2021. På x-aksen vises antallet for hver aldersgruppe i prosent av det totale antallet tilfeller. De fleste tilfeller av SD rammer eldre mennesker, og det er en mannlig overvekt. GBS har predileksjon for nyfødte, fødende kvinner og eldre mennesker. GAS har en relativt jevn fordeling mellom ulike aldersgrupper og kjønn.
fra en lang rekke industrialiserte land (10, 13).
For både SD og GBS er tilsynelatende den epidemiologiske trenden i stor grad forbundet med en aldrende populasjon og en økning i komorbiditet og sårbarhet i befolkningen.
Ulik smittespredning
GAS har predileksjon for kolonisering og sykdom i øvre luftveier, og i likhet med andre luftveispatogene mikrober spres den via dråpesmitte. Dette understøttes også av at GAS har en tydelig sesongvariasjon med en topp i det kalde vinterhalvåret (19).
Flere studier har påvist at noen særegne GAS virulensfaktorer, inkludert superantigener, fører til en hyperaktivering av immunforsvaret lokalt i øvre luftveier (24). Dette fremprovoserer økt slimhinnesekresjon og er vist å sterkt potensere smitteoverføring og spredning av GAS i populasjonen.
GAS-infeksjoner har således potensiale til epidemisk spredning i befolkningen, noe som er dokumentert fra store utbrudd i militærleirer (25).
Nedstenging og sosial distansering under COVID-pandemien førte, som nevnt, til en kraftig nedgang også av bakteriemier forårsaket av andre luftveisbårne mikrober, som GAS (16, 26). Det er interessant at en tilsvarende nedgang aldri fant sted for GBS eller SD (14, 26). Årsaksmekanismene her er ikke klarlagt, men det kan indikere at invasiv GBS og SD i mindre grad skyldes eksogen smitte, men snarere har et
endogent utgangspunkt. Epidemiske utbrudd av GBS eller SD er heller aldri beskrevet, utover enkelte tilfeller av mat-båren smitte. Selv om begge mikrobene tidvis kan identifiseres som kolonisatorer i hals, gir de langt sjeldnere opphav til øvre luftveisinfeksjoner, og spredning via dråpesmitte er sannsynligvis langt mindre vanlig enn for GAS (3, 5). Superantigener påvises sjelden eller aldri i henholdsvis SD og GBS.
Ulik smitte og patogenese kan forklare en del av de observerte forskjellene i epidemiologisk mønster for de betahemolytiske artene: GAS som en luftveispatogen med klar sesongfluktuasjon og sporadiske epidemier, mens GBS og SD primært holder til i tarm og gir opphav til endogene infeksjoner i enkeltindivider. Sistnevnte gir et mer «endemisk» bilde i populasjonen, uten store årlige eller sesongbaserte svingninger.
Mikrobiell genetikk I samsvar med det epidemiske potensialet for GAS, er det vist at det stadig introduseres nye klonale varianter i befolkningen som forårsaker større eller mindre utbrudd (27). I mange av disse klonene har en identifisert genetiske endringer som øker mikrobens virulensegenskaper. De siste årene har den nye GAS M1UK-klonen spredt seg raskt, og er nå den dominerende genotypen i store deler av verden (16). En har påvist økt produksjon av superantigenet speA i denne klonen, noe som medfører økt transmisjon og spredning.
Tilsvarende klonale utbrudd har i liten grad vært rapportert for SD eller GBS, og i nesten alle epidemiologiske publikasjoner beskrives tvert imot en polyklonal bakteriepopulasjon (5, 20). En sammenlikning av SD genotyper i Sør-Korea og Japan fant knapt noen felles sirkulerende kloner i de to nabolandene (28).
De siste årene har man imidlertid for første gang påvist en SD-klon med global spredning, genotypen stG62647 (29). I Helse Bergen synes en stor del av økningen av invasive SD-infeksjoner det siste tiåret å kunne tilskrives introduksjonen av denne klonen (18). Den bærer en mutasjon i et genetisk område den har til felles med GAS, og tilsvarende mutasjoner i GAS har vist seg å gi opphav til svært virulente stammer. Dyreforsøk har sågar vist av stG62647-klonen er klart mer virulent enn tidligere sirkulerende SD varianter (30).
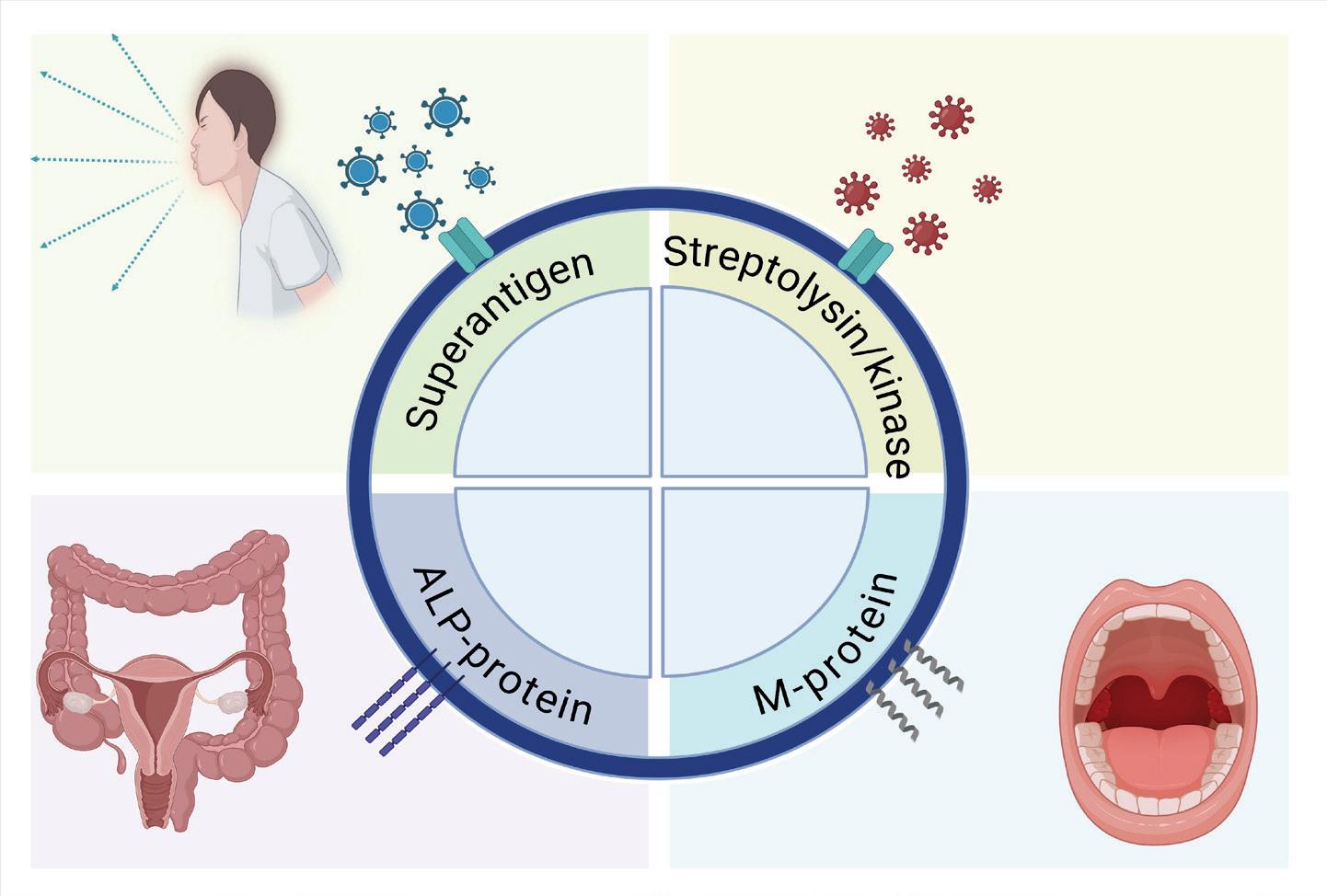
Generelt er det holdepunkter for utstrakt utveksling av genmateriale mellom GAS og SD (31). En rekke av kjente GAS virulensgener kan påvises i sirkulerende SD stammer, inkludert enzymer som medierer vevsinvasjon (Streptolysin O, Streptokinase), overflateproteiner som medvirker til adhesjon (M-protein) og tidvis også superantigener (Figur 4). Nylig har en blitt klar over at det nesten utelukkende er SD varianter som angriper mennesker som har ervervet seg disse GAS virulensgenene, mens SD som sirkulerer blant produksjonsdyr ikke har det (32).
Disseminering
Det kan være nærliggende å spekulere i om noe av oppsvinget i SD infeksjoner kan skyldes en gradvis tilpasning til den menneskelige vert gjennom genetiske bidrag fra GAS. Vi mangler dessverre longitudinelle data på SD genetikk som eventuelt kunne bidra til å belyse situasjonen.
Oppsummering og fremtidsutsikter
GAS er en virulent mikrobe med stort potensiale for å forårsake sykdom hos friske individer, og den spres lett som en luftbåren patogen. Sykdombyrden i samfunnet gjenspeiler
Referanser
1. Gunnarson RK, Holm SE, Søderstrøm M. «The prevalence of beta-haemolytic streptococci in throat specimens from healthy children and adults. Implications for the clinical value of throat cultures». Scand J Prim Health Care. 1997 Sep;15(3):149-55.
2. Oppegaard O, Mylvaganam H, Kittang BR. «Betahaemolytic group A, C and G streptococcal infections in Western Norway: a 15-year retrospective survey». Clin Microbiol Infect. 2015 Feb;21(2):171-8
3. Couture-Cossette et al. Secular trends in incidence of invasive beta-hemolytic streptococci and efficacy of adjunctive therapy in Quebec, Canada, 1996-2016. PLoS One, 2018.
4. Spellerberg B, Pathogenesis of neonatal Streptococcusagalactiae infections. Microbes and Infection, 2000.
5. Takahashi et al. Clinical aspects of invasive infections with Streptococcus dysgalactiae ssp. equisimilis in Japan: differences with respect to Streptococcus pyogenes and Streptococcus agalactiae infections. Clin Microbiol Infect, 2010.
6. Bruun et al. Etiology of Cellulitis and Clinical Prediction of Streptococcal Disease: A Prospective Study. Open Forum Infect Dis. 2015 Nov 25;3(1):ofv181.
7. Madsen et al. Patient's characteristics and outcomes in necrotising soft-tissue infections: results from a Scandinavian, multicentre, prospective cohort study. Intensive Care Medicine, 2019.
8. Oppegaard et al. Clinical and molecular characteristics of infective β-hemolytic streptococcal endocarditis. Diagn Microbiol Infect Dis. 2017 Oct;89(2):135142.
9. Bläckberg et al. Infective endocarditis due to Streptococcus dysgalactiae: clinical presentation and microbiological features. European Journal of Clinical Microbiology & Infectious Diseases, 2018.
10. Watkins et al. Epidemiology of invasive group B streptococcal infections among nonpregnant adults in the United States, 2008-2016. JAMA internal Medicine, 2019.

Figur 4: Overlappende genetiske og patogenetiske særtrekk ved betahemolytiske streptokokker. En forenklet oversikt over noen av de felles virulensfaktorene som har vært identifisert i GAS, GBS og SD. Superantigener synes å være involvert i flere patogenetiske prosesser, men dets betydning for disseminering har kommet frem først de senere år. Streptolysin O og streptokinase er viktige i patogenesen ved nekrotiserende bløtdelsinfeksjoner i både GAS og SD. Alle GBS har ALP-proteiner, og disse synes å mediere adhesjon til blant annet vaginalceller. Tilsvarende ALP-gener finnes også i ca. ¼-del av SD-isolatene, samt i noen få GAS-isolater. Figuren er laget i BioRender.
den kontinuerlige kampen mellom bakteriell evolusjon og flokkimmunitet i befolkningen, og den forårsaker følgelig jevnlige epidemier når vektskålen tipper i mikrobens favør.
Sykdom forårsaket av GBS og SD skyldes derimot sannsynligvis oftere endogen smitte, og oppstår antagelig som følge av svekket immunologisk motstandskraft hos enkeltindividet.
Raske endringer i forekomst som ved GAS epidemier er relativt enkle å fange opp, og de får også mye oppmerksomhet og medieomtale.
11. Carapetis JR, Steer AC, Mulholland EK et al. «The global burden of group A streptococcal diseases». Lancet Infect Dis. 2005 Nov;5(11):685-94.
12. Seale et al. Estimates of the Burden of Group B Streptococcal Disease Worldwide for Pregnant Women, Stillbirths, and Children. Clin Infect Dis. 2017 Nov 6;65(suppl_2):S200-S219.
13. Navarro-Thorne et al. Burden of invasive group B Streptococcus disease in non-pregnant adults: A systematic review and meta-analysis. PLoS One. 2021 Sep 30;16(9):e0258030.
14. NORM/NORM-VET 2005-2023. Usage of Antimicrobial Agents and Occurrence of Antimicrobial Resistance in Norway. ISSN:1502-2307.
15. Indremedisineren 2024-1.
16. Vieira et al. Rapid expansion and international spread of M1UK in the post-pandemic UK upsurge of Streptococcus pyogenes. Nature Communications, 2024.
17. Flamant et al. Invasive group A streptococcal infections: lessons learned from the 2022–23 upsurge. Lancet Infect Dis. 2025 Jul 9:S1473-3099(25)00343-3.
18. Oppegaard et al. Streptococcus dysgalactiae Bloodstream Infections, Norway, 1999-2021. Emerg Infect Dis. 2023 Feb;29(2):260-267.
19. Paspaliari et al. Invasive beta-haemolytic streptococcal infections, Finland, 2006 to 2020: increase in Lancefield group C/G infections. Eurosurveillance, 2023.
20. Shinohara et al. Clonal Expansion of MultidrugResistant Streptococcus dysgalactiae Subspecies equisimilis Causing Bacteremia, Japan, 2005–2021. Emerg Infect Dis. 2023.
21. Bergseng et al. Invasive group B streptococcus (GBS) disease in Norway 1996-2006. Eur J Clin Microbiol Infect Dis. 2008.
22. Uggen et al. Incidence of invasive infections with Group B streptococcus in adults in Norway 19962019: a nationwide registry-based case-control study. Infection. 2024.
23. Nevanlinna et al. Major risk factors for Streptococ-
Mer snikende epidemier, som utviklingen vi ser for SD går i stor grad under radaren. Gitt den nære koblingen til alder, diabetes og overvekt, er det nærliggende å tro at den kraftige økningen av SD og GBS-infeksjoner vi fortsette i industrialiserte land. Sykdomsbyrden forårsaket av disse to mikrobene vil medføre en stor belastning på folkehelsen, spesielt i den eldre del av befolkningen.
Kanskje burde FHI innføre MSISovervåkning også av SD-infeksjoner?
cus dysgalactiae subsp. equisimilis bacteremia: a population-based study. BMC Infectious Diseases, 2023.
24. Kaspar et al. Bacterial superantigens promote acute nasopharyngeal infection by Streptococcus pyogenes in a human MHC Class II-dependent manner. PLoS Pathog. 2014 May 29;10(5):e1004155.
25. Crum NF, Russell KL, Kaplan EL et al. «Pneumonia outbreak associated with group a Streptococcus species at a military training facility». Clin Infect Dis. 2005 Feb 15;40(4):511-8.
26. Shaw et al. Trends in invasive bacterial diseases during the first 2 years of the COVID-19 pandemic: analyses of prospective surveillance data from 30 countries and territories in the IRIS Consortium. Lancet Digital Health, 2023.
27. Xie et al. Temporal and geographical lineage dynamics of invasive Streptococcus pyogenes in Australia from 2011 to 2023: a retrospective, multicentre, clinical and genomic epidemiology study. Lancet Microbe. 2025
28. Kim et al. Molecular Epidemiological Features and Antibiotic Susceptibility Patterns of Streptococcus dysgalactiae subsp. equisimilis Isolates from Korea and Japan. Ann Lab Med. 2018 May;38(3):212-219.
29. Oppegaard et al. Emergence of a Streptococcus dysgalactiae subspecies equisimilis stG62647-lineage associated with severe clinical manifestations. Sci Rep. 2017 Aug 8;7(1):7589.
30. Beres et al. Analysis of the Genomics and Mouse Virulence of an Emergent Clone of Streptococcus dysgalactiae Subspecies equisimilis. Microbiol Spectr. 2023 Mar 27;11(2):e0455022.
31. Xie et al. Inter-species gene flow drives ongoing evolution of Streptococcus pyogenes and Streptococcus dysgalactiae subsp. Equisimilis. Nature Communications, 2024.
32. Porcellato et al. Whole genome sequencing reveals possible host species adaptation of Streptococcus dysgalactiae. Scientific Reports, 2021
Erysipelas og cellulitt er vanlige årsaker til innleggelse ved medisinske avdelinger, og de fleste indremedisinere får god erfaring med disse tilstandene. Retningslinjene for diagnostikk og behandling er enkle. Likevel viser det seg at overdiagnostikk og overbehandling er svært vanlig. En medvirkende årsak kan være seiglivede myter og behandlingstradisjoner.
Trond Bruun, seksjonsoverlege og førsteamanuensis, Infeksjonsseksjonen, Medisinsk klinikk, Haukeland universitetssykehus og Universitetet i Bergen

Introduksjon
Hud- og bløtdelsinfeksjoner er hyppige årsaker til innleggelser i sykehus og tilhørende antibiotikabruk. I en studie av 219 pasienter med non-purulente hud- og bløtdelsinfeksjoner behandlet ved Haukeland universitetssykehus ble det startet med hele 23 ulike antibiotikaregimer ved innkomst (1). Liknende funn forenlig med overbehandling er også rapportert internasjonalt (2). Uklar diagnose kan være en viktig årsak, men kanskje er det også behov for å avlive en del seiglivede myter som kan bidra til mangelfull etterlevelse av retningslinjer og overforbruk av antibiotika i denne relativt store pasientgruppen. Både internasjonalt og ved Haukeland er det de siste årene gjort klinikknære studier som setter spørsmålstegn ved flere mer eller mindre etablerte sannheter og behandlingstradisjoner.
Myte #1. Erysipelas og cellulitt er to forskjellige sykdommer I Norge har vi tradisjon for å skille mellom erysipelas og cellulitt, der erysipelas angir en overfladisk infeksjon i dermis, med skarpt avgrenset hevelse og lakserødt erytem (figur 1A). Cellulitt brukes om dypere infeksjoner der også subcutis er affisert, ofte med mindre uttalt erytem, mer hevelse og der avgrensingen ikke er skarp. Det viser seg imidlertid at skillet kanskje ikke er så skarpt (figur 1B) (3). I en kohort med 216 pasienter med erysipelas og cellulitt ved Haukeland universitetssykehus hadde nesten halvparten av pasientene overlappende klinikk, f.eks. skarpt avgrensede lesjoner med affeksjon av subcutis (4). Der
det ikke foreligger klassisk erysipelas, er det nok lett å komme i tvil. Er penicillin tilstrekkelig? I bl.a. USA og Storbritannia skiller de i mindre grad mellom erysipelas og cellulitt. Ofte brukes betegnelsen cellulitt eller non-purulent cellulitt også på erysipelas, og de behandler i stor grad disse infeksjonene likt. Kanskje har dette noe for seg, da etiologien ofte er lik (se nedenfor).
Myte #2. Erytem rundt en abscess = cellulitt
Rett behandling forutsetter rett diagnose. Cellulitt behandles med antibiotika. Abscesser behandles med insisjon og drenasje. Også ved erytem rundt en abscess er det vanligvis tilstrekkelig med kirurgisk behandling. Det er primært ved større abscesser (>2 til 5cm) eller systemisk påvirkning at det er indisert med antibiotika som tilleggsbehandling. Den amerikanske infeksjonsforeningen, Infectious Diseases Society of America (IDSA) presiserer i sin retningslinje tydelig skillet mellom cellulitt og abscess: «The term “cellulitis” is not appropriate for cutaneous inflammation associated with collections of pus, such as in septic bursitis, furuncles, or skin abscesses” (5).
Myte #3. Erysipelas skyldes alltid Streptococcus pyogenes Streptococcus pyogenes (gruppe A streptokokker) har vært den klassiske årsaken til erysipelas. De siste tiårene har det imidlertid vært en endring i epidemiologien når det gjelder hudinfeksjoner med betahemolytiske streptokokker. Som redegjort for i egen artikkel i dette
nummer, er Streptococcus dysgalactiae, tidligere ofte angitt som gruppe C og G streptokokker, stadig oftere påvist som årsak til infeksjoner, også invasive infeksjoner med vekst i blodkultur (6, 7). Dette gjelder også som årsak til erysipelas og cellulitt (4, 8, 9). Spesielt underekstremitetsinfeksjoner synes å være assosiert med S. dysgalactiae (figur 1B) (4).
Myte #4. Cellulitt skyldes oftest Staphylococcus aureus Staphylococcus aureus (gule stafylokokker) ble tidligere ansett som den viktigste årsaken til dypere cellulitt, mye på bakgrunn av eldre studier med dyrkning av biopsier. I en nyere biopsistudie brukte de derimot PCR og fant at S. aureus var like ofte å finne i frisk som i syk ekstremitet (4). Hyppige funn av S. aureus i biopsistudier har nok også vært uttrykk for at umodne abscesser, og andre purulente infeksjoner har vært feilklassifisert som cellulitt. Serologistudier med bruk av antistoffanalyser tyder på at streptokokker er vanligste årsak ikke bare ved erysipelas, men også ved ikke-purulent cellulitt (4,10). Også der S. aureus påvises i sår eller inngangsporter, tyder serologi på at streptokokker er vanligste årsak (4). At S. aureus har vært overvurdert som årsak støttes også av studier som har vist at selv i land der meticillinresistente S. aureus (MRSA) er hyppig, så er det ikke bedre behandlingsresultater av å gi antibiotika som også dekker MRSA (11). I norske retningslinjer anbefales stafylokokk penicillin ved cellulitt, dvs. der det ikke foreligger klassisk erysipelas. Kunnskapsgrunnlaget for å dekke mot stafylokokker er

Figur 1: Klassisk erysipelas er lett å identifisere og er i praksis en streptokokksykdom. Cellulitt er en mer heterogen tilstand med varierende etiologi. A. Erysipelas med skarpt avgrenset overfladisk infeksjon (i dermis). Forårsakes ikke bare av Streptococcus pyogenes, men kan også skyldes Streptococcus dysgalactiae, sjelden andre agens. B. Cellulitt. Hos denne pasienten går infeksjonen dypere enn erysipelas og affiserer både epidermis (med bullae), dermis og subcutis. Her sees samtidig tegn typiske for erysipelas (kraftig, frisk rødfarge og relativt skarp avgrensning). Slike tilfeller med overlappende klinikk er vanlig. Ikke-purulent cellulitt skyldes vanligvis streptokokker, men kan også skyldes andre agens. Denne pasienten var immunsupprimert og hadde vekst i blodkultur av S. dysgalactiae. Denne arten er spesielt vanlig hos eldre, kronisk syke og immunsvekkede. Det er primært immunsvekkede og pasienter med alvorlig cellulitt som har nytte av blodkultur.

imidlertid svakt ved ikke-purulente infeksjoner (12). Penicillin er trolig godt nok i de fleste tilfeller.
Myte #5. Diffust erytem i hud + feber eller høy CRP = indikasjon for antibiotika
Flere ikke-infeksiøse tilstander kan likne cellulitt, som venøs stasedermatitt, lipodermatosklerose, kontakteksem, insektsstikk, urinsyregikt og dyp venetrombose. Det er vist at feilbehandling av disse med antibiotika er svært vanlig (13). Feber, allmennsymptomer og forhøyet CRP kan styrke mistanken om infeksjon, men f.eks. urinsyregikt gir ofte både feber og høy CRP. En nøye og samlet vurdering av klinikk og supplerende undersøkelser er avgjørende der klinikken ikke er typisk. Hudlegetilsyn er vist å kunne redusere antibiotikabruk i denne sammenhengen (13).
Myte #6. Blodkultur er indisert ved erysipelas og cellulitt innlagt i sykehus Ved innleggelse av pasienter med feber og mistanke om infeksjon tas det ofte rutinemessig blodkultur. Erysipelas er i praksis en streptokokksykdom. Streptokokker er følsomme for penicillin og frekvensen av positiv blodkultur er under 5% i de fleste studier. Blodkultur har derfor lav nytteverdi (14). Dypere cellulitt er en mer heterogen tilstand, og ved mistenkt sepsis eller hos immunsvekkede (figur 1B) er blodkultur viktig, spesielt med tanke på å påvise andre agens enn streptokokker. Mikrobiologiske undersøkelser er generelt av underordnet betydning ved cellulitt pga. lav sensitivitet (blodkultur), men også pga. lav spesifisitet (sårprøver). Funn av andre bakterier enn streptokokker gjenspeiler oftest
kolonisering (4). Ukritisk bruk av sårprøver kan lett føre til unødig bredspektret behandling (1).
Myte #7. Stafylokokkpenicilliner virker for dårlig mot streptokokker
Er kloksacillin godt nok ved cellulitt der en er i tvil om det er streptokokkeller stafylokokketiologi? En randomisert studie har undersøkt dette (15). Behandlingsresponsen var like rask i gruppen som kun fikk stafylokokkpenicillin (flukloksacillin) intravenøst som hos dem som fikk penicillin i tillegg. Resultater etter utreise var ikke undersøkt, men studien indikerer likevel at stafylokokkpenicillin oftest gir god respons ved ukomplisert streptokokk-cellulitt, i hvert fall når det gis intravenøst. Det er derfor trolig sjelden nyttig å gi penicillin og kloksacillin samtidig.
Seiglivede myter og behandlingstradisjoner kan bidra til mangelfull etterlevelse av retningslinjer og overforbruk av antibiotika.
Myte #8. Klindamycin bør gis som tilleggsbehandling ved hissig cellulitt eller sen behandlingsrespons Klindamycin har en viktig rolle ved alvorlige streptkokkinfeksjoner som nekrotiserende fasciitt, spesielt for å redusere toksin-effekten. Dette har nok bidratt til at klindamycin ofte legges til også ved cellulitt eller erysipelas hvis hudforandringene er uttalte eller behandlingsresponsen er treg. En randomisert studie har sammenlignet respons hos pasienter behandlet med stafylokokk penicillin alene med pasienter som fikk klindamycin i tillegg. Ingen signifikant forskjell ble funnet i respons dag 5, men ikke uventet fikk klindamycingruppen oftere diaré. Kanskje er vi for utålmodige i forhold til behandlingsrespons. I vår Haukelandsstudie så vi at noen pasienter responderte tregere uten at det var assosiert med behandlingssvikt (16). Klindamycin brukes trolig for ofte.
Myte #9. Diabetikere trenger bredspekret behandling Terskelen for å gi bredspektret behandling er lavere for sårbare
Referanser
1. Rath E, Skrede S, Oppegaard O, Bruun T. Nonpurulent skin and soft tissue infections: predictive power of a severity score and the appropriateness of treatment in a prospective cohort. Infect Dis (London). 2020; 52: 361-71.
2. Marwick C, Broomhall J, McCowan C et al. Severity assessment of skin and soft tissue infections: cohort study of management and outcomes for hospitalized patients. J Antimicrob Chemother. 2011; 66: 387-97.
3. Cranendonk DR, Lavrijsen APM, Prins JM, Wiersinga WJ. Cellulitis: current insights into pathophysiology and clinical management. Neth J Med. 2017; 75: 36678.
4. Bruun T, Oppegaard O, Kittang BR et al. Etiology of Cellulitis and Clinical Prediction of Streptococcal Disease: A Prospective Study. Open Forum Infect Dis. 2016; 3: ofv181.
5. Stevens DL, Bisno AL, Chambers HF et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis 2014; 59:e10-52.
6. Oppegaard O, Mylvaganam H, Kittang BR. Betahaemolytic group A, C and G streptococcal infections in Western Norway: a 15-year retrospective survey. Clin Microbiol Infect. 2015; 21: 171-8.
pasientgrupper. Streptokokker er imidlertid vanligste årsak også ved erysipelas og cellulitt hos diabetikere, immunsvekkende og andre med alvorlig komorbiditet (4). Det er velkjent at tarmbakterier kan gi alvorlige infeksjoner ved kroniske diabetessår. Men ved nyoppståtte, ikke-alvorlige diabetes fotinfeksjoner er både norske og internasjonale retningslinjer klare på at det er gram positive agens (streptokker og stafylokokker) som er vanligst (17). Penicillin eller stafylokokkpenicillin er derfor rett behandling også til denne gruppen.
Myte #10. Cellulitt og erysipelas skal behandles i minst 7 dager Anbefalt behandlingstid ved bakterielle infeksjoner har ofte vært 7, 10 eller 14 dager. Dette har ofte hatt bakgrunn i tradisjoner og erfaring, og i mindre grad i studier som har sammenlignet behandlingslengde. Nyere studier viser imidlertid at kortere kurer er nok ved mange infeksjoner. I antibiotikaretningslinjene for primær helsetjenesten er 5 dager nå satt som standard behandlingstid ved erysipelas og
7. Oppegaard O, Glambek M, Skutlaberg DH et al. Streptococcus dysgalactiae Bloodstream Infections, Norway, 1999-2021. Emerg Infect Dis. 2023; 29: 2607.
8. Gunderson CG, Martinello RA. A systematic review of bacteremias in cellulitis and erysipelas. J Infect. 2012; 64:148-55.
9. Siljander T, Karppelin M, Vahakuopus S et al. Acute bacterial, nonnecrotizing cellulitis in Finland: microbiological findings. Clin Infect Dis 2008; 46: 855-61.
10. Jeng A, Beheshti M, Li J, Nathan R. The role of betahemolytic streptococci in causing diffuse, nonculturable cellulitis: a prospective investigation. Medicine (Baltimore). 2010; 89: 217-26.
11. Pallin DJ, Binder WD, Allen MB, et al. Clinical trial: comparative effectiveness of cephalexin plus trimethoprim-sulfamethoxazole versus cephalexin alone for treatment of uncomplicated cellulitis: a randomized controlled trial. Clin Infect Dis 2013; 56:1754-62.
12. Karakonstantis S. Is coverage of S. aureus necessary in cellulitis/erysipelas? A literature review. Infection. 2020; 48: 183-91.
13. Lin V, Callado GY, Pardo I, Gutfreund M, et al. Diagnostic stewardship and dermatology consultation in cellulitis management: a systematic literature review and meta-analysis. Arch Dermatol Res. 2024; 317: 61.
cellulitt på bakgrunn av nyere studier (18, 19). I sykehus er syv dager fremdeles standard. Trenden går ikke bare mot kortere, men også mot mer persontilpasset behandlingslengde. Ved alvorlige infeksjoner, immunsvekkelse eller sen respons er lengre behandlingstid indisert. Å finne rett behandlingslengde hos den enkelte kan imidlertid være utfordrende. Skal vi behandle til inflammasjonstegnene er borte? I en nyere studie var vedvarende inflammasjonstegn ved avsluttet antibiotikakur ikke assosiert med tilbakefall (20). Trolig behandler vi ofte for lenge i en del tilfeller der inflammasjonstegn vedvarer.
Konklusjon
Ulike myter og tradisjoner om håndtering av cellulitt og erysipelas kan bidra til overdiagnostikk og overbehandling av disse vanlige tilstandene. For å øke kvaliteten i behandlingen kreves trolig større bevissthet om differensialdiagnoser, streptokokkenes dominans som årsak, forsiktighet ved tolkning av sårprøver, at respons kan ta tid, og ikke minst at retningslinjer anerkjennes og følges.
14. Ko LN, Garza-Mayers AC, St John J, et al. Clinical Usefulness of Imaging and Blood Cultures in Cellulitis Evaluation. JAMA Intern Med. 2018;178: 994-6.
15. Leman P, Mukherjee D. Flucloxacillin alone or combined with benzylpenicillin to treat lower limb cellulitis: a randomised controlled trial. Emerg Med J. 2005; 22: 342-6.
16. Bruun T, Oppegaard O, Hufthammer KO, et al. Early Response in Cellulitis: A Prospective Study of Dynamics and Predictors. Clini Infect Dis: 2016; 63:10341041.
17. Senneville E, Albalawi Z, van Asten SA, et al. IWGDF/ IDSA Guidelines on the Diagnosis and Treatment of Diabetes-related Foot Infections (IWGDF/IDSA 2023). Clin Infect Dis 2023:ciad527. doi: 10.1093/cid/ciad527.
18. Cranendonk DR, Opmeer BC, van Agtmael MA, et al. Antibiotic treatment for 6 days versus 12 days in patients with severe cellulitis: a multicentre randomized, double-blind, placebo-controlled, non-inferiority trial. Clini Microbiol Infect. 2020; 26: 606-12.
19. Williams OM, Brindle R. Antibiotic route and duration of therapy for cellulitis: data extracted from a multi-center clinical trial. International journal of antimicrobial agents. 2020; 56:106076.
20. Williams OM, Hamilton F, Brindle R. The Natural History of Antibiotic-Treated Lower Limb Cellulitis: Analysis of Data Extracted From a Multicenter Clinical Trial. Open Forum Infect Dis. 2023;10: ofad488.
Nekrotiserende bløtdelsinfeksjoner («NSTI») er forskjellige, svært alvorlige infeksjoner som forårsaker vevsødeleggelse, noen ganger svært hurtig. Nesten alle pasientene har sepsis, mange septisk sjokk, og rundt 20% dør Over lang tid har det vært lite utvikling av standardbehandlingen og resultatene lite forbedret. I denne artikkelen presenteres områder for særlig oppmerksomhet og muligheter for forbedringer.
Steinar Skrede, assisterende klinikkdirektør Medisinsk klinikk, Haukeland universitetssjukehus og professor II ved Klinisk institutt 2, Universitetet i Bergen.
Bakgrunn
Med nekrotiserende bløtdelsinfeksjoner forstår vi tilstander som må diagnostiseres av kirurg på operasjonsstua (1,2). Det foreligger ingen entydige kliniske kriterier for per operative vurderinger, men sentrale indikasjoner inkluderer løsning av hud, misfarget ødemvæske ved incisjon, tromboser av små eller større kar, vevsnekroser i dypt vev med udefinerbar anatomi, og fortykkete, misfargete eller løse muskelfascier (Figur 1). Tidvis kan løsning av vev foregå ved stump disseksjon. Abscesser er ikke med i gruppen og vanligvis er det fravær av puss (1, 2).
Vi har nylig presentert en norsk oversikts artikkel om infeksjonene, som ofte forkortes til «NSTI» (necrotizing soft tissue infections), en betegnelse som har fått fotfeste internasjonalt (3). Kort oppsummert er forekomsten ukjent i Norge, men hvert år får trolig 150-200 pasienter tilstanden. Langt de fleste er voksne, og forekomsten er høyest blant de eldste (4). NSTI kategoriseres grovt i infeksjoner forårsaket av obligat anaerobe mikrober i samspill med andre bakterier, oftest gramnegative intestinale stavbakterier (type 1), eller av enkeltmikrober som er uavhengige av samspill med andre mikrober (type 2), hyppigst S. pyogenes (gruppe A streptokokker; GAS) (5). Type 1 infeksjoner er hyppigst og antallet tilfeller øker langsomt, mens forekomsten av type 2 infeksjoner svinger, med en svær, forbigående økning i 2023-24 (se Oppegaard i dette nummeret).
Behandlingen består i tillegg til kirurgi i intravenøse antibiotika. Det er to aktuelle, empiriske antibotikaregimer
(6). Det første velges ved infeksjoner i ekstremiteter, der betahemolytiske streptokokker dominerer, og består av kombinasjonen av benzylpenicillin, gentamicin og klindamycin. Det andre består av kombinasjonen piperacillin-tazobaktam og klindamycin og er foretrukket empirisk valg ved infeksjoner i hode-hals- og bukbekken-regionene, der polymikrobiell etiologi er hyppigst (6).
Klindamycin skal alltid være ett av midlene. Det rettes mot streptokokker, stafylokokker, Clostridiumarter og hemmer proteinsyntese, inkludert produksjon av toksiner. Annen akuttbehandling inkluderer surstoff, krystalloider (Ringeracetat), opiater og vanligvis rask overføring til intensivavdeling for mer avansert støttebehandling som vasopressorer og respiratorbehandling. Bruk av blodprodukter er indisert hos et mindretall, mens IVIG og trykkammerbehandling er omdiskutert.
Hjørnesteinsbehandlingen vil alltid være kirurgi, som er livreddende, men tidvis mutilerende (1). Samtidig har indremedisineren viktige roller i diagnostikk og valg av øvrig behandling, inkludert vurdering av behandlingsavklaring. Vi har også sentrale oppgaver i videreutvikling og forbedring av tiltak. I senere tid er det kommet en viss utvikling av diagnostiske hjelpemidler. Økt kunnskap om unik patogenese ved ulike NSTI-former (7) er ennå ikke omsatt i nye behandlingsanbefalinger, men kliniske studier av gamle og nye adjuvante behandlinger er innen rekkevidde.
Tid fra innkomst til kirurgi ved NSTI er sterkt knyttet til dødsrisiko, med dokumentert statistisk signifikant bedre overlevelse ved kirurgi innen 6 timer (8). Samtidig rapporteres det jevnlig om forsinkelser i behandlingen, som kan forårsakes av pasient, i legevakt og sykehus. Forbedringer rettet mot prosesser og tiltak som har med tidsaspektet å gjøre vil derfor kunne være særlig nyttige.
Når NSTI er arbeidsdiagnosen; Utfør kirurgisk eksplorasjon Når arbeidsdiagnosen er NSTI, må pasienten snarest til kirurgisk eksplorasjon og eventuell behandling, uten at man igangsetter mulig forsinkende (diagnostiske) tiltak (9). I tabell 1 sammenstilles informasjon som er tilgjengelig tidlig og ofte før man har utført omfattende supplerende diagnostikk.
Tabell 1, rød kolonne angir funn til støtte for at NSTI kan være hoveddiagnosen og senker terskelen for å sende pasienten direkte til kirurgisk eksplorasjon og behandling. Klinisk kan NSTI skilles fra cellulitt ved bruk av et skårsystem (10) som vi har modifisert (11) og som senere er eksternt validert (12), der «mistenkt NSTI, NEWS >5 og qSOFA ≥2» skiller NSTI fra cellulitt og styrker indikasjon for kirurgi. Ved mottak fyller flertallet kriteria for sepsis og inntil halvparten for septisk sjokk (50%) (13). Dette er sjelden ved den hyppigste differensialdiagnosen, cellulitt (14).
Mange pasienter har behov for systemiske opiater for at full klinisk undersøkelse skal la seg gjennomføre, noe som er svært uvanlig blant pasienter med differensialdiagnostiske tilstander som erysipelas,

cellulitt, flegmone, septisk artritt, postoperativ sårinfeksjon eller dyp venetrombose. Blant «klassiske funn» som trekker i retning av akuttkirurgi er hemoragisk bulladannelse, gangren i hud, tap av berøringssans og gass, men tross høyere spesifisitet for NSTI er dette mindre nyttige funn på gruppenivå, da de er sent opptredende og sjelden forekommende (15).
Tabell 1, gul kolonne angir funn og opplysninger som har lav spesifisitet for NSTI fordi de forekommer også ved langt vanligere tilstander. Selv om pasientrapporterte symptomer og tegn er betydningsfulle (og funnene kan ha nokså høy spesifisitet for NSTI når de opptrer i riktig klinisk sammenheng), så er den positive prediktive verdien av dem lav. Pasientrapporterte tegn ved NSTI inkluderer lokale sterke smerter, kroppsverk, ødem og varme i affisert vev, etter hvert rødme i hudoverflate, rask forverring av smerter og allmenntilstand, forvirring, uvelhet, diare og hjertebank (16). Ødem kan være det første objektive lokale funnet, mens rødhet og varme er variabelt, avhengig av om det er lokal inngangsport gjennom sår og overfladisk spredning av markert rødme, eller hematogen spredning med infeksjonstart i dyptliggende vev, oftere uten eller med diffus rødme i starten.
Mistenkt NSTI med NEWS>5 og qSOFA ≥2
Septisk sjokk
Diskrepans kliniske tilstand og funn
Smerter sterkere enn svarende til funn ved lokalstatus
Frostrier, assosiert med bakteriemi, og hypotensjon er begge hyppigere ved NSTI enn ved alternativene. Alle disse opplysningene må tolkes sammen med øvrige kliniske data.
I Haukeland har vi gitt oppgaven å avklare eventuell mistanke om NSTI til vaktlaget i Medisinsk klinikk, i samarbeid med (plastikk-)kirurg, fordi vaktlaget vårt tar imot langt de fleste pasientene med aktuelle differensialdiagnoser og håndterer organsvikter som må korrigeres i spesialenhet. Videre arbeid er tverrfaglig og rutiner for dette etablert på tvers av en rekke fagspesialiteter, noe som sikrer raske håndteringer (3). Rett organisering av tjenesten er avgjørende for rasjonelle mottak ved NSTI. Tilgang på kirurg kan være utfordrende i en del sykehus, men det viktigste er å sikre tilgjengeligheten av kirurg fremfor et tenkt, ideelt valg av ansvarlig grenspesialist, er vurderingen i en nyere oversiktsartikkel i JAMA Surgery (9). Sentralisering av kirurgi til større sykehus er et annet omdiskutert tema (17) og må vurderes på tvers av spesialiteter før eventuelle beslutninger tas. I land som har sentralisert tjeneste og kort vei til nasjonalt senter, som i Danmark, er det fremdeles primærsykehusets oppgave å gjøre første kirurgiske behandling før overføring (13).
Opiatkrevende smerter for at full klinisk status skal la seg gjennomføre
Rask forverring
Sene funn:
(Hemorrhagiske) bullae
Vevskrepitasjoner
Overflatenekroser
Tap av sensibilitet
Når NSTI er en differensialdiagnose; Rask og rasjonell utredning
I tilfeller der NSTI er en mulig tilstand, men ikke den primære diagnose, er supplerende diagnostikk aktuelt. Det er viktig å ha bevisst forhold til at tester som tar tid kan medføre risiko for prognosetap dersom pasienten har NSTI, og at tester med lav kvalitet kan medføre ubegrunnet svekkelse av mistanke om NSTI.
Kirurgisk eksplorasjon som undersøkelse
Dersom man utfører tester som styrker mistanken om NSTI, er det kirurgisk eksplorasjon i full narkose som gjelder. I noen sykehus benyttes en omdiskutert metode kalt «finger test» i akuttmottak. Man legger ett eller flere «2 cm lange snitt» for å se etter ødemvæske,palpere for å påvise vevsdestruksjon eller utføre eventuelle hurtigtester. Dersom mistanken om NSTI styrkes er det mer aktuelt med kirurgisk eksplorasjon og behandling. Denne testen er lokalt i Haukeland ikke anbefalt. Under søkelsen er svakt vitenskapelig belagt og vi vurderer at risikoen for å overse funn i dypet er for høy til at metoden kan tillegges vekt. Jeg er tilhenger av gode incisjoner for undersøkelse av dypereliggende vev, med et konkret eksempel på dette vist i i figur 2.
Feber, frostrier
Rød eller misfarget hudoverflate
Ødem og varme lokalt
Lokale sterke smerter
Hypotensjon
Kroppsverk
Mental uro, forvirring, infeksjonsdelir
Kroniske sår
Enhver kirurgi siste 4 uker
Stumpt traume
Penetrerende traume
Medikamentell immunsuppresjon
Aktiv kreftsykdom
Diabetes mellitus
Rusmisbruk
Influensa, vannkopper, hepatitt C
Tabell 2. Obligatoriske (grønn), aktuelle (gul) og frarådede (rød) diagnostiske hjelpemidler ved mistenkt NSTI
Klinisk biokjemiske analyser Blodgass, «sepsisprøver», blodtyping, pretransfusjonsprøver.
Forberede kirurgi tidlig i beslutningsprosessen.
Blodkulturer To sett aerob + anaerob flaske. Positive hos inntil 40% av pasienter med NSTI.
Per operative dype prøver til mikrobiologiske analyser
Per operativ diagnostikk inkluderer Gramfarging, mikroskopi, dyrkning.
Laboratorieskårsystemer Kan ikke sikkert skille NSTI fra cellulitt, men «påvirker kliniske vurderinger».
Pre operativ CT/MR Kan ev. påvise gass i vev, fasciefortykkelse, ødem, utgangspunkt for infeksjon og utbredelse. Sensitivitet og spesifisitet rundt 90%. Må ikke forsinke kirurgi
Ultrasonografi Økende dokumentasjon. Tilgjengelig, rask, non-invasiv. Væskesjikt langs vevsplan mest sensitivt (fra 85%), subkutan gass mest spesifikt (fra 92%).
Perkutane aspirat Gramfarging, dyrkning (subsidiært antigentester, PCR-analyser). Svært lav sensitivitet for NSTI.
Tom-røntgen Kan påvise gass i vev. Lav sensitivitet for NSTI (<50%), høy spesifisitet (>90%).
Per operativ histopatologi Mangelfulle vurderingskriterier. Ikke egnet til å skille NSTI fra non-NSTI. Ikke evne til sikkert å gi alvorlighetsgrad
Velger man å finne frem kniven som ledd i diagnostikk, bør det være på en operasjonssal. Med denne strategien må man akseptere at noen pasienter gjennomgår kirurgisk eksplorasjon, der man finner annen tilstand enn NSTI. I en studie av mistenkt NSTI var det 20% av de opererte som ikke hadde denne infeksjonen (18). Tross noen forbehold er det, etter min vurdering akseptabelt med høyere negative rater enn 20%, særlig ved fokus i (under-)ekstremitet, som er det hyppigste. Per operativ histopatologisk under søkelse har svakheter i diagnostikk som gjør at vi fraråder bruk av metoden (19).
Stol ikke på skårsystem basert på blodprøveanalyser
Flere skårsystemer er foreslått til bruk for å skille pasienter med NSTI fra pasienter med cellulitt. Den laboratoriebaserte LRINEC skåren (20) har blitt testet ut i flere studier, med variable resultater (tabell 2). Gjennomgående er sensitiviteten lav (21) og i WSES-retningslinjene fra 2022 er de ikke anbefalt (1). Andre skårsystem basert på kombinasjoner av enkle kliniske opplysninger og biomarkører i blod kan vise seg nyttige til å skille cellulitt og NSTI, men ytterligere validering behøves før de kan tas i bruk (22,23). Vi har identifisert enkelte nye biomarkører som muligvis kan skille pasienter med mistenkt NSTI fra annen alvorlig
Korrekt tatt dyrkningsprøver er positive i >90% av tilfellene. PCR-tester og GAS-hurtigtest på vev har mangelfull dokumentasjon, men er aktuelle i kliniske studier.
Diagnostisk: LRINEC-score: Lav sensitivitet (≥41%), variabel spesifisitet (≥88%). S-thrombomodulin kan muligvis skille NSTI fra mistenkt NSTI, mens IL-1β , IL-6, IL22, TNF- α , CXCL8, MMP-8, pentraxin-3, S100A8 ev. kan skille streptokokk-NSTI fra streptokokk-cellulitt. Ikke eksternt validert, ikke lett tilgjengelige.
Prognostisk: enkeltfaktorer assosiert med uønskete utfall; hyponatremi, hyperlaktatemi, kreatininstigning. ICAM-1, suPAR, pentraxin-3 er kandidater, ikke eksternt validert, begrenset tilgjengelighet
Vurderes når NSTI bare er differensialdiagnose, der eksplorasjon vurderes som mindre aktuelt. Aktuelt ved behov for vurderinger av anatomisk krevende område, eller som ledd i oppfølging ved uventet behandlingsforløp.
Mangelfulle data vedrørende sammenligning med differensialdiagnoser. Gass sent funn. Vanskelig å opparbeide erfaring. Høy risiko for utøvervariabilitet.
Svar på et aspirat har verdi utelukkende når mikroskopi er positiv, mens negative prøver er non-informative.
Liten nytte. Gass opptrer oftest sent og er dermed mindre vanlig.
Høy interrater variabilitet. Lav sensitivitet og spesifisitet. Vi fraråder bruk av metoden.
bløtdelsinfeksjon (24) og streptokokkcellulitt fra streptokokk-NSTI (25), men analysene er verken eksternt validert eller i rutinemessig bruk. Tilsvarende gjelder for biomarkører som gir prognostisk informasjon ved NSTI (26).
Mikrobiologisk diagnose er viktig
Det er mulig å stille mikrobiologisk etiologisk diagnose ved dyrkning hos nesten alle opererte pasienter med NSTI (13). Av flere grunner kan det ha betydning å stadfeste mikrobeetiologi allerede før operasjon, men ennå lar det seg ikke gjøre. Blodkulturer er obligatorisk ved mistenkt NSTI (1) og i den største prospektive studien av NSTI til nå, INFECT, var de positive hos 40% (13). Per operativ prøve -
Monomikrobiell nekrotiserende bløtdelsinfeksjon i underekstremitet forårsaket av Streptococcus dysgalactiae

taking til dyrkning er obligatorisk og svært nyttig. I INFECT-studien oppnådde vi vekst ved dyrkning av per operative vevsprøver fra dypet hos 93% av 409 pasienter (13). Vi opplever god nytte av gramfarging og mikroskopi per operativt også. Enkelte sykehus benytter hurtigtest for påvisning av S. pyogenes, men kommersielle tester er ikke validert for bruk på sterilt vev og studier av bruken er mangelfulle. Nyere metodikk inkluderer PCR baserte analyser, til mikrobeidentifikasjon i blod og vev pre- og per operativt. Studier pågår, men mulig bruk i hverdagen ligger enda et godt stykke fram. En eldre metode er «saltvannsaspirat» fra dyptliggende vev, men evidensgrunnlaget er tynt. Vi har gjort pilottesting av kvaliteten av aspirasjon på operasjonsstua, før incisjon er foretatt, og sammenlignet med dype per operative prøver. Vår opplevelse er at metoden har svært lav sensitivitet (upubliserte data). Det er min vurdering at analyseresultat av aspirasjon bare kan tillegges vekt i akuttvurderinger dersom et grampreparat viser tilstedeværelse av mikrober.
I senere tid er det gjennomført studier av presisjon av bildediagnostiske metoder, sammenfattet i tabell 2. Dersom de gjennomføres, anbefales også her å tillegge kliniske vurderinger større vekt enn bildediagnostiske resultater (1,9). Samtidig kan radiologiske undersøkelser bidra til å øke mistanken om NSTI.
Kan maskinlæring hjelpe oss i å identifisere etiologi før operasjon? Ved type 2 infeksjoner dominerer betahemolytiske streptokokker og penicillin er virksomt. Selv om behandling i dag er universell, så kan det å stille etiologisk diagnose før operasjon ha betydning for unike valg ved S. pyogenes infeksjon. Våre studie medarbeidere i INFECT har testet denne muligheten, utviklet en maskinlæringsmodell og validert denne eksternt. Basert på opplysninger om alder, fokus for infeksjon, diabetes, kirurgi siste 4 uker, kreatinin- og hemoglobinkonsentrasjoner kan man med akseptabel presisjon sannsynliggjøre GAS-
etiologi (manuskript i revisjon). Dette kan omsettes i raske smitteverntiltak, tidlige vurderinger av indikasjon for IVIG behandling og mulighet for eventuell behandling av sekundærtilfeller.
Forbedringsarbeid og kliniske studier
Ved NSTI er gode studier krevende metodisk og etisk, og kunnskapsgrunnlaget er stort sett av lav kvalitet. Vi mangler en entydig definisjon, et nasjonalt datagrunnlag som gjør det mulig å vurdere tilgang til behandling og evaluere behandlingsinnsatser og utfall, og en tverrfaglig nasjonal behandlingsveileder for NSTI. Til tross for de svære ressursene som går med til behandling, rehabilitering og invaliditet, er vi et godt stykke unna gode forutsetninger for forbedringsarbeid.
Av disse grunner kan det være hensiktsmessig for mange sykehus å utføre enklere kvalitets- og forbedringsstudier, med tanke på å hente gevinster lokalt. Slikt arbeid kan inkludere gjennomganger av organisering og rutiner som vedrører både vår og andre spesialiteter.
Referanser
1. Sartelli M, Coccolini F, Kluger Y et al. WSES/GAIS/ WSIS/SIS-E/AAST global clinical pathways for patients with skin and soft tissue infections. World J Emerg Surg 2022;17:3
2. Stevens DL, Bisno AL, Chambers HF et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis 2014;59:e10-52
3. Gundersen IM, Bruun T, Almeland SK et al. Necrotising soft tissue infections. Tidsskr Nor Laegeforen 2024;144(3)
4. Hedetoft M, Madsen MB, Hyldegaard O. Hyperbaric oxygen treatment in the management of necrotising soft-tissue infections: results from a Danish nationwide registry study. BMJ Open 2023; 13: e066117
5. Skrede S, Bruun T, Rath E, Oppegaard O. Microbiological Etiology of Necrotizing Soft Tissue Infections. Adv Exp Med Biol 2020; 1294:53-71-
6. Hud- og bløtdelsinfeksjoner - Helsedirektoratet. Revidert den 20.12.2022
7. Thänert R, Itzek A, Hoßmann J et al. Molecular profiling of tissue biopsies reveals unique signatures associated with streptococcal necrotizing soft tissue infections. Nat Commun 2019;10:3846
8. Nawijn F, Smeeing DPJ, Houwert RM et al. Time is of the essence when treating necrotizing soft tissue infections: a systematic review and meta-analysis. World J Emerg Surg 2020;15:4
9. McDermott J, Kao LS, Keeley JA et al. Necrotizing Soft Tissue Infections: A Review. JAMA Surg 2024; 159:1308-1315
10. Marwick C, Broomhall J, McCowan C et al. Severity assessment of skin and soft tissue infections: cohort study of management and outcomes for hospitalized patients. J Antimicrob Chemother 2011; 66:387-97
11. Rath E, Skrede S, Oppegaard O, Bruun T. Nonpurulent skin and soft tissue infections: predictive power of a severity score and the appropriateness of treatment in a prospective cohort. Infect Dis (Lond) 2020; 52:361-371
Mens det gjøres fremskritt i å forbedre diagnostiske hjelpemidler, går det smått med gjennomføring av kliniske behandlingsstudier. Det finnes fremdeles kun to randomiserte kliniske studier av NSTI av alle mikrobe årsaker, en med CD-28 blokking (27) og en av bruk av IVIG (28). Immunblokkingstudien oppnådde kun «myke endepunkter», mens IVIG-studien dessverre hadde svakheter i design, som kan ha bidratt til negative studieresultater.
Det finnes noen holdepunkter for at IVIG behandling har effekt ved NSTI forårsaket av betahemolytiske streptokokker, fremst S. pyogenes I vår observasjonsstudie INFECT fant vi at blant 128 pasienter med S. pyogenes NSTI var det i multivariatanalyse høyere dødelighet blant dem som ikke fikk IVIG (29). Videre har en mye sitert metaanalyse av IVIG ved streptokokksjokk vist mulige gevinster (30). Med foreliggende data er dette ikke anbefalt i autorative retningslinjer (1,2), mens nasjonal antibiotikaretningslinje støtter bruk av midlet ved S. pyogenes etiologi (7) En RCT med bruk av IVIG ved S. pyogenes NSTI er fortsatt ønskelig.
12. Ruiz C, Gibson G, Crosby J et al. Assessing Empiric Antimicrobial Therapy With the Modified Dundee Classification for Nonpurulent Skin and Soft Tissue Infections in a Community Hospital System. Open Forum Infect Dis 2023;10:ofad186
13. Madsen MB, Skrede S, Perner A et al. Patient’s characteristics and outcomes in necrotising soft-tissue infections: results from a Scandinavian, multicentre, prospective cohort study. Intensive Care Med. 2019;45:1241-1251
14. Cranendonk DR, van Vught LA, Wiewel MA et al.. Clinical Characteristics and Outcomes of Patients With Cellulitis Requiring Intensive Care. JAMA Dermatol 2017; 153:578-582
15. Goh T, Goh LG, Ang CH, Wong CH. Early diagnosis of necrotizing fasciitis. Br J Surg. 2014;101:e119-25
16. Erichsen-Andersson A, Egerod I, Knudsen VE, Fagerdahl AM. Signs, symptoms and diagnosis of necrotizing fasciitis experienced by survivors and family: a qualitative Nordic multi-center study. BMC Infect Dis 2018; 18:429
17. Peetermans M, de Prost N, Eckmann C, et al. Necrotizing skin and soft-tissue infections in the intensive care unit. Clin Microbiol Infect 2020; 26:8-17
18. Howell EC, Keeley JA, Kaji AH et al. Chance to cut: defining a negative exploration rate in patients with suspected necrotizing soft tissue infection. Trauma Surg Acute Care Open 2019; 4: e000264
19. Gundersen IM, Berget E, Haugland HK et al. Clinical Characteristics and Histopathology in Suspected Necrotizing Soft Tissue Infections. Open Forum Infect Dis 2022;9:ofac571
20. Wong CH, Khin LW, Heng KS et al.. The LRINEC (Laboratory Risk Indicator for Necrotizing Fasciitis) score: a tool for distinguishing necrotizing fasciitis from other soft tissue infections. Crit Care Med 2004;32:1535-41
21. Fernando SM, Tran A, Cheng W et al. Necrotizing Soft Tissue Infection: Diagnostic Accuracy of Physical Examination, Imaging, and LRINEC Score: A Systematic Review and Meta-Analysis. Ann Surg 2019;269:58-65
I forbindelse med at HUS og OUS Ullevål fra høsten 2025 deltar i en internasjonal, multisenter, randomisert behandlingsstudie av hyperbar oksygenbehandling ved NSTI (se artikkel av Torbjørn Nedrebø i dette nummeret), har vi hatt ønske om å utføre en enkel studie av forekomst, behandling og resultat ved NSTI i alle norske sykehus. Vi ønsker også å undersøke behov og tilgjengelighet til rehabilitering blant overlevere, og søker for tiden finansiering til arbeidet.
Gjennom nasjonalt søkelys på håndtering av sepsis er dødeligheten ved livstruende infeksjoner gradvis blitt lavere, til tross for at pasientpopulasjonen øker i alder og sårbarhet. Med tiltak inspirert av pasientsikkerhetsprogrammet for sepsis kan vi kanskje forbedre resultater også ved NSTI. Forekomst, andel eldre og multimorbide pasienter, etiologi med problematisk resistens, fremtidig ressursbruk, behov for tverrfaglighet og etiske utfordringene som behandlingsavklaring, vil alle trolig øke fremover. Dette kan være motivasjoner for ulike lokale forbedringsarbeider.
22. Kim DY, Lavasile A, Kaji AH et al. Prospective derivation and validation of a necrotizing soft tissue infections score: An EASTmulticenter trial. J Trauma Acute Care Surg 2024; 97:910-917
23. Cribb BI, Wang MTM, Kulasegaran S et al. The SIARI Score: A Novel Decision Support Tool Outperforms LRINEC Score in Necrotizing Fasciitis. World J Surg 2019; 43:2393-2400
24. Palma Medina LM, Rath E, Jahagirdar S et al. Discriminatory plasma biomarkers predict specific clinical phenotypes of necrotizing soft-tissue infections. J Clin Invest 2021; 131: e149523
25. Rath E, Palma Medina LM, Jahagirdar S et al. Systemic immune activation profiles in streptococcal necrotizing soft tissue infections: A prospective multicenter study. Clin Immunol 2023; 249:109276
26. Polzik P, Grøndal O, Tavenier J et al. SuPAR correlates with mortality and clinical severity in patients with necrotizing soft-tissue infections: results from a prospective, observational cohort study. Sci Rep. 2019;9:5098
27. Bulger EM, May AK, Robinson BRH et al. A Novel Immune Modulator for Patients With Necrotizing Soft Tissue Infections (NSTI): Results of a Multicenter, Phase 3 Randomized Controlled Trial of Reltecimod (AB 103). Ann Surg 2020;272:469-478
28. Madsen MB, Hjortrup PB, Hansen MB et al. Immunoglobulin G for patients with necrotising soft tissue infection (INSTINCT): a randomised, blinded, placebo-controlled trial. Intensive Care Med 2017;43:1585-1593
29. Bruun T, Rath E, Madsen MB, et al. Risk Factors and Predictors of Mortality in Streptococcal Necrotizing Soft-tissue Infections: A Multicenter Prospective Study. Clin Infect Dis 2021; 72:293-300
30. Tom Parks, Clare Wilson, Nigel Curtis et al. Polyspecific Intravenous Immunoglobulin in Clindamycintreated Patients With Streptococcal Toxic Shock Syndrome: A Systematic Review and Meta-analysis. Clin Infect Dis. 2018; 67:1434-1436
Hyperbar oksygenbehandling (HBO) er en behandling hvor pasienten puster 100% oksygen under høyt omgivelsestrykk. Denne gjennomgangen gir en oversikt over HBO-prinsipper, indikasjoner, behandlingspraksis i Norge og den kliniske bruken ved nekrotiserende bløtdelsinfeksjoner (NSTI). Videre omtales egne kliniske erfaringer og pågående forskningsprosjekter, inkludert HOT-NSTI, den første randomiserte kontrollerte studien for å undersøke effekten av HBO ved NSTI. Tilgjengelighet, seleksjon av pasienter og behovet for ytterligere evidens er noen av utfordringene knyttet til bruk av HBO både i Norge og internasjonalt.

Hva er hyperbar oksygenbehandling?
Hyperbar oksygenbehandling (HBO) innebærer at pasienten puster inn 100 % oksygen under økt atmosfærisk trykk i et trykkammer. Vanlig behandlingstrykk ligger mellom 2,0 og 3,0 ATA (atmosfærisk trykk absolutt). En behandling varer vanligvis i rundt 90 minutter. Det brukes både kamre som tar en pasient (monoplace), jf. bilde 1, eller kamre som kan ta flere pasienter blant annet intensivpasienter som ligger på respirator (multi-place), jf. Bilde 2. Ved bruk av intensivkammer kan også medisinsk personell trykksettes sammen med pasient om behov.
Det høye trykket øker den løste delen av oksygen i plasma, og gir dermed økt diffusjon av oksygen til vev med redusert sirkulasjon. Ved å tilføre oksygen i høye konsentrasjoner øker oksygendiffusjonen, noe som påvirker vev med kompromittert sirkulasjon: Leukocytter blir mer effektive og prosesser som fagocytose og bakteriedrap blir forbedret. HBO har også dokumentert virkning på endotelceller, og bidrar til nydannelse av kapillærer og fibroblastaktivitet, noe som er av stor betydning i sårtilheling.
Indikasjoner og bruk av HBO i Norge
Indikasjoner for HBO i Norge baserer seg på anbefalinger fra Undersea
and Hyperbaric Medical Society (UHMS) (1). Elektive indikasjoner med god dokumentasjon inkluderer stråleskade etter kreftbehandling, men også kronisk osteomyelitt. Pre- og postoperativ behandling tilbys også når det skal gjøres inngrep i stråleskadet vev som f.eks. ved innsetting av tannimplantat.
I Norge finnes det tre sykehus som tilbyr HBO-behandling: Haukeland universitetssjukehus (HUS), Oslo universitetssykehus (OUS) og Universitetssykehuset Nord-Norge (UNN).
HUS har i dag landsfunksjon for den elektive behandlingen. I 2024 ble det ved HUS gjennomført 4692 elektive behandlinger fordelt på 171


pasienter. 99% av disse pasientene fikk HBO grunnet stråleskader etter kreftbehandling (2).
Øyeblikkelig hjelp behandling tilbys ved HUS, OUS og UNN. Helse Midt-Norge har ikke eget trykkammer, så HUS har i dag flerregionalt ansvar for både Helse Vest og Helse Midt- Norge når det gjelder akutt trykkammer behandling. I akuttberedskapen ved HUS går det seks leger i dykkerlegevakt.
Ved HUS var det 271 ØH-behandlinger i 2024. Av disse var 12 dykkere, 12 med akutt idiopatisk sensonevrinalt hørselstap (del av pågående studie, SuDHO) og 11 respiratorkrevende intensivpasienter med alvorlig bløtvevsinfeksjon
HBO ved nekrotiserende bløtdelsinfeksjoner (NSTI) Hyperbar oksygenbehandling har vært foreslått som adjuvant behandling for nekrotiserende bløtdelsinfeksjoner (NSTI) siden 1950-tallet, basert på dens evne til å øke oksygenleveransen til hypoksisk vev, hemme vekst av anaerobe bakterier, redusere ødem, styrke leukocyttfunksjon og begrense systemisk inflammasjon. I tillegg er
Tabell 1: Indikasjoner for hyperbar oksygenbehandling (HBO) Tabellen oppsummerer de vanligste akutte og elektive indikasjonene. Listen spenner fra akutte livstruende tilstander (CO-forgiftning, dekompresjonssyke, gassemboli) til kroniske problemtilstander (stråleskader, refraktær osteomyelitt).
Luft- eller gassembolier (arterielle eller venøse)
Alvorlig eller symptomatisk karbonmonoksidforgiftning (CO-forgiftning)
Gassgangren
Knusningsskader, losjesyndrom og annen akutt traumatisk iskemi
Dekompresjonssyke (dykkersyke)
Kroniske diabetiske fotsår med mikroangiopati
Nekrotiserende bløtdelsinfeksjoner (NSTI)
Kronisk terapiresistent osteomyelitt
Stråleindusert skade med ben- eller bløtdelsnekrose
Kompromitterte hudtransplantater
Akutte termiske brannskader
Akutt idiopatisk sensorinevralt hørselstap (SSNHL) - pågående studie
det rapportert at HBO kan forbedre antibiotika sin effekt og redusere toksinproduksjon (3).
Primærbehandling ved NSTI er kirurgi og antibiotika. Er det indikasjon for HBO, tilbys dette så snart pasienten er operert og klinisk stabil nok til å gå i trykkammer. Er pasienten for ustabil klinisk til å kunne forlate intensivavdelingen, utsettes HBO. Den kontinuerlige vurdering av behovet for HBO i sykdomsforløpet, tas i samarbeid mellom kirurg, intensivlege, infeksjonsmedisiner og dykkerlege.
En vanlig behandlingsprotokoll med HBO ved NSTI innebærer at pasienten puster 100 % oksygen under et trykk på 2.4–2.8 ATA i 90 minutter per behandling. Behandlingen startes med to behandlinger det første døgnet, og det er aktuelt å gi totalt tre til fem behandlinger i løpet av tre til fire døgn. Behandlingen gir høy oksygentensjon også i hypoperfundert vev så den samlede effekten kan redusere lokal vevsnekrose.
Effekten av HBO ved NSTI er fortsatt omdiskutert, fordi kliniske observasjonsstudier har vist varierende resultater. En retrospektiv kohort-
studie fra USA viste lavere 90-dagers mortalitet hos pasienter som fikk HBO, særlig ved store sårflater og høy APACHE II-score (3). Hedetoft et al. publiserte en systematisk oversikt og metaanalyse med data fra over 48 000 pasienter, og fant at HBO var assosiert med redusert mortalitet. I samme oversikt viste noen studier at HBO også var assosiert med redusert antall amputasjoner (4).
Samtidig peker en annen oversikt på betydelige metodologiske svakheter i tilgjengelig litteratur og fravær av RCT-studier, noe som også ble bekreftet i Cochrane-gjennomgangen fra 2015 (5, 6).
Selv om det er mangel på gode RCT-er, så har Vinkel et al. undersøkt systemiske effekter av HBObehandling hos sepsispasienter med NSTI. Studien viste endring i genekspresjonsprofiler i retning av adaptiv immunrespons og nedregulering av inflammatoriske signalveier, som NF- κB, etter behandling (7). Dette kan være med å forklare hvorfor HBO i noen tilfeller ser ut til å forbedre utfall hos pasienter med alvorlig systemisk inflammasjon.
Tilgjengeligheten av trykkammer for HBO er begrenset, og pasienter
Tabell 2: Hyperbar oksygenbehandling ved NSTI og gassgangren (HUS 2010–2024)
Variabel
Alder, median (
Kjønn, menn (%)
Infeksjonstype
– NSTI type 1
– NSTI type 2
Gassgangren
Lokalisasjon – Hode/hals
Kirurgiske inngrep, median
Antall HBO2-behandlinger, median
SAPS II, median
Respiratorbehandling
Amputasjoner
(n=66)
(39-63)
(68 %)
(73 %)
(18 %)
(8 %)
(4–9)
(23–42)
(6 %)
30-dagers mortalitet 4 (6 %)
med NSTI er ofte klinisk ustabile og vanskelige å transportere. Dette har medført at de sykeste pasientene gjerne ikke kan tilbys behandlingen i akuttfasen. Internasjonale registerdata viser at under 1 % av NSTI-pasientene i USA mottar HBO, mens dekningen i Danmark ved det nasjonale senteret i København, er rundt 30 % (4). Ulikheter i ressursbruk og behandlingsprotokoller fører til variabel praksis, forsinket oppstart og mulig feil bruk av ressurser (8).
Klinisk erfaring og pågående forskning
Ved HUS har man lang erfaring med HBO ved alvorlige bløtvevsinfeksjoner. De første årene ble pasientene transport til Haakonsvern Orlogsstasjon for behandling i trykkammer der, men fra 2009 har sykehuset kunnet tilby behandling av intensivpasienter i eget kammer.
INFECT-studien
I INFECT-studien (2013–2017) ble det inkludert 409 pasienter fra fem skandinaviske sentre (9). Av disse mottok 329 HBO, mens 80 ikke fikk behandlingen. Resultatene antyder redusert dødelighet hos pasienter som mottok HBO, men studien var ikke randomisert og pasientene som
(67 %)
(79 %)
(21 %)
(5 %)
(7 %)
ikke mottok HBO var sykere enn gruppen som fikk behandlingen (10).
NSTI og HBO: pasientkarakteristikk og utfall ved Haukeland Universitetssjukehus 2010-2024
Vi har nylig gjort en gjennomgang av alle pasienter behandlet med HBO ved HUS i perioden 2010-2024, totalt 66 pasienter, tabell 2. Median alder var 49 år, og majoriteten var menn (68 %). De fleste pasientene hadde infeksjonsfokus i hode- og halsregionen (73 %), etterfulgt av abdominal/ano-genitalområdet (15 %) og ekstre miteter (12 %). Over halvparten (73 %) hadde NSTI forårsaket av flere mikrober (type 1), mens andelen forårsaket av en enkeltmikrobe (type 2) var 18 %. Fem pasienter (8 %) fikk diagnosen gassgangren. Ved innleggelse på intensivavdelingen var median SAPS II 31 og SOFA-skår 6. I løpet av oppholdet hadde 44 % septisk sjokk. Amputasjonsraten var 6 % og 30-dagers mortalitet 6 %.
Oppsummering
Disse funnene viser at hyperbar oksygenbehandling (HBO) er benyttet hos en heterogen pasientgruppe med betydelig sykdomsbyrde, men med en stor andel yngre og friskere pasienter. Majoriteten hadde
(27-66)
(80 %)
(4–9)
(5–10)
(20 %)
(0 %)
infeksjoner lokalisert til hode- og halsregionen med overvekt av polymikrobielle type 1-infeksjoner. Både mortalitet og amputasjonsrate var lavere sammenlignet med tidligere studier, noe som kan indikere mulig nytte av HBO som adjuvant behandling ved NSTI (11). Dataene viser også at det internt er skjev rekruttering til behandlingen, da mindre enn 1/3 har infeksjon i hode-halsområdet og andelen med monomikrobiell infeksjon som mottar øvrig behandling i sykehuset, er rundt 1/3-1/2-part.
Det er stort behov for bedre dokumentasjon av effekt av HBO og det har lenge vært etterlyst en randomisert studie. Den planlagte klinisk randomiserte studien HOTNSTI (Hyperbaric Oxygen Treatment for Necrotizing Soft Tissue Infections) vil forhåpentlig gi oss bedre kunnskap om effekten av HBO på mortalitet og funksjon hos NSTI-pasienter. Den skal inkludere nærmere 1500 pasienter med NSTI de neste 5 årene og vil være den første klinisk randomiserte studien som ser på effekten av HBO ved NSTI noen gang. Studien utgår fra Rigshospitalet i København med deltakelse fra Norge (HUS og OUS) og flere andre sentra rundt om i verden.
RCT (100-200) pasienter. Ullevål og Haukeland
Observasjonskohort. (400-600 pasienter). Alle større sykehus i Norge (unntatt Ullevål og Haukeland)
Standardbehandling + HBO Standardbehandling
Rehabiliteringsstudie, Oppfølging i 12 måneder. 500-800 pasienter
Figur 1. Flytdiagram over HOT-NSTI, observasjonskohort og rehabiliteringsstudie.
Videre forskningsprosjekter
Vi planlegger også en parallell studie som følger opp alle pasienter i Norge med NSTI i en observasjonskohort og rehabiliteringsstudie (Fig. 1).
Ved HUS og Ullevål vil pasientene randomiseres i henhold til protokoll for HOT-NSTI. Ved sykehus uten fasiliteter for HBO inkluderes pasienter i en observasjonskohort. Overlevende inviteres til klinisk vurdering ved 6 og 12 måneder post-
Referanser:
1. Hyperbaric Medicine Indications Manual https://www. uhms.org/images/indications/UHMS%20Indications%2015th%20Ed%20Front%20Matter%20and%20 References.pdf2023 [15:[
2. Årsmelding Hyperbar 2024. Helse Bergen; 2025.
3. Shishido A, Schrank G, Vostal A, Uehling M, Tripathi R, Chintalapati S, et al. Hyperbaric Oxygen Therapy for Necrotizing Soft Tissue Infections: A Retrospective Cohort Analysis of Clinical Outcomes. Surg Infect (Larchmt). 2025;26(6):384-9.
4. Hedetoft M, Bennett MH, Hyldegaard O. Adjunctive hyperbaric oxygen treatment for necrotising softtissue infections: A systematic review and metaanalysis. Diving Hyperb Med. 2021;51(1):34-43.
5. Levett D, Bennett MH, Millar I. Adjunctive hyperbaric
innleggelse. Fysisk funksjon måles objektivt, livskvalitet og psykisk helse kartlegges med validerte spørreskjema, og kvalitative intervjuer gjennomføres med et utvalg for å belyse pasienterfaringer.
Gjennom dette designet kombinerer studien effekt av HBO i en RCT, med bred nasjonal observasjon og detaljert rehabiliteringsdata, og legger grunnlag for evidensbaserte
oxygen for necrotizing fasciitis. Cochrane Database Syst Rev. 2015;1(1):CD007937.
6. Fauno Thrane J, Ovesen T. Scarce evidence of efficacy of hyperbaric oxygen therapy in necrotizing soft tissue infection: a systematic review. Infect Dis (Lond). 2019;51(7):485-92.
7. Vinkel J, Buil A, Hyldegaard O. Blood from septic patients with necrotising soft tissue infection treated with hyperbaric oxygen reveal different gene expression patterns compared to standard treatment. BMC Med Genomics. 2025;18(1):12.
8. Kariksiz M, Ates O. Treatment and clinical outcomes in lower extremity necrotizing soft tissue infection. Eur J Trauma Emerg Surg. 2025;51(1):148.
9. Madsen MB, Skrede S, Perner A, Arnell P, Nekludov M, Bruun T, et al. Patient’s characteristics and outcomes in necrotising soft-tissue infections: results
behandlingsretningslinjer. Vi vet at mange pasienter sliter med fysiske og psykiske plager etter NSTI, men at studier som følger opp disse pasientene er få (12). I et pasientperspektiv vil det også være viktig å avklare om ulik tilgang til tjenester (manglende tilgang på trykkammer) kan ha en betydning.
from a Scandinavian, multicentre, prospective cohort study. Intensive Care Med. 2019;45(9):1241-51.
10. Hyldegaard O, Nekludov M, Arnell P, Nedrebo T, Karlsson Y, Madsen MB, et al. Use of Hyperbaric Oxygen in Patients with Necrotizing Soft Tissue Infections: A Scandinavian Multicenter, Prospective, Observational Cohort. Infect Dis Ther. 2025;14(8):171538.
11. Emmerhoff SL. Hyperbar oksygenbehandling ved nekrotiserende bløtdelsinfeksjoner. Karakteristikk og utfall hos pasienter behandlet ved Haukeland Universitetssjukehus (HUS) 2010-2024. In: Hospital HU, editor. 2025.
12. Carqueja I, Lobato CT, Ferreira AP, Gomes E. Necrotizing Soft Tissue Infections: Intensive Care Unit (ICU) Survivor’s Long-Term Functional Outcomes and Quality of Life. Cureus. 2025;17(1):e77530.

2025
17.-18. okt Indremedisinsk høstmøte Oslo 07.-12. des Update in Internal Medicine, Harvard Boston, USA/web
2026
25.-28. mars European Congress of Internal Medicine Wien, Østerrike 16.-18. april Internal Medicine 2026, ACP San Franscisco
07.-09. mai MIRCIM, McMaster International Review Conference of Internal Medicine Krakow, Polen 01.-06. juni Comprehensive Review and Update Boston, USA/web
15.-16. okt Indremedisinsk høstmøte Oslo 12.-15. nov World Congress of Internal Medicine Taipei, Taiwan
Indikasjon: Tezspire er indisert som tillegg til vedlikeholdsbehandling hos voksne og ungdom i alderen 12 år og eldre med alvorlig astma som er utilstrekkelig kontrollert til tross for høye doser inhalasjonskortikosteroider i tillegg til et annet legemiddel for vedlikeholdsbehandling.
Dosering: Anbefalt dose: 210 mg s.c. hver 4. uke. Tezspire er til langtidsbehandling. Forsiktighetsregler: Skal ikke brukes til å behandle akutte astmaeksaserbasjoner. Astmarelaterte symptomer eller eksaserbasjoner kan oppstå. Pasienten bør instrueres om å oppsøke lege hvis astmaen forblir ukontrollert eller forverres. Alvorlige infeksjoner bør behandles før oppstart av behandling. Ved utvikling av alvorlig infeksjon under behandling, bør behandlingen seponeres inntil denne er over. Graviditet og amming: Bruk under graviditet bør unngås med mindre forventet nytte for den gravide oppveier mulig risiko for fosteret.
Vanlige bivirkninger: Faryngitt, utslett, artralgi, reaksjon på injeksjonsstedet.
Pakninger og priser: Injeksjonsvæske, oppløsning i ferdigfylt penn (210 mg): 1 stk: kr. : 15 053,40. Injeksjonsvæske, oppløsning i ferdigfylt sprøyte (210 mg): 1 stk. kr. : 15 053,40 Reseptgruppe: C. Refusjon: H-resept. Refusjonsberettiget bruk: Der det er utarbeidet nasjonale handlingsprogrammer/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. Vilkår: 216 Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist. Tezspire inngår i RHF anbefalinger for alvorlig ukontrollert T2-høy astma. Beslutning i Beslutningsforum for nye metoder 18.03.2024. Tezepelumab (Tezspire) innføres som tillegg til vedlikeholdsbehandling ved alvorlig astma med eosinofili hos voksne og ungdom i alderen 12 år og eldre som er utilstrekkelig kontrollert til tross for høye doser inhalasjonskortikosteroider i tillegg til et annet legemiddel for vedlikeholdsbehandling.
For fullstendig informasjon, les mer på www.felleskatalogen.no
Referanser:
ID: NO-13578-01-2025-TEZ
1. Busse WW. Biological treatments for severe asthma: a major advance in asthma care. Allergol Int 2019;68:158-66. 2. Tran TN, Zeiger RS, Peters SP et al. Overlap of atopic, eosinophilic, and T 2-high asthma phenotypes in a general population with current asthma. Ann Allergy Asthma Immunol 2016;116:37-42. 3. Kupczyk M, Dahlén B, Sterk PJ et al. Stability of phenotypes defined by physiological variables and biomarkers in adults withasthma. Allergy 2014;69:1198-1204. 4. Chipps BE, Soong W, Panettieri Jr RA et al. Number of patient-reported asthma triggers predicts uncontrolled disease among specialist-treated patients with severe asthma. Ann Allergy Asthma Immunol 2023;130:784-90. 5. Menzies-Gow A, Wechsler ME, Brightling CE. Unmet need in severe, uncontrolled asthma: can anti-TSLP therapy with tezepelumabprovide a valuable new treatment option? Respir Res 2020;21:268. 6. Gauvreau GM, Sehmi R, Ambrose CS et al. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert Opin Ther Targets 2020;24:777–92. 7. Gauvreau GM, Sehmi R, Ambrose CS et al. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert Opin Ther Targets 2020;24:777-92. 8. Tezspire SPC. 4.1, 4.2, 4.4, 4.8, 5.1. 9. Corren J, Karpefors M, Hellquist A et al. Tezepelumab reduces exacerbations across all seasons in patients with severe, uncontrolled asthma: a post hoc analysis of the PATHWAY phase 2b study. J Asthma Allergy 2021;14:1-11.

Har du pasienter med alvorlig allergisk eosinofil astma, med symptomer som forverres under pollensesongen? Eller av andre triggere gjennom ulike årstider?
Alvorlig astma er sammensatt og individuell1-4, ofte utløst av ulike triggere som aktiverer signalcytokinet TSLP* i luftveisepitelet5. TSLP kan sette i gang multiple inflammasjonsdrivere, som kan variere gjennom hele året.6
Tezspire (tezeplumab) blokkerer TSLP fra toppen av inflammasjonskaskaden5,7,8 og reduserer forverringer med mellom 67 og 82 % gjennom de ulike årstidene - hele året9
Les mer på azconnect.no/astma-triggere
Indikasjon:8 Tezspire er indisert som tillegg til vedlikeholdsbehandling hos voksne og ungdom i alderen 12 år og eldre med alvorlig astma som er utilstrekkelig kontrollert til tross for høye doser inhalasjonskortikosteroider i tillegg til et annet legemiddel for vedlikeholdsbehandling.
Forsiktighetsregler:8 Skal ikke brukes til å behandle akutte astmaeksaserbasjoner.
Vanlige bivirkninger:8 Faryngitt, utslett, artralgi, reaksjon på injeksjonsstedet.
* TSLP: tymisk stromal lymfopoietin
Anne Karin Rime, ønsket oss velkommen til intervju en juni ettermiddag på Legenes hus. Som nylig gjenvalgt president, delte hun villig av sine erfaringer i sommerlige omgivelser på takterassen. I tillegg til sitt mangeårige engasjement og sterke tillitsvalgtarbeid er hun indremedisiner og anestesiolog. Vi får her et innblikk i hennes tanker og perspektiver.
Ole Kristian H. Furulund og Stephen Hewitt, redaksjonen


Litt om presidentskapet
Hun forteller tidlig at hun ikke er den første som er gjenvalgt til sin 3 periode. Forrige president, Marit Hermansen, ble også gjenvalgt 2 ganger. Hun tror at bakgrunnen for gjenvalget hadde sammenheng med at styret hadde samarbeidet godt og at foreningen «vet hva man får». Hun opplevde støtte fra alle. Samtidig var hun sterkt engasjert i aktuelle viktige saker for Legeforeningen. Sentralt i hennes lederskap står det å ha stor takhøyde, der også alternative stemmer er viktige, og det er lov å skifte mening. - «Sammen blir man klokere», poengterer hun. – Vi har også fått utviklet fagaksen videre, som er blitt en viktig del av arbeidet i Legeforeningen.
Koronapandemien og beredskap Rime ble valgt til president sent i koronapandemien, etter å ha vært leder i Overlegeforeningen under starten av pandemien. Alle opplevde den store usikkerheten om hva dette viruset kunne føre med seg. Vi så fort hvordan markeder kunne bryte sammen, og at vi er ekstemt sårbare her i nord. Brått manglet vi elementært smittevernutstyr og vaksiner, som bare utgjør en del av dette markedet. Uten fellesskapsløsninger og internasjonalt samarbeid ville vi ikke fått del i den utviklingen som jo skjedde innen så mange områder. Koronapandemien ble en vekker for
alle, og bevisstheten rundt beredskap økte enormt. Hun forteller at hun lett lar seg engasjere, og måtte så trå til også her. Pandemien og den økte bevissthet rundt beredskap har følgelig påvirket hennes ferd og Legeforeningens i årene som fulgte. Beredskap står høyt også i tiden vi lever i nå og hva vi tenker fremover. At hun hadde tatt Forsvarssjefens ledelseskurs, vurderer hun også som sentralt, noe som også har styrket hennes engasjement for beredskap.
Nye sykehusbygg
Vel så engasjerende for at hun stilte til valg til presidentvervet, var nok nye sykehusbygg. Allerede før innflyttingen til det nye sykehuset på Kalnes, så hun de store begrensningene som lå i prosjektet. Engasjementet gjorde at hun ble overlegetillitsvalgt på Sykehuset Østfold i 2015. Sammen med 2 andre tillitsvalgte kjempet hun som del av det fryktede «trehodete trollet» i kampen om mer plass og midler, minnes hun og ler. På et kurs for tillitsvalgte på Danskebåten var selvfølgelig nye sykehusbygg et viktig tema for henne, et tema som også var blitt viktig for Legeforeningen på denne tiden. Det bør ikke overraske at Rime ble rekruttert inn i styret til Overlegeforeningen etter denne turen, der hun etterhvert ble leder, og noe senere kandidat til sentralstyret i Legeforeningen.
Legeforeningen fremover På spørsmål om viktige saker fremover, anser hun prioritering som viktig. Det offentlige har tatt helse- og legetjenestene for gitt, men vi kjenner hvordan kampen om de fleste tjenestene har økt. Å skape likeverdige helsetjenester for alle, er avgjørende. Dette betyr ikke at alle skal ha det samme, men alle skal få gode helsetjenester, avhengig av sine behov. Hun er også enig i prinsippene i Prioriteringsmeldingen om nødvendighet, ressurs og alvorlighet, og tenker at disse er viktige når man skal prioritere.
Videre understreker hun at beredskap også er viktig fremover, med satsing på gode fellesskapsløsninger og internasjonalt samarbeid. Vi må f.eks. unngå at tilgangen til nødvendig smittevernutstyr er nær ved å glippe. Legeforeningen vil derfor jobbe videre med beredskap i årene som kommer.
Digitalisering er et annet område. Dette ser hun som relevant også for indremedisinere. God opplæring er viktig. Her inngår å innarbeide effektive kunnskapsbaser og systemer for beslutningsstøtte. Vi må stille krav om å balansere det vi må kunne og hva vi kan slå opp. Det blir også viktigere å vite hva man kan stole på. Kildekritikk blir derfor mer påkrevet, særlig med kunstig intelligens (KI),

som har betydelige begrensninger. Hvilke kilder kan man stole på? Vi trenger også en opprydning i det juridiske for KI.
På Landsmøtet i mai ble spørsmålet om aktiv dødshjelp drøftet. Vi har sett det som en viktig debatt å ta. Enkelte partier er for en utredning av dette temaet. Dette er imidlertid en sak som også vil berøre norske leger, og Legeforeningen kan ikke være nøytral. Vi må imidlertid skille dette tydelig fra overbehandling og å avslutte behandling. Det vil videre bli interessant å se hvordan saken utvikler seg i England. I Nederland gis i dag aktiv dødshjelp til unge med psykiske lidelser og til eldre. Økningen er bekymringsfull, spesielt for unge kvinner med psykiske begrunnelser. Legeforeningene i både Finland og Danmark har valgt å fortsatt si nei. Vi vedtok på Legeforeningens landsstyremøte en resolusjon om viktigheten av
palliasjon og å opplyse bedre om retten til å avslå behandling.
Interesse og tro på indremedisin
Anne Karin Rime forteller at hun vurderte geriatri og kardiologi under sin spesialisering i indremedisin. Hun ønsket å se mer av bakgrunnen for pasientenes sykdommer og hvordan man kunne behandle disse. Indremedisin er et bredt og krevende fag å være god på og vil alltid være i utvikling, og det er viktig å ikke miste nysgjerrigheten på nye ting som lege. Under sideutdanningen med anestesiologi, så hun mange av de samme problemstillingene, og engasjerte seg mer og mer i dette og intensivmedisin. Hun ser også dette faget som en bred disiplin, og sier hun har med seg også indremedisinen i det daglige – og det er viktig å se helheten. - I intensivbehandlingen, ligger alltid indremedisinen i bunnen, sier hun.
Flere har vært bekymret for hvordan det vil gå med indremedisin fremover i lys av at færre vil spesialisere seg i faget og det har vært utlyst få stillinger som overlege i indremedisin. Rime mener det vil snu fremover. Vi trenger bedre og mer helhetlige pasientforløp. Og om vi skal ha sykehus som ikke er så subspesialiserte, må vi få tilbake interessen for det helhetlige ansvaret for pasientene. Det arbeides nå for å få flere leger til å jobbe i generelle indremedisinske avdelinger. Erfaring og mye kunnskap er kjennetegn på god generell indremedisin. Det bør gi kollegial respekt å ha en bred spesialitet, som indre medisin. Vi må også se nærmere på EU-reglene og hvordan man organiserer sykehusene. Det tar i dag minst 2½ år ekstra å bli spesialist både i generell indremedisin i tillegg til annen indremedisinsk spesialitet. Ved generelle indremedisinske avdelinger trengs også overleger i generell indremedisin.

Videre har vi har nytte av erfaringsutvekslingen på tvers av spesialiteter og avdelinger. - Blant noen av mine litt morsomme minner fra rotasjonen, husker jeg blant annet diskusjonene rundt oppstart av ACE-hemmer på hjerteavdelingen, men hvordan disse ble plukket bort da jeg kom til nyreavdelingen. Vi ler alle med, og vet at denne forståelsen har utviklet seg til det bedre. Det trengs mye helhetlig kunnskap når man skal jobbe på sykehus i en hovedspesialitet.
Selvfølgelig trenger vi alle de tidligere grenspesialitetene med sine viktige funksjoner. Og vi trenger samarbeidet på tvers av disse.
Mangeårig engasjement som tillitsvalgt
Rime forklarer at bakgrunnen for at hun ble tillitsvalgt, var og er, at hun lett blir engasjert. Hun var avdelingsog foretakstillitsvalgt både for legene i spesialisering og for overlegene. Hun hadde en pause på ca.10 år etter tiden i spesialisering, men lot seg
altså engasjere igjen i forbindelse med prosjektet og etableringen av Sykehuset Østfold Kalnes. Hun har også vært styremedlem i anestesiforeningen, men ikke ledet denne slik noen tror, påpeker hun. Som president treffer man utrolig mange flinke kollegaer i et stort alderspenn. På sist møte i Tromsø var den yngste fra 26 år og den eldste 92 år. Hun tror på dialog og at man sammen kan få til gode resultater både for faget, pasientene og samfunnet.
Læringspunkter fra Sykehuset Østfold Kalnes
Vi viser til planlagt bygging av nye OUS og andre nye sykehus, og stiller spørsmål om hva hun mener man må ta med seg av læringspunkter fra Sykehuset Østfold Kalnes. Hun sier finansierinmodellen er den viktigste man kan endre. Det bygges for smått og da blir ikke driften effektiv. Det at sykehusene skal «spare opp» tilstrekkelig egenkapital til å finansiere sykehus-utbygging er ikke realistisk.
Innsparinger går utover drift, og det er grenser for hvor mye den kan effektiviseres. Og bygges det for lite, reduserer det bare effektiviteten. Man trenger f.eks. god plass for å drive poliklinikk effektivt. Trange avdelingsforhold gjør det bare dyrere for både pasienter, sykehus og samfunn. Kapasitetsbegrensninger gjør at pasienter som skrives ut i dag, er sykere enn tidligere. Reinnleggelser og samlet liggetid går da ikke nødvendigvis ned.
Spesialisthelsetjenesten fremover Vi må erkjenne at vi må gå opp flere grenseoppganger hva angår bruken av tilgjengelige ressurser. Pasienter lever lenger, flere må leve med økt antall sykdommer, og nye medikamentene blir dyrere. Kloke valg kampanjen og prioriteringsmeldingen er begge viktige redskaper for å møte overbehandling og målrette ressursene. Vi må i større grad lære når nok er nok. Og vi må tørre og lære å prioritere bedre. I tillegg må vi tørre å snakke med pasientene om begrensning og avslutning av behandling. Det som er det beste for en pasient er ikke det beste for en annen pasient.
Rime ser fremover
Hun synes det er vanskelig å uttale seg om hva hun selv vil gjøre etter presidenttiden. Den 3. perioden starter først i september, og det skjer så mye. Det er for tidlig å tenke på hva man skal gjøre om 2 år. I løpet av samtalen kommer det tydelig frem hvordan hun lar seg fascinere av alle de dyktige menneskene hun møter i sin gjerning. Og dialogen står høyt i kurs. Hun pendler fra Fredrikstad, og disponerer en leilighet i Oslo. Barn og familien er viktige for henne, og hun er spesielt takknemlig for at mannen stiller slik opp. Hun skal fortsette å være president i 2 år og skal konsentrere seg om dette. Det er fortsatt masse som må gjøres i tiden fremover for henne som president!

Dosering og administrering1
RA: Voksne inkl. eldre: Anbefalt dose er 100 mg 1 gang daglig CAPS: Voksne inkl. eldre, ungdom og barn ≥8 måneder og ≥10 kg: Anbefalt startdose 1-2 mg/kg dag.
FMF og Stills sykdom: Anbefalt dose 100 mg/dag ved kroppsvekt ≥50 kg. Ved kroppsvekt <50 kg justeres dosen etter kroppsvekt, med startdose 1-2 mg/kg/dag. Hos barn med utilstrekkelig respons kan dosen økes opptil 4 mg/kg/dag.
Kineret skal gis subkutant i daglige injeksjoner.
Utvalgte advarsler og forsiktighetsregler1
Hepatiske hendelser: I kliniske studier har det blitt observert forbigående økning i leverenzymer. Rutinemessig testing av leverenzymer i løpet av den første måneden bør vurderes, særlig hvis pasienten har predisponerende faktorer eller utvikler symptomer som antyder leverdysfunksjon. Alvorlige infeksjoner: Kineretbehandling skal ikke initieres hos pasienter med aktive infeksjoner. Med nøye overvåking kan behandlingen med Kineret fortsettes også ved en alvorlig infeksjon. Behandling med Kineret for covid 19 kan fortsette til tross for (sekundære) infeksjoner. Nøytropeni: Kineret bør ikke initieres hos pasienter med nøytropeni (ANC < 1,5 x 109/l).
Annet: Varier injeksjonssted for å unngå tegn og reaksjoner på injeksjonsstedet.
Swedish Orphan Biovitrum AS Dronning Eufemias gate 16, 0191 Oslo Tlf.: 66 82 34 00 mail.no@sobi.com www.sobi.com/norway

Revmatoid artritt: Voksne med revmatoid artritt (RA) i kombinasjon med metotreksat hos de som ikke oppnår tilstrekkelig effekt med metotreksat alene. Autoinflammatoriske periodiske febersyndromer hos voksne, ungdom, barn og spedbarn (≥8 måneder med kroppsvekt ≥10 kg): Cryopyrinassosierte periodiske syndromer (CAPS) inkl. NOMID/CINCA , MWS og FCAS.
Familiær middelhavsfeber (FMF), hvis hensiktsmessig i kombinasjon med kolkisin. Stills sykdom: systemisk juvenil idiopatisk artritt (sJIA) og Stills sykdom i voksen alder (AOSD), med aktive systemiske trekk av moderat til høy sykdomsaktivitet, eller ved fortsatt sykdomsaktivitet etter behandling med NSAID eller glukokortikoider. Kan gis som monoterapi eller i kombinasjon med andre antiinflammatoriske legemidler og DMARD.
Svært vanlige: Reaksjon på injeksjonsstedet, hodepine.
Vanlige: Nøytropeni, trombocytopeni, alvorlige infeksjoner.
For fullstendig oversikt over bivirkninger og forsiktighetsregler: se godkjent SPC på www.felleskatalogen.no
Varenummer: 418642 Styrke: 100mg/0,67 ml
Pakning: 7 x 0,67 ml (ferdigfylt sptøyte) Pris (AUP): 2875,30 Refusjon: H-resept, R.gr.: C
For mer informasjon om Kineret: www.kineret.no eller scan QR-koden PP-27823- april 2025

semaglutid injektion 2,4 mg


20 % risikoreduksjon i alvorlige kardiovaskulære hendelser hos pasienter med overvekt eller fedme og etablert kardiovaskulær sykdom#1


~15 %
gjennomsnittlig vektreduksjon opprettholdt i 2 år*2
Mer enn 1/3 av pasienter gikk ned 20 % eller mer med Wegovy®2

Δ Effekten av Wegovy® én gang i uken på kardiovaskulære utfall har blitt vurdert i SELECT-studien.#3

SELECT viste at Wegovy® reduserte risiko for MACE med 20 %, hos personer med overvekt eller fedme og etablert kardiovaskulær sykdom, sammenlignet med placebo, som tillegg til standard behandling for hjertesykdom for begge grupper.
MACE er definert som et sammensatt endepunkt bestående av kardiovaskulær død, ikke-fatalt hjerteinfarkt eller ikke-fatalt hjerneslag.
#
Vist i SELECT-Kardiovaskulær endepunktstudie: 17604 pasienter med BMI ≥ 27 kg/m2 og etablert kardiovaskulær sykdom ble tilfeldig randomisert til Wegovy ® eller placebo, begge i tillegg til standardbehandling. Det primære endepunktet var tid fra randomisering til første inntreden av en alvorlig kardiovaskulær hendelse (MACE): kardiovaskulær død, ikke-fatalt hjerteinfarkt eller ikke-fatalt hjerneslag. HR: 0,80 i favør av Wegovy ® 2,4 mg sammenlignet med placebo. [95 % KI: 0,27;0,90], p < 0,001.1,3
* STEP 5: -2,6 % for placebo og -15,2 % for Wegovy ® ved uke 104, som tillegg til diett med redusert kaloriinntak og økt fysisk aktivitet for begge grupper (500 kcal/dag + 150 min/uke fysisk aktivitet + individuell oppfølging hver 4. uke). 12,6 % forskjell fra placebo, [95 % KI: -15,3; -9,8], p < 0,0001.1,2
Novo Nordisk Norway AS Nydalsveien 28 · NO-0484 Oslo Telefon: + 47 22185050 · Kundeservice: +47 2218 5051 · www.novonordisk.no
Indikasjon:
Voksne: Tillegg til diett med redusert kaloriinntak og økt fysisk aktivitet for vektkontroll, inkludert vekttap og vedlikehold av vekt, hos voksne med initial BMI ≥ 30 kg/m2 (fedme), eller ≥ 27 kg/m2 til < 30 kg/m2 (overvekt) ved forekomst av minst én vektrelatert komorbiditet, som dysglykemi (prediabetes eller diabetes mellitus type 2), hypertensjon, dyslipidemi, obstruktiv søvnapné eller kardiovaskulær sykdom.
For resultater fra studier vedrørende kardiovaskulær risikoreduksjon, fedmerelatert hjertesvikt og populasjoner som ble undersøkt, se pkt. 5.1 i Wegovy ® preparatomtale.4
Ungdom (≥ 12 år): Tillegg til diett med redusert kaloriinntak og økt fysisk aktivitet for vektkontroll hos ungdom ≥ 12 år med fedme # og kroppsvekt > 60 kg. Behandling skal seponeres og re-evalueres etter 12 uker dersom ungdomspasienten ikke oppnår en reduksjon i BMI på minst 5 % etter 12 ukers behandling med (Wegovy®) 2,4 mg eller maks. tolererte dose.
# Fedme (BMI ≥ 95-prosentil) som definert i kjønns- og aldersspesifikk BMI-vekstkurve (CDC.gov). Se tabell 1 i Wegovy ® preparatomtale.
Wegovy® – utvalgt sikkerhetsinformasjon
• De hyppigst rapporterte bivirkningene var gastrointestinale (svært vanlige, ≥ 1/10), inkludert kvalme, diaré, forstoppelse, oppkast og magesmerter. Disse var generelt milde eller moderate i alvorlighetsgrad og av kort varighet. De gastrointestinale hendelsene førte til permanent seponering hos 4,3 % av pasientene. Kan forårsake dehydrering som i sjeldne tilfeller kan forverre nyrefunksjon. Unngå væskemangel
• Andre svært vanlige (≥ 1/10) bivirkninger: Hodepine, fatigue
• Andre vanlige (≥ 1/100 til < 1/10) bivirkninger: Dysestesi, dysgeusi, svimmelhet, gastritt, gastroøsofageal reflukssykdom, dyspepsi, raping, flatulens, abdominal distensjon, gallestein, hårtap, reaksjoner på injeksjonsstedet. Hos pasienter med diabetes type 2: hypoglykemi (særlig i kombinasjon med insulin eller sulfonylurea), retinopati
• Gallestein: Vanlig bivirkning ved bruk av semaglutid. Ble rapportert hos 1,6 % av de som fikk semaglutid og 1,1 % hos de som fikk placebo. Førte til kolecystitt hos 0,6 % og 0,3 % hos de som fikk henholdsvis semaglutid og placebo
Pankreatitt: Frekvensen av avklart (adjudikert) bekreftet akutt pankreatitt rapportert i kliniske fase 3a-studier, var henholdsvis 0,2 % for semaglutid og < 0,1 % for placebo. I den kardiovaskulære endepunktsstudien
SELECT var frekvensen av akutt pankreatitt, bekreftet ved avklaring (adjudikering), 0,2 % for semaglutid og 0,3 % for placebo. Ved mistanke bør semaglutid seponeres. Semaglutid skal ikke gjenopptas etter bekreftet pankreatitt. Forsiktighet bør utvises hos pasienter som tidligere har hatt pankreatitt
• Tarmobstruksjon: En alvorlig form for forstoppelse med tilleggssymptomer som magesmerte, oppblåsthet og oppkast. Rapportert med ukjent frekvens etter markedsføring
Puls: Gjennomsnittlig økning på 3 slag per minutt observert
• Skal ikke brukes av gravide eller ved amming. Semaglutid skal på grunn av den lange halveringstiden seponeres minst 2 måneder før en planlagt graviditet Forsiktighet bør utvises hos pasienter med inflammatorisk tarmsykdom eller gastroparese
• Ungdom (12 - < 18 år): Generelt var frekvens, type og alvorlighetsgrad av bivirkninger hos ungdom tilsvarende det som sees hos voksne. Gallestein ble sett hos 3,8 % av pasientene behandlet med Wegovy® og 0 % behandlet med placebo. Ingen effekt på vekst eller pubertetsutvikling ble funnet etter 68 uker med behandling
Dosering – én gang per uke
Alder
Nyrefunksjon
Kan benyttes uten dosejustering
Voksne og ungdom ≥ 12 år
Begrenset erfaring hos pasienter ≥ 85 år
Lett og moderat nedsatt eGFR > 30 ml/min 1,73m2
Anbefales ikke
Barn/ungdom under 12 år
Alvorlig nedsatt, eller terminal nyresykdom eGFR < 30 ml/min 1,73m2
Hjertesvikt NYHA klasse I-III NYHA klasse IV
Leverfunksjon
Lett og moderat nedsatt Forsiktighet bør utvises
Diabetes Diabetes type 2
Alvorlig nedsatt
Wegovy® skal injiseres subkutant i abdomen, i låret eller i overarmen og administreres én gang per uke når som helst i løpet av dagen, til måltid eller utenom måltid. For å redusere sannsynligheten for gastrointestinale symptomer bør dosen trappes opp i løpet av en 16-ukers periode til en vedlikeholdsdose på 2,4 mg én gang per uke.
For ungdom i alderen 12 år og eldre benyttes samme doseopptrappingsplan som for voksne. Dosen bør økes opptil 2,4 mg, eller til maksimalt tolererte dose oppnås. Se preparatomtale for mer informasjon om dosering.
Reseptgruppe og pris
Legemiddelgruppe: GLP-1-analog Reseptgruppe: C ATC-nr.: A10B J06
Pakninger og priser: 0,25 mg: 1,5 ml (ferdigfylt penn) kr 1773,50. 0,5 mg: 3 ml (ferdigfylt penn) kr 1773,50. 1 mg: 3 ml (ferdigfylt penn) kr 1773,50. 1,7 mg: 3 ml (ferdigfylt penn) kr 2597,20. 2,4 mg: 3 ml (ferdigfylt penn) kr 3189,40 (Priser per august 2025).
Behandling med Wegovy® er ikke refundert og kan ikke skrives på blå resept
For individuell stønad se vedlegg 1 til folketrygdloven § 5-14 (legemiddellisten) på www.helsedirektoratet.no5
Referanser: 1. Wegovy® SPC, avsnitt 5.1 2. Garvey WT, Batterham RL, Bhatta M, et al. Two-year effects of semaglutide in adults with overweight or obesity (STEP 5) Nature medicine 2022; 28(10), 2083-2091 3. Lincoff AM, Brown-Frandsen K, Colhoun HM, et al. Semaglutide and cardiovascular outcomes in obesity without diabetes. N Engl J Med. 2023; 389(24): 2221-2232 4. Wegovy® preparatomtale. Tilgjengelig på: https://www.ema.europa.eu/no/documents/product-information/wegovyepar-product-information_no.pdf 5. Informasjon om vilkår for individuell refusjon er hentet fra: https://www.helsedirektoratet.no/rundskriv/kapittel-5-stonad-vedhelsetjenester/vedlegg-1-til--5-14-legemiddellisten/virkestoffer/semaglutid (Lest 04.08.2025)
Norsk endokrinologisk forening har nå etablert Norsk Endokrinjournal, en strukturert journal som skal øke kvaliteten på pasientbehandlingen, styrke spesialistutdanning, bidra til datafangst til forsknings- og kvalitetsregistre og understøtte nasjonale forskningsprosjekter.

Strukturert journal er ikke nytt i norsk endokrinologi. Mest kjent og velbrukt er Noklus Diabetes som så dagens lys i 2007, og som med årene har vært benyttet av alle diabetespoliklinikker i landet. Fortløpende registrering av data i Noklus Diabetes har vært avgjørende for utviklingen av Norsk diabetesregister for voksne (NDV) til å bli et kvalitetsregister med svært høy dekningsgrad og datakvalitet. Nå er strukturert barnediabetesjournal tatt i bruk, bygget på samme lest.
I kjølvannet av Noklus Diabetes ble det ved Haukeland Universitetssjukehus fra 2011 utviklet en strukturert journal for alle endokrine sykdommer, kalt EndoJournal, som siden har vært i bruk ved flere sykehus i Norge. EndoJournal har vært viktig for oppbygging og vedlikehold
av Register for Organspesifikke Autoimmune Sykdommer (ROAS). Videre er det bygget en strukturert fedmejournal, som har fått økende utbredelse.
Dataprogrammet FastTrak ble utviklet av lege Magne Rekdal fra 2002 og framover, som et verktøy for å strukturere pasientdata for klinisk forskning og praksis. Mens medisinske journalsystemer i all hovedsak er tekst, kan man med FastTrak registrere opplysninger som struk turerte variabler. Dette gir en helt annen mulighet for oversikt, standar diserte journalnotater, og til registre uten ekstrainnsats fra behandler.
Programmet FastTrak og firmaet Emetra AS ble i 2016 kjøpt av DIPS, og fungerer nå som en applikasjon
delvis integrert med DIPS Arena. Fra 2023 er EndoJournal gjort tilgjengelig for alle sykehus som har DIPS. Innføring av Helseplattformen i Helse Midt-Norge har dessverre gitt utfordringer for en felles strukturert journal, ettersom FastTrak ikke lenger kan benyttes her. Videre arbeid med strukturert journal i Helse Midt-Norge må gjennomføres med den funksjonaliteten Helseplattformen gir.
Norsk Endokrinjournal vil bygge


Vi benytter også anledningen til å presentere vårt nye styre fra 1.9.2025. Fra venstre:
Daniel Hannisdal, Fuxx, vara i styret. LIS 3 endokrinologi på Bærum sykehus. Opptatt av kloke valg for en fornuftig prioritering av ressurser i helsevesenet, men vel så mye for å unngå sykdomsidentitet og styrke mestringstro hos menneskene vi behandler.
Borghild Aakra , sekretær. Indremedisinar og endokrinolog, overlege Medisinsk avdeling Haugesund sjukehus. Klinikkoverlege Medisinsk klinikk Haugesund frå juni 2022. Travel arbeidskvardag delt mellom administrasjon og klinikk. Hjarte for spesialistutdanning og for å bevara breidde- og vaktkompetanse. Endokrinologar er gode indremedisinarar!
Kari Lima , nestleder. Overlege endokrinologisk avdeling, AHUS. PhD. Medlem i redaksjonskomiteen i nasjonal veileder i endokrinologi. Er opptatt av at vi arbeider sammen nasjonalt for å styrke endokrinologifaget.
Trine Finnes, gjenvalgt leder. Overlege endokrinologisk avdeling, Oslo Universitetssykehus og Sykehuset Innlandet, PhD. Selverklært tidsoptimist og altmulig kvinne med fokus på bensykdommer og ledelse som får frem det beste i folk.
Guri Grimnes, nettansvarlig. Seksjonsleder/overlege endokrinologisk seksjon, UNN Tromsø og professor ved Institutt for Klinisk Medisin, UiT-Norges Arktiske Universitet. Tilhenger av pragmatiske løsninger som sikrer at både leger og pasienter har det bra uansett hvor i landet de bor.
Bjørn Olav Åsvold, kasserer.
Professor ved Institutt for samfunnsmedisin og sykepleie ved NTNU og overlege ved Avdeling for endokrinologi ved St. Olavs hospital. Han arbeider mest med diabetes og tyreoidea, og med epidemiologisk forskning i HUNT-studien. I den nasjonale veilederen i endokrinologi er han ansvarlig for tyreoide akapitlene.
Vi ønsker spesielt Borghild Aakra med den brede bakgrunnen og positive energien og den like sprudlende og samtidig faglig suverene
Bjørn Olav Åsvold velkomne som nye medlemmer i styret. Åsne Bakke og
Eystein S. Huseby ble begge takket av etter lang og tro tjeneste. Det endokrinologiske miljøet er lite, og vi ser frem til å treffe dem igjen i andre sammenhenger.

Vi er glade for å kunngjøre publiseringen av Nasjonal Metodebok for Infeksjonsmedisin, et stort løft for behandling av infeksjonssykdommer ved norske sykehus. Metodeboken, som utgis av Norsk Forening for Infeksjonsmedisin (NFIM), representerer et betydelig fremskritt i å standardisere diagnostikk og behandling av infeksjonsrelaterte sykdommer på tvers av sykehus, helseforetak og -regioner i Norge.
Kristian Tonby, leder, Norsk Forening for Infeksjonsmedisin

Metodeboken er utviklet av rundt 100 fageksperter og inneholder en omfattende oversikt over de fleste infeksjonssykdommer som leger i Norge kan møte i sin praksis. Målgruppen for metodeboken er alle leger som jobber innen sykehus, fra leger i spesialisering til erfarne spesialister. Anbefalingene er basert på ”expert opinion”. Alle anbefalinger om antibiotikabruk i metodeboken er i samsvar med de nasjonale retningslinjene
fra Helsedirektoratet. Prosessen er forankret både i fagmedisinsk forening, alle infeksjonsmedisinske avdelinger og regionale helseforetak.
Hvorfor er dette viktig? Infeksjonssykdommer utgjør en betydelig årsak til sykehusinnleggelser og kan forårsake komplikasjoner til annen behandling. For å forbedre pasientsikkerheten er det avgjørende at helsepersonell har
tilgang til oppdaterte retningslinjer og anbefalinger. Etableringen av en nasjonal metodebok vil bidra til å unngå uhensiktsmessig lokal variasjon i diagnostikk og behandling, noe som vil sikre kvalitetsforbedring. Samtidig vil dette redusere dobbeltarbeid med parallelle prosesser på lokale nivåer og dermed optimalisere ressursbruken. I tillegg vil den nasjonal «mastermalen» tillate nødvendige lokale tilpasninger.

Metodeboken er tilgjengelig for alle via www.metodebok.no, i nettversjon og som app, noe som gjør det enkelt for helsepersonell å bruke ressursen når som helst og hvor som helst.
For mer informasjon eller spørsmål, vennligst kontakt en av følgende:
- Kristian Tonby, Norsk Forening for Infeksjonsmedisin. Mobil 415 50 565, mail: kritonby@ous-hf.no
- Dag Henrik Reikvam, redaktør OUS Ullevål: Mobil 94858939, mail: d.h.reikvam@medisin.uio.n
- Knut Anders Mosevoll, redaktør, Haukeland Universitetssykehus. Mobil: 97742184, mail: Knut.Anders.Mosevoll@ helse-bergen.no
Norsk Forening for Infeksjonsmedisin
Norsk Forening for Infeksjonsmedisin (NFIM) er en fagmedisinsk forening som har som mål å fremme faglig utvikling og kvalitet i behandlingen av infeksjonssykdommer i Norge.

Skjermdump av metodeboken


Hvert tiende år er det i Norsk Nyremedisinsk Forenings (NNF) lodd å arrangere The Nordic Society of Nephrology Biannual Congress – NSN, eller nordiske nyredager som vi gjerne omtaler kongressen som. I år var det Norges tur, og 345 deltakere fikk med seg et rikholdig faglig og sosialt program på Radisson Blu Scandinavia Hotell på Holbergs plass i Oslo fra onsdag 11. juni til lørdag 14. juni 2025.
Ivar Anders Eide, på vegne av styret i NNF
Best på stor tromme.
NSN 2025 var det største arrangementet i foreningens historie. Da fant vi det rett og rimelig å slå så hardt vi kunne på stortromma og hente inn den verdensledende eksperten på henholdsvis glomerulonefritt og dialyse, i tillegg til et stort knippe ledende nordiske og internasjonale eksperter på en rekke felt i nyre medisin, fordelt over flere vitenskapelige sesjoner. Vi fant også plass til paneldiskusjoner med utveksling av behandlingstradisjoner i ulike nordiske land, postersesjoner, best abstract sesjoner og diverse symposier. Kongressen tilbød et bredt faglig program, tydelig fokus på forskningsfront og klinisk relevans og gode rammer for faglig påfyll og nettverksbygging over nordiske lande grenser. Det ble klart for oss at det felles nordiske må vektlegges

enda mer med en politisk urolig verden som bakteppe.
Utstilling fra industrisponsorer var lagt til mingleområdet rett utenfor kongresshallen Scandinavia Ballroom, og det gjorde at industrien også fikk godt besøk, og slik skal det være på en kongress.
Og best på fest.
Vi hadde en flott sosial sammenkomst på Rådhuset torsdag kveld hvor varaordfører hilste velkommen og guider loset oss gjennom husets og byens fascinerende historie med entusiasme og glimt i øyet. Festmiddagen ble avholdt på kongresshotellet fredag kveld. Slik tradisjonen er ved de nordiske nyredager, reiser hver lands delegasjon seg uanmeldt og temmelig abrupt opp og fyrer avgårde en sang mellom serveringene.

Danskene tok like gjerne alle fem vers på Svantes lykkelige dag, vi nordmenn hadde en minst like optimistisk sang og den finske delegasjon tok eierskap til det svenske Grand Prix bidraget Bara bada badstu. Det er tross alt en finsk tradisjon. Da var stemningen satt og den innleide DJ med saksofonist var gitt en flying start, men de tok også svært godt vare på muligheten. Det skal kanskje litt til å lokke nordiske nyreleger fram fra bakre bukvegg, men når de først plopper ut på dansegulvet, så blir de der. Det ble dans inn i de små nattetimer. Sverige har lovet like god stemning om 2 år – tja … Artig var det i alle fall!
Vi får vel si litt om kongressens innhold også, dette er tross alt et tidsskrift.

Onsdag. Nyrenerdegodis.
Tradisjonen tro startet NSN med et presymposium på onsdagen med tre forelesninger fra hvert av de fem nordiske land, hvor hvert land har en tematisk overbygning.
Norge var først ute med tema nyreamyloidose, hvor Tale Wien, Bærum sykehus, vår fremste ekspert på feltet, var først ute med en stilsikker innføring i amyloidose fra nefrologens ståsted. Hun ble fulgt av Hilde Vasstrand, også fra Bærum sykehus, som viste data fra egen forskning og tok oss dypere inn i epidemiologi på feltet. Den norske sesjonen ble avsluttet av Helga Gudmundsdottir, Ullevål sykehus, som delte deres erfaring med dialysebehandling hos personer som injiserer rusmidler, en gruppe som hyppig utvikler AA amyloidose. Både AL og AA amyloidose er sykdommer som hyppig rammer nyre og hvor samarbeid med andre fagfelt er avgjørende for behandlingsresultat. Dette ble vektlagt i forelesningene.
Danmark fulgte deretter med CVD i CKD, ettersom hjertesykdom og nyresykdom ofte er to sider av samme sak, og de kan anta et maladaptivt organvennskap som ikke tjener noen av dem særlig vel. Ellen Ballegaard, København, viste at CKD gir høy risiko for CVD, men ofte underbehandles. Særlig etter AMI er invasiv behandling og sekundær profylaktisk behandling mindre

brukt. Jesper Rantanen, Aalborg, belyste høy forekomst av arrytmier hso dialysepasienter, ofte asymptomatiske og ligger bak en høy andel plutselig død. Kontinuerlig overvåkning avslører arrytmier og strategi for antikoagulasjon fortsatt uklar. Mark Reinhard, Aarhus, viste at kun ganske få med alvorlig renovaskulær sykdom har utbytte av stenting, vist i DAN-PTRAII studien. Samlet pekte sesjonen på et udekket behov for målrettet tiltak mot CVD i CKD og behovet for å styrke samarbeid mellom kardiologi, endokrinologi og nefrologi.
Siste sesjon før lunsj var Sverige. De valgte å ha to forelesere som kunne ta oss dypt inn i det komplisert temaet mekansimer bak ANCA vaskulitt – skikkelig nyrenerdegodis med andre ord. Johanna Dahlqvist, Uppsala, ga en innføring i genetiske mekanismer i ANCA vaskulitt og alle de muligheter det gir for utvikling av framtidig persontilpasset behandling. Sophie Ohlsson, Lund, tok oss gjennom komplementhemming som er en ny og spennende behandlingsmulighet for glomerulonefritter og vaskulitter.
Island røsket tilhørende ut av den postprandiale sukkerskyen med teamer som akutt nyreskade, litium forgiftning og død i dialyse. Nei, hvorfor gjøre det lystig? Telma Ragnarsdottir, Haraldur Arnarsson og Gisli Gislason tok oss trygt gjennom
disse temaer og krydret det med underfundig, mørk islandsk humor. Det satte vi pris på.
Finland landet også på flere temaer. Pasi Nevalainen, Tampere, ga en flott oversikt over forskningsfront for primær hyperaldosteronisme. Tapio Hellman, Turku, tok for seg skrøpelighet i CKD, et tema alle nefrologer er mye eksponert for og hvor vi ennå søker å finne de beste løsningene for pasienten og for samfunnet. Wisar Bitar, Helsinki, avsluttet deres sesjon med å dele resultater og erfaringer med hjemmedialyse, både peritoneal dialyse og hjemme hemodialyse, gjennom mange år.
Torsdag. Elvis has entered the building. Første sesjon torsdag var en paneldebatt om hvordan vi kan oppnå tidlig diagnostikk av CKD, som er avgjørende for å sette i gang tiltak i rett tid. Bård Waldum-Grevbo, Ullevål sykehus, delte norske erfaringer og Maria Eriksson Svensson, Uppsala, og Rikke Borg, Roskilde, fulgte opp og fortalte hvordan de arbeider med temaet i Sverige og Danmark. Dette er og blir en utfordring for vårt fag, men det jobbes godt med tidlig CKD diagnostikk i alle nordiske land og selv om vi er ganske samstemt i forståelsen av problemet, løses det litt ulikt.
Så fulgte en sesjon om hyper tensjon. Daniel Gordin, Helsinki, tok oss


gjennom antihypertensiv behandling i CKD, fulgt av Jana Brguljan Hitji, Ljubliana, som er en ledende ekspert på hypertensjon i svangerskap og ga en flott innføring i temaet og hva vi kan gjøre bedre framover.
Da var vi kommet til showets kanskje største stjerne Edwina Brown, London, en levende legende innen dialyse forskning, en Elvis for nyrefolket, med state-of-the art forelesning om livskvalitet i dialyse for eldre pasienter. Alle satt som tente lys og hørte på orakelet dele sine dype innsikter i hva vi egentlig holder på med og hva vi kanskje kan retenke.
Det ledet naturlig til neste sesjon som fokuserte på peritoneal dialyse. Vi ønsker å øke andelen som velger peritoneal dialyse foran hemodialyse. For å oppnå dette må vi utfordre myter. Stig Arne Kjellevold, Tønsberg sykehus, ga en tankevekkende forelesning om hvor mange myter vi leger har trodd på opp gjennom historien og hvordan vi fortsatt kan ha en blind flekk som hindrer oss å gi pasientene våre de beste råd, i dette tilfellet ved valg av dialysemodalitet. Helga Gudmundsdottir, Ullevål sykehus, fulgte opp med prevalenstall før Richard Corbett, London, viste oss teknologisk innovasjon i peritoneal dialyse og alle de muligheter vi har for å optimalisere denne behand-

lingen. PD first gjelder fortsatt med mindre du har en veldig skrøpelig pasient som ikke kan nyttiggjøre seg de fordelene peritoneal dialyse gir.
Fredag. Øycelle what now? Første sesjon fredag var en gjennomgang av kardiovaskulær screening før påmelding til nyretransplantasjon med Simon Winther, Aarhus og vår egen Trond Jenssen, Rikshospitalet.
Transplantasjon var i fokus første halvdel av denne kongressdagen og vi fortsatte med et dypdykk i opportunistiske virussykdommer som kan ramme transplanterte. Nyretransplanterte har pga immunsuppresjon en redusert og av og til også manglende vaksinerespons. Optimal og oppdatert vaksinasjon før transplantasjon samt regelmessig boosterdoser etter transplantasjon er derfor viktig. En oversikt over vaksiner og hvordan man kan gjennomføre dette praktisk ble lagt frem av Susanne Dam Poulsen fra København. Alle levende vaksiner (Varicella/MMR/Gul feber/rotavirus) MÅ gis før oppstart immundempende behandling, dvs før transplantasjon, mens andre kan gis etter transplantasjon, men vær obs på at respons på vaksinen kan være betydelig redusert. Det erfarte man spesielt tydelig under Covid-19 pandemien. Post-transplanasjons lymfoproliferativ sykdom (PTLD) er en ikke uvanlig og fryktet sykdom som
i den tidlige fasen etter nyretransplantasjon og oftest er EBV-drevet. Hyppighet og target verdier for EBV monitorering er omdiskutert. Lene Ludvigsen fra Aarhus presenterte foreløpige resultater fra en stor dansk-norsk prospektiv EBV-studie. Det er kommet nye internasjonale quidelines for monitorering, profylakse og behandling av CMV og monitorering og behandling BK-virus etter nyretransplantasjon. Disse ble presentert av professor Ilkka Helanterä fra Helsinki. Stort sett var guidelines på linje med det som gjøres per i dag i Norge.
Den fascinerende utviklingen av beta-celle erstatning i type 1 diabetes gjennom stamcelle deriverte eller genmodifiserte øyceller, som plasseres under musklatur i arm og ikke trenger immunsuppresjon, var vel verdt en state-of-the art forelesning fra Per Ola Carlsson, Uppsala.
Så byttet vi fokus til beinsykdom ved CKD. Hanne Mari Skov Jørgensen fra Stavanger, men jobber i Aarhus, er blitt en ledende forsker på feltet internasjonalt. Hun tok oss gjennom spekteret av beinsykdommer i CKD og ga en praktisk innføring i hvilke markører som kan brukes til hva ved diagnostisering og oppfølging av denne pasientgruppen. Jaja Salam, Sheffield, UK, fulgte opp med

en forelesning om hvordan vi kan forhindre frakturer hos CKD pasienter med beinsykdom.
Lørdag. Rosinen i kongresspølsa. Glomerulonefritt var temaet lørdag, som var siste kongressdag. Kati Kaartinen, Helsinki, tok oss gjennom sykdomsmekanismer for ulike glomerulonefritter. Øystein Eikrem, Haukeland sykehus, viste bruk av molekylærprofilering i FFPE biopsier, som åpner opp store muligheter i forskning gjennom å bruke arkiverte nyrebiopsier. Yngvar Haaskjold, St Olav hospital, ga en innføring i CAR-T celleterapi ved nyresykdommer - et gløtt inn i hva som kan bli framtidens behandling.
Rosinen i kongresspølsa for mange av de frammøtte var state-of-the art forelesningen til Jonathan Barratt, Leicester, på behandling ved Ig A nefritt. Han er en helt sentralt skikkelse i nær sagt all forskning på feltet og en fantastisk formidler. Sammen med Yngvar Haaskjold, St Olav hospital, ble moderne behandling av IgA nefritt gjennomgått. Der det før denne forelesningen kunne framstå litt uklart, fikk vi nå klare råd på når skal vi starte behandling, hva skal vi velge, hvor lenge, hva kommer av ny behandling i nær framtid. Nytt, nyttig og fascinerende fra start til slutt i 60 samfulle minutter. Det fikk man bare på NSN 2025.
Poster meg her, poster meg der og poster meg everyvær. Vi hadde rekordmange postere, inklusive mange norske bidrag. Vi ryddet kongresshallen og satte av 2 ganger 2 timer postersesjon med stort oppmøte tross strålende sol ute. Det sier mye om kvaliteten på det som ble servert. Hver poster ble presentert fra scenen med 1 min pitch fra hver. Det fungerte veldig godt. Vi kan nå trygt si at Covidpandemiens påvirkning av forskningen har løsnet og forskningsmiljøene i Norden er i full sving igjen.
Vi hadde tre Best Abstract sesjoner. Først ute var Kati Kaartinen, Helsinki, som delte resultater fra en klinisk studie på pegcetaloplan for C3 glomerulopati og idiopatisk membranoproliferativ glomerulonefritt. Så steppet Lene Halvorsen inn for Sverre Kjeldsen og presenterte resultater fra Value studien på valsartan mot amlodipin for å senke blodtrykk og bremse CKD. Lene Ludvigsen, Aarhus presenterte resultater fra Evita studien på EBV monitorering av nyretransplanterte for å hindre PTLD.
Industrien sponset flere symposier og hentet inn flere internasjonalt ledende forskere, som bidro til å løfte kongressopplevelsen. Det var et symposium som fokuserte på fedme, diabetes og CKD med særlig vekt

på GLP-1 reseptor agonister, et som fokuserte på de mange muligheter for persontilpasset behandling som finnes innen peritoneal dialyse, et som fokuserte på multidisiplinær tilnærming til cardio-reno-metabolsk syndrom og hvilke hindre vi må klatre over for å sikre våre pasienter behandlingen som guidelines anbefaler, et som fokuserte på alternative komplementsystem som target for behandling ved ANCA vaskulitt og metoder for å hindre kløe hos uremiske pasienter, et som fokuserte på nye grupper av pasienter som kunne nyttiggjøre seg behandling med SGLT2 hemmer og et som fokuserte på nytten av hypoksiinduserbar faktor propyl hydroksylase hemmer ved anemi i CKD.
Du finner mer informasjon på kongressens nettside: NSN Oslo 2025
Til slutt vil styret i NNF få rette en stor takk til kongressarrangøren CIC, til de mange industrisponsorene, til kongresshotellet, til Oslo kommune som arrangerte treff i Rådhuset og ikke minst til vår kurskomite under den kompetente og blide ledelse av Lene Halvorsen.

januar 2026
www.spesialisthelsetjenesten.no/lis/kurs-for-leger-i-spesialisering/kurs-i-hypertensjon-nyr/
Dag 1 – Torsdag 29. januar 2026
08.15-08.30 Velkommen ved ordstyrere: Leder for Norsk hypertensjonsforening Pr. Marit Dahl Solbu, Tromsø og kursledere Dr. Liv Mejdell Jacobsen og Overlege Lene V. Halvorsen, Oslo
08.30-08.45 Hypertensjons-epidemiologi i verden: Pr. Hans-Peter Marti, Bergen
08.45-09.00 Hypertensjons-epidemiologi i Norge: Seniorforsker PhD Inger Ariansen, Oslo
09.00-09.15 Diskusjon: Hvorfor avtar prevalensen av hypertensjon i Norge og øker i verden?
Måling av blodtrykk og utredning av hypertensjon.
Ordstyrere: 1. Amanuensis em. Aud Høieggen, Oslo og Liv Mejdell Jacobsen
09.30-09.45 Du måler et blodtrykk til 162/87 mmHg. Hva nå? Strategier for blodtrykksmåling i og utenfor kontoret (inkludert ortostatisk hypotensjon): Lene V. Halvorsen
09.45-10.00 Utredning og oppfølging av hypertensjon i allmennpraksis: Dr. Marit Aasbrenn, Tromsø 10.00-10.15 Primær hyperaldosteronisme og andre endokrinologiske årsaker til hypertensjon. Nye behandlingsmuligheter: Overlege PhD Marianne Grytaas, Bergen
10.15-10.30 Utredning og behandling av renovaskulær sykdom: Marit Dahl Solbu 10.30-10.45 Diskusjon: Hva med serum urinsyre (SUA)?
Norske og europeiske retningslinjer for utredning og behandling av hypertensjon.
Ordstyrere: Marit Dahl Solbu og Hans-Peter Marti
11.00-11.15
Hovedpunkter i de siste retningslinjene fra European Society of Hypertension (2023) og de nye fra European Society of Cardiology (2024) – likheter og forskjeller for behandlingsindikasjon og målblodtrykk: Pr. em. Sverre E. Kjeldsen, Oslo
11.15-11.30 Offisielle norske retningslinjer i regi av Helsedirektoratet: Seksjonsoverlege PhD Tor Ole Klemsdal, Oslo
11.30-12.00
Diskusjon: Hva er evidensbasert behandling og behandlingsmål for blodtrykket?
Hypertensjonsmediert organskade (HMOD).
Ordstyrere: Marianne Grytaas og 1. amanuensis PhD Anne Cecilie Larstorp, Oslo
13.00-13.15 Hypertensjon og forebyggelse av hjerneslag: Overlege PhD Else Charlotte Sandset, Oslo
13.15-13.30
13.30-13.45
13.45-14.00
14.00-14.15
Hypertensjon og nyresykdom – gjensidig påvirkning: Marit Dahl Solbu
Kardiorenalt «syndrom»: Pr. Bård Waldum-Grevbo, Oslo
Hypertensjon og hjertesykdom – en oversikt over vanlige og kanskje mindre vanlige hjertesykdommer som HT kan medføre: Overlege PhD Ester Kringeland (Bergen)
Diskusjon: Felles patofysiologiske mekanismer ved hjerte og nyre affeksjoner (RAAS, SNSA). Hva med statin behandling?
Hypertensjon og hjertesykdom inklusive forebyggelse og behandling.
Ordstyrere: Pr. em. Knut Gjesdal, Oslo og Dr. Eirik Olsen, Trondheim
14.30-14.45
14.45-15.00
15.00-15.15
15.15-15.30
Hypertensjon og koronarsykdom: Tor Ole Klemsdal
Hypertensjon og venstre ventrikkel hypertrofi: Sverre E. Kjeldsen
Hypertensjon og atrieflimmer: Overlege PhD Tonje Aksnes, Oslo
Hypertensjon og aortastenose: Ester Kringeland
15.45-16.00 Er pasienter med diabetes og hypertensjon forskjellig fra andre hypertonikere når det gjelder å forebygge hjerte-kar hendelser? Eirik Olsen
16.00-16.15
16.15-16.30
16.30-16.45
Hypertensjon og HFrEF: 1. Amanuensis Rune Mo, Trondheim
Typisk hypertensiv hjertesvikt (HFpEF): Sverre E. Kjeldsen
Diskusjon: Har betablokker fortsatt plass i forebyggende behandling?


Viktige livsstilstiltak i forebyggelse og behandling av hypertensjon.
Ordstyrere: Rune Mo og Dr. PhD Camilla Lund Søraas, Oslo
08.30-08.45: Hva betyr kost og salt ved hypertensjon?
Oppdaterte norske ernæringsråd og Middelshavsdiett: Anne Cecilie Larstorp
08.45-09.00 Fysisk aktivitet ved hypertensjon. Hvem skal trene og hvordan? Overlege PhD Eigil Fossum, Oslo
09.00-09.15 Overvekt og fedme ved hypertensjon. Hvilken plass har GLP-1 reseptor agonist (ex. semaglutid) og andre diabetes medikamenter? Dr. Liv Mejdell Jacobsen
09.15-09.30 Alkohol og hypertensjon: Overlege PhD Jon Viljar Norvik, Tromsø
09.30-09.45 Diskusjon: Hypertensjon er assosiert med usunn diett, lav fysisk aktivitet, overvekt og mye alkohol (de 4 «store»). Er det andre fornuftige tiltak som kan iverksettes?
Adherence og persistence – helsepedagogiske utfordringer! Hvordan kan vi bedre pasientens etterlevelse?
Ordstyrere: Bård Waldum-Grevbo og Camilla Lund Søraas
10.00-10.15 Behandlingsresistent hypertensjon: Aud Høieggen
10.15-10.35 Adherence og persistence (CAT og TDM) i hypertensjonsbehandlingen: Lene V. Halvorsen
10.35-10.50 «Inertia» i hypertensjonsbehandlingen – hva viste IDA? Camilla Lund Søraas
11.00-11.15 Erfaringer med renal denervering under kontrollerte betingelser: Eigil Fossum
11.15-11.30 Erfaringer med bruk av non-invasiv hemodynamisk undersøkelse til å styre medikamentvalg under kontrollerte betingelser: Anne Cecilie Larstorp
11.30-11.45 Mer intensiv antihypertensive behandling og forebyggelse av Alzheimer: Pr. Anette Hylen Ranhoff (Oslo og Bergen)
11.45-12.00 Diskusjon: Tilsynelatende resistent hypertensjon. Demens forebyggelse.
Behandling av hypertensjon – annen medikamentell intervensjon.
Ordstyrer: Bård Waldum-Grevbo og Jon Viljar Norvik
13.00-13.20 Malign hypertensjon og hypertensive kriser: Marit Dahl Solbu
13.20-13.40 Hvordan bremse funksjonstapet ved kronisk nyresvikt: Hans-Peter Marti 13.40-14.00 Basert på dobbelt blindede studier med til sammen nesten 80.000 pasienter: Er det forskjell på utvikling av terminal nyresvikt mellom forskjellige antihypertensiva? Er det holdepunkter for at <130/80 mmHg er bedre enn <140/90 mmHg? Hvilken betydning har endringer i eGFR for risiko for hjerte-kar sykdom? Lene V. Halvorsen
14.00-14.15 Diskusjon: Er behandling med SGLT2-hemmer løsningen?
Svangerskap og hypertensjon hos unge og gamle.
Ordstyrere: Anne Cecilie Larstorp, Liv Mejdell Jacobsen og Ester Kringeland
14.30-14.55 Hypertensjon og svangerskap: Pr. Anne Cathrine Staff, Oslo
14.55-15.15 Europeiske retningslinjer for utredning og behandling av høyt blodtrykk hos barn og ungdom: Barnelege PhD Tonje Baardsen, Bergen
15.15-15.25
Hypertensjonsbehandling av de aller eldste: Rune Mo
15.25-15.45 Diskusjon (ordstyrere): Klinisk praksis og poliklinisk oppfølgning av pasienter med hypertensjon. Fokus på fremdrift med cuffless målinger, bruk av nye medikamenter på markedet og forebyggelse av Alzheimer.
15.45-16.15 Kursprøve, evaluering og avslutning
Norske indremedisinere har stor glede og nytte av Indremedisineren (IM). IM bidrar til faglig utvikling og er både et viktig bindeledd i miljøet, og mellom styret i NIF og det enkelte medlem.
Redaksjonen og alle bidragsytere jobber på dugnad. Dere annonsører bidrar til at vi kan utgi et flott IM og at vi kan drifte indremedisineren.no, der trafikken er sterkt økende. Uten deres hjelp hadde det ikke vært mulig.
Vi håper det gode samarbeidet fortsetter, og at dere blir med videre!


















Familiær hyperkolesterolemi* FH – sekundærprevensjon LDL-C >2,6 mmol/l, FH – primærprevensjon (barn og voksne fra og med 8 år) LDL-C >3,6 mmol/l.
Hyperkolesterolemi ved etablert aterosklerotisk sykdom** (sekundærprevensjon) med en av følgende risikofaktorer: tidligere hjerteinfarkt, med tilbakevendende CV-hendelser, diabetes mellitus LDL-C >2,6 mmol/l, uten tilleggsrisiko LDL-C >3,6 mmol/l. Krav til tidligere behandling: Refusjon ytes når alirokumab brukes som tillegg til statin og/eller ezetimib hos pasienter som ikke oppnår LDL-nivåer under grenseverdiene nevnt ovenfor. Se følgende krav.***
Spesialistkrav: Forskrivning skal være instituert av spesialist i indremedisin, kardiologi, endokrinologi, geriatri, pediatri, nevrologi eller av lege ved tilsvarende sykehusavdeling.
* Gentest må være utført.
** Sekundærprofylakse etter akutt koronarsykdom (hjerteinfarkt, ustabil angina med sykehusinnleggelse), koronar- eller annen arteriell revaskularisering, angina pectoris, iskemisk hjerneslag eller symptomatisk perifer arteriell sykdom.
*** For brukere som tåler statiner: Høyeste tolererbare dose statin i kombinasjon med ezetimib. For brukere som ikke tåler statiner (statinintoleranse): Minst to forskjellige statiner i laveste dose i kombinasjon med ezetimib. Intoleranse må dokumenteres i journal av forskrivende lege. Ved absolutt kontraindikasjon mot statiner: ezetimib i monoterapi.
Refusjonskoder ICD: -26 etablert aterosklerotisk sykdom (sekundærprevensjon) og E78 ren hyperkolesterolemi. ICPC: -26 etablerte atersklerotisk sykdom og T93 hyperkolesterolemi.
Referanser:
1. Praluent SPC 18.11.2024 pkt 4.2.
2. https://www.felleskatalogen.no/medisin/blaarev-register/c10ax14-1 (15.05.2025).
MAT-NO-2500180 (V1.0) 05.2025
sanofi-aventis Norge AS - Pb 133, 1325 Lysaker - Tel.: 67 10 71 00 www.sanofi.no
Praluent godkjent preparatomtale


C Praluent «sanofi-aventis»
Lipidmodifiserende middel, humant monoklonalt antistoff (IgG1).
ATC-nr.: C10A X14
INJEKSJONSVÆSKE, oppløsning 75 mg/ml, 150 mg/ml og 300 mg/2 ml: Hver ferdigfylt penn inneh.: Alirokumab 75 mg, 150 mg resp. 300 mg, histidin, sukrose, polysorbat 20, vann til injeksjonsvæsker.
PRALUENT er indisert ved: Primær hyperkolesterolemi eller blandet dyslipidemi: Til voksne med primær hyperkolesterolemi (heterozygot familiær og ikke-familiær) eller blandet dyslipidemi, og hos pediatriske pasienter >8 år med heterozygot familiær hyperkolesterolemi (HeFH) som tilleggsbehandling til diett: I kombinasjon med et statin eller statin med annen lipidsenkende behandling hos pasienter som ikke oppnår LDL-kolesterol (LDL-C)-mål med høyeste tolererte dose av et statin, eller alene eller i kombinasjon med annen lipidsenkende behandling hos pasienter som er statinintolerante, eller der et statin er kontraindisert.
Påvist aterosklerotisk kardiovaskulær sykdom: Til voksne med påvist aterosklerotisk kardiovaskulær sykdom for å redusere kardiovaskulær risiko ved å senke LDL-C-nivåene, som tillegg til korreksjon av andre risikofaktorer: I kombinasjon med den maks. tolererte dosen av et statin med eller uten andre lipidsenkende behandlinger, eller, alene eller i kombinasjon med andre lipidsenkende behandlinger hos pasienter som er statinintolerante, eller der et statin er kontraindisert. For informasjon om studieresultater i forhold til effekt på LDL-C, kardiovaskulære hendelser og studerte pasientgrupper, se SPC. Dosering: Vanlig oppstartsdose er 75 mg 1 gang hver 2. uke. Hvis ønsket LDL-C-reduksjon er >60%, gis 150 mg 1 gang hver 2. uke, eller 300 mg 1 gang hver 4.uke (månedlig).
Utvalgt sikkerhetsinformasjon:
Bivirkninger: Vanlige (≥1/100 til <1/10): Generelle: Reaksjon på injeksjonsstedet inkl. erytem/rødhet, kløe, hevelse, smerter/ømhet. Hud: Kløe. Luftveier: Tegn og symptomer fra de øvre luftveiene inkl. smerter i orofarynks, rhinoré, nysing. Sjeldne (≥1/10 000 til <1/1000): Hud: Nummulært eksem, urtikaria. Immunsystemet: Overfølsomhet, overfølsomhetsvaskulitt. Ukjent frekvens: Generelle: Influensalignende sykdom. Hud: Angioødem. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Forsiktighetsregler: Brukes med forsiktighet ved alvorlig nedsatt lever- eller nyrefunksjon. Interaksjoner: Klinisk relevante interaksjoner forventes ikke. Pakninger og listepriser: 75 mg/ml: 2 stk. kr 4453. 6 stk. kr 13286,60. 150 mg/ml: 2 stk. kr 4453. 6 stk. kr 13286,60. 300 mg/2 ml: 3 stk. kr 13286,60. Refusjonsprisen er rabattert: Anbudskode: 2580. For fullstendig informasjon les godkjent FK-tekst eller SPC for Praluent. Praluent «Sanofi» - Felleskatalogen. Basert på Praluent SPC godkjent av DMP/EMA 18.11.2024.
sanofi-aventis Norge AS - Pb 133, 1325 Lysaker - Tel.: 67 10 71 00 www.sanofi.no
ATTR-CM behandling med fem års overlevelsesdata3
TRANSTYRETIN AMYLOID KARDIOMYOPATI (ATTR-CM) ER EN UNDERDIAGNOSTISERT ÅRSAK TIL HJERTESVIKT1,2
Etter 30 måneder reduserte Vyndaqel risiko vs. placebo for 4,‡:
Død uansett årsak

Kardiovaskulære sykehusinnleggelser


HR: 0,70 (95 % KI: 0,51-0,96)



Relativ risikoratio: 0,68 (95 % CI 0,56-0,81)
Etter fem år var relativ risikoreduksjon for død uansett årsak 41 % (HR: 0,59 (95% KI: 0,44-0,79))3
Se et variert utvalg av foredrag som dekker ulike emner innen kardiologi
▼Vyndaqel® (tafamidis) 61 mg er indisert til behandling av villtype eller arvelig transtyretin amyloid kardiomyopati (ATTR-CM). Anbefalt dosering er 1 kapsel 1 gang daglig. Forsiktighet anbefales ved alvorlig nedsatt leverfunksjon. Kan gi interaksjoner ved klinisk relevante konsentrasjoner med BCRP-substrater (f.eks. metotreksat, rosuvastatin, imatinib). Utvalgte bivirkninger: Økte verdier i leverfunksjonsprøver og reduksjon i tyroksin kan forekomme. Pris: Det er fremforhandlet en konfidensiell, kostnadseffektiv pris til norske helseforetak og enkelte private sykehus. Denne er betydelig lavere enn maksimal utsalgspris i apotek, som er kr 129 737,10.
Pakning: Myke kapsler, 30 stk. Reseptgruppe: C. Refusjon: H-resept. ICD10: E85
Kriterier for forskrivning på H-resept:
1. Oppstart av behandling kan kun gjøres av kardiolog med erfaring i behandling av transtyretin amyloidose (ATTR), ansatt ved universitetssykehus eller annet helseforetak med kardiologisk enhet med kompetanse på behandling for denne pasientgruppen.Pasienten må ha en sikkert diagnostisert ATTR kardiomyopati, vanligvis med nukleærmedisinsk påvist amyloid i myokard. Pasienten skal ved oppstart være i NYHA-klasse I eller II.
2. Pasienten må ha en sikkert diagnostisert ATTR kardiomyopati, vanligvis med nukleærmedisinsk påvist amyloid i myokard. Pasienten skal ved oppstart være i NYHA-klasse I eller II.
3. Pasienten skal ha en forventet gjenstående levetid betydelig over 18 måneder.
4. Ved progresjon til vedvarende (minst 6 måneder) NYHA-klasse III, skal beslutning om å fortsette behandlingen tas i samråd med kardiolog med erfaring i behandling av ATTR, ansatt ve universitetssykehus eller annet helseforetak med kardiologisk enhet med kompetanse på behandling for denne pasientgruppen.
5. Ved rask progresjon til vedvarende NYHA-klasse III i løpet av 6 måneder etter initiert behandling, bør behandlingen avsluttes.
Før forskrivning, konsulter preparatomtalen på www.legemiddelsok.no
‡Hjertetransplantasjon, kombinert hjerte- og levertransplantasjon og hjertemekanisk hjelpemiddelimplantasjon (CMAD) ble behandlet som likeverdig med død i denne analysen. ATTR-ACT=Tafamidis in Transthyretin Cardiomyopathy Clinical Trial; TTR=Transtyretin; HR=Hazard ratio Referanser: 1. Witteles RM, et al. JACC Heart Fail. 2019;7(8):709-716. 2. Maurer MS, et al. J Am Coll Cardiol. 2016;68(2):161-172. 3. Eliott P, et al. Long-term survival with tafamidis in patients with transthyretin amyloid cardiomyopathy. Circ Heart Fail. 2022;15:4-11. 4. Maurer MS, et al. N Engl J Med. 2018;379(11):1007-1016.