Spis treści szczegółowy
Tom pierwszy
1 Podstawy. Wiązania chemiczne i budowa cząsteczek
1.1 Życie i chemia związków węgla – jesteśmy gwiezdnym pyłem
1.1A Jakie jest pochodzenie pierwiastka węgla?
Jak powstały żywe organizmy?
Teoria rezonansu
1.8C Jak określić, która ze struktur rezonansowych wnosi większy wkład do struktury hybrydy?
Mechanika kwantowa i
1.16C Woda
1.16D Trifluorek boru
1.16F Ditlenek węgla (dwutlenek węgla)
1.17 Zastosowanie podstawowych reguł
2 Rodziny związków węgla. Grupy funkcyjne, oddziaływania
międzycząsteczkowe i spektroskopia w podczerwieni (IR)
2.1 Węglowodory: reprezentatywne alkany, alkeny, alkiny i związki aromatyczne
2.1A Alkany
Alkiny
2.1D Benzen – reprezentatywny węglowodór aromatyczny
2.2 Polarne wiązania kowalencyjne
Mapy potencjału elektrostatycznego
2.3 Cząsteczki polarne i niepolarne
2.4 Grupy funkcyjne
2.4A Grupy alkilowe i symbol R
2.4B Grupa fenylowa i benzylowa
2.5 Halogenki alkilowe lub halogenoalkany
2.7 Etery
Aminy
Aldehydy i ketony
2.10 Kwasy karboksylowe, estry i amidy
2.10A Kwasy karboksylowe
2.10C Amidy
2.12 Podsumowanie podstawowych rodzin związków organicznych
12A Grupy funkcyjne w związkach o znaczeniu biologicznym
2.13 Właściwości fizyczne i struktura cząsteczkowa
2.13A Związki jonowe: oddziaływania jonowo–jonowe
2.13B Siły międzycząsteczkowe (siły van der Waalsa)
2.13C Temperatury wrzenia
2.13D Rozpuszczalność
2.13E Reguły dotyczące rozpuszczalności w wodzie
2.13F Oddziaływania międzycząsteczkowe w biochemii
2.14 Podsumowanie przyciągających oddziaływań elektrostatycznych
2.15 Spektroskopia w podczerwieni – metoda instrumentalna do wykrywania grup funkcyjnych
2.16 Interpretacja widm IR
2.16A Widma węglowodorów w podczerwieni
2.16B Widma IR niektórych grup funkcjonalnych zawierających
2.17 Wnioski dotyczące podstawowych zasad
3 Kwasy i zasady. Reakcje organiczne i ich mechanizmy. Wprowadzenie
3.1 Reakcje kwas–zasada
3.1A Teoria kwasów i zasad Brønsteda–Lowry’ego
3.1B Kwasy i zasady w wodzie
3.2 Jak i kiedy? Zakrzywione strzałki w opisie reakcji .
3.3 Kwasy i zasady Lewisa .
3.3 Ładunki przeciwne przyciągają się
3.4 Heteroliza wiązań z atomami węgla. Karbokationy i karboaniony
3.4A Elektrofile i nukleofile
3.5 Moc kwasów i zasad Brønsteda–Lowry’ego: Ka i pKa
3.5A Stała kwasowości, K
3.5B Kwasowość i pKa
3.5C Określanie mocy zasady
3.6 Jak przewidzieć wynik reakcji kwas–zasada
3.6A Rozpuszczalność w wodzie jako wynik tworzenia soli
3.7 Zależność między strukturą a kwasowością
3.7A Efekt hybrydyzacji
Efekt indukcyjny
3.8 Zmiany energii
3.8A Energia potencjalna i wiązania kowalencyjne
3.9 Relacja między stałą równowagi i standardową zmianą energii swobodnej, ΔG°
3.10 Kwasowość. Kwasy karboksylowe a alkohole
3.10A Efekt delokalizacji
3.10B Efekt indukcyjny
3.10C Podsumowanie i porównanie mocy sprzężonych kwasów i zasad
3.10D Efekty indukcyjne innych grup funkcyjnych
3.10E Moc kwasowa fenoli
3.10F Rozróżnianie i oddzielanie fenoli od alkoholi i kwasów karboksylowych
3.11 Wpływ rozpuszczalnika na kwasowość
3.12 Związki organiczne jako zasady
3.13 Mechanizm reakcji związków organicznych
3.14 Kwasy i zasady w roztworach niewodnych
3.15 Reakcje kwas–zasada i synteza związków znakowanych deuterem oraz trytem
4.1 Alkany i cykloalkany – wprowadzenie
Źródło
Jak nazywamy alkany, halogenki alkilowe i alkohole.
nazywamy alkany o rozgałęzionym łańcuchu
Jak nazywamy halogenki alkilów
Jak nazywamy alkohole
Jak nazywamy monocykliczne cykloalkany
4.5 Jak nazywamy alkeny
Jak nazywamy alkiny
Właściwości
4.9A Stereoizomery i stereoizomery konformacyjne
4.10 Względna trwałość cykloalkanów. Naprężenie pierścienia
4.10B Cyklobutan
4.10C Cyklopentan
4.11 Konformacje cykloheksanu. Konformacja krzesłowa i łodziowa
4.11A Konformacje wyższych cykloalkanów
4.12 Podstawione cykloheksany. Aksjalne i ekwatorialne pozycje atomów wodoru
4.12A Jak rysujemy krzesłowe struktury konformacyjne
4.12B Analiza konformacyjna metylocykloheksanu
4.12C 1,3-Diaksjalne oddziaływania grupy tert-butylowej
4.13 Dipodstawione cykloalkany. Izomeria cis-trans
4.13A Izomeria cis–trans i struktury konformacyjne cykloheksanu
4.14 Alkany bicykliczne i policykliczne
4.15 Reakcje chemiczne alkanów
4.16 Synteza alkanów i cykloalkanów
4.16A Reakcja uwodornienia alkenów i alkinów
4.17 Jak uzyskać informacje strukturalne ze wzoru sumarycznego i indeksu niedoboru wodoru (IHD)
4.17A Związki zawierające halogeny, tlen lub azot
4.18 Wykorzystanie podstawowych reguł
Podsumowanie
Zagadnienie dodatkowe A Spektroskopia 13C NMR – wprowadzenie
A.1 Jeden sygnał dla każdego odrębnego węgla
A.2 Przesunięcie chemiczne – lokalizacja sygnału zależy od otoczenia elektronowego
A.3 Jak wykorzystać 13C NMR do wyjaśnienia struktury
5 Stereochemia. Cząsteczki chiralne
5.1 Chiralność i stereochemia
5.1A Biologiczne znaczenie chiralności
5.2 Izomeria. Izomery konstytucyjne i stereoizomery
5.2A Izomery konstytucyjne
5.2B Stereoizomery
5.2C Enancjomery i diastereoizomery
5.3 Enancjomery i związki chiralne
5.4 Cząsteczki z jednym centrum chiralności są chiralne
5.4A Tetraedryczne oraz trygonalne centra stereogeniczne
5.5 Chiralność i jej znaczenie biologiczne
5.6 Jak sprawdzić czy związki są chiralne. Płaszczyzna symetrii
5.7 Nazewnictwo enancjomerów. System R i S
5.7A Jak określić konfiguracje (R) i (S)
5.8 Właściwości enancjomerów. Czynność optyczna
5.8A Światło liniowo spolaryzowane
5.8C Skręcalność właściwa
5.9 Mieszaniny racemiczne
5.9A Formy racemiczne i nadmiar enancjomeryczny
5.10 Synteza związków chiralnych
5.10A Mieszaniny racemiczne
5.10B Synteza stereoselektywna
5.11 Chiralne leki
5.12 Cząsteczki z więcej niż jednym centrum chiralności
5.12A Jak rysować stereoizomery cząsteczek, które mają więcej niż jedno centrum chiralaności
5.12B Związki mezo
5.12C Jak nazywać związki z więcej niż jednym centrum chiralności
5.13 Wzory w projekcji Fischera
5.13A Jak rysować i wykorzystywać projekcję Fischera
5.14 Stereoizomeria związków cyklicznych
5.14A Pochodne cykloheksanu
5.15 Konfiguracja w reakcjach, w których nie są zrywane wiązania z atomem będącym centrum chiralności
5.15A Konfiguracja względna i absolutna
5.16 Rozdzielanie enancjomerów
5.16A Metoda Pasteura rozdzielania enancjomerów
5.16B Nowoczesne metody rozdziału enancjomerów
5.17 Związki z centrum chiralności innym niż atom węgla
5.18 Związki chiralne bez centrum chiralności
6 Reakcje nukleofilowe. Właściwości i reakcje substytucji halogenków alkilowych
6.1 Halogenki alkilowe
6.1A Właściwości fizyczne halogenków alkilowych
6.2 Reakcje substytucji nukleofilowej
6.3 Nukleofile
6.4 Grupy opuszczające
6.5 Kinetyka reakcji podstawienia nukleofilowego. Reakcja SN2
6.5A Jak mierzyć szybkość tej reakcji?
6.5B Jaki jest rząd tej reakcji?
6.6 Mechanizm reakcji SN2
6.7 Teoria stanu przejściowego. Diagramy swobodnej energii
6.7A Temperatura i szybkość reakcji
6.8 Stereochemia reakcji SN2
6.9 Reakcja chlorku tert-butylu z wodą. Reakcja SN1
6.9A Reakcje wieloetapowe i etap określania szybkości
6.10 Mechanizm reakcji SN1
6.11 Karbokationy
6.11A Struktura karbokationów
6.11B Względna trwałość karbokationów
6.12 Stereochemia reakcji SN1
6.12A Reakcje racemiczne
6.12B Solwoliza
6.13 Czynniki wpływające na szybkość reakcji SN1 i SN2
6.13A Wpływ struktury substratu
6.13B Wpływ stężenia i rodzaju nukleofila
6.13C Wpływ rozpuszczalnika w reakcjach SN2 i SN1
6.13D Charakter grup opuszczających
6.14 Synteza organiczna. Przemiany grup funkcyjnych z wykorzystaniem reakcji substytucji SN2
6.14A Niereaktywne halogenki winylowe i fenylowe
7 Alkeny i alkiny. Właściwości i synteza. Reakcje eliminacji halogenków alkilowych
7 .1 Wstęp .
7.1A Właściwości fizyczne alkenów i alkinów
7.2 System (E)–(Z) do oznaczania diastereoizomerów alkenowych
7.2A Jak korzystać z systemu (E)–(Z)
7.3 Względne trwałości alkenów
7.3A Ciepło reakcji
7.3B Ogólna względna trwałość alkenów
7.5 Synteza alkenów. Reakcje eliminacji
7.6 Dehydrohalogenowanie
7.6A Zasady wykorzystywane w dehydrohalogenowaniu
7.6B Mechanizmy dehydrohalogenowania
7.7 Reakcja E2
7.7A Reguła Zajcewa: w reakcjach eliminacji z wykorzystaniem „małej” objętościowo zasady uprzywilejowane jest powstanie bardziej podstawionych alkenów
7.7B Powstawanie mniej podstawionego alkenu przy wykorzystaniu objętościowo stłoczonych zasad
7.7C Stereochemia reakcji E2. Orientacja grup w stanie przejściowym
E1
7.8A W jaki sposób faworyzować mechanizm E2
7.9 Konkurencyjność reakcji eliminacji i substytucji
7.9A Jak ustalić, co jest procesem faworyzowanym – substytucja, czy eliminacja
7.10 Reakcje eliminacji alkoholi. Katalizowana kwasem reakcja dehydratacji
7.10A Mechanizm odwadniania alkoholi drugorzędowych i alkoholi trzeciorzędowych. Reakcja E1
7.10B Trwałość karbokationów i stan przejściowy
7.10C Mechanizm dehydratacji alkoholi pierwszorzędowych. Reakcja E2
7.11 Trwałość karbokationów i występowanie przegrupowań molekularnych
7.11A Przegrupowania podczas dehydratacji alkoholi drugorzędowych
7.11B Przegrupowania po dehydratacji alkoholi pierwszorzędowych
7.12 Kwasowość terminalnych alkinów
7.13 Synteza alkinów z wykorzystaniem reakcji eliminacji
7.13A Uwagi praktyczne dotyczące syntezy alkinów w reakcji podwójnej dehydrohalogenacji
7.14 Terminalne alkiny można przekształcić w nukleofile w celu utworzenia wiązań węgiel–węgiel
7.14A Struktura–reaktywność na przykładzie alkilowania anionów alkinilowych
7.15 Uwodornianie alkenów
7.16 Uwodornianie. Rola katalizatora
7.16A Addycje syn i anti
7.17 Uwodornianie alkinów
7.17A Addycja syn wodoru. Synteza cis-alkenów
7.17B Addycja anti wodoru. Synteza trans-alkenów
7.18 Wprowadzenie do syntezy organicznej
7.18A Dlaczego synteza organiczna?
7.18B Analiza retrosyntetyczna – planowanie syntezy organicznej
7.18C Wybór prekursorów
Podsumowanie
8.1B Addycja elektrofilowa do alkenu
8.2 Elektrofilowa addycja halogenowodorów do alkenów. Mechanizm i reguła Markownikowa
8.2A Teoretyczne wyjaśnienie reguły Markownikowa
8.2B Ogólne wnioski wynikające z reguły Markownikowa
8.2C Reakcje regioselektywne
8.2D Addycja HBr w obecności nadtlenków. Addycja antymarkownikowa
8.3 Stereochemia addycji jonowej do alkenu
8.4 Addycja wody do alkenów. Hydratacja katalizowana kwasem
8.4A Mechanizm
8.4B Przegrupowania
8.5 Alkohole z alkenów w reakcji oksymerkuracja–demerkuracja. Addycja Markownikowa
8.5A Regioselektywność oksymerkuracji––demerkuracji
8.5B Przegrupowania tylko sporadycznie występują w reakcjach oksymerkuracji–demerkulacji
8.5C Mechanizm oksymerkuracji
8.6 Alkohole z alkenów w reakcji hydroborowania–utleniania. Hydratacja syn przebiegająca antymarkownikowo
8.7 Hydroborowanie. Synteza alkiloboranów
8.7A Mechanizm hydroborowania
8.7B Stereochemia hydroborowania
8.8 Utlenianie i hydroliza alkiloboranów
8.8A Regiochemia i stereochemia utleniania i hydrolizy alkiloboranu
8.9 Podsumowanie metod hydratacji alkenu
8.10 Protonoliza alkiloboranów
8.11 Elektrofilowa addycja bromu i chloru do alkenów
8.11A Mechanizm addycji halogenu
8.12 Reakcje stereospecyficzne
8.13 Powstawanie halohydryn
8.14 Dwuwartościowe związki węgla. Karbeny
8.14A Struktura i reakcje metylenu
8.14B Reakcje innych karbenów. Dihalokarbeny
8.14C Karbenoidy. Synteza cyklopropanu metodą Simmonsa–Smitha
8.15 Utlenianie alkenów. syn-1,2-Dihydroksylowanie
8.15 Mechanizm syn-dihydroksylowania alkenów
8.16 Oksydacyjne rozszczepienie alkenów
8.16A Rozszczepienie za pomocą gorącego zasadowego roztworu nadmanganianu potasu
8.16B Rozszczepienie ozonem (ozonoliza)
8.17 Elektrofilowa addycja bromu i chloru do alkinów
8.18 Addycja halogenowodorów do alkinów
8.19 Oksydacyjne rozszczepienie alkinów
8.20 Jak planować syntezę. Kilka przykładów
8.20A Analiza retrosyntetyczna
8.20B Rozłączenia, syntony i syntetyczne równoważniki
8.20C Aspekty stereochemiczne
Podsumowanie
9 Magnetyczny rezonans jądrowy i spektrometria mas. Narzędzia do ustalania struktury związków
9.1 Wprowadzenie
9.2 Spektroskopia magnetycznego rezonansu jądrowego (NMR)
9.2A Przesunięcie chemiczne
9.2B Całkowanie (integracja) obszarów pod sygnałami
9.2C Sprzęganie (rozczepienie sygnału)
9.3 Jak interpretować widma 1H NMR
9.4 Przesłanianie (ekranowanie) i odsłanianie protonów. Więcej o przesunięciu chemicznym
9.5 Przesunięcia chemiczne równoważnych i nierównoważnych protonów
9.5A Atomy homotopowe i heterotopowe
9.5B Enancjotopowe i diastereotopowe atomy wodoru
9.6 Sprzężenie spin–spin. Więcej o rozczepieniu sygnału oraz o nierównoważnych lub równoważnych protonach
9.6A Sprzężenia wicynalne
9.6B Stałe sprzężenia – rozpoznawanie wzorców rozczepienia
9.6C Zależność stałych sprzężenia od kąta dwuściennego
9.7 Widma protonowego NMR i procesy kinetyczne
9.8 Spektroskopia NMR węgla-13
9.8A Interpretacja widm 13C NMR
9.8B Jeden pik przypisany każdemu magnetycznie wyróżnionemu atomowi węgla
9.8C Przesunięcia chemiczne 13C NMR
9.8D Widma DEPT 13C
9.9 Techniki dwuwymiarowego (2D) NMR
9 9A 1H–1H COSY. Korelacje między pikami
9.9B Korelacja heterojądrowa 1H–13C. Korelacje między pikami
9.10 Wprowadzenie do spektrometrii mas
9.11 Powstawanie jonów. Jonizacja elektronowa
9.12 Przedstawianie jonów molekularnych
9.13 Fragmentacja
9.13A Fragmentacja w wyniku rozszczepienia pojedynczego wiązania
9.13B Fragmentacja dłuższego łańcucha i rozgałęzione alkany
9.13C Fragmentacja ze stabilizacją rezonansową kationu
9.13D Fragmentacja w wyniku rozszczepienia dwóch wiązań
9.14 Izotopy w widmach masowych
9.14A Spektrometria mas wysokiej rozdzielczości
9.15 Analiza GC/MS
9.16 Spektrometria mas biomolekuł
Zagadnienie dodatkowe B NMR. Teoria i oprzyrządowanie
B.1 Spin jądrowy. Pochodzenie sygnału
B.2 Detekcja sygnału. Spektrometry NMR z transformatą Fouriera
B.3 Przesunięcie chemiczne
B.3A Część na milion (ppm) i skala δ
B.4 Przesłanianie i odsłanianie protonów. Indukowane pola magnetyczne
B.5 Geneza rozszczepienia sygnału. Schematy rozszczepień
B.6 Czynniki, które mogą komplikować analizy widm 1H NMR
10 Reakcje rodnikowe
10.1 Wprowadzenie. Jak powstają i jak reagują rodniki
10.1A Powstawanie rodników
10.1B Reakcje rodników
10.2 Energie dysocjacji wiązania homolitycznego (DH°)
10.2A Jak wykorzystać energie dysocjacji homolitycznej wiązania do określenia względnej trwałości rodników
10.3 Reakcje alkanów z halogenami
10.3A Wielokrotna substytucja halogenu
10.3B Brak selektywności chlorowania
10.4 Chlorowanie metanu. Mechanizm reakcji
10.5 Halogenowanie wyższych alkanów
10.5A Selektywność reakcji bromowania
10.6 Geometria rodników alkilowych
10.7 Reakcje, w których powstają tetraedryczne centra chiralności
10.7A Generowanie drugiego centrum chiralności w reakcji rodnikowego halogenowania
10.8 Reakcja substytucji allilowej i rodniki allilowe
10.8A Allilowe chlorowanie (wysoka temperatura)
10.8B Reakcja allilowego bromowania z N-bromosukcynoimidem (małe stężenie Br2)
10.8C Stabilizacja rodników allilowych dzięki delokalizacji elektronów
10.9 Substytucja benzylowa i rodniki benzylowe
10.10 Rodnikowa addycja do alkenów. Addycja bromowodoru niezgodna z regułą
Markownikowa
10.10A Podsumowanie reakcji addycji HBr do alkenów przebiegających zgodnie i niezgodnie z regułą Markownikowa
10.11 Rodnikowa polimeryzacja alkenów. Polimery wzrostu łańcucha
10.12 Inne ważne reakcje rodnikowe
10.12A Tlen cząsteczkowy i ponadtlenki
10.12B Tlenek azotu
10.12C Samoutlenianie
Zagadnienie dodatkowe C Polimery wzrostu łańcucha
C.1 Stereochemia polimeryzacji wzrostu łańcucha
11 Alkohole i etery. Synteza i reakcje
11.1 Budowa i nazewnictwo
11.2 Właściwości fizyczne alkoholi i eterów
11.3 Najważniejsze alkohole i etery
Metanol
Etanol
11.3C Glikole etylenowy i propylenowy
Eter dietylowy
11.4 Synteza alkoholi z alkenów
11.5 Reakcje alkoholi
11.6 Alkohole jako kwasy
11.7 Przekształcanie alkoholi w halogenki alkilu
11.8 Halogenki alkilu z reakcji alkoholi z halogenowodorami
11.8A Mechanizm reakcji alkoholi z HX
11.9 Otrzymywanie halogenków alkilu z alkoholi przy użyciu PBr3 i SOCl2
11.10 Tosylany, mesylany i triflany. Pochodne alkoholu zawierające grupy opuszczające . 527
11.11 Otrzymywanie eterów
11.11A Otrzymywanie eterów w wyniku miedzycząsteczkowej dehydratacji alkoholi
11.11B Synteza eterów Williamsona
11.11C Fenole w syntezie eterów Williamsona
11.11D Synteza eterów przez alkoksyrtęciowanie/odrtęciowanie
11.11E Etery tert-butylowe otrzymywane przez alkilowanie alkoholi. Grupy ochronne .
11.11F Eter sililowy jako grupa zabezpieczająca
11.12 Reakcje eterów
11.12A Rozszczepienie eterów
11.12B Rozszczepienie eterów alkilowo-arylowych
11.13. Epoksydy . . .
11.13A Synteza epoksydów. Epoksydowanie .
11.13B Stereochemia reakcji epoksydowania
11.14 Reakcje epoksydów
11.14A Polietery z epoksydów
11.15 Anti 1,2-dihydroksylowanie alkenów poprzez epoksydy
11.16 Etery koronowe
11.17 Podsumowanie reakcji alkenów, alkoholi i eterów
11.17A Zastosowanie alkenów w syntezie
Podsumowanie
12 Alkohole ze związków karbonylowych. Utlenianie–redukcja i związki magnezoorganiczne
12.1 Budowa grupy karbonylowej
12.1A Reakcje związków karbonylowych z nukleofilami
12.2 Reakcje utleniania i redukcji w chemii organicznej
12.3 Alkohole powstające w reakcji redukcji związków kabronylowych
12.3A Tetrahydrydoglinian litu
12.3B Tetrahydroboran sodu
12.3C Podsumowanie reaktywności LiAlH4 i NaBH4
12.3D Redukcja halogenków alkilu do węglowodorów: RX → RH
12.4 Utlenianie alkoholi
12.4A Wspólne etapy mechanizmów utleniania
12.4B Utlenianie Swerna
12.4C Utlenianie kwasem chromowym (H2CrO4)
12.4D Chlorochromian pirydyny (PCC)
12.4E Nadmanganian potasu (KMnO4)
12.4F Spektroskopowe właściwości alkoholi
12.5 Związki metaloorganiczne
12.6 Otrzymywanie związków litoorganicznych i magnezoorganicznych
12.6A Związki litoorganiczne
12.6B Związki Grignarda
12.7 Reakcje związków litoorganicznych i magnezoorganicznych
12.7A Reakcje ze związkami zawierającymi kwasowy atom wodoru
12.7B Reakcje związków Grignarda z epoksydami (oksiranami)
12.7C Reakcja związków Grignarda ze związkami karbonylowymi
12.8 Alkohole ze związków grignarda
12.8A Planowanie syntezy z zastosowaniem związków Grignarda
12.8B Ograniczenia przy stosowaniu związków Grignarda
12.8C Zastosowanie związków litoorganicznych
12.8D Zastosowanie acetylenków sodu
12.9 Grupy zabezpieczające 584
Podsumowanie
Pierwszy zestaw zadań powtórkowych
13 Sprzężone układy nienasycone
13.1 Wprowadzenie
13.2 Stabilność rodników allilowych
13.2A Opis rodnika allilowego za pomocą orbitali molekularnych
13.2B Opis rodnika allilowego za pomocą rezonansu
13.3 Kation allilowy .
13.4 Powrót do teorii rezonansu
13.4A Jak zapisywać poprawne struktury rezonansowe
13.4B Jak oszacować względną stabilizację, jaką dają struktury rezonansowe .
13.5 Alkadieny i węglowodory wielonienasycone
13.6 Buta-1,3-dien. Delokalizacja elektronów
13.6A Długość wiązań w buta-1,3-dienie
13.6B Konformacje buta-1,3-dienu
13.6C Orbitale molekularne buta-1,3-dienu
13.7 Stabilność sprzężonych dienów
13.8 Spektroskopia w nadfiolecie-świetle widzialnym (UV-Vis)
13.8A Widmo promieniowania elektromagnetycznego
13.8B Spektrofotometr UV-Vis
13.8C Maksima absorpcji sprzężonych i niesprzężonych dienów
13.8D Zastosowanie spektroskopii UV-Vis w analityce
13.9 Atak elektrofilowy na sprzężone dieny. Addycja 1,4
13.9A Kontrola kinetyczna a kontrola termodynamiczna reakcji chemicznej
13.10 Reakcja Dielsa–Aldera. Reakcja 1,4-cykloaddycji dienów
13.10A Czynniki ułatwiające reakcję Dielsa–Aldera
13.10B Stereochemia reakcji Dielsa–Aldera
13.10C Jak przewidzieć produkt reakcji Dielsa–Aldera
13.10D Jak użyć reakcji Dielsa–Aldera w analizie retrosyntetycznej
Podsumowanie
Rozwiązania wybranych ćwiczeń i zadań
Słowniczek
Indeks i-1
Na marginesie str. 59
Model kryształu fluorku litu
Schematic representation of benzene p orbitals
Schematyczne przedstawienie orbitali p benzenu
Kszta ty obliczonych orbitali p w benzenie
Calculated p orbital shapes in benzene
Obliczony cz steczkowy orbital benzenu wynikaj cy z korzystnego nak adania si p orbitali nad i pod p aszczyzn pier cienia benzenowego
Calculated benzene molecular orbital resulting from favorable overlap of p orbitals above and below plane of benzene ring
W wyjaśnieniu orbitali molekularnych, co zostanie omówione znacznie bardziej szczegółowo w rozdziale 14 zaczynamy od stwierdzenia, że atomy węgla pierścienia benzenowego są zhybrydyzowane sp 2 i mają kąty wiązania 120°. Dlatego każdy atom węgla ma orbital p, który ma jeden płat powyżej płaszczyzny pierścienia i jeden płat poniżej, jak pokazano w schematycznym i obliczonym przedstawieniu orbitali p
Płaty każdego orbitalu p nad i pod pierścieniem pokrywają się z płatami orbitali p przy atomach po obu stronach. Ten rodzaj nakładania się orbitali p prowadzi do zestawu wiązań orbitala molekularnego, który obejmuje wszystkie atomy węgla pierścienia benzenu, co przedstawiono jako obliczony orbital molekularny. Tak więc sześć elektronów związanych z tymi orbitalami p (jeden elektron z każdego orbitalu) są zdelokalizowane wokół wszystkich sześciu atomów węgla pierścienia. Ta delokalizacja elektronów wyjaśnia, w jaki sposób wszystkie wiązania węgiel–węgiel są równocenne i mają taką samą długość. W rozdziale 14.7B, kiedy zostanie omówiona spektroskopia magnetycznego rezonansu jądrowego, przedstawione zostaną przekonujące dowody fizyczne na tę delokalizację elektronów.
2.2 POLARNE WI ZANIA KOWALENCYJNE
W omówieniu dotyczącym wiązań chemicznych w rozdziale 1.3 analizowaliśmy związki, takie jak fluorek litu, w którym wiązanie znajduje się między dwoma atomami o bardzo dużej różnicy elektroujemności. W takich przypadkach zachodzi całkowity transfer elektronów między atomami, co w konsekwencji prowadzi do powstania wiązania jonowego: Li+ F –
Fluorek litu ma wi zanie jonowe
Opisaliśmy również cząsteczki, w których różnice elektroujemności nie są duże lub takie, w których atomy nie różnią się elektroujemnością, jak na przykład w wiązaniu węgiel–węgiel etanu. Tutaj elektrony są równo dzielone między atomy.
H H
H C : C H
H H
Wi zanie kowalencyjne w etanie.
Elektrony s uwspólnione przez atomy w gla
Do tej pory nie rozważaliśmy możliwości, że elektrony wiązania kowalencyjnego mogą być dzielone nierówno.
• Jeśli istnieje różnica elektroujemności między dwoma związanymi atomami i nie jest ona duża, elektrony nie są równo dzielone pomiędzy atomami, w wyniku czego powstaje polarne wiązanie kowalencyjne
• Pamiętaj: jedną z definicji elektroujemności jest zdolność atomu do przyciągania elektronów, które zlokalizowane są w wiązaniu kowalencyjnym.
Model kryszta u uorku litu
Przykładem takiego polarnego wiązania kowalencyjnego jest to w chlorowodorze. Atom chloru, ze swoją większą elektroujemnością, przyciąga do siebie elektrony wiążące. To sprawia, że atom wodoru ma pewien niedobór elektronów, co powoduje powstanie częściowego ładunku dodatniego ( +). Atom chloru staje się nieco bardziej bogaty w elektrony i niesie częściowy ładunek ujemny ( –): + –H : Cl
Tak więc cząsteczka chlorowodoru ma jeden koniec częściowo dodatni, a drugi częściowo ujemny, jest dipolem i charakteryzuje się momentem dipolowym. Kierunek polaryzacji wiązania spolaryzowanego można symbolicznie przedstawić jako wektor. Przekreślony koniec strzałki wektora jest końcem dodatnim, a grot wskazuje koniec ujemny:
(koniec dodatni) (koniec ujemny)
Na przykład w HCl wskazujemy kierunek momentu dipolowego w sposób następujący: H Cl
Moment dipolowy jest właściwością fizyczną, którą można zmierzyć doświadczalnie. Jest on zdefiniowany jako iloczyn wielkości ładunku w jednostkach elektrostatycznych (ang. electrostatic units, esu) i odległości dzielącej je w centymetrach (cm):
Moment dipolowy = adunek (w esu) × odleg o (w cm)
= e × d
Wielkości ładunku są zazwyczaj rzędu 10–10 esu, a odległości są rzędu 10–8 cm; stąd momenty dipolowe są zatem zazwyczaj rzędu 10–18 esu · cm. Dla wygody, tę jednostkę, 1 × 10–18 esu · cm, definiujemy jako jeden debaj, symbol D. (Jednostka nosi imię Petera J. W. Debye’a, chemika urodzonego w Holandii i który wykładał na Cornell University w latach 1936–1966. Debye zdobył Nagrodę Nobla w chemii w 1936 roku). W jednostkach SI 1 D = 3,336 × 10–30 kulombometr (C · m).
W razie potrzeby długość strzałki może służyć do wskazania wielkości momentu dipolowego. Momenty dipolowe, jak zobaczymy w rozdziale 2.3, są bardzo użytecznymi wielkościami w różnicowaniu właściwości fizycznych związków.
WICZENIE 2.2 Wskaż ładunki + i – na odpowiednich atomach i narysuj wektor momentu dipolowego dla poniżej przedstawionych cząsteczek, które są polarne: (a) HF (b) IBr (c) Br2 (d) F2
Polarne wiązania kowalencyjne silnie wpływają na właściwości fizyczne i reaktywność cząsteczki. W wielu przypadkach te polarne wiązania kowalencyjne są częścią grup funkcyjnych, z którymi się wkrótce zapoznamy (rozdz. 2.5–2.13). Grupy funkcyjne to zdefiniowane grupy atomów w cząsteczce, które determinują właściwości chemiczne (reaktywność lub właściwości fizyczne) cząsteczki. Grupy funkcyjne często zawierają atomy o różnej elektroujemności i niewiążące pary elektronów. (Atomy, takie jak tlen, azot i siarka tworzą wiązania kowalencyjne i mają niewiążące pary elektronów nazywane są heteroatomami).
2.2A Mapy potencja u elektrostatycznego
Jednym ze sposobów wizualizacji rozkładu ładunku w cząsteczce jest mapa potencjału elektrostatycznego (MEP). Obszary powierzchni gęstości elektronowej, które są bardziej ujemne niż inne – mają kolor czerwony. Regiony te przyciągają dodatnio naładowane indywidua molekularne (lub odpychają te obarczone ładunkiem ujemnym). Regiony, które są mniej ujemne (lub są dodatnie) zaznaczono kolorem niebieskim. Niebieskie regiony
Liczba atomów w gla Temperatura
Liczba atomów w gla
RYS. 4.3 (a) Temperatury wrzenia nierozga zionych alkanów (zaznaczone kolorem czerwonym) i cykloalkanów (w kolorze bia ym). (b) Temperatury topnienia nierozga zionych alkanów
Temperatura wrzenia Temperatura wrzenia nierozgałęzionych alkanów wykazuje regularny wzrost wraz ze wzrostem masy cząsteczkowej (rys. 4.3a) w szeregu homologicznym alkanów o prostym łańcuchu. Rozgałęzienie łańcucha alkanów obniża jednak temperaturę wrzenia. Izomery heksanu przedstawione w tabeli 4.1 ilustrują ten trend. Częściowo wyjaśnienie tych efektów można opierać na omówionych w rozdziale 2.13B siłach dyspersyjnych. W przypadku nierozgałęzionych alkanów, wraz ze wzrostem masy cząsteczkowej, zwiększa się również cząsteczka i co ważniejsze, pole powierzchni cząsteczki. Wraz ze zwiększającym się polem powierzchni, siły dyspersyjne między cząsteczkami wzrastają, dlatego potrzeba więcej energii (wyższa temperatura) do oddzielenia cząsteczek od siebie i doprowadzenia do wrzenia. Z drugiej strony rozgałęzienie łańcucha sprawia, że cząsteczka jest bardziej zwarta, redukując jego powierzchnię, a wraz z nią siłę sił dyspersyjnych działających między nimi i sąsiednimi cząsteczkami. Powoduje to obniżenie temperatury wrzenia. Na rysunku 4.4 zilustrowano to dla dwóch izomerów C8.


RYS. 4.4 W przypadku rozga zionego izomeru C8 (b) rozga zienie a cucha powoduje zmniejszenie pola powierzchni styku pomi dzy cz steczkami, zmniejszaj c si y dyspersyjne mi dzy nimi i prowadz c do ni szych temperatur wrzenia w porównaniu do nierozgazionego izomeru C8 (a)
Temperatura topnienia Nierozgałęzione alkany nie wykazują takiego samego płynnego wzrostu temperatur topnienia wraz z rosnącą masą cząsteczkową (niebieska linia na rysunku 4.3b), jakie widoczne jest w przypadku temperatur wrzenia. Istnieje pewna różnica w miarę przejścia od nierozgałęzionego alkanu z parzystą liczbą atomów węgla do następnego z nieparzystą liczbą atomów węgla. Jeśli jednak, alkany o parzystych i nieparzystych liczbach atomów węgla są wykreślone na oddzielnych krzywych (białe i czerwone linie na rysunku 4.3b), zauważymy, że następuje płynny wzrost temperatury topnienia wraz ze wzrostem masy cząsteczkowej.
Badania dyfrakcji rentgenowskiej, które dostarczają informacji o strukturze molekularnej, pokazały przyczynę tej pozornej anomalii. Łańcuchy alkaliczne o parzystej liczbie atomów węgla są ściślej upakowane w stanie krystalicznym. W rezultacie siły przyciągające pomiędzy poszczególnymi łańcuchami są większe, a temperatury topnienia są wyższe.
Cykloalkany charakteryzują się również wyższą temperaturę wrzenia i topnienia niż ich odpowiedniki o otwartym łańcuchu (rys. 4.3).
G sto Jako grupa związków, alkany i cykloalkany mają najmniejszą gęstość ze wszystkich klas związków organicznych. Wszystkie alkany i cykloalkany mają gęstość znacznie mniejszą niż 1,00 g × mL –1 (gęstość wody w temperaturze 4°C). W rezultacie ropa naftowa (mieszanina węglowodorów bogata w alkany) unosi się na powierzchni wody. Rozpuszczalno Alkany i cykloalkany są prawie całkowicie nierozpuszczalne w wodzie, ze względu na ich bardzo niską polarność i niezdolność do tworzenia wiązań wodorowych. Ciekłe alkany i cykloalkany są rozpuszczalne między sobą i generalnie rozpuszczają się w rozpuszczalnikach o niskiej polarności. Dobrymi rozpuszczalnikami alkanów i cykloalkanów są benzen, tetrachlorek węgla, chloroform i inne węglowodory.
Feromony. Komunikacja za pomoc zwi zków chemicznych

Wiele zwierz t komunikuje si w ramach swojego gatunku za pomoc j zyka opartego nie na d wi kach czy nawet sygna ach wizualnych, ale na zapachach substancji chemicznych zwanych feromonami, które s przez nie uwalniane. W przypadku owadów wydaje si , e jest to g ówna metoda komunikacji. Mimo to, e feromony wydzielane s przez owady w bardzo ma ych ilo ciach, mog powodowa g bokie i zró nicowane skutki biologiczne. Niektóre owady u ywaj feromonów jako atraktantów seksualnych. Inne u ywaj feromonów jako substancji ostrzegawczych, a jeszcze inne wydzielaj substancje chemiczne zwane „zwi zkami agregacyjnymi”, aby nak ania przedstawicieli ich gatunku do zgromadzenia si . Cz sto feromony s stosunkowo prostymi zwi zkami, a kilka z nich to w glowodory. Na przyk ad pewien gatunek karalucha u ywa undekanu jako feromonu agregacyjnego. Kiedy samica my tygrysiej chce si kojarzy , wydziela 2-metyloheptadekan, perfumy, którym najwyra niej samiec my tygrysiej nie mo e si oprze . Atraktantem p ciowym muchy domowej (Musca domestica) jest 23-w glowy alken z podwójnym wi zaniem cis mi dzy atomami w gla 9 i 10 o nazwie muscalur; (Z)-9-trikozan.

Undekan (feromon agregacyjny karalucha)
Undecane (cockroach aggregation pheromone)
2-metyloheptadekan (atraktant p ciowy my tygrysiej)
2-Methylheptadecane (sex attractant of female tiger moth)
Muscalur (atraktant p ciowy muchy domowej)
Muscalure (sex attractant of common housefly)
Zsyntetyzowano wiele atraktantów p ciowych owadów, które s u ywane do wabienia owadów do pu apek. Jest to metoda zwalczania owadów, znacznie bardziej bezpieczna dla rodowiska ni stosowanie insektycydów.
Na podstawie bada sugeruje si , e feromony odgrywaj równie rol w yciu ludzi. Na przyk ad wykazano, e zjawisko synchronizacji menstruacyjnej kobiet, które ze sob mieszkaj lub pracuj , jest te prawdopodobnie spowodowane przez feromony. Wra liwo w chowa na pi mo, w tym sterydy, takie jak androsteron, du e cykliczne ketony i laktony (estry cykliczne), równie zmieniaj si cyklicznie u kobiet. Ponadto ró ni si te pomi dzy p ciami i mo e wp ywa na nasze zachowanie. Niektóre z tych zwi zków s u ywane w perfumach, na przyk ad cyweton, naturalny produkt wyizolowany z gruczo ów kota cywetowego, oraz pentalid, syntetyczne pi mo.
Danilo Donadoni/Photoshot
ROZDZIA
Alkohole i etery
SYNTEZA I REAKCJE
Czy wchodz c do piekarni czujecie zapach mi ty lub wanilii wydobywaj cy si z ciastek i tortów? A mo e lubicie zapach lukrecji? Te zapachy i aromaty, tak samo jak wiele innych, które codziennie do was docieraj , pochodz od naturalnie wyst puj cych cz steczek zawieraj cych alkoholowe b d eterowe grupy funkcyjne. Znanych s setki podobnych cz steczek i, oprócz tego, e s u ywane jako aromaty, niektóre z nich maj równie inne zastosowania, na przyk ad jako rodki przeciwzamarzaniowe czy farmaceutyki. Zrozumienie w a ciwo ci zycznych i reaktywno ci tych zwi zków pozwoli wam zobaczy jak mo na ich u y do tworzenia nowych substancji o innych a niekiedy nawet bardziej warto ciowych w a ciwo ciach.
(–)-Mentol (z mi ty pieprzowej)
(z lasek (owoców) wanilii)
(z kopru w oskiego)
photo credit: (mięta pieprzowa) © Alexey Ilyashenko/iStockphoto; (korzenie lukrecji) © Fabrizio Troiani/Age Fotostock America, Inc.; (nasiona i laski wanilii) © STOCKFOOD LBRF/Age Fotostock America, Inc
W TYM ROZDZIALE B DZIEMY OMAWIA :
• budow , w a ciwo ci i nazewnictwo alkoholi i eterów,
• najwa niejsze cz steczki zawieraj ce te grupy,
• reaktywno alkoholi, eterów w tym wyj tkowej grupy eterów – epoksydów.
DLACZEGO TE ZAGADNIENIA S WA NE? Na ko cu tego rozdzia u zobaczycie, jak reaktywno epoksydów mo e by wykorzystana do otrzymywania w jednym etapie z liniowych substratów z o onych cz steczek zawieraj cych wiele pier cieni, a tak e jak ich tworzenie si pozwala usun kancerogenne zwi zki z grillowanego lub sma onego mi sa, papierosów oraz orzeszków ziemnych.
11.1 BUDOWA I NAZEWNICTWO
Alkohole zawierają grupę hydroksylową ( OH) połączoną z nasyconym atomem węgla. Ten atom węgla może stanowić fragment prostej grupy alkilowej, jak w niektórych poniższych przykładach, ale może też być częścią bardziej złożonych cząsteczek, np. cholesterolu. Alkohole określa się jako 1°, 2° i 3°-rzędowe zależnie od ilości atomów węgla połączonych z atomem węgla połączonym z grupą hydroksylową.
CH3OH
* W starszych podręcznikach dla propan-2-olu można znaleźć niezalecaną obecnie nazwę 2-propanol (analogicznie w przypadku innych alkoholi i dioli; przyp. tłum.).
dietylowy
Metanol (alkohol metylowy)
Methanol (methyl alcohol) Ethanol (ethyl alcohol), a 1° alcohol
Etanol (alkohol etylowy), alkohol 1°
Propan-2-ol* (alkohol izopropylowy), alkohol 2°
2-Propanol (isopropyl alcohol), a 2 ° alcohol OH
Cholesterol
2-Methyl-2-propanol (tert-butyl alcohol), a 3 ° alcohol OH
2-Metylopropan-2-ol (alkohol tert-butylowy), alkohol 3°
Grupa hydroksylowa może być przyłączona do nasyconego atomu węgla sąsiadującego z wiązaniem podwójnym (grupą alkenylową), W tym wypadku określamy ten atom węgla jako allilowy. Jeżeli ten atom węgla jest połączony z pierścieniem fenylowym, określa się go jako benzylowy.
Benzylic, 1° position Pozycja allilowa
Pozycja benzylowa, 1°
Allylic, 1° position OH
2-Propenol (or prop-2-en-1-ol, or allyl alcohol),
Prop-2-en-1-ol (alkohol allilowy)
Alkohol benzylowy
Benzyl alcohol, a benzylic alcohol OH
Związki, w których grupa hydroksylowa jest bezpośrednio przyłączona do pierścienia benzenowego to fenole
Phenol p-Methylphenol, a substituted phenol
Fenol p-Metylofenol, podstawiony fenol
General formula for a phenol
Ogólny wzór fenoli
W eterach atom tlenu jest połączony z dwoma atomami węgla pochodzącymi z grup alkilowych, alkenylowych, winylowych, alkenylowych czy arylowych. Przykładami eterów są:
allilowo-metylowy
tert-butylowo-metylowy
diwinylowy Eter fenylowo-metylowy
Jeżeli uwzględnimy tylko orbitale atomowe p znajdujące się na atomach węgla benzenu powinniśmy otrzymać sześć orbitali molekularnych π. Te orbitale pokazano na rysunku 14.4.
Antywi ce orbitale molekularne
Six isolated p orbitals (with six electrons)
Sze izolowanych orbitali p (z sze cioma elektronami)
Orbitale atomowe
RYS. 14.4 Sze orbitali atomowych p (po jednym z ka dego atomu w gla pier cienia benzenowego) czy si , aby utworzy sze orbitali molekularnych . Trzy z tych orbitali molekularnych maj energi ni sz ni izolowany orbital p; s to wi ce orbitale molekularne. Trzy spo ród orbitali molekularnych maj energi wy sz ni izolowany orbital p; s to antywi ce orbitale molekularne. Orbitale 2 i 3 maj tak sam energi i okre la si je jako zdegenerowane; to samo mo na powiedzie o orbitalach 4 i 5
Konfigurację elektronową benzenu w stanie podstawowym otrzymamy, obsadzając orbitale molekularne π pokazane na rysunku 14.4, sześcioma elektronami π, zaczynając od orbitalu o najniższej energii. Orbital molekularny π benzenu o najniższej energii powstaje w wyniku nakładania się orbitali p o tym samym matematycznym znaku funkcji falowej na górnej i dolnej stronie pierścienia. W tym orbitalu nie ma płaszczyzny węzłowej (zmiany znaku funkcji falowej orbitalu) prostopadłej do płaszczyzny atomów w pierścieniu. Następne w kolejności orbitale o wyższej energii mają jedna płaszczyznę węzłową. (Ogólnie rzecz biorąc, każdy z kolejnych wyżej energetycznych orbitali π zawiera dodatkową płaszczyznę węzłową). Każdy z tych orbitali jest zajęty przez parę elektronową. Te orbitale mają tę samą energię (są zdegenerowane), ponieważ oba zawierają jedną płaszczyznę węzłową. Razem te trzy orbitale stanowią wiążące orbitale molekularne π cząsteczki benzenu. Następny wyżej energetyczny zestaw orbitali molekularnych π ma dwie płaszczyzny węzłowe, a najwyżej energetyczny orbital molekularny π ma trzy płaszczyzny węzłowe. Te trzy orbitale są antywiążącymi orbitalami π benzenu i w stanie podstawowym są niezajęte. O benzenie można powiedzieć, że ma zamkniętą wiążącą powłokę zdelokalizowanych elektronów π, ponieważ wszystkie jego wiążące orbitale są zajęte sparowanymi elektronami i nie ma elektronów na orbitalach antywiążących. Ta zamknięta wiążąca powłoka zwiększa dodatkowo trwałość benzenu.
Mając omówione orbitale molekularne benzenu, warto się przyjrzeć mapie potencjału elektrostatycznego na powierzchni van der Wallsa benzenu obliczonej za pomocą mechaniki kwantowej (rys. 14.5). Jak widzimy ten obraz jest spójny z naszą wiedzą, że elektrony π benzenu nie są zlokalizowane, ale równo rozprowadzone między dolną i górną stroną (nie pokazane) pierścienia węglowego benzenu.
Warto tu zwrócić uwagę na obecne odkrycia pokazujące, że w krysztale benzen uczestniczy w prostopadłych oddziaływaniach między pierścieniami benzenowymi w taki sposób, że względny ładunek dodatni obrzeża jednej cząsteczki wiąże się z względnym ładunkiem ujemnym w płaszczyźnie drugiej cząsteczki benzenu znajdującej się powyżej lub poniżej pierwszej.
Wi ce orbitale molekularne
RYS. 14.5 Mapa potencja u elektrostatycznego benzenu
Energia
WSKAZÓWKA
Diagramy wykorzystuj ce metod okr gu opisanego na wielok cie foremnym (metod wielok ta i okr gu) okre la si czasami jako diagramy Frosta lub okr gi Frosta.
14.7 REGU A HÜCKLA. REGU A 4n + 2 ELEKTRONÓW π
W 1931 niemiecki fizyk Erich Hückel wykonał serię obliczeń matematycznych, bazując na pewnej teorii, którą sam właśnie stworzył. Reguła Hückla dotyczy związków zawierających jeden płaski pierścień, w którym każdy atom ma orbital p tak, jak ma to miejsce w cząsteczce benzenu. Jego obliczenia pokazały, że płaski pierścień zawierających 4n + 2 elektronów π, gdzie n = 0, 1 , 2, 3, itd. (tj. pierścień zawierający 2, 6, 10, 14 itd. elektronów π), ma podobnie jak benzen zamkniętą powłokę zdelokalizowanych elektronów i powinien mieć znaczącą energię rezonansową.
• Innymi słowy reguła Hückla mówi, że płaski pierścień o 2, 6, 10, 14, …, zdelokalizowanych elektronach π powinien być aromatyczny.
14.7A Jak stworzy diagram wzgl dnych energii orbitali molekularnych π w uk adzie jednopier cieniowym w oparciu o regu Hückla
Istnieje prosta metoda tworzenia diagramu pokazującego względne energie orbitali w jednopierścieniowym układzie sprzężonym w oparciu o obliczenia Hückla. W tym celu musimy zastosować następującą procedurę.
1. Zaczynamy od narysowania wielokąta foremnego odpowiadającego liczbie atomów węgla w pierścieniu, umieszczając jeden z narożników wielokąta na samym dole.
2. Następnie opisujemy na wielokącie okrąg dotykający każdy narożnik wielokąta.
3. W punktach, w których wielokąt styka się z okręgiem rysujemy krótką poziomą linię na zewnątrz okręgu. Poziom każdej linii odpowiada względnej energii danego orbitalu molekularnego π
4. Następnie rysujemy przerywaną poziomą linię przechodzącą przez środek okręgu. Energie wiążących orbitali molekularnych π są ułożone poniżej tej linii. Energie antywiążących orbitali molekularnych π są powyżej, a te niewiążących orbitali są na poziomie przerywanej linii.
5. Znając liczbę elektronów w pierścieniu, umieszczamy strzałki przedstawiające elektrony na liniach odpowiadających poszczególnym orbitalom, zaczynając od najniższego poziomu energetycznego i zapewniając kolejno wyższe energetycznie orbitale. W przypadku zdegenerowanych orbitali najpierw umieszczamy na nich po jednym elektronie, a dopiero później, jeżeli mamy elektrony, uzupełniamy elektronem o przeciwnym spinie. Stosując tę metodę do cząsteczki benzenu (rys. 14.6) otrzymujemy te same poziomy energetyczne, które widzieliśmy wcześniej na rysunku 14.4, tj. poziomy energetyczne, które obliczono metodami kwantowo-mechanicznymi.
RYS. 14.6 Metoda Frosta (wielok ta i okr gu) do okre lania wzgl dnych energii orbitali molekularnych benzenu. Pozioma linia przechodz ca przez rodek okr gu oddziela orbitale wi ce od orbitali antywi cych. Je eli orbital znajduje si na tej przerywanej linii, to jest to orbital niewi cy. Ta metoda zosta a rozwini ta przez C.A. Coulsona (Oxford University)
Polygon in circle
Energy levels ofMOs
Wielok t opisany okr giem Poziomy energetyczne orbitali molekularnych
Antywi ce orbitale
Antibonding π orbitals
Wi ce orbitale
Bonding π orbitals
Rodzaj orbitali
Type of π orbital
To wyjaśnia, dlaczego cyklooktatetraen nie jest aromatyczny. Cyklooktatetraen ma w sumie 8 elektronów π. Osiem nie jest liczbą Hückla; to jest 4n, a nie 4n + 2. Na podstawie diagramu Frosta (rys. 14.7) możemy wywnioskować, że cyklooktatetraen, gdyby był płaski, to w przeciwieństwie do benzenu, nie miałby zamkniętej powłoki elektronów π; miałby po jednym niesparowanym elektronie na każdym z dwóch orbitali niewiążących. Cząsteczki o niesparowanych elektronach (rodniki) nie są na ogół trwałe; zazwyczaj są bardzo reaktywne i niestabilne. Płaska struktura cyklooktatetraenu nie powinna przypominać w najmniejszym stopniu benzenu i nie powinna być aromatyczna.
ROZDZIA



Zwi zki organiczne zawieraj ce grupy aminowe maj bardzo szeroki zakres w a ciwo ci biochemicznych. Niektóre, jak acetylocholina, dzia aj jako neuroprzeka niki, kontroluj funkcj mi ni, poprawiaj percepcje sensoryczne i utrzymuj koncentracj uwagi. Inne wykazuj znacznie bardziej niebezpieczne w a ciwo ci. Na przyk ad, kolumbijskie aby li cio azy ó te s malutkie i pi kne, ale s te zabójczo niebezpieczne. Indianie pozyskuj z nich substancj do zatruwania strza ek. aby te wytwarzaj zwi zek zwany histrionikotoksyn , amin , która powoduje parali i ostatecznie mier przez uduszenie. Mi nie oddechowe przestaj funkcjonowa , poniewa nie mo e dzia a acetylocholina, która odpowiada za wytwarzanie impulsów elektrycznych powoduj cych ruch mi ni p uc. Podobnie plemiona Amazonii od dawna stosuj mieszank zwi zków z pn cza o zdrewnia ych zwanego kurar do polowania na zwierzyn i do samoobrony; materia ten zawiera inn neurotoksyn paralityczn zwan d-tubokuraryn , która równie blokuje funkcj acetylocholiny. Jak zobaczymy, te przyk ady stanowi zaledwie wierzcho ek góry lodowej takich zastosowa amin.
photo credit: © Eric Isselée/iStockphoto
W TYM ROZDZIALE B DZIEMY OMAWIA :
• w a ciwo ci, struktur i nazewnictwo amin,
• zdolno amin do dzia ania jako zasady, sole i rodki rozdzielaj ce,
• syntez i reaktywno amin.
DLACZEGO TE ZAGADNIENIA S WA NE? Na ko cu tego rozdzia u poka emy, jak zwi zki zawieraj ce aminy doprowadzi y nie tylko do powstania rewolucyjnego pomys u na leczenie chorób za pomoc ma ych cz steczek, ale tak e do zidenty kowania pierwszych na wiecie terapii zapalenia p uc i infekcji o dkowo-jelitowych.
20.1 NAZEWNICTWO
W nomenklaturze zwyczajowej większość pierwszorzędowych amin nazywa się alkiloaminami. W nazewnictwie systematycznym (niebieskim drukiem w nawiasach poniżej) są one nazywane przez dodanie przyrostka -amina do nazwy łańcucha lub układu pierścieniowego, do którego przyłączona jest grupa NH2 z zastąpieniem końcowego -an końcówką -ylo. Aminy są również klasyfikowane jako pierwszorzędowe (1°), drugorzędowe (2°) lub trzeciorzędowe (3°) na podstawie liczby podstawników organicznych przyłączonych do aminowego atomu azotu (rozdz. 2.8).
Aminy pierwszorz dowe
CH3NH2
* Zgodnie z polską nomenklaturą nazwy podstawników przy atomie azotu powinny być w nawiasach, tj. (trietylo)amina. Nie jest to jednak stosowane w praktyce (przyp. tłum.).
Methylamine (methanamine)
Metyloamina (metanoamina)
Etyloamina (etanoamina) (2-metylopropylo)amina (izobutyloamina)
Isobutylamine (2-methyl-1-propanamine) NH2
Ethylamine (ethanamine) NH2 NH2
Cykloheksyloamina (cykloheksanoamina)
Cyclohexylamine (cyclohexanamine)
Większość drugorzędowych i trzeciorzędowych amin jest zazwyczaj nazwana w analogiczny sposób. W nomenklaturze zwyczajowej albo podajemy nazwy grup organicznych indywidualnie, jeśli są różne, albo używamy przedrostków di- lub tri-, jeśli podstawniki są takie same. W nazewnictwie systematycznym używamy lokantu N do wskazania podstawników przyłączonych do atomu azotu*.
Aminy drugorz dowe
Aminy trzeciorz dowe
Ethylmethylamine (N-methylethanamine)
Etylometyloamina (N-metyloetanoamina)
Dietyloamina (N-etyloetanoamina)
Diethylamine (N-ethylethanamine)
Triethylamine (N,N-diethylethanamine)
Trietyloamina (N,N-dietyloetanoamina)
Etylometylopropyloamina (N-etylo-N-metylo-1-propanoamina)
Ethylmethylpropylamine (N-ethyl-N-methyl-1-propanamine)
W systemie nazewnictwa IUPAC podstawnik NH2 nazywa się grupą aminową. Często używamy tego systemu do nazywania amin zawierających grupę OH lub grupę CO2H:
2-Aminoethanol3-Aminopropanoic acid H2NOH O H2N OH 2-Aminoetanol Kwas 3-aminopropionowy
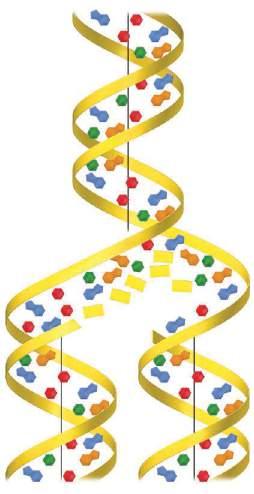
RYS. 25.11 Replikacja DNA. Podwójna ni rozwija si z jednego ko ca i wzd u ka dego pojedynczego a cucha formuje si nowy a cuch
W efekcie każdy łańcuch staje się matrycą do utworzenia swego komplementarnego partnera. Gdy zakończy się proces rozwijania i replikacji, w miejsce jednej cząsteczki DNA pojawiają się dwie identyczne cząsteczki. Te cząsteczki mogą być następnie przekazane po jednej do każdej komórki potomnej.
(a) W DNA pojedynczej komórki człowieka jest ok. 3 miliardy par zasad. Zakładając, że ma on formę podwójnej helisy, oblicz długość całego DNA zawartego w ludzkiej komórce. (b) DNA pojedynczej ludzkiej komórki ma masę 6 · 10–12 g. Przyjmując, że populacja Ziemi to 6,5 miliarda, można określić, że cała informacja genetyczna, dzięki której pojawili się wszyscy żyjący obecnie ludzie była zawarta w odpowiadającej liczbie zapłodnionych komórek jajowych. Jaka jest całkowita masa DNA zawartego w tych komórkach? (Objętość, którą zajmuje ten DNA odpowiada w przybliżeniu objętości kropli deszczu, ale gdyby rozciągnąć wszystkie te cząsteczki i ułożyć je w jedną linię, byłyby równe niemal ośmiokrotnej odległości do Księżyca i z powrotem).
WICZENIE 25.7 (a) Najtrwalszą formą tautomeryczną guaniny jest forma laktamu (inaczej cyklicznego amidu, patrz rozdz. 17.8I). Forma ta jest zwykle obecna w DNA i jak widzieliśmy, specyficznie ulega sparowaniu z cytozyną. Natomiast gdy guanina tautomeryzuje (patrz rozdz. 18.2) do formy laktimowej, może się sparować z tyminą. Narysuj wiązania wodorowe, które się utworzą w tej nietypowej parze zasad.
Lactam form of guanine
Laktamowa forma guaniny
Laktimowa forma guaniny
Lactim form of guanine
(b) Zasugerowano, że źródłem samorzutnych mutacji może być niewłaściwe parowanie zasad, wynikające z tautomeryzacji, jaka zachodzi podczas procesu replikacji DNA. W części (a) widzieliśmy, że gdy w odpowiednim momencie dojdzie do tautomeryzacji guaniny, efektem może być wprowadzenie tyminy (zamiast cytozyny) do komplementarnego łańcucha DNA. Jaki błąd wywoła ten nowy DNA w swoim komplementarnym łańcuchu, jeżeli nie dojdzie już do dalszych tautomeryzacji?
WICZENIE 25.8 Mutacje mogą też mieć przyczynę chemiczną, a jednym z najsilniejszych mutagenów chemicznych jest kwas azotowy(III) (azotawy). Jednym z wyjaśnień mechanizmu jego działania mutagennego są reakcje deaminacji, jakie on wywołuje w purynach i pirymidynach mających grupy aminowe. Na przykład, gdy podziała się kwasem azotowym(III) na nukleotyd zawierający adeninę, zostaje on przekształcony w pochodną hipoksantyny:
Adenine nucleotide
Nukleotyd adeniny
Hypoxanthine nucleotide
Nukleotyd hipoksantyny
(a) Na podstawie odpowiedzi dotyczących poprzednich reakcji, jakie przewidujesz związki pośrednie podczas przekształcenia adenina hipoksantyna? (b) W normalnych warunkach adenina paruje się w DNA z tyminą, ale hipoksantyna z cytozyną. Zaznacz wiązania wodorowe w parze zasad hipoksantyna–cytozyna. (c) Pokaż, jakie błędy po dwóch replikacjach wywoła w DNA przekształcenie adenina hipoksantyna.
25.5 RNA I SYNTEZA BIA KA
Wkrótce po opublikowaniu hipotezy Watsona–Cricka, została ona rozwinięta przez uczonych w twierdzenie nazwane przez Cricka „centralnym dogmatem genetyki molekularnej”. Dogmat ten stwierdza, że przepływ informacji genetycznej jest następujący:
DNA RNA bia ko
Oczywiste jest, że synteza białek ma podstawowe znaczenie dla funkcjonowania komórki, ponieważ to białka (będące enzymami) katalizują zachodzące w niej reakcje. Nawet bardzo prymitywne komórki bakterii potrzebują aż 3000 różnych enzymów. Oznacza to, że cząsteczki DNA tych komórek muszą zawierać odpowiednią liczbę genów zdolnych pokierować syntezą tych białek. Genem nazywamy fragment cząsteczki DNA, który zawiera informację niezbędną do pokierowania syntezą jednego rodzaju białka (lub polipeptydu).