W przypadku bakterii wewnątrzkomórkowych największe znaczenie ma odpowiedź komórkowa. Większość bakterii wewnątrzkomórkowych wnika przez błony śluzowe (dróg oddechowych, przewodu pokarmowego, narządów płciowych). Po przedostaniu się przez warstwę komórek nabłonkowych bakterie są wychwytywane przez makrofagi, wewnątrz których mogą bytować miesiącami. W odpowiedzi zaangażowane są:
z komórki dendrytyczne – fagocytują oraz prezentują antygeny bakteryjne limfocytom T, a także
z limfocyty T, komórki NK, limfocyty T CD4+ (głównie Th1 przez IL-2 i IFNα wzmacniają prezentację antygenów przez makrofagi) i cytotoksyczne limfocyty CD8+ (uwalniają perforyny tworzące pory w komórkach docelowych).
Przebieg zakażeń bakteriami wewnątrzkomórkowymi jest zwykle przewlekły (np. gruźlica, salmonelloza) i mimo rozwoju odpowiedzi swoistej bakterie często nie zostają całkowicie wyeliminowane – pozostają w uśpieniu w ziarniniakach lub ulegają zwłóknieniu i zwapnieniu.
Pamięć immunologiczna
Kontrola chorób zakaźnych lub ich eliminacja wymagają indukcji odpowiedniego poziomu odporności protekcyjnej dla danej populacji. Cel ten jest osiągany poprzez programy immunizacji zapewniające wytworzenie długotrwałej odporności swoistej. Odporność długotrwała, czyli pamięć immunologiczna, jest związana z wytworzeniem antygenowo-swoistych komórek efektorowych i/lub indukcją komórek pamięci immunologicznej, które mogą być szybko reaktywowane w komórki efektorowe w przypadku ponownego kontaktu z drobnoustrojem.
Czynnikami efektorowymi pamięci immunologicznej są:
z przeciwciała produkowane przez limfocyty B – zdolne do łączenia toksyn lub drobnoustrojów,
z cytotoksyczne limfocyty T CD8+ – mogą ograniczyć rozprzestrzenienie się drobnoustrojów poprzez rozpoznanie i zabicie zakażonych komórek lub poprzez uwalniane cytokiny,
z generacja przeciwciał i cytotoksycznych limfocytów T CD8+ jest wspomagana przez czynniki wzrostu i sygnały dostarczane przez limfocyty T CD4+ oraz kontrolowane przez limfocyty Treg (zaangażowane w proces tolerancji immunologicznej).
Większość drobnoustrojów (lub ich antygenów) pobudza odpowiedź ze strony obu populacji komórek immunokompetentnych – limfocytów T i B, więc trudno ściśle rozgraniczać rolę odpowiedzi humoralnej i komórkowej w budowaniu odporności na zakażenia i pamięci immunologicznej. Dzięki pamięci immunologicznej odpowiedź wtórna rozwija się szybciej, wytwarzanie przeciwciał jest bardziej intensywne, a ich stężenie – większe. Poniżej zestawiono mechanizmy tłumaczące długotrwałość pamięci immunologicznej:
z Limfocyty B pamięci swoiście rozpoznające antygen są obecne przez wiele lat po szczepieniu; mają receptory immunoglobulinowe (BCR, B-cell receptor; receptor limfocytu B) o większym powinowactwie do antygenu, na ich powierzchni znajduje się więcej cząsteczek MHC klasy II i cząsteczek kostymulujących CD80 i CD86, łatwiej ulegają aktywacji, mają więcej receptorów Toll-podobnych. Powstają w grudkach limfatycznych i pozostają we wtórnych narządach limfatycznych (głównie w śledzionie).
z Może zachodzić regeneracja limfocytów B pamięci przez ciągły kontakt z antygenami i limfocytami Th (np. w węzłach chłonnych antygeny mogą się utrzymywać przez wiele miesięcy dzięki związaniu ich przez komórki dendrytyczne grudek chłonnych).
z Limfocyty B pamięci zachowują zdolność do samoodnowy – powstają różnicujące się komórki efektorowe oraz kolejne komórki pamięci mogące przetrwać do następnego kontaktu z antygenem.
z Komórki plazmatyczne produkujące przeciwciała migrują do szpiku kostnego, gdzie mogą żyć bardzo długo dzięki działaniu czynników wzrostowych zrębu szpiku.
z Limfocyty T pamięci (limfocyty T pamięci centralne i limfocyty T pamięci efektorowe w węzłach chłonnych i szpiku kostnym), o zwiększonej ekspresji cząsteczek adhezyjnych do komórek prezentujących antygen, szybko proliferują, uwalniają więcej cytokin; mogą być obecne przez całe życie, nawet przy braku ekspozycji na antygen.
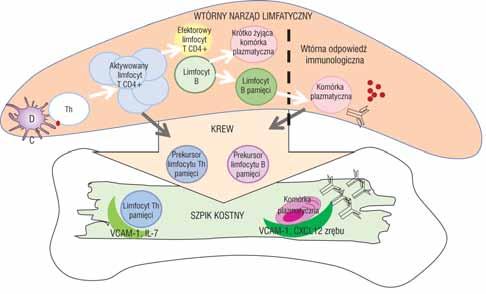
Generacja pamięci immunologicznej (za: Sarkander J., Hojyo S., Tokoyoda K.: Vaccination to gain humoral immune memory. Clin. Trans. Immunol., 2016, 5, e120 – w modyfikacji własnej).
Objaśnienia: Podczas zakażenia lub immunizacji (podanie antygenu szczepionkowego) DCs prezentują antygen „naiwnym” limfocytom Th0 w węzłach chłonnych/śledzionie – powstają aktywowane limfocyty T CD4+ oraz mała populacja prekursorowych limfocytów T pamięci migrujących do szpiku kostnego, później różnicujących się w limfocyty Th pamięci. Inna populacja aktywowanych limfocytów T CD4+ współdziała z limfocytami B i później różnicuje się w efektorowe limfocyty Tfh. Część aktywowanych limfocytów B różnicuje się do limfocytów B pamięci i krótko żyjących komórek plazmatycznych. Przy ponownym kontakcie z antygenem limfocyty B pamięci różnicują się do prekursorowych komórek plazmatycznych pamięci – migrują do szpiku kostnego (przy współudziale komórek zrębu o ekspresji VCAM-1 i CXCL12).
DCs (dendritic cells) – komórki dendrytyczne; VCAM-1 (vascular cell adhesion molecule 1) –naczyniowy czynnik adhezji komórek; IL-7 – interleukina 7; CXCL12 – chemokina
Odporność poszczepienna
Obrona przed mikroorganizmami jest podstawową funkcją układu immunologicznego. Poznanie regulacji tej odpowiedzi doprowadziło do stworzenia szczepionek przeciwzakaźnych, powszechnie uznawanych za największy sukces immunologii.
Szczepienia ochronne są oparte na mechanizmach indukowania odpowiedzi pierwotnej po szczepieniu podstawowym, a następnie wtórnej po podaniu dawki (dawek) przypominających. Podstawową właściwością szczepionek zawierających zabity lub atenuowany drobnoustrój, unieczynnioną toksynę bakteryjną (toksoid) lub fragment drobno-
