Manual de necropsia y toma de muestras



El diagnóstico clínico en bovinos es una práctica compleja que incluye varios puntos que deben complementarse para tratar de que el mismo sea acertado o nos permita descartar ciertas patologías. Estos puntos importantes son: correcta anamnesis, buena técnica de necropsia, identificación de posibles lesiones o cambios autolíticos, toma de muestra y elección de las técnicas de laboratorio. Todos estos pasos deben realizarse de forma metódica y organizada para intentar arribar a un diagnóstico certero y como consecuencia tomar medidas para prevenirlo o tratarlo.
Al llegar al establecimiento es de suma importancia recabar información no solo del o nico, sino también del sistema productivo y el establecimiento para buscar información que nos pueda orientar en posibles diagnósticos. Esto es imprescindible, ya que, un gran porcentaje de las mortandades tienen involucradas medidas de manejo. A continuación de enumeran datos a tomar:
1. Características productivas: Ubicación geográfica, superficie ganadera, tipo de explotación, que superficie se destina a cada actividad, tipo de suelo (bajo, media loma, loma, anegado, etc.).
2. Población animal: Cantidad de animales, categorías, raza, sexo y estado fisiológico.
3. Alimentación: Especies forrajeras, estado y disponibilidad de estas; carga animal, administración de aditivos o suplementos alimenticios, características del agua para consumo animal, presencia de plantas toxicas en el establecimiento.
4. Manejo: Movimientos en los últimos días, encierres, cambio de dietas, de potreros, trabajos en la manga.
5. Sanidad: Plan sanitario, administración de tratamientos o vacunas en los últimos días, historial de enfermedades previas.
6. Información reproductiva: Tipo de servicio, época del año, índices reproductivos, destetes, etc.
7. Tasas epidemiológicas: Cantidad de animales afectados, categoría, cantidad de muertos.
8. Historia clínica: Temperatura, signos, duración de los signos, curso de la enfermedad.

Comenzamos con la exploración física del animal y en este momento podemos realizar la toma de parámetros como son temperatura corporal, frecuencia respiratoria y cardiaca en casos en los que el animal se encuentre en un corral o manga. De no ser posible solo observaremos signos clínicos.
Constantes fisiológicas normales:
• T corporal: 37,7-39°C
• Frecuencia respiratoria: 10-30rpm
• Frecuencia cardiaca: 40-80 lpm
Otro parámetro por observar son los movimientos ruminales en la fosa del ijar.
En cuanto a los signos, nos permitirán saber que sistema se encuentra afectado:
• Sistema respiratorio/cardiovascular: Dificultad en la respiración, babeo, jadeo, posición ortopneica, secreción nasal.
• Sistema nervioso: Nistagmo, giro en círculos, agresividad, depresión, pedaleo, convulsiones, movimientos involuntarios, etc.
• Sistema digestivo: Observación de la materia fecal y sus características (diarrea, moco, sangre, constipación), inflamación del flanco.
• Piel y anexos: coloración de mucosas, lesiones en piel.

Eutanasia: Se describe como la mejor muestra para diagnostico la que proviene de un animal con signos clínicos eutanasiado, esto se debe a que el paso de las horas deteriora los tejidos y, por lo tanto, dificulta la correcta ejecución de las técnicas o la obtención de un resultado certero. Bajo esta premisa se debe intentar que el sacrificio del animal sea lo más humanitario posible evitando al máximo el sufrimiento de este y no interfiriendo con el diagnóstico.

Necropsia: Si bien no existe una técnica determinada de necropsia (cada veterinario puede usar la que le sea mas cómodo) es importante que se realice siempre de la misma forma y en el mismo orden. Idealmente debe realizarse ni bien se produjo la muerte del animal, debido a que esto ocurre pocas veces es importante que las horas de muerte sean acotadas para evitar la autolisis. Dadas estas condiciones el veterinario deberá ser capaz de diferenciar lesiones ante mortem de cambios post mortem. Cambios post mortem: son los cambios que se producen en los tejidos luego de la muerte y dependen en gran medida de la temperatura del animal al momento del deceso y la temperatura ambiental. La autolisis también aumenta en los tejidos que están expuestos a bacterias (sistema digestivo), enzimas pancreáticas y bilis.
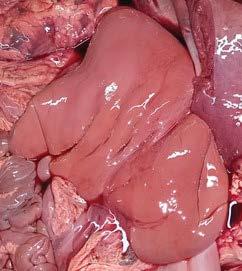
 Hígado con severa autolisis
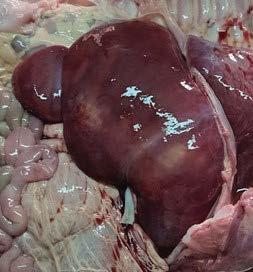
Hígado con mancha rosácea (cambio post mortem característico de hígado)
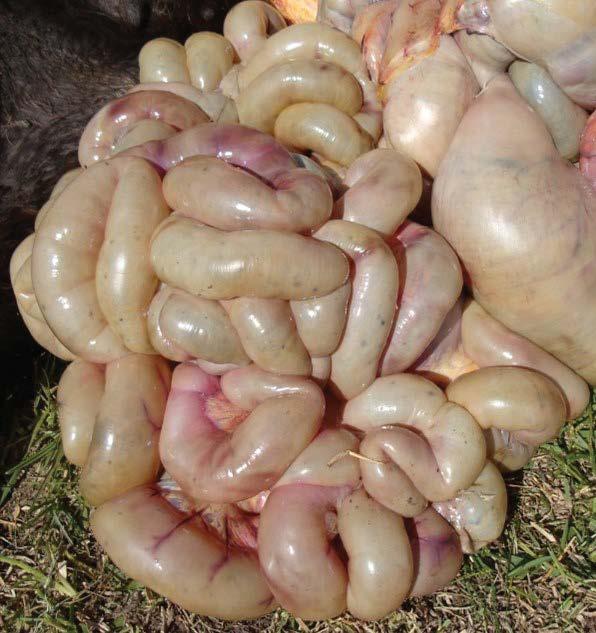
Colecta de gas en intestinos
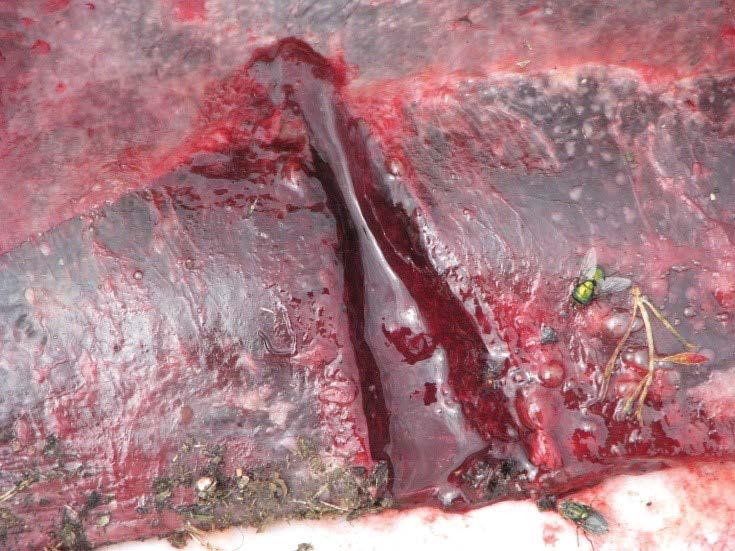
Desprendimiento de la mucosa de rumen
Hígado con severa autolisis
Hígado con mancha rosácea (cambio post mortem característico de hígado)
Colecta de gas en intestinos
Desprendimiento de la mucosa de rumen
1. Minimizar el proceso de autolisis llevando el cadáver a la sombra o zona fresca de ser posible.
2. Utilizar la vestimenta adecuada respetando las medidas de seguridad: mameluco, guantes, botas de goma, antiparras y barbijo en caso de ser requerido.
3. Disponer del instrumental correcto: cuchillos, chaira, sierra, hacha, pinzas diente de ratón o similares, tijeras, portaobjetos, jeringas, agujas, mechero, recipiente con alcohol, costotomo, bisturí, frascos estériles, frascos de boca ancha, hisopos, formol al 10%, hilo para ligar, bolsas de plástico, etc.
4. Elementos para higienizarse.
5. Examinar los órganos y tejidos ordenadamente.
6. Si observamos una lesión es de gran utilidad fotogra arla en caso de que debamos hacer una interconsulta.
7. Colocar las muestras en recipientes para cada n, rotuladas y refrigerarlas en caso de que sea necesario.
Bazo con autolisis


Este es otro punto de suma importancia dentro del diagnóstico. Hay varios puntos críticos a tener en cuenta: la elección de la muestra, los recipientes donde se colocan y como se remiten al laboratorio. A continuación, mencionamos las principales muestras que se remiten al Laboratorio Azul y su correcta toma y remisión.
Se basa principalmente en el cultivo en diferentes medios, aislamiento y tipi cación de diferentes cepas.
Se debería contar con un mechero, pizas y tijera estériles y frasco con alcohol. Antes de tomar la muestra amear la zona con el mechero, colocar el instrumental en el frasco con alcohol y amear antes de utilizar.
• Recipientes individuales y estériles.
• Refrigeradas (nunca congelar).
• La mejor muestra es de un animal eutanasiado y no tratado con antibiótico.
• Tamaño 5x5 (para sacar la muestra del interior).
•En el límite entre la sección afectada y la sana.
• Secreciones, exudados o abscesos, limpiar la piel con alcohol 70 y muestrear con un hisopo estéril.
• Carbunclo: Si se realizó la necropsia se puede tomar bazo, de lo contrario tomar un hueso largo (metatarso o metacarpo). Enviar en bolsas plásticas.
• Salmonella: Muestras de bilis, materia fecal y linfonódulo mesentérico.
• Leptospira: Si bien el cultivo es difícil de realizar se pueden tomar muestras de orina y riñón. Impronta de riñón para IFD.
• Enfermedades clostridiales: Al ser gérmenes anaeróbicos, tomar la muestra y sumergir en glicerina, otra opción es tomar un trozo grande para que entre a presión y evitar al máximo el oxígeno en el recipiente, también se puede usar contenedores comerciales.
Se basa en el cultivo y aislamiento, PCR y búsqueda de anticuerpos.
• La mejor muestra es al comienzo de la enfermedad.
• Enviar antes de las 24hs de tomadas.
• En el caso de PCR pueden congelarse.
• Diarrea viral bovina: tejidos (bazo, linfonódulo y piel) y sangre entera o suero.
• IBR: tejido afectado o linfonódulo que drenen la zona. Signos nerviosos: corteza y nervio trigémino.
• Rabia: la cabeza completa del animal.
• La extracción de sangre debe ser por punción yugular.
• Colocar la sangre en el tubo por sus paredes evitando que caiga de golpe para minimizar la hemolisis.
• Muestras de humor vítreo para medición de magnesio deber ser de un animal en buen estado de conservación.
• Vit A y E: Cubrir los tubos con papel aluminio.
• Líquido cefalorraquídeo: Se debe desarticular la articulación atlanto-occipital y exponer las meninges, tomar la muestra evitando que ingrese sangre para medir minerales.
 Zona de toma de muestra
Zona de toma de muestra
• Se sugiere incluir dentro de la información anamnésica, datos meteorológicos previos al caso.
• En el caso de enviar forraje para determinación de Ac. Cianhídrico y/o nitratos las muestras deben ir refrigeradas y llegar al laboratorio lo antes posibles para evitar la descomposición del compuesto. Para determinar cianhídrico se pueden congelar en el momento de tomarlas si es que no se pueden enviar antes de las 24 hs de cortadas. Tomar la muestra de cultivo al ras
del suelo, siempre incluyendo la planta entera.
• Para la determinación de nitratos además de forraje se puede enviar humor vítreo y líquido cefalorraquídeo.

• Conteo de esporas de Phitomyces chartarum: Muestra de forraje incluyendo material muerto.
• Identi cación y conteo de cornezuelo (Claviceps purpurea).
Muestras de materia fecal:
• Deben ser tomadas en forma individual.
• 10-15 por lote.
• Sin aire en la bolsa para evitar la eclosión de los huevos.
• Refrigeradas y como máximo deben procesarse 5 días posteriores a ser tomadas.
• Aproximadamente 60 gramos (una pelota de tenis).
Determinación de ectoparásitos
• Tomar la muestra del límite de la lesión con la zona sana.
• Raspar con hoja de bisturí.
• Colocar en recipientes de plástico o bolsas individuales.
• Remitir datos de últimos tratamientos.
Muestras de tejidos:
• Trozos de 1cm de espesor.
• Formol al 10%.
• Relación tejido-formol 1-10.
• Frascos plásticos de boca ancha.
• Especi car en el rótulo que órgano se remite.

• Si se envía SNC deberá colocarse en un frasco a parte del resto de los órganos.
Cabeza: separarla desarticulando la articulación atlanto-occipital. En ese momento se puede tomar la muestra de LCR. Usando sierra o hacha incidir el cráneo realizando 3 cortes diferentes:
1. Un corte que una las dos orbitas oculares
2. Dos cortes que unan cada una de las orbitas oculares (derecha e izquierda) con la zona medial de cada uno de los cóndilos del occipital (derecho e izquierdo), respectivamente.
3. Estos cortes nos permiten quitar la tapa del cráneo para retirar el encéfalo.

Descripción anatomo-patológica:
Para tratar de reconocer, caracterizar e interpretar las lesiones presentes debería comenzar con describir el aspecto general del animal, luego la descripción de cada órgano y tejido para poder relacionarlo con el cuadro clínico.
En cuanto a la descripción de los órganos se debe mencionar:
• El tamaño
• Distribución de las lesiones: focal, multifocal, extendido, coalescentes, etc.
• Como se encuentran los márgenes: bien delimitados, difusos o poco delimitados
• Super cie del órgano: deprimida, sobreelevada.
• Forma de la lesión: circular, irregular, etc.
• Color
• Textura o consistencia
• Sonido
• Olor
Vet. Sofia Fanti
Esp. en sanidad animal
Laboratorio Azul Diagnostico SA
Mail: sofia.fanti@laboratorioazul.com.ar
Cel: 2281-364398
Bibliografía:
Técnica de necropsia de rumiantes- Germán Cantón y Ernesto Odriozola - INTA ediciones.
Jubb, Kennedy and Palmer´s Patologhy of Domestic Animals - 6th Edition.