Alubias tradicionales mediterráneas
Un tesoro de alto valor nutricional
Elisa Gorbe¹, Miguel Morard², Armand Rausell-Moreno¹, Ángeles Calatayud¹, Consuelo
Penella¹*
¹Departamento de Horticultura, Centro de Citricultura y Producción Vegetal, Instituto Valenciano de Investigaciones Agrarias (IVIA), Moncada, Valencia, España
²Departamento de Biotecnología de los Alimentos, Instituto de Agroquímica y Tecnología de los Alimentos (IATA)-CSIC, Valencia, España
*penella_con@gva.es Índice
1. Introducción
La judía (Phaseolus vulgaris L.) es un cultivo de gran importancia a nivel global, tanto por su valor económico como nutricional. Según datos de la FAO (2021), es la legumbre con más producción el mundo, alcanzando los 23 millones detoneladas. Desde el punto devista nutricional, las judías destacan por su riqueza en proteínas, almidón, ácidos grasos insaturados, fibra dietética, vitaminas esenciales, minerales, y compuestos antioxidantes como los flavonoides (Hayat et al., 2014). Este perfil nutricional las convierte en un aliado para la salud, ya que su consumo se ha asociado con la prevención y mejora de enfermedades como las cardiopatías, la diabetes mellitus, la obesidad y el cáncer (Jenkins et al., 2007). Su versatilidad y beneficios la consolidan como un alimento fundamental en la dieta humana.
El cultivo de la judía tiene sus raíces en América, donde se originó hace miles de años (Arteaga et al., 2019). Desde entonces, ha sido un alimento básico en diversas culturas. Este versátil cultivo se consume tanto en forma de semillas secas, conocidas como judías o alubias, como en vainas verdes, denominadas judías verdes. Una de sus características más apreciadas es su capacidad para adaptarse a suelos con bajos niveles de nitrógeno, gracias a su relación simbiótica con bacterias del género Rhizobium, que le permiten fijar este nutriente esencial (Karavidas et al., 2022). Esta cualidad lo convierte en una opción ideal para el cultivo en zonas marginales, donde otros cultivos podrían no prosperar.
Entre las variedades de judía disponibles, las variedades tradicionales destacan por sus beneficios agronómicos, culinarios y su contribución a la conservación de la biodiversidad (Rivera et al., 2016). Algunas de estas variedades presentan una calidad nutricional superior, mientras que otras muestran una mayor resistencia a estreses abióticos (Villalba et al., 2024). Contar con una mayor diversidad genética asegura una mayor adaptación de los cultivos al preocupante cambio climático (Vasconcelos et al., 2013). Estas características hacen de las variedades tradicionales un valioso recurso para la agricultura sostenible y la seguridad alimentaria
La región mediterránea alberga una extraordinaria diversidad vegetal, destacándose como un reservorio de recursos genéticos (Bennett y Maxted, 2001). De hecho, esta zona incluye dos de los reconocidos"centros dediversidad genética" identificados por Vavilov (Vavilov, 1997), lo que subraya su importancia a nivel global. Sin embargo, a pesar de su relevancia, la diversidad nutricional de las variedades de judías mediterráneas no ha sido estudiada en profundidad Por ello, este trabajo busca ahondar en el conocimiento de la diversidad fenotípica, nutricional y nutracéutica de las variedades tradicionales de la región, con el objetivo de contribuir a una agricultura más sostenible y resiliente frente a los retos ambientales en constante evolución
2. Materiales y métodos
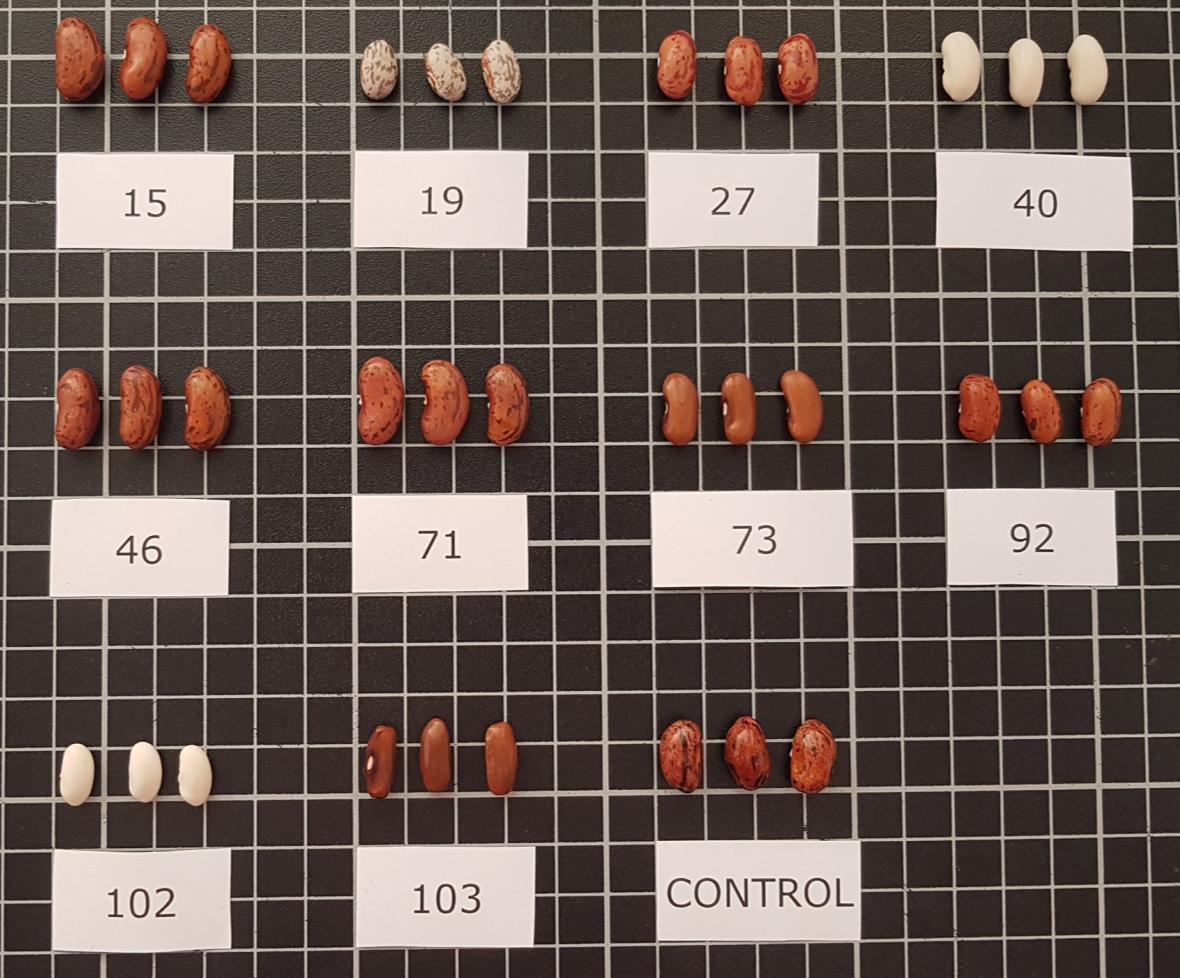
En este trabajo, se utilizaron accesiones de judía que habían sido seleccionadas, en un estudio previo, por sus rasgos agronómicos y fenotípicos (Tabla 1; Figura 1)
Alubias tradicionales mediterráneas
Tabla 1. Identidad (ID) y códigos de las accesiones, nombres locales, orígenes de los diferentes genotipos y centro de localización de las semillas utilizados en este estudio
ID Código de la accesión
15 CAT-PH-2
19 BGV008520
27 BGV001582
40 BGV014914
46 BGV005757
71 LG29
73 LG5
92 BGV016394
102 BGV014085
103 BGV014088
Control Control comercial
Nombre local Origen
Centro
Judía Roget Catarroja COMAV-UPV
Judía Vigácea Millares COMAV-UPV
Judía pinta Mallorca COMAV-UPV
Judía tavella Valencia COMAV-UPV
Judía Roget Silla COMAV-UPV
Judía Roget Valencia IVIA
Judía de la Mantega Valencia IVIA
Judía de corfa i molla Millares COMAV-UPV
Judía blanca Portell de Morella COMAV-UPV
Judía marrón Portell de Morella COMAV-UPV
Big Borlotto
Semillas Batle
Plantas de estas variedades se cultivaron en un invernadero del IVIA en Moncada, Valencia. Las semillas se sembraron el 31 de marzo de 2021 en macetas de 25 x 23 cm, en un diseño de bloques aleatorizados con cuatro bloques por genotipo. Cada bloque contenía 4-6 macetas con dos semillas cada una, y se usaron redes verticales para soportar el crecimiento. Las judías se
Figura 1 Semillas utilizadas en el ensayo. Ver en Tabla 1 los códigos de identificación (ID)
cosecharon en julio, se secaron y, en septiembre (temperaturas registradas en Tabla 2), se pelaron y almacenaron para su análisis.
Tabla 2 Temperaturas mínimas y máximas medias durante el ensayo (°C)
Se hizo un análisis comparativo de las características físicas de las semillas (longitud, altura y anchura, volumen, capacidad de absorción de agua y color), así como de sus propiedades nutricionales (minerales y ácidos grasos) y nutracéuticas (capacidad y compuestos antioxidantes).
En cuanto a las características físicas de las semillas, se usó un calibrador electrónico (RS PRO) con 10 semillas por variedad (n=10) y el volumen de cada semilla se estimó con la fórmula del elipsoide.
La capacidad de absorción de agua se calculó como el porcentaje de aumento respecto al peso seco inicial para ello se pesaron (peso inicial) cuatro grupos de 100 semillas (n=4) por genotipo, se sumergieron en agua destilada durante 48 horas, se escurrieron, se secaron con papel de filtro y se pesaron nuevamente (peso final).. El color se determinó utilizando, un colorímetro (CR-400, Konica Minolta Inc., Tokio, Japón), que mide la luz reflejada y la traduce a valores CIE: L* (luminosidad, 0-100), a* (rojo a verde), b* (amarillo a azul), C* (saturación) y h (tono, en grados). Se calibró con una placa blanca y se hicieron 10 mediciones por accesión (n=10) para asegurar precisión.
Para analizar las propiedades nutricionales de las semillas, se utilizaron cuatro réplicas por genotipo (n=4), con 50 g de semillas molidas por réplica. Las concentraciones de minerales se midieron mediante espectrometría de emisión óptica de plasma acoplado inductivamente (ICPOES; iCAP 6500 Duo, Thermo Scientific, Cambridge, Reino Unido) en la plataforma de Ionomics del CEBAS-CSIC (Murcia, España), y se expresaron como mg g 1 o µg g 1 según se tratara de macro- o micronutrientes. La composición de ácidos grasos se determinó por medio de cromatografía de gases con transmetilación en el Laboratorio Agroalimentario de Burjassot, y los resultados se expresaron en porcentaje de ácidos grasos sobre el total de grasa.
En cuanto a las propiedades nutracéuticas de las judías, esto es, las de aquellos componentes que aportan beneficios para la salud (Das et al., 2012), se determinó el contenido de flavonoides totales siguiendo el método de Du et al. (2009), la concentración de ácido ascórbico según Kampfenkel et al. (1995), la de carotenoides siguiendo el método de Lichtenthaler (1987), el contenido de fenoles totales mediante el método de Folin-Ciocalteu, basado en Singleton et al. (1999), y la capacidad antioxidante se midió mediante la inhibición del radical DPPH, siguiendo a Brand-Williams et al. (1995). Todos los análisis se realizaron con n=4 por genotipo.
Los resultados obtenidos se realizaron mediante ANOVA y regresiones simples, utilizando Statgraphics Centurion XVIII
3. Resultados y discusión
3.1. Evaluación de la calidad externa
Las accesiones utilizadas en este estudio mostraron variaciones en el tamaño, peso y capacidad de absorción de agua de las semillas, como se detalla en la Tabla 3. Las accesiones 15 y 46 destacaron por ser las más grandes y pesadas, respectivamente, mientras que la accesión 102 fue notablemente más pequeña y ligera. La capacidad de absorción de agua tras la inmersión varió entre un 145,20 % (variedad local 92) y un 94,85 % (variedad local 102) Este parámetro es relevante para la industria alimentaria, ya que puede afectar la textura y la aceptabilidad sensorial de las judías cocidas. Las alubias que absorben más agua durante el remojo tienden a cocinarse más rápido, presentar una textura más suave y cremosa, y ser más digestibles (Santos Pedone et al., 2024).
Tabla 3 Características físicas de los granos de judía por accesión (ID): longitud (mm), ancho (mm), grosor (mm), volumen de semilla calculado (mm³), capacidad de absorción de agua (%) y peso medio de la semilla (g). Los valores representan medias ± error estándar (SE) (n=10 semillas para las mediciones de tamaño y n=4 muestras de 100 granos de judía para las mediciones de peso). Letras diferentes dentro de cada columna indican diferencias significativas entre los accesos (p<0.05). C representa el control (variedad comercial).
ID
3.2. Evaluación de la calidad interna
La judía es una fuente de minerales (Chávez-Mendoza y Sánchez, 2017), que varía según la variedad considerada. Así pues, este estudio detectó diferencias significativas en la concentración de minerales esenciales entre las variedades analizadas. Las variedades 103, 15, 40 y 102 presentaron los niveles más altos de fósforo (P), hierro (Fe), manganeso (Mn) y cobalto (Co) que la variedad comercial de referencia. Esto es debido a que, tradicionalmente, el principal objetivo de la selección de judías ha sido aumentar el rendimiento (Smýkal et al., 2018) en vez
de la calidad. Como resultado, muchas variedades modernas son menos nutritivas y contienen menos compuestos beneficiosos para la salud en comparación con sus variedades ancestrales (Assefa et al., 2019). En este contexto, las colecciones tradicionales de germoplasma vegetal tienen un gran valor debido a su potencial para mejorar la calidad nutricional de las variedades modernas (Márquez et al., 2024).
En cuanto a los distintos elementos esenciales, la literatura hace particular énfasis en el zinc (Zn), calcio (Ca) y hierro (Fe). En este estudio, el rango de medida de estos minerales, entre todas las variedades estudiadas, fue el siguiente (Figura 2): (1) el Fe, tuvo un rango de entre 50.12 mg kg-1 (variedad 102) a 117.36 mg kg-1 (variedad 103); (2) el zinc (Zn) varió entre 35 59 mg kg-1 (variedad comercial) a 60.52 mg kg-1 (variedad 40); y el calcio (Ca) tuvo valores de entre 0.55 g kg-1 (variedad 27) hasta 2.34 g kg-1 (variedad 102), el doble del promedio del resto de las variedades estudiadas. Los valores obtenidos en este estudio están de acuerdo con los obtenidos por otros trabajos realizados con variedades de otras regiones (Becerra et al., 2010; Beebe et al., 2001; Blair et al., 2010; Celmeli et al. 2018; Islam et al., 2002; Murube et al., 2021; Pinheiro et al., 2010; Sica et al., 2021; Smith et al., 2019). Estos resultados sugieren que algunas variedades locales son una importante fuente de micronutrientes esenciales en comparación con las variedades comerciales.

Figura 2. Comparación de la concentración de minerales esenciales en diferentes variedades de judía. Las barras representan el contenido de hierro (mg kg-1) (azul, eje izquierdo), zinc (mg kg-1) (verde, eje izquierdo) y calcio (g kg-1) (naranja, eje derecho)
El contenido de grasa de los granos de judía varió entre 1.33 % y 2.2 %, la variedad comercial registro el mayor nivel lipídico. En contraste, la variedad 40 presentó la menor proporción de grasa, con un 40 % menos que el control. En cuanto a la composición de ácidos grasos, se encontró que el ácido linolénico (omega-3) era el más abundante en todas las muestras, tal y como describen Celmeli et al. (2018) y Sekiya et al (1982), con un rango de 39.1 % (variedad 102) a 47.3 % (variedad 46) del total de grasas. Celmeli et al. (2018) también midió un mayor contenido de ácidos grasos en variedades locales turcas comparadas con variedades comerciales.
Los componentes de las semillas con propiedades nutracéuticas desempeñan un papel fundamental en la prevención de enfermedades gracias a su capacidad para contrarrestar el
estrés oxidativo, reducir la inflamación, regular la homeostasis de la microbiota intestinal y modular el metabolismo de los lípidos. Esto contribuye a la protección contra enfermedades crónicas como el cáncer, las enfermedades autoinmunes, las afecciones cardiovasculares y los trastornos neurodegenerativos (AlAli et al., 2021; Caponio et al., 2022; Makkar et al., 2020; Naliyadhara et al., 2023; Samtiya et al., 2021), ya que la mayoría de estas patologías están mediadas por la inflamación crónica (Costa et al., 2012). Por ejemplo, los flavonoides y los ácidos fenólicos poseen propiedades antiinflamatorias al modular las vías de señalización celular asociadas a la inflamación (Chen et al., 2017; Costa et al., 2012). Los carotenoides se han relacionado con una mejor salud del colon y una menor incidencia de obesidad, diabetes y ciertos tipos de cáncer (Crupi et al., 2023; Eroglu et al., 2023; Rowles y Erdman, 2020). El ácido ascórbico es un potente antioxidante que protege los tejidos, las membranas celulares y el ADN del daño oxidativo, además de fortalecer el sistema inmunológico (Carr y Maggini, 2017; Jacob y Sotoudeh, 2002; Mittu et al., 2022). Por último, un alto consumo de vitamina C se ha asociado con un menor riesgo de enfermedades cardíacas, cáncer, afecciones oculares y trastornos neurodegenerativos (Jacob y Sotoudeh, 2002).
En este estudio, la capacidad antioxidante mostró valores de entre 28 % y 90 %. Las variedades con los niveles más altos de actividad antioxidante fueron la 15 y 71, ambas con semillas de color rojizo. Por el contrario, la variedad 40, de semilla blanca, presentó la menor capacidad antioxidante. El contenido de flavonoides varió entre 0.5 y 1.4 mg de equivalente de rutina por g de peso seco (PS). La variedad 92 presentó la mayor concentración de flavonoides, mientras que las variedades 40 y 102, ambas con semillas blancas, mostraron los valores más bajos. La concentración de compuestos fenólicos varió entre 0.54 y 1.75 mg GA g⁻¹ (PS). La variedad local 92 presentó el mayor contenido de compuestos fenólicos, mientras que las variedades locales 19, 40 y 102 (todas con testa predominantemente blanca) exhibieron los niveles más bajos. El contenido de carotenoides se encontró en un rango de 0.09 a 0.70 µg por g (PS). La variedad comercial y la variedad 71 exhibieron los valores más altos, mientras que las variedades 40, 73, 102 y 103 presentaron los niveles más bajos. El contenido de ácido ascórbico osciló entre 0.01 y 0.22 mg por g (PS). Las variedades 27 y 103 mostraron las mayores concentraciones, lo que las posiciona como fuentes potenciales de vitamina C en dietas basadas en legumbres, como las vegetarianas.

Figura 3. Comparación de la capacidad antioxidante y la concentración de compuestos bioactivos en diferentes variedades de judía. Las barras representan la capacidad antioxidante (%) (rojo, eje izquierdo), los fenoles totales (mg g-1) (azul, eje derecho) y los flavonoides (mg g-1) (verde, eje derecho).
3.3. Relación entre los distintos parámetros
Por una parte, se mostraron correlaciones positivas entre el contenido de ácidos grasos y algunos minerales, como magnesio (Mg) con ácido linolénico (r = 0.66) y ácido palmítico (r = 0.63), lo que sugiere una posible relación entre el metabolismo de los ácidos grasos y el contenido de minerales en estas variedades.
Por otra parte, se identificaron correlaciones positivas entre la capacidad antioxidante y la concentración de fenoles totales (r = 0.83), flavonoides (r = 0.73) y carotenoides (r = 0.55), reforzando el papel de estos compuestos en la protección celular contra el estrés oxidativo (Huber et al., 2016).
El análisis de las correlaciones entre los distintos parámetros demostró que el color de las semillas está íntimamente relacionado con su calidad interna. La correlación más alta se observó entre la coordenada a (rojo-verde) y la capacidad antioxidante (r = 0,97), el contenido de fenoles (r = 0,9) y, en menor medida, los flavonoides (r = 0,74), los carotenoides (r = 0,59) y el ácido ascórbico (r = 0,39). Es decir, cuanto más rojizo es el color de la testa de las semillas de las alubias, mayor es la concentración de compuestos antioxidantes, y mayor capacidad antioxidante. Estos resultados refuerzan hallazgos previos reportados en legumbres a nivel mundial (Blair et al., 2010; Madrera et al., 2021; Murube et al., 2021).
En contraste, las variedades con semillas blancas o de tonos más claros tuvieron menores concentraciones de estos compuestos bioactivos, y se encontró una fuerte correlación negativa entre el parámetro L (luminosidad) y la capacidad antioxidante de las semillas (r = -0.97). En contraste, las judías de colores claros presentaron una mayor concentración de varios de los minerales esenciales.
Por tanto, este estudio ha constatado la utilidad del color de la testa como marcador visual de calidad nutracéutica y nutricional en alubias, lo cual respalda los resultados obtenidos en otros estudios anteriores (Blair et al., 2010; Iniestra-González et al., 2005; Madrera et al., 2021; Murube et al., 2021; Rocha-Guzmán et al., 2013).
4. Conclusión
Los resultados de este estudio subrayan la importancia de conservar y promover el cultivo de variedades tradicionales de alubias mediterráneas. No solo ofrecen una mayor diversidad nutricional en comparación con las variedades comerciales, sino que también tienen el potencial de mejorar la seguridad alimentaria y la sostenibilidad agrícola en un contexto de cambio climático.
El conocimiento de la composición nutricional y nutracéutica de estas variedades locales podría ser clave para el desarrollo de nuevas estrategias de mejoramiento genético, orientadas a producir judías más nutritivas y resistentes. Además, su inclusión en la dieta cotidiana podría aportar beneficios significativos para la salud, reforzando el papel de las legumbres como alimentos funcionales dentro de la dieta mediterránea.
Conservar y valorar la biodiversidad agrícola no solo es una cuestión de tradición, sino también una estrategia inteligente para el futuro de la alimentación y la salud.
Alubias tradicionales mediterráneas
Agradecimientos
Nos gustaría expresar nuestro más sincero agradecimiento al Laboratorio Agroalimentario de Burjassot (GVA), y en especial a María Luisa Ruiz Domínguez y su equipo, por su invaluable asistencia y apoyo durante la investigación sobre ácidos grasos. Este trabajo fue respaldado por el proyecto IVIA-GVA 52201D del Instituto Valenciano de Investigaciones Agrarias (proyecto susceptible de ser cofinanciado por la Unión Europea a través del Programa FEDER 2021–2027 de la Comunitat Valenciana). Finalmente, MM recibió financiación gracias a la concesión del gobierno español MCIN/AEI al IATA-CSIC como Centro de Excelencia Acreditación Severo Ochoa (CEX2021–001189-S/ MCIN/AEI / 10.13039/501100011033).
Bibliografía
AlAli, M., Alqubaisy, M., Aljaafari, M. N., AlAli, A. O., Baqais, L., Molouki, A., Abushelaibi, A., Lai, K.-S., & Lim, S.-H. E. (2021). Nutraceuticals: Transformation of conventional foods into health promoters/diseasepreventers and safety considerations. Molecules, 26(9), 2540. https://doi.org/10.3390/molecules26092540
Arteaga, S., Yabor, L., Torres, J., Solbes, E., Muñoz, E., Díez, M. J., Vicente, O., & Boscaiu, M. (2019). Morphological and agronomic characterization of Spanish landraces of Phaseolus vulgaris L. Agriculture, 9, Article 149. https://doi.org/10.3390/agriculture9070149
Assefa, T., Assibi Mahama, A., Brown, A. V., Cannon, E. K. S., Rubyogo, J. C., Rao, I. M., Blair, M. W., & Cannon, S. B. (2019). A review of breeding objectives, genomic resources, and marker-assisted methods in common bean (Phaseolus vulgaris L.). Molecular Breeding, 39(20). https://doi.org/10.1007/s11032-018-0920-0
Becerra, V., Paredes, M., Rojo, C., Díaz, L. M., & Blair, M. W. (2010). Microsatellite marker characterization of Chilean common bean (Phaseolus vulgaris L.) germplasm. Crop Science, 50(5), 1932–1941. https://doi.org/10.2135/cropsci2009.08.0442
Beebe, S., Rengifo, J., Gaitan, E., Duque, M. C., & Tohme, J. (2001). Plant genetic resources: Diversity and origin of Andean landraces of common bean. Crop Science, 41(3), 854–862. https://doi.org/10.2135/CROPSCI2001.413854X
Bennett, S. J., & Maxted, N. (2001). Ecogeographic environment of the Mediterranean. In N. Maxted & S. J. Bennett (Eds.), Plant genetic resources of legumes in the Mediterranean (pp. 33–50). Springer Dordrecht. https://doi.org/10.1007/978-94-015-9823-1
Blair, M. W., González, L. F., Kimani, P. M., & Butare, L. (2010). Genetic diversity, inter-gene pool introgression and nutritional quality of common beans (Phaseolus vulgaris L.) from Central Africa. Theoretical and Applied Genetics, 121(2), 237–248. https://doi.org/10.1007/s00122-010-1305-x
Brand-Williams, W., Cuvelier, M. E., & Berset, C. L. W. T. (1995). Use of a free radical method to evaluate antioxidant activity. LWT - Food Science and Technology, 28(1), 25–30. https://doi.org/10.1016/s0023-6438(95)80008-5
Caponio, G. R., Lippolis, T., Tutino, V., Gigante, I., De Nunzio, V., Milella, R. A., Gasparro, M., & Notarnicola, M. (2022). Nutraceuticals: Focus on anti-inflammatory, anti-cancer, antioxidant properties in gastrointestinal tract. Antioxidants, 11(7), 1274. https://doi.org/10.3390/antiox11071274
Carr, A. C., & Maggini, S. (2017). Vitamin C and immune function. Nutrients, 9(11), 1211. https://doi.org/10.3390/nu9111211
Celmeli, T., Sari, H., Canci, H., Sari, D., Adak, A., Eker, T., & Toker, C. (2018). The nutritional content of common bean (Phaseolus vulgaris L.) landraces in comparison to modern varieties. Agronomy, 8(9). https://doi.org/10.3390/agronomy8090166
Chávez-Mendoza, C., & Sánchez, E. (2017). Bioactive compounds from Mexican varieties of the common bean (Phaseolus vulgaris L.): Implications for health. Molecules, 22(8), Article 1360. https://doi.org/10.3390/molecules22081360
Chen, L., Teng, H., Jia, Z., Battino, M., Miron, A., Yu, Z., Cao, H. & Xiao, J. (2017). Intracellular signaling pathways of inflammation modulated by dietary flavonoids: The most recent evidence. Critical Reviews in Food Science and Nutrition, 58(17), 2908–2924. https://doi.org/10.1080/10408398.2017.1345853
Costa, G., Francisco, V., Lopes, M. C., Cruz, M. T., & Batista, M. T. (2012). Intracellular signaling pathways modulated by phenolic compounds: Application for new anti-inflammatory drugs discovery. Current Medicinal Chemistry, 19(18), 2876–2900. https://doi.org/10.2174/092986712800672049
Crupi, P., Faienza, M. F., Naeem, M. Y., Corbo, F., Clodoveo, M. L., & Muraglia, M. (2023). Overview of the Potential Beneficial Effects of Carotenoids on Consumer Health and Well-Being. Antioxidants, 12(5), 1069. https://doi.org/10.3390/antiox12051069
Das, L., Bhaumik, E., Raychaudhuri, U., & Chakraborty, R. (2012). Role of nutraceuticals in human health. Journal of Food Science and Technology, 49(2), 173–183. https://doi.org/10.1007/s13197-011-0269-4
Du, G., Li, M., Ma, F., & Liang, D. (2009). Antioxidant capacity and the relationship with polyphenol and vitamin C in Actinidia fruits. Food Chemistry, 113, 557–562. https://doi.org/10.1016/j.foodchem.2008.08.025
Eroglu, A., Al’Abri, I. S., Kopec, R. E., Crook, N., & Bohn, T. (2023). Carotenoids and their health benefits as derived via their interactions with gut microbiota. Advances in Nutrition, 14(2), 238–255. https://doi.org/10.1016/j.advnut.2022.10.007
Hayat, I., Ahmad, A., Masud, T., Ahmed, A., & Bashir, S. (2014). Nutritional and health perspectives of beans (Phaseolus vulgaris L.): An overview. Critical Reviews in Food Science and Nutrition, 54(5), 580–592. https://doi.org/10.1080/10408398.2011.596639
Huber, K., Brigide, P., Bretas, E. B., & Canniatti-Brazaca, S. G. (2016). Phenolic acid, flavonoids and antioxidant activity of common brown beans (Phaseolus vulgaris L.) before and after cooking. Journal of Nutrition & Food Sciences, 6(5), 551. https://doi.org/10.4172/21559600.1000551
Iniestra-González, J. J., Ibarra-Pérez, F. J., Gallegos-Infante, J. A., Rocha-Guzmán, N. E., & González Laredo, R. F. (2005). Antinutritional factors and antioxidant activity in improved varieties of common bean (Phaseolus vulgaris L.). Agrociencia (Montecillo) 39 (6), 603-610
Islam, F. M. A., Basford, K. E., Jara, C., Redden, R. J., & Beebe, S. (2002). Seed compositional and disease resistance differences among gene pools in cultivated common bean. Genetic Resources and Crop Evolution, 49(3), 285–293. https://doi.org/10.1023/A:1015510428026
Jacob, R. A., & Sotoudeh, G. (2002). Vitamin C function and status in chronic disease. Nutrition in Clinical Care, 5(2), 66–74. https://doi.org/10.1046/j.1523-5408.2002.00005.x
Jenkins, A. L. (2007). The glycemic index: Looking back 25 years. Cereal Foods World, 52, 50–53. https://doi.org/10.1094/cfw-52-1-0050
Kampfenkel, K., Van Montagu, M., & Inzé, D. (1995). Extraction and determination of ascorbate and dehydroascorbate from plant tissue. Analytical Biochemistry, 225, 165–167. https://doi.org/10.1006/abio.1995.1127
Karavidas, I., Ntatsi, G., Vougeleka, V., Karkanis, A., Ntanasi, T., Saitanis, C., Agathokleous, E., Ropokis, A., Sabatino, L., Tran, F., Lannetta, P. P. M. & Savvas, D. (2022). Agronomic practices to increase the yield and quality of common bean (Phaseolus vulgaris L.): A systematic review. Agronomy, 12, 271. https://doi.org/10.3390/agronomy12020271
Lichtenthaler, H. K. (1987). Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes. Methods in Enzymology, 148, 351–382.
Madrera, R. R., Negrillo, A. C., Valles, B. S., & Fernández, J. J. F. (2021). Phenolic content and antioxidant activity in seeds of common bean (Phaseolus vulgaris L.). Foods, 10(4). https://doi.org/10.3390/foods10040864
Makkar, R., Behl, T., Bungau, S., Zengin, G., Mehta, V., Kumar, A., Uddin, M. S., Ashraf, G. M., Abdel-Daim, M. M., Arora, S., & Oancea, R. (2020). Nutraceuticals in Neurological Disorders. International Journal of Molecular Sciences, 21(12), 4424. https://doi.org/10.3390/ijms21124424
Márquez, K., Arriagada, O., Pérez-Díaz, R., Cabeza, R. A., Plaza, A., Arévalo, B., Meisel, L. A., Ojeda, D., Silva, H., Schwember, A. R., Fuentes, C., Flores, M., & Carrasco, B. (2024). Nutritional characterization of Chilean landraces of common bean. Plants, 13(6), 817. https://doi.org/10.3390/plants13060817/s1
Mittu, B., Bhat, Z. R., Chauhan, A., Kour, J., Behera, A., & Kaur, M. (2022). Chapter 16 - Ascorbic acid. In J. Kour & G. A. Nayik (Eds.), Nutraceuticals and Health Care (pp. 289–302). Academic Press. https://doi.org/10.1016/B978-0-323-89779-2.00015-6
Murube, E., Beleggia, R., Pacetti, D., Nartea, A., Frascarelli, G., Lanzavecchia, G., Bellucci, E., Nanni, L., Gioia, T., Marciello, U., Esposito, S., Foresi, G., Logozzo, G., Frega, G. N., Bitocchi, E., & Papa, R. (2021). Characterization of nutritional quality traits of a common bean germplasm collection. Foods, 10(7). https://doi.org/10.3390/FOODS10071572
Consumo – Alimentación saludable
Naliyadhara, N., Kumar, A., Gangwar, S. K., Devanarayanan, T. N., Hegde, M., Alqahtani, M. S., Abbas, M., Sethi, G., & Kunnumakkara, A. (2023). Interplay of dietary antioxidants and gut microbiome in human health: What has been learnt thus far? Journal of Functional Foods, 100, 105365. https://doi.org/10.1016/j.jff.2022.105365
Pinheiro, C., Baeta, J. P., Pereira, A. M., Domingues, H., & Ricardo, C. P. (2010). Diversity of seed mineral composition of Phaseolus vulgaris L. germplasm. Journal of Food Composition and Analysis, 23(4), 319–325. https://doi.org/10.1016/j.jfca.2010.01.005
Rivera, A., Casquero, P. A., Mayo, S., Almirall, A., Plans, M., Simó, J., Romero-Del-Castillo, R., & Casañas, F. E. (2016). Culinary and sensory traits diversity in the Spanish core collection of common beans (Phaseolus vulgarisL.). Spanish Journal of Agricultural Research, 14(1). https://doi.org/10.5424/sjar/2016141-7726
Rocha-Guzman, N. E., Gallegos-Infante, J. A., Gonzalez-Laredo, R. F., Cardoza-Cervantes, V., Reynoso-Camacho, R., Ramos-Gomez, M., Garcia-Gasca, T., & De Anda Salazar, A. (2013). Evaluation of culinary quality and antioxidant capacity for Mexican common beans (Phaseolus vulgaris L.) canned in pilot plant. International Food Research Journal, 20(3), 1087–1093.
Rowles, J. L., & Erdman, J. W. (2020). Carotenoids and their role in cancer prevention. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 1865(11), 158613. https://doi.org/10.1016/j.bbalip.2020.158613
Samtiya, M., Aluko, R. E., Dhewa, T., & Moreno-Rojas, J. M. (2021). Potential health benefits of plant food-derived bioactive components: An overview. Foods, 10(4), 839. https://doi.org/10.3390/foods10040839
Santos Pedone, I., Narita, I. M. P., da Silveira, M. M., Bassinello, P. Z., Vanier, N. L., & Colussi, R. (2024). Enhancing quick-cooking bean quality: The impact of salt concentrations on soaking of fresh and aged Brazilian genotypes. Food and Humanity, 3, 100422. https://doi.org/10.1016/j.foohum.2024.100422
Sekiya, J., Kamiuchi, H., & Hatanaka, A. (1982). Lipoxygenase, hydroperoxide lyase and volatile C6-aldehyde formation from C18-fatty acids during development of Phaseolus vulgaris L. Plant and Cell Physiology, 23(4), 631–638. https://doi.org/10.1093/oxfordjournals.pcp.a076390
Sica, P., Galvao, A., Scariolo, F., Maucieri, C., Nicoletto, C., Pilon, C., Sambo, P., Barcaccia, G., Borin, M., Cabrera, M., & Franklin, D. (2021). Effects of drought on yield and nutraceutical properties of beans (Phaseolus spp.) traditionally cultivated in Veneto, Italy. Horticulturae, 7(2), Article 17. https://doi.org/10.3390/horticulturae7020017
Singleton, V. L., Orthofer, R., & Lamuela-Raventos, R. M. (1999). Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent. Methods in Enzymology, 299, 152–178.
Smith, M. R., Veneklaas, E., Polania, J., Rao, I. M., Beebe, S. E., & Merchant, A. (2019). Field drought conditions impact yield but not nutritional quality of the seed in common bean (Phaseolus vulgaris L.). PLoS ONE, 14(6). https://doi.org/10.1371/journal.pone.0217099
Smýkal, P., Nelson, M. N., Berger, J. D., & Von Wettberg, E. J. B. (2018). The impact of genetic changes during crop domestication on healthy food development. Agronomy, 8(3). https://doi.org/10.3390/agronomy8030026
Vasconcelos, A., Bonatti, M., Schlindwein, S., D’Agostini, L., Homem, L., & Nelson, R. (2013). Landraces as an adaptation strategy to climate change for smallholders in Santa Catarina, Southern Brazil. Land Use Policy, 34, 250. https://doi.org/10.1016/j.landusepol.2013.03.017
Vavilov, N. I. (1997). Five continents. International Plant Genetic Resources Institute.
Villalba, A., Martínez-Ispizua, E., Morard, M., Crespo-Sempere, A., Albiach-Marti, M. R., Calatayud, A., & Penella, C. (2024). Optimizing sweet potato production: Insights into the interplay of plant sanitation, virus influence, and cooking techniques for enhanced crop quality and food security. Frontiers in Plant Science, 15, Article 1357611. https://doi.org/10.3389/fpls.2024.1357611
ESPECIALISTES EN SERVEIS PER A LA PRODUCCIÓ EDITORIAL, SL
Doctor Manuel Candela 26, 11ª 46021 VALENCIA – ESPAÑA
Tel.: +34-649 48 56 77 / info@poscosecha.com NIF: B-43458744
www.poscosecha.com www.postharvest.biz www.bibliotecahorticultura.com www.tecnologiahorticola.com www.actualfruveg.com
www.bibliotecahorticultura.com