





Hay algo profundamente humano en el afán de comprender la enfermedad. No solo por lo que amenaza, sino por lo que revela… Las patologías que afectan al ganado porcino no son meros obstáculos productivos; son el reverso tenaz de la vida, una suerte de espejo oscuro que refleja nuestras vulnerabilidades, pero también nuestra capacidad de respuesta, colaboración y conocimiento.
Vivimos una época marcada por contrastes: a la par que algunas enfermedades infecciosas parecen ceder gracias al esfuerzo conjunto de la ciencia y el sector, otras resurgen o se transforman, impulsadas por nuevas dinámicas epidemiológicas, por la presión evolutiva de los propios microorganismos o por las condiciones de producción intensiva.
Entre ellas, viejos conocidos como el PRRS, PCV-2 o la pleuroneumonía porcina mantienen su presencia constante, desafiando los protocolos más minuciosos. En cambio, otras amenazas como la Fiebre Aftosa o la Peste Porcina Africana, aunque aún ajenas a nuestras granjas, exigen vigilancia infatigable y preparación responsable.
La patología no se queda en la lesión o en la clínica. Es también política sanitaria, estrategia económica, diálogo científico y ética productiva.
La lucha contra las resistencias antimicrobianas, por ejemplo, no se limita a una elección terapéutica: es una causa compartida que nos interpela desde el plano técnico, pero también desde el compromiso con la salud pública y la sostenibilidad del propio modelo productivo.
La dirección de la revista no se hace responsable de las opiniones de los autores. Todos los derechos reservados. Imágenes: Noun Project/Freepik/Dreamstime/BioRender
La innovación, en este contexto, emerge como un faro más que como una bandera. Desde la fagoterapia hasta el estudio de las biopelículas, desde la comprensión de complejas interacciones entre patógenos entéricos hasta la exploración de nuevas herramientas diagnósticas, los avances nos permiten afinar la mirada y el abordaje, dejando atrás las soluciones simplistas y abrazando la complejidad con humildad, pero también con convicción.
Hoy más que nunca, necesitamos remar juntos. Veterinarios, ganaderos, investigadores, industria y administración. No porque suene bien, sino porque solo así es posible trazar una sanidad porcina que sea eficaz y sensata.
Que sea resiliente frente a los cambios, pero firme en sus principios. Que no olvide que el bienestar animal no es una concesión estética, sino un pilar fundamental que repercute en la inmunidad, en la productividad y, sobre todo, en la legitimidad social del sector.
Contamos con herramientas de diagnóstico cada vez más precisas y accesibles. Con biotecnologías que nos permiten anticipar, prevenir y actuar. Con conocimiento acumulado y con redes de colaboración que cruzan fronteras.
Que esta edición especial sobre Patología sirva no solo como una muestra del estado del arte, sino como un recordatorio del arte de estar en estado de alerta.
LA CIENCIA VETERINARIA, CUANDO SE PRACTICA CON RIGOR Y MIRADA LARGA, NO SOLO COMBATE ENFERMEDADES, CONSTRUYE CONFIANZA, TERRITORIO Y FUTURO.
EDITOR GRUPO DE COMUNICACIÓN AGRINEWS S.L.
PUBLICIDAD
Laura Muñoz +34 629 42 25 52 laura@mediatarsis.com
Luis Carrasco +34 605 09 05 13 lc@agrinews.es
REDACCIÓN
Daniela Morales
ADMINISTRACIÓN
Mercè Soler
Barcelona
España
Tel: +34 93 115 44 15 info@agrinews.es
www.porcinews.com www.porcinews.com/revista-porcisapiens/
Precio de suscripción anual: España 45 €
Extranjero 120 €
ISSN (Revista impresa) 2696-8142
ISSN (Revista digital) 2696-8151
DIRIGIDA A VETERINARIOS DE PORCINO Depósito Legal PorciSapiens B 7620-2021
Revista Cuatrimestral
4/9
PUNTUACIÓN DE INFLAMACIÓN Y NECROSIS EN LECHONES COMO INDICADOR DE RIESGOS SANITARIOS Y DE BIENESTAR
Karien Koenders-van Gog1, Thomas Wijnands1, Mirjam Lechner2, Gerald Reiner3 y Johanna Fink-Gremmels4
1Lintjeshof Veterinary Practice, LH Vet Group, Países Bajos
2UEG Hohenlohe, Alemania
3Clínica de Gestión Sanitaria y Diagnóstico Molecular del Ganado Porcino, Universidad Justus-Liebig de Giessen, Alemania
4IRAS-Departamento de Ciencias de la Población, Facultad de Medicina Veterinaria, Universidad de Utrecht, Países Bajos
La puntuación de SINS en lechones permite identificar de forma temprana riesgos sanitarios y de bienestar, aportando una herramienta práctica para la mejora continua en granja.
10/16
CONTROL DE LA ANEMIA FERROPÉNICA Y LA COCCIDIOSIS PORCINA EN LOS TIEMPOS ACTUALES
Sonia Cárceles, Carlos Casanovas, Salvador Oliver, Susana Mesonero, Fernando Cerro y David Espigares Servicio Técnico Porcino, Ceva Salud Animal
18/25
FORMACIÓN DE STREPTOCOCCUS SUIS: CLAVE EN SU PATOGENICIDAD
Oscar Mencía-Ares, Rubén Miguélez Pérez, César B. Gutiérrez Martín, Alba González Fernández, Máximo Petrocchi Rilo, Mario Delgado García, Ana I. Pastor Calonge, Carmen Arenas Fernández y Sonia Martínez Martínez
Grupo BACRESPI. Departamento de Sanidad Animal, Universidad de León
26/30
INTERACCIÓN ENTRE PATÓGENOS ENTÉRICOS: EL CASO DE ROTAVIRUS, ESCHERICHIA COLI Y CLOSTRIDIUM SPP.
Guillermo Ramis y Antonio Muñoz Departamento de Producción Animal de la Facultad de Veterinaria de la Universidad de Murcia
32/40
COLIBACILOSIS Y DESMEDICALIZACIÓN EN LA PRODUCCIÓN PORCINA: ¿ES LA FAGOTERAPIA UNA NUEVA ALTERNATIVA

SALUD DIGESTIVA: EL ORIGEN DE LA SANIDAD EN PRODUCCIÓN PORCINA
La formación de persistencia y patogenicidad, con variaciones relevantes según el serotipo y los genes de virulencia presentes.
Casas Nuevas.
ESTUDIOS
César B. Gutiérrez Martín
Catedrático del Departamento de Sanidad Animal de la Universidad de León 52/62
El control de A. pleuropneumoniae continúa siendo un reto pese a los avances en el conocimiento de su virulencia y el desarrollo de nuevas estrategias vacunales.

FIEBRE AFTOSA EN GANADO PORCINO: ORÍGENES, CAUSAS Y ACTUALIDAD 64/72
Carolina Rodríguez Sanz Evaluadora de preclínica y clínica. Departamento de Medicamentos Veterinarios. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
La fiebre aftosa es una enfermedad vírica altamente contagiosa que afecta al ganado porcino y otras especies unguladas, y su control requiere vigilancia, bioseguridad y respuestas rápidas ante brotes.
Agradecemos a nuestros anunciantes por hacer posible la publicación de esta revista: Ceva Salud Animal, Elanco, Livisto, MSD Animal Health, PIC, Vetia Animal Health, Vetoquinol y Zoetis.

EEn la búsqueda constante por mejorar el bienestar y la salud de los animales de granja, se vuelve esencial contar con herramientas prácticas que permitan detectar de forma temprana y fiable posibles alteraciones. La puntuación de signos de inflamación y necrosis en lechones (Swine Inflammation and NecrosisSyndrome, SINS) se propone como un sistema sencillo, no invasivo y fácilmente aplicable en granja que puede contribuir significativamente a identificar riesgos sanitarios y de bienestar desde los primeros días de vida. Basado en observaciones clínicas visibles, este enfoque permite tomar decisiones informadas e implementar medidas correctivas antes de que los problemas se agraven. Su utilidad ha sido validada en condiciones reales y sus principios pueden aplicarse de forma general en distintos sistemas productivos.
Karien Koenders-van Gog1, Thomas Wijnands1, Mirjam Lechner2, Gerald Reiner3*y Johanna Fink-Gremmels4
1Lintjeshof Veterinary Practice, LH Vet Group, Países Bajos
2UEG Hohenlohe, Alemania
3Clínica de Gestión Sanitaria y Diagnóstico Molecular del Ganado Porcino, Universidad Justus-Liebig de Giessen, Alemania
4IRAS-Departamento de Ciencias de la Población, Facultad de Medicina Veterinaria, Universidad de Utrecht, Países Bajos

Descarga el PDF

SEl bienestar animal está determinado tanto por características individuales heredadas como por las condiciones del entorno.
En este sentido, los indicadores basados en recursos (como el tipo de alojamiento, la higiene o la dieta) deben complementarse con indicadores basados en el propio animal, observando directamente su comportamiento, aspecto físico y estado general1,2,3. Mediante este enfoque integral es posible realizar una evaluación realista del estado de bienestar.
El sistema de puntuación de SINS se enmarca entre los indicadores centrados en el animal y permite detectar manifestaciones clínicas visibles de procesos inflamatorios, como enrojecimiento, hinchazón, erosiones cutáneas y lesiones necróticas.
Estas señales, cuando se identifican en las primeras etapas de vida, pueden actuar como indicadores de alteraciones metabólicas o inmunológicas más profundas, facilitando intervenciones tempranas.
El síndrome de inflamación y necrosis porcina (SINS) engloba una serie de lesiones inflamatorias que, en ocasiones, evolucionan hacia necrosis tisular. Las zonas más afectadas4,5 suelen ser:
Base y punta de la cola
Orejas
Pezuñas (rodete coronario y talones)
Pezones
Cara
Ombligo
Vulva
Para su evaluación, se ha desarrollado un sistema de puntuación estructurado (Tabla 1 y Figuras 1 y 2) que clasifica los signos en tres niveles:
Ausencia de lesión: puntuación 0
Lesión leve: puntuación 1
Lesión grave o necrótica: puntuación 2
Los datos pueden recogerse fácilmente durante la manipulación rutinaria de los lechones en la primera semana de vida, sin necesidad de equipamiento adicional ni procedimientos invasivos.
Cada lechón recibe una puntuación individual basada en la suma de los signos presentes, normalizada según el número total de puntos posibles (13 en machos, 15 en hembras).
Este sistema permite convertir observaciones clínicas en datos cuantificables y estandarizados que pueden utilizarse tanto a nivel individual como poblacional.
TABLA 1
Matriz de puntuación de los signos clínicos del SINS aplicada en el presente estudio.
Puntuación 0: Sin lesiones
Punta de la cola
Puntuación 1: Lesiones
Sin lesiones Edema, hinchazón, enrojecimiento, sin pelo
Sin lesiones
Rodete coronario

Puntuación 2: Lesiones graves
Constricción anular y lesiones necróticas*
Enrojecimiento, hemorragias Necrosis
Sin lesiones Sin pelo, piel brillante, erosión, exudado Lesiones necróticas
Sin lesiones Enrojecimiento, hinchazón Lesiones necróticas
Sin lesiones Hinchazón, edema alrededor de los ojos y el hocico, piel dañada, erosiones, exudado Múltiples lesiones necróticas
Sin lesiones Enrojecimiento, exudado, piel dañada
Sin lesiones Sangrado
Sin lesiones
Enrojecimiento, hinchazón
Lesiones necróticas
Lesiones necróticas
Lesiones necróticas
*Lesiones necróticas: zonas secas, negras y avitales que indican tejido muerto. Piel dañada: lesiones cutáneas, no necróticas.
FIGURA 1
Representación de las zonas corporales evaluadas en la puntuación de signos clínicos del SINS en lechones. El sistema contempla tres niveles de puntuación: 0 (sin lesiones), 1 (lesiones leves) y 2 (lesiones graves o necróticas). Las zonas observadas incluyen cara, orejas, base y punta de la cola, vulva, pezones, ombligo y pezuñas (rodetes coronarios y talones).

FIGURA 2
Ejemplos de puntuaciones SINS aplicadas en este estudio.
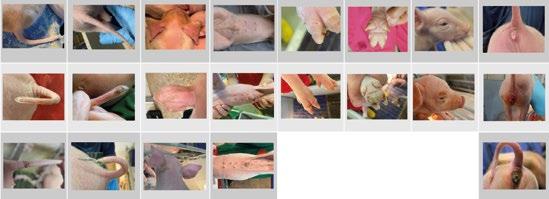
Una de las revelaciones más interesantes derivadas de la aplicación de este sistema de puntuación en condiciones de prácticas (5.985 lechones en 13 rebaños porcinos holandeses entre julio de 2022 y enero de 2024) fue la presencia de lesiones inflamatorias visibles desde el primer día de vida, lo que sugiere que en muchos casos el proceso se inicia antes del nacimiento.
La patogénesis del SINS se asocia, en parte, con una pérdida de integridad de la barrera intestinal, facilitando la translocación de toxinas bacterianas y microorganismos a la circulación sanguínea6-10 .
Estas alteraciones pueden tener múltiples causas, incluyendo hipoxia perinatal, adaptación intestinal inadecuada al pienso, colonización microbiológica anómala, exposición a micotoxinas y disbiosis intestinal11-18
En lechones recién nacidos, incluso eventos fisiológicos como el parto pueden generar estrés inflamatorio, habiéndose observado infiltración de macrófagos y linfocitos en tejidos afectados tan solo dos horas después del nacimiento19, y su carácter endógeno ha sido corroborado mediante estudios transcriptómicos, metabolómicos y de heredabilidad20-23

La utilidad del sistema de puntuación SINS va más allá de la identificación de lesiones cutáneas, ya que los signos observados son indicadores de inflamación sistémica y se asocian con alteraciones en el sistema inmunitario y la integridad intestinal y hepática5,22
LECHONES CON PUNTUACIONES ELEVADAS
TIENEN MAYOR SUSCEPTIBILIDAD A INFECCIONES
COMUNES, LO QUE
LOS CONVIERTE EN UN GRUPO DE RIESGO
Además, existe una correlación entre el SINS y la aparición de conductas anómalas como la caudofagia.
De hecho, estudios recientes sugieren que las mismas vías inflamatorias implicadas en el síndrome pueden estar relacionadas con la predisposición a este tipo de comportamientos24
FACTORES PREDISPONENTES AL SINS
CONDICIÓN DE LA CERDA Y SÍNDROME METABÓLICO
CONDICIÓN DE LA CERDA Y SÍNDROME METABÓLICO
Factores metabólicos maternos como la disgalaxia postparto, el consumo insuficiente de agua y la coprostasis han demostrado estar directamente relacionados con una mayor incidencia de SINS en las camadas25-28
Estas condiciones favorecen la disbiosis intestinal y la liberación de endotoxinas bacterianas, comprometiendo la integridad intestinal de la cerda y, en consecuencia, afectando el desarrollo fetal30–33.
En este contexto, el crecimiento intrauterino restringido (CIR) y el aumento de lechones nacidos muertos o débiles pueden estar vinculados a la presencia de puntuaciones SINS elevadas.
UNA ESTRATEGIA CLAVE DE INTERVENCIÓN ES ASEGURAR UNA INGESTA ADECUADA DE AGUA Y FIBRA DURANTE LA GESTACIÓN, LO QUE PUEDE REDUCIR LA DISGALAXIA EN LAS CERDAS Y LA APARICIÓN DE SINS EN LOS LECHONES
MICOTOXINAS Y SUSCEPTIBILIDAD HORMONAL
MICOTOXINAS Y SUSCEPTIBILIDAD HORMONAL
La exposición a micotoxinas representa otro factor de riesgo para el desarrollo de SINS.
Por ejemplo, la zearalenona, que presenta actividad estrogénica y propiedades proinflamatorias4,34,35, puede atravesar la barrera placentaria y excretarse en la leche, conduciendo a una exposición temprana que afecta al sistema inmunitario en desarrollo, especialmente en las hembras, donde se ha observado una mayor prevalencia de lesiones en los pezones.
CONDICIONES AMBIENTALES
CONDICIONES AMBIENTALES
Aunque el tipo de suelo en la sala de partos puede influir en la aparición de lesiones en pezuñas y talones, la presencia de estos signos desde el nacimiento apunta a una etiología más compleja, muchas veces intrauterina. Además, factores como el estrés térmico pueden agravar el cuadro, ya que la hipoxia local contribuye a la pérdida de integridad intestinal y a la disbiosis7–10,36,37

Una de las ventajas del sistema de puntuación SINS es que, además de su utilidad diagnóstica, es una herramienta de comunicación entre ganaderos, veterinarios y nutrólogos.
Permite visualizar de forma clara la necesidad de intervenir sobre factores específicos del manejo, la nutrición o el estado de las cerdas, de modo que su integración en los protocolos de manejo facilita la toma de decisiones basadas en datos objetivos.
La correlación de los patrones de puntuación con otros indicadores productivos y sanitarios permite mejorar continuamente la gestión de la granja y anticipar posibles brotes o pérdidas de rendimiento.
LIMITACIONES Y PERSPECTIVAS DE FUTURO
Como cualquier herramienta clínica, la puntuación SINS presenta limitaciones:
Su uso requiere formación del personal y, aunque se basa en observaciones objetivas, la subjetividad no puede eliminarse por completo.
Se necesitan más estudios longitudinales que evalúen la correlación entre puntuaciones y factores específicos a lo largo de varios ciclos reproductivos para establecer relaciones causales más sólidas.
No obstante, su simplicidad, aplicabilidad inmediata y valor diagnóstico la convierten en una herramienta prometedora para mejorar la salud y el bienestar de los lechones en distintos sistemas de producción.
SISTEMA DE PUNTUACIÓN SINS OFRECE UNA FORMA PRÁCTICA, VISUAL Y EFICAZ DE EVALUAR EL ESTADO DE SALUD Y BIENESTAR DE LOS LECHONES DESDE EL NACIMIENTO

Permite detectar signos tempranos de inflamación, identificar factores de riesgo maternos y ambientales, y orientar estrategias de intervención.
Su aplicación no requiere equipamiento especializado y puede integrarse fácilmente en la rutina de manejo.
Lejos de ser una herramienta limitada a casos clínicos concretos, el sistema de puntuación SINS representa un enfoque extrapolable, adaptable y útil para cualquier granja porcina interesada en mejorar la calidad sanitaria, reducir la presión antimicrobiana y aumentar el bienestar de sus animales.
En este sentido, constituye un paso hacia una producción más sostenible, responsable y alineada con las demandas actuales del sector y de la sociedad.
Artículo adaptado de: Koenders-van Gog, K.; Wijnands, T.; Lechner, M.; Reiner, G.; Fink Gremmels, J. Screening of Piglets for Signs of Inflammation and Necrosis as Early Life Indicators of Animal Health and Welfare Hazards. Animals 2025, 15, 378. https://doi.org/10.3390/ani15030378 (CC BY)
1. Mellor, D.J. Updating Animal Welfare Thinking: Moving beyond the “Five Freedoms” towards “A Life Worth Living”. Animals 2016, 6, 21. https:// doi.org/10.3390/ani6030021.
2. Zuliani, A.; Romanzin, A.; Corazzin, M.; Salvador, S.; Abrahantes, J.; Bovolenta, S. Welfare assessment in traditional mountain dairy farms: Above and beyond resource-based measures. Anim. Welf. 2017, 26, 203–211. https://doi. org/10.7120/09627286.26.2.203.

14. Pinton, P.; Nougayrede, J.P.; Del Rio, J.C.; Moreno, C.; Marin, D.E.; Ferrier, L.; Bracarense, A.P.; Kolf-Clauw, M.; Oswald, J.P. The food contaminant deoxynivalenol decreases intestinal barrier permeability and reduces claudin expression. Toxicol. Appl. Pharmacol. 2009, 237, 41–48.
3. Whay, H.R.; Main, D.C.J.; Green, L.E.; Webster, A.J.F. Animal-Based Measures for the Assessment of Welfare State of Dairy Cattle, Pigs and Laying Hens: Consensus of Expert Opinion. Anim. Welf. 2003, 12, 205–217. https://doi. org/10.1017/S0962728600025641.
4. Reiner, G.; Kuehling, J.; Loewenstein, F.; Lechner, M.; Becker, S. Swine Inflammation and Necrosis Syndrome (SINS). Animals 2021, 11, 1670.
5. Reiner, G.; Kuehling, J.; Lechner, M.; Schrade, H.J.; Saltzmann, J.; Muelling, C.; Dänicke, S.; Löwenstein, F. Inflammation and necrosis syndrome is influenced by husbandry and quality of sow in suckling piglets weaners and fattening pigs. Porc. Health Manag. 2020, 6, 32.
6.Berchieri-Ronchi, C.B.; Kim, S.W.; Zhao, Y.; Correa, C.R.; Yeum, K.-J.; Ferreira, A.L.A. Oxidative stress status of highly prolific sows during gestation and lactation. Animal 2011, 5, 1774–1779. https://doi.org/10.1017/S1751731111000772.
7.Pearce, S.C.; Mani, V.; Boddicker, R.L.; Johnson, J.S.; Weber, T.E.; Ross, J.W.; Baumgard, L.H.; Gabler, N.K. Heat stress reduces barrier function and alters intestinal metabolism in growing pigs. J. Anim. Sci. 2012, 90, 257–259.
8.Pearce, C.S.; Mani, V.; Boddicker, R.L.; Johnson, J.S.; Weber, T.E.; Ross, J.W.; Rhoads, R.P.; Baumgard, L.H.; Gabler, N.K. Heat stress reduces intestinal barrier integrity and favors intestinal glucose transport in growing pigs. PLoS ONE 2013, 8, e70215.
9.Pearce, S.C.; Sanz-Fernandez, M.V.; Hollis, J.H.; Baumgard, L.H.; Gabler, N.K. Short-term exposure to heat stress attenuates appetite and intestinal integrity in growing pigs. J. Anim. Sci. 2014, 92, 5444–5454.
10.Sanz Fernandez, M.V.; Stoakes, S.K.; Abuajamieh, M.; Seibert, J.T.; Johnson, J.S.; Horst, E.A.; Rhoads, R.P.; Baumgard, L.H. Heat stress increases insulin sensitivity in pigs. Physiol. Rep. 2015, 3, e1247.
11. Chae, Y.R.; Lee, Y.R.; Kim, Y.S.; Park, H.Y. Diet-Induced Gut Dysbiosis and Leaky Gut Syndrome. J. Microbiol. Biotechnol. 2024, 34, 747–756. https://doi.org/10.4014/jmb.2312.12031.
12. Schrauwen, E.; Thoonen, H.; Hoorens, J.; Houvenaghel, A. Pathophysiological effects of endotoxin infusion in young piglets. Br. Vet. J. 1986, 142, 364–370.
13. Guillou, D.; Demey, V.; Chacheyras-Durand, F.; Le Treut, Y. Mise en evidence du transfer des endotoxines de la truie vers sa portée dans le context du syndrome de dysgalactie post-partum. Journées Rech. Porc. 2013, 45, 269–270.
15. Kullik, K.; Brosig, B.; Kersten, S.; Valenta, H.; Diesing, A.K.; Panther, P.; Reinhardt, N.; Kluess, J.; Rothkötter, H.J.; Breves, G.; et al. Interactions between the Fusarium toxin deoxynivaleno and lipopolysaccharides on the in vivo protein synthesis of acute phase proteins, cytokines and metabolic activity of peripheral blood mononuclear cells in pigs. Food Chem. Toxicol. 2013, 57, 11–20.
16. Dänicke, S.; Valenta, H.; Ganter, M.; Brosig, B.; Kersten, S.; Diesing, A.K.; Kahlert, S.; Kluess, J.; Rothkötter, H.J. Lipopolysaccharides (LPS) modulate the metabolism of deoxynivalenol (DON) in the pig. Mycotoxin Res. 2014, 30, 161–170.
17. Pestka, J.J.; Zhou, H.R.; Moon, Y.; Chung, Y.J. Cellular and molecular mechanisms for immune modulation by deoxynivalenol and other trichothecenes: Unravelling a paradoxon. Toxicol. Lett. 2004, 153, 61–73.
18. Pierron, A.; Alassane-Kpembi, I.; Oswald, I.P. Impact of two mycotoxins deoxynivalenol and fumonisin on pig intestinal health. Porc. Health Manag. 2016, 2, 21.
19. Betz, P. Histological and enzyme histochemical parameters for estimating the age of human skin wounds. Int. J. Forens. Med. 1994, 107, 60–68.
20. Leite, N.G.; Knol, E.K.; Nuphaus, S.; Vogelzang, R.; Tsuruta, S.; Wittmann, M.; Lourenco, D. The genetic basis of swine inflammation and necrosis syndrome and its genetic association with post-weaning skin damage and production traits. J. Anim. Sci. 2023, 101, skad067. https:// doi.org/10.1093/jas/skad067.
21. Loewenstein, F.; Becker, S.; Kuehling, J.; Schrade, H.; Lechner, M.; Ringseis, R.; Eder, K.; Moritz, A.; Reiner, G. Inflammation and necrosis syndrome is associated with alterations in blood and metabolism in pigs. BMC Vet. Res. 2022, 18, 50.
22. Ringseis, R.; Gessner, D.; Löwenstein, F.; Kuehling, J.; Becker, S.; Willems, H.; Lechner, M.; Eder, K.; Reiner, G. Swine inflammation and necrosis syndrome is associated with plasma metabolites and liver transcriptome in affected piglets. Animals 2021, 11, 772.
23. Gerhards, K.; Becker, S.; Kuehling, J.; Lechner, M.; Willems, H.; Ringseis, R.; Reiner, G. Screening for transcriptomic associations with Swine Inflammation and Necrosis Syndrome. BMC Vet. Res. 2025, 21, 26. https://doi. org/10.1186/s12917-024-04469-y.
24. Nordgreen, J.; Edwards, S.A.; Boyle, L.A.; Bolhuis, J.E.; Veit, C.; Sayyari, A.; Marin, D.M.; Dimitrov, I.; Janczak, A.M.; Valros, A. A proposed role for proinflammatory cytokines in damaging behavior in pigs. Front. Vet. Sci. 2020, 7, 646. 25. Reiner, G.; Hertrampf, B.; Richard, H.R. Postpartales Dysgalaktiesyndrom der Sau—Eine Übersicht mit besonderer Berücksichtigung der Pathogenese. Tierärztl. Prax. 2009, 5, 305–318.
26. Hirsch, A.C.; Philipp, H.; Kleemann, R. Investigation on the efficacy of meloxicam in sows with mastitis-metritis-agalactia syndrome. J. Vet. Pharmocol. Ther. 2003, 26, 355–360.
27. Smith, B.B.; Wagner, W.C. Effect of dopamine agonists or antagonists, TRH, stress and piglet removal on plasma prolactin concentrations in lactating gilts. Theriogenology 1985, 3, 283–296.
28. Smith, B.B.; Wagner, W.C. Effect of Escherichia coli endotoxin and thyrotropin releasing hormone on prolactin in lactating sows. Am. J. Vet. Res. 1985, 46, 175–180.
29. Pritts, T.; Hungness, E.; Wang, Q.; Robb, B.; Hershko, D.; Hasselgren, P.O. Mucosal and enterocyte IL-6 production during sepsis and endotoxemia—Role of transcription factors and regulation by the stress response. Am. J. Surg. 2002, 183, 372–383. https://doi.org/10.1016/ S0002-9610(02)00812-7.
30. Cheng, C.; Wei, H.; Yu, H.; Xu, C.; Jiang, S.; Peng, J. Metabolic syndrome during perinatal period in sows and the link with gut microbiota and metabolites. Front. Microbiol. 2018, 9, 1989. https://doi.org/10.3389/fmicb.2018.01989.
31. Sahasrabudhe, N.; Beukema, M.; Tian, L.; Troost, B.; Scholte, J.; Bruininx, E.; Bruggeman, G.; van den Berg, M.; Scheurink, A.; Schols, H.; et al. Dietary fiber pectin directly blocks Toll-like receptor 2-1 and prevents doxorubicin-induced ileitis. Front. Immunol. 2018, 9, 383. https://doi. org/ 10.3389/fimmu.2018.00383.
32. Luu, M.; Monning, H.; Visekruna, A. Exploring the molecular mecha nisms underlying the protective effects of microbial SCFAs on intestinal tolerance and food allergy. Front. Immunol. 2020, 11, 1225. https://doi.org/10 .3389/fimmu.2020.01225.
33. Liu, B.; Zhu, X.; Cui, Y.; Wang, W.; Liu, H.; Li, Z.; Guo, Z.; Ma, S.; Li, D.; Wang, C.; et al. Consumption of Dietary Fiber from Different Sources during Pregnancy Alters Sow Gut Microbiota and Improves Performance and Reduces Inflammation in Sows and Piglets. mSystems 2021, 6, e00591-20. https://doi.org/10.1128/msystems.00591-20.
34. EFSA. Risks for animal health related to the presence of zearalenone and its modified forms in feed. EFSA J. 2017, 15, e04851. https://doi. org/10.2903/j.efsa.2017.4851.
35. Marin, D.E.; Pistol, G.C.; Neagoe, I.V.; Calin, L.; Taranu, I. Effects of zearalenone on oxidative stress and inflammation in weanling piglets. Food Chem. Toxicol. 2013, 58, 408–415. https:// doi.org/10.1016/j.fct.2013.05.033.
36. Ortega, A.D.S.V.; Szabó, C. Adverse Effects of Heat Stress on the Intestinal Integrity and Function of Pigs and the Mitigation Capacity of Dietary Antioxidants: A Review. Animals 2021, 11, 1135. https://doi.org/10.3390/ani11041135.
37. Lian, P.; Braber, S.; Garssen, J.; Wichers, H.J.; Folkerts, G.; Fink-Gremmels, J.; Varasteh, S. Beyond Heat Stress: Intestinal Integrity Disruption and Mechanism-Based Intervention Strategies. Nutrients 2020, 12, 734. https://doi. org/10.3390/nu12030734.

Salvador Oliver, Susana Mesonero, Fernando Cerro y David Espigares
Servicio Técnico Porcino, Ceva Salud Animal
Descarga el PDF
OObtener lechones sanos y vigorosos al destete es clave para el éxito en la producción porcina, y los primeros días de vida son decisivos. Enfermedades como la anemia ferropénica y la coccidiosis siguen siendo un reto, afectando al crecimiento y al bienestar animal. Hoy, contamos con soluciones inyectables que permiten prevenir ambas enfermedades a la vez, reducir el estrés y ahorrar tiempo en la granja.
ALa obtención de un lechón de calidad al destete es una de las claves para maximizar los resultados en la producción porcina. Son muchos los factores de los que depende conseguir lechones sanos, con buen apetito y edad y peso adecuados.
Los primeros días tras el nacimiento son críticos y marcarán la vida de los lechones. Por ello, es importante intensificar el control de las condiciones ambientales, reducir el estrés y evitar las enfermedades durante esos días.
La anemia ferropénica y la coccidiosis son dos patologías extendidas a nivel mundial y muy importantes durante la etapa de lactación de los lechones (Hinney et al., 2020).
Ambas enfermedades dan lugar a un retraso en el crecimiento, lo que impedirá obtener el anhelado lechón de calidad al destete.
Además, en los últimos años se ha incrementado la concienciación sobre bienestar animal, incluso en los animales de producción como el ganado porcino (Scollo et al., 2020), lo que está originando cambios en los requerimientos legales relativos a su cuidado.
A ESTE RESPECTO, EL NIVEL DE ESTRÉS ES UN INDICADOR DE BIENESTAR ANIMAL
Desde hace unos años se puede prevenir la anemia ferropénica y la coccidiosis utilizando un solo producto inyectable (Forceris™), ofreciendo la posibilidad de prevenir estas enfermedades a la vez que se minimizan los niveles de estrés durante su administración (Sperling et al., 2024), además de proporcionar beneficios adicionales como una mejor dosificación y un ahorro de tiempo en el manejo (Rodríguez et al., 2022).
La anemia ferropénica sigue siendo un problema en la industria porcina (Perri et al., 2016; De Backer et al., 2021; Pileri et al., 2021). Todas las granjas son susceptibles de sufrir este desorden, consistente en una enfermedad metabólica debida a una insuficiencia de hierro (Fe) en sangre.
El Fe es un componente esencial de la hemoglobina (Hb) en sangre y de la mioglobina en músculo, por lo que, sin suficiente cantidad de Fe, el cuerpo no puede producir la Hb necesaria en los glóbulos rojos o eritrocitos para la transferencia de oxígeno a las células.
Los factores que contribuyen al desarrollo de la anemia ferropénica se resumen en la Figura 1.
FIGURA 1
Factores que contribuyen a la anemia ferropénica del lechón.
RESERVAS CORPORALES de Fe MUY BAJAS con las que apenas se cubren las necesidades para los 2-3 pimeros días de vida.

El lechón presenta un CRECIMIENTO MUY RÁPIDO en las primeras etapas de vida.
FERROPÉNICA DEL LECHÓN
El lechón criado en intensivo NO tiene ACCESO a parques de TIERRA, los cuales serían una FUENTE NATIURAL de Fe.
Durante las 2-3 primeras semanas de vida el lechón toma como único alimento el CALOSTRO y la LECHE de la cerda, POBRES en Fe.
CONSECUENCIAS DE LA DEFICIENCIA DE HIERRO
A continuación, se enumeran algunas de las principales consecuencias clínicas y productivas asociadas a la deficiencia de Fe en los animales:
Disminución de las defensas, con menor número de leucocitos, neutrófilos y eosinófilos (Svoboda et al., 2004).
Trastornos digestivos y menor tasa de crecimiento (Dunningan et al., 2015).
A partir de la tercera semana de vida, disminución del apetito, palidez de las mucosas, pelo abundante y áspero, piel arrugada y blanca, y cabeza, orejas y cola caídas (Victor, 2012).
Posible disminución de la temperatura corporal y aumento de la frecuencia respiratoria con movimientos espasmódicos del diafragma tras ejercicios físicos moderados.
DIAGNÓSTICO DE LA ANEMIA FERROPÉNICA
La confirmación de la anemia ferropénica se realiza mediante un análisis laboratorial de los niveles de Hb y del valor de hematocrito en sangre. A este respecto, Hanl (2014) establece los siguientes valores de Hb:
Anemia clínica: <90 g/l.
Anemia subclínica: 90-110 g/l.
Valor óptimo: >110 g/l.
UNA FORMA SENCILLA Y EN TIEMPO REAL DE OBTENER LOS NIVELES DE Hb DE LOS LECHONES
ES TOMAR UNA GOTA DE SANGRE DE UNA VENA
AURICULAR Y MEDIR LA Hb CON UN FOTÓMETRO
PORTÁTIL
PREVENCIÓN DE LA ANEMIA FERROPÉNICA
Los lechones necesitan una suplementación de hierro exógeno durante la primera semana de vida para prevenir la deficiencia de hierro y la anemia.
La administración parenteral de Fe es el método de suplementación más común en granjas porcinas comerciales, aplicando una inyección intramuscular (IM) de 200 mg de Fe (gleptoferron o dextrano) durante los primeros 3 días de vida (Svoboda et al., 2005).
EL GLEPTOFERRON, A DIFERENCIA DEL Fe DEXTRANO, SE ABSORBE DE FORMA COMPLETA Y CASI INMEDIATA (95 % DEL Fe EN 24H)
También conviene recordar que, aunque es posible utilizar hierro oral, la mayor parte no se absorbe y se excreta a través de las heces.
SIENDO IMPORTANTE LA COCCIDIOSIS PORCINA?
La coccidiosis sigue siendo una patología susceptible de mejora en su control en granjas porcinas (Sperling et al., 2021).
El agente causal de la coccidiosis en cerdos es Cystoisospora suis (C. suis) y forma parte del grupo de patógenos entéricos que causan la diarrea en lactación.
C. SUIS ES UN PARÁSITO PROTOZOARIO
INTESTINAL (Joachim & Shrestha, 2019) QUE
OCASIONA DIARREA Y RETRASO EN EL CRECIMIENTO EN LOS LECHONES
La fuente más habitual de infección de los lechones son las plazas de partos donde se encuentran los ooquistes, muy resistentes en el medio ambiente. ciclo biológico es directo, no esporulados a través de las heces y éstos son ingeridos directamente por otros lechones.
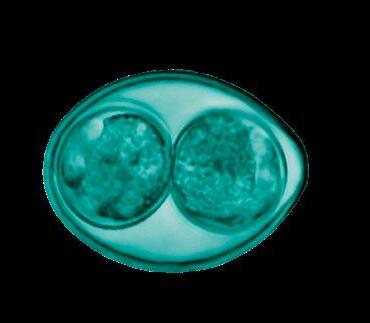
Hay evidencia de infección y excreción de ooquistes muy temprana, a partir de la primera semana de vida del lechón (Sotiraki et al., 2007), tras la ingestión de ooquistes esporulados (la esporulación ocurre en condiciones de elevada temperatura y humedad), que son los que tienen capacidad patógena.
Cuanto más temprana sea la infección de los lechones mayor será la excreción de ooquistes, el número de lechones infectados y la gravedad y duración de la diarrea (Mundt et al., 2003).
PRESENTACIÓN CLÍNICA DE LA COCCIDIOSIS
Generalmente, la clínica aparece a los 7-11 días de vida con diarrea pastosa amarilla-gris en una primera etapa, pudiendo evolucionar a diarrea semilíquida y líquida.
Los lechones normalmente siguen mamando, presentando pelo áspero, deshidratación y retraso en el crecimiento.
Aunque la mortalidad es baja si no se complica con infecciones bacterianas, cuando existen coinfecciones aumenta la mortalidad, tal y como ocurre en coinfecciones con Clostridium perfringens tipo A (Mengel et al., 2012).
A nivel lesional, C. suis produce una enteritis necrótica, principalmente en yeyuno e íleon.
DIAGNÓSTICO DE LA COCCIDIOSIS
El diagnóstico de la coccidiosis se realiza en base a:
La clínica compatible.
Diarrea que no responde a tratamientos antibióticos.
La detección de ooquistes usando técnicas de flotación o autofluorescencia (Joachim et al., 2018), o bien mediante RT-PCR (Bartelt et al., 2024).
PREVENCIÓN Y CONTROL DE LA COCCIDIOSIS
Para la prevención de la infección de C. suis se recomienda, junto a medidas de manejo (todo dentro-todo fuera) y de higiene (limpieza y desinfección), el tratamiento con toltrazurilo (TLZ) (Hinney et al., 2020).
EL TLZ HA DEMOSTRADO SER EFICAZ CONTRA
LA COCCIDIOSIS A UNA DOSIS ÚNICA DE 20 Mg/Kg, REDUCIENDO LA GRAVEDAD DE LOS SIGNOS
CLÍNICOS Y LA EXCRECIÓN DE OOQUISTES

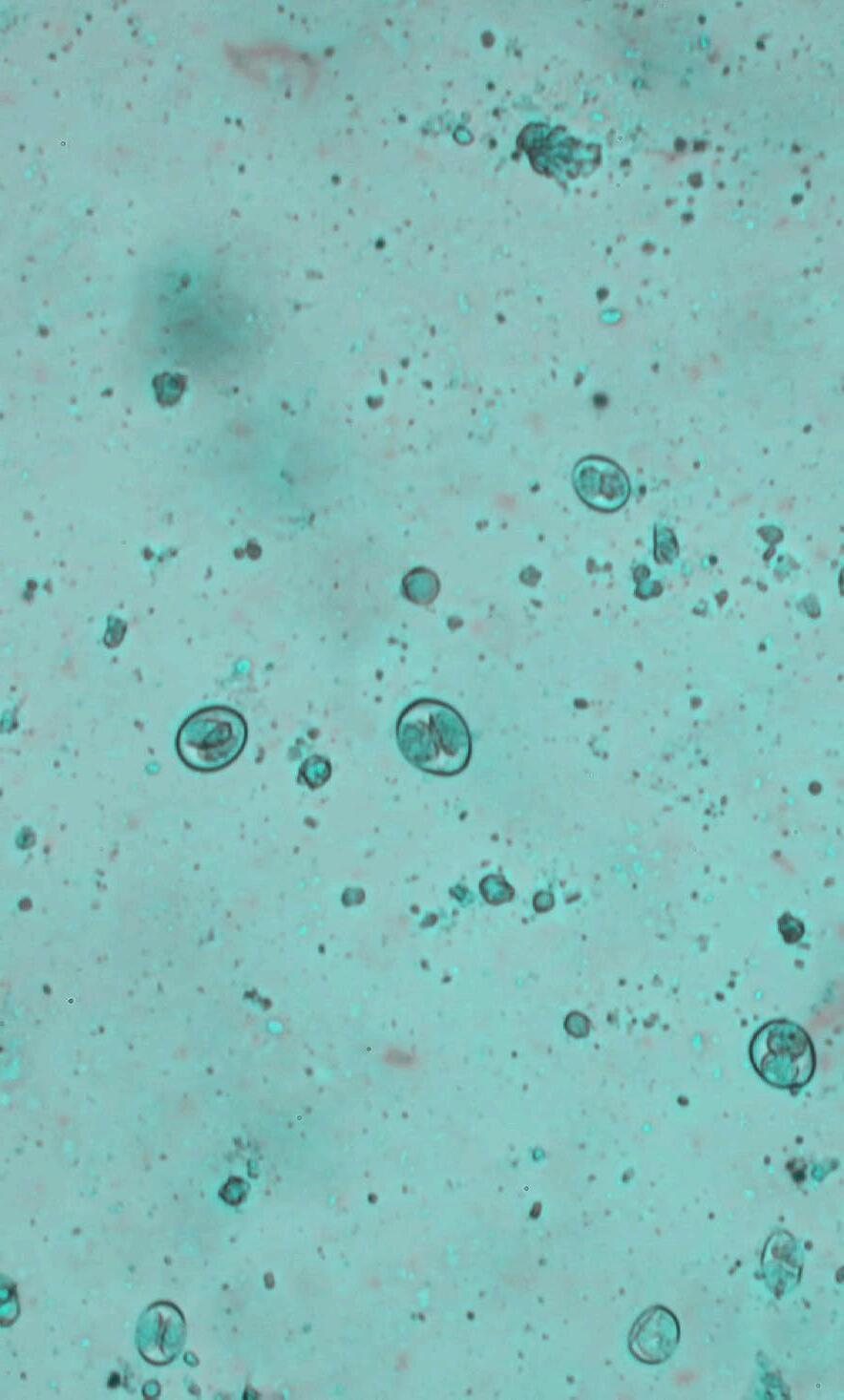
Clásicamente, la forma más extendida en la prevención de la anemia ferropénica y la coccidiosis era el uso de Fe (dextrano o gleptoferron), aplicado vía intramuscular, y TLZ administrado vía oral, ambos tratamientos realizados durante los primeros días de vida (Joachim et al., 2018).
Desde hace unos años, se viene utilizando un producto combinado inyectable (Forceris™) compuesto por Fe y TLZ (133,4 mg gleptoferron/ml; 30 mg TLZ/ml), que se administra vía intramuscular entre las 24 y 96h de edad, en una sola dosis (1,5 ml).
A continuación, se exponen los resultados de algunos de los estudios publicados recientemente en los que se compararon los resultados del producto combinado inyectable (gleptoferron + TLZ) aplicado a las 24-96 h de edad frente a diferentes alternativas administradas con los protocolos habituales de las granjas.
De Jonghe et al. (2024), Cornelis et al. (2024) y Vallejo et al. (2024) evaluaron el impacto sobre el nivel de Hb al final del periodo de lactación, tras la aplicación de Fe dextrano IM frente al producto combinado IM (gleptoferron + TLZ).
TABLA 1
Nivel de Hb en lechones tratados con producto Fe convencional frente a producto combinado.
Estudio
De Jonghe et al. (2024)
Cornelis et al. (2024)
Vallejo et al. (2024)
granjas (7 granjas
y 3 granjas gleptoferron)
Como se observa en la Tabla 1, el porcentaje de animales anémicos fue significativamente menor en los lechones tratados con el producto combinado
Cornelis et al. (2024) comprobaron que los niveles de Hb eran más homogéneos en los lechones tratados con el producto combinado (Gráfica 1).
Vallejo et al. (2024) midieron el efecto sobre el crecimiento de los animales en el periodo de lactación y observaron que los lechones tratados con el producto combinado (gleptoferron+TLZ) crecieron significativamente más, fueron 580 g más pesados (7,96±1,35 vs 7,38±1,22) que el grupo al que se le administró Fe dextrano (IM) y TLZ oral.
GRÁFICA 1
Nivel de Hb en lechones tratados con producto Fe convencional frente a producto combinado (Adaptado de Cornelis et al., 2024)
Granja A Granja C Granja B Granja D Granja E Granja F Granja G Granja H Granja I Granja J
Producto hierro convencional (7 granjas Fe dextrano, 3 granjas gleptoferron)
Producto combinado
Diness et al. (2024) centraron su trabajo en analizar:
El número de ooquistes de C. suis (coccidios)/g de heces.
La consistencia de las heces (asociada a la incidencia y gravedad de la diarrea).
El crecimiento de los lechones durante la etapa de lactación.
En los animales tratados con el producto combinado (gleptoferron + TLZ)
IM se detectaron menos ooquistes/g de heces y menos incidencia de diarrea que en los tratados con gleptoferron IM y TLZ oral (Gráficas 2 y 3), observándose también una mejora significativa en la ganancia media diaria (GMD) (+20 g/d).
GRÁFICA 2
Media ooquistes/g heces/camada (Adaptado de Diness et al., 2024)
GRÁFICA 3
Media puntuación heces/camada (Adaptado de Diness et al., 2024).
En otro estudio, Ramis et al. (2024) aunque no evidenciaron diferencias en el peso al destete, como ocurre en multitud de trabajos previos, observaron un mayor peso y una mayor GMD en el periodo de transición en los lechones tratados con el producto combinado (Forceris™) IM frente a los que se aplicó TLZ oral (Control).
Estos resultados sugerían una infección tardía por C. suis, que fue confirmada laboratorialmente.
Las diferencias observadas al final del periodo de transición se mantuvieron durante la etapa de cebo, sin que hubiese crecimiento compensatorio.
Los animales tratados con producto combinado (gleptoferron + TLZ) IM pesaban significativamente más (+6 kg) que los tratados con TLZ oral, lo que supuso una mejora significativa de la GMD global (+35 g/d) desde el nacimiento al sacrificio (Gráfica 4).
GRÁFICA 4
Resultados productivos de Forceris vs Control (Adaptado de Ramis et al., 2024).
+6 Kg AL SACRIFICIO
En nuestra práctica diaria nos encontramos con múltiples desafíos que nos obligan a establecer prioridades y tomar decisiones.
REPERCUTIRÁN
POSITIVAMENTE Y DE FORMA EXPONENCIAL EN ETAPAS
POSTERIORES DE LA VIDA DE LOS ANIMALES
Peso destete Peso 50 d (entrada cebo)
Peso 171 d (final cebo)
Los resultados de los estudios presentados en este artículo confirman que aún existe área de mejora en el control de la anemia ferropénica y la coccidiosis porcina.
Cada vez existen más trabajos que ponen de manifiesto que, administrando un producto combinado (Forceris™) vía intramuscular de forma temprana (24-96 h de edad) y en una sola dosis, se minimiza el porcentaje de lechones anémicos a la vez que se reduce la excreción de ooquistes de coccidios, disminuyendo la incidencia de diarrea y mejorando los crecimientos en todas las fases productivas, especialmente durante el periodo de lactación.
+35 g/d NACIMIENTOSACRIFICIO




Prevención de la coccidiosis y la anemia ferropénica del lechón en una sola inyección
Tratamiento inyectable único
Disminuye la excreción de ooquistes y previene la diarrea Cómodo. Ahorra tiempo
Forceris™ 30 mg/ml + 133 mg/ml. Suspensión inyectable para lechones. Composición: cada ml contiene: sustancias activas: toltrazurilo 30,0 mg, hierro (iii) 133,4 mg, (como gleptoferron 355,2 mg). Excipientes: fenol 6,4 mg. Especies de destino: porcino (lechones 24 a 96 horas después del nacimiento). Indicaciones de uso: para la prevención simultánea de la anemia por deficiencia de hierro y la prevención de los signos clínicos de la coccidiosis (diarrea) así como la reducción de la excreción de ooquistes en lechones en granjas con antecedentes confirmados de coccidiosis causada por cystoisospora suis Contraindicaciones: no usar en lechones de los que se sospecha sufren una deficiencia de vitamina e y/o selenio. Advertencias especiales: como con otros parasiticidas, el uso frecuente y repetido de antiprotozoarios de la misma clase puede conllevar el desarrollo de resistencias. Se recomienda administrar a todos los lechones de cada camada. Una vez que los signos clínicos de coccidiosis sean evidentes, ya se habrá producido un daño en el intestino delgado. Por lo tanto, el producto debe administrarse a todos los animales antes del inicio esperado de los signos clínicos, es decir, en el período de prepatencia. Las medidas higiénicas pueden reducir el riesgo de coccidiosis porcina. Por ello, se recomienda mejorar simultáneamente las condiciones higiénicas en las instalaciones, especialmente la sequedad y la limpieza. El medicamento está recomendado en lechones que pesen entre 0,9 y 3 kg. Precauciones especiales: no debe excederse la dosis recomendada, dado el relativamente bajo margen de seguridad para el medicamento veterinario. El medicamento no debe administrarse más de una vez. No se recomienda usar el medicamento veterinario en lechones que pesen menos de 0,9 kg. Únicamente use este medicamento veterinario en granjas con antecedentes de cystoisosporasuisconfirmados. El veterinario responsable debe tener en cuenta los resultados de los exámenes clínicos y/o analíticos de muestras fecales y/o en los hallazgos histológicos que confirmaron la presencia de c.Suisen episodios anteriores de infección en la granja. Las personas con hipersensibilidad conocida al hierro (como complejo gleptoferrón), al toltrazurilo o a cualquiera de los excipientes deben evitar todo contacto con el medicamento veterinario. La exposición al medicamento veterinario puede causar irritación en ojos o efectos adversos en la piel. Evite el contacto de la piel y los ojos con el producto. En caso de exposición accidental en piel u ojos, lave el área afectada con agua. La autoinyección accidental puede causar reacciones locales como irritación, granulomas o reacciones anafilácticas graves en personas sensibles. Se debe tener cuidado para evitar la autoinyección accidental. En caso de autoinyección accidental, consulte con un médico inmediatamente y muéstrele el prospecto o la etiqueta. Este medicamento puede ser perjudicial para el feto. Las mujeres embarazadas o que tengan intención de concebir, deben evitar el contacto con el medicamento veterinario, especialmente la autoinyección accidental. Lávese las manos después del uso. Reacciones adversas: se han observado muertes en lechones tras la administración parenteral de inyecciones de hierro en muy raras ocasiones. Estas muertes se han relacionado con factores genéticos o deficiencias en vitamina e y/o selenio. Se han notificado muertes de lechones que se han atribuido a una mayor susceptibilidad a la infección debido al bloqueo temporal del sistema reticuloendotelial. Pueden producirse reacciones de hipersensibilidad. Posología y vía de administración: vía intramuscular. Agitar bien (durante 20 segundos) antes de usar. La dosis recomendada es de 45 mg de toltrazurilo y 200 mg de hierro por lechón, equivalentes a 1,5 ml de Forceris™ por lechón, que se administrará una vez, en una única inyección intramuscular detrás de la oreja, entre 24 y 96 horas después del nacimiento). Tiempos de espera: carne: 70 días. Incompatibilidades principales: en ausencia de estudios de compatibilidad, este medicamento veterinario no debe mezclarse con otros medicamentos veterinarios. Período de validez: período de validez del medicamento veterinario acondicionado para su venta: 3 años. Período de validez después de abierto el envase primario: 28 días. Precauciones especiales de conservación: este medicamento veterinario no requiere condiciones especiales de conservación. Formatos: caja con 1 vial de 250 ml. Precauciones especiales para la eliminación del medicamento veterinario no utilizado o, en su caso, los residuos derivados de su uso: todo medicamento veterinario no utilizado o los residuos derivados del mismo deberán eliminarse de conformidad con las normativas locales. Titular de la autorización de comercialización: Ceva Santé Animale, 10 Av. De la Ballastière, 33500 Libourne, Francia. Número de la autorización de comercialización: EU/2/19/235/001–003. Ceva Salud Animal - Avenida Diagonal, 609-615, 9ª planta - 08028 Barcelona - Tel: +34 902 367 218 - www.ceva.es

Descarga el PDF


treptococcus suis es un patógeno de gran impacto en la producción porcina y comprender el papel que juega la formación de biofilms en su persistencia y virulencia resulta clave para mejorar su control. Este estudio analiza 240 aislados procedentes de granjas españolas, explorando la relación entre serotipo, factores de virulencia y capacidad de formar biofilms. Los hallazgos aportan nuevas pistas para diseñar estrategias de prevención más eficaces.







Oscar Mencía-Ares, Rubén Miguélez Pérez, César B. Gutiérrez Martín, Alba González Fernández, Máximo Petrocchi Rilo, Mario Delgado García, Ana I. Pastor Calonge, Carmen Arenas Fernández y Sonia Martínez Martínez Grupo BACRESPI. Departamento de Sanidad Animal, Universidad de León
Streptococcus suis es una bacteria que está presente como parte de la microbiota comensal de los cerdos, habitando en el tracto respiratorio, el intestino, la piel y la zona genital. Generalmente, esta colonización ocurre por transmisión desde la cerda a los lechones durante el periodo perinatal.
Las situaciones de estrés generadas por un manejo deficiente o las malas condiciones ambientales pueden facilitar que S. suis traspase las barreras mucosas de los cerdos, ingresando en el torrente sanguíneo y escapando de la respuesta inmunitaria.
Cuando esto ocurre, la bacteria puede diseminarse por el organismo y ocasionar alteraciones graves, como:
Artritis
Endocarditis
Meningitis
Neumonía
Septicemia y muerte súbita
Comensal en tracto respiratorio, intestino, piel y genitales

Circulación sanguínea

Transmisión vertical de cerda a lechones en el periparto


y muerte súbita
Pese a su relevancia, no se comprende del todo qué mecanismos llevan a S. suis a pasar de ser un comensal a uno de los patógenos con mayor impacto económico en la producción porcina española.

Uno de los mayores desafíos para prevenir y controlar las enfermedades causadas por S. suis radica en su enorme diversidad genética, que puede apreciarse incluso entre cepas pertenecientes a un mismo serotipo.
Hasta el momento, se han descrito 19 serotipos (1-19, 21, 23-25, 27-31 y 1/2) basados en diferencias de los antígenos de su cápsula polisacárida. Además, se han identificado más de un centenar de factores que podrían contribuir a su virulencia.
Sin embargo, aparte de la importancia bien demostrada de su cápsula, no se ha descrito aún la existencia de otros factores indispensables para causar la enfermedad.
Entre los candidatos más relevantes se incluyen:
Diversas proteínas de adhesión o de superficie, como la proteína liberada por muramidasa (MRP), el factor extracelular (EF) o la gliceraldehído-3-fosfato deshidrogenasa (GAPDH).
Algunas toxinas, como la suilisina.
La enzima S-ribosilhomocisteinasa (LuxS), que está implicada en la comunicación entre bacterias.
En los últimos años, se ha prestado cada vez más atención a un aspecto fundamental de la patogenia y la persistencia de S. suis: la formación de biopelículas o biofilms.
Este proceso no solo refuerza la supervivencia de la bacteria, sino que también aumenta su resistencia frente a los tratamientos antibióticos, desempeñando así un papel clave en la colonización de los órganos y tejidos del cerdo.
En términos generales, un biofilm puede definirse como una comunidad de células bacterianas —de la misma o distintas especies— rodeadas de una matriz extracelular que ellas mismas producen y adheridas con fuerza a diferentes superficies (vivas o inertes).
Esta organización otorga a S. suis una mejor tolerancia a los antimicrobianos, al estrés ambiental y a la respuesta inmunitario del hospedador, lo que suele derivar en infecciones más crónicas y difíciles de combatir.
A pesar de que la investigación sobre los biofilms en S. suis ha aumentado desde que se describieron por primera vez en 2007 (Grenier et al., 2009), aún queda mucho por descubrir acerca de los mecanismos moleculares que rigen su formación.
Dada la relevancia de S. suis en la producción porcina y el posible papel de los biofilms en su persistencia, el objetivo principal de este estudio fue evaluar la capacidad de formación de biofilms in vitro y caracterizar diversos factores de virulencia en aislados de S. suis procedentes de granjas españolas y pertenecientes a diferentes serotipos.
Con ello, se pretende profundizar en los mecanismos que determinan la virulencia de esta bacteria y sentar las bases para futuras estrategias de prevención y control más eficaces.
Para conocer la distribución de los factores de virulencia de S. suis en granjas porcinas españolas, se analizaron 240 aislados obtenidos entre 2020 y 2024 a partir de casos clínicos que afectaban al sistema nervioso central, los pulmones o las articulaciones. En total, se incluyeron 16 serotipos distintos.
FRECUENCIA DE GENES DE VIRULENCIA
Mediante PCR, se determinó la presencia de cinco genes de virulencia principales (epf, gapdh, luxS, mrp y sly), detectándose al menos uno de ellos en la gran mayoría de aislados.
El gen más frecuente fue luxS (90 %), seguido de gapdh (80 %), epf (64,6 %), mrp (64,2 %) y sly (62,5 %) (Gráfica 1).
GRÁFICA1
Frecuencia (%) de cinco genes de virulencia (epf, gapdh, luxS, mrp, sly) en 240 aislados de Streptococcus suis obtenidos en granjas porcinas españolas.
UN 33,8 % DE LOS AISLADOS
CINCO GENES A LA VEZ, MIENTRAS QUE EL 24,2 %
PRESENTABA COMBINACIONES DE CUATRO DE ELLOS
Estos datos concuerdan con investigaciones previas realizadas en Europa y Asia, donde la ausencia de estos genes se asocia más a cepas procedentes de cerdos sanos o portadores (Louise Prüfer et al., 2019; Meekhanon et al., 2017).
PATRÓN DE DISTRIBUCIÓN DE GENES DE VIRULENCIA
Se identificaron patrones relevantes al comparar la distribución de estos genes según el serotipo:
Los serotipos 1, 2 y 9 presentaron una asociación significativa (p < 0,05) con los genes epf, sly y mrp.
El serotipo 7 se caracterizó por la ausencia de los genes epf y sly
Este resultado concuerda con un estudio previo efectuado en granjas porcinas alemanas (Rieckmann et al., 2018).
Estos hallazgos ponen de manifiesto la complejidad de la patogenia de S. suis, ya que ninguna combinación genética puede explicar por sí sola el comportamiento de la bacteria. Por ello, además del conjunto de factores de virulencia, es imprescindible considerar otros mecanismos implicados en la infección, como la formación de biofilms.
La capacidad de formación de biofilms se evaluó mediante un ensayo in vitro con tinción de cristal violeta, que cuantifica la biopelícula midiendo la densidad óptica (DO), expresándose como diferencia con respecto al control negativo (DC) (Gráfica 2).
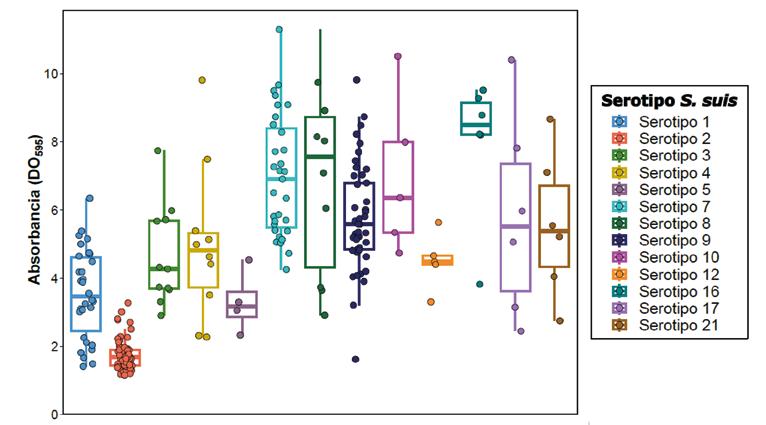
serotipo 2 (DC = 1,77 ± 0,46), especialmente en comparación con otros serotipos habitualmente relacionados con infecciones porcinas (p < 0,05). Las imágenes de microscopía electrónica (Figura 1B) confirmaron dicha limitación.
Dado que el serotipo 2 es uno de los más frecuentes en los brotes de S. suis y desempeña un papel relevante en las infecciones humanas a nivel mundial, estos hallazgos apuntan a que la formación de biofilm no resulta imprescindible para su patogénesis.
Otros serotipos clínicamente relevantes, como el serotipo 7 (DC = 6,98 ± 2,33) y el serotipo 9 (DC = 5,77 ± 1,56), demostraron una mayor formación de biofilm (Figuras 1C y 1D).
Concretamente, el serotipo 9, reconocido por su importancia y prevalencia en la producción porcina europea, mantuvo una formación de biofilm destacada, independientemente de los genes de virulencia que portase.

GRÁFICA 2
Diagrama de cajas que ilustra la formación de biofilms en 240 aislados Streptococcus suis procedentes de granjas porcinas españolas, agrupados por serotipo. Cada punto representa un aislado individual. Las líneas horizontales de cada recuadro señalan el primer cuartil, la mediana y el tercer cuartil, y las líneas se extienden hasta 1,5 veces la distancia intercuartílica.
LA PERSISTENCIA DE CIERTOS SEROTIPOS EN LAS
FIGURA 1
Imágenes de microscopía electrónica de barrido que ilustran la formación de biofilms en aislados de Streptococcus suis pertenecientes a los serotipos 1, 2, 7 y 9.
Diagrama de cajas que ilustra la formación de biofilms en 240 aislados de Streptococcus suis granjas porcinas españolas, agrupados por la presencia de los cinco factores de virulencia indicados. Cada punto representa un aislado individual. Las líneas horizontales de cada recuadro señalan el primer cuartil, la mediana y el tercer cuartil, y las líneas se ex tienden hasta 1,5 veces la distancia intercuartílica. Las comparaciones entre grupos se representan con asteriscos: ** (p < 0,01); **** (p < 0,0001); ns (no significativo).
Un rasgo frecuente en las infecciones de S. suis que cursan con formación de biofilm es su menor virulencia.
En nuestro estudio, los aislados que portaban los genes epf, mrp y sly mostraron una reducción significativa (p < 0,05) en su capacidad de formar biofilm (Gráfica 3).
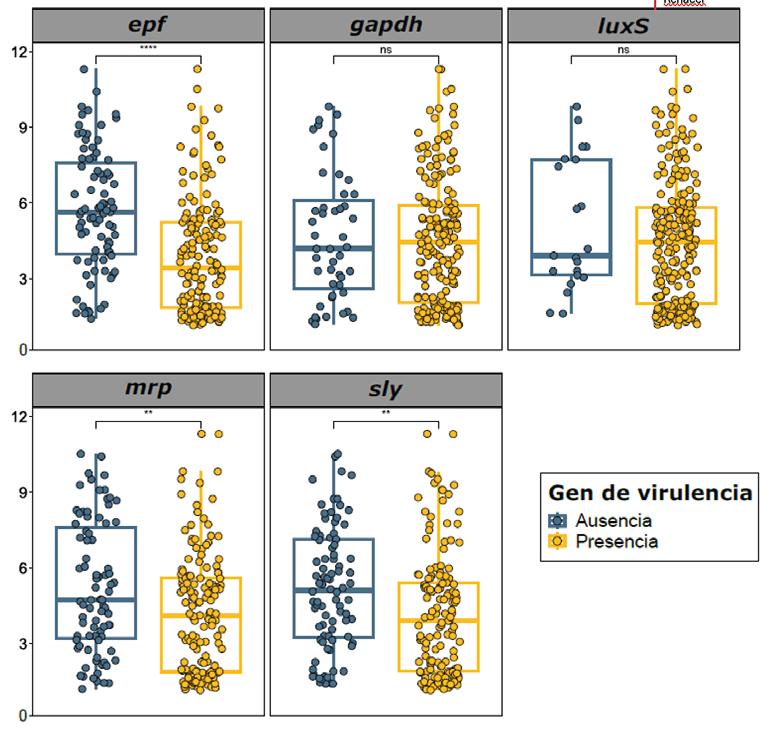
Los aislados del serotipo 2 positivos al gen epf y los del serotipo 9 portadores del gen sly evidenciaron una menor capacidad de producción de biofilm.
Las cepas del serotipo 1 portadoras del gen epf exhibieron un incremento significativo en su formación de biopelículas.
Este último hallazgo coincide con la hipótesis de que las cepas más virulentas pueden desarrollar una gran capacidad de formación biofilm. Aun así, estas variaciones dependen más de la regulación y expresión de los genes en estado de biofilm que de su mera presencia.
Este estudio pone de manifiesto la gran diversidad existente en los factores de virulencia y en la capacidad de formación de biofilm de S. suis en las granjas porcinas españolas, influida en gran medida por el serotipo.
Mientras que algunos, como el serotipo 2, generan biofilms de forma limitada, otros —entre ellos los serotipos 1, 7 y 9— forman biopelículas más sólidas sin depender necesariamente de un amplio repertorio de genes de virulencia.
Estos hallazgos sugieren que la formación de biofilm podría desempeñar un papel determinante en la persistencia de S. suis y en la gravedad de los brotes.
Para profundizar en estos mecanismos, los futuros estudios se centrarán en comparar la expresión génica de las cepas con diferentes capacidades de formar biofilms, lo que permitirá entender mejor cómo se relacionan estos procesos con la virulencia.
En última instancia, este conocimiento contribuirá al diseño de estrategias de prevención y control más eficaces, ayudando a minimizar el impacto económico de S. suis en la producción porcina.
Adaptado de: Miguélez-Perez et al. Biofilm formation in Streptococcus suis: in vitro impact of serovars and assessment of coinfections with other porcine respiratory disease complex bacterial pathogens (2024). https:// doi.org/10.1186/s13567-024-01412-9.
BIBLIOGRAFÍA
Grenier, D., Grignon, L., & Gottschalk, M. (2009). Characterisation of biofilm formation by a Streptococcus suis meningitis isolate. Veterinary Journal, 179(2), 292–295. https://doi.org/10.1016/J. TVJL.2007.09.005
Louise Prüfer, T., Rohde, J., Verspohl, J., Rohde, M., De Greeff, A., Willenborg, J., & Valentin-Weigand, P. (2019). Molecular typing of Streptococcus suis strains isolated from diseased and healthy pigs between 1996-2016. PLOS ONE, 14(1), e0210801. https://doi.org/10.1371/JOURNAL. PONE.0210801
Meekhanon, N., Kaewmongkol, S., Phimpraphai, W., Okura, M., Osaki, M., Sekizaki, T., & Takamatsu, D. (2017). Potentially hazardous Streptococcus suis strains latent in asymptomatic pigs in a major swine production area of Thailand. Journal of Medical Microbiology, 66(5), 662–669. https://
doi.org/10.1099/JMM.0.000483
Rieckmann, K., Seydel, A., Szewczyk, K., Klimke, K., Rungelrath, V., & Baums, C. G. (2018). Streptococcus suis cps7: An emerging virulent sequence type (ST29) shows a distinct, IgM-determined pattern of bacterial survival in blood of piglets during the early adaptive immune response after weaning. Veterinary Research, 49(1), 48. https:// doi.org/10.1186/S13567-018-0544-8
Wang, H., Fan, Q., Wang, Y., Yi, L., & Wang, Y. (2024). Rethinking the control of Streptococcus suis infection: Biofilm formation. Veterinary Microbiology, 290, 110005. https://doi.org/10.1016/J. VETMIC.2024.110005
Wang, Y., Zhang, W., Wu, Z., & Lu, C. (2011). Reduced virulence is an important characteristic of biofilm infection of Streptococcus suis. FEMS Microbiology Letters, 316(1), 36–43. https://doi. org/10.1111/J.1574-6968.2010.02189.X

Guillermo Ramis y Antonio Muñoz
Departamento
de Producción
Animal de la Facultad de Veterinaria de la Universidad de Murcia
LLDescarga el PDF
a interacción entre patógenos no es un fenómeno reciente. De hecho, desde hace décadas conocemos cómo la acción patogénica de un determinado patógeno puede favorecer la acción de otro. Lo que inicialmente llamamos sinergias terminamos denominándolo complejos, en un intento de explicar cómo la intrincada trama de acciones de los distintos patógenos conlleva un agravamiento significativo de la enfermedad resultante. Sin embargo, aunque hablemos de complejo respiratorio o de complejo entérico, con frecuencia abordamos los patógenos como si estuvieran aislados y actuando de forma singular.
En este artículo, trataremos de desentrañar las sinergias existentes entre algunos patógenos entéricos, concretamente Rotavirus, Escherichia coli y Clostridium spp.
Como ya mencionamos, nos centraremos en tres patógenos que pueden interactuar sinérgicamente en un momento dado.
ROTAVIRUS
El primero, es el Rotavirus, un virus ARN que ha experimentado una reemergencia en los últimos años, siendo endémico y muy resistente en el ambiente.
Presenta varios serotipos, siendo predominantes en España los serotipos A y C (RVA y RVC), que afectan a lechones de distintas edades.
Se pueden observar infecciones concomitantes de varios serotipos e, incluso, se puede encontrar el virus en animales de cebo, aunque esto no implica necesariamente que tenga relevancia patológica en ese momento.
La capacidad de producir daño depende de dos elementos:
Los factores de adhesión o fimbrias (F4, F5, F18, F41, F6 intimina)
La producción de endotoxinas (verotoxinas: VT1 y VT2) y exotoxinas (enterotoxinas: STa, STb y LT).
CLOSTRIDIUM SPP.
COMPARTEN CON LOS LECHONES
ESCHERICHIA COLI EL 80 % DE LAS CEPAS DE RVA QUE AFECTAN A LOS NIÑOS SE
Escherichia coli, generalmente enterotoxigénico (ETEC), es bien conocido, pudiendo ocasionar hasta cinco cuadros clínicos diferentes a diversas edades:
Diarrea neonatal
Diarrea de lechones jóvenes
Diarrea postdestete
Enfermedad de los edemas
Septicemia colibacilar
LAS FIMBRIAS SON IMPRESCINDIBLES PARA QUE E. COLI EJERZA SU ACCIÓN Y PUEDA ADHERIRSE AL EPITELIO Y FORMAR COLONIAS
Finalmente, del complejo de Clostridium cabe citar a:
Forman parte del acervo de patógenos que siempre se han incluido en los diferenciales de lechones.
C. perfringens tipo A puede provocar diarrea, alteraciones en el crecimiento y muertes súbitas.
C. perfringens tipo C puede inducir hasta cuatro cuadros clínicos (hiperagudo, agudo, crónico y subagudo), produciendo desde muertes súbitas hasta diarreas sanguinolentas o de color azafrán.
Ha emergido recientemente siendo además una zoonosis.
Produce un cuadro similar al de C. perfringens, con alta morbilidad.

Las sinergias que se pueden producir entre patógenos se basan en alteraciones morfológicas, funcionales, fisiológicas o del sistema inmunitario.
En general, al romperse un mecanismo de defensa, otros patógenos pueden aprovechar la situación y sumarse a la enfermedad provocada por uno o varios microorganismos.
Las bacterias, por ejemplo, comparten la característica de ser proteolíticas, lo que significa que su principal substrato son las proteínas.
Esto representa un riesgo considerable en el intestino de lechones cuando reciben dietas ricas en proteínas.
Otro factor que tienen en común las bacterias es que ambos géneros producen toxinas, que son fundamentales para ejercer su acción patogénica.
MECANISMOS DE DEFENSA SUSCEPTIBLES DE SER VULNERADOS
Comenzando por la boca se encuentra el efecto de la saliva, que tiene cierta capacidad antiséptica. Posteriormente, el ambiente gástrico compuesto por ácido clorhídrico (HCl), pepsina y moco, que dificulta la entrada de patógenos.
En el intestino existen varios mecanismos de defensa:
Las enzimas pancreáticas
Los ácidos biliares
El moco
La integridad y motilidad intestinal
El microbioma
El sistema inmunitario asociado al tracto digestivo, que constituye la mayor parte de la inmunidad en el cerdo, siendo un sistema clave en la defensa contra los patógenos.
MECANISMOS MÁS VULNERABLES Y QUE FAVORECEN LAS SINERGIAS INCLUYEN LA MOTILIDAD E INTEGRIDAD INTESTINAL, LA MICROBIOTA Y EL SISTEMA INMUNITARIO
Una de las formas más importantes de sinergia es la inducción de alteraciones morfológicas e histológicas.
Un ejemplo clásico es la acción del Rotavirus A (RVA), que produce atrofia del epitelio intestinal, lo que se traduce en un achatamiento, acortamiento y fusión de las vellosidades intestinales.
Como consecuencia, los receptores de E. coli en el epitelio intestinal quedan más expuestos, siendo más fácil para la bacteria encontrarlos.
En todos los casos, y por la acción de todos los patógenos mencionados, estos procesos conducen a un síndrome de mala absorción, lo que incrementa, más si cabe, la cantidad de proteína no digerida en el intestino. Esto, a su vez, favorece el crecimiento de bacterias proteolíticas y genera un círculo vicioso que agrava la enfermedad.
INTEGRIDAD INTESTINAL
INTEGRIDAD INTESTINAL

Evidentemente cualquiera de estos patógenos alterará la integridad intestinal, entendida como el cierre entre células epiteliales del intestino que impide la translocación por vía paracelular de cualquier elemento.

¿POR QUÉ EXISTE LA BARRERA INTESTINAL?
La barrera intestinal regula el paso de moléculas al interior del organismo a través de receptores, canales y trasportadores en la superficie de las células epiteliales, asegurando que la absorción ocurra principalmente por vía transcelular. En contraste, la vía paracelular está limitada al paso de agua, pequeños azúcares y a algunos iones.
Sin embargo, la acción de cualquiera de estos patógenos produce una alteración de las uniones estrechas (conglomerado de proteínas como claudinas, ocludinas, JAM y c-adherina vinculadas al citoesqueleto a través de la actina).
Esta alteración facilita la penetración de endotoxinas de E. coli, las toxinas de Clostridium e, incluso, la translocación de E. coli, lo que puede derivar en un cuadro septicémico que puede acompañar a cualquiera de los otros cuadros.
RVA, por su parte, también puede aprovechar esta pérdida de integridad intestinal para agredir a las células por otras vías.
FIGURA 1. Representación esquemática de las vías de transporte intestinal y de la pérdida de integridad de la barrera epitelial. En condiciones normales, el paso de moléculas ocurre de forma regulada por vía transcelular o paracelular. La alteración de las uniones estrechas facilita la paso de patógenos, toxinas y otros antígenos desde el lumen intestinal hacia la circulación, favoreciendo la translocación bacteriana y el desencadenamiento de respuestas inmunitarias no deseadas.
Vía transcelular
Paso exclusivo de agua, pequeños azucares y algunos iones.
Intervención de proteínas de uniones estrechas (claudinas, ocludinas, JAM y c-adherina).
Pérdida de la integridad intestinal
Paso de patógenos, toxinas y otros antígenos por vía paracelular desde el lumen intestinal a la circulación sanguínea
Vía paracelular
Absorción de moléculas complejas. Intervención de receptores, canales y transportadores de superficie.
MOCO INTESTINAL
MOCO INTESTINAL
El moco intestinal es un elemento constitutivo de la defensa intestinal. En este contexto, la relación entre E. coli y la mucina es particularmente interesante.
Un ejemplo claro de interacción con la mucina es el de Lawsonia intracellularis, que inhibe la expresión del gen MUC2, responsable de la producción de moco en el momento en que la bacteria empieza a diseminarse por el tejido.
Este mecanismo es ventajoso para la bacteria, ya que el moco dificulta su desplazamiento entre las células epiteliales.
En el caso de E. coli, la relación con el moco es bivalente.
Durante el pico de la infección, ETEC puede inducir una sobreexpresión de MUC2, lo que favorece la formación de colonias al facilitar su adhesión al epitelio.
Por otro lado, se ha identificado una metaloproteasa en ETEC altamente conservada que degrada la mucina, permitiendo una mayor interacción con los enterocitos y las células inmunitarias, lo que desencadena respuestas inflamatorias en el intestino.
MOTILIDAD INTESTINAL
MOTILIDAD INTESTINAL
Otra consecuencia de la atrofia de las vellosidades inducida por RVA y E. coli es la reducción de la motilidad intestinal, un mecanismo clave para la defensa contra patógenos, ya que dificulta notablemente su adhesión a los receptores específicos.
Así, cuando el intestino pierde motilidad por cualquier circunstancia, E. coli y otros patógenos tienen mayor facilidad para encontrar su punto de adhesión y colonizar el epitelio intestinal.
MICROBIOTA INTESTINAL SISTEMA INMUNITARIO
MICROBIOTA INTESTINAL SISTEMA INMUNITARIO
La interacción entre patógenos y la microbiota intestinal es muy compleja y requeriría de un artículo entero dedicado a ella.
Lo cierto es que, en muchas ocasiones, las enfermedades entéricas asociadas a patógenos comienzan con una disbiosis, es decir, una desviación de la microbiota normal (eubiosis).
Múltiples factores pueden producir un desequilibrio y desembocar, por ejemplo, en la proliferación de microbiota proteolítica (entre la que se encuentran géneros como Brachyspira, Lawsonia, Clostridium, Escherichia o Salmonella).
UNA MAYOR DIVERSIDAD DE LA MICROBIOTA SE ASOCIA CON UNA MEJOR SALUD INTESTINAL
Sin embargo, se ha demostrado que RVA reduce esta diversidad, mientras que ETEC disminuye la abundancia de Lactobacillus y favorece el crecimiento de proteobacterias como Shigella o Helicobacter
Por último, es importante señalar la relación de los patógenos con el sistema inmunitario y cómo su acción conjunta puede generar desviaciones cuantitativas y cualitativas en la respuesta inmunitaria, favoreciendo que otros se unan a la acción patogénica conjunta.
Cualquiera de los 3 patógenos principales mencionados a lo largo de este artículo, inducen una respuesta inmunitaria inicial basada en la producción de TNFα
A partir de ahí, pueden desencadenarse respuestas mediadas por interferones, IL12, IL6, IL8, entre otras citocinas.
Esta activación inmune puede comprometer la integridad intestinal, tal y como se ha demostrado en humanos. Así, la acción de IFN-γ puede provocar una redistribución de algunas proteínas estructurales de las uniones estrechas o reguladoras de su apertura como la zonulina
Los patógenos no actúan de manera aislada, sino que forman parte de un sistema ecológico donde la acción de cualquiera de ellos o la influencia de multitud de factores desencadenará un efecto patogénico.
Es esperable que, una vez un patógeno actúe, le abra la posibilidad de acción a otros muchos.
LA ROTURA DE MECANISMOS DE DEFENSA EN FAVOR PROPIO POR UN AGENTE HACE
QUE OTROS PATÓGENOS, QUE QUIZÁ DE OTRO
MODO NO PODRÍAN HACER DAÑO, EJERZAN

SIMULTÁNEAMENTE SU ACCIÓN
Si ya es malo tener un virus o una bacteria actuando, cuánto peor será tener varios actuando al mismo tiempo. Por ello, entender las enfermedades de forma aislada nos llevará a cometer graves errores, tanto en el diagnóstico como en la adopción de medidas de control o prevención.
Tener un intestino con una barrera íntegra, un sistema inmunitario efectivo, una estructura histológica intacta y una microbiota equilibrada será la mejor manera de evitar enfermedades entéricas. Y esto, muchas veces, pasa por un uso de vacunas junto con una nutrición correcta, un manejo excelente y una bioseguridad eficaz.

5
25 DOSIS




Descarga el PDF
El uso masivo de antibióticos durante las últimas décadas ha desembocado en la aparición de bacterias multirresistentes que están teniendo un gran impacto en la producción porcina.
Para dar solución a este problema, en los últimos años ha adquirido gran relevancia la desmedicalización del sector ganadero, es decir, el uso prudente de antibióticos para restringir su uso a los casos estrictamente necesarios.

El impulso de la desmedicalización persigue dos objetivos principales:
La disminución de la aparición de resistencias a los antibióticos.
La preservación de algunos de los antibióticos que actualmente se utilizan en veterinaria para uso exclusivo en medicina humana.
En este contexto, se trabaja en la búsqueda de alternativas que permitan:
Disminuir el uso de antibióticos para controlar las enfermedades de etiología bacteriana.
Hacer frente a los patógenos que, por las resistencias adquiridas, no puedan ser eliminados con los antibióticos destinados para uso veterinario.
Los bacteriófagos se postulan como gran alternativa, ya que pueden sustituir a los antibióticos tradicionales y eliminar las cepas con resistencia múltiple.
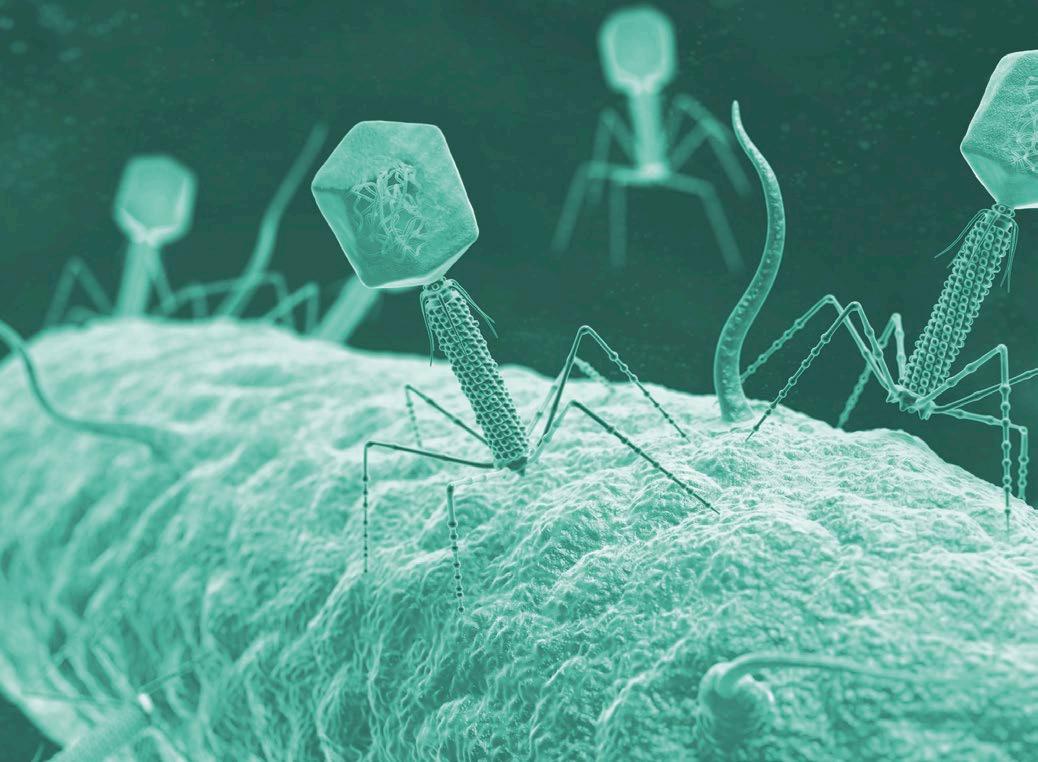
Los bacteriófagos, comúnmente conocidos como, fagos, son virus que infectan bacterias, replicándose en su interior hasta alcanzar un número suficiente que provocará su lisis y la liberación de las nuevas partículas virales (Figura 1).
FIGURA 1 Ciclo replicativo de los bacteriófagos.
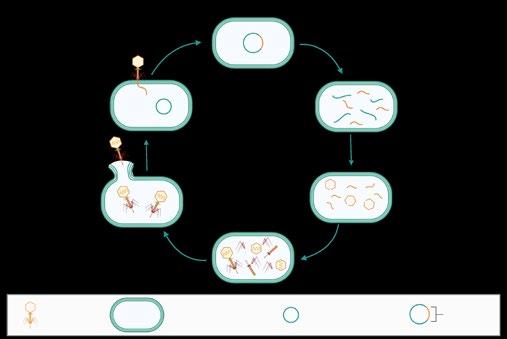
Bacteriófago Bacteria hospedadora
Integración del genoma viral en el cromosoma bacteriano, formando un profago (no siempre sucede).
Adsorción del bacteriófago a la bacteria hospedadora e inyección del ácido nucleico.
Lisis de la bacteria y liberación de los fagos.

partículas virales.
proteínas del fago.
LOS FAGOS SON UBICUOS Y REPRESENTAN LA ENTIDAD BIOLÓGICA MÁS ABUNDANTE DEL PLANETA CON ALREDEDOR DE 1031 PARTÍCULAS VÍRICAS
A pesar del interés creciente que han adquirido los fagos en los últimos tiempos, estos fueron descubiertos a principios del siglo XX por Félix d’Hérelle y Frederick Twort.
Al observar la capacidad lítica de los fagos, d’Hérelle propuso su uso como tratamiento de infecciones bacterianas. Sin embargo, el posterior descubrimiento de la penicilina y el auge de los antibióticos, con mayor espectro y eficacia que los fagos, detuvo su uso como antimicrobianos en los países occidentales.
Una de las principales causas de bajas y pérdidas económicas en el sector porcino son los procesos digestivos y la colibacilosis (diarrea asociada a Escherichia coli) aparece en todas las fases de producción porcina, desde lechones en lactación hasta semanas después del destete, siendo menos frecuente en animales de cebo.
E. coli se encuentra de forma habitual en el tracto digestivo formando parte de la microbiota intestinal de animales sanos. Sin embargo, existen cepas patógenas caracterizadas por la presencia de factores de virulencia que incluyen proteínas de adhesión y toxinas.
En función de los factores de virulencia que presente la cepa, se pueden diferenciar tres patotipos de E. coli responsables de los cuadros diarreicos de colibacilosis:
E. COLI ENTEROTOXIGÉNICAS (ETEC)
Las E. coli enterotoxigénicas (ETEC) poseen fimbrias y enterotoxinas.
Las fimbrias son adhesinas que facilitan la unión de la bacteria al enterocito. Las más frecuentes son:
ENTEROTOXINAS
Las enterotoxinas secretadas por las cepas ETEC dañan la mucosa intestinal causando la diarrea. Se clasifican en
Toxinas termolábiles (LT)
Toxinas termorresistentes (STa y STb)
E. COLI ENTEROPATÓGENAS (EPEC)
Las cepas de E. coli enteropatógenas (EPEC) se caracterizan por la presencia de intimina, una proteína de adherencia distinta a las fimbrias.
Esta proteína de membrana externa permite la unión de la bacteria al enterocito y, como resultado de la unión bacteria-enterocito, se eliminan las microvellosidades y se reduce la superficie intestinal, lo que genera una malabsorción y las consecuentes diarreas.
E. COLI VEROTOXIGÉNICAS (STEC)
Las E. coli verotoxigénicas (STEC) se caracterizan por la presencia de F18 y la secreción de shigatoxinas (Sxt2e).
Estas cepas de E. coli producen la enfermedad de los edemas, que cursa con edemas y signos nerviosos. En ocasiones, también presentan toxinas tipo LT o ST y el cuadro clínico habitual puede verse acompañado de diarreas.
Hasta ahora uno de los principales medios para el control de la colibacilosis porcina era el óxido de zinc. Sin embargo, la Agencia Europea del Medicamento (EMA) prohibió la comercialización de productos veterinarios basados en este compuesto a partir de 2022. Así, tras la desaparición del óxido de zinc del mercado, las principales vías de control de la colibacilosis son:
1 2
El mantenimiento de la bioseguridad.
La administración de antibióticos.
Ya se han reportado resistencias a algunos de los antibióticos más frecuentes, además de que muchos de ellos, como la colistina (categoría B), son de uso prioritario en humanos.

Durante años, la naturaleza contagiosa de la enfermedad ha llevado a recurrir a la metafilaxis. Sin embargo, esta práctica se ha visto restringida, ya que conlleva un aumento de la cantidad de antibiótico utilizado y choca con la tendencia actual hacia la desmedicalización que se persigue desde los organismos oficiales.
Por esta razón, cobran gran importancia otras vías de prevención como el uso de vacunas o la aplicación de colifagos, que se postula como una opción de gran interés para el tratamiento y control de las diarreas por E. coli.
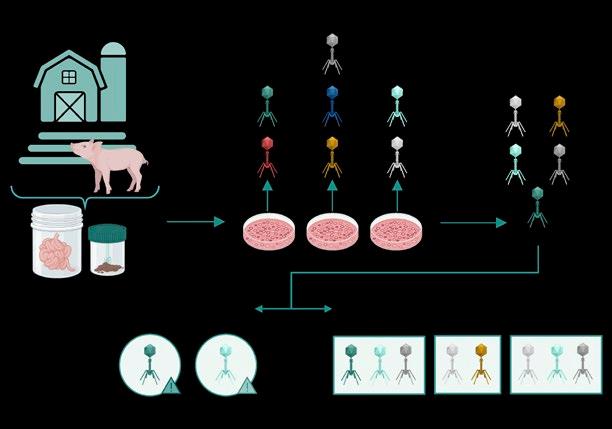
Para el tratamiento con fagos, en primer lugar, hay que aislar las cepas patógenas que están causando el problema en la granja.
A partir de diferentes muestras, preferiblemente de las granjas de cerdos en las que haya presencia de E. coli (heces, contenido intestinal, purines…), se aíslan fagos específicos frente a esas cepas.
Tras caracterizar los fagos obtenidos, se seleccionan aquellos que han demostrado unas propiedades más adecuadas:
Mayor actividad lítica en las cepas problema.
Mejor estabilidad a diferentes pH y temperatura.
Ausencia de genes de resistencia u otros factores que comprometan la seguridad.
CON LOS FAGOS SELECCIONADOS SE LLEVAN A CABO PRUEBAS DE SEGURIDAD Y EFICACIA
Por último, con los resultados de estas pruebas se registra el producto de fagos para su administración en las granjas (Figura 2).

Protege a los cerdos de forma sostenible con Coliprotec®, la única vacuna viva oral contra el E.coli posdestete disponible en el mercado que ha demostrado reducir la mortalidad y el uso de antibióticos en los nuevos estándares productivos sin óxido de zinc
Para acompañarte en este importante reto y que transiciones de manera efectiva, Elanco dispone de servicios de diagnóstico y de apoyo a la vacunación para que estés seguro de que tus lechones son destetados con la protección que necesitan.
1.Vangroenweghe F. Improved piglet performance and reduced mortality and antimicrobial use following oral vaccination with a live non-pathogenic Escherichia coli against post-weaning diarrhoea. 2021. Austin Journal of Infectious Disease, 8(2): 1048-1051.

Para más información sobre Coliprotec® F4/F18 liofilizado para suspensión oral para porcino, ver ficha técnica
EN CASO DE DUDA, CONSULTA CON TU VETERINARIO
Muestreo en granja
Preparación representativa (estudios de seguridad y eficacia)
Aislamiento de fagos
Preparación parental (monofagos)
Preparación multifagosa (cóctel)
Los bacteriófagos, y en particular los colifagos, se perfilan como una herramienta prometedora en el control de la colibacilosis gracias a una serie de ventajas clave que los diferencian de otras estrategias antimicrobianas:
La ubicuidad y el alto número de partículas víricas presentes en cualquier ambiente facilitan el descubrimiento de nuevos colifagos a partir de diferentes muestras ambientales y biológicas.
La alta especificidad de los colifagos disminuye los efectos adversos y no compromete la microbiota del aparato digestivo.
La capacidad de autorreplicación permite que, mientras el patógeno que actúa hospedador está presente, el fago se multiplique en el lugar de infección, aumentando el número de partículas virales y, con él, su eficacia.
DRÁSTICAMENTE
La velocidad de aparición de resistencias a los fagos es 10 veces menor que la de resistencia a antibióticos. Además, la naturaleza biológica de los fagos permite su optimización mediante técnicas de evolución dirigida para eliminar las cepas resistentes.
FIGURA 2
Flujo de trabajo para la obtención de fagos y el desarrollo de cócteles frente a cepas causantes de colibacilosis.
El éxito de la fagoterapia depende de:
La elección de la ruta de administración adecuada y solución de los problemas asociados a ella: puesto que la colibacilosis es un proceso digestivo la administración por vía oral se postula como la más adecuada.

El principal obstáculo en esta vía es la acidez gástrica, el pH del estómago puede inactivar algunos fagos. Por ello, proteger los fagos hasta su llegada al intestino se puede recurrir a técnicas de microencapsulación.
Formulación adecuada del cóctel de fagos: con el objetivo de disminuir la aparición de resistencias al fago, lo ideal es desarrollar cócteles de fagos en lugar de administrar fagos únicos.
Es importante elegir la combinación adecuada de fagos evitar resistencias, mejorar la eficacia y aumentar el espectro de acción
Interacción de los colifagos con el organismo: tras su administración, el sistema inmunitario del animal puede activarse, generando anticuerpos que neutralicen los fagos.
Es importante llevar a cabo pruebas experimentales que confirmen la seguridad y eficacia del cóctel de fagos a utilizar.
Por lo general, el espectro de acción de los fagos de E. coli limitado, siendo no solo específico de especie, sino incluso de cepa, lo que dificulta el desarrollo de productos comerciales generales frente a colibacilosis.
Con gran probabilidad, las fórmulas fijas de fagos frente a tendrán una eficacia limitada frente a muchas de las cepas patógenas, o bien contarán con un gran número de fagos que conlleva un aumento del precio de producción y coste.
La aproximación ideal para el tratamiento de la colibacilosis porcina son las fórmulas magistrales, es decir, cócteles de colifagos “a la carta”, específicos para las cepas que causan el proceso diarreico en cada explotación.

La publicación en 2024 de la guía de productos médicos veterinarios diseñados para fagoterapia ha abierto un nuevo horizonte.
Este documento complementa el Reglamento (UE) 2019/6 y el Reglamento Delegado (UE) 2021/805 por el que se modifica el Anexo II del Reglamento (UE) 2019/6. Todos estos documentos ofrecen un marco regulatorio que otorga cierta flexibilidad a los productos basados en bacteriófagos.
Dada la naturaleza adaptable de la interacción fago-bacteria, la guía prevé la necesidad de que un producto basado en fagos pueda ser modificado para hacer frente a nuevas cepas y la aparición de potenciales resistencias.
Con este objetivo, se está impulsando el desarrollo de herramientas basadas en bacteriófagos mediante la financiación de diferentes proyectos.
Por ejemplo, Biotegania, un proyecto financiado por el CDTI y la Agencia Estatal de Investigación del MICIU Gobierno de España en el marco de la iniciativa TransMisiones, buscan dar solución al problema de los antibióticos mediante el desarrollo de un cóctel de fagos para el tratamiento de enfermedades de importancia en veterinaria, entre ellas la colibacilosis postdestete en porcino.
colibacilosis es uno de los problemas que mayor agravio económico genera en el sector porcino y las herramientas que poseíamos para hacerle frente han visto como su uso se debe reducir drásticamente.
El uso de cócteles de colifagos, específicos frente a las cepas patógenas de cada explotación, permitiría controlar la enfermedad de manera personalizada y exitosa disminuyendo en gran medida el uso de antibióticos.
Redefiniendo los límites de lo posible

Su éxito es fruto del esfuerzo. Nuestra innovación también. Conseguir resultados visibles en sus granjas requiere progresos sin precedentes y una mejora genética contínua. Nuestra innovación amplifica su éxito presente y futuro.
LLa implementación de limitaciones en el uso de antibióticos, junto con la retirada del óxido de zinc y el incremento de la circulación de virus PRRS, han dado lugar a un escenario sanitario distinto al que conocíamos anteriormente. Este cambio ha estado marcado en gran medida por empeoramiento de los datos productivos.
Esta situación requiere un cambio en la forma de abordar la producción porcina. Para ello, hoy en día disponemos de herramientas nuevas que permiten la monitorización de las granjas, facilitando la adopción de medidas para limitar el impacto de las enfermedades.
Andrea Martínez Martínez1, Anabel Fernández Bravo1, Emilio José Ruíz Fernández1, Simón García Legaz1 y Manuel Toledo Castillo2
1Veterinario de producción, Agropecuaria Casas Nuevas.
2Veterinario jefe de producción, Agropecuaria Casas Nuevas.
Descarga el PDF

La saliva es un fluido biológico que adquiere cada vez más importancia en las pruebas diagnósticas veterinarias.
Desde hace unos años, se utiliza ampliamente para la determinación de patógenos, siendo una muestra sencilla de obtener y con una técnica poco invasiva, minimizando el estrés en los animales.
En la actualidad, existen numerosos analitos medibles que pueden aportar información sobre el estatus sanitario y el bienestar de nuestra población porcina.
De esta forma, existe la posibilidad de detección de procesos subclínicos, permitiendo establecer medidas a nivel de granja de forma precoz, limitando el impacto clínico de las patologías.
Existe una serie de biomarcadores entre los que destacan los siguientes:
Haptoglobina: es una proteína de fase aguda que aumenta su concentración en procesos inflamatorios, sean infecciosos o no.
No está influenciada por los efectos del estrés térmico, por lo que es una buena herramienta para la determinación de la intensidad de un proceso infeccioso.
Inmunoglobulinas G inespecíficas (IgG): aumentan en procesos infecciosos, siendo reflejo del desarrollo de la respuesta inmunitaria contra un patógeno.
ADA (adenosín desaminasa): sus niveles se elevan con la presencia de inflamación y con el desarrollo de respuesta inmunitaria celular.
La mucosa intestinal está altamente correlacionada con otros órganos, como la glándula mamaria y el pulmón, de modo que los cambios que se puedan producir a nivel local tienen repercusiones a nivel general.
Estas alteraciones surgen de varias maneras:
Interfieren con la respuesta inmunitaria e inflamatoria.
Las citoquinas producidas en el intestino pueden alterar la respuesta inflamatoria en el pulmón.
ADOPTAR UNA NUEVA
PERSPECTIVA SOBRE EL IMPACTO DE LOS PROCESOS
RESPIRATORIOS SOBRE LA MICROBIOTA Y SANIDAD INTESTINAL DE LOS ANIMALES
Este nuevo escenario, con una notable reducción de antibióticos en producción, conlleva un cambio importante en la microbiota intestinal.
Esto se debe a que muchas patologías digestivas, anteriormente enmascaradas por el uso generalizado de antibióticos para el control de enfermedades, ahora se manifiestan con mayor claridad.
Como resultado, se observa un aumento en la incidencia de trastornos digestivos como la ileítis, la disentería y otros cuadros similares, que están más presentes que nunca en los sistemas de producción.
El estado de disbiosis inducido por un proceso respiratorio incrementa la inflamación y compromete la integridad de la barrera intestinal, lo que conlleva un aumento de su permeabilidad. A su vez, la alteración de la mucosa intestinal puede amplificar la inflamación pulmonar y reducir la eficacia de la respuesta inmunitaria del animal.
FIGURA 1
Interacciones en el eje intestino-pulmón: comunicación bidireccional entre las mucosas respiratoria y digestiva. Las infecciones a nivel respiratorio desencadenan una cascada de eventos que afectan al sistema digestivo, entre ellos, un aumento de citoquinas inflamatorias y una disminución del consumo de alimento, lo que repercute en la producción de ácidos grasos de cadena corta (SCFA) y en la estimulación de los receptores tipo Toll (TLR). Estos cambios favorecen la aparición de disbiosis intestinal, caracterizada por un aumento de la inflamación, una menor integridad de la barrera intestinal y una reducción en la producción de péptidos antimicrobianos (AMPs). Todo ello compromete la inmunidad innata y predispone a superinfecciones bacterianas, tanto respiratorias como digestivas.
Respiratorio

Infección viral
Consumo Citoquinas in amatorias
Digestivo
Inmunidad innata alterada Número y función celular
SCFA
Estimulación TLR
In amación Integridad barrera AMPs Disbiosis intestinal
Superinfección bacteriana Pulmonar y digestiva incontrolable
Adapatacion del artículo: MartínezMartínez, A.; Toledo, M.; Ruiz, E.; García, S.; Fernández, A.; Cerón, J.J.; Menjon, R.; Tejedor, M.T.; Goyena, E.; Muñoz-Prieto, A. Changes in Analytes Related to Immunity in the Saliva of Pigs After Vaccination Against Lawsonia intracellularis. Immuno 2025, 5, 3. https://doi.org/10.3390/ immuno5010003
LEER ARTÍCULO
Con el fin de determinar si una vacuna inactivada frente a Lawsonia intracellularis puede ejercer una influencia positiva más allá de los parámetros productivos —cuyo beneficio ya está ampliamente demostrado—, este estudio analizó su posible efecto sobre la evolución de las enfermedades respiratorias en cerdos de cebo. Para ello, se estudiaron los cambios tras la vacunación en los niveles salivales de:
Haptoglobina (Hp).
Inmunoglobulina G (IgG).
Adenosina desaminasa (ADA).
Se trabajó con dos grupos de 630 animales cada uno —vacunados y control— en los que se evaluaron los parámetros productivos.
Dentro de cada grupo, se seleccionaron al azar 15 lechones de 10 semanas de edad al inicio del cebo, que fueron identificados con un crotal de la explotación y otro individual.
Todos los animales del grupo vacunado habían recibido la vacuna inactivada Porcilis® Lawsonia (MSD Animal Health) frente a L.intracellularis al destete.
Durante el estudio, se obtuvieron muestras de los 15 lechones de cada grupo en cuatro momentos diferentes del engorde:
T1: Entrada al engorde (suero y saliva).
T2: Al mes de la entrada (suero y saliva).
T3: A los dos meses de la entrada (suero y saliva).
T4: A los tres meses de la entrada (suero).
DINÁMICA DE SEROCONVERSIÓN DINÁMICA DE SEROCONVERSIÓN
Primer muestreo a las 10 semanas de vida (entrada al cebo, T1)
Se detectó una diferencia altamente significativa en cuanto al porcentaje de positivos entre ambos grupos (chi cuadrado de Pearson =9,130; p=0,003), siendo la proporción de positivos mayor en el grupo vacunado.
La dinámica de seroconversión frente L. intracellularis siguió un patrón que permite afirmar que no había recirculación hasta las 10 semanas de vida, solamente apareciendo el grupo vacunado, como es lógico, debido a la vacuna (Gráfica 1).
GRÁFICA 1
Presencia de positivos y negativos a L. intracellularis en ambos grupos a la entrada en cebo (T1).
Segundo muestreo (al mes de entrar, T2)
En la segunda toma de muestras se detectó una diferencia significativa en cuanto al porcentaje de positivos entre ambos grupos (chi cuadrado de Pearson =3,968; p=0,046), siendo la proporción de positivos mayor en el grupo vacunado.
El grupo control empezó a seroconvertir como consecuencia de la circulación de L. intracellularis entre los individuos de la población (Gráfica 2).

GRÁFICA 2
Presencia de positivos y negativos a L. intracellularis en ambos grupos al mes desde la entrada en cebo (T2).
GRÁFICA 3
Presencia de positivos y negativos a L. intracellularis en ambos grupos a los dos meses desde la entrada en cebo (T3).

Tercer muestreo (a los dos meses de entrar, T3)
En esta toma de muestras no se encontraron diferencias significativas en cuanto a la seroconversión entre el grupo vacunado y el grupo control (Gráfica 3).
GRÁFICA 4
Presencia de positivos y negativos a L. intracellularis en ambos grupos a los tres meses desde la entrada en cebo (T3).
Cuarto muestreo (a los tres meses de entrar, T4)
Se detectó una diferencia altamente significativa en cuanto al porcentaje de positivos entre ambos grupos (chi cuadrado de Pearson =12,128; p<0,001), siendo la proporción de positivos es mayor en el grupo vacunado.
En el grupo vacunado ya habían seroconvertido todos los animales, mientras que el grupo control seguían en proceso de seroconversión (Gráfica 4).
GRÁFICA 5
Presencia de positivos y negativos a L. intracellularis a lo largo de todo el periodo de estudio en el grupo control.
La dinámica de recirculación de L. intracellularis fue totalmente diferente en el grupo vacunado y en el grupo control (Gráficas 5 y 6), condicionando el estatus sanitario de la población y poniendo de manifiesto una correlación entre la recirculación del patógeno y la reacción inmunitaria e inflamatoria en los animales.
Esta dinámica de seroconversión tuvo una consecuencia reseñable: la transmisión de la enfermedad en el efectivo ocurrió de forma muy lenta, lo que conllevó la coexistencia de animales infectados y animales susceptibles en la misma población.
Desde el punto de vista clínico, no hubo un único momento de infección con L. intracellularis, sino que ocurrió durante un largo periodo de tiempo.
Esto tiene consecuencias para la salud intestinal, repercutiendo de manera directa en los procesos respiratorios observados en el cebo y que cursan de forma recurrente.
DE LOS BIOMARCADORES SALIVARES DINÁMICA DE LOS BIOMARCADORES SALIVALES
Niveles de haptoglobina (HP: ng/mL)
Dado que esta variable no presenta una distribución normal, se aplicó una transformación logarítmica (log10), detectándose una interacción tiempo - grupo altamente significativa (F=18,805; p<0,001) (Gráfica 7).
En el T1 (entrada al cebo) no se encontraron diferencias significativas entre los dos grupos. En cambio, al mes (T2) y dos meses (T3) desde la entrada al cebo se produjo un incremento de la reacción inflamatoria en el grupo control.
Esto se debió, en parte, a la recirculación de L. intracellularis, pero también coincidió con los momentos en los que aumentaron los procesos respiratorios, lo que requirió que los animales que presentaban fiebre, tos y disnea fueran tratados con antibióticos.
GRÁFICA 6
Presencia de positivos y negativos a L. intracellularis a lo largo de todo el periodo de estudio en el grupo vacunado.

GRÁFICA 7
Concentración de haptoglobina en los muestreos realizados en los grupos control y vacunado.
GRÁFICA 8
Concentración de IgG en los muestreos realizados en los grupos control y vacunado.

GRÁFICA 9
Concentración de ADA en los muestreos realizados en los grupos control y vacunado.
Niveles de inmunoglobulina G inespecífica (IgG)
El incremento de la IgG estuvo altamente correlacionado con la recirculación de L. intracellularis en la población (Gráfica 8).
Tiempo
Niveles de adenosín desaminase (ADA)
Se encontraron diferencias altamente significativas entre los dos grupos, independientemente del momento considerado (F=10,298; p=0,003), siendo las medias del grupo control significativamente superiores, lo que implica que la respuesta inmunitaria celular fue también más alta en el grupo control.
Grupo Control
Vacunado
2 3
Tiempo
Barras de error: 95% CI
Paralelamente a la determinación de la seroconversión frente a L. intracellularis y la medición de los biomarcadores salivales, se realizó un estudio de la dinámica de la viremia de los lechones en el cebo a PRRS mediante PCR cuantitativa para ver su posible influencia en los resultados obtenidos.
La viremia, ya existente a finales de transición, persistió en las dos tomas de muestras iniciales en el grupo control (Gráfica 10). No se observaron diferencias en cuanto a la dinámica de la viremia entre ambos grupos, ya que el grupo vacunado mostró el mismo patrón, siendo los animales virémicos en la segunda toma de muestras, mientras que en los momentos T3 y T4 fueron negativos (Gráfica 11).
GRÁFICA 10
Viremia de PRRS en el grupo control a lo largo del periodo estudio.
GRÁFICA 11
Viremia de PRRS en el grupo vacunado a lo largo del periodo de estudio.
La ausencia de respuesta en los biomarcadores de inflamación e inmunidad se podría explicar porque los lechones ya eran positivos antes de su entrada en el cebo, lo que impediría una activación detectable en la fase final de la viremia.
Se consideró la mortalidad como un indicador de las diferentes patologías que habían tenido las poblaciones estudiadas, encontrándose un mayor número de bajas en el grupo control (Tabla 1)
Grupo control
El porcentaje de bajas total de este cebadero se situó en 5,8 % (37 bajas en 630 animales entrados).
Grupo vacunado
El porcentaje de bajas fue de 3,81 % (24 de 630 lechones entrados), lo que implica una reducción muy significativa con respecto al grupo control.
En relación a los datos zootécnicos (Tabla 1), se evaluó la ganancia media diaria (GMD), un parámetro estrechamente vinculado al estado sanitario de los animales, ya que, cuanto mayor sea el crecimiento, mejor será salud.
Asimismo, se valoró el índice de conversión (IC), uno de los indicadores más relevantes en cuanto al coste de producción durante la fase de cebo.






Se encontraron diferencias importantes en cuanto a las bajas, siendo aproximadamente un 2 % inferiores en el grupo vacunado respecto al grupo control.
El dato más destacado fue el índice de conversión (IC), con una mejora de 141 gramos en el grupo vacunado. Si se considera el IC técnico, la diferencia fue de 113 gramos a favor del mismo grupo.
En términos de eficiencia alimentaria, un cerdo no vacunado necesitó 12,9 kg más de pienso para alcanzar el mismo peso que un cerdo vacunado. Además, la ganancia media diaria (GMD) fue 72 gramos superior en los animales vacunados.
Estos resultados se enmarcan en un contexto en el que la recirculación de L. intracellularis generaba un estado de disbiosis intestinal, acompañado de signos clínicos respiratorios como tos y disnea en un porcentaje elevado de animales.
Como reflejo de este desequilibrio sanitario, el coste y la cantidad de antibióticos empleados en el grupo control fueron considerablemente superiores a los del grupo vacunado (3,1 vs 1,7 euros por animal).
El control de la salud digestiva ayuda de una manera significativa a incrementar la salud respiratoria y a la reducción del uso de antibióticos para el control de las recidivas respiratorias que se producen.
BIBLIOGRAFÍA
1.Enaud R, Prevel R, Ciarlo E, Beaufils F, Wieërs G, Guery B, Delhaes L. The Gut-Lung Axis in Health and Respiratory Diseases: A Place for Inter-Organ and Inter-Kingdom Crosstalks. Front Cell Infect Microbiol. 2020 Feb 19;10:9
2. Dickson RP, Erb-Downward JR, Falkowski NR, Hunter EM, Ashley SL, Huffnagle GB. The Lung Microbiota of Healthy Mice Are Highly Variable, Cluster by Environment, and Reflect Variation in Baseline Lung Innate Immunity. Am J Respir Crit Care Med. 2018 Aug 15;198(4):497-508.
3. Leite FLL, Singer RS, Ward T, Gebhart CJ, Isaacson RE. Vaccination Against Lawsonia intracellularis Decreases Shedding of Salmonella enterica serovar Typhimurium in Co-Infected Pigs and Alters the Gut Microbiome. Sci Rep. 2018 Feb 12;8(1):2857.
4. Borewicz KA, Kim HB, Singer RS, Gebhart CJ, Sreevatsan S, Johnson T, Isaacson RE. Changes in the Porcine Intestinal Microbiome in Response to Infection with Salmonella enterica and Lawsonia intracellularis. PLoS One. 2015 Oct 13;10(10)
5. Savage DC. Microbial ecology of the gastrointestinal tract. Annu Rev Microbiol. 1977;31:10733.

6. Zheng, L.; Shi, L.; Wu, X.; Hu, P.; Zhang, B.; Han, X.; Wang, K.; Li, X.; Yang, F.; Wang, Y.; et al. Advances in Research on Pig Salivary Analytes: A Window to Reveal Pig Health and Physiological Status. Animals2024, 14, 374.
7. Tecles F, Rubio CP, Contreras-Aguilar MD, et al. Adenosine deaminase activity in pig saliva: analytical validation of two spectrophotometric assays. Journal of Veterinary Diagnostic Investigation. 2018;30(1):175-179.
8. Piirainen V, Gutiérrez AM, Heinonen M, König E, Valros A, Junnikkala S. Salivary and serum haptoglobin, adenosine deaminase, and immunoglobulin G in growing pigs. Porcine Health Manag. 2024 May 21;10(1):21.
9. WenJie Yang a, Abdur Rahman Ansari b, XiaoYu Niu a, WeiHua Zou c, MengQi Lu a, Ling Dong a, Fan Li a, YanHong Chen a, KeLi Yang d, Interaction between gut microbiota dysbiosis and lung infection as gut-lung axis caused by Streptococcus suis in mouse model
10. Intestinal Regeneration: Regulation by the Microenvironment. Author links open overlay panelJoris H. Hageman 1 2, Maria C. Heinz 1 2, Kai Kretzschmar 2 3 4, Jelte van der Vaart 2 3, Hans Clevers 2 3 5, Hugo J.G. Snippert 1 2
GMD = (Peso final de cebo – Peso inicial de entrada)/ días de estancia en cebo IC económico (ICe) = kg totales de pienso consumido/ (kg vendidos – kg entrados) IC técnico (ICt) = kg totales de pienso consumido/[(kg vendidos + (bajas x 40) – kg entrados
TABLA 1
Datos zootécnicos durante la fase de cebo.
11. Lung immune tone via gut-lung axis: gut-derived LPS and short-chain fatty acids’ immunometabolic regulation of lung IL-1, FFAR2, and FFAR3 expressionnd
12. Valentin Sencio, Marina Gomes Machado, François Trottein; The lung–gut axis during viral respiratory infections: the impact of gut dysbiosis on secondary disease outcomes
13. Ma Y, Yang X, Chatterjee V, Wu MH, Yuan SY. The Gut-Lung Axis in Systemic Inflammation. Role of Mesenteric Lymph as a Conduit
14. Changes in saliva biomarkers of stress and immunity in domestic pigs exposed to a psychosocial stressor.
15. Escribano D, Gutiérrez AM, Tecles F, Cerón JJ; Changes in saliva biomarkers of stress and immunity in domestic pigs exposed to a psychosocial stressor.
16. Martinez. A, Toledo. M, Ruiz. E, Garcia. S, Fernández. A, Cerón. JJ, Menjon. R, Tejedor. M, Goyena. E, Muñoz-Prieto. (2 January 2025) A. Changes un analytes related to immunity in the saliva of pigs after vaccination against Lawsonia intracellularis.

César
B.
Gutiérrez Martín
Catedrático del Departamento de Sanidad Animal de la Universidad de León
Descarga el PDF
ste artículo aborda las investigaciones más recientes sobre la pleuroneumonía porcina, con atención especial a los factores de virulencia Actinobacillus pleuropneumoniae (App), y a los diversos ensayos sobre vacunas, al objeto de obtener una que prevenga y controle esta enfermedad, provocada por un patógeno primario del Complejo Respiratorio Porcino (CRP).
PRESENTACIÓN CLÍNICA Y DINÁMICA DE INFECCIÓN DE App
Los cerdos afectados por App sufren una pleuroneumonía caracterizada por:
Bronconeumonía fibrinohemorrágica necrotizante.
Pleuritis fibrinosa.
Puede cursar con elevadas tasas de mortalidad y suponer un quebranto económico considerable en la porcinocultura intensiva.
Las presentaciones habituales son las formas sobreaguda o aguda
Sin embargo, también pueden desarrollarse cuadros subagudos o crónicos, con porcentajes mínimos o nulos de mortalidad en este último caso, especialmente si los animales han sido tratados con antibióticos.
Los cerdos se convierten en portadores asintomáticos de la bacteria en sus tonsilas, lo que sucede, no solo en los rebaños infectados con cepas de virulencia intermedia o escasa, sino también en los afectados con cepas virulentas.
Cuando sucede esta última circunstancia, se originan brotes repentinos junto con otras enfermedades respiratorias, en los que los cambios en el manejo y/o en el medio ambiente de las explotaciones intensivas se vuelven fundamentales (Saade et al., 2020).
EL CERDO ES EL
DIVERSIDAD DE SEROTIPOS Y BIOTIPOS DE App
SEROTIPOS
Se han descrito 19 serotipos de App, en función del polisacárido capsular y del lipopolisacárido (LPS), el último de ellos en 2021 (Stringer et al., 2021). Además, en 2024 se describió el subtipo K6b:03 dentro del serotipo 6 (To et al., 2024).
En un brote de pleuroneumonía suele predominar un serotipo , pero ello no impide que se aíslen cepas pertenecientes a varios serotipos.
BIOTIPOS
Los serotipos se integran en dos biotipos, en función de sus características de crecimiento en el laboratorio:
Biotipo 1: precisa para su crecimiento dinucleótido de nicotinamida y adenina (NAD) como suplemento externo, agrupando a la mayoría de los serotipos (1-12 y 15-19).
Biotipo 2: que no requiere NAD y concentra los aislados de los serotipos 13 y 14.
(Soto Perezchica et al., 2023).
La mayoría de las vacunas solo han demostrado generar una protección suficiente frente a los serotipos contenidos en ellas, sin extenderse a la totalidad de los 19 serotipos.
Entre los condicionantes que influyen en el desarrollo y difusión de esta enfermedad infecciosa figuran el estrés, la mezcla de animales de diferentes camadas, la densidad excesiva en las explotaciones, las condiciones climáticas desfavorables, etc., es decir, los habituales en las patologías respiratorias.
Dentro del concepto nosológico de Complejo Respiratorio Porcino (CRP), es frecuente que App concurra como agente primario junto con otros patógenos también primarios, como Mycoplasma hyopneumoniae, entre las bacterias, o el virus de la enfermedad de Aujeszky, entre los agentes submicroscópicos (Chiers et al., 2010).
RESISTENCIA ANTIMICROBIANA Y ESTRATEGIAS TERAPÉUTICAS
FRENTE A LA PLEURONEUMONÍA PORCINA
Respecto al tratamiento, de sobra sabemos que en la actualidad hay que utilizar los antibióticos de

Ante el aumento exponencial de las resistencias frente a las penicilinas, los aminoglucósidos, el enrofloxacino y el clotrimoxazol (Ke et al., 2024; Przyborowska & Tobolski, 2025), las cefalosporinas de tercera generación ejercen un papel destacado en el tratamiento de la pleuroneumonía porcina, aunque debe preocupar el porcentaje elevado de aislados resistentes descritos actualmente (Przyborowska & Tobolski, 2025).
Lo mismo puede afirmarse del florfenicol, frente al que se ha identificado el gen de resistencia floR, localizado en el plásmido pAp-floR, de gran similitud con el plásmido pMVSCS1 de Mannheimia varigena (Brenciani et al., 2024).
Una de las esperanzas terapéuticas se asienta en el pradofloxacino, quinolona fluorada de doble diana aprobada recientemente frente a las enfermedades respiratorias de los animales de abasto (Blondeau & Fitch, 2024), siempre con un uso racional para evitar la aparición de resistencias a corto plazo.
Otra de las alternativas futuras conduce al empleo de sustancias diferentes a los antibióticos.
Se ha ensayado en ratones la naringina que, aunque no inhibe la multiplicación de App, ejerce una actividad antiinflamatoria potente que alivia las lesiones pulmonares, tal y como se ha demostrado en los casos de COVID-19.
Se trata de un flavonoide extraído de la cáscara del pomelo y el principal responsable de su sabor amargo.
Sobre un modelo de pleuroneumonía murina, se ha demostrado la mejoría de las lesiones pulmonares, a través del efecto antiinflamatorio del patrón de señalización MAPK/NF-κB que, a su vez, evita el daño oxidativo mediante la potenciación de la enzima superóxido-dismutasa (Huang et al., 2024).
β-DEFENSINA 5
Β-DEFENSINA 5
Se ha utilizado la β-defensina 5 expresada en la levadura Pichia pastoris y se ha comprobado que estimula la respuesta inmunitaria innata en las mucosas, cuando es aplicada por vía intranasal, mediante la liberación de diversas citocinas de los macrófagos y las células dendríticas, revirtiendo así la inmunosupresión provocada por App (Huang et al., 2024).

A continuación se presentan de forma detallada las últimas investigaciones publicadas sobre dos aspectos complementarios, investigados desde que se tiene conocimiento de esta enfermedad exclusiva de la especia porcina:
Los factores de virulencia bacterianos.
Los ensayos vacunales dirigidos a la obtención de una formulación eficaz frente a cualquier episodio de pleuroneumonía porcina.
no se une con facilidad a las porciones superiores del aparato respiratorio porcino, todo lo contrario de lo que ocurre con su fijación a los cilios de los bronquiolos o a las células del epitelio alveolar.
serotipos 1, 2, 7 y 12, formadas por proteínas cuyos primeros aminoácidos del extremo terminal amino son similares a los de otras bacterias próximas, como sucede con las fimbrias de tipo 4 de
solo son expresadas cuando se desarrolla la enfermedad adherencia, con conclusiones
Como receptores, participan algunos glucoesfingolípidos de las células epiteliales respiratorias (AbulMilh et al., 1999)
En relación con las biopelículas como factor de virulencia, se ha desarrollado proteína del receptor cAMP, poniendo de manifiesto adherencia, invasión y colonización (He et al.,
La formación de biopelículas en un modelo murino.
de protección frente a los cambios también favorece la formación de resistencia frente a varias clases de
Hoy en día se admite que todos los serotipos pueden formar biopelículas (Labrie et al., 2010), aunque esta característica no se ha explorado en los últimos serotipos, concretamente, a partir del serotipo 16.
Además, se ha comprobado que App forma agregados de biopelículas en los pulmones, sola, combinada con otros patógenos del CRP o con otras bacterias ajenas a él, como Escherichia coli o Staphylococcus aureus (Loera-Muro et al., 2016).
NUTRIENTES ESENCIALES

Una vez fijada, App requiere nutrientes esenciales para multiplicarse en el cerdo.
HIERRO HIERRO
App necesita cantidades de hierro superiores a las que existen libres en el animal doméstico, por lo que debe disponer de mecanismos para captar este elemento químico ligado a diversas moléculas.
App PUEDE UTILIZAR LA TRANSFERRINA COMO FUENTE DE HIERRO, PERO
LA DE ORIGEN PORCINO, LO QUE EXPLICA SU
ESPECIFICIDAD DE HOSPEDADOR
Para ello, requiere dos proteínas de unión a la transferrina, TbpA y TbpB, cuya acción coordinada permite la penetración de la transferrina porcina cargada con hierro al citoplasma bacteriano. La TbpB también puede unir hemina, aunque no hemoglobina (Baltes et al., 2001).
Con menor relevancia, se han identificado sideróforos como mecanismos alternativos de captación de hierro (Diarra et al., 1996).
NÍQUEL
NÍQUEL
El níquel resulta igualmente necesario y también se encuentra en concentraciones bajísimas en los mamíferos.
Resulta imprescindible para que la enzima ureasa pueda activarse, lo que es necesario a su vez para la producción de amoniaco, fuente de nitrógeno esencial para App (Bossé et al., 2001).
ESTRATEGIAS DE EVASIÓN DEL SISTEMA INMUNITARIO
EVASIÓN DE LA FAGOCITOSIS
EVASIÓN DE LA FAGOCITOSIS
Como mecanismos del hospedador para luchar contra la invasión bacteriana se encuentran la función mucociliar y la fagocitosis, ambos pertenecientes a la inmunidad innata.
Se estima que App puede sobrevivir, como mínimo, 90 minutos en los macrófagos, tiempo que aprovecha para destruir estos fagocitos mediante sus toxinas Apx.
Otros factores de subsistencia bacteriana dentro de los macrófagos son la cápsula, el LPS, la superóxido-dismutasa de cobre y zinc, las proteínas del estrés y el amoniaco (este último compuesto impide la fusión de los lisosomas con los fagosomas).
LAS TOXINAS ApxI, ApxII y ApxIII ESTÁN, SIN DUDA, IMPLICADAS
PRINCIPALMENTE EN LA ALTERACIÓN DE LA FUNCIÓN FAGOCITARIA (Bossé et al., 2002)
Además de colaborar en la fagocitosis a través de la opsonización, el sistema del complemento porcino desencadena la acción bactericida frente a App
Sin embargo, este microorganismo está en condiciones de evadir este efecto gracias nuevamente a su polisacárido capsular y a su LPS (Rioux et al., 2000).
TOXINAS Apx
La mayoría de las lesiones de la pleuroneumonía están producidas por las toxinas Apx, que actúan sobre las células porcinas directamente o de forma indirecta mediante diversos mediadores de la inflamación.
App desencadena la producción de citocinas proinflamatorias (IL-1α y IL-1β, IL-6 y IL-8) y facilita la síntesis de radicales tóxicos de oxígeno, con producción final de mieloperoxidasa, gracias a la cual se libera ácido hipocloroso, el mayor oxidante citotóxico de la inflamación.
Además, la activación de la vía alternativa del complemento por acción del LPS bacteriano activa la coagulación sanguínea, la vasodilatación, la constricción de las vías pulmonares, la fibrinolisis y el sistema de las cininas.
Debido a la coagulación, se desarrollarán microtrombos y la necrosis característica de la lesión de la forma aguda de la pleuroneumonía.

La toxina ApxIV ha sido la última descubierta y, a diferencia de las tres primeras toxinas Apx, que solo se expresaba durante el transcurso de la enfermedad, hasta que en 2011 se consiguió su producción en el laboratorio et al., 2011).
Cuatro años después, el grupo de caracterizarla desde el punto de vista genético, para concluir que favorece la invasión del microbioma de la mucosa respiratoria, además de representar un
PROTEÍNAS ANTIOXIDANTES
Continuando con otras, las proteínas HbpA1 y Hbp2 permiten la utilización del glutatión y favorecen la tolerancia de App al estrés oxidativo, pero ninguna de ellas se considera un factor de virulencia relevante, puesto que la limitación del consumo de este antioxidante por parte de App no resulta determinante en el bloqueo de su colonización y ulterior actividad patógena (Zhang et al., 2024).

Se han realizado numerosos ensayos en roedores, especialmente entre los grupos asiáticos.
Sin embargo, aunque los animales de laboratorio resultan cómodos por su facilidad de manejo, el componente económico y la obtención rápida de conclusiones, los resultados deben ser valorados con precaución, porque no pueden extrapolarse a los cerdos sin haberse verificado posteriormente la eficacia de las vacunas en ellos.
En este artículo nos ceñiremos a las pruebas recientes efectuadas exclusivamente en la especie porcina, con la excepción de un comentario relativo al modelo murino.
Park et al. (2025) valoraron la eficacia de las vesículas extracelulares (Omvs) de App y comprobaron que estimulaban las células dendríticas a través del receptor de reconocimiento de patógenos TLR-4, con inducción de respuestas potentes Th1, Th17 y de T citotóxicos, lo que convertía a esta formulación en un candidato prometedor, antes de ser ratificado naturalmente en el hospedador natural.
BACTERINAS
Entre las últimas publicaciones sobre bacterinas, podemos referenciar las de los grupos de López-Bermúdez (2014) y Kim (2016), que estudiaron varios serotipos, pero sin alcanzar una protección completa.
AUTOVACUNAS
Como autovacunas, aún se siguen proponiendo algunas, como la de van den Wyngaert et al. (2015), cuya utilización, si bien garantizaba una protección aceptable en la explotación de donde fue recuperada la cepa de App no

Trabajando con vacunas atenuadas podemos citar a Xie et al. (2017) que desarrollaron un mutante atenuado con una doble deleción (para una proteasa necesaria para la formación de biopelículas y para la toxina ApxII), induciendo una respuesta protectora adecuada frente a los serotipos 5a y 7.
En general, las vacunas vivas atenuadas siguen adoleciendo del inconveniente por todos conocido, el peligro de reversión a la forma salvaje, aunque resulta más difícil cuando se practica su atenuación por métodos genéticos.
Con las vacunas de subunidades se han utilizado varias proteínas, pero principalmente las toxinas Apx.
Shin et al. (2015) aplicaron por vía oral una preparación en la que se expresaba la toxina ApxII del serotipo 5 en Saccharomyces cerevesiae, con protección frente al desafío con el mismo serotipo, el único valorado.
Esta ruta de inoculación resulta atractiva en este tipo de vacunas por su seguridad y la sencillez de su administración. No obstante, se produce la degradación del antígeno en el tubo gastrointestinal, lo que debilita la calidad de la respuesta inmunitaria inducida.
Por ello, se ha de optar por adyuvantes como el gliceril monooleato o la monooleína, que protegen los antígenos en esta ruta de administración.
El grupo de López-Bermúdez (2014) probó este gel viscoso con las toxinas ApxI, ApxII y ApxIII, con resultados aceptables para este adyuvante.
Se obtuvieron buenos resultados, en términos de reducción de los síntomas y las lesiones típicas de la pleuroneumonía, al probar una vacuna basada en la combinación de una bacterina (serotipo 1) y las toxinas ApxIA, ApxIIA y ApxIIIA recombinantes, pero se desafió únicamente con el serotipo 1 (Zhang et al., 2022).
Continuando con las toxinas Apx, se valoró una bacterina con los serotipos 1 y 2 que incorporaba además los toxoides ApxI, ApxII y ApxIII.
Fue enfrentada a estos mismos serotipos y, como heterólogos, a los serotipos 4 a 7, 9/11 y 13, induciéndose una buena protección frente a todos ellos, medida en términos de una minimización de las lesiones desarrolladas (Mortensen et al., 2022).
Buettner et al. (2011) diseñaron una vacuna con ocho proteínas de la membrana externa de App (entre ellas, la TbpA y la TbpB) y una concentración importante de la ApxIVA, lo que supuso la apertura de vías futuras de exploración de las vacunas DIVA (que permiten diferenciar los cerdos vacunados de los infectados de forma natural), aunque desgraciadamente no se ha profundizado más a este respecto, hasta la fecha.
Otro abordaje actual consiste en el empleo de partículas de tipo vírico como portadores (VLPs, por sus siglas en inglés: virus-like particles), que permitan una liberación progresiva de antígenos como las proteínas de la membrana externa.
En este sentido trabajaron Ong et al. (2017) y comprobaron que los patrones moleculares asociados a estos patógenos (PAMPs) activaban la respuesta innata porcina mediante sus receptores Toll.
Otro estudio recurre a la proteína recombinante (rApfA) de las fimbrias de tipo 4, sola o en combinación con las cuatro toxinas Apx y la TbpB, consiguiendo buenos resultados con esta formulación multiantigénica (Sadilkova et al. 2012).
Una investigación posterior probó la ApfA y la lipoproteína de la membrana externa VacJ en el interior de Omvs, de modo que Antenucci et al. (2018) constataron que se potenciaba la respuesta de IgGs frente a ambas, aunque sin desarrollar una protección suficiente tras el desafío con el serotipo homólogo.
Las vacunas de ADN presentan ventajas destacadas, como su seguridad, termoestabilidad, facilidad de producción y precio económico, puesto que basta con pequeñas cantidades de plásmido para estimular ambas respuestas inmunitarias, humoral y celular (Ramjeet et al., 2008) Sin embargo, los escasos estudios realizados han sido desarrollados sobre ratones.
Recientemente, Jarovosa et al. (2023) consiguieron una buena protección con la administración intradérmica de una bacterina de los serotipos 2 y 9, junto con los toxoides, proteínas y LPS de estos mismos serotipos, comparada con la vía intramuscular, más convencional.
Solo comprobaron el desafío con el serotipo 9, pero ya pudieron concluir que no era factible, desde un punto de vista comercial, la utilización de los antígenos y el adyuvante (Montanide® ISA 201 VG) a las concentraciones utilizadas en el experimento, debido a las lesiones cutáneas producidas.

Como otras propuestas de vanguardia, nos podemos referir a la “secuenciación de nueva generación”, en la que se asientan muchos de los intentos basados en la vacunología más moderna, que también puede ser aplicada a la pleuroneumonía (Li et al., 2017).
Otra posibilidad la constituyen los nanoportadores y, una tercera, las vacunas basadas en plantas, con excelentes resultados en el control frente a la pleuroneumonía (Loera-Muro & Angulo, 2018).
Otra vía de exploración la representan los adyuvantes de última generación, como el acetato de α-tocoferol, la toxina del cólera, diversos ligandos para receptores celulares, algunos carbohidratos o los últimos adyuvantes oleosos, utilizados como prototipos de otras formulaciones porcinas (van Aalst et al., 2018).
Como ejemplo de alguna de estas últimas propuestas figura el desarrollo de vacunas nasales frente a la pleuroneumonía porcina basadas en nanogeles (Nakahash-Ouchida et al., 2017).
A pesar de los avances logrados en el conocimiento de Actinobacillus pleuropneumoniae y de los múltiples enfoques vacunales explorados, la prevención y el control de la pleuroneumonía porcina siguen planteando retos importantes.
La complejidad del patógeno, su diversidad antigénica y su capacidad de evasión inmunitaria exigen seguir apostando por una investigación integrada, que combine el estudio de los factores de virulencia con el desarrollo de formulaciones vacunales eficaces y seguras, adaptadas a las condiciones reales del campo.

VER BIBLIOGRAFÍA





LLDescarga el PDF


Carolina Rodríguez Sanz
Evaluadora de preclínica y clínica. Departamento de Medicamentos Veterinarios. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
a fiebre aftosa o glosopeda es una de las enfermedades víricas de mayor importancia económica a nivel mundial, debido a que se considera de las más contagiosas de los mamíferos (Grubman y Baxt, 2004). Afecta a un elevado número de especies unguladas, incluyendo al ganado bovino, porcino, ovino y caprino, así como a más de 70 especies de rumiantes silvestres. Por esta razón, representa una de las mayores barreras sanitarias para el comercio transfronterizo de animales y sus productos (Grubman y Baxt, 2004; González Gordon et al., 2022).
A su vez, la fiebre aftosa es una de las principales enfermedades vesiculares del ganado porcino, junto con el exantema vesicular, la estomatitis vesicular y la enfermedad vesicular porcina. Todas ellas son indistinguibles entre sí desde un punto de vista clínico, pero difieren en cuanto a su etiopatogenia y potencial impacto económico (Belsham et al., 2024).
El agente responsable de la fiebre aftosa es un virus ARN monocatenario, sin envoltura, perteneciente al género Aphthovirus de la familia Picornaviridae (Grubman y Baxt, 2004).
Existen más de 60 cepas diferentes de este virus, clasificadas en 7 serotipos:
O A C SAT 1 SAT 2
SAT 3
Asia 1
EL SEROTIPO O ES EL MÁS FRECUENTE A NIVEL MUNDIAL (Belsham et al., 2024)
MEDIOAMBIENTALES
SENSIBILIDAD
Es sensible al calor, inactivándose progresivamente a temperaturas superiores a los 50 °C.
Es sensible a pH inferiores a 6 o superiores a 9. Los desinfectantes a base de hidróxido de sodio al 2 %, de carbonato de sodio al 4 % o de ácido cítrico al 0,2 % también son efectivos para lograr su inactivación.
DESTRUCCIÓN
Es importante destacar que no se genera inmunidad cruzada entre los diferentes serotipos, lo que implica que, para lograr una inmunidad completa frente a la fiebre aftosa, sería necesaria la inmunización frente a cada uno de ellos.
Como sucede con otros virus ARN, presenta una elevada variabilidad genética, es decir, se producen fácilmente mutaciones en su genoma que pueden dar lugar a variaciones antigénicas que podrían:
1 2
Dificultar su diagnóstico y control.
Alterar los mecanismos mediante los cuales produce la enfermedad.
Se destruye en tejido muscular tras el rigor mortis.
CONDICIONES AMBIENTALES
RESISTENCIA
Es resistente a los iodóforos, los compuestos cuaternarios de amonio, hipoclorito y fenol, especialmente en presencia de materia orgánica (Prempeh et al., 2001).
RESISTENCIA
MATRICES ORGÁNICAS

Es capaz de sobrevivir en la leche y otros productos lácteos, así como en los nódulos linfáticos y la médula ósea de los animales si se mantiene a un pH neutro.
Puede persistir en forrajes contaminados y el

La fiebre aftosa fue descrita por primera vez por Fracastoro, en el año 1546, como una epidemia que asoló Europa.
Desde entonces, la fiebre aftosa continuó ocasionando epidemias en el continente europeo hasta que, en 1954, se creó la Comisión Europea para la Lucha contra la Fiebre Aftosa de la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO).
En la actualidad, la fiebre aftosa es una enfermedad endémica en múltiples países de Asia, África, Oriente Medio y Sudamérica (González Gordon et al., 2022).
Concretamente, según datos de la Organización Mundial de Sanidad Animal (OMSA), desde comienzos de 2024 la enfermedad está activa en países como Argelia, China, Comoras, Corea del Norte, Gambia, Guinea, Iraq, Libia, Mauricio, Mozambique, Palestina, Sierra Leona, Sudáfrica, Túnez, Uganda y Zimbabue (Organización Mundial de Sanidad Animal, 2025).
De hecho, el pasado mes de enero de 2025 se detectó un foco de fiebre aftosa en una explotación de búfalos de agua (Bubalus bubalis) de Alemania (Ministerio de Agricultura, Pesca y Alimentación, 2025).
Según la información transmitida por el Ministerio de Agricultura, Pesca y Alimentación (MAPA), las autoridades de Alemania procedieron a la toma de muestras oficiales, que fueron analizadas para distintas enfermedades, confirmándose como positivas al virus de la fiebre aftosa por parte del Friedrich-Loeffler Institute de Alemania (DEU), Laboratorio Nacional de Referencia para esta enfermedad, en todos los animales de la explotación.
La cepa responsable de este brote (serotipo O, topotipo ME-SA/linaje SA 2018) también había sido detectada con anterioridad en Turquía, Irán, Omán, Emiratos Árabes Unidos, India y Nepal, teniendo la mayor homología genómica (99,8%) con un aislado procedente de Turquía en 2024.
En este sentido, las autoridades alemanas procedieron inmediatamente a adoptar todas las medidas de control establecidas en el Reglamento Delegado 687/2020, incluyendo:
La inmovilización de la explotación afectada.
El sacrificio y destrucción de animales de la explotación y otros productos que puedan vehicular el virus.
El establecimiento de una zona de protección y vigilancia alrededor del foco.
Hasta la fecha, no se han detectado nuevos focos y todas las sospechas y contactos epidemiológicos detectados han resultado negativos a fiebre aftosa.
España, el último foco tuvo lugar en Talavera de la Reina (Toledo) en 1986 y afectó solo a ganado bovino.
La vacunación empleada como método para su control finalizó en 1989 y, unos meses después, el país recuperó el estatus de libre de fiebre aftosa sin vacunación (Ministerio de Agricultura, Pesca y Alimentación, 2025).
MAPA 1
Distribución mundial de la fiebre aftosa en animales domésticos y silvestres, según los datos notificados por los países miembros de la Organización Mundial de Sanidad Animal (OMSA) entre 2005 y 2025. En rojo, países con presencia confirmada de la enfermedad; en amarillo, países con sospecha; en verde, países libres de fiebre aftosa; en gris, países que no proporcionaron información en el informe; y en blanco, países sin informes disponibles o sin brotes señalados. (Fuente: WOAH-WAHIS, consulta realizada en abril de 2025).


No existe ningún informe disponible o no se señaló brote alguno en la zona para una enfermedad presente en el país.
No se ha proporcionado información en el informe para las enfermedades seleccionadas
Ausente en el país
Sospecha
Presente
El virus de la fiebre aftosa tiene una elevada capacidad de transmisión, lo que explica su gran distribución geográfica a nivel mundial.
En una población susceptible, la morbilidad puede llegar a ser de casi un 100 %. Esto se debe, principalmente, a que el virus es capaz de acantonarse en la orofaringe de los animales infectados y liberarse en todas las excreciones y secreciones de estos individuos (aerosoles, saliva, mucus nasal, heces, orina, mucus vaginal, semen, leche, etc.), durante mucho tiempo, incluso aunque no presenten signos clínicos de la enfermedad (Belsham et al., 2024).
AFTOSA ES LA RESPIRATORIA U ORAL, YA QUE LOS ANIMALES INFECTADOS VAN A LIBERAR GRANDES CANTIDADES DE VIRUS EN
DESDE EL COMIENZO DE LA INFECCIÓN ES DE APROXIMADAMENTE UN MES (Moreno -Torres et al., 2022).
Los animales que se han recuperado de la infección y aquellos vacunados con vacunas vivas atenuadas también pueden actuar como portadores del virus.
Las piras de incineración y las fosas de purinas también son fuentes de infección.
A nivel de las granjas, el virus se puede propagar por los siguientes medios (Organización Mundial de Sanidad Animal, 2025):
Introducción de animales portadores del virus (saliva, leche, semen, etc.) que pueden contagiar al resto de los animales de la granja.
Corrales, edificios o vehículos contaminados utilizados para la estabulación y desplazamiento de animales susceptibles.
Materiales contaminados (paja, piensos, agua, leche u otros productos biológicos).
Prendas, calzado o equipos contaminados.
Carne o productos animales infectados con el virus, crudos o insuficientemente cocidos, y utilizados en la alimentación de animales susceptibles.
Dispersión del virus, en forma de aerosoles, a través de las corrientes de aire dentro de una granja con animales infectados.
Por último, es importante destacar que el ser humano juega un papel muy relevante en la transmisión y propagación de esta enfermedad, ya que puede actuar como portador asintomático del virus, que se acantona en el tracto respiratorio durante 2-6 días, también pudiendo vehicular el virus en calzado, ropa, etc.
Sin embargo, es poco frecuente que el virus de la fiebre aftosa produzca cuadros de enfermedad en personas y, cuando lo hace, tiende a ocasionar síntomas leves (Bauer, 1997; Prempeh et al., 2001; Belsham et al., 2024).
Acantonamiento en mucosa orofaríngea
Excreciones y secreciones de individuos infectados (aerosoles, saliva, mucus nasal, heces, orina, mucus vaginal, semen, leche, etc.)
Introducción de animales portadores del virus
Corrales, edificios o vehículos contaminados
TRANSMISIÓN RESPIRATORIA U ORAL
FUENTES DE INFECCIÓN
Presencia en portadores asintomáticos (recuperados de la infección o vacunados con vacuna viva atenuada)
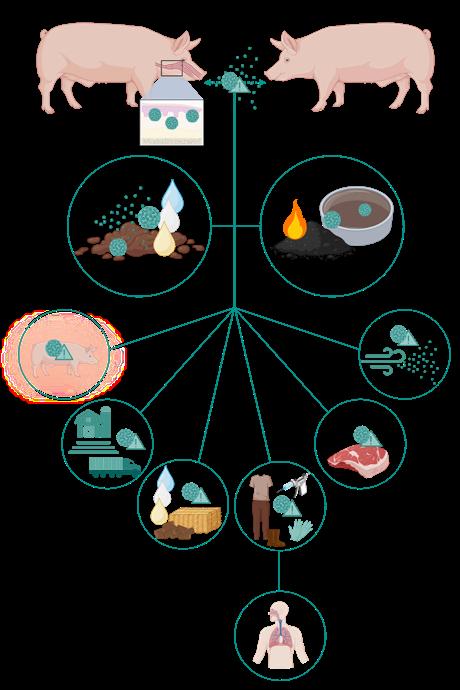
Piras de incineración y fosas de purinas
VÍAS DE PROPAGACIÓN
Dispersión de aerosoles a través de corrientes de aire

Materiales contaminados (paja, piensos, agua, leche u otros productos biológicos)
Carne o productos animales infectados con el virus Prendas, calzado o equipos contaminados
El ser humano juega un papel relevante en la transmisión y propagación de enfermedad



En
El PCV2 evoluciona rápidamente 1. Protege a tus lechones con la primera y única vacuna en Europa con dos genotipos.
COBERTURA * ANTIGÉNICA MÁS AMPLIA
frente a múltiples genotipos de PCV2 y Mycoplasma hyponeumoniae
LARGA DURACIÓN DE INMUNIDAD
Duración de la inmunidad de 23 semanas frente a PCV2 y frente a Mycoplasma hyopneumoniae
FORMULACIÓN AVANZADA
Dos genotipos PCV2 y una fracción única de M. hyopneumoniae formulada con MetaStim® para generar una potente y completa respuesta inmunitaria
DOSIS ÚNICA
Lista para usar, a partir de las 3 semanas de edad
COBERTURA** MÁS AMPLIA Y DURADERA
La mucosa de la faringe es la principal zona de entrada y replicación del virus de la fiebre aftosa, aunque también puede acceder a través del tracto gastrointestinal o de heridas
Se trata de un virus epiteliotropo, lo que significa que, una vez en el organismo, migra por la circulación linfática hacia distintos epitelios (oral, nasal, glandular, de las pezuñas, etc.):
Su replicación en las glándulas hace que esté presente en todas las secreciones de los animales infectados.
Su replicación en la cavidad oral y nasal, así como en las pezuñas, produce la aparición de las aftas típicas de la enfermedad.
El periodo de incubación es variable, dependiendo del hospedador, la vía de entrada, las condiciones ambientales y la cepa vírica implicada.

EN PORCINO, EL PERIODO DE INCUBACIÓN TIENE UNA DURACIÓN MEDIA DE 2 DÍAS, AUNQUE, EN DETERMINADAS CONDICIONES, PUEDE LLEGAR
A SER DE SOLO UNAS POCAS HORAS (Belsham et al., 2024)
Desde el punto de vista clínico, la enfermedad se caracteriza por:
Fiebre alta, pudiendo alcanzar los 41,5 °C.
Lesiones de tipo vesicular en mucosas y epitelios, produciendo dolor que, a su vez, ocasiona sialorrea, cojeras e incluso la postración de los animales, sobre todo, en ganado bovino y porcino.
(Belsham et al., 2024)
EN CERDOS, EL CUADRO CLÍNICO DURA
APROXIMADAMENTE 1-2 SEMANAS (Moreno-Torres et al., 2022)
Aunque la fiebre aftosa puede afectar a animales de todas las edades, los cuadros más graves se dan en animales muy jóvenes (menores de dos semanas de edad), pudiendo producir altas tasas de mortalidad debido a casos de miocarditis y muerte súbita o a la falta de amamantamiento si la madre también está afectada por la enfermedad.
El virus también se replica en tejido muscular, pudiendo ocasionar miositis. También pueden aparecer signos clínicos inespecíficos, como anorexia, depresión y/o pérdida de peso.
La enfermedad evoluciona con la rotura de las vesículas y la producción progresiva de anticuerpos que limitan la viremia.
Las lesiones comienzan a desaparecer y el virus desaparece del organismo, aunque persiste temporalmente en la orofaringe, quedando el animal como portador asintomático durante un tiempo.
EN EL CASO DEL GANADO PORCINO, ESTE PERIODO DE PORTADOR ASINTOMÁTICO
SUELE SER DE UNOS 30 DÍAS
En conjunto, todo ello ocasiona importantes pérdidas de producción y, aunque la mayoría de los animales afectados logra recuperarse, la infección por el virus de la fiebre aftosa puede dejar secuelas en los animales afectados, tales como infecciones crónicas secundarias, deformación de las patas con la consecuente cojera permanente, mastitis crónica y/o bajo rendimiento lechero, debilidad por lesiones cardiacas y menor ganancia de peso, así como pérdida de la regulación térmica.

La primera aproximación al diagnóstico de la fiebre aftosa se basa en la presencia de los signos clínicos descritos en el apartado anterior. Sin embargo, como se ha mencionado previamente, la fiebre aftosa es indistinguible de otras enfermedades vesiculares, especialmente en el cerdo.
En el porcino, la fiebre aftosa es clínicamente indiferenciable de la estomatitis vesicular, la enfermedad vesicular porcina y el exantema vesicular del cerdo, ya que todas ellas cursan con fiebre y la aparición de vesículas que progresan a erosiones (Belsham et al., 2024; Organización Mundial de Sanidad Animal, 2024b).
El diagnóstico definitivo de fiebre aftosa se debe confirmar de forma:
Directa, mediante el aislamiento y la detección del virus (ej.: RT-PCR), preferiblemente a partir de muestras de tejido de vesículas intactas o líquido orofaríngeo.
Indirecta, con pruebas serológicas (ej.: ELISA).
(Belsham et al., 2024; Organización Mundial de Sanidad Animal, 2024b).
La fiebre aftosa es una enfermedad vírica para la cual no existe tratamiento. Por ello, su manejo se basa en estrategias de prevención y control que abarcan desde los sistemas de detección temprana y alerta hasta la adopción de medidas de prevención conforme a las Directrices de la OMSA para la vigilancia de la fiebre aftosa (Organización Mundial de Sanidad Animal, 2024a).
Esta enfermedad está incluida en la Lista única de enfermedades de notificación obligatoria del Código Sanitario para los Animales Terrestres (2009) de la OMSA y en la Categoría A de enfermedades de notificación obligatoria de la Unión Europea.
LA FIEBRE AFTOSA ES UNA
NOTIFICARSE EN MENOS DE 24 HORAS DESDE SU DIAGNÓSTICO DEFINITIVO
Fue la primera enfermedad para la cual la OMSA estableció una lista oficial de países y zonas reconocidos libres, con o sin vacunación (Belsham et al., 2024; Organización Mundial de Sanidad Animal, 2025).
La protección de los países, áreas o zonas libres de fiebre aftosa se mantiene gracias a la vigilancia epidemiológica y a los controles estrictos de las importaciones y desplazamientos de animales y sus productos en las fronteras.
MEDIDAS DE BIOSEGURIDAD
Es fundamental que se lleven a cabo prácticas eficaces de bioseguridad a nivel de las explotaciones para prevenir la introducción o la propagación del virus. Las principales medidas recomendadas en las explotaciones son (Organización Mundial de Sanidad Animal, 2025):
Control del acceso de personas y equipos.
Control de la introducción de nuevos animales.
Mantenimiento de la higiene de corrales, edificios, vehículos y equipos utilizados.
Seguimiento, control y notificación de la enfermedad.
MEDIDAS DE CONTINGENCIA
En caso de que se detecte un brote de fiebre aftosa, deben ponerse en marcha estrategias de contingencia para erradicar la enfermedad lo antes posible. Entre estas medidas, destacan:
Destrucción de todos los animales infectados, recuperados y de contactos susceptibles a la fiebre aftosa; así como de todos sus productos.
Vigilancia y seguimiento de rebaños potencialmente infectados o expuestos a la infección.
Cuarentena estricta y control de los desplazamientos de los animales, equipos y vehículos.
Desinfección completa de los establecimientos y de todo el material infectado (ropa, equipos, vehículos, etc.).
En los países o zonas endémicos, se puede complementar la eliminación selectiva con la vacunación de animales susceptibles, pero es imprescindible tener en cuenta que las vacunas usadas deberán proteger contra la cepa particular del virus circulante en cada región geográfica (Organización Mundial de Sanidad Animal, 2024b).
En las regiones libres de fiebre aftosa sin vacunación, como es el caso de la Unión Europea, la vacunación profiláctica está prohibida, dado que puede interferir con los resultados de las pruebas diagnósticas y los animales vacunados también pueden actuar como portadores del virus.
No obstante, en caso de detectarse un foco de fiebre aftosa en estas regiones, las autoridades pueden considerar la autorización de la vacunación de emergencia como medida de contención para tratar de limitar la propagación de la enfermedad.
ESPAÑA NO EXISTEN VACUNAS AUTORIZADAS PARA LA FIEBRE AFTOSA (Belsham et al., 2024; Organización Mundial de Sanidad Animal, 2025), POR LO QUE LAS MEDIDAS DE BIOSEGURIDAD Y LA VIGILANCIA
EPIDEMIOLÓGICA SON LAS ESTRATEGIAS MÁS EFICACES PARA SU PREVENCIÓN Y CONTROL

1.Bauer, K. (1997). Foot- and-mouth disease as zoonosis. Archives of virology. Supplementum, 13, 95–97. https://doi.org/10.1007/978-3-70916534-8_9
2.Belsham, G. J., Botner, A., Lohse, L. (2024). Foot-and-mouth disease in animals. The Merck veterinary manual. Whitehouse Station, NJ:Merck & Co., Inc.
3.González Gordon, L., Porphyre, T., Muhanguzi, D., Muwonge, A., Boden, L., & Bronsvoort, B. M. C. (2022). A scoping review of foot-and-mouth disease risk, based on spatial and spatio-temporal analysis of outbreaks in endemic settings. Transboundary and emerging diseases, 69(6), 3198–3215. https://doi.org/10.1111/tbed.14769
4.Grubman, M. J., & Baxt, B. (2004). Footand-mouth disease. Clinical microbiology reviews, 17(2), 465–493. https://doi.org/10.1128/ CMR.17.2.465-493.2004
5.Ministerio de Agricultura, Pesca y Alimentación (2025). Fiebre aftosa. https://www.mapa.gob.es/ es/ganaderia/temas/sanidad-animal-higiene-ganadera/sanidad-animal/enfermedades/fiebre-aftosa/fiebre_aftosa.aspx
6.Moreno-Torres, K. I., Delgado, A. H., Branan, M. A., Yadav, S., Stenfeldt, C., & Arzt, J. (2022). Parameterization of the durations of phases of foot-and-mouth disease in pigs. Preventive veterinary medicine, 202, 105615. https://doi. org/10.1016/j.prevetmed.2022.105615
7.Organización Mundial de Sanidad Animal, (2024a). - Terrestrial Animal Health Code. WOAH, Paris.
8.Organización Mundial de Sanidad Animal, (2024b). - Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. WOAH, Paris.
9.Organización Mundial de Sanidad Animal,
(2025). WOAH Technical Disease Card – Foot and mouth disease. https://www.woah.org/en/document/oie-technical-disease-card-foot-and-mouth-disease/
10.Prempeh, H., Smith, R., & Müller, B. (2001). Foot and mouth disease: the human consequences. The health consequences are slight, the economic ones huge. BMJ (Clinical research ed.), 322(7286), 565–566. https://doi.org/10.1136/ bmj.322.7286.565



Ibai, tu equipo es genial... Pero los porcinos son lo nuestro.


Nueva vacuna bivalente intradérmica sin aguja frente a Circovirus porcino tipo 2 y M. hyopneumoniae.
Controla hasta
patologías con 4 dispositivo IDAL® 1
Posibilidad de mezclar con Porcilis® Lawsonia ID y/o aplicarse de forma simultánea con Porcilis® PRRS.



