






Long-term implant can be placed any time prior to surgery⁶
Highly visible under imaging, including MRI

Precise surgical guidance with accurate detection to ±1mm³
detection 60mm depth
and capabilities³

Provides a better patient experience, recommended by 97% of patients¹



TEMAER I 2025:
Nr. 1. Plastikkirurgi
Nr. 2. Bryst- og endokrinkirurgi
Nr. 3. IBD
Nr. 4. Nevrokirurgi
INNLEVERINGSFRISTER:
Kirurgen nr 3-25: 24. august
Kirurgen nr 4-25: 24. oktober

Kirurgen ønsker å være en nasjonal plattform for kirurgi ved å inspirere til faglig kompetanseheving, bedre utdanning og opplæring av unge kirurger, samt øke interessen for kirurgisk forskning.
– VISJON, KIRURGEN
UTGIVER
Norsk Kirurgisk Forening
Pb 17 Kjelsås, 0411 Oslo
ISSN 1504-88 88
REDAKSJON
Tobias Hauge (redaktør) OUS Ullevål tobias@kirurgen.no
Marte Bliksøen (redaksjonsmedlem) OUS Rikshospitalet marte@kirurgen.no
Saira Mauland Mansoor (redaksjonsmedlem) Vestre Viken Bærum sykehus saira@kirurgen.no
David Hui (redaksjonsmedlem) OUS Rikshospitalet david@kirurgen.no




FASTE SPALTER
Ord fra redaktøren 76
Ord fra lederen i NKF
Bryst- og endokrinkirurgi – behandlingsprinsipper i endring 79
Kirurgisk tilnærming etter neoadjuvant behandling for brystkreft 80
Onkoplastisk brystbevarende kirurgi: En ny tilnærming til brystkreftbehandling 86
Merking av tumores i brystet Nye metoder for å trygge og optimalisere brystkreftbehandling 92
Anaplastisk thyreoideakarsinom nye behandlingsprinsipper – bedre prognose 96
Paratyreoidea – små kjertler, stor fysiologisk betydning. Kirurgisk behandling av primærog tertiær hyperparatyreoidisme.
robotkirurgi
Akutte hendelser i bryst- og endokrinkirurgisk praksis
LAYOUT, PRODUKSJON OG ANNONSESALG
Apriil Media AS www.apriil.no
Annonsesalg ragnar.madsen@apriil.no
Tlf.: 92 84 84 02
En mann i 80-årene med nekrotisk sår på hånden etter fisketur 124
Reisebrev fra Norwegian International Hernia Team 127
Endoskopisk behandling av Bouverets syndrom hos en multimorbid pasient 130

Forsideillustrasjon: Harald Kryvi

TOBIAS HAUGE , REDAKTØR
TOBIAS @ KIRURGEN.NO
Det har skjedd mye spennende i Kirurgen siden forrige utgivelse. Over mange år har Webpress ved John Brataas stått ansvarlig for den tekniske løsningen i forbindelse med utgivelse av Kirurgen og drift av kirurgen.no. Dette har vært et fruktbart samarbeid hvor Kirurgen har fått mulighet til å gjennom store omveltninger i alt fra design, fokusområder til redaksjonelt arbeid. Webpress har hele veien vært en profesjonell aktør og vi ønsker å takke Webpress for et godt samarbeid gjennom mange år.
Fra og med dette nummeret vil Apriil Media stå for den tekniske løsningen. De har bred erfaring med utgivelse av andre norske medisinske fagtidsskrifter og vi ser fram imot et spennende samarbeid. Men, selv om vi får ny tjenesteleverandør, vil fokuset for Kirurgen fremdeles være det samme – vi skal være et fagtidsskriftet for kirurger, skrevet av kirurger. Et fagtidsskrift som motiverer, vekker interesse og har tema både for den spesielt interesserte og for den generelle kirurg. Rett og slett et blad dere liker!
Siden sist utgivelse, har det også vært utskiftelse i redaksjonen. Vår trofaste redaksjonsmedlem, Ingvar Rognum fra Bærum sykehus, takker for seg etter mange års utmerket arbeid. Vi i redaksjonen ønsker å takke Ingvar for all den tid han har lagt den i Kirurgen. Lykke til videre!
Tema for denne utgivelse av Kirurgen er bryst- og endokrinkirurgi. Her venter dere mange spennende temaer med alt fra robotassistert endokrinkirurgi til tips og triks på vakt.
Vi har den siste tiden hatt en skrivekonkurranse hvor vinnerartikkelen presenteres i denne utgivelsen. Dette er en spennende pasientkasuistikk, skrevet av Sara Namek og Tone Myrland ved Plastikkirurgisk avdeling Sykehuset Telemark, hvor du kan lese om sammenhengen mellom et nekrotisk sår og en fisketur. Jeg ønsker riktig god lesing.
Til slutt ønsker jeg og hele redaksjonen dere alle en riktig god sommer!
MARI - LIIS.KALJUSTO @ OUS - HF.NO Foto: Arkady

MARI - LIIS KALJUSTO , LEDER NKF
Vi har en robot-gressklipper fra Bosch - en grønn, merkelig, for ikke å si lite intelligent, apparat med en stor rød knapp. Denne jobber seg gjennom hagen i diagonaler og må på pleie til «robot-sykehuset» et par ganger i året. Vi har døpt den Hugo og håper den holder seg i såpass form at plenen er i stand til å stå imot blikket fra naboen vår, som på sin side har en perfekt golfbane til plen. Det er min eneste kontakt med robot i hverdagen og det begrenser seg til sommerhalvåret.
Har jeg noen gang drømt om å ha en operasjonsrobot?
En med leddete instrumentarmer som mestrer presisjon og stabilitet på et nivå som langt overgår evnene til de fleste kirurger? En robot utstyrt med 3D-visning og bildeklarhet som gjør at man føler seg som om man vandrer i kroppens indre landskap - noe man nesten trodde var utenkelig?
Det dreier seg ikke om meg eller mine preferanser. Som kirurg har jeg allerede en givende og meningsfull jobbrikelig med travle dager, så å lære seg ny teknologi ville sannsynligvis bare legge til et ekstra stressmoment. Sannheten er at mine pasienter møter en kirurg som bruker velprøvde gamle teknikker, akkurat som en gjorde for 10, 20 og til og med 30 år siden.
For mine pasienters skyld skulle jeg ønsket meg en robot på operasjonsstuen. Det ville vært fint å se dem på egne ben allerede operasjonsdagen. For 80-åringer med sårbart vev kan selv minimalt operasjonstraume være nok til å forvandle en aktiv og vital mosjonist til en pasient på sykehjem (og verre). Antallet eldre og syke som trenger kirurgisk behandling vokser, og dette må tas med i vurderingen når vi snakker om kostnadene ved robot-assistert kirurgi. Her kan man raskt se konsekvensene av bevart helse, uten å glemme liggedøgnene og kostnadene for engangsutstyret som roboten krever.
Beslutningsforum sin konklusjon om robot-assistert kirurgi og påfølgende diskusjon i vår har ført til at fagdirektørene i RHF´ene har invitert det kirurgiske fagmiljøet til å legge en interregional strategi for videre bruk av robot-assistert kirurgi. Spørsmålene står i kø: for hvem, hvor mange, hvor skal det foregå, og så videre. Arbeidet skal være ferdig i høst og vi håper at de involverte får tilstrekkelig tid og fri fra andre forpliktelser til å dykke ned i dette viktige arbeidet. Massevis med lykke til!
Med ønske om en god sommer, På vegne av styret i NKF Mari-Liis Kaljusto
Curved Jaw, Single-Action

Curved Jaw, Double-Action Straight Jaw, Double-Action
Laparoscopic Portfolio
The Next Level of Advanced Bipolar Technology
· Confident vessel sealing.
· Multifunctional design.
· Ergonomic comfort.
The Choice Is Yours
· Three different jaw styles.
· Three shaft lengths.
· One common handle design.
For more information, please contact us or visit www.olympus.no

INGRID MUNTHE ALM ANDERSEN
SEKSJON FOR BRYST- OG ENDOKRINKIRURGI, KREFTKIRURGISK AVDELING, OUS
KORRESPONDANSE: ANINGR @ OUS - HF.NO

INGRID MUNTHE ALM ANDERSEN
Spesialiteten bryst- og endokrinkirurgi er nå nærmere 20 år, med godt etablerte og sterke fagmiljøer spredt over hele Norge. Gruppen av bryst- og endokrinkirurger innehar spisskompetanse innen behandling av cancer mamma, cancer thyreoidea og annen kirurgisk thyreoideasykdom, hyperparathyreoidisme, og binyretumores, og kirurgene har etablert tett samarbeid med endokrinologer, onkologer, patologer, nukleærmedisinere, radiologer og plastikkirurger.
Mye har skjedd innen faget vårt i løpet av perioden siden spesialiteten ble etablert. For eksempel har den kirurgiske brystkreftbehandlingen endret seg markant over de siste tre tiårene, etter at brystbevarende kirurgi ble gradvis implementert i klinisk praksis på 90-tallet. Brystbevarende kirurgi er nå den dominerende operasjonsmetoden for brystkreft, og 90 prosent av alle brystkreftoperasjonene i Norge er brystbevarende ved primærkirurgi for svulster inntil 3 cm. Videre ble vaktpostlymfeknuteoperasjon i armhulen introdusert i Norge på begynnelsen av 2000 tallet, og med dette har færre og færre pasienter trengt å gjennomgå aksilledisseksjon, med risiko for senskader det kan føre med seg. For at brystbevarende operasjon skal være mulig hos en høy andel av brystkreftpasientene, og at nedskalering av aksillekirurgi skal være mulig, er også neoadjuvant behandling for brystkreft og onkoplastisk brystkirurgi
av betydning. I dette nummeret av Kirurgen får dere lese om brystkreftkirurgi etter neoadjuvant behandling, onkoplastisk brystkreftkirurgi, og lokaliseringsteknikker i brystet for å optimalisere den brystbevarende reseksjonen.
Også innen endokrinkirurgi har stadig nye behandlingsprinsipper tilkommet, og samtidig er incidens av thyreoideacancer og deteksjon av parathyreoideasykdom økende. I denne utgaven får dere lese om behandling av anaplastisk thyreoideacancer, som tidligere hadde begrensete behandlingsmetoder, men hvor nye medikamenter og behandlingsprinsipper kan gi en bedret prognose til denne pasientgruppen. Videre er behandling av hyperparathyreodisme trukket frem i denne utgaven. Parathyreoideakjertlene er små, men kan gi betydelig systemisk sykdom ved forstyrrelser av kalsium-homeostasen, og vi synes det er interessant å kunne presentere dette samt kirurgisk behandling av hyperparathyreoidisme for våre kolleger. I mange kirurgiske spesialiteter har robot-assistert kirurgi blitt veletablert, og også innen endokrinkirurgi er slik behandling etablert med robotassistert adrenalektomi og – thyreoidektomi, og dette beskrives også i denne utgaven av Kirurgen.
Ofte blir bryst- og endokrinkirurgi omtalt som et meget ‘elektivt’ kirurgisk fag, men på tampen har vi også tatt med litt om akutte tilstander i bryst og endokrinkirurgi. Dette vil kanskje spesielt være interessant for de yngre kollegene som treffer bryst- og endokrinkirurgiske pasienter i forbindelse med vaktarbeid.
Jeg vil rette en stor takk til alle forfatterne av temaartiklene, og jeg vil også takke styret i Norsk Forening for Bryst- og Endokrinkirurgi for et fint samarbeid om hvilke deler av faget vårt vi ville fremheve i dette nummeret av Kirurgen.
Riktig god lesning!
Neoadjuvant behandling innebærer systemisk terapi administrert før kirurgi med mål om å redusere tumorbyrde, muliggjøre deeskalert kirurgi i bryst og aksille og vurdere tumorbiologi in vivo. Neoadjuvant behandling brukes i økende grad, både nasjonalt og internasjonalt og krever gode detaljerte behandlingsforløp og bred tverrfaglig kompetanse.
INGER CHRISTINE L’ORANGE, LENE CATHRIN JOHNSEN, HELLE KRISTINE SKJERVEN
BRYST- OG ENDOKRINKIRURGISK SEKSJON, AVDELING FOR KREFTKIRURGI OUS
KORRESPONDANSE: INGER CHRISTINE L’ORANGE – INGLOR @ OUS - HF.NO

Neoadjuvant behandling kan bestå av kjemoterapi, ofte i kombinasjon med immunterapi for trippel-negative tumorer, HER2-rettet terapi for HER2-positive tumorer, eventuelt endokrin behandling for hormonreseptorpositive svulster.
Beslutning om neoadjuvant behandling tas i et multidisiplinært møte (MDT), der onkolog, patolog, radiolog og kirurg med kompetanse i onkoplastisk brystkirurgi vurderer pasientens sykdom basert på cTNM-status og tumorbiologi. Primærutredningen inkluderer klinisk undersøkelse, bildediagnostikk (mammografi/tomosyntese, ultralyd og MR) og histopatologi. En tentativ onkologisk og kirurgisk behandlingsplan skisseres basert på primærutredningen, men kan justeres basert på onkologisk respons under behandlingen.
Det er indikasjon for neoadjuvant behandling for pasienter diagnostisert med lokalavansert sykdom (cT3 eller cT4) og/eller brystkreftsykdom med lokalavansert lymfeknutemetastasering (cN2-3) hvor det ikke er påvist fjernmetastaser. I tillegg er det også anbefalt ved cT2-svulster og ved cT1N1-stadium, HER2-positiv eller trippel negativ sykdom (1). Per i dag har vi ikke evidens for å si at neoadjuvant behandling bedrer prognosen sammenlignet med adjuvant behandling, men den gir muligheten til å vurdere tumorrespons på systemisk behandling, som kan ha implikasjoner for videre adjuvant terapi (2). (Figur 1: TNM staging)
For å sikre at tumorområdet kan identifiseres ved operasjon, legges det inn en eller flere markører i tumorområdet før oppstart av behandling. Markører er særlig viktige i de tilfellene der det er komplett radiologisk respons (3). Preoperativ markering av tumor er essensielt for responstilpasset kirurgisk behandling. Flere forskjellige markører er i bruk i Norge, og de har alle fordeler og ulemper. Da MR brukes som ledd i responsevaluering, er MR kompatibilitet viktig i valg av markør.
Jodkorn gir en langtidsholdbar markering med høy presisjon, men krever spesifikke prosedyrer for håndtering pre, per- og postoperativt. Dette inkluderer prosedyrer for håndtering av radioaktivt avfall. Radar-markører angir nøyaktig lokalisasjon i brystet, men krever eget utstyr peroperativt og kan gi artefakter på MR. Kull-markering er enkel å implementere og billig. Den kan imidlertid diffundere over tid og gjøre eksakt peroperativ lokalisasjon vanskelig. Titan-klips er en permanent markør som er enkel å plassere, men kan være vanskelig å identifisere ved enkelte bildediagnostiske metoder og krever preoperativ trådmarkering (4). Studier viser at bruk av markører reduserer risikoen for positive kirurgiske marginer og forbedrer presisjonen ved brystbevarende kirurgi (5). (Bilde 1)
RESPONS BASERT PÅ TUMORBIOLOGI OG
RESPONSMØNSTER
Tumors respons på neoadjuvant behandling varierer med tumorbiologi. Komplett patologisk respons (pCR) betyr at man ikke finner gjenværende invasiv sykdom ved histopatologisk undersøkelse. pCR etter neoadjuvant behandling gir bedret prognose, både residivfri og total overlevelse (3,2). Trippel-negativ og HER2-positiv brystkreft har høy sannsynlighet for pCR (50-70 %) (6). Hormonreseptor-positiv og HER2-negativ brystkreft har lavere pCR-rate (10-20 %) og ofte et mer diffust responsmønster, som kan gjøre den kirurgiske vurderingen av type inngrep mer utfordrende (7). Lobulær brystkreft har lav pCR-rate (<10 %), høy risiko for inkomplett reseksjon med økt risiko for ufrie marginer og behov for rereseksjon (8).
Morfologisk ses også ulike responsmønstre. Konsentrisk skrumpning er typisk for trippel-negativ og HER2-positiv brystkreft. Spredt respons er vanligere ved hormonreseptor-positive tumorer, spesielt lobulær brystkreft, noe som kan komplisere kirurgisk planlegging (9). (Graf 1) (Bilde 2)
1: Mammografi med titanmarkør i tumor og merketråder som viser utbredelse av gjenværende kalk som anbefales eksidert.

BILDE 2: MR bilder før og etter neoadjuvant systemisk behandling med komplett radiologisk respons.
patologisk respons %
GRAF 1: Andel med patologisk komplett patologisk respons etter neoadjuvant behandling for klinisk stadium II-III pasienter, fordelt på immunhistokjemiske subtyper, operasjonsår 2021–2023 i henhold til Nasjonalt kvalitetsregister for bryst 2023 (6).
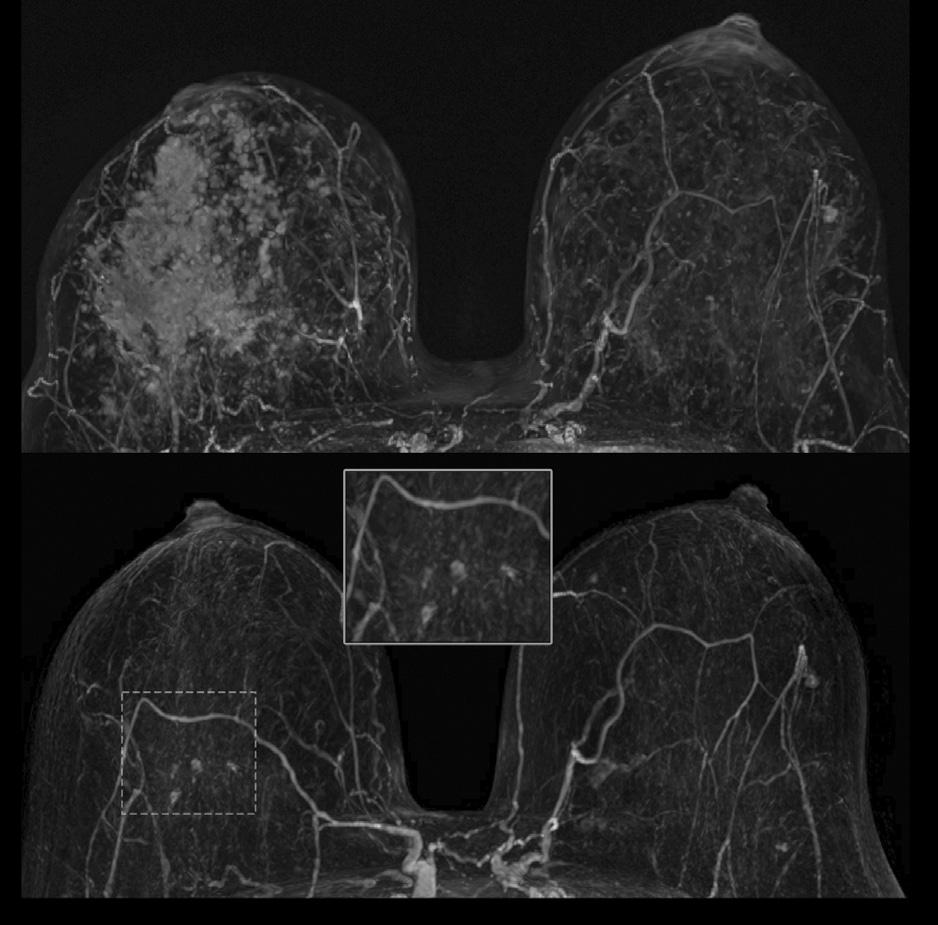
BILDE 3: MR-bilder før og etter neoadjuvant systemisk behandling med spredt radiologisk responsmønster.
EVALUERING AV RESPONS OG KIRURGISK STRATEGI
MR er standard modalitet for evaluering av behandlingsrespons, med sensitivitet på 86-92 % og spesifisitet på 60-89 % (10). Mammografi er viktig ved maligne mikroforkalkninger, da gjenværende DCIS (ductalt carcinoma in situ) kan være til stede selv ved komplett respons på MR (11). Pasientene diskuteres i et eget MDT-møte, der strategi for responstilpasset kirurgi legges. Her vurderes radiologisk og klinisk utredning før og under/etter den neoadjuvante behandlingen. I tillegg planlegges peroperativ merking av gjenværende tumorområde i tilfeller der brystet kan bevares, enten ved hjelp av merketråder (guidewire) mot tidligere innlagte markører eller ved hjelp av prober dersom pasienten har fått jodkorn, radarmarkør eller tilsvarende. En plan for kirurgi i bryst og aksille legges. Endelig beslutning om kirurgisk prosedyre gjøres basert på klinisk undersøkelse, komorbiditet og alltid i samråd med pasienten.
BRYSTKIRURGI ETTER NEOADJUVANT BEHANDLING
Brystbevarende kirurgi
Brystbevarende kirurgi er indisert for pasienter med god respons, der under 20 % av brystvevet må fjernes. Denne kirurgiske tilnærmingen bevarer brystets naturlige form og reduserer behovet for rekonstruktive inngrep. Fordelene inkluderer kortere operasjonstid, raskere postoperativ restitusjon og lavere risiko for kirurgiske komplikasjoner. Pasientene beholder også bedre følelse
i brystet sammenlignet med mastektomi med rekonstruksjon. Ulempene inkluderer økt risiko for positive reseksjonsmarginer, spesielt ved mer diffust vekstmønster, samt behov for adjuvant strålebehandling for å redusere risikoen for lokalt residiv i brystet (1).
Onkoplastisk brystbevarende kirurgi
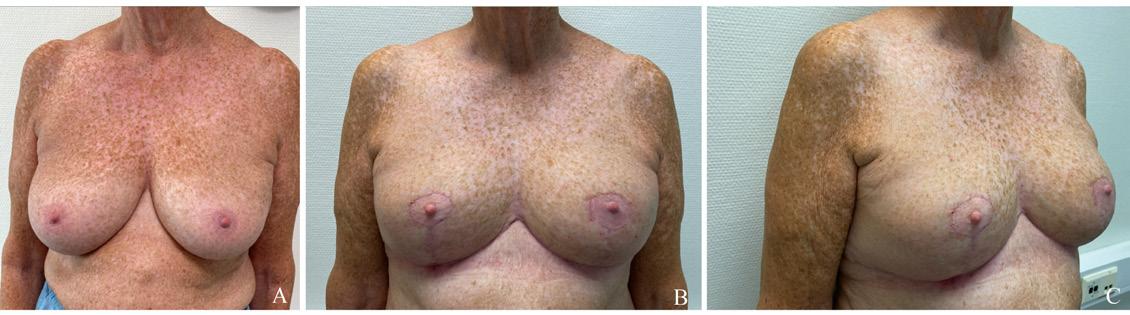
Onkoplastikk kombinerer prinsipper fra kreft- og plastikkirurgi for å optimalisere onkologisk sikkerhet og kosmetisk resultat. Dette muliggjør større reseksjoner enn ved enkel brystbevarende kirurgi, samtidig som brystets form og symmetri bevares. Teknikkene er spesielt nyttige ved større tumorreseksjoner eller ugunstig tumorlokalisasjon hvor alternativet ellers ville vært mastektomi. En vanlig variant er terapeutisk reduksjonsplastikk som krever et visst volum og ptose. Pasienten må da akseptere et noe mindre volum postoperativt og det vil ofte være behov for kontralateral symmetrisering (12). Lateral intercostal artery perforator flap (LICAP) er en form for erstatningsplastikk som egner seg for pasienter med moderat bryststørrelse og tilstrekkelig subkutant fettvev. Metoden kan brukes til å erstatte volumtap etter større tumorreseksjoner, samtidig som den opprettholder brystets naturlige kontur og reduserer risikoen for asymmetri (13). I 2024 ble 69,7 % av norske neoadjuvant behandlede pasienter operert med ulike brystbevarende kirurgiske teknikker (6).
Mastektomi
Enkel mastektomi eller ablatio er indisert ved T4-tumores uavhengig av respons, samt der hvor MDT fraråder hudbesparende strategier ut fra radiologi eller klinisk undersøkelse. Denne prosedyren innebærer fullstendig fjerning av brystvevet uten bevaring av hud eller mamillekompleks. Fordelene inkluderer en mer omfattende reseksjon som reduserer risikoen for gjenværende sykdom mot hud og eliminerer behovet for ytterligere kirurgiske inngrep. Ulempene er kosmetisk deformitet, et potensielt behov for senere rekonstruksjon, samt ofte fysiske og psykologiske utfordringer for pasienten (14).
Hudbesparende eller nippelsparende mastektomi vurderes dersom det er onkologisk trygt, for eksempel hos pasienter med god respons og begrenset restsykdom på MR, men utbredt gjenværende malign kalk. Denne teknikken kan være aktuell dersom tumor ikke har affisert hud primært. Det må gjøres en nøye vurdering av onkologisk sikkerhet, spesielt hos pasienter med sentral tumorvekst og liten avstand til mamillekomplekset, der risiko for restsykdom kan være høyere (15).
Rekonstruksjon av bryst
Rekonstruksjon av brystet kan utføres som primær eller sekundær prosedyre, med valg mellom protese eller autologt vev. Protesebasert rekonstruksjon innebærer raskere operasjonstid og mindre donorstedsmorbiditet, men kan være assosiert med utvikling av kapselkontraktur og ofte et behov for senere revisjoner. Risikoen for kapselkontraktur øker betydelig etter strålebehandling, som er indisert hos en stor andel av pasientene som mottar neoadjuvant behandling. Ved primær protesebasert rekonstruksjon kan prepektoral plassering være mulig ved adekvat hudkvalitet og fravær av dorsal tumor. Fordelene med prepektoral plassering inkluderer mindre postoperativ smerte, redusert risiko for animasjonsdeformitet og kortere rehabiliteringstid. Ulempene er høyere risiko for rippling og mer synlig protese, samt noe volumbegrensning i primær settingen (16).
Autolog rekonstruksjon, som for eksempel DIEP (deep inferior epigastric perforator flap), gir ofte et mer naturlig estetisk resultat og bedre langtidsholdbarhet. Denne type operasjon krever lengre operasjonstid med mikrokirurgisk kompetanse og innebærer potensielt komplikasjoner også fra donorstedet. Autolog primær rekonstruksjon etter neoadjuvant behandling er ikke et rutinemessig etablert tilbud per i dag for norske brystkreftpasienter, men vil forhåpentligvis kunne bli det. Delayed autolog rekonstruksjon, der man legger inn protese midlertidig i påvente av endelig autolog rekonstruk-
sjon kan være et alternativ. Mindre omfattende autologe metoder, som Goldilocks-mastektomi, der lokalt vev brukes for å skape en brystlignende kontur uten implantat, kan også vurderes hos utvalgte pasienter. Valg av metode avhenger av pasientens komorbiditet, anatomi, preferanser, behov for strålebehandling og onkologiske faktorer (17).
AKSILLEKIRURGI ETTER NEOADJUVANT BEHANDLING
Sentinel node biopsi
Sentinel node biopsi (SNB) er en minimal-invasiv staging metode for å evaluere spredning til aksillære lymfeknuter ved brystkreft. SNB innebærer identifikasjon og fjerning av den første lymfeknuten (eller de første få) som mottar drenasje fra primærtumor. Dette gir informasjon om tumorens lymfogene spredningsmønster og kan redusere behovet for aksilledisseksjon hos pasienter med negativ SNB, noe som reduserer risikoen for lymfødem og andre komplikasjoner. Dersom pasienten er diagnostisert primært som cN0, utføres SNB med identifikasjon av minst én sentinel node. Ved cN1 konvertert til cN0 utføres SNB med minst tre identifiserte lymfeknuter for å redusere falsk negativ rate (18). Alternativt kan man utføre targeted axillary dissection (TAD). TAD er en prosedyre, der SNB og målrettet fjerning av en tidligere merket patologisk lymfeknute i aksillen kombineres. Lymfeknuten kan merkes med ulike metoder tilsvarende tumor i brystet, og vaktpostprosedyren gjøres ellers på vanlig måte (19). Hensikten er å sikre at påviste metastase tas med ut uten å gjøre aksilledisseksjon, og målet er å evaluere responsen på neoadjuvant behandling både i påvist lymfeknutemetastase og i sentinel node. I over halvparten av tilfellene er den markerte lymfeknuten også sentinel node (20), men i de tilfellene det ikke er det, kan TAD sikre at metastatiske lymfeknuter fjernes. TAD kan være en strategi for å skreddersy aksillekirurgien, og metoden kan spare noen pasienter for aksilledisseksjon.
I motsetning til hos pasienter operert primært, aksepteres kun isolerte tumorceller i sentinel node før aksilledisseksjon er indisert, mot opptil to patologiske lymfeknuter med makrometastaser i en primærkirurgisk setting. Responsraten i aksillen er tilsvarende hva man ser i bryst (21) og en rekke pasienter som tidligere ble operert med aksilledisseksjon blir i dag kun operert med SNB.
Aksilledisseksjon
Aksilledisseksjon er et kirurgisk inngrep, der lymfeknuter i aksillens nivå 1 og 2 eksideres for å vurdere og kontrollere spredning av brystkreft. Aksilledisseksjon gir en mer omfattende staging og lokal kontroll. Det er
en betydelig høyere risiko for komplikasjoner som lymfødem, sensoriske forstyrrelser og redusert skulderbevegelighet med dette inngrepet (22).
Pasienter som mottar neoadjuvant behandling opereres direkte med aksilledisseksjon ved persisterende metastaser etter neoadjuvant behandling, samt ved lokalavansert aksillestatus primært (cN2-3) uavhengig av respons. Aksilledisseksjon er også indisert ved T4-svulster uavhengig av aksillestatus, da sensitiviteten og spesifisiteten på SNB i denne situasjonen så langt er uavklart.
Rereseksjonsrate etter neoadjuvant behandling
Studier viser at rereseksjonsraten etter neoadjuvant behandling er høyere enn ved primær kirurgi, særlig ved lobulær kreft og gjenværende DCIS (23). Raten varierer fra 20-30 %, avhengig av tumorbiologi og responsmønster (24). MDT-vurdering og onkoplastiske teknikker kan redusere behovet for reoperasjon (25).
KAN KIRURGI UTELATES HOS ”EXCEPTIONAL RESPONDERS”?
Muligheten for å utelate kirurgi hos pasienter med komplett respons på neoadjuvant behandling er et tema for pågående forskning. Studier har vist at enkelte pasienter med komplett respons (pCR) har svært lav risiko for
terapi (26). Det er imidlertid usikkerhet knyttet til påliteligheten av radiologisk og patologisk evaluering av respons, og dagens standard er fortsatt kirurgisk fjerning av tumorområdet for å sikre kurativ behandling. Randomiserte studier pågår for å avklare hvorvidt selekterte pasientgrupper kan unngå kirurgi uten kompromiss i onkologisk utfall (27,28). Det er også uavklart hvor omfattende aksillekirurgi som er nødvendig etter neoadjuvant behandling.
KONKLUSJON
Kirurgiske beslutninger etter neoadjuvant behandling krever erfaring med responsbasert vurdering, presis bildediagnostikk og bredt tverrfaglig samarbeid. Onkoplastiske teknikker kan utvide indikasjonen for brystbevarende kirurgi og forbedre både onkologiske og kosmetiske resultater. Videre forskning må avklare om kirurgi kan utelates hos utvalgte pasientgrupper. Individualisert behandling og multidisiplinær tilnærming er avgjørende for optimale pasientutfall.
REFERANSER :
Se bakerst i nettutgaven på kirurgen.no

Rask testosteronsuppresjon. Rask gjenopprettelse av testosteron ORGOVYX® (relugoliks)

For behandling av voksne pasienter med fremskreden hormonsensitiv prostatakreft2
*
ADT= Androgen Deprivation Therapy
*Behandling av avansert hormonavhengig prostatakreft. Refusjonskoder: ICPC Y77: Ondartet svulst i prostata. ICD C61 Ondartet svulst i blærehalskjertel. Vilkår 9: Behandlingen skal være instituert i sykehus, sykehuspoliklinikk eller av spesialist i vedkommende disiplin.


Referanser: 1. Shore ND, et al. N Engl J Med. 2020;382(4):2187–2196. 2. Preparatomtale Orgovyx (relugoliks), seksjon 4.1 og 5.1. www.felleskatalogen.no.
Dette legemidlet er underlagt særlig overvåking. Orgovyx (relugoliks) 120 mg filmdrasjerte tabletter, ATC-nr.: L02BX04, Reseptgruppe: C. Reseptbelagt. Indikasjon: Behandling av voksne pasienter med fremskreden hormonsensitiv prostatakreft. Dosering og administrasjonsmåte: Behandling med Orgovyx skal startes og overvåkes av spesialleger med erfaring innen medisinsk behandling av prostatakreft. Behandling med Orgovyx skal innledes med en startdose på 360 mg (tre tabletter) på den første dagen, etterfulgt av en dose på 120 mg (én tablett) som tas én gang daglig på omtrent samme tid hver dag. Orgovyx kan tas med eller uten mat. Tablettene bør tas med litt væske etter behov, og skal svelges hele. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Advarsler og forsiktighetsregler: Androgen deprivasjonsterapi kan forlenge QT-intervallet. Hos pasienter med en historie med eller risikofaktorer for QT-forlengelse samt hos pasienter som samtidig får legemidler som kan forlenge QT-intervallet, må man nøye evaluere samtidig bruk av Orgovyx med legemidler kjent for å forlenge QT-intervallet, eller legemidler som kan indusere torsades de pointes, slik som klasse IA (f.eks. kinidin, disopyramid) eller klasse III (f.eks. amiodaron, sotalol, dofetilid, ibutilid) antiarytmika, metadon, moksifloksacin, antipsykotika osv. Hjerte- og karsykdom slik som myokardinfarkt og slag har blitt rapportert for pasienter som fikk androgen deprivasjonsterapi. Derfor bør alle risikofaktorer for hjerte- og karsykdom tas med i beregningen. Redusert bentetthet kan forekomme. Redusert bentetthet, hos pasienter med ytterligere risikofaktorer, kan føre til osteoporose og økt risiko for benfraktur. Overvåkning av leverfunksjon hos pasienter med kjent eller mistenkt leversykdom er tilrådelig under behandling, da det er observert lette forbigående økninger i ALAT og ASAT. Forsiktighet ved alvorlig nedsatt nyrefunksjon. Eksponeringen for relugoliks hos pasienter med alvorlig nedsatt nyrefunksjon kan være økt med opptil 2 ganger. Det må utvises forsiktighet hos pasienter med alvorlig nedsatt nyrefunksjon ved administrasjon av en 120 mg dose med relugoliks én gang daglig. Effekten av Orgovyx skal overvåkes via kliniske parametere og nivåer av prostataspesifikt antigen (PSA) i serum. Interaksjoner: P-gp-hemmere: Samtidig administrasjon av Orgovyx og orale P-gp-hemmere anbefales ikke. Legemidler som er orale P-gp-hemmere inkluderer visse legemidler mot infeksjon (f.eks. azitromycin, erytromycin, klaritromycin, gentamicin, tetracyklin), antimykotika (ketokonazol, itrakonazol), antihypertensiva (f.eks. karvedilol, verapamil), antiarytmika (f.eks. amiodaron, dronedaron, propafenon, kinidin), antianginale legemidler (f.eks. ranolazin), cyklosporin, humant immunsviktvirus (hiv)- eller hepatitt C-virus (HCV)-proteasehemmere (f.eks. ritonavir, telaprevir). Hvis samtidig administrasjon med orale P-gp-hemmere én eller to ganger daglig er nødvendig, skal Orgovyx tas først og den orale P-gp-hemmeren tas 6 timer senere, og pasientene skal overvåkes hyppigere for bivirkninger. Alternativt kan behandling med Orgovyx avbrytes i opptil 2 uker for en kort behandlingsperiode med en P-gp-hemmer. Hvis behandling med Orgovyx avbrytes i mer enn 7 dager, skal administrasjon av Orgovyx gjenopptas med en startdose på 360 mg på den første dagen etterfulgt av 120 mg én gang daglig. Kombinerte P-gp- og sterke CYP3A-induktorer: Samtidig administrasjon av Orgovyx med kombinerte P-gp- og sterke CYP3A-induktorer anbefales ikke. Legemidler som er kombinerte P-gp- og sterke CYP3A4-induktorer inkluderer den androgene reseptorinduktoren apalutamid, visse antikonvulsiva (f.eks. karbamazepin, fenytoin, fenobarbital), legemidler mot infeksjon (f.eks. rifampicin, rifabutin), johannesurt (Hypericum perforatum), hiv- eller HCV-proteaseinduktorer (f.eks. ritonavir) og ikke-nukleoside reverstranskriptaseinduktorer (f.eks. efavirenz). Hvis samtidig administrasjon er nødvendig, skal Orgovyx-dosen økes. Etter seponering av den kombinerte P-gp- og sterke CYP3A-induktoren skal den anbefalte dosen Orgovyx gjenopptas én gang daglig. Fertilitet, graviditet og amming: Legemidlet er ikke indisert for kvinner i fertil alder. Det skal ikke brukes hos kvinner som er eller kan være gravide eller som ammer. Bivirkninger: Noen mindre vanlige bivirkninger kan være alvorlige, og lege kontaktes umiddelbart dersom symptomer på urtikaria eller angioødem utvikles (kan forekomme hos opptil 1 av 100 personer). De vanligste bivirkningene under behandling med relugoliks er fysiologiske effekter av testosteronsuppresjon, inkludert hetetokter (54 %), muskel- og skjelettsmerter (30 %) og fatigue (26 %). Andre svært vanlige bivirkninger inkluderer diaré og forstoppelse (12 % hver). Svært vanlige: Karsykdommer: hetetokter. Gastrointestinale sykdommer: diaré, forstoppelse. Sykdommer i muskler, bindevev og skjelett: muskel- og skjelettsmerter. Generelle lidelser og reaksjoner på administrasjonsstedet: fatigue. Vanlige: Sykdommer i blod og lymfatiske organer: anemi. Endokrine sykdommer: gynekomasti. Psykiatriske lidelser: insomni, depresjon. Nevrologiske sykdommer: svimmelhet, hodepine. Gastrointestinale sykdommer: kvalme. Hud- og underhudssykdommer: hyperhidrose, utslett. Lidelser i kjønnsorganer og brystsykdommer: redusert libido. Undersøkelser: vektøkning, økt glukosed, økt triglyserid, økt blodkolesterol. Mindre vanlige: Hjertesykdommer: myokardinfarkt. Hud- og underhudssykdommer: urtikaria, angioødem. Sykdommer i muskler, bindevev og skjelett: osteoporose/ osteopeni. Undersøkelser: økt aspartataminotransferase, økt alaninaminotransferase. Ikke kjent frekvens: Hjertesykdommer: forlenget QT-tid. Pakningsstørrelser og pris: Orgovyx Filmdrasjert tablett, 120 mg: 30 stk. flaske: 1674,6 kr. Blå resept: Ja. Refusjonsberettiget bruk: Behandling av avansert hormonavhengig prostatakreft. Refusjonskoder: ICPC Y77: Ondartet svulst i prostata. ICD C61 Ondartet svulst i blærehalskjertel. Vilkår 9: Behandlingen skal være instituert i sykehus, sykehuspoliklinikk eller av spesialist i vedkommende disiplin. Basert på SPC godkjent av DMP/EMA: 10/2024. Innehaver av markedsføringstillatelse: Accord Healthcare S.L.U., World Trade Center, Moll de Barcelona, s/n, Edifici Est 6ª planta, 08039 Barcelona, Spania. Tel: +34 93 301 00 64. Les preparatomtale (SPC) for ytterligere informasjon, se www.felleskatalogen.no NO-Onc-Org-01440
Stadig flere kvinner overlever brystkreft, og kravene til behandling som bevarer livskvalitet og kroppsbildet øker. Onkoplastisk brystkirurgi (OPS) kombinerer kreftkirurgi med plastikkirurgiske teknikker for å sikre både onkologisk trygghet og estetisk resultat. Denne artikkelen gir en oversikt over indikasjoner, teknikker og resultater ved OPS – en stadig viktigere del av moderne brystkreftbehandling
CAMILLA M KRISTOFFERSEN 1, KRISTIAN JENSEN 2, INGER CHRISTINE L’ORANGE 2
1 BRYST- OG ENDOKRINKIRURGISK AVDELING, HAUKELAND UNIVERSITETSSJUKEHUS
2 BRYST- OG ENDOKRINKIRUGISK SEKSJON, AVDELING FOR KREFTKIRURGI, OSLO UNIVERSITETSSYKEHUS KORRESPONDANSE: CAMILLA.MORKEN.KRISTOFFERSEN @ HELSE - BERGEN.NO
INNLEDNING
I 2023 ble 4076 kvinner diagnostisert med brystkreft og 484 kvinner fikk diagnosen DCIS (duktalt karsinoma in situ, et forstadium til brystkreft) i Norge, med en median alder på 62 år. Prognosen er bedret betraktelig de siste tiårene, og i dag er samlet relativ 5- og 10-års overlevelse nasjonalt henholdsvis 92,6 % og 87,8 % (1). Et stort antall kvinner er brystkreftoverlevere og skal leve med resultatene av sin behandling i mange tiår fremover. Det er derfor viktig at behandlingen man tilbyr, tar hensyn til dette.
I et historisk perspektiv er utviklingen av kirurgisk brystkreftbehandling en fortelling om eskalerende kirurgi. Fra de første store, mutilerende operasjonene, der man fjernet brystet, underliggende muskel og de aksillære lymfeknutene hos alle (Halsteds radikale mastektomi, 1894) via modifiserte mastektomier med eller uten muskelfjerning (henholdsvis Maddens mastektomi 1972 og Huggins modifiserte radikale mastektomi på 70-tallet), til man samme tiår kunne vise at brystbevarende kirurgi (BCT) med simpel lumpektomi, i kombinasjon med strålebehandling, var et like trygt alternativ (2). Med introduksjonen av aksillær vaktpostlymfeknutebiopsi på 90-tallet slapp mange også unødvendig aksillekirurgi (3).
I dag er BCT standardbehandling for kvinner med tidlig stadium brystkreft (I-II), forutsatt at svulsten er godt av-
grenset, tilstrekkelige marginer kan oppnås og brystet bestråles (12). European Society of Breast Cancer Specialists (EUSOMAs) sine kvalitetsmål anbefaler at brystbevarende kirurgi skal utføres hos minimum 85 %, men med mål om 90 %, og i Norge lå man i 2023 på 89,5 % (1). Veiledet av palpasjonsfunn eller merketeknikk fjernes tumor med makroskopisk margin på typisk en cm mellom mastektomiplanet og muskelfascien. Nyere studier viser at denne behandlingen gir høyere overlevelse og bedre opplevd helse- og kroppsbilde enn mastektomi (4,5).
Lumpektomien etterlater arr og en defekt i brystet, og teknikken har dermed også sine begrensninger. Ved store svulster, diskrepans mellom tumor og brystvolum eller tumor lokalisert i utfordrende områder kan ledsagende volumdefekter gi opphav til sjenerende, inndratte arr og adheranser mellom hud og muskel, forsterket av strålebehandlingen med påfølgende dårlig kosmetisk resultat. «Fuglenebb-» og «haibittdeformiteter” ses fremdeles i dag, og sekundære korreksjoner er ikke enkle eller uten risiko for komplikasjoner. Ved stort brystvolum (makromasti) kan doseplanleggingen for strålebehandling være vanskelig, og var lenge akseptert som en relativ kontraindikasjon mot BCT (6).
For å omgå disse problemstillingene er alltid mastektomi en løsning, enten at man “går flat” eller med en primær

rekonstruktiv prosedyre. Protesebasert rekonstruksjon gir imidlertid et følelsesløst bryst med et stort fremmedlegeme og livslangt behov for serviceoperasjoner, og tilgangen på primær autolog rekonstruksjon med stilket eller fri lapp er utfordrende i store deler av landet.
For å adressere utfordringene skissert over, begynte man på slutten av 1990-tallet å kombinere brystkreft- og plastikkirurgiske teknikker i det vi i dag omtaler som onkoplastisk brystkirurgi (OPS) (7). Dette har blitt en viktig og validert metode for å utvide indikasjonen for brystbevarende kirurgi uten å kompromittere onkologisk trygghet (8). I denne artikkelen skal vi gi en introduksjon til brystbevarende OPS med fokus på pasientutvelgelse, noen utvalgte teknikker og langtidsresultater.
INDIKASJONER OG PASIENTSELEKSJON
OPS bør vurderes i tilfeller der svulsten er stor i forhold til brystvolumet (Figur 1). Fjerning av 20 % av totalt brystvolum kan gi endring i brystets volum og form (9). Tumorens lokalisasjon er også av betydning for om det vil oppstå asymmetri eller defekt etter reseksjon. Dersom tumor er lokalisert i nedre kvadranter eller i øvre mediale kvadrant, kan OPS være indisert ved eksisjon av mindre enn 15 % (10). OPS kan tilbys dersom pasienten har ønske om brystbevarende kirurgi, men tradisjonell lumpektomi ikke vil kunne gi et tilfredsstillende kosmetisk resultat, eller hvis pasienten har hypertrofe bryst/stor asymmetri og ønske om funksjonell bedring.
FORSIKTIGHET BØR UTVISES
OPS skal ikke gå på bekostning av onkologisk behandling. Det er nødvendig med et godt samarbeid i en
FIGUR 1: Grafen viser andel brystvev som er forventet å fjernes ved ulik størrelse på tumor. Ved fjerning av mer enn 15 % av brystet, bør onkoplastiske metoder vurderes. (Fra nasjonalt handlingsprogram, gjengitt med tillatelse av Christian Korvald).
multidisiplinær gruppe med brystkirurg, plastikkirurg, mammaradiolog, onkolog og patolog. Brystbevarende OPS bør ikke tilbys pasienter som ikke egner seg for adjuvant strålebehandling, for eksempel ved residiv av cancer mammae eller DCIS med tidligere gjennomgått strålebehandling, og hvor rebestråling ikke kan utføres.
Det er viktig at man tar hensyn til faktorer som kan føre til forsinket sårtilheling og gi risiko for utsatt adjuvant behandling. Bruk av tobakk, dårlig regulert diabetes og høy BMI kan føre til forsinket sårtilheling (11). Det samme kan aktiv bindevevssykdom som affiserer hud. Hos pasienter med fettrike bryst/lav brysttetthet (BIRADS A og B, “Breast Imaging-Reporting and Data System”) er sirkulasjonen mer utsatt og det kan oppstå utfordringer med økt risiko for fettvevsnekrose og redusert kosmetisk resultat etter reseksjon (12).
BRCA 1/2 og genfeil i TP53 bør opereres med mastektomi. Brystbevarende behandling er kontraindisert ved T4tumor, utbredt multifokal tumor, utbredt, diffus malign kalk (bør verifiseres histologisk) og inflammatorisk brystkreft. Det er også kontraindisert ved ufrie reseksjonsrender, der rereseksjon ikke er mulig.
INNDELING AV ONKOPLASTISK KIRURGI
OPS-teknikker inndeles tradisjonelt i to hovednivåer: Level 1: Enkel remodellering ved mindre reseksjoner, tradisjonelt definert som mindre enn 20 % av brystets volum. Dette kan innebære mobilisering og samling av kjertelvevet, med mindre justeringer av hud og areola. Eksempler på disse teknikkene inkluderer “tennis racket”, “batwing” og “round block”. Teknikker på dette
FIGUR 2: Onkoplastisk brystreduksjon venstre bryst med symmetrisering høyre bryst. A): Preoperativt frontbilde. B og C) Resultat etter operasjon med symmetriske bryst. Bilder publisert med pasientens skriftlige samtykke.
FIGUR 3: Tumor oppad lateralt i venstre bryst er fjernet i en bit, sammen med hele øvre laterale kvadrant. Det skraverte området på skissen viser område for deepitalisering. Lappen med hud og brystvev flyttes opp og fyller defekten.
FIGUR 4: Rekonstruksjon med LICAP. 44 mm kalk i nedre laterale kvadrant, biopsert cancer mammae og DCIS grad 3. A) Preoperative bilder. To merketråder er lagt perkutant for å avgrense eksisjonsområde nedad lateralt. Fremre aksillærlinje er påtegnet og brystets omslagsfold oppad og antatt eksisjonsområde er markert med stiplede linjer. LICAP-lapp påtegnet ut lateralt i forlengelsen av intramammær fold. Kryss markerer utdopplede perforanter, pålitelige og typisk beliggende i 5.-8. interkostalrom i “triangle of plenty”. B) Perioperative bilder. Hele nedre laterale kvadrant er tømt og vaktpost lymfeknute er fjernet. Lappen er deepitelialisert, løsnet med bevarte intercostalperforanter, og roteres deretter inn i tumordefekten. Man tilstreber å overfylle defekten ettersom strålebehandling normalt vil krympe lappen. C) Kontroll 9. postoperative dag. Normal postoperativ hevelse. Bevart form. Blåfarge ses i hud etter SN-prosedyre. Bilder publisert med pasientens skriftlige samtykke.
nivået brukes vanligvis for pasienter med små svulster med veldefinert plassering (14,15).
Level 2: Mer kompleks onkoplastisk kirurgi ved større reseksjoner, tradisjonelt definert som 20-50 % av brystets volum, og vanskelige tumorlokalisasjoner som for eksempel i mediale og nedre kvadranter. Disse inndeles videre etter volumprinsipper og kan innebære bruk av kjente plastikkirurgiske teknikker (14,15).
En annen vanlig måte å kategorisere onkoplastikk på er: Vid lokal eksisjon: Det gjenværende brystvevet omfordeles for å fylle defekten etter tumorreseksjon, enten via rotasjon og/eller forflytning av gjenværende kjertelvev. Disse inngrepene regnes som level 1-prosedyrer. Ved brystbevarende kirurgi er det viktig å planlegge snittføringen med tanke på arrplassering – både for å kunne skjule arret i en BH, og for å muliggjøre inkludering av arret ved eventuell senere mastektomi.
Terapeutisk mastopeksi: Kvinner med middels store bryst (400-700 mL) og samtidig hudoverskudd kan ofte tilbys et brystløft. Ved mastopeksi fjernes kun svulsten med god margin til friskt vev, i motsetning til brystreduksjon der også betydelige mengder antatt friskt brystvev fjernes. Resterende vev vil vanligvis roteres for å lukke defekten og hudoverskuddet korrigeres. Ved begge inngrep bevares blodsirkulasjon til brystvorten direkte fra samme vevslapp eller fra en subcutant basert lapp. Det vil ofte være behov for symmetriserende inngrep på det andre brystet og man forsøker å tilby dette i samme operasjon.
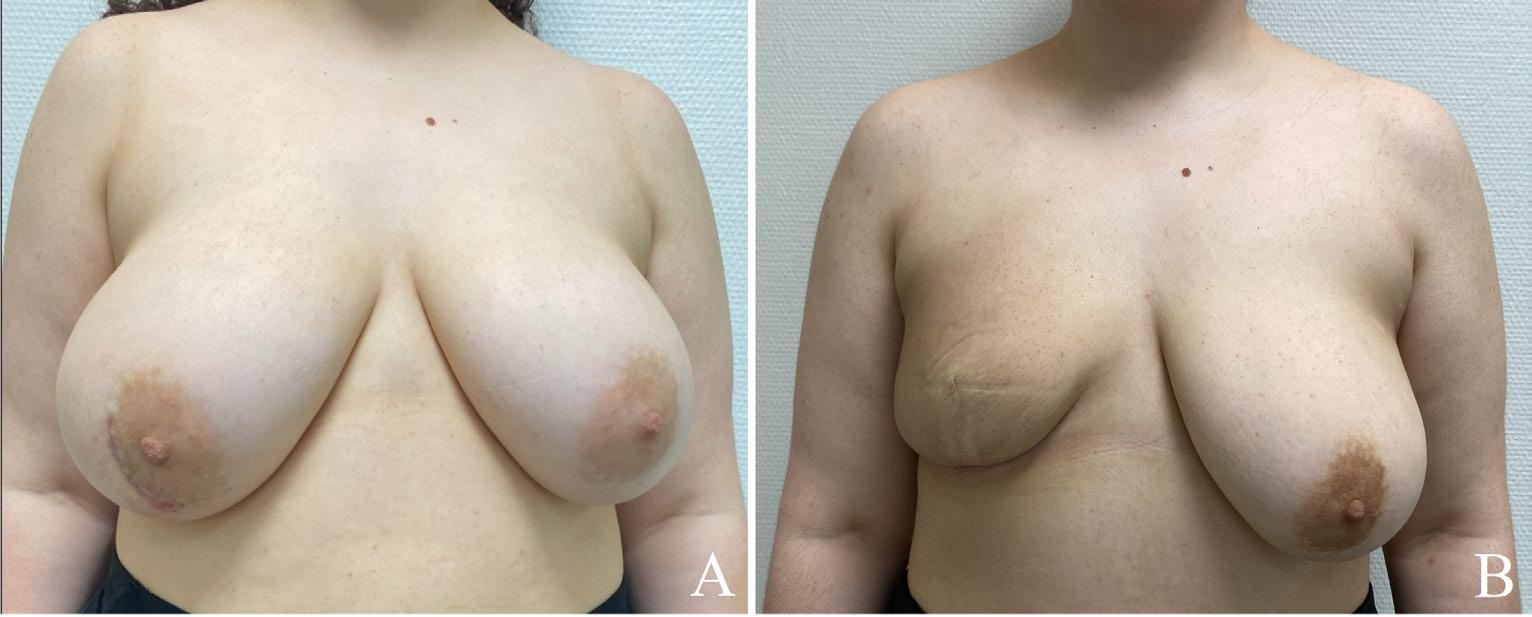
Terapeutisk reduksjonsplastikk: Kvinner med relativt store bryst (>700 mL) som aksepterer redusert brystvolum og løft av brystet er kandidat for dette. De vil vanligvis få arr som ved “ankersnitt”. Forskjellige teknikker for reduksjonsplastikk benyttes avhengig av tumors lokalisasjon. Tumor eksideres som del av reduksjonsresektatet, eventuelt kan tumordefekten dekkes med en intern lapp av mammavev. I tillegg til tumor fjernes overflødig hud og vev før brystets form gjenskapes (Figur 2 og 3).
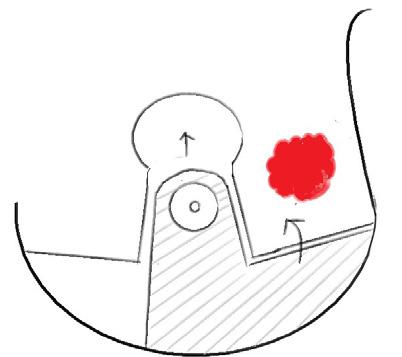
Volumerstatning: For kvinner med små til middels store bryst (100-700 mL) eller bryst uten ptose kan det være vanskelig å lukke en stor vevsdefekt etter tumorreseksjon. For å opprettholde form og volum i brystet benytter man ofte volumerstatning med lokale lapper av deepitelialisert hud og subkutant fettvev. Interkostale kar mellom hvert ribben avgir perforerende grener til subkutant vev på brystkassen. Eksempler på slike brystveggsperforatorlapper er LICAP, MICAP and AICAP (lateral,
medial og anterior intercostal artery perforators). MICAP og AICAP høstes fra inframammærfolden og brukes ofte for reseksjoner medialt i brystet. Mest benyttet er LICAP, som høstes fra laterale thoraksvegg, og kan gi betydelig volum, spesielt lateralt (Figur 3). Incisjonen vil skjules av en brystholder, da den legges i folden under brystet og lateralt på brystkassen. Ved store defekter i øvre og mediale del av brystet eller behov for å erstatte hele brystkjertelen kan LTAP (lateral thoracic artery perforator) eller TDAP (thoracodorsal artery perforator) være alternativer (10, 13, 16).
EKSTREM ONKOPLASTIKK
I nyere tid er det foreslått å legge til et “Level 3” ved store reseksjoner av over 50 % av brystets volum, svulster større enn 5 cm, store områder med DCIS, multifokal eller multisentrisk sykdom og partiell respons på neoadjuvant behandling. Mange av disse pasientene har lymfeknutesykdom og de fleste behøver strålebehandling, selv ved mastektomi. Dette omtales også som ekstrem onkoplastikk. Disse pasientene har tradisjonelt blitt anbefalt mastektomi, men forbedringer av neoadjuvant behandling gjør at stadig flere vil være kandidater for et brystbevarende inngrep. Også hos disse pasientene er brystbevarende kirurgi å foretrekke fremfor protesebasert rekonstruksjon, og særlig hvis strålebehandling er planlagt. Behandlingen innebærer ofte en blanding av flere av teknikkene nevnt over, for eksempel en stor intern rotasjonsplastikk sammen med en perforatorlapp (17, 26).
Goldilocks (Gullhår) mastektomi bør nevnes, selv om det strengt tatt ikke er et brystbevarende inngrep (Figur 4). Dette er en type mastektomi som innebærer en balansert tilnærming mellom å fjerne brystvev og bevare et estetisk godt resultat, som i eventyret: “akkurat passe”. Teknikken benytter kun hud og subkutant fettvev i brystet, som ved en hudsparende mastektomi, men med en teknikk og fremgangsmåte som også benyttes i brystreduksjon; deepitelialisering og ankersnitt. Det kan være et godt alternativ dersom det er indikasjon for mastektomi og pasienten ikke ønsker å gå flat, men har kontraindikasjoner mot direkte rekonstruksjon med protese/ autologt vev eller sekundær rekonstruksjon. Det egner seg for pasienter med store eller hengende bryst, ved høy BMI, komorbiditet og for eldre pasienter (18).
OPS fører ofte til større reseksjoner som utgjør mer vevstraume og vesentlig lenger operasjonstid enn enkel brystbevarende kirurgi. Komplikasjonsratene i litteraturen varierer. Flere studier har imidlertid ikke påvist
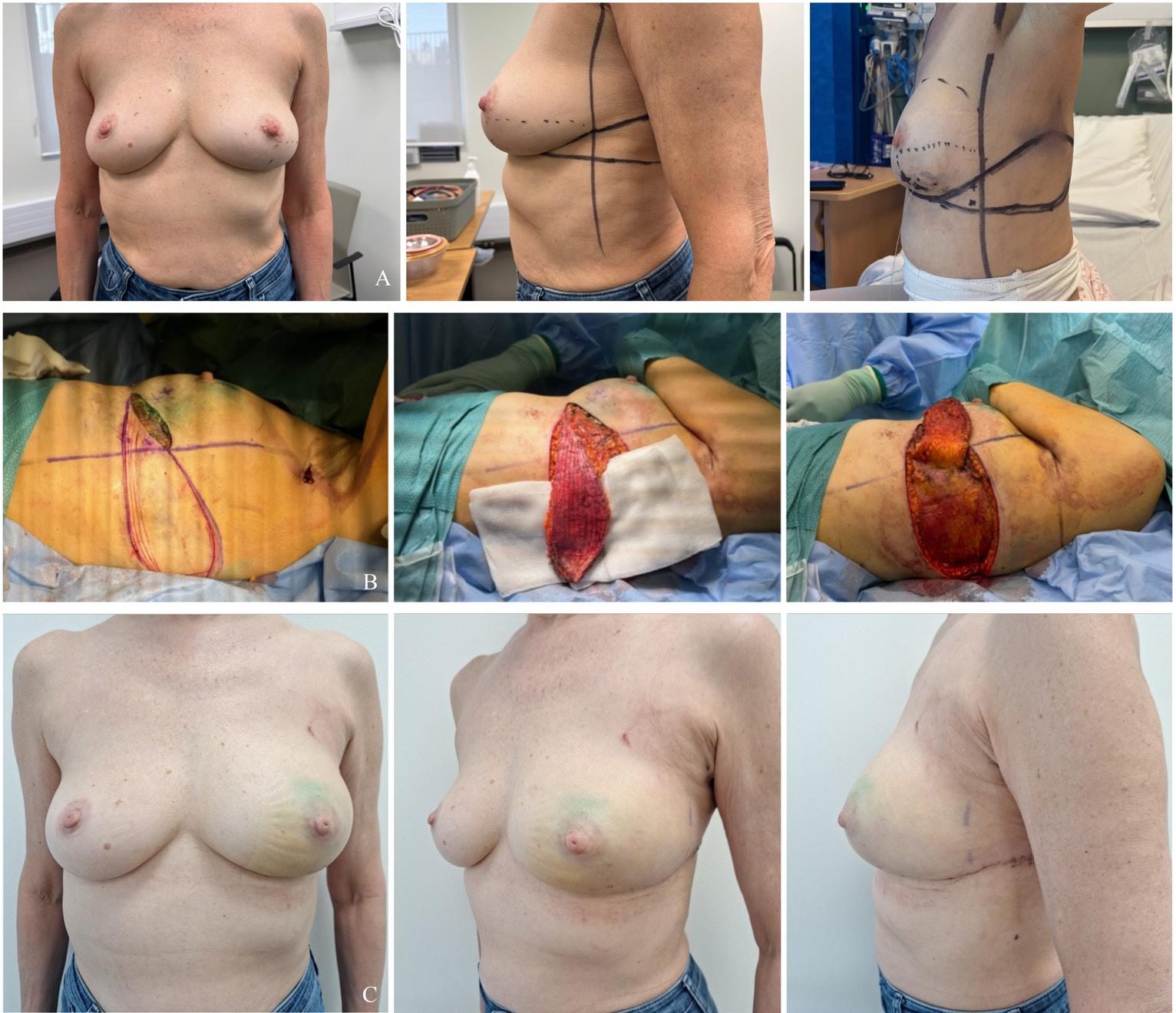
5: Ung pasient med mastittmistanke høyre bryst. A) Bilde etter primær merkebiopsi med funn av DCIS grad 3 med ufrie marginer. B) Ufri margin også etter re-reseksjon, og indikasjon for mastektomi. Pasienten var ikke kandidat for protese- eller autolog rekonstruksjon og ønsket ikke å gå helt flat. Postoperative bilder etter Goldilocks mastektomi og gjennomført postoperativ strålebehandling. Hun venter nå på rekonstruktiv operasjon med fettvevstransplantat til høyre bryst og reduksjonsplastikk venstre bryst. Bilder publisert med pasientens skriftlige samtykke.
signifikante forskjeller i forekomsten av kirurgiske komplikasjoner mellom de to pasientgruppene (19).
En artikkel fra 2023 har sett på komplikasjoner hos pasienter som ble operert med onkoplastisk brystreduksjon. Dette var en systematisk gjennomgang av 9 artikler som inkluderte 1715 pasienter operert mellom år 1995-2020. Resultatene fra denne artikkelen viste: 3 % hematom, 2 % nekrose av nippel, 4 % forsinket sårtilheling, 3 % infeksjon og 2 % serom. 4 % av pasientene fikk utsatt adjuvant postoperativ behandling (strålebehandling eller kjemoterapi) som konsekvens av komplikasjonene. Reeksisjonsrater var på 8 %, og kompletterende mastektomi på 2 %. Mindre sårtilhelingsproblematikk og revisjoner som ble utført poliklinisk, var ekskludert (20).
Ved en gjennomgang av 336 rekonstruksjoner av bryst med perforatorlapp fant man komplikasjoner hos 13 % av pasientene. 8 % av disse var mindre komplikasjoner uten behov for intervensjon. Re-eksisjonsrate var 13 % og kompletterende mastektomi nødvendig kun hos en pasient (0,3 %) (21).
PASIENTOPPLEVDE LANGTIDSRESULTATER
Pasienter som har gjennomgått onkoplastisk kirurgi rapporterer ofte høyere grad av tilfredshet sammenlignet med dem som behandles med standard mastektomi. Dette kan tilskrives både et mer tilfredsstillende estetisk resultat og en opplevelse av at behandlingen i større grad ivaretar deres kvinnelighet og identitet etter sykdommen. (22). Sammenlignet med pasienter som gjennomgår mastektomi med total rekonstruksjon, kan OPS vise til høyere grad av tilfredshet, lavere frekvens av komplikasjoner og færre operasjoner for å fullføre rekonstruksjon (23).
ONKOLOGISKE RESULTATER: OPS VS. BCT
Studier har vist at OPS gir like gode onkologiske resultater som BCT, forutsatt at man oppnår tilstrekkelige marginer (8, 24). Videre er OPS assosiert med lavere risiko for reoperasjon sammenlignet med konvensjonell BCT. Dette skyldes trolig at OPS tillater mer omfattende reseksjoner med bedre marginer samtidig som brystets form bevares. Det er ikke vist at det blir flere postoperative komplikasjoner eller forsinket oppstart av adjuvant behandling (25).
ONKOLOGISKE RESULTATER: EKSTREM OPS
En nylig publisert metaanalyse av ekstrem OPS ved lokalavansert sykdom viste like gode eller bedre onkologiske resultater sammenlignet med mastektomi, og gir grunn til å tro at brystbevarende behandling kan være å foretrekke også for denne gruppen. Man observerte lett forhøyet risiko for lokoregionale residiv, men forskjellene var ikke signifikante og overlevelsen var sammenlignbar (26).
Det er viktig å være klar over at kvaliteten på studiene innenfor OPS er lav og at evidensen for mange av utfallene er svake. Forskningen sammenfatter i stor grad artikler basert på kasus-serier og observasjonsstudier med få pasienter, dårlig definerte utfall og mye fokus på teknikk. Det er få randomiserte studier og manglende standardisering av kliniske og pasientrelaterte utfall. Onkologisk langtidsoppfølging foreligger heller ikke enda (27).
STRÅLEBEHANDLING OG KLIPSING AV SÅRHULE Boost-strålebehandling er anbefalt for alle pasienter under 40 år og bør vurderes for alle under 50 år. Klipsing av sårhulen etter OPS er nødvendig for å identifisere
reseksjonskantene og sikre at strålebehandlingen rettes presist mot det gjenværende brystvevet etter eksisjon. Det er viktig å være klar over at store eksisjoner kan komplisere målrettingen av boost-stråling hos yngre pasienter (28, 29).
RADIOLOGISK OPPFØLGING ETTER OPS
Onkoplastisk kirurgi (OPS) kan resultere i økte postoperative forandringer, som fibrose og arrdannelse, noe som potensielt kan komplisere tolkningen av mammografibilder. Flere studier har imidlertid vist at disse forandringene ikke medfører økt vanskelighetsgrad ved mammografisk oppfølging. Det er avgjørende at operasjonsmetode fremkommer tydelig i radiologiske henvisninger, for å sikre optimal tolkning ved videre bildediagnostikk og oppfølging (30).
KONKLUSJON
Brystbevarende OPS kombinerer onkologisk sikkerhet med estetiske fordeler og har blitt en stadig viktigere del av brystkreftkirurgien. Riktig seleksjon av pasienter, nøye preoperativ planlegging og valg av passende teknikk

er avgjørende for å oppnå optimale resultater. I tillegg er det viktig med multidisiplinært samarbeid for å sikre best mulig behandlingstilbud. Stadig bedret neoadjuvant og adjuvant systemisk behandling, merketeknikker og kirurgi vil gjøre at flere pasienter i fremtiden vil være aktuelle for brystbevarende OPS, og indikasjonene vil utvides ytterligere. Autolog fettransplantasjon er allerede vist å være trygt ved rekonstruksjoner etter brystkreft (31) og det blir spennende å se om det også kan bli aktuelt å bruke primært. Varsomhet bør fremdeles utvises ved OPS og virksomheten bør overvåkes nøye med bruk av kvalitetsregister. Særlig gjelder dette ved ekstrem OPS. Onkologiske langtidsresultater og flere studier av god kvalitet er påkrevd, inkludert randomiserte multisenterstudier med store pasienttall og veldefinerte kliniske og pasientopplevde utfall.
REFERANSER :
Se bakerst i nettutgaven på kirurgen.no
Dr. Alexander Malthe (1845-1928) har vært banebrytende i norsk kirurgi. Han arbeidet ved Rikshospitalet, og startet privat kirurgisk praksis i Christiania. Malthe hadde flere studieopphold i utlandet, bla London, Paris og Tyskland. Han utførte den første appendicitt operasjonen i Norge (1889), den første ventrikkelreseksjonen (1897), og den første elektive brokkplastikken.
• Dr. Alexander Malthes legat ble opprettet i 1920 etter donasjon av 1 mill. fra dr Malthe. Avkastningen skulle brukes til det beste for unge norske kirurger. Da Oslo kirurgiske forening ble lagt ned i 2014, ble legatet med beholdning ca 1,9 millioner overført til Norsk kirurgisk forening.
• Formålet med Malthes legatet er «å fremme norsk kirurgi i form av reisestipend, fortrinnsvis til engelsktalende land, for dyktige, yngre leger til videre utdannelse.» Søkere i overlegestilling vil ikke bli vurdert for stipendtildeling.
• Kun søknader med kort beskrivelse av formål og med budsjettforslag vil komme i betraktning for stipendtildeling, og sendes legatstyret ved leder Olaug Villanger, mail ovillang@ous-hf.no
• Stipendmottakerne må levere en kort reiserapport med angivelse av faglig utbytte egnet for publisering
i Kirurgen innen 1 mnd etter gjennomført reise/ kongress. Reiserapporten sendes til legatstyret ved leder ovillang@ous-hf.no.
Dr. Alexander Malthes legat består av et legatstyre (Arne Christian Mohn, Birgitte Brandt og Olaug Villanger) samt en forretningsfører. Legatstyret har de siste årene delt ut stipendmidler totalt for ca kr 50-120 000 hvert år. Dr. Alexander Malthes legat vil også i 2025 dele ut stipendmidler.
Søknadsfrist for stipend er 1. september 2025.
Olaug Villanger
Leder Legatstyret ovillang@ous-hf.no.
Markering av ikke-palpable maligne og pre-maligne tumores i brystet med metalltråd har vært avgjørende for innføringen av brystbevarende kirurgi. Palpable svulster må nå i tillegg markeres hos pasienter som får neoadjuvant behandling. Ny teknologi er i ferd med å erstatte tradisjonell trådmarkering i stor grad, og kan gi både bedre logistikk og bedre behandlingsresultater. I artikkelen beskriver vi de mest aktuelle markeringssystemene til bruk i klinikken.
ÅSE FLORHOLMEN - KJÆR OG VEGARD HEIMLY BRUN
SEKSJON FOR BRYST- OG ENDOKRINKIRURGI, UNIVERSITETSSYKEHUSET NORD - NORGE
KORRESPONDANSE: ÅSE FLORHOLMEN - KJÆR – ASE.FLORHOLMEN @ UNN.NO
Tradisjonell trådmarkering av små brystlesjoner ble utviklet i 1979 av Ferris Hall og Howard Frank (1). De oppfant en metalltråd med krok som kunne plasseres i brystet ved radiologisk veiledning for å muliggjøre lokalisering av ikke-palpable lesjoner under operasjonen. Metoden var avgjørende for utviklingen av brystbevarende kirurgi for brystkreft i påfølgende tiår. Trådmarkering er særlig aktuell ved fjerning av små, screening-detekterte lesjoner. Den har flere fordeler, blant annet enkel plassering i brystet ved hjelp av ultralyd eller stereotaktisk veiledning. Metoden er godt utprøvd, og tråden kan enkelt plasseres på nytt dersom den blir feilplassert.
Ulempene med trådmarkering inkluderer forsinkelser i operasjonen på grunn av preoperativ lokalisering og kirurgisk planlegging, plagsomme, utstikkende tråder fra brystet ved desinfisering og kirurgi, risiko for forskyvning av tråden før og under operasjonen, samt begrensninger i valg av snittsted på grunn av tråden(e)s plassering. Pasienter opplever ofte tråden som ubehagelig, og den kan føre til stress og bekymring for at den skal forskyves før operasjonen (2,3) Derfor er tradisjonell markering blitt utfordret særlig det siste tiåret av flere nye, «trådløse» alternativer (4,5). De nye metodene benytter markører på størrelse med et riskorn og kan plasseres i lesjonen flere uker eller måneder før operasjonen, noe som forenkler logistikk og tillater plassering før neoadjuvant behandling.
RADIOAKTIVT JODKORN (125 I )
Før operasjonen plasseres et lite, radioaktivt jodkorn i brystlesjonen ved hjelp av ultralyd eller stereotaktisk veiledning. Kornet, som er på størrelse med et riskorn, inneholder en minimal mengde radioaktivt materiale, som anses som trygg for både pasienter og helsepersonell. Under operasjonen fjernes kornet sammen med lesjonen, hvilket eliminerer den radioaktive kilden. Jodkornet detekteres ved hjelp av en gammaprobe, som også kan brukes til deteksjon av 99mTechnetium under sentinel node-prosedyren i armhulen. Bruk av radioaktive jodkorn har flere fordeler, inkludert den lave kostnaden for selve kornet og muligheten til å bruke gammaproben som klinikken allerede har investert i. Disse aspektene gjør teknikken spesielt attraktiv sammenlignet med andre alternativer.
Bruken av radioaktive materialer er imidlertid strengt regulert, og krever spesifikke tillatelser og prosedyrer for lagring, transport og håndtering av jodkorn. Dette kan komplisere logistikken og kreve ekstra ressurser. Jodkornene har en halveringstid på omtrent 60 dager, hvilket betyr at de må plasseres og brukes innen en viss tidsramme for å være effektive. Dette begrenser fleksibiliteten i operasjonsplanleggingen og gjør dem mindre egnet for neoadjuvant behandlingsforløp som varer i flere måneder. Disse tidsbegrensningene krever nøye koordinering mellom radiologer, kirurger, onkologer og annet helse-

personell for å sikre optimal bruk av radioaktive jodkorn i brystkreftbehandling.
MAGNETISK KORN
På samme måte som radioaktive jodkorn kan et magnetisk korn plasseres i brystlesjonen ved hjelp av ultralyd eller stereotaktisk veiledning. Magnetiske korn kan enkelt identifiseres med en magnetisk detektor under kirurgien. Sentimag® er en del av et system som inkluderer både detektoren og det magnetiske kornet, kalt Magseed®. Sirius Pintuition er en annen leverandør (6). Den mest omdiskuterte ulempen ved bruk av magnetiske korn er artefaktene de skaper på MR-bilder av brystet, da de er laget av stål. Kornet forstyrrer magnetfeltene, og bør derfor bare legges inn når utredning med MR og eventuelt oppfølgning av neoadjuvant behandling er ferdig. Dette gjør at den logistiske fordelen med metoden blir noe mindre enn hos konkurrentene, spesielt hos pasienter som gjennomgår neoadjuvant behandling.
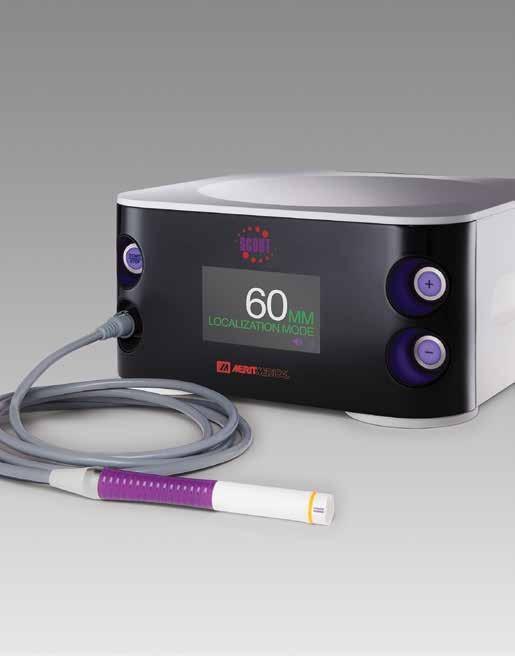
RADAR- OG RADIOFREKVENS - SYSTEM
SCOUT®-systemet (Merit Medical, Utah, USA) bruker en liten elektromagnetisk radarreflektor som plasseres i brystlesjonen ved hjelp av ultralyd- eller stereotaktisk veiledning. Fordelen med teknologien er at markøren skaper lite artefakt på MR. Dermed er det uproblematisk å legge den inn på diagnosetidspunktet og før man vet om det skal tas MR senere i utredningen eller som respons-
FIGUR 1: SCOUT®-systemet (Merit Medical, Utah, USA). Under operasjonen aktiveres reflektoren i brystet av infrarøde lysimpulser generert av en konsollprobe og et elektromagnetisk bølgesignal reflekteres tilbake til håndstykket. Avstand (mm) fra konsollproben til reflektoren indikeres av intensiteten på lydsignalet og angis i tillegg på displayet.
evaluering. Under operasjonen aktiveres reflektoren av infrarøde lysimpulser generert av en konsollprobe og reflekterer et elektromagnetisk bølgesignal tilbake til håndstykket (Figur 1).
LOCalizer® er leverandør av markeringssystem som bruker radiofrekvens-identifikasjon (RFID)-brikker bygd inn i små markør-kapsler som deponeres i brystet på tilsvarende måte som de øvrige omtalte markørene. Systemet som brukes på operasjonsstuen er trådløst og noe mer kompakt enn hos de andre leverandørene. Teknologien er den samme som brukes i bankkort blant annet. Markørene gir større artefakt på MR enn radarreflektorene, men ikke så mye som stål-korn. I likhet med stålkorn og radar-reflektorer er det ingen tidsbegrensning i hvor lenge de kan ligge i kroppen før kirurgi.
ERFARINGER FRA INNFØRING AV SCOUT®- SYSTEMET
VED UNIVERSITETSSYKEHUSET NORD - NORGE TROMSØ SCOUT®-systemet ble innført som rutine ved Universitetssykehuset Nord-Norge i 2020 og har i stor grad erstattet trådmarkering. Selv om markørene koster mer enn merketråd har dette forenklet logistikken og redusert kostnadene betydelig da vi sparer besøk hos radiolog for markering i forbindelse med operasjonen. Det er også en fordel for planleggingen at operasjonen frikobles fra innleggelse av markering. De fleste pasientene får markør innlagt ved diagnosetidspunktet, altså uker eller måneder
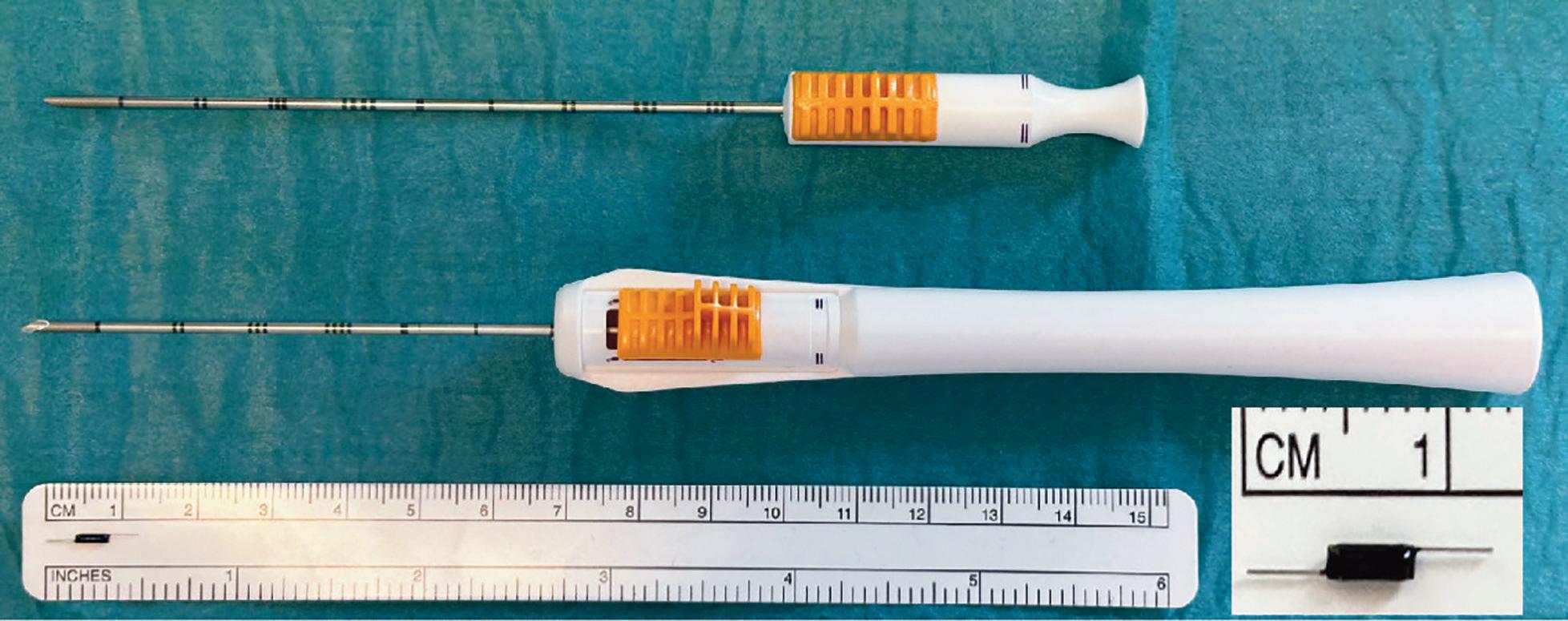
FIGUR 2: SCOUT®-systemets 16G nåler som brukes når reflektoren legges inn stereotaktisk (10 cm nål, øverst) eller ultralyd-veiledet (7 cm nål, nederst). Reflektoren som legges inn i brystet måler totalt 12 mm.
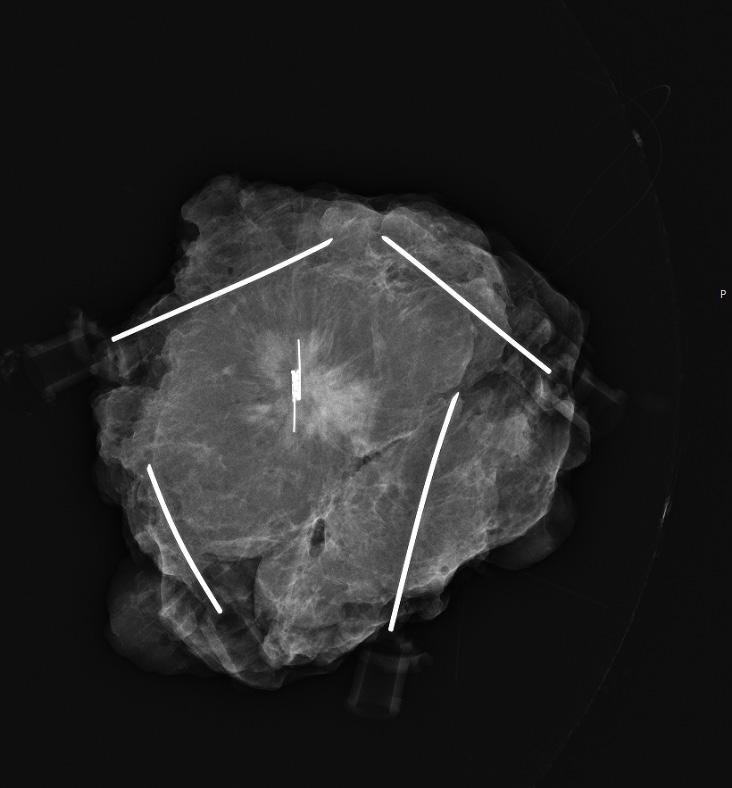
FIGUR 3: Preparatmammografi som viser sentralt plassert SCOUT-markør i et resektat, montert på korkplate med kanyler.
før operasjonen. En fersk studie viser at karbonavtrykket i forbindelse med markering er betydelig lavere enn ved tradisjonell trådmarkering (7). De totale kostnadene for samfunnet er antagelig også lavere på grunn av den forenklede logistikken, og raskere operasjonstid, dog er dette et komplisert regnestykke. Våre resultater fra de første 100 pasientene etter innføring av SCOUT® viste redusert tidsbruk på operasjonsstua med ca. 20 minutter per pasient (8). Enda større betydning har det at bruk av både SCOUT®-markering og markering med radioaktive jodkorn ser ut til å redusere andelen pasienter som får ufrie marginer og behov for reoperasjon (8,9). I vårt materiale ble antallet ufrie marginer og reoperasjoner halvert. Studier som sammenligner overlevelse ved de ulike metoder mangler.
SCOUT®-markering har ikke erstattet tradisjonell trådmarkering fullstendig ved Universitetssykehuset Nord-Norge. Hos pasienter med multiple lesjoner eller store premaligne forandringer kreves ofte flere markeringspunkter i brystet. I disse tilfellene kan det være gunstig å kombinere trådmarkering og SCOUT®-markør.
Bruker man to eller flere SCOUT®-markører bør disse ligge minst 4 cm fra hverandre for å kunne identifiseres separat.
Figur 1, 2 og 3 viser hhv SCOUT®-systemets konsollprobe, SCOUT®-systemets 16G nåler, samt preparatmammografi med reflektor plassert sentralt. Alle bilder tatt ved vår klinikk.
KONKLUSJON
Tradisjonell trådmarkering bør erstattes med ny teknologi. Gevinsten er bedre logistikk, lavere karbonavtrykk og færre reoperasjoner. Markering av lesjoner i både bryst og aksille før neoadjuvant behandling er aktuelt for en stadig større andel av brystkreftpasientene. Ved valg av metode bør lokale logistiske forhold veie tungt, og man bør ta særlig hensyn til de neoadjuvante behandlingsforløpene i dette valget.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
LumenEye® X1 System består av:
• LumenEye® X1 endoskop
• Nettbrettskjerm med full HD
• Intuitiv CHiP-programvareplattform
• Bærbart etui og arbeidsstasjon
–Brukes sammen med LumenEye® X1 Consumables.

Medivatus er stolt distributør for LumenEye® i Norge
LumenEye X1 System gir HD-kvalitet på bilder og video av anorektum, noe som både forbedrer den diagnostiske nøyaktigheten og reduserer behovet for formell endoskopi.
USB-tilkobling gir rask dataoverføring, sikker lagring og deling av bilder og video, samt mulighet for raskere diagnostisering og tiltak for behandling.
medivatus.com

LumenEye® X1 kan brukes ved polikliniske undersøkelser, kreftreseksjon, anastomoseovervåkning og endoskopisk kirurgi.
Den intelligente utformingen gir en komfortabel og effektiv bruker- og pasientopplevelse.
Anaplastisk thyreoideakarsinom (ATC) er en svært alvorlig sykdom som opptrer sjeldent. Sykdommen er ofte lokalavansert med fjernmetataser ved diagnosetidspunktet, vokser aggressivt og med kort overlevelsestid. Behandling har vært kjemoterapi, strålebehandling og kirurgi. Nyere medikamentell behandling som BRAF-/MEK hemmere og PD-L1 hemmere ser ut til å bedre prognosen med økt overlevelse. Vi presenterer oppdatert informasjon vedrørende ATC og nyere behandling.
OPSAHL EM 1,2, HELSET K 3, BRAUCKHOFF K 4,5
1. SEKSJON FOR BRYST- OG ENDOKRINKIRURGI, AVDELING FOR KREFTKIRURGI, OSLO UNIVERSITETSSYKEHUS
2. AVDELING FOR GLOBAL HELSE, OSLO UNIVERSITETSSYKEHUS
3. SEKSJON FOR BRYST- OG ENDOKRINKIRURGI, ST OLAVS HOSPITAL
4. AVDELING FOR BRYST- OG ENDOKRINKIRURGI, HAUKELAND UNIVERSITETSSYKEHUS
5. KLINISK INSTITUTT 2, UNIVERSITETET I BERGEN
KORRESPONDANSE: ELSE MARIE OPSAHL – ELSOPS @ OUS - HF.NO / OPSAHLELSEMARIE @ GMAIL.COM
INTRODUKSJON
I motsetning til differensiert thyreoideakarsinom (DTC), som opptrer hos 85 % av pasienter med kreft i skjoldbruskkjertelen og har høy sykdomsfri overlevelse, er anaplastisk thyreoideakarsinom (ATC) en svært sjelden, men alvorlig sykdom. Av DTC opptrer papillært thyreoideakarsinom (PTC) aller hyppigst. Locati et al. (2020) presenterte europeiske alders-standardisert insidensrater for PTC og ATC på henholdsvis 3,4/100.000 og <0,4/100.000 innbyggere (1). I 2023 ble thyreoideakarsinom diagnostisert i Norge hos 497 personer totalt (2). Sammenlignet med DTC som har ti års overlevelse på over 90 %, er mortaliteten høy hos pasienter med ATC med bare 10-15 % to års overlevelse (3,4,5).
ATC vokser raskt lokalt på halsen, gir hyppig rekurrensparese og pustebesvær. De fleste pasientene har lokalavansert sykdom ved diagnosetidspunkt. Fjernmetastaser opptrer ofte initialt eller innen få måneder og nesten ingen pasienter helbredes da, uansett terapeutisk tilnærming. Median levetid har til nylig vært under ett år til
tross for multimodal terapi (6) og med fem års overlevelse på under 10 %. Hos de få som har kunnet helbredes har det ofte vært et lite, intrathyreoidalt fokus av ATC i struma eller DTC.
Ved ATC har primær kirurgi ofte ikke vært mulig, og palliativ strålebehandling og sikring av luftveier med trakeostomi har vært behandlingen man har kunnet tilby. I senere tid er det utviklet mer målrettet medikamentell behandling som BRAF-/MEK hemmere og PD-L1 hemmere i tillegg til tyrosinkinase hemmere. Disse medikamentene, både i neoadjuvant og palliativ behandling, har vist effekt med økt overlevelse.
Nasjonalt handlingsprogram med retningslinjer for utredning, behandling og oppfølgning av kreft i skjoldbruskkjertelen er under revisjon og vil snart foreligge (7). Denne revisjonen ligger også til grunn for innholdet i denne artikkelen. Artikkelen presenterer i korte trekk oppdatert kunnskap om ATC og nyere behandlingsformer. Videre presenteres to kasuistikker.
Generelle prinsipper
• Overgang til strikt palliasjon skal vurderes løpende som alternativ gjennom hele behandlingsforløpet
• Inklusjon i kliniske studier anbefales hvis tilgjengelig
Stadium IVa (T1-3a N0 M0)
Stadium IVb (T3b-4 N0 M0 T1-4 N1 M0)
Generelle prinsipper
• Overgang til strikt palliasjon skal vurderes løpende som alternativ gjennom hele behandlingsforløpet
• Inklusjon i kliniske studier anbefales hvis tilgjengelig
Stadium IVc (T1-4 N0-1 M1)
Ønske om aggressiv behandling?
Radikal kirurgi Resektabel?*
Postopr. strålebehandling Konk./adj. kjemoterapi
BRAF-mutert
Dabrafenib + trametinib
Ja Nei
IHC: BRAF
IHC: PD-L1 Utvidet genpanel
RET-/NTRK-/ALK-fusjon
TMB-high/MSI
PD-L1+
Annet
Tilgjengelig målrettet behandling
Nei Ja
Utmerket respons?
* Realistisk mål om R0/R1-reseksjon uten laryngectomi øsofagusreseksjon eller rekonstruksjon av store kar. Debulkende kirurgi frarådes.
Ikke BRAF-mutert **
Radikal strålebehandling Konk./adj. kjemoterapi eller
Palliativ strålebehandling
Ingen tilgjengelig målrettet behandling
**Nytte av gentesting og målrettet behandling utover BRAF-/MEKhemmere som ledd i primærbehandlingen av inoperabelt stadium IVb er lite dokumentert. Dersom denne veien velges, kan kjemoterapi som bro frem til molekylærpatologisk konklusjon foreligger være aktuelt
FIGUR 1: Flytskjema over behandlingsprinsipper hos pasienter med anaplastisk thyreoideakarsinom og primær resektabel sykdom (stadium IVa og operabelt stadium IVb) (27). Utarbeidet av overlege Elin Hallan Naderi, Avdeling for kreftbehandling, Oslo Universitetssykehus. Tillatelse til publisering er innhentet fra Oslo Universitetssykehus ved Elin Hallan Naderi og Elin Høy.
PATOLOGI
Anaplastiske karsinomer kan oppstå de-novo eller ved dedifferensiering av karsinomer med høyere differensiering. ATC viser enten et ensartet vekstmønster eller en kombinasjon av sarkomatoid, kjempecelle- og/eller epitelialt preg. Det kan morfologisk være vanskelig å avgjøre hvorvidt tumor er primært utgående fra thyreoidea eller representerer innvekst i thyreoidea fra et naboorgan. BRAF (V600E) er uttrykt i 45 % av tilfellene ved ATC (9).
I henhold til gjeldende WHO-klassifisering skal plateepitelkarsinomer inkluderes blant de anaplastiske karsinomene (8). ATC med plateepiteldifferensiering kan ha en komponent av DTC, med BRAF (V600E) uttrykt i 87 % av tilfellene (7,9).
Tumorcellene i ATC viser vanligvis uttalt pleomorfi og mange mitoser. Siden morfologien kan overlappe med
Ja Nei
Molekylær testing:
IHC BRAF-mutasjon
IHC PD-L1-uttrykk Utvidet genpanel
Målrettbar genendring?
BRAF-mut
Strikt palliasjon
Palliativ strålebehandling og/eller kjemoterapi i påvente av genpanel
RET-/NTRK-/ALK-fusjon
TMB-high/MSI PD-L1+
Annet
Dabrafenib + trametinib
Evt tilgjengelig målrettet behandling
God tumorrespons og toleranse?
Ja
Nei
Vurdere konsoliderende behandling*
Palliativ strålebehandling og/eller kjemoterapi
Ingen
FIGUR 2: Flytskjema over behandlingsprinsipper hos pasienter med anaplastisk thyreoideakarsinom stadium IVc (27). Utarbeidet av overlege Elin Hallan Naderi, Avdeling for kreftbehandling, Oslo Universitetssykehus. Tillatelse til publisering er innhentet fra Oslo Universitetssykehus ved Elin Hallan Naderi og Elin Høy.
maligne svulster med annet utgangspunkt, kan diagnosen være vanskelig å stille. Immunhistokjemisk undersøkelse av grovnålsbiopsi gir ofte ikke en endelig avklaring av primært utgangspunkt, og korrelasjon med radiologiske og kliniske funn er viktig.
Umiddelbar undersøkelse av BRAF (V600E)-mutasjon (immunhistokjemisk eller molekylærpatologisk) er nå påkrevd ved påvisning av ATC. Kombinasjon av BRAF-/ MEK hemmere er aktive mot BRAF (V600E) mutert anaplastisk karsinom. PD-L1 anbefales undersøkt med immunhistokjemi (IHC) umiddelbart ved mistanke om eller påvisning av ATC med henblikk på medikamentell behandling. Det er også aktuelt å vurdere Ki-67 og analyse for DICER1 mutasjon. For ATC gjelder en annen UICC stadium inndeling da alle er UICC stadium IV (10), også forklart i Figur 1 og 2.
UTREDNING OG BEHANDLING
Pasienter med mistanke om eller påvist ATC, skal henvises til regionsykehus. Rask utredning og behandling kan være avgjørende. Innleggelse skal vurderes tidlig, også med tanke på truende luftvei. Pasienten utredes som øyeblikkelig hjelp med CT collum/thorax/abdomen/ bekken og MR caput eller FDG-PET/CT. Samme dag gjøres ultralyd hals med finnålsbiopsi og sylinderbiopsi, gjerne med patolog tilstede. Vevet undersøkes for BRAF (V600E) mutasjon og PD-L1 antistoffer. Det skal tidlig involveres onkolog og et palliativt team. Fiberoptisk laryngoskopi for bedømmelse av stemmebåndsfunksjon, subglottis og øvre trakea skal utføres raskt (11). Øsofagoskopi er ofte indisert. Lokal sykdomskontroll er viktig for å avlaste symptomer og øke livskvalitet.
Hos pasienter med ATC i stadium IVa og IVb, og der det foreligger resektabel tumor, anbefales operasjon med total thyreoidektomi og terapeutisk sentral og lateral lymfadenektomi (11,12). Det skal unngås tumordebulking eller utvidet organreseksjon (trachea, øsofagus). Omfattende kirurgi er heller ikke indisert ved fjernmetastaser, stadium IVc, siden det reflekterer uhelbredelig sykdom. Derimot kan det hos pasienter med stadium IVc være en fordel å redusere operasjonens omfang til hemithyreoidektomi ved ensidig sykdom for om mulig å oppnå lokal kontroll (12). Det er svært viktig at evaluering av sykdomsutbredelsen er utredet rett før eventuell kirurgi, da sykdommen endrer karakter svært raskt (12).
Kurasjon og langtidsoverlevelse forekommer sjeldent. Data tyder på at komplett (R0) eller nær komplett (R1) kirurgisk reseksjon av tumor på hals med påfølgende postoperativ strålebehandling, eventuelt med konkomitant og/eller adjuvant kjemoterapi, karakteriserer de fleste pasientene som oppnår langtidsoverlevelse (13-15). For stadium IVa og operable stadium IVb anbefales derfor primær kirurgi med postoperativ kjemoradioterapi. Et mulig unntak er insidentelt oppdaget stadium IVa-sykdom, der tilleggsnytte av aggressiv adjuvant behandling er mer usikker.
Av systemisk behandling har det inntil nylig kun vært mulig å tilby pasientene kjemoterapi.
Allikevel, ingen former av thyreoideakarsinomer er særlig følsomme for cytostatika. Ukedose doxorubicin har vært benyttet sammen med primær og postoperativ strålebehandling ved ATC i Norge siden 2002, grunnet eldre rapporter som har vist respons (16,17). Nytte av
taksaner, alene eller i kombinasjon med strålebehandling, er også rapportert (18-20). Internasjonale retningslinjer har også anbefalt konkomitant antrasyklin og/ eller taksan ved primær radikal eller postoperativ strålebehandling av ATC (12,21). For pasienter med primært inoperabelt stadium IVb tyder data på at aggressiv multimodal behandling kan gi overlevelsesgevinst (13-15).
For pasienter med fjernmetastatisk sykdom (stadium IVc) er det ikke holdepunkter for at radikal lokoregional kjemoradioterapi gir overlevelseseffekt, og disse bør i hovedsak tilbys symptomlindrende behandling, som kan omfatte lokoregional strålebehandling.
Figurene 1 og 2 viser flytskjema for behandling ved ATC stadium IVa, IVb og IVc.
For BRAF-mutert anaplastisk thyreoideakarsinom foreligger en fase 2-studie som har vist høy responsrate ved bruk av BRAF-/MEK-hemmer (22, 23). En publisert pasientserie har vist at BRAF-/MEK-hemmer, med eller uten samtidig PD-L1 hemmer, kan gjøre opprinnelig teknisk inoperable primærtumorer operable, med høy grad av histopatologisk respons (24). På bakgrunn av dette, har nordamerikanske og europeiske retningslinjer nylig anbefalt at pasienter med inoperabel lokalavansert anaplastisk thyreoideakarsinom uten fjernmetastaser (Stadium IVb), skal testes for tilstedeværelse av BRAF-mutasjon som del av innledende utredning. Ved BRAF-mutert status tilbys neoadjuvant behandling med BRAF-/MEK hemmer før ny vurdering av radikal kirurgi eller radikal strålebehandling (12,18). Bruk av dabrafenib og trametinib på denne indikasjonen er per i dag ikke søkt godkjent i European Medical Agency (EMA), men etter søknad har Beslutningsforum i Norge godkjent innføring av behandlingen på denne indikasjonen. Pasienter bør diskuteres fortløpende på MDT møter mellom kirurg og onkolog.
Noen få pasienter med anaplastisk thyreoideakarsinom har translokasjoner som involverer RET-, NTRK- eller ALK-genene, med fusjonsproteiner som er potensielle drivere av kreftsykdommen, og som kan være tilgjengelig for spesifikk målrettet behandling etter individuell søknad eller på forhåndsgodkjent tumoragnostisk indikasjon. Allikevel er nytten foreløpig ukjent.
Kombinasjon av immunterapi og kinasehemmer ved anaplastisk thyreoideakarsinom er publisert i små serier. En liten studie beskriver seks pasienter med metasta-
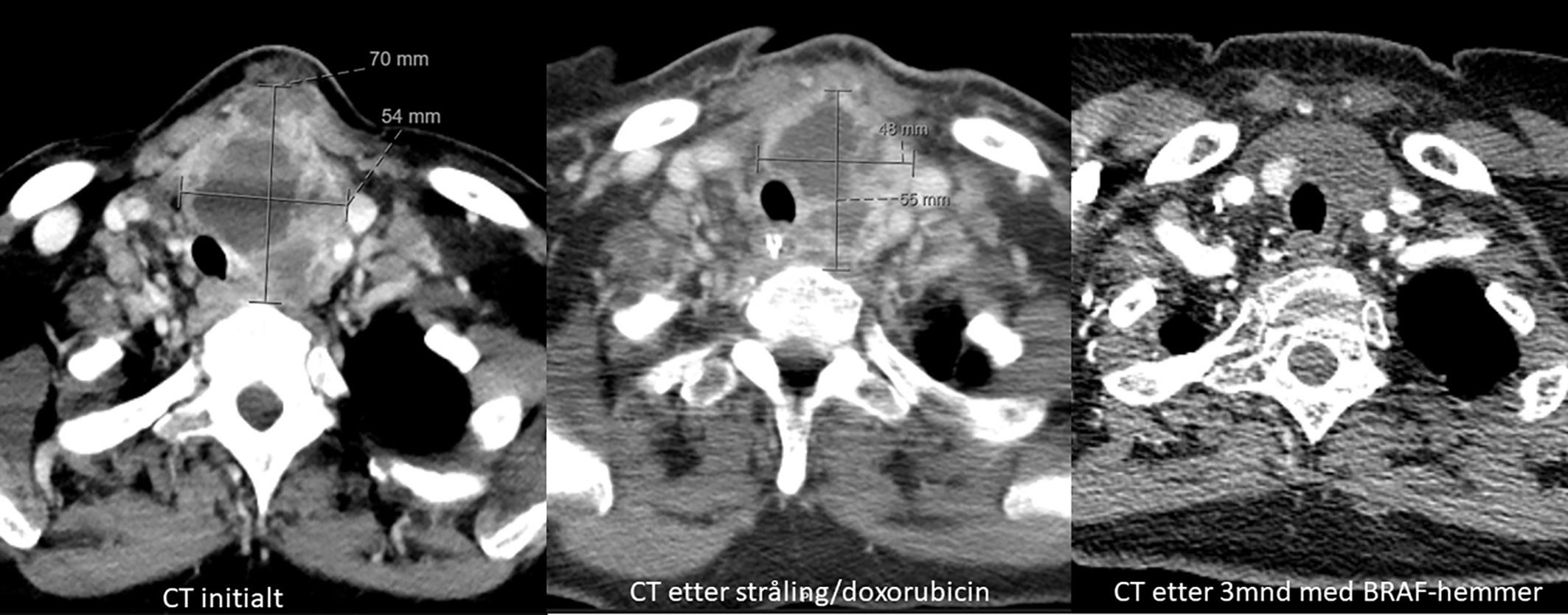
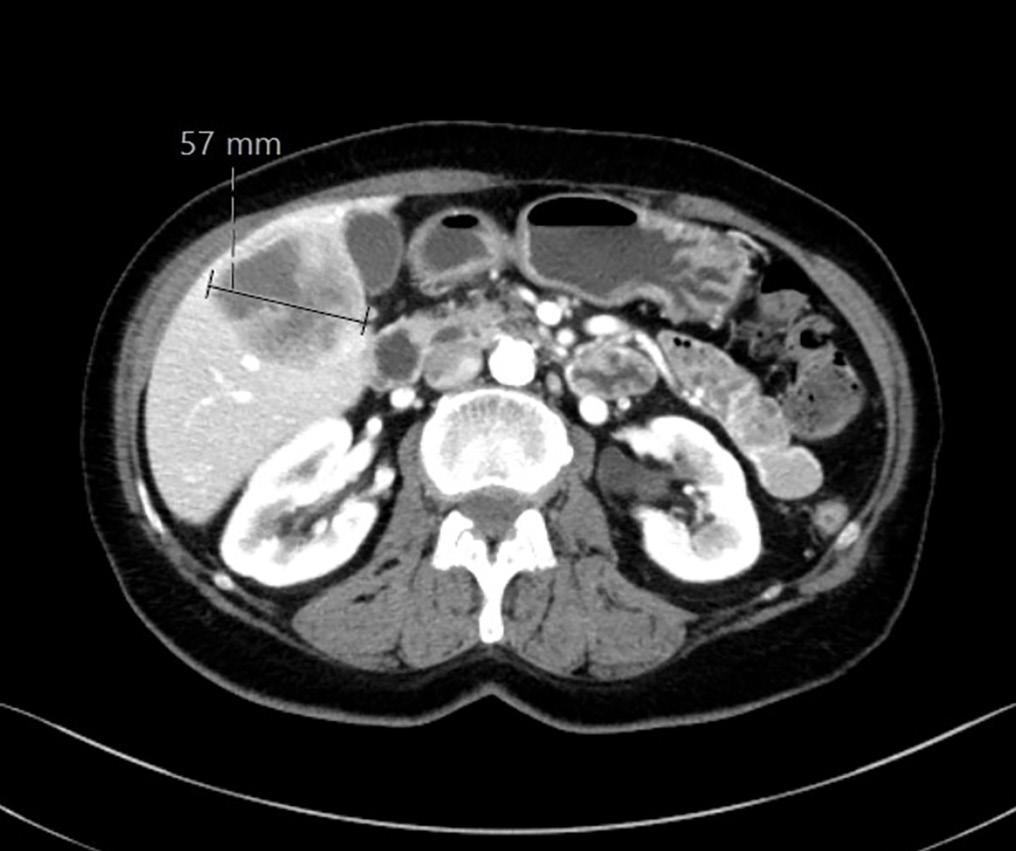
BILDE 1: Initial CT collum viste tumorstørrelse på 70x54 mm. CT undersøkelse en måned senere som var tre dager etter fullført strålebehandling viste tumor-reduksjon til 55x48mm. CT undersøkelse etter ytterligere tre måneder med tillegg av dabrafenib og trametinib viste at tumor hadde gått tilbake til tre cm i størrelse. Samtykke til publisering av røntgenbildene er innhentet fra pasientens ektemann da pasienten er død.
tisk anaplastisk karsinom og to med lite differensiert karsinom, som fikk immunterapi med PD-L1 hemmeren pembrolizumab i kombinasjon med lenvatinib (25). Hos fire av seks ATC-pasienter tilkom komplett respons med median progresjonsfri overlevelse 16,5 måneder. Pasientene med komplett remisjon mer enn to år hadde enten høy tumormutasjonsbyrde (TMB > 10 mutasjoner/megabase) eller PD-L1 uttrykk i mer enn 50 % av tumorcellene. Det pågår en fase 2 studie med kombinasjonsbehandling med pembrolizumab og lenvatinib.
Immunterapi alene er også testet i en fase 2 studie som inkluderte 42 pasienter med lokalavansert eller fjernmetastatisk anaplastisk thyreoideakarsinom (26). Behandling med PD-L1 hemmeren spartalizumab ga en total responsrate på 19 %. Stratifisering ut ifra PD-L1 uttrykk hos pasienter der denne informasjonen var tilgjengelig, viste ingen respons hos PD-L1 negative pasienter (0/12), men 29 % responsrate hos PD-L1 positive pasienter (8/28).
Medikamentell behandling med nyere medikamenter bør om mulig foregå i studier. Det må gjøres en individuell vurdering av hver enkelt pasient med tanke på om det er grunnlag for å prøve palliativ onkologisk intervensjon, eller kun støttebehandling og symptomlindring.
ETIKK
Vi presenterer nå to kasuistikker. Det foreligger signert pasientsamtykke fra pasientens mann i første kasuistikk, da pasienten er død, og samtykke fra pasienten selv i andre kasuistikk.
KASUISTIKK 1
En 72 år gammel kvinne oppsøkte fastlegen med nyoppstått 2x2 cm stor kul på halsen. Hun ble henvist til ultralydundersøkelse lokalt og senere ble det utført finnålsprøve samme sted, som ga mistanke om anaplastisk karsinom. Da hadde svulsten vokst til 8 cm. Hun ble henvist til regionsykehus og innlagt neste dag. Grovnålsbiopsier bekreftet anaplastisk thyreoideakarsinom. Pasienten hadde da utviklet heshet og smerter, men hadde ikke svelgvansker eller dyspné. Tumor i thyroidea var inoperabel, samt at hun hadde multiple små lungemetastaser. Det ble startet med strålebehandling to ganger daglig (1,5 GYx30-45) samt ukedose doksorubicin. Behandlingsrespons ble evaluert med CT-undersøkelse (Bilde 1). Det ble påvist BRAF (V600E) mutasjon, og etter fullført strålebehandling ble det startet med BRAF-/MEK hemmerne dabrafenib 75 mg x 1 og trametinib 1 mg x 1 en måned etter innleggelsen. Dosen ble økt etter ni dager. Tumor og metastaser på hals og i lunger viste komplett respons, og pasienten ble operert med venstresidig hemithyreoidektomi etter fem måneder. Det var betydelige adheranser og forandringer rundt thyroidea relatert til tidligere behandling. Endelig histologi viste kun enkeltliggende tumorceller i thyreoidealappen. Dabrafenib 100 mg x 2 og trametinib 2 mg x1 ble kontinuert med enkelte pauser på en til tre uker på grunn av nøytropen feber.
CT thorax/abdomen/bekken 16 måneder etter sykdomsdebut viste ingen tegn til persisterende sykdom. Imidlertid hadde pasienten fått smerter i skulder og 17 måneder etter sykdomsdebut ble det påvist en 4,5 cm stor metas-
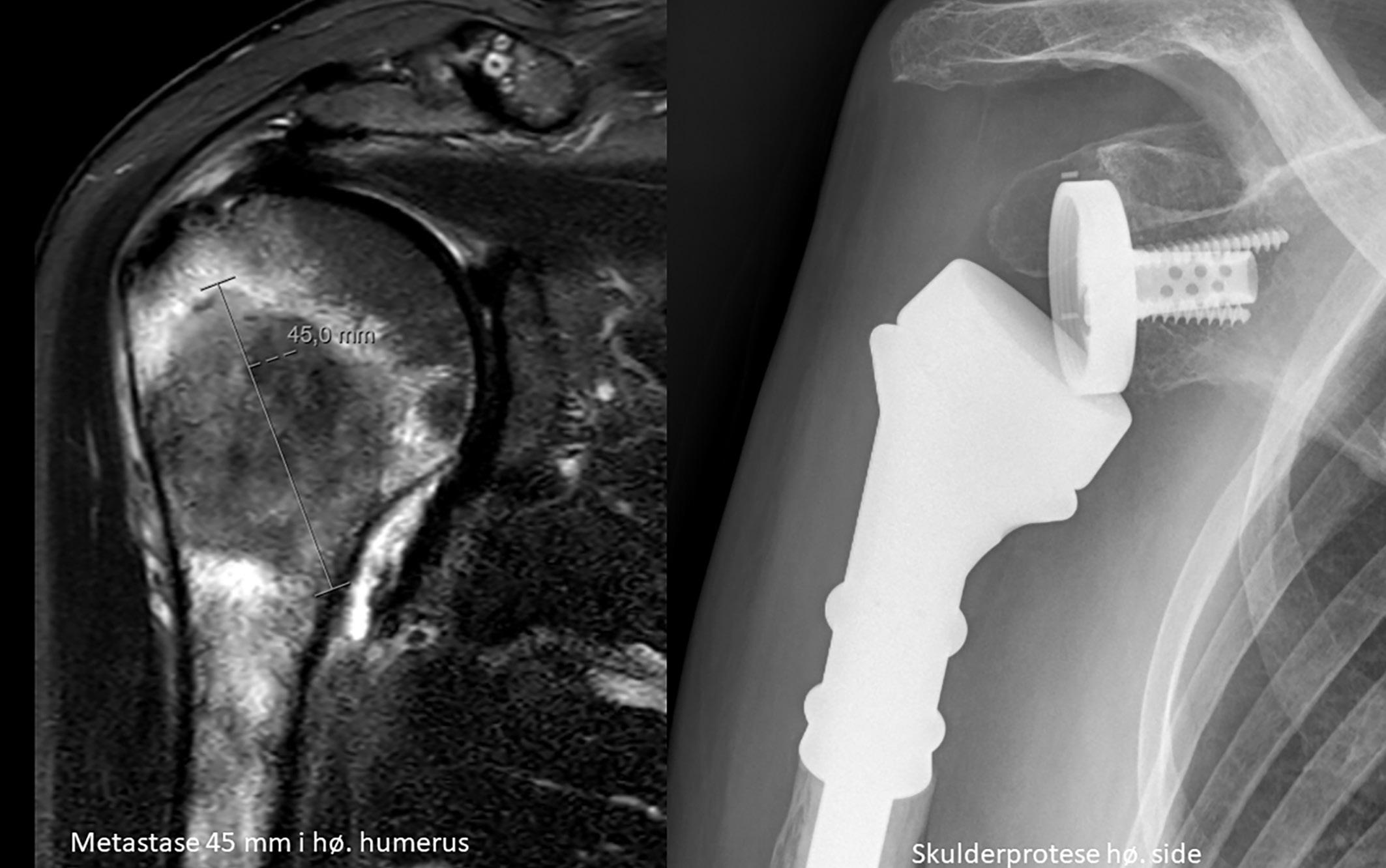
2: MR høyre skulder 14 måneder etter sykdomsdebut viste metastase i humerus. Den ble initial strålebehandlet med noe bedring av smertene. Etter hvert tilkom det påny vekst og smerter, og pasienten ble operert med protese etter åtte måneder. Samtykke til publisering av røntgenbilde er innhentet fra pasientens ektemann da pasienten er død.

tase i humerus (Bilde 2). Biopsi bekreftet metastase fra anaplastisk karsinom. NTRAK 1-3 fusjon og RET fusjon/ mutasjon var negative. Pasienten fikk strålebehandling 4 Gy x 7 mot metastase i humerus. Medikasjon ble endret til encorafenib 150 mg og bimetinib 45 mg x 2. Åtte måneder senere ble hun operert med fjerning av tumor i humerus og implantasjon av skulderprotese på grunn av økende vekst og smerter.
Tjuesju måneder etter sykdomsdebut viste CT progredierende sykdom med lunge- og skjelettmetastaser. Encorafenib og bimetinib ble seponert, og pasienten fikk PDL1 hemmer nivolumab 480 mg hver fjerde uke. Det var dessverre ingen effekt av nivolumab og pasienten døde tre måneder senere.
Til tross for fjernmetastaser på diagnosetidspunktet og primært inoperabel tumor på hals, overlevde denne pasienten i to år og åtte måneder. Dette skyldes ny BRAFrettet behandling.
KASUISTIKK 2
En 72 år gammel kvinne med tidligere revmatoid artritt ble i januar 2021 operert for et papillært thyreoideakarsinom med total thyreoidektomi og cervikosentral lymfadenektomi. Endelig histologi viste multifokalt, bilateralt papillært thyreoideakarsinom, største på 42 mm venstre side, med ekstrathyreoidal vekst og metastaser til 6 av 17 undersøkte lymfeknuter. Helkroppsscintigrafi etter behandling med 3 GBq radioaktiv jod ga ikke mistanke om gjenværende tumorvev. Poliklinisk kontroll ble planlagt etter 9-10 måneder.
Pasienten ble henvist på nytt i juli 2021 med raskt voksende tumor lateralt på venstre side av halsen og smerter relatert til tumor. Snarlig ultralyd hals med finnålsbiopsi avdekket metastaser fra thyreoideakarsinom. FDG-PET/ CT bekreftet FDG-avide tumores på hals, men ingen fjernmetastaser. Pasienten ble reoperert august 2021 med venstresidig cervikosentral og lateral lymfadenektomi. Histologi viste 3 av 21 lymfeknuter med metastaser fra anaplastisk thyreoideakarsinom. Pasienten ble henvist for adjuvant stråleterapi med 3 Gy x 17.
Allerede to uker postoperativt tilkom det ny hevelse cervikalt og PET/CT viste residiv venstre hals og metastaser til lever og lunge. Pasienten var i utmerket all-
menntilstand og startet med planlagt stråleterapi. Pasienten ble inkludert i IMPRESS studien og molekylærpatologisk analyse fant BRAF (V600E) mutasjon og PD-L1 antistoff positivitet på 20 %. Pasienten startet i november 2021 med BRAF-/MEK hemmer (vemurafenib og cobimetinib) med betydelig klinisk og radiologisk respons. Grunnet toksisitet måtte behandling seponeres og pasienten ble fulgt uten behandling fra mai til september 2022, men med progress av levermetastasene og forverring av allmenntilstand (Bilde 3). Man valgte derfor å starte med PD-L1 hemmer pembrolizumab utenfor indikasjon. Allerede to uker etter oppstart var det klinisk bedring med radiologisk regress av sykdom (lever, lunge og hals). Pasienten fikk fire behandlinger med pembrolizumab men ønsket å slutte med immunterapi grunnet økende bivirkninger.
Siste kontroll i desember 2024: «…hun har uendret naturlige funksjoner. Hun synes livskvaliteten er svært god, opplever selv ingen sykdomsfølelse nå…» CT hals/ thorax/abdomen viste restforandringer i lunge og lever, ingen tilkomne lesjoner (Bilde 4).
KONKLUSJON
Inntil nylig har man hatt lite å stille opp med av behandling hos pasienter med ATC. Sykdommen utvikler seg raskt, med kort overlevelsestid for pasienten. Ny systemisk behandling som BRAF-/MEK hemmere og PD-L1 hemmere ser ut til å gi lovende resultater med bedret prognose og økt overlevelse.
TAKK
Takk til overlege Elin Hallan Naderi, Avdeling for kreftbehandling, Oslo universitetssykehus for tillatelse til publisering av Figurene 1 og 2, som er utarbeidet av henne.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
Små anatomiske strukturer kan til tross for størrelse ha stor innvirkning på menneskelig helse. Paratyreoideakjertlene (biskjoldkjertlene) er et klassisk eksempel på dette paradokset. I denne artikkelen ser vi på paratyreoidea sin rolle i reguleringen av kalsium i kroppen og hvordan ulike former for hyperparatyreoidisme behandles kirurgisk.
OLA WESTERHEIM 1, YNGVE NORDBØ 2, MARIANNE TODAL 2, INGA KARSRUD 1
1 SEKSJON FOR BRYST- OG ENDOKRINKIRURGI, KREFTKIRURGISK AVDELING, OSLO UNIVERSITETSSYKEHUS
2 AVDELING FOR BRYST- OG ENDOKRINKIRURGI, HAUKELAND UNIVERSITETSJUKEHUS KORRESPONDANSE: OLA WESTERHEIM – UXOLWE @ OUS - HF.NO
ANATOMI OG FYSIOLOGI
Trolig på grunn av størrelsen ble paratyreoidea oppdaget sent i den medisinske historie. Først i 1880 ble paratyreoidea beskrevet i en publikasjon av den svenske anatomist og medisinstudent Ivar Sandström i Uppsala. Dette ble omtalt som oppdagelsen av «det siste anatomiske organ», men fikk liten internasjonal oppmerksomhet,
FIGUR 1: Sandströms tegning av paratyroideakjertlenes anatomi (fra Upsala Journal of Medical Sciences. 2015; 120: 72–77, Open Access)
da forfatteren kun fikk publisert artikkelen på sitt eget morsmål. Sandstrøm beskrev en liten blek kjertel «knapt så stor som et hampefrø» lokalisert ved skjoldbruskkjertelen (Figur 1) (1).
I tiårene etter oppdagelsen erfarte en at ved å fjerne disse små kjertlene hos forsøksdyr kunne en utløse alvorlige kramper (tetani). Det var likevel først i 1925 at en gjennomførte første operasjon hos menneske med fjerning av en forstørret paratyreoidea. Denne ble gjennomført i lokalanestesi av Felix Mandl i Wien hos en 38 år gammel mann med alvorlig bensykdom (osteitis fibrosa cystica) og etter å ha fjernet en forstørret kjertel oppnådde en dramatisk bedring i skjelettstatus (2).
I årene etter andre verdenskrig ble det vanligere å behandle pasienter med primær hyperparatyreoidisme (pHPT) operativt og både utredning og behandling ble etter hvert systematisert.
Anatomisk kartlegging konkluderte etter hvert med at det hos mennesker og de fleste dyrearter finnes fire paratyreoideakjertler i nær relasjon til tyreoidea, og at normale kjertler kun måler 4-6 mm med vekt 20-40 mg. Hos noen kan det (tidvis til kirurgers frustrasjon) fore-


BILDE 1, 2 og 3: 18FCholin PET-undersøkelse og operasjonspreparat av et stort paratyroideaadenom (54 g) beliggende retroøsofagealt med ekstensjon ned i mediastinum. Sykdommen ble påvist på grunn av hyperkalsemisk krise. Pasienten har samtykket til bruk av bilder.
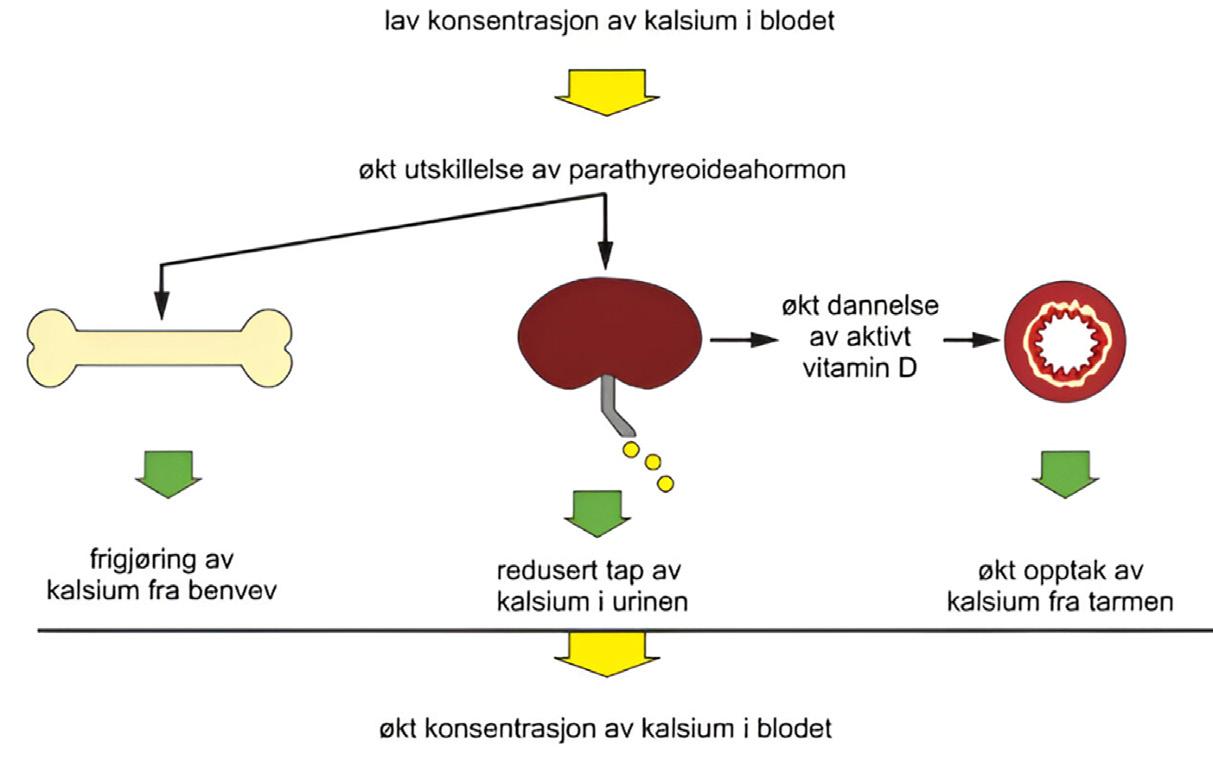
FIGUR 2: Kalsiummetabolismen (Halse, Johan; Berg, Jens Petter: parathyreoideahormon i Store medisinske leksikon på snl.no. Hentet 23. april 2025 fra https://sml.snl.no/parathyreoideahormon)
ligge en femte kjertel og en sjelden gang flere. Embryologisk stammer de øvre paratyreoideakjertlene fra fjerde gjellebue og de nedre fra tredje gjellebue (sammen med tymus). Vanlig lokalisasjon er på hals, men som kirurger opp gjennom årene har erfart, kan lokalisasjon variere en del og kan gjenfinnes også i mediastinum (Bilde 1-3).
Paratyreoideahormon (PTH) utskilles fra hovedcellene (chief cells) i kjertlene som respons på fall i serumkalsium. Regulering skjer via kalsium-sensitive reseptorer (CaSR) på celleoverflaten, som monitorerer ekstracellulært kalsiumnivå og øker utskillelsen ved fallende kalsium-
nivå. PTH regulerer kalsium via målorganer (skjelett og nyrer) for å oppnå homeostase. I nyrene økes den tubulære reabsorbsjon av kalsium. Dette skjer parallelt med at en får økt tap av fosfat i urinen, som følge av redusert tubulær reabsorbsjon av fosfat. Hos friske individer er det lite tap av kalsium fra ben i det daglige. Nyrene filtrerer opptil 10 000 mg kalsium hver dag, men 98 % blir reabsorbert. Utskillelse av kalsium i urin reflekterer i hovedsak netto absorbsjon fra tarm. I nyrene stimulerer PTH i tillegg til omdanning av vitamin D til aktive metabolitter som øker kalsiumopptak i tarm (Figur 2).
A summary of panel recommendations for surgical management of PHPT
1. Symptomatic PHPT: all symptomatic patients should be offered parathyroid surgery unless medically contraindicated.
2. Asymptomatic PHPT
A. Serum calcium >1 mg/dL (0.25 mmol/L) above the upper limit of normal
B. Skeletal involvement:
a. A fracture by VFA or vertebral X-ray or b. BMD by T-score ≤ −2.5 at any site or
C. Renal involvement:
a. eGFR or creatinine clearance <60 mL/min or b. Nephrocalcinosis or nephrolithiasis by X-ray, ultrasound, or other imaging modality or c. Urinary calcium excretion: hypercalciuria (eg, >250 mg/day in women; >300 mg/day in men).
D. Age <50 years (no other indications are necessary; age <50 years is a sufficient indication)
E. If no aforementioned guidelines are met, PTX is still an option with concurrence of the patient and physician and if there are no contraindications
TABELL 1: Anbefalinger for kirurgisk behandling av asymptomatisk pHPT, (fra Bilezikian JP, Khan AA, Silverberg SJ et al. Evaluation and Management of Primary Hyperparathyroidism: Summary Statement and Guidelines from the Fifth International Workshop. JBMR 2022; 37(11): 2293-2314, Open Access)
Paratyreoideakjertlene imponerer ikke i størrelse, men utgjør termostaten for regulering av kroppens kalsiumnivå. Denne reguleringen er kritisk for funksjonen til nerver, muskler og hjerte, i tillegg til koagulasjonssystemet.
PRIMÆR HYPERPARATYREOIDISME
I den vestlige verden diagnostiseres primær hyperparatyreoidisme (pHPT) hos 0,7 % av befolkningen og 2 % av postmenopausale kvinner (3). 85-90 % har paratyreoideaadenom/enkjertelsykdom, 10-15 % har flerkjertelsykdom, mens cancer er svært sjelden (< 1 %). I dag er den vanligste årsaken til at pHPT blir oppdaget at pasienten får påvist forhøyet kalsium i serum uten at det på forhånd var mistanke om sykdommen. Andre årsaker kan være utredning på grunn av lavenergibrudd, påvist nedsatt bentetthet eller at pasienten har nyresteinsplager. Hos de fleste er imidlertid sykdommen asymptomatisk. Kurativ behandling er kirurgi, og det er dokumentert at operasjon kan bedre osteoporose, redusere nye nyresteinsanfall og stabilisere en eventuelt synkende nyrefunksjon (4).
Diagnosen stilles ved påvist forhøyet kalsium med en samtidig PTH-verdi som er forhøyet eller uforholdsmessig høy i forhold til kalsiumverdien. Tiazider bør seponeres minst en uke før blodprøvetaking. Eventuell nyresvikt bør utelukkes ved måling av kreatinin og GFR og sekundær hyperparatyreoidisme, på grunn av D-vitaminmangel, utelukkes ved å konstatere at 25-OH-vitamin D >75 nmol/l.
En viktig, men sjelden differensialdiagnose til pHPT er familiær hypokalsiurisk hyperkalsemi (FHH), en autosomalt arvelig tilstand der kalsium og PTH kan være lett til moderat forhøyet. Kirurgi er ikke indisert for denne tilstanden som, i motsetning til pHPT, gir lav utskillelse av kalsium i urin. Ifølge internasjonale retningslinjer bør man før operasjon for hyperparatyreoidisme utelukke denne tilstanden ved utregning av kalsium-kreatininclearance-ratio (CCCR) ved målinger av kalsium og kreatinin i døgnurin og samtidig blodprøve. Endokrinologisk veileder anbefaler at man for enkelhets skyld starter med å regne ut kalsiumekskresjonsratio etter målinger i dagens andre morgenurin, selv om dette har lavere sensitivitet og spesifisitet (5). Ved usikkerhet om det kan foreligge FHH, kan man supplere med CCCR eller gå videre med gentest.
Ved påvist primær hyperparatyreoidisme utredes pasienten med DXA-scan for å utelukke osteoporose (påvises hos 50-60 %) med samtidig VFA (Vertebral Fracture Assessment) for å utelukke kompresjonsfrakturer i ryggen (hos ca. 1/3) og utredning med UL eller CT av nyrer for å utelukke nyrestein (15-20 %) eller nefrokalsinose (6).
Familieanamnese med tanke på hyperkalsemi, hyperparatyreoidisme eller nevroendokrine tilstander hører også med i det 2-5 % av pHPT har genetisk årsak (7). Flerkjertelsykdom eller hyperparatyreoidisme i ung alder gir økt mistanke om arvelig bakgrunn for sykdommen. Ved mistanke om familiær sykdom bør det foreligge svar på genpanel for hyperparatyreoidisme preoperativt, da dette kan ha betydning for operasjonsstrategien. Man bør også spørre om pasienten er operert med gastrisk bypass eller har andre malabsorbsjonstilstander, da disse pasientene kan være vanskelige å behandle dersom de får postoperativ hypokalsemi. Bruk av Litium eller benresorbsjonshemmere kan også komplisere diagnostikken.
Det kan også være nyttig med måling av magnesium, fosfat og alkalisk fosfatase preoperativt, spesielt ved alvorlig hyperkalsemi. Forhøyet ALP kan indikere økt fare for «hungry bone syndrom» (benhunger) med risiko for lave kalsiumverdier postoperativt.
Ved symptomatisk pHPT er det indikasjon for operasjon dersom det ikke foreligger sterk medisinsk kontraindikasjon eller pasienten etter informasjon ikke ønsker operasjon. Ved asymptomatisk sykdom er det også indikasjon for operasjon, dersom kriteriene i Tabell 1 er oppfylt. Endokrinologisk veileder anbefaler som nevnt kalsiumekskresjonsratio i spoturin i første omgang og har
4 og 5: 18FCholin PET-undersøkelse og operasjonspreparat av et mindre paratyroideaadenom ved nedre pol av høyre tyroidealapp. Sykdommen ble påvist i forbindelse med utredning av osteoporose. Pasienten har samtykket til bruk av bilder.

fritt kalsium i serum > 0,12 mmol/ l over øvre referansegrense som eget tilleggskriterium (5). Internasjonale retningslinjer finner også indikasjon for kirurgi hos pasienter med påvist asymptomatisk pHPT der videre medisinsk overvåkning som alternativ til operasjon av forskjellig grunner ikke er mulig eller der pasienten etter informasjon ønsker operasjon (4,8).
PREOPERATIV BILLEDDIAGNOSTIKK
– ANATOMISK KARTLEGGING
Når det er funnet indikasjon for operasjon, henvises pasienten til billeddiagnostikk med tanke på å lokalisere den
eller de patologiske paratyreoideakjertlene. Det vanligste har de siste årene vært å gjøre sestamibi-scintigrafi kombinert med SPECT/CT med en deteksjonsrate på 88 % i en metaanalyse (9). Problemet er betydelig lavere deteksjonsrate ved multiglandulær sykdom enn ved et adenom.
4D-CT, der den fjerde dimensjonen er tid for oppladning og utskillelse av kontrast i paratyreoideakjertelen, kan også være svært nyttig i den preoperative lokaliseringen, spesielt ved ektopisk lokalisasjon, og gir den beste fremstillingen av akkurat hvor patologien ligger i forhold til
omgivende anatomiske strukturer. 4D-CT er bedre enn sestamibi med SPECT/CT, der det er behov for å reoperere pasienten for persisterende sykdom (10).
De siste par årene har vi fått et enda bedre nukleærmedisinsk lokaliseringsverktøy i 18FCholin PET/CT med en deteksjonsrate på minst 92 % (9). Dette brukes ved usikre funn på sestamibi-scintigrafi, og ved mange sentra er 18FCholinPET nå den foretrukne undersøkelsen (Bilde 1, 4 og 5).
Nukleærmedisinske undersøkelser, alternativt 4D-CT, kombineres så med ultralydundersøkelse av halsen, der man ved et adenom gjerne ser en velavgrenset hypoekkoisk lesjon og da gjerne på et av predileksjonsstedene for paratyreoideakjertlene (Bilde 6). Sensitiviteten er svært avhengig av undersøker, men var i en metaanalyse 76 % med en positiv prediktiv verdi på 93 % (9). Det er en stor fordel om operatør har erfaring med ultralyd og selv gjør ultralyd preoperativt. Uansett bør operatøren selv granske det som foreligger av billeddiagnostikk før operasjonen for å danne seg et tredimensjonalt bilde av hvor patologien ligger. Ved konkordanse mellom to forskjellige billeddiagnostiske metoder, er det stor sannsynlighet for at det foreligger et enkelt adenom (>96 %) og det ligger til rette for en fokusert operasjon med stor sannsynlighet for at pasienten blir kurert.
Hvis det ikke er konkordante funn eller man ikke ser noe ved undersøkelsene, kan dette skyldes at den forstørrede kjertelen kun er lett forstørret eller at det foreligger multiglandulær sykdom (10-15 %) og man må da ta høyde for at det må gjøres bilateral eksplorasjon. En erfaren endokrinkirurg må da være en del av operasjonsteamet.
KIRURGISK BEHANDLING
– EKSPLORASJON VERSUS FOKUSERT KIRURGI
Bilateral halseksplorasjon med eksplorering og visualisering av alle fire paratyreoideakjertler er fortsatt gullstandarden i paratyreoideakirurgien som alle andre metoder vurderes opp mot. De fleste vil imidlertid i dag gjøre en eller annen form for målrettet operasjon dersom to billeddiagnostiske metoder viser én forstørret paratyreoideakjertel med samsvarende lokalisasjon. Dette kan gjøres som en målrettet operasjon via et lite Kochersnitt, det vil si et lett buet tverrsnitt litt ovenfor jugulum, eller det kan gjøres som en mini-invasiv paratyreoidektomi gjennom et ca. to cm langt snitt mellom laterale kant av rette halsmuskel og mediale kant av musculus sternocleidomastoideus ved en antatt forstørret øvre paratyreoideakjertel eller alternativt i midt-
linjen ved en forstørret nedre kjertel. Det er en fordel at operatøren selv gjør ultralyd og merker av lokalisasjon til paratyreoideakjertelen i hud før oppstart av operasjonen. Ved større sentra med stort operasjonsvolum er den såkalte MIVAP-teknikken (minimalt invasiv video-assistert paratyreoidektomi), der man legger et halvannet cm langt snitt nedad i midtlinjen og dissekerer, veiledet av sanntidsvideobilder fra et endoskop som brukes som et “øye” i snittåpningen, en meget elegant og rask metode (11).
Intraoperativ PTH-måling anses av mange som en nødvendighet dersom man velger å utføre målrettet operasjon framfor bilateral halseksplorasjon. PTH har meget rask halveringstid i blod (3-5 min) og en protokoll hvor man anser > 50 % fall i PTH målt i blodprøve tatt 10 minutter etter eksisjon vil gi en positiv prediktiv verdi for biokjemisk kurasjon på >96 % (12).
Ved bruk av intraoperativ PTH-måling kan man også med mer usikre funn ved billeddiagnostikken, velge en mer begrenset operasjonsstrategi, selv om risikoen for multiglandulær sykdom er økt. Det kan noen ganger være aktuelt å starte med en ensidig halseksplorasjon der man vurderer begge paratyreoidakjertlene og hvis kun en anses «syk», kan denne fjernes, og man kan så benytte intraoperativ PTH-måling. Ved tilfredsstillende fall, kan operasjonen avsluttes. Gevinsten er at man unngår bilateral eksplorasjon, slik at kun en recurrensnerve utsettes for risiko for parese med heshet som følge, og faren for vedvarende hypoparatyreoidisme er svært liten. Ved planlegging av slik kirurgi bør man legge første incisjonen slik at denne kan forlenges til et Kochersnitt dersom det blir behov for full eksplorasjon.
Ved alle disse målrettede operasjonene er det den preoperative billeddiagnostikken som lokaliserer sykdommen og den intraoperative PTH-målingen som forteller operatøren om pasienten er biokjemisk kurert.
Hvis man ikke får tilfredsstillende fall i PTH peroperativt, må man gå videre og gjøre bilateral halseksplorasjon, der man lokaliserer alle fire kjertler og vurderer disse. Dersom alle er patologiske, må man gjøre subtotal paratyreoidektomi der man fjerner tre eller tre og en halv kjertel. Man bevarer hele eller en del som svarer til en normalt stor paratyreoidea av den mest normalt utseende kjertelen. Operatør tar også med i vurderingen at den bevarte kjertelen blir liggende slik til at det skal være mulig å reoperere pasienten ved et eventuelt residiv uten alt for stor komplikasjonsrisiko.
TERTIÆR HYPERPARATYREOIDISME
PATOFYSIOLOGI
Reguleringen av kalsium- og fosfathomeostasen er et innviklet, men nøye regulert samspill mellom nyrer, paratyreoideakjertler, skjelett og tarm. Ved redusert nyrefunksjon på grunn av kronisk nyresvikt utløses en rekke biokjemiske prosesser i disse organsystemene. Man betegner tilstanden som «chronic kidney disease - mineral and bone disease» (CKD-MBD). Når GFR faller til under 45, kan man se økende PTH-verdier, og pasienten har utviklet en sekundær renal hyperparatyreoidisme. Hvis nyrefunksjonen blir så dårlig at det er behov for dialyse, har så å si alle pasienter forhøyet PTH og mer enn 80 % har PTH > 16 (13). I starten er disse prosessene hensiktsmessige for å forsøke å opprettholde homeostasen og også påvirkelige av medikamentell behandling. Kalsium og fosfat kan derfor ofte ha normale verdier helt ned til en GFR på 20. Når pasienten har nådd kronisk nyresvikt i endestadiet (GFR< 15) med behov for dialyse, kan hen etter hvert utvikle refraktær renal hyperparatyreoidisme, som ikke lenger er påvirkelig av medikamentell behandling (med fosfatbindere, aktive D-vitamin analoger eller kalsimimetika). De har utviklet tertiær hyperparatyreoidisme (tHPT). tHPT kjennetegnes av at det ikke lenger er en polyklonal diffus hyperplasi av paratyreoidakjertlene - den langvarige overstimuleringen har gitt en monoklonal nodulær hyperplasi med blant annet redusert antall CaSR (kalsium-sensitive reseptorer) og VDR (vitamin D reseptorer) i paratyroideakjertlene. I motsetning til ved den sekundære fasen av renal HPT, der man gjerne finner lav eller normal kalsiumverdi, har man ved tHPT, som ved pHPT, både forhøyet kalsium og PTH. Fosfat er imidlertid også høy, mens den ved pHPT gjerne er rundt nedre referansegrense.
Ved tHPT ser man gjerne først symptomer ved PTH-verdier > 100 pmol/l. Dette kan dreie seg om kløe, proksimal muskelsvakhet og smerter i vektbærende ledd og knokler. Man kan også få bløtvevskalsifikasjoner og da gjerne i kar og en sjelden gang ser man kalsifylaksi eller «brun tumor» i skjelett.
EFFEKTER AV PARATYREOIDEKTOMI
Hos de som har gått i dialyse i 10 år er det nødvendig med paratyreoidektomi hos ca. 15 % og etter 20 år hos 38 % (14).
Vellykket paratyreoidektomi medfører oftest at mange av symptomene forsvinner (hos 95 % i en studie), bentettheten øker, frakturrisikoen reduseres (med 31 %) og helserelatert livskvalitet bedres (15). Noen studier har
også vist bedret ernæringsstatus og mindre resistens mot erytropoietinbehandling av anemi (16). Ifølge en metaanalyse med mer enn 22 000 pasienter der 10 000 var paratyreoidektomert, var det 37 % redusert kardiovaskulær mortalitet og 28 % redusert mortalitet uansett årsak blant de opererte (17).
I en studie utgående fra en stor amerikansk database over nyrepasienter som ble paratyreoidektomert i perioden 2007-2009 var det økt mortalitet de første 30 dagene postoperativt (2,0 %) og så mange som en fjerdedel ble reinnlagt første 30 dager (18). Disse pasientene som ofte er reduserte i utgangspunktet, er svært utsatt for hypokalsemi på grunn av benhunger, og man må også være oppmerksom på faren for kardiovaskulære komplikasjoner og hyperkalemi. I en studie med 187 nyretransplanterte pasienter som enten var paratyreoidektomert før eller etter transplantasjonen ved et av fire nederlandske akademiske sykehus i perioden 1994-2015 var det imidlertid ingen 30-dagers mortalitet. 49 % hadde hypokalsemi men bare 2,4 % trengte å ligge på overvåkingsavdeling for dette (19).
TIMING AV KIRURGI OG VALG AV OPERASJONSMETODE
Det finnes ikke klare omforente retningslinjer for når det er indikasjon for paratyreoidektomi hos disse pasientene, men de fleste kan være enige i at alvorlig og vedvarende refraktær hyperparatyreoidisme med PTH-verdier >85 pmol/l som ikke kan kontrolleres tilfredsstillende med medisinsk behandling uten signifikant hyperfosfatemi eller hyperkalsemi, bør opereres dersom dette ikke er medisinsk kontraindisert.
Noe av bakgrunnen for at grensen har vært satt på dette nivået, er at lavere verdier av PTH ikke sikkert utelukker adynamisk bensykdom med lav benomsetning som kan tenkes å bli forverret etter en paratyreoidektomi. Risikoen for adynamisk bensykdom anses imidlertid for å være liten så lenge PTH er over 64 dersom pasienten samtidig har vedvarende hyperkalsemi eller hyperfosfatemi. Enkelte studier tyder på at man i tvilstilfeller kan supplere med måling av ALP for enda sikrere å utelukke dette (20).
DOPPS-studien så blant annet på dødelighet hos mer en 35 000 medikamentelt behandlede hemodialysepasienter fra en rekke forskjellige land fulgt over en 15 års periode (21). Behandlingsmålene endret seg gjennom perioden. Lavest mortalitet var det for pasientene som hadde en PTH mellom 16-32, mens mortalitet uansett årsak var litt økt i gruppen med PTH 32-48, og i gruppen med PTH >64
var det økt risiko for både kardiovaskulær død og død uansett årsak. Det var også litt økt mortalitet i gruppen som hadde PTH lavere enn 16 og man har i den medikamentelle behandlingen vært redd for å supprimere PTH for mye på grunn av risiko for adynamisk bensykdom og i de siste anbefalingene for medisinsk behandling fra Kidney Disease: Improving Global Outcomes (KDIGO) i 2017 er målet for PTH satt til en verdi på mellom 2-9 ganger øvre referansegrense for PTH for dialysepasientene (22).
Noen har vært redd for at man risikerer liknende effekter dersom PTH blir for lav etter en paratyreoidektomi og har lagt seg på et tilsvarende mål for per- og postoperativ PTH, men det finnes lite gode data å navigere etter (23). I en stor studie fra det japanske nasjonale registeret over pasienter i hemodialyse sammenliknet man data fra mer enn 4400 pasienter som var paratyreoidektomert med et tilsvarende antall ”matchede” pasienter som ikke var operert. De fant at de som var paratyreoidektomert hadde 34 % lavere mortalitetsrisiko og 41 % mindre risiko for kardiovaskulær død (24). De fant også at de som hadde en postoperativ PTH i nedre del av normalområdet hadde lavest mortalitet, men pasientene ble bare fulgt i ett år postoperativt.
Når det gjelder operasjonsmetode foreligger det to hovedalternativer: subtotal paratyreoidektomi med fjernelse av 3 ½ kjertel eller total paratyreoidektomi med autotransplantasjon av paratyreoideavev omtrent svarende til en normalt stor kjertel i musculus brachioradialis i ikkedominant arm eller til musculus sternocleidomastoideus på halsen. De fleste sammenlikninger mellom metodene konkluderer med at begge metodene er nokså jevnbyrdige og at begge kan brukes (25). Det er kanskje litt økt fare for tilbakefall av hyperparatyreoidismen ved subtotal paratyreoidektomi og litt økt fare for hypoparatyreoidisme ved total paratyreoidektomi. Dersom pasienten kan bli kandidat for senere nyretransplantasjon er subtotal paratyreoidektomi å foretrekke, mens dersom dette er utelukket, men pasienten sannsynligvis vil gå i dialyse i mange år, vil mange anbefale total paratyreoidektomi. De fleste anbefaler at det gjøres samtidig bilateral cervical tymektomi fordi mange kan ha overtallig kjertel og 13 – 45 % kan ha intratymisk paratyreoideavev ved renal HPT (15,26).
Nyretransplantasjon er den beste behandlingen for kronisk nyresvikt i endestadiet. Transplanterte har bedre overlevelse, redusert kardiovaskulær risiko, bedret livs-
kvalitet og de helseøkonomiske utgiftene er alt i alt lavere enn for pasienter i dialyse. Tidligere var det en etablert sannhet at når nyrefunksjonen ble normalisert etter transplantasjon, ville hyperparatyreoidismen gå tilbake hos de aller fleste i løpet av ett år, men dette har i nyere studier vist seg å ikke være riktig. 70-80 % har fortsatt forhøyet PTH ett år etter transplantasjon og ca. 40 % to år etter transplantasjon (27). Nyretransplanterte med persisterende HPT har økt risiko for nedsatt bentetthet, frakturer, kardiovaskulær sykdom og død (28,29). Det er også holdepunkter for økt risiko for tap av transplantatet, men dette kan kanskje reduseres dersom man griper inn innen 6-12 måneder etter transplantasjonen ved persisterende hyperparatyreoidisme (30). Ved alvorlig tHPT anbefales det gjerne å avvente nyretransplantasjon til pasienten er tilfredsstillende behandlet medisinsk eller kirurgisk, og ved alvorlig tHPT er kirurgi oftest å foretrekke. Høye PTH-verdier, langvarig forutgående dialysebehandling og store paratyreoideakjertler vurdert ved preoperativ ultralyd (>500 mm3) kan brukes som indikatorer på økt fare for refraktær sykdom.
Pasientgruppen med renal hyperparatyreoidisme er kompleks, der mange hensyn må tas med i vurderingene, og pasienten bør diskuteres multidisiplinært mellom nyremedisinere, endokrinologer og endokrinkirurger for å sikre den beste behandlingen i hvert enkelt tilfelle.
KONKLUSJON
Pasienter med sykdom i paratyreoidakjertlene er en heterogen pasientgruppe. De enkleste pasientene er ferdigbehandlet med et raskt inngrep med lav morbiditet, mens hos de vanskeligste kasusene vil man i enkelte tilfeller ikke lykkes å kurere pasienten selv etter gjentatte kirurgiske behandlinger. Reoperasjoner etter «mislykkede» inngrep er ikke uvanlig. God kunnskap hos behandlende kirurg om paratyroideakjertlenes normalanatomi og varierende beliggenhet og en optimal preoperativ billedutredning er viktige suksessfaktorer.
REFERANSER
Nå enda flere varianter av STRATAFIXTM

Vil du vite mer om våre suturer? Ring
eller besøk ortomedic.no.

Toveis STRATAFIX™ Spiral MONOCRYL™ Plus
• Antibakteriell teknologi på en større del av porteføljen
• Tilgang til flere lengder og farger
• Oppgradering av nåler med Multipass og Ethalloy
• Oppgradert forpakning med enklere åpning og bedre merking
Robotassistert teknikk er godt etablert innen flere kirurgiske fagområder i Norge som urologi, thoraxkirurgi, gastrokirurgi og gynekologi. De siste årene er robotassistert teknikk også etablert innenfor endokrinkirurgien og denne bruken belyses i artikkelen.
ANETTE HEIE¹ OG VEGARD HEIMLY BRUN²
¹ AVDELING FOR BRYST- OG ENDOKRINKIRURGI, HAUKELAND UNIVERSITETSSYKEHUS
² SEKSJON FOR BRYST- OG ENDOKRINKIRURGI, UNIVERSITETSSYKEHUSET NORD - NORGE
KORRESPONDANSE: ANETTE HEIE – ANETTE.HEIE @ HELSE - BERGEN.NO
Robotassistert minimal invasiv kirurgi hadde sin start på 1990-tallet og har utviklet seg fra den første stemmestyrte kamera-holderen til mer avanserte systemer. En av de viktigste fordelene ved dagens robotassistert teknikk er den gode bevegeligheten i de leddede instrumentene som kan roteres og vinkles nesten som et menneskelig håndledd. Dessuten gir det stabile kameraet som kirurgen selv kan styre god visualisering med 3D-syn av det kirurgiske feltet. Bevegelsesskalering og filtrering av håndtremor gir stødigere og mer nøyaktig disseksjon. Bedring av kirurgens ergonomi er en tilleggsgevinst (1). Ulemper med teknikken er økt kostnad og i noen tilfeller også økt tidsbruk på operasjonsstuen knyttet til klargjøring og docking av roboten.
ROBOTASSISTERT ADRENALEKTOMI ( RA )
Den første vellykkede laparoskopiske adrenalektomien (LA) ble beskrevet av Gagner et al. i 1992 (2). I det påfølgende tiåret ble denne teknikken gradvis innført og har befestet sin stilling som gullstandard ved kirurgi på binyre ved benign og i mange tilfeller også ved malign sykdom. LA kan utføres både transabdominalt og retroperitoneoskopisk, oftest valgt etter kirurgens foretrukne metode. I Norge var miljøet ved Intervensjonssenteret ved Oslo universitetssykehus med Bjørn Edwin i spissen først ute med denne prosedyren. Som mange andre laparoskopiske inngrep egner binyrekirurgi seg godt for robotassistert kirurgi. Første robotassisterte adrenalektomi (RA) ble utført av Piazza i 1999 (3). Første robotassisterte partielle adrenalektomi ble utført i 2006 på en pasient med bilaterale feokromocytomer ved von Hippel-Lindaus syndrom (4). I Norge ble RA først tilbudt ved Radiumhospitalet på urologiske pasienter i 2004. Metoden ble innført på Haukeland universitetssykehus i 2022 og har vært standard på Universitetssykehuset Nord-Norge siden januar 2024.
Robotassistert teknikk ved binyrekirurgi har flere fordeler i forhold til vanlig laparoskopisk teknikk. De leddede instrumentene kan roteres og vinkles og gjør det lettere å komme til med fin disseksjon rundt svulster i binyrene og langs med omgivende strukturer, for eksempel ved fridisseksjon av binyrevenen langs vena cava på høyre side. Kirurgstyrt, stabilt kamera med godt 3D-syn gir god oversikt og nøyaktighet ved disseksjonen og kan være en fordel, spesielt ved barksparende kirurgi. Dette er for eksempel aktuelt ved kirurgi av feokromocytom ved påvist genfeil ved von Hippel-Lindau og MEN 2A og B. Av ulemper kan relativ lang læringskurve nevnes. Gjennomgang av litteraturen har antydet cirka 20 inngrep før resultatene ved RA er sammenlignbare med LA (5). I tillegg må man påregne lenger operasjonstid på grunn av ekstra tid for docking av roboten. Dette er vist i komparative studier og bekreftet i metaanalyser (6,7). Økte kostnader er ulempe ved RA som ved all robotassistert kirurgi.
RA har tilsvarende resultater som LA når det kommer til intra- og postoperative komplikasjoner, samt mortalitet ifølge en metaanalyse fra 2017 (6), mens data fra Eurocrine-registeret antyder lavere komplikasjonsrate hos pasienter som er operert med RA sammenlignet med LA (8). Både metaanalyser og data fra Eurocrine-registeret har vist at pasienter som er operert med RA har kortere sykehusinnleggelse enn pasienter som er operert med LA (6,7,8,9). Gjennomsnittlig liggetid var mellom 0,35 og 1 dag kortere etter RA enn etter LA.
På Haukeland universitetssykehus ble RA innført i oktober 2022 og ved utgangen av mars 2025 er det utført 70 robotassisterte inngrep. Som forberedelse til oppstarten hospiterte to kirurger i Lund i Sverige, der RA har vært standard siden år 2000. Kirurgene fikk robotsertifisering ved Intuitive og brukte mye tid på å trene i simulatoren.

BILDE 1: Oppsett ved høyresidig robotassisterte adrenalektomi (RA). Sideleie med nyreknekk, høyre side opp. 12 mm trokar til leverhake samt hjelpeport, tre robot-trokarer. Gjengitt med tillatelse fra pasienten.

BILDE 2: Bilde fra robot-konsoll tatt under høyresidig RA. Leveren er løftet frem med hake. Binyre til venstre i bildet, instrumentet under binyrevenen som på høyre side går horisontalt inn i vena cava.

BILDE 4: Bilde fra robot-konsoll under høyresidig transaksillær robotassistert hemityreoidektomi. Nervestimulatoren ses fra nedre høyre del av bildet og peker på nervus laryngeus recurrens. Bak nervestimulatoren ses også paratyreoidea.
BILDE 3: Ved transaksillær robotassistert tyreoidektomi opereres pasienten gjennom en subkutan tunell (opptegning) mens huden løftes av en retraktor. Bildet er trykket med pasientens samtykke.
Teamet rundt kirurgene på operasjonsstuen hadde jobbet med robotassisterte inngrep på gastrokirurgisk avdeling i flere år og var i så måte drillet i det praktiske rundt selve roboten. Til støtte og god hjelp var Bjørn Brennhovd fra Oslo universitetssykehus til stede på operasjonsstuen på de to første inngrepene.
Erfaringen med RA fra Haukeland universitetssykehus har vært positiv. Kirurgene opplevde det uvant i starten å ikke ha den taktile feedback ved disseksjon og håndtering av vevet, men dette ble fort en vanesak. Å finne riktig portplassering for å unngå at portene/instrumentene kom i konflikt under inngrepet var en annen utfordring som ble mindre med erfaring. Det har vært få komplikasjoner og konverteringer og vi opplever at vi planlegger og fullfører laparoskopisk (robotassistert) kirurgi på større benigne svulster enn tidligere.
ROBOTASSISTERT TRANSAKSILLÆR TYREOIDEKTOMI ( RATT )
Tyreoidektomi gjennom den tradisjonelle cervikotomien (kragesnitt) er forbundet med lite lokale plager og har for de fleste et akseptabelt kosmetisk resultat. Imidlertid vil et synlig arr så nært ansiktet for noen være sjenerende og en daglig påminnelse om gjennomgått sykdom. Ønsket om å redusere/unngå arr på halsen har vært hoveddrivkraften i utviklingen av alternative kirurgiske teknikker for endokrin halskirurgi de siste 30 årene. I tillegg har man håpet at videoassisterte teknikker kunne redusere noen av de vanlige komplikasjonene og bivirkningene av kirurgien, slik som stemmeforandringer, svelgeproblemer, stemmebåndslammelse og hypoparatyreoidisme.
De første alternativene til tradisjonell tyreoidektomi oppstod på 90-tallet i form av videoassistert minimal invasiv kirurgi (10,11). Konseptet minimal invasiv videoassistert tyreoidektomi (MIVAT) innebar at man kunne klare seg med en kort incisjon som ga tilstrekkelig plass for både vanlige håndholdte instrumenter og laparoskopikameraet (12). Det neste tiåret ble det utviklet videoassisterte teknikker, der tilgangen til tyreoidea ble flyttet vekk fra halsen. Inngrepet ble utført med endoskopiske instrumenter gjennom subkutane tuneller til halsen slik at alle arr i huden kunne plasseres på mindre synlige steder, enten fra axille/ bryst, postaurikulært (facelift) eller fra underleppa (13,14). De ulike tilgangene har spesifikke fordeler og ulemper, for eksempel risiko for nerveskader i forbindelse med etablering av tilgangen. Bruk av gass er forlatt til fordel for haker eller tråder som holder huden oppe for å lage plass, da CO2 gir subkutant emfysem og risiko for alvorlige komplikasjoner som gassemboli.
I Norge har robotassistert transaksillær tyreoidektomi (RATT) vært tilbudt ved Universitetssykehuset Tromsø til utvalgte pasienter siden 2022. Siden metoden var ny i Norge, ble det først gjort metodevurdering (minimetodevurdering.no). Opplæringen skjedde i samarbeid med Gabriele Materatzzi fra Pisa, Italia, der de har en av de største europeiske erfaringene med teknikken siden 2012. RATT har hatt en sakte utbredelse fra opprinnelsen i Asia til Europa i løpet av de siste 10-15 årene, men finnes godt etablert i enkelte europeiske land. RATT har gjennomgått en utvikling siden år 2000, der man har forsøkt innføring av instrumenter via en eller begge aksiller, eventuelt med hjelpeporter i areolakanten på brystene (15). På Universitetssykehuset Nord-Norge gjøres nå operasjonen med kun én incisjon i forkant av aksillen. Tilgangen til halsen går gjennom en subkutan tunell, der huden holdes oppe av en spesialtilpasset retraktor. Selve tyreoidektomien utføres med robot-assistert karforsegler og disseksjonsinstrument. Nervemonitorering brukes som ved åpen kirurgi.
Størrelse på tumor er den største begrensningen ved metoden. I erfarne hender kan man operere opp mot 6 cm store tyreoideatumores, men når størrelsen overstiger 4 cm blir det merkbart trange arbeidsforhold. Det er mulig å gjøre lymfeknutedisseksjon med RATT, men det tilbys foreløpig ikke RATT til pasienter med lymfeknutemetastaser ved Universitetssykehuset Nord-Norge. Andre relative kontraindikasjoner kan være tidligere kirurgi i området, tyreoiditt og høy BMI. Oppsummert egner metoden seg for pasienter der kosmetisk resultat betyr mye, som er normalvektige og har en relativt liten tumor.
Studier fra sentra som har stor erfaring viser at risiko for rekurrensparese og hypoparatyreoidisme er sammenlignbar med åpen teknikk, og at alvorlige komplikasjoner forekommer i svært liten grad (16,17). Det finnes enkeltstudier som viser forbedret pasienttilfredshet og stemmekvalitet ved RATT sammenlignet med åpen kirurgi (18,19). Erfaringen med de første cirka 20 RATT i Norge har vist at metoden er mulig å etablere uten at vi hittil har hatt alvorlige hendelser eller uventede komplikasjoner. Pasientene blir utskrevet første postoperative dag som ved vanlig åpen operasjon.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
The intelligent performance of Signia™ with Tri-Staple™ technology provides better staple formation across sizes and delivers distinct advantages compared to the da Vinci SureForm™* robotic stapler.1,†
Test tissue thickness SureForm™* stapler (indicated tissue thickness)
Black (2.30–4.00 mm)
Extra thick
2.80–3.2 2mm
Thick 2.50–2.80 mm
Medium/Thick 1.90 mm
Green (2.00–3.30 mm)
Blue (1.50–2.40 mm)
Signia™ linear stapler with Tri-Staple™ technology (indicated tissue thickness)
Black (2.29–3.00 mm)

Purple (1.50–2.29 mm)

114% greater staple line security across staple sizes1,†
Signia™ with Tri-Staple™ black staple lines can withstand 20% greater leak pressure1,† than SureForm™* black staple lines

Staple formation reference

Optimally formed staple


Undercrimped staple
Functional closure
Signia™ with Tri-Staple™ tan staple lines are 37% less likely to bleed1,†,‡ than SureForm™* white staple lines
Meet clinical challenges with confidence. Visit https://www.medtronic.com/covidien/en-gb/surgical-stapling-innovation.html
Contact your Medtronic representative today to experience the Signia™ stapler with Tri-Staple™ technology.
†When fired in indicated porcine tissue thickness. Preclinical testing may not be indicative of clinical performance.
‡P-value of 0.061, statistical significance seen at 10-minute time point.
1. Based on internal report #RE00498029, Competitive evidence final report — Signia™ with Tri-Staple™ technology vs. Intuitive’s da Vinci robotic stapling system with SureForm™* SmartFire technology.
©2024 Medtronic. Medtronic, Medtronic logo, and Engineering the extraordinary are trademarks of Medtronic.
™* Third-party brands are trademarks of their respective owners. All other brands are trademarks of a Medtronic company. emea-st-2400048-signia-and-tri-staple-vs-sureform-ad--emea-14451623
Når det skal diskuteres bryst-/endokrinkirurgiske akuttsituasjoner, er det vanskelig å skille mellom akuttsituasjoner og bryst-/endokrinkirurgiske komplikasjoner. De fleste tilstandene som krever akuttbehandling er, med noen få unntak, et resultat av kirurgi. Organene som blir behandlet er tradisjonelt sett ikke utsatt for påvirkning av traumer eller medisinske tilstander som krever akutt kirurgisk behandling. Både thyroidea, parathyroidea og binyrer kan utvikle sykdommer som krever rask behandling, men disse behandles som regel primært medisinsk; kirurgi kommer da inn senere som endelig behandling.
ERLING JOHAN SETSÅ 1, VIBEKE HAGAN 2, RENATE VIK 3
1 BRYST OG ENDOKRINKIRURGISK AVDELING, NORDLANDSSYKEHUSET BODØ
2 BRYST OG ENDOKRINKIRURGISK AVDELING, ST. OLAVS HOSPITAL
3 BRYST OG ENDOKRINKIRURGISK AVDELING, HAUKELAND UNIVERSITETSSYKEHUS
KORRESPONDANSE: ERLING JOHAN SETSÅ – ERLING.JOHAN.SETSA @ NLSH.NO
KOMPLIKASJONER ETTER BRYST- OG AKSILLEKIRURGI
Akutt blødning etter brystkreftkirurgi
Den største behandlingskrevende tilstanden i bryst innen faget bryst/-endokrinkirurgi, er brystkreft. Selv om tilstanden krever rask utredning og behandling, er brystkreft ikke en akutt problemstilling. De vanligste akutte tilstander i bryst er komplikasjoner til brystkirurgi. Blødning og hematom etter brystkreftkirurgi, oppstår oftest i perioden fra avsluttet operasjon og de påfølgende 24 timer. Ved en brystkreftoperasjon, gjøres som hovedregel inngrep både i bryst og i aksille. Postoperativ blødning kan oppstå med utgangspunkt i brystet og/eller i aksillen.
1,7 % av norske brystkreftpasienter får blødningskomplikasjon etter kirurgi, dette i henhold til Nasjonalt kvalitetsregister for brystkirurgi, siste utgave i 2023 (1). Internasjonalt rapporteres stor variasjon med hensyn til risiko for postoperativ blødning. UpToDate® angir risikoen for omkring 4 %, hvor 0,5 % av pasientene får behov
for kirurgisk intervensjon. En stor svensk studie fra 2022 med over 57000 inkluderte pasienter, viste innleggelseskrevende postoperativ blødning etter brystkreftkirurgi på 2,24 % (2).
Risikofaktorer
Bruk av blodfortynnende medisin øker risiko for postoperativ blødning. NSAID har ikke vist å gi økt risiko for blødning (3). En annen større svensk studie fra 2023, viste større blødningsrisiko ved mastektomi sammenlignet med brystbevarende kirurgi. Eldre kvinner opereres i større grad med mastektomi, og blir dermed utsatt for større blødningsrisiko etter operasjon (4).
Forskning har ikke påvist forskjell i risiko for blødning på bakgrunn av pasientkarakteristika (alder, vekt eller komorbiditet) og heller ikke endret risiko på bakgrunn av onkologiske faktorer. Derimot peker én studie på viktigheten av opererende kirurgs grundighet og presisjon
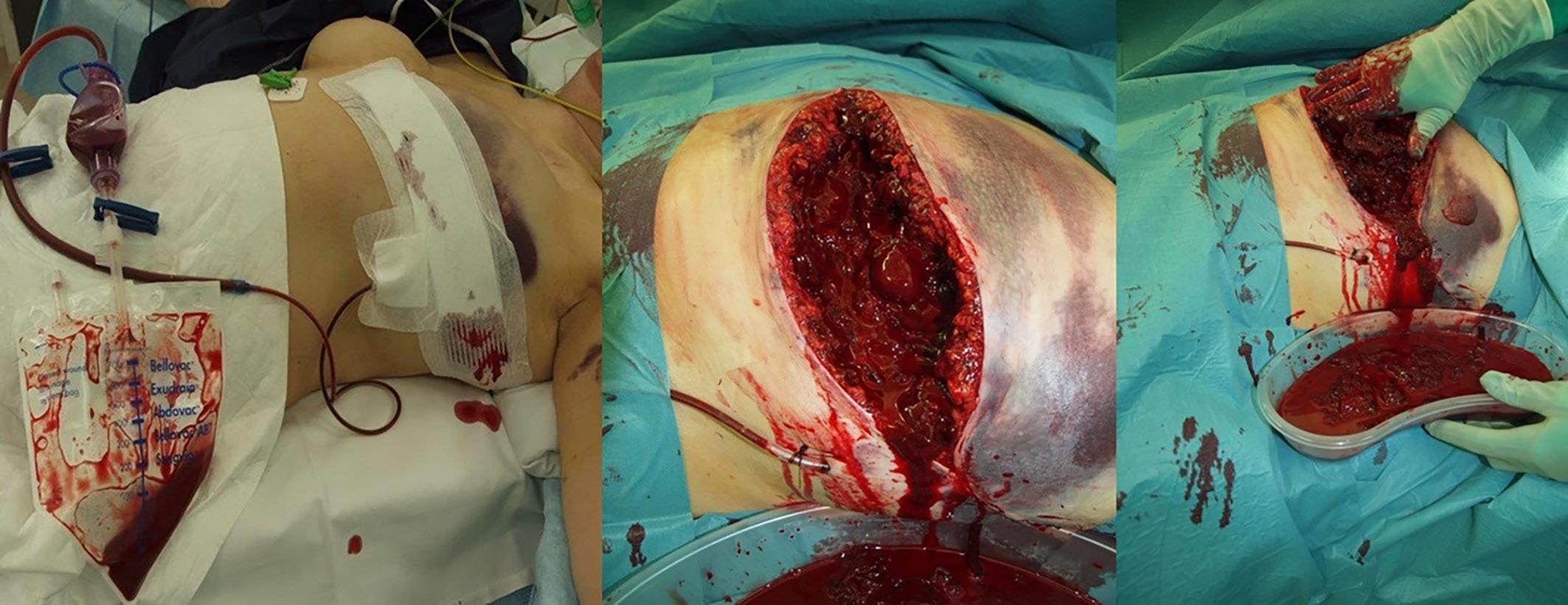
med hemostase og at hemostase utføres under adekvat blodtrykk hos pasienten (5).
Symptomer på hematom etter brystkreftkirurgi er fast hevelse, økende smerter, blålig misfarging av overliggende hud og noen ganger dårlig sirkulert vev i brystet. Vedvarende, blodig produksjon på dren bør også gi mistanke om blødning. Vær oppmerksom på at drenet kan blokkeres av koagler. Fallende drensproduksjon utelukker dermed ikke blødning.
Brystbevarende inngrep
De fleste pasienter som opereres for brystkreft, blir behandlet med brystbevarende inngrep og vaktpostlymfeknutediagnostikk («sentinel node biopsy») (1). Ved postoperativ blødning hos disse pasientene, kan de fleste observeres uten kirurgiske tiltak. Hematomet er ofte selvlimiterende og reabsorberes spontant.
Dersom hematomet medfører sterke smerter og/eller tegn på nekrose av overliggende hud, gir det indikasjon for kirurgisk evakuering.
Pasienter som er operert brystbevarende med onkoplastisk teknikk bør vurderes ekstra nøye med tanke på indikasjon for reoperasjon. Onkoplastiske teknikker medfører forflytning av kjertelvev og ofte hudlapper med kompromittert sirkulasjon. Postoperativt hematom
kan dermed føre til nekrose av hud eller kjertelvev på et tidligere tidspunkt. Når disse pasientene reopereres, bør kirurgen ha viten om hvilken teknikk som ble benyttet ved primærinngrep, dette for å oppnå tilsvarende form på brystet. Noen ganger setter kirurgen klips i sårhulen under primæroperasjon. Plasseringen av klips må kontrolleres ved reoperasjon, siden klipsene brukes til målrettet adjuvant strålebehandling senere.
Etter kirurgiske inngrep for benigne tilstander i bryst og etter reduksjonsplastikker, skal komplikasjoner håndteres på samme vis som for brystkreftpasientene.
Mastektomi
Pasienter som opereres med hudsparende mastektomi og direkte rekonstruksjon med protese, har spesielt sårbar sirkulasjon i hudlappene og bør derfor alltid tilses ved mistanke om hematom. Operatør/plastikkirurg bør konfereres og ofte ivaretas reoperasjonen av ansvarlig kirurg.
Ved blødning etter simpel mastektomi, kan hematomet bli betydelig (Fig 1). Pasienten kan da bli hemodynamisk påvirket og få blødningsanemi. Konservativ tilnærming kan bestå av sirkulær bandasje på thorax ved lite uttalt klinikk og stabile sirkulatoriske forhold.
Hevelse som tilkommer dager/uker etter inngrepet, er

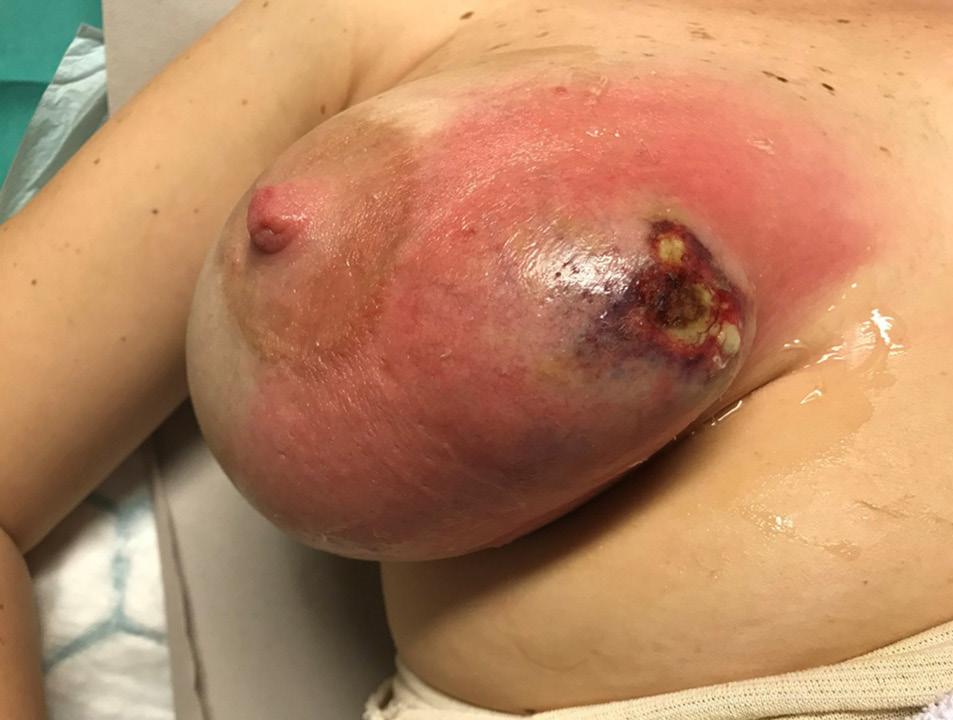
mest sannsynlig et postoperativt serom. Dette håndteres med tapping etter behov. Mistenker man komplikasjon i form av postoperativ blødning, bør pasienten holdes fastende inntil situasjonen er avklart.
Som kliniker kan man støte på langt framskreden og ubehandlet brystkreft. Dette viser seg gjerne som tumorer med store sår i huden, noen ganger med eksofytisk vekst. Det kan oppstå blødning fra tumor, enten spontant eller som følge av traume. Behandling vil avgjøres ut fra hvert enkelt kasus.
Infeksjoner
Infeksjoner etter brystkirurgi er ikke uvanlig. Ved mastektomi og brystbevarende kirurgi angis insidensen til 3-15 % og ved primær rekonstruksjon opp mot 15 % (2). De vanligste agens er grampositive mikrober. Ved primær rekonstruksjon er nekrose på grunn av kompromittert sirkulasjon i hudlapper også en risiko for infeksjon (Fig 2).
Den vanligste formen for brystkreftkirurgi er brystbevarende kirurgi. Dette blir etterfulgt av postoperativ strålebehandling, og eventuelt også adjuvant kjemoterapi eller annen onkologisk behandling. En postoperativ sårinfeksjon vil derfor være uheldig siden det kan forsinke adjuvant kreftbehandling.
Det fleste tilfeller av infeksjon håndteres med kun antibiotika. Ved en abscess må denne dreneres, etterfulgt av antibiotikabehandling (Fig. 3). Ved primær rekonstruksjon med implantat, må man ved infeksjon vurdere å
fjerne implantatet. Dette kan i noen tilfeller unngås, men bør vurderes av kirurg med erfaring i protesekirurgi.
Pasienter som får primær rekonstruksjon settes på antibiotikaprofylakse, dette benyttes gjerne så lenge de har dren.
Faktorer som disponerer for postoperativ infeksjon kan være pasientrelaterte som overvekt, diabetes, røyking, skrøpelighet, ernæringssvikt og immunsvikt (6), reoperasjoner, lang operasjonstid over tre timer, stråleskadet hud, eller forutgående neoadjuvant kjemoterapi i kombinasjon med overnevnte. Neoadjuvant kjemoterapi alene er ikke godt dokumentert som en risikofaktor med tanke på komplikasjoner ved brystkreftkirurgi (7).
Det er likevel ikke etablert praksis å gi antibiotikaprofylakse ved brystkreftkirurgi uten implantat. Det er generelt mangel på retningslinjer innen dette området. Valg av kloksacillin er anbefalt i henhold til metodebok (HDIR) ved postoperativ sårinfeksjon i hud og bløtvev. Ved sepsis eller utvikling av nekrotiserende bløtdelsinfeksjoner, henvises det til egne anbefalinger.
Thyroideakirurgi er forbundet med komplikasjoner av varierende hyppighet og alvorlighetsgrad. De vanligste er ensidig skade på n. recurrens (RLN), hypokalsemi etter total thyroidektomi, samt chylus-lekkasje etter disseksjon av lymfeknuter på hals. Av de mer sjeldne, men desto mer alvorlige, er postoperativ blødning, infeksjon, bilateral skade på RLN og trakeaskade. Komplikasjonene etter
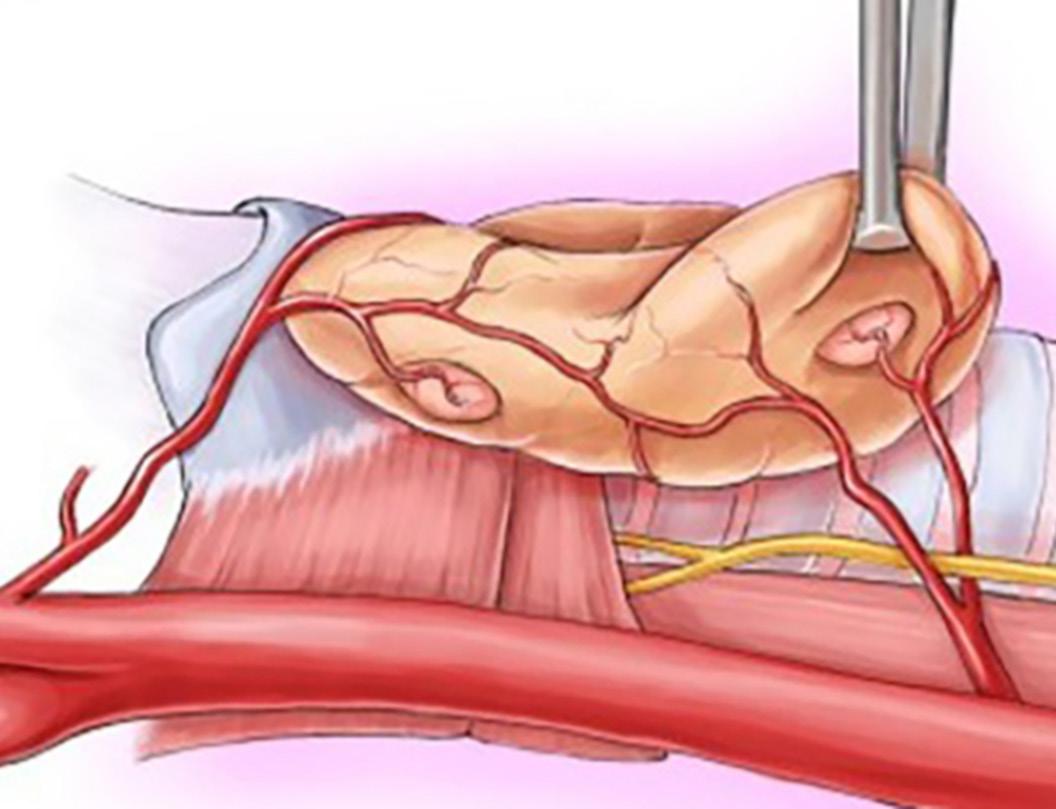
FIGUR 4: Her ser vi en mulig plassering av parathyreoideakjertlene i forhold til thyreoidea.
kirurgi på parathyroidea er stort sett de samme, men noe sjeldnere. De fleste studier er basert på thyroideakirurgi.
Skade på n. laryngeus recurrens
Ensidig nerveskade på RLN er blant de vanligste komplikasjonene etter thyroideakirurgi med en insidens vanligvis rapportert mellom 2-10 % for midlertidig skade og 1-2 % for permanent skade (8, 9). Dette kan gi ubehag i form av hes og svak stemme, samt svelgevansker i enkelte tilfeller. Dette skyldes skade på RLN under kirurgi. Mistenkes det at skaden er permanent, henvises pasienten til logoped og øre-nese-hals-lege for oppfølging. Den rapporterte insidensen av midlertidig dobbeltsidig skade varierer mellom 0,4 og 1,3 % (10, 11), mens permanent skade er angitt i 0,2 til 0,6 % av tilfellene (12). Dobbeltsidig skade er en mulig livstruende situasjon siden «hvileposisjonen» til et stemmebånd uten nerveinnervasjon legger seg paramediant, og dermed kan blokkere luftveiene hvis begge stemmebånd er affisert.
Dobbelsidig nerveskade vil gi afoni og potensielt ufri luftvei med kraftig stridor. Ved bruk av intraoperativ nervemonitorering (IONM) vil man i de fleste tilfeller være klar over muligheten for bilateral skade, og klargjøre for tiltak før ekstubering. Dette vil ofte kunne dreie seg om beredskap for trakeotomi. I en gjennomgang fra 2024 fant man at dette var nødvendig i ca. 36 % av tilfellene med bilateral skade på RLN (12).
Hypokalsemi
På grunn av thyroideas nærhet til parathyroidakjertlene, er de i fare for skade under thyroideakirurgi (Fig 4). Etter
Tabell 1. Risikofaktorer for hypokalsemi etter thyreoideakirurgi
Bilaterale (simultaneous or sequential) thyroideaprosedyrer
Autoimmun thyroideasykdom (Graves’ disease, kronisk thyroiditt)
Sentral halsdisseksjon — profylaktisk eller terapautisk
Substernalt struma
Lav-volum thyroideakirurg
Tidligere gastric bypass-kirurgi, eller annen malabsorbsjonstilstand
Samtidig thyroidektomi and parathyroidektomi
Tidligere sentral halskirurgi
bilateral operasjon kan man oppleve en periode med lav funksjon av parathyroideakjertlene med påfølgende raskt innsettende hypokalsemi. Etter total thyroidektomi, enten som primæroperasjon eller der man gjør en kompletterende fjerning av resterende thyroidea, følger man derfor PTH og kalsium postoperativt nøye. Midlertidig hypokalsemi er rapportert mellom 8-20 % (13, 14) og permanent mellom 10-20 % (14, 15), varierende etter etiologi. Symptomer på hypokalsemi kan variere fra prikking rundt munn og fingre ved lett hypokalsemi, til generaliserte krampeanfall med hjertestans ved meget alvorlig hypokalsemi. Risikofaktorer for hypokalsemi ses i Tabell 1. Det er viktig å ha kjennskap til denne komplikasjonen dersom man håndterer endokrinkirurgiske pasienter. Behandlingen er enkel, da pasienten skal ha tilført kalsium. Dette gis oftest i tablettform, eventuelt i kombinasjon med D-vitamin. I alvorlige tilfeller gis kalsiumtilskudd intravenøst. Ved mistanke om postoperativ hypokalsemi, skal man ha lav terskel for å gi kalsium per os, da det har hurtig effekt. Mistanke om hypokalsemi bekreftes ved blodprøve, men man bør ikke vente på lab-prøver ved symptomer før man iverksetter behandling.
Det skal nevnes at i Danmark fikk Reinke et al. en kraftig bedring i sine resultater når de overførte sine totale thyroidektomier fra kirurger som kun opererte thyroidea og ikke parathyroidea, til kirurger som utførte begge typer kirurgi. For eksempel falt da raten av postoperativ hypokalsemi fra 30 % til nærmere 10 % for pasienter operert for thyroideakreft (16). Dette viser den nære relasjonen mellom disse endokrine organene.
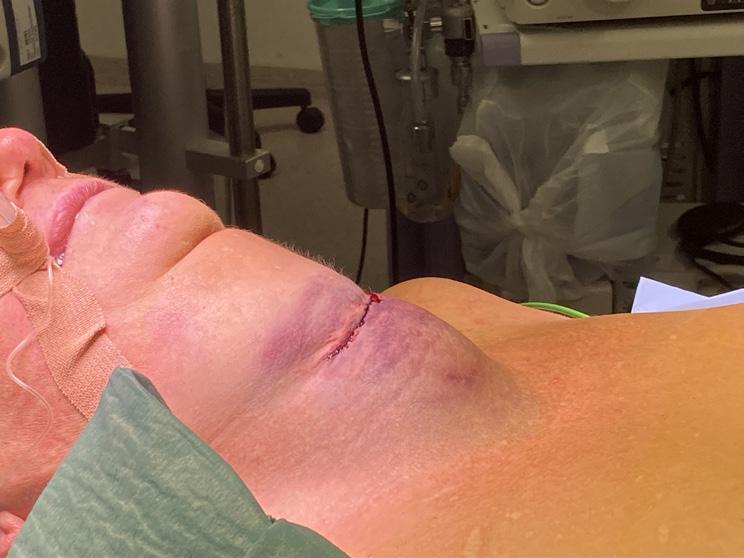

Postoperativ blødning
Dette er en sjelden, men dramatisk komplikasjon. Her ligger ratene mellom 0,3-2 % (17-19). De fleste blødninger skjer i løpet av det første postoperative døgn. Lorenz et al. rapporterte rundt 84 % av tilfeller i løpet av de første 24 timer, mens Lee et al. fant at 58 % postoperative blødninger i samme tidsrom. Totalrisikoen for postoperativ blødning første postoperative døgn ligger altså på rundt 0,2 %, altså en meget sjelden hendelse.
Det er fortsatt en alvorlig komplikasjon, selv om disse pasientene ikke forblør.. Risikoen ved postoperativ blødning er blant annet det direkte trykket mot trakea, noe som kan gi pustevansker og kraftig ubehag for pasienten. Her kan man bli fristet til å lette på trykket ved å åpne snittet og evakuere eventuelle hematom før endelig kirurgi. Dette er sjelden nødvendig, men i distrikt, ved manglende mulighet for intubasjon eller overvåkning, kan dette forsøkes. Den alvorligste effekten av postoperative blødninger er dog det påfølgende laryngeale ødemet som kan oppstå. Trykk fra hematomet på små vener og lymfekar kan gi en gradvis økende hevelse i de øvre luftveiene. Dette kan gi uttalte pustevansker, og i tillegg gjøre intubasjon meget vanskelig. Behandlende leger må være klar over denne tilstanden, da man ved evakuering av et postoperativt hematom kan tro faren er over, og så forsinke intubasjon/sikring av luftveiene. Intubasjon er den aller viktigste behandlingen ved postoperativ blødning (Fig 6).
Det er viktig å huske på at hvis man skulle oppleve et laryngealt ødem etter thyreoideakirurgi, er trakea lett tilgjengelig via operasjonssnittet og anleggelse av nødtrakeotomi et relativt enkelt inngrep.
Infeksjoner etter thyroideakirurgi
Ved åpen thyroideakirurgi via Kochers kragesnitt benyttes ikke profylaktisk antibiotika, da pasientene sjelden utvikler infeksjoner. Raten ligger på mellom 0,3-0,9 % (20, 21). Stapylococcus aureus er den vanligste bakterien, og empirisk behandling med peroral antibiotika er standard. Ved abscessformasjon kan noen pasienter behøve drenasje, og en CT eller ultralyd kan hjelpe med å kartlegge utbredelsen.
Ved utvikling av mer alvorlige infeksjonstegn som høy feber, smerter og tegn på sepsis, må man vurdere andre agens som årsak til infeksjon. Spesielt gruppe A-Streptokokker (GAS) kan utvikle seg til cellulitt og nekrotiserende fasciitt. Her vil infeksjonen kunne true vitale strukturer som store kar, trakea og øsofagus. Tidlig kirurgisk intervensjon og bytte av antibiotika vil være nødvendig.
Postoperativ trakeaskade
Ved peroperativ erkjent skade på trakea skal dette håndteres umiddelbart. En ikke-erkjent skade er alvorlig og kan potensielt være livstruende.
Trakealskade gir stor risiko for infeksjon, spesielt ved økt intraluminalt trykk, som for eksempel hvis pasienten hoster. Ikke-erkjente peroperative skader og forsinket perforasjon grunnet nekrose, kan oppstå også en tid etter kirurgi. Symptomer på perforasjon er emfysem, både subkutant og i mediastinum, noen ganger i uttalt grad. Videre kan det utvikles mediastinitt. Retningslinjer for behandling foreligger ikke per i dag, men bør involvere øre-nese-hals-spesialist med spesialkompetanse på luftveier, og behandlingen bør foregå på universitetssykehus. Det er avgjørende at tilstanden diagnostiseres tidligst mulig (Fig. 7).
SPONTANE BINYREBLØDNINGER
Spontane blødninger i binyre er sjeldent og behandlingen er ikke standardisert (22). Det foreligger begrenset litteratur og flest kasusrapporter (22, 23).
Situasjonen kan kreve akutt behandling og være livstruende (22-25). Ved tegn til blodtrykksfall startes stabilisering av pasienten med intravenøs væske. Videre behandlingsvalg kan være observasjon eller intervensjon med embolisering. Eksempel på CT-funn ses i Figur 8. Akuttkirurgi bør unngås, og biokjemisk utredning før eventuell kirurgi anbefales. Dette for å unngå operasjon på et ikke- diagnostisert feokromocytom.
Symptomene er akutte flankesmerter, og hemorragisk sjokk kan forekomme. Ved blødning fra binyren bør feokromocytom vurderes som en mulig årsak. Når neoplasme står bak, er feokromocytom den vanligste diagnosen og forekommer i 50 % av tilfellene (22,23). Blodtrykksfall kan være forårsaket av selve blødningen, men også av frigjøring av katekolaminer. Et slikt katekolaminutslipp
kan føre til myokardialt stress og svikt i hjertets funksjon, med påfølgende kardiogent sjokk.
Risikofaktorer for spontane blødninger i binyre kan være traume, sepsis, bruk av antikoagulantia, graviditet og binyretumorer. Tilstanden kan også oppstå i etterkant av abdominal kirurgi.
Ved retrospektive journalgjennomganger har man sett pseudoaneurisme i flere tilfeller. Ved pågående blødning kan embolisering være livreddende.
Binyren har vanligvis tre arterier, arteria suprarenalis, arteria media og arteria phrenicus inferior. Karforsyning fra aorta eller dens grener kan føre til kraftig blødning. Disse arteriene kan visualiseres på angiografi hos 5792 % (24).
Et hematom i binyren kan føre til binyrebarksvikt. Ved akutt adrenalektomi skal det foreligge høy anestesiologisk beredskap intraoperativt, grunnet risikoen for katekolaminkrise, som i verste fall kan ende med peroperativ død.
Det er ikke alle som etter spontan blødning i binyre trenger kirurgi senere. En CT-kontroll etter ca. tre måneder benyttes som rutine ved Haukeland universitetssykehus. Ved elektiv kirurgi for feokromocytom benyttes alfablokkade som forbehandling i ca. 14 dager.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
Epistaksis, eller neseblødning, er en hyppig forekommende tilstand i øre-nese-hals-faget og utgjør en betydelig andel av akutte øre-nese-hals-henvisninger (1). Det kan variere fra milde, selvbegrensende episoder til livstruende blødninger (2). Tilstanden deles inn i fremre blødninger, som utgjør omtrent 90 % av tilfellene, og bakre blødninger, som er mer sjeldne og ofte mer alvorlige (3). Mens fremre blødninger vanligvis har sitt utspring i locus Kiesselbachi, en anastomose lokalisert anteroinferiort på septum nasi, oppstår bakre blødninger ofte fra arteria sphenopalatina (4). Etiologien kan være multifaktoriell, og i de fleste tilfeller kan ingen umiddelbar årsak påvises. Lokale faktorer som traume, slimhinnetørrhet og infeksjon er vanlige årsaker, mens systemiske faktorer som hypertensjon, hematologisk sykdom, koagulopati og bruk av antitrombotisk medikament må også vurderes (Tabell 1) (5).
INGRID CECILIE OFSTAD RAKNES 1*, DAVID HUI 2*
1 ØRE - NESE - HALS - AVDELINGEN, HAUGESUND SJUKEHUS.
2 ØRE - NESE - HALS - AVDELINGEN OG SEKSJON FOR TRANSPLANTASJONSKIRURGI, RIKSHOSPITALET, OSLO UNIVERSITETSSYKEHUS OG UNIVERSITETET I OSLO.
KORRESPONDANSE: INGRID CECILIE OFSTAD RAKNES - INGRIDCECILIE_RAKNES @ HOTMAIL.COM
*Delt førsteforfattere
Epistaksis rammer opptil 60 % av befolkningen i løpet av livet, men kun 6–10 % av tilfellene krever medisinsk intervensjon (6). Tørre klimatiske forhold, spesielt i vinterhalvåret, disponerer for slimhinneskader (7). Andre predisponerende faktorer kan være hypertensjon, økt venetrykk, antitrombotisk behandling med platehemmer og antikoagulantia, alkohol, leversvikt og uremi (8). Pasienter på Warfarin eller antikoagulantia har en betydelig økt risiko for alvorlig neseblødning og residiv (9).
Blodforsyningen til neseslimhinnen kommer fra arteria carotis interna og arteria carotis externa. Locus Kiesselbachi er den vanligste blødningskilden ved fremre epistaksis. Dette området, lokalisert anteroinferiort på septum nasi, forsynes av et rikt anastomosenettverk
Lokale faktorer til epistaksis
bestående av arteria sphenopalatina, arteria ethmoidalis anterior, arteria labialis superior og arteria palatina major (Figur 1) (5). Den høye vaskulariseringen gjør det særlig utsatt for blødning ved mekanisk irritasjon. Arteria sphenopalatina er oftest affisert ved bakre blødning, som kan være kraftigere og vanskeligere å kontrollere, spesielt hos en eldre pasient med hypertensjon (10).
Anamnesen bør kartlegge blødningsvarighet, tidligere episoder, komorbiditeter og medikamentbruk. Den kliniske undersøkelsen bør inkludere rensing av nesen for blod og koagler, enten ved at pasienten snyter seg eller med sug. Koagler kan maskere blødningsstedet og gi inntrykk av pågående siving. Deretter avsvelles neseslimhinnen med et gasbind dynket i Tetrakain med adrenalin
Systemiske faktorer til epistaksis
Traume Hypertensjon
Slimhinnetørrhet
Hematologisk sykdom
Infeksjon Koagulopati
Bruk av antitrombotisk medikament
TABELL 1: Faktorer til epistaksis
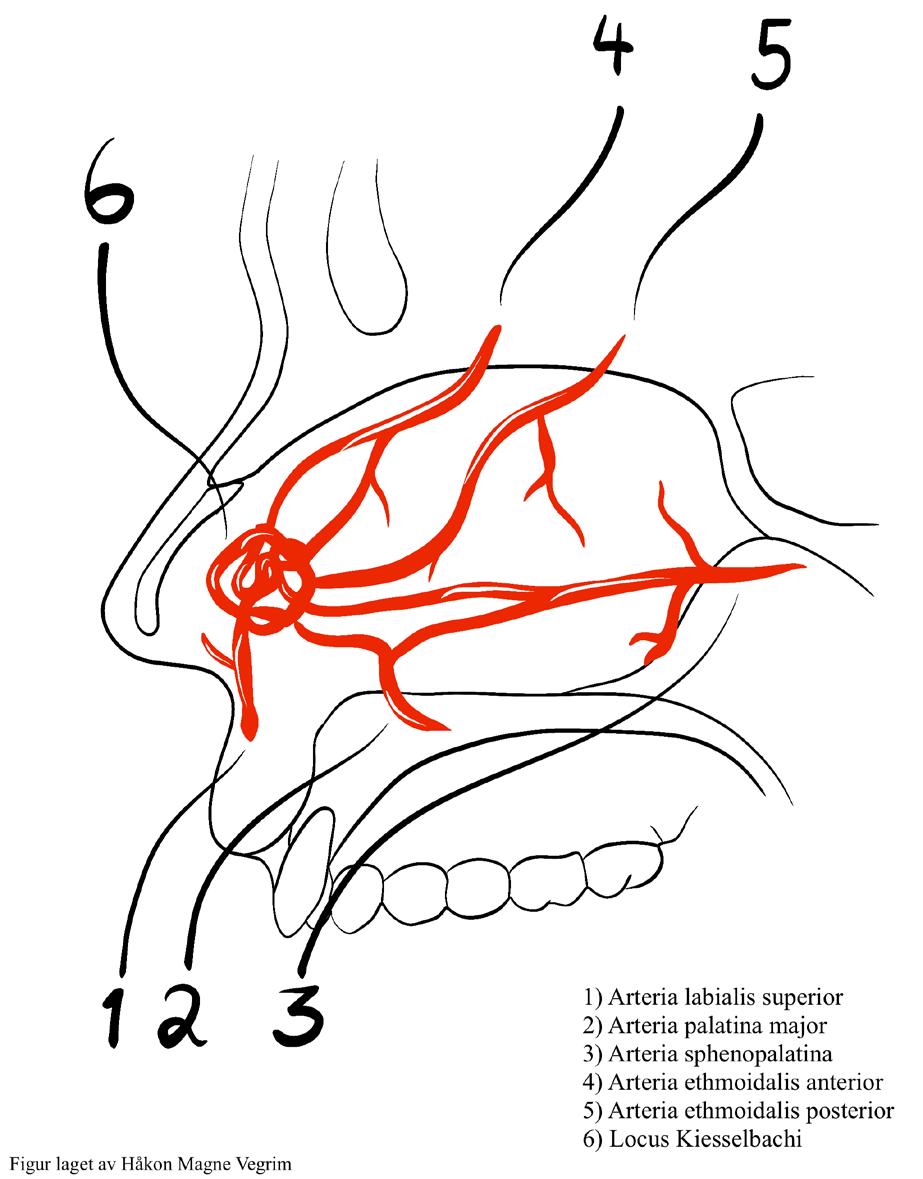
FIGUR 1: Blodforsyning av nesen inkludert locus Kiesselbachi.
for lokalanestesi og vasokonstriksjon. Fremre rhinoskopi utføres for å lokalisere blødningsfokus. Nasal endoskopi gir bedret innsyn og kan bidra til å redusere behovet for innleggelse. Det er også viktig å inspisere munn og svelg for å vurdere eventuell bakre blødning.
Dersom et blødende kar identifiseres i locus Kiesselbachi, kan kjemisk etsing med sølvnitrat benyttes. Diatermi er ofte den foretrukne metoden, særlig i akuttfasen der man skaper en sluttet strømkrets i slimhinne og omkringliggende vev. Tamponader finnes i flere utgaver med felles formål å hindre reblødning ved å utøve trykk mot septum nasi og neseveggen. Ofte brukes lagvis pakket gasbind tilsatt Terra-Cortril-salve som fremre tamponade. Denne er vanlig å ha liggende i en til to dager før tamponaden fjernes. Prehospitalt brukes ofte Rapid Rhino for midlertidig blødningskontroll. Dette er en oppblåsbar ballong og gir rask kompresjon. Langvarig bruk av ballongkateter øker risikoen for slimhinneskader og nekrose, og det er viktig å begrense bruken til kortvarig stabilisering.
Ved bakre epistaksis kreves det ofte mer invasive tiltak, der bakre tamponade kan være nødvendig, i tillegg til at det ofte fører til innleggelse ved øre-nese-hals-avdeling for videre observasjon og behandling. Bakre tamponade oppnås ved å føre et Foley-kateter eller et spesialisert ballongkateter inn i nesen til orofarynks, fylle ballongen med 5–10 ml vann og trekke det tilbake til nasofarynks for å komprimere choana. Kombinasjon med fremre tamponade anbefales for optimal effekt. Antibiotikaprofylakse med Penicillin kan være aktuelt for å forebygge infeksjoner ved bakre tamponering i mer enn to døgn.
Ved vurdering av pasienter med epistaksis bør det gjennomføres en strukturert utredning som inkluderer både lokal og systemisk årsak. I den akutte situasjonen vurderes sirkulasjonsstatus med blodtrykk, puls og kliniske tegn til hypovolemi. Laboratorieprøver som hemoglobin, hematokrit, trombocyttall, INR og APTT er sentrale for å avdekke koagulopati eller pågående anemi, særlig ved større eller residiverende blødninger. Tilleggsprøver
som leverfunksjonstester og kreatinin bør vurderes ved klinisk mistanke, da leversvikt og nyresykdom kan disponere for forlenget blødningstid.
Ved ensidig neseblødning hos eldre pasienter, særlig ved ledsagende nesetetthet eller vedvarende sporblødning, bør det foreligge lav terskel for billeddiagnostisk utredning. Ved klinisk mistanke om økt risiko for malignitet anbefales MR bihuler. Endoskopisk vurdering av nesehulen gir god visualisering av blødningskilder og er særlig nyttig ved høytsittende blødning eller manglende effekt av fremre tamponade. Ved mistanke om hereditær hemorragisk telangiektasi, Morbus Osler, bør pasienten undersøkes for mukokutane telangiektasier og henvises for videre genetisk vurdering.
Epistaksis kan føre til hypovolemisk sjokk og blødningsanemi ved store eller gjentatte blodtap, spesielt hos eldre og pasienter med hjerte- og karsykdom (11). Særlig bakre nesetamponader øker risikoen for infeksjoner som sinusitt (12). Langvarig tamponade kan gi slimhinneskade, septumperforasjon og i sjeldne tilfeller obstruktiv søvnapné (13). Kirurgisk behandling, inkludert embolisering, har høy suksessrate, men kan føre til mukosainfarkt eller utilsiktet karokklusjon (14). Balansert behandling og skånsomme metoder er avgjørende for å minimere komplikasjoner.
Ved behandlingsresistent epistaksis kan kirurgiske tiltak vurderes. Dette gjelder i stor grad bakre blødninger. Endoskopisk ligering av arteria sphenopalatina har blitt den foretrukne metoden for kirurgisk kontroll av bakre epistaksis og bør være førstevalg ved behov for kirurgi. Metoden er minimalt invasiv, gir rask effekt og er assosiert med høy suksessrate, ofte rapportert til over 90 % i litteraturen (15). Tilgangen skjer via transnasal endoskopisk teknikk. Etter bruk av adrenalinholdig lokalbedøvelse for å oppnå vasokonstriksjon løftes mukosa i meatus nasi posterior, og crista ethmoidalis identifiseres som et anatomisk landemerke. Foramen sphenopalatinum, gjennom hvilket arteria sphenopalatina og dens grener passerer, lokaliseres inferiort og posteriort for cristaen. Ved hjelp av subperiostal disseksjon eksponeres arterien, og crista ethmoidalis fjernes ofte for bedre tilgang. Hemostase oppnås vanligvis ved klipping med hemoklips, ofte i kombinasjon med bipolar diatermi for å redusere risiko for residivblødning. Anatomiske variasjoner i forgreningsmønster og antall foramina må kartlegges intraoperativt for å sikre komplett ligering, da ufull-
stendig avbrudd av blodtilførselen er vanligste årsak til behandlingssvikt (16).
Ved mistanke om blødning fra arteria ethmoidalis anterior eller posterior, slik som ved ansikts- eller orbitatraumer, neoplasmer eller høytsittende septalblødning, kan kirurgisk ligering være nødvendig. Arteria ethmoidalis anterior kan nås endoskopisk etter gjennomført etmoidektomi og identifiseres i nivå med den frontoethmoidale suturlinjen i orbitataket, hvor den krysser gjennom en benet kanal. Ligering skjer med bipolar koagulasjon eller klips, og forsiktighet må utvises for å unngå skade på n. opticus og periorbita (17). Som alternativ til endoskopisk tilgang kan også ekstern tilgang vurderes ved kirurgisk behandling av blødning fra arteria ethmoidalis anterior, særlig når endonasal eksponering er vanskelig eller anatomisk utilgjengelig. Den tradisjonelle eksterne tilgangen skjer via et snitt i hudfolden i det øvre øyelokket, kjent som Lynch-incisjon, og gir god eksponering av orbitakanten og den frontoethmoidale suturlinjen hvor arterien krysser orbitataket. Selv om inngrepet teknisk sett er mer krevende, gir korrekt utført kirurgi på både arteria sphenopalatina og ethmoidalarteriene høy suksessrate og lav morbiditet, og bør være standard ved refraktær epistaksis hos selekterte pasienter.
Som et alternativ tilbyr den transkarunkulære tilgangen en minimalt invasiv metode uten ytre arrdannelse. Denne teknikken gir direkte tilgang til arteria ethmoidalis anterior gjennom en konjunktival incisjon mellom karunkel og plica semilunaris, og har vist seg effektiv i håndteringen av refraktær epistaksis med lav komplikasjonsrate (18). Videre kan denne tilgangen kombineres med endoskopisk transorbital tilgang for bedre visualisering av orbita apex ved behov.
Oppsummert er epistaksis en vanlig tilstand som krever en systematisk tilnærming for effektiv håndtering. Tidlig identifisering av blødningskilde og etiologi er essensielt for å kunne velge riktig behandlingsstrategi. Ved kompliserte eller vedvarende tilfeller bør spesialiserte tiltak vurderes for å sikre optimal pasientbehandling. Økende bruk av endoskopisk evaluering og forbedrede tamponadealternativer kan potensielt gi bedre pasientutfall og redusere behovet for kirurgisk intervensjon.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
36 M
NYHET! Kan oppbevares i romtemperatur, 2-30 °C1
NYHET! Utvidet holdbarhet til 36 månader1
NYHET! Mindre produktpakking
Forsegler vev, stopper og forebygger lekkasjer
Rask og effektiv hemostase innen 2 minutter
Trygg og effektiv forseglingshemostat
Klar til bruk – forberedelse er ikke nødvendig
Resorberes og erstattes av vertsvev
Hemopatch leveres i følgende 3 størrelser:
Størrelse Produktkod Antall
27 x 27 mm 1506257RT 5 enheter
45 x 45 mm 1506256RT 3 enheter
45 x 90 mm 1506253RT 3 enheter


Kontakt oss for mer informasjon
En mann i 80-årene utviklet hevelse og væskende sår på håndryggen etter å ha blitt stukket av en fjesing. Fjesingens ryggpigger inneholder toksiner. Stikkstedet utviklet seg til å bli et nekrotisk sår med behov for kirurgisk revisjon. Ekstensorsener ble blottlagte og vevsdefekten ble dekket med en «arbeidshest» innen rekonstruktiv plastikkirurgi; en revers radialis-lapp.
SARA NAMEK, TONE MYRLAND SEKSJON FOR PLASTIKK- OG HÅNDKIRURGI, SYKEHUSET TELEMARK HF KORRESPONDANSE: SARA NAMEK – SARNAM @ STHF.NO
En mann i 80-årene ble innlagt på medisinsk avdeling på lokalsykehuset med mistanke om cellulitt i høyre hånd. Han brukte medisiner mot atrieflimmer og hypertensjon, og var ellers frisk og sprek. Tre dager før innleggelse var han på fisketur ved sjøen og fikk en fjesing på kroken. Da han skulle håndtere fisken, ble han stukket av ryggtaggene til fisken på høyre håndrygg. I løpet av tre dager utviklet det seg hevelse i området rundt stikkstedet og et lite sår som væsket serøst.
Ved innleggelsen hadde han feber med temperatur 39,1 °C, ellers god allmenntilstand. Blodtrykket var 146/89 mmHg, puls 87/min, respirasjonsfrekvens 20/min og oksygenmetning 96 %. Han hadde ingen hvilesmerter i hånden. Det var tydelig hevelse og varme, og han var øm ved palpasjon over høyre håndrygg. Nevrovaskulær status i fingrene var normal. Biokjemi ved innkomst viste forhøyde leukocytter 16 × 109/L (referanseområde 4,1–9,8 × 109/L) og CRP 14 mg/l (referanseområde <5). Det ble sikret mikrobiologisk prøve av sårsekret og blodkultur. Tilstanden ble tolket som bløtvevsinfeksjon i form av cellulitt, og det ble startet intravenøs antibiotika-behandling med Kloksacillin 2 g x 4. Dagen etter ble det beskrevet hevelse, varme og rødme i huden opp til albuenivå. Leukocyttene hadde steget til 21,6 x 109/L og CRP til 74
mg/l. Såret væsket mye og ble skiftet på flere ganger daglig. Han fikk tilsyn av ortoped. Det ble ikke funnet indikasjon for kirurgisk intervensjon.
Blodkultur var negativ. Undersøkelse av sårprøven viste rikelig oppvekst av Staphyloccus aureus, følsom for Kloksacillin. Pasienten ble utskrevet dagen etter innleggelse med peroral antibiotikakur i 10 dager og videre oppfølging hos fastlegen. På grunn av klinisk forverring med økende hevelse og rødme startet fastlegen ny behandling med Dalacin 300 mg x 4 etter at forrige antibiotikakur var avsluttet.
18 dager etter stikket ble pasienten igjen akutt innlagt på lokalsykehuset, denne gangen på kirurgisk avdeling. Han hadde utviklet nekrose i huden over høyre hånd med blottlagt ekstensorsene til andre finger. Allmenntilstanden var god med normale vitalia og han var afebril. Leukocytter var lett forhøyet 11,7 × 109/L og CRP 7,4 mg/l.
Håndkirurg ved universitetssykehus ble konsultert og anbefalte revisjon av såret med fjerning av alt ikke-vitalt vev (bilde 1). Etter blodkultur og vevsbiopsi var sikret ble det startet intravenøs antibiotika-behandling med Kloksacillin 2 g x 4. Det ble gjort flere sårrevisjoner på opera-
sjonsstue. Begge ekstensorsenene til andre finger (Extensor Digitorum Communis og Extensor Indicis Proprius) ble fjernet på grunn av nekrose. Såret ble dekket med vakuum-pumpe mellom revisjonene.
Dyrkning av vevsprøver tatt ved første sårrevisjon viste oppvekst av Haemophilus parainfluenzae, Neisseria elongata, Staphyloccous aureus, Aggregatibacter aphrophilus og anaerob blandingsflora. Etter resistensbestemmelse og konferering med infeksjonsmedisiner, ble antibiotika byttet til Ampicillin 2 g x 4 og Klindamycin 600 mg x 4.
Ca. seks uker etter skadetidspunktet ble pasienten overflyttet til Seksjon for plastikk- og håndkirurgi ved Sykehuset Telemark med tanke på dekning av såret. Det forelå en huddefekt på 11x 6 cm med eksponert, men vital ekstensorsene til tredje finger (bilde 2). Han hadde ingen infeksjonstegn og ved siste sårrevisjon var det tatt to vevsbiopsier uten oppvekst av bakterier.
Allens test viste adekvat arteriell sirkulasjon av hånden via arteria ulnaris, og vi besluttet å dekke såret med en revers radialis-lapp (bilde 3). Donorstedet var for stort til å kunne lukkes primært og ble dekket med delhudstransplantat fra låret. Operasjonen og det postoperative forløpet var ukomplisert, og han ble utskrevet syv dager etter operasjonen (bilde 4).
DISKUSJON
Fjesing (Trachinus draco) er en bunnfisk som finnes langs kysten fra Trondheimsfjorden til Middelhavet og Nord-Afrika (bilde 5) (1). Fiskens ryggpigger inneholder toksiner og kan være svært smertefulle å stikke seg på. Intens smerte i og rundt stikkstedet er vanlig, samt hevelse, rødme og nedsatt bevegelighet. Svimmelhet, kvalme, magesmerter og oppkast forekommer (2). Død på grunn av respirasjonssvikt er rapportert ved én pasientkasuistikk (3). Smertene går vanligvis over innen 24 timer, men lokale symptomer kan sees i dager til uker etter stikk (2).
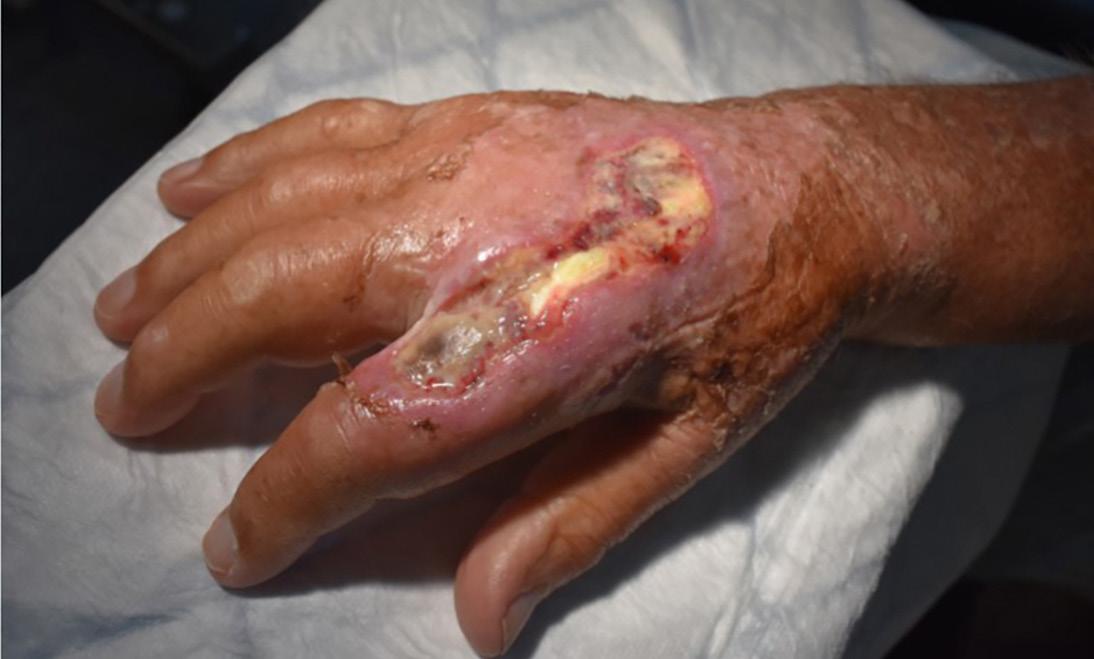
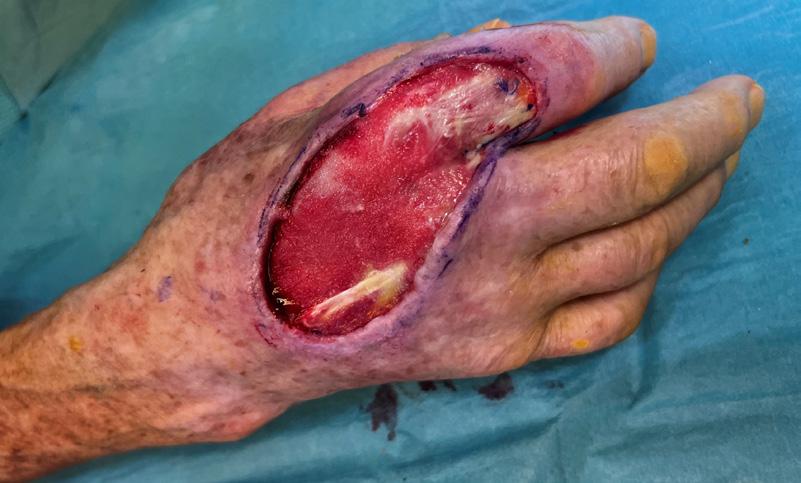
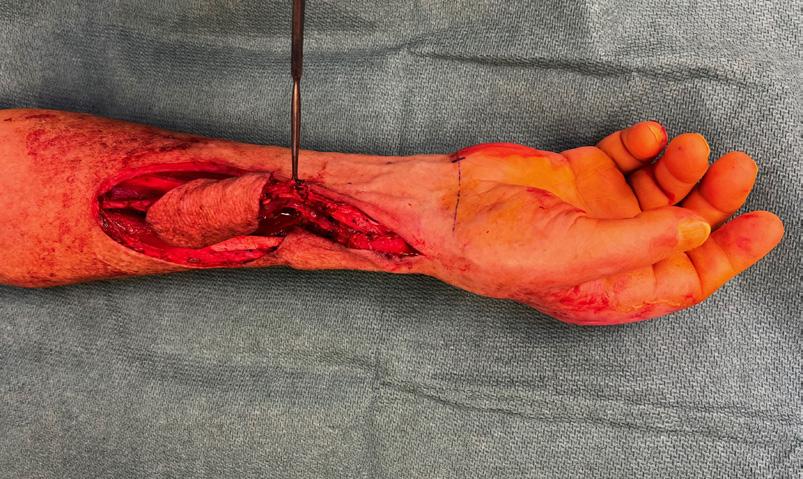


Toksinene inaktiveres og spaltes av varme, hvilket gir mulighet for effektiv behandling. Anbefalingen er å fjerne synlige pigger og fiskehud, og rask nedsenking av det affiserte området i så varmt vann som mulig (40-45 °C). Man bør sjekke temperaturen først med frisk kroppsdel for å unngå skoldeskade. Behandlingen kan fortsette inntil smerten har gitt seg, ofte innen 30-45 minutter (2). Toksinene og eventuell sekundær infeksjon kan gi variabel grad av hudnekrose (4). Stivkrampevaksine kan vurderes og ved langvarige symptomer må man vurdere sekundærinfeksjon og antibiotikabehandling (2).
I norske farvann er fjesing den mest giftige fisken, mens pigghå og havmus har en mildere gift. Fjesing er en bunnfisk som om dagen ligger nedgravd i sanden og om natten jager langs bunnen (2). Stikk oppstår typisk ved håndtering under fiske eller ved bading.
Stilket eller fri radialis-lapp er en “arbeidshest» innen rekonstruktiv plastikkirurgi. Lappen er sirkulert av arteria radialis, og som stilket lapp kan den perfunderes distalt eller proksimalt. Med sirkulasjon fra proksimale del av arterien, kan lappen dekke huddefekter over albueregionen. Sirkulert fra distalt, det vil si retrograd eller reverst gjennom anastomoser med arteria ulnaris, kan en radialis-lapp dekke nesten alle sår på hånden. Lappen er fasciokutan, men kan også høstes med bein, muskel og sene. Som fri lapp er den hyppig brukt i rekonstruksjoner i hode-hals-området. Lappen er lett å forme, tynn og re-
lativt enkel å høste. En ulempe er at man må ofre arteria radialis, samt at donorstedet på volare underarm ofte må dekkes med hudtransplantat eller primærsutureres meget stramt. Det er obligatorisk å utføre Allens test før operasjon for å sikre at hånden postoperativt er adekvat sirkulert gjennom arteria ulnaris (5).
Vår erfaring med stikk fra fjesing har før dette vært begrenset til pasienter med mer overfladiske skader og med mindre omfang. Denne kasuistikken viser hvor potent fjesing-toksinet er dersom ikke førstehjelp med varmt vann blir utført. Legevakter og sykehus med kystnær lokasjon bør være klare over skadeomfanget som kan oppstå, og kunne anbefale riktig førstehjelp. Dersom en sårrevisjon fører til blottlagte vitale strukturer og/ eller en vevsdefekt som ikke lar seg lukke primært, bør plastikkirurg involveres tidlig i forløpet.
Pasienten og hans nærmeste pårørende har samtykket til at artikkelen blir publisert, samt bruk av bilder. Lokalsykehuset hvor pasienten ble innlagt først er informert om publiseringen.
REFERANSER : Se bakerst i nettutgaven på kirurgen.no
I 2024 etablerte undertegnede, sammen med Odd Mjåland og Hans Gunnar Botnen, non-profit organisasjonen «Norwegian International Hernia Team (NIHT)» (figur 1). Formålet er å etablere samarbeid med lokale sykehus i lav- og mellominntektsland for å drive produksjon og lokalutdanning i brokkirurgi. Teamet har utviklet en standardisert modell for opplæring i lyskebrokkirurgi, hvor høyt volum kombineres med opplæring av lokale leger. I november 2024 fikk jeg, med støtte fra Malthes Legat, anledning til å reise til et kommunalt sykehus i Berekum, Ghana, for å organisere et ukeskurs i lyskebrokkirurgi.
ROBBERT- JAN LINDEMAN
GASTROKIRURGISK AVDELING, STAVANGER UNIVERSITETSSJUKEHUS
KORREPONDANSE: RJSLINDEMAN @ OUTLOOK.COM
Ghana har ca. 34 millioner innebyggere og ligger mellom Elfebenskysten (øst) og Togo (vest) i Vest-Afrika. Landet har nylig oppnådd status som mellominntektsland, etter betydelig økonomisk vekst de siste tiårene, hovedsakelig drevet av olje-, kakao- og gullindustrien. Til tross for dette har Ghana fortsatt betydelige utfordringer knyttet

til fattigdom og manglende infrastruktur i helsevesenet. Den kirurgiske kapasiteten og kirurgisk opplæring er utilstrekkelig, noe som resulterer i lange ventetider for pasienter. Dette har ført til at mange pasienter med lyskebrokk forblir ubehandlet; om lag to tredjedeler av pasientene presenteres med skrotale brokk, og de fleste operasjonene utføres som øyeblikkelig hjelp (figur 2).
Holy Family Hospital Berekum er et kommunalt sykehus med 240 senger og dekker et nedslagsfelt på omtrent 120 000 innbyggere. Sykehuset tilbyr kirurgiske tjenester innen traume, ortopedi, gastrokirurgi, gynekologi og mer. Det har et regionalt utdanningsansvar og vil fra 2025 bli akkreditert som nasjonalt utdanningssenter for utdanning av ”surgical residents” – leger som spesialiserer seg innen kirurgi. NIHT har startet et samarbeid med Holy Family Hospital Berekum og the Ghana College of Physicians and Surgeons for å etablere et standardisert utdanningsløp innenfor brokkirurgi. Ambisjonen er å innføre vår utdanningsmodell som en del av den nasjonale utdanningen for “surgical residents”.
Fredag 15. november 2024 reiste Hans Gunnar Botnen (Drammen sykehus), Jens Christian Bech (Ullevål syke-

FIGUR 2. Et massivt venstresidig skrotalbrokk. Generell kirurger i Ghana blir i stor grad konfrontert med store, komplekse skrotale brokk. Opplæringen retter seg også mot trygg håndtering av disse. På bildet ser du et eksempel av et stort venstresidig skrotalbrokk som vi opererte under kurset. Pasienten har samtykket til deling.

FIGUR 4. Systematisk feedback ved hjelp av digitale tilbakemeldingsskjemaer. På bildet ser du Jens som gir systematiske tilbakemeldinger til Emmanuel. Denne strukturerte opplæringen med høyt volum er en effektiv måte for å bygge kompetanse.
3. Hans Gunnar opererer med Daniel. Kursdeltakerne opererer mest mulig som hovedoperatører og får så mye praktisk trening som mulig.
5. Daniel og Francis selvstendig på operasjonsstuen ved slutten av uken. Operasjonen måtte utføres med hodelykt på grunn av strømbrudd, noe som skjer med jevne mellomrom.
“Vi opererte totalt 50 pasienter og behandlet 56 brokk i løpet av én uke”
hus), Irina Balieva (Stavanger universitetssykehus) og meg selv til Berekum, Ghana. Uken begynte med et besøk til St. Matthews Hospital, et lite ruralt sykehus med et nedslagsfelt på cirka 60.000, en times kjøretur fra Berekum Hospital. Sykehuset bemannes av to leger som har 24 timers vakter om hverandre, 7 dager i uken. Begge legene arbeider som generalister innen flere medisinske disipliner og har basal kirurgisk kompetanse. Én av legene, Emmanuel Amoah, deltok på kurset vårt.
Hensikten med besøket var å bli bedre kjent med det lokale helsesystemet og vurdere mulighetene for fremtidige kurs ved St. Matthews Hospital. Grunnet lav kapasitet og kompetanse henvises mange pasienter med lyskebrokk til Berekum, som heller ikke har ledig kapasitet. Likevel har St. Matthews Hospital ansvar for å håndtere akutte brokk og har følgelig et stort behov for økt kompetanse innen lyskebrokkirurgi.
Fra mandag til fredag ble kurset gjennomført på to operasjonsstuer ved Holy Family Hospital Berekum. Vi opererte totalt 50 pasienter og behandlet 56 brokk. To lokale leger deltok i opplæringen sammen med en lege fra St. Matthews Hospital. I forkant gjennomgikk de en digital opplæringsmodul for Lichtenstein-prosedyren gjennom den norske plattformen Alfred Surgery.
LIS-legene var hovedoperatører i 24 av de 56 operasjonene og deltok som assistenter i 52 av de 56 brokkprosedyrene (figur 3). Totalt ble 22 pasienter med store skrotale brokk operert. Vi gjennomførte systematiske tilbakemeldinger om kirurgisk teknikk etter hver operasjon, og kompetansedata ble lagret i Alfred Surgery plattformen for å kartlegge progresjon og sertifisering (figur 4). Ved slutten av uken kunne LIS-legene utføre ukompliserte lyskebrokkoperasjoner selvstendig (figur 5).
Systematiske tilbakemeldinger er et grunnprinsipp i vår utdanningsmodell. Gjennom den strukturerte opplæringen ble Emmanuel i løpet av uken i stand til å utføre ukompliserte lyskebrokkoperasjoner selvstendig. Etter opplæringen returnerte Emmanuel til St. Matthews Hospital, utrustet med sponset utstyr som gjør det mulig for ham å tilby (gratis) nettplastikk til pasientene i månedene fremover. Han skal loggføre videoer fra operasjonene digitalt i plattformen slik at teamet har mulighet for digital veiledning. Neste steg i samarbeidet er allerede planlagt, med et nytt besøk for videre trening i november 2025. Dette understreker vårt langsiktige fokus på å styrke den kirurgiske kompetansen i ressursbegrensede områder.
I november 2024 ble det innvilget midler fra Forskningsrådet til et forprosjekt innen global helse. Hovedprosjektet ble deretter søkt om i mars 2025. Som en del av forprosjektet planlegger vi å teste ut utdanningsmodellen for lyskebrokkirurgi ved Masanga Hospital i Sierra Leone i juni 2025. Med støtte fra både internasjonale og lokale partnere som NTNU, CapaCare, Alfred Surgery og The College of Surgeons i Ghana, Sierra Leone og Liberia skal vi forske på nasjonal implementering av utdanningsmodellen. Prosjektet vil også involvere PhD-kandidater fra de tre afrikanske landene og fra Norge.
Jeg vil gjerne takke Malthes Legat for støtten jeg fikk til denne reisen. Norwegian International Hernia Team og jeg setter stor pris på de opplevelsene og erfaringene vi har hatt. Vi har hatt flere spennende og inspirerende samtaler med sykepleiere, leger, sykehusdirektører og professorer, og vi har fått besøke ulike sykehus i forskjellige omgivelser. Vi har økt vår kunnskap om Ghanas helsevesen og utdanningssytemet. Mest av alt har denne reisen styrket vår motivasjon til å fortsette arbeidet i årene som kommer.
Bouverets syndrom er en sjelden komplikasjon til kronisk kolecystitt, der en fistel mellom galleblæren og tynntarmen muliggjør passasje av en gallestein til gastrointestinaltraktus med påfølgende mekanisk obstruksjon. Tradisjonell behandling er kirurgisk, men hos eldre og multimorbide pasienter innebærer dette høy risiko. Vi presenterer her en kasuistikk der endoskopisk behandling ved hjelp av thuliumlaser ble benyttet som alternativ til kirurgi.
RISHAB S. CHAWLA¹, LEONID BARKHATOV¹, RACHEL MAHESWARAN², ANNA MAJA AGDESTEIN³, ANDREAS BRINCHMANN - HANSEN 5 , HÅVARD MJØRUD FORSMO¹,4
¹ GASTROKIRURGISK AVDELING, HAUKELAND UNIVERSITETSSJUKEHUS
² UROLOGISK AVDELING, HAUKELAND UNIVERSITETSSJUKEHUS
³ AVDELING FOR MEDISINSK UNDERSØKELSE, HAUKELAND UNIVERSITETSSJUKEHUS
4 UNIVERSITETET I BERGEN
5 AVDELING FOR RADIOLOGI, HAUKELAND UNIVERSITETSSJUKEHUS
KORRESPONDANSE: RISHAB S. CHAWLA - CHAWLARISHAB @ GMAIL.COM
KASUISTIKK
En 88 år gammel mann med kjent paroksysmal atrieflimmer, mitralinsuffisiens, diabetes mellitus type II, tidligere cerebralt insult og kronisk kolecystitt ble innlagt ved Gastrokirurgisk avdeling, Haukeland Universitetssjukehus, med vedvarende oppkast. Klinisk var pasienten dehydrert, men infeksjonsparametere og leverfunksjonsprøver var innenfor normalområdet. Arteriell blodgass viste respiratorisk alkalose med pH 7,57, pCO₂ 3,3 kPa, pO₂ 12 kPa, laktat 3,4 mmol/L og bikarbonat 24 mmol/L.
CT abdomen påviste en gallestein på 3.0 cm i pars descendens duodeni med mekanisk obstruksjon (Figur 1).
Gitt pasientens betydelige komorbiditet og høye operasjonsrisiko, besluttet vi å forsøke endoskopisk behandling under generell anestesi for å redusere faren for aspirasjonspneumoni. Etter preoperativ ventrikkeltømming
via nasogastrisk sonde ble et barnekoloskop (Olympus PCF-HQ190I) ført frem til obstruksjonsstedet I duodenum. Steinen var for stor til å passere med skopet.
Innledningsvis ble det forsøkt fragmentering med ERCP-steinknuser, nettekstraksjon og slyngereseksjon med skarpe polypektomislynger, uten tilstrekkelig effekt. Det ble deretter benyttet thuliumlaser (Olympus SOLTIVE Pro) med standard energiinnstillinger for blæresteinbehandling, noe som førte til vellykket fragmentering av gallesteinen (Figur 2). Større fragmenter ble fjernet med endoskopisk ekstraksjonsnett brukt ved avanserte polypektomier.
Den samlede prosedyrens varighet, inkludert anestesi, var fire timer. Pasienten ble overvåket i 1,5 døgn postoperativt, med rask klinisk bedring. Han ble utskrevet i god allmenntilstand og rapporterte gjenopprettet gastro-
intestinal funksjon. Ved ett års oppfølging var pasienten fortsatt i live, bosatt hjemme, og i stand til å utføre daglige aktiviteter uten funksjonsnedsettelse.
Bouverets syndrom innebærer mekanisk ileus forårsaket av gallestein gjennom en fistel mellom galleblære og duodenum [1]. Tilstanden forekommer oftest hos eldre pasienter med høy komorbiditet. Standardbehandlingen er kirurgisk fjerning av steinen, men denne tilnærmingen innebærer betydelig risiko i sårbare pasientgrupper [1].
Endoskopisk behandling har en lavere primær suksessrate (~30–40 %) sammenlignet med kirurgi, men utviklingen av laserteknikker har økt muligheten for vellykket behandling [2,3,4]. Thuliumlaser gir presis energiavlevering og effektiv fragmentering av harde konkrementer, og kan være et verdifullt verktøy i denne sammenhengen.
Generell anestesi, fremfor sedasjon alene, reduserer risikoen for aspirasjonspneumoni under inngrepet. I denne kasuistikken viser vi at endoskopisk laserlitripsi kan være et trygt, skånsomt og effektivt alternativ til kirurgi hos selekterte eldre, multimorbide pasienter med Bouverets syndrom.
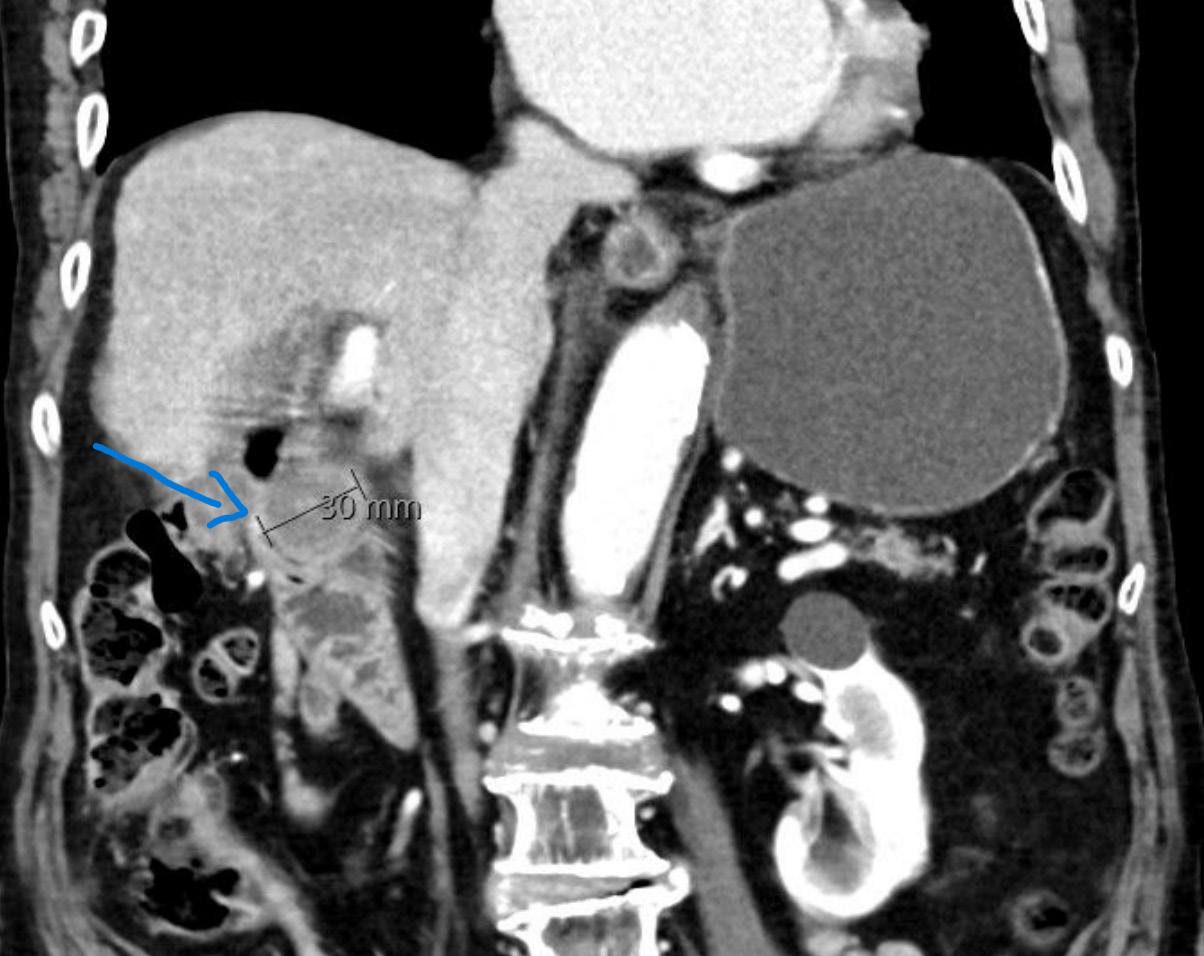
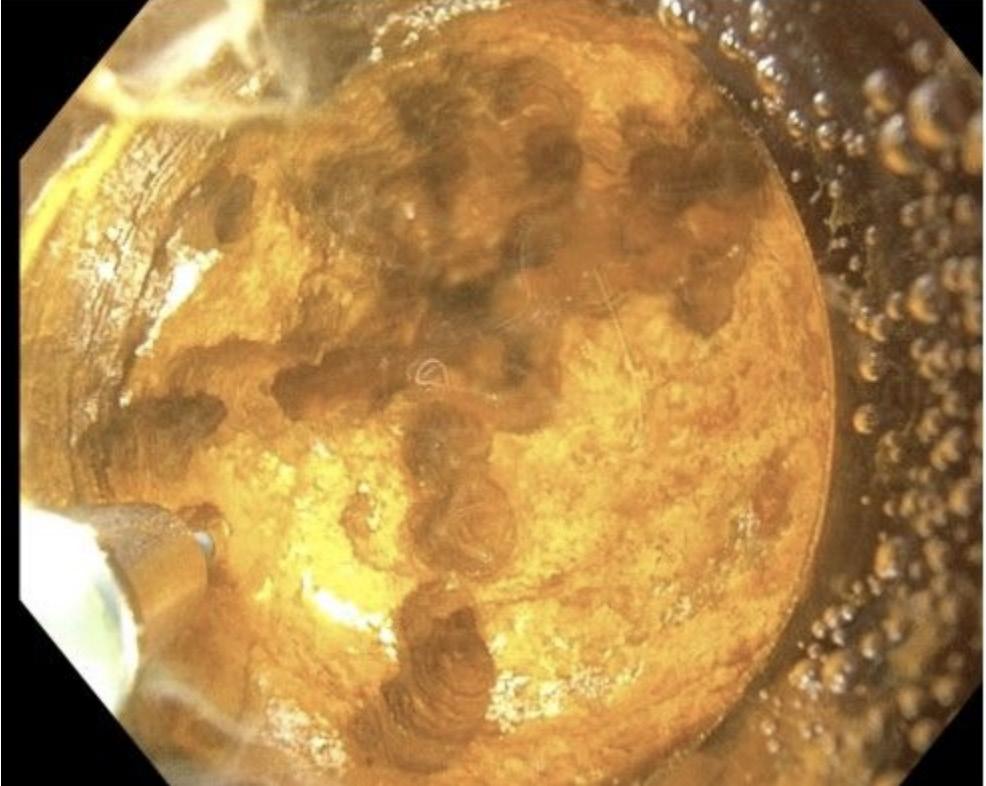
2: Endoskopisk bilde av gallesteinen under pågående thuliumlaserfragmentering. Lasersonden er synlig nede til venstre i bildet.
REFERANSER :
Se bakerst i nettutgaven på kirurgen.no
S80: KIRURGISK TILNÆRMING ETTER NEOADJUVANT BEHANDLING FOR BRYSTKREFT
1. www.helsedirektoratet.no: Brystkreft - Handlingsprogram 2025
2. Spring LM, Fell G, Arfe A, et al. Pathologic complete response after neoadjuvant chemotherapy and impact on breast cancer recurrence and survival: a comprehensive meta-analysis. Clin Cancer Res. 2020;26(12):2838-2848.
3. Heil J, Pfob A, Sinn HP, et al. Can a pathological complete response of breast cancer after neoadjuvant chemotherapy be diagnosed by minimal invasive biopsy? Eur J Cancer. 2020;131:1-10.
4. Banys-Paluchowski M, Kühn T, et al. Localization Techniques for Non-Palpable Breast Lesions: Current Status, Knowledge Gaps, and Rationale for the MELODY Study (EUBREAST-4/iBRA-NET, NCT 05559411). Cancers (Basel). 2023 Feb 12;15(4):1173.
5. Landercasper J, Attai D, et al. Toolbox to Reduce Lumpectomy Reoperations and Improve Cosmetic Outcome in Breast Cancer Patients: The American Society of Breast Surgeons Consensus Conference. Ann Surg Oncol. 2015 Oct;22(10):3174-83.
6. www.kreftregisteret.no: Nasjonalt kvalitetsregister for bryst 2024
7. Boughey JC, McCall LM, Ballman KV, et al. Tumor biology correlates with rates of breast-conserving surgery and pathologic complete response in the ACOSOG Z1071 (Alliance) trial. Ann Surg. 2014;260(4):608-614.
8. Loibl S, Volz C, Mau C, et al. Response and prognosis after neoadjuvant chemotherapy in 1,051 patients with infiltrating lobular breast carcinoma. Breast Cancer Res Treat. 2014 Feb;144(1):153-62.
9. Goorts B, Dreuning KMA, et al. MRI-based response patterns during neoadjuvant chemotherapy can predict pathological (complete) response in patients with breast cancer. Breast Cancer Res. 2018 Apr 18;20(1):34.
10. Janssen LM, den Dekker BM, et al. MRI to assess response after neoadjuvant chemotherapy in breast cancer subtypes: a systematic review and meta-analysis. NPJ Breast Cancer. 2022 Sep 19;8(1):107.
11. An YY, Kim SH, Kang BJ. Residual microcalcifications after neoadjuvant chemotherapy for locally advanced breast cancer: comparison of the accuracies of mammography and MRI in predicting pathological residual tumor. World J Surg Oncol. 2017 Nov 6;15(1):198
12. Clough KB, Kaufman GJ, Nos C, et al. Improving breast cancer surgery: A classification and quadrant per quadrant atlas for oncoplastic surgery. Ann Surg Oncol. 2010;17(5):1375-1391.
13. McCulley, S. (2023). Chest Wall Perforator Flaps in Breast-Conserving Surgery: Nottingham Approach. In: Hamdi, M., Vidya, R., Agrawal, A. (eds) Pedicled Flaps in Partial Breast Reconstruction. Springer, Cham. https://doi.org/10.1007/978-3-031-084836_14
14. Comparison of psychological aspects and patient satisfaction following breast conserving surgery, simple mastectomy and breast reconstruction Al-Ghazal, S.K. et al. European Journal of Cancer, Volume 36, Issue 15, 1938 – 1943
15. Headon HL, Kasem A, Mokbel K. The oncological safety of nipple-sparing mastectomy: A systematic review of the literature with a pooled analysis of 12,358 procedures. Arch Plast Surg. 2016;43(4):328-338.
16. Cattelani L, Polotto S, Arcuri MF, et al. One-step prepectoral breast reconstruction with dermal matrix-covered implant compared to submuscular implantation: Functional and cost evaluation. Clin Breast Cancer. 2018;18(4):e703-e711.
17. Kronowitz SJ, Robb GL. Autologous tissue breast reconstruction: A review. Semin Plast Surg. 2004;18(2):79-86.
18. Boughey JC, Suman VJ, Mittendorf EA, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: The ACOSOG Z1071 (Alliance) clinical trial. JAMA. 2013;310(14):1455-1461
19. Banys-Paluchowski M, de Boniface J. Axillary staging in node-positive breast cancer converting to node negativity through neoadjuvant chemotherapy: Current evidence and perspectives. Scand J Surg. 2023;112(2):117-125.
20. Kuemmel S, Heil J et al. A Prospective, Multicenter Registry Study to Evaluate the Clinical Feasibility of Targeted Axillary Dissection (TAD) in Node-positive Breast Cancer Patients. Ann Surg. 2022 Nov 1;276(5).
21. Samiei S, Simons JM, Engelen SME, Beets-Tan RGH, Classe JM, Smidt ML; EUBREAST Group. Axillary Pathologic Complete Response After Neoadjuvant Systemic Therapy by Breast Cancer Subtype in Patients With Initially Clinically Node-Positive Disease: A Systematic Review and Meta-analysis. JAMA Surg. 2021 Jun 1;156(6):e210891.
22. DiSipio T, Rye S, Newman B, et al. Incidence of unilateral arm lymphoedema after breast cancer: A systematic review and meta-analysis. Lancet Oncol. 2013;14(6):500-515
23. Devane LA, Baban CK, O’Doherty A, Quinn C, McDermott EW, Prichard RS. The Impact of Neoadjuvant Chemotherapy on Margin Re-excision in Breast-Conserving Surgery. World J Surg. 2020 May;44(5):1547-1551.
24. Fancellu A, Sanna V, Cottu P, et al. Benefits of oncoplastic breast-conserving surgery in the management of locally advanced breast cancer after neoadjuvant chemotherapy. J Surg Oncol. 2016;114(7):889-895.
25. Clough KB, Benyahi D, Nos C, et al. Oncoplastic surgery: pushing the limits of breast-conserving surgery. Breast J. 2015;21(2):140-146
26. Kuerer HM, Smith BD, Krishnamurthy S, Yang WT, Valero V, Shen Y, Lin H, Lucci A, Boughey JC, White RL, Diego EJ, Rauch GM; Exceptional Responders Clinical Trials Group. Eliminating breast surgery for invasive breast cancer in exceptional responders to neoadjuvant systemic therapy: a multicentre, single-arm, phase 2 trial. Lancet Oncol. 2022 Dec;23(12):1517-1524.
27. Kuerer HM, Yang WT, Krishnamurthy S, et al. Identification of exceptional responders to neoadjuvant chemotherapy in HER2-positive breast cancer. Ann Surg. 2022;275(5):892-899.
28. Boughey JC, Ballman KV, Le-Petross HT, et al. Identifying exceptional responders to neoadjuvant chemotherapy: Can surgery be omitted? Ann Surg Oncol. 2021;28(9):4840-4850
S86: ONKOPLASTISK BRYST BEVARENDE KIRURGI: EN NY TILNÆRMING TIL BRYSTKREFTBEHANDLING
1. Årsrapport fra Nasjonalt kvalitetsregister for brystkreft, 2023.
2. Veronesi U, Cascinelli N, Mariani L et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med. 2002 Oct 17;347(16):1227–32
3. Krag DN, Anderson SJ, Julian TB et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. Lancet Oncol. 2010 Oct;11(10):927-33.
4. de Boniface J, Szulkin R, Johansson ALV. Survival After Breast Conservation vs Mastectomy Adjusted for Comorbidity and Socioeconomic Status: A Swedish National 6-Year Follow-up of 48 986 Women. JAMA Surg. 2021 Jul 1;156(7):628-637.
5. Zehra S, Doyle F, Barry M et al. Health-related quality of life following breast reconstruction compared to total mastectomy and breast-conserving surgery among breast cancer survivors: a systematic review and meta-analysis. Breast Cancer. 2020 Jul;27(4):534-566.
6. Emiroğlu M, Sert İ, İnal A. The Role of Oncoplastic Breast Surgery in Breast Cancer Treatment. J Breast Health. 2015 Jan 1;11(1):1-9.
7. Audretsch W, Rezai M, Kolotas C, et al. Onco-plastic surgery: “Target” volume reduction (BCT-mastopexy), lumpectomy, reconstruction (BCT-reconstruction), and flap-supported operability in breast cancer. Second European Congress on Senology, Breast Diseases 1994:139-57.
8. C André, C Holsti, A Svenner et al. Recurrence and survival after standard versus oncoplastic breast-conserving surgery for breast cancer, BJS Open, Volume 5, Issue 1, January 2021
9. Chan, S. W., Cheung, P. S., & Lam, S. H. Cosmetic outcome and percentage of breast volume excision in oncoplastic breast conserving surgery. World journal of surgery. 2010; 34(7), 1447-1452.
10. Macmillan RD, McCulley SJ, Rainsbury RM, et al. Oncoplastic breast surgery: what, when and for whom? Breast. 2016;31(6):754–61.
11. Moen M, Holton T, Phung A et al. Complications after oncoplastic breast reduction and impact on time to adjuvant therapy. PRS Global Open, 2024;30;12(7):e6010
12. Clough KB, Kaufman GJ, Nos C et al. Improving breast cancer surgery: a classification and quadrant per quadrant atlas for oncoplastic surgery. Ann Surg Oncol. 2010 May;17(5):1375-91.
13. Helsedirektoratet. Nasjonalt handlingsprogram for brystkreft. 2023.
14. Chatterjee A, Gass J, Patel K et al. A Consensus Definition and Classification System of Oncoplastic Surgery Developed by the American Society of Breast Surgeons. Ann Surg Oncol. 2019 Oct;26(11):3436-3444
15. Clough KB, Kaufman GJ, Nos C et al. Improving breast cancer surgery: a classification and quadrant per quadrant atlas for oncoplastic surgery. Ann Surg Oncol. 2010 May;17(5):1375-91.
16. Korvald C, L’orange IC. Onkoplastisk brystbevarende kirurgi. Tidsskr Nor Legeforen 2020; 140. doi: 10.4045/tidsskr.19.0371.
17. Silverstein MJ et al. Extreme oncoplasty: breast conservation for patients who need mastectomy. Breast J. 2015 Jan-Feb;21(1):52-9.)
18. Richardson H, Ma G. The Goldilocks mastectomy. Int J Surg. 2012;10(9):522-6.
19. Behluli I, Renard PEL, Rozwag K, et al. Oncoplastic breast surgery versus conventional breast-conserving surgery: a comparative retrospective study. ANZ J Surg. 2019;89:1236–1241.
20. Benedict K, Brown M, Berry H et al. Oncoplastic Breast Reduction: A Systematic Review of Postoperative Complications. Reconstr Surg Glob Open 2023 Oct 16;11(10):e5355.
21. Karakatsanis A, Pantiora E, Aristokleous I, et al. Chest wall perforator flaps in breast cancer surgery are safe and can decrease mastectomy rates. A multicentre study. Br J Surg. 2024;30;111(11):znae266
22. Sydney A, Bloom JA, Erlichman Z, et al. How does oncoplastic surgery compare with standard partial mastectomy? A systematic review of patient-reported outcomes. Plast Reconstr Surg. 2022;150(5):950e–958e.
23. Lisboa FCA, Paulinelli RR, Veras LPC, et al. Aesthetic results were more satisfactory after oncoplastic surgery than after total breast reconstruction according to patients and surgeons. Breast. 2023;71:47–53.
24. Mansell, J, Weiler-Mithoff, E., Stallard, S., et al. Oncoplastic breast conservation surgery is oncologically safe when compared to wide local excision and mastectomy. Breast.2017;(32), 179-185
25. Campbell, E. J, Romics, L. Oncological safety and cosmetic outcomes in oncoplastic breast conservation surgery, a review of the best level of evidence literature. Breast Cancer: Targets and Therapy, 2017;(9) 521-530.
26. Chua Wern Ee, Megan et al. Oncological outcomes following extreme oncoplastic breast conserving surgery (eOPBCS) for locally advanced breast cancer (LABC): A systematic review and meta-analysis The Breast, Volume 79, 103869.
27. Rocco N, Catanuto G, Cinquini M, et al. Should oncoplastic breast conserving surgery be used for the treatment of early stage breast cancer? Using the GRADE approach for development of clinical recommendations. Breast. 2021 Jun;57:25-35.
28. Campbell, E. J, Romics, L. Oncological safety and cosmetic outcomes in oncoplastic breast conservation surgery, a review of the best level of evidence literature. Breast Cancer: Targets and Therapy, 2017;(9) 521-530.
29. Schaverien MV, Doughty JC, Stallard S. Quality of information reporting in studies of standard and oncoplastic breast-conserving surgery. Breast. 2014;23(2):104–11
30. Piper, M., Peled, A. W., Sbitany, H., et al. Comparison of Mammographic Findings Following Oncoplastic Mammoplasty and Lumpectomy Without Reconstruction. Annals of surgical oncology,2016; 23(1), 65-71.
31. T K Krastev, S J Schop, J Hommes, et al. Metaanalysis of the oncological safety of autologous fat transfer after breast cancer, British Journal of Surgery, Volume 105, Issue 9, August 2018, Pages 1082–1097.
S92: MERKING AV TUMORES I BRYSTET NYE METODER FOR Å TRYGGE OG OPTIMALISERE BRYSTKREFT BEHANDLING
1. Hall FM, Kopans DB, Sadowsky NL, Homer MJ. Development of Wire Localization for Occult Breast Lesions: Boston Remembrances. Radiology. 2013 Sep;268(3):622–7.
2. Jeffries DO, Dossett LA, Jorns JM. Localization for Breast Surgery: The Next Generation. Arch Pathol Lab Med. 2017 Oct 1;141(10):1324–9.
3. Bercovici N, Makarenko V, Vijayaraghavan G, Larkin A, Lafemina J, Clark J, et al. A single-institution analysis of reflector-guided localization using SAVI SCOUT® in nonpalpable breast carcinoma compared to traditional wire localization. Breast J. 2021 Sep;27(9):737–8.
4. Kapoor MM, Patel MM, Scoggins ME. The Wire and Beyond: Recent Advances in Breast Imaging Preoperative Needle Localization. RadioGraphics. 2019 Nov;39(7):1886–906.
5. Hayes MK. Update on Preoperative Breast Localization. Radiol Clin North Am. 2017 May;55(3):591–603.
6. Ceccato V, Wallaert L, Michel S, Gaillard T, Girard N, Darrigues L, et al. Magnetic surgical marker navigation for excision of non-palpable ultrasound visible breast lesions: first 200 cases in a French cancer center. Sci Rep. 2025 Feb 10;15(1):5002.
7. Lukac S, Leinert E, Kühn T, Dayan D, Ebner F, Pfister K, et al. Eco-logistical comparison of non-radioactive seeds and the wire-guided localization for intraoperative detection of breast lesions. Eur J Surg Oncol. 2025 Jan;51(1):108779.
8. Florholmen-Kjær Å, Mortensen R, Brun VH. SCOUT® Radar Localization of non-palpable breast carcinomas versus traditional wire-based localization: a single center retrospective comparison. Surg Oncol. 2025;in press.
9. Shirazi S, Hajiesmaeili H, Khosla M, Taj S, Sircar T, Vidya R. Comparison of Wire and Non-Wire Localisation Techniques in Breast Cancer Surgery: A Review of the Literature with Pooled Analysis. Medicina (Mex). 2023 Jul 13;59(7):1297.
S96: ANAPLASTISK THYREOIDEAKARSINOM
NYE BEHANDLINGSPRINSIPPER – BEDRE PROGNOSE
1. Locati L, Cavalieri S, Dal Maso L et al. 2020. Rare thyroid malignancies in Europe: Data from the information network on rare cancers in Europe (RARECAREnet). Oral Oncology, 2020; 108, 104766.
2. Cancer in Norway 2023, Cancer Registry of Norway. cancer-in-norway-2023.pdf
3. Alam IS, Patel KN. Management of Poorly Differentiated Thyroid Cancer and Differentiated High Grade Thyroid Carcinoma. Surg Clin N Am 104 2024; 751-765
4. Shaha AR. Implications of prognostic factors and risk groups in the management of differentiated thyroid cancer. Laryngoscope 2004; 114(3):393–402.
5. Molinaro E, Romei C, Biagini A, et al. Anaplastic thyroid carcinoma: from clinico pathology to genetics and advanced therapies. Nat Rev Endocrinol 2017; 13(11):644–60.
6. Bisof V, Rakusic Z, Despot M. Treatment of patients with anaplastic thyroid cancer during the last 20 years: whether any progress has been made? European Archives of Oto-Rhino-Laryngology 2015; 272(7): 1553-1567.
7. Nasjonalt handlingsprogram med retningslinjer for utredning, behandling og oppfølging av kreft i skjoldbruskkjertelen – Revisjon i progress http://www.helsedirektoratet.no/publikasjoner/
8. WHO Classification of Tumours Editorial Board. 2022. Endocrine Tumours [Beta version ahead of print] (5. utg.). Lyon: International Agency for Research on Cancer. https:// tumourclassification.iarc.who.int/
9. Xu B. Fuchs T, Dogan S et al. Dissecting Anaplastic Thyroid Carcinoma: A Comprehensive Clinical, Histologic, Immunophenotypic, and Molecular Study of 360 Cases. Thyroid 2020, 30(10): 1505-1517.
10. Brierley JD, Gospodarowicz MK, Wittekind, C. (red.). TNM classification of malignant tumors (8. edit., 2017). Hoboken, NJ: John Wiley & Sons, Inc.
11. Smallridge RC, Ai KB, Asa SL et al. American Thyroid Association guidelines for management of patients with anaplastic thyroid cancer. Thyroid 2012; 22(11): 1104-1139.
12. Bible KC, Kebebew E, Brierley J et al. 2021 American Thyroid Association Guidelines for Management of Patients with Anaplastic Thyroid Cancer. Thyroid 2021, 31(3), 337-386.
13. Lambrecht M, Eekers DBP, Alapetite C et al. Radiation dose constraints for organs at risk in neuro-oncology; the European Particle Therapy Network consensus. Radiotherapy and Oncology 2018; 128(1), 26-36.
14. Prasongsook N, Kumar A et al. Survival in Response to Multimodal Therapy in Anaplastic Thyroid Cancer. Journal of Clinical Endocrinology and Metabolism 2017; 102(12), 4506-4514.
15. Sugitani I, Onoda N, Ito KI et al. Management of Anaplastic Thyroid Carcinoma: the Fruits from the ATC Research Consortium of Japan. Journal of Nippon Medical School = Nippon Ika Daigaku zasshi. 2018; 85(1), 18-27
16. Kim JH, Leeper RD. Treatment of locally advanced thyroid carcinoma with combination doxorubicin and radiation therapy. Cancer 1987; 60(10), 2372-2375.
17. Levendag PC, De Porre PM, van Putten W L. Anaplastic carcinoma of the thyroid gland treated by radiation therapy. International Journal of Radiation Oncology, Biology, Physics 1993; 26(1), 125-128.
18. Higashiyama T, Ito, Y, Hirokawa M et al. Induction chemotherapy with weekly paclitaxel administration for anaplastic thyroid carcinoma. Thyroid 2010; 20(1), 7-14.
19. Kawada K, Kitagawa, K, Kamei S et al. The feasibility study of docetaxel in patients with anaplastic thyroid cancer. Japanese Journal of Clinical Oncology 2010; 40(6), 596-599.
20. Troch M, Koperek O, Scheuba C et al. High efficacy of concomitant treatment of undifferentiated (anaplastic) thyroid cancer with radiation and docetaxel. Journal of Clinical Endocrinology and Metabolism 2010; 95(9), E54-57.
21. Filetti S, Durante C, Hartl D et al. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Annals of Oncology 2019; 30(12), 1856-1883.
22. Subbiah V, Kreitman RJ, Wainberg ZA et al. Dabrafenib and Trametinib Treatment in Patients With Locally Advanced or Metastatic BRAF V600-Mutant Anaplastic Thyroid Cancer. Journal of Clinical Oncology. 2018; 36(1), 7-13.
23. Subbiah V, Kreitman RJ, Wainberg ZA et al. Dabrafenib plus trametinib in patients with BRAF V600E-mutant anaplastic thyroid cancer: updated analysis from the phase II ROAR basket study. Annals of Oncology 2022; 33(4), 406-415.
24. Wang JR, Zafereo ME, Dadu R et al. Complete Surgical Resection Following Neoadjuvant
Dabrafenib Plus Trametinib in BRAF(V600E)-Mutated Anaplastic Thyroid Carcinoma. Thyroid 2019, 29(8), 1036-1043.
25. Dierks C, Seufert J, Aumann K et al. Combination of Lenvatinib and Pembrolizumab Is an Effective Treatment Option for Anaplastic and Poorly Differentiated Thyroid Carcinoma. Thyroid 2021; 31(7), 1076-1085.
26. Capdevila J, Wirth LJ, Ernst T et al. PD-1 Blockade in Anaplastic Thyroid Carcinoma. Journal of Clinical Oncology 2020; 38(23), 2620-2627.
27. Standardisert pasientforløp for skjoldbruskkjertelkreft, dokumentert i Skjoldbruskkjertelkreft - Standardisert pasientforløp - onkologisk Kreftklinikken (KRE)/Avd. kreftbehandling – E-håndboken Oslo Universitetssykehus https://ehandboken.ous-hf.no/document/141404
S102: PARATYREOIDEA- SMÅ KJERTLER, STOR FYSIOLOGISK BETYDNING. KIRURGISK BEHANDLING AV PRIMÆR- OG TERTIÆR HYPERPARATYREOIDISME.
1. Johansson H. The Uppsala anatomist Ivar Sandström and the parathyroid gland. Upsala Journal of Medical Sciences 2015;120: 72-77
2. Mandl F. Therapeutischer Versuch bei Ostitis fibrosa generalisata mittels Extirpation eines Epithelkörperchentumors. Wien Klin Wochenschr 1925; 50: 1343-44
3. Callender GG, Udelsman R. Surgery for Primary Hyperparathyroidism. Cancer 2014; Dec 1:3602-3616
4. Wilhelm SM, Wang TS, Ruan DT et al. The American Association of Endocrine Surgeons Guidelines for Definitive Management of Primary Hyperparathyroidism. JAMA Surg 2016; 151(10): 959-968
5. Endokrinologisk forening (Endokrinologisk veileder) https://metodebok.no/emne/ xB9RLjZd
6. Vescini F, Borretta G, Chiodini I et al. Italian Guidelines for the Management of Primary Hyperparathyroidism. Endocr, Metab Immune Disord Drug Targets 2024; 24: 991-1006
7 Li Y, Simonds WF. Endocrine Neoplasms in familial syndromes of hyperparathyroidism. Endocr Relat Cancer 2016; 23: R229-R247.
8. Bilezikian JP, Khan AA, Silverberg SJ et al. Evaluation and Management of Primary Hyperparathyroidism: Summary Statement and Guidelines from the Fifth International Workshop. JBMR 2022; 37(11): 2293-2314
9. Ovcaricek PP, Giovanella L, Gasset IC et al. The EANM guidelines for parathyroid imaging. Eur J Nucl Med Mol Imaging 2021; 48: 2801-2822
10. Barczynski M, Bränström R, Dionigi G et al. Sporadic multiple parthyroid gland disease-a consensus report of the European Society of Endocrine Surgeons (ESES). Langenbecks Arch Surg 2015; 400:887-905
11. Miccoli P, Bert P, Materazzi G et al. Minimally invasive video assisted parathyroidectomy (MIVAP). Eur J Surg Oncol 2003; 29:188-190
12 Khan ZF, Lew JI. Intraoperative Parathyroid Hormone Monitoring in the Surgical Management of Sporadic Primary Hyperparathyroidism. Endocrinol Metab 2019; 34: 327-339
13. Lau WL, Obi Y, Kalantar-Zadeh K. Parathyreoidectomy in the Management of Secondary Hyperparathyroidism. Clin J Am Soc Nephrol 2018 Jun 7; 13(6): 952-961
14. Schneider R, Slater EP, Karakas E et al. Initial Parathyroid Surgery in 606 Patients with Renal Hyperparathyroidism. World J Surg (2012); 36: 318-326
15. Dream S, Kuo LE, Kuo JH et al. The American Association of Endocrine Surgeons Guidelines for the Definitive Surgical Management of Secondary and Tertiary Renal Hyperparathyroidism. Ann Surg 2022; 276 (3): e141-e176
16. Komaba H, Kakuta T, Fukagawa M. Management of secondary hyperparathyroidism: how and why? Clin Exp Nephrol 2017; 21 (Suppl 1): S37-S45
17. Chen L, Wang K, Yu S et al. Long-term mortality after parathyroidectomy among chronic kidney disease patients with secondary hyperparathyroidism: a systematic review and meta-analysis. Ren Fail 2016; 38:1050-1058
18. Kim SS, Long J, Montez-Rath ME et al. Rates and Outcomes of Parathyroidectomy for Secondary Hyperparathyroidism in the United States. Clin J Am Soc Nephrol 2016; 11: 1260-1267
19. van der Plas WY, Dulfer RR, Koh EY et al. Safety and efficacy of subtotal or total parathyroidectomy for patients with secondary or tertiary hyperparathyroidism in four academic centers in Netherlands. Langenbecks Arch Surg 2018; 403: 999-1005
20. El-Husseini A, Wang K, Edon AA et al. Parathyroidectomy-A last resort for hyperparathyroidism in dialysis patients. Semin Dial 2017; 30: 385-389
21. Tentori F, Wang M, Bieber BA et al. Recent Changes in Therapeutic Approaches and Association with Outcomes among Patients with Secondary Hyperparathyrpoidism on Chronic Hemodialysis: The DOPPS Study. Clin J Am Soc Nephrol 2015 Jan 7; 10(1): 98109
22. Ketteler M, Block GA, Evenepoel P et al. Executive summary of the 2017 KDIGO Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) Guideline Update: what’s changed and why it matters. Kidney Int 2017; 92:26-36
23. Almquist M, Isaksson E, Clyne N. The treatment of renal hyperparathyroidism. Endocr Relat Cancer 2020; 27: R21-R34
24. Komaba H, Taniguchi M, Wada A et al. Parathyroidectomy and survival among Japanese hemodialysis patients with secondary hyperparathyroidism. Kidney Int 2015; 88: 350359
25. Yuan Q, Liao Y, Zhou R et al. Subtotal parathyroidectomy versus total parathyroidectomy with autotransplantation for secondary hyperparathyroidism: an updated systematic review and meta-analysis. Langenbecks Arch Surg (2019) 404: 669-679
26. Åkerstrøm G, Malmaeus J, Bergstrøm R. Surgical anatomy of human parathyroid glands. Surgery 1984 Jan;95(1):14-21
27. Lou I, Foley D, Odorico SK et al. How well does Renal Transplantation Cure Hyperparathyroidism? Ann Surg 2015; 262 (4): 653-659
28. Cianciolo G, Tondolo F, Barbuto S et al. A roadmap to parathyroidectomy for kidney transplant candidates. Clin Kidney J 2022; 15 (8), 1459-1474
29. Pihlstrøm H, Dahle DO, Mjøen G et al. Increased Risk of All-Cause Mortality and Renal Graft Loss in Stable Renal Transplant Recipients with Hyperparathyroidism. Transplantation 2015; 99: 351-359
30. Zhao HH, Wilhelm SM. Timing of parathyroidectomy for tertiary hyperparathyroidism after kidney transplant. Surgery 2024; 176:1617-1622
S 110: ENDOKRINKIRURGISK ROBOTKIRURGI
1. C Pérez-Salazar MJ et al. Comparative Study of Ergonomics in Conventional and Robotic-Assisted Laparoscopic Surgery. Sensors 2024 Jun 14;24(12):3840.
2. Gagner M, Lacroix A, Bolté E. Laparoscopic adrenalectomy in Cushing’s syndrome and pheochromocytoma. N Engl J Med. 1992;327(14):1033
3. Piazza L, Caragliano P, Scardilli M, Laparoscopic robot-assisted right adrenalectomy and left ovariectomy (case reports) Chir Ital. 1999;51(6):465–466.
4. Jamii St Julien et al, Robot-assisted cortical-sparing adrenalectomy in a patient with Von Hippel-Lindau disease and bilateral pheochromocytomas separated by 9 years, J Laparoendosc Adv Surg Tech A 2006 Oct;16(5):473-7.
5. Morris LF, Perrier ND. Advances in robotic adrenalectomy. Curr Opin Oncol. 2012;24(1):1–6
6. Economopoulos KP, Mylonas KS, Stamou AA, Laparoscopic versus robotic adrenalectomy: a comprehensive meta-analysis. Int J Surg. 2017;38:95–104
7. Tang K, Li H, Xia D, Robot-assisted versus laparoscopic adrenalectomy: a systematic review and meta-analysis. J Laparoendosc Adv Surg Tech A. 2015;25(3):187–195
8. Safa Vatansever et al, Robot-assisted versus conventional laparoscopic adrenalectomy: Results from the EUROCRINE Surgical Registry, Surgery 2022 May;171(5):1224-1230
9. Lairmore TC, Folek J, Govednik CM, Improving minimally invasive adrenalectomy: selection of optimal approach and comparison of outcomes. World J Surg. 2016;40(7):1625–1631.
10. Lirici MM, Hüscher CSG, Chiodini S, Endoscopic right thyroid lobectomy. Surg Endosc. 1997 Aug;11(8):877–877.
11. Gagner M. Endoscopic subtotal parathyroidectomy in patients with primary hyperparathyroidism. J Br Surg. 1996 Jun 1;83(6):875–875.
12. Miccoli P, Berti P, Conte M, Minimally invasive surgery for thyroid small nodules: Preliminary report. J Endocrinol Invest. 1999 Dec;22(11):849–51.
13. Lee MC, Ahn J, Choi IJ, Comparative Study of Gasless Transaxillary, Bilateral Axillo-Breast, Unilateral Axillo-Breast With Carbon Dioxide Insufflation, Retroauricular, and Transoral Vestibular Endoscopic Thyroidectomy Approaches at a Single Institution: A Retrospective Analysis and Lessons Learned. Clin Exp Otorhinolaryngol. 2022 Aug 31;15(3):283–91.
14. Chang EHE, Kim HY, Koh YW, Overview of robotic thyroidectomy. Gland Surg. 2017 Jun;6(3):218–28.
15. Ikeda Y, Takami H, Sasaki Y, Endoscopic neck surgery by the axillary approach1. J Am Coll Surg. 2000 Sep;191(3):336–40.
16. Kim MJ, Chung WY. Yonsei, Experience of 5000 Gasless Transaxillary Robotic Thyroidectomies: Reply. World J Surg. 2018 Jul;42(7):2281–2.
17. Papini P, De Palma A, Ginesini M, Robot-assisted transaxillary surgery for thyroid cancer: Oncologic and surgical outcomes in long term follow-up. Int J Med Robot. 2024 Feb;20(1):e2563.
18. Matteucci V, Bai D, Fregoli L, The effect of robot-assisted transaxillary thyroidectomy (RATT) on body image is better than the conventional approach with cervicotomy: a preliminary report. Updat Surg. 2021 Jun;73(3):1169–75.
19. Song CM, Yun BR, Ji YB, Long-Term Voice Outcomes After Robotic Thyroidectomy. World J Surg. 2016 Jan;40(1):110–6.
S 114: AKUTTE HENDELSER I BRYST-
OG ENDOKRINKIRURGISK PRAKSIS
1. Nasjonsalt kvalitetsregister for brystkreft, Årsrapport 2023. 2023.
2. de Boniface J, Szulkin R, Johansson ALV. Major surgical postoperative complications and survival in breast cancer: Swedish population-based register study in 57 152 women. The British journal of surgery. 2022;109(10):977-83.
3. Bongiovanni T, Lancaster E, Ledesma Y, Whitaker E, Steinman MA, Allen IE, et al. Systematic Review and Meta-Analysis of the Association Between Non-Steroidal Anti-Inflammatory Drugs and Operative Bleeding in the Perioperative Period. J Am Coll Surg. 2021;232(5):765-90.e1.
4. de Boniface J, Szulkin R, Johansson ALV. Medical and surgical postoperative complications after breast conservation versus mastectomy in older women with breast cancer: Swedish population-based register study of 34 139 women. The British journal of surgery. 2023;110(3):344-52.
5. Seth AK, Hirsch EM, Kim JY, Dumanian GA, Mustoe TA, Galiano RD, Fine NA. Hematoma after mastectomy with immediate reconstruction: an analysis of risk factors in 883 patients. Ann Plast Surg. 2013;71(1):20-3.
6. Thalji SZ, Cortina CS, Guo MS, Kong AL. Postoperative Complications from Breast and Axillary Surgery. Surgical Clinics of North America. 2023;103(1):121-39.
7. Chin K, Wärnberg F, Kovacs A, Olofsson Bagge R. Impact of Surgical Care Bundle on Surgical Site Infection after Non-Reconstructive Breast Cancer Surgery: A Single-Centre Retrospective Comparative Cohort Study. Cancers (Basel). 2023;15(3).
8. Jeannon J-P, Orabi AA, Bruch GA, Abdalsalam HA, Simo R. Diagnosis of recurrent laryngeal nerve palsy after thyroidectomy: a systematic review. 2009;63(4):624-9.
9. Thomusch O, Machens A, Sekulla C, Ukkat J, Lippert H, Gastinger I, Dralle H. Multivariate analysis of risk factors for postoperative complications in benign goiter surgery: prospective multicenter study in Germany. World J Surg. 2000;24(11):1335-41.
10. Bergenfelz A, Jansson S, Kristoffersson A, Mårtensson H, Reihnér E, Wallin G, Lausen I. Complications to thyroid surgery: results as reported in a database from a multicenter audit comprising 3,660 patients. Langenbeck’s archives of surgery. 2008;393(5):667-73.
11. Francis DO, Pearce EC, Ni S, Garrett CG, Penson DF. Epidemiology of vocal fold paralyses after total thyroidectomy for well-differentiated thyroid cancer in a Medicare population. Otolaryngol Head Neck Surg. 2014;150(4):548-57.
12. Lechien JR, Hans S, Mau T. Management of Bilateral Vocal Fold Paralysis: A Systematic Review. Otolaryngol Head Neck Surg. 2024;170(3):724-35.
13. Ho TW, Shaheen AA, Dixon E, Harvey A. Utilization of thyroidectomy for benign disease in the United States: a 15-year population-based study. Am J Surg. 2011;201(5):570-4.
14. Wang X, Wang SL, Cao Y, Li CQ, He W, Guo ZM. Postoperative hypoparathyroidism after
thyroid operation and exploration of permanent hypoparathyroidism evaluation. Front Endocrinol (Lausanne). 2023;14:1182062.
15. Reinke R, Udholm S, Christiansen CF, Almquist M, Londero S, Rejnmark L, et al. Hypoparathyroidism and mortality after total thyroidectomy: A nationwide matched cohort study. Clin Endocrinol (Oxf). 2024;100(4):408-15.
16. Reinke R, Londero SC, Almquist M, Rejnmark L, Rolighed L. Total thyroidectomy: reduction in postoperative hypoparathyroidism. Endocr Connect. 2023;12(9).
17. Promberger R, Ott J, Kober F, Koppitsch C, Seemann R, Freissmuth M, Hermann M. Risk factors for postoperative bleeding after thyroid surgery. The British journal of surgery. 2012;99(3):373-9.
18. Lorenz K, Sekulla C, Kern J, Dralle H. [Management of postoperative hemorrhage following thyroid surgery]. Chirurg. 2015;86(1):17-23.
19. Lee JS, Lee JS, Yun HJ, Chang H, Kim SM, Lee YS, Chang HS. Comparison of delayed bleeding to immediate bleeding following thyroidectomy. Sci Rep. 2023;13(1):18342.
20. Bures C, Klatte T, Gilhofer M, Behnke M, Breier AC, Neuhold N, Hermann M. A prospective study on surgical-site infections in thyroid operation. Surgery. 2014;155(4):67581.
21. Rosato L, Avenia N, Bernante P, De Palma M, Gulino G, Nasi PG, et al. Complications of thyroid surgery: analysis of a multicentric study on 14,934 patients operated on in Italy over 5 years. World J Surg. 2004;28(3):271-6.
22. Marti JL, Millet J, Sosa JA, Roman SA, Carling T, Udelsman R. Spontaneous Adrenal Hemorrhage with Associated Masses: Etiology and Management in 6 Cases and a Review of 133 Reported Cases. World Journal of Surgery. 2012;36(1):1.
23. Rzepka E, Kokoszka J, Grochowska A, Ulatowska-Białas M, Lech M, Opalińska M, et al. Adrenal bleeding due to pheochromocytoma - A call for algorithm. Front Endocrinol (Lausanne). 2022;13:908967.
24. Fowler AM, Burda JF, Kim SK. Adrenal Artery Embolization: Anatomy, Indications, and Technical Considerations. American Journal of Roentgenology. 2013;201(1):190-201.
25. Gellert SE, Hilscher M, Aagaard M. [Not Available]. Ugeskr Laeger. 2023;185(38).
1. Villwock JA, Jones K. Recent trends in epistaxis management in the United States: 2008–2010. Int Forum Allergy Rhinol. 2013;3(2):123–9.
2. Tunkel DE, Anne S, Payne SC, et al. Clinical practice guideline: Nosebleed (epistaxis). Otolaryngol Head Neck Surg. 2020;162(1_suppl):S1–S38.
3. Pallin DJ, Chng YM, McKay MP, et al. Epidemiology of epistaxis in US emergency departments, 1992 to 2001. Ann Emerg Med. 2005;46(1):77–81.
4. Rudmik L, Smith TL. Management of intractable epistaxis. Am J Rhinol Allergy. 2012;26(1):55–60.
5. Tabassom A, Dahlstrom JJ. Epistaxis. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan.
6. Pollice PA, Yoder MG. Epistaxis: a retrospective review of hospitalized patients. Otolaryngol Head Neck Surg. 1997;117(1):49–53.
7. Walker TW, Macfarlane TV, McGarry GW. The epidemiology and chronobiology of epistaxis: an investigation of Scottish hospital admissions 1995–2004. Clin Otolaryngol. 2007;32(5):361–5.
8. Kucik CJ, Clenney T. Management of epistaxis. Am Fam Physician. 2005;71(2):305–11.
9. Ingason AB, Rumba E, Hreinsson JP, et al. Warfarin is associated with higher rates of epistaxis compared to direct oral anticoagulants: A nationwide propensity score-weighted study. J Intern Med. 2022;292(3):501–511.
10. Schlosser RJ. Clinical practice. Epistaxis. N Engl J Med. 2009;360(8):784–9.
11. Krulewitz NA, Fix ML. Epistaxis. Emerg Med Clin North Am. 2019 Feb;37(1):29–39.
12. Leadon M, Hohman MH. Posterior Epistaxis Nasal Pack. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Mar 1.
13. Regli A, von Ungern-Sternberg BS, Strobel WM, et al. The impact of postoperative nasal packing on sleep-disordered breathing and nocturnal oxygen saturation in patients with obstructive sleep apnea syndrome. Anesth Analg. 2006 Feb;102(2):615–20.
14. Rudmik L, Smith TL. Management of intractable epistaxis. Am J Rhinol Allergy. 2012;26(1):55–60.
15. Nouraei SA, Maani T, Hajioff D, et al. Outcome of endoscopic sphenopalatine artery occlusion for intractable epistaxis: a 10-year single-centre experience. Laryngoscope. 2007;117(8):1452–6.
16. Shires CB, Boughter JD, Sebelik ME. Sphenopalatine artery ligation: a cadaver anatomic study. Otolaryngol Head Neck Surg. 2011;145(3):494–7.
17. Woolford TJ, Jones NS. Endoscopic ligation of anterior ethmoidal artery in treatment of epistaxis. J Laryngol Otol. 2000;114(11):858–860.
18. Fath L, Léon A, Djennaoui I et al. Transcaruncular anterior ethmoidal artery ligation. Eur Ann Otorhinolaryngol Head Neck Dis. 2023 Jan;140(1):46-48. doi: 10.1016/j. anorl.2022.06.001. Epub 2022 Jul 14. PMID: 35842350
SÅR PÅ HÅNDEN
1. Store norske leksikon (2005-2007): Fjesing i Store norske leksikon på snl.no. Hentet 30. mars 2025 fra https://snl.no/fjesing
2. Helse Norge: Fjesing og andre fisk med giftige pigger på helsenorge.no. Hentet 30. mars 2025 fra https://www.helsenorge.no/giftinformasjon/giftige-bitt-og-stikk/fjesing/
3. Borondo JC, Sanz P, Nogué S, Poncela JL et.al. Fatal weeverfish sting. Human & Experimental Toxicology. 2001;20(2):118-119. doi:10.1191/096032701668435659
4. V. Haddad & T. Sardenberg. Management of Venomous Injuries. Wolfe SW. Pederson WC. Kozin SH. Green’s Operative Hand Surgery (8.utg, kap. 52). Elsevier 2022
5. Pederson WC. Nonmicrosurgical Coverage of the Upper Extremity. Wolfe SW. Pederson WC. Kozin SH. Green’s Operative Hand Surgery (8.utg, kap. 44). Elsevier 2022
6. Lindesnes avis: Blir du stukket er behandlingen glovarmt vann. Bilde hentet med samtykke 29. mars 2025 fra https://www.l-a.no/nyheter/i/VbaE41/blir-du-stukketBlir%20du%20stukket%20-er-behandlingen-glovarmt-vann
S 130: ENDOSKOPISK BEHANDLING AV BOUVERETS
SYNDROM HOS EN MULTIMORBID PASIENT
1. Chang L, Chang M, Chang HM, Chang AI, Chang F. Clinical and radiological diagnosis of gallstone ileus: A mini review. Emergency Radiology. 2018;25(2):189–196. https:// doi.org/10.1007/s10140-017-1568-5
2. Singh A, Thapa B, Sharma A. Endoscopic management of Bouveret syndrome: A case report and review of literature. International Journal of Surgery Case Reports. 2023;110:108766. https://doi.org/10.1016/j.ijscr.2023.108766
3. Chen YC, Yeh CN, Tseng JH, Hwang TL, Jan YY. Successful endoscopic treatment of Bouveret syndrome using a novel technique with mechanical lithotripsy and laser lithotripsy. Case Reports in Gastroenterology. 2018;12(1):151–158. https://doi. org/10.1159/000485884
4. Cappell MS, Davis M. Characterization of Bouveret’s syndrome: A comprehensive review of 128 cases. American Journal of Gastroenterology. 2006;101(9):2139–2146. https://doi.org/10.1111/j.1572-0241.2006.00723.x
FORSIDEILLUSTRASJON: Harald Kryvi

Indication: this medicinal product is for diagnostic use only. Carmyne is indicated in adults for the intra-operative detection of suspected ureteral injuries during abdominal and pelvic surgery.
Carmyne 40 mg – Plikttekst for Carmyne 40 mg «Indigokarmin» injeksjonsvæske, oppløsning Reseptgruppe C. Indikasjoner: Kun til bruk ved diagnostiske formål. Indisert hos voksne til intraoperativ påvisning av mistenkte ureterskader under abdominal kirurgi og bekkenkirurgi. Dosering: Anbefalt startdose er 1 ampulle på 5 ml ved langsom i.v. injeksjon. En andre ampulle kan injiseres 20 til 30 minutter etter den første injeksjonen, om nødvendig. Se SPC for spesielle pasientgrupper og administrasjonsmåte. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Forsiktighetsregler: Kan forårsake en forbigående økning av blodtrykket og refleksbradykardi, spesielt hos pasienter under generell anestesi eller under spinalanestesi. Sjeldne idiosynkratiske reaksjoner med bradykardi og hypotensjon er også rapportert. Det er derfor nødvendig å overvåke hjertefrekvens og blodtrykk under og noen minutter etter injeksjonen. I.v. injeksjon bør stoppes ved følgende symptomer: bradykardi, takykardi, hypotensjon, hypertensjon, utslett eller erytem, luftveissymptomer som dyspné eller bronkospasme. Har ikke blitt studert hos pasienter med GFR <30 ml/min, og bør derfor ikke brukes hos disse. Kan forstyrre puls eller cerebrale oksymetrimålinger. Bør brukes med forsiktighet ved: høyt blodtrykk, lav hjertefrekvens, hjerte- og ledningsforstyrrelser, samtidig bruk av legemidler som induserer bradykardi eller påvirker blodtrykket eller produksjonen av nitrogenoksid, koronare lidelser på grunn av dets perifere vasokonstriktoreffekt. Bruk bør unngås hos pasienter med: hemodynamisk ustabilitet, ukontrollert hjertesvikt, allergiske reaksjoner i anamnesen. Graviditet, amming og fertilitet: Graviditet: Ingen data. Anbefales ikke under graviditet og hos fertile kvinner som ikke bruker prevensjon. Amming: Overgang i morsmelk er ukjent. Risiko for diende barn kan ikke utelukkes. Nytte-/risikovurdering må foretas. Bivirkninger: Svært vanlig: Bradykardi, hypertensjon (forbigående). Svært sjeldne: Anafylaktoide reaksjoner, AV-blokk, bronkial hyperreaktivitet, dyspné, hypotensjon, misfarging av hud, utslett og erytem, takykardi. Overdosering/ Forgiftning: En overdose kan indusere en hypertensiv krise og alvorlig bradykardi. Ved overdosering kan det vurderes behandling med en perifer vasodilator.
For mer informasjon, se Felleskatalogteksten eller preparatomtalen (SPC)Innehaver av markedsføringstillatelsen: SERB S.A., Belgia. Kontaktinformasjon: Telefon: 003227920500. E-post: safety@serb.eu. Basert på SPC godkjent av DMP/EMA: 19.06.2024. Pakninger og priser per 17.07.2024: Ampulle 10 × 5 ml. 4713,00 kr. (priser og ev. refusjon oppdateres hver 14. dag). Refusjon: Ingen refusjon. Utarbeidet 07/2024