



Hvordan helsesektoren kan bane vei med kunstig intelligens side 28 1 • 2024 ISSN 1891-1617 Streptococcus pyogenes – en post-pandemisk bumerang s. 14 www.indremedisineren.no • www.legeforeningen.no/Fagmed/Norsk-indremedisinsk-forening Vi intervjuer: Morten Mowe s 36 Prognostiske faktorer ved molekylært målrettet kreftbehandling s. 24 IM 15 ÅR ESIM Winter School 2024 s. 34 Fagtidsskrift for Norsk Indremedisinsk Forening Rask implementering av retningslinjer via hjertesviktpoliklinikker s. 10 1 Redusert opptak 2 Eliminasjon/utpumping 3 Mutert målprotein 4 Endret nivå av målprotein 5 Redusert DNA reparasjon 6 Antiapoptotisk (rosa) overvekt 1 6 4 5 3 2
TABLET T DAGLIG
Med ERLEADA® 240 mg, kan pasienten din fortsette å nyttigjøre seg ektiviteten og sikkerheten til ERLEADA®, men med kun én-tablettdaglig.1,2
Med ERLEADA® 240 mg, kan pasienten din fortsette å nyttigjøre seg ektiviteten og sikkerheten til ERLEADA®, men med kun én-tablettdaglig.1,2
DOSERING = FIRE 60 MG TABLETTER, EN GANG DAGLIG1

DOSERING = FIRE 60 MG TABLETTER, EN GANG DAGLIG1



•
•
DOSERING = EN 240 MG TABLETT, EN GANG DAGLIG1
DOSERING = EN

• En enkelt 240 mg ERLEADA® tablett gir samme effektivitet og trygghet som 4 x 60 mg ERLEADA® tabletter 1,2
• Forenkling av dosering har vist seg å ha den mest positive effekten på etterlevelse av orale prostatakreftbehandlinger, sammenlignet med andre tiltak 3,4
ERLEADA® forblir tilgjenglig i sin opprinnelige 60 mg formulering.1
sammenlignet med andre tiltak 3,4
ERLEADA® forblir tilgjenglig i sin opprinnelige 60 mg formulering.1
REFERANSER
1. ERLEADA® SPC 09/2023, chapter 1
2. Chi KN, Chowdhury S, Bjartell A, et al. Apalutamide in Patients With Metastatic Castration-Sensitive Prostate Cancer: Final Survival Analysis of the Randomized, Double-Blind, Phase III TITAN Study. J Clin Oncol. 2021 Jul 10;39(20):2294-2303.
3. Higano CS, Hafron J. Adherence With Oral Anticancer Therapies: Clinical Trial vs Real-world Experiences With a Focus on Prostate Cancer. J Urol. 2023 Mar;209(3):485-493.
4. Duerden M, Avery T, Payne. Polypharmacy and Medicines Optimisation. King's Fund Report, November 2013. https://www.kingsfund.org.uk/sites/default/files/field/field_publication_file/ polypharmacy-and-medicines-optimisation-kingsfund-nov13.pdf. Accessed: December 2023.
REFERANSER
1. ERLEADA® SPC 09/2023, chapter 1
2. Chi KN, Chowdhury S, Bjartell A, et al. Apalutamide in Patients With Metastatic Castration-Sensitive Prostate Cancer: Final Survival Analysis of the Randomized, Double-Blind, Phase III TITAN Study. J Clin Oncol. 2021 Jul 10;39(20):2294-2303.
3. Higano CS, Hafron J. Adherence With Oral Anticancer Therapies: Clinical Trial vs Real-world Experiences With a Focus on Prostate Cancer. J Urol. 2023 Mar;209(3):485-493.
4. Duerden M, Avery T, Payne. Polypharmacy and Medicines Optimisation. King's Fund Report, November 2013. https://www.kingsfund.org.uk/sites/default/files/field/field_publication_file/ polypharmacy-and-medicines-optimisation-kingsfund-nov13.pdf. Accessed: December 2023.
UTVALGT PRODUKT OG SIKKERHETSINFORMASJON FOR APALUTAMID, ERLEADA®
INDIKASJONER
• Til voksne menn til behandling av ikke-metastaserende, kastrasjonsresistent prostatakreft (nmCRPC) som har høy risiko for å utvikle metastaserende sykdom.
UTVALGT PRODUKT OG SIKKERHETSINFORMASJON FOR APALUTAMID, ERLEADA®
• Til voksne menn til behandling av metastaserende, hormonsensitiv prostatakreft (mHSPC) i kombinasjon med androgendeprivasjonsterapi (ADT).
DOSERING
INDIKASJONER
• Fall og frakturer: Økt risiko for fall og frakturer. Pasienten skal evalueres for frakturer og fallrisiko før behandlingsstart, og videre overvåkes og behandles for frakturer iht. etablerte behandlingsretningslinjer, og bruk av skjelettspesifikke legemidler skal vurderes. Alvorlige kutane bivirkninger (SCARs): SCARs, inkl. DRESS og Stevens-Johnsons syndrom/ toksisk epidermal nekrolyse (SJS/TEN), som kan være livstruende eller dødelig, er rapportert. Pasienten skal informeres om tegn og symptomer på DRESS og SJS/TEN. Ved symptomer skal preparatet seponeres umiddelbart. Behandlingen skal ikke gjenopptas hos pasienter som har fått DRESS eller SJS/TEN under behandlingen.
INTERAKSJONER
• Fall og frakturer: Økt risiko for fall og frakturer. Pasienten skal evalueres for frakturer og fallrisiko før behandlingsstart, og videre overvåkes og behandles for frakturer iht. etablerte behandlingsretningslinjer, og bruk av skjelettspesifikke legemidler skal vurderes.
• Til voksne menn til behandling av ikke-metastaserende, kastrasjonsresistent prostatakreft (nmCRPC) som har høy risiko for å utvikle metastaserende sykdom.
• Til voksne menn til behandling av metastaserende, hormonsensitiv prostatakreft (mHSPC) i kombinasjon med androgendeprivasjonsterapi (ADT).
DOSERING
Voksne (inkl. eldre) menn: Behandlingen skal innledes og overvåkes av legespesialist med erfaring innen medisinsk behandling av prostatakreft. Anbefalt dose er 240 mg (4 tabletter à 60 mg eller 1 tablett à 240 mg) 1 gang daglig. Medisinsk kastrasjon med gonadotropinfrisettende hormonanalog (GnRHa) skal fortsette under behandlingen hos pasienter som ikke er kirurgisk kastrert. Ved toksisitet grad ≥3 eller uakseptabel bivirkning skal doseringen utsettes fremfor å seponere behandlingen permanent, inntil symptomene bedres til grad ≤1 eller opprinnelig grad, og deretter gjenopptas med samme dose eller om nødvendig, redusert dose (180 mg eller 120 mg).
KONTRAINDIKASJONER
Overfølsomhet for innholdsstoffene. Kvinner som er eller kan bli gravide.
BIVIRKNINGER
Voksne (inkl. eldre) menn: Behandlingen skal innledes og overvåkes av legespesialist med erfaring innen medisinsk behandling av prostatakreft. Anbefalt dose er 240 mg (4 tabletter à 60 mg eller 1 tablett à 240 mg) 1 gang daglig. Medisinsk kastrasjon med gonadotropinfrisettende hormonanalog (GnRHa) skal fortsette under behandlingen hos pasienter som ikke er kirurgisk kastrert. Ved toksisitet grad ≥3 eller uakseptabel bivirkning skal doseringen utsettes fremfor å seponere behandlingen permanent, inntil symptomene bedres til grad ≤1 eller opprinnelig grad, og deretter gjenopptas med samme dose eller om nødvendig, redusert dose (180 mg eller 120 mg).
Svært vanlige bivirkninger (≥1/10) er fatigue, hudutslett, hypertensjon, hetetokter, artralgi, diaré, fall, vekttap og frakturer.
Vis forsiktighet ved behandling av pasienter med:
• Krampeanfall: Ikke anbefalt ved krampeanfall i anamnesen eller andre disponerende faktorer.
KONTRAINDIKASJONER
Overfølsomhet for innholdsstoffene. Kvinner som er eller kan bli gravide.
BIVIRKNINGER
Svært
Apalutamid er en induktor av enzymer og transportører som kan medføre til redusert plasmakonsentrasjon og dermed tapt eller redusert klinisk effekt av enkelte legemidler.
MONITORERING
Ingen laboratorieundersøkelser utover rutineundersøkelsene som følger diagnosen prostatakreft er nødvendig.
• Alvorlige kutane bivirkninger (SCARs): SCARs, inkl. DRESS og Stevens-Johnsons syndrom/ toksisk epidermal nekrolyse (SJS/TEN), som kan være livstruende eller dødelig, er rapportert. Pasienten skal informeres om tegn og symptomer på DRESS og SJS/TEN. Ved symptomer skal preparatet seponeres umiddelbart. Behandlingen skal ikke gjenopptas hos pasienter som har fått DRESS eller SJS/TEN under behandlingen.
PAKNINGER, PRISER OG REFUSJON
INTERAKSJONER
Pakninger og priser: Tabletter; filmdrasjerte 60 mg og 240 mg: Hver tablett inneholder: Apalutamid; 60 mg resp. 240 mg, hjelpestoffer. Fargestoff: 60 mg og 240 mg: Svart og gult jernoksid (E 172), titandioksid (E 171). 60 mg: 112 stk.1 (kalenderpakn.) 512560.; 37292,20 kr. 240 mg: 28 stk. (kalenderpakn.) 525400.; 37292,20 kr.
Apalutamid er en induktor av enzymer og transportører som kan medføre til redusert plasmakonsentrasjon og dermed tapt eller redusert klinisk effekt av enkelte legemidler.
MONITORERING
Refusjon: H-resept: L02B B05_1 Apalutamid. Refusjonsberettiget bruk: Der det er utarbeidet nasjonale handlingsprogrammer/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/ LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. Basert på SPC 09/2023. For utfyllende informasjon se felleskatalogen.
Ingen laboratorieundersøkelser utover rutineundersøkelsene som følger diagnosen prostatakreft er nødvendig.
PAKNINGER, PRISER OG REFUSJON
Pakninger og priser: Tabletter; filmdrasjerte 60 mg og 240 mg: Hver tablett inneholder: Apalutamid; 60 mg resp. 240 mg, hjelpestoffer. Fargestoff: 60 mg og 240 mg: Svart og gult jernoksid (E 172), titandioksid (E 171). 60 mg: 112 stk.1 (kalenderpakn.) 512560.; 37292,20 240 mg: 28 stk. (kalenderpakn.) 525400.; 37292,20 kr.
er fatigue, hudutslett, hypertensjon, hetetokter,
bivirkninger (≥1/10)
vanlige
TABLETT,
GANG DAGLIG1
NYHET! OR =
240 MG
EN
ERLEADA® ER NÅ TILGJENGELIG SOM EN ENKEL EN-GANG-OM-DAGEN TABLETT
En enkelt
ERLEADA® tablett
4
240 mg
gir samme effektivitet og trygghet som
x 60 mg ERLEADA® tabletter 1,2
Forenkling av dosering har vist seg å ha den mest positive effekten på etterlevelse av orale prostatakreftbehandlinger,
ADT, androgen deprivation therapy; AE, adverse event; CI, confidence interval; PCWG2, Prostate Cancer Clinical Trials Working Group; HR, hazard ratio; HRQoL, health-related quality of life; ITT, intent-to-treat; not reached; PSA, prostate-specific antigen; TEAEs, treatment-emergent AEs. *Median follow-up was 44.0 months.2 †Time to castration resistance was defined as time from random assignment to radiographic progression, PSA progression per PCWG2, or symptomatic skeletal event, whichever occurred first.2
TABLET T DAGLIG
NYHET! OR
ERLEADA® ER NÅ TILGJENGELIG SOM EN ENKEL EN-GANG-OM-DAGEN TABLETT
=
ADT, androgen deprivation therapy; AE, adverse event; CI, confidence interval; PCWG2, Prostate Cancer Clinical Trials Working Group; HR, hazard ratio; HRQoL, health-related quality of life; ITT, intent-to-treat; NR, not reached; PSA, prostate-specific antigen; TEAEs, treatment-emergent AEs. *Median follow-up was 44.0 months.2 †Time to castration resistance was defined as time from random assignment to radiographic disease progression, PSA progression per PCWG2, or symptomatic skeletal event, whichever occurred first.2
CP-431805
Styret i Norsk indremedisinsk forening:
Trond Vartdal
Leder
Knut Lundin
Nestleder
Cecilie H Nordmo
Styremedlem
Runa Andreassen
Styremedlem
Hamza Nahoui Leder NYI
Stephen Hewitt
Redaktør Indremedisineren
Maria Seferowicz
Høstmøtetkomitéen
Bjørn Jørgensen
Spesialitetskomiteen
Rune Eilertsen
Vara
Anita Suntharalingam
Vara NYI
Fagredaktører: Bernt Aarli (Lungemedisin)
Haukeland universitetssykehus
Eystein Husebye (Endokrinologi)
Haukeland universitetssykehus
Gunnar Einvik (Lungemedisin)
Akershus universitetssykehus/NTNU
Indremedisineren er et fagtidsskrift rettet mot norske leger som arbeider innen fagomådet indremedisin, med dets ulike retninger. Indremedisineren sendes ut til alle medlemmer av Norsk indremedisinsk forening (Nif), som for tiden er ca 3 400, samt til andre med interesse for faget.
Forsidebilde
Trine Finnes (Endokrinologi)
Sykehuset Innlandet/OUS
Guri Hagberg (Geriatri) OUS Ullevål
og
fra norske miljøer, samt noe internasjonalt rettet stoff av allmen interesse. Vi ønsker å legge til rette for at terskel og takhøyde gir rom for en allment engasjert
"Nye antibiotika som oppdages ved hjelp av kunstig intelligens", generert med ChatGPT.
Utgivelsesplan
Annonsepriser 2024
Bakside 23.500,Omslagsside 20.500,-
Helside 19.500,1/2 side 13.000,-
Årsavtale Med fire innrykk oppnås min. 20% rabatt.
Annonseformat
Bredde x Høyde
1/1 side 210 mm x 297 mm + 5 mm
1/2 side liggende 210 mm x 148,5 mm + 5 mm
1/2 side stående 105 mm x 297 mm + 5 mm
Bakside 210 mm x 230 mm + 5 mm
Annonsemateriell Høyoppløste PDF-filer, der fonter og høyoppløste bilder er inkludert.
Layout, produksjon og annonsesalg Apriil Media AS E-post: ragnar.madsen@apriil.no www.apriil.no Opplag









Disclaimer
• Informasjon, meninger og synspunkter som utgis i Indremedisineren tilhører forfatterne, og ikke nødvendigvis Norsk indremedisinsk forening eller redaksjonen.
• Publisering av artikler, annonser eller annen informasjon, betyr ikke nødvendigvis støtte eller aksept for disse.
• Redaksjonen og utgiver anstrenger seg for ikke å publisere unøyaktige eller misvisende data, men forfatterne må selv ta ansvar for data,






uttalelser og meninger som blir utgitt på deres vegne.
• Redaksjonenen og utgiver gjør sitt beste for å sikre at legemiddeldoser og andre kvantiteter presenteres nøyaktig, men vi anbefaler leserne å bruke legemidler i samsvar med Felleskatalogen/Norsk legemiddelhåndbok.
• Indremedisineren og/eller utgiver kan ikke holdes ansvarlig for evt. feil eller konsekvenser som oppstår som følge av bruk av informasjon i tidsskriftet.
3 Indremedisineren 1 • 2024 Leder Innhold
Bestillingsfrist/ Levering Forfatterfrister Materiellfrist annonsører Posten Nr. 1 1/2 26/2 26/3 Nr. 2 1/5 29/5 28/6 Nr. 3 1/9 9/9 8/10 Nr. 4 1/11 11/11 10/12
4 600 eks
Indremedisineren vil presentere relevant
indremedisiner å ytre seg. Reproduksjon av materiale fra Indremedisineren må skje etter tillatelse fra redaksjon og forfatter. Faste spalter Leder 4 Redaksjonen 6 Fagartikler Rask implementering av retningslinjer via hjertesviktpoliklinikker 10 Streptococcus pyogenes – en post-pandemisk bumerang 14 Samval – korleis kan det integrerast i klinisk praksis? 18 Delirium og demens - hvordan virker disse tilstandene på hverandre? 20 Prognostiske faktorer ved molekylært målrettet kreftbehandling 24 Hvordan helsesektoren kan bane vei med kunstig intelligens 28 Foreningsnytt Indremedisin i Norge 32 ESIM Winter School 2024 34 Vi intervjuer Morten Mowe 36 Norsk endokrinologisk forening 39 Norsk forening for geriatri 40 Indremedisinsk Høstmøte 2024 42 Redaktører: Stephen Hewitt (ansvarlig redaktør) OUS Aker stehewi@online.no T: 913 72 199 Ole Kristian H. Furulund (assisterende redaktør) Kommuneoverlege i Bærum Maya Bass Akuttmottaket, Bærum sykehus, mctbass@hotmail.com Tone Svilaas OUS Aker tosvil@ous-hf.no 10 14 28 36 36 40 39 18 18 20 24 10 10 10 10
faglig
fagpolitisk stoff
TRANSTYRETIN AMYLOID KARDIOMYOPATI (ATTR-CM) ER EN UNDERDIAGNOSTISERT ÅRSAK TIL HJERTESVIKT1,2
VYNDAQEL
ATTR-CM behandling med fem års overlevelsesdata 3
Etter 30 måneder reduserte Vyndaqel risiko vs. placebo for 4,‡:
Død uansett årsak


Kardiovaskulære sykehusinnleggelser


HR: 0,70 (95 % KI: 0,51-0,96)



Relativ risikoratio: 0,68 (95 % CI 0,56-0,81)
Etter fem år var relativ risikoreduksjon for død uansett årsak 41 % (HR: 0,59 (95% KI: 0,44-0,79))3

www.pfi.sr/behandle
Se Einar Gude sitt foredrag: Hvem skal behandles for ATTR hjerteamyloidose og hvordan?
▼Vyndaqel® (tafamidis) 61 mg er indisert til behandling av villtype eller arvelig transtyretin amyloid kardiomyopati (ATTR-CM). Anbefalt dosering er 1 kapsel 1 gang daglig. Forsiktighet anbefales ved alvorlig nedsatt leverfunksjon. Kan gi interaksjoner ved klinisk relevante konsentrasjoner med BCRP-substrater (f.eks. metotreksat, rosuvastatin, imatinib). Utvalgte bivirkninger: Økte verdier i leverfunksjonsprøver og reduksjon i tyroksin kan forekomme. Pris: Det er fremforhandlet en konfidensiell, kostnadseffektiv pris til norske helseforetak og enkelte private sykehus. Denne er betydelig lavere enn maksimal utsalgspris i apotek, som er kr 195058,40.
Pakning: Myke kapsler, 30 stk. Reseptgruppe: C. Refusjon: H-resept. ICD10: E85
Kriterier for forskrivning på H-resept:
• Oppstart av behandling kan kun gjøres av kardiolog med erfaring i behandling av transtyretin amyloidose (ATTR), ansatt ved universitetssykehus eller annet helseforetak med kardiologisk enhet med kompetanse på behandling for denne pasientgruppen.
• Pasienten må ha en sikkert diagnostisert ATTR kardiomyopati, vanligvis med nukleærmedisinsk påvist amyloid i myokard. Pasienten skal ved oppstart være i NYHAklasse I eller II.
• Pasienten skal ha en forventet gjenstående levetid betydelig over 18 måneder.
• Ved progresjon til vedvarende (minst 6 måneder) NYHA-klasse III, skal beslutning om å fortsette behandlingen tas i samråd med kardiolog med erfaring i behandling av ATTR, ansatt ved universitetssykehus eller annet helseforetak med kardiologisk enhet med kompetanse på behandling for denne pasientgruppen.
• Ved rask progresjon til vedvarende NYHA-klasse III i løpet av 6 måneder etter initiert behandling, bør behandlingen avsluttes.
Før forskrivning, konsulter preparatomtalen på www.legemiddelsok.no
‡Hjertetransplantasjon, kombinert hjerte- og levertransplantasjon og hjertemekanisk hjelpemiddelimplantasjon (CMAD) ble behandlet som likeverdig med død i denne analysen. ATTR-ACT=Tafamidis in Transthyretin Cardiomyopathy Clinical Trial; TTR=Transtyretin; HR=Hazard ratio
Referanser: 1. Witteles RM, et al. JACC Heart Fail. 2019;7(8):709-716. 2. Maurer MS, et al. J Am Coll Cardiol. 2016;68(2):161-172. 3. Eliott P, et al. Long-term survival with tafamidis in patients with transthyretin amyloid cardiomyopathy. Circ Heart Fail. 2022;15:4-11. 4. Maurer MS, et al. N Engl J Med. 2018;379(11):1007-1016.
Pfizer AS - Postboks 3, 1324 Lysaker - www.pfizerpro.no PP-VYN-NOR-0561 Desember 2023
Kjære kolleger
Rekrutteringssvikt går igjen i spesialisthelsetjenesten. Nasjonalt er det over 30 av spesialitetene som har rekrutteringsvansker til LIS- og/eller overlege-stillinger. Faktum er likevel at aldri har det jobbet flere leger i spesialisthelsetjenesten. Men antall stillinger har økt betydelig, og raskere enn tilfanget av nye leger og spesialister. Nye tjenesteplaner med kortere vakter, flere på vakt samtidig, kompetanse i front (akuttmottak), fastlegekrisen og generelt økt press på avdelingene har økt behovet for arbeidskraft. Kirurgene ser derimot at antall operasjoner ikke har økt tilsvarende. For å opprettholde volum ser vi spesielt ved de større syke husene, en økende grad av subspesialisering og seksjonering hvilket igjen øker behovet for arbeidskraft.
Det er trolig liten politisk vilje til å endre dagens sykehusstruktur og akutt-tilbud til befolkningen.
Flere hensyn spiller inn. Avstander/ geografi, vær, bosetningsmønster, sysselsetning, industri, forsvar og beredskap for å nevne noen. Hvordan kan spesialistutdanningen tilpasses for å møte helsetjenestens behov? Høstens og vinterens debatt om generalistkompetanse er trolig utløst av dette bakteppet. I tillegg til å utdanne generalister (om det er det man ønsker) bør organiseringen sikre at disse generalistene har interessante og stimulerende karrierer i hele landet. I tillegg til å dekke vakter, vil det være behov for breddekompetanse også på dagtid. Endret demografi, med økende levealder gir økt multimorbiditet og langvarige tilstander som krever nærhet til
behandling og oppfølging fremfor stadig henvisning til organspesialist – noe som kan gi fragmentert pasient-oppfølging. Det er derfor behov for generalister i norske sykehus, både små og store sykehus.
Det er i prinsippet tre måter å utvikle generell kompetanse i sykehusene. Det ene er å legge til rette for å ha leger som har to spesialiteter (dobbeltspesialitet), likt det man hadde før 2019. Systemet slik det er nå, legger ikke enkelt til rette for leger som ønsker å inneha to spesialiteter, med generell kirurgi eller indre medisin som den ene av de to. Videre kan man betydelig styrke «LIS2», altså de henholdsvis felles kirurgiske («FKI») og felles indremedisinske læringsmålene («FMI»). Disse læringsmålene er det så langt varierende hvem som «eier» og gir utdanning i, og blir stemoderlig behandlet i spesialistutdanningen. Kan man tenke seg et system der LIS2 styrkes betraktelig, og kunne tilby solide generalister? Det må diskuteres. Den tredje veien er å sørge for at det opprettes stillinger for LIS og overlege-stillinger for leger som ønsker å ha, eller allerede innehar kun én generell spesialitet, og at sykehusene organiseres rundt disse generalistene, både på dagtid og hva gjelder vaktordninger.
Helsedirektoratet har nylig startet et omfattende arbeid med å definere behov for generalister i sykehusene, og det arbeides med å lage en større «rådslagning», trolig 25. og 26. april. Legeforeningen og flere fagmedisinske foreninger er invitert til å
delta. Men leger og ledere på norske sykehus må også delta. Sykehusene og de regionale helseforetakene er de som skal ansette legene og tilby meningsfullt arbeid til legene på landets sykehus. Det er derfor viktig at de er aktivt med å definere generalistbehovet.
Det arbeidet som gjøres nå, vil definere generalistkompetansen i sykehusene i lang tid fremover. Jeg håper derfor at indremedisinere og helseledere på de ulike sykehus rundt om i landet vil engasjere seg i diskusjonen. Styret og spesialitetskomiteen er sterkt involvert, og vil prøve å søke bistand fra medlemmer rundt om i landet, slik at vi får presentert hele bildet av behov og utfordringer. Ta gjerne direkte kontakt med undertegnede, om dere har innspill.
Hilsen
Trond Vartdal

Indremedisineren 1 • 2024 Lederen har ordet
Helsedirektoratet anbefaler
DIFICLIR (fidaksomicin)1
Retningslinjer for antibiotikabehandling i sykehus anbefaler at DIFICLIR (fidaksomicin) vurderes til behandling av Clostridioides difficile-infeksjon (CDI) hos pasienter med høy risiko for residiv
Faktorer som kan øke risiko for residiv er1:
• Immunsvikt
• Tidligere CDI
• Sykehusopphold siste 3 måneder
• Protonpumpehemmer
• Høy alder
Vennligst se retningslinjer for fullstendig behandlingsanbefaling
Elektronisk søknadsløsning for individuell refusjon til legemidler på blåresept
Utvalgt produkt- og sikkerhetsinformasjon DIFICLIR (fidaksomicin) 200 mg tabletter
Indikasjoner: For behandling av Clostridioides difficile-infeksjoner (CDI), også kjent som C. difficile-assosiert diaré (CDAD), hos voksne og pediatriske pasienter med en kroppsvekt på minst 12,5 kg. Det skal tas hensyn til offisielle retningslinjer for korrekt bruk av antibakterielle midler. Vanligste bivirkninger: Vanlige: Forstoppelse, kvalme, oppkast. Vanligste alvorlige bivirkninger: Overfølsomhetsreaksjoner inkl. alvorlig angioødem. Interaksjoner: Forsiktighet utvises ved samtidig bruk av potente P-gp-hemmere. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Forsiktighetsregler: Fidaksomicin bør brukes med forsiktighet ved kjent allergi mot makrolider. Hvis det oppstår en alvorlig allergisk reaksjon, skal legemidlet seponeres og egnede tiltak igangsettes. Bør brukes med forsiktighet ved pseudomembranøs kolitt eller fulminant eller livstruende CDI og ved nedsatt lever- og nyrefunksjon. Graviditet, amming og fertilitet: Graviditet: Det anbefales å unngå bruk under graviditet. Amming: Det må tas en beslutning om amming skal opphøre eller behandling avstås fra, basert på nytte-/risikovurdering. Fertilitet: Dyrestudier indikerer ingen effekt på fertilitet. Dosering: Tabletter: Standard dosering: Voksne og barn ≥12,5 kg: Anbefalt dose er 200 mg (1 tablett) administrert 2 ganger daglig (1 tablett hver 12. time) i 10 dager. Utvidet pulsdosering: Voksne: 200 mg tabletter administreres to ganger daglig for dag 1–5 (ingen tablett på dag 6) og deretter én gang daglig annenhver dag for dag 7–25. Hvis en dose blir glemt, skal den glemte dosen tas så snart som mulig, men hvis det snart er tid for neste dose, skal tabletten hoppes helt over. Administrering: Kan tas med eller uten mat. Svelges hele sammen med et glass vann. Pakninger og priser: 20 stk. (blister) kr 18 099,90. Reseptgruppe C. Basert på SPC godkjent av DMP/EMA: 01.12.2023. PM-DT-NO-00020.
For utfyllende informasjon om dosering, forsiktighetsregler, interaksjoner og bivirkninger – se felleskatalogen no.
Referanse: 1. https://www.helsedirektoratet.no/retningslinjer/antibiotika-i-sykehus/infeksjoner-i-abdomen#clostridioides-difficile-infeksjon. Sist faglig oppdatert 01.03.2022.
Tillotts Pharma AB | Gustavslundsv. 135, 167 51 Bromma, Sverige |
Tel: +46 8-704 77 40 | nordicinfo@tillotts.com
Kjære kolleger
I år kan vi feire 15 års drift med Indremedisineren. Vi er svært takknemlige for bidragsviljen til og mottakelsen av dette medlemsblad for Norsk indremedisinsk forening. Mye har skjedd innen faget disse årene, og engasjerte indremedisinere har formidlet av sin kunnskap.
I dette nummer skriver først Torfinn Eriksen-Volnes og medarbeidere fra Norsk hjertesviktregister om virksomheten til hjertesviktklinikkene, som startet registreringsarbeidet fra 2013. Hjertepoliklinikkene er multidisiplinære og tar sikte på en helhetlig tilnærming. Registreringen er nå obligatorisk, og registeret har fått en dekningsgrad på over 90%. Artikkelen tar utgangspunkt i retningslinjene fra den europeiske kardiologiske forening (ESC) av 2021, og viser stor optimalisering av sviktbehandlingen de siste årene. Særlig ses en økning i bruk av mineralkortikoid-antagonister og SLGT2-hemmere.
Oddvar Oppegaard tok på Høstmøtet 2023 for seg økningen man har observert i forekomst av S. pyogenes infeksjoner i etterkant av Covid-19 – herunder overhyppighet av nekrotiserende fasciitt. Han stiller spørsmål ved hva som kan være årsaken til denne økningen: Immunologisk gjeld, økning i ko-smitte og ko-infeksjon eller evt. evolusjon av mikroben? Han stiller også spørsmål om hva som vil skje videre, og peker på betydningen av kliniske studier på nye

behandlingsmodaliteter for nekrotiserende bløtvevs-infeksjoner og at man må følge med på forekomst og patogenisitet hos mikroben.
Samvalg mellom lege og pasient er et rådende ideal for kliniske avgjørelser. Silje Orstad og Margrethe Aase Schaufel tar for seg dette temaet, og peker på utfordringer i klinisk praksis. Samvalg er bl.a. blitt et eget læringsmål i LIS-utdanningen. Forfatterne har kartlagt hva pasienter med alvorlig lungekreft og helsepersonell hadde behov for i en slik sammenheng. Og de planlegger etter dette å intervenere med et nylig utarbeidet redskap for bedre samvalg.
I klinikken erfarer man gjerne at delir kan oppstå hos eldre pasienter som samtidig også har en grad av kognitiv svikt. I Maria Krogseth sin artikkel gjennomgår hun hvordan disse tilstandene påvirker hverandre: Kognitiv svikt øker risiko for delirium, og delirium øker risikoen for kognitiv svikt. Tilstandene synes således forbundet med hverandre. Hun peker på at delirium er assosiert med en stigning i Neurofilament Light Chain (NfL), som er en markør for nevronskade, og at dette sammen med forverring av kognitiv funksjon, støtter at delirium er farlig for hjernen.
Øystein Bruserud diskuterer i sin artikkel nødvendigheten av å revidere de prognostiske faktorene som man benytter seg av ved molekylært

målrettet kreftbehandling. Han tar utgangspunkt i erfaringer ved akutt myelogen leukemi og argumenterer for at flere av de tradisjonelle prognostiske faktorene fortsatt kan være gyldige ved molekylært målrettet behandling. Men også nye faktorer synes å ha betydning og kan identifiseres på grunnlag av forskjellene mellom pasientene. Vi viser også til deres nye bok om cytostatika.
Lege og grunder Ishita Barua har disputert over temaet kunstig intelligens (KI), og hun gir oss en innføring i hva KI er og hvordan den kan brukes klinisk. KI-verktøy er allerede tatt i bruk i Vestre Viken HF for vurdering av røntgenbilder, og kan potensielt være et effektivt redskap for å håndtere mange problemstillinger i helsevesenet. Blant disse nevnes muligheten å oppdage sepsis tidlig, finne nye antibiotika, utvikle nye legemidler, øke sannsynligheten for vellykket IVF-behandling mm.
Vi viser også til foreningssidene og håper dere finner interessant lesning.
Vennlig hilsen Redaksjonen


7 Indremedisineren 1 • 2024 Redaktørens spalte
Stephen Hewitt
Ole Kristian H. Furulund
Maya Bass
Tone Svilaas








Rask implementering av retningslinjer via hjertesviktpoliklinikker
Siden europeiske retningslinjer for behandling av hjertesvikt ble publisert i 2021, viser data fra Norsk hjertesviktregister at hjertesviktpoliklinikkene raskt har implementert anbefalt medikamentell behandling for pasienter med hjertesvikt med redusert ejeksjonsfraksjon 40%.
Torfinn Eriksen-Volnes1,2, Charlotte B. Ingul1,3, Martin Blindheimsvik 1, Marianne Lægran1, Eva Kjøl Slind1 1Norsk hjertesviktregister (NHSR), 2 Hjerteavdelingen, St. Olavs hospital, 3 Institutt for sirkulasjon og bildediagnostikk, NTNU.
Prognose og epidemiologi ved hjertesvikt
Hjertesvikt er en alvorlig tilstand med dårlig prognose: tradisjonelt har 5-års dødelighet vært over 50%. Den eksakte prevalensen er ukjent, men en antar at opptil 175 000 personer kan leve med hjertesvikt i Norge. Selv om den aldersjusterte insidensen har flatet ut de siste årene, gjør et økende antall eldre og bedre behandling at antallet personer med kronisk hjertesvikt vil øke i årene fremover (2).
Hjertesviktpoliklinikk
En hjertesviktpoliklinikk skal tilby informasjon og opplæring om hjertesvikt, støtte til egenmestring, råd om fysisk aktivitet og kosthold, kliniske undersøkelser, justering og opptitrering av hjertesviktmedikamenter, avanserte laboratorietjenester, funksjonstesting via 6-minutter gangtest, ekkokardiografi og strukturert måling av livskvalitet og generell helse. I tillegg bør en tilby et tverrfaglig tilbud med hjertetreningsgrupper eller strukturert treningsopplegg med veiledning fra kompetent personell (også en IA anbefaling fra European
Society of Cardiology (ESC) 2021 Guidelines (1)) og infusjon av intravenøs jernbehandling (3).
Norske hjertesviktpoliklinikker er i hovedsak bemannet av syke pleiere med spesialkompetanse, i tett samarbeid med ansvarlig kardiolog. Hjertesviktpoliklinikkene registrerer et bredt utvalg av variabler til Norsk hjertesviktregister (NHSR). Medikamentell behandling er en viktig del av håndteringen av personer med hjertesvikt med redusert ejeksjonsfraksjon (HFrEF = hjertesvikt med EF ≤40%), og hele fire medikamentgrupper har nå en IA-anbefaling i de siste retningslinjene fra ESC (1). Medikamenter, demografiske data, livskvalitetsdata (Minnesota living with heart failure questionnaire, EQ-5D-5L), 6-minutter gangtest og komorbiditetsdata registreres i NHSR. NHSR har fra 2013 hentet data fra et økende antall hjertesviktpoliklinikker i Norge. I 2013 startet 9 hjertesviktpoliklinikker å registrere i NHSR, mens det i februar 2024 var økt til 44 fra alle fylker.
Norsk hjertesviktregister NHSR er et nasjonalt medisinsk kvalitetsregister for behandling gitt til pasienter med diagnosen hjertesvikt og som er fulgt ved en hjertesviktpoliklinikk i Norge. Norsk Cardiologisk Selskap (NCS) ga i januar 2022 sin tilslutning til anbefalingene fra ESC 2021 Guidelines for behandling av hjertesvikt (1). Disse retningslinjene har hele tiden vært veiledende for hjertesviktpoliklinikkene. NHSR er en del av Hjerte- og karregisteret (HKR) som har obligatorisk registrering etter helseregisterloven. Nasjonal dekningsgrad for NHSR var på 90% i 2022, slik at data er tilgjengelig for en stor andel av personer som ble behandlet ved norske hjertesviktpoliklinikker. Hensikten med NHSR er å gi sammenlignbare data om aktivitet og resultat i behandlingen av hjertesvikt ved landets hjertesviktpoliklinikker, og således medvirke til gode tjenestetilbud og pasientforløp. Det er et mål at kvalitetsregistrene skal medvirke til å minske forskjeller i behandling og oppfølging av pasienter i Norge. NHSR er derfor et verktøy for det enkelte regionale helseforetak
En ACE-hemmer er anbefalt for personer med HFrEF for å redusere risiko for sykehusinnleggelser for hjertesvikt og død (2-5)
En betablokker er anbefalt for personer med HFrEF for å redusere risiko for sykehusinnleggelser for hjertesvikt og død (6-11)
En MRA er anbefalt for personer med HFrEF for å redusere risiko for sykehusinnleggelser for hjertesvikt og død (12,13)
Dapagliflozin eller Empagliflozin er anbefalt for personer med HFrEF for å redusere risiko for sykehusinnleggelser for hjertesvikt og død (14,15)
Sacubitril/Valsartan er anbefalt som erstatning for ACE-hemmer for personer med HFrEF for å redusere risiko for sykehusinnleggelser og død (16)
Klasse Nivå
I A
I A
I A
I A
I B
10 Indremedisineren 1 • 2024 Fagartikkel
Torfinn Eriksen-Volnes
Charlotte B. Ingul
Martin Blindheimsvik
Marianne Lægran
Eva Kjøl Slind
Tabell 1. ESC 2021 guidelines. Anbefalinger om farmakologisk behandling for pasienter med HFrEF i NYHA klasse II-IV (1)
(RHF), hvert helseforetak (HF) og det enkelte sykehus i vurderingen av egen praksis og behandlingsresultat. I tillegg til kunnskapsbasert praksis, skal registerdataene danne grunnlag for videre forskning.
ESC Guidelines 2021 for medikamentell behandling av HFrEF (EF ≤40%)
Siden slutten av 1980-tallet, har en rekke medikamentelle randomiserte behandlingsstudier vist redusert dødelighet, symptomer og antall sykehusinnleggelser ved HFrEF. Dette gjelder for ACE-hemmere (4-7), betablokkere (8-13), mineralkortikoidreseptor hemmere (MRA) (14,15) og de siste årene natriumglukosekotransportør 2 (SGLT-2)-hemmere (16,17). En studie har vist bedre utkomme ved bruk av Sacubitril/ Valsartan sammenlignet med ACEhemmeren Enalapril, slik at dette medikamentet har en IB anbefaling som foretrukket medikament (18).
Tabell 1 viser gjeldende anbefalinger vedrørende medikamenter for HFrEF.
Det er altså sterkt anbefalt å starte opp med hele 4 medikamentfamilier hos pasienter med HFrEF, som ofte har høy alder og betydelig komorbiditet. De siste retningslinjene fra 2021 (1) vektlegger også rask opptrapping mot måldoser. ACEhemmere og betablokkere har relativt høye måldoser (f.eks. 10 mg Ramipril og 200 mg Metoprolol Depot per døgn). Alle medikamentgruppene senker i større eller mindre grad blodtrykket. For ACE-hemmere og MRA er nyrefunksjon og kaliumverdi en bekymring, som kan hindre opptitrering eller bruk av medikamentene.
ESC Guidelines 2021 for medikamentell behandling av HFmrEF (EF 41-49%) og HFpEF (EF ≥50%)
For hjertesvikt med høyere EF enn 40% har de medikamentelle behandlings alternativene historisk vært mer begrenset. Nyere studier har vist effekt av SGLT2-hemmere også for personer med hjertesvikt med høyere EF (19,20), og disse medikamentene har nå fått en IAanbefaling også for denne pasientgruppen i et tillegg til ESC Guidelines 2021 som ble publisert i august 2023


11 Indremedisineren 1 • 2024 Fagartikkel
Figur 2. Andel med HFrEF som behandles med SGLT2-hemmer (%), nasjonale tall.
Figur 3. Andel med HFrEF som behandles med alle fire medikamenter (%), nasjonale tall.
Figur 1. Andel med HFrEF som behandles med MRA (%), nasjonale tall.
(21). Fra 01.01.2024 gis det også refusjon på blå resept på denne behandlingen i Norge.
Anbefaling om multidisiplinært program
En annen IA anbefaling i ESC Guidelines 2021 (1) er at pasientene blir innrullert i et multidisiplinært program for å hindre risikoen for sykehusinnleggelser for hjertesvikt og død. Nøyaktig hva et slikt program innebærer er ikke eksakt definert, men de norske hjertesviktpoliklinikkene tilbyr en helhetlig tilnærming til pasienter med hjertesvikt, som er tenkt å oppfylle intensjonen i anbefalingen. Slik oppfølging har vist effekt på både sykehusinnleggelser og død i flere randomiserte studier (22-26). NHSR har gitt ut anbefalinger om innholdet i en hjertesviktpoliklinikk (3)
Bruk av resultatene fra NHSR NHSR kan bidra til å følge og systematisere data om behandlingen som blir gitt, og påpeke forbedringspotensialer. Bruken av ACE-hemmer og betablokker har hele veien vært på et svært høyt nivå ved hjertesviktpoliklinikkene, der 94-97% av pasientene med HFrEF har fått denne anbefalte behandlingen. Figur 1 viser imidlertid at kun 38% av pasientene fikk MRA tilbake i 2017, selv om gjeldene guidelines den gangen
Referanser
1. McDonagh TA, Metra M, Adamo M et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;42:35993726.
2. Rosano GMC, Seferovic P, Savarese G et al. Impact analysis of heart failure across European countries: an ESC-HFA position paper. ESC Heart Fail 2022;9:2767-2778.
3. Supplementfil. Årsrapport norsk hjertesviktregister 2022. https://wwwkvalitetsregistreno/register/hjerteog-karsykdommer/norsk-hjertesviktregister.
4. The CONSENSUS trial study group. Enalapril for congestive heart failure. NEJM 1988;317:1349-1351.
5. SOLVD Investigators, Yusuf S, Pitt B, Davis CE, Hood WB, JN C. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. NEJM 1991;325:293-302.
6. Garg R, S. Y. Overview of randomized trials of angiotensin-converting enzyme inhibitors on mortality and morbidity in patients with heart failure. Collaborative Group on ACE Inhibitor Trials. JAMA 1995;273:14501456.
7. Packer M, Poole-Wilson PA, et al. Comparative effects of low and high doses of the angiotensinconverting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. Circulation 1999;100:2312-2318.
8. MERIT-HF study groutp. Effect of metoprolol CR/ XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in-Congestive Heart Failure (MERIT-HF). The Lancet 1999;353:2001-2007.
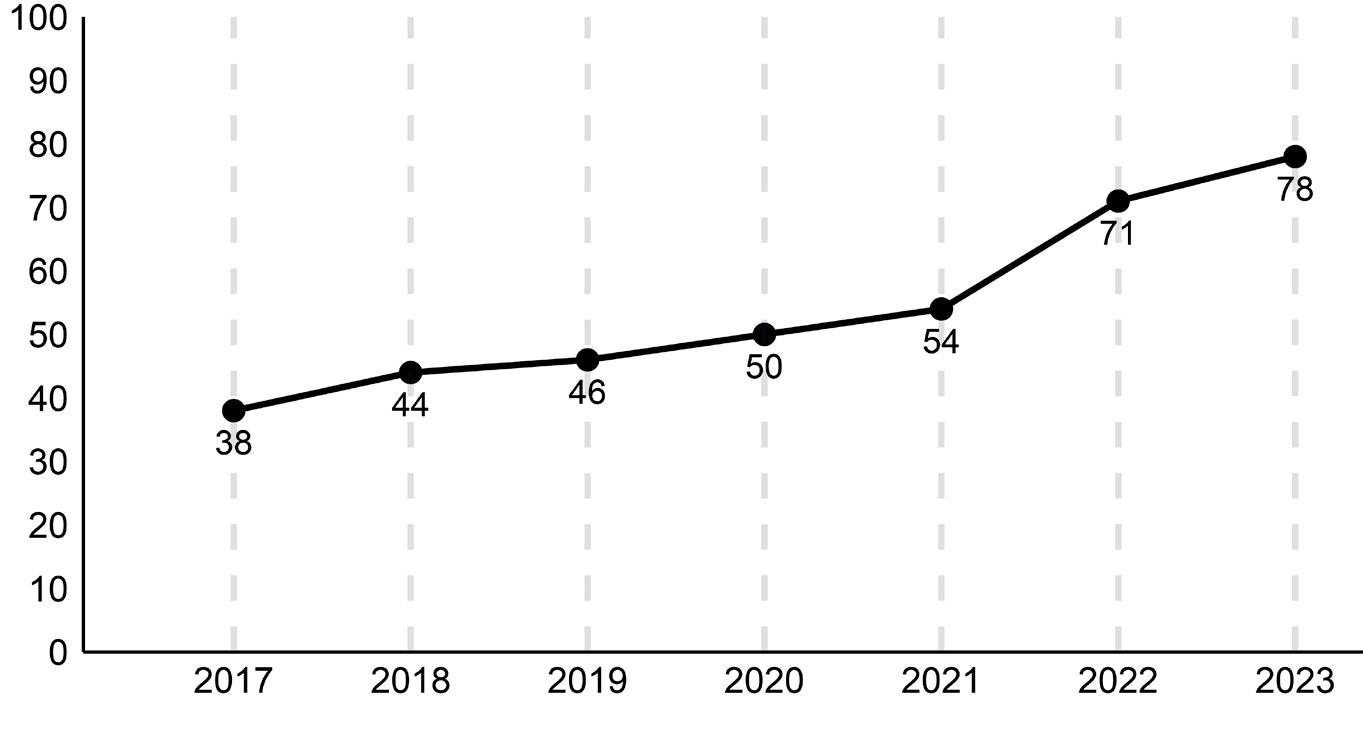
også hadde en IA-anbefaling om bruk av denne medikamentgruppen. Riktignok presiserte de eldre ESC Guidelines 2016 at ACE-hemmer og betablokker skulle startes og titreres opp først med EF ≥35% som grense, men en kunne med data fra registeret vise at svært mange som hadde indikasjon, ikke fikk denne behandlingen. Det var uklart hvorfor 1 av de 3 medikamentfamiliene som den gang hadde en sterk anbefaling ble brukt i så liten grad. NHSR satte i gang en serie tiltak som inkluderte presentasjon av studiene angående MRA på registerseminardager og informasjon per e-post. Resultatene ble også gjennomgått i Årsrapportene fra NHSR som blir sendt ut til alle hjertesviktpoliklinikkene. I etterkant har en observert en økning av andel pasienter som stod på MRA fra 38% i 2017 til 54 % i 2021. Siden nye ESC Guidelines ble publisert i august 2021, observerer NHSR en kraftig ytterligere økning slik at 78% nå mottar denne behandlingen. NHSR antar at denne økningen i bruk av MRA vil ha en betydelig effekt på antall sykehusinnleggelser og også mortalitet for denne gruppen (Figur 1).
Figur 2 viser bruken av SGLT2hemmere ved norske hjertesviktpoliklinikker. SGLT2-hemmere fikk en
IA anbefaling i de nye retningslinjene fra ESC som kom i august 2021. SGLT2-hemmere var registrert før de ble anbefalt brukt som ledd i behandling av hjertesvikt. NHSR hadde fokus på denne medikamentgruppen med en egen undervisningsrunde året før medikamentgruppen kom inn som anbefalt hjertesviktbehandling. Kurven viser en rask økning i bruken fra 2% (som nok i stor grad utelukkende var personer med diabetes) i 2020 til 85% i 2023.
Figur 3 viser andel pasienter med HFrEF som mottar alle de 4 medikament familiene ACE-hemmer, betablokker, MRA og SGLT2hemmer. Her har det har vært en kraftig økning fra 16% (i 2021 da ESC kom med sine nye retningslinjer) til 66% i 2023.
Konklusjon
NHSR mener disse funnene viser at et system med dedikerte hjertesviktpoliklinikker kan bidra til raskt å korrigere underbehandling og implementere ny behandling for pasienter med hjertesvikt som får oppfølging ved en hjertesviktpoliklinikk. NHSR oppdaterer resultater to ganger per år på nettsiden www.kvalitetsregistre.no.
9. Packer M, Bristow MR, Cohn JN, et al. The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. U.S. Carvedilol Heart Failure Study Group. NEJM 1996;334:1349-1355.
10. Packer M, Coats AJ, Fowler MB et al. Carvedilol Prospective Randomized Cumulative Survival Study Group. Effect of carvedilol on survival in severe chronic heart failure. NEJM 2001;344:1651-1658.
11. Hjalmarson A, Goldstein S, Fagerberg B et al. Effects of controlled-release metoprolol on total mortality, hospitalizations, and well-being in patients with heart failure: the Metoprolol CR/XL Randomized Intervention Trial in congestive heart failure (MERIT-HF). JAMA 2000;283:12951302.
12. Flather MD, Shibata MC, Coats AJ et al. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur Heart J 2005;26:215-25.
13. The Cardiac Insufficiency Bisoprolol Study II (CIBISII): a randomised trial. The Lancet 1999;353:9-13.
14. Pitt B, Zannad F, Remme WJ et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized Aldactone Evaluation Study Investigators. NEJM 1999;341:709717.
15. Zannad F, McMurray JJ, Krum H et al. EMPHASIS-HF Study Group. Eplerenone in Patients with Systolic Heart Failure and Mild Symptoms. NEJM 2011;364:1121.
16. McMurray JJV, Solomon SD, Inzucchi SE et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med 2019;381:1995-2008.
17. Packer M, Anker SD, Butler J et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med 2020;383:1413-1424.
18. McMurray JJ, Packer M, Desai AS et al. Angiotensinneprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993-1004.
19. Solomon SD, McMurray JJV, Claggett B et al. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med 2022;387:10891098.
20. Anker SD, Butler J, Filippatos G et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med 2021;385:1451-1461.
21. McDonagh TA, Metra M, Adamo M et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2023;44:3627-3639.
22. Jonkman NH, Westland H, Groenwold RH et al. What Are Effective Program Characteristics of SelfManagement Interventions in Patients With Heart Failure? An Individual Patient Data Meta-analysis. J Card Fail 2016;22:861-871.
23. Feltner C, Jones CD, Crystal W. Transitional care interventions to prevent readmissions for Persons With Heart Failure. A systematic review and meta-analysis. Annals of Internal Medicine 2014;160:774-792.
24. Blue L, Lang E, McMurray JJ, Davie AP. Randomised controlled trial of specialist nurse intervention in heart failure.pdf. BMJ 2001;323:715-718.
25. Lambrinou E, Kalogirou F, Lamnisos D, Sourtzi P. Effectiveness of heart failure management programmes with nurse-led discharge planning in reducing readmissions: a systematic review and meta-analysis. Int J Nurs Stud 2012;49:610-24.
26. Ekman I, Wolf A, Olsson LE, Taft C, et al. Effects of person-centred care in patients with chronic heart failure: the PCC-HF study. Eur Heart J 2012;33:1112-9.
12 Indremedisineren 1 • 2024
Fagartikkel
*
VISSTE DU AT
2430ahyperkalemi1
de regionale helseforetakene anbefaler Lokelma (NATRIUMZIRKONIUMSYKLOSILIKAT) som førstevalg i vedlikeholdsbehandlingen av hyperkalemi fra 1. jan 2024?1
korreksjonsfase
Anbefalt startdose:
10 g x 3 / dag*



til normokalemi er oppnådd
vedlikeholdsfase kronisk hemodialyse
Anbefalt startdose: Anbefalt startdose: NYHET RHFs1.valg1
5 g x 1 / dag*

5 g x 1 / dag*

med mulighet for justering på dager uten dialyse
LOKELMA - KALIUMBINDER INDISERT FOR BEHANDLING AV HYPERKALEMI HOS VOKSNE 2,3
Utvalgt sikkerhetsinformasjon: De vanligste bivirkningene er hypokalemi (4,1%) og ødemrelaterte hendelser (5,7%). Serumkaliumnivå bør monitoreres ved klinisk indikasjon også etter endring av legemidler som påvirker serumkaliumkonsentrasjonen (eks. ved RAASi eller diuretika) og etter at Lokelma-dosen er titrert. Monitoreringshyppighet vil avhenge av bl.a. andre legemidler, progresjon av kronisk nyresykdom og kaliuminntak i kosten. Ved alvorlig hypokalemi skal Lokelma seponeres og pasienten revurderes. Bruk under graviditet bør unngås.
LOKELMA (NATRIUMZIRKONIUMSYKLOSILIKAT) – VIKTIG INFORMASJON
Indikasjon: Behandling av hyperkalemi hos voksne.
Dosering: Korrigeringsfase: Anbefalt startdose er 10 g 3 ganger daglig. Når normokalemi er oppnådd bør vedlikeholdsdosering følges. Hvis normokalemi ikke oppnås etter 72 timer med behandling, bør andre behandlingsstrategier vurderes.
Vedlikeholdsfase: Når normokalemi er oppnådd, skal den laveste effektive dose fastsettes. Anbefalt startdose 5 g 1 gang daglig. Ved behov kan dosen titreres opp til 10 g en gang daglig, eller ned til 5 g annenhver dag. Vedlikeholdsdosen bør ikke overskride 10g en gang daglig. Kronisk hemodialyse: Lokelma skal kun gis på dager uten dialyse. Anbefalt startdose er 5 g en gang daglig. For å etablere normokalemi kan dosen titreres ukentlig opp eller ned, basert på predialytisk serum-kaliumnivå etter et langt interdialytisk intervall/LIDI. Dosen kan justeres med en ukes intervall, i trinn på 5 g, opp til en dose på 15 g en gang daglig på dager uten dialyse. Det anbefales å overvåke serum-kaliumnivå ukentlig under dosejustering. Administrering: Doseposens innhold blandes med ca. 45 ml vann, og væsken drikkes mens den ennå er uklar.
Refusjon: H-resept
Refusjonsberettiget bruk: Der det er utarbeidet nasjonale handlingsprogrammer/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. Vilkår: 216 Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist. Lokelma inngår i RHF anbefalinger til vedlikeholdsbehandling av hyperkalemi hos pasienter med kronisk nyresvikt eller hjertesvikt.
For legemidlene under skal denne rangeringen legges til grunn for de ulike doseringene:
1. valg: Natriumzirkoniumsiklosilikat (Lokelma, AZ) 5 g daglig / 10 g daglig
2. valg: Patiromersorbitekskalsium (Veltassa, Vifor) 8,4 g daglig / 16,8 g daglig
Der det foreligger en rangering, skal førstevalg benyttes i oppstart og medisinsk begrunnet endring av behandling. Vedtaket gjelder i perioden 01.01.2024 - 31.05.2026.
Pakninger og priser: 5 g 30 stk. (dosepose) kr. 3264,20; 10 g 30 stk. (dosepose) kr. 6492,10. Reseptgruppe C.
For fullstendig informasjon, les FK-tekst eller godkjent SPC på www.felleskatalogen.no for Lokelma. NO-11602-12-23-CVRM NO-11781-01-24-CVRM
www.astrazeneca.no
Referanser: 1. www.sykehusinnkjøp.no 2. Lokelma godkjent SPC pkt 4.1, 5.1 3. LOKELMA, godkjent SPC pkt. 4.1, 4.2
Hvis pasienten glemmer en dose, bør neste dose tas til planlagt tid Natriumzirkoniumsyklosilikat pulver til mikstur, suspensjon
 Oddvar Oppegaard
Oddvar Oppegaard
Streptococcus pyogenes
– en post-pandemisk bumerang
Streptococcus pyogenes forårsaker et bredt spekter av sykdomsmanifestasjoner, hvorav nekrotiserende bløtvevsinfeksjon er den mest fryktede. En sterk økning i antall alvorlige S. pyogenes-infeksjoner har blitt rapportert fra hele Europa siste året, men hva ligger bak dette oppsvinget? Og hvordan er situasjonen i Norge?
Oddvar Oppegaard, overlege dr.med., Infeksjonsavdelingen, Haukeland universitetssykehus og Universitetet i Bergen.
Mennesket og mikroben
Infeksjoner forårsaket av Streptococcus pyogenes (ofte omtalt som gruppe A streptokokk) er relativt vanlig i de fleste samfunn. Tonsillitt, peritonsillær abscess og post-partum feber ble beskrevet allerede i den 2500 år gamle medisinske læreboken Corpus Hippocraticum, og indikerer at vi har hatt en langvarig sameksistens med denne mikroben (1).
S. pyogenes utviser dog varierende grad av patogenisitet. Asymptomatisk bærerskap i halsen er tross alt den vanligste formen for sameksistens, og forekommer hos 10 - 20 % av barn i skolealder og blant 1 – 5 % av friske voksne (2). En del utvikler imidlertid symptomatisk infeksjon, hovedsakelig i form av tonsillitt, otitt eller impetigo (3). Tidvis sirkulerer også stammer som gir opphav til skarlagensfeber.
Langt sjeldnere utvikles mer alvorlige tilstander som medfører sykehusinnleggelse, herunder erysipelas (ca. 25 %), luftveisinfeksjoner (ca. 15 %), postpartum infeksjoner (ca. 10 %), eller bein- og leddinfeksjoner (ca. 10 %) (4). Nekrotiserende bløtvevsinfeksjoner er kanskje den mest dramatiske presentasjonsformen, og utgjør i Norge ca. 5 – 20 % av invasive S. pyogenes-infeksjoner (4, 5). Denne tilstanden har en dødelighet på 10 – 20 % selv ved moderne behandlingsmuligheter, og ytterligere 10 - 20 % gjennomgår amputasjon i kurativ intensjon (6, 7).
Til forskjell fra mange andre bakterielle species, kan S. pyogenes forårsake alvorlig invasiv sykdom hos tilsynelatende friske individer, inkludert barn og gravide (8). Globalt er det estimert at S. pyogenes forårsaker en halv million dødsfall årlig, og en stor andel av disse hos

yngre individer (3). God kunnskap om epidemiologi, diagnostikk og behandling er viktig for å bedre prognosen ved S. pyogenes infeksjoner.
Epidemiologiske drivkrefter Transmisjon av S. pyogenes foregår hovedsakelig ved dråpe- og kontaktsmitte, og epidemiologisk overvåkning utbrudd i skoleklasser har dokumentert kolonisering av opptil 50 % av elevene i løpet av et par uker (9). Tilsvarende transmisjonsrater og utbrudd har vært beskrevet i en rekke militærleirer (10). Trangboddhet og sosial interaksjon er tilsynelatende sterke drivkrefter for spredning av mikroben. Dette understøttes også av at S. pyogenes, i likhet med de fleste luftveisvirus, har en tydelig sesongvariasjon med en topp i det kalde vinterhalvåret (5). Enkelte mener sågar at det foreligger en synergisme mellom virale luftveisagens og S. pyogenes, og at både ko-smitte og ko-infeksjon påvirker sykdomsforekomsten (11).
I enkelte år har det dessuten vært observert en kraftig stigning i antall sykdomstilfeller. Slike utbrudd relateres ofte til spredning av nye genetiske varianter av S. pyogenes som omgår flokkimmuniteten i vertspopulasjonen (12). Etter hvert som befolkningen eksponeres for en slik ny variant vil flokkimmuniteten gradvis øke, og disse utbruddene klinger gjerne av i løpet av et par år.
Forekomsten av S. pyogenes infeksjoner i samfunnet fluktuerer således kontinuerlig, basert på samspillet mellom evolusjon i mikroben, potensiale for smittespredning og immuniteten i befolkningen.
14 Indremedisineren 1 • 2024 Fagartikkel
Figur 1. Pasient med nekrotiserende fasciitt forårsaket av S. pyogenes. Typiske hudforandringer ved nekrotiserende fasciitt er raskt progredierende rubor med diffus avgrensning. Kirurgi med fjerning av affisert vev er nødvendig for kurasjon.
Dagens situasjon
Våren 2023 kom det flere presseoppslag om en overhyppighet av streptokokk-relaterte nekrotiserende bløtvevsinfeksjoner i Stavangerregionen, inkludert enkelttilfeller med fatalt utkomme. Men Stavangerregionen var ikke unike i så måte. Allerede høsten 2022 kom de første rapportene fra kontinentet om økt forekomst av alvorlige S. pyogenes-infeksjoner, inkludert nekrotiserende bløtvevsinfeksjoner (13). Tilsvarende observasjoner har senere blitt bekreftet fra de fleste land i Europa, og nasjonale tall fra MSIS viser en tydelig overhyppighet av alvorlige S. pyogenes-infeksjoner i 2023 sammenliknet med foregående år, jf. figur 2 (5, 14, 15, 16).
Estimering av forekomst basert på rapportering fra klinikere, som ved MSIS, er sårbart for rapporteringsbias. Med økt fokus og oppmerksomhet rundt tilstanden vil flere klinikere tendere til å rapportere nye tilfeller. Men er den observerte S. pyogenes-epidemien bare en storm i et vannglass? I Danmark er det etablert en felles nasjonal database for alle dyrkningspositive prøver ved landets mikrobiologiske avdelinger. Der finner de en klar økning i antall dyrkningspositive invasive S. pyogenes tilfeller (vekst i blodkultur, spinalvæske eller annen steril lokalisasjon), men også i antallet non-invasive tilfeller (14). Økningen synes således å være reell.
Noe overraskende er økningen av invasive S. pyogenes tilfeller mest uttalt blant de minste barna. I Nederland fant man 42 tilfeller av nekrotiserende bløtvevsinfeksjoner og/eller streptokokk toksisk sjokk-syndrom blant barn < 5 år i 2022, mot normalt 5 – 10 tilfeller per år (13). I Skottland observerte man en dobling av antall tilfeller av empyem forårsaket av S. pyogenes blant barn (15). Også her til lands er det de yngste som står for den mest markante økningen av S. pyogenes-infeksjoner, jf. figur 3.
Hvorfor ble det slik?
Årsaken er sannsynligvis, som alltid, multifaktoriell.
Immunologisk gjeld?
Mye kan diskuteres om de enkelte smitteverntiltakenes treffsikkerhet
Figur 2.
S. pyogenes-infeksjoner meldt til MSIS. Antallet invasive infeksjoner forårsaket av S. pneumoniae, H. influenzae og S. pyogenes var markant redusert under perioden med Covidrestriksjoner (markert rosa). De to førstnevnte har returnert til vanlig epidemiologisk forekomst, mens S. pyogenes infeksjoner er langt hyppigere enn normalt i post-pandemisk fase. Kriterier for melding til MSIS er systemisk infeksjonssykdom med laboratoriepåvisning av S. pyogenes fra normalt sterilt prøvemateriale ved isolering, nukleinsyre- eller antigenundersøkelse.
Figur 3. Alderfordeling av invasive S. pyogenes-infeksjoner meldt til MSIS. Antallet tilfeller av invasive S. pyogenes-infeksjoner meldt til MSIS i 2023 var høyere enn vanlig, spesielt for aldergruppen 0 – 9 år. X-aksen representerer antall tilfeller. Året 2023 er markert med skravert areal.
under Covid-19-pandemien, men det er ikke tvil om at de samlet sett reduserte transmisjonen av Sars-CoV-2-viruset. En bivirkning av smitteverntiltakene var en kraftig reduksjon også i smittespredning av mange andre luftveispatogener, inkludert Haemophilus influenzae, Streptococcus pneumoniae og S. pyogenes, jf. figur 2.
Tall fra Centers for Disease Control and Prevention (CDC) i USA viser at den største nedgangen i antall invasive S. pyogenes infeksjoner under pandemien ble observert
nettopp hos de yngste, med opptil 80 % lavere forekomst enn forventet i 2020 (17). Men sparte vi oss for disse infeksjonene, eller bare utsatte vi dem?
Enkelte mener Covid-19-pandemiens smitteverntiltak satte oss i en immunologisk gjeld (18). Når transmisjonen av S. pyogenes ble redusert var det mange barn som ble snytt for sitt første møte med mikroben, noe som trolig påvirket den generelle immuniteten i denne aldersgruppen. Når restriksjonene senere ble opphevet var antallet immunologisk
15 Indremedisineren 1 • 2024 Fagartikkel
0 100 200 300 400 500 600 700 2015 2016 2017 2018 2019 2020 2021 2022 2023 Antall tilfeller S. pyogenes H. influenzae S. pneumoniae 0 5 10 15 20 25 JanuarFebruar Mars April Mai Juni JuliAugustSeptemberOktoberNovemberDesember 0 - 9 år 0 5 10 15 20 25 JanuarFebruar Mars April Mai Juni JuliAugustSeptemberOktoberNovemberDesember 10 - 39 år 0 5 10 15 20 25 JanuarFebruar Mars April Mai Juni JuliAugustSeptemberOktoberNovemberDesember 40 - 69 år 0 5 10 15 20 25 JanuarFebruar Mars April Mai Juni JuliAugustSeptemberOktoberNovemberDesember ≥ 70 år 2015 2016 2017 2018 2019 2020 2021 2022 2023 ÅR
Invasive
Fagartikkel
Referanser
1 Pappas G, Kiriaze IJ, Falagas ME. «Insights into infectious disease in the era of Hippocrates». Int J Infect Dis. 2008 Jul;12(4):347-50
2 Gunnarson RK, Holm SE, Søderstrøm M. «The prevalence of beta-haemolytic streptococci in throat specimens from healthy children and adults. Implications for the clinical value of throat cultures». Scand J Prim Health Care. 1997 Sep;15(3):149-55.
3 Carapetis JR, Steer AC, Mulholland EK et al. «The global burden of group A streptococcal diseases». Lancet Infect Dis. 2005 Nov;5(11):685-94.
4 Oppegaard O, Mylvaganam H, Kittang BR. «Beta-haemolytic group A, C and G streptococcal infections in Western Norway: a 15-year retrospective survey». Clin Microbiol Infect. 2015 Feb;21(2):171-8.
5 www.MSIS.no
6 Bruun T, Rath E, Madsen MB et al. «Risk Factors and Predictors of Mortality in Streptococcal Necrotizing Soft-tissue Infections: A Multicenter Prospective Study». Clin Infect Dis. 2021 Jan 27;72(2):293-300.
7 Bruun T, Kittang BR, de Hoog BJ et al. «Necrotizing soft tissue infections caused by Streptococcus pyogenes and Streptococcus dysgalactiae subsp. equisimilis of groups C and G in western Norway». Clin Microbiol Infect. 2013 Dec;19(12):E545-50.
8 Sherwood E, Vergnano S, Kakuchi I et al. «Invasive group A streptococcal disease in pregnant women and young children: a systematic review and meta-analysis». Lancet Infect Dis. 2022 Jul;22(7):10761088.
9 Cordery R, Purba AK, Begum L et al. «Frequency of transmission, asymptomatic shedding, and airborne spread of Streptococcus pyogenes in schoolchildren exposed to scarlet fever: a prospective, longitudinal, multicohort, molecular epidemiological, contact-tracing study in England, UK». Lancet Microbe. 2022 May;3(5):e366-e375.
10 Crum NF, Russell KL, Kaplan EL et al. «Pneumonia outbreak associated with group a Streptococcus species at a military training facility». Clin Infect Dis. 2005 Feb 15;40(4):511-8.
11 Turner CE. «Can group A streptococcus infections be influenced by viruses in the respiratory tract?». Lancet Infect Dis. 2023 Feb;23(2):142-144.
12 Colman G, Tanna A, Efstratiou A et al. «The serotypes of Streptococcus pyogenes present in Britain during 1980-1990 and their association with disease». J Med Microbiol. 1993 Sep;39(3):165-78.
13 de Gier B, Marchal N, de Beer-Schuurman I et al. «Increase in invasive group A streptococcal (Streptococcus pyogenes) infections (iGAS) in young children in the Netherlands, 2022». Euro Surveill. 2023 Jan;28(1):2200941.
14 Johannesen TB, Munkstrup C, Edslev SM. «Increase in invasive group A streptococcal infections and emergence of novel, rapidly expanding sub-lineage of the virulent Streptococcus pyogenes M1 clone, Denmark, 2023». Euro Surveill. 2023 Jun;28(26):2300291.
15 Davies PJB, Russell CD, Morgan AR et al. «Increase of Severe Pulmonary Infections in Adults Caused by M1UK Streptococcus pyogenes, Central Scotland, UK».
16 Lassoued Y, Assad Z, Ouldali N et al. «Unexpected Increase in Invasive Group A Streptococcal Infections in Children After Respiratory Viruses Outbreak in France: A 15-Year Time-Series Analysis». Open Forum Infect Dis. 2023 Apr 6;10(5):ofad188.
17 CDC (cdc.gov/abcs/reports-findings/ data-2020.html)
18 Burrell R, Saravanos G, Britton PN. «Unintended impacts of COVID-19 on the epidemiology and burden of paediatric respiratory infections». Paediatr Respir Rev. 2023 Aug 3:S1526-0542(23)00044-1.
19 Lynskey NN, Jauneikaite E, Li HK et al. «Emergence of dominant toxigenic M1T1 Streptococcus pyogenes clone during increased scarlet fever activity in England: a population-based molecular epidemiological study». Lancet Infect Dis. 2019 Nov;19(11):1209-1218.
20 Bulger EM, May AK, Robinson BRH et al. «A Novel Immune Modulator for Patients With Necrotizing Soft Tissue Infections (NSTI): Results of a Multicenter, Phase 3 Randomized Controlled Trial of Reltecimod (AB 103)». Ann Surg. 2020 Sep 1;272(3):469-478.
naive barn langt høyere enn i et normalår. Sammenholdt med den utbredte transmisjonen vi vet kan forkomme i denne populasjonen, kan man se for seg at dette kan ha bidratt til en slags bumerang-effekt i forekomsten av S. pyogenesinfeksjoner.
Men hvorfor ser vi ikke en tilsvarende rekyl i forekomsten av H. influenzae og S. pneumoniae, jf. figur 2? De synes kun å ha returnert til sin vanlige forekomst uten noen overhyppighet. Vi er igjen overlatt til spekulasjoner. Kanskje har det virket forebyggende at disse luftveispatogenene inngår i barnevaksinasjonsprogrammet, og at barnepopulasjonen således ikke var immunologisk naive på samme måte.
Økning i ko-smitte og ko-infeksjon?
Forekomsten av flere luftveisvirus har vært redusert under pandemien, og kan potensielt komme tilbake med økt styrke i post-pandemisk fase. Enkelte har tatt til orde for at den observerte økningen i S. pyogenes-infeksjoner til dels kan skyldes en synergistisk effekt med økt forekomst av virale luftveisinfeksjoner.
I en studie fra Frankrike fant de at 60 % av barn med invasive S. pyogenes infeksjoner, hadde fått påvist ko-infeksjon med et luftveisvirus ved ankomst sykehus, inkludert 24 av 24 barn med empyem (16). Tilsvarende funn ble rapportert fra Skottland (15). Ingen av disse studiene var imidlertid designet for å vurdere kausalitet, og betydningen av disse funnene er således usikre. Det er heller ikke dokumentert en relasjon til spesifikke virus, snarere en samvariasjon med diverse luftveisvirus.
Evolusjon i mikroben? Like før covid-19-pandemien brøt ut, ble en ny virulent S. pyogenes variant (M1UK) påvist i Storbritannia (19).
M1UK hadde økt produksjon av toksiner, og var assosiert med utbrudd av skarlagensfeber. Spredning til flere land ble påvist, men den fikk sin seiersgang avbrutt av pandemiske smitteverntiltak.
Genetisk karakterisering av invasive S. pyogenes-stammer i post-pandemisk fase har ikke gitt entydige holdepunkter for at den økte forekomsten av invasive infeksjoner skyldes et klonalt utbrudd av en ny og virulent stamme (13, 14, 16). Hovedtyngden av infeksjonene i mange regioner forårsakes likevel av M1UK-stammer. I en studie av alvorlige S. pyogenes lungeinfeksjoner i Skottland ble det dokumentert at 95 % av tilfellene var forårsaket av M1UK (15). Det er derfor ikke usannsynlig at manglende flokkimmunitet mot denne relativt nye genetiske varianten kan ha bidratt til å potensere den pågående S. pyogenes epidemien.
Hva vil skje videre?
Den epidemiologiske balansen mellom mikrobiell evolusjon og flokkimmunitet vil etter all sannsynlighet snart gjenvinne ekvilibrium for S. pyogenes, og høstens tall fra MSIS indikerer nettopp en slik utvikling (5). Utbruddet understreker dog nytten av epidemiologisk årvåkenhet og internasjonalt samarbeid. Nedbyggingen av FHIs kapasitet til genetisk karakterisering av sirkulerende invasive S. pyogenes-stammer er i så måte et steg i feil retning, og vil vanskeliggjøre fortolkning av den epidemiologiske situasjonen.
Barnepopulasjonen synes å utgjøre den epidemiologiske motoren i S. pyogenes transmisjon, og de rammes også av alvorlige sykdomsmanifestasjoner. Utvikling av vaksiner for pneumokokker og Haemophilus influenzae har hatt betydelig suksess når det gjelder reduksjon av invasiv sykdom hos barn, i tillegg til
en sekundær gevinst blant eldre. En S. pyogenes-vaksine ville således være et svært nyttig forebyggende tiltak, spesielt i et internasjonalt perspektiv. Slike vaksiner har vært under utvikling i mer enn 20 år, men har fortsatt ikke nådd fase 3 for kliniske utprøvingsstudier. Veien frem synes derfor fortsatt lang.
Det aktuelle utbruddet synliggjør også viktigheten av å ha god beredskap for diagnostikk og behandling av de mest alvorlige sykdomsmanifestasjonene forårsaket av S. pyogenes, kanskje spesielt nekrotiserende bløtvevsinfeksjoner. Slike infeksjoner er sjeldne, men rask og riktig behandling er avgjørende for pasientens utkomme. Selv med optimal antibakteriell og kirurgisk behandling er mortalitet og morbiditet fremdeles høy. Det er således et stort behov for kliniske studier på nye behandlingsmodaliteter for nekrotiserende bløtvevsinfeksjoner. Nylig viste dog en randomisert studie at immunmodulerende behandling med CD28-hemmeren Reltecimod kortet ned tid til klinisk bedring (20). Kanskje er tiden kommet for utvikling av en enda mer persontilpasset behandlingsstrategi for denne pasientkohorten?
Det pågår allerede norske initiativ til utvikling av randomiserte behandlingsstudier med immunblokkere ved nekrotiserende bløtdelsinfeksjon forårsaket av S. pyogenes (permedinfect.com). Antall tilfeller per behandlingssenter er imidlertid lavt, og skal vi få dette til er vi avhengige av omfattende samarbeid nasjonalt.
Uansett er én ting sikkert –bumerangen S. pyogenes kommer alltid tilbake.
16 Indremedisineren 1 • 2024

WWW. WCIM2024 .COM WCIM2024 WCIM 2024 WCIM2024 @WCIM2024 wcim2024 FOLLOW US WORLD CONGRESS OF INTERNAL MEDICINE THE CAPITAL CITY OF INTERNAL MEDICINE CONGRESS SECRETARIAT GUARANT International Českomoravská 19, 190 00 Prague 9 Czech Republic Phone: +420 284 001 444 E-mail: wcim2024@guarant.cz WEBSITE: www.wcim2024.com REGISTER NOW AND SAVE! Early Bird registration until 15 July 2024 DON´T FORGET TO SUBMIT YOUR ABSTRACT! The abstract submission deadline is 31 May 2024 PROGRAMME


Samval – korleis kan det integrerast i klinisk praksis?
Samval har i fleire år vore det rådande idealet for kliniske avgjersler, og er også eit læringsmål for legar i spesialisering. Likevel kan det vere vanskeleg å få til i praksis. Implementeringsforsking kan vere ein måte å skreddarsy tiltak for ulike fagområde.
Silje Orstad, lege i spesialisering i lungemedisin, Haukeland Universitetssjukehus Margrethe Aase Schaufel, overlege ved Lungeavdelinga, Haukeland Universitetssjukehus
Bakgrunn
Nasjonal helse- og sjukehusplan stadfestar at samval (shared decision-making) skal vere ein etablert standard i helsetenesta, slik at pasienten deltar aktivt ved val av undersøkingar og behandling (1). Samval inneber ein strukturert kommunikasjon mellom helsepersonell og pasient for å ta informerte og verdibaserte val når det eksisterer ulike alternativ (2, 3). Det å avstå frå behandling, eller vente og sjå, er også viktig å ta med som moglegheit (4). Hovudmålet er å sikre at pasienten har forstått og tenkt gjennom konsekvensane av den medisinske behandlinga, og at avgjersla er i tråd med det som er viktigast for pasienten og eventuelt pårørande (5). Det er forskjellige måtar å operasjonalisere dette på i klinisk praksis (5, 6). Figur 1 illustrerer dei ulike stega i ein helsepersonell-pasient-samtale der det skal takast eit val (sjå figur 1). Tre spørsmål bør vere drøfta i samtalen (7, 8):
- Kva behandlingsalternativ finst?
- Kva er moglege fordelar og ulemper ved desse alternativa?
- Kor truleg er det at pasienten vil oppleve desse fordelane og ulempene?
Tiltak for å fremje samval Helsedirektoratet har vedtatt eit eige læringsmål for at alle legar i spesialisering «selvstendig skal kunne gjennomføre en god beslutningsprosess om behandlingsalternativer sammen med pasienten (samvalg)», FKM LM-33 (9). Dei ulike helseforetaka har sett i verk opplæring av tilsette og utarbeidd pasientinformasjon som skal bidra til samval (10, 11). Samvalsreiskapar som skildrar
behandlings alternativ, evidens, fordelar og ulemper er utvikla for ei rekkje tilstandar, og kan betre pasienten sin kunnskap, risikoforståing og at avgjersla samsvarer med pasienten sine verdiar (12, 13). Slike samvalsreiskapar kan nyttast både før, under og etter ein konsultasjon. Samvalgssenteret ved Universitetssykehuset i Nord-Norge har hatt ei nøkkelrolle i utvikling av samvalsreiskapar for norske pasientar, som ligg tilgjengeleg på HelseNorge.no (14). Samvalgssenteret bistår også med opplæring og implementering av samval i ulike institusjonar (4).
Utfordringar
Trass både politiske føringar og mangfaldige tiltak, har det vist seg at samval er vanskeleg å integrere i klinisk praksis (15, 16). Utfordringane omfattar mellom anna haldningar hjå helsepersonell som meiner at pasientane allereie er involvert i tilstrekkeleg grad og ikkje ønskjer samval, at ein manglar gode reiskapar og at ein har mange andre krav og konkurrerande prioriteringar. Gode kommunikasjonsferdigheiter er viktige for å engasjere pasienten i avgjersler, og det kan vere vanskeleg å finne tid til kommunikasjonstrening i ein travel klinisk kvardag. Det er også uvisse knytta til kva for intervensjonar som kan vere effektive for å betre grad av samval (17). Alvorleg sjukdom, der eksistensielle aspekt gjer seg gjeldande på ein særskilt måte, kan svekke autonom kapasitet og adekvat informasjonsutveksling (18).
Samval ved avansert lungekreft Tilrådd behandling ved lungekreft er grundig skildra i eit nasjonalt handlingsprogram som kontinuerleg opp -
daterast i tråd med nye tilgjengelege medikament og øvrige behandlingsmodalitetar (19). Pasientar med nydiagnostisert, avansert lungekreft vil få tilbod om ulike behandlingslinjer utifrå molekylærpatologiske analysar av tumorvev. Ved førstelinjesbehandling vil det normalt sett vere ein definert behandlingsplan og ikkje val mellom ulike, sidestilte alternativ. Val kan oppstå om å inkluderast i ein klinisk studie, eller å avstå frå behandling, men som hovudregel er det liten tvil om kva som er det beste alternativet utifrå gjeldande retningslinjer. Ved progresjon av sjukdomen og fallerande allmenntilstand, kan det vere stor uvisse kring kva som er den beste avgjersla, og dette vil avhenge av pasienten sine verdiar og preferansar. Per i dag eksisterer det ingen etablerte, tilgjengelege samvalsreiskapar for lungekreftbehandling ved uhelbredeleg sjukdom, sjølv om det har vore forska på i over 20 år (20, 21).
Implementeringsforsking
Implementeringsforsking undersøkjer føresetnadar og erfaringar knytta til implementering av ein spesifikk intervensjon i ein kontekst (22). Målsetjinga er å forstå korleis intervensjonar fungerer i den “verkelege verda” og teste tilnærmingar til å betre dei ved å evaluere om intervensjonen er gjennomførbar, akseptabel, passande og berekraftig. Vi ønska å gjennomføre ein studie for å identifisere kva for avgjerdsstøtte pasientar med avansert lungekreft, deira pårørande og helsepersonell rapporterte behov for ved progresjon av sjukdomen, utforme ein intervensjon i tråd med dette og teste den ut i eit implementeringsdesign
18 Indremedisineren 1 • 2024 Fagartikkel
Silje Orstad
Margrethe Aase Schaufel
i Helse Vest (23). Funna så langt viser følgande:
- Kontinuitet i helsepersonellpasient-forholdet er grunnleggande for å sikre best mogleg avgjersler
- Barrierer for informasjonsutveksling omfattar vanskar med å formidle tilpassa, forståeleg informasjon ved uhelbredeleg sjukdom
- Både pasientar og legar opplever å måtte inngå kompromiss med tanke på kva dei ser på som det beste valet
Referanser
1 Meld. St. 7 (2019–2020). Nasjonal helse- og sykehusplan 2020–2023. Meld. St. 7 (2019–2020)regjeringen.no
2 Charles C, Gafni A, Whelan T. Shared decisionmaking in the medical encounter: what does it mean? (or it takes at least two to tango). Soc Sci Med. 1997 Mar;44(5):681-92.
3 Kienlin S, Eiring Ø, Kasper J. Samvalg. Michael 2020; 17: Supplement 24; 127–43.
4 Samvalgssenteret, Universitetssykehuset i NordNorge. Samvalgsveiviseren
5 Elwyn G, Frosch D, Thomson R, et al. Shared decision making: a model for clinical practice . Journal of general internal medicine. 2012;27(10):1361-7.
6 Stiggelbout AM, Pieterse AH, De Haes JC. Shared decision making: Concepts, evidence, and practice. Patient Educ Couns. 2015 Oct;98(10):1172-9. doi: 10.1016/j.pec.2015.06.022. Epub 2015 Jul 15
7 Folkehelseinstituttet. Samvalg - FHI
8 Shepherd HL, Barratt A, Trevena LJ et al. Three questions that patients can ask to improve the quality of information physicians give about treatment options: A cross-over trial. Patient Educ Couns. 2011 Sep;84(3):379-85.doi: 10.1016/j.pec.2011.07.022. Epub 2011 Aug 9.
9 Helsedirektoratet. Felles kompetansemål - Helsedirektoratet.
10 Universitetssykehuset Nord-Norge. Samvalg - Uni-
- I møte med stor uvisse om kva som er best behandling, vil betre risikovurdering av biverknader vere til hjelp
Ein samvalsreiskap som kan møte desse utfordringane, vil vere vanskeleg å utforme. Vi har utforma ein intervensjon som inneber skreddar sydd kommunikasjonstrening for helsepersonell og skrøpelegheitsvurdering før vurdering av kreftbehandling ved progresjon.
versitetssykehuset Nord-Norge (unn.no)
11 Helse Sør-Øst. Samvalg - Helse Sør-Øst RHF (helsesorost.no)
12 Stacey D, Légaré F, Lewis K, et al: Decision aids for people facing health treatment or screening decisions. Cochrane Database Syst Rev. 2017 Apr 12;4(4):CD001431. doi: 10.1002/14651858.CD001431. pub5.
13 McAlpine K, Lewis KB, Trevena LJ, et al: What Is the Effectiveness of Patient Decision Aids for CancerRelated Decisions? A Systematic Review Subanalysis. JCO Clin Cancer Inform. 2018 Dec:2:1-13. doi: 10.1200/CCI.17.00148.
14 Norsk Helsenett. Samvalg – du kan være med og bestemme - helsenorge.no
15 Joseph-Williams N, Lloyd A, Edwards A, et al: Implementing shared decision making in the NHS: lessons from the MAGIC programme. BMJ. 2017 Apr 18:357:j1744. doi: 10.1136/bmj.j1744.
16 Ankolekar A, Dekker A, Fijten R, et al: The Benefits and Challenges of Using Patient Decision Aids to Support Shared Decision Making in Health Care. JCO Clin Cancer Inform. 2018 Dec:2:1-10. doi: 10.1200/ CCI.18.00013.
17 Légaré F, Adekpedjou F, Stacey D, et al. Interventions for increasing the use of shared decision making by healthcare professionals. Cochrane Database Syst Rev. 2018 Jul 19;7(7):CD006732. doi: 10.1002/14651858.CD006732.pub4.
Konklusjon
Samval er det rådande idealet for kliniske avgjersler, men kan vere vanskeleg å gjennomføre i klinisk praksis. Implementeringsforsking kan bidra til å avdekke utfordringar i ulike fagområde og utforme intervensjonar som kan fremje samval.
18 Gulbrandsen P, Clayman ML, Beach MC, et al. Shared decision-making as an existential journey: Aiming for restored autonomous capacity. Patient Educ Couns. 2016 Sep;99(9):1505-10. doi: 10.1016/j. pec.2016.07.014. Epub 2016 Jul 7.
19 Helsedirektoratet. Nasjonalt handlingsprogram med retningslinjer for diagnostikk, behandling og oppfølging av lungekreft, mesoteliom og thymom, Nasjonalt handlingsprogram for lungekreft, mesoteliom og thymom (nlcg.no)
20 Fiset V, O’Connor AM, Evans W, et al: Development and evaluation of a decision aid for patients with stage IV non-small cell lung cancer. Health Expect. 2000 Jun;3(2):125-136. doi: 10.1046/j.13696513.2000.00067.x.
21 Spronk I, Meijers MC, Heins MJ, et al: Availability and effectiveness of decision aids for supporting shared decision making in patients with advanced colorectal and lung cancer: Results from a systematic review. Eur J Cancer Care (Engl). 2019. May;28(3):e13079.doi: 10.1111/ecc.13079. Epub 2019 May 8.
22 Peters DH, Adam T, Alonge O, et al. Implementation research: what it is and how to do it. BMJ 2013; Nov 20;347:f6753. 23 Orstad S, Fløtten Ø, Madebo M et al. “The challenge is the complexity” - A qualitative study about decision-making in advanced lung cancer treatment. Lung Cancer. 2023 Sep;183:107312. doi: 10.1016/j. lungcan.2023.107312. Epub 2023 Jul 20.
19 Indremedisineren 1 • 2024 Fagartikkel
Figur 1. Seks steg til samval. Samvalgssenteret, UNN.
Delirium og demens - hvordan virker disse
tilstandene på hverandre?
Demens er den sterkeste risikofaktoren for å utvikle delirium ved akutt sykdom eller skade. Da symptomer på delirium og demens er delvis overlappende, kan delirium være krevende å diagnostisere ved kjent demens. I motsetning til demens anses delirium som en reversibel tilstand, men nye studier indikerer at delirium er farlig for hjernen, og assosiert med økt risiko for kognitiv svikt og demens. I denne artikkelen gis det noen praktiske råd innen diagnostikk av delirium ved kjent demens (engelsk: delirium superimposed on dementia), og ny forskning vedrørende delirium sin påvirkning på videre kognitiv funksjon gjennomgås.

Kognitiv svikt
Vår evne til å tenke, løse problemer, sanse og lære, sammenfattes i begrepet kognitive funksjoner. Folk flest, men også mange helsepersonell, forbinder ofte kognitiv svikt med svekket hukommelse alene. Da kognisjon omhandler mer enn bare vår evne til å huske, medfører kognitiv svikt en stor variasjon av symptomer. Demens er en fellesbetegnelse på ulike hjernesykdommer som resulterer i en kronisk kognitiv svikt i en slik grad at den påvirker daglig funksjonsevne (1). Da ulike demenssykdommer oppstår i ulike områder av hjernen vil man, gjennom kognitiv testing, ofte kunne skille demenssykdommer fra hverandre ut fra hvilke kognitive funksjoner pasienten har utfall i. Eksempelvis vil enkelte demenssykdommer som oppstår frontalt kunne debutere med språkforstyrrelser, men pasienten har ofte bevart hukommelse i sykdommens tidlige fase (2). Den hyppigst forekommende demenssykdommen, Alzheimers sykdom, oppstår medialt i temporallappen (3), i hjerneområder som er nødvendige for innlæring. Tidlige symptomer hos pasienter med Alzheimers sykdom er derfor redusert hukommelse, især for nyere data. De fleste demenssykdommer har en snikende debut og er gradvis progredierende. Når flere områder av hjernen rammes, vil pasientene utvikle en mer global kognitiv svikt. Før diagnosen demens kan stilles må symptomene ha vart i 6 måneder eller mer (1).
Delirium defineres som en akutt oppstått kognitiv svikt, med debut i løpet av noen få minutter til dager. Den kognitive svikten ved delirium rammer ofte flere kognitive funksjoner samtidig og symptomene svinger ofte gjennom døgnet. Pasientene kan være både desorienterte og ha persepsjonsforstyrrelser, men kjernesymptomene ved delirium er svekket oppmerksomhet og endret bevissthetsnivå (4). I motsetning til ved demens, er delirium kun et symptom på en annen akutt tilstand, slik som akutt sykdom, legemiddelbivirkning eller skade, og ofte er utløsende årsak til delirium en eller flere tilstander utenfor hjernen.
Forekomst av delirium hos personer med demens
Forekomsten av delirium avhenger av hvilken populasjon man studerer. Årsaken til dette er at risikoen for delirium er en konsekvens av to faktorer; forekomsten av disponerende faktorer for delirium i aktuelle populasjon, og alvorligheten av den utløsende sykdom/hendelse (5). De viktigste disponerende faktorer for delirium er høy alder og demens. I tillegg vil sansesvikt, polyfarmasi, redusert fysisk funksjonsevne og tilstedeværelse av flere kroniske sykdommer, gjøre pasienter mer utsatt for utvikling av delirium. Å ha flere disponerende faktorer for delirium, som å være gammel og lide av demens, vil ikke i seg selv utløse delirium, men en akutt hendelse/ sykdom/skade må til. Hyppige triggere av delirium er infeksjoner,
frakturer, hjerneslag, akutt forverring av kroniske sykdommer og medikamenter. Enhver akutt sykdom eller skade kan i teorien utløse et delirium, men jo flere disponerende faktorer pasienter har, jo mindre alvorlig stressor skal til. Dette er årsaken til at man blant sykehjemspasienter, en gruppe med høy alder og hvor omtrent 80 % lider av demens, ser at 60 % av pasientene utvikler delirium ved akutt sykdom, og selv mindre alvorlige akutte hendelser kan utløse delirium (6). Blant pasienter med demens innlagt på sykehus har 30-60 % av pasientene delirium (7).
Symptomer og diagnostikk av delirium hos pasienter med kjent demens
En rekke symptomer ved demens overlapper med symptomer ved delirium, og dette medfører at å diagnostisere delirium hos pasienter med kjent demens kan være utfordrende, spesielt ved alvorlig demens (8). Det er dessverre lite forskning som omhandler diagnostikk av delirium hos pasienter med demens. I de formelle diagnosekriteriene for delirium i ICD10 og DSM-5 er det lite hjelp å få. DSM-5 kriteriene for delirium sier kun at ved et delirium skal pasientens symptomer ikke bedre kunne forklares av demenssykdommen alene (9), mens i ICD-10 kriteriene gis det ingen veiledning. Selv om delirium er vanlig hos akutt syke pasienter med kjent demens, blir tilstanden ofte oversett ved at pasientens akutte kognitive forverring vurderes å skyldes pasientens kjente demenssykdom alene.
20 Indremedisineren 1 • 2024 Fagartikkel
Maria Krogseth, lege i spesialisering (LIS) 3, geriatrisk avdeling, Sykehuset Vestfold HF, Førsteamanuensis II, Universitetet i Sørøst-Norge.
Maria Krogseth
Slik underdiagnostikk av delirium ved demens er nok det hyppigste, allikevel kan også feildiagnostikk skje ved at pasienter med kjent demens oppfattes å ha delirium når årsaken til deres atferd nok er atferdsforstyrrelser og psykiatriske symptomer ved demens (APSD).
Diagnostikk av delirium ved kjent demens følger samme oppsett som deliriumsdiagnostikk hos pasienter uten demens, og baserer seg på å kartlegge kjernesymptomene for delirium: akutt endret bevissthet og oppmerksomhet, og akutt forverret kognisjon eller persepsjonsforstyrrelser. For å stille diagnosen delirium må tilstanden ha oppstått som en reaksjon på akutt sykdom, skade eller annen påvirkning som for eksempel bivirkning av et legemiddel. Det finnes flere screeningverktøy for delirium, men verktøyet 4AT (10) har de siste årene tatt over som det mest brukte. Da 4AT kun er et screeningverktøy, må man ha en bevisst tilnærming til hva man observerer for å diagnostisere delirium hos pasienter med kjent demens. Det er også viktig å minne seg selv på at svikt i ulike kognitive domener ikke representerer dikotome størrelser, men et kontinuum fra lett til alvorlig svikt. Selv om 4AT er et screeningverktøy, er det i en klinisk hverdag nyttig å bruke verktøyets punkter som en ramme for deliriumsdiagnostikk, også hos pasienter med kjent demens. En gjennomgang av punktene i verktøyet 4AT, med råd for vurdering hos pasienter med kjent demens, gis i Tabell 1.
Når det gjelder persepsjonsforstyrrelser ved delirium så vil 25-70 % av pasienter med delirium oppleve dette (14). Visuelle hallusinasjoner er mer vanlig enn hørselshallusinasjoner. Klinisk erfaring er at hallusinasjoner og vrangforestillinger sjeldent oppstår fra intet, men at sanseinntrykk forvrenges eller feiltolkes. Vrangforestillinger og hallusinasjoner tar derfor ofte utgangspunkt i faktiske gjenstander, hendelser eller sanseinntrykk. Din atferd i møte med pasienter med delirium må derfor være preget av ro, omsorg og trygghet, og man må forsøke å minimere stimuli som kan gi opphav til persepsjonsforstyrrelser.
Tabell 1: Hvordan vurdere 4AT punkter ved demens? Endret årvåkenhet og bevissthet
Pasienter med kjent demens har vanligvis et normalt bevissthetsnivå, og «klar bevissthet» er et eget punkt i diagnosekriteriene for demens, nettopp for å skille demens fra delirium. Pasienter med delirium har ofte forstyrret bevissthet. De kan være somnolente, gi dårlig blikk-kontakt, og sovne i situasjoner der det ikke er normalt å sovne; slik som under en undersøkelse, ved en legevisitt, under et måltid, eller i forbindelse med stell. Slikt redusert bevissthetsnivå sees ved hypoaktivt delirium. Ved et hyperaktivt delirium har også pasienten en bevissthetsforstyrrelse og de gir ofte dårlig blikkontakt. Men i stedet for somnolens og reduserte bevegelser, sees formålsløse plukkende bevegelser, motorisk uro, og hos noen, agitasjon. For å strukturere kartleggingen av endret bevissthet anbefales verktøy som Observational Scale of Level of Arousal (OSLA) (11) eller Richmond Agitation and Sedation Scale (RASS) (12), som begge er tilgjengelig på norsk. En diagnostisk utfordring er delirium hos pasienter med demens med lewylegemer der fluktuerende bevissthetsforstyrrelse sees i stabil fase (13). Hos slike pasienter er det viktig å innhente opplysninger fra pårørende om det foreligger noen endret bevissthet sammenliknet med hvordan pasienten er til vanlig. Det er også verdt å presisere at pasienter med demens er trettbare grunnet sin hjernesykdom, og etter morgenstell og frokost vil mange sykehjemspasienter med demens kunne sovne. På samme måte vil mange fysisk spreke pasienter med demens i sin hverdag kunne fremvise motorisk uro, tegn til rastløshet og vandring. Begge disse eksemplene illustrerer at søvnighet eller motorisk uro på ingen måte er ensbetydende med delirium, men dersom slik atferdsendring oppstår akutt sammenliknet med hvordan pasienten er til vanlig bør man reagere og observere pasienten for andre tegn til delirium.
Desorientering
Desorientering sees ofte ved delirium, men også ved demens. I 4AT er det en kort test av orientering som anbefales og poengmessig vektes desorientering mindre enn endret bevissthet og tegn til akutt endring. Mange pasienter med demens vil ikke være orientert for verken sted, tid eller egen alder i stabil fase og orienteringstest bør da suppleres ved å innhente opplysninger fra pårørende om hva din pasient med demens vanligvis husker eller klarer, og kartlegge akutt forverring ut fra dette. At din pasient med kjent demens er akutt mer desorientert, er suspekt på delirium. De fleste demenssykdommer er gradvis progredierende og forverres ikke i løpet av timer til få dager. Samtidig er også dette et punkt som krever en skjønnsmessig vurdering i møtet med pasienter med demens: De fleste helsepersonell som jobber med pasienter med alvorlig demens vet at disse pasientene har en sårbar hjerne, og dagen etter et stort familiebesøk på sykehjemmet, eller etter en natt med noe dårligere søvn, vil mange pasienter med alvorlig demens fungere litt dårligere kognitivt.
Oppmerksomhetssvikt
Oppmerksomhetssvikt ansees som en hjørnestein i symptomatologien ved delirium. Klinisk vil svekket oppmerksomhet medføre at pasienter ikke tar instruksjon, de klarer verken å fullføre oppgaver eller overse distraherende stimuli. Pasienter med mild demens har vanligvis bevart oppmerksomhet, og klarer å ta instruksjoner og fullføre oppgaver. Ved moderat til alvorlig demens vil mange pasienter ha en kronisk oppmerksomhetssvikt grunnet sin demenssykdom. Verktøyet 4AT inneholder en oppmerksomhetstest hvor man ber pasienten om å si årets måneder i motsatt rekkefølge. For pasienter med kjent demens kan dette være en for vanskelig oppgave som de ikke mestrer selv i stabil fase. Det er derfor nyttig å vite at oppmerksomhet kan testes ved andre oppgaver som å be pasienten si ukens dager i motsatt rekkefølge, telle fra 20 til 0, eller rett og slett klinisk vurdere hvor godt pasienten følger instruksjoner ved testing av hjernenerver, somatisk undersøkelse, eller under et stell.
Akutt endring og tegn til fluktuasjon
Akutt endring og tegn til fluktuasjon er nok det viktigste punktet i deliriumsdiagnostikk, spesielt hos pasienter med kjent demens. Med mindre du kjenner pasienten godt fra tidligere, må pårørende kontaktes og opplysninger om tegn til akutt endring innhentes. Både underdiagnostisering av delirium ved demens, og feildiagnostisering av APSD som delirium, kan ofte unngås ved innhenting av informasjon fra pårørende om hvordan pasienten fungerer til vanlig. Hvis pårørende eller andre som kjenner pasienten godt rapporterer om en akutt kognitiv endring, skal delirium mistenkes og medføre utredning med tanke på underliggende årsak.
21 Indremedisineren 1 • 2024 Fagartikkel
Prognose etter delirium Til tross for at delirium ansees som en reversibel tilstand som vil gå tilbake når den akutte utløsende sykdommen/skaden behandles, så er delirium assosiert med dårlig prognose både når det gjelder liggetid i sykehus, videre fysisk funksjon, livskvalitet og risiko for død (15, 16). Også for hjernen ser det ut til at delirium er farlig (17). Delirium blir ofte beskrevet som en reversibel kognitiv svikt, men både klinisk erfaring og stadig flere studier tyder på at ikke alle pasienter kommer seg tilbake til den kognitive funksjonen de hadde før delirium oppstod. Selv blant unge pasienter, dog kritisk syke og innlagt i en intensivavdeling, har man avdekket at pasienter med langvarig delirium har en kognitiv funksjon som ved mild Alzheimers sykdom når de undersøkes tre og 12 måneder senere (18). Det ser altså ut til at påvirkningen mellom delirium og demens går begge veier; demens er den sterkeste risikofaktoren for å utvikle delirium ved akutt sykdom/ skade, men delirium ser også ut til å påvirke videre risiko for kognitiv svikt og demens. Da delirium inntreffer akutt er det store metodologiske utfordringer knyttet til å studere delirium sin påvirkning på senere kognitiv funksjon. Det er to årsaker til dette: Hvis man i en studie undersøker pasienter for delirium og følger dem opp med tanke på kognitiv funksjon, så mangler man data på pasientens
Referanser
1. WHO. The ICD-10 Classification of Mental and Behavioural Disorders. Clinical descriptions and diagnostic guidelines.1992.
2. Bekkhus-Wetterberg P, Brækhus A, Müller EG, Norvik MI, Winsnes IE, Wyller TB. Primary progressive aphasia. Tidsskrift for den Norske laegeforening : tidsskrift for praktisk medicin, ny raekke. 2022;142(17).
3. Scheltens P, De Strooper B, Kivipelto M, Holstege H, Chételat G, Teunissen CE, et al. Alzheimer’s disease. Lancet (London, England). 2021;397(10284):1577-90.
4. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders: DSM-IV-TR. 4th edn. Washington. 2000.
5. Inouye SK. Predisposing and precipitating factors for delirium in hospitalized older patients. Dementia and geriatric cognitive disorders. 1999;10(5):393-400.
6. Skretteberg WH, Holmefoss I, Krogseth M. Delirium During Acute Events in Nursing Home Patients. J Am Med Dir Assoc. 2022;23(1):146-9.
7. Han QYC, Rodrigues NG, Klainin-Yobas P, Haugan G, Wu XV. Prevalence, Risk Factors, and Impact of Delirium on Hospitalized Older Adults With Dementia: A Systematic Review and Meta-Analysis. J Am Med Dir Assoc. 2022;23(1):23-32.e27.
8. Morandi A, Davis D, Bellelli G, Arora RC, Caplan GA, Kamholz B, et al. The Diagnosis of Delirium Superimposed on Dementia: An Emerging Challenge. J Am Med Dir Assoc. 2017;18(1):12-8.
9. American Psychiatric Association. DSM-5 Classification. Washington. 2013.
10. Evensen S, Forr T, Al-Fattal A, de Groot C, Lønne G,
kognitive funksjon før delirium oppstod da de færreste pasienter har dokumentert kognitiv testing fra tiden før den akutte hendelsen. I disse studiene har man da benyttet seg av surrogatmarkører, vanligvis pårørende opplysninger, for å gradere kognitiv funksjon før delirium oppstod (19). Således vil gradering av kognitiv funksjon før et delirium være usikker. I andre studier har man gjennomført regelmessig kognitiv testing av populasjoner, og deretter gjennomgått sykehusjournaler for å lete etter tegn til delirium (20). Da delirium ofte oversees, vil deliriumsdiagnostikken i disse studiene være usikker.
Det finnes i dag tre studier i verden, hvorav én fra Norge, hvor man har fulgt pasienter over tid med regelmessig kognitiv testing, samt direkte undersøkt pasientene for tegn til delirium ved akutt sykdom (21-23). Alle disse studiene finner at delirium er assosiert med økt risiko for videre tap av kognitiv funksjon og demens, også når man justerer for tidligere kognitiv funksjon. Mange leger har nok trodd at kognitiv svikt etter et delirium skyldes at delirium bare avdekker en tidligere subklinisk kognitiv svikt. Men vi har nå studier som tydelig viser økt risiko for kognitiv forverring og demens også når man justerer for tidligere kognitiv funksjon. I den norske studien om delirium sin påvirkning på kognitiv funksjon (23), er det i blodprøver
Gjevjon ER, et al. Nytt verktøy for å oppdage delirium og kognitiv svikt. Tidsskrift for den Norske laegeforening. 2016;136(4):299-300.
11. Tieges Z, McGrath A, Hall RJ, Maclullich AM. Abnormal level of arousal as a predictor of delirium and inattention: an exploratory study. The American journal of geriatric psychiatry : official journal of the American Association for Geriatric Psychiatry. 2013;21(12):124453.
12. Ely EW, Truman B, Shintani A, Thomason JW, Wheeler AP, Gordon S, et al. Monitoring sedation status over time in ICU patients: reliability and validity of the Richmond Agitation-Sedation Scale (RASS). Jama. 2003;289(22):2983-91.
13. McKeith IG, Boeve BF, Dickson DW, Halliday G, Taylor JP, Weintraub D, et al. Diagnosis and management of dementia with Lewy bodies: Fourth consensus report of the DLB Consortium. Neurology. 2017;89(1):88-100.
14. Tachibana M, Inada T, Ichida M, Ozaki N. Factors affecting hallucinations in patients with delirium. Sci Rep. 2021;11(1):13005.
15. Beishuizen SJ, Festen S, Loonstra YE, van der Werf HW, de Rooij SE, van Munster BC. Delirium, functional decline and quality of life after transcatheter aortic valve implantation: An explorative study. Geriatr Gerontol Int. 2020;20(12):1202-7.
16. Witlox J, Eurelings LS, de Jonghe JF, Kalisvaart KJ, Eikelenboom P, van Gool WA. Delirium in elderly patients and the risk of postdischarge mortality, institutionalization, and dementia: a meta-analysis. Jama. 2010;304(4):443-51.
17. Goldberg TE, Chen C, Wang Y, Jung E, Swanson A, Ing C, et al. Association of Delirium With Long-term
målt en biomarkør for nevronskade, Neurofilament Light Chain (NfL). Vi har da avdekket at delirium er assosiert med en stigning av NfL. I tillegg finner vi at under og etter et delirium foreligger det høyere nivåer av NfL. Dette, sammen med funn av forverret kognitiv funksjon hos pasienter med delirium, støtter at vi nå tror at delirium i seg selv er farlig for hjernen (23).
Selv om delirium synes å være assosiert med forverring av kognitiv funksjon, både hos pasienter med og uten demens, er det ingen studier hvor man effektivt har forebygget delirium og sett at dette har effekt på videre kognitiv funksjon. Således har vi, per i dag, ingen data som viser noen kausalitet mellom delirium og forverret kognitiv funksjon.
Da delirium rammer et stort antall mennesker årlig, og demens tross alt er samfunnets mest kostbare enkeltsykdom (24), er det viktig å inter venere mot alle faktorer som forverrer kognitiv svikt. Derfor bør alle som arbeider med eldre pasienter være klar over at også delirium ser ut til å ha en negativ påvirkning på både kognitiv og fysisk funksjon, og trolig medvirker til den store økonomiske og menneskelige kostanden knyttet til demens, både for samfunnet, pasienten og pårørende.
Cognitive Decline: A Meta-analysis. JAMA Neurol. 2020;77(11):1373-81.
18. Pandharipande PP, Girard TD, Jackson JC, Morandi A, Thompson JL, Pun BT, et al. Long-term cognitive impairment after critical illness. The New England journal of medicine. 2013;369(14):1306-16.
19. Krogseth M, Wyller TB, Engedal K, Juliebø V. Delirium is an important predictor of incident dementia among elderly hip fracture patients. Dementia and geriatric cognitive disorders. 2011;31(1):63-70.
20. Davis DH, Muniz Terrera G, Keage H, Rahkonen T, Oinas M, Matthews FE, et al. Delirium is a strong risk factor for dementia in the oldest-old: a populationbased cohort study. Brain. 2012;135(Pt 9):2809-16.
21. Richardson SJ, Davis DHJ, Stephan BCM, Robinson L, Brayne C, Barnes LE, et al. Recurrent delirium over 12 months predicts dementia: results of the Delirium and Cognitive Impact in Dementia (DECIDE) study. Age and ageing. 2021;50(3):914-20.
22. Tsui A, Searle SD, Bowden H, Hoffmann K, Hornby J, Goslett A, et al. The effect of baseline cognition and delirium on long-term cognitive impairment and mortality: a prospective population-based study. Lancet Healthy Longev. 2022;3(4):e232-e41.
23. Krogseth M, Davis D, Jackson TA, Zetterberg H, Watne LO, Lindberg M, et al. Delirium, neurofilament light chain, and progressive cognitive impairment: analysis of a prospective Norwegian population-based cohort. Lancet Healthy Longev. 2023;4(8):e399-e408.
24. Kinge JM, Dieleman JL, Karlstad Ø, Knudsen AK, Klitkou ST, Hay SI, et al. Disease-specific health spending by age, sex, and type of care in Norway: a national health registry study. BMC Med. 2023;21(1):201.
22 Indremedisineren 1 • 2024
Fagartikkel

Utvalgte indikasjoner1
Revmatoid artritt: Voksne med revmatoid artritt (RA) i kombinasjon med metotreksat hos de som ikke oppnår tilstrekkelig effekt med metotreksat alene.
Autoinflammatoriske periodiske febersyndromer hos voksne, ungdom, barn og spedbarn (≥8 måneder med kroppsvekt ≥10 kg):
Cryopyrinassosierte periodiske syndromer (CAPS) inkl. NOMID/CINCA , MWS og FCAS.
Familiær middelhavsfeber (FMF), hvis hensiktsmessig i kombinasjon med kolkisin.
Stills sykdom: systemisk juvenil idiopatisk artritt (sJIA) og Stills sykdom i voksen alder (AOSD), med aktive systemiske trekk av moderat til høy sykdomsaktivitet, eller ved fortsatt sykdomsaktivitet etter behandling med NSAID eller glukokortikoider.
Kan gis som monoterapi eller i kombinasjon med andre antiinflammatoriske legemidler og DMARD.
Dosering og administrering1
RA: Voksne inkl. eldre: Anbefalt dose er 100 mg 1 gang daglig
CAPS: Voksne inkl. eldre, ungdom og barn ≥8 måneder og ≥10 kg: Anbefalt startdose 1-2 mg/kg dag.
FMF og Stills sykdom: Anbefalt dose 100 mg/dag ved kroppsvekt ≥50 kg. Ved kroppsvekt <50 kg justeres dosen etter kroppsvekt, med startdose 1-2 mg/kg/dag. Hos barn med utilstrekkelig respons kan dosen økes opptil 4 mg/kg/dag.
Kineret skal gis subkutant i daglige injeksjoner.
Utvalgte advarsler og forsiktighetsregler1
Skal ikke initieres ved nøytropeni.
Skal ikke initieres ved aktive infeksjoner.
Samtidig behandling med TNF-α-antagonister anbefales ikke pga. økt risiko for alvorlige infeksjoner.
Legemiddelreaksjon med eosinofili og systemiske symptomer . (DRESS) er rapportert i sjeldne tilfeller, hovedsakelig hos SJIA pasienter.
Varenummer: 418642 Styrke: 100mg/0,67 ml
Pakning: 7 x 0,67 ml (ferdigfylt sptøyte)
Pris (AUP): 2685,20 Refusjon: H-resept, R.gr.: C
Rabattert pris- Kineret er med på LIS-anbud 2306b TNFBIO
Swedish Orphan Biovitrum AS
Dronning Eufemias gate 16, 0191 Oslo
Tlf.: 66 82 34 00 mail.no@sobi.com
www.sobi.com/norway
Utvalgte bivirkninger1
Svært vanlige: Reaksjon på injeksjonsstedet
Hodepine
Vanlige: Nøytropeni
Trombocytopeni
Alvorlige infeksjoner
For fullstendig oversikt over bivirkninger og forsiktighetsregler: se godkjent SPC på
www.felleskatalogen.no
For mer informasjon om Kineret: scan QR-koden / www.kineret.no

Referanser: 1.Kineret SmPC- mars 2023.
2. Dinarello CA, et al. Nat Rev Drug Discov. 2012;11:633–652.
PP-17155
Mars 2023
Blokkerer IL-1 α og β ved autoinflammatorisk sykdom hos barn og voksne1,2
Sobi and Kineret ® are trademarks of Swedish Orphan Biovitrum AB (publ) © 2023 Swedish Orphan Boivitrum AB (publ) - All rights reserved
Prognostiske faktorer ved molekylært målrettet kreftbehandling
Molekylært målrettet kreftbehandling benyttes i økende grad og denne praksisen kan nødvendiggjøre fornyet gjennomgang av prognostiske faktorer. Denne artikkelen omtaler noen erfaringer ved akutt myelogen leukemi

Introduksjon
Målet for cytostatikabehandling av kreftsykdommer kan være sykdomsstabilisering eller helbredelse, og man vil ofte vektlegge prognostiske faktorer i forkant av behandlingsstart for å kunne ha en begrunnet mening om mulighetene for å lykkes med behandlingen. Slike faktorer kan også benyttes for å avgjøre hvor intensiv behandling man vil tilrå, for eksempel om man tilrår allogen stamcelletransplantasjon ved akutt myelogen leukemi (AML). Ofte kan de biologiske prognosefaktorer være ulike typer genetiske avvik i kreftcellene (1,2), i noen tilfeller vil man også vektlegge kliniske markører som for eksempel forutgående predisponerende sykdommer (2).
Molekylært målrettet behandling blir nå i økende grad brukt ved ulike kreftformer, og en rekke slike medikamenter er registret i Norge og dermed blitt tilgjengelige for klinisk bruk (3). Man har ved mange kreftformer kartlagt prognostiske parametere som gjerne er assosiert med aggressiviteten i sykdommen eller knyttet til resistensmekanismer mot medikamentell behandling. Disse tradisjonelle og mer generelle resistensmekanismene er i vesentlig grad kartlagt med utgangspunkt i den tradisjonelle cytostatikabehandlingen (4). Det vil ikke være uventet om man ved bruk av spesifikk molekylært målrettet behandling i tillegg vil ha mer spesifikke resistensmekanismer/ prognosemarkører som er knyttet til regulering og funksjon av det spesifikke målproteinet. I denne artikkelen
vil vi bruke sykdommen AML som et eksempel på at dette er tilfelle.
Prognostiske faktorer ved cellegiftbehandlet akutt myelogen leukemi
AML er en aggressiv sykdom som kjennetegnes ved infiltrasjon av maligne celler i beinmargen (1). Sykdommen forekommer i alle aldre men spesielt etter 50 års alder. Leukemicellene er kjennetegnet ved økt overlevelse, rask og ukontrollert proliferasjon og en hemmet celle differensiering sammenlignet med normale celler. Selv om differensieringen er hemmet kan AML-cellene likevel vise begrensede tegn til modning for eksempel i form av morfologiske trekk eller uttrykk av enkelte molekylære markører forbundet med differensiering i retning granulocytter, monocytter eller erytrocytter. Akutt promyelocyttleukemi (APL) er en variant av AML som krever helt spesiell håndtering; i denne artikkelen blir kun omtalt de andre ikke-APL variantene av AML og man bruker begrepet AML som en betegnelse for disse ikke-APL formene av sykdommen.
AML kan helbredes med intensiv cytostatikabehandling eventuelt kombinert med allogen stamcelletransplantasjon. Mulighetene for helbredelse varierer og kan vurderes på grunnlag av definerte prognostiske faktorer. Disse faktorene synes å ha en generell betydning i forhold til cytostatika-følsomhet og kan benyttes selv om pasientene blir behandlet med ulike cytostatikaregimer (2). Blant de best etablerte prognostiske
faktorene er grunnleggende biologiske egenskaper ved kreftcellene, først og fremst definerte kromosomavvik og molekylære genetiske avvik. For eksempel er NPM1 mutasjoner assosiert med relativt gode muligheter for helbredelse ved AML, mens kromosomavvik som rammer kromosom 5, komplekse kromosomavvik og mutasjoner i TP53 genet er assosiert med behandlingsresistens og reduserte muligheter for helbredelse. Det morfologiske bildet med eventuelle tegn til begynnende differensiering av AML cellene har imidlertid vist seg uten vesentlig prognostisk betydning ved konvensjonell cytostatikabehandling (1,2).
Klassifisering av ulike prognostiske faktorer ved venetoklaks-behandling spesifikt blokkerer det antiapoptotiske målmolekylet Bcl-2 I en nylig undersøkelse av prognostiske markører ved AML basert på genekspresjonsprofiler beskrev man to typer prognostiske markører (5). Den første typen var assosiert med sensitivitet for en rekke antileukemiske medikamenter, og disse markørene dannet dermed en profil som var felles for ulike terapier. Den andre typen syntes mer spesifikke, og for Bcl-2 hemmeren venetoklaks fant man derfor en markørprofil som var ulikt andre behandlinger og inkluderte uttrykk av monocyttmarkører som tegn på resistens mot Bcl-2 inhibering.
Mange ulike resistensmekanismer mot cytotksisk behandling har blitt beskrevet ved ulike kreftsykdommer,
24 Indremedisineren 1 • 2024 Fagartikkel
Øystein Bruserud
Øystein Bruserud, MD PhD, professor emeritus, Institutt for Klinisk Medisin 2, Universitetet i Bergen
også AML (Figur 1). Markører for behandlingsresistens har også blitt undersøkt i kliniske studier av eldre AML pasienter som får stabiliserende kombinasjonsbehandling med venetoklaks og metyleringshemmeren azacitidin (6-17):
• Også ved denne kombinasjonsbehandlingen var mutasjoner i NPM1 genet assosiert med kjemosensitivitet, mens behandlingsresistens var assosiert med at pasientene hadde TP53 mutasjon, Flt3 mutasjon eller komplekse kromosomavvik i leukemicellene (6-9). Dette er genetiske avvik som er velkjente ved AML, og deres prognostiske kraft ved kombinasjonsbehandling med venetoklaks pluss azacitidin tilsvarer slik man ser ved konvensjonell intensiv cytostatikaterapi for AML (2). Disse faktorene synes altså mer generelle
• Imidlertid fant man også at tegn til monocytt-differensiering av AML cellene var assosiert med behandlingsresistens (10,11); dette er i motsetning til tidligere studier med konvensjonell cytostatikaterapi der tegn til differensiering i beste fall må sies å ha en svært begrenset eller tilnærmet ingen prognostisk kraft (12,13). Seinere studier antyder at erytroid og megakaryocyttisk differensiering også er assosiert med resistens mot venetoklaks-basert AML terapi. Årsaken til kjemoresistensen er at i disse differensierte cellene har Bcl-2 en redusert betydning som antiapoptotisk signal mens andre medlemmer av Bcl-2 familien er langt viktigere både i monocyttære (Mcl-1 er viktigst) (10,14,15) og erytroide/ megakaryocyttære celler (Bcl-XL er viktigst) (16). Når man da bruker en spesifikk Bcl-2 hemmer i behandlingen ser man derfor en klinisk resistens mot medikamentet i mer differensierte celler ettersom målmolekylet Bcl-2 da har en mindre framtredende biologisk funksjon.
• Resistens ved monocyttær differensiering synes også å forekomme ved hemming av CDK2/4/6 (17); hemming av
transkripsjonsfaktoren BET4 er derimot mest effektivt ved monocyttær differensiering mens man har redusert effekt i umodne/ udifferensierte AML celler (17).
Molekylært målrettet behandling vil trolig i tillegg til de konvensjonelle generelle markørene ha medikamentspesifikke prognostiske markører De fleste av dagens prognostiske markører ved AML er basert på genetiske markører i form av kromosomavvik (manglende eller for mange kromosomer, delesjoner, multiple kromosomavvik) eller mutasjoner som påvises ved molekylærgenetiske metoder (Figur 2) (1,2).
Erfaringene med Bcl-2 hemmeren venetoklaks viser at ved molekylært målrettet behandling, i dette tilfellet mot det antiapoptotiske og metabolisme-regulerende molekylet Bcl-2, vil proteinanalyser kunne identifisere viktige tillegsmarkører (Figur 2) (16,17). Dette er egentlig ikke uventet; når man har en behandling målrettet mot et spesifikt protein er det rimelig at effekten av slik målrettet behandling i tillegg til generelle resistensmekanismene vil bli påvirket av målproteinets mengde og/eller den molekylære cellebiologiske sammenhengen proteinet fungerer i hos den enkelte pasient.
Man kan i dag kartlegge kreftcellenes proteinprofiler ved å måle tusenvis av cellens proteiner med proteomikk-teknikker, og man kan i tillegg til kvantitering kartlegge i hvor stor grad proteiners funksjoner er regulert gjennom modifisering med såkalt posttranskripsjonell binding av ulike tilleggsmolekyler etter at proteinkjeden er syntetisert (18-21). Dette skjer ved at proteinkjeden påkobles ulike tilleggskomponenter som for eksempel fosfat, metyl eller acetylgrupper som blir viktige for å regulere proteinenes funksjon. Slike proteomiske teknikker kan derfor benyttes for å identifisere nye biomarkører og dermed kartlegge det molekylære nettverket som regulerer og påvirker målmolekylets funksjoner hos den enkelte pasients kreftceller. Det er ikke urimelig at slike spesifikke
1 Redusert opptak
2 Eliminasjon/utpumping
3 Mutert målprotein
4 Endret nivå av målprotein
5 Redusert DNA reparasjon
6 Antiapoptotisk (rosa) overvekt
Figur 1. Kreftcellens resistens mot medikamentell behandling og dermed progresjon av kreftsykdom. Tradisjonelt har man regnet at behandlingsresistens kan oppstå på grunn av ulike mekanismer i kreftceller. Disse mekanismene inkluderer (1) suboptimalt cellulært opptak av medikamentet; (2) økt eliminasjon blant annet ved ulike utpumpingsmekanismer; (3) mutasjon av medikamentets molekylære angrepspunkt i cellen og dermed redusert følsomhet for medikamentet; (4) endret nivå av et terapeutisk målmolekyl eller signalmolekyl påvirker dets biologiske betydning og dermed effekten av medikamentell whemming; (5) økt kapasitet for reparasjon av medikamentutløst DNA-skade; eller (6) økt overlevelsesevne for cellene ved at man i utgangspunktet har en overvekt av proapoptotiske mekanismer (rosa farge) i kreftcellen. Blant de vanlige mekanismene/ markørene for økt resistens ved AML er mekanisme 6. Man kan da i utgangspunktet ha genetiske avvik (i) enten i selve intracellulære signalprotein (ii) eller i molekyl som endrer genavlesning og dermed gir økt nivå av visse antiapoptotiske (rosa) i forhold til antiapoptotiske (fiolett) proteiner. I begge tilfellene blir sluttresultatet en generelt økt overlevelsesevne for AML cellen når den blir utsatt for skade eller stress i form av leukemibehandling (figur tilpasset fra Medikamenter mot kreft Cytostatikaboken, 9. utgave 2023).
25 Indremedisineren 1 • 2024 Fagartikkel
1 2 3 4 5 6 1 6 4 5 3 2
1 6 4 5 3 2
Biologiske kjennetegn: Økt proliferasjon og overlevelsesevne, manglende eller redusert evne til modning
Klassiske generelle prognostiske markører: Kromosomavvik eller molekylær-genetiske avvik som gir økt proliferasjon og/eller økt overlevelsesevne
AML cellen
Behandling med venetoklaks: En molekylært målrettet behandling mot det antiapoptotiske molekylet Bcl2 gir redusert evne til overlevelse og endret energimetabolisme
protein-markører vil bli et viktig tillegg til de generelle resistensmarkørene når man i økende grad nå benytter molekylært målrettet kreftbehandling.
Konklusjon
Molekylært målrettet terapi blir nå benyttet i økende grad i den medisinske kreftbehandlingen. De tradisjonelle resistensmekanismene
og prognostiske faktorene er i hovedsak kartlagt med utgangspunkt i tradisjonell cellegiftbehandling (Figur 2). Mange av disse etablerte faktorene kan fortsatt være gyldige også ved molekylært målrettet behandling. Det vil likevel trolig være nødvendig med en fornyet og utvidet gjennomgang av de prognostiske parameterne ved bruk av målrettet behandling. For den målrettede
Nye molekylære markører for behandlingseffekt: Redusert nivå av målmolekylet Bcl-2 i mitokondriene og dermed redusert betydning av Bcl-2 som overlevelsesmekanisme i forhold til andre overlevelsesproteiner
behandlingen kan man da identifisere nye prognostiske eller prediktive faktorer på grunnlag av forskjeller mellom pasienter for eksempel i nivået/modifisering av målproteinet eller ulikheter i den cellebiologiske sammenhengen som målproteinet fungerer i. Bruken av Bcl-2 hemmeren venetoklaks ved AML er et eksempel på dette.
Referanser
1 Arber DA, Orazi A, Hasserjian RP et al. Blood. 2022;140(11):1200-28.
2 Döhner H, Wei AH, Appelbaum FR et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood. 2022;140(12):1345-77.
3 Dahl O, Bruserud Ø. Signalhemmere. Side 299-413 Medikamenter mot kreft Cytostatikaboken, 9. utgave. Onkologisk avdeling, Haukeland Universitetssykehus, 2023.
4 Bruserud Ø, Dahl O. Kreftcellebiologi: Mekanismer for resistent sykdom. Side 44-52 i Medikamenter mot kreft Cytostatikaboken, 9. utgave. Onkologisk avdeling, Haukeland Universitetssykehus, 2023.
5 White BS, Khan SA, Mason MJ et al. Bayesian multisource regression and monocyte-associated gene expression predict BCL-2 inhibitor resistance in acute myeloid leukemia. NPJ Precis Oncol. 2021;5(1):71.
6 Gangat N, Johnson I, McCullough K et al. Molecular predictors of response to venetoklaks plus hypomethylating agent in treatment-naïve acute myeloid leukemia. Haematologica. 2022;107(10):2501-5.
7 DiNardo CD, Tiong IS, Quaglieri A et al. Molecular patterns of response and treatment failure after frontline venetoclax combinations in older patients with AML. Blood. 2020;135(11):791-803.
8 Aldoss I, Yang D, Pillai R et al. Association of leukemia genetics with response to venetoclax and hypomethylating agents in relapsed/refractory acute myeloid leukemia. Am J Hematol. 2019;94(10):E253-5.
9 Tiong IS, Dillon R, Ivey A et al. Venetoclax induces rapid elimination of NPM1 mutant measurable residual disease in combination with low-intensity chemotherapy in acute myeloid leukaemia. Br J Haematol. 2021;192(6):1026-30.
10 Pei S, Pollyea DA, Gustafson A et al. Monocytic Subclones Confer Resistance to Venetoclax-Based Therapy in Patients with Acute Myeloid Leukemia. Cancer Discov. 2020;10(4):536-51.
11 Cherry EM, Abbott D, Amaya M et al. Venetoclax and azacitidine compared with induction chemotherapy for newly diagnosed patients with acute myeloid leukemia. Blood Adv. 2021;5(24):5565-73.
12 Canaani J, Beohou E, Labopin M et al. Impact of FAB classification on predicting outcome in acute myeloid leukemia, not otherwise specified, patients undergoing allogeneic stem cell transplantation in CR1: An analysis of 1690 patients from the acute leukemia working party of EBMT. Am J Hematol. 2017;92(4):344-50.
13 Walter RB, Othus M, Burnett AK et al. Significance of FAB subclassification of “acute myeloid leukemia, NOS” in the 2008 WHO classification: analysis of 5848 newly diagnosed patients. Blood. 2013;121(13):2424-31.
14 Kuusanmäki H, Leppä AM, Pölönen P et al. Phenotype-based drug screening reveals association between venetoclax response and differentiation stage in acute myeloid leukemia. Haematologica. 2020;105(3):708-20.
15 Pollyea DA, Stevens BM, Jones CL et al. Venetoclax with azacitidine disrupts energy metabolism and targets leukemia stem cells in patients with acute myeloid leukemia. Nat Med. 2018;24(12):1859-66.
16 Kuusanmäki H, Dufva O, Vähä-Koskela M et al. Erythroid/megakaryocytic differentiation confers BCL-XL dependency and venetoclax resistance in acute myeloid leukemia. Blood. 2023;141(13):1610-25.
17 Romine KA, Nechiporuk T, Bottomly D et al. Monocytic differentiation and AHR signaling as Primary Nodes of BET Inhibitor Response in Acute Myeloid Leukemia. Blood Cancer Discov. 2021;2(5):518-31.
18 Hernandez-Valladares M, Bruserud Ø, Selheim F. The Implementation of Mass Spectrometry-Based Proteomics Workflows in Clinical Routines of Acute Myeloid Leukemia: Applicability and Perspectives. Int J Mol Sci. 2020;21(18):6830.
19 Hernandez-Valladares M, Vaudel M, Selheim F et al. Proteogenomics approaches for studying cancer biology and their potential in the identification of acute myeloid leukemia biomarkers. Expert Rev Proteomics. 2017;14(8):649-63.
20 Selheim F, Aasebø E, Bruserud Ø et al. High Mitochondrial Protein Expression as a Potential Predictor of Relapse Risk in Acute Myeloid Leukemia Patients with the Monocytic FAB Subtypes M4 and M5. Cancers (Basel). 2023;16(1):8.
21 Aasebø E, Berven FS, Bartaula-Brevik S et al. Proteome and Phosphoproteome Changes Associated with Prognosis in Acute Myeloid Leukemia. Cancers (Basel). 2020;12(3):709.
26 Indremedisineren 1 • 2024 Fagartikkel
Figur 2. AML cellenes resistens mot behandling: konvensjonell cytotoksisk behandling (grå) versus Bcl-2 hemmeren venetoklaks
Figur 2. AML cellenes resistens mot behandling: konvensjonell cytotoksisk behandling (grå) versus Bcl-2 hemmeren venetoklaks.
MEDIKAMENTER MOT KREFT
‘CYTOSTATIKABOKEN’ 9. UTGAVE 2023, 492 SIDER.
Den nye utgaven er grundig revidert med vekt på å få med nye medikamanter med relevante nyere referanser (totalt 2481 referanser) Vi har spesielt fokusert på de mange nye signalrettede mediakamentene og muligheter med immunterapi Hvert enkelt medikament er presentert med virkningsmekanisme, farmakologiske data, effekt og bivirkninger og indikasjoner Boken er på 492 sider. Referanselistene er oppdatert og utvidet som et utgangspunkt for videre fordypning.
Teksten er primært beregnet for leger i kreftomsorgen, men vil også være av interesse for annet helsepersonell som vil orientere seg om nyere behandlingsmuligheter
Praktisk medikamentell kreftbehandling kan i dag for de fleste kreftformer i Norge leses på nettet i Handlingsprogrammene utarbeidet av norske fagfolk og godkjent av Helsedirektoratet. Vi har derfor ikke lenger mer detaljert beskrivelse av generelle retningslinjer for behandling av de enkelte hovedtyper av kreft Hensikten med boken er å være et supplement og gå mer i dybden enn det som gis i generelle retningslinjer når det gjelder egenskapene til de enkelte medikamentene og dermed gi mer omfattende kunnskap om de enkelte midlenes egenskaper og begrensninger I klinikken vill det derfor gi bedre grunnlag for terapivalgene, spesielt dersom et medikament svikter eller ikke kan gis på grunn av annen sykdom.
Forfatterne har ingen tilknytning til noen Legemiddelfirmaer
Redaktører: Olav Dahl, Øystein Bruserud
Haukeland universitetssjukehus og Universitetet i Bergen
Boken kan bestilles på adresse: Bjørg Algerøy, Kreftavdelingen, Haukeland Universitetssjukehus, 5021 Bergen.
Eller: bjorg.algeroy@helse-bergen.no
+47-45972070
Boken koster kr 480,-, Ved kjøp av 620 bøker kr. 400 per bok, og ved kjøp av pakker på 20 bøker for kr. 350,- per bok.



27 Indremedisineren 1 • 2024 Fagartikkel
Hvordan helsesektoren kan bane vei med kunstig intelligens
Pasient nummer 10 000 har nylig fått røntgenbildet sitt vurdert med kunstig intelligens i Vestre Viken HF. 2600 av disse pasientene har blitt sendt hjem uten å måtte vente i flere timer før diagnosen foreligger.
Ishita Barua, lege PhD i kunstig intelligens og gründer/medisinsk sjef i Livv Health

Siden oppstarten i august 2023 har Vestre Viken spart inn 115 dager med ventetid for pasienter og 15 legekonsultasjoner per dag.1 Dette illustrerer godt noen av oppgavene som kunstig intelligens kan bidra med i klinikken – effektivisering og reallokering av ressurser. Og nettopp det er noe essensen i hva kunstig intelligens er - et optimaliseringsverktøy.

Mange ønsker å definere kunstig intelligens (KI) på en mer konkret måte. I den nasjonale strategien for kunstig intelligens skrevet av Kommunal- og distriktsdepartementet i 20202 står det at «Kunstig intelligente systemer utfører handlinger, fysisk eller digitalt, basert på tolkning og behandling av strukturerte eller ustrukturerte data, i den hensikt å oppnå et gitt mål». Basert på denne definisjonen kan vi utlede hva som kreves for å lage kunstig intelligens, nemlig regnekraft, data og mål. Disse tre faktorene regnes som de viktigste ingrediensene for å utvikle gode KI-modeller.3 Regnekraft er teknologenes domene, og noe vi klinikere ikke tradisjonelt har kontroll over. Derimot er data og mål noe vi klinikere bør ta større eierskap til. For helsevesenet har i alle år produsert «big data» som brukes til blant annet forskning, og slike store og robuste datasett kreves også for å trene KI-modeller. Og det er klinikere som er domeneeksperter på kliniske data og klinisk nyttige mål, og som derfor må involveres tidlig i utviklingen og implementeringen av KI-modeller for klinikken.
For hva er eksempler på klinisk nyttige oppgaver å løse? De kliniske utfordringene starter allerede før livet blir til. KI-verktøy brukes i dag av mange IVF-klinikker rundt omkring i verden for å identifisere de embryoene som har størst sannsynlighet for å resultere i et levendefødt barn og dermed øke suksessraten til IVF-behandling. I 2019 viste forskere
ved Weill Cornell Medicine i New York hvordan KI-verktøy kunne vurdere kvaliteten på embryo mer nøyaktig enn leger.4 Dette skjer ved at KI-verktøyet med det passende navnet STORK har blitt trent på titusenvis av bilder hentet fra videoer av embryoutvikling. Deretter har KI-verktøyet STORK maskinlært seg hvilke embryo som har høyest sjanse for å utvikle seg til et foster. Og STORK baserer seg ikke bare på de kjente variablene som embryologer vurderer, men har lært seg å studere egenskaper ved embryoer som tidligere ikke har vært vektlagt eller kjent for å være viktige diagnostiske kriterier for å estimere suksessraten for fosterutvikling. Altså bidrar KIverktøyet med å identifisere mønstre i morfologiske trekk som vi ikke vet hvordan vi skal vurdere enda. Dette er et eksempel på såkalt svart-boks problematikk som kjennetegnes ved at KI-modellens beslutningsprosess ikke er helt transparent eller forståelig for brukeren. Manglende forklarbarhet og åpenhet i algoritmiske beslutninger, er en utfordring som det medisinske fagmiljøet vil fortsette å møte på etter hvert som flere og flere KI-verktøy implementeres i klinikken.
Men å øke suksessraten til IVFbehandling med bruk av kunstig intelligens, må likevel anses for å være et klinisk nyttig mål. Andre klinisk nyttige oppgaver å løse for KI-verktøy er det å identifisere pasienter som har eller kan utvikle sepsis. Årlig innlegges ca. 10 000 pasienter på sykehus i Norge med mistanke om sepsis, og
28 Indremedisineren 1 • 2024 Kunstig intelligens
Ishita Barua
Foto:
Anne-Julia Granberg
"Nye antibiotika som oppdages ved hjelp av kunstig intelligens", generert med ChatGPT.
årlig dør ca. 3000 pasienter av denne diagnosen. Dødeligheten ligger på 20% i Norge. 5 Ved John Hopkins i USA har forskere i samarbeid med selskapet Bayesian Health utviklet et klinisk beslutningsstøttesystem basert på KI, som kan estimere risikoen for at pasienter utvikler sepsis. KI-verktøyet har fått navnet TREWS (Targeted Real-Time Early Warning System) og er blitt klinisk testet på nesten 600 000 amerikanske pasienter fordelt på fem ulike sykehus. Studien er en prospektiv multisenterstudie publisert i Nature Medicine i 20226 og fikk raskt global oppmerksomhet for de gode resultatene. TREWS identifiserte korrekt 82% av pasientene som stod i fare for å utvikle sepsis og relativ risikoreduksjon i dødelighet var 18,7% hos pasienter hvis varsel ble bekreftet av en behandler innen 3 timer etter varslingen. Utvikling av KI-baserte sepsisdetektorer er også noe vi er i gang med her hjemme gjennom prosjektet «Genetikk og kunstig intelligens skal bedre overlevelsen av sepsis», som er et samarbeid mellom St. Olavs Hospital HF, Helse NordTrøndelag HF og NTNU.7
Som ledd i det å behandle sepsis, er vi helt avhengig av å ha tilgang på antibiotika som bakteriene ikke har utviklet resistens mot. Antibiotikaresistens er en av ti mest kritiske globale helseutfordringene ifølge WHO og årlig dør 1,27 millioner mennesker som en direkte følge av infeksjoner med antibiotikaresistente bakterier. 8 For å få bukt med dette problemet i fremtiden, er vi avhengig av restriktiv antibiotikapraktisering i tillegg til at vi finner nye antibiotikatyper som bakteriene ikke har utviklet resistens mot. I 1928 oppdaget den skotske legen og bakteriologen Alexander Fleming det første antibiotikumet, Penicillin. Dette ble oppdaget ved en tilfeldighet da sporer fra en muggsopp dyrket i et laboratorium i nabolaget, blåste med vinden og landet oppi Fleming sine petriskåler. Fleming med sin domenekunnskap innså hva oppklaringen rundt bakterien betydde

”Kunstig
og kunne konstatere funnet av antibiotika. Det måtte altså både flaks og talent til for å gjøre denne historiske oppdagelsen mulig. Men heldigvis er vi ikke lengre like avhengig av å ha flaks eller talent i disse dager. Vi har kunstig intelligens til å hjelpe oss. I henholdsvis 2020 og 2023 publiserte Massachusetts Institute of Technology (MIT) to studier hvor de beskrev to nye antibiotikatyper oppdaget gjennom bruk av kunstig intelligens.9,10
Den første fikk navnet Halicin (inspirert av datamaskinen HAL 9000 fra kultfilmen «2001: En romodyssé) og ble oppdaget da forskerne brukte et KI-verktøy (nevralt nettverk) til å identifisere molekyler som hemmet E. coli mest effektivt og i tillegg
hadde en annen virkningsmekanisme enn eksisterende antibiotika. KIverktøyet fant ca. 100 kandidater, men kun Halicin stod igjen til slutt. Halicin var opprinnelig utviklet som en diabetesmedisin, men viste svake resultater i studier og ble forkastet som det. Fortsatt gjenstår kliniske studier av Halicin brukt som antibiotikum, men tiden det tok å identifisere legemidlet som en antibiotika-kandidat var bare noen få timer med KI-verktøyet. På liknende vis ble også antibiotika-kandidaten Abaucin oppdaget av forskere ved MIT i 2023. Så da har KI-verktøy hjulpet oss med å oppdage hele to nye antibiotika-kandidater på 3-4 år, i stedet for at vi bruker 35 år på å finne én ny type antibiotika med de tradisjonelle metodene.11
29 Indremedisineren 1 • 2024 Kunstig intelligens
intelligens i helsevesenet”, generert med ChatGPT

Men det er ikke alltid at vi kommer i mål bare ved å la KI-verktøy saumfare våre registre over kjente og eksisterende molekyler, slik at man oppdager legemidler med nye bruksområder. Vi trenger også å kunne syntetisere legemidler for å kurere sykdommer som vi i dag ikke har legemidler mot. Og nettopp det har forskningsinstitusjonen
Referanser
1. Rønhovde, H. & Gauteplass, T. Har allereie spart 115 døgns ventetid for pasientar i Vestre Viken takka vere kunstig intelligens – NRK Buskerud – Lokale nyheter, TV og radio. NRK (2023).
2. Kommunal-og moderniseringsdepartementet. Nasjonal Strategi for Kunstig Intelligens. https://www. regjeringen.no/no/dokumenter/nasjonal-strategi-forkunstig-intelligens/id2685594/?ch=3 (2020).
3. Barua, I. Kunstig Intelligens Redder Liv - AI Er Legenes Nye Superkrefter. (Cappelen Damm, 2023).
4. Khosravi, P. et al. Deep learning enables robust assessment and selection of human blastocysts after in vitro fertilization. npj Digital Medicine 2019 2:1 2, 1–9 (2019).
DeepMind (kjøpt opp av Google i 2014) bidratt til gjennom KI-verktøyet AlphaFold. AlphaFold har løst et av biologiens hellige graler ved å kunne forutsi den tredimensjonale strukturen til proteiner. Dette KI-verktøyet har kartlagt den tredimensjonale strukturen til mer enn 200 millioner proteiner med høy nøyaktighet. Å forutsi hvordan proteinene folder seg
5. Helsedirektoratet. Reviderte anbefalinger for antibiotikabehandling av sepsis. Helsedirektoratet https:// www.helsedirektoratet.no/nyheter/reviderte-anbefalinger-for-antibiotikabehandling-av-sepsis (2022).
6. Adams, R. et al. Prospective, multi-site study of patient outcomes after implementation of the TREWS machine learning-based early warning system for sepsis. Nature Medicine 2022 28:7 28, 1455–1460 (2022).
7. Lian, A. Nærmer seg svar på Sepsis-gåten - St. Olavs hospital HF. St. Olavs Hospital https://www.stolav. no/nyheter/2018/nermer-seg-svar-pa-sepsis-gaten/ (2020).
og dermed hva proteinstrukturen blir, er viktig fordi strukturen bestemmer funksjonen til proteinet. Dette er noe forskere har forsøkt å løse de siste 50 årene og gjennombruddet kom i 2020. Året etter ble AlphaFold kåret til det viktigste vitenskapelige gjennombruddet det året av tidsskriftet Science.12 Potensialet til AlphaFold ligger i muligheten til å lage legemidler mer effektivt og billigere. Håpet er å kunne bruke AlphaFold til å utvikle legemidler som korrigerer f.eks. feilfolding av proteiner, hvilket er tilfelle for Alzheimers sykdom. Eller å designe legemidler som målrettet interagerer med spesifikke proteiner, f.eks. innen kreftbehandling. Under koronapandemien bidro AlphaFold til å forutsi strukturen til proteinene i koronaviruset og hvordan det vekselvirker med reseptorer i menneskeceller.
Kunstig intelligens kan bli et effektivt redskap for å håndtere noen av de mest utfordrende problemstillingene i helsetjenesten. Enten det er å øke sannsynligheten for å få barn gjennom IVF-behandling, oppdage sepsis i tide, finne nye antibiotika eller utvikle nye legemidler. Og som vi ser i eksemplet fra Vestre Viken og KI-verktøy for røntgenvurderinger, kan vi starte med de lavthengende fruktene som har lavere risiko for skadelige helseutfall og potensielt stort utbytte. Men det finnes også forbedringspotensiale her. Vi burde sørge for at vi kan kvantifisere hvilken klinisk effekt vi oppnår med kunstig intelligens gjennom å benytte randomiserte studier når vi tar i bruk nye verktøy. Slik som tilfelle er når nye medisiner utvikles. Først da følger vi virkelig prinsippet bak legeeden «primum non nocere» og kan bane vei for andre sektorer som skal ta i bruk KI på en trygg og nyttig måte.
8. Murray, C. J. et al. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet 399, 629–655 (2022).
9. Stokes, J. M. et al. A Deep Learning Approach to Antibiotic Discovery. Cell 180, 688-702.e13 (2020).
10. Liu, G. et al. Deep learning-guided discovery of an antibiotic targeting Acinetobacter baumannii. Nature Chemical Biology 2023 1–9 (2023) doi:10.1038/ s41589-023-01349-8.
11. Shukla, R. et al. Teixobactin kills bacteria by a twopronged attack on the cell envelope. Nature 2022 608:7922 608, 390–396 (2022).
12. Service, R. F. Science’s 2021 Breakthrough of the Year: AI brings protein structures to all. Science (2021).
30 Indremedisineren 1 • 2024 Kunstig intelligens
”AlphaFold som forutser proteinstrukturer”, generert med ChatGPT.

EU-ME3 — Advancing the Dimensions of Endosonography
Focused on Your Expertise
With high-end features and elevated image quality incorporated in a small box, EU-ME3 is tailored to improve a variety of procedures.
Smart user settings and software upgrades enable customization to individual clinical needs. High-quality visualization allows you to fully focus on the procedure and supports accurate diagnosis and treatment of pancreaticobiliary and lung diseases.
For more information, please visit www.olympus.eu

Drengsrudbekken 12, 1383 Asker | www.olympus.no 129059
M00515EN · 04/23 · OEKG Follow us on Linkedin
Indremedisin i Norge


Tidligere besøkt:
4-2023 Levanger
3-2023 Diakonhjemmet
2-2023 Elverum
1-2023 Harstad
4-2022 Sykehuset Østfold
3-2022 Lillehammer
2-2022 Kongsberg
1-2022 Sandnessjøen
4-2021 Mo i Rana
3-2021 Arendal sykehus
2-2021 Haraldsplass
1-2021 Drammen sykehus
4-2020 Førde sentralsjukehus
3-2020 Ringerike sykehus
2-2020 Ålesund sykehus
1-2020 Lovisenberg diakonale sykehus
4-2019 Nordlandssykehuset Bodø
3-2019 Akershus universitetssykehus
2-2019 Bærum sykehus
1-2019 Finnmarkssykehuset Kirkenes
Hvorfor være hjemme, når du kan være på Diakonhjemmet?
Diakonhjemmet sykehus, Oslo Medisinsk avdeling er antagelig Levangers største valfartssted og kommunens arbeidshest
Sykehuset Levanger
Indremedisin i Norge
Ønsker du å skrive en artikkel om din medisinske avdeling?
Maya Bass, assisterende redaktør i Indremedisineren
Den første artikkelen om medisinske avdelinger ved norske sykehus kom i Indremedisineren nr. 1 fra 2019 og serien startet med medisinsk avdeling ved Finmarksykehuset, klinikk Kirkenes. Sykehuset var helt nytt, et av de få i landet med passivhusstandard og pent plassert mellom to innsjøer, slik at de 24 legene som jobbet ved medisinsk avdeling kunne komme seg til jobb enten ved "å gå, sykle, sparke eller gå på ski".
Siden den gang har vi presentert en medisinsk avdeling i hvert nummer av Indremedisineren, og serien har blitt et populært innslag i bladet. Vi er blitt litt bedre kjent med måten kollegaer på sykehus rundt om i landet organiserer sitt arbeid, og oppdaget at mye er likt og like mye er forskjellig: Størrelsen på avdelingen og nærheten til universitetssykehusene har mye å si for hvilken pasientgrupper man forventes å kunne behandle lokalt.
På AHUS har f.eks. alle de medisinske spesialitetene egen sengepost og poliklinikk samt tertiærvakt i døgnvakt. Sykehuset utfører også avansert behandling i form av bla. PCI og trombektomi. Arbeidshverdagen blir ganske annerledes i f.eks.
Skagsvola, Elverum
Ulriken, Bergen
32 Indremedisineren 1 • 2024

Mo i Rana, hvor de 7 overlegene går generell indremedisinske vakter og "LIS1 har todelt vaktdøgn og felles nattevakt med kirurgisk og ortopedisk avdeling".
Arbeidet som gjøres både på store og små sykehus har i alle fall et felles nevner: Det er utrolig imponerende!
Vi setter alltid pris på et lite innblikk i lokal historie/ sykehushistorie og geografi, derfor inneholder artiklene som oftest spennende historiske data om byen eller sykehuset, informasjon om mulighetene for fritidsaktiviteter og flotte bilder av kollegiet og omgivelsene.
Uansett geografisk beliggenhet og avdelingens størrelse, klarer artikkelforfatterne å fremheve det positive ved akkurat deres arbeidsplass, slik at jeg ofte har tenkt "det hadde vært morsomt å jobbe der"
For å fortsette denne artikkelserien ønsker vi nå hjelp fra dere som jobber på både store og små medisinske avdelinger ved sykehus i vårt langstrakte land. Drømmen er å få presentert alle! Spiller ingen rolle om du er LIS eller overlege, det viktigste er at du har lyst å fortelle om ditt arbeidssted.
Se på vedlagt kart - og hjelp oss med å fylle det ut!
Send noen ord til Maya Bass på mailadresse: mctbass@hotmail.com, så tar jeg kontakt.



 Sykehuset Levanger
Kirkenes sykehus. Foto: Bernt Nilsen
Kongsberg
Rødøyløva, Mo i Rana. Foto: Kenneth Lauvås
Lillehammer.
Sykehuset Levanger
Kirkenes sykehus. Foto: Bernt Nilsen
Kongsberg
Rødøyløva, Mo i Rana. Foto: Kenneth Lauvås
Lillehammer.
33 Indremedisineren 1 • 2024 Indremedisin i Norge

ESIM Winter School 2024
Den europeiske vinterskolen i indremedisin ble holdt i Bjørkliden, Sverige. Det var et opphold preget av faglige innlegg og diskusjoner. Skolen har også en meget god sosial profil.
Hamza Nahoui og Kristine Thoresen, Akershus universitetssykehus og Peder Slettingdalen, Viken sykehus Bærum
Svensk indremedisinsk forening arrangerte 11-17. februar vinterversjonen av europeisk indremedisinsk skole i Bjørkliden i Nord-Sverige, ca 100 km Nord-vest fra byen Kiruna. Bjørkliden er kjent for sine kalde og snørike vintre, noe som gjør området til et ferieparadis for skiturister og vinteraktiviteter. Nordlyset kunne man også oppleve rett utenfor hotellet hvor deltakerne spiste, bodde, lærte, ble kjent og utvekslet medisinsk erfaring.
Vi var omtrent 60 indremedisinske leger under spesialisering fra 21 europeiske land som deltok på årets vinterskole. Mange deltagere hadde reist flere dager for å komme seg til Bjørkliden. De følte seg likevel veldig heldige for å få sjansen. Flere europeiske land hadde valgt ut deltagerne basert på tøffe fagkonkurranser.
Skolens hovedhensikt er å tilby et rikt, variert og moderne indre medisinsk fagprogram. De hadde derfor skaffet forelesere med akademisk bakgrunn, samt indremedisinsk lidenskap og erfaring.
Forelesningene var en kombinasjon av teoretiske foredrag, hands-on trening og konstruktivt gruppearbeid.
Tema som hjertestans, bed-side legekunst og forgiftninger treffer alltid bredt. Diskusjoner om sensitive temaer som behandlingsbegrensninger, arbeidstid og vaktbelastning ga tankevekkere for mange yngre engasjerte leger.
Fagprogrammet inneholdt daglige sesjoner med pasienthistorier fra hvert land som deltok, presentert av en eller flere deltagere. Høy kvalitet i valg av tema og utmerkede presentasjonsevner hos deltagerne preget denne sesjonen.
Like viktig var de sosiale aktiviteter. Sosialisering og nettverksbygging mellom deltagerne startet allerede i togene og flyene på vei til Bjørkliden. Svensk indremedisinsk forening hadde på plass en dedikert tur- og utelivsveileder. Deltagerne fikk en gjennomgående opplæring i turgåing, vinterpåkledning og nordlys fenomenet. I tillegg var alle
fellesmåltidene på hotellet en arena hvor deltakerne kunne skape bånd og fortelle om medisinsk praksis i Europa.
Det var tydelig at skolekomiteen og Svensk indremedisinsk forening hadde lagt en formidabel innsats for å gjennomføre en vellykket uke, full av opplevelser og erfaringer. Mest imponerende var at de kunne styre hverdagen presist etter tidsskjema, men samtidig holde et meget vennlig forhold til skolens deltagere.
Den norske deltagelsen var relativt stor denne gangen. Vi var 3 leger i spesialisering som tok turen til Bjørkliden. Peder Slettingdalen fra Bærum sykehus. Kristine Thoresen og Hamza Nahoui fra Akershus universitetssykehus. I området til hotellet var det preparerte langrennsløyper, slalåmbakke og muligheter for toppturer. I kjente vinteromgivelser, hadde de norske en uforglemmelig og opplevelsesrik uke. Å vise frem skiferdigheter under strålende sol, går nordmenn aldri lei av.
34 Indremedisineren 1 • 2024
Foreningsnytt

Peder Slettingdalen presenterte en pasienthistorie fra avdelingen der han jobber daglig. Han forklarte hvordan lunge-aspergillose kan være en vanskelig diagnose å oppdage tidlig i forløpet. Kliniske symptomer og tegn, forhøyete inflammasjonsmarkører og radiologiske funn kan forveksles med bakteriell og viral pneumoni som er de vanligste årsakene til luftveisinfeksjoner i norske sykehus.
Kaverne dannelser på CT er en pekepinn for å gå videre med mikrobiologiske spesifikke prøver som kan bekrefte diagnosen.
Hamza Nahoui, lege i spesialisering og phd-stipendiat på Akershusuniversitetssykehus foreleste om temaet Søvnapne og hjertesvikt. Foreleseren introduserte fenomenet søvn som et essensielt behov og vane for vår eksistens og helse. Han definerte søvnapne og utdypet diagnostikken og behandlingen av tilstanden. Hovedtyngden til foredraget var den sterke assosiasjonen mellom kardiovaskulær sykdom og søvnapne.
Hjertesvikt kan være betinget i forverrede kardiale tilstander, som søvnapne er en risikofaktor for, eller at patofysiologiske mekanismer, relatert til søvnapne, har skadet hjertefunksjonen direkte. Det ble presentert i foredraget resultatene fra ADVENT HF studien (des 2023) som viste trygghet ved bruk av adaptiv servo ventilering (ASV), sammenlignet med SERVE HF studien som ble stoppet på grunn av en økning

i kardiovaskulær dødelighet blant HFrEF pasienter behandlet med ASV for sin søvnapne.
Indremedisin står sterkt som et fag i de fleste europeiske land. Oppfatningen helsemyndighetene har i Europa er lik som her i Norge. Generalistrollen er sterkt ønsket i sykehusene. Grunnen til det er at det øker effektiviteten av pasientbehandlingen, i tillegg til at pasienten blir sett mer som en helhet. Rekrutteringen av unge indremedisinere er problemfritt så lenge man oppretter stillinger. Muligheten for å jobbe med varierte problemstillinger og flere organer er årsaken som går igjen når man spør yngre europeiske indremedisinere om hvorfor de velger karriere innenfor faget.
Norge er også et nordisk land med unike vinterforhold. Indremedisin har i flere tiår vært bærebjelken i norske sykehus. Å se til hva våre svenske naboer har bidratt med i forbindelse med denne vinterskolen inspirerer norske yngre indremedisinere til å engasjere seg mer i faget, og hvorfor ikke vurdere å få til et slikt arrangement på norsk jord.
Om ett år er det vinterskole igjen. Unge leger med interesse for indremedisin oppfordres sterkt til å søke om plass. Erfaringer for arbeidshverdagen, spesielle natur og turopplevelser og venner for livet er det man kan forvente i løpet av en slik uke.



35 Indremedisineren 1 • 2024 Foreningsnytt
Morten Mowe – pensjonert klinikkleder ved medisinsk klinikk ved Oslo Universitetssykehus
Med fylte 70 år går Morten Mowe av som klinikkleder for Medisinsk klinikk ved Oslo Universitetssykehus (OUS). Han har mange års ledererfaring innen OUS, herunder Aker Universitetssykehus, og er spesialist i både indremedisin, geriatri og gastroenterologi. Vi hadde en interessant samtale omkring hans betraktninger etter mange år som overlege, forsker og leder.


Hvilke tanker gjør seg mest gjeldende når du ser bakover?
– De medisinske fremskrittene har vært store og fantastiske. Jeg husker for eksempel hvordan hjerteinfarkt de første årene ble behandlet med kvalme stillende og smertestillende, via trombolyttisk behandling på slutten av 80-tallet til at man i dag har PCI og åpner hjertets blodårer. Tilsvarende med hjerneinfarkt der man kan «fiske ut blodpropper», noe som bedrer prognosen enormt. Viktig disse årene har også vært erkjennelsen av at pasientene som oftest har flere sykdommer samtidig, og ikke bare den ene. Jeg må også trekke frem overgangen fra skriftlige journaler, som man måtte lete opp ved innleggelser om natten, til dagens digitale journalsystemer. Utviklingen har vært enorm – både faglig og digitalt. Samtidig er det uløste problemer, som det må jobbes videre med å forbedre til beste for alle.
Du startet din legekarrieren med turnus. Fortell litt om dette.
– Min sykehusturnus var på det lutherske sykehus i Porsgrunn og distrikstjenesten i Fetsund, der jeg fortsatte som legevaktslege. Jeg glemmer ikke spøken om frokost på sengen i Porsgrunn, og at jeg til min store overraskelse fikk dette, forteller han med et blygt smil. Jeg hadde før dette jobbet flere år på Aker sykehus, som pleiemedhjelper, laboratorieassistent, skopvakt, og som legevikar de 2 siste studieårene.
Hvorfor ble det indremedisin som spesialitet, og at du fikk spesialitet i både geriatri og gastroenterologi?
– Det var mye en tilfeldighet. På slutten av militærtjenesten i 1987 fortalte en nabo at det var et ledig assistentlegevikariat på medisinsk avdeling B på Aker sykehus. Jeg tok kontakt og kunne «møte opp mandag» Jeg gikk der 2 år i ulike korte rotasjoner. Jeg kom så over et utlyst doktogradsstipend innen eldreernæring hos professor Thomas Bøhmer ved metabolsk avdeling. (idag endokrinologi). Midlene ble stilt til rådighet via Sosialdepertamentet og daværende sosialminister Tove Strand. Gjennom dette kartla vi ernæringsstatus hos eldre, og jeg ble interessert i dette og fortsatte med stillinger innen gastroenterologi og geriatri og ble spesialist i disse to sammen med indremedisin.
Du har også fortsatt med forskning og undervisning. Fortell litt om dette og hvordan har du opplevd forskningen i ditt arbeid?
– Jeg disputerte i februar 1998, og jobbet som universitetslektor i noen år fram mot dette. Jeg fullførte også spesialitetene på denne tiden. Så ble jeg satt til å lede et forbedringsprosjekt på Aker Universitets sylehus: «Pasienten Først», som ble initiert av daværende direktør Mai Len Sundin. I to år jobbet vi med forbedringsprosesser på sykehuset, drevet fra av ansatte. De fleste faggrupper på
sykehuset ble involvert, godt støttet av sykehsuets ledelse og tillitsvalgte.
– Etter dette prosjketarbeidet fortsatte jeg som phd-veileder, som etterhvert også kvalifiserte meg til amanuensis og senere som førsteamanuensis. Jeg hadde da mye studentundervisning. Jeg overtok noen stipendiater etter Thomas Bøhmer da han begynte å trappe ned. Jeg ble bedømt professorkompetent våren 2013, og fortsatte som PhD-veileder for flere yrkesgrupper: lege, tannlege, klinisk farmasøyt og ernæringsfysiologer. Felles tematikk var «ernæring hos eldre»
– Slik fortsatte forskningen parallelt med det kliniske arbeidet.
– Som avdelingsleder på indremedisinsk avdeling på Ullevål var jeg den eneste førsteamanuensis og ble en del av forskningsgruppen her, sammen med det geriatriske miljøet. Dette ble mer krevende fra jeg overtok som klinikkleder i 2018, men jeg er glad for at jeg fortsatt fikk være en del av miljøet og følge den gode forskningen. Jeg tenker å fortsette også de neste årene som professor emeritus.
Hvordan ser du på forskningens plass i dagens medisin?
– Forskning er en av grunnpilarene et universitetssykehus er tuftet på. Som leder har jeg jobbet for å ivareta dette. De store fremskrittene
36 Indremedisineren 1 • 2024 Vi intervjuer
Ole Kristian H. Furulund og Stephen Hewitt, redaksjonen
Ole Kristian H. Furulund
Stephen Hewitt


er mye et resultat av forskning. Det er samtidig viktig å ha et fokus på å implementere forskningsresultatene. Det tar ofte altfor lang tid fra viktige forskningsresultater kommer, til de blir implementert, og noen blir aldri implementert. Dette burde få større fokus fremover. Samtidig bør en ha økt fokus på forbedring av pasientforløp og prosesser i sykehuset, slik at man kan etablere evidens også på dette området.
Hvordan har du klart å holde deg faglig oppdatert?
– I tillegg til det som angår min forskning, har jeg prøvd å følge det som rapporteres fra de store kliniske tidsskriftene, som BMJ, New England Journal, JAGS, og Tidsskriftet Jeg ser at også Indremedisineren formidler mye viktig. Forfatterene her er gjerne fagpersoner med mye internasjonal forskningserfaring. Fra jeg ble klinikkleder ble det mer utfordrende å følge med i den faglige utviklingen – det krever så mye annet å være i en slik stilling. Under pandemitiden ble Folkehelseinstituttet med sin kompetanse en viktig støtte, da ulike nyheter florerte fra dag til dag, og siste status kunne endre seg på kort tid.
På hvilken måte falt det seg naturlig å bli avdelingsoverlege på Aker universitetssykehus og senere klinikkleder på OUS Ullevål?
– Jeg var seksjonsleder på geriatrisk avdeling, da jeg i 2009 tok over som
klinikkleder på Aker universitetssykehus i forbindelse med fusjonen. Men jeg var nok ikke helt klar over utfordringene Aker sto overfor. Med fusjonen og dannelsen av OUS og vedtaket om å legge ned Aker, var det krevende å opprettholde gløden. Fra 2011 ble fagmiljøet delt, der noen begynte på Ahus, Ullevål og Rikshospitalet, og noen gikk privat. Vi fikk etablert en generell indremedisinsk avdeling, men flere var kritiske til dette. Jeg ble avdelingsleder for denne avdelingen, først på Aker og fra juni 2012 på Ullevål, da Indremedisnsk avdeling ble en del av Medisink klinikk, under ledelse av Lena Gjevert. Jeg ble etter hvert assisterende klinikkleder og fortsatte i den stillingen til jeg ble klinikkleder høsten 2018. Av egenskaper jeg vil trekke frem som viktig å ha med seg inn i ledelse, tenker jeg det viktigste er å lytte til og ivareta sine pasienter og ansatte. En kommer langt med alminnelig høflighet overfor de man møter i eller utenfor sykehuset. Av formell lederutdanning ble det noen masterprogram på BI pluss legeforeningens kurs i ledelse. Som leder på avdelingsnivå ser jeg den kliniske erfaringen som helt vesentlig. Forskningserfaringen er også viktig.
Hvordan har din kliniske kompetanse og forskningserfaring påvirket arbeidet som klinikkleder?
– Jeg tror det ville ha vært vanskelig å fungere godt som klinikkleder i OUS uten denne erfaringen. Man kjenner sykehusdrift fra «gulvet».
Man må ikke nødvendigvis være lege, men det er viktig å forstå hvordan pasientene blir påvirket av beslutningene som fattes og ta hensyn til dette i sitt virke. Med forskningens sentrale rolle, er forståelsen og oppmerksomheten rundt dette viktig når man fatter beslutninger. Jeg tror det er svært vanskelig å bli en god klinikkleder uten utdanning innen medisin eller helsefag.
OUS står overfor nye omstillinger med utbygging på Aker og Rikshospitalet, og nedleggelse av Ullevål. Hvordan ser du på utfordringene og mulighetene fremover? Går vi fra vondt til verre?
Jeg støtter målbildet til nye OUS, men mener at Aker burde få enda mer av lokalsykehus-funksjonen enn foreslått. Helsepersonellkommisjonens rapport peker på at det blir færre fagfolk per pasient i tiden som kommer. Vi har også et ansvar å sikre tilstrekkelig med helsepersonell ved andre sykehus i landet. Jeg er opptatt av at sykehuset får bedre fleksibilitet enn det som har vært i gamle sykehusbygg. Men det må ikke bygges så lite at det vanskeliggjør effektiv og god drift og behandlig i framtiden. Selv om det skal bygges for store beløp i Nye OUS, utgjør ikke det mer nn 1-2 års vanlig drift.
Hvilke refleksjoner gjør du deg om utviklingen i spesialisthelsetjenesten i dine år med å ivareta de eldre pasientene?
37 Indremedisineren 1 • 2024 Vi intervjuer
Morten Mowe kobler av med hytteliv.

– Som jeg var inne på har det skjedd store fremskritt. Geriatri har stått frem som et nytt og sterkere fag, og flere områder innen geriatrien har fått mer fokus, som hjerneslag, ernæring, demens, delir, kreft og skrøpelighet. Indremedisin er også et fag å satse på, siden mange av pasientene har lidelse i flere indremedisinske organsystem, og pasienten må legges ett sted som kan ivareta det meste av dette, i samarbeid med de andre spesialitetene. Det har vært fantastisk med utviklingen innen PCI og fisking av cerebrale blodpropper ved hjerneslag. Imidlertid ser jeg også utfordringer innen overbehandling, og vi må få til gode løsninger og god kunnskap omkring når «nok er nok». De økonomiske incentivene fremmer dessverre ikke godt samarbeid mellom spesialistog kommunehelsetjenesten. Finansierings-systemene bør fremme de gode løsningene.
Hvilke tanker gjør du deg om indremedisinens utvikling i tiden fremover?
– Det har vært en stadig økende spesialisering innen indremedisin med flere nye spesialiteter.
Dette er helt sentralt når vi idag kan tilby en helsetjeneste av ypperste klasse. Det er fordeler ved å kunne avgrense sitt fagområde. Dessverre har den nye spesialitetsordningen
gjort det vanskeligere å kombinere generell indremedisin med de tidligere subspesialitetene. Vi ser kompleksiteten med flere parallelle sykdomsmanifestasjoner hos pasientene, og at antallet eldre øker i årene som kommer. Det er for få stillinger innen disse områdene. Jeg mener derfor at vi trenger flere indremedisinere og geriatere, som i større grad kan ta seg av flere problemstillinger hos den enkelte pasient.
Hvordan synes du sykehusvesenet skal utvikle seg fremover for å kunne møte det økte antall eldre på en forsvarlig måte i tiden som ligger foran oss?
– Vi har allerede snakket om endel om dette. Jeg vil videre trekke frem at finansierings-systemene må fremme de gode løsninger. ISF fremmer ikke god håndtering av den gamle pasient med mange ulike lidelser. Her må en ha større fokus på rammefinansiering. Finansieringssystemet bør også fremme god samhandling og samarbeid mellom kommune- og spesialisthelsetjenesten. Legeforeningen har tatt initiativ for å se på dette med overbehandling – og kloke valg. Fremover vil vi se nærmere på hvordan man kan unngå unødige innleggelser, og hvordan geriaterne og indremedisineren kan bistå sykehjemmene med faglige vurderinger. Det er mye gevinst dersom vi kan unngå en unødvendig innleggelse
med en halvtimes samtale. Vi er også involvert i et prosjekt som skal se nærmere på hjemmebehandling av pasienter slik man har erfaring med fra utlandet i det som kalles «Hospital at home».
Hva gleder du deg over i fritiden?
– Arbeidet har tatt mye tid de siste årene. Ofte har jeg vært på jobb kl 07 og kommet hjem til Dagsrevyen. I tillegg til arbeid både lørdag og søndag. Egen forskning måtte vike.
Vi har hytte på Beitostølen som har vært et viktig sted å koble av både vinter som sommer. Forruten familie så har jeg god og nær kontakt med barn og barnebarn med ukentlige treff. Så har jeg en vennegjeng fra russetiden i Sarpsborg i -73, som har holdt sammen, bl.a gjennom månedlig bridgespilling, og med årlige slalomturer til alpene og på sykkelturer i Europa. Neste sykkeltur blir fra München til Wien. Jeg setter også pris på vår gjeng fra gastromedisinsk avdelingen på Aker som har holdt sammen med årlige pinnekjøtt-treff i 30 år. Det har blitt mer av kultur og teater siste tiden og jeg har nå flere begivenheter jeg skal være med på fremover. Med bedre tid har jeg også kommet igang igjen med trening på senter.
Et nest siste spørsmål: Hva vil du savne fra klinikklederrollen?
– Det er mye jeg vil savne men jeg kan nevne noe. Det å være sentral i all den betydelige informasjonsstrøm som skjer på et så stort sykehus vil savnes. Det er fryktelig mye og spennende informasjon som tilkommer en klinikkleder. Samtidig vil jeg også savne de fine folkene i min ledergruppe og i min stab.
Hvilke tips måtte du ha til den som skal overta etter deg?
– Det er viktig som leder å ivareta pasienter og kollegaer på en god og ordentlig måte. Jeg har stor tro på at den nye klinikklederen Asle Medhus vil klare utfordringene bra.
38 Indremedisineren 1 • 2024 Vi intervjuer
Intervju av Morten Mowe (til høyre), Stephen Hewitt til venstre. (Foto: Ole Kristian Furulund)
Takk for nyttig møte
Trine Finnes. Leder, Norsk endokrinologisk forening
Representanter fra brukerorganisasjonene er viktige samarbeidspartnere for helsepersonell når det kommer til bruker medvirkning til forskning, samarbeid om tjenesteutvikling og gjennomføring av primært brukerrettede tilbud som likepersonstjenester. Norsk endokrinologisk forening (NEF) har hatt som mål styrke kontakten med brukerorganisasjonene, og styret har de siste årene invitert representanter fra en aktuell pasientorganisasjon til dialog i forbindelse med styremøtene. Agendaen for møtene har i hovedsak vært å bli kjent med hverandres målsetninger og behov. Vi tilstreber med dette å legge grunnen for bedre samarbeid om konkrete saker, ikke bare mellom brukerorganisasjonene og NEF, men med hele det kliniske og akademiske endokrinologiske miljøet. I forbindelse med tidligere avholdte møter med osteoporoseforbundet (nå innlemmet i revmatikerforbundet), Diabetes forbundet og Morbus Addison Foreningen har vi også invitert de respektive interessegruppene i NEF.
I forbindelse med det aktuelle møtet med Stoffskifteforbundet representerte Kari Lima interessegruppen. Leder for interessegruppen for tyreoidea, Sara Hammerstad er allerede godt kjent med stoffskifteforbundet og deres arbeid, da hun er medisinsk faglige rådgiver i deres faglige råd. Fra stoffskifteforbundet møtte Mette Kaaby (generalsekretær) og Lasse Jangås (kommunikasjonsansvarlig/

politisk rådgiver). Stoffskifteforbundet er en solid organisasjon med fem fulltidsansatte og ca. 8-9000 medlemmer. Dette er langt færre enn de ca. 250 000 personene som lever med stoffskiftesykdom i Norge. Kaaby antydet at medlemsmassen nok i hovedsak utgjøres av dem som har mest plager som følge av sykdommen. Stoffskifteforbundet er en aktiv pasientforening. De utgir medlemsbladet Thyra og har flere lokallag. De deltar i debatter og tar aktivt kontakt med politikere og myndigheter for å få gjennomslag for sine saker.
Representantene møtte godt forberedt og hadde sendt inn ønskede temaer for dialogen på forhånd. De fremhevet spesielt kommunikasjon og faglig formidling og behovet for oppdatering på fag og forskning. Jangås kunne fortelle at artikler om forskning får mange klikk sammenlignet med andre saker. Stoffskifteforbundet bidrar også med forskningsmidler etter søknad. Thyrafondet er på 2,5 millioner kroner. Forbundet etterlyser forskning på flere behandlingsalternativer enn dagens refusjonsberettigede medisiner. Studier av en slik størrelse at de kan føre frem til godkjenning av nye medikamenter er som regel så kostbare at de må finansieres av produsenten selv. Den forsker-initierte forskningen innen tyreoidea-feltet i Norge omfatter studier på Graves oftalmopathi og langtidsoppfølging av personer med høyt stoffskifte. I løpet av diskusjonen ble studien
fra Helse Hardanger på strukturert rehabiliteringsprogram for personer med long-covid nevnt som et tiltak som kan prøves ut i en studie hos personer med stoffskiftesykdom.
Stoffskifteforbundet har gjenopprettet sitt faglige råd som skal kvalitets sikre kunnskapsformidlingen fra forbundet. Fagrådet hadde sitt første møte ultimo januar 2024. Det består blant annet av en tverrfaglig gruppe med fastleger, endokrinologer, psykologer og representanter fra SKIL (senter for kvalitet i legetjeneste). Målet er å lage en kunnskapsdatabase tilgjengelig for medlemmer og deres behandlere. Forbundet ønsker å bidra for å gjøre hverdagen bedre for den lille gruppen som er hardest rammet. Det ble nevnt lærings- og mestringskurs og samlinger i regi av stoffskifteforbundet med mer spesifikke problemstillinger. I den forbindelse gikk vi også gjennom hva som allerede finnes av ressurser for pasienter og fastleger. Særlig Norsk elektronisk legemiddelhåndbok og Nasjonal veiledere i endokrinologi ble trukket frem. Eventuell nasjonal retningslinje fra Helsedirektoratet a la det svenske vårdprogrammet ligger nok langt frem i tid.
NEF ser frem til videre samarbeid med Stoffskifteforbudnet, og gleder oss spesielt til «meet-the-patientsession» på Vintermøtet i 2025.
Trine Finnes


39 Indremedisineren 1 • 2024 Norsk endokrinologisk forening
Trine Finnes
Styret i Stoffskifteforbundet
Mette Kaaby.

Velkommen til Oslo i april 2024
Den 10. norske geriatrikongressen 8.-9. april
Jubileumsutgaven av den norske geriatrikongressene arrangeres i Gamle Logen i Oslo 8. og 9.april.
Marius Myrstad. Leder av arrangementskomiteen
Programmet er variert og spennende, med mange av de største kapasitetene og nestorene i norsk geriatri blant foreleserne, og åpningsforedraget holdes av delirium-eksperten Professor Allasdair Maclullich fra University of Edinburgh. Kongressen passer like godt for sykepleiere, fysio- og ergoterapeuter, andre helsearbeidere og leger som jobber med geriatri og/ eller hjerneslag.
Ikke gå glipp av det sosiale arrangementet på mandagskvelden, 8.april! Dette blir veldig hyggelig og gøy, med underholdning fra øverste hylle med Robert Stoltenberg og tapas! Kveldsarrangementet er inkludert i kongressavgiften!
Frie foredrag
Vi inviterer alle deltakere til å presentere egne prosjekter, forskningsresultater, erfaringer eller aktuelle problemstillinger i form av frie foredrag. Temaer kan hentes fra ethvert område av relevans for helse- og omsorgstjenester for eldre. De som
ønsker å holde et slikt foredrag, må senest 21. mars 2024 sende inn et sammendrag på maksimalt 250 ord. Sammendragene skrives på norsk, og innledes med en kort, dekkende overskrift, fulgt av forfatterens (eller forfatternes) navn, arbeidssted og e-postadresse. Teksten struktureres i fem (ev. fire) avsnitt, som innledes med overskriftene Bakgrunn, Materiale og Metode, Resultater og Fortolkning (ev. Resultater og for tolkning i ett avsnitt). Sammendragene sendes som vedlegg til e-post til marius. myrstad@vestreviken.no.
Norsk forening for geriatri deler ut to priser til de beste frie foredrag. En jury med medlemmer fra kongresskomiteen vil vurdere foredragene.
Som sist vil deltakerantallet bli begrenset til 300 personer. Det er det maksimale lokalet har kapasitet til. Ved påmeldingen vil vi prioritere kongressens primære målgruppe, som er leger og annet helsepersonell med tilknytning til sykehusenes geriatriske avdelinger,

seksjoner og team. For å være sikret plass, er det svært viktig at disse melder seg på innen fristen! Så langt plassen tillater det vil vi også ønske hjertelig velkommen til våre kolleger i primærhelsetjenesten med interesse og engasjement i geriatri, sykehjemsmedisin og eldreomsorg.
Mandag kveld innbyr vi, tradisjonen tro, til et sosialt arrangement med bevertning i Gamle Logen – en av Oslos mest staselige bygninger. Dette arrangementet er inkludert i kongressavgiften, og vi håper på stor oppslutning både av tilreisende og av de som bor i Osloområdet!
Med unntak av forelesningene fra vår utenlandske gjest, vil kongressen foregå på norsk.
Hjertelig velkommen til Gamle Logen i Oslo 8. og 9. april.
Kongresslokale
Gamle Logen, Grev Wedels plass 2, Oslo
Registreringsavgift og betaling: Kongressavgiften er kr 4200,- for leger og kr 3000,- for ikke-leger. Dette dekker deltagelse, skriftlig materiale, lunsj, kaffe/te og frukt begge dager, samt kveldsarrangementet i Gamle Logens store sal mandag 8.april.
Påmelding
Lenke til program, informasjon om frie foredrag og påmelding: butikk.aldringoghelse.no/vaar-2022/ geriatrikongressen-oslo-2022
Påmeldingsfrist 21. mars 2024!
40 Indremedisineren 1 • 2024 Norsk forening for geriatri
Marius Myrstad
Demenskoret. Foto: Hilde Siwers.
Program
Mandag 8. april
08.30-09.30 Ankomst og registrering, kaffe
09.30-10.00 Åpning av kongressen, musikk
Møteleder: Marius Myrstad
10.00-10.45 Åpningsforedrag:
Delirium detection, treatment and prevention
Prof. Alasdair Maclullich, University of Edinburgh
10.45-11.10
11.10-12.30
11.10-11.30
11.30-11.50
11.50-12.10
12.10-12.30
Pause med frukt
Sesjon 1: Demens og delirium
Møteleder: Anette Hylen Ranhoff
Demenssykdommer – kan de forebygges og hva er viktigst?
Prof. Geir Selbæk, Nasjonalt senter for Aldring og Helse
Nye medikamenter mot demenssykdommer – endelig lys i enden av tunnelen?
Førsteamanuensis Ragnhild Eide Skogseth, Universitetet i Bergen
Utredning og behandling av demens i en ny tid – behov for omstilling
Prof. Ingvild Saltvedt, St.Olavs Hospital
Er delirium farlig for hjernen?
Førsteamanuensis Maria Krogseth, Geriatrisk avdeling, sykehuset i Vestfold - Kort reklame for ettermiddagens «Geriatric Corner», samt kveldarrangement
12.30-13.40 Lunsj
13.40-14.35 forts. Sesjon 1: Demens og delirium
13.40-14.00
14.00-14.20
14.20-14.40
14.40-15.40
15.40-16.05
16.05-17.15
16.05-16.30
16.30-16.50
16.50-17.15
Møteleder: Marius Myrstad
Hva er oppmerksomhet og hvordan skille delirium fra demens?
Overlege Bjørn Erik Neerland, Oslo Universitetssykehus
Delirium biomarkører i spinalvæske – hva kan de brukes til og kan de løse demensgåten?
Prof. Leiv Otto Watne, Akershus universitetssykehus
Distress in delirium: detection and management including improving our interactions with Patients
Prof. Alasdair Maclullich, University of Edinburgh
Sesjon 2: Frie foredrag 1
Møteleder: Hege Ihle-Hansen
Pause med kaffe og kake
Sesjon 3: Jubileumssesjon – 20 år med Den norske geriatrikongressen
Møteleder: Marius Myrstad
Norsk geriatri de siste 20 årene, i dag og de neste 20 årene
Prof. Torgeir Bruun Wyller, Oslo universitetssykehus
Velferdsteknologi og sårbare eldre – en umulig kombinasjon?
Førsteamanuensis Nina Jøranson, VID vitenskapelig høgskole
Norsk geriatrisk forskning og betydning for pasientene våre
Prof. emerita Anette Hylen Ranhoff, Diakonhjemmet sykehus
17.20 Felles avmarsj til «Geriatric corner» (mingling på SALT Art & Music)
19.00
Sosialt arrangement med bevertning og underholdning i Gamle Logen
Tirsdag 9. april
08.15-08.45 Ankomst og kaffe
08.45-09.00 Musikk
09.00- 10.40 Sesjon 4: Hjerneslag
Møteleder: Ingvild Saltvedt
09.00-09.20 Hva har vi lært av hjerneslagregisteret – og hva kan vi bruke det til?
Prof. emeritus Bent Indredavik, Hjerneslagregisteret
09.20-09.40 Inflammasjon og kognitiv svikt etter hjerneslag
Stipendiat Heidi Sandvik, Oslo universitetssykehus
09.40-10.00 Språktrening via videokonferanse til afasipasienter etter hjerneslag
Førsteamanuensis Hege Prag Øra, Sunnaas sykehus
10.00-10.20 På jakt etter atrieflimmer
Overlege Håkon Ihle-Hansen, Bærum sykehus, Vestre Viken
10.20-10.40 Indremedisinerens rolle i slagbehandling i 2024
Seksjonsoverlege Yngve Seljeseth, Ålesund sjukehus
10.40-11.10 Pause med frukt
11.10-12.10 Sesjon 5: Frie foredrag 2
Møteleder: Susanne Hernes
12.10-12.30 Sesjon 6: Fall, skrøpelighet og de vanskelige overgangene
Møteleder: Anette Hylen Ranhoff
12.10-12.30 Siste nytt om fallforebygging
Prof. Kristin Taraldsen, OsloMet
12.30-13.40 Lunsj
13.40-15.00 Sesjon 5: Fall, skrøpelighet og de vanskelige overgangene
Møteleder: Torgeir Bruun Wyller
13.40-14.00 Betydning av skrøpelighet hos eldre pasienter med hjertesykdom
Overlege Elisabeth Skaar, Haukeland universitetssykehus
14.00-14.20 Kan skrøpelighet forebygges?
Fagdirektør Susanne Hernes, Sørlandet sykehus, og analysesjef Christian Thoresen, Analyseavdelingen, Helse Sør-Øst
14.20-14.40 Vurdering av skrøpelighet i primærhelsetjenesten Stipendiat Isabel Sebjørnsen, Nasjonalt kompetanse senter for legevaktmedisin, NORCE og Universitetet i Bergen
14.40-15.00
Eldre med skrøpelighet i akuttmottaket Seksjonsoverlege Jørn Rasmussen, Drammen sykehus
15.00-15.30 Sesjon 7: Avslutning
Møteleder: Marius Myrstad
15.00-15.15 Ved siste korsvei – om Peer Gynt, løk, innsikt og kjærlighet
Overlege Marte Mellingsæter, Akershus universitetssykehus
15.15-15.25
Utdeling av Norsk geriatrisk forenings priser for de to beste frie foredrag
ved leder for Norsk forening for geriatri Paal Naalsund
15.25-15.30 Kunngjøringer, kommende møter og kongresser ved Prof. emerita Anette Hylen Ranhoff
41 Indremedisineren 1 • 2024 Norsk forening for geriatri




Velkommen til Indremedisinsk
HØSTMØTE 2024
17. og 18. oktober, Hotell Bristol, Oslo
Fjorårets møte med temaet ”førstehjelp for medisinske bakvakter og andre vaktgående leger” ga oss faglige oppdateringer innenfor medisinske tilstander mange av oss kan stå overfor på vakt. Årets høstmøte vil også rette seg mot vaktgående leger med mål om å styrke og ivareta breddekompetanse i indremedisin. Program vil komme i neste nummer av Indremedisineren.
Nytt for året er at vi vil ha en kasuistikkonkurranse. Har du en spennende kasuistikk fra din jobbhverdag? Meld deg på til kasuistikkonkurransen! Tre av innsenderne vil bli invitert til å presentere sin kasuistikk på høstmøtet. Den beste kasuistikken premieres med et stipend på inntil NOK 25000 til

den amerikanske indremedisinske kongressen ACP (American College of Physicians) 2025. Abstrakt på maksimalt 300 ord sendes til programkomiteen på e-post hostmotet@indremedisineren.no innen 01.06.24.
Indremedisineren og indremedisinsk høstmøte ønsker å bidra til å beholde fellesskapet mellom de indremedisinske spesialitetene og håper at nettopp du kommer på årets møte.
Vennlig hilsen
Høstmøte komiteen ved
Jelena Soares
Maria Seferowicz
Cecilie Nordmo






KAN DET VÆRE ATTR-CM?
KAN DET VÆRE ATTR-CM?
KAN DET VÆRE ATTR-CM?
KAN DET VÆRE ATTR-CM?
Tenk på det!
Tenk på det!
Tenk på det!
Tenk på det!
ATTR-CM er en dødelig sykdom som det er lett å overse.
ATTR-CM er en dødelig sykdom som det er lett å overse. Den er også lett å diagnostisere – bare du tenker på det!
ATTR-CM er en dødelig sykdom som det er lett å overse.
Den er også lett å diagnostisere – bare du tenker på det!
ATTR-CM er en dødelig sykdom som det er Den er også lett å diagnostisere – bare du
Tenk på det!
Den er også lett å diagnostisere – bare du tenker på det!
ATTR-CM er en dødelig sykdom som det er lett å overse. bare du tenker på det!

Tenk på transtyretin amyloid ardiomyopati (ATTR-CM)
år du ser: 1,2
Tenk på transtyretin amyloid kardiomyopati (ATTR-CM) når du ser: 1,2
Tenk på transtyretin amyloid kardiomyopati (ATTR-CM) når du ser: 1,2
Tenk på transtyretin amyloid kardiomyopati (ATTR-CM) når du ser: 1,2
Tenk kardi når du
Tenk på transtyretin kardiomyopati (ATTR-CM) når du ser: 1,2
Venstre ventrikkel (LV)veggtykkelse ≥ 12 mm
Venstre ventrikkel (LV)veggtykkelse ≥ 12 mm
Venstre ventrikkel (LV)veggtykkelse ≥ 12 mm
Venstre ventrikkel (LV)veggtykkelse ≥ 12 mm
Hjertesvikt
Hjertesvikt
Hjertesvikt
Venstre ventrikkel (LV)veggtykkelse ≥ 12 mm
Hjertesvikt
Pasient ≥ 65* år
Hjertesvikt
Pasient ≥ 65* år
Pasient ≥ 65* år
Pasient ≥ 65* år
Les mer på www.kardialamyloidose.no
Les mer på www.kardialamyloidose.no
Les mer på www.kardialamyloidose.no
Les mer på www.kardialamyloidose.no

www.pfi.sr/utred
Se Rune Mo sitt foredrag
Pasient ≥
Se Rune Mo sitt foredrag “Hvem skal utredes for ATTR hjerteamyloidose og hvordan?”
www.pfi.sr/utred
www.pfi.sr/utred
www.pfi.sr/utred
Se Rune Mo sitt foredrag “Hvem skal utredes for ATTR hjerteamyloidose og hvordan?”
Se Rune Mo sitt foredrag “Hvem skal utredes for ATTR hjerteamyloidose hvordan?”
* Menn ≥65 år eller kvinner ≥ 70
Se Rune
KAN DET VÆRE ATTR-CM?
PP-UNP-NOR-0936 November 2023
Referanser: 1. Dorbala S, Ando Y, Bokhari S, et al. J Nucl Cardiol. 2019;26(6):2065-2123. Addendum: J Nucl Cardiol. Published online July 1, 2021. 2. Garcia-Pavia P, Rapezzi C, Adler Y, et al. Eur Heart J. 2021;42(16):1554-1568. 3. Witteles RM, Bokhari S, Damy T, et al. JACC Heart Fail. 2019;7(8):709-716.
* Menn ≥65 år eller kvinner ≥ 70 år.3
Pfizer AS - Postboks 3, 1324 Lysaker - www.pfizerpro.no ATTR-CM er en dødelig sykdom som det er lett å overse.
å diagnostisere
KAN DET VÆRE ATTR-CM? Tenk på det!
Den er også lett
– bare du tenker på det!
PP-UNP-NOR-0936 November 2023
Ando Y, Bokhari S, et al. J Nucl Cardiol. 2019;26(6):2065-2123. Nucl Cardiol. Published online July 1, 2021. P, Rapezzi C, Adler Y, et al. Eur Heart J. 2021;42(16):1554-1568. Bokhari S, Damy T, et al. JACC Heart Fail. 2019;7(8):709-716.
Menn ≥65 år eller kvinner ≥ 70 år.3
*
skal
ATTR
“Hvem
utredes for
hjerteamyloidose og hvordan?”
Pfizer AS - Postboks 3, 1324 Lysaker - www.pfizerpro.no
Les mer
Mo “Hvem skal ATTR hjerteamyloidose hvordan?” Les mer på www.kardialamyloidose.no
S, Ando Y, Bokhari S, et al. J Nucl Cardiol. 2019;26(6):2065-2123. Addendum: J Nucl Cardiol. Published online July 1, 2021. Garcia-Pavia P, Rapezzi C, Adler Y, et al. Eur Heart J. 2021;42(16):1554-1568. RM, Bokhari S, Damy T, et al. JACC Heart Fail. 2019;7(8):709-716.
≥ 70
* Menn ≥65 år eller kvinner
Referanser: Dorbala S, Ando Y, Bokhari S, et al. J Nucl Cardiol. 2019;26(6):2065-2123. Addendum: J Nucl Cardiol. Published online July 1, 2021. Garcia-Pavia P, Rapezzi C, Adler Y, et al. Eur Heart J. 2021;42(16):1554-1568. Witteles RM, Bokhari S, Damy T, et al. JACC Heart Fail. 2019;7(8):709-716.
LV veggtykkelse ≥ 12 mm

Helseforetakene anbefaler Calquence som førstevalg BTKi i anskaffelsen fra 1/10-20231

Viktig sikkerhetsinformasjon
CalquenCe
® (akalabrutinib)
Helseforetakene anbefaler Calquence i anskaffelsen fra 1/10-2023. Førstevalg BTK hemmer ved KLL i førstelinje for høyrisiko pasienter (del17p, mutTP53 eller del11q) og for pasienter med tilbakefall1
CALQUENCE er indisert for behandling av voksne med tidligere ubehandlet kronisk lymfatisk leukemi (KLL) som monoterapi eller i kombinasjon med obinutuzumab, eller som monoterapi for behandling av voksne med kronisk lymfatisk leukemi (KLL) som har fått minst én tidligere behandling.2
Alvorlige blødninger er sett. Pasienter som bruker antitrombotiske midler kan ha økt risiko for blødning og forsiktighet skal utvises ved bruk. Atrieflimmer/flutter forekom hos pasienter med hematologiske maligniteter både ved monoterapi og i kombinasjon med obinutuzumab.2
Viktig informasjon om Calquence (akalabrutinib)
Indikasjoner: Som monoterapi eller i kombinasjon med obinutuzumab, til behandling av voksne med tidligere ubehandlet kronisk lymfatisk leukemi (KLL). Som monoterapi til behandling av voksne med KLL som har fått minst 1 tidligere behandling. Dosering: Behandling skal igangsettes og følges opp av lege med erfaring i bruk av legemidler mot kreft. Voksne: Anbefalt dose er 100 mg 2 ganger daglig. Behandling bør fortsette inntil sykdomsprogresjon eller uakseptabel toksisitet. Forsiktighetsregler: Alvorlige blødninger, inkl. blødning i CNS og gastrointestinal blødning er sett. Pasienter som bruker antitrombotiske midler kan ha økt risiko for blødning og forsiktighet skal utvises ved bruk. Warfarin eller an-dre vitamin K-antagonister skal ikke gis samtidig med akalabrutinib. Atrieflimmer/flutter forekom hos pasienter med hematologiske maligniteter både ved monoterapi og i kombinasjon med obinutuzumab. Overvåk for symptomer på atrieflimmer og atrieflutter og foreta EKG om nødvendig. Ved høy risiko for tromboembolisk sykdom, skal nøye kontrollert behandling med antikoagulanter og andre behandlingsalternativer vurderes. Interaksjoner: Samtidig bruk av sterke CYP3A-hemmere skal unngås; kan gi økt eksponering for akalabrutinib og dermed økt risiko for toksisitet. Dersom slike hemmere skal brukes i en kort periode (f.eks. antiinfektiva i opptil 7 dager), skal behandlingen avbrytes. Pasienten skal overvåkes nøye hvis en moderat CYP3A-hemmer brukes. Samtidig bruk av en CYP3A-induktor og sterke CYP3A4-induktorer skal unngås; vil kunne gi redusert eksponering og risiko for manglende effekt. Akalabrutinib kan øke eksponeringen for samtidig administrerte BCRP-substrater (f.eks. metotreksat) ved å hemme BCRP i tarm. Metabolitten ACP-5862 kan øke eksponeringen for samtidig administrerte MATE1-substrater (f.eks. metformin). Bivirkninger: Svært vanlige (≥1/10): Anemi, nøytropeni, trombocytopeni. Abdominalsmerter, diaré, forstoppelse, kvalme, oppkast. Fatigue. Hud: Utslett. Infeksiøse: Nasofaryngitt, pneumoni, sinusitt, urinveisinfeksjon, øvre luftveisinfeksjon. Blåmerke, blødning/hematom, kontusjon, petekkier. Artralgi, muskel-skjelettsmerter. Hodepine, svimmelhet. Ny primær malignitet. Undersøkelser: Redusert Hb, redusert absolutt nøytrofiltall, redusert trombocyttall. Vanlige (≥1/100 til <1/10): Trombocytopeni. Asteni. Atrieflimmer/-flutter. Bronkitt, herpesvirusinfeksjon. Kar: Ekkymose, epistakse, gastrointestinal blødning, intrakraniell blødning, hypertension. Ikke-melanom hudkreft, sekundær primær malignitet. Pakninger og priser: 60 stk. (blister) kr 76267,60. Reseptgruppe C. Refusjon: H-resept. Rekvirering skal gjøres i tråd med anbefalinger fra RHF, og refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist. Calquence er godkjent refundert som monoterapi eller i kombinasjon med et anti CD20-antistoff, til behandling av voksne pasienter med tidligere ubehandlet kronisk lymfatisk leukemi (KLL) med 17p-delesjon/TP53-mutasjon og/eller 11q-delesjon, eller som monoterapi hos KLL pasienter som har fått minst én tidligere behandling. Calquence inngår i Helseforetakenes anbefaling for KLL (Onkologi 2307, gjeldende fra 1.10.2023):Som monoterapi eller i kombinasjon med et anti CD20-antistoff, til behandling av voksne pasienter med tidligere ubehandlet kronisk lymfatisk leukemi (KLL) med 17p-delesjon/TP53-mutasjon og/eller 11q-delesjon (førstevalg BTK hemmer). - Til behandling av voksne pasienter med kronisk lymfatisk leukemi (KLL) som har fått minst én tidligere behandling (førstevalg BTK-hemmer). For mer info. om Calquence, les FK tekst på www.felleskatalogen.no eller godkjent SPC. Beslutningsforum for Nye Metoder, sak 153-20221, og sak 167-20221, www.nyemetoder.no. ID: NO-11408-11-23-ONC
Referanser: 1. https://www.sykehusinnkjop.no/avtaler-legemidler/onkologi 2. Calquence SPC. section 4.1, 4.4, 5.1
AstraZeneca Nordic • Postboks 6050 Etterstad 0601 Oslo • www.astrazeneca.no
NO-11526-11-23-ONC




















































 Oddvar Oppegaard
Oddvar Oppegaard























 Sykehuset Levanger
Kirkenes sykehus. Foto: Bernt Nilsen
Kongsberg
Rødøyløva, Mo i Rana. Foto: Kenneth Lauvås
Lillehammer.
Sykehuset Levanger
Kirkenes sykehus. Foto: Bernt Nilsen
Kongsberg
Rødøyløva, Mo i Rana. Foto: Kenneth Lauvås
Lillehammer.






























