

GENIE 4 Chemie ©VANIN
Heb je nog geen account?
Ga naar myvanin.be en registreer je. Registreer je via een Smartschool-account? Koppel dan je e-mailadres aan je account.
Heb je je account aangemaakt?
Meld je aan op myvanin.be Activeer onderstaande code. Klik op het geactiveerde leermiddel om ermee aan de slag te gaan op iDiddit. Lukt het niet om de code te activeren? Neem dan contact op met onze klantendienst.
LET OP: DEZE CODE IS UNIEK, EENMALIG TE ACTIVEREN EN GELDIG VOOR EEN PERIODE VAN 12 MAANDEN NA ACTIVATIE
GENIE 4 Chemie ©VANIN
!
Help, de activatiecode hierboven is al gebruikt! Krijg je bij het activeren van de bovenstaande code de melding dat de activatiecode reeds in gebruik is? Dan ben je wellicht niet de eerste leerling die met dit leerboek aan de slag gaat. Op vanin.be/leerboeklicentie kun je terugvinden welke stappen je kunt ondernemen of hoe je een nieuwe licentie kunt aankopen.
Tip: Normaal gezien mag je niet schrijven in een leerboek. Per uitzondering mag jij na activatie de bovenstaande activatiecode doorstrepen.
Eerste druk 2025
ISBN 978-94-647-0849-3
Vormgeving en ontwerp cover: Shtick
Tekeningen: Geert Verlinde, Tim Boers (Studio B) D/2025/0078/125
Zetwerk: Barbara Vermeersch Art. 608620/01 NUR 126 Via www.ididdit.be
Dit leermiddel is onderdeel van de lesmethode GENIE Chemie van Uitgeverij VAN IN. Het is ontwikkeld met de intentie dat iedere leerling zich herkent en thuis voelt in beeld en tekst. Heb je op- of aanmerkingen, dan kun je contact opnemen met Uitgeverij VAN IN.
Fotokopieerapparaten zijn algemeen verspreid en vele mensen maken er haast onnadenkend gebruik van voor allerlei doeleinden. Jammer genoeg ontstaan boeken niet met hetzelfde gemak als kopieën. Boeken samenstellen kost veel inzet, tijd en geld. De vergoeding van de auteurs en van iedereen die bij het maken en verhandelen van boeken betrokken is, komt voort uit de verkoop van die boeken.
In België beschermt de auteurswet de rechten van deze mensen. Wanneer u van boeken of van gedeelten eruit zonder toestemming kopieën maakt, buiten de uitdrukkelijk bij wet bepaalde uitzonderingen, ontneemt u hun dus een stuk van die vergoeding. Daarom vragen auteurs en uitgevers u beschermde teksten niet zonder schriftelijke toestemming te kopiëren buiten de uitdrukkelijk bij wet bepaalde uitzonderingen. Verdere informatie over kopieerrechten en de wetgeving met betrekking tot reproductie vindt u op www.reprobel.be.
Ook voor het digitale lesmateriaal gelden deze voorwaarden. De licentie die toegang verleent tot dat materiaal is persoonlijk. Bij vermoeden van misbruik kan die gedeactiveerd worden. Meer informatie over de gebruiksvoorwaarden leest u op www. ididdit.be.
© Uitgeverij VAN IN, Wommelgem, 2025
De uitgever heeft ernaar gestreefd de relevante auteursrechten te regelen volgens de wettelijke bepalingen. Wie desondanks meent zekere rechten te kunnen doen gelden, wordt verzocht zich tot de uitgever te wenden.
Credits
p. 24 Fast and Furious © Shutterstock/Steve Lagreca, p. 25 Archeologen © Getty Images/DPA/AFP/Andreas Arnold, p. 31 Ontstopper © Shutterstock/RVillalon, p. 74 Mijngas © Shutterstock/Sunshine Seeds, p. 76 Benzinepomp © Shutterstock/DarSzach, p. 85 Jupiler © Shutterstock/defotoberg, p. 88 Festival © Shutterstock/Christian Bertrand, p. 96 Voedingswaarden frisdrank © kiliweb per Open Food Facts / CC BY-SA 3.0, p. 131 Jezushagedis © Imageselect/Scott Linstead Science Source
©VANIN
INHOUD
` HOOFDSTUK 1: Verdere indeling van de materie 9
1 Organische en anorganische stoffen 9
2 Het oxidatiegetal 12
3 Indeling van de anorganische stoffen 14
3.1 Van formule naar stofklasse 15
3.2 Van naam naar stofklasse 15
1
2 De metaaloxiden
2.1 Metalen met slechts 1 mogelijk oxidatiegetal
2.2 Metalen met meerdere mogelijke oxidatiegetallen
3 De niet-metaaloxiden
4 Gebruik en toepassingen van oxiden
5 Reactiepatronen
5.1 Vorming metaaloxiden
5.2 Vorming niet-metaaloxiden
THEMA 02: ORGANISCHE STOFKLASSEN
` HOOFDSTUK 1: Organische chemie of koolstofchemie
1 Bindingsmogelijkheden van het koolstofatoom 57
2 Notatiemogelijkheden van een organische stof 59
2.1 De brutoformule 59
2.2 De uitgebreide en beknopte structuurformule 59
2.3 De skeletnotatie of zaagtandstructuur 61
3 De stofklassen 63
` HOOFDSTUK 2:
1 Formule en systematische naam 67
2 Fysische eigenschappen, voorkomen en toepassingen uit het dagelijks leven 70
2.1 Fysische eigenschappen 70
2.2 Voorkomen en toepassingen uit het dagelijks leven 73
THEMA 03: CHEMISCH REKENEN
` HOOFDSTUK 1: Atoommassa, molecuulmassa, formulemassa 81
1 Atoommassa 81
2 Molecuulmassa 82
3 Formulemassa 83
` HOOFDSTUK 2: De mol en het getal van Avogadro 85
1 De mol als eenheid en de molaire massa 85
2 Omrekeningen gram / mol / aantal deeltjes 89
` HOOFDSTUK 3: Concentratie van een oplossing 94
1 Wat is een concentratie van een oplossing? 94
2 Massaconcentratie 95
3 Molaire concentratie of stofhoeveelheidsconcentratie 97
4 Oplossingen verdunnen en indampen 98
` HOOFDSTUK 4: Chemisch rekenen met gassen 102
1 Het molaire gasvolume onder normomstandigheden 102
` HOOFDSTUK 5: Stoichiometrische vraagstukken 105 (verdieping 2u)
1 De molverhouding 105
2 Vraagstukken waarbij 1 stofhoeveelheid is gegeven 107
THEMA 04: POLARITEIT EN OPLOSBAARHEID
` HOOFDSTUK 2: Intermoleculaire krachten 126
1 Invloed van massa en polariteit op het kookpunt van een stof 126 2 Intermoleculaire krachten 128 2.1 De Londonkracht of Londondispersiekracht
©VANIN
` HOOFDSTUK 1: Polaire en apolaire bindingen en moleculen 117
1 Het dipoolkarakter van water 117
2 De elektronegativiteit 118
3 Polariteit van de binding 119
4 Polariteit van
` HOOFDSTUK 3: Oplosbaarheid en geleidbaarheid van stoffen 133
1 Oplosbaarheid van ionverbindingen in polaire en apolaire oplosmiddelen 133
2 Oplosbaarheid van moleculaire verbindingen 136 3 Ionisatie van zuren en ammoniak 138
algemeen
4 Verband tussen zuurtegraad en concentratie van protonen 142
THEMA 05: REACTIESOORTEN
` HOOFDSTUK 1: Soorten chemische reacties 151
1 Ionuitwisselingsreactie versus redoxreactie 151
2 Classificatie ionuitwisselingsreacties aan de hand van waarnemingen 152
` HOOFDSTUK 2: Ionuitwisselingsreacties van dichtbij bekeken 156
1 Algemene notatie van ionuitwisselingsreacties 156
1.1 Visuele weergave 156
1.2 Weergave met behulp van reactievergelijkingen 157
2 Neerslagreacties 160
2.1 Oplosbaarheid in water: gebruik van de oplosbaarheidstabel 160
2.2 Neerslagreacties opstellen 161
INHOUD
3 Gasontwikkelingsreacties 163
3.1 Veelvoorkomende gassen in chemische reacties 163
3.2 Gasontwikkelingsreacties opstellen 164
4 Neutralisatiereacties 166
` HOOFDSTUK 3: Redoxreacties van dichtbij bekeken 169
©VANIN
1 Redoxreacties ontleden 169
2 Redoxreacties opstellen 171
Als er binnen een bepaalde paragraaf verdieping is, dan duiden we dat aan met een oranje lijn.
ANORGANISCHE STOFKLASSEN 01 THEMA
In de straten van Londen werd door het ESEF (European Science and Environment Forum) een enquête uitgevoerd. Aan toevallige voorbijgangers werd de volgende stelling voorgelegd:
‘De industrie maakt vaak gebruik van diwaterstofmonoxide. Die chemische stof is het hoofdbestanddeel van zure regen, draagt bij tot erosie en verlaagt het remvermogen van een auto. De stof beïnvloedt ook de gezondheid van de mens: in gastoestand kan ze ernstige brandwonden veroorzaken, in de longen kan ze leiden tot de dood en ze wordt ook teruggevonden in kankercellen. Vind jij dat dat product aan een strikte reglementering zou moeten worden onderworpen of misschien zelfs verboden zou moeten worden door de Europese Unie?’
Wat denk je dat de meeste mensen hebben geantwoord? Ontdek het via het extra materiaal op .

` Zit er een logica in de naamgeving van stoffen?
` Kan een chemicus over de taalgrenzen heen duidelijk maken over welke stof die het heeft?
We zoeken het uit! ?
VERKEN
• mengsels en zuivere stoffen van elkaar onderscheiden;
• enkelvoudige en samengestelde stoffen herkennen;
• de formule van moleculen interpreteren.

• van enkelvoudige stoffen de naam geven en de formule vormen;
• eigenschappen en toepassingen aan enkelvoudige stoffen verbinden.
©VANIN
• samengestelde stoffen nog verder indelen in anorganische en organische stoffen.

• de anorganische stoffen verder indelen op basis van hun naam, formule of toepassing.
• het onderscheid tussen een atoombinding, ionbinding en metaalbinding uitleggen;
• de lewisstructuur en formule-eenheid van verbindingen opstellen.
• formules van anorganische stoffen interpreteren.
Organisch afval
Anorganisch afval Restafval
JE KUNT AL ...
JE LEERT NU ...
HOOFDSTUK 1
Verdere indeling van de materie
Vorig schooljaar lag de focus op de enkelvoudige stoffen. We zijn gestart met het onderzoeken van de materie. We hebben de materie ingedeeld in mengsels en zuivere stoffen. De zuivere stoffen konden nog verder ingedeeld worden in samengestelde stoffen en enkelvoudige stoffen.
Dit jaar gaan we dieper in op de samengestelde stoffen.
LEERDOELEN
L de samengestelde stoffen verder indelen in anorganische en organische samengestelde stoffen
L de anorganische stoffen indelen in hun stofklasse
L het begrip ‘oxidatiegetal’ toelichten en het oxidatiegetal bepalen
L formules opstellen aan de hand van het oxidatiegetal
L de algemene principes van naamgeving bij anorganische stoffen toepassen
1 Organische en anorganische stoffen
Alle stoffen die afkomstig zijn van de levende natuur worden ingedeeld bij de organische stoffen. Vetten, eiwitten, suiker … behoren allemaal tot de organische stoffen. Maar ook alle aardolieproducten behoren tot de organische stoffen. Ze ontstaan uit afgestorven organismen die onder hoge druk en een hoge temperatuur in aardolieproducten omgezet worden.
Voorbeelden van organische stoffen zijn aardgas en eiwitten in vlees.

©VANIN

Afb. 1 Aardgas is een organische stof.
Afb. 2 Eiwitten in vlees zijn organische stoffen.
Een andere, betere naam voor organische stoffen is koolstofverbindingen, want dat hebben al die stoffen gemeenschappelijk: ze bevatten allemaal het element koolstof. Maar de indeling ‘organische en anorganische stoffen’ is zodanig ingeburgerd dat die nog steeds wordt gebruikt.
Een andere naam voor anorganische stoffen is minerale verbindingen. Die stoffen zijn afkomstig van de levenloze natuur. Denk maar aan bijvoorbeeld mineralen en gesteenten.
Voorbeelden van anorganische stoffen zijn keukenzout en marmer:


©VANIN
WEETJE
Vroeger ging men ervan uit dat organische stoffen niet in een laboratorium konden worden gemaakt. In 1828 werd dat idee ontkracht: toen werd ureum, een stof aanwezig in urine, gemaakt uit alleen maar anorganische stoffen. En er zijn zelfs een heleboel stoffen die, omwille van hun chemische structuur, tot de organische stoffen behoren, maar zelfs niet door levende organismen worden gemaakt. Dat zijn de kunststoffen
De onderstaande tabel geeft de eigenschappen van de anorganische en de organische stoffen weer:
Anorganische stoffen (minerale verbindingen)
Organische stoffen (koolstofverbindingen) afkomstig van de levenloze natuur afkomstig van de levende of afgestorven natuur uitgebreide keuze uit atoomsoorten: 92 elementen van het PSE beperkte keuze uit atoomsoorten: steeds C, vaak H, maar vaak ook N, O, S of X (halogenen) beperkt aantal atomen per verbinding aantal atomen per molecule kan gaan van heel weinig (5) tot enorm veel (>100 000) totale verzameling van verbindingen is beperkt totale verzameling van verbindingen is zeer uitgebreid atoombindingen, ionbindingen, metaalbindingen voornamelijk atoombindingen
1 Eigenschappen van anorganische en organische stoffen
Afb. 4 Marmer is een anorganische stof.
Afb. 3 Keukenzout is een anorganische stof.
Tabel
Je vindt het misschien raar dat de groep van organische verbindingen veel uitgebreider is dan die van de anorganische verbindingen. Voor de organische verbindingen kun je maar gebruikmaken van een zeer beperkt aantal elementen, terwijl je voor de anorganische verbindingen gebruik kunt maken van ongeveer alle elementen uit het PSE. Je kunt dat gemakkelijk begrijpen als je aan legoblokjes denkt. Om de organische verbindingen te vormen, kun je kiezen uit ongeveer 10 kleuren. Om de anorganische verbindingen te maken, mag je gebruikmaken van 92 verschillende kleuren legoblokjes. Hoe komt het dan dat je veel meer verschillende bouwwerken kunt maken met slechts zo’n beperkt aantal kleuren van blokjes? Je kunt misschien maar kiezen uit 10 kleuren, maar je kunt wel heel veel blokjes in eenzelfde bouwwerk steken. Voor de anorganische verbindingen mag een bouwwerk (formule-eenheid of molecule) slechts uit een zeer beperkt aantal blokjes bestaan. Daarom is de groep van de anorganische verbindingen minder uitgebreid.
De indeling in organische en anorganische stoffen is niet altijd even gemakkelijk. Zo zul je bijvoorbeeld CO2 waarschijnlijk bij de organische verbindingen indelen. Het is namelijk afkomstig van de levende natuur – we ademen het uit – en de formule bevat ook het element koolstof. Toch zul je ontdekken dat de stof tot de anorganische stoffen behoort. Naast CO2 zijn er nog moleculen die, ook al bevatten ze het element koolstof, toch niet tot de organische verbindingen behoren. We gaan later verder in op die uitzonderingen.
WEETJE
anorganische samenstelling 6 %
samenstelling
ORGANISCH
ANORGANISCH
DNAsuiker keukenzoutzilver
methaanethanol diamant koolstofdioxide
5 Organische en anorganische stoffen
GEN4_CHE_LB_KOV_T1_H1_organisch.ai
Het is niet omdat organische stoffen afkomstig zijn van levende organismen, dat er in een levend organisme geen anorganische stoffen aanwezig zijn. Zoals je kunt zien op afbeelding 6, bestaat het menselijk lichaam zelfs voor het grootste deel uit anorganische stoffen: water is namelijk een anorganische stof.
GEN4_CHE_LB_KOV_T1_H3_kalkwater_koolstofdioxide.ai
De formule-eenheid geeft de samenstelling weer van de kleinste eenheid waaruit het ionrooster is opgebouwd.
©VANIN
Anorganische stoffen (minerale verbindingen)
Organische stoffen (koolstofverbindingen) afkomstig van de levenloze natuurafkomstig van de levende of afgestorven natuur uitgebreide keuze uit atoomsoorten: 92 elementen van het PSE beperkte keuze uit atoomsoorten: steeds C, vaak H, maar vaak ook N, O, S of X (halogenen) beperkt aantal atomen per verbindingaantal atomen per molecule kan gaan van heel weinig (5) tot enorm veel (>100 000) totale verzameling verbindingen is beperkt totale verzameling verbindingen is zeer uitgebreid atoombindingen, ionbindingen, metaalbindingen voornamelijk atoombindingen
Afb. 6 Ons lichaam bestaat voor 70 % uit water.
Afb.
Op vind je meer info over chemische bindingen in het vademecum.
2 Het oxidatiegetal
Om voor samengestelde stoffen de formule te vormen, is het gemakkelijk om met het begrip oxidatiegetal (OG) te werken. Het oxidatiegetal is het aantal elektronen dat een atoom zou opnemen of afstaan bij overgang naar de ionaire vorm.
Voor de ionbinding komt het oxidatiegetal overeen met de lading van het ion. Voor de elementen in een atoombinding komt dat overeen met de lading die het element zou krijgen wanneer we zouden doen alsof het een ionbinding zou zijn. Het niet-metaal met de hoogste elektronegatieve waarde (het sterkste niet-metaalkarakter) zal een negatief oxidatiegetal krijgen en het andere niet-metaal een positief oxidatiegetal. We gaan er in thema 05 nog dieper op in.
Het oxidatiegetal wordt genoteerd door een Romeins cijfer voorafgegaan door de juiste lading: —een + wanneer het element elektronen wil afstaan —een – wanneer het element elektronen wil opnemen
VOORBEELD OXIDATIEGETALLEN
Een oxidatiegetal van +II betekent dat het element 2 elektronen wil afstaan bij overgang naar de ionaire vorm. Zo is het oxidatiegetal van beryllium in een samengestelde stof +II.
In peroxiden
Bij de atomen van een enkelvoudige stof is het OG van elk element = 0.
Bv. Fe: OG = 0
O2: OG = 0
Bij monoatomische ionen is het OG van het ion = de relatieve ionlading.
Bv. Na+: OG = +I
Ca2+: OG = +II
Een oxidatiegetal van -II betekent dat het element 2 elektronen wil opnemen bij overgang naar de ionaire vorm. Zo is het oxidatiegetal van zuurstof in een samengestelde stof (meestal) -II.
Verschillende elementen hebben slechts 1 mogelijk oxidatiegetal verschillend van nul.
Alle elementen uit groep Ia hebben in een samengestelde stof een oxidatiegetal van +I. Al die elementen hebben maar 1 elektron op de buitenste schil. Met andere woorden, ze willen dat elektron afstaan om de edelgasconfiguratie te bekomen. Analoog hebben alle elementen uit groep IIa in een samengestelde stof een oxidatiegetal van +II.
Bij de niet-metalen heeft fluor in een samengestelde stof 1 mogelijk oxidatiegetal, namelijk -I Fluor wilt 1 elektron opnemen om de edelgasconfiguratie te bereiken. Zuurstof heeft meestal een oxidatiegetal van -II, want het wil 2 elektronen opnemen om de edelgasconfiguratie te bereiken. Edelgassen bezitten logischerwijze een oxidatiegetal van nul: ze willen immers geen elektronen opnemen of afgeven omdat ze de edelgasconfiguratie al bezitten.
Voor de elementen met meerdere mogelijke oxidatiegetallen mag je een tabel gebruiken (tabel 2). Je vindt ze ook op de achterkant van het PSE. De verklaring voor de oxidatiegetallen zie je pas in het 5de jaar.
Symbool element Mogelijke oxidatiegetallen
+III +V
-I +I +III +V +VII +II
-I +I +III +V +VII
+II +III +VI
-III +III +V
+I +III
+II +III
-I +I +III +V +VII
+II +III
+II +IV
+I +II
+I +II
Tabel 2 Oxidatiegetallen
Symbool element Mogelijke oxidatiegetallen
+IV +II +III +IV +VI +VII
+III
+IV +IV +V +VI
+I +II +III +IV +V
+IV
+VI
+IV +VI
Voor de a-groepen IVa tot en met VIIa is het hoogst mogelijke oxidatiegetal gelijk aan het groepsnummer. Het laagst mogelijke oxidatiegetal is gelijk aan het groepsnummer -8.
Zo liggen de oxidatiegetallen van chloor, dat in groep VIIa staat, tussen +VII (dus het groepsnummer) en -I (het groepsnummer -8). Die uiterste waarden kun je gemakkelijk begrijpen. Een oxidatiegetal van +VII betekent 7 elektronen afstaan. Op die manier bekomt chloor de edelgasconfiguratie van neon. Een oxidatiegetal van -I betekent 1 elektron opnemen. Op die manier bekomt chloor de edelgasconfiguratie van argon.
Het oxidatiegetal van de overgangselementen is bijna altijd +II, met uitzondering van Fe (+II en +III), Cu (+I en +II), Cr (+II, +III en +VI) en Ag (heeft alleen +I als mogelijk oxidatiegetal). En Pb heeft als enige mogelijke oxidatiegetallen +II en +IV.
Het is van essentieel belang dat je voor het werken met oxidatiegetallen ook de neutraliteitsregel toepast. Op die manier kun je vlot de formule van een atoombinding vormen.
VOORBEELD OXIDATIEGETAL IN FORMULES
1 Oxidatiegetal gebruiken om een formule te vormen
Voor het opstellen van de brutoformule voor de binding tussen chloor (met OG = +III) en zuurstof (heeft meestal OG = -II):
©VANIN
Cl: +III = 3 elektronen afstaan
O: -II = 2 elektronen opnemen
Het kleinste gemene veelvoud van 3 en 2 is 6. Vandaar dat de formule-eenheid Cl2O3 is. Je kunt ook via de kruisregel de formule-eenheid vormen.
Volgens de neutraliteitsregel is de som van de lading van de positieve en negatieve ionen gelijk.
→ Op die manier bekom je ook als formule-eenheid Cl2O3
VOORBEELD OXIDATIEGETAL IN FORMULES (VERVOLG)
2 Oxidatiegetal uit een formule berekenen
Wanneer je een chemische formule krijgt, dan kun je altijd het oxidatiegetal van een element met meerdere mogelijke oxidatiegetallen bepalen, uitgaande van de gekende oxidatiegetallen.
Voorbeeld: SO3
De som van de oxidatiegetallen is nul (er staat namelijk geen lading bij SO3):
OG(S) + 3 · OG(O) = 0
x + 3 · (-II) = 0
x = +VI
©VANIN
—Het oxidatiegetal (OG) is het aantal elektronen dat een atoom zou opnemen of afstaan bij overgang naar de ionaire vorm. De volgende oxidatiegetallen moet je vanbuiten kennen:
Groep Ia: +I
Groep II a: +II
Groep IIIa: +III
Fluor (F): -I
Zuurstof (O): meestal -II
Edelgassen: oxidatiegetal is altijd 0.
—Voor de elementen in groep IVa tot en met VIIa (zie ook tabel 2 op p. 12):
• hoogst mogelijke oxidatiegetal = +groepsnummer
• laagst mogelijke oxidatiegetal = groepsnummer -8
Neutraliteitsregel: de som van de lading van de positieve en negatieve ionen is gelijk.
3 Indeling van de anorganische stoffen
Je weet nu dat we stoffen kunnen indelen in anorganische stoffen (minerale verbindingen) en organische stoffen (koolstofverbindingen). In dit thema zul je ook leren hoe de moleculevorming en naamgeving gebeurt bij anorganische samengestelde stoffen. In thema 02 leer je alles over de organische stoffen.
Verbindingen vertonen analoge chemische eigenschappen door de aanwezigheid van eenzelfde atoom of atoomgroep: de chemische functie of functionele groep. Dat laat toe de verbindingen te ordenen in chemische verbindingsklassen of stofklassen. De anorganische samengestelde stoffen worden onderverdeeld in 4 stofklassen: de oxiden, de hydroxiden, de zuren en de zouten. In de volgende tabel vind je de basisstructuur van elke stofklasse.
StofklasseFunctionele groepAlgemene formuleUitgang naam oxiden O MO of nMO -oxide hydroxidenOH MOH -hydroxide
zuren H HZ -ide -aat
zouten geen functionele groepMZ -ide -aat
M = metaal, nM = niet-metaal, O = zuurstof, H = waterstof, Z = zuurrest (zie verder bij de zuren) = nM of nMO
01 LABO
3.1 Van formule naar stofklasse
Indien je een formule van een samengestelde stof krijgt, dan kun je op basis van de algemene formule uit de tabel op de vorige pagina de stof in de juiste stofklasse indelen. Het volgende schema kan je helpen om dat efficiënt aan te pakken:
Bestaat de formule uit 2 elementen en eindigt het op 'O'?
Het is een oxide
Begint de formule met een metaal of NH4+ en eindigt het op 'OH'?
Het is een hydroxide
Begint de formule met 'H'?
Het is een zuur
Eindigt de formule op 'O'?
Het is een zout
Eindigt de formule op 'O'?
Het is een binair zuur
3.2 Van naam naar stofklasse
Het is een ternair zuur
Het is een binair zout
Het is een ternair zout
Wanneer we de naam van verschillende anorganische stoffen bekijken, valt het op dat we ze in 3 groepen kunnen indelen:
Groep 1 Ionverbindingen waarbij het metaal slechts 1 mogelijk oxidatiegetal heeft
©VANIN
De naam is zo beknopt mogelijk: de naam van het metaal (in deze voorbeelden respectievelijk natrium en aluminium) + de juiste uitgang afhankelijk van de stofklasse (in deze voorbeelden oxide).
Na2O natriumoxide Al2O3 aluminiumoxide
Zowel natrium als aluminium hebben slechts 1 mogelijk oxidatiegetal in een samengestelde stof. Met behulp van de kennis van de oxidatiegetallen en de neutraliteitsregel kun je gemakkelijk zelf de formule opstellen, daarom bevat de naam alleen de essentiële onderdelen.
Wist je dat het ook correct is om Griekse telwoorden te gebruiken om de index aan te duiden? Maar we proberen altijd om zo beknopt mogelijk te werken. Vandaar dat we je leren werken met de verkorte systematische naam. Bij de voorbeelden is dan zowel ʻnatriumoxideʼ als ʻdinatriumoxideʼ correct, en ook ʻaluminiumoxideʼ of ʻdialuminiumtrioxideʼ is correct.
Griekse telwoorden: mono (wordt meestal niet geschreven) –di – tri – tetra – penta –hexa – hepta
Schema 1 Indeling van anorganische stoffen op basis van een gegeven formule
Groep 2 Ionverbindingen waarbij het metaal meerdere mogelijke oxidatiegetallen heeft
Er zijn 2 manieren om de naam weer te geven:
—Voor de systematische naam noteer je het Griekse telwoord voor de index dat bij het eerste element staat. Vervolgens noteer je de naam van het eerste element. Daarna het Griekse telwoord voor de index dat bij het laatste deel van de formule staat en tot slot de juiste uitgang.
—Voor de stocknotatie noteer je de naam van het metaal. Achter dat metaal schrijf je tussen haakjes de waarde van het oxidatiegetal en je eindigt met de juiste uitgang.
verdieping 1u en 2u
FeO ijzermonoxide of ijzer(II)oxide
Fe2O3 diijzertrioxide of ijzer(III)oxide
©VANIN
Van ijzer bestaan er 2 mogelijke oxiden. Om verwarring te vermijden, moet er extra informatie in de naam aanwezig zijn: met de naam 'ijzeroxide' kun je de formule FeO vormen, maar niet de formule Fe2O3.
Groep 3 De atoomverbinding tussen niet-metalen
Voor de naam wordt ook hier de systematische naam gebruikt: je noteert het Griekse telwoord voor de index dat bij het eerste element staat. Vervolgens noteer je de naam van het eerste element, dan het Griekse telwoord voor de index dat bij het laatste deel van de formule staat, en tot slot de juiste uitgang.
CO koolstofmonoxide CO2 koolstofdioxide
Ook hier zijn er verschillende oxiden van koolstof mogelijk. Er is een zeer groot verschil tussen die 2 stoffen. Omdat het echt belangrijk is dat er geen twijfel bestaat, wordt het Griekse telwoord 'mono' vaak expliciet geschreven.
Je hebt al het schema gezien waarmee je op basis van een gegeven formule de stof kunt indelen in de juiste stofklasse. Het volgende schema helpt je om op basis van een gegeven naam de stof in te delen in de juiste stofklasse:
Eindigt de naam op 'hydroxide'?
Het is een hydroxide Eindigt de naam op 'oxide'?
Het is een oxide Eindigt de naam op 'zuur' of begint de naam met 'waterstof'?
Eindigt de naam op -ide of is het zoutzuur?
Het is een binair zuur
Het is een zuur
Eindigt de naam NIET op -ide of is het GEEN zoutzuur
Het is een ternair zuur
Het is een zout
Het is een binair zout Eindigt de naam op -ide?
Het is een ternair zout Eindigt de naam NIET op -ide?
De functionele groep is een atoomgroep die bepaalt dat verbindingen analoge chemische eigenschappen vertonen. Op basis van die functionele groep kunnen we anorganische samengestelde stoffen onderverdelen in 4 stofklassen:
ANORGANISCHE STOFKLASSEN
oxiden: MO of nMO
hydroxiden: MOH zuren: HZ zouten: MZ
Naamgeving van anorganische samengestelde stoffen:
—Voor metalen met slechts 1 mogelijk oxidatiegetal ga je als volgt te werk om de naam te geven:
• systematische naam: je maakt gebruik van de Griekse voorvoegsels om de indexen weer te geven:
Grieks telwoord + naam van het metaal + Grieks telwoord + juiste uitgang (oxide, hydroxide ...) afhankelijk van de stofklasse
• Maar vanwege het KISS-principe (keep it short and simple) werkt men vaak met de verkorte systematische naam: naam van het metaal + juiste uitgang
—Voor metalen met meerdere mogelijke oxidatiegetallen heb je 2 opties om de naam te geven: een systematische naam of de stocknotatie. In de 2e graad is het belangrijk dat je de systematische naam kent: je maakt gebruik van de Griekse voorvoegsels om de indexen weer te geven:
Grieks telwoord + naam van het metaal + Grieks telwoord + juiste uitgang
—Voor atoombindingen maak je altijd gebruik van de Griekse voorvoegsels om de systematische naam te vormen:
Grieks telwoord + naam van het eerste niet-metaal + Grieks telwoord + juiste uitgang
©VANIN
AAN DE SLAG
Bepaal het oxidatiegetal van alle elementen in de volgende stoffen:
a K
b K2O
c Cl2
d O3
e A
f HNO3
Bepaal het oxidatiegetal van het vetgedrukte element in de volgende verbindingen:
a CO2
b NH3
c H2SO3
Horen de volgende uitspraken alleen bij anorganische stoffen (A), alleen bij organische stoffen (O) of bij zowel de anorganische als de organische stoffen (A + O)?
a kan het element Ca bevatten
b aardolie behoort tot die groep stoffen
c maakt gebruik van zeer veel verschillende atoomsoorten
d de totale verzameling van moleculen is zeer uitgebreid
Zijn de volgende stoffen organisch of anorganisch?
Behoren de volgende formules tot de oxiden, hydroxiden, zuren of zouten?
a CO
b H2CO3
c KOH
d KCl
e HI
d Al(OH)3
g Na2O
h (NH4)3PO4
Behoren de volgende stoffen tot de oxiden, hydroxiden, zuren of zouten?
a dichloorpentaoxide
b waterstofbromide
c ammoniumhydroxide
d diijzertrioxide
` Meer oefenen? Ga naar .




Op afbeelding a zie je een skeletnotatie, waarbij elke hoekpunt een C-atoom (met bijbehorende H-atomen) voorstelt.
HOOFDSTUK 2
De oxiden
Je hebt misschien al eens gehoord over oxideren en ook vorig jaar maakte je al kennis met het gevarenlogo voor oxiderende stoffen. Wanneer ijzer roest, ontstaat er een oxide. De gevormde stof is een zeer brosse verbinding: het heeft andere eigenschappen dan het oorspronkelijke metaal.
LEERDOELEN
L de algemene formule van een oxide
L de oxiden verder indelen in metaaloxiden en niet-metaaloxiden
L de eigenschappen en toepassingen van oxiden
L de formule van oxiden opstellen
L de naam van oxiden opstellen
L via welke chemische reactie je een oxide kunt vormen
1 Wat is een oxide?
Wanneer een element een binding aangaat met zuurstof, ontstaat er een oxide. Concreet kun je dat doen door een stof te verbranden.
Oxiden zijn binaire verbindingen en zijn dus opgebouwd uit 2 atoomsoorten: een metaal of niet-metaal enerzijds en zuurstof anderzijds, waarbij zuurstof altijd als laatste wordt geschreven. We spreken respectievelijk dan ook over metaaloxiden en niet-metaaloxiden. Aangezien alle oxiden het element zuurstof gemeenschappelijk hebben, is zuurstof de functionele groep
De oxiden kunnen nog verder worden ingedeeld: metaaloxiden MO niet-metaaloxiden nMO
De metaaloxiden zijn ionverbindingen aangezien ze opgebouwd zijn uit een metaal en een niet-metaal terwijl de niet-metaaloxiden atoomverbindingen zijn, want ze zijn opgebouwd uit 2 niet-metalen.
Zowel de systematische naam (met Griekse telwoorden) als de verkorte systematische naam is correct.
2 De metaaloxiden
Zoals we in hoofdstuk 1 al hebben vermeld, moeten we bij de ionverbindingen, wat metaaloxiden zijn, een onderscheid maken tussen:
—metalen met slechts 1 mogelijk oxidatiegetal; —metalen met meerdere mogelijke oxidatiegetallen.
2.1 Metalen met slechts 1 mogelijk oxidatiegetal
Die metalen kunnen slechts 1 oxide vormen. Van zodra je weet over welk metaal het gaat, kun je gemakkelijk zelf door middel van de neutraliteitsregel of kruisregel de formule vormen. Het is dus niet nodig om het aantal ionen van elke soort in de naam te vermelden (met behulp van Griekse telwoorden). De verkorte systematische naam bevat dan alleen de naam van het metaalion met als uitgang ‘oxide’.
VOORBEELD FORMULE EN NAAM VAN EEN METAAL MET 1 OXIDATIEGETAL
1 De naam en formule van het oxide van natrium (Na)
—natrium: +I want in groep Ia zuurstof: -II
Omwille van de neutraliteitsregel heb je 2 natriumionen nodig en 1 oxide-ion:
1+ O 2- 1+ Na
Bij de kruisregel plaats
je de lading van het eerste element als index bij het tweede element en omgekeerd.
©VANIN
Of je gebruikt de kruisregel:
—Natrium staat in groep IA en heeft dus een oxidatiegetal van +I.
—Zuurstof heeft een oxidatiegetal van -II.
—Je noteert de waarde van het oxidatiegetal van natrium bij zuurstof en omgekeerd.
O 2 1 +I -II
Hierdoor bekom je: Na2O1 → Na2O
De waarde 1 mag je weglaten. Als je nog kunt vereenvoudigen, dan doe je dat ook. De formule-eenheid is dus Na2O en de naam natriumoxide.
2 De formule van aluminiumoxide
Uit de naam halen we al dat de formule Al en O bevat. Aluminium heeft slechts één mogelijk oxidatiegetal, daarom moeten we de neutraliteitsregel of kruisregel toepassen om de formule te vormen.
—aluminium: +III want groep IIIa
—zuurstof: -II
ʻDialuminiumtrioxideʼ zou hier ook correct zijn.
Hierdoor bekom je als formule-eenheid voor aluminiumoxide: Al2O3
Je ziet dus dat je moet opletten wanneer de naam gegeven is voor metalen met slechts 1 mogelijk oxidatiegetal. Uit de naam aluminiumoxide kun je namelijk niet gemakkelijk de formule Al2O3 afleiden.
2.2 Metalen met meerdere mogelijke oxidatiegetallen
Hier zijn er meerdere oxiden mogelijk. Het is dus belangrijk dat er in de naam extra informatie wordt gegeven om te weten over welk oxide het juist gaat:
—Ofwel wordt de systematische naam gebruikt: hierbij wordt het aantal ionen van elke soort weergegeven met behulp van Griekse telwoorden.
Dus: Grieks telwoord + metaal + Grieks telwoord + oxide
—Ofwel wordt er gebruikgemaakt van de stocknotatie waarbij het oxidatiegetal van het metaal tussen haakjes achter de naam van het metaal wordt genoteerd.
Dus: metaal + (oxidatiegetal) + oxide
VOORBEELD FORMULE EN NAAM VAN EEN METAAL MET MEERDERE OXIDATIEGETALLEN
1 De formule van alle mogelijke oxiden van ijzer (Fe)
KruisregelFormule-eenheidStocknotatie Systematische naam
+II Fe O
2 2
+II -II FeO
+III Fe O 2 3
ijzer(II)oxideijzermonoxide
Hier kun je Fe2O2 vereenvoudigen tot FeO.
+III -II Fe2O3 ijzer(III)oxidediijzertrioxide
2 De formule en systematische naam van lood(II)oxide
Bij dit voorbeeld is de stocknotatie gegeven. Het getal tussen haakjes is het oxidatiegetal van lood. Zodra je dat weet, kun je gemakkelijk met de kruisregel de formule vormen: Pb O 2 2 +II -II
De formule-eenheid wordt (na vereenvoudigen) PbO.
De systematische naam is loodoxide.
3 De stocknotatie van dikoperoxide
Voor de stocknotatie hebben we het oxidatiegetal van koper nodig. Om dat te bepalen, noteer je eerst de formule: Cu2O
De berekening van het oxidatiegetal van koper is:
2 · OG(Cu) + 1 · OG(O) = 0
2 · x + 1 · (-II) = 0
x = +I
Daarom is de stocknotatie koper(I)oxide.
verdieping 1u en 2u
verdieping 1u en 2u
3 De niet-metaaloxiden
Niet-metaaloxiden zijn atoomverbindingen die in veel verschillende verhoudingen kunnen binden.
Je zult dus altijd een systematische naam krijgen met Griekse telwoorden die aangeven hoeveel keer je elk atoom moet nemen:
Grieks telwoord + niet-metaal + Grieks telwoord + oxide
VOORBEELD NAAM EN FORMULE VAN NIET - METAALOXIDEN
1 De naam en formule van alle oxiden van chloor (Cl)
Mogelijke oxidatiegetallen van chloor
©VANIN
Systematische naam
Het oxidatiegetal -I van chloor nemen we niet op. Aangezien zuurstof een negatief oxidatiegetal heeft, kan dat in een binaire verbinding nooit gecombineerd worden met een ander negatief oxidatiegetal. De som van die oxidatiegetallen kan dan nooit nul worden.
2 De naam en formule van alle oxiden van zwavel (S)
Mogelijke oxidatiegetallen van chloor
Hier kan je S2O4 vereenvoudigen tot SO2
Hier kan je S2O6 vereenvoudigen tot SO3
Systematische naam
—Oxiden zijn binaire verbindingen: ze zijn opgebouwd uit een metaal of een niet-metaal en zuurstof. Er bestaan 2 soorten oxiden:
• metaaloxiden: MO
• niet-metaaloxiden: nMO
—De functionele groep is zuurstof.
—Metaaloxiden:
→ metalen met slechts 1 mogelijk oxidatiegetal :
• formule: lading opzoeken in het PSE + kruisregel toepassen
• systematische naam: Grieks telwoord + metaal + Grieks telwoord + oxide
• verkorte systematische naam: metaal + oxide
→ metalen met meerdere mogelijke oxidatiegetallen:
• formule: meerdere mogelijkheden, er moet dus informatie over het oxidatiegetal gegeven worden
• systematische naam: Grieks telwoord + metaal + Grieks telwoord + oxide
—Niet-metaaloxiden:
• formule: meerdere mogelijkheden, er moet dus informatie over het oxidatiegetal gegeven worden.
• systematische naam: Grieks telwoord + niet-metaal + Grieks telwoord + oxide
4 Gebruik en toepassingen van oxiden
Je staat er waarschijnlijk niet altijd bij stil, maar je wordt omringd door oxiden. Ontdek de belangrijkste toepassingen van oxiden via de ontdekplaat.
Eén van de meest gekende oxiden is ongetwijfeld koolstofdioxide of koolzuurgas CO2. Het is een zeer belangrijk broeikasgas, dat ontstaat bij de volledige verbranding van fossiele brandstoffen. Verder wordt het ook gebruikt in drank met prik. Je hebt thuis misschien een toestel om zelf spuitwater of limonade te maken. Dat is gevuld met koolstofdioxide onder hoge druk.
Maar dat gas zit ook in sommige brandblusapparaten. Aangezien koolstofdioxide een hogere dichtheid heeft dan lucht, stijgt het gas niet en zorgt het ervoor dat er geen zuurstofgas meer aan het vuur kan waardoor het vuur dooft.
Wanneer koolstofdioxide zodanig wordt afgekoeld dat het vast wordt, wordt het droogijs genoemd. Droogijs wordt vooral als koelmiddel gebruikt, maar ook als ‘showeffect’ bij optredens, bepaalde cocktails … Pas toch op met die stof. Zoals gezegd: koolstofdioxide heeft een hogere dichtheid dan lucht, dus bij heel grote hoeveelheden kun je sterven door zuurstofgebrek.
©VANIN

ontdekplaat: anorganische stofklassen
Afb. 9 Koolstofdioxide ontstaat bij heel wat verbrandingsprocessen.
Afb. 10 Koolstofdioxide als droogijs
Wanneer fossiele brandstoffen verbrand worden in zuurstofarme omstandigheden, bijvoorbeeld wanneer een schoorsteen onvoldoende lucht en dus ook zuurstofgas doorlaat, ontstaat het zeer giftige koolstofmonoxide CO. Aangezien dat een kleurloos en geurloos gas is, wordt het vaak de stille sluipdoder genoemd. Spijtig genoeg sterven er in België nog jaarlijks veel mensen aan een CO-vergiftiging.

Een ander gasvormig oxide dat je misschien kent, is distikstofoxide N2O of lachgas. Die stof wordt onder andere gebruikt in slagroompatronen en om het vermogen van een motor op te drijven (denk maar aan de filmreeks ‘Fast and Furious’).
©VANIN



Vroeger werd lachgas als verdovingsmiddel gebruikt, maar de laatste jaren wordt het vooral misbruikt: het wordt nu als drug gebruikt en is zeer gevaarlijk. Daarom is de verkoop van lachgas sinds 5 maart 2021 verboden aan minderjarigen. Bekijk de ‘Rij ballonvrij’-campagne in Nederland over de gevaren van lachgas.
Wanneer je kijkt naar de ingrediëntenlijst van voedingsstoffen, dan zie je vaak E-nummers staan. Zo verwijst E220 naar zwaveldioxide SO2. Het wordt toegevoegd aan bijvoorbeeld rozijnen of gedroogde abrikozen.
Gedroogde abrikozen
Ingrediënten: Abrikozen, antioxidant: zwaveldioxide (E220)
Gemiddelde voedingswaarde
Per 100 g1 Portie (30 g)% GDA* (30 g)
Energie 1156 kJ 347 kJ 4 % 273 kcal82 kcal 4 %
Eiwitten 2,7 g 0,8 g 2 %
Koolhydraten waarvan suikers 61,1 g 18,3 g 7 % 36,5 g 11,0 g12 % Vet 0,3 g 0,1 g <1 %
waarvan verzadigd vet 0,1 g 0,03 g <1 %
Voedingsvezels
Afb. 15 Zwaveldioxide in gedroogde abrikozen
Afb. 11 Een schoorsteen moet geregeld worden gereinigd.
Afb. 12 Slagroomspuit Afb. 13 Nitrofles om het vermogen van wagens op te drijven
Afb. 14 Snelle auto’s in Fast and Furious
video: rij ballonvrij
Een vast metaaloxide dat spijtig genoeg heel gemakkelijk wordt gevormd, is diijzertrioxide of roest Fe2O3. Van zodra er lucht en water aan een niet-beschermd ijzeren voorwerp kunnen begint het ijzer te roesten. Het metaal verliest zijn eigenschappen zoals sterkte en plooibaarheid en de stof wordt zeer bros en verpulvert gemakkelijk.
Een ander vast oxide dat vaak wordt gebruikt, is calciumoxide of ongebluste kalk CaO. Vroeger werd het gebruikt om de lijnen op een voetbalveld te tekenen (nu is het verboden). Maar het werd ook toegepast om het ontbindingsproces van stoffelijke resten te versnellen.


In de stad Mainz in het westen van Duitsland hebben archeologen na jaren onderzoek het deksel gelicht van een 1 000 jaar oude sarcofaag. In de grafkist vonden ze de bijna volledig vergane resten van een persoon aan, mogelijk een geestelijke uit de 11de eeuw. De wetenschappers vermoedden dat de overledene allicht met ongebluste kalk werd bedekt om het ontbindingsproces te versnellen.
Bron: hln.be, 08/06/2019

Formule Systematische naamTriviale naam Toepassing/eigenschap CO2 koolstofdioxide koolzuurgas —brandblusapparaat —drank met prik
N2O distikstofoxide lachgas anesthesie
Fe2O3 diijzertrioxide roest roesten van ijzer SO2 zwaveldioxide bewaarmiddel CO koolstofmonoxide —ontstaat bij slechte verbranding —zeer giftig
©VANIN
CaO calciumoxide ongebluste kalk
WEETJE
Afb. 16 Roest is een vast metaaloxide.
Afb. 17 Lijnen op een voetbalveld
5 Reactiepatronen
5.1 Vorming metaaloxiden
DEMO
Verbranding van magnesium
Onderzoeksvraag
Welke stof ontstaat er bij de verbranding van een metaal?
©VANIN
Werkwijze
Je leerkracht neemt een stukje magnesiumlint vast met een tang en steekt het in brand. Vervolgens wordt er een beetje water met universeel-indicatoroplossing toegevoegd.
Waarnemingen
Het magnesiumlint brandt met een fel wit licht en er ontstaat een witte vaste stof: magnesiumoxide. Wanneer je er water met universeel-indicatoroplossing aan toevoegt, verandert de kleur. Hier komen we in hoofdstuk 3 op terug.

Besluit
Wanneer je een metaal verbrandt, ontstaat er een metaaloxide.
Het reactiepatroon geeft algemeen weer wat voor soort stoffen of stofklassen reageren en welke stoffen of stofklassen worden gevormd. Het bevat geen concrete stoffen op zuurstofgas, water … na. De coëfficiënten kunnen dus niet worden aangepast.
reactiepatroon: metaal + zuurstofgas → metaaloxide M + O2 → MO
De reactievergelijking bevat wel concrete stoffen. Hierbij moeten natuurlijk de coëfficiënten in orde worden gebracht:
—reactievergelijking: 2 Mg + O2 → 2 MgO
5.2 Vorming niet-metaaloxiden
DEMO
Verbranding van zwavel
Onderzoeksvraag
Welke stof ontstaat er bij de verbranding van een niet-metaal?
Werkwijze
Je leerkracht neemt een oude glazen pot met plastic deksel en steekt een verbrandingslepel door het deksel, door de achterzijde van de verbrandingslepel even te verwarmen. Vervolgens wordt een bodempje water met universeel-indicatoroplossing toegevoegd aan de glazen pot. Je leerkracht vult de verbrandingslepel met zwavel, steekt de zwavel aan en brengt de brandende zwavel boven het vloeistofoppervlak. De pot wordt gesloten.
Waarnemingen
Er ontstaan dikke, witte dampen: zwaveldioxide. Wanneer je met de pot schudt zodat de dampen in het water oplossen, verandert de universeel-indicatoroplossing van kleur. Hier komen we in hoofdstuk 4 op terug.
Besluit
Wanneer je een niet-metaal verbrandt, ontstaat er een niet-metaaloxide.
reactiepatroon: niet-metaal + zuurstofgas → niet-metaaloxide nM + O2 → nMO
reactievergelijking: S8 + 8 O2 → 8 SO2
Het reactiepatroon geeft algemeen weer wat voor soort stoffen of stofklassen reageren en welke stoffen of stofklassen worden gevormd.
reactiepatroon vorming metaaloxiden: metalen + zuurstofgas → metaaloxiden M + O2 → MO
reactiepatroon vorming niet-metaaloxiden: niet-metalen + zuurstofgas → niet-metaaloxiden nM + O2 → nMO
©VANIN
AAN
DE SLAG
Zijn de volgende stoffen metaaloxiden (MO), niet-metaaloxiden (nMO) of behoren ze tot een andere stofklasse (/)?
a Ca(OH)2
b ZnO
c P2O3 d H2O e HClO f NaNO3
Zijn de volgende stoffen metaaloxiden (MO), niet-metaaloxiden (nMO) of behoren ze tot een andere stofklasse (/)?
a aluminiumhydroxide
b dibroomtrioxide
c waterstofcarbonaat
d siliciumdioxide
e waterstofsulfide
Van het element zwavel bestaan meerdere oxiden. Welke formules kun je met behulp van de tabel van oxidatiegetallen vormen?
a SO b SO2
c S2O d SO3
Vorm de formule van het oxide van de volgende elementen. Als een bepaald element meerdere mogelijke oxidatiegetallen heeft, schrijf je alle opties.
a aluminium
b cadmium
c zwavel
d broom
Noteer de juiste naam naast de formules van de vorige oefening.
Schrijf de juiste formule van alle oxiden die bij de ingrediënten hieronder vermeld worden.
Behoren de volgende stoffen tot de metaaloxiden (MO) of de niet-metaaloxiden (nMO)?
a lachgas
b roest
c ongebluste kalk d koolzuurgas
Schrijf het reactiepatroon voor de vorming van:
a een niet-metaaloxide
b een metaaloxide
Hoort bij de volgende reacties reactiepatroon a of b (uit de vorige oefening)?
a P4 + 5 O2 → 2 P2O5
b 4 Al + 3 O2 → 2 Al2O3
c 2 C + O2 → 2 CO
©VANIN
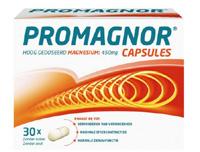
Magnesiumoxide; Vulstof:
Hydroxypropylmethylcellulose (E464); Bevochtigingsmiddel:
Sorbitol; Antiklontermiddel: Magnesiumstearaat (E470b); Kleurstof: E171; Verdikkingsmiddel: Siliciumdioxide. 1 capsule bevat 450 mg MAGNESIUM ELEMENT (120% Referentie inname).
d de reactie beschreven in de volgende tekst: Alkalimetalen zijn zo zacht dat je ze met een mes kunt snijden. Natrium reageert zo snel met zuurstofgas in de lucht dat het oppervlak al na enkele minuten dof wordt.

Natrium: een zacht alkalimetaal
HOOFDSTUK 3
De hydroxiden
In dit hoofdstuk gaan we dieper in op de hydroxiden. In hoofdstuk 1 heb je met die stofklasse al kennisgemaakt.
LEERDOELEN
L de algemene formule van een hydroxide
L de eigenschappen en toepassingen van hydroxiden
L de formule van hydroxiden opstellen
L de naam van hydroxiden opstellen
L via welke chemische reactie je een hydroxide kan vormen
1 Wat is een hydroxide?
Een hydroxide is een verbinding van een metaal met één of meerdere hydroxide-groepen (OH-groepen). Het zijn dus allemaal ionverbindingen. De functionele groep is het hydroxide-ion: OH-. De lading van het hydroxide-ion is -I, aangezien zuurstof een oxidatiegetal van -II heeft en waterstof een oxidatiegetal van +I. De algemene formule van een hydroxide is dus MOH. Er komt nooit een andere index dan 1 voor bij het metaal.
In de plaats van een metaalion kan ook het ammoniumion (NH4+) gebonden worden.
WEETJE
Ook al zijn hydroxiden ionverbindingen, toch is er ook een atoombinding aanwezig. De binding tussen het metaal en zuurstof is een binding tussen een metaal en een niet-metaal, en bijgevolg een ionverbinding. Maar zuurstof is ook gebonden met waterstof. Dat zijn 2 niet-metalen en die vormen dus samen een atoomverbinding.
2 Formule- en naamvorming
De formule- en naamvorming verloopt analoog aan die van de metaaloxiden.
Voor hydroxiden met het ammoniumion of met een metaalion dat slechts 1 mogelijk oxidatiegetal heeft, lees je het oxidatiegetal f uit het PSE en vorm je de formule door de kruisregel toe te passen. De naamgeving is als volgt: —systematische naam: metaal (of ammonium) + Grieks telwoord + hydroxide —verkorte systematische naam (volgens KISS-principe): metaal (of ammonium) + hydroxide
Het gebruik van Griekse telwoorden mag uiteraard altijd, waardoor ‘magnesiumdihydroxide’ ook correct is.
VOORBEELD HYDROXIDEN VAN METALEN MET 1 OXIDATIEGETAL OF MET HET AMMONIUMION
—Mg: OG = +II want staat in groep IIa
—OH: OG = -I
—neutraliteitsregel: je hebt 1 keer het magnesiumion nodig en 2 keer het hydroxide-ion.
—kruisregel:
De formule-eenheid is dus Mg(OH)2 en de naam is magnesiumhydroxide.
©VANIN
verdieping 1u en 2u
Aangezien magnesium maar 1 mogelijk oxidatiegetal heeft, moet er in de naam niet aangegeven worden dat er 2 hydroxide-ionen aanwezig zijn en is er geen stocknotatie nodig.
Ook het ammoniumion heeft altijd hetzelfde oxidatiegetal, namelijk +I.
De formule is dan NH4OH en de naam is ammoniumhydroxide.
VOORBEELD HYDROXIDEN VAN METALEN MET MEERDERE OXIDATIEGETALLEN
Aangezien er meerdere mogelijke oxidatiegetallen zijn, kun je voor eenzelfde metaal meerdere mogelijke hydroxiden vormen. Bij de systematische naam moeten dan ook de Griekse telwoorden worden vermeld en is er ook een stocknotatie mogelijk.
1 De formule en namen van alle mogelijke oxiden van koper (Cu)
Mogelijke oxidatiegetallen van chloor
Kruisregel
Formuleeenheid
Systematische naam
Stocknotatie
2 Stocknotatie van loodtetrahydroxide
Ook hier moet je het oxidatiegetal van lood vinden. Dat doe je door eerst de formule te noteren en vervolgens via de neutraliteitsregel het oxidatiegetal van lood te bepalen.
—formule: Pb(OH)4
—neutraliteitsregel: OG(Pb) + 4 ∙ OG(OH) = 0
x + 4 ∙ (1-) = 0
x = +IV
De stocknotatie is lood(IV)hydroxide.
—Hydroxiden zijn ionverbindingen tussen een metaalion en het hydroxide-ion.
—Het hydroxide-ion is de functionele groep en heeft een oxidatiegetal van -I: OH-
—NH4+ = ammoniumion
—Indien het metaal slechts 1 mogelijk oxidatiegetal heeft:
• formule: oxidatiegetal opzoeken in het PSE + kruisregel toepassen
• systematische naam: metaal (of ammonium) + Grieks telwoord + hydroxide
• verkorte systematische naam: metaal (of ammonium) + hydroxide
—Wanneer het metaal meerdere mogelijke oxidatiegetallen heeft:
• formule: meerdere mogelijkheden, er moet dus informatie over het oxidatiegetal gegeven worden
• systematische naam: metaal + Grieks telwoord + hydroxide
3 Gebruik en toepassingen van hydroxiden
In het dagelijks leven worden veel hydroxiden gebruikt bij het poetsen. Zo is natriumhydroxide of bijtende soda NaOH een zeer sterke ontstopper. Een oplossing van natriumhydroxide lost haren en zeepresten op. Doe bijvoorbeeld een aantal haren in een bekerglas. Voeg er een beetje vloeibare ontstopper aan toe. Laat de oplossing even staan. De haren lossen langzaamaan op: ze worden eerst dunner, worden dan afgebroken in kortere stukjes en lossen uiteindelijk op. Wanneer je die stof gebruikt, moet je extra voorzichtig zijn. Het is namelijk een zeer corrosieve stof en ze kan dus brandwonden veroorzaken.
Een speciaal geval is ammoniak NH3. Wanneer je NH3 oplost in water, ontstaat er ammoniumhydroxide NH4OH. In thema 04 gaan we dieper in op dat oplosproces. Die oplossing wordt vooral gebruikt door haar ontvettende eigenschappen om bijvoorbeeld ramen te poetsen. Als je de stof eenmaal geroken hebt, zul je ze nooit meer vergeten. De stof staat bekend voor zijn zeer indringende geur. Maar let op, het kan je slijmvliezen irriteren. Dezelfde doordringende geur kun je in stallen ruiken. Ammoniak komt namelijk ook in mest voor.


Tijdens de labo’s zul je geregeld gebruikmaken van calcium(di)hydroxide, gebluste kalk of kalkwater Ca(OH)2. Die oplossing kan gebruikt worden om koolstofdioxide aan te tonen.
©VANIN
WEETJE
Let op: het water dat thuis uit de kraan loopt, is kalkrijk water maar het is geen kalkwater!
ontdekplaat: anorganische stofklassen
Corrosief is afgeleid van het Latijnse werkwoord corrodere, dat bijten betekent.
Afb. 18 In ontstopper zit natriumhydroxide.
Afb. 19 Ammoniak werkt ontvettend.
Kalkwater
Onderzoeksvraag
Wat gebeurt er wanneer je aan kalkwater koolstofdioxide toevoegt?
Werkwijze
Je leerkracht maakt een oplossing van kalkwater door calciumoxide in water op te lossen. De leerkracht schenkt ongeveer 2 mL van die oplossing in een proefbuis en blaast voorzichtig met een rietje in de oplossing.
kalkwater
Waarnemingen
Er ontstaat een troebele oplossing.
Besluit
Wanneer je kalkwater met koolstofdioxide mengt, ontstaat er een troebele oplossing. Je kunt kalkwater gebruiken om koolstofdioxide aan te tonen.
Formule Systematische naamTriviale naam Toepassing/eigenschap
©VANIN
Ca(OH)2 calciumhydroxidegebluste kalk indicator voor koolstofdioxide
NaOH natriumhydroxide bijtende soda ontstopper NH4OH ammoniumhydroxide / ontvetter
4 Reactiepatroon
Bij het experiment met kalkwater hebben we zelf kalkwater gemaakt door calciumoxide in water op te lossen:
reactiepatroon: metaaloxide + water → hydroxide MO + H2O → MOH
reactievergelijking: CaO + H2O → Ca(OH)2
DEMO
Magnesiumoxide
Onderzoeksvraag
Welke stof ontstaat er wanneer je een metaaloxide in water oplost?
Werkwijze
Je leerkracht doet het gevormde magnesiumoxide van de proef bij de oxiden in een bekerglas met een beetje water en een paar druppels universeel-indicatoroplossing.
Waarnemingen
Er ontstaat een oplossing met een groenblauwe kleur.
Besluit
Bij de reactie van een metaaloxide met water ontstaat een oplossing met een pH > 7 of een base (zie hoofdstuk 5).
—reactiepatroon: metaaloxide (MO) + water (H2O) → hydroxide (MOH)
—reactievergelijking: 2 MgO + H2O → Mg(OH)2
Doordat er bij de reactie van een metaaloxide met water een hydroxide gevormd wordt, noemt men de metaaloxiden ook wel basevormende oxiden (zie ook hoofdstuk 5). Dat geldt wel alleen voor oxiden uit groep IA en IIA.
Reactiepatroon voor de vorming van hydroxiden is: metaaloxide + water → hydroxide MO + H2O → MOH
Metaaloxiden zijn basevormende oxiden.
©VANIN
AAN DE SLAG
Vorm de formule van alle hydroxiden van Mn.
Ook al heeft chloor een mogelijk oxidatiegetal van +VII en kun je door de kruisregel correct toe te passen de formule Cl(OH)7 bekomen. Toch is dat geen juiste formule voor een hydroxide. Leg uit waarom niet.
Wat is de systematische naam van de volgende triviale namen?
a gebluste kalk
b ontstopper
Waarom noemen ze metaaloxiden ook wel basevormende oxiden?
Welke van de volgende stoffen zijn basevormende oxiden?
a SO2 b NaOH c K2O d CO2
Welke van de volgende stoffen zijn basevormende oxiden?
a koolstofdioxide
b zwaveltrioxide
c natriumoxide d natriumhydroxide
Verklaar waarom Ca(OH)2 ook wel gebluste kalk genoemd wordt.
HOOFDSTUK 4
De zuren
Je hebt misschien al weleens iets zuurs gegeten: een schijfje citroen of een zuur snoepje. Tijdens de lessen chemie mag je natuurlijk niet proeven, daarom hebben we tijdens het practicum andere manieren geleerd om te bepalen of een stof tot de zuren behoort of niet. In dit hoofdstuk gaan we verder in op die stofklasse.
LEERDOELEN
L de algemene formule van een zuur
L de zuren verder indelen in binaire en ternaire zuren
L de eigenschappen en toepassingen van zuren
L de formule van binaire en ternaire zuren
L de naam van binaire en ternaire zuren
L via welke chemische reactie je een binair en ternair zuur kan vormen
1 Wat is een zuur?
Een zuur is opgebouwd uit een waterstofatoom en een zuurrest. Het waterstofatoom is de functionele groep. De zuurrest kan een niet-metaal zijn of een niet-metaal en 1 of meerdere zuurstofatomen. De algemene formule van een zuur is HZ
Aangezien alle zuren een vaste formule hebben, moet de index bij het waterstofatoom nooit vermeld worden in de naam. Afhankelijk van de samenstelling van de zuurrest, kunnen de zuren in 2 groepen ingedeeld worden:
1 Zuren waarbij de zuurrest aleen uit een niet-metaal bestaat, zijn de binaire zuren (ze bestaan uit 2 atoomsoorten). De algemene formule van een binair zuur is HnM.
2 Dat in tegenstelling tot de ternaire zuren, waarbij de zuurrest naast een niet-metaal ook nog zuurstof bevat. De algemene formule voor een ternair zuur is HnMO.
Zowel de binaire als de ternaire zuren zijn alleen opgebouwd uit niet-metalen. Het zijn dus allemaal atoombindingen. Aangezien de zuurrest heel belangrijk is voor zouten, zal er in het deel van de zuren al extra aandacht gespendeerd worden aan de zuurresten.
©VANIN
2 Binaire zuren
Een binair zuur is opgebouwd uit 2 atoomsoorten: het waterstofatoom en een niet-metaal HZ of HnM is de algemene formule voor een binair zuur.
Alle niet-metalen bezitten hun laagst mogelijke oxidatiegetal in de binaire zuren. Op die manier kun je zeer gemakkelijk de formule van de binaire zuren afleiden.
De naam ‘diwaterstofsulfide’ is dus niet fout, maar het kan korter (aangezien waterstof maar 1 OG heeft).
VOORBEELD FORMULE WATERSTOFSULFIDE
waterstof: OG = +I
zwavel: OG = -II Het laagst mogelijke oxidatiegetal voor zwavel is -II (= groep VI – 8)
Door de neutraliteitsregel vind je dan de formule H2S.
De naam van de binaire zuren is als volgt:
De systematische naam: Grieks telwoord + waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ‘ide’
Omdat de formule voor zuren vastligt (waterstof heeft immers altijd OG = +I), kan de naam ook verkort worden genoteerd als: waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ‘ide’
©VANIN
De zuurrest is heel belangrijk voor de vorming van zouten. Je bekomt die door de waterstofionen (H+) uit de formule van het zuur te verwijderen. Per waterstofion dat je uit de formule haalt, krijgt de zuurrest een lading van -1. Voorbeeld:
HCl -1 H+ → Cl-
H2S -2 H+ → S2-
De naam voor de zuurrest is volledig analoog aan de naam van het zuur zelf, alleen worden de waterstoffen niet meer vermeld, omdat die eraf gehaald zijn. De naam van de zuurrest wordt gevormd door de verkorte Latijnse naam van het niet-metaal + uitgang ‘-ide’.
De extra uitgang ‘-ion’ wijst erop dat het over een geladen deeltje gaat en dat het geen volledige verbinding is: er is nog een positief deel nodig om de formule compleet te maken.
Het is belangrijk om de zuurrest te kennen:
Brutoformule Systematische naamZuurrest Naam zuurrest
HF waterstoffluorideF- fluoride-ion
HCl waterstofchloride Cl- chloride-ion
HBr waterstofbromideBr- bromide-ion
HI waterstofjodideI- jodide-ion
H2S waterstofsulfideS2- sulfide-ion
Tabel 3 Binaire zuren en zuurresten
Van 1 binair zuur moet je ook de triviale naam kennen. De triviale naam van waterstofchloride is zoutzuur
3 Ternaire zuren
De naam zegt het zelf: de ternaire zuren zijn opgebouwd uit 3 atoomsoorten. Naast waterstof en een niet-metaal is er ook altijd minstens 1 zuurstofatoom aanwezig: HnMO is de algemene formule voor een ternair zuur. Ook hier is de functionele groep het waterstofatoom.
De ternaire zuren kun je indelen in de stamzuren, die het vaakst voorkomen, en de afgeleide zuren.
Het aantal waterstof- en zuurstofatomen in de formule kun je niet afleiden uit het PSE of uit de naam. Je moet de formule van de zuren dus zeer goed uit het hoofd leren!
In het stamzuur is het oxidatiegetal van het specifieke niet-metaal gelijk aan het groepsnummer, met uitzondering van de halogenen: daar is het niet +VII, maar +V.
VOORBEELD
H2CO3 HClO3
OG(C) = +IV
OG(Cl) = +V
De naam voor de stamzuren is analoog aan die van de binaire zuren, alleen is de uitgang niet -ide, maar -aat. Ook hier kun je werken met de systematische naam: Grieks telwoord + waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ‘aat’. Maar omdat de formule voor zuren vastligt, kan de naam ook verkort worden genoteerd als: waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ‘aat’. De meeste ternaire zuren hebben ook een triviale naam.
De zuurrest vorm je analoog aan die van de binaire zuren. Je haalt een of meer waterstofionen uit de formule. Per waterstofion krijgt de zuurrest een lading van -1. In de naam laat je ‘waterstof’ weg, maar voeg je ‘ion’ toe om aan te geven dat het een geladen deeltje is.
Ook hier is het heel belangrijk om de zuurrest te kennen: die hebben we nog nodig om de zouten te vormen:
Brutoformule Systematische naamTriviale naamZuurrest Naam zuurrest
H2CO3 waterstofcarbonaat koolzuur
CO32- carbonaation
HNO3 waterstofnitraat salpeterzuur NO3- nitraation
H3PO4 waterstoffosfaat fosforzuur PO43- fosfaation
H2SO4 waterstofsulfaat zwavelzuur SO42- sulfaation
HClO3 waterstofchloraat chloorzuur
HBrO3 waterstofbromaat broomzuur
HIO3 waterstofjodaat joodzuur
Een binair zuur:
ClO3- chloraation
BrO3- bromaation
IO3- jodaation
—bestaat uit 2 atoomsoorten: het waterstofatoom en een niet-metaal.
—Het oxidatiegetal van het niet-metaal is zo laag mogelijk, namelijk groepsnummer -8.
—Om de naam te vormen zijn, er 2 opties:
• systematische naam: Grieks telwoord + waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ‘ide’
• verkorte systematische naam (volgens het KISS-principe): waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ‘ide’
—De triviale naam van waterstofchloride is zoutzuur
©VANIN
—Je kunt de zuurrest vormen door één of meerdere waterstofionen uit de formule van het zuur te verwijderen. Per waterstofion dat je verwijdert, krijgt de zuurrest een lading van 1-.
—De te kennen binaire zuren en zuurresten zijn:
Brutoformule Systematische naamZuurrest Naam zuurrest
HF waterstoffluorideF- fluoride-ion
HCl waterstofchloride Cl- chloride-ion
HBr waterstofbromideBr- bromide-ion
HI waterstofjodideI- jodide-ion
H2S waterstofsulfideS2- sulfide-ion
De namen ‘diwaterstofcarbonaat’, ‘triwaterstoffosfaat’ en ‘diwaterstofsulfaat’ zijn dus niet fout, maar het kan korter (aangezien waterstof maar 1 OG heeft).
Tabel 4 Ternaire zuren en zuurresten
ontdekplaat: anorganische stofklassen
Een ternair zuur:
—bevat, naast waterstof en een niet-metaal, ook altijd minstens 1 zuurstofatoom.
—Om de naam van een stamzuur van de ternaire zuren te vormen, vermeld je eerst waterstof, dan de verkorte Latijnse naam van het niet-metaal en als uitgang -aat.
—De te kennen stamzuren en hun zuurresten zijn:
Brutoformule Systematische naamTriviale naamZuurrest Naam zuurrest
H2CO3 waterstofcarbonaatkoolzuur CO32- carbonaation
HNO3 waterstofnitraatsalpeterzuurNO3- nitraation
H3PO4 waterstoffosfaatfosforzuurPO43- fosfaation
H2SO4 waterstofsulfaatzwavelzuurSO42- sulfaation
HClO3 waterstofchloraatchloorzuur ClO3- chloraation
HBrO3 waterstofbromaatbroomzuur BrO3- bromaation
HIO3 waterstofjodaatjoodzuur IO3- jodaation
4 Gebruik en toepassingen van zuren
Het zuur dat aanwezig is in je maag, is zoutzuur of HCl Het helpt bij de vertering van voedingsstoffen. Zoutzuur is vrij corrosief. Dat kun je gewaarworden wanneer je regelmatig moet overgeven of wanneer de klep tussen je slokdarm en je maag niet meer goed werkt. Je maag is door onder andere een slijmvlieslaag beschermd tegen die zure brij, maar je slokdarm kan er serieus door aangetast worden.
Bij vulkaanuitbarstingen komt waterstofsulfide of H2S vrij. Mogelijk heb je die zeer specifieke geur ook al waargenomen bij rotte eieren of stinkbommen.
WEETJE
©VANIN
gezonde maag re ux
Afb. 20 Zoutzuur in de maag helpt bij de vertering. Relfux is een aandoening waarbij de zure maaginhoud terugvloeit in de slokdarm.

Afb. 21 Giftige zoutzuurdampen bij een vulkaanuitbarsting.
Bij de vulkaanuitbarsting op La Palma in 2021 werd de bevolking gewaarschuwd voor giftige zoutzuurdampen. Als lava met een temperatuur van 1 000 °C in contact komt met zout water, dan kunnen er giftige dampen ontstaan. De chemische reactie resulteert dan in een zoutzuurhoudende gaswolk. Dat fenomeen is gekend als ‘laze', een samentrekking tussen ‘lava' en ‘haze' (nevel). De giftige dampen kunnen ademhalings- en huidproblemen veroorzaken.
Bron: standaard.be, 29/09/2021
Onder de ternaire zuren is koolzuur of waterstofcarbonaat (H2CO3) ongetwijfeld het zuur dat het meest gekend is. Het is het zuur dat gevormd wordt wanneer koolstofdioxide in water wordt opgelost.

Maar ook van zwavelzuur of waterstofsulfaat (H2SO4) heb je waarschijnlijk al gehoord. Het is aanwezig in een autobatterij, maar komt spijtig genoeg vooral in het nieuws omwille van zijn corrosieve eigenschappen. De krant bericht soms over mensen die verminkt werden door een zwavelzuuraanval. Het is een sterk hygroscopische stof. Dat wil zeggen dat zwavelzuur water heel hard aantrekt. Zo hard dat het al het vocht uit je cellen trekt met zware brandwonden tot gevolg.
DEMO
Zwavelzuur

Je leerkracht kan heel gemakkelijk aantonen dat zwavelzuur hygroscopisch is. Je leerkracht doet ongeveer 1 gram kristalsuiker in een proefbuis (of een oud theelichthoudertje) en voegt er een paar druppels geconcentreerd zwavelzuur aan toe.
Waarnemingen
Er blijft een zwarte, vaste stof achter: koolstof.
VEILIGHEIDSVOORSCHRIFT !
Wanneer je in een labo toch water met zwavelzuur moet mengen, dan moet je eerst water nemen en daar voorzichtig zwavelzuur op gieten. Je kunt dat heel gemakkelijk onthouden aan de hand van het volgende ezelsbruggetje: ‘zwavelzuur mag nooit gedoopt worden’.
©VANIN
water geconcentreerd
Afb. 24 Zwavelzuur mag nooit gedoopt worden. GEN4_CHE_LB_KOV_T1_H4_Overgieten.ai
Afb. 22 In spuitwater zit koolzuur.
Afb. 23 De loodzuurbatterij, ontworpen in 1859, is vandaag nog steeds de populairste batterij voor auto’s.
demovideo: zwavelzuur
Wil je weten wat er gebeurt nadat je cola gedronken hebt?
Op vind je een artikel terug.
Vandaag gebruiken we nog de oude benaming voor suiker: koolhydraten. Wetenschappers dachten vroeger dat suiker was opgebouwd uit koolstof en een of meerdere moleculen water. Cola is de enige frisdrank die niet alleen koolzuur, maar ook fosforzuur of waterstoffosfaat (H3PO4) bevat.

©VANIN
Afb 25 4 foto’s van dezelfde wijsheidstand: linksboven in zijn oorspronkelijke staat, rechtsboven na onderdompeling in cola gedurende één dag, linksonder na een week en rechtsonder na een maand. Het fosforzuur in cola tast het tandemail aan en de kleurstoffen zorgen ervoor dat de wortel bruin wordt.
Formule Systematische naamTriviale naam Toepassing H3PO4 waterstoffosfaatfosforzuur aanwezig in cola H2CO3 waterstofcarbonaatkoolzuur frisdrank HCl waterstofchloride zoutzuur maag H2SO4 waterstofsulfaatzwavelzuur autobatterij
5 Reactiepatronen
Een binair zuur kun je vormen door een niet-metaal met waterstofgas te laten reageren. —reactiepatroon: niet-metaal + waterstofgas → binair zuur nM + H2 → HnM
reactievergelijking: Cl2 + H2 → 2 HCl
Ternaire zuren kun je vormen door een niet-metaaloxide met water te laten reageren. Daarom noemen ze niet-metaaloxiden zuurvormende oxiden. —reactiepatroon: niet-metaaloxide + water → ternair zuur nMO + H2O → HnMO
reactievergelijking: CO2 + H2O → H2CO3
Reactiepatronen voor de vorming van zuren zijn: niet-metaal + waterstofgas → binair zuur nM + H2 → HnM
niet-metaaloxide + water → ternair zuur nMO + H2O → HnMO → Niet-metaaloxiden zijn zuurvormende oxiden.
AAN DE SLAG
Zijn de volgende formules binaire (B) of ternaire (T) zuren?
a HI
b HIO3
c HBrO
d HNO2
e H2S
Horen de volgende namen bij een binair (B) of bij een ternair (T) zuur?
a waterstofchloride
b waterstofbromaat
c fosforzuur
Noem 1 overeenkomst en 1 verschil tussen een binair en een ternair zuur.
Welke formule hoort bij welke toepassing of eigenschap?
1 H3PO4 A aanwezig in spuitwater

2 HCl B geur van rotte eieren

3 H2CO3 C aanwezig in de maag

4 H2S D aanwezig in cola

Vervolledig de volgende reactiepatronen.
a niet-metaaloxide + ? → ?
b ? + waterstofgas → ?
Welk reactiepatroon uit de vorige oefening hoort bij de volgende reacties: a of b?
a P2O5 + 3 H2O → 2 H3PO4
b I2 + H2 → 2 HI
c de onderlijnde reactie in volgend artikel:
Na oxidatie van zwaveldioxidegas (uitstootgas van verbrandingsprocessen) ontstaat SO3. Wanneer SO3 in de vochtige lucht komt, ontstaat zure regen.
Meer oefenen? Ga naar .
ontdekplaat: zuurtegraad
Zuurtegraad van een oplossing
We hebben in hoofdstuk 1 gebruikgemaakt van indicatoren om de anorganische stoffen in te delen in hun stofklasse. In dit hoofdstuk gaan we verder in op die indicatoren.
LEERDOELEN
L het begrip zuurtegraad en pH van een oplossing bespreken in voorbeelden
L het verband leggen tussen zuur, basisch en neutraal en de pH of zuurtegraad van een oplossing
L de manier waarop je de pH of de zuurtegraad van een oplossing experimenteel kunt bepalen
L indicatoren gebruiken om te bepalen welke stoffen tot dezelfde stofklasse behoren
1 pH en de zuurtegraad van een oplossing
©VANIN
meest zuur minst zuurneutraalminst basisch meest basisch
Afb. 26 De pH-schaal
De pH-schaal gaat van 0 tot 14. Hoe lager de pH, hoe zuurder een oplossing is. Een oplossing met een hoge pH noemen we een basische oplossing. De tegenhanger van zuur in de lessen chemie is dus niet zoet of zout, maar basisch! Een oplossing met een pH-waarde van 7 is een neutrale oplossing: die oplossing is dus niet zuur, maar ook niet basisch. Let op: de zuurtegraad en de pH zijn dus tegengesteld: hoe zuurder een oplossing is, hoe hoger de zuurtegraad, hoe lager de pH
Vroeger werd de zuurtegraad van een oplossing bepaald door de stof te proeven. Een oplossing met een lage pH proeft ook zuur en een oplossing met een hoge pH proeft eerder zeepachtig. Vorig jaar leerde je al dat het in een labo verboden is om te proeven van een oplossing. Het is in eerste instantie gevaarlijk, maar het is ook nog eens zeer onnauwkeurig. De pH van cola is bijvoorbeeld 2,4 en toch zou je niet zeggen dat cola zuur is. Dat komt natuurlijk door de enorme hoeveelheid suiker of zoetstoffen die worden toegevoegd.
2 pH-indicatoren

Een gemakkelijke manier om te bepalen of een oplossing zuur of basisch is, is met behulp van pH-indicatoren. Die stoffen komen vaak voor in de natuur en hebben een andere kleur afhankelijk van de zuurtegraad van de oplossing. Een pH-indicator die je gemakkelijk zelf kunt maken, is rodekoolsap. Hiervoor leg je een paar stukjes rodekool in kokend water of plet je ze met behulp van een stamper met een beetje water in een mortier. Het water zal heel snel blauwpaars kleuren. Wanneer je aan een oplossing van rodekoolsap een paar druppels citroensap (een zuur) toevoegt, verandert de kleur naar rood. Wanneer je aan een oplossing van rodekoolsap een paar druppels natriumhydroxide-oplossing (een base) toevoegt, verandert de kleur naar groengeel. De resultaten van experimenten met andere indicatoren vind je in de volgende tabel:
pH-indicator
Kleur in zuur midden
Kleur in neutraal midden
Kleur in basisch midden rodekoolsap rood blauwpaars groengeel methyloranje rood geel geel lakmoes rood roodblauw blauw fenolftaleïne kleurloos kleurloos fuchsia broomthymolblauw geel groen blauw
Maar ook in het dagelijks leven kom je dat effect tegen. Wanneer je rodekool maakt, wordt er vaak een scheutje azijn toegevoegd aan de paarse rodekool. Hierdoor krijgt het gerecht een mooie rode kleur. Maar ook een hortensia krijgt een andere kleur afhankelijk van de zuurtegraad van de grond. Zo is het perfect mogelijk dat een roze hortensia na een aantal jaren blauwe bloemen geeft wanneer de grond te zuur geworden is.
Ook al zijn die indicatoren heel gemakkelijk te gebruiken, het nadeel is dat je soms geen onderscheid kunt maken tussen bijvoorbeeld 2 zure oplossingen: een oplossing met pH-waarde 1 en met pH-waarde 2 geeft eenzelfde kleur. Dat kun je vrij eenvoudig oplossen door een mengsel te maken van verschillende indicatoren. Zo kun je gebruikmaken van pH-strips om de zuurtegraad van een zwembad te controleren. Dat is filtreerpapier dat in een oplossing van universeel indicator is ondergedompeld. Je kunt de universeel-indicatoroplossing ook gewoon als vloeistof gebruiken en de kleur van de bekomen oplossing vergelijken met een kleurenschaal.

Lightfrisdranken zijn voor erosie van het gebit even slecht als gewone frisdranken, omdat ze evenveel zuur bevatten. Voor het ontstaan van gaatjes zijn ze wel minder schadelijk. omdat ze minder suiker bevatten
©VANIN

Afb. 27 Cola heeft een pH van 2,4. Een frisdrank met een pH van <4 kan eroderend werken op het tandglazuur.
02 LABO
Afb. 28 Een hortensia verandert van kleur door de zuurtegraad van de grond.
Afb. 29 Met een universeel-indicatoroplossing kan de pH van een oplossing bepaald worden.
3 pH-meter
Voor sommige toepassingen (vooral in het labo) is het belangrijk om de pH-waarde heel exact te kennen. Je kunt dat gemakkelijk meten met een pH-meter. Je steekt dan een elektrode in de oplossing en kunt snel en nauwkeurig de pH-waarde aflezen.

©VANIN
—Hoe zuurder een oplossing, hoe groter de zuurtegraad en hoe lager de pH-waarde.
De pH-schaal gaat van 0 tot 14:
• Een oplossing met pH < 7 is een zure oplossing.
• Een oplossing met pH = 7 is een neutrale oplossing.
• Een oplossing met pH > 7 is een basische oplossing.
Je kunt de pH bepalen met behulp van pH-indicatoren: dat zijn stoffen die een andere kleur vertonen afhankelijk van de pH of de zuurtegraad van de oplossing.
Een pH-meter is een digitale en zeer nauwkeurige manier om de pH van een oplossing te bepalen.
Afb. 30 Een pH-meter
AAN DE SLAG
Je voegt aan de volgende oplossingen lakmoes toe.
Welke kleur kun je waarnemen? Maak gebruik van de tabel op p. 43.
a een oplossing met een pH-waarde 2
b een oplossing waarin HCl is opgelost
c een oplossing waarin ongebluste kalk is opgelost
Bepaal bij elk van de volgende pH-waarden of de oplossing zuur, basisch of neutraal is. Noteer ook de juiste kleur na het toevoegen van de opgegeven indicator. Gebruik de tabel op p. 43.
a 7 + rodekoolsap
b 4 + lakmoes
c 12 + fenolftaleïne
d 2 + broomthymolblauw
Welke kleur neem je waar als je de volgende stoffen aan een oplossing van lakmoes toevoegt?
Gebruik de tabel op p. 43.
a CO2
b Na2O
c NaCl
d HCl
e NaOH
Zijn de volgende stellingen juist of fout? Indien fout, verbeter dan het onderlijnde deel.
a In de chemie is het tegengestelde van zuur zoet.
b Een oplossing met een pH-waarde 2 is zuurder dan een oplossing met een pH-waarde 3.
Welke soort van chemische stof is aanwezig in deze lippenstift?
a De Essence ‘Kiss The Frog’-lippenbalsem belooft ‘magische, roze lippen’: na het aanbrengen van de balsem verandert de kleur van vreemd groen naar prachtig roze. De lippenbalsem kan dus de functie overnemen van ...
b Beschrijf een proef waarmee je de kleur in zuur en in basisch midden van de lippenbalsem ‘Kiss
The Frog’ kunt bepalen.
HOOFDSTUK 6
De
zouten
Wanneer je in het dagelijks leven praat over zout, bedoel je natuurlijk keukenzout. Voor een chemicus is zout een volledige stofklasse. Er zijn dus verschillende stoffen die tot de zouten behoren.
LEERDOELEN
L de algemene formule van een zout
L de zouten verder indelen in binaire en ternaire zouten
L de eigenschappen en toepassingen van zouten
L de formule van zouten opstellen
L de naam van zouten opstellen
L via welke chemische reactie je een zout kunt vormen
©VANIN
1 Wat is een zout?
Een zout is een ionverbinding die opgebouwd is uit een positief ion (metaalion of het ammoniumion) en een zuurrestion. De algemene formule van een zout is MZ
Afhankelijk van de zuurrest kun je de zouten verder indelen in binaire zouten MnM en ternaire zouten MnMO
2
Formule- en naamvorming
De algemene formule van een zout is MZ.

Afhankelijk van de zuurrest heb je te maken met een binair of een ternair zout. Als de zuurrest alleen uit een niet-metaal bestaat, dan is het een binair zout: MnM. Bevat de zuurrest ook nog een of meerdere zuurstofatomen, dan is het een ternair zout: MnMO
Voor de vorming van de formule van de zouten heb je de formule van de zuurresten nodig (zie p. 36).
Net zoals bij de oxiden en de hydroxiden moet je ook hier een onderscheid maken tussen metalen met slechts één mogelijk oxidatiegetal en metalen met meerdere mogelijke oxidatiegetallen. Het oxidatiegetal van de zuurrest ligt vast, aangezien die afgeleid is van de formule van het zuur.
Afb. 31 Zouten zijn niet altijd witte, vaste stoffen, maar kunnen in verschillende kleuren voorkomen.
HEEFT
Voor metalen met slechts 1 mogelijk oxidatiegetal (of met ammonium) is de naamgeving analoog als bij de metaaloxiden en de hydroxiden:
—systematische naam: Grieks telwoord + metaal (of ammonium) + Grieks telwoord + zuurrest
—verkorte systematische naam (volgens het KISS-principe): metaal (of ammonium) + zuurrest
1 Het zout tussen calcium en de jodide-zuurrest
Ca: OG = +II want het staat in groep IIa
De jodide-zuurrest heeft een oxidatiegetal van -I want het is afkomstig van HI.
—neutraliteitsregel: je hebt 1 keer het calciumion nodig en 2 keer het jodide-ion.
—kruisregel:
→ De formule-eenheid is CaI2.
→ De naam is calcium(di)jodide.
→ Het is een voorbeeld van een binair zout.
2 Het zout tussen aluminium en de sulfaat-zuurrest
Al: OG = +III want het staat in groep IIIa
De sulfaat-zuurrest heeft een oxidatiegetal van -II, want het is afkomstig van H2SO4.
—neutraliteitsregel: je hebt 2 keer het aluminiumion nodig en 3 keer het sulfaat-ion.
—kruisregel:
→ De formule-eenheid is Al2(SO4)3.
→ De naam is (di)aluminium(tri)sulfaat.
→ Het is een voorbeeld van een ternair zout.
3 Het zout tussen ammonium en de fosfaat-zuurrest
Het oxidatiegetal van het ammoniumion (NH4+) ligt vast en is +I.
De fosfaat-zuurrest heeft een oxidatiegetal van -III, want het is afkomstig van H3PO4.
—neutraliteitsregel: je hebt 3 keer het ammoniumion nodig en 1 keer het fosfaat-ion.
—kruisregel:
©VANIN
→ De formule is (NH4)3PO4.
→ De naam is (tri)ammoniumfosfaat.
→ Het is een voorbeeld van een (quaternair) ammoniumzout.
VOORBEELDEN
Voor eenzelfde metaal met een welbepaalde zuurrest zijn er verschillende formules mogelijk. Voor de naam maak je gebruik van de systematische naam met Griekse telwoorden: Grieks telwoord + metaal + Grieks telwoord + zuurrest
Of je maakt gebruik van de stocknotatie: metaal + (lading) + zuurrest
1 De formule van alle zouten tussen ijzer en de sulfide-zuurrest
De sulfide-zuurrest is afkomstig van H2S. Het oxidatiegetal van S is dus -II.
Mogelijke oxidatiegetallen van ijzer:
©VANIN
verdieping 1u en 2u
Kruisregel Formule-eenheid Stocknotatie Systematische naam
FeS: Hier kun je Fe2S2 vereenvoudigen tot FeS.
ijzer(II)sulfide ijzersulfide
→ Het zijn allebei voorbeelden van binaire zouten.
2 De formule van de lood(II)nitraat
Bij dit voorbeeld is de stocknotatie gegeven. Het getal tussen haakjes is het oxidatiegetal van lood. De nitraat-zuurrest is afkomstig van HNO3. Het oxidatiegetal van NO3 is dus -I.
Zodra je dat weet, kun je gemakkelijk met de kruisregel de formule vormen: Pb NO3 1 2 +II -I
→ De formule-eenheid is dus Pb(NO3)2
3 De stocknotatie van dikopercarbonaat
Om de stocknotatie te bepalen, moet je het oxidatiegetal van koper kennen. Daarom moet je eerst de formule van dit zout noteren: Cu2CO3
Vervolgens bepalen we het oxidatiegetal van koper:
2 OG(Cu) + OG(CO32-) = 0
2 ∙ x + 1 ∙ (-II) = 0 Het carbonaation is afkomstig van H2CO3, x = +I daarom is het OG -II
→ De stocknotatie is dus koper(I)carbonaat.
—Zouten zijn ionverbindingen: opgebouwd uit een metaal (of ammonium) en een zuurrest (die bestaat uit een niet-metaal al dan niet gecombineerd met één of meerdere zuurstofatomen)
—algemene formule: MZ
—2 soorten: binair zout (MnM): zuurrest bevat enkel een niet-metaal, de naam eindigt op -ide ternair zout (MnMO): zuurrest bevat een niet-metaal en zuurstof, de naam eindigt niet op -ide
—een metaal met slechts 1 mogelijk oxidatiegetal:
• formule: oxidatiegetal opzoeken in het PSE + kruisregel toepassen
• systematische naam: Grieks telwoord + metaal (of ammonium) + Grieks telwoord + zuurrest
• verkorte systematische naam (volgens het KISS-principe): metaal (of ammonium) + zuurrest
—een metaal met meerdere mogelijke oxidatiegetallen:
• formule: meerdere mogelijkheden, er moet dus informatie over het oxidatiegetal gegeven worden
• systematische naam: Grieks telwoord + metaal + Grieks telwoord + zuurrest
3 Gebruik en toepassingen van zouten


©VANIN

Het bekendste zout is natuurlijk keukenzout of natriumchloride NaCl. Het wordt vooral als smaakmaker en bewaarmiddel gebruikt. In de winter wordt het ook gebruikt om op een glad wegdek te strooien. Het is niet aan te raden om strooizout in je eten te gebruiken. Er is namelijk een antiklontermiddel aan toegevoegd.
Bij heel lage temperaturen (in Noorwegen, Zweden ...) wordt vaak calciumchloride CaCl2 als strooizout gebruikt.
Van de ternaire zouten heb je ongetwijfeld calciumcarbonaat CaCO3 in huis. Marmer, maar ook eierschalen en mosselschelpen, bestaan uit dat zout. Als je weet dat je een eischaal kunt oplossen met een zuur, dan besef je ongetwijfeld onmiddellijk waarom het niet zo interessant is om een marmeren werkblad in de keuken te laten installeren, hoewel we zuren in een keuken vaak in een fel verdunde oplossing tegenkomen, zodat ze veel minder corrosief zijn.
Denk eraan: het is nooit fout om Griekse telwoorden te gebruiken.
ontdekplaat: anorganische stofklassen
Afb. 32 Natriumchloride is het bekendste zout.
Afb. 33 Strooizout bevat calciumchloride.
Afb. 34 Eierschalen bestaan uit calciumcarbonaat.
Verder kun je een aantal zouten in de badkamer tegenkomen. Wratten kun je verwijderen door ze te laten bevriezen, maar je kunt hier ook zilvernitraat AgNO3 voor gebruiken. En in tandpasta zit heel vaak natriumfluoride NaF, dat zorgt voor sterker glazuur.

De kans is ook groot dat je soda of badzout of natriumcarbonaat Na2CO3 in huis hebt. Dat wordt vaak aan water toegevoegd als waterverzachter of waterontharder. Verwar het zeker niet met baksoda of bijtende soda. Baksoda is aanwezig in bakpoeder, en bijtende soda wordt als ontstopper gebruikt.

Formule Systematische naamTriviale naam Toepassing/ voorkomen
NaF natriumfluoride / tandpasta
AgNO3 zilvernitraat / wratten verwijderen
©VANIN
NaCl natriumchloride keukenzout smaak, bewaarmiddel
CaCO3 calciumcarbonaat / marmer, eierschaal
Na2CO3 natriumcarbonaat soda of badzout waterverzachter
CaCl2 calciumchloride / strooizout
Afb. 35 In de meeste tandpasta's zit natriumfluride.
Afb. 36 Met natriumcarbonaat kun je water ontharden.
4 Reactiepatroon
Neutralisatiereactie
Onderzoeksvraag
Welke stof ontstaat er bij de reactie van een zuur en een hydroxide?
Werkwijze
Je leerkracht voegt 2 mL zoutzuur toe aan een proefbuis. Nadien worden enkele druppels universeel-indicatoroplossing toegevoegd aan de oplossing en bepaalt de pH van de oplossing. Vervolgens voegt je leerkracht druppelsgewijs natriumhydroxideoplossing toe en bepaalt ook regelmatig de pH. Wanneer de pH 7 is geworden, stopt je leerkracht met het toevoegen van natriumhydroxideoplossing. Vervolgens plaatst je leerkracht het bekerglas op een draadnet en dampt die de oplossing uit.
Waarnemingen
De pH is tijdens het experiment gestegen. Na het verdampen van het water blijft er een witte vaste stof achter.
Besluit
Wanneer je aan een zuur een hydroxide toevoegt, stijgt de pH en wordt de pH uiteindelijk neutraal. Je kunt een zout vormen door de reactie van een zuur met een hydroxide. Aangezien de pH van de oplossing 7 wordt en de oplossing dus neutraal geworden is, spreken we van een neutralisatiereactie
reactiepatroon: zuur + hydroxide → zout + water HZ + MOH → MZ + H2O
reactievergelijking: HCl + NaOH → NaCl + H2O
Je kunt een zout vormen door een zuur met een hydroxide te laten reageren. Hierbij verandert de zuurtegraad of de pH. We noemen die reactie ook een neutralisatiereactie
Reactiepatroon zout:
zuur + hydroxide → zout + water HZ + MOH → MZ + H2O
©VANIN
AAN DE SLAG
Zijn de volgende verbindingen oxiden, hydroxiden, zuren of zouten?
a ammoniumsulfaat
b Al2O3
c H2S
d KOH
e bijtende soda
f lachgas
g Br2O
h Zn(OH)2
i waterstofnitraat
j natriumjodaat
k bariumhydroxide
Noteer bij elk van de volgende verbindingen zo nauwkeurig mogelijk de juiste stofklasse.
a Al2S3
b Fe(OH)3
c CO2
d H2SO4
e H2S
f LiOH
g CuF2
h Cu(NO3)2 i HCl
j (NH4)2CO3
k H3PO4
l P2O5
m K2O
n HNO2
Noteer de naam en de formule van de gevraagde zouten.
a kalium en sulfidezuurrest
b aluminium en carbonaatzuurrest
c alle zouten van ijzer en de ternaire zuurrest met chloor
d ammonium en waterstofzuurrest van koolzuur
De volgende ionen zijn gegeven:
Al3+ – Li+ – Sn2+ – SO42- – I-
Vorm met die ionen zo veel mogelijk verschillende formules en noteer de juiste naam/namen.
Noteer de juiste formule van de volgende stoffen.
a magnesiumjodaat
b aluminiumhydroxide
Verbind de juiste formule met de gegeven gebruiksnamen.
1 badzout a NaF
2 keukenzout b CaCl2
c NaOH
d Na2CO3 e NaCl
Vervolledig de volgende reactiepatronen.
a MOH + ? → MZ + H2O
b ? + ? → MO
c ? + ? → HnMO of HZ
d nM + O2 → ?
e MO + H2O → ?
f ? + ? → HnM
Noteer bij de volgende reactievergelijkingen de juiste letter van het reactiepatroon dat erbij hoort.
a I2 + H2 → 2 HI
b 2 Ca + O2 → 2 CaO
c Ca(OH)2 + 2 HI → CaI2 + 2 H2O
d 2 NaOH + H2SO4 → Na2SO4 + 2 H2O
Welke stoffen moet je samenvoegen om via een neutralisatiereactie Al(NO3)3 te bekomen? ` Meer oefenen? Ga naar .
KERNBEGRIPPEN
naamgeving
ANORGANISCHE STOFFEN
NOTITIES
Hoofdstuk 1: Verdere indeling van de materie
Metaal heeft 1 mogelijk oxidatiegetal:
—systematische naam: Grieks telwoord + metaal + Grieks telwoord + uitgang
—verkorte systematische naam (KISS-principe): metaal + uitgang
Metaal heeft meerdere mogelijke oxidatiegetallen:
systematische naam: Grieks telwoord + metaal + Grieks telwoord + uitgang
Atoomverbindingen: Grieks telwoord + niet-metaal + Grieks telwoord + oxide
Schema 1: indeling van anorganische stoffen op basis van een gegeven formule, zie p. 15
Schema 2: indeling van anorganische stoffen op basis van een naam, zie p. 16
Hoofdstuk 2: De oxiden oxiden
—MO (metaaloxide) of nMO (niet-metaaloxide)
—Functionele groep: O2-
—M + O2 → MO
—nM + O2 → nMO
Hoofdstuk 3: De hydroxiden hydroxiden MOH
—Functionele groep: OH-
—MO + H2O → MOH
—MO = basevormend oxide
Hoofdstuk 4: De zuren
zuren
©VANIN
pH zuurtegraad
—HnM (binair zuur) of HnMO (ternair zuur)
—Functionele groep: H+
—H2 + nM → HnM
—nMO + H2O → HnMO
—nMO = zuurvormend oxide
Hoofdstuk 5: Zuurtegraad van een oplossing
pH: 0-7 = zuur
7 = neutraal
7-14 = base
Hoe lager de pH, hoe zuurder de oplossing
Hoofdstuk 6: De zouten zouten
algemeen: MZ
MnM (binair zout) of MnMO (ternair zout)
HZ + MOH → MZ + H2O
Tijdens de reactie verandert de pH. Die reactie wordt ook een neutralisatiereactie genoemd.
M = metaal + O2
MO = metaaloxide + H2O
MOH = hydroxide
nM = niet-metaal + O2
nMO = niet-metaaloxide + H2O
HZ (= HnMO)
©VANIN
MZ + H2O
MnMO = ternair zout, ontstaat met HZ = ternair zuur HnMO
MnM = binair zout, ontstaat met HZ = binair zuur HnM
ORGANISCHE STOFKLASSEN 02 THEMA
Het kan gebeuren: je picknickt in het park en plots heb je een branderig gevoel aan je been. Wat blijkt nu? Je zit bovenop een mierennest. De kleine diertjes verdedigen zich met behulp van een zuur. Weet je welk zuur dat is? Het is zeker geen zoutzuur (HCl) of salpeterzuur (HNO3). Het is een organisch zuur. Zoek eens op het internet over welke stof het gaat.

` Hoe kun je specifieke stofklassen van organische stoffen herkennen?
` Hoe vorm je de systematische naam en chemische formule van die stoffen?
` Wat zijn enkele eigenschappen en toepassingen van een aantal van die organische stoffen?
We zoeken het uit!
VERKEN










































































• enkelvoudige stoffen en anorganische samengestelde stoffen voorstellen m.b.v. de brutoformule;









• de naam formuleren van anorganische stoffen als je de brutoformule krijgt;

• het belang, voorkomen en toepassingen van anorganische stoffen bespreken.
©VANIN












• de brutoformule noteren van anorganische stoffen als je de systematische naam of stocknotatie krijgt.

















• organische stoffen voorstellen met hun brutoformule, beknopte structuurformule, uitgebreide structuurformule en skeletnotatie;
• de naam van organische stoffen formuleren als je de formule krijgt;
• de formule van organische stoffen noteren als je de systematische naam krijgt.

• het voorkomen en mogelijke toepassingen van organische stoffen in het dagelijks leven in verband brengen met de stofklasse.
HClO3 – chloorzuur
HCl – zoutzuur
JE KUNT AL ...
JE LEERT NU ...
HOOFDSTUK 1
Organische chemie of koolstofchemie
Je kent ondertussen het verschil tussen een anorganische en een organische stof. De term koolstofverbindingen wordt gebruikt als synoniem voor organische stoffen. Zo spreekt men ook over koolstofchemie in plaats van over organische chemie, omdat organische stoffen minstens één koolstofatoom bevatten. De binding(en) die dat atoom aangaat, bepaalt tot welke stofklasse een organische stof behoort:
—Welk atoom is gebonden aan het koolstofatoom?
—Hoeveel bindingen worden er gevormd tussen het koolstofatoom en het volgende atoom?
Bij de anorganische stoffen beschreven we 4 stofklassen: de oxiden, de hydroxiden, de zuren en de zouten. Omwille van de verscheidene bindingsmogelijkheden van het koolstofatoom, bestaan er meer dan 10 stofklassen in de organische chemie. Voordat we enkele van die stofklassen bespreken, bekijken we eerst de bindingsmogelijkheden van het koolstofatoom.
Bovendien ken je het begrip brutoformule al uit thema 01. In dit hoofdstuk bestuderen we hoe een organische stof wordt voorgesteld. Naast de brutoformule worden organische stoffen ook nog op andere manieren voorgesteld.
LEERDOELEN
L de structuurformule, brutoformule en skeletnotatie van een organische stof herkennen, weergeven, in elkaar omzetten en interpreteren
L organische stoffen classificeren in alkanen, alkenen, alcoholen of carbonzuren op basis van een gegeven formule of naam
1 Bindingsmogelijkheden van het koolstofatoom
Organische stoffen worden gekenmerkt door de aanwezigheid van minstens 1 koolstofatoom. Een koolstofatoom heeft 4 vrije valentie-elektronen en gaat 4 bindingen aan om de octetstructuur te bereiken.
Bekijk enkele formules van organische stoffen:
Het valt op dat elk koolstofatoom 4 bindingen aangaat, maar dat wil niet zeggen dat het 4 bindingspartners nodig heeft! Zo zie je in de derde en vijfde voorstelling dat een atoom meerdere (dubbele of drievoudige) bindingen kan aangaan met een ander atoom waardoor er minder waterstofatomen nodig zijn om de edelgasconfiguratie te bereiken.
Wanneer het koolstofatoom 4 bindingspartners heeft en dus 4 enkelvoudige bindingen, dan spreekt men van verzadigde verbindingen. Als het koolstofatoom een binding vormt met 2 of 3 andere atomen, dan zijn er meervoudige bindingen aanwezig (dubbele of drievoudige) en spreken we van onverzadigde verbindingen
Wanneer de C-atomen alleen binden met andere C-atomen en met H-atomen, dan noemen we de stoffen koolwaterstoffen. Ook hier wordt dan het onderscheid gemaakt tussen verzadigde koolwaterstoffen en onverzadigde koolwaterstoffen.
Zoals je weet, heeft het koolstofatoom 4 valentie-elektronen. Om de octetstructuur te bereiken, zal het atoom dus met nog 4 extra elektronen moeten binden. Dat kan op een aantal manieren: het koolstofatoom kan zich binden aan 4, 3 of 2 atomen.
Binding met 4 atomen Binding met 3 atomen Binding met 2 atomen
Koolstof kan een atoombinding aangaan met 4 atomen, die elk 1 ongepaard elektron bezitten. Zowel waterstof als de halogenen zijn niet-metaalatomen met 1 ongepaard elektron.
We bekijken de molecule methaan (CH4):
Koolstof kan de octetstructuur ook bereiken door slechts aan 3 atomen te binden. Omdat het C-atoom 4 ongepaarde elektronen heeft, moet het dan een dubbele binding aangaan met 1 atoom.
We bekijken de molecule etheen (C2H4):
lewisstructuur:
©VANIN
Als het koolstofatoom slechts aan 2 atomen bindt, dan kan het de octetstructuur bereiken door 2 dubbele bindingen aan te gaan of een enkelvoudige en een drievoudige binding aan te gaan.
We bekijken de molecule ethyn (C2H2): lewisstructuur:
lewisstructuur:
Het koolstofatoom zal de 4 bindingen met waterstofatomen rondom zich in de ruimte maximaal spreiden. Hierdoor ontstaat een 3D-molecule, een tetraëder met hoeken tussen de C-Hbindingen die 109° bedragen.
ruimtelijke structuur:
Er is een dubbele binding tussen de 2 koolstofatomen. De bindingen van het koolstofatoom vormen nu een trigonale structuur: de bindingen liggen in een vlak met onderlinge bindingshoeken van 120°
De molecule heeft een lineaire structuur, wat betekent dat de bindingshoeken 180° bedragen.
ruimtelijke structuur:
WEETJE
In een organische stof zal het koolstofatoom altijd 4 atoombindingen aangaan met andere atomen. Dat kunnen andere koolstofatomen zijn, maar evengoed atomen van andere elementen (H, Cl, O …). Een koolstofatoom heeft dus altijd 4 bindingen, maar niet noodzakelijk 4 bindingspartners. Organische verbindingen die alleen bestaan uit C-atomen en H-atomen, worden ook wel koolwaterstoffen genoemd.
Verzadigde koolstofverbindingen zijn organische stoffen waarbij elk koolstofatoom steeds 4 bindingspartners heeft.
Onverzadigde koolstofverbindingen zijn organische stoffen waarbij sommige koolstofatomen 2 of 3 verschillende bindingspartners hebben.
2 Notatiemogelijkheden van een organische stof
Een organische stof bestaat dus uit koolstofatomen, die steeds 4 bindingen aangaan. Vaak ontstaat er een binding met een waterstofatoom. Organische stoffen worden op meerdere manieren weergegeven.
2.1 Brutoformule
Eén manier ken je al vanuit thema 01: de brutoformule. De brutoformule van een organische stof geeft de aanwezige elementen weer en het aantal van elk element met een index. De index 1 wordt niet genoteerd. In de organische chemie worden de elementen bovendien als volgt gerangschikt: eerst C (koolstof), dan H (waterstof) en ten slotte de overige elementen alfabetisch.
VOORBEELD BRUTOFORMULE
CH4 C2H6 C2H4 C3H8O
2.2 De uitgebreide en beknopte structuurformule
Over de manier waarop de atomen met elkaar verbonden zijn, krijg je geen informatie in de brutoformule. Hiervoor werken we met de structuurformule.
In die formule wordt het aantal atomen van elke soort weergegeven. Ze worden rond elk koolstofatoom apart geordend, waardoor de bindingen tussen de koolstofatomen zichtbaar zijn. De structuurformule is dus een tweedimensionale weergave van de structuur van een molecule waarbij de bindingen worden weergegeven tussen de verschillende koolstofatomen. De bindingen met waterstof worden, na een goede beheersing van het schrijven van een structuurformule, vaak weggelaten. We spreken dan van de beknopte structuurformule. Wanneer de C-H-bindingen wel nog worden getoond, spreekt men over een uitgebreide structuurformule.
©VANIN
Isomerie is afkomstig van het Griekse iso, dat ‘gelijk’ betekent, en meros, dat ‘bouwsteen’ betekent.
VOORBEELD STRUCTUURFORMULE
Brutoformule Uitgebreide structuurformule Beknopte structuurformule
C2H6
C2H4
C3H8O
- CH3
©VANIN
- CH2 - CH2 - OH
Merk op dat in het laatste voorbeeld het lijkt alsof het zuurstofatoom gebonden is aan een van de 2 waterstofatomen rond het koolstofatoom. Maar het is gebonden aan het koolstofatoom zelf.
Wanneer er in een structuurformule een atoomgroep, bijvoorbeeld CH2, vaak voorkomt, dan kan het als volgt verkort worden weergegeven:
- CH2 - CH2 - CH2 - CH2 - CH2 - CH3 → CH3 - (CH2)5 - CH3
WEETJE
Isomerie
De brutoformule kan, in tegenstelling tot bij een anorganische stof, niet altijd 1 op 1 gelinkt worden aan een organische stof. Ze wordt daarom ook minder gebruikt om een organische stof weer te geven. Zo kunnen er vanuit de brutoformule C4H10 2 verschillende organische stoffen worden gevormd, zoals te zien is in de onderstaande (beknopte) structuurformules:
CH3 - CH2 - CH2 - CH3
CH3 - CH - CH3 CH3
Omdat beide organische stoffen opgebouwd zijn uit dezelfde atomen en ook van elk eenzelfde aantal bevatten, worden de 2 stoffen isomeren van elkaar genoemd. Ze verschillen echter in fysische en chemische eigenschappen (bv. kooktemperatuur en reactiviteit). De isomere eigenschap ligt mee aan de basis van de grote hoeveelheid moleculen binnen de koolstofchemie. In de 3de graad komen we hier zeker op terug.
CH3
TIP
2.3 De skeletnotatie of zaagtandstructuur
Bij de organische stoffen maakt men ten slotte ook nog gebruik van een derde notatie: de skeletnotatie of zaagtandstructuur. De skeletnotatie toont enkel het skelet van een organische molecule, die heeft 2 onderdelen:
—de atoombinding(en) tussen de koolstofatomen; —de atoombinding(en) tussen de koolstofatomen en andere (niet-waterstof)atomen.
VOORBEELD SKELETNOTATIE OF ZAAGTANDSTRUCTUUR
Brutoformule Uitgebreide structuurformule Skeletnotatie
C4H10
CH3 - CH2 - CH2 - CH3
C3H6
CH2 = CH - CH3
CH3 - CH2 - OH
WEETJE
Skeletnotaties worden vooral gebruikt om grote organische moleculen voor te stellen. Denk bijvoorbeeld aan koolstofverbindingen uit het dagelijks leven, zoals fructose en glucose. Die suikers heb je misschien in de lessen biologie al gezien onder de vorm van hun skeletnotatie:
©VANIN
Fructose en glucose zijn trouwens ook isomeren van elkaar. Ze hebben allebei dezelfde brutoformule (C6H12O6) maar een specifieke structuurformule of skeletnotatie.
Afb. 40 De skeletnotatie van glucose
Afb. 39 De skeletnotatie van fructose
C2H6O
Een organische stof kan op verschillende manieren voorgesteld worden:
Brutoformule Uitgebreide structuurformule Beknopte structuurformule
Skeletnotatie of zaagtandstructuur = een lineaire weergave van de aanwezige elementen, met een index die het aantal per element weergeeft.
Volgorde: C – H –andere elementen in alfabetische volgorde
= een tweedimensionale weergave van de structuur van een molecule waarbij alle bindingen worden weergegeven.
= een tweedimensionale weergave van de structuur van een molecule waarbij de bindingen worden weergegeven tussen de verschillende koolstofatomen.
De C-H-bindingen worden niet weergegeven.
= een tweedimensionale weergave van de structuur van een molecule, waarbij alle bindingen worden weergegeven, maar de C- en H-atomen (gebonden aan de C-atomen) niet meer genoteerd worden.
3 De stofklassen
Bij de anorganische stoffen hebben we 4 stofklassen beschreven. Door de verschillende bindingsmogelijkheden van het koolstofatoom bestaan er meer dan 10 stofklassen in de organische chemie. Elk van die stofklassen wordt gekenmerkt door een specifieke binding of een functionele groep. Die functionele groep is een kenmerkende groep van atomen.
Dit schooljaar zullen we 5 stofklassen bespreken:
1 alkanen
2 alkenen
3 alkynen
4 alcoholen
5 carbonzuren
Bekijk enkele structuurformules, skeletnotaties en namen van de 5 stofklassen:

Hoofdbestanddeel van aardgas. Ook wel moerasgas genoemd.

Brandstof voor snijbranders of lassen. Ook wel acetyleen genoemd.
ethaanzuur CH3COOH n-butaan CH3-CH2-CH2-CH3

Wordt gebruikt als bewaarmiddel, maar ook om mayonaise en vinaigrettes te maken. Ook wel azijnzuur of ijsazijn genoemd.
©VANIN

In gasvuurtjes en om huizen te verwarmen.

Brandstof voor fonduestellen. Oplosmiddel voor lijmen, verven en vetten. Zeer giftige, kleurloze vloeistof.
methaanzuur H-COOH

Zit in de haren van brandnetels en wordt door mieren ingespoten als ze je bijten. Ook wel mierenzuur genoemd.
propaan
CH3-CH2-CH3

In gasvuurtjes en om huizen te verwarmen.
ethanol
CH3-CH2-OH

Drankalcohol. Ook gebruikt als ontsmettingsmiddel of biobrandstof.
propeen n-octaan

Grondstof voor polypropeen (PP).
n-hexaan
CH3-(CH2)4-CH3

Wordt gebruikt als oplosmiddel voor verschillende stoffen, waaronder oliën, wassen en waxen, en wordt daarom vaak gebruikt in de cosmetische en farmaceutische industrie.

Ideale brandstof voor verbrandingsmotoren.
©VANIN
etheen CH2=CH

Hormoon in planten dat zorgt voor rijping van de vruchten. Grondstof voor polyetheen (PE).
Probeer, eventueel in overleg met je klasgenoten, alle voorbeelden in 4 groepen onder te brengen. Welke kenmerken ga je hiervoor gebruiken? Noteer op een apart blad.
Als je kijkt naar de naam van de stofklassen en de namen van de stoffen, dan kun je het volgende vaststellen:
—alkanen → systematische naam eindigt op -aan
—alkenen → systematische naam eindigt op -een
—alkynen → systematische naam eindigt op -yn
—alcoholen → systematische naam eindigt op -ol
—carbonzuren → systematische naam eindigt op -zuur
Als je kijkt naar de structuurformules en skeletnotaties, dan kun je vaststellen dat:
—alkanen → enkelvoudige bindingen
—alkenen → dubbele binding
—alkynen → drievoudige binding
—alcoholen → OH-groep aanwezig
—carbonzuren → COOH-groep aanwezig
Zo komen we tot de volgende onderverdeling in 5 stofklassen:
1 alkaan → enkelvoudige bindingen tussen de C-atomen alleen maar C- en H-atomen aanwezig = verzadigde koolwaterstof
2 alkeen → dubbele binding tussen 1 paar C-atomen alleen maar C- en H-atomen aanwezig = onverzadigde koolwaterstof
3 alkyn → drievoudige binding tussen 1 paar C-atomen alleen maar C- en H-atomen aanwezig = onverzadigde koolwaterstof
4 alcohol → enkelvoudige bindingen tussen de C-atomen hydroxylfunctie (-OH groep) in de molecule
5 carbonzuur → enkelvoudige bindingen tussen de C-atomen → carboxylfunctie (-COOH groep) in de molecule
Stofklasse Systematische naam
Structuurformule
alkanen -aan - alleen C/H-atomen - alleen maar enkelvoudige bindingen
alkenen -een - alleen C/H-atomen - dubbele binding aanwezig
alkynen -yn - alleen C/H-atomen - drievoudige binding aanwezig
alcoholen -ol - C/H/O-atomen
- OH als functionele groep aanwezig
carbonzuren-zuur - C/H/O-atomen
- COOH als functionele groep aanwezig
Dit schooljaar beperken we ons tot die 5 stofklassen. In de volgende hoofdstukken bespreken we dan ook telkens 1 van die stofklassen. De kennis die je dit jaar verzamelt, vormt de basis voor het volgende jaar waarin je meer stofklassen zult leren en waarin je binnen 1 stofklasse het aantal stoffen uitgebreider zult bespreken.
©VANIN
AAN DE SLAG
Lees de volgende stellingen. Vermeld of ze juist (J) of fout (F) zijn. Verbeter de onderlijnde tekst indien fout.
a In een organische verbinding heeft elk koolstofatoom 4 bindingspartners.
b Bij een organische stof wordt tussen een C- en H-atoom steeds een enkelvoudige binding gevormd.
c CH2-CH2-CH2-CH3 is een juiste weergave van een organische verbinding met alleen enkelvoudig gebonden C- en H-atomen.
d CH2 = CH-CH2-CH3 is een juiste weergave van een organische verbinding met enkel C- en H-atomen en één dubbele binding.
Noteer de brutoformule van de onderstaande stoffen.
Voorbeeld:
Structuurformule van de verbinding
CH3 - CH2- CH3 C3H8
Brutoformule van de verbinding
a CH3 - (CH2)4 - CH3
b CH3 - CH2 - CH2OH
c CH2 = CH - CH2 - CH3
d CH3 - CH2 - CH2 - CH = CH - CH3
Geef de brutoformule, structuurformule en/of skeletnotatie van de onderstaande stoffen. Vraag a werd al ingevuld als voorbeeld.
Brutoformule van de verbinding Structuurformule van de verbinding
a C5H12 CH3 - CH2 - CH2 - CH2 - CH3
b
c CH3 - CH2 - CH = CH - (CH2)3 - CH3
d CH3 - COOH
Skeletnotatie van de verbinding
Binnen de organische verbindingen komen de stofklassen alkanen, alkenen en alkynen voor. Waarin verschillen de 3 stofklassen van elkaar?
Plaats de onderstaande koolstofverbindingen in de juiste stofklasse (alkaan, alkeen, alkyn, alcohol of carbonzuur).
Koolstofverbinding (systematische naam, structuurformule of skeletnotatie)
a hexaan
b
c CH2 = CH - CH2 - CH3
d OH O e nonaanzuur
f g
h methanol
h 3-heptyn
` Meer oefenen? Ga naar .
HOOFDSTUK
2
Alkanen
Een stofklasse die we uitgebreider bekijken, zijn de alkanen. Die moleculen bevatten alleen koolstof- en waterstofatomen. We geven ze daarom dan ook vaak de naam koolwaterstoffen. Tussen de koolstofatomen komt telkens maar 1 binding voor; we spreken van een enkelvoudige atoombinding. Hierdoor heeft elk koolstofatoom een maximaal aantal waterstofatomen en kunnen er geen extra atomen opgenomen worden in de molecule. We noemen alkanen daarom ook verzadigde koolwaterstofverbindingen.
Stofklasse Typisch kenmerk Alkaan Enkelvoudige bindingen tussen de C-atomen‘C-C’
LEERDOELEN
L de naam van een alkaan formuleren op basis van een gegeven structuurformule of skeletnotatie en omgekeerd
L enkele toepassingen van alkanen uit het dagelijks leven en de industrie bespreken
1 Formule en systematische naam
Centraal in de molecule staat de koolstofketen, de stam van de molecule. De lengte van de stam bepaalt de naam van de molecule. Dit jaar bespreken we alleen de onvertakte alkanen: er komen geen zijketens voor in de moleculen.
Hoe wordt de systematische naam van een specifiek alkaan juist gevormd?
—De stam ‘alk-‘ verwijst naar het specifieke aantal C-atomen in de molecule. —Het achtervoegsel ‘-aan’ verwijst naar de het feit dat er alleen maar enkelvoudige bindingen tussen alle C-atomen bestaan.
Het is dus belangrijk dat je de stammen goed kent, want ze vormen de basis voor het grote aantal moleculen dat je de volgende jaren zult leren kennen.
De eerste 3 alkanen onthoud je misschien met het ezelsbruggetje ‘MEP’. Vanaf het vijfde alkaan herken je de Griekse telwoorden. Om de namen van die moleculen te onthouden, bestaat er ook een geheugensteuntje. De eerste letters van de alkanen keren terug in de volgende zin: ‘Mama en papa bakken pannenkoeken, heel heerlijk of niet dan?’
De ‘n’ in de naam voor de onvertakte alkanen staat voor ‘normal’, maar je kunt het misschien beter onthouden als ‘niet-vertakt’.
Vanaf 4 koolstofatomen kan met dezelfde bouwstenen ook een vertakt alkaan gevormd worden, bv. C4H10:
CH3 - CH2 - CH2 - CH3
CH3 - CH - CH3 CH3
Vanaf butaan wordt de alkaannaam daarom ook als een verzamelnaam gezien. Wanneer men het specifiek over het lineair molecule heeft, dan plaatst men ‘n-’ voor de naam. De systematische naam van CH3-CH2-CH2-CH3 wordt dan n-butaan, omdat het onvertakt is.
VOORBEELD SYSTEMATISCHE NAAM ONVERTAKTE ALKANEN
We formuleren de systematische naam van enkele (onvertakte) alkanen vanuit de gegeven structuurformule of skeletnotatie.
1 CH4
—stam = 1 koolstofatoom: METH
—Het C-atoom heeft 4 bindingspartners en is dus verzadigd: achtervoegsel AAN
De systematische naam van de molecule is methaan
2 CH3-CH2-CH2-CH2-CH3
—stam = 5 koolstofatomen: PENT
—Elk C-atoom heeft 4 bindingspartners en is dus verzadigd: achtervoegsel AAN.
—Het is een onvertakt alkaan met meer dan 4 C-atomen, dus met ‘n’ voor de naam.
De systematische naam van de molecule is n-pentaan.
©VANIN
3
—stam = 8 koolstofatomen: OCT
—Elk C-atoom heeft 4 bindingspartners en is dus verzadigd: achtervoegsel AAN.
—Het is een onvertakt alkaan met > 4 C-atomen, dus met ‘n’ voor de naam.
De systematische naam van de molecule is n-octaan.
Hoe worden de brutoformule, structuurformule of skeletnotatie van een specifiek (onvertakt) alkaan gevormd?
Bij het opstellen van de structuurformule van een alkaan overloop je best het volgende stappenplan:
Stap 1: Schrijf het aantal C-atomen.
Stap 2: Plaats een enkelvoudige binding tussen de C-atomen.
Stap 3: Vul de formule aan met H-atomen totdat elk C-atoom 4 bindingen heeft.
VOORBEELD FORMULEVORMING ONVERTAKTE ALKANEN n-heptaan
Stap 1: Schrijf het aantal C-atomen.
De stam is HEPT, wat wil zeggen 7 C-atomen + afkorting ‘n’ dus een onvertakt alkaan.
C C C C C C C
Stap 2: Plaats tussen alle koolstofatomen een enkelvoudige binding.
C – C – C – C – C – C – C
Stap 3: Vul de formule aan met H-atomen, tot elk C-atoom 4 bindingspartners heeft.
Uitgebreide structuurformule:
HC H H C H H C H H C H H C H H C H H C H H H
Beknopte structuurformule:
CH3 - CH2 - CH2 - CH2 - CH2 - CH2 - CH3 of CH3-(CH2)5-CH3
Brutoformule: C7H16
Skeletnotatie:
Uit het bovenstaande voorbeeld blijkt dat in de brutoformule van een alkaan het aantal waterstofatomen steeds gelijk is aan tweemaal het aantal koolstofatomen plus 2.
Dat leidt tot de volgende algemene brutoformule voor de alkanen:
C nH2n+2 (met n = natuurlijk getal)
WEETJE
De 10 alkanen die we al gezien hebben, zijn maar een deel van de beschikbare alkanen. Er zijn alkanen die meer dan 10 koolstofatomen bezitten en bovendien zijn er vertakkingen mogelijk. Omdat er enorm veel mogelijke combinaties zijn, zijn er internationaal duidelijke afspraken gemaakt over de naamgeving van die vertakte alkanen.
©VANIN
Zijketengroepen verkrijgen we door bij een alkaan 1 H-atoom weg te nemen. De namen ervan worden gevormd door aan de stamnaam het achtervoegsel -yl toe te voegen.
Voorbeeld: – CH2 – CH2 – CH3 → propyl-zijketen
ALKANEN
onvertakt vertakt
©VANIN
Naamgeving
stam = aantal C-atomen + achtervoegsel ‘aan’
—vanaf 4 C-atomen met symbool ‘n’ vooraan
Formulevorming
—brutoformule:
C nH2n+2
—structuurformule: Zie stappenplan p. 68
2 Fysische eigenschappen, voorkomen en toepassingen uit het dagelijks leven
2.1 Fysische eigenschappen
Paraffine, het hoofdbestanddeel van kaarsen, is een mengsel van n-alkanen met 17 tot 57 koolstofatomen. Afb. 41 Kook- en smelttemperatuur van alkanen
Alkanen komen in groot aantal voor in de natuur. Wanneer we de kook- en smelttemperatuur bekijken op de onderstaande grafiek, wordt duidelijk dat korte alkanen zoals methaan (CH4), ethaan (CH3-CH3), propaan (CH3-CH2-CH3) en butaan (CH3-CH2-CH2-CH3) gasvormig zijn bij kamertemperatuur. Naarmate de molecule langer wordt, stijgt het kookpunt van het alkaan. Alkanen met 5 tot 16 C-atomen zijn vloeibaar bij kamertemperatuur en alkanen met 17 of meer C-atomen zijn vast bij kamertemperatuur. De laatste noemen we de hogere alkanen of paraffinen

ORGANISCHE STOFFEN

DEMO
Alkanen zijn goed brandbaar. Methaan (aardgas) wordt als brandstof gebruikt voor het verwarmen van onze huizen en het koken van eten op een gasvuur.
Kortere alkanen zijn bovendien licht ontvlambaar. Daarom moet je thuis altijd goed controleren of je de gasaansluiting van je gasfornuis goed hebt afgesloten wanneer je klaar bent met koken.
n-pentaanbrug: hoe blus je branden van alkanen (licht ontvlambaar)?
Werkwijze
Je leerkracht bevochtigt een propje watten met n-pentaan. Een gehalveerde plastic staaf wordt onder een hoek van 45° opgesteld met behulp van een statief. Het andere uiteinde rust op tafel in de buurt van een theelichtje of brandende kaars.
Waarnemingen
watje met pentaan
gehalveerde plastic buis
emmer met water en vochtige handdoek
GEN4_CHE_KOV_LB_T2_H2_pentaan.ai
Wanneer het natte propje bovenaan op de plastic buis geplaatst wordt, zullen de dampen van het solvent de baan van de buis volgen om uiteindelijk het kaarsje te bereiken. De dampen zullen ontbranden en het spoor naar het propje toe volgen zodat ook dat in brand vliegt. Wanneer het propje brandt, wordt het met behulp van een ijzeren tang in een emmer water gelegd. Het propje blijft drijven en branden.
Besluit
Water helpt hier niet om te blussen, maar hoe kan de brand dan wel geblust worden? Door de emmer af te dekken met een met water bevochtigde handdoek en alle luchttoevoer af te sluiten.
VEILIGHEIDSVOORSCHRIFT !
Juiste blusmethode
Een stof is licht ontvlambaar als ze met een vlam of klein vonkje gaat branden bij kamertemperatuur in de aanwezigheid van lucht. Let op: ontvlambaarheid mag je niet verwarren met brandbaarheid van een stof. Een stof kan goed brandbaar zijn, maar toch slecht ontvlambaar.
©VANIN
demovideo: n-pentaanbrug
• Neem de natte doek met 2 handen vast aan de bovenste hoekpunten (de handpalmen naar boven).
• Draai de handen zodat de blusdoek de handen en onderarmen bedekt.

• Benader het vuur met gestrekte armen en de blusdoek voor je.
• Plaats de blusdoek over de brand, beginnende met de onderkant van de blusdoek.
• Zorg ervoor dat de blusdoek de vuurhaard volledig bedekt. Laat de blusdoek liggen want de brandstof kan opnieuw ontvlammen.
GEN4_CHE_KOV_LB_T2_H2_methaan.ai
demovideo: juiste blusmethode
kaarsje
dalende
dichtheid en kookpunt gasfractie
oplopende
dichtheid en kookpunt
ruwe olie
chemicaliën 70 °C
petroleum voor auto’s 120 °C
kerosine voor vliegtuigen paraffine voor verlichting en verwarming 170 °C
diesel 270 °C
smeerolie, glansen boenproducten
brandstof voor schepen, industrie en centrale verwarming 600 °C asfaltfractie voor wegen
WEETJE
Kraken van langere alkanen
De wereldindustrie steunt voor haar energievoorziening grotendeels op alkaanmengsels, zoals petroleum en aardgas. Die grondstoffen vormen ook de basis van de petrochemie waaruit allerlei producten ontstaan die niet meer uit het moderne leven zijn weg te denken. Vorig jaar leerde je al dat ruwe aardolie in fracties wordt gescheiden door gefractioneerde destillatie.
©VANIN
Je leerde dat de kortere alkanen vlugger ontvlammen en dus goed bruikbaar zijn als brandstof. Petrochemici proberen langere ketens dan ook te splitsen in meerdere kortere ketens. Dat heet het kraken van alkanen. Om dat resultaat te bereiken, worden de langere alkaanketens verhit in een omgeving zonder zuurstofgas, waardoor er kortere brokstukken ontstaan: kortere alkanen, maar ook alkenen.
Afb. 43 Kraken van C15H32. Let op de dubbele bindingen die hierbij worden gevormd.
Afb. 42 Gefractioneerde destillatie van ruwe aardolie
2.2 Voorkomen en toepassingen uit het dagelijks leven
Methaan
GEN4_CHE_KOV_LB_T2_H2_methaan.ai
Methaan is het voornaamste bestanddeel van aardgas en wordt soms aangetroffen samen met aardolie en andere fossiele brandstoffen. Methaangas ontstaat wanneer bacteriën onder anaerobe omstandigheden (= omgeving zonder zuurstofgas) afgestorven organismen afbreken. Omdat anaerobe omstandigheden vooral in moerasbodems voorkomen, wordt methaan vaak moerasgas genoemd. Het gas ontstaat ook bij de verwerking van o.a. tuinafval.
Door die gassen over generatoren te sturen, wordt elektrische energie opgewekt. Methaan wordt daarom ook vaak een biogas genoemd.
Veel gezinnen gebruiken aardgas als brandstof voor het verwarmen van hun woning. Gasleidingen komen dan ook overal in Vlaanderen voor. Methaan is echter geur- en kleurloos. Om een gaslek tijdig op te merken, voegen gasleveranciers daarom sterk geurende organische stoffen toe.
De verbrandingsreactie van methaan verloopt dan als volgt (bij volledige verbranding):
CH4 + 2 O2 → CO2 + 2 H2O
WEETJE

Op 30 juli 2004 was er een grote gasontploffing in Gellingen (Frans: Ghislenghien), in de provincie Henegouwen. In het plaatselijke industriegebied raakte een aannemer bij werken een grote gasleiding met zijn graafmachine. Toen enkele dagen later de gasnetbeheerder de druk verhoogde in de pijpleiding, is die volledig opengebarsten. Men vermoedt dat door de warme, zomerse temperatuur een zware ontploffing ontstond, gepaard met een geweldige steekvlam. Door de explosie en de zware brand die volgde, kwamen 24 mensen om het leven. De gasexplosie bracht een discussie op gang over hoe zo’n ongevallen in de toekomst vermeden kunnen worden. Normaal gezien is elke aannemer verplicht om na te gaan of er zich een gasleiding onder de plaats van de werken bevindt. Als dat het geval is, moet de netbeheerder van de leiding ingelicht worden over de werken en mogen er geen graafmachines gebruikt worden vlakbij de leiding. Er kwam echter aan het licht dat in de praktijk de tekeningen van de ondergrondse gasleiding niet bestonden of onvolledig waren.
Bron: De Standaard, 30/07/2009
©VANIN
De grootste methaanvoorraad bevindt zich echter nog in de aarde. Belangrijke methaanrijke moerasgebieden zijn te vinden in het hoge noorden van Europa, Siberië en Amerika. In die gebieden is de bodem permanent bevroren: op enige diepte bevindt zich ijs. Dat heet permafrost. Alleen de bovenste decimeters van de bodem ontdooien elke zomer. Omdat het water niet weg kan zakken door het ijs in de bodem, wordt het vooral in vlakke gebieden nat met veel moerasvorming tot gevolg. Er wordt nu gevreesd dat de temperatuurstijging op aarde zal zorgen voor het ontdooien van de permafrost. Dat zou kunnen leiden tot het vrijkomen van grote hoeveelheden methaan, en een verdere toename van het broeikaseffect.

Afb. 44 Een molecule methaan
3D-beeld methaan ontdekplaat: organische stofklassen
Afb. 45 Moerasgebieden bevatten methaan.
3D-beeld
3D-beeld

Ook het gevreesde mijngas, dat – gemengd met lucht – in steenkoolmijnen ernstige ontploffingen (‘grauwvuur’) kon veroorzaken, bevatte methaan. Aangezien het gas kleur- en geurloos is, moesten mijnwerkers uiterst waakzaam zijn voor explosies. Om die reden namen mijnwerkers vaak een kanarie in een kooi mee in de schachten. Wanneer er mijngas aanwezig was, stierf de kanarie alvorens groot gevaar voor de mijnwerkers optrad. Op die manier konden de mijnwerkers zichzelf op tijd in veiligheid brengen. WEETJE
Spoken op het kerkhof – gevaren in de ondergrond Lang geleden, toen er nog echt donkere nachten waren, werd een late bezoeker van het kerkhof soms opgeschrikt door blauwe dwaallichtjes. Dat was methaan dat uit de aarde opsteeg, gemengd met een geringe hoeveelheid fosfine (PH3). Wanneer dat mengsel in contact kwam met de lucht, ontvlamde het spontaan.
©VANIN
Aardgas bevat naast methaan ook nog andere koolwaterstoffen. De 2de belangrijkste organische fractie is ethaan, hoewel het beduidend minder in aardgas voorkomt dan methaan.
Aangezien ook ethaan als brandstof wordt gebruikt, schrijven we ook hiervoor de verbrandingsreactie: 2 C2H6 + 7 O2 → 4 CO2 + 6 H2O
Ethaan is een belangrijke grondstof voor de productie van andere organische stoffen zoals etheen, ethanol en ethaanzuur.
Propaan en n-butaan



Propaan en n-butaan zijn gasvormige alkanen, die gebruikt worden om bijvoorbeeld huizen te verwarmen of om fornuizen aan te steken in de keuken. De gassen worden als vloeistoffen onder druk in de handel gebracht onder de benamingen propagas en butagas. Beide gassen worden in een school ook vaak gebruik als mobiele opstelling bij het gebruik van een bunsenbrander.
Afb. 46 Mijngas kan ontploffingen veroorzaken.
Ethaan
Afb. 47 Een molecule ethaan
3D-beeld
Afb. 48 Een molecule propaan
Afb. 49 Een molecule n-butaan
Afb. 50
Ook voor propaan en n-butaan schrijven we een (volledige) verbrandingsreactie:
C3H8 + 5 O2 → 3 CO2 + 4 H2O 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
DEMO
Verbranding propaan en n-butaan
Werkwijze
Je leerkracht vult een bekerglas met water en voegt afwasmiddel toe. Door middel van een lepel wordt voor een goede schuimvorming gezorgd. De leerkracht leidt met behulp van een slang gedurende enkele seconden gas in de oplossing en schept met natte handen een klein beetje schuim van de zeepoplossing. Je leerkracht steekt vervolgens het schuim in brand met behulp van lucifers.
Waarnemingen
Het schuim schiet in brand. De hand van de leerkracht wordt niet aangetast.
Besluit
Het propaan en n-butaan uit de gasleiding ontbrandt goed. Dat bevestigt dat ze licht ontvlambaar zijn en gebruikt kunnen worden als brandstof.
Als je houdt van kamperen, heb je zeker al eens gekookt op een gasvuurtje. De bekende blauwe bussen zijn gevuld met butaan. Het gas staat onder verhoogde druk, waardoor het vloeibaar is. Wanneer zo’n bus wordt opengedraaid, ontsnapt eerst het n-butaangas dat zich boven de vloeistof bevindt. Vervolgens verdampt een gedeelte van het vloeibare n-butaan. Die omzetting kan pas voldoende snel gebeuren als de temperatuur van het samengeperste n-butaan hoger ligt dan het kookpunt: -0,5 °C. Om die reden is butaan niet bruikbaar bij vriesweer. Bergbeklimmers en wintersporters gebruiken daarom propaan als campinggas. Het kookpunt van propaan is -42 °C en dat geeft dus geen problemen bij lage temperaturen.
©VANIN

demovideo: de verbranding van propaan en n-butaan
Afb. 51 Koken met butaangas
n-octaan
Benzine bevat ongeveer 300 verschillende koolstofverbindingen, waarvan de meeste alkanen zijn, onder andere octaan. Octaan is een ideale brandstof voor verbrandingsmotoren: hoe hoger het octaangehalte, hoe beter. De verbrandingsreactie noteren we als volgt:
WEETJE
Octaangehalte versus octaangetal aan de benzinepomp

n-alkaan
methaan
ethaan
propaan
n-butaan
Er is een verschil tussen het octaangehalte en het octaangetal. Het octaangehalte duidt op de hoeveelheid octaan in benzine. Het octaangetal is een maat voor de klopvastheid van de brandstof (de mate waarin die brandstof in een brandstofluchtmengsel kan worden samengeperst zonder tot zelfontbranding te komen). De cijfers 95 of 98 die je op de benzinepomp aantreft, geven het octaangetal weer.
Toepassing
—brandstof om woningen te verwarmen
—brandstof om woningen te verwarmen —grondstof voor productie etheen, ethanol, ethaanzuur ...
—brandstof om woningen te verwarmen —in gasflessen voor campingvuurtjes en kookfornuis
—brandstof om woningen te verwarmen —in gasflessen voor campingvuurtjes en kookfornuis
De 4 kleinste n-alkanen komen voor in ruwe aardolie, zijn gasvormig bij kamertemperatuur en licht ontvlambaar. Methaan vind je daarnaast ook in aardgas en in permafrost.
n-pentaan tot n-decaan zijn ook terug te vinden in ruwe aardolie, maar zijn vloeibaar bij kamertemperatuur. n-octaan wordt gebruikt als brandstof voor benzinemotoren.
©VANIN
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O
AAN DE SLAG
Geef de systematische naam, structuurformule en/of brutoformule van de gegeven alkanen.
a propaan
b CH3 - (CH2)3 - CH3
c CH3 - CH3 d CH3- (CH2)8- CH3
Geef de systematische naam, structuurformule, skeletnotatie en/of brutoformule van de gegeven alkanen.
a b n-butaan
c CH3 - (CH2)6 - CH3 d
Koppel de juiste alkanen aan de juiste toepassing(en) of het juiste voorkomen.
1 ethaan 2 propaan 3 methaan
a komt voor in de permafrost van Siberië b grondstof voor ethanol (drankalchohol)
c campinggas
Geef de aggregatietoestand van de gegeven alkanen bij 21 °C en -10 °C. In de grafiek zie je de smelt- en kookpunten van n-alkanen in functie van het aantal koolstofatomen in de keten.
a octaan b propaan c butaan d C18H38
Methaan wordt gebruikt als brandstof. Uit het derde jaar weten we dat verbranden eigenlijk het reageren met zuurstofgas is. Schrijf nu zelf de verbrandingsreactie.
Schrijf de verbrandingsreactie van octaan. Wat heeft autorijden met het versterkt broeikaseffect te maken?
` Meer oefenen? Ga naar .

ORGANISCHE STOFKLASSEN
bindingsmogelijkheden C-atoom: 4 bindingen, niet noodzakelijk 4 bindingspartners soorten formules: brutoformule, (beknopte) structuurformule, skeletnotatie telwoorden stam naamgeving (indicatie voor het aantal C-atomen):
1 - 2 - 3 - 4 - 5 - 6 - 7 - 8 - 9 - 10
meth-eth-prop-but-pent-hex-hept-oct-non-dec
—bestaan enkel uit
C- en H-atomen
—bevat enkelvoudige bindingen
—bestaan enkel uit
C-en H-atomen
—bevat een dubbele binding
—bestaan enkel uit C-en H-atomen —enkelvoudige bindingen
—naamgeving en formulevorming alkanen:
• ALK = stam (aantal C-atomen)
Kenmerken
—bestaan enkel uit
C- en H-atomen
—bevat een drievoudige binding
—bestaan uit
C-,H- en O-atomen
—bevat een OH-groep
kennisclip 1u kennisclip 2u
• AAN (= alleen maar enkelvoudige bindingen tussen de C-atomen)
n-alkaan Toepassing
methaan
ethaan
propaan
n-butaan
—brandstof om woningen te verwarmen
—brandstof om woningen te verwarmen
—grondstof voor productie etheen, ethanol, ethaanzuur …
—brandstof om woningen te verwarmen
—brandstof om woningen te verwarmen
—bestaan uit
C-,H- en O-atomen
—bevat een COOH-groep
—in gasflessen voor campingvuurtjes en kookfornuis
—in gasflessen voor campingvuurtjes en kookfornuis
De 4 kleinste n-alkanen komen voor in ruwe aardolie, zijn gasvormig bij kamertemperatuur en licht ontvlambaar. Methaan vind je daarnaast ook in aardgas en in de permafrost.
©VANIN
n-pentaan tot n-decaan zijn ook terug te vinden in ruwe aardolie, maar zijn vloeibaar bij kamertemperatuur. n-octaan wordt gebruikt als brandstof voor benzinemotoren.
ALKANEN
CHEMISCH REKENEN 03 THEMA
Om zelf mayonaise te maken, is het belangrijk om de juiste hoeveelheden van de ingrediënten te gebruiken: 1 eierdooier, 1 eetlepel mosterd, een snuifje zout … Eenheden zoals een ‘snuifje’ of een ‘eetlepel’ zullen we echter in de chemielessen niet gebruiken. In de keuken kun je nog spelen met de hoeveelheden van ingrediënten, in de chemie is dat niet zo. Reagentia moeten in zeer nauwkeurige hoeveelheden worden samengevoegd.

zout mosterd
` Hoe kun je te weten komen welke hoeveelheden van stoffen met elkaar reageren?
` En hoe ga je die stofhoeveelheden afwegen? De massa van atomen is immers veel te klein.
We zoeken het uit!
citroensap
VERKEN
JE KUNT AL ...
• de historische evolutie van de atoommodellen van Dalton tot en met Bohr begrijpen;
• de evolutie van de atoommodellen chronologisch weergeven.

• uitleggen wat een oplossing is.
• de stofeigenschappen van een oplossing omschrijven.
JE LEERT NU ...

©VANIN
• de juiste stofhoeveelheden afmeten hoewel de massa’s van een atoom en een molecule bijzonder klein zijn.
• de concentratie berekenen van een oplossing;
• verklaren wat er gebeurt met de concentratie na het toevoegen of het verwijderen van oplosmiddel.
HOOFDSTUK 1
Atoommassa, molecuulmassa, formulemassa
Het atoom is het kleinste deeltje dat nog alle eigenschappen van het element bezit. Niet-metalen binden via atoombinding tot moleculen, tot zuren en niet-metaaloxiden bijvoorbeeld. Metalen en niet-metalen binden onderling via een ionbinding. De metaaloxiden, de hydroxiden en de zouten binden op die manier, zoals je in thema 01 al hebt geleerd.
LEERDOELEN
L het verband aantonen tussen de relatieve en absolute massa van atomen
L de molecuulmassa van een molecuulverbinding of de formulemassa van een ionverbinding uit de atoommassa’s berekenen
1 Atoommassa
Je weet al dat het gecombineerde atoommodel van Bohr-Rutherford een atoom beschrijft met een kern, bestaande uit neutronen en protonen, en schillen met elektronen rond die kern.
—Atomen van hetzelfde element hebben altijd hetzelfde aantal protonen en elektronen, maar kunnen een verschillend aantal neutronen bevatten.
—De relatieve atoommassa A r van een element is de verhouding tussen de absolute atoommassa en de eenheidsmassa (u).
Een proton heeft een massa van 1,6726231 · 10-27 kg, net iets minder dan de massa van een neutron. De massa van een elektron is verwaarloosbaar klein: slechts 1 2 000 van de massa van een proton. Om het rekenen wat te vereenvoudigen, werd de unit (u) als eenheid gedefinieerd:
©VANIN
—De unit is de standaard om massa aan te duiden op atomair of moleculair niveau. Het werd gedefinieerd als 1 12 de van de massa van het 12C-isotoop en bedraagt 1,66 · 10−27 kg.
—Bij benadering kunnen we de unit gelijkstellen aan de massa van een proton of aan die van een neutron.
Synoniemen:
Unit = eenheidsmassa = atomaire massa-eenheid
3D-beeld atoom
Afb. 52 Het schillenmodel van Bohr-Rutherford
elektronenschillen
elektronen protonen en neutronen
Absolute atoommassa
Symbool: A a
Gemiddelde relatieve atoommassa
Symbool: <A r >
Vorig jaar leerde je al dat het volstaat om de massa van het aantal protonen en neutronen van een atoom samen te tellen om het massagetal te berekenen:
—De massa van het atoom (massagetal A) is de som van het aantal protonen (Z) en van het aantal neutronen (N).
A (massagetal) = Z (aantal protonen) + N (aantal neutronen)
VOORBEELD ABSOLUTE ATOOMMASSA BEREKENEN
We berekenen de absolute atoommassa, uitgedrukt in unit, van een magnesiumatoom met 12 neutronen:
24Mg heeft 12 protonen (Z) en dus 12 (A-Z) neutronen. De massa is dus: A = Z + N = 24 u
Omgerekend naar kg is dat dan: A a(Mg) = 24 u · 1,66 · 10−27 kg u = 40 · 10-27 kg
©VANIN
Zo’n kleine massa is onmeetbaar voor om het even welk instrument. Daar moeten we een oplossing voor vinden.
Bovendien kunnen atomen van hetzelfde chemische element, dus met hetzelfde aantal protonen, een verschillend aantal neutronen in de kern hebben. Zo zullen niet alle magnesiumatomen 12 neutronen in de kern hebben. We spreken in dat geval over isotopen. Als er meerdere isotopen bestaan van eenzelfde element, dan kunnen we de atoommassa van een element niet zomaar gelijkstellen aan die van één bepaalde isotoop. We moeten de atoommassa van een element dan bepalen door rekening te houden met het procentueel voorkomen van elke isotoop. We spreken dan over de gemiddelde relatieve atoommassa. We ronden in berekeningen de gemiddelde relatieve atoommassa <A r > steeds af op 1 cijfer na de komma.
De gemiddelde relatieve atoommassa is het ‘gewogen gemiddelde’ van alle relatieve atoommassa’s van de voorkomende isotopen. In het PSE wordt bij elk element <A r > vermeld.
magnesium 24,31 atoomnummer (Z) elektronegatieve waarde (EN)
12 1,2
symbool naam
gemiddelde relatieve atoommassa (<A r >) Afb. 53 De gemiddelde relatieve atoommassa van magnesium
2 Molecuulmassa
Je weet nu hoe de massa van een atoom wordt berekend, maar hoe bereken je de massa van een molecule die uit verschillende soorten atomen bestaat?
Vergelijk het met een zak snoepjes: om de totale massa van de snoepjes te berekenen zul je de massa van elk soort snoepje moeten kennen en het aantal snoepjes per soort.

Ook moleculen bestaan uit een welbepaalde combinatie van meerdere atomen. Die atomen kunnen tot verschillende elementen behoren. Om de gemiddelde massa van een molecule of de molecuulmassa te berekenen, volstaat het de som te nemen van de gemiddelde atoommassa's van alle atomen in de molecule
VOORBEELD MOLECUULMASSA BEREKENEN
—de molecuulmassa van 1 molecule zwavelzuur (H2SO4):
• 2 waterstofatomen
• 1 zwavelatoom
• 4 zuurstofatomen
m(H2SO4) = = (2 · 1,0 u) + (1 · 32,1 u) + (4 · 16,0 u) = 98,1 u
Uitgedrukt in kg is dat:
m = 98,1 · 1 u · 1,66 · 10−27 kg u = 1,63 · 10-25 kg
—de massa van 1 molecule salpeterzuur (HNO3):
• 1 waterstofatoom
• 1 stikstofatoom
• 3 zuurstofatomen
m(HNO3) = (1 · 1,0 u) + (1 · 14,0 u) + (3 · 16,0 u) = 63,0 u
Uitgedrukt in kg is dat:
m = 63,0 u · 1,66 · 10−27 kg u = 1,05 · 10-25 kg
3 Formulemassa
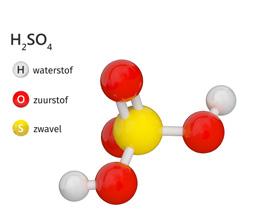

In een verbinding opgebouwd uit metalen en niet-metalen worden de gevormde ionen samengehouden door een ionbinding. Die stof noemen we een ionverbinding. Voor ionverbindingen kunnen we dezelfde methode toepassen, alleen gebruiken we nu de formule-eenheid: de steeds wederkerende eenheid uit het ionrooster.
Zouten vormen bijvoorbeeld geen aparte moleculen. We spreken hier dan ook beter over de formule-eenheidsmassa of kortweg de formulemassa. Die wordt bepaald door de som van de gemiddelde massa’s van de ionen die we uit die formule-eenheid nemen. De berekening van de formulemassa verloopt analoog aan die van de molecuulmassa. We maken geen onderscheid tussen de massa van een ion en een atoom. Het verschil tussen beide is namelijk maar een aantal elektronen meer of minder, en elektronen hebben een verwaarloosbare massa.
VOORBEELD FORMULE-EENHEID NATRIUMSULFAAT (Na2SO4)
m(Na2SO4) = (2 · 23,0 u) + (1 · 32,1 u) + (4 · 16,0 u) = 142,1 u
Uitgedrukt in kg is dat:
©VANIN

m = 142,1 u · 1,66 · 10−27 kg u = 2,36 · 10-25 kg massagetal (A) = som van het aantal protonen en neutronen gemiddelde relatieve atoommassa (<Ar>) = gewogen gemiddelde van de atoommassa's van de voorkomende isotopen molecuulmassa = som van de atoommassa's van de samenstellende atomen formulemassa = som van de massa's van de ionen in de formule-eenheid
Afb. 54 Zwavelzuur
Afb. 55 Salpeterzuur
Afb. 56 Natriumsulfaat
AAN DE SLAG
Noteer de correcte naam van de verbindingen en bereken hun molecuul- of formulemassa.
a CaSO4
b NaNO3
c MgF2
d Fe2O3
e Ag2S
Twee van de ternaire zuren die je in thema 01 leerde kennen, hebben een massa van ongeveer 98 u. Over welke zuren gaat het?
Bereken de molecuul- of formulemassa van de moleculen. Noteer de waarden op 1 decimaal nauwkeurig.
a O2
b S8
c H2
d MgO
e SiCl4
f H2SO4
g Al(IO3)3
Bereken de molecuul- of formulemassa van de onderstaande chemische stoffen. Noteer de waarden op 1 decimaal nauwkeurig.
a CaCO3
b SiI4
c Be(OH)2
d Al2(HPO4)3 ` Meer oefenen? Ga naar .
HOOFDSTUK 2
De mol en het getal van Avogadro
De massa van een molecule of formule-eenheid is onmeetbaar klein. Er moet dus worden overgegaan naar een veelvoud moleculen of formule-eenheden, zodat we de massa wel kunnen afmeten met dagdagelijkse meetapparatuur. Geen enkel meetinstrument is immers in staat om, met zo’n precisie, zo’n kleine massa te meten. We moeten op een of andere manier naar de eenheid gram kunnen overstappen.
LEERDOELEN
L uitleggen met voorbeelden wat een mol materie is met behulp van de constante van Avogadro
L op basis van een gegeven formule, uit een gegeven massa de stofhoeveelheid in mol berekenen en omgekeerd
L het verband tussen stofhoeveelheid en molaire massa toepassen
1 De mol als eenheid en de molaire massa
In vakgebieden worden veel verzamelnamen gebruikt om een hoeveelheid deeltjes te omschrijven.
Voorwerp Verzamelnaam Aantal deeltjes





een paar schoenen 2 schoenen
een dozijn eieren 12 eieren een bak bier 24 flesjes bier
een riem papier 500 vellen papier
in de chemie: 1 mol keukenzout
6,02 · 1023 moleculen keukenzout
Mol komt van het Latijnse woord moles, dat ‘stapel’ of ‘hoop’ betekent.
De mol is de hoeveelheid materie die evenveel deeltjes bevat (atomen, moleculen …) als er atomen zijn in 12 gram van het 12C-isotoop. Talloze experimenten tonen aan dat 1 mol = 6,02 · 1023 deeltjes. Dat aantal is beter gekend als het getal van Avogadro (NA), vernoemd naar de Italiaanse fysicus Amadeo Avogadro.
Welke soort materie je ook wilt afmeten, het gaat telkens over hetzelfde aantal deeltjes. Het aantal mol slaat dus op het aantal deeltjes van een stof. Dat kunnen erg zware atomen zijn (zoals uranium) maar ook erg lichte atomen (zoals waterstof). We gebruiken het symbool ‘n’ om het aantal mol (de stofhoeveelheid) aan te duiden, maar de getalwaarde van de constante van Avogadro heeft nog een groter voordeel. Dat wordt zo dadelijk duidelijk.
Een hoeveelheid van een stof kunnen we dus op meerdere manieren omschrijven:
—via de massa van die stof (m), uitgedrukt in gram (g)
—via het aantal deeltjes van die stof (N), uitgedrukt in het aantal moleculen, atomen, formule-eenheden …
—via het aantal mol van die stof (n), uitgedrukt in mol
Let op: De hoeveelheid mol gaat over een gigantisch groot aantal deeltjes!
Zoals je weet, maken 6 nullen een miljoen, 1 000 miljoen is een miljard. Verder is 1 000 miljard een biljoen, 1 000 biljoen is een biljard en 1 000 biljard is een triljoen. 1 000 triljoen is dan weer een triljard.
We komen dus aan 602 triljard deeltjes in 1 mol: 602 000 000 000 000 000 000 000 deeltjes!
WEETJE

106 = 1 000 000
109 = 1 000 000 000
1012 = 1 000 000 000 000
1015 = 1 000 000 000 000 000
©VANIN
1018 = 1 000 000 000 000 000 000
1021 = 1 000 000 000 000 000 000 000
Als je 1 mol papier, hoe dun de vellen ook zijn, opeenstapelt, kun je 80 keer de afstand tussen de aarde en de maan (384 400 km) overbruggen, heen én terug.


Als je 1 mol donuts verdeelt over het aardoppervlak, wordt de aarde bedekt met een mantel donuts van 8 km hoog.
Als je 1 mol basketballen bezit, kun je er een nieuwe planeet mee vormen, even groot als de aarde.
Nu we weten hoeveel deeltjes een mol omvat, kunnen we steeds de omzettingen tussen het aantal mol (n) en het aantal deeltjes (N) makkelijk maken door gebruik te maken van de formule:
aantal deeltjes = aantal mol · aantal deeltjes mol
N = n NA
Let wel goed op dat het aantal deeltjes en de stofhoeveelheid in mol over hetzelfde gaat!
VOORBEELDVRAAGSTUK
Hoeveel atomen zuurstof zitten er in 3,00 mol CO2 ?
Gegeven: n(CO2) = 3,00 mol
Gevraagd: N(O)
Oplossing:
Uit de stofhoeveelheid CO2 die gegeven is in mol, berekenen we het aantal deeltjes (moleculen) CO2
N(CO2) = n · NA = 3,00 mol . 6,02 · 1023 moleculen mol = 1,81 · 1024 moleculen CO2
Maar elke molecule CO2 bevat 2 atomen zuurstof. Het aantal atomen zuurstof in 3 mol CO2 of in 1,81 · 1024 moleculen CO2 is dus gelijk aan 1,81 · 1024 · 2 = 3,62 · 1024. Er zitten dus 3,62 · 1024 atomen zuurstof in 3 mol CO2
TIP
Vergelijk met een zak kersensnoepjes: Je kunt enerzijds het aantal snoepjes berekenen, maar er kan ook gevraagd worden naar het aantal kersen, dan moet je de hoeveelheid snoepjes nog met 2 vermenigvuldigen.

Bij berekeningen ronden we tussenresultaten niet af: we rekenen steeds verder met de exacte uitkomst van een vorige bewerking. Zorg er wel voor dat je uiteindelijke resultaat de juiste hoeveelheid beduidende cijfers heeft!
De getalwaarde 6,02 · 1023 , of 1 mol, is zeer precies berekend:
de massa van 1 12 van het 12C-atoom = 1 unit
©VANIN
12
de massa van 1 12C-atoom= 12 unit
de massa van 1 mol 12C-atomen= 6,02 · 1023 · 12 unit
1 unit = 1,66 · 10−27 kg
de massa van 1 mol 12C-atomen 6,02 · 1023 · 12 · 1,66 · 10−27 kg u = 12 · 10-3 kg = 12 g
Afb. 57 Koolstofdioxide
Op het eerste gezicht is het een ingewikkelde berekening om te komen tot een zeer bruikbare conclusie: De massa van 1 mol deeltjes is gelijk aan de getalwaarde van de massa van een atoom, molecule of formule-eenheid, met de eenheid gram in plaats van unit.
De massa van 1 mol deeltjes noemen we in het kort ook wel de molaire massa (M).
VOORBEELD MOLECUULMASSA OMZETTEN IN MOLMASSA
1 molecule fosforzuur (H3PO4) heeft een massa van 98,0 unit
⇩· NA
1 mol fosforzuur heeft een massa van 98,0 g
Stofhoeveelheid n
1 mol Zn
1 mol Fe
1 mol CuSO4
1 mol MgCl2
©VANIN
Massa m
65,4 g
55,8 g
159,6 g = m(Cu) + m(S) + m(O)
= 63,6 g + 32,1 g + 4 · 16,0 g
95,3 g = m(Mg) + m(Cl)
= 24,3 g + 2 · 35,5 g
De molaire massa: —De grootheid krijgt het symbool M. —De eenheid voor de molaire massa is g mol —De numerieke waarde van de molaire massa van een atoom is steeds dezelfde als die van de atoommassa, maar de eenheid unit kan gewoon vervangen worden door g mol .
WEETJE
Je vraagt je misschien af hoe Avogadro aan dat getal 6,02 · 1023 is gekomen. Is hij beginnen te tellen? Nee, Avogadro kwam tot die waarde door de dichtheid van een stof, de relatieve atoommassa van de bindende elementen en de grootte van de eenheidscel in het ionrooster te vergelijken. Met de huidige nauwkeurigste meetapparatuur kan het getal van Avogadro nu al tot 8 cijfers na de komma bepaald worden: de meest nauwkeurig gemeten waarde is 6,02214179 · 1023.











Afb. 58 Ionrooster



Je kunt het vergelijken met de schatting van het aantal toeschouwers op een plein waar een evenement plaatsvindt. Als je weet hoe groot het plein is en hoe dicht de toeschouwers bij elkaar staan, kun je bij benadering bepalen hoeveel volk er aanwezig is. Gelukkig zijn atomen in een kristal ordelijker gerangschikt dan toeschouwers op een plein en kunnen wetenschappers daarom precieze berekeningen uitvoeren. Naargelang de bron (de politie of de organisator) lopen de schattingen over het aantal toeschouwers soms ver uiteen. Het aantal atomen per mol is echter altijd NA!

Afb. 59 Toeschouwers op een festival
2
Omrekeningen gram / mol / aantal deeltjes
Als we dezelfde methode gebruiken als bij de berekening van de massa (in unit) van 1 molecule of formule-eenheid, kunnen we ook de molaire massa van stoffen berekenen door de som te nemen van de molaire massa’s van de opbouwende atomen in een molecule. Bij ionverbindingen wordt met 1 mol van de stof 1 mol formule-eenheden bedoeld, want die stoffen vormen geen aparte moleculen. De werkwijze om te komen tot de molaire massa M van een formule-eenheid is identiek. We berekenen de molaire massa M opnieuw door de som te nemen van de molaire massa’s van de opbouwende ionen in een formule-eenheid.
VOORBEELDVRAAGSTUK
1 Wat is de molaire massa van 1,0 mol chloorgas (Cl2)?
Gegeven: n(Cl2) = 1,0 mol
Gevraagd: M(Cl2)
Oplossing:
1 mol Cl2-moleculen bevat 2 mol Cl-atomen.
M(Cl2) = 2 · 35,5 g mol = 71,0 g mol
2 Wat is de molaire massa van 1,0 mol calciumchloride (CaCl2)?
Gegeven: n(CaCl2) = 1,0 mol
Gevraagd: M(CaCl2)
Oplossing:
1 mol formule-eenheden CaCl2 bestaat uit 1 mol Ca2+-ionen en 2 mol Cl--ionen. Herinner je je dat de massa van elektronen verwaarloosbaar is? De massa van ionen en atomen kunnen we dus aan elkaar gelijkstellen.
M(CaCl2) = 1 · 40,1 g mol M(Ca) + 2 · 35,5 g mol M(Cl) = 111,1 g mol
Er wordt niet altijd naar de molaire massa gevraagd. Soms gaat het over een grotere stofhoeveelheid dan 1 mol. Het volstaat dan natuurlijk om het aantal mol (n) te vermenigvuldigen met de molaire massa (M)
VOORBEELDVRAAGSTUK
1 Wat is de massa van 3,00 mol zwavelzuur (H2SO4)?
Gegeven: n(H2SO4) = 3,00 mol
Gevraagd: m(H2SO4)
Oplossing:
1 mol H2SO4 bevat:
Molaire massa symbool: M eenheid: g mol
©VANIN
—2 mol H-atomen
—1 mol S-atomen
—4 mol O-atomen

Afb. 60 Chloorgas
Afb. 61 Calciumchloride
Afb. 62 Zwavelzuur
VOORBEELDVRAAGSTUK (VERVOLG)
a We berekenen de molaire massa van H2SO4:
M(H2SO4) = 2 · M(H) g mol + 1 · M(S) g mol + 4 · M(O) g mol = 2 · 1,0 g mol + 1 · 32,1 g mol + 4 · 16,0 g mol = 98,1 g mol
b Nu we de molaire massa (M) van H2SO4 berekend hebben, kunnen we ook de massa (m) van 3,0 mol berekenen door gebruik te maken van de formule m = n · M:
m(H2SO4) = 3,00 mol · 98,1 g mol = 294 g
©VANIN
2 Wat is de massa van 2,5 mol magnesiumsulfaat (MgSO4)?
Gegeven: n(MgSO4) = 2,5 mol
Gevraagd: m(MgSO4)
Oplossing:
1 mol magnesiumsulfaat bestaat uit 1 mol Mg2+-ionen en 1 mol sulfaationen SO421 mol SO42--ionen bestaat op zijn beurt uit 1 mol zwavelatomen (S) en 4 mol zuurstofatomen (O).
M(MgSO4) = 1 · M(Mg) + 1 · M(S) + 4 · M(O) = 1 · 24,3 g mol + 1 · 32,1 g mol + 4 · 16,0 g mol = 120,4 g mol
De massa van 2,5 mol MgSO4 berekenen we opnieuw met de formule m = n · M:
m(MgSO4) = 2,5 mol · 120,4 g mol = 3,0 · 10² g
We kunnen nu dus een gegeven stofhoeveelheid in mol omzetten naar zowel een aantal deeltjes van die stof, als naar de massa in gram van die stof. Als we echter een aantal deeltjes van een stof willen omzetten naar een aantal gram, dan zullen we altijd eerst de eenheid mol moeten omrekenen!
Aantal deeltjes (N) → stofhoeveelheid (n) → massa (m) of massa (m) → stofhoeveelheid (n) → aantal deeltjes (N)
VOORBEELDVRAAGSTUK
Hoeveel atomen zuurstof zitten er in 426,0 gram difosforpentaoxide (P2O5)?
Gegeven: m(P2O5) = 426,0 g
Gevraagd: N(O)
Oplossing:
a We berekenen de molaire massa van P2O5:
M(P2O5) = 2 · M(P) g mol + 5 · M(O) g mol
= 2 · 31,0 g mol + 5 · 16,0 g mol = 142,0 g mol










b We zetten de gegeven stofhoeveelheid (massa m, in gram) nu om naar het aantal mol door het te delen door de molaire massa van P2O5:
n = m M
n(P2O5) = 426,0 g 142,0 g mol = 3,000 mol
c Die molhoeveelheid (n) zetten we vervolgens om naar het aantal moleculen P2O5 door het te vermenigvuldigen met NA:
N = n · NA
N(P2O5) = 3,000 mol P2O5 · 6,02 · 1023 moleculen mol = 1,806 · 1024 moleculen
Er zitten 1,806 · 1024 moleculen P2O5 in 426,0 g P2O5. Er zitten 5 atomen zuurstof in 1 molecule P2O5. Het aantal atomen zuurstof zal dus 5 keer zo groot zijn:
N(O) = 1,806 · 1024 moleculen P2O5 · 5 atomen O molecule = 9,030 · 1024 atomen O
©VANIN
Afb. 63 Difosforpentaoxide
fosfor P zuurstof O
Als we het getal samen met zijn eenheid beschouwen, spreken we over de constante van Avogadro: 6,02 · 1023 deeltjes mol .
De mol is een eenheid, een verzameling van NA of 6,02 · 1023 deeltjes.
Stofhoeveelheid Symbool Eenheid deeltjesaantal N deeltjes massa m g
molhoeveelheid of stofhoeveelheid n mol constante van Avogadro NA deeltjes mol
m = n · M
m = massa (g)
n = stofhoeveelheid (mol)
M = molaire massa ( g mol )
Door vermenigvuldiging van de molaire massa (M, in g mol) met de stofhoeveelheid (n, in mol) krijgen we de totale massa (m, in gram).
Door de totale massa te delen door de molaire massa, krijgen we de stofhoeveelheid.
Als we van mol naar het aantal deeltjes willen overschakelen, vermenigvuldigen we de stofhoeveelheid met NA. Als we het aantal deeltjes willen omzetten in mol, delen we door NA.
n = m M
delen door molaire massa (g/mol)
vermenigvuldigen met molaire massa (g/mol) m = n · M
N = n · NA
vermenigvuldigen met het getal van Avogadro (deeltjes/mol)
aantal mol n
delen door het getal van Avogadro (deeltjes/mol) aantal deeltjes N aantal gram m n = N NA
©VANIN
AAN DE SLAG
Wat bevat het grootste aantal moleculen: 1 mol stikstofgas of 1 mol zuurstofgas?
Bevat een mol stikstofgas evenveel atomen als moleculen?
Hoeveel mol vertegenwoordigt 6,00 g zuurstofgas?
Wat is de massa van 0,1 mol waterstofgas?
Hoeveel moleculen bevat 3,55 g chloorgas?
Hoeveel mol vertegenwoordigt 3,4 g ammoniak (NH3)?
Wat is de massa van 2,8 mol ammoniumfosfaat (NH4)3PO4?
Van de volgende stoffen is telkens 1 gegeven bekend:
a HNO3: N = 2,41 · 1024 moleculen
b K2SO3: n = 1,5 mol
c NaCl: n = 3,2 mol
d H2O: m = 1 000,0 g
e C3H8: m = 176,0 g
Bereken van elke stof de ontbrekende grootheden: molaire massa (M), stofhoeveelheid (n), aantal deeltjes (N), massa (m)
Bereken de massa van 0,200 mol stikstofgas.
Bereken de massa van 5,00 mol calciumsulfaat.
Hoeveel ionen zijn aanwezig in 28,6 g magnesiumchloride?
Hoeveel kaliumionen zijn aanwezig in 19,55 g kaliummetaal?
Hoeveel zuurstofatomen zijn aanwezig in 50,0 g natriumsulfiet Na2SO3?
Hoeveel mol vertegenwoordigen 3,01 · 1024 elektronen?
Goud is een gegeerd edelmetaal maar is op zich een te zacht edelmetaal om er sieraden mee te maken. Daarom gebruikt men een legering van goud met andere metalen. Het gehalte goud dat de legering dan bevat drukt een juwelier uit in ‘karaat’, oftewel 1 24 ste massadeel goud. 24 karaat is dus zuiver goud, maar voor sieraden wordt meestal 18-karaats goud gebruikt. Anke draagt een oorringetje van 18-karaats goud. Naast goud bevat het oorringetje enkel nog koper. Anke zegt dat het oorringetje meer goudatomen dan koperatomen bevat. Heeft ze gelijk? Bewijs met een berekening.
Vul de tabel aan met behulp van het PSE. In de eerste rij vind je alvast een voorbeeld.
Atomen/ moleculen
Aantal deeltjesAf te wegen
Vul de tabel aan met behulp van het PSE. In de eerste rij vind je alvast een voorbeeld.
Atomen/ moleculen Stofhoeveelheid (in mol) Af te wegen massa (in g)
b CuSO4 0,50 c MgCl2 2,0
De productie van methaangas (CH4) door koeien wordt door wetenschappers beschouwd als een van de oorzaken van globale opwarming, omdat het gas het broeikaseffect versterkt. Gemiddeld produceert een koe 400 g methaangas per dag. Hoeveel moleculen CH4 komen zo vrij in de lucht?
HOOFDSTUK 3
Concentratie van een oplossing
Alcoholgel wordt veel gebruikt voor het ontsmetten van de handen. Om voldoende werkzaam te zijn, moet de hoeveelheid alcohol die wordt opgelost in de gel, een hoge concentratie hebben.
In een labo gaan we vaak stoffen oplossen in een oplosmiddel (meestal water), omdat ze dan beter reageren. Maar het aantal gram van de oplossing geeft niet de nodige informatie over de stofhoeveelheid van het opgeloste reagens. We moeten weten hoeveel mol of gram van de opgeloste stof er in de oplossing zit. In ons voorbeeld van de alcoholgel is de hoeveelheid alcohol (opgeloste stof) belangrijk, niet zozeer de hoeveelheid alcoholgel (oplossing). We willen weten hoeveel alcohol er in de alcoholgel zit, dus wat de concentratie aan alcohol is.
LEERDOELEN
L de verhoudingen en evenredigheden tussen massa’s, volumes en stofhoeveelheden gebruiken en molaire grootheden en concentraties beschrijven
L het verband tussen stofhoeveelheid en massaconcentratie toepassen
L het verband tussen stofhoeveelheid en molaire concentratie toepassen
©VANIN
1 Wat is een concentratie van een oplossing?
Een oplossing is een hoeveelheid opgeloste stof in een hoeveelheid oplosmiddel Neem het voorbeeld van een kopje koffie waarin een klontje suiker wordt gedaan:
—Het oplosmiddel is hier de koffie.
—De opgeloste stof is de suiker.
—De oplossing bestaat uit gesuikerde koffie.
Je weet natuurlijk al dat de koffie zoeter zal smaken naargelang je er 1, 2 of 3 klontjes suiker in oplost. Het is dus belangrijk om de concentratie van de oplossing goed te kennen. Als we de concentratie van de opgeloste stof willen kennen, dan moeten we de hoeveelheid van de opgeloste stof en de hoeveelheid oplossing kennen. Suiker, net als vele andere stoffen, kan in verschillende hoeveelheden opgelost worden in water. Niet alle stoffen zijn trouwens even goed oplosbaar in water. Daar komen we later op terug.

De maximale oplosbaarheid kan sterk verschillen van stof tot stof. Ook voor stoffen die wel oplossen in water is de hoeveelheid stof die kan opgelost worden, niet onbeperkt. Vanaf een bepaalde concentratie treedt verzadiging op: extra toegevoegd zout zal dan niet meer oplossen maar bezinken in de oplossing.
Afb. 64 Gesuikerde koffie is een oplossing.
Concentratie van oplossingen
Werkwijze
Je leerkracht maakt 4 oplossingen van koper(II)sulfaat. Die oplossingen herkennen we aan de blauwe kleur.
1 gram CuSO4 wordt opgelost tot een volume van 0,05 L oplossing
1 gram CuSO4 wordt opgelost tot een volume van 0,1 L oplossing
2 gram CuSO4 wordt opgelost tot een volume van 0,05 L oplossing
2 gram CuSO4 wordt opgelost tot een volume van 0,1 L oplossing
—bekerglas 1: 1 gram CuSO4 wordt opgelost tot een volume van 0,05 L oplossing
—bekerglas 2: 1 gram CuSO4 wordt opgelost tot een volume van 0,1 L oplossing
—bekerglas 3: 2 gram CuSO4 wordt opgelost tot een volume van 0,05 L oplossing
—bekerglas 4: 2 gram CuSO4 wordt opgelost tot een volume van 0,1 L oplossing
Waarnemingen
Je merkt aan de helderblauwe kleur van de oplossing hoe geconcentreerd de oplossing is (hoe donkerder blauw, hoe hoger de concentratie CuSO4). Merk op dat de inhoud van bekerglas 1 en 4 dezelfde kleur hebben. Dat komt doordat voor die bekers de verhouding van de hoeveelheid opgeloste stof tot de hoeveelheid oplossing, de concentratie dus, gelijk is:
1 g CuSO4
0,5 L = 2 g CuSO4 1 L
Er zijn verschillende manieren om de concentratie van een oplossing uit te drukken, afhankelijk van in welke eenheid de hoeveelheid opgeloste stof wordt uitgedrukt. Zo kunnen we onze hoeveelheid CuSO4 uit het voorbeeld uitdrukken in gram of in mol. We spreken dan respectievelijk over de massaconcentratie (γ) en de molaire concentratie of stofhoeveelheidsconcentratie (c).
De verhouding tussen de hoeveelheid opgeloste stof (stofhoeveelheid n of massa m) en de hoeveelheid oplossing (V) noemen we de concentratie van de oplossing γ = m V met eenheid g L of c = n V met eenheid mol L
2 Massaconcentratie
©VANIN
Het begrip mol is natuurlijk niet bij iedereen bekend. Daarom staat voornamelijk op voedingswaren de hoeveelheid opgeloste stof vaak aangeduid in aantal gram. Als we de hoeveelheid opgeloste stof in gram uitdrukken en de hoeveelheid oplossing in liter, dan bekomen we voor de concentratie een eenheid van g L , we spreken dan over de massaconcentratie. Zo zit in 1 glas cola van 250 mL maar liefst 27 gram suiker. De concentratie suiker is dus 27 g 250 mL of 108 g L .

De SI-eenheid voor massaconcentratie is kg m3 , maar doorgaans wordt er in het labo gebruiktgemaakt van de eenheid g L
Afb. 65 Een glas cola bevat veel suiker.
VOORBEELDVRAAGSTUK
Bereken hoeveel kaliumchloride (KCl) je moet afwegen als je 3,5 L oplossing wilt maken met een concentratie van 60 g L .
Gegeven: V(oplossing) = 3,5L
γ(KCl) = 60 g L
Gevraagd: m(KCl)
Oplossing:
©VANIN
Let op dat je bij vloeistoffen de dichtheid niet verwart met de massaconcentratie. Dichtheid heeft niets te maken met de concentratie van de opgeloste stof.
DICHTHEID
MASSACONCENTRATIE
ρ = massa oplossing volume oplossing γ = massa opgeloste stof volume oplossing
De verwarring tussen beide gebeurt omdat beide grootheden dezelfde eenheid kunnen hebben.
Bij voedingswaren wordt de hoeveelheid oplossing vaak herleid naar 100 mL, waardoor de eenheid g/100 mL wordt. Het etiket vermeldt dan de concentratie in % (per 100 mL dus). Voor de suikerconcentratie in het voorbeeld van het glas cola wordt dat dan 108 g L = 10,8 g 100 mL of 10,8 %.
Op het etiket van een blikje Ice Tea lezen we bijvoorbeeld hoeveel gram er van verschillende stoffen zijn opgelost in 100 ml van de drank (oplossing). Zo zit er per 100 mL Ice Tea 4,5 g suiker opgelost. In de tweede kolom staat dan hoeveel suiker er in het totale flesje van 33 cl zit. De massaconcentratie is altijd 4,5 g 100 mL = 4,5 %
TIP
Afb. 66 Voedingswaarden frisdrank
WEETJE
Chemici zullen de stofhoeveelheid altijd aanduiden met de eenheid mol. We zullen in het labo de concentratie van de oplossing daarom ook uitdrukken in het aantal mol opgeloste stof per liter oplossing: de molaire concentratie, stofhoeveelheidsconcentratie of molariteit van de oplossing
molaire concentratie = aantal mol opgeloste stof aantal liter oplossing
formule: c = n V
eenheid molaire concentratie: mol L of M
Let op:
M is het symbool voor de eenheid van molaire concentratie. M is het symbool voor de grootheid molaire massa.
VOORBEELDVRAAGSTUK
We berekenen de molaire concentratie van suiker in cola. Uit het vorige voorbeeld weet je al dat een glas van 250 mL 27 gram suiker bevat.
Gegeven: V(oplossing) = 250 mL = 0,250 L m(suiker) = 27 g
Gevraagd: c
Oplossing:
c = n(suiker) V(oplossing) en n (suiker) = m(suiker) M(suiker)
→ c = m(suiker) M(suiker) · V(oplossing) met M(suiker) = M(C12H22O11)
= 12 · 12,0 g mol + 22 · 1,0 g mol + 11 · 16,0 g mol
= 342,0 g mol = 27 g
342,0 g mol · 0,250 L
= 0,32 mol L
De SI-eenheid voor molaire concentratie is mol m3 , maar doorgaans wordt er in het labo gebruiktgemaakt van de eenheid mol L .
©VANIN
De molaire concentratie of stofhoeveelheidsconcentratie c wordt berekend door de stofhoeveelheid uitgedrukt in mol (n) te delen door het volume oplosmiddel, uitgedrukt in L.
Formule: c = n V
Om massaconcentratie om te zetten in molaire concentratie, moet de massa omgerekend worden naar aantal mol.
Formule: m M = n
oplossingen (c, V)
©VANIN
delen door molaire massa (g/mol) N = n · NA
vermenigvuldigen met het getal van Avogadro (deeltjes/mol)
vermenigvuldigen met molaire massa (g/mol) m = n · M
4 Oplossingen verdunnen en indampen
delen door het getal van Avogadro (deeltjes/mol) aantal
N NA
In een labo worden veel zoutoplossingen gebruikt. Maar voor verschillende proeven zijn vaak ook verschillende concentraties van de oplossing vereist. Je leerkracht zal vast en zeker wel ergens een oplossing op voorraad houden, maar de concentratie is niet altijd diegene die nodig is in een volgend experiment. Gelukkig kunnen we de concentratie van een oplossing aanpassen door:
a Een extra hoeveelheid opgeloste stof toe te voegen: de concentratie zal nu stijgen.
b Een extra hoeveelheid oplosmiddel toe te voegen: de concentratie zal nu dalen. Dat noemen we het verdunnen van de oplossing.
c Een hoeveelheid oplosmiddel laten verdampen: de concentratie zal nu stijgen. Dat noemen we het indampen van de oplossing.
In een keuken proeft de kok heel vaak van de gerechten. Is de soep niet zout genoeg of net te zout? In het eerste geval zal de kok een snuifje zout toevoegen, in het tweede geval kan die de soep aanlengen met water. Indampen zou wat meer tijd in beslag nemen bij het op smaak brengen van soep, maar dat komt wel van pas bij de bereiding van sauzen.
Merk op dat zowel bij het verdunnen van een oplossing door toevoeging van extra oplosmiddel, als bij het indampen van een oplossing, de hoeveelheid opgeloste stof ongewijzigd blijft. Samen met de eerder geziene formule voor molaire concentratie (c = n V) kunnen we zo de verdunningsformule afleiden:
n1 = n2
c1 · V1 = c2 · V2
VOORBEELDVRAAGSTUK
Hoeveel mL water moet je toevoegen aan 150 mL waterstofchlorideoplossing (HCl) van 0,250 mol L om een oplossing van 0,200 mol L te bekomen?
Gegeven: de beginconcentratie c1 = 0,250 mol L het beginvolume V1 = 0,150 L de gewenste eindconcentratie c2 = 0,200 mol L
Gevraagd: Welk volume oplosmiddel moet je toevoegen (V2 - V1) ?
Oplossing: c1 · V1 = c2 · V2 toepassen: 0,250 mol L · 0,150 L = 0,200 mol L · V2
Hieruit berekenen we V2 = 0,188 L of 188 mL: V2 - V1 = 188 mL - 150 mL = 38 mL
Antwoord: Er moet 38 mL water worden toegevoegd om de concentratie te verminderen naar 0,200 mol L
©VANIN
Bij het indampen van een oplossing geldt dus precies dezelfde formule c1 · V1 = c2 · V2, maar omdat het volume van de oplossing na het indampen (V2) nu kleiner is dan het oorspronkelijk volume V1, zal de concentratie c2 groter worden dan de concentratie voor het indampen (c1)
Indampen is het laten verdampen van een hoeveelheid oplosmiddel zodat de concentratie van de opgeloste stof stijgt.
Opgelet: het gaat hier dus telkens over de molaire concentratie (en niet de massaconcentratie).
03 LABO
Het aantal mol opgeloste stof ...
Voor verdunning
Na verdunning
n1 = n2
c1 · V1 = c2 · V2
c1 · V1 = c2 · V2
In die formule is:
c1 = beginconcentratie van de oplossing
V1 = beginvolume van de oplossing
c2 = concentratie van de oplossing na verdunning
V2 = Volume van de oplossing na verdunning
Let op: V2 is het eindvolume na verdunning. Vaak wordt het toe te voegen volume water gevraagd. We trekken het beginvolume er dan dus weer af (V2 - V1)!
©VANIN
Als je een oplossing blijft indampen tot de maximale oplosbaarheid is bereikt, dan zal de opgeloste stof opnieuw kristalliseren. Op die techniek berust bijvoorbeeld de winning van zout uit zeewater.

Afb. 67 Zoutproductie
AAN DE SLAG
Welke oplossing heeft de hoogste concentratie: een keukenzoutoplossing met massaconcentratie van 60 g L of een keukenzoutoplossing met molaire concentratie van c = 1 mol L ?
Hoeveel gram natriumchloride moet je oplossen in water om 3,00 L van een oplossing van 2,00 mol L te bereiden?
200 mL van een natriumhydroxideoplossing bevat 2,00 g natriumhydroxide. Wat is de molaire concentratie (of stofhoeveelheidsconcentratie) van die oplossing?
Bereken de hoeveelheid water die je aan 1,5 L van een calciumhydroxideoplossing van 0,80 mol L moet toevoegen om een oplossing van 0,70 mol L te bekomen.
Je lost 49,0 g fosforzuur op in water en vormt een halve liter oplossing. Hoeveel water moet je toevoegen om een concentratie van 0,0100 mol L te bekomen?
Een student moet 500 mL keukenzoutoplossing bereiden met een concentratie van 0,90 mol L
Die beschikt over 800 mL zoutoplossing met een concentratie van 1,00 mol L en voldoende demi-water. Geef een te volgen werkwijze om de gevraagde oplossing te maken.
Meer oefenen? Ga naar .
HOOFDSTUK 4
Chemisch rekenen met gassen
Bij sommige reacties reageren of ontstaan gassen. De massa van een gas is moeilijk te bepalen. We kunnen wel het volume van een gas meten, maar dat gasvolume is dan weer afhankelijk van de heersende temperatuur en druk. Hier zullen we rekening mee moeten houden bij de omzetting van de stofhoeveelheid naar de eenheid mol.
Uit het deeltjesmodel weet je al dat gassen bij een bepaalde druk en temperatuur een groter volume innemen per stofhoeveelheid dan vloeistoffen of vaste stoffen.
LEERDOELEN
L het verband toepassen tussen stofhoeveelheid en molair volume
©VANIN
Normomstandigheden duiden we aan als n.o.
1 Het molaire gasvolume onder normomstandigheden
Ook het volume gas zullen we moeten omzetten naar een stofhoeveelheid, uitgedrukt in mol. Een gelijke molhoeveelheid van verschillende gassen neemt bij een gelijke druk en temperatuur hetzelfde volume in. Als we het volume van 1 mol gas kennen, het molaire gasvolume V m (eenheid L mol), dan kunnen we het aantal mol gas berekenen door het volume gas te delen door het molaire gasvolume:
Als we de stofhoeveelheid (n) van een gas kennen, dan kunnen we door het omvormen van de formule ook het volume berekenen dat dat gas inneemt:
V = n · V m
Afb. 68 Molair gasvolume
We beschouwen een gas onder normomstandigheden. We spreken over normomstandigheden als de temperatuur i = 0 °C en de druk p = 1 013 hPa. Het molaire gasvolume is dan steeds 22,4 L mol Als we dat getal onthouden, is het eenvoudig om vraagstukken op te lossen waarbij de reactie onder normomstandigheden plaatsvindt. We kunnen dan schakelen tussen het volume van het gas en het aantal mol door gebruik te maken van het molaire gasvolume:
V m = 22,4 L mol waarbij n = V V m = V 22,4 L mol
VOORBEELDVRAAGSTUKKEN
1 Bereken het volume van 15,0 g waterstofgas onder normomstandigheden.
Gegeven: m(H2) = 15,0 g n.o.
Gevraagd: V(H2)
Oplossing:
n(H2) = m(H2) M(H2) = 15,0 g 2,0 g mol = 7,5 mol
n.o. : V m = 22,4 L mol
V = n · V m
V(H2) = 7,5 mol · 22,4 L mol = 1,7 · 102 L
2 Bereken het volume van 25,0 g koolstofdioxidegas onder normomstandigheden.
Gegeven: m(CO2) = 25,0 g n.o.
Gevraagd: V(CO2)
Oplossing:
n(CO2) = m(CO2) M(CO2) = 25,0 g 44,0 g mol = 0,568 mol
n.o: V m = 22,4 L mol
V(CO2) = n · V m = 0,568 mol · 22,4 L mol = 12,7 L
Gassen met een gelijke molhoeveelheid nemen bij een gelijke druk en temperatuur hetzelfde volume in:
©VANIN
oplossingen (c, V) gassen (V, Vm )
AAN DE SLAG
Bereken het volume van 15,0 g waterstofgas onder normomstandigheden.
Bereken het volume van 25,0 g koolstofdioxidegas onder normomstandigheden.
Welk volume nemen 8,0 · 1026 moleculen stikstofgas in onder normomstandigheden? Wat is de totale massa van die moleculen?
Welk volume nemen 8,0 · 1026 moleculen zuurstofgas in onder normomstandigheden? Wat is de totale massa van die moleculen?
Meer oefenen? Ga naar .
HOOFDSTUK 5 VERDIEPING 2U
Stoichiometrische vraagstukken
Het is belangrijk dat we bij een chemische reactie weten welke hoeveelheid van een bepaalde stof reageert met een hoeveelheid van een andere stof. De berekening van de verhoudingen waarin stoffen reageren noemen we stoichiometrie.
LEERDOELEN
L het verband leggen tussen mol, molaire massa en molaire concentratie aan de hand van eenvoudige stoichiometrische berekeningen
L stoichiometrische vraagstukken oplossen
1 De molverhouding
VOORBEELD VERBRANDINGSREACTIE VAN MAGNESIUM
Wanneer we magnesium (Mg) verbranden, vormt er zich een fel wit licht en ontstaat een wit poeder: magnesiumoxide (MgO).
De reactie ziet er als volgt uit:
2 Mg + O2 → 2 MgO
a Wat leren we uit de reactievergelijking?
2 atomen Mg + 1 molecule O2 → 2 formule-eenheden MgO
b Als we alles vermenigvuldigen met bijvoorbeeld een factor 500, dan kunnen we verhoudingsgewijs stellen dat:
2 atomen Mg + 1 molecule O2 → 2 formule-eenheden MgO · 500 · 500 · 500
©VANIN
1 000 atomen Mg + 500 moleculen O2 → 1 000 moleculen Mg
c Als we die redenering doortrekken, kun je ook stellen dat:
2 · 6,02 · 1023 atomen Mg + 6,02 · 1023 moleculen 02 → 2 · 6,02 · 1023 formule-eenheden MgO of nog korter:
2 mol Mg reageert met 1 mol O2 tot 2 mol MgO
Stoichiometrie is afkomstig van de Griekse woorden stoicheion, wat ‘element’ betekent, en metron, wat ‘verhouding’ betekent.

Afb. 69 Bij verbranding van Mg ontstaat een wit poeder.
demovideo: elektrolyse
Merk op dat je, als controle bij je berekeningen, altijd de wet van behoud van massa kunt toepassen: de som van de massa’s van de reagentia = de som van de massa’s van de reactieproducten.
De molverhouding, oftewel de verhouding waarin stoffen met elkaar reageren, wordt gegeven door de voorgetallen uit de reactie. Let op: die voorgetallen geven echter nooit informatie over de stofhoeveelheid die je ter beschikking hebt!
VOORBEELD MAGNESIUMOXIDE
Hoeveel gram magnesium reageert met hoeveel gram zuurstofgas en hoeveel gram magnesiumoxide ontstaat er? Uit het periodiek systeem halen we de volgende info:
M(Mg) = 24,3 g mol M(O2) = 2 · 16,0 g mol = 32,0 g mol M(MgO) = 24,3 g mol + 16,0 g mol = 40,3 g
We berekenen de massa’s door gebruik te maken van de formule m = n
M
= 48,6 g magnesium = 32,0 g zuurstofgas → =
VOORBEELD SYNTHESE VAN WATER
Vorig schooljaar heb je de elektrolyse van water uitgevoerd, waarbij water met behulp van elektriciteit werd gesplitst in zuurstofgas en waterstofgas.
De omgekeerde reactie wordt in brandstofcellen gebruikt bij hybride of elektrische auto’s:
Twee moleculen waterstofgas reageren met 1 molecule zuurstofgas tot 2 moleculen water.
©VANIN
Bij uitbreiding is dat ook zo voor een groot aantal deeltjes: 2 mol waterstofgasmoleculen zullen dus met 1 mol zuurstofgasmoleculen reageren tot 2 mol water.
6 7
Je leerde ook al de molhoeveelheid omzetten in de massahoeveelheid met de formule: m = n · M
En dus 2 · 2,0 g mol = 4 g waterstofgas zal reageren met 1 mol · 32,0 g mol = 32 g zuurstofgas tot
2 mol · 18,0 g mol = 36 g water. O2 + 2 H2 → 2 H2O
VOORBEELDVRAAGSTUK
Gebluste kalk of calciumhydroxide reageert met 4,5 mol salpeterzuur tot calciumnitraat en water. Hoeveel gram gebluste kalk (Ca(OH)2) kan hiermee reageren en hoeveel gram calciumnitraat (Ca(NO3)2) kan er dan ontstaan?
We schrijven de reactie met de correcte formules en voorgetallen, zodat de reactievergelijking klopt.
Gegeven: Ca(OH)2 + 2 HNO3 → Ca(NO3)2 + 2 H2O
Uit de reactievergelijking, en meer bepaald uit de voorgetallen, leid je de molverhouding af: 1 mol calciumhydroxide reageert met 2 mol salpeterzuur. Er wordt dan 1 mol calciumnitraat gevormd en 2 mol water.
Je hebt m(HNO3) = 283,5 g
Gevraagd: m(Ca(OH)2) m(Ca(NO3)2)
Oplossing:
a Schrijf onder de reactievergelijking de molverhouding waarin de stoffen reageren:
Ca(OH)2 + 2 HNO3 → Ca(NO3)2 + 2 H2O
1 mol + 2 mol → 1 mol + 2 mol
b Schrijf de gegeven stofhoeveelheid (in dit geval massa m) onder de betreffende stof :
Ca(OH)2 + 2 HNO3 → Ca(NO3)2 + 2 H2O
1 mol + 2 mol → 1 mol + 2 mol 4,5 mol
c Met de berekende stofhoeveelheid in mol (n) vinden we, door gebruik te maken van de molverhouding, de andere stofhoeveelheden in mol:
Ca(OH)2 + 2 HNO3 → Ca(NO3)2 + 2 H2O 1 mol + 2 mol → 1 mol + 2 mol 2,25 mol 4,5 mol 2,25 mol 4,5 mol
Op vind je meer info over vraagstukken oplossen in het vademecum.
©VANIN
d Zet ten slotte de gevonden stofhoeveelheden om in de gevraagde eenheid gram door opnieuw gebruik te maken van de molaire massa M.
M(Ca(OH)2) = 40,1 g mol + 2 · 16,0 g mol + 2 · 1,0 g mol = 74,1 g mol
m(Ca(OH)2) = n · M = 2,25 mol · 74,1 g mol = 167 g
M(Ca(NO3)2) = 40,1 g mol + 2 · 14,0 g mol + 6 · 16,0 g mol = 164,1 g mol
m(Ca(NO3)2) = n · M = 2,25 mol · 164,1 g mol = 369 g /2 /2 · 1
VOORBEELDVRAAGSTUK (VERVOLG)
We weten dus nu dat er 167 g gebluste kalk of Ca(OH)2 kan reageren met de 4,5 mol salpeterzuur of HNO3 en dat er dan maximaal 369 g calciumnitraat of Ca(NO3)2 kan worden gevormd.
Let op: de berekende hoeveelheid calciumnitraat is inderdaad de maximale hoeveelheid die we zouden kunnen bekomen. In de praktijk zal een reactie nooit een rendement van 100 % hebben. Voorlopig laten we dat buiten beschouwing en berekenen we steeds de maximale hoeveelheden.
TIP
©VANIN
—Als je wilt controleren of je berekeningen juist zijn, dan kun je de wet van behoud van massa toepassen: ∑ massa’s reagentia = ∑ massa’s reactieproducten. In het voorbeeld ontstond ook 4,5 mol water of 81,0 g water. We kijken nu of die vergelijking klopt: 166,7 g + 283,5 g = 369,2 g + 81,0 g? Beide sommen hebben 450,2 g als resultaat!
—De gegeven stofhoeveelheid is niet altijd in gram opgegeven, zo kan er ook een aantal deeltjes zijn opgegeven. Om die dan om te rekenen naar mol, gebruiken we het getal van Avogadro.
Voor het oplossen van vraagstukken met 1 gegeven stofhoeveelheid gebruik je het onderstaande stappenplan:
Stap 1: Lees het vraagstuk
Stap 2: Maak een analyse van gegeven en gevraagd
Stap 3: Schrijf de reactievergelijking
Stap 4: Zet de gegeven stofhoeveelheid om in mol
Stap 5: Pas de molverhouding toe
Stap 6: Zet het resultaat om naar de gevraagde eenheid
Bij het oplossen van vraagstukken zul je ook vaak ‘de regel van drie’ toepassen. Als je weet wat de molverhouding is waarin de stoffen A en B reageren (uit de voorgetallen), dan kun je ook berekenen hoeveel mol van stof B er met 1 mol van stof A reageert. En vervolgens bereken je hoeveel mol B er reageert met de gegeven molhoeveelheid A. Op vind je meer info over de regel van drie.
TIP
AAN DE SLAG
Waterstofchloride reageert met 50,0 g natriumhydroxide. Daarbij ontstaan keukenzout en water. Hoeveel gram zuur heb je nodig en hoeveel gram zout ontstaat er?
reactievergelijking: HCl + NaOH → NaCl + H2O
Bereken hoeveel gram kaliumhydroxide (KOH) kan reageren met 15,75 g salpeterzuur (HNO3).
Bij die reactie ontstaan kaliumnitraat (KNO3) en water. Hoeveel gram zout wordt er maximaal gevormd?
reactievergelijking: KOH + HNO3 → KNO3 + H2O
Hoeveel gram calciumfosfaat (Ca3(PO4)2) ontstaat door de reactie van 2,7 mol calciumhydroxide (Ca(OH)2) met voldoende fosforzuur (H3PO4)?
Bij die reactie ontstaat naast calciumfosfaat ook water.
reactievergelijking: 3 (Ca(OH)2) + 2 H3PO4 → (Ca3(PO4)2) + 6 H2O
Wanneer een metaal en een zuur reageren, ontstaat vaak waterstofgas. Zink reageert bv. met zwavelzuur (H2SO4) tot zinksulfaat (ZnSO4) en waterstofgas (H2).
Hoeveel gram zink moet reageren met een overmaat zwavelzuur om 6,0 g waterstofgas te bekomen?
Koolstofdisulfide (CS2) reageert met dizuurstof (O2) tot zwaveldioxide (SO2) en koolstofdioxide (CO2). Hoeveel gram zuurstofgas moet je hebben om 38,1 g koolstofdisulfide te verbranden?
Butaan wordt verbrand bij gebruik van bijvoorbeeld de gasbarbecue volgens de reactie 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O. Hoeveel gram zuurstofgas heb je nodig om 40,00 gram butaangas te verbranden? Hoeveel gram CO2 wordt daarbij gevormd?
Stel dat je auto op zuiver octaan rijdt en 5 600 gram octaan verbruikt per 100 kilometer. De verbrandingsreactie kan als volgt geschreven worden: 2 C8H18 + 25 O2 → 16 CO2 + 18 H2O
AA < 100 g CO2/km
BB 100 ≤ g CO2/km < 130
CC 130 ≤ g CO2/km < 160
DD 160 ≤ g CO2/km < 190
EE 190 ≤ g CO2/km < 190
FF 220 ≤ g CO2/km < 250
GG ≥ 250 g CO2/km
Op basis van CO2-uitsoot worden auto’s ingedeeld in een categorie A tot G.
a Wat is de CO2-uitstoot van je wagen in g km?
b In welke klasse wordt jouw auto ingedeeld?
Bereken de vraagstukken aan de hand van het stappenplan.
a Schelpen bestaan voor een groot gedeelte uit calciumcarbonaat. Bij 500 °C ontbindt calciumcarbonaat in calciumoxide en koolstofdioxide. Calciumoxide wordt als ongebluste kalk gebruikt in de cementindustrie en in de bouw. Bereken hoeveel ton calciumoxide ontstaat uit de omzetting van 10,0 ton schelpen.
De reactievergelijking is: CaCO3 → CaO + CO2
b Dichloor (Cl2) kan bereid worden door zeezout (NaCl) te laten ontbinden. Daarbij wordt ook natrium (Na) gevormd. Bereken hoeveel kilogram dichloor ontstaat uit 10,0 kg zeezout.
AAN DE SLAG
Vul de zin aan met het juiste antwoord.
a Je wilt 6,0 g zuurstofgas bereiden uit kaliumchloraat (reactievergelijking:
2 KClO3 → 2 KCl + 3 O2). De massa KClO3 die daarvoor nodig is, bedraagt … —precies 6,0 g —meer dan 6,0 g —minder dan 6,0 g.
b Je wilt 34,0 g ammoniakgas bereiden uit de reactie van stikstofgas met waterstofgas (reactievergelijking: N2 + 3 H2 → 2 NH3).
De massa H2 die daarvoor nodig is, bedraagt …
—6,00 g
—28,0 g
—34,0 g
c Je laat 28,0 g koolstofmonoxide verbranden (reactievergelijking: 2 CO + O2 → 2 CO2).
De massa O2 die daarvoor nodig is, bedraagt …
—16,0 g
—32,0 g
—64,0 g
d Je laat 7,00 g etheen met dibroom reageren (reactievergelijking: C2H4 + Br2 → C2H4Br2).
De massa C2H4Br2 die hierbij ontstaat, bedraagt …
—7,00 g
—28,0 g
47,0 g
—188 g
` Meer oefenen? Ga naar .
©VANIN
CHEMISCH REKENEN
KERNBEGRIPPEN
KERNVRAGEN
kennisclip 1u kennisclip 2u
NOTITIES
Hoofdstuk 1: Atoommassa, molecuulmassa, formulemassa
gemiddelde relatieve atoommassa <A r > = het gewogen gemiddelde van alle relatieve atoommassa’s van de voorkomde isotopen
molecuulmassa = de massa van een molecule
de relatieve massa van een molecule = de som van alle relatieve atoommassa's in de molecule
formulemassa = de relatieve massa van een formule-eenheid = de som van alle relatieve atoommassa's van de formule
stofhoeveelheid = uitdrukking voor de hoeveelheid van een stof, dat kan in aantal deeltjes, aantal gram of aantal mol.
A = Z + N
massagetal = aantal protonen + aantal neutronen
GrootheidSymboolEenheid
stofhoeveelheid (aantal deeltjes) N deeltjes
stofhoeveelheid (aantal gram) m g
stofhoeveelheid (aantal mol) n mol
Hoofdstuk 2: De mol en het getal van Avogadro constante van Avogadro = een grootheid
symbool: NA
eenheid: deeltjes mol
molaire massa = molecuulmassa of formulemassa, aangevuld met de eenheid g mol
molverhouding = de verhouding (in mol) waarin de stoffen reageren
©VANIN
NA = de constante van Avogadro = 6,02 · 1023 deeltjes mol
CHEMISCH REKENEN
KERNBEGRIPPEN
KERNVRAGEN
Hoofdstuk 3: Concentratie van een oplossing
een oplossing = een hoeveelheid opgeloste stof in een hoeveelheid oplosmiddel
concentratie = de verhouding opgeloste stof per hoeveelheid oplossing ten opzichte van het totale volume van de oplossing
NOTITIES
—massaconcentratie γ = m V ( g L )
delen door molaire massa (g/mol)
oplossingen (c, V) aantal gram m
vermenigvuldigen met molaire massa (g/mol) m = n · M
verdunningsformule met water c1 · V1 = c2 · V2
Een oplossing kun je verdunnen of indampen
mol n
n = N NA n = m M c = n V n = c · V
N = n · NA
vermenigvuldigen met het getal van Avogadro (deeltjes/mol)
delen door het getal van Avogadro (deeltjes/mol) aantal deeltjes
©VANIN
—molaire concentratie of stofhoeveelheidsconcentratie c = n V (eenheid: mol L )
—Verdunnen met oplosmiddel: aantal mol opgeloste stof verandert niet
n1 = n2 of c1 · V1 = c2 · V2 concentratie daalt c2 < c1
—Indampen: oplosmiddel verdampt, aantal mol opgeloste stof verandert niet
n1 = n2 of c1 · V1 = c2 · V2 concentratie stijgt c2 > c1
CHEMISCH REKENEN
KERNBEGRIPPEN
KERNVRAGEN
Hoofdstuk 4: Chemisch rekenen met gassen
gasvolume onder normomstandigheden
molair gasvolume
NOTITIES
i = 0 °C
p = 1 013 hPa → molair gasvolume = 22,4 L mol
©VANIN
Gassen met een gelijke molhoeveelheid nemen bij een gelijke druk en temperatuur hetzelfde volume in.
V = n · V m
oplossingen (c, V)
delen door molaire massa (g/mol)
vermenigvuldigen met molaire massa (g/mol) m = n · M
N = n · NA
vermenigvuldigen met het getal van Avogadro (deeltjes/mol)
delen door het getal van Avogadro (deeltjes/mol) aantal deeltjes
gram m n = N NA
gassen (V, Vm )
Hoofdstuk 5: Stoichiometrische vraagstukken (verdieping 2u)
vraagstukken met 1 gegeven stofhoeveelheid Volg het stappenplan op p. 108.
©VANIN
POLARITEIT EN OPLOSBAARHEID 04 THEMA
Eenden, pinguïns en heel wat andere vogels vertoeven een groot deel van hun leven op het water. Maar toch worden ze niet nat. Dat kun je mooi zien tijdens een regenbui: de waterdruppels glijden van hen af. Dat verschijnsel komt ook bij planten voor: ’s morgens of na een regenbui zie je overal druppels liggen op de bladeren. Als je de plant aanraakt, dan vallen ze er zo van af. Helaas heeft papier die eigenschap niet: het wordt meteen drijfnat.

` Hoe komt het dat de veren van sommige vogels geen water opnemen en papier wel?
` Hoe komt het dat waterdruppels gemakkelijk van een plant rollen?
` Kunnen we voorspellen welke stoffen water opnemen en welke niet?
` Kunnen we voorspellen welke stoffen in elkaar oplossen?
We zoeken het uit!
VERKEN
• eigenschappen van elementen afleiden op basis van hun plaats in het PSE.

Ionbindingen
elektronen werden overgedragen bv. natriumchloride
Metaalbindingen
een zee van elektronen tussen positieve metaalionen bv. kopermetaal
Atoombindingen
elektronen worden gemeenschappelijk gesteld bv. water
metaalatoom
niet-metaalatoom
• aangeven dat er verschillende soorten bindingen tussen elementen bestaan.

©VANIN

• dat er polaire en apolaire moleculen bestaan.
• welke krachten er tussen verschillende moleculen heersen.
• verschillende soorten mengsels beschrijven. ?

• voorspellen en verklaren welke stoffen in elkaar oplossen.
HOOFDSTUK 1
Polaire en apolaire bindingen en moleculen
Een molecule is opgebouwd uit een bepaald aantal niet-metaalatomen, al dan niet van dezelfde soort. Die atomen zijn met elkaar verbonden door een gemeenschappelijk elektronenpaar. De symbolen van die atomen worden weergegeven in de formule en het aantal van elke soort wordt weergegeven door de index.
LEERDOELEN
L de betekenis van elektronegativiteit begrijpen
L bepalen of een covalente binding polair of apolair is
L water herkennen als een polaire molecule
L het verschil begrijpen tussen een polaire en een apolaire binding
L het verschil begrijpen tussen een polaire en apolaire verbinding
L op basis van de chemische structuur bepalen of een molecule polair of apolair is
1 Het dipoolkarakter van water
Ongeveer 70 % van het aardoppervlak is bedekt met water. Organismen bestaan bovendien voor een groot deel uit water. Zonder water is er geen leven. Ook tijdens de chemielessen gebeuren heel wat proefjes in een waterige oplossing. Het is daarom belangrijk om even te kijken wat water zo speciaal maakt.
DEMO
Invloed van een geladen staaf op een straal water en n-pentaan
Werkwijze
—Je leerkracht vult een buret met n-pentaan (C5H12) en plaatst er een beker onder.
—De leerkracht brengt negatieve ladingen aan op een kunststof lat of staaf door er met een wollen of zijden doek over te wrijven.
—De leerkracht opent het kraantje en houdt de negatief geladen staaf naast de straal n-pentaan die uit de buret loopt.
©VANIN
—Door papier te wrijven over een glazen staaf, ontstaat er een glasstaaf die positief geladen is.
De leerkracht opent het kraantje en houdt de positief geladen staaf naast de straal n-pentaan die uit de buret loopt.
—Je leerkracht brengt daarna achtereenvolgens een negatieve en een positieve staaf naast een waterstraal die uit een andere buret stroomt.
Waarnemingen
—n-pentaan wordt niet aangetrokken door de positief geladen staaf, maar ook niet door de negatief geladen staaf.
—De straal water wordt zowel door de positief als de negatief geladen staaf aangetrokken.
demovideo: invloed van een geladen staaf op een straal water en n-pentaan
Tegengestelde ladingen trekken elkaar aan!
Of zoals het Engelse spreekwoord luidt: opposites attract.
Water (H2O) is een molecule opgebouwd uit 2 waterstofatomen en een zuurstofatoom.
Moleculen zijn neutraal, wat wil zeggen dat een waterdeeltje niet negatief of positief geladen is.
Toch worden watermoleculen aangetrokken door zowel negatieve als positieve ladingen. Dat kan worden verklaard doordat water zowel een positief geladen als een negatief geladen zijde of pool heeft.

—Als een positieve lading in de buurt wordt gebracht van een straal water, worden de negatieve zijden van alle watermoleculen aangetrokken. Hierdoor buigt de waterstraal zich naar de positieve lading.
—Als een negatieve lading in de buurt van een waterstraal wordt gebracht, trekt die de positieve zijde van alle watermoleculen aan, waardoor de straal ook naar de lading afgebogen wordt.
Omdat water gekenmerkt wordt door een negatieve pool en een positieve pool, is water een voorbeeld van een polaire molecule of een dipoolmolecule.
n-pentaan wordt niet aangetrokken door een positieve of negatieve lading, omdat ze geen positieve of negatieve zijde heeft. n-pentaan is dus een voorbeeld van een apolaire molecule
—Een molecule die zowel een positief geladen als een negatief geladen pool heeft, wordt een polaire molecule of een dipoolmolecule genoemd.
—Moleculen die geen positieve en negatieve pool hebben, worden apolaire moleculen genoemd.
©VANIN
De EN-waarde vind je terug op het PSE.
1,2
Of een molecule polair of apolair is, hangt af van de bouw van de molecule en de mate waarin de atomen in de molecule geneigd zijn om elektronen naar zich toe te trekken. In de volgende delen zul je leren om te voorspellen of een molecule polair of apolair is.
2 De elektronegativiteit
Zoals je vorig jaar al hebt geleerd, staan sommige elementen (zoals metalen) liever elektronen af terwijl andere (zoals niet-metalen) liever elektronen opnemen. Dat hangt af van een aantal eigenschappen zoals de grootte van de positieve kernlading, het aantal elektronen en de schikking van de elektronen op de schillen. Die factoren leiden tot een grotere of minder grote aantrekkingskracht op andere elektronen: de elektronegatieve waarde van een atoom.
De elektronegatieve waarde of de elektronegativiteit (EN) drukt uit in welke mate een element geneigd is om elektronen naar zich toe te trekken. De elektronegatieve waarde ligt tussen 0,7 en 4 en is een onbenoemd getal: ze heeft geen eenheid. Hoe groter de elektronegatieve waarde van een element, hoe sterker de neiging van een element om elektronen aan te trekken.
De elektronegatieve waarde of de elektronegativiteit (EN) is een onbenoemd getal dat weergeeft in welke mate een element geneigd is om elektronen naar zich toe te trekken.
Afb. 71 Watermoleculen zijn neutraal: ze zijn niet positief of negatief geladen.
3 Polariteit van de binding
Wanneer 2 atomen met eenzelfde EN gebonden zijn door middel van een atoombinding, dan trekken beide atomen even hard aan de elektronen van de atoombinding. Het gemeenschappelijk elektronenpaar bevindt zich dan perfect tussen de 2 atoomkernen. Zo’n atoombinding noemen we een apolaire atoombinding

Het verschil tussen de EN van beide atomen (grootste EN – kleinste EN) duiden we aan met ΔEN
VOORBEELD ATOOMBINDINGEN IN H2 EN CS2
EN(H) = 2,1 EN(H) = 2,1
EN(S) = 2,5EN(C) = 2,5EN(S) = 2,5
Hier bedraagt ΔEN = 0.
Als 2 atomen die verbonden zijn door een atoombinding een verschillende elektronegatieve waarde hebben, dan zal het atoom met de hoogste EN het hardst aan de elektronen van de atoombinding trekken. Hierdoor zal het bindend elektronenpaar zich niet perfect in het midden tussen de 2 kernen bevinden, maar verschuiven naar het element met de hoogste elektronegativiteit. Een dergelijke atoombinding noemen we een polaire atoombinding

Doordat de elektronen van de atoombinding nu dichter bij het atoom met de hoogste EN liggen, wordt het atoom gedeeltelijk negatief geladen. Maar omdat de elektronen van de atoombinding nog steeds gedeeld worden met het andere atoom, spreekt men van een negatieve deellading of een partieel negatieve lading. Die negatieve lading wordt aangeduid met het symbool δ-
Doordat de elektronen van de atoombinding nu het verst van het atoom met de laagste EN liggen, wordt het atoom gedeeltelijk positief geladen. Omdat de elektronen van de atoombinding nog steeds gedeeld worden met het andere atoom, spreekt men van een positieve deellading of een partieel positieve lading. Die positieve lading wordt aangeduid met het symbool en δ+
De grootte van de positieve en negatieve deelladingen rond een atoombinding neemt toe naarmate het verschil in EN van de atomen groter wordt.
©VANIN
Het Griekse symbool δ wordt uitgesproken als delta
Afb. 72 Apolaire covalente binding
Afb. 73 Polaire covalente binding
VOORBEELD HCI
Waterstofchloride heeft als formule HCl. Het waterstofatoom is verbonden door een covalente binding met het chlooratoom. De EN van het element chloor bedraagt 3,0 en van het element waterstof 2,1. De waarde van ΔEN bedraagt hier 0,9. Het chlooratoom trekt het gemeenschappelijk elektronenpaar naar zich toe, waardoor het bindend elektronenpaar zich dichter bij de kern van het chlooratoom bevindt. Zo ontstaat de partieel negatieve lading van het chlooratoom. Omdat de EN van het waterstofatoom lager is dan chloor, verkrijgt waterstof een partieel positieve lading.
EN(H) = 2,1EN(Cl) = 3,0
CI CICI H HH
©VANIN
Afb 74 Door het verschil in EN tussen het element waterstof en chloor, verschuiven de elektronen van de atoombinding in de richting van het element chloor. Daardoor krijgt het element waterstof een partieel positieve lading en het element chloor een partieel negatieve lading.
Opgelet! De waarde ΔEN tussen de 2 elementen moet voldoende groot zijn om een polaire binding te hebben. Pas als het verschil in EN groter is dan 0,5 wordt van een polaire binding gesproken.
ΔEN < 0,5 → apolair
ΔEN > 0,5 → polair
De waarde ΔEN geeft het verschil aan tussen de EN van de 2 atomen waartussen een atoombinding zich bevindt. Als ΔEN < 0,5, dan bevindt het bindend elektronenpaar van de atoombinding zich in het midden tussen de 2 kernen en spreken we van een apolaire covalente binding of een apolaire atoombinding.
In een molecule ontstaat tussen 2 atomen een polaire atoombinding als ΔEN > 0,5. Het bindend elektronenpaar bevindt zich dan niet perfect tussen beide atoomkernen. Door de verschuiving van het bindend elektronenpaar, krijgt het atoom met de hoogste EN een negatieve deellading (δ-) en het atoom met de laagste EN een positieve deellading (δ+).
4 Polariteit van moleculen
Dipolen of polaire moleculen zijn neutrale moleculen met zowel een positief als een negatief geladen zijde. Die positief en negatief geladen zijden zijn een gevolg van de aanwezigheid van polaire atoombindingen én de ruimtelijke structuur van de molecule.
Als de molecule is opgebouwd uit 2 atomen die verbonden zijn door een polaire atoombinding, dan ontstaat er een molecule met aan de ene zijde een positieve (partiële) lading en aan de andere zijde een negatieve (partiële) lading: een dipool of polaire molecule.
75 Zoutzuur (HCl) is een polaire molecule. Ze heeft een positieve zijde (blauw) en een negatieve
Afb.
zijde (rood).
In een molecule die 2 of meerdere polaire atoombindingen bevat, zullen meerdere atomen een positieve en/of negatieve partiële ladingen hebben. Valt het centrum van de negatieve deelladingen niet samen met het centrum van de positieve deelladingen, dan heeft de molecule een positieve en negatieve zijde en is ze een dipool. Vallen de centra van de positieve en negatieve deelladingen wél samen, dan is de molecule apolair omdat er geen positieve en negatieve pool aanwezig is.
VOORBEELD WATER (H2O)
De polaire molecule water
Water is opgebouwd uit 2 waterstofatomen en een zuurstofatoom. Net zoals andere moleculen heeft water een bepaalde ruimtelijke, driedimensionele structuur. De 3 atomen bevinden zich niet op een rechte lijn, maar de molecule is ‘geknikt’. De hoek tussen beide waterstofatomen bedraagt 104,5°.
OHH
O HH
EN (H) = 2,1
EN (O) = 3,5
Het zuurstofatoom heeft een hogere EN dan waterstof en trekt dus harder aan het gemeenschappelijk elektronenpaar van de atoombinding dan het waterstofatoom. Beide bindende elektronenparen verschuiven bijgevolg in de richting van het zuurstofatoom. Het zuurstofatoom krijgt hier tweemaal een negatieve deellading (2δ-), elk waterstofatoom krijgt een positieve deellading (δ+).
Doordat het centrum van de positieve deelladingen en het centrum van de negatieve deelladingen niet samenvallen, heeft de molecule een positieve en negatieve zijde. Water is dus een polaire molecule of dipool.
©VANIN
Afb. 77 In een molecule water valt het centrum van de negatieve ladingen (rood) niet samen met het centrum van de positieve ladingen (blauw).
Afb. 76 De 3 atomen van de molecule water liggen niet op een rechte lijn. De molecule is geknikt.
VOORBEELD KOOLSTOFDIOXIDE (CO2)
De apolaire molecule koolstofdioxide Koolstofdioxide bestaat uit een koolstofatoom dat gebonden is aan 2 zuurstofatomen. Koolstof heeft de lineaire structuur (zie thema 02) en de 3 atomen bevinden zich op een rechte lijn. Omdat zuurstof een hogere EN (3,5) heeft dan koolstof (2,5) worden de gemeenschappelijke elektronenparen van de atoombindingen naar de zuurstofatomen toe getrokken. Alle atoombindingen zijn dus polair. Doordat de elektronen van de atoombindingen dichter bij zuurstof zitten dan bij koolstof, zijn de zuurstofatomen partieel negatief geladen en het koolstofatoom partieel positief.
De centra van de positieve deelladingen en negatieve deelladingen, of ladingswolken, vallen samen. Hoewel er dus polaire atoombindingen aanwezig zijn, is de molecule apolair
2δ- 4δ+ 2δ-
©VANIN
Afb. 78 Koolstofdioxide bevat polaire bindingen waardoor partiële ladingen ontstaan (blauw=positief, rood=negatief), maar de molecule is apolair omdat het centrum van de positieve ladingen samenvalt met het centrum van de negatieve ladingen.
Wanneer een geladen voorwerp in de buurt van een dipool wordt gebracht, zullen de dipoolmoleculen zich oriënteren als gevolg van die lading. Breng je een positieve lading in de buurt van dipoolmoleculen, dan zal de negatieve zijde van alle moleculen aangetrokken worden en de positieve zijde afgestoten. Omgekeerd zal een negatieve lading de positieve zijde van dipoolmoleculen aantrekken en de negatieve zijde ervan afstoten. Dat verklaart waarom een waterstraal dus zowel aangetrokken wordt door een negatief als een positief geladen staaf.
Als in een molecule enkel apolaire atoombindingen voorkomen, dan zijn er geen partiële ladingen aanwezig. De molecule bevat bijgevolg ook geen negatieve en positieve polen. Een molecule met alleen maar apolaire bindingen zal daarom altijd een apolaire molecule zijn.
VOORBEELD n-PENTAAN
De molecule n-pentaan heeft als formule C5H12
H H C H H C H H C H H C H H H
Afb. 79 Een molecule n-pentaan
Koolstof en waterstof hebben een verschillende elektronegativiteit. Het verschil is zo klein (ΔEN < 0,5) dat de binding als apolair wordt beschouwd. Er zijn dus geen partiële ladingen aanwezig, waardoor de molecule geen positief en negatief geladen pool heeft. n-pentaan is dus in tegenstelling tot water een apolaire molecule.
Om na te gaan of een molecule een dipool is of niet, volg je het volgende schema:
Polaire bindingen aanwezig (ΔEN > 0,5)?
Apolaire molecule
Valt centrum positieve deelladingen samen met centrum negatieve deelladingen?
Apolaire molecule
3
Polaire molecule
Let op dat een molecule pas een dipoolmolecule is wanneer ze aan 2 voorwaarden voldoet:
1 Er moeten polaire bindingen aanwezig zijn.
2 De ladingscentra van de positieve en negatieve deelladingen mogen niet samenvallen.
WEETJE
Om na te gaan of een molecule een dipool is, wordt vaak gebruikgemaakt van dipoolvectoren. Een dipoolvector is een symbolische voorstelling voor de kracht die op een elektronenpaar wordt uitgeoefend. De grootte van de vector is evenredig met het verschil in EN-waarden van beide gebonden atomen: de zin gaat van de partieel positieve naar de partieel negatieve lading.
Dipoolvectoren kun je, net zoals vectoren in de wiskunde en fysica optellen. Als de som van de vectoren, de resultante, niet gelijk is aan nul, dan dan is het een dipool(molecule) of een polaire molecule en is er een positieve en negatieve zijde aanwezig
Als we de dipoolvectoren in een watermolecule verschuiven om in hetzelfde punt aan te grijpen, dan zien we duidelijk dat de resultante (in het rood) niet gelijk is aan nul. Water is duidelijk een polaire molecule, met een positieve en een negatieve zijde.
©VANIN
Schema
Polaire of apolaire moleculen
Je kunt een polaire of apolaire binding ook als volgt voorstellen: Geiten vertegenwoordigen een polaire binding en duwen tegen of trekken aan een paal. Als de geiten sterk genoeg zijn (ΔEN > 0,5) en hun krachten elkaar niet in evenwicht houden, dan wordt de paal schuin of omvergeduwd. Dan is de molecule een dipool.

In het geval van water zullen de geiten de paal omverduwen. Water is dus polair.

In een molecule CO2 trekken beide geiten aan de paal in tegengestelde richting én even hard. De 2 geiten werken elkaar zo tegen dat de paal blijft staan. CO2 is dus een apolaire molecule.

©VANIN
In een molecule zoals CH4 zijn er geen polaire bindingen aanwezig. De geiten duwen of trekken niet. De paal blijft dus staan. De molecule CH4 is bijgevolg apolair.
—Een molecule met uitsluitend apolaire atoombindingen is altijd apolair. —Een molecule die polaire atoombindingen bevat, kan polair of apolair zijn:
• Als het centrum van de positieve deelladingen samenvalt met het centrum van de negatieve deelladingen, dan is de molecule apolair.
• Vallen de centra van de positieve en negatieve deelladingen niet samen, dan heeft de molecule een positieve en negatieve zijde. Het is een dipoolmolecule.
AAN DE SLAG
Ga op zoek naar de EN in je PSE.
a Zoek in het periodiek systeem op welk element de hoogste EN heeft.
b En welk element heeft de laagste EN?
c Orden de volgende elementen volgens stijgende EN:
Al – B – Ge – Ra
Bepaal de EN van beide elementen en ga vervolgens na of de atoomverbinding tussen de elementen polair of apolair is.
a C & H
b H & S
c C & O
d O & N
e S & O
f P & H
Met welk element uit de 7de groep kan koolstof een apolaire atoombinding vormen?
Bepaal of de volgende stoffen bestaan uit polaire of apolaire moleculen.
3D-beelden stoffen a, b en e
HOOFDSTUK 2
Intermoleculaire krachten
Vorig jaar zijn de 3 aggregatietoestanden al aan bod gekomen. In een vaste stof zitten deeltjes op elkaar gestapeld, vaak op een zeer regelmatige manier in een rooster. Wanneer een vaste stof smelt, krijgen de deeltjes een hogere bewegingsvrijheid en rollen ze over elkaar. Als een vloeistof de kooktemperatuur bereikt, dan komen de deeltjes volledig los van elkaar en krijgen ze een nog grotere bewegingsvrijheid: ze gedragen zich nu als een gas. De aggregatietoestand van een stof bij een bepaalde temperatuur is deels een gevolg van de aantrekkingskrachten tussen de deeltjes waaruit ze is opgebouwd.
LEERDOELEN
L de verschillende soorten krachten tussen moleculen onderscheiden
L uitleggen dat intermoleculaire krachten mee het kookpunt en smeltpunt van een stof bepalen
©VANIN
1 Invloed van massa en polariteit op het kookpunt van een stof
Bij kamertemperatuur zijn sommige stoffen vast, terwijl anderen vloeibaar of een gas zijn.
De aggregatietoestand hangt af van het smelt- en kookpunt van de stof. In de onderstaande tabel en grafiek op de volgende pagina wordt het kookpunt van enkele stoffen weergegeven.
1
2
REEKS 3
REEKS 4
Tabel 5 Kookpunten van enkele stoffen
reeks 1reeks 2reeks 3reeks 4water
Wanneer we het kookpunt van gelijksoortige, apolaire stoffen met elkaar vergelijken (reeks 1, reeks 2 en reeks 3), valt uit de grafiek het verband tussen het kookpunt en de molecuulmassa af te leiden: hoe hoger de massa van de deeltjes, hoe hoger het kookpunt. Dat komt doordat zwaardere moleculen moeilijker ontsnappen aan de zwaartekracht en er meer energie nodig is om de moleculen te doen bewegen. In vergelijking tot lichtere moleculen zullen zwaardere moleculen pas bij een hogere temperatuur over elkaar (vloeistof) rollen of van elkaar loskomen (gas).
Als je het kookpunt van stoffen met een gelijkaardige massa vergelijkt (reeks 4), dan valt op dat het kookpunt van polaire verbindingen of dipoolmoleculen hoger ligt dan het kookpunt van apolaire verbindingen. Dat komt doordat er tussen polaire moleculen sterkere intermoleculaire krachten bestaan: krachten die tussen de moleculen heersen en de moleculen bij elkaar houden. Pas als die intermoleculaire krachten verbroken worden, komen deeltjes los van elkaar. Omdat het verbreken van de intermoleculaire krachten energie kost, zullen stoffen die opgebouwd zijn uit dipoolmoleculen, hogere kookpunten hebben. Water heeft, ondanks zijn zeer lage molecuulmassa (18 unit), een bijzonder hoog kookpunt: 100 °C. Dat kookpunt ligt veel hoger dan dat van verbindingen tussen waterstof en de andere elementen van de 6de groep. Het wijst erop dat er tussen watermoleculen bijzonder sterke krachten heersen die veel energie vereisen om ze te verbreken.
©VANIN
Die intermoleculaire krachten hebben een gelijkaardig effect op het smeltpunt van stoffen.
De massa van deeltjes heeft een invloed op het kookpunt van de stof. Hoe hoger de massa, hoe hoger het kookpunt. Polaire verbindingen hebben een hoger kookpunt dan apolaire verbindingen met een gelijkaardige massa. Dat is een gevolg van het bestaan van krachten die tussen de moleculen heersen: de intermoleculaire krachten
Je kunt de relatie tussen de massa en het kookpunt vergelijken met een zwembad vol ballen. Opblaasbare strandballen zullen sneller uit het bad vliegen dan bowlingballen van eenzelfde grootte.
2 Intermoleculaire krachten
2.1 De Londonkracht of Londondispersiekracht
Apolaire moleculen hebben geen polaire bindingen en dus geen permanente negatief geladen en positief geladen pool. Je zou dus denken dat er geen elektrostatische aantrekking (aantrekking tussen + en – ladingen) tussen de moleculen is. Maar doordat elektronen continu in beweging zijn, ontstaan er kortstondig minieme ladingsverschuivingen in moleculen, waardoor de moleculen elkaar een klein beetje aantrekken. Die zwakke intermoleculaire aantrekkingskrachten noemen we de Londonkrachten of de Londondispersiekrachten. Die krachten zijn aanwezig in alle moleculen, dus ook in dipoolmoleculen, maar het zijn de enige intermoleculaire krachten in apolaire moleculen. De grootte van de Londonkracht neemt toe naarmate de molecule groter wordt.
asymmetrische verdeling van elektronen
©VANIN
symmetrische verdeling van elektronen
asymmetrische verdeling van elektronen
Afb. 80 Door bewegende elektronen ontstaan minieme ladingsverschuivingen, waardoor zwakke aantrekkingskrachten tussen moleculen ontstaan.
Door kortstondige ladingsverschuivingen ontstaan er zwakke aantrekkingskrachten tussen moleculen. Die krachten noemen we de Londonkrachten of Londondispersiekrachten Die aantrekkingskrachten zijn de enige intermoleculaire krachten tussen apolaire moleculen. De grootte van de krachten neemt toe met de grootte van de molecule.
WEETJE

Gekko’s kunnen moeiteloos op verticale wanden klauteren en blijven hangen. Het maakt voor gekko’s ook niet uit of het oppervlak nat of droog, koud of warm, glad of ruw, proper of vuil is. Ze doen dat niet op basis van klauwtjes, haakjes of lijm. Nee, ze blijven voornamelijk vastgehecht aan het oppervlak door de zwakke Londonkrachten. Aan de onderzijde van elke teen bevinden zich miljoenen haarachtige structuren, setae genoemd. Op de uiteinden daarvan zitten weer honderden tot duizenden nanohaartjes of spatulae. Die haartjes maken een intens contact met het oppervlak waar ze zich aan vasthechten. Tussen de spatulae en de moleculen van het oppervlak heersen Londonkrachten. Die zijn weliswaar zeer zwak, maar door het grote aantal spatulae tellen al die krachten op. De resulterende kracht is zo groot dat 1 teen het gewicht van een ondersteboven hangende gekko aan de wand kan houden.
1 miljoen setae
1 setae
1 000 nanohaartjes aan de top van 1 seta
gekko
2.2 Dipoolkracht
Polaire moleculen of dipoolmoleculen hebben een permanente positief geladen en negatief geladen pool. Je hebt al gezien dat positieve en negatieve ladingen elkaar aantrekken en gelijksoortige ladingen elkaar afstoten. Op die manier trekt de positief geladen pool van een dipoolmolecule de negatief geladen pool van een andere dipoolmolecule aan. Die intermoleculaire aantrekkingskracht noemen we de dipoolkracht of dipoolinteractie
Dipoolkrachten zijn veel groter dan de zwakke Londonkrachten, die zowel in polaire als apolaire moleculen aanwezig zijn. Het kost dan ook veel meer energie om ze te verbreken en dat verklaart waarom de kook- en smeltpunten van polaire verbindingen (dipoolmoleculen) veel hoger zijn dan die van apolaire verbindingen met een gelijkaardige molecuulmassa. Hoe groter de partiële ladingen in de molecule, hoe sterker de onderlinge aantrekking tussen de moleculen. Daarom neemt de grootte van de dipoolkrachten toe naarmate het verschil in EN-waarde van de atomen die door de atoombinding met elkaar gebonden zijn, groter wordt.
Afb. 81 De tegengesteld geladen polen trekken elkaar aan, waardoor de moleculen zich op een welbepaalde manier oriënteren.
Tussen de positief geladen en negatief geladen polen van dipoolmoleculen (polaire moleculen) heersen intermoleculaire aantrekkingskrachten die we de dipoolkrachten of dipoolinteracties noemen. Die aantrekkingskrachten zijn veel groter dan de zwakke Londonkrachten. De grootte neemt toe naarmate de EN groter wordt.
2.3 Waterstofbruggen
Als het element waterstof gebonden is aan een element met een hoge elektronegatieve waarde zoals N, O, Cl of F, ontstaat een zeer polaire binding. De positieve en negatieve deelladingen zijn dan zo groot dat de dipoolkracht tussen het waterstofatoom en het niet-metaal (N, O, Cl of F) zeer sterk is. Die sterke dipoolkracht geven we daarom een aparte naam: de waterstofbrug
©VANIN
Door de hoge EN van het zuurstofatoom verschuiven de bindende elektronenparen van beide atoombindingen in een watermolecule naar het zuurstofatoom. Het zuurstofatoom wordt hierdoor tweemaal partieel negatief geladen. Elke watermolecule kan nu door 4 waterstofbruggen verbonden worden met andere watermoleculen:
—Twee waterstofbruggen ontstaan doordat de partieel positieve waterstofatomen aangetrokken worden door een vrij elektronenpaar van een zuurstofatoom van een watermolecule.
—Het tweemaal partieel negatief geladen zuurstofatoom kan 2 waterstofatomen van andere watermoleculen aantrekken, waardoor 2 bijkomende waterstofbruggen ontstaan.
©VANIN
Afb. 82 Tussen watermoleculen bestaan sterke waterstofbruggen.
Het zijn de waterstofbruggen die verantwoordelijk zijn voor het zeer hoge kookpunt en de oppervlaktespanning van water, want de waterstofbruggen zorgen ervoor dat de watermoleculen elkaar onderling zeer hard aantrekken.

waterstofbrug polaire covalente binding
Afb. 83 De waterstofbruggen in water zijn verantwoordelijk voor sterke onderlinge aantrekking van de watermoleculen.
Een waterstofbrug ontstaat bij polaire moleculen die waterstof gebonden hebben op een sterk elektronegatief element (zoals zuurstof, stikstof, fluor). Daardoor ontstaat een zeer polaire atoombinding en grote (positieve en negatieve) deelladingen en dus een bijzonder sterke dipoolkracht tussen het waterstofatoom met de positieve deellading en het atoom met een negatieve deellading van een andere molecule.
Als je een glas vol water schenkt, dan komt het water hoger dan de rand van het glas. Dat is te danken aan de oppervlaktespanning van water. Een molecule water IN de vloeistof is aan alle zijden omringd door andere watermoleculen. De krachten die de moleculen op elkaar uitoefenen, heffen elkaar op. Bij de watermoleculen aan het wateroppervlak is dat niet het geval: hierdoor ondervinden ze een nettokracht naar binnen toe. De aantrekkingskrachten tussen de moleculen in het wateroppervlak zijn zelfs zo groot dat het oppervlak zich gedraagt als een vlies. Je kunt er dus een punaise of paperclip op laten drijven. Probeer het zelf eens!


De helmbasilisk of jezushagedis kan hierdoor zelfs over het water lopen, tenminste als hij er voldoende vaart achter steekt. Het vlies op het wateroppervlak is net niet sterk genoeg om zijn gewicht te dragen, dus moet hij ervoor zorgen dat hij zijn volgende stap heeft gezet voordat zijn vorige voet doorheen het wateroppervlak breekt.
Water is de enige stof op aarde die voorkomt in 3 aggregatietoestanden: vast (ijs), vloeibaar (water) en gas (waterdamp). Bij de meeste stoffen neemt de massadichtheid (de massa per volume) af met toenemende temperatuur: door warmte zetten stoffen uit, waardoor eenzelfde volume een kleinere hoeveelheid stof bevat.
Water is een buitenbeentje. Water heeft de hoogste massadichtheid bij 4 °C: 1 liter water bij 4 °C is zwaarder (en bevat meer water) dan een liter bij elke andere temperatuur. Water van 4 °C dat opwarmt, zet net als andere stoffen uit, waardoor er per liter minder water in zit. De massadichtheid neemt af.
Wanneer je water laat afkoelen onder de 4 °C, zal het uitzetten. Wie ooit al een fles of blikje met drank in de vriezer heeft gestopt, weet wellicht dat het zal barsten als het bevriest. Maar hoe komt dat?
In vast water – ijs dus– zitten de water-moleculen gerangschikt in een rooster. De waterstofbruggen houden de watermoleculen op een relatief grote afstand van elkaar. Als het ijs begint te smelten, dan komen er moleculen los en wat dichter bij elkaar. Het volume water krimpt dus als het water smelt. Bij 4 °C zitten de watermoleculen het dichtst op elkaar. Als de temperatuur verder toeneemt, worden steeds meer waterstofbruggen gebroken en bewegen de moleculen steeds heviger, waardoor de onderlinge afstand tussen de moleculen weer groter wordt en het water uitzet.
Afb. 84 Oppervlaktespanning van water
Afb. 85 De jezushagedis
video: de jezushagedis
Afb. 86 Water dat bevriest, zet uit en kan glazen flessen doen breken.
Afb. 87 Dichtheidsverloop van water. Zuiver water heeft de grootste dichtheid bij 4 °C.
AAN DE SLAG
Welke intermoleculaire krachten zijn aanwezig tussen:
a apolaire moleculen zoals F2, I2, H2
b polaire moleculen zonder H, zoals CO
c polaire moleculen met H gebonden op een nM met een lage EN zoals HI
d polaire moleculen met H gebonden op een nM met een hoge EN zoals H2O, HF
In welke moleculen zijn Londonkrachten (1), dipoolinteracties (2) en/of waterstofbruggen (3) aanwezig?
a ammoniak (NH3)
b fluorgas (F2)
FF
c koolstofdioxide (CO2)
COO
d methanol (CH3OH)
e joodmonochloride
ICI
Propaan-1-ol en glycol hebben een gelijkaardige massa. Propaan-1-ol kookt bij 97 °C, terwijl glycol pas kookt bij 197 °C. Hoe verklaar je dat het kookpunt van glycol hoger ligt dan dat van propaan-1-ol?
Zoutzuur (HCl) heeft een kookpunt van -85 °C en waterstofbromide (HBr) een kookpunt van -66 °C. Hoe verklaar je het verschil in kookpunt?
Een waterdruppel aan een lekkende kraan kan soms uren blijven hangen vooraleer het plots valt. Hoe komt het dat de druppel zo lang blijft hangen … en dan uiteindelijk toch valt?
Plat op je buik vallen in water is pijnlijk. Verklaar waarom het minder pijnlijk is als je je lichaam kaarsrecht houdt en eerst met de handen of voeten in het water terechtkomt.

Als je een soepbord vult met water en een paar snuifjes peper op het water strooit, blijft de peper op het oppervlak drijven (foto 1). Wanneer je vervolgens een tandenstoker in wat afwasmiddel dipt en daarmee het wateroppervlak aanraakt, wijkt de peper uiteen (foto 2). Hoe kun je dat verschijnsel verklaren?


Propaan-1-ol Glycol
HOOFDSTUK 3
Oplosbaarheid en geleidbaarheid van stoffen
Mensen moeten gemiddeld anderhalve liter water drinken om de hoeveelheid water die ze dagelijks door zweet en urine verliezen, terug aan te vullen. Maar veel mensen vinden water te smaakloos. Ze verkiezen cola, limonade, koffie, thee, bier of wijn. Die dranken bestaan uit water waarin heel wat stoffen zijn opgelost. Maar niet alle stoffen lossen goed op. We willen weten of er een verband bestaat tussen de polariteit van een stof en de oplosbaarheid in een oplosmiddel.
Een oplosmiddel is een vloeistof. Tussen de moleculen van het oplosmiddel heersen intermoleculaire krachten. Je leerde al dat tussen apolaire moleculen zoals n-pentaan alleen zwakke Londonkrachten heersen en tussen polaire moleculen dipoolkrachten, en bij water ook nog waterstofbruggen. Die intermoleculaire krachten bepalen welke stoffen kunnen worden opgelost.
LEERDOELEN
L polaire en apolaire stoffen op basis van hun oplosbaarheid in water onderscheiden
L elektrolyten onderscheiden van niet-elektrolyten
L de processen ionisatie, hydratatie en dissociatie beschrijven
L een ionisatie- en dissociatievergelijking opstellen
L het verband leggen tussen bindingstype en geleidingsvermogen
1 Oplosbaarheid van ionverbindingen in polaire en apolaire oplosmiddelen
Ionverbindingen zijn opgebouwd uit grote aantallen positieve en negatieve ionen die zich in een ionrooster bevinden. De ionen worden op hun plaats gehouden door sterke elektrostatische aantrekkingskrachten. Sommige ionverbindingen lossen op in polaire oplosmiddelen zoals water.
Wanneer een ionverbinding in water terechtkomt, richten de watermoleculen hun positief geladen zijde (H-atomen) naar de negatieve ionen en hun negatief geladen pool (het zuurstofatoom) naar de positieve ionen. Zo ontstaan ion-dipoolinteracties. Als die krachten groter zijn dan de krachten tussen de ionen in het ionrooster, dan komen de ionen los. Het verschijnsel waarbij de ionen die aanwezig waren in de verbinding, loskomen, wordt dissociatie genoemd. Eenmaal volledig vrij ontstaan er gehydrateerde ionen doordat de ionen volledig worden omringd door een mantel van watermoleculen. Dat verschijnsel heet hydratatie.
De aggregatietoestand wordt in de reactievergelijking als subscript bij de verschillende deeltjes gemeld. Daarbij gebruiken we de volgende notaties: (s) of (v): vaste toestand (l) of (vl): vloeibare toestand (g): gasvormige toestand (aq): gehydrateerd ion, opgelost in water
We kunnen het oplosproces voor een ionverbinding in duidelijke stappen formuleren:
1 De ionen zijn al aanwezig en zitten met ionkrachten stevig vast in het ionrooster. Als het zout oplost, dan komen de ionen los uit het rooster en dissocieert het zout.
2 Watermoleculen richten zich met hun positieve pool naar de negatieve ionen.
©VANIN
3 Andere watermoleculen richten zich met hun negatieve pool naar positieve ionen.
4 Als de ion-dipoolinteracties groter zijn dan de krachten tussen de ionen, dan komen de ionen los uit het rooster en valt het kristal uiteen. Dat is dissociatie
5 Doordat de ionen zich omgeven met een watermantel, ontstaan er gehydrateerde ionen. Dat verschijnsel heet hydratatie.
Ionverbindingen zijn al opgebouwd uit ionen voordat ze oplossen in water. Het oplosproces in water is een dissociatiereactie
Afb. 88 Schematische voorstelling van dissociatie
De dissociatie van een zout kun je voorstellen door de dissociatievergelijking. Die vergelijking wordt opgesteld door links van de reactiepijl de formule-eenheid van de ionverbinding te noteren en rechts van de reactiepijl de soorten ionen. Het aantal van de verschillende ionen in de formuleeenheid, schrijven we als coëfficiënt in de vergelijking. Boven de reactiepijl schrijven we H2O omdat het die molecule is die het ionrooster dissocieert.
VOORBEELD DISSOCIATIEVERGELIJKING VAN ALUMINIUMCHLORIDE EN NATRIUMHYDROXIDE
Dissociatievergelijking van aluminiumchloride: AlCl3 (s) → Al3+(aq) + 3 Cl-(aq)
Dissociatievergelijking van natriumhydroxide: NaOH(s) → Na+ (aq) + OH-(aq)
Bij sommige ionverbindingen zijn de elektrostatische aantrekkingskrachten zo groot dat de watermoleculen ze bijna niet uit hun ionrooster kunnen trekken. Die zouten zijn zeer slecht oplosbaar. In thema 05 zul je zien welke zouten goed oplosbaar zijn en welke slecht oplosbaar.
DEMO
Geleidbaarheid oplossingen van ionverbindingen
Werkwijze
Je leerkracht onderzoekt bij verschillende zuivere stoffen en oplossingen of ze de stroom geleiden. Je leerkracht gebruikt hiervoor een open stroomkring met een testlampje en elektroden. Als het lampje gaat branden, dan geleidt de stof of de oplossing de elektrische stroom.
Besluit
—Vaste ionverbindingen geleiden de elektrische stroom niet.
—Ionverbindingen die oplossen, geleiden de elektrische stroom.
Omdat in een oplossing van een ionverbinding met water vrije ionen ontstaan, zal de oplossing de elektrische stroom geleiden. Ionverbindingen zijn daarom elektrolyten.
Ionverbindingen lossen niet op in apolaire oplosmiddelen omdat er geen elektrostatische aantrekking heerst tussen de apolaire moleculen van het oplosmiddel en de ionen in het rooster. Het oplosmiddel is niet in staat om zich tussen de ionen te begeven of de ionen uit het rooster los te trekken.
Ionverbindingen zijn niet oplosbaar in apolaire oplosmiddelen, maar veel ionverbindingen lossen goed op in polaire oplosmiddelen
In een polair oplosmiddel zoals water ontstaan ion-dipoolinteracties tussen ionen.
—Ion-dipoolinteracties overwinnen krachten tussen ionen in rooster niet: slecht oplosbaar zout.
—Ion-dipoolinteracties overwinnen krachten tussen ionen in rooster: dissociatie of loskomen van ionen → hydratatie: de ionen worden omringd door een watermantel.
De dissociatievergelijking is de reactievergelijking die de dissociatie voorstelt. Omdat in een mengsel van ionverbindingen en water vrije ionen voorkomen, zijn ionverbindingen elektrolyten.
©VANIN
demovideo: geleidbaarheid oplossingen ionverbindingen
2 Oplosbaarheid van moleculaire verbindingen
Apolaire stoffen blijken niet op te lossen in polaire oplosmiddelen maar wel in apolaire oplosmiddelen. Dat komt omdat er tussen de moleculen van een apolair oplosmiddel alleen zwakke Londonkrachten heersen. Apolaire moleculen kunnen zich bijgevolg gemakkelijk plaatsen tussen de moleculen van een apolair oplosmiddel. Omdat de moleculen van de opgeloste stof elkaar onderling niet aantrekken, blijven ze onderling ook niet bijeen.
©VANIN
Afb. 89 Tussen apolaire moleculen van het oplosmiddel n-pentaan zijn enkel zwakke Londonkrachten aanwezig. Andere apolaire moleculen kunnen gemakkelijk plaatsnemen tussen de moleculen van het oplosmiddel.
Zowat het meest gebruikte polaire oplosmiddel is water. In vloeibaar water zijn de watermoleculen onderling stevig met elkaar verbonden door waterstofbruggen. Een apolaire molecule (zoals dijood) kan zich dus niet tussen de watermoleculen wringen. Mocht een apolaire molecule toch tussen watermoleculen verzeild raken, dan zou de onderlinge aantrekking van de moleculen van het oplosmiddel ervoor zorgen dat de apolaire molecule er terug uit wordt geduwd.
II
Afb. 90 Door de sterke onderlinge aantrekking van de watermoleculen, kunnen apolaire moleculen er niet plaats tussen nemen.
Stoffen die opgebouwd zijn uit polaire moleculen, zoals glucose en methanol, lossen op in water en andere polaire oplosmiddelen. Dat komt doordat dipoolinteracties ontstaan tussen de moleculen van de opgeloste stof en het oplosmiddel: de positieve pool van een polaire molecule zal zich richten op de negatieve pool van de moleculen van het oplosmiddel en omgekeerd. Polaire moleculen van de op te lossen stof nemen dan als het ware de plaats in van enkele moleculen van het polaire oplosmiddel. Eventueel kunnen ook waterstofbruggen gevormd worden tussen de opgeloste stof en het oplosmiddel.
Afb. 91 Polaire moleculen lossen op in polaire oplosmiddelen, omdat tegengesteld geladen polen van oplosmiddel en opgeloste stof elkaar aantrekken.
Het ontbreken van aantrekkingskracht tussen de dipoolmolecule en de moleculen van een apolair oplosmiddel enerzijds, en de onderlinge aantrekking van de dipoolmoleculen anderzijds, zorgt dat polaire moleculen zich niet verspreiden tussen de apolaire moleculen. Dipolen lossen dus niet op in apolaire oplosmiddelen. Ze blijven erop drijven als hun massadichtheid kleiner is dan die van het oplosmiddel of ze zinken als hun massadichtheid groter is.
Afb. 92 Omdat de dipoolinteracties sterker zijn dan de Londonkrachten tussen apolaire oplosmiddelen, lossen polaire moleculen niet op in apolaire oplosmiddelen zoals n-pentaan.
De oplosbaarheid van een moleculaire verbinding hangt af van de aard van de verbinding en het oplosmiddel:
Polaire moleculen lossen op in polaire oplosmiddelen
Apolaire moleculen lossen op in apolaire oplosmiddelen.
WEETJE

Zijn je handen vettig van een afgevallen fietsketting?
Dat krijg je niet schoon met water. Vetten zijn apolair en je weet inmiddels dat apolaire stoffen niet oplossen in water. Vuil dat bestaat uit apolaire stoffen spoel je niet zomaar weg met water. Je hebt zeep of een detergent nodig.
Een molecule zeep of detergent is opgebouwd uit een lang, apolair staartdeel en een polaire/geladen kop:
©VANIN
apolaire staart polaire kop
Afb. 93 De lange staart van een zeepmolecule bestaat uit C- en H-atomen en is apolair. De kop van de molecule is opgebouwd uit een -COO- groep en lost op in water.
Wanneer zeep wordt opgelost in water, zullen de apolaire staarten van de zeepmoleculen oplossen in het vet. De polaire kopjes van de zeepmoleculen blijven buiten het apolaire vuil zitten. Wanneer je de handen gaat spoelen met water, trekken de watermoleculen met dipoolkrachten en waterstofbruggen aan de polaire koppen. Zo komt het deeltje vuil los.
WEETJE (VERVOLG)
Apolaire staarten lossen op in vet. De polaire/geladen kopjes blijven opgelost in water en helpen om het apolaire vuil los te maken van het oppervlak.
apolaire staart
zeepmolecule
polaire/ geladen kop
©VANIN
Afb. 94 De werking van zeep
3
Ionisatie van zuren en ammoniak
3.1 Ionisatie algemeen
Soms zijn de dipoolkrachten tussen de watermoleculen en de opgeloste molecule zo groot dat de opgeloste molecule stuk wordt getrokken en ionen ontstaan. Het verschijnsel waarbij een neutrale molecule stuk wordt getrokken en aanleiding geeft tot het ontstaan van ionen, wordt ionisatie genoemd. Het treedt op wanneer zuren of ammoniak (NH3) oplossen in water.
Dat verschijnsel wordt weergegeven door middel van de ionisatievergelijking. De ionisatievergelijking geeft links van de reactiepijl het zuur en rechts de gevormde ionen weer.
3.2 Ionisatie van zuren
Als een zuur oplost in water, trekt het zuurstofatoom van de watermolecule zo hard aan het waterstofatoom van het zuur, dat het gescheiden wordt van beide elektronen van de atoombinding. Op die manier wordt de zuurmolecule gesplitst in een proton of positief geladen waterstofion (H+) en een negatief geladen zuurrestion. Het waterstofion wordt gebonden op een watermolecule en vormt zo een hydroxoniumion (H3O+). Als een zuur meerdere waterstofatomen bevat, kunnen elk van de waterstofatomen als protonen van het zuur verwijderd worden. De negatieve lading van het zuurrestion is gelijk aan het aantal protonen dat werd afgesplitst van het zuur.
oppervlak
1 De ionen zijn nog niet aanwezig in de molecuulstructuur van het zuur voordat het in water oplost.
©VANIN
2 De zuurmolecule met een polaire atoombinding wordt omgeven door de polaire watermoleculen.
3 Door de dipoolkrachten van de watermoleculen wordt de binding tussen waterstof en het zuurrest verbroken. Beide elektronen van de atoombinding blijven achter waardoor een negatief zuurrestion ontstaat.
4 Het proton wordt gebonden op een watermolecule waardoor H3O+ ontstaat.
Het zuur valt uiteen in een hydroxoniumion en een negatief zuurrestion. We spreken van ionisatie
Afb. 95 Schematische voorstelling van de ionisatie
VOORBEELD ZOUTZUUR (HCl) EN ZWAVELZUUR (H2SO4)
Als je zoutzuur oplost in water, dan wordt de atoombinding tussen waterstof en chloor verbroken. Beide elektronen van de atoombinding blijven achter bij chloor. Zo ontstaat een positief waterstofion of een proton en een negatief geladen zuurrestion. Het zuurrest is een ion dat eenmaal negatief geladen is omdat 1 proton werd afgesplitst. Het proton wordt gebonden op een watermolecule, zodat een hydroxoniumion ontstaat (H3O+).
OCI + H HH
O H HH + CI -
De ionisatievergelijking van zoutzuur is : HCl + H2O → H3O+ + Cl-
©VANIN
Zwavelzuur heeft als formule H2SO4. Als zwavelzuur opgelost wordt in water, dan kunnen 2 protonen worden afgesplitst. Dat gebeurt in 2 verschillende stappen, waarbij telkens een proton wordt overgedragen aan een andere watermolecule. We spreken van een stapsgewijze ionisatie. Het zuurrest dat uiteindelijk ontstaat, draagt daarom de lading 2-.
H2SO4 + H2O → HSO4- + H3O+
HSO4- + H2O → SO42- + H3O+
De ionisatievergelijking van zwavelzuur is: H2SO4 + 2H2O → 2H3O+ + SO42-
3.3 Ionisatie van ammoniak
Als ammoniak (NH3) oplost in water, richt het partieel positief geladen waterstofatoom van een watermolecule zich naar het partieel negatief geladen stikstofatoom van ammoniak. Door de sterke dipoolkracht wordt een proton afgesplitst van een watermolecule, waardoor een negatief hydroxide-ion ontstaat. De beide elektronen van het niet-bindende elektronenpaar van N worden vervolgens gebruikt om het proton te binden op de molecule ammoniak, waardoor een positief ammoniumion (NH4+) wordt gevormd.
Afb. 96 Het vrije elektronenpaar van stikstof wordt gebruikt om een waterstof afkomstig van water te binden.
De ionisatievergelijking van ammoniak wordt dan NH3 + H2O → NH4+ + OH-
Geleidbaarheid oplossingen van polaire moleculen
Werkwijze
De leerkracht onderzoekt bij verschillende zuivere stoffen en oplossingen of ze de stroom geleiden. De leerkracht gebruikt hiervoor een open stroomkring met testlampje en elektroden. Als het lampje gaat branden, geleidt de stof of de oplossing de elektrische stroom.
Besluit
—Zuivere polaire en apolaire oplosmiddelen geleiden de elektrische stroom niet.
—Sommige waterige oplossingen van polaire stoffen geleiden de elektrische stroom.
Stoffen die bestaan uit neutrale moleculen, zoals zuren of ammoniak, kunnen aanleiding geven tot een oplossing die ionen bevat. Die ionen kunnen zich verplaatsen doorheen de vloeistof. Aangezien een elektrische stroom een verplaatsing is van geladen deeltjes, geleiden die oplossingen elektriciteit. Stoffen die in een oplossing de elektrische stroom geleiden, zoals zuren en ammoniak, noemen we elektrolyten. Stoffen die wel oplossen maar geen ionen vormen, zoals suiker, geven geen aanleiding tot een oplossing die de elektrische stroom geleidt. Dergelijke stoffen noemen we niet-elektrolyten
In de chemie betekent ‘oplossen’ dat 2 stoffen een homogeen mengsel vormen. Als oplosmiddel wordt meestal water gebruikt. Het oplossen van een stof in water kan betekenen dat:
—aanwezige ionen loskomen uit het ionrooster (dissociëren), zoals een oplossing van een ionverbinding;
—moleculen van de opgeloste stof onveranderd mengen met de moleculen van het oplosmiddel, zoals een oplossing van suiker in water;
—moleculen gesplitst worden in ionen (ioniseren), zoals een oplossing van een zuur of ammoniak.
Ionisatie is het verschijnsel waarbij ionen ontstaan als moleculen oplossen in water. Het kan worden voorgesteld door een ionisatievergelijking. De ionisatievergelijking geeft links van de pijl water en ammoniak of het zuur weer, rechts de gevormde ionen na ionisatie. Zuren die oplossen in water geven aanleiding tot positieve hydroxoniumionen en negatieve zuurresten. Als ammoniak oplost in water ontstaan positieve ammoniumionen en negatieve hydroxideionen.
©VANIN
Een stof opgebouwd uit moleculen die in water ioniseren, is een elektrolyt omdat een oplossing van die stof de elektrische stroom geleidt. Moleculen die niet ioniseren zijn nietelektrolyten
TIP
Als je de concentratie van een stof wilt geven in mol L , dan plaats je de stof tussen vierkante haakjes. [H3O+] betekent 'de concentratie van H3O+'
4 Verband tussen zuurtegraad en concentratie van protonen
Je zag al dat tussen de watermoleculen in zuiver water sterke dipoolkrachten (en waterstofbruggen) heersen. Nu en dan zullen watermoleculen onder invloed van die krachten, net zoals zuren, ioniseren. Als een watermolecule stuk wordt getrokken, ontstaat zowel een hydroxoniumion (H3O+) als een hydroxide-ion (OH-). Dat noemen we de auto-ionisatie van water. O H2OH2O H3O+ OHO H H H H + + + + O H H H + O H-
De term pH staat voor power of hydrogen, of de ‘(negatieve) macht van water’.
©VANIN
Nauwkeurige metingen tonen aan dat in 1 L zuiver water zich 10-7 mol H3O+- en 10-7 mol OH--ionen bevinden.
In zuiver water geldt: concentratie H3O+ = concentratie OH- = 10-7 mol L [H3O+] = [OH-] = 10-7 mol L
Een oplossing waar de concentratie aan H3O+ gelijk is aan de concentratie aan OH-, noemen we een neutrale oplossing.
Als de concentratie aan H3O+ stijgt (en groter wordt dan de concentratie aan OH-), ontstaat een zure oplossing. Als de concentratie aan OH- stijgt (en groter wordt dan de concentratie aan H3O+), ontstaat een basische of alkalische oplossing.
De zuurtegraad of de pH geeft weer hoe zuur een oplossing is en hangt af van de concentratie aan H3O+ en OH--ionen. De zuurtegraad wordt berekend op basis van de concentratie aan H3O+ in de oplossing volgens:
[H3O+] = 10-pH
Omdat de concentratie aan [H3O+] in zuiver water gelijk is aan 10-7 mol L , is de pH van zuiver water gelijk aan 7.
WEETJE
Naast de pH is er ook de pOH. De pOH geeft weer hoe basisch de oplossing is. Ze kan worden berekend volgens de formule:
[OH ] = 10-pOH
In zuiver water is ook de pOH gelijk aan 7.
In oplossingen blijkt er steeds een verband te bestaan tussen de concentratie aan hydroxide-ionen en het aantal hydroxoniumionen, namelijk:
[H3O+] ∙ [OH ] = 10-14 mol2 L2
Het betekent dat de concentratie hydroxoniumionen stijgt als de concentratie aan hydroxide-ionen daalt en omgekeerd.
menselijk bloed8 10–8
oplossing van bakpoeder9 10–9
broccoli10 10–10 zeep bleekmiddel 11 10–11 12 10–12 schoonmaakproduct oven13 10–13 14 10–14
WEETJE
Als zuren oplossen in water, dan ioniseert het zuur waardoor de concentratie aan H3O+ stijgt. Als de concentratie aan hydroxoniumionen groter wordt dan 10-7 mol L , wordt de pH kleiner dan 7.
De concentratie OH- neemt toe bij ionisatie van ammoniak of dissociatie van ionverbindingen zoals hydroxiden. Als de concentratie OHtoeneemt, dan wordt de concentratie aan H3O+ kleiner dan 10-7 mol L , waardoor de pH groter wordt dan 7.
Omdat de concentratie van de hydroxoniumionen van de meeste oplossingen tussen 1 (= 100) en 10-14 mol L ligt, ligt de pH van de meeste oplossingen tussen 0 en 14. Wanneer de concentratie aan hydroxoniumionen groter is dan 1 mol L , zal de pH kleiner zijn dan 0. Als ze kleiner is dan 10-14 mol L , dan zal de pH groter zijn dan 14. Die oplossingen zijn extreem zuur of alkalisch, en dus zeer gevaarlijk.
—De zuurtegraad of pH hangt af van de concentratie aan H3O+ en OH-.
—In een neutrale oplossing, zoals zuiver water, is de concentratie van beide ionen gelijk aan elkaar en de pH = 7.
—Zure oplossingen: pH < 7 omdat de concentratie H3O+ > concentratie OH-.
—Basische oplossingen: pH > 7 omdat de concentratie H3O+ < concentratie OHAfb. 97 Het verband tussen de concentratie van protonen en de pH
©VANIN
AAN DE SLAG
Je gooit enkele kristallen keukenzout (NaCl) in een proefbuis met water en enkele kristallen in een oplossing met n-pentaan (apolair oplosmiddel).
Je controleert of beide oplossingen de stroom geleiden. Wat zal het resultaat zijn en hoe kun je het resultaat verklaren?
Geef de dissociatievergelijking van de volgende ionverbindingen.
a natriumfluoride
b Mg(NO3)2
c aluminiumsulfide
d kaliumcarbonaat
e K2SO4
Lossen de stoffen op in water of in benzine (=een mengsel van apolaire koolwaterstoffen)?
TIP
1 Bepaal het verschil in elektronegativiteit tussen de elementen van elke atoombinding.
2 Over welke soort binding gaat het: polair of apolair?
3 Duid in de lewisstructuren de partiële ladingen aan.
4 Wat is de aard van de stof: polair of apolair?
5 Lost de stof op in water of in benzine?
c CCl4
e H2S
Welke stoffen lossen op in water en welke stoffen lossen op in n-pentaan: dijood, ethaan, KOH, salpeterzuur (HNO3), NH3?
Bekijk de structuurformule van ammoniak en salpeterzuur bij het extra materiaal op
Je giet een kleine hoeveelheid water en een kleine hoeveelheid maïsolie (apolair) in een reageerbuis. Maisolie heeft een kleinere massadichtheid dan water. Je laat een druppel inkt vallen in de proefbuis. Enige tijd later merk je dat de onderste laag diepblauw gekleurd is. Is inkt een mengsel opgebouwd uit polaire of apolaire moleculen?
Verklaar je antwoord.
Kun je een pan waarin je spek hebt gebakken, proper maken met alleen maar water? Verklaar je antwoord.
Als je weet dat de poten van bijen en muggen bedekt zijn met een klein waslaagje, kun je dan verklaren waarom die dieren een tijdje over water of frisdrank kunnen lopen?

Je gooit enkele kristallen bariumchloride (BaCl2) in een proefbuis met water, en enkele kristallen in een oplossing met n-pentaan. Zullen de kristallen oplossen in beide proefbuizen? Leg kort uit waarom.
Stoffen
Schrijf de ionisatievergelijking van de volgende stoffen:
a ammoniak (NH3)
b waterstofjodide
c zwavelzuur
d fosforzuur
e water (auto-ionisatie)
Schrijf de stapsgewijze ionisatie van H2SO4
Je meet de pH-waarde van 3 vloeistoffen in een maatbeker. De pH van de vloeistof in de eerste maatbeker bedraagt 5, van de vloeistof in de tweede maatbeker 7 en van de derde maatbeker 11,4.
In welke maatbeker:
—bevinden zich hydroxoniumionen?
—bevinden zich hydroxide-ionen?
—is de concentratie hydroxoniumionen groter dan 10-7 mol L ?
—is de concentratie aan hydroxide-ionen kleiner dan 10-7 mol L ?
Citroensap is zuurder dan een azijnzuuroplossing.
Wat zijn de mogelijke pH-waarden van het citroensap en de azijnzuuroplossing?
KERNBEGRIPPEN
KERNVRAGEN
POLARITEIT EN OPLOSBAARHEID
NOTITIES
Hoofdstuk 1: Polaire en apolaire bindingen en moleculen
elektronegativiteit (EN) = waarde die neiging weergeeft om elektronen naar zich toe te trekken
polaire atoombinding: beide elektronen van een atoombinding zitten dichter bij een van de 2 atomen
polaire molecule of dipool: molecule met een positieve en negatieve zijde
apolaire molecule: molecule zonder positieve en negatieve zijde
Een polaire atoombinding ontstaat als ∆EN > 0,5. Door een polaire atoombinding ontstaan partieel positieve (δ+) en partieel negatieve (δ-) ladingen.
Een polaire molecule of dipool ontstaat als: —de molecule polaire atoombindingen bevat EN
—het centrum van alle partieel positieve ladingen niet samenvalt met het centrum van alle partieel negatieve ladingen.
Hoofdstuk 2: Intermoleculaire krachten
intermoleculaire krachten: krachten die heersen tussen moleculen:
Londonkrachten dipoolkrachten waterstofbruggen
©VANIN
Eigenschappen zoals het kookpunt en smeltpunt van een stof hangen af van de massa van de moleculen en de intermoleculaire krachten:
Londonkrachten: zwakke aantrekkingskrachten die ontstaan door minieme ladingsverschuivingen in een molecule. Ze zijn aanwezig in alle moleculen.
dipoolkrachten: aantrekkingskracht tussen positieve pool van een dipoolmolecule en negatieve pool van een andere dipoolmolecule. waterstofbruggen: sterke dipoolkracht tussen een H gebonden op een sterk elektronegatief element en de negatieve zijde van een andere dipool.
Hoofdstuk 3: Oplosbaarheid en geleidbaarheid van stoffen
dissociatie: het verbreken van ionbindingen bij oplossen
hydratatie: ionen worden omringd door watermoleculen
dissociatievergelijking: vergelijking die de dissociatie voorstelt
elektrolyt: stof die in opgeloste of gesmolten toestand de elektrische stroom geleidt
—Sommige ionverbindingen zijn goed oplosbaar in water, andere zijn slecht oplosbaar.
—Bij dissociatie van een zout komen de positieve en negatieve ionen vrij. De ionen worden hierbij gehydrateerd = ze worden omringd door watermoleculen.
—De dissociatie kan voorgesteld worden door een dissociatievergelijking.
—Omdat in een oplossing of smelt van een ionverbinding ionen aanwezig zijn, zijn ionverbindingen elektrolyten.
KERNBEGRIPPEN
KERNVRAGEN
POLARITEIT EN OPLOSBAARHEID
NOTITIES
Hoofdstuk 3: Oplosbaarheid en geleidbaarheid van stoffen
ionisatie: een molecule die oplost wordt stukgetrokken in ionen.
ionisatievergelijking: vergelijking die ionisatie van een molecule voorstelt.
zuurtegraad of pH: maat voor de concentratie aan hydroxoniumionen in een oplossing
—Polaire stoffen lossen op in polaire oplosmiddelen maar niet in apolaire oplosmiddelen.
—Apolaire stoffen lossen op in apolaire oplosmiddelen maar niet in polaire oplosmiddelen.
—Als een zuur ioniseert in water, dan ontstaat er een hydroxoniumion (H3O+) en een negatief zuurrest (Z-)
—Als ammoniak (NH3) ioniseert in water, dan ontstaat ammonium (NH4+) en hydroxide (OH-).
—Stoffen die ioniseren in water, zijn elektrolyten.
—De ionisatie kan voorgesteld worden door een ionisatievergelijking.
—Sommige moleculen lossen op in water maar ioniseren niet. Dat zijn niet-elektrolyten.
—De zuurtegraad houdt verband met de concentratie aan hydroxoniumionen in een oplossing.
• neutrale oplossing:
pH = 7 [H3O+] = [OH-] = 10-7 mol L
• zure oplossing
pH < 7 [H3O+] > 10-7 mol L
• basische oplossing
pH > 7 [H3O+] < 10-7 mol L
©VANIN
©VANIN
REACTIESOORTEN 05 THEMA
Bosbranden komen regelmatig in het nieuws. Vaak zijn ze moeilijk onder controle te krijgen. Je weet ondertussen al dat een verbranding een chemische reactie is tussen bijvoorbeeld een koolstofverbinding en zuurstofgas, waarbij een van de eindproducten koolstofdioxide is. Maar over welke soort chemische reactie gaat het hier specifiek?

` Kunnen we chemische reacties nog verder onderverdelen?
` Hoe noteren we die chemische reacties?
` Welke specifieke kenmerken hebben die soorten chemische reacties?
We zoeken het uit!
VERKEN
• het oxidatiegetal van een element in een verbinding bepalen.

• het onderscheid maken tussen een fysisch en een chemisch proces.

• het onderscheid tussen een ionuitwisselingsreactie en een redoxreactie;
©VANIN
• ionisatie- en dissociatievergelijkingen opstellen.
• gebruikmaken van zuur-base
• indicatoren;
• het begrip pH gebruiken bij het onderscheiden van een zure, neutrale of basische oplossing.
• de overdracht van elektronen in een redoxreactie bestuderen en noteren.

• ionuitwisselingsreacties onderverdelen in neerslag-, gasontwikkelings- en neutralisatiereacties.

• essentiële en stoffenreactievergelijkingen opstellen voor ionuitwisselingsreacties.
• neutralisatiereacties herkennen.
JE KUNT AL ...
JE LEERT NU ... H2O
OG: +I -II
HOOFDSTUK 1
Soorten chemische reacties
Je kent ondertussen het verschil tussen chemische en fysische reacties. Een chemisch proces (of een chemische reactie) is een reactie waarbij na de reactie andere stoffen worden gevormd. Een fysisch proces is een proces waarbij de beginstoffen achteraf opnieuw terug te vinden zijn. In de lessen fysica ga je verder onderzoeken hoe zo’n fysisch proces werkt. In dit hoofdstuk leer je hoe je chemische reacties nog verder kunt onderverdelen.
LEERDOELEN
L een chemische reactie classificeren als redoxreactie of ionuitwisselingsreactie
L een chemische reactie classificeren als een neerslag-, gasontwikkelings- of neutralisatiereactie
1 Ionuitwisselingsreactie versus redoxreactie
We kunnen chemische reacties nog verder onderverdelen.
Een mogelijke, veel gebruikte onderverdeling is de verdeling op basis van een verandering van de oxidatiegetallen van de elementen. We bekijken dat even aan de hand van enkele chemische reacties, waarbij we de oxidatiegetallen van de elementen in de stoffen bepalen:
De reactie tussen bakpoeder en zoutzuur 1

+ HCl → H2O + CO2 + NaCl OG: +I +I +IV -II +I -I +I -II +IV -II +I -I

Het roesten van ijzeren nagels 2
©VANIN
Fe + 3 O2 + 6 H2O → 4 Fe(OH)3 OG: 0 0 +I -II +III -II +I
Hoe bepaal je het OG van een stof? Meer info vind je op bij het extra materiaal.

De verbranding van methaan 3
CH4 + O2 → CO2 + H2O
OG: -IV +I 0 +IV -II +I -II

De vorming van stalagtieten en stalagmieten 4
©VANIN
Subscripts bij stoffen in reacties:
(aq) = opgelost in water
(v) of (s) = vast
(vl) of (l) = vloeibaar
(g) = gasvormig
Ca(HCO3)2 → CaCO3 + H2CO3
OG: +II +I +IV -II +II +IV -II +I +IV -II
Als we reactie 2 en 3 bekijken, dan zien we dat sommige elementen van oxidatiegetal veranderen, terwijl andere elementen niet van oxidatiegetal veranderen. Zo is in reactie 2 het oxidatiegetal van ijzer voor de reactie nul, terwijl het na de reactie gelijk is aan +III. Het element zuurstof heeft een oxidatiegetal 0 voor de reactie, maar een oxidatiegetal –II na de reactie. We noemen dat soort chemische reacties redoxreacties. Bij een redoxreactie hoeven niet alle elementen van oxidatiegetal te veranderen. Zo wijzigt het OG van het element H in reactie 2 niet.
Bij reactie 1 en 4 zien we dat het oxidatiegetal van elk van de elementen, voor en na de reactie, niet verandert. Zo is het oxidatiegetal van natrium in de stof NaHCO3 en in de stof NaCl gelijk aan +I. En dat geldt voor alle elementen in die reacties. Er worden echter wel nieuwe (andere) stoffen gevormd. We noemen dat ionuitwisselingsreacties
2 Classificatie ionuitwisselingsreacties aan de hand van waarnemingen
Binnen de ionuitwisselingsreacties kunnen we nog een verder onderscheid maken op basis van de eigenschappen van de gevormde producten:
1 Een neerslagreactie kun je herkennen aan de vorming van een neerslag (een slecht oplosbare stof) op de bodem van je proefbuis. In een chemische reactie wordt dat voorgesteld met een pijl naar beneden (↓) achter de chemische formule van de stof die neerslaat. In een reactievergelijking kan dat ook aangeduid worden met de subscripts (v) of (s) bij de stof.
2 Een gasontwikkelingsreactie kun je herkennen aan het ontsnappen van gasbelletjes uit de proefbuis. In een chemische reactie wordt dat voorgesteld met een pijl naar boven (↑) achter de chemische formule van de stof die ontsnapt. In een reactievergelijking kan dat ook aangeduid worden met het subscript (g) bij de stof.
3 Een neutralisatiereactie is een reactie tussen een zuur en een base waarbij water gevormd wordt.
07 LABO
Opmerkingen:
Sommige chemische reacties kunnen ook een combinatie van de bovenstaande reacties vertonen en bijvoorbeeld zowel een neerslag vormen als een neutralisatiereactie zijn. We komen hier in het volgende hoofdstuk op terug.
—Ook bij redoxreacties kunnen er gassen gevormd worden. Op die manier zou je de redoxreacties dus ook kunnen indelen bij de gasontwikkelingsreacties. Dat toont nogmaals aan dat chemie niet helemaal zwart-wit is.
—Een reactie tussen een zuur en een base kan leiden tot een neutrale oplossing (pH = 7).
De term neutralisatie verwijst echter naar de H+-ionen die samen met de OH--ionen water vormen en niet naar een neutrale pH
VOORBEELD ‒ CLASSIFICEREN VAN IONUITWISSELINGSREACTIES
1 De reactie tussen zoutzuur en zilvernitraat in waterig midden:
HCl (aq) + AgNO3 (aq) → HNO3 (aq) + AgCl (s)
De afkorting (aq) bij de stoffen toont aan dat de stoffen goed oplossen in water (en de componenten dus vrije ionen vormen in water).
De afkorting (s) bij de stof zilverchloride toont aan dat die stof onder zijn vaste vorm voorkomt in water. Dat wil zeggen dat het een neerslag vormt.
Een andere manier van noteren is als volgt: HCl + AgNO3 → HNO3 + AgCl ↓
Dat is een voorbeeld van een neerslagreactie
2 De reactie tussen zoutzuur en bakpoeder in waterig midden:
HCl (aq) + NaHCO3 (aq) → H2O + CO2 (g) + NaCl (aq)
Het subscript (aq) achter de stoffen toont aan dat de stoffen goed oplossen in water (en de componenten dus vrije ionen vormen in water).
Bij de stof H2O (water) staat geen subscript, aangezien dat het oplosmiddel zelf is.
Het subscript (g) bij de stof koolstofdioxide toont aan dat die stof als een gas voorkomt, en dus zal ontsnappen uit de oplossing.
©VANIN
Een andere manier van noteren is als volgt: HCl + NaHCO3 → H2O + CO2 ↑ + NaCl
Dat is een voorbeeld van een gasontwikkelingsreactie
3 De reactie tussen zoutzuur en natriumhydroxide in waterig midden:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O
Het subscript (aq) achter de stoffen toont opnieuw aan dat de stoffen goed oplossen in water (en de componenten dus vrije ionen vormen in water).
Daarnaast zien we dat er, door de reactie tussen een zuur (HCl) en een base (NaOH) water wordt gevormd.
Een andere manier van noteren is als volgt: HCl + NaOH → NaCl + H2O
Dat is een voorbeeld van een neutralisatiereactie.
©VANIN
fysisch proces
chemische reactie andere stoffen gevormd na reactie
ionuitwisselingsreactie OG elementen verandert niet neerslagreactie na reactie: slecht oplosbare stof gevormd die naar de bodem zakt ↓ of indicatie (s) of (v) achter de stof in de reactievergelijking
gasontwikkelingsreactie na reactie: gas gevormd dat uit de oplossing ontsnapt ↑ of indicatie (g) achter de stof in de reactievergelijking
redoxreactie
OG bepaalde elementen verandert na reactie
neutralisatiereactie: reactie tussen zuur en base waarbij water gevormd wordt
AAN DE SLAG
Gaat het om een ionuitwisselingsreactie of redoxreactie? Tip: Controleer aan de hand van de oxidatiegetallen!
a SO3 + H2O → H2SO4
b Cl2 + H2S → 2 HCl + S
c NaOH + HCl → H2O + NaCl
d 4 Fe + 3 O2 → 2 Fe2O3
e 2 CuS + 3 O2 → 2 CuO + 2 SO2
f H2CO3 → H2O + CO2
g 2 H2 + O2 → 2 H2O
h AgNO3 + NaCl → AgCl + NaNO3
i H+ + OH- → H2O
j 2 Al2O3 → 4 Al + 3 O2
Welke soort ionuitwisselingsreactie wordt hier voorgesteld:
—een gasontwikkelingsreactie;
—een neerslagreactie;
—een neutralisatiereactie.
a Grotvorming: stalagmieten en stalactieten worden gevormd door de aanwezigheid van Ca2+- en CO32- -ionen in het insijpelende regenwater.

d Als je zoutzuur op een stuk marmer (calciumcarbonaat) giet, ontstaat een gas. Wanneer dat gas door kalkwater wordt geleid, wordt het kalkwater troebel.
CaCO3 (aq) + HCl (aq) → H2O + CO2 (g) + CaCl2 (aq)
e In draagbare blusapparaten wordt natriumcarbonaat in combinatie met zoutzuur gebruikt. Door reactie met zoutzuur ontstaat koolstofdioxide.
©VANIN
b De reactie tussen looddinitraat en kaliumjodide in waterig midden.
2 KI (aq) + Pb(NO3)2 (aq) → PbI2 (s) + 2 KNO3 (aq)
c Het opsporen van chloride-ionen in water door de toevoeging van zilvernitraat.
2 AgNO3 + CaCl2 → 2 AgCl ↓+ Ca(NO3)2
Na2CO3 + HCl → H2O + CO2 ↑+ NaCl
f Een oplossing van gebluste kalk (calciumhydroxide) en waterstofnitraat worden samengevoegd. Wat neerslag of gasvorming betreft, is er niets waarneembaar.
Ca(OH)2 + 2 HNO3 → 2 H2O + Ca(NO3)2


Ionuitwisselingsreacties van dichtbij bekeken
In het eerste hoofdstuk heb je de ionuitwisselingsreacties leren herkennen. We maakten een onderscheid tussen gasontwikkelingsreacties, neerslagreacties en neutralisatiereacties. Maar kunnen we die 3 soorten reacties ook zelf voorspellen en uitschrijven?
LEERDOELEN
L met een oplosbaarheidstabel voorspellen of een combinatie van stoffen leidt tot een onoplosbare stof
L de vergelijking van een neerslagreactie opstellen
L de vergelijking van een gasontwikkelingsreactie opstellen
L de vergelijking van een neutralisatiereactie opstellen
L chemische reacties classificeren als neerslag-, gasontwikkelings- of neutralisatiereactie
1 Algemene notatie van ionuitwisselingsreacties
1.1
Visuele weergave
De verschillende ionuitwisselingsreacties kunnen we voorstellen door middel van een visuele weergave. Als we waterige oplossingen van 2 elektrolyten AB en CD samenvoegen, dan brengen we 4 ionen samen in eenzelfde reactievat: A+, B-, C+ en D-. In dat reactievat kunnen de negatieve ionen van de ene stof een verbinding maken met de positieve ionen van de andere stof (en omgekeerd). De interacties die kunnen optreden zijn:
1 Neerslagreacties
De nieuwe combinatie is een stof die weinig oplost in water. We merken een troebeling die na een tijdje naar de bodem zakt, bezinkt en een neerslag vormt.
2 Gasontwikkelingsreacties
De nieuwe combinatie is een gas dat weinig oplost in water. We merken gasbelletjes op die uit de oplossing opstijgen.
98 Visuele weergave neerslagreactie
99 Visuele weergave gasontwikkelingsreactie
3 Neutralisatiereacties
Bij het samenvoegen van een zuur (pH < 7) en een base (pH > 7) combineren de waterstofionen (H+) van het zuur met de hydroxide-ionen (OH-) van het hydroxide tot water (H2O).
Opmerkingen:
Afb. 100 Visuele weergave neutraliteitsreactie
—Het is ook mogelijk dat alle ionen een nieuwe combinatie aangaan. In dat geval gebeuren er gelijktijdig 2 chemische reacties.
—Het kan ook zijn dat er geen chemische reactie optreedt. De stoffen worden dan alleen gemengd, wat een fysisch proces is. Er ontstaat geen nieuwe combinatie tussen de tegengesteld geladen ionen (alle ionen blijven gedissocieerd in de oplossing).
Afb. 101 Visuele weergave fysisch proces
1.2 Weergave met behulp van reactievergelijkingen
Ionuitwisselingsreacties kunnen, naast een visuele weergave, ook in 3 soorten reactievergelijkingen weergegeven worden:
1 de stoffenreactievergelijking (SR) = reactievergelijking waarbij alle stoffen als formule worden weergegeven in de reactie
2 de ionenreactievergelijking (IR) = reactievergelijking waarbij alle stoffen die dissociëren of ioniseren ook als ionen worden weergegeven in de reactie
3 de essentiële reactievergelijking (ER) = reactievergelijking waarbij alleen de ionen die een nieuwe stof vormen, behouden blijven.
©VANIN
Hoe weet je of een stof slecht oplost in water? Dat leer je in het volgende onderdeel.
Opmerkingen in verband met de essentiële reactievergelijking:
—In het geval van een neerslagreactie zijn dat de ionen die de neerslag vormen. In het geval van de gasontwikkelingsreactie zijn het de ionen die het gas vormen. En bij een neutralisatiereactie is de essentiële reactievergelijking altijd dezelfde: het zijn altijd H+- en OH- -ionen die samen combineren tot de vorming van water.
—Als er tijdens een chemische reactie geen neerslag, gas of water gevormd wordt, dan zal er ook geen essentiële reactie optreden.
—Zoals eerder vermeld, kunnen er tegelijkertijd 2 ionuitwisselingsreacties plaatsvinden. Je noteert dan ook beide essentiële reactievergelijkingen afzonderlijk.
Om de correcte reactievergelijkingen van een ionuitwisselingsreactie te noteren, doorloop je het volgende stappenplan:
STAP 1: Noteer de dissociatie/ionisatievergelijkingen van de reagentia.
©VANIN
STAP 2: Combineer de vrije ionen tot nieuwe verbindingen. Zorg dat de wet van behoud van atomen gerespecteerd wordt en denk aan de kruisregel bij de vorming van hydroxiden en zouten (zie thema 01). Noteer welke reactieproducten slecht oplosbaar zijn (neerslag of gas) en noteer in de vergelijking met een ↓ (neerslag) of ↑ (gas).
Je noteerde nu de stoffenreactievergelijking (SR)
STAP 3: De vrije ionen die aanleiding geven tot de neerslag, het gas of water, zijn de componenten die als stof behouden blijven in de ionenreactievergelijking. De andere vrije ionen blijven onder hun ion-vorm in de vergelijking staan.
Je noteerde nu de ionenreactievergelijking (IR).
STAP 4: Vereenvoudig de ionenreactievergelijking en behoud alleen de onderdelen die aanleiding geven tot de neerslag, het gas of de vorming van water.
Dat is de essentiële reactievergelijking (ER)
VOORBEELD REACTIEVERGELIJKING IONUITWISSELINGSREACTIE
De reactie tussen zoutzuur (HCl) en zilvernitraat (AgNO3) zorgt voor de vorming van het zuur waterstofnitraat (HNO3) en de neerslag zilverchloride (AgCl).
STAP 1
We bekijken eerst de reagentia: HCl is een zuur, dus spreken we van een ionisatievergelijking
AgNO3 als zout dissocieert in ionen volgens de dissociatievergelijking
2
We bekijken de reactieproducten: H+ kan reageren met NO3- ter vorming van het zuur HNO3
Ag+ vormt met Cl- het slecht oplosbaar zout AgCl. We noteren dat dus als een neerslag in de stoffenreactievergelijking.
3
We gaven aan dat het zuur HNO3 werd gevormd. Zuren ioniseren echter in water, waardoor de ionen H+ en NO3- als vrije ionen naast elkaar blijven bestaan.
We noteren dat dan in een ionenreactievergelijking
STAP 4
Als we de ionenreactievergelijking vereenvoudigen, dan bekomen we de essentiële reactievergelijking.
In de ionenreactievergelijking zien we dat alleen de ionen Ag+ en Cl- tot een nieuwe stof reageren.
Opmerking:
©VANIN
H+ + Cl- + Ag+ + NO3- → H+ + NO3- + AgCl ↓
Ag+ + Cl- → AgCl ↓
Je ziet dat je de ER gemakkelijk kan afleiden uit de IR door de gelijke ionen links en rechts van de reactiepijl te schrappen.
IR: H+ + Cl- + Ag+ + NO3- → H+ + NO3- + AgCl ↓ ↓
ER: Ag+ + Cl- → AgCl ↓
HCl → H+ + Cl-
AgNO3 → Ag+ + NO3-
SR: HCl + AgNO3 → HNO3 + AgCl ↓
STAP
IR:
STAP
ER:
2 Neerslagreacties
2.1 Oplosbaarheid in water: gebruik van de oplosbaarheidstabel
Wanneer we kijken naar reacties met stoffen in water, is het belangrijk om te weten welke stoffen effectief vrije ionen vormen in water en welke stoffen slecht oplosbaar zijn (en dus geen vrije ionen zullen vormen). Een globale indeling voor oplosbaarheid is:
goed oplosbaar: > 10 g L
matig oplosbaar: 1 - 10 g L
slecht oplosbaar: < 1 g L
©VANIN
De oplosbaarheid van stoffen kan worden beïnvloed door externe factoren zoals temperatuur. De oplosbaarheid van vaste stoffen is groter bij een hogere temperatuur. Voor gassen geldt het tegenovergestelde. Aangezien een hogere temperatuur ervoor zorgt dat de moleculen sneller bewegen, betekent dat dat ze makkelijker uit de oplossing kunnen ontsnappen.
De volgende tabel geeft een overzicht van de oplosbaarheid van verbindingen in water. Deze tabel werd via experimentele vaststellingen opgesteld en mag je altijd gebruiken. Je vindt ze ook op de coverflap van je leerboek.
Verbindingen Goed oplosbaar Slecht oplosbaar verbindingen met Na+ verbindingen met K+ verbindingen met NH4+ alle alle alle
Zouten van:
nitraat (NO3-) bromide (Br-) chloride (Cl-) jodide (I-) sulfaat (SO42-) sulfiet (SO32-) sulfide (S2-) fosfaat (PO43-) carbonaat (CO32-)
alle
alle, behalve → alle, behalve → alle, behalve → alle, behalve →
Na+, K+, NH4+
Na+, K+, NH4+, Mg2+, Ba2+, Ca2+ Na+, K+, NH4+
Na+, K+, NH4+
Ag+, (Hg+, Pb2+: matig)
Ag+, (Hg+, Pb2+: matig)
Ag+, (Hg+, Hg2+ en Pb2+: matig)
Ba2+, (Pb2+, Ca2+: matig)
Fe2+, Zn2+, Cu2+, Ca2+, Pb2+, Hg+, Ag+, (Mg2+: matig)
alle andere alle andere alle andere
hydroxide (OH-)groep IA, beperkter voor groep IIA andere groepen
Tabel 6 Oplosbaarheidstabel
VOORBEELD OPLOSBAARHEID ZOUTEN
Zijn deze zouten goed oplosbaar in water of zullen ze een neerslag vormen?
Magnesiumsulfaat
—symbolische voorstelling: MgSO4
—MgSO4 is een combinatie van de ionen Mg2+ en SO42-.
—Wanneer we de oplosbaarheidstabel bekijken, zien we dat de combinatie een goed oplosbaar zout is.
Zilverchloride
—symbolische voorstelling: AgCl
—AgCl is een combinatie van de ionen Ag+ en Cl-.
—Wanneer we de oplosbaarheidstabel bekijken, zien we dat de combinatie een slecht oplosbaar zout geeft. Het zal dus een neerslag vormen in water.
Ammoniumsulfide
—symbolische voorstelling: (NH4)2S (NH4)2S is een combinatie van de ionen NH4+ en S2-
—Wanneer we de oplosbaarheidstabel bekijken, zien we dat alle zouten van NH4+ goed oplosbaar zijn in water.
2.2 Neerslagreacties opstellen
Bij het samenvoegen van oplossingen kunnen positieve en negatieve ionen nieuwe verbindingen vormen. Die reactie noemen we een ionenuitwisselingsreactie. Die nieuwe verbindingen kunnen een slecht oplosbaar zout vormen. In dat geval ontstaat er een neerslag. De reactie noemen we dan een neerslagreactie. Er kunnen tegelijkertijd ook 2 nieuwe slecht oplosbare zouten gevormd worden. Met behulp van het stappenplan en de oplosbaarheidstabel kunnen we de bijbehorende vergelijkingen opstellen.
©VANIN
VOORBEELD LOODDINITRAAT EN KALIUMJODIDE
Als een oplossing van looddinitraat wordt samengevoegd met een kaliumjodide-oplossing, ontstaat een gele neerslag.
STAP 1 Noteer de dissociatie/ionisatievergelijkingen van de reagentia.
Beide reagentia zijn zouten, dus we noteren de dissociatievergelijking van beide stoffen:
Dissociatievergelijking kaliumjodide: Dissociatievergelijking looddinitraat:
©VANIN
STAP 2 Noteer de stoffenreactievergelijking.
We bekijken de reactieproducten: K+ kan reageren met NO3- ter vorming van het goed oplosbare zout KNO3. In de oplosbaarheidstabel zien we immers dat alle zouten met K+ goed oplosbaar zijn.
Pb2+ vormt met I- het slecht oplosbaar zout PbI2 (zoals we zien in de oplosbaarheidstabel).
We noteren dat dus als een neerslag in de stoffenreactievergelijking. Daarnaast houden we ook rekening met de wet van behoud van atomen.
STAP 3 Noteer de ionenreactievergelijking.
We gaven aan dat het goed oplosbare zout KNO3 werd gevormd, dat wil zeggen dat de ionen K+ en NO3- als vrije ionen naast elkaar blijven bestaan.
De ionenreactievergelijking ziet er dan als volgt uit:
STAP 4 Noteer de essentiële reactievergelijking.
Vereenvoudigen we de ionenreactievergelijking, dan bekomen we de essentiële reactievergelijking.
In de ionenreactievergelijking zien we dat alleen de ionen Pb2+ en I- tot een nieuwe stof reageren, waardoor de essentiële reactievergelijking van die reactie als volgt wordt genoteerd:
KI → K+ + IPb(NO3)2 → Pb2+ + 2 NO3-
SR: 2 KI + Pb(NO3)2 → 2 KNO3 + PbI2 ↓
IR: 2 K+ + 2 I- + Pb2+ + 2 NO3- → 2 K+ + 2 NO3- + PbI2 ↓
ER: Pb2+ + 2 I- → PbI2 ↓
Dankzij de typische kleur van bepaalde neerslagen worden neerslagreacties gebruikt om de aanwezigheid van bepaalde ionen aan te tonen. De neerslagreactie op afbeelding 102 laat bijvoorbeeld toe om Pb2+-ionen in bodemstalen te identificeren door toevoeging van een KIoplossing. Omgekeerd kan door middel van een Pb(NO3)2-oplossing de aanwezigheid van I– worden aangetoond. De aanwezigheid van Pb2+-ionen in bodemstalen of in je drinkwater is niet gewenst: In het oude Rome stierven de rijken vaak eerder dan de arme inwoners. Toch hadden rijke Romeinen veel meer nutsvoorzieningen, terwijl de armen op elkaar gepakt in kazernes woonden. Wat bleek nu?
De rijke Romeinen gebruikten loden buizen om het drinkwater in hun woningen binnen te brengen. Velen stierven dan ook een pijnlijke dood door loodvergiftiging.
3 Gasontwikkelingsreacties
3.1 Veelvoorkomende gassen in chemische reacties
Om een chemische reactie te herkennen als een ionuitwisselingsreactie waarbij een gas gevormd wordt, is het belangrijk om te weten welke stoffen gassen zijn. Hieronder vind je een tabel met veel voorkomende gassen die bij chemische reacties ontstaan en die je moet onthouden
Formule
Naam
H2 waterstofgas – diwaterstof
O2 zuurstofgas – dizuurstof
N2 stikstofgas – distikstof
Cl2 chloorgas – dichloor
H2S waterstofsulfide
CO2 koolzuurgas - koolstofdioxide
NH3 ammoniak
SO2 zwaveldioxide
©VANIN
NO2 stikstofdioxide
Tabel 7 Veelvoorkomende gassen die ontstaan bij chemische reacties
Onthoud bovendien dat sommige moleculen, in een waterige oplossing, spontaan ontbinden Zo treden de volgende chemische reacties (spontaan) op in waterig midden:
—De ontleding van waterstofcarbonaat: H2CO3 → H2O + CO2↑
—De ontleding van ammoniumhydroxide: NH4OH → H2O + NH3↑
3.2 Gasontwikkelingsreacties opstellen
Bij het samenvoegen van oplossingen kunnen positieve en negatieve ionen nieuwe verbindingen vormen. Die nieuwe verbindingen kunnen gassen zijn. In dat geval spreken we van een gasontwikkelingsreactie. Die reactie kunnen we, via het stappenplan op p. 158, opstellen.
VOORBEELD CALCIUMCARBONAAT (CaCO3) EN ZOUTZUUR (HCl)
Als je zoutzuur op een stuk marmer (calciumcarbonaat) giet, dan ontstaat er een gas. Wanneer we dat gas door kalkwater leiden, wordt het kalkwater troebel. Dat is een indicatie dat er CO2gas werd gevormd.
STAP 1 Noteer de dissociatie/ionisatievergelijkingen van de reagentia.
—dissociatievergelijking:
—ionisatievergelijking:
STAP 2 Noteer de stoffenreactievergelijking.
We bekijken de reactieproducten:
Ca2+ kan reageren met Cl- ter vorming van het goed oplosbare zout CaCl2, zoals we in de oplosbaarheidstabel zien.
2 H+ vormt met CO32- het zuur H2CO3, dat in water ontleedt in H2O en CO2-gas.
We noteren dat dus als een gas in de stoffenreactievergelijking. Daarnaast houden we ook rekening met de wet van behoud van atomen.
STAP 3 Noteer de ionenreactievergelijking.
We gaven aan dat het goed oplosbare zout CaCl2 werd gevormd, dat wil zeggen dat de ionen Ca2+ en Cl- als vrije ionen naast elkaar blijven bestaan.
De ionenreactievergelijking ziet er dan als volgt uit:
STAP 4 Noteer de essentiële reactievergelijking.
CaCO3 → Ca2+ + CO32HCl → H+ + Cl-
©VANIN
Als we de ionenreactievergelijking vereenvoudigen, dan bekomen we de essentiële reactievergelijking:
In de ionenreactievergelijking zien we dat alleen de ionen 2 H+ en CO32- tot een nieuwe stof reageren, waardoor de essentiële reactievergelijking van die reactie als volgt wordt genoteerd:
CaCO3 + 2 HCl → (H2CO3 + CaCl2) → H2O + CO2 ↑ + CaCl2
IR: Ca2+ + CO32- + 2 H+ + 2 Cl→ H2O + CO2 ↑ + Ca2+ + 2 Cl-
ER: 2 H+ + CO32- → H2O + CO2 ↑
SR:
Monumenten bedreigd door zuren

Veel gebouwen, monumenten en beeldhouwwerken zijn gemaakt uit kalksteen of marmer. Beide gesteenten bestaan uit calciumcarbonaat (CaCO3), maar kalksteen is minder hard dan marmer. Onze hedendaagse levenswijze vormt een bedreiging voor eeuwenoude monumenten.
Bij de verbranding van zwavelhoudende brandstoffen zoals steenkool, stookolie en diesel komt naast koolstofdioxide namelijk ook zwaveldioxide vrij. Zwaveldioxide reageert langzaam met zuurstofgas tot zwaveltrioxide, dat met water het sterke zuur zwavelzuur (of waterstofsulfaat: H2SO4) vormt.
Bij de reactie van zwavelzuur met kalksteen of marmer ontstaan koolstofdioxide en poedervormig calciumsulfaat (gips). Ook dat kunnen we weer op 3 manieren weergeven als reactievergelijkingen.
We beginnen met de ionisatie/dissociatievergelijking van beide producten in water: dissocatievergelijking: CaCO3 → Ca2+ + CO32—ionisatievergelijking: H2SO4 → 2 H+ + SO42-
Nieuwe combinaties die kunnen worden gevormd, zijn H2CO3 en CaSO4.
Zoals je al weet, is H2CO3 een molecule die in water spontaan ontbindt tot H2O en CO2 (gas), terwijl CaSO4 een matig oplosbaar zout is. We bekomen dan de volgende 3 reactievergelijkingen:
SR: CaCO3 + H2SO4 → H2CO3 + CaSO4↓ → H2O + CO2↑+ CaSO4↓
©VANIN
IR: Ca2+ + CO32- + 2H+ + SO42- → H2CO3 + CaSO4↓ → CaSO4↓+ H2O + CO2↑
ER (gasontwikkeling): CO32- + 2 H+ → H2O + CO2↑
ER (neerslag): Ca2+ + SO42- → CaSO4↓
Zo wordt de kalksteen van monumenten door zuren omgezet in een poeder en een gas waardoor ze meer en meer worden aangetast. Een middel om de schade te herstellen, is het aanbrengen van kunststoffen. Die duurzame ingreep voor de verdere bewaring van ons erfgoed noemt men consolidatie door steenversteviging.
Afb. 103 De Menenpoort in Ieper
ontdekplaat: pH Als er tijdens een neutralisatiereactie ook een onoplosbaar zout wordt gevormd, dan zal er naast de ER voor de neutralisatie ook een essentiële reactievergelijking voor de neerslag-reactie zijn. We noteren dan ook beide essentiële reactievergelijkingen onder elkaar.
4 Neutralisatiereacties
Het derde type van ionuitwisselingsreacties zijn de neutralisatiereacties: een reactie tussen een zuur en een base waarbij water gevormd wordt.
In het woord neutralisatiereactie herken je het begrip neutraal, dat je al eerder tegenkwam in thema 01 toen je het begrip pH leerde kennen. In thema 04 leerde je ook dat de pH-waarde afhankelijk is van de hoeveelheid H+- en OH--ionen in de oplossing
Gedestilleerd water wordt een neutrale oplossing genoemd, omdat de hoeveelheid H+- en OH--ionen aan elkaar gelijk is (pH = 7). Wanneer we H+-ionen toevoegen aan het water, krijgen we een zure oplossing. Het toevoegen van OH--ionen leidt tot een basische of alkalische oplossing.
©VANIN
Een neutralisatiereactie is dan ook een reactie tussen een zuur (H+-ionen) en een base (OH--ionen), waarbij de H+-ionen en OH--ionen elkaar neutraliseren door de vorming van water Daarom wordt de reactie vaak ook een zuur-basereactie genoemd
Om de correcte reactievergelijkingen van een neutralisatiereactie te noteren, gebruiken we opnieuw hetzelfde stappenplan. Maar bij een neutralisatiereactie is de essentiële reactievergelijking steeds dezelfde: het zijn namelijk steeds H+- en OH- -ionen die samen combineren tot de vorming van water
VOORBEELD GEBLUSTE KALK EN ZWAVELZUUR
Weiden, grasvelden of akkers die te zuur zijn, kunnen behandeld worden met basisch reagerende stoffen zoals gebluste kalk (Ca(OH)2). Die gebluste kalk neutraliseert de H+-ionen die aanwezig zijn in de zure bodem. We bekijken een eenvoudig voorbeeld van zwavelzuur (als bron van H+-ionen).
STAP 1
Gebluste kalk (als hydroxide) gaat dissociëren in water, terwijl zwavelzuur zal ioniseren in water. Dat geeft de volgende reactievergelijkingen:
—dissociatie gebluste kalk —ionisatie zwavelzuur
STAP 2
We bekijken de reactieproducten:
Ca2+ kan reageren met SO42- ter vorming van het goed oplosbare zout CaSO4 (zie oplosbaarheidstabel).
H+ en OH- vormen samen water.
We kunnen nu de stoffenreactievergelijking noteren.
→ Ca2+ + 2 OHH2SO4 → 2 H+ + SO42-
Ca(OH)2
SR: Ca(OH)2 + H2SO4 → CaSO4 + 2 H2O
STAP 3
We gaven aan dat het goed oplosbare zout CaSO4 werd gevormd. Dat wil zeggen dat de ionen Ca2+ en SO42- als vrije ionen naast elkaar in de oplossing blijven bestaan.
We kunnen nu de ionenreactievergelijking noteren.
STAP 4
We vereenvoudigen ten slotte de ionenreactievergelijking en behouden dan de essentiële reactievergelijking van deze neutralisatiereactie: —neutralisatiereactie: —neerslagreactie
IR: Ca2+ + 2 OH- + 2 H+ + SO42- → Ca2+ + SO42- + 2 H2O
ER: 2 H+ + 2 OH- → 2 H2O
ER: Ca2+ + SO42- → CaSO4
Ionuitwisselingsreacties worden steeds volgens hetzelfde stappenplan uitgeschreven (zie p. 158).
neerslagreacties → de nieuw gevormde stof is slecht oplosbaar in water → gebruik de oplosbaarheidstabel op p. 160
gasontwikkelingsreacties → de nieuw gevormde stof is een gas
H2CO3 → H2O + CO2↑ NH4OH → H2O + NH3↑
neutralisatiereacties → H+-ionen en OH--ionen vormen samen H2O → de essentiële reactievergelijking is steeds: H++ OH- → H2O

©VANIN
Om te voorkomen dat het industrieel afvalwater met een (te) hoge of (te) lage pH zou geloosd of hergebruikt worden, wordt het geneutraliseerd. Bij dat neutraliseren wordt, in tegenstelling tot wat je zou denken, het water niet noodzakelijk op een pH = 7 gebracht, maar meestal op een pH tussen 6,5 en 9,5.
In de industrie is het belangrijk om het afvalwater te neutraliseren om corrosie en andere chemische reacties, die plaatsvinden bij een hoge of een erg lage pH, te vermijden. Gassen die bij zo’n ongewenste reacties kunnen vrijkomen, zijn ammoniak (NH3) en het zeer giftige blauwzuur (waterstofcyanide = HCN).
Te lage pH
Te hoge pH stoffen die afvalwater neutraliserenNaOH, Ca(OH)2 H2SO4, HCl
WEETJE
AAN DE SLAG
Bepaal of de volgende stoffen goed of slecht oplosbaar zijn in water. Noteer daarna de naam of de formule en gebruik de oplosbaarheidstabel.
a BaSO4
b zilvernitraat
c magnesiumbromide
d HgI2
e kaliumfosfaat
f ammoniumsulfaat
Vervolledig de volgende neerslagreacties. Geef hiervoor eerst de ionisatie/dissociatievergelijking van beide stoffen; de stoffenreactievergelijking, de ionenreactievergelijking en de essentiële reactievergelijking.
a Fe(NO3)3 + KOH
b CaCl2 + Na3PO4
c CuSO4 + (NH4)2S
d KBr + AgNO3
e Na3PO4 + MgSO4
Vervolledig de volgende gasontwikkelingsreacties
Geef hiervoor eerst de ionisatie-/ dissociatievergelijking van beide stoffen; de stoffenreactievergelijking, de ionenreactievergelijking en de essentiële reactievergelijking.
a Na2CO3 + HCl
b MgS + HNO3
c H3PO4 + K2CO3
d ZnCO3 + HNO3
Vervolledig de volgende neutralisatiereacties
Geef hiervoor eerst de ionisatie/ dissociatievergelijking van beide stoffen; de stoffenreactievergelijking, de ionenreactievergelijking en de essentiële reactievergelijking.
a HNO3 + KOH
b H3PO4 + LiOH
c NH4OH + H2S
d NaOH + H2SO4
e KOH + HBr
Geef aan welke soort ionuitwisselingsreactie optreedt. Geef hiervoor eerst de ionisatie/ dissociatievergelijking van beide stoffen; de stoffenreactievergelijking, de ionenreactievergelijking en de essentiële reactievergelijking(en).
a BaCl2 + Na2CO3
b Co(NO3)2 + MgS
c HCl + Na2CO3
d CaCl2 + H2SO4
e HNO3 + NH4OH
In het labo van een groot bedrijf is van enkele recipiënten het etiket van de fles gevallen. De etiketten liggen allemaal op de grond en je leest dat ze de volgende zouten bevatten:
—kopersulfaat
—bariumdihydroxide
—magnesiumdinitraat
—dinatriumcarbonaat
Om uit te zoeken welke stof in welke fles zit, mag je gebruik maken van 3 extra stoffen:
—HBr
—Ca(OH)2
—K2CO3
Stap 1: Geef de chemische formules van de gekende zouten:
a Kopersulfaat
b Bariumdihydroxide
c Magnesiumdinitraat
d Dinatriumcarbonaat
Stap 2: Combineer de 3 extra stoffen met de 4 al gekende zouten.
a Noteer in een tabel of er een gasontwikkelingsreactie (↑), neerslagreactie (↓) of neutralisatiereactie (H2O-vorming; reactie tussen zuur en base) optreedt. Treedt er geen reactie op, dan noteer je /.
b Noteer welke stof gevormd wordt.
Stap 3: Kun je nu met 100 % zekerheid besluiten welke stof in welke fles zit? Leg uit.
HOOFDSTUK 3
Redoxreacties van dichtbij bekeken
Je hebt de ionuitwisselingsreacties van naderbij bekeken: neerslagreacties, gasontwikkelingsreacties en neutralisatiereacties hebben geen geheimen meer voor jou. Maar je zag in hoofdstuk 1 ook nog redoxreacties: reacties waarbij het oxidatiegetal van bepaalde elementen verandert.
LEERDOELEN
L een eenvoudige redoxreactie ontleden en de begrippen oxidator, reductor, oxidatie, reductie en elektronenoverdracht hierbij gebruiken
L een eenvoudige redoxreactievergelijking tussen enkelvoudige stoffen opstellen
1 Redoxreacties ontleden
In hoofdstuk 1 zagen we 2 reacties (het roesten van ijzeren nagels en het verbranden van methaangas) waarbij het oxidatiegetal van bepaalde elementen veranderde. Die verandering kan op 2 manieren gebeuren:
—Wanneer het oxidatiegetal van een element stijgt, wilt dat zeggen dat het element elektronen heeft afgegeven = oxidatie
—Wanneer het oxidatiegetal van een element daalt, wilt dat zeggen dat het element elektronen heeft opgenomen = reductie.
Merk op dat oxidatie en reductie hand in hand gaan: het ene element kan pas elektronen afstaan als er een ander element is dat elektronen wilt opnemen. Je kunt dus alleen een oxidatie hebben als er ook een reductie is, vandaar de naam redoxreactie (reductie-oxidatie). Concreet draagt het ene element een of meerdere elektronen over aan het andere element. Daarom worden die chemische reacties elektronenoverdrachtreacties genoemd.
We gebruikten de termen oxidatie (waarbij een element in een stof stijgt in OG) en reductie (waarbij een element in een stof daalt in OG) al.
©VANIN
De stoffen die de oxidatie en reductie ondergaan, krijgen ook een specifieke naam:
1 reductor
= stof waarin een element in oxidatiegetal stijgt
= stof die geoxideerd wordt
= stof die elektronen overdraagt aan een andere stof: de andere stof doet reduceren
2 oxidator
= stof waarin een element in oxidatiegetal daalt
= stof die gereduceerd wordt
= stof die elektronen onttrekt van een andere stof: de andere stof laat oxideren
Om het makkelijk te onthouden, denk je maar aan het woord ‘reductie’ of afprijzing tijdens de solden: tijdens de solden daalt de prijs.
De reductor ondergaat een oxidatie. De oxidator ondergaat een reductie.
Bekijk de ontdekplaat en ontdek verschillende redoxreacties uit het dagelijkse leven.
ontdekplaat: redoxreacties
demovideo: verbranden van koper
Er zijn ook elementen die in die nieuwe soort reactie niet betrokken zijn en niet van OG veranderen.
VOORBEELD ROESTEN VAN IJZER
We bekijken een van de reacties uit hoofdstuk 01 opnieuw, namelijk het roesten van een ijzeren nagel. We bepaalden hier eerst het OG van elk van de atoomsoorten.
4 Fe + 3 O2 + 6 H2O → 4 Fe(OH)3
OG: 0 0 +I -II +III -II +I
We passen de nieuwe begrippen toe op de reactievergelijking.
©VANIN
—Het oxidatiegetal van het element ijzer stijgt van 0 (in de stof Fe) naar +III (in de stof Fe(OH)3) door 3 elektronen af te geven. Fe ondergaat dus een oxidatie en is zelf de reductor
—Het oxidatiegetal van het element zuurstof in de stof O2 daalt van 0 naar -II in Fe(OH)3 door 2 elektronen op te nemen. O2 wordt dus gereduceerd (ondergaat een reductie) en is zelf de oxidator
In die reactie zijn er 4 Fe-atomen die 3 elektronen afgeven, dus in totaal worden er 12 elektronen afgegeven. Daarnaast zijn er 6 O-atomen die 2 elektronen opnemen, dus in totaal worden er 12 elektronen opgenomen. Er worden dus evenveel elektronen afgegeven als opgenomen.
DEMO
Verbranden van koper
Werkwijze
Je leerkracht houdt een stukje rood koper in de vlam van een bunsenbrander.
Waarneming
Na de verbranding kleurt het koper zwart
We schrijven de reactievergelijking voor de verbranding van koper tot koper(II)oxide en noteren het OG van elk van de atoomsoorten:
2 Cu + O2 → 2 CuO
OG: 0 0 +II -II
—Het oxidatiegetal van het element koper stijgt van 0 naar +II door 2 elektronen op af te geven. Koper ondergaat dus een oxidatie en is zelf de reductor
—Het oxidatiegetal van het element zuurstof daalt van 0 naar -II door 2 elektronen op te nemen. Zuurstof ondergaat dus een reductie en is zelf de oxidator.
Besluit
In deze reactie zijn er 2 Cu-atomen die elk 2 elektronen afgeven, dus in totaal worden er 4 elektronen afgegeven. Daarnaast zijn er 2 O-atomen die telkens 2 elektronen opnemen, dus in totaal worden er 4 elektronen opgenomen. Er worden dus evenveel afgegeven als opgenomen.
Bij de verbranding van koper staan 2 koperatomen in totaal 4 elektronen af aan de 2 zuurstofatomen van de zuurstofgasmolecule.
We kunnen het volledige proces voorstellen in een schema:
2x omdat 2 zuurstofatomen worden gereduceerd
per zuurstofatoom worden 2 elektronen opgenomen
reductie van zuurstof
2x omdat 2 koperatomen worden geoxideerd
Schema 4 De oxidatie van koper door zuurstofgas
oxidatie van koper
per koperatoom worden 2 elektronen afgestaan
Opmerkingen: Hoewel we spreken over oxidatie, is het absoluut niet noodzakelijk dat er zuurstof in de reactie voorkomt. De definitie van oxidatie is dus ruimer, namelijk: ‘het afstaan van elektronen’, en dat kan dus evengoed met andere elementen.
2 Redoxreacties opstellen
Je bestudeerde net een aantal redoxreacties, maar hoe kun je nu zelf op een correcte manier zo’n redoxreactie aanvullen en noteren? We bekijken het onderstaande stappenplan:
Stap 1: Duid in alle brutoformules het OG van elk element aan.
Stap 2: OXIDATIE
—Teken een pijl boven de reactie vanuit de reductor.
—Zet bij de pijl 'oxidatie' en het aantal elektronen dat per element wordt afgegeven.
—Controleer of er een coëfficiënt nodig is om te voldoen aan de wet van behoud van atomen voor die stof.
©VANIN
—Vermenigvuldig, indien nodig, het aantal afgegeven elektronen met de coëfficiënt van de reductor. Je plaatst hiervoor het aantal afgegeven elektronen tussen ronde haakjes.
Stap 3: REDUCTIE
—Teken een pijl onder de reactie vanuit de oxidator.
—Zet bij de pijl 'reductie' en het aantal elektronen dat per element wordt opgenomen.
—Controleer of er een coëfficiënt nodig is om te voldoen aan de wet van behoud van atomen voor die stof.
—Vermenigvuldig, indien nodig, het aantal opgenomen elektronen met de coëfficiënt van de oxidator. Je plaatst hiervoor het aantal opgenomen elektronen tussen ronde haakjes.
reductor
oxidator
De laatste stap vervangt de tot nu gebruikte methode waarbij we de coëfficiënten aanpassen op basis van de wet van behoud van atomen. Uiteraard kun je die wet nog steeds gebruiken om je antwoord te controleren.
Stap 4: ELEKTRONENBALANS
—Vermenigvuldig voor de oxidatie en de reductie het aantal afgegeven/opgenomen elektronen met een factor zodat het aantal afgegeven elektronen gelijk is aan het aantal opgenomen elektronen. —Je plaatst hiervoor het aantal opgenomen/afgegeven elektronen tussen vierkante haakjes. —Controleer daarna of je de coëfficiënten van je reactie moet aanpassen.
VOORBEELD OPSTELLEN VAN DE REDOXREACTIE VERBRANDING VAN ALUMINIUM
Al + O2 → Al2O3
STAP 1: Duid in alle brutoformules het OG van elk element aan.
Al + O2 → Al2O3
OG: 0 0 +III –II
©VANIN
Stap 2: OXIDATIE
We zien dat er in het rechterlid een index ‘2’ bij aluminium staat. We moeten dus ook in het linkerlid een coëfficiënt ‘2’ voor Al plaatsen en het aantal afgegeven elektronen vermenigvuldigen met een factor 2.
Stap 3: REDUCTIE
We zien in het linkerlid een index ‘2’ bij zuurstof staan en in het rechterlid een index ‘3’. Het kleinste gemeen veelvoud van 2 en 3 is 6, dus we moeten het aantal opgenomen elektronen vermenigvuldigen met een factor 6. Omdat de wet van behoud van atomen klopt, moeten we in het linkerlid een coëfficiënt 3 plaatsen voor O2 en in het rechterlid een coëfficiënt 2 plaatsen voor Al2O3.
Stap 4: ELEKTRONENBALANS
We zien in de reactie dat er 6 elektronen worden afgegeven door aluminium (oxidatie) en dat er 12 elektronen worden opgenomen door dizuurstof (reductie). We moeten dus het aantal afgegeven elektronen vermenigvuldigen met een factor 2. Het aantal opgenomen elektronen vermenigvuldigen we in dit geval met een factor 1.
Hierdoor krijgen we uiteindelijk:
oxidatie: 2 ∙ (- 3 e-)
2 Al reductor + O2 → Al2O3
OG: 0 0 +III –II
oxidatie: 2 ∙ (- 3 e-)
2 Al reductor + 3 O2 oxidator → 2 Al2O3
OG: 0 0 +III –II
reductie: 6 ∙ (+ 2 e-)
4 Al-atomen
OG: 0 0 +III –II oxidatie: 2 ∙ 2 ∙ (- 3 e-)
4 Al reductor + 3 O2 oxidator → 2 Al2O3
reductie: 1 ∙ 6 ∙ (+ 2 e-)
6 O-atomen
—4 atomen aluminium → Dat klopt in het rechterlid al, maar in het linkerlid moeten we de coëfficiënt aanpassen: coëfficiënt 4 in plaats van 2.
—6 atomen zuurstof → Dat klopt al in het linkerlid en in het rechterlid.
De redoxreactie is correct aangevuld.
Een elektronenoverdrachtreactie, ook wel reductie-oxidatie-reactie of kortweg redoxreactie genoemd, is een reactie waarbij zich gelijktijdig een oxidatie en een reductie voordoen.
Oxidatie
= een chemisch proces waarbij in een stof of deeltje het OG van een element stijgt door het afstaan van elektronen
Reductor
= stof of deeltje waarin een element in OG stijgt
Reductie
= een chemisch proces waarbij in een stof of deeltje het OG van een element daalt door het opnemen van elektronen
Oxidator
= stof of deeltje waarin een element in OG daalt
= stof of deeltje dat geoxideerd wordt= stof of deeltje dat gereduceerd wordt
Er worden evenveel elektronen afgegeven door de reductor, als dat er worden opgenomen door de oxidator: de oxidator zal de reductor oxideren, en de reductor zal de oxidator reduceren.
Het opstellen van redoxreactievergelijkingen gebeurt volgens een stappenplan, zie p. 171-172.
Reddingsvesten zijn vaak uitgerust met een lampje. Bij bepaalde uitvoeringen is dat lampje via stroomdraadjes verbonden met een magnesiumstrip en een koperstrip.
Op de koperstrip is een dun laagje vast koper(I)chloride aangebracht. Koper(I)chloride is slecht oplosbaar in water.

Zodra zo’n reddingsvest in het water belandt, gaat het lampje branden. De Cu+-ionen worden omgezet in kopermetaal via de onderstaande redoxreactie. Daardoor wordt er kopermetaal afgezet op de koperstrip en verdwijnt de koper(I)chloridelaag. De elektronenoverdracht (en dus elektrische stroom) wordt hierdoor verzekerd.
Aangezien zowel CuCl als MgCl2 volledig dissociëren in water, kan die reactie ook met behulp van de ionenreactievergelijking genoteerd worden:
Mg + 2 Cu+ + 2 Cl- → Mg2+ + 2 Cl- + 2 Cu
We controleren nu even of de reactie eveneens een redoxreactie is.
Reactie: Mg + 2 Cu+ → Mg2+ + 2 Cu OG: 0 +I +II 0
Het OG van Cu daalt van +I (in Cu+) naar 0 (in Cu). Cu+ wordt gereduceerd en dus is Cu+ zelf de oxidator. Het OG van Mg stijgt van 0 (in Mg) naar +II (in Mg2+). Magnesium wordt geoxideerd en dus is magnesiummetaal de reductor.
Wanneer we die veranderingen in OG bekijken, lijkt het zo dat er een verschillend aantal elektronen reageert. Als je de volledige reactie bekijkt en rekening houdt met de voorgetallen voor de elementen, worden er wel degelijk 2 elektronen afgegeven door magnesium, die dan alle 2 worden opgenomen door de Cu+-ionen. Met andere woorden: ook hier worden evenveel elektronen afgegeven door het ene element, als er worden opgenomen door het andere element.
WEETJE
AAN DE SLAG
a Duid bij de onderstaande redoxreacties de volgende onderdelen aan:
oxidator – reductor – oxidatie – reductie
b Noteer daarna het aantal overgedragen elektronen.
a Cl2 + H2S → 2 HCl + S
b 4 Fe + 3 O2 → 2 Fe2O3
c 2 CuS + 3 O2 → 2 CuO + 2 SO2
d 2 H2 + O2 → 2 H2O
e 2 Al2O3 → 4 Al + 3 O2
Vul de volgende reactievergelijkingen aan. Het is de bedoeling dat jij de vergelijking telkens aanvult volgens de regels van de kunst:
—Vermeld onder elk element het OG.
—Benoem de oxidatie en reductie.
—Noteer de elektronenoverdracht en vervolledig de reactievergelijking.
—Duid de oxidator en reductor aan.
a P4 + O2 → P2O5
b Na + Cl2 → NaCl
c CuO + Mg → Cu + MgO
d Sn2+ + Br2 → Sn4+ + Br-
Stel de volgende redoxreacties schematisch voor. Volg het stappenplan op p. 171-172.
a synthese van zilveroxide uit zilver en zuurstofgas
b verbranding van magnesium
c synthese van koper(II)jodide uit de enkelvoudige stoffen ` Meer oefenen? Ga naar .
KERNBEGRIPPEN
KERNVRAGEN
REACTIESOORTEN
Hoofdstuk 1: Soorten chemische reacties
redoxreactie = reactie waarbij OG van atoomsoorten verandert
ionuitwisselingsreactie = reactie waarbij OG van atoomsoorten niet verandert
3 soorten:
NOTITIES
Bepalen OG → zie thema 01
1 Neerslag: Er is neerslag op de bodem te zien.
2 Gasontwikkeling: Gasbelletjes ontsnappen uit de oplossing.
3 Neutralisatie: Een zuur en base reageren samen en vormen een zout en water.
Hoofdstuk 2: Ionuitwisselingsreacties van dichtbij bekeken
notatie ionuitwisselingsreactie via: stoffenreactievergelijking
ionenreactievergelijking
essentiële reactievergelijking
neerslagreacties
gasontwikkelingsreacties
Zie stappenplan p. 158
Neerslag aangeduid met ↓ Gebruik de oplosbaarheidstabel op p. 160.
Gas aangeduid met ↑ H2CO3 → H2O + CO2 ↑ NH4OH → H2O + NH3 ↑ neutralisatiereacties
zuur + base → zout + water
ER is steeds H++ OH- → H2O
Hoofdstuk 3: Redoxreacties van dichtbij bekeken
©VANIN
redoxreactie = reactie waarbij oxidator wordt gereduceerd en elektronen opneemt van de reductor De reductor geeft de elektronen af en wordt hierdoor geoxideerd
oxidatie = toename in OG reductie = afname in OG
voorbeeld:
©VANIN
Tabel Oxidatiegetallen
