15 minute read
Endovenøs kateter-dirigeret trombolysebehandling ved akut dyb venetrombose
from DSTH-Forum 1. udgave 2021
by DSTH
Af: Jens-Ove Schmidt, overlæge, Karkirurgi, Kolding Sygehus. Mail: jens.ove.schmidt@rsyd.dk
Trine Maria Mejnert Jørgensen, Afdelingslæge, Ph.d., Karkirurgi, Kolding Sygehus
Baggrund
Dyb venøs trombose (DVT) i underekstremiteterne er en hyppigt forekommende, alvorlig tilstand, der indebærer stor risiko for morbiditet og mortalitet. På verdensplan er venøs tromboemboli, dvs. DVT og/eller lungeemboli (LE), den tredjehyppigste kardiovaskulære lidelse, kun overgået af akut myokardieinfarkt og apopleksi [1]. DVT optræder hos ca. 75 pr. 100.000 indbyggere pr. år i Danmark [2].
DVT forekommer med nogenlunde ens hyppighed hos kvinder og mænd. Forekomsten stiger med alderen, især efter 60-65-års-alderen, og størsteparten er lokaliseret i det iliacofemorale venesegment i forhold til rene crusDVT’er (ca. 2-3:1), og DVT ses hyppigere i venstre ben end i højre (ca. 3:1). Endelig ses en vis sæsonvariation i forekomsten af DVT, med størst forekomst i vintermånederne og navnlig i februar måned.
Ud over alder > 65 år disponerer en række risikofaktorer for udvikling af DVT: Akut medicinsk sygdom, malign sygdom, hospitalisering, overvægt, hormonbehandling, graviditet, trombofili, ikke-0-blodtype og sidst men ikke mindst kirurgisk behandling og immobilisering af mere end 3 dages varighed. Endelig er tidligere DVT en risikofaktor i sig selv [3].
Akut DVT medfører smertefuld hævelse af den afficerede ekstremitet og indebærer stor risiko for LE, som tegner sig for 300.000 dødsfald årligt i USA og 370.000 dødsfald årligt i seks europæiske lande med tilsammen 454,4 mio indbyggere [1]. Ca. to ud af tre patienter med DVT har LE, som ofte er subklinisk. Behandling af DVT retter sig derfor i den akutte fase mod forebyggelse af trombeprogression og embolisering og sidenhen mod forebyggelse af recidiv.
Der findes en række nationale [3] og internationale guidelines til behandling af DVT og LE, senest er det europæiske karkirurgiske selskab udkommet med opdaterede rekommendationer [4].
Posttrombotisk syndrom
Selv med relevant AK-behandling kan akut DVT medføre posttrombotisk syndrom (PTS) i den afficerede ekstremitet, som igen medfører betydelig morbiditet hos patienten og betydende omkostninger for samfundet. Op mod 2050% af patienter med DVT udvikler en vis grad af PTS, og enkelte udvikler svær PTS med venøse sår og/eller venøs claudicatio [5].
Ud over AK-behandling kan akut DVT behandles med endovenøs kateter-dirigeret trombolysebehandling ('venetrombolyse'), der sigter imod opløsning af hele tromben. Denne behandling har vist sig at medføre hurtig lindring
af de akutte symptomer samt at kunne nedsætte risikoen signifikant for udvikling af PTS og dermed øge patienternes livskvalitet. Flere studier dokumenterer effekten, forudsat at behandlingen gives tidligt (< 2-3 uger efter symptomdebut) og forbeholdes tromboser i det (cava-)iliacofemorale venesegment [6, 7]. I to danske publikationer, udgående fra de to centre, der tilbyder venetrombolyse i Danmark, beskrives, at ud af hhv. 109 og 50 behandlede patienter udviklede kun hhv. 16,5% og 17% PTS efter hhv. 71 og 12 måneders median follow-up [8, 9].
Venetrombolyse i Danmark
I Danmark blev venetrombolyse introduceret i 1999 på karkirurgisk afdeling, Gentofte Hospital (behandlingen er siden flyttet til karkirurgisk klinik, Rigshospitalet) og siden 2011 ligeledes på karkirurgisk afdeling, Kolding Sygehus. Patienter bosiddende vest for Storebælt behandles fortrinsvist i Kolding og patienter bosiddende øst for Storebælt samt på Færøerne og i Grønland fortrinsvist på Rigshospitalet. I Kolding behandles ca. 40-45 patienter årligt, ca. halvt så mange behandles på Rigshospitalet.
genkontrast), samtidig udelukkes en stor del af eventuelle okkulte cancersygdomme. Scanningen udføres ligeledes på lokalt sygehus, og der opstartes samtidig behandling med lavmolekylært heparin (LMH) i terapeutisk dosis.
Såfremt der på CT-scanningen ses større, fritliggende trombemasser i vena cava inferior, anbefaler vi anlæggelse af vena cava-filter forud for behandling med trombolyse for at forebygge embolisering til lungerne. Cavafilteret er som hovedregel en midlertidig løsning og skal fjernes, når tromberne i v. cava er opløst.
Henvisning til karkirurgisk afdeling på Kolding Sygehus sker telefonisk til karkirurgisk bagvagt på telefon 7636 2359. Karkirurgisk vagthavende på Rigshospitalet kontaktes via omstillingen på telefon 3545 3545. Eventuel P-pillebehandling fortsættes, idet menstruation kontraindicerer trombolyse.
Behandlingen tilbydes patienter med ≤ 2 ugers symptomvarighed, og som skønnes at kunne medvirke til behandlingen. Patienten må ikke have aktiv cancersygdom af hensyn til blødnings- og recidivrisikoen, ikke være gravid og ikke have haft DVT i samme ekstremitet tidligere, idet der i så fald må forventes allerede at være kroniske forandringer i de dybe vener. Endelig må der ikke foreligge tilstande, der kontraindicerer trombolyse, primært nylige (< 14 dage) traumer inkl. kirurgi og fødsler eller pågående blødninger inkl. menstruation.
Patienten får stillet diagnosen DVT efter gængse kriterier på lokalt sygehus. Tilstedeværelse af DVT i iliacavenerne bekræftes ved CT af abdomen med kontrast i venøs fase (scanning ca. 2 minutter efter indgift af intravenøs rønt-
Behandling med venetrombolyse
Såfremt patienten tilbydes behandling, aftales indlæggelse dagen før planlagt behandlingsopstart. Behandlingen opstartes typisk mandag eller tirsdag, således at den kan være afsluttet senest fredag. Behandlingen foretages ved ultralydvejledt punktur af vena poplitea i den afficerede ekstremitet under lokalanæstesi. Det er uden betydning, om venen er åben eller tromboseret. Under røntgengennemlysning sprøjtes kontrast i venen og der laves flebografi, hvorefter hele det tromboserede venesegment passeres med guidewire indtil åbenstående central vene. Over guidewire placeres et trombolysekateter i det tromboserede venesegment. Trombolysekatetret er perforeret over en given længde, og katetret vælges således, at der er perforationer over hele det behandlede segment. Der
gives bolus i kateteret med 10 mg Alteplase og 2500 IE Heparin, hvorefter kateteret fikseres til huden med plaster og tilsluttes infusionspumpe til kontinuerlig indgift af Alteplase og Heparin, doseret efter patientens vægt. Behandlingseffekten kontrolleres med flebografi 1 x i døgnet indtil tromben ses fuldstændig opløst. Typisk opnås dette i løbet af 48 timer. Under behandlingen skal patienten være sengeliggende med ≤ 30° eleveret hovedgærde. Der anlægges kompressionsbandager eller intermitterende pneumatisk kompression på begge ben til stimulation af patientens venepumpe under trombolysebehandlingen.
Endovenøs trombektomi
Ud over den beskrevne fremgangsmåde, som er den mest anvendte i Danmark, findes der flere forskellige systemer til mekanisk trombektomi, hvor tromberne fragmenteres og aspireres, samt en blanding af teknikkerne, såkaldt farmakomekanisk trombektomi. Mekanisk trombektomi suppleres dog ofte med kateterdirigeret trombolyse pga. tromberester og evt. ubehandlede veneafsnit. Åben, operativ trombektomi, som er væsentlig mere traumatisk og risikofyldt end trombolyse, udføres kun meget sjældent.
Afslutning af behandlingen
Ved kontrolflebografi afsløres i ca. 75% af tilfældene en mekanisk afløbshindring i form af kompression af iliacavenerne som medvirkende årsag til trombosen. I disse tilfælde forbedres det centrale venøse afløb med ballonudvidelse og stentning af iliacavenerne i samme seance, idet der i modsat fald er stor risiko for re-trombose.
Efter endt behandling fortsætter patienten med kompressionsstrømper og antikoagulerende behandling. I tilfælde, hvor der ikke er anlagt stents, følger efterbehandlingen gængse retningslinjer for behandling af DVT. I tilfælde, hvor der er lagt stents (som er ganske store, intravaskulære fremmedlegemer), må der i efterbehandlingen tages hensyn til disse. Der findes imidlertid ingen nationale eller internationale behandlingsrekommendationer. I Kolding fortsættes med LMH i 14 dage og der opstartes behandling med Warfarin til INR-niveau 2,5 – 3,5 i min. 1 år, idet der er set flere re-tromboser under behandling med direkte orale antikoagulantia (DOAK) eller ved for tidlig seponering af AK-behandlingen. Fravalget af DOAK er i overensstemmelse med en nyere Delphianalyse blandt 106 eksperter på 78 centre i 28 lande [10].
Opfølgning
Patienten udskrives typisk samme dag som behandlingen afsluttes, og der følges op med kontroller i karkirurgisk ambulatorium. I Kolding udføres klinisk kontrol og duplexscanning efter 3, 6, 12 og 24 måneder. Efter 12 og 24 måneder udføres der derudover MR-flebografi. Opfølgning på AK-behandling og evt. trombofiliudredning sker på lokalt sygehus.
Konklusion
Efter forfatternes opfattelse tilbydes venetrombolyse fortsat ikke til alle de patienter, der må forventes at kunne have gavn af behandlingen. Behandlingen tolereres generelt godt og risikoen for komplikationer er lav. Der er fortsat ingen klare retningslinjer vedrørende efterbehandlingen efter stentanlæggelse, hvilket ville være ønskeligt. Forfatterne håber, med dette skrift at udbrede kendskabet til behandlingen samt evt. i DSTH-regi at få sat fokus på efterbehandlingen efter stentning af de dybe vener.
Referencer 1. Konstantinides SV, Meyer G. The 2019 ESC Guidelines on the Diagnosis and Management of Acute Pulmonary Embolism. Eur Heart J. 2019 Nov 1;40(42):3453-3455. doi: 10.1093/eurheartj/ehz726. PMID: 31697840. 2. Bækgaard N. Incidence and location of deep vein thrombosis in the lower extremities: what do we know? Phlebolymphology 2017;24:97-104. 3. Grove EL, Kjærgaard J, Pareek M, Würtz M, Kümler T. National behandlingsvejledning (NBV) Kapitel 12: Lungeemboli og dyb venetrombose (nbv.cardio.dk/lungeemboli). 4. Kakkos SK, Gohel M, Baekgaard N et al. European Society for Vascular Surgery (ESVS) 2021 Clinical Practice Guidelines on the Management of Venous Thrombosis. Eur J Vasc Endovasc Surg 2020; article in press. 5. Schmidt J-O, Ipsen M, Eldrup N et al. Posttrombotisk syndrom og endovaskulær behandling. Ugeskr f laeger 2021; article in press. 6. Haig Y, Enden T, Grøtta O et al. Post-thrombotic syndrome after catheterdirected thrombolysis for deep vein thrombosis (CaVenT): 5-year followup results of an open-label, randomized controlled trial. Lancet Haematol 2016;3:e64-71. 7. Comerota AJ, Kearon C, Gu C-S et al. Endovascular Thrombus Removal for Acute Iliofemoral Deep Vein Thrombosis – Analysis From a Stratified Multicenter Randomized Trial. Circulation 2019;139:1162-73. 8. Broholm R, Sillesen H, Damsgaard MT et al. Postthrombotic syndrome and quality of life with iliofemoral venous thrombosis treated with catheterdirected thrombolysis. J Vasc Surg 2011;54:18S-25S. 9. Madsen CP, Gesla J, Vijdea RL et al. Results of catheter-directed thrombolysis for acute ilio-femoral deep venous thrombosis – A retrospective cohort study. JRSM Cardiovascular Disease;7:1-8. 10. Milinis K, Thapar A, Shalhoub J et al. Antithrombotic Therapy Following Venous Stenting: International Delphi Consensus. Eur j Vasc Endovasc Surg 2018;55:537-44.
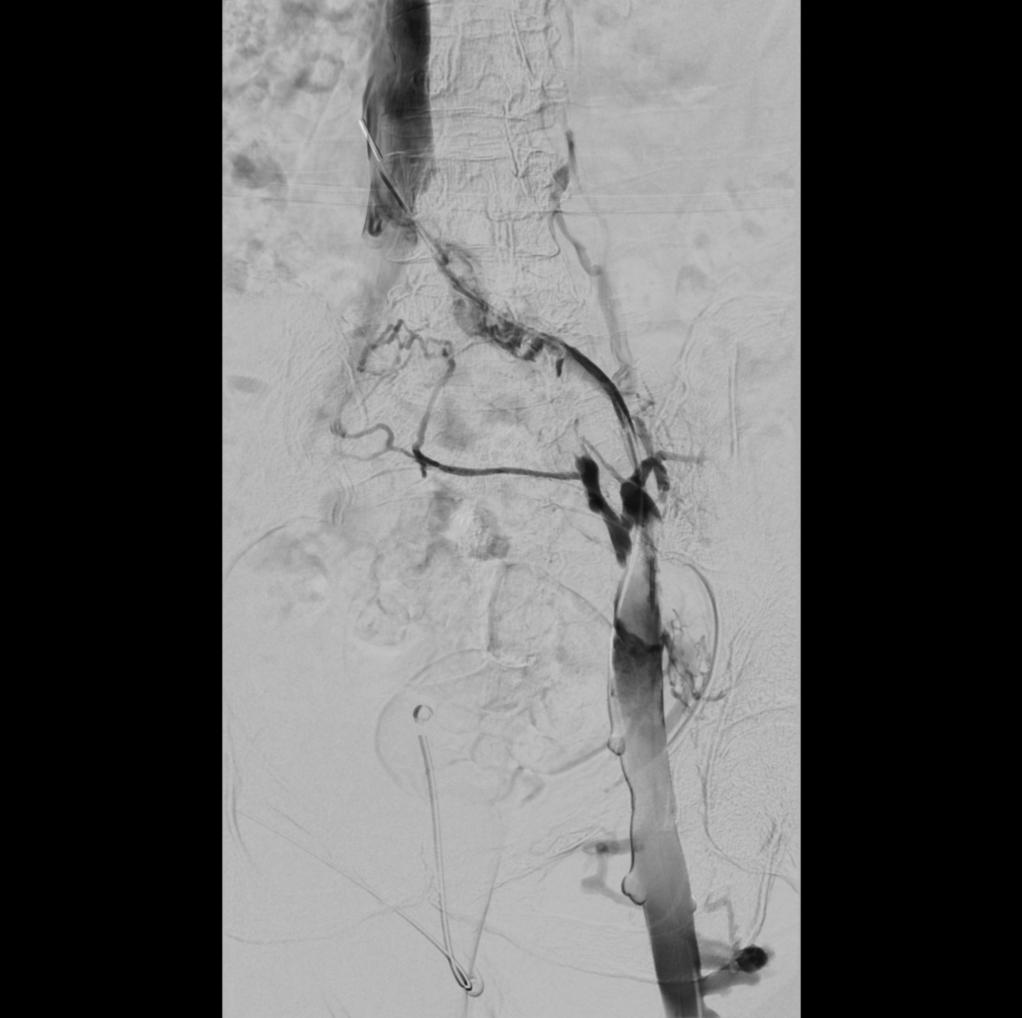
Direkte (subtraktions-)flebografi visende okklusion af de venstresidige bækkenvener. Der ses kollateralt venøst afløb til modsatte side og til paravertebrale vener. Trombosen er passeret intraluminalt, og der ses diagnostisk kateter med spidsen i v. cava inf.
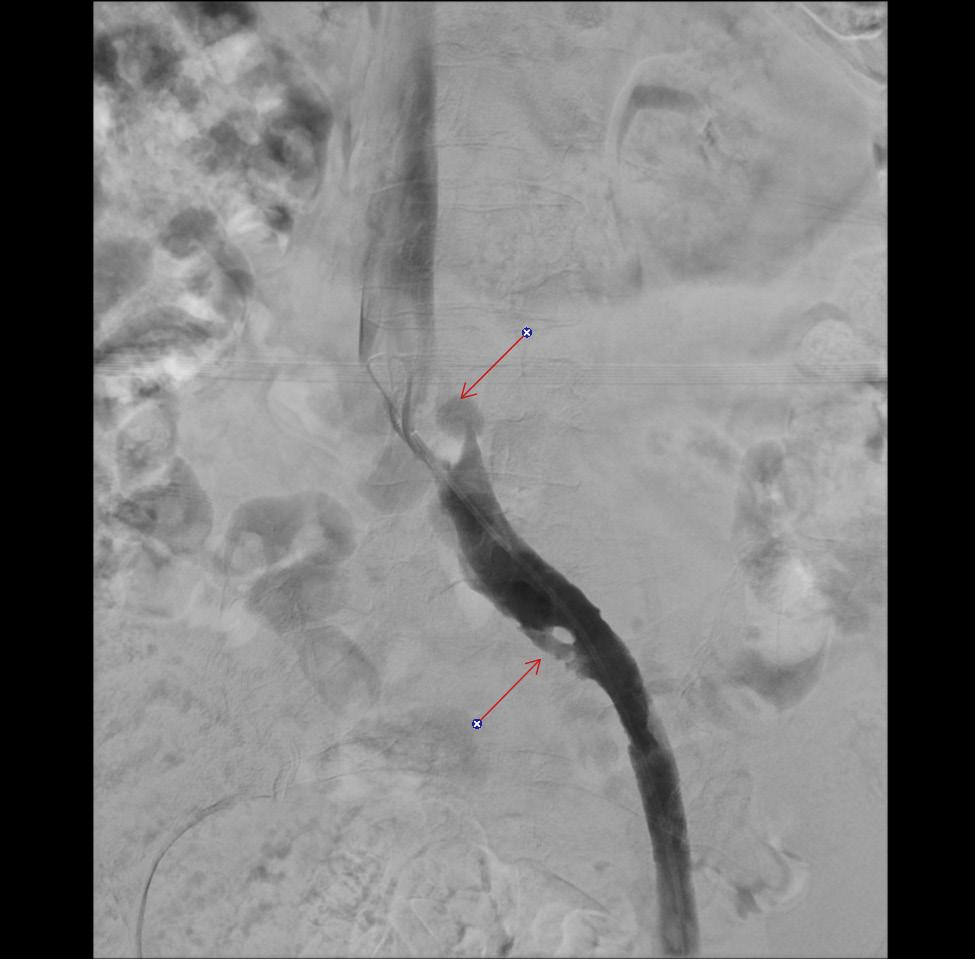
Kontrolflebografi efter afsluttet trombolyse. Iliacavenerne ses åbenstående, men der er tegn på kompression af venen centralt under den krydsende a. iliaca communis dxt og midt på forløbet, under den krydsende a. iliaca interna sin (pile). Konfigurationen med en kontrastfri ”ø” midt i venen er en karakteristisk, kronisk forandring, der skydes sammenvoksning af venens for- og bagvæg som følge af lang tids kompression. Fluoroskopi viser trombolysekateter (EKOS®) i det tromboserede venesegment. Kateteret er perforeret med sidehuller i hele det markerede område.
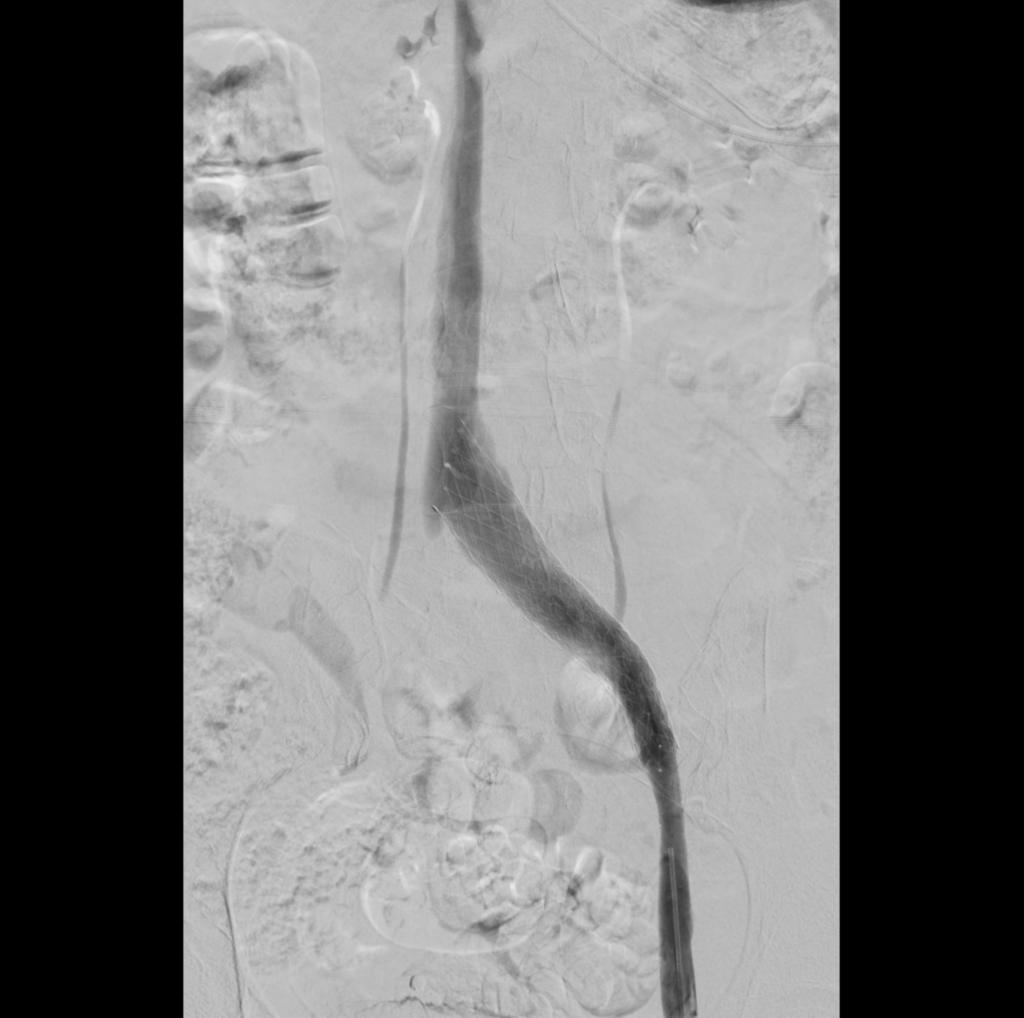
Kontrolflebografi efter trombolyse og stentning. Det kollaterale afløb ses helt ophørt, som udtryk for uhindret afløb og stenten dækker alle forandrede veneafsnit. Den anvendte stent er en dedikeret venestent (Sinus Obliquus®).


▼ Dette lægemiddel er underlagt supplerende overvågning. Dermed kan nye sikkerhedsoplysninger hurtigt tilvejebringes. Sundhedspersoner anmodes om at indberette alle formodede bivirkninger. IDELVION® (albutrepenonacoq alfa) pulver og solvens til injektionsvæske, opløsning Teraputiske indikationer: Behandling og profylakse af blødning hos patienter med hæmofili B (medfødt mangel på faktor IX). Kan bruges til alle aldersgrupper. Dosering*: Behandlingen skal superviseres af en læge med erfaring i behandling af hæmofili B. Monitorering af behandling: Under behandlingsforløbet anbefales relevant bestemmelse af faktor IX-niveauet som vejledning til bestemmelse af den dosis, der skal administreres, og af doserings-hyppigheden ved gentagne infusioner. Dosering: Dosis og substitutionsbehandlingens varighed afhænger af, hvor alvorlig faktor IX-manglen er, af blødningsstedet og blødningsomfanget samt af patientens kliniske tilstand. Behandling efter behov: Beregning af den nødvendige dosis af faktor IX er baseret på det empiriske fund, at 1 IE (international enhed) faktor IX pr. kg legemsvægt forventes at øge niveauet af cirkulerende faktor IX med gennemsnitligt 1,3 IE/dl (1,3 % af normalværdien) hos patienter ≥ 12 år og med 1,0 IE/dl (1,0 % af normalværdien) hos patienter < 12 år. Den dosis, der skal administreres, og administrationshyppigheden skal altid indrettes efter den kliniske effekt i det enkelte tilfælde. Patienter < 12 år: Ved en inkrementel genfinding på 1 IE/dl pr. 1 IE/kg beregnes dosis på følgende måde: Dosis (IE) = legemsvægt (kg) × ønsket faktor IX-forøgelse (IE/dl) × 1 dl/kg. Patienter ≥ 12 år: Ved en inkrementel genfinding på 1,3 IE/dl pr. 1 IE/kg beregnes dosis på følgende måde: Dosis (IE) = legemsvægt (kg) × ønsket faktor IX-forøgelse (IE/dl) × 0,77 dl/kg. Profylakse: Den sædvanlige dosis til langvarig profylakse mod blødning hos patienter med svær hæmofili B er 35-50 IE/kg én gang om ugen. Visse patienter, som opnår god kontrol med behandling én gang om ugen, kan behandles med op til 75 IE/kg ved et interval på 10 eller 14 dage. Hos patienter > 18 år kan det overvejes at forlænge behandlingsintervallet yderligere. Efter en blødningsepisode under profylakse bør patienterne bibeholde deres profylakseregime så nøje som muligt. IDELVION® bør administreres med mindst 24 timer mellem 2 doser eller længere, hvis det vurderes velegnet for patienten. Pædiatrisk population: Til rutinemæssig profylakse er det anbefalede dosisregime 35-50 IE/kg én gang om ugen. Administration*: Intravenøs anvendelse. Den rekonstituerede injektionsvæske skal injiceres langsomt intravenøst med en hastighed, der er behagelig for patienten, op til maksimalt 5 ml/min. Kontraindikationer*: Overfølsomhed over for det aktive stof eller over for et eller flere af hjælpestofferne. Allergisk reaktion over for hamsterprotein. Særlige advarsler og forsigtighedsregler vedrørende brugen*: Sporbarhed: For at forbedre sporbarheden af biologiske lægemidler skal det administrerede produkts navn og batchnummer tydeligt registreres. Overfølsomhed: Der kan forekomme allergiske overfølsomhedsreaktioner med IDELVION® . Præparatet indeholder spor af hamsterproteiner. Patienterne skal informeres om omgående at afbryde behandlingen og kontakte lægen, hvis overfølsomhedssymptomer skulle forekomme. Patienterne skal informeres om de tidlige tegn på overfølsomhedsreaktioner såsom urticaria, generaliseret urticaria, trykken for brystet, hvæsende vejrtrækning, hypotension og anafylaksi. Det anbefales, at den første administration af faktor IX foretages under lægeligt opsyn med mulighed for relevant håndtering af allergiske reaktioner. I tilfælde af shock skal standardbehandling af shock iværksættes. Inhibitorer: Der er rapporteret om dannelse af inhibitorer til faktor IX under faktorsubstitutionsbehandling med IDELVION® i behandlingen af hæmofili B. Efter gentagen behandling med humane koagulationsfaktor IX-præparater skal patienterne monitoreres for udvikling af neutraliserende antistoffer (inhibitorer), der bør kvantificeres i Bethesda-enheder (BE) under anvendelse af relevante biologiske test. I litteraturen er der rapporter, som viser en forbindelse mellem forekomst af faktor IX-inhibitor og allergiske reaktioner. Alle patienter, der oplever allergiske reaktioner, bør derfor undersøges for tilstedeværelsen af inhibitorer. Det skal bemærkes, at patienter med faktor IX-inhibitorer kan have øget risiko for anafylaksi ved efterfølgende eksponering for faktor IX. Tromboemboli: Når IDELVION® administreres til patienter med leversygdom, til patienter postoperativt, til nyfødte og til patienter med risiko for trombotisk fænomen eller dissemineret intravaskulær koagulation (DIC) skal klinisk overvågning for tidlige tegn på trombose og konsumptiv koagulopati initieres under anvendelse af relevant biologisk testning. I hvert enkelt tilfælde skal fordelen ved behandling med IDELVION® vejes op imod risikoen for disse komplikationer. Kardiovaskulære hændelser: Hos patienter med kardiovaskulære risikofaktorer kan substitutionsbehandling med faktor IX øge den kardiovaskulære risiko. Kateterrelaterede komplikationer: Når det er nødvendigt at anlægge et centralt venekateter (CVK), skal risikoen for CVK-relaterede komplikationer inklusive lokale infektioner, bakteriæmi og trombose på kateterstedet tages i betragtning. Ældre: Kliniske studier med IDELVION® har ikke inkluderet personer på 65 år og derover. Det vides ikke, om de reagerer anderledes end yngre personer. Induktion af immuntolerance: IDELVION®s sikkerhed og virkning med hensyn til induktion af immuntolerance er ikke klarlagt. Natriumindhold: Dette lægemiddel indeholder op till 8,6 mg natrium pr. haetteglas, svarende til 0,4 % af den WHO anbefalede maksimale daglige indtagelse af 2 g natrium for en voksen. Pædiatrisk population: De anførte advarsler og forsigtighedsregler gælder for både voksne og børn. Interaktion med andre lægemidler og andre former for interaktion: Der er ikke rapporteret interaktioner mellem humane koagulationsfaktor IX (rDNA)-præparater og andre lægemidler. Fertilitet, graviditet og amning: På grund af den sjældne forekomst af hæmofili B hos kvinder er der ingen tilgængelige data fra brug af faktor IX under graviditet og amning. Faktor IX bør derfor kun anvendes under graviditet og amning, hvis det er klart indiceret. Bivirkninger*: I meget sjældne tilfælde er der observeret udvikling af antistoffer mod hamsterprotein, der var forbundet med overfølsomhedsreaktioner. Patienter med hæmofili B kan udvikle neutraliserende antistoffer (inhibitorer) mod faktor IX. Hvis sådanne inhibitorer forekommer, vil tilstanden vise sig ved utilstrækkeligt klinisk respons. I sådanne tilfælde anbefales det at kontakte et specialiseret hæmofilicenter. Der blev rapporteret udvikling af inhibitorer i et igangværende klinisk studie med tidligere ubehandlede patienter. Der er observeret udvikling af inhibitorer hos tidligere behandlede patienter efter markedsføring af IDELVION®. Bivirkninger nedenfor er opstillet efter MedDRAs klassifikation (systemorganklasse og foretrukken term). Hyppighederne er baseret på fem ublindede kliniske studier med i alt 114 forsøgsdeltagere. Almindelige (≥ 1/100 til < 1/10): Hovedpine, svimmelhed. Reaktioner på injektionsstedet. Ikke almindelige (≥ 1/1.000 til < 1/100): Overfølsomhed, udslæt, eksem. Ikke kendt: FIX-hæmning/udvikling af inhibitorer. Beskrivelse af udvalgte bivirkninger: Én tidligere ubehandlet patient i det igangværende kliniske forsøg udviklede høj titer inhibitor mod faktor IX. Der er utilstrækkelige data til at give information om incidensen af inhibitorer hos tidligere ubehandlede patienter. Overdosering: Der er ikke rapporteret om symptomer i forbindelse med overdosering af IDELVION® . For oplysninger om holdbarhed, instruktion i brug mm. se fuldt produktresumé og læs indlægssedlen. Indehaver af markedsføringstilladelse: CSL Behring GmbH, Marburg, Tyskland. Udlevering: BEGR. Tilskud: Ikke tilskud. Pakninger og priser: IDELVION® pulver og solvens til injektionsvæske, opløsning fås i følgende pakningsstørrelser: IDELVION® 250 IE. IDELVION® 500 IE. IDELVION® 1000 IE. IDELVION® 2000 IE. IDELVION® 3500 IE. Dagsaktuelle priser findes på www.medicinpriser.dk. De med * markerede afsnit er omskrevet/forkortede i forhold til det af EMA godkendte produktresumé, dateret 08.2020. Fuldt produktresumé kan vederlagsfrit rekvireres hos: CSL Behring AB, Box 712, SE-182 17 Danderyd. Telefon: +46 8 544 966 70.
TILTRO TIL BEHANDLINGEN
Længerevarende blødningsbeskyttelse og fleksibilitet til dine hæmofili B patienter.1–4
Frihed er en vigtig faktor – i alle aldre. Idelvion behandler og forebygger blødninger hos patienter med hæmofili B, i alle aldersgrupper.1 En injektion med Idelvion resulterede i 0 blødninger* og beskyttelse hos udvalgte patienter (≥12 år) i op til 14 dage.1,2 I et forlængelsesstudie, publiceret i 2020, gav Idelvion beskyttelse i op til 21 dage for en gruppe udvalgte og velbehandlede patienter over 18 år.1,4
Referencer: 1. IDELVION SPC 08/2020. 2. Santagostino E, et al. Blood 2016;127:1761-9. 3. von Mackensen S, et al. Haemophilia 2019;25:45-53. 4. Mancuso EM, et al. J Thromb Haemost 2020;18:1065-74. * Årlig spontan blødningsfrekvens (AsBR), Median Interquartile Range (IQR) = 7 d: 0 (0, 0); 10 d: 0 (0, 0); 14 d: 0 (0, 1) (Mediandosis for 7 d: 40 IE/kg; 10 d: 75 IE/kg; 14 d: 75 IE/kg).







