Naturligtvis
NATURKUNSKAP 2
Karl-Ni K l as Hult Peter Olss O N
INNEHÅLL
AMATERIA I MILJÖ OCH SAMHÄLLE 6
A1 Egna vetenskapliga undersökningar 7
Testa dig själv 16
A2 Atomer 17
Testa dig själv 21
A3 Kemiska föreningar 22
Testa dig själv 33
A4 Organisk kemi 34
Testa dig själv 42
Fördjupning – Biogas och naturgas 43
A5 Miljöföroreningar och rubbade kretslopp 44
Testa dig själv 53
Fördjupning – Peak fosfor 54
Fördjupning – DDT – från framgång till miljöhot 55
Sammanfattning 56
Uppgifter 58
BUNIVERSUM OCH MATERIANS UPPKOMST 60
B1 Vår plats i universum 61
Testa dig själv 66
B2 Vår världsbild förändras 67
Testa dig själv 71
Fördjupning – Paradigmskiften 72
B3 Stjärnor är grundämnesfabriker 73
Testa dig själv 79
Fördjupning – Spektralanalys 80
B4 Universums ursprung 81
Testa dig själv 86
B5 En planet med liv 87
Testa dig själv 92
B6 Teknikutveckling 93
Testa dig själv 97
Sammanfattning 98
Uppgifter 99
CLIVET UTVECKLAS 100
C1
Livets uppkomst 101
Testa dig själv 107
C2 Evolutionsteorin 108
Testa dig själv 117
C3 Artbildning 118
Testa dig själv 124
Fördjupning – Massutdöenden 125
C4 Människans evolution 126
Testa dig själv 132
Fördjupning – Spår av neandertalare i vårt DNA 133
C5 Sjukdomarnas evolution 134
Testa dig själv 142
A MATERIA I MILJÖ
OCH SAMHÄLLE
A1 Egna vetenskapliga undersökningar
A2 Atomer
A3 Kemiska föreningar
A4 Organisk kemi
A5 Miljöföroreningar och rubbade kretslopp
A1 Egna vetenskapliga undersökningar
Diskutera
Varför kan det vara viktigt att kunna planera och utföra en egen vetenskaplig undersökning?

Att kunna planera och utföra egna vetenskapliga undersökningar är ett återkommande inslag i skolans naturvetenskapliga ämnen.
vetenskaplig måste den vara såväl testbar som falsifierbar. Det betyder att det måste gå att undersöka hypotesen i observationer och experiment. I experiment testas om en förutsägelse (ett förväntat resultat om vi utgår från att hypotesen stämmer) faktiskt inträffar. En hypotes är falsifierbar om det går att göra experiment som motbevisar hypotesen.

Exempel på en frågeställning
Hur påverkar koncentrationen av socker (sackaros) i en jästlösning mängden koldioxid som bildas i jäsningsprocessen?
Att svara på frågeställningar och testa hypoteser
Exempel på en hypotes
Jäsningsprocessen begränsas av tillgången på socker. Ju högre sockerkoncentration, desto mer koldioxid bildas i jäsningen.
För att besvara frågeställningar och testa hypoteser behöver vi samla in mätbara data i olika experiment. Datan samlas in för två typer av variabler. Den oberoende variabeln är den som hypotesen påstår påverkar något, medan den beroende variabeln är det som enligt hypotesen skulle påverkas. I exemplet ovan är sockerhalten den oberoende variabeln, och mängden koldioxid som produceras den beroende variabeln. Därefter letar vi efter mönster i datan, till exempel om det bildats olika mycket koldioxid beroende på hur mycket socker som finns i jästlösningen.
I experiment är det viktigt att undvika att andra variabler än den man vill testa påverkar resultatet. Sådana variabler kallas störvariabler. I exemplet skulle det kunna vara att de olika jästlösningarna har olika temperatur, pH-värde eller att de fått reagera under olika lång tid.
I ett naturligt experiment (observationsstudie) samlas data in utan att den oberoende variabeln manipuleras. Observationsstudier är exempelvis användbara när det av etiska eller tekniska skäl inte är lämpligt att genomföra ett kontrollerat experiment. Genom att observera hur människor påverkas av naturliga variationer, till exempel när de av misstag utsatts för radioaktivitet eller giftiga kemikalier, kan vi få kunskap utan att behöva genomföra farliga eller oetiska experiment. Eftersom miljön inte kontrolleras lika noggrant i observationsstudier kan störvariabler få
Det är viktigt att såväl frågeställningar som hypoteser är avgränsade och specifika. Är de för generella går de inte att besvara eller testa. I exemplet följs hypotesen av en förutsägelse. Den anger vad det förväntade resultatet av undersökningen kommer att vara om hypotesen stämmer.
Att analysera data och dra slutsatser
När resultaten samlats in ska de analyseras. Genom att presentera sina data i tabeller och diagram blir det lättare att kunna urskilja trender, korrelationer och skillnader mellan de olika grupperna.

Volym koldioxid som bildas (ml)
1
Kontrollgrupp (inget tillsatt socker)
Försöksgrupper (olika sockermängder)
Om den data som samlats in överensstämmer med hypotesens förutsägelse ger det stöd åt att hypotesen är sann. Anledningen till att man säger att det ”ger stöd åt” istället för ”bevisar” beror på att vi faktiskt inte kan lämna några garantier för att våra hypoteser är korrekta. Det kan vara så att vi inte varit tillräckligt noggranna eller så kan slumpen ha påverkat vårt resultat. Flera replikat ger ett starkare stöd för att hypotesen stämmer än om resultatet kommer från en enskild undersökning. Vi kan inte heller utesluta att en okänd störvariabel ligger bakom resultatet. Här är kontrollgruppen viktig för att stärka slutsatsen. Eftersom kontrollgruppen utsatts för experimentet på samma sätt som testgrupperna borde skillnaden mellan kontrollgruppen och testgruppernas resultat endast bero på förändringar av den oberoende variabeln.
I de fall som den insamlade datan motbevisar hypotesen säger vi att hypotesen ”förkastas”. Det betyder att vi behöver hitta en ny förklaringsmodell till det vi vill undersöka. För att testa den nya förklaringsmodellen behöver nya hypoteser formuleras. Bara för att en hypotes förkastas behöver det inte
I tabellen visas mätdata för kontrollgruppen och de fyra olika försöksgrupperna. Notera att det ska finnas tydliga rubriker i tabellen där enheterna på det som mäts ska anges inom parentes.
Skriftlig redovisning av ett experiment
Den skriftliga redovisningen av ett experiment sker i regel genom en rapportskrivning. Det är viktigt att rapporten är välstrukturerad och tydlig. Nedan ges ett exempel på hur en vetenskaplig rapport kan struktureras, men rubrikerna kan ibland variera något.
Titel
Det är viktigt att rapportens titel avspeglar innehållet i undersökningen.
Inledning
Här ges nödvändig bakgrundsinformation som läsaren kan behöva känna till för att förstå undersökningen. Svåra begrepp förklaras. Om undersökningen bygger på några speciella teorier bör de förklaras. Undersökningen kan också sättas i ett större sammanhang. Varför är det exempelvis viktigt att undersökningen görs?
I inledningen ska också frågeställningen och eventuell hypotes finnas med.
Material och metod
Här beskrivs noggrant vilken utrustning som använts samt hur experimentet utförts. De som läser beskrivningen ska själva kunna upprepa experimentet.
Resultat
Här redovisas resultatet av undersökningen. Tabeller och diagram används för att göra resultaten lättöverskådliga. Om medelvärden beräknats kan de visas i diagrammet istället för alla mätdata. Tabeller och figurer behöver tabell- och figurtexter.
Diskussion
Här besvaras frågeställningen och hypoteser utvärderas genom tolkningen av resultaten. Om det finns resultat som avviker, eller gör att en säker slutsats inte kan dras, behöver de tänkbara orsakerna till det diskuteras. Om undersökningen utgår från någon teori bör diskussionen ta upp ifall slutsatserna stödjer teorin eller inte. I diskussionen är det också vanligt att eventuella begränsningar och svagheter med försöket diskuteras. Det är också lämpligt att ange förbättringsförslag till undersökningen samt föreslå hur den ska kunna utvecklas vidare.
Källförteckning
I alla vetenskapliga arbeten ska de källor som det refereras till i texten finnas angivna i form av en källförteckning. Det finns olika standardsätt för hur en källförteckning skrivs.
Säkerhet i laboratoriet
När naturvetenskapliga undersökningar planeras och utförs är det viktigt att utrustning och kemikalier används på ett säkert sätt. På så sätt kan risken för skada minskas. Ett sådant säkerhetstänkande kan också komma till användning i vardagslivet och i ett framtida yrkesliv. En del av säkerhetsarbetet handlar om att göra en riskbedömning innan vi påbörjar det praktiska arbetet. Det gäller såväl laborationer där vi hanterar kemikalier och biologiskt material som när vi samlar in svar via enkätundersökningar och intervjuer. I det praktiska arbetet, exempelvis i en laborationssal, finns vissa generella regler som måste följas. Det kan handla om att skolans säkerhetsföreskrifter måste följas och att skyddsutrustning ska användas då läraren säger det. Det kan också vara att inga experiment får utföras utan lärarens tillstånd och det kan vara ett krav att närvara vid en säkerhetsgenomgång för att få vara med och delta. Utöver de generella reglerna kan det också finnas specifika regler som gäller vid arbete med kemikalier, öppen låga och biologiskt material.
Skadlig. Kan ge klåda och irritation på huden eller i ögonen. Kan ge allergi vid hudkontakt. Kan göra dig dåsig och yr.
Brandfarlig. Produkten är brandfarlig och kan brinna våldsamt. Den ska därför hållas borta från värme, gnistor och öppen låga.
Frätande. Farlig att få på huden, i ögonen eller i munnen.
Hälsofarlig. Produkten kan vara cancerframkallande, ge fosterskador och störa fortplantningen. Produkten är därför farlig att förtära.
Miljöfarlig. Produkten är farlig för vattenmiljön.
Giftig. Produkten ger livshotande skador vid inandning, hudkontakt och förtäring.
För att förebygga skada och olyckor ska hälso- och brandfarliga produkter vara märkta med farosymboler.
Forskningsetik
När försök genomförs i skolan eller när nya läkemedel testas behöver man överväga om försöket får utföras utan tillstånd, eller om ett etiskt godkännande krävs. I Sverige kan ett sådant godkännande ges av Etikprövningsmyndigheten.
Vid studier på människor är det en grundläggande etisk princip att deltagandet ska vara frivilligt. Försökspersonerna måste dessutom ha lämnat ett informerat samtycke. Det innebär att de, muntligt eller skriftligt, har godkänt sitt deltagande efter att ha fått utförlig information om vad deltagandet innebär. Alla undersökningar som kan medföra risk för fysisk eller psykisk skada kräver ett etiskt godkännande för att få genomföras. Detta gäller till exempel försök med läkemedel. Det gäller också vid försök på ryggradsdjur och bläckfiskar.
För att Etikprövningsmyndigheten ska ge sitt godkännande måste studiens nytta väga tyngre än de risker och det lidande som kan uppstå. Om möjligt bör alternativa metoder till djurförsök användas, enligt 3R-principen. Det kan till exempel innebära att man inom medicinsk forskning testar läkemedel på cellodlingar och vävnader istället för på försöksdjur. I skolmiljö används ofta bakterier, jästceller och alger som modellorganismer.
3R
Replace
Det innebär att du ersätter djurförsök med djurförsöksfria metoder.
Reduce
Det innebär att så få försöksdjur som möjligt ska användas.
Refine
Det innebär att försöksdjuren ska ha detså bra som möjligt.
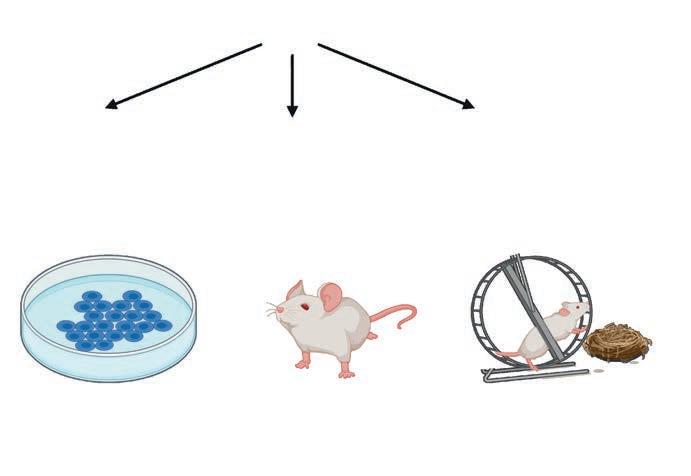
Alla som arbetar med försöksdjur inom EU ska arbeta efter 3R-principen. Förkortningen står för replace (ersätta), reduce (minska) och refine (förfina). Det innebär att forskare inte får använda djurförsök om det finns en metod utan djur som kan ge samma resultat. Om djurförsök måste göras ska så få djur som möjligt användas och de ska inte behöva lida i onödan.
Försöket utförs på en cellkultur istället för på djur.
Forskare kan dela data och resultat med varandra.
Försöksdjuren hålls i en berikande miljö med inredning.
Det kan vara viktigt att notera att även enkätundersökningar och intervjuer behöver följa etiska riktlinjer. Till det hör att undersökningen inte får orsaka intrång i privatlivet eller röja känsliga personuppgifter. Svaren ska också i de fall där det är möjligt vara anonyma. I annat fall måste försökspersonerna ha gett ett informerat samtycke till att deras personuppgifter används.
Inom forskning är det inte heller tillåtet att plagiera, förfalska eller undanhålla resultat från sin forskning. Det räknas som forskningsfusk. Att plagiera kan innebära att man lämnar in någon annans arbete som sitt eget eller att man använder olika texter utan att namnge källorna. Forskare måste också ange var pengarna till forskningen kommit ifrån och om de har intressekonflikt, så att allmänheten kan bedöma om slutsatserna inte är vinklade.
TESTA DIG SJÄLV
1. Vad menas med att en hypotes måste vara falsifierbar?
2. Vilken är den beroende variabeln i ett experiment där man undersöker hur mängden socker i en jästlösning påverkar mängden koldioxid som bildas vid jäsning?
3. Vad kallas den grupp i ett experiment som inte utsatts för den oberoende variabeln i ett kontrollerat experiment?
4. Vad menas med ett kontrollerat experiment?
5. Vad betyder farosymbolen?
6. Vad menas med att plagiera inom forskningen?
Atomkärnan
Idén om att all materia är uppbyggd av små oförstörbara partiklar brukar tillskrivas filosofen Demokritos, som levde under 400-talet f.Kr. Demokritos valde att kalla partiklarna atomer, vilket betyder odelbar. I slutet av 1800-talet upptäcktes radioaktiviteten som visade att atomer inte alls är odelbara. När större atomkärnor klyvs till mindre frigörs energi. Energin används i kärnkraftverk för att producera el. Den vetenskapliga teorin om atomens uppbyggnad som ligger till grund för allt vi vet om atomen idag har utvecklats från naturvetenskapliga upptäckter som gjorts under de senaste tvåhundra åren. Viktiga pusselbitar i det här arbetet är upptäckten av atomkärnan, elektronen, elektronskalen och neutronerna.

Fission
Energin i kärnkraftverk kommer från kärnklyvning av stora atomkärnor, som uran. Processen kallas fission och är ett bevis på att atomkärnor, i motsats till vad Demokritos en gång trodde, inte alls är odelbara. I centrum av stjärnor sker en motsatt process. Där förenas mindre atomkärnor och bildar tyngre grundämnen i en process kallad fusion.
Enligt atomteorin finns det i centrum av atomen en atomkärna. Den är uppbyggd av positivt laddade protoner och oladdade neutroner. Båda partiklarna väger ungefär lika mycket, omkring 1 atommassenhet (1 u). Atomkärnorna hålls samman med hjälp av den kraft som heter den starka kärnkraften. Utan den skulle protonerna repelleras (stötas bort) från varandra eftersom de har samma elektriska laddning. Det är antalet protoner i kärnan som bestämmer vilket grundämne atomen tillhör. Till exempel har väteatomer alltid atomnummer 1 vilket betyder att det endast finns en proton i atomkärnan. Antalet neutroner i ett grundämne kan variera. Atomer med samma antal protoner men med olika antal neutroner kallas för isotoper. Vilken isotop av ett grundämne det är som avses anges av masstalet. Det är det sammanlagda antalet protoner och neutroner i atomkärnan. En isotop av grundämnet väte med masstalet 2 består därför av 1 proton och 1 neutron.
Varje elektron har laddningen –1 och massan 0 u
Varje neutron har laddningen 0 och massan 1u
Varje proton har laddningen +1 och massan 1u

Helium
kärna 1H1
Väte
Masstal (antalet protoner + antalet neutroner)
Atomnummer (antalet protoner)
Kemisk symbol för grundämnet helium

1 proton 0 neutroner
H1 3H1
Deuterium
1 proton 1neutron
Tritium
1 proton 2 neutroner
Överst visas en heliumatom och nedan väteatomer. Väte finns i naturen som en blandning av tre olika isotoper. De har samma antal protoner men olika antal neutroner. Den isotop av väte som saknar neutron är den dominerande i naturen. De två andra är sällsynta.
Runt atomkärnan finns negativt laddade elektroner. Eftersom de har en mycket mindre massa än protonerna och neutronerna räknas inte deras vikt med i masstalet. Elektronbanornas diameter är cirka 100 000 gånger större än atomkärnans diameter. Man kan därför säga att det mesta av en atom egentligen utgörs av tomrum. Elektroner kan endast finnas på vissa bestämda avstånd från kärnan i något av de olika elektronskalen. Egentligen är modellen med atomskal en förenkling. Elektronerna rör sig snarare i en typ av ”elektronmoln” runt atomen. Modellen med elektronskal är dock användbar för att kunna förstå varför kemiska reaktioner sker.
Hur elektronerna är fördelade i de olika skalen kallas för elektronkonfiguration. Det innersta skalet, som ligger närmast kärnan, kallas K-skalet och i det kan det finnas totalt 2 elektroner. Utanför det finns L-skalet, där det kan finnas 8 elektroner och M-skalet, där det kan finnas upp till 18 elektroner. Hos grundämnen med atomnummer 1–20 fylls skalen inifrån och ut. Därefter finns specialregler för hur elektronskalen fylls på. Det är dock viktigt att notera att det yttersta skalet på en atom som mest kan innehålla 8 elektroner. Elektroner i det yttersta skalet kallas också för valenselektroner.
Atomkärna med 18 protoner och 22 neutroner
En atommodell över ädelgasen argon.
Den har 8 valenselektroner i M-skalet, vilket är det yttersta skalet i argonatomen.
Det innebär att atomen har ett fyllt sitt yttersta skal och att atomen därför ogärna reagerar med andra ämnen.

Periodiska systemet
K-skal (2 elektroner)
L-skal (8 elektroner)
M-skal (8 elektroner)
Ett grundämne består av atomer med samma atomnummer och kan inte brytas ner till enklare ämnen i kemiska reaktioner. På jorden finns 92 naturligt förekommande grundämnen. De två lättaste grundämnena är väte och helium medan det tyngsta naturligt förekommande grundämnen på jorden är uran. Utöver detta har 26 grundämnen skapats på konstgjord väg i partikelacceleratorer. Det innebär att det totalt finns 118 kända grundämnen som är ordnade på ett snillrikt sätt i det periodiska systemet. Där är ämnen organiserade på så sätt att atomnumret ökar från vänster till höger och från topp till botten i tabellen. Varje kolumn i tabellen kallas för en grupp och anger hur många valenselektroner en elektriskt neutral atom har. Varje rad i tabellen kallas för en period och anger hur många elektronskal det finns runt atomkärnan (enligt den förenklade modellen).

Det periodiska systemet är ett användbart sätt att organisera grundämnena på eftersom deras plats kan ge ledtrådar om ämnets egenskaper och dess beteende i kemiska reaktioner. Till exempel är grundämnena som är placerade i gruppen längst till vänster (huvudgrupp 1) i det periodiska systemet vanligtvis reaktiva och ger ifrån sig elektroner i kemiska reaktioner. Ämnena i gruppen näst längst till höger (huvudgrupp 17) är också reaktiva ämnen. Men istället för att ge ifrån sig elektroner, plockar de upp elektroner från andra ämnen så att det yttersta skalet får 8 valenselektroner. Ämnena i gruppen längst till höger i systemet (huvudgrupp 18), ädelgaserna, har redan ett fullt yttersta skal och reagerar därför ogärna med andra ämnen.
TESTA DIG SJÄLV
1. Vad betyder ordet atom?
2. Vad händer med en atomkärna då den genomgår fission?
Här visas ett periodiskt system för grundämnen med atomnummer 1–20. De ämnen som tillhör samma period har lika många elektronskal. Ämnen som tillhör samma huvudgrupp har likartade kemiska egenskaper. Det beror på att de (med undantag av helium) har samma antal valenselektroner. Atommassan anger medelvärdet av de naturligt förekommande isotoperna av ämnet.
3. Vad är skillnaden mellan ett grundämnes atomnummer och masstal?
4. Vad menas med en isotop?
5. Hur många protoner och neutroner finns det i isotopen kol-14?
6. Hur många valenselektroner har en oladdad kloratom?
A3 Kemiska föreningar
Diskutera
Varför bildar vissa ämnen kemiska föreningar med varandra?

Svartkrut är en blandning av ämnen. När krutet antänds reagerar beståndsdelarna med syret i luften och bildar gas, främst koldioxid. För varje kilogram krut som antänds bildas omkring 350 liter rökgaser. Det är den här gasen som ger kraft åt en kanonkula så att den kan flyga iväg i snabb hastighet.
I en kemisk förening är olika typer av atomer bundna till varandra genom kemiska bindningar. En kemisk förening har unika egenskaper som skiljer sig från egenskaperna hos ämnena som ingår i föreningen.
Vätgas och syrgas reagerar våldsamt med varandra vid antändning. Slutprodukten blir vatten. Vatten är en kemisk förening som har helt andra egenskaper än vätgas och syrgas. Vatten är exempelvis flytande vid rumstemperatur. Överst visas reaktionen med en kalottmodell. I den representeras atomerna som ingår i molekylen av olikfärgade klot som går in i varandra.
Experiment
Syrgas i luften (O2)
Kemiska föreningar
Oktettregeln är en kemisk tumregel som säger att atomerna reagerar med varandra så att de uppnår en elektronkonfiguration med åtta elektroner i sitt yttersta skal. Det kallas också för att de vill uppnå ädelgasstruktur, eftersom det är den elektronkonfiguration som ädelgaser har. Det är värt att notera att oktettregeln inte gäller för de metaller som räknas som övergångselement. Den gäller inte heller för atomer med låga atomnummer, exempelvis väte och litium, som istället uppnår ädelgasstruktur om det innersta skalet är fyllt med 2 elektroner. Atomer kan uppnå ädelgasstruktur genom att på olika sätt reagera med varandra så att det bildas kemiska föreningar.
En kemisk reaktion är en process där atomer reagerar med varandra och bildar nya föreningar. Det kan ske genom att atomerna avger elektroner, upptar elektroner eller delar på elektroner.

Provrör med vätgas (H2)
Reaktionsformel
Siffran framför den kemiska beteckning anger att 2 vätgasmolekyler deltar i reaktionen.
Siffran framför den kemiska beteckningen anger att det bildas två vattenmolekyler i reaktionen. Den nedsänkta siffran visar att det till varje syreatom fäster två väteatomer.
Bokstaven är symbolen för grundämnet. H står för väte (hydrogen).
Den nedsänkta siffran anger hur många väteatomer det finns i varje vätgasmolekyl.
Pilen visar i vilken riktning reaktionen går. I det här fallet omvandlas i princip all vätgas och syrgas till vatten.
Jonföreningar (salter)
Vissa ämnen kan uppnå ädelgasstruktur genom att de avger valenselektroner till andra atomer. Det gäller exempelvis alkalimetallerna i perioden längst till vänster i det periodiska systemet, som endast har en valenselektron. På så sätt kommer det yttre skalet tömmas på elektroner och det näst yttersta skalet kommer istället att överta rollen som det yttersta skalet. Det innebär att atomen får ädelgasstruktur. Hos halogenerna, ämnena i perioden näst längst till höger, saknas en valenselektron för att atomerna ska få ädelgasstruktur. De upptar därför elektroner från andra atomer för att fylla sitt yttersta skal.
När elektroner tas upp eller avges kommer det att bli en obalans mellan protoner (positivt laddade) och elektroner (negativt laddade) i atomen. Det gör att hela atomen blir positivt eller negativt laddad, den har då blivit en jon.
Laddningen på en jon skrivs ut med laddningen (+ eller −) som en exponent (i upphöjt läge) bakom ämnets kemiska beteckning. Natriumjonen har den kemiska beteckningen (Na+) och kalciumjonen (Ca2+). Kloridjonen har på motsvarande sätt den kemiska beteckningen (Cl ).

Natriumatom Kloratom
Positiv natriumjon
Negativ kloridjon
11 protoner 11 elektroner laddning 0
K-skalet, 2
L-skalet, 8
M-skalet, 1
17 protoner 17 elektroner laddning 0
K-skalet, 2
L-skalet, 8 M-skalet, 7
11 protoner 10 elektroner
K-skalet, 2
L-skalet, 8
17 protoner 18 elektroner laddning -1
K-skalet, 2
L-skalet, 8 M-skalet, 8
Båda atomerna har blivit joner och uppnåt ädelgasstruktur
När natrium (Na) reagerar med klor (Cl) bildas saltet natriumklorid som består av natriumjoner (Na+) och kloridjoner (Cl ). Genom att natriumatomen avger en elektron till kloratomen uppnår de båda jonerna ädelgasstruktur. Reaktionsformeln skrivs: Na + Cl NaCl.
Jonföreningar som är lösta i vatten sitter inte ihop med varandra. Istället omges varje positiv och negativ jon av vattenmolekyler. Om vattnet avdunstar kommer jonerna arrangera sig i regelbundna mönster så att joner med samma laddning kommer så långt bort från varandra som möjligt. Samtidigt bildas starka kemiska bindningar mellan atomerna som kallas jonbindningar. Det beror på att det uppstår attraherande krafter mellan joner med olika laddning. Jonföreningar i fast form bygger på så sätt upp kristaller och kallas då för salter. Det mest kända saltet är det vanliga koksaltet (NaCl) vi använder i mat.
Attraherande krafter mellan joner med motsatt laddning bildar jonbindningar som håller ihop atomerna i saltkristallen.

Saltkristall
Det finns också sammansatta joner. I de här bildar grupper av atomer joner på grund av att de är positivt eller negativt laddade. Sammansatta joner bildar salter med joner av motsatt laddning på samma sätt som andra joner. Exempel på sammansatta joner är karbonatjoner (CO32−), nitratjoner (NO3 ) och sulfatjoner (SO42−).
Na+ (Natriumjon) Cl (Kloridjon) NaCl (Natriumklorid) Koksalt
Na+ (Natriumjon) NO3 (Nitratjon) NaNO3 (Natriumnitrat) Konstgödsel
Ca2+ (Kalciumjon) CO32− (Karbonatjon) CaCO3 (Kalciumkarbonat) Kalksten
Na+ (Natriumjon) HCO3 (Vätekarbonatjon) NaHCO3 (Natriumvätekarbonat) Bikarbonat (bakpulver)
NH4+ (Ammoniumjon) Cl (Kloridjon)
NH4Cl (Ammoniumklorid) Salmiak
Ca2+ (Kalciumjon) SO42− (Sulfatjon) CaSO4 (Kalciumsulfat) Gips
Kväveatom Kväveatom Kvävgasmolekyl
Sex elektroner bildar tre elektronpar
Summaformel: N2
Strukturformel: N N (Varje elektronpar representeras av ett streck.)
Kul- och pinnmodell: (Varje ”kula” representeras en atom och varje ”pinne” ett elektronpar.)

Kväveatomer har fem valenselektroner och behöver tre till för att uppnå ädelgasstruktur. Det får de genom att dela tre elektronpar med varandra.
Syror och baser
Syror är kemiska föreningar som kan ge ifrån sig vätejoner (H+) när de löses i vatten. Hur stark en syra är beror på hur lätt de kan ge ifrån sig vätejoner. När gasen väteklorid (HCl) löses i vatten sönderfaller (protolyseras) praktiskt taget alla molekyler till vätejoner (H+) och kloridjoner (Cl ). Den räknas därför tillsammans med svavelsyra (H2SO4) och salpetersyra (HNO3) till de starka syrorna. Saltsyra bildas av särskilda körtlar i magsäcken och dess funktion är att sänka pH-värdet i magsaften. Det skapar dels en ogästvänlig miljö som hindrar skadliga bakterier att ta sig in i kroppen samtidigt som det aktiverar ett enzym (pepsin) som deltar i nedbrytningen av proteiner i magsäcken.
HCl + H2O H+ + Cl + H2O saltsyra + vatten vätejoner + kloridjoner + vatten
Kolsyra (H2CO3) räknas som en svag syra eftersom den har svårare att sönderfalla och avge vätejoner jämfört med de starka syrorna. När koldioxid löses i vatten uppstår en jämvikt mellan kolsyran och de produkter den bildar. Det visas som med en dubbelpil i reaktionsformeln och visar att reaktionen kan gå åt båda håll.
H2CO3 HCO3 + H+ kolsyra vätekarbonatjoner + vätejoner
Kolsyra (H2CO3) bildas då koldioxid reagerar med vätskan i vårt blod. Koldioxiden är en restprodukt som bildas då vi bryter ner näringsämnen i cellandningen. Ju mer koldioxid det löses i blodet desto mer sjunker blodets pH-värde. Som ett svar ökar pulsen och andningstakten. På så sätt vädras överskottet av koldioxid ut via lungorna och pH-värdet stiger igen.
Baser är till skillnad mot syror kemiska föreningar som kan ta upp vätejoner när de löses i vatten. Hur basiskt ett ämne är beror på hur lätt de kan ta upp vätejoner. Ett exempel på en stark bas är natriumhydroxid (NaOH) som till vardags också kallas kaustiksoda eller lut. När den löses i vatten sönderfaller den fullständigt och det bildas natriumjoner (Na+) och hydroxidjoner (OH ). Det är hydroxidjonerna som tar upp vätejoner.
NaOH Na+ + OH natriumhydroxid natriumjoner + hydroxidjoner

Såväl starka syror som baser är starkt frätande och kan orsaka skador på både hud och ögon. I värsta fall kan de orsaka frätskador och blindhet. Därför ska skyddsutrustning, som gummihandskar, säkerhetskläder och ögonskydd, alltid användas vid hantering av sådana lösningar. Behållare för den sortens av kemikalier ska alltid vara märkta med en farosymbol.
Materia i miljö och samhälle
Saltsyra 1 M
pH-skalan och neutralisationsreaktioner
Hur sur eller basisk en lösning är kan avgöras med hjälp av pH-skalan. Ett pH-värde är ett mått på koncentrationen vätejoner i lösningen (H i pH står för H+). Ju lägre ett pH-värde är desto surare är lösningen.
Tvättmedel
pH-skalan
Natriumhydroxid 1 M

Hög koncentration av H+
pH-indikator
Hög koncentration av OH–
Hur surt eller basiskt något är kan mätas med en pH-indikator eller med en digital pH-meter. Ett pH-värde på 7 är neutralt medan värden lägre och högre är sura respektive basiska. Speciellt med pH-skalan är att den är omvänd och logaritmisk. Det innebär att ju mer koncentrationen av vätejoner ökar desto lägre blir pH-värdet. Dessutom ökar eller minskar koncentrationen med vätejoner med 10 gånger för varje steg i skalan. Det innebär att en lösning med pH 5 är 100 gånger surare än en lösning med pH 7.
När en stark syra blandas med en lika stark bas resulterar det i att lösningen blir neutral (förutsatt att det avges lika många vätejoner som det tas upp). En sådan kemisk reaktion kallas därför för en neutralisationsreaktion. Om exempelvis saltsyra blandas med natriumhydroxid i rätt proportioner bildas en lösning av vatten med natrium- och kloridjoner. Det har med andra ord bildats en blandning av vatten och natriumklorid, vilket är detsamma som saltvatten.
HCl + NaOH Na+ + Cl + H2O
saltsyra + natriumhydroxid natriumjoner + kloridjoner + vatten
Neutralisationsreaktioner har många användningsområden. I laboratoriet kan tekniken användas för att göra starkt sura och basiska lösningar ofarliga innan de kasseras. Tekniken kan också användas för att rena rökgaserna från sopförbränningsanläggningar och fossileldade kraftverk.
Surt regn
Surt regn är en form av nederbörd med ett pH-värde under 5,5. Det kan uppstå av naturliga orsaker, såsom vulkanutbrott och skogsbränder, men den främsta orsaken är mänskliga aktiviteter. Vid förbränning av fossila bränslen och avfall släpps luftföroreningar ut i form av svaveldioxid (SO₂) och kväveoxider (NOx). När de reagerar med ämnen i atmosfären bildas svavelsyra (H₂SO₄) och salpetersyra (HNO₃), vilket ger upphov till surt regn. Eftersom gaserna kan färdas med vinden över långa avstånd kan surt regn falla långt ifrån den plats där utsläppen skett.
Sedan 1980-talet har problemet med surt regn minskat i både Europa och Nordamerika. Samtidigt har utflyttningen av tung tillverkningsindustri till Asien lett till att surt regn blivit ett växande problem i länder som Kina och Indien. Minskningen av försurande utsläpp i västvärlden beror till stor del på strängare miljöregler, som begränsat användningen av fossila bränslen med högt svavelinnehåll. Dessutom har många industrier och fossileldade kraftverk börjat rena sina rökgaser med hjälp av scrubbers. Det är filter som neutraliserar sura utsläpp genom att rökgaserna får reagera med basiska ämnen, exempelvis kalciumkarbonat eller natriumhydroxid. I många länder är det numera också ett krav att nytillverkade bensinbilar ska vara utrustade med en katalysator. Det är en anordning på avgasröret som omvandlar kväveoxider (NOx) till mindre skadliga ämnen innan avgaserna släpps ut i luften.

NOx är ett samlingsnamn för kväveoxiderna kvävemonoxid (NO) och kvävedioxid (NO2). De bildas vid förbränning vid höga temperaturer och bidrar till luftföroreningar.
Vid förbränning bildas rökgaser som innehåller kväveoxider (NOx) och ibland även svaveldioxid (SO2). Gaserna bidrar till luftföroreningar, vilket kan påverka människors hälsa och leda till bildning av surt regn. Surt regn kan i sin tur orsaka försurning av sjöar, vattendrag och skogsmark, vilket påverkar både djur och växter negativt.
Surt regn
Skogsskador
Surt regn kan orsaka allvarliga skador på skogar, vilket kan leda till att träden försvagas och växer långsammare. Skadornas omfattning beror på flera faktorer, såsom regnets surhetsgrad, trädslag och markens kalkhalt. I de allvarligaste fallen kan hela skogspartier dö. Surt nedfall kan påverka ett träd på olika sätt. Förutom att skada rötter och barr kan surt regn även orsaka indirekta skador genom att utarma jorden på viktiga näringsämnen. Det försvagar träden ytterligare och gör dem mer sårbara för skadeinsekter och sjukdomar. Omfattande skador till följd av surt regn kan försämra den biologiska mångfalden och orsaka stora ekonomiska förluster inom skogsindustrin.

Barrens skyddande vaxlager förstörs, vilket gör att de gulnar och tappas i förtid.
Försvagade träd är mer mottagliga för skadeinsekter och sjukdomar.
Vätejoner från surt regn tränger undan postivt laddade näringsämnen från markpartiklarna.
Vid låga pH-värden kan aluminiumjoner frigöras och skada trädens rötter.
Näringsämnen urlakas och försvinner med markvattnet.
Surt regn kan försämra tillväxten hos en gran på flera olika sätt. Förutom att förstöra barren (1) och öka risken för skadeinsekter och sjukdomar (2) kan det också skada rotsystemet (3) och orsaka näringsbrist i jorden (4a och 4b).
Försurning i sjöar och vattendrag
Surt regn kan även orsaka försurning i sjöar och vattendrag. Det ska inte förväxlas med havsförsurning, som uppstår när ökade mängder koldioxid löser sig i havsvattnet och omvandlas till kolsyra. När ett vattendrag försuras sjunker pH-värdet så mycket att vissa arter börjar påverkas negativt. Hur allvarlig påverkan blir beror både på mängden surt nedfall och på vattendragets buffertförmåga, det vill säga dess förmåga att motstå förändringar i pH-värdet. I områden med kalkrik berggrund, till exempel Gotland och Skåne, har sjöar och vattendrag en god buffertförmåga och påverkas endast lite av surt regn. Däremot har vattendrag i områden med kalkfattig berggrund, som i delar av Västra Götaland, en låg buffertförmåga. Där kan surt regn leda till att pH-värdet sjunker drastiskt. Eftersom planktonalger, kräftdjur och snäckor är känsliga för surt vatten leder det till en förändrad artsammansättning. Eftersom algerna dessutom utgör grunden för många näringskedjor kommer andra organismer indirekt att påverkas av att planktonalgerna försvinner.
TESTA DIG SJÄLV

pH 4 5 6 7
Genom att göra en fältundersökning och leta efter indikatororganismer för försurning i ett vattendrag kan man snabbt få en uppfattning om det är försurat eller inte. Om man till exempel hittar kräftdjur och snäckor tyder det på att vattnet inte är försurat. De här organismerna är känsliga för vatten med lågt pH-värde eftersom deras skal består av kalciumkarbonat (CaCO3). I en sur miljö löses skalen långsamt upp, vilket kan leda till att skalen blir tunnare och att djuren dör. Andra djur, såsom klodyvlar och mygglarver, är däremot relativt tåliga mot försurning. Det beror bland annat på att de andas atmosfärisk luft från vattenytan och saknar gälar som kan skadas av det sura vattnet.
1. Vilka av följande är blandningar? koldioxid, luften i atmosfären, destillerat vatten, sand blandat med salt, en sockerlösning
2. Vad menas med en legering?
3. Hur många elektroner i det yttersta skalet behöver en kloratom ha för att uppnå ädelgasstruktur?
4. Vad betyder den nedsänkta siffran i H2O?
5. Vad är den kemiska beteckningen på kalcium efter det att den avgett två elektroner och blivit en jon?
6. En syreatom har 6 valenselektroner. Hur många elektronparbindningar behöver bildas för att 2 syreatomer ska kunna förenas i en syrgasmolekyl?
7. Vad kännetecknar ämnen som är starka syror?
8. Vad säger ett lågt pH-värde om koncentrationen av vätejoner i vatten?
9. Vilka två gaser bidrar till surt regn?
10. Ge två exempel på hur surt regn kan leda till att en gran försvagas.
11. Ge två exempel på djurgrupper som är känsliga för surt vatten.
A4 Organisk kemi
Diskutera
Varför finns det så många olika typer av organiska föreningar?

Olja och naturgas består av en typ av organiska ämnen som heter kolväten. Bränslena sägs vara fossila eftersom de härstammar från organismer som levde i haven för miljontals år sedan.

Många organiska ämnen har en viktig betydelse inom läkemedelsindustrin. Ett exempel är acetylsalicylsyra som är den aktiva substansen i en grupp läkemedel med smärtstillande, febernedsättande, antiinflammatorisk effekt.
Organiska ämnen
Kemiska föreningar kan antingen vara organiska eller oorganiska. Organiska ämnen kännetecknas av att de innehåller kolatomer som är bundna till exempelvis väte-, syre- och kväveatomer. Oorganiska ämnen är vanligtvis mindre komplexa i sin uppbyggnad och saknar, med några få undantag, kolatomer. Namnen organiska ämnen kommer från tiden då kemister antog att de endast kunde bildas i levande organismer. Idag finns det många organiska ämnen som kan skapas på konstgjord väg i laboratorium. Några sorter används också som drivmedel i förbränningsmotorer och som råmaterial vid plasttillverkning. En del organiska föreningar är en förutsättning för liv, andra bildar miljögifter.
Kolväten
De enklaste organiska föreningarna är kolväten. Namnet har de fått eftersom de enbart består av kolatomer och väteatomer. Kolatomerna bildar tillsammans en grundstruktur, kallad ett kolskelett, som väteatomerna sitter bundna till. Det enklaste kolvätet heter metan (CH4) och består av en kolatom och fyra väteatomer.

Väteatom
Kolatom
Summaformel: CH4
Strukturformel:
Kul- och pinnmodell:
Metanmolekyl
Kolatomen har fyra valenselektroner vilket gör att den har speciella egenskaper. Genom att dela fyra elektronpar med andra atomer kan kolatomen bilda ett mycket stort antal olika kemiska föreningar.

Metan (CH4) har endast en kolatom och är det enklaste av alla ämnen i metanserien. Det andra ämnet i serien är etan (C2H6) som består av två kolatomer. Serien fortsätter sedan med propan (C3H8), butan (C4H10) och så vidare.
Namn Summaformel Strukturformel
Metan CH4
Etan C2H6
Propan C3H8
Butan C4H10
Pentan C5H12

Här visas de fem första ämnena i metanserien. De utgör ofta byggstenar till andra typer av organiska föreningar. Gemensamt för de ämnen som visas är att de är mättade. Med det menas att de saknar dubbelbindningar mellan kolatomerna.
Metan bildas när vissa typer av bakterier bryter ner organiskt material i syrefria miljöer. Det sker exempelvis i våtmarker, risodlingar och på platser där organiskt avfall dumpas på deponi. Metan bildas också i tarmarna på idisslande djur, exempelvis kor. Om metan släpps ut oförbränd i atmosfären är den en mycket effektiv växthusgas. Sammantaget står utsläppen av metan för omkring 30 % av växthusgasernas samlade påverkan på klimatet.
Alkoholer
Ämnena i metanserien kan lätt modifieras genom att en eller flera väteatomer byts ut mot andra atomgrupper. Sådana typer av atomgrupper kallas för funktionella grupper. Molekyler med samma funktionella grupper delar liknande kemiska egenskaper med varandra. Om en av väteatomerna byts ut mot en hydroxylgrupp (-OH) bildas en alkohol. Det kan i vissa fall finnas flera hydroxylgrupper på en och samma molekyl. Ett exempel är glycerolmolekylen som har tre hydroxylgrupper.
Inom bioteknik används levande organismer för att utveckla olika produkter. Ett exempel är jäsning med hjälp av mikroorganismer.

Etanol är den alkohol de flesta syftar på när de talar om ”alkohol”. Den bildas genom att mikroorganismer som till exempel jäst, en typ av encelliga svampar, omvandlar socker eller stärkelse från växtriket till etanol i en process som kallas jäsning. Processen används inom bakning för att jäsa bröd och inom öl- och vinindustrin för att producera alkoholhaltiga drycker. I naturlig jäsning kan alkoholhalten inte bli högre än 14 %. Efter det dör jästcellerna. I jäsningen sker följande reaktion:
C6H12O6 2C2H5OH + 2CO2 glukos etanol + koldioxid
Vätskor med en hög alkoholhalt kallas för sprit och framställs genom att ett alkoholhaltigt utgångsmaterial destilleras. Med det menas att olika vätskor i en blandning separeras från varandra vid upphettning. När en etanolblandning upphettas kommer etanolen förångas först eftersom den har en lägre kokpunkt (78 °C) än vatten (100 °C). Genom att därefter låta etanolångorna passera igenom en kylanordning kommer den att kondenseras och omvandlas till flytande etanol igen. På så sätt kan etanolen separeras från vattnet.
Alkoholer namnges genom att ändelsen -ol läggs till namnet på motsvarande kolväte i metanserien. Metan och etan är grundstrukturerna i alkolholerna metanol och etanol.

Etanolen i handsprit är denaturerad. Med det menas att det finns tillsatser som gör att spriten blir otjänlig för förtäring.
Enligt alkohollagen är det förbjudet att på egen hand destillera alkohol. Olovlig framställning av spritdrycker kallas för hembränning.
Etanol tillverkas för andra ändamål än att vara ett berusningsmedel. På grund av att den ena änden av etanolmolekylen är polär och den andra opolär kan den användas som lösningsmedel, som till exempel T-sprit. Etanol är också bakteriedödande vilket gör att den utgör huvudråvaran i både handsprit och de medel för ytdesinfektion som används inom sjukvården. Etanol är också lättantändlig vilket gör att den kan användas i en förbränningsmotor på samma sätt som bensin. Etanol i form av biodrivmedel säljs i Sverige som E85 (85 % etanol och 15 % bensin).
Biomolekyler
Kolhydrater, lipider, proteiner och nukleinsyror (DNA och RNA) är organiska molekyler och benämns biomolekyler. Producenter som växter, alger och cyanobakterier bildar själva de här molekylerna från oorganiska ämnen i fotosyntesen. De organismer som inte själva kan utöva fotosyntes måste istället få i sig biomolekyler genom att äta. I kroppen används biomolekyler antingen som byggstenar eller för att brytas ner så att vi får energi.
Kolhydrater
Kolhydrater är ett samlingsnamn för enklare sockerarter, stärkelser och fibrer. De består av en eller flera sockermolekyler och innehåller endast grundämnena kol, väte och syre. Eftersom sockermolekyler oftast förekommer i ringformade strukturer kallas enskilda molekyler ofta bara för ”sockerringar”. De som endast består av en sockerring benämns monosackarider (mono betyder en). Exempel är glukos (druvsocker), fruktos och galaktos.
Strukturformel Skelettformel ”Sockerring”
Inom kemin kan molekyler representeras på olika sätt. Till vänster har en glukosmolekyl ritats med en strukturformel. I mitten har samma molekyl ritats med skelettstruktur. Det innebär att varken kolatomerna, eller de väteatomer som är bundna till kolatomerna, skrivs ut. Till höger har glukosmolekylen ritats som en ”sockerring”.

De som består av två ihopkopplade sockerringar kallas disackarider (di betyder två). Exempel på vanligt förekommande disackarider är sackaros (rörsocker), maltos (maltsocker) och laktos (mjölksocker). De som består av ett stort antal ihopkopplade sockerringar kallas polysackarider (poly betyder flera). Exempel är stärkelse, glykogen och cellulosa. Stärkelse bildas hos växter och är ett sätt för växten att lagra glukosmolekyler. Cellulosa är en närbesläktad polysackarid där de kemiska bindningarna skiljer sig från dem hos stärkelse. Glykogen är djurens motsvarighet till stärkelse. Hos oss lagras glykogen framförallt i levern och i musklerna.

Monosackarider
Disackarider
Polysackarider
Glykogen
Både disackarider och polysackarider består av hopfogade monosackarider. Beroende på vilka monosackarider som ingår i en disackarid bildas olika sockerarter. De olika polysackariderna består av glukosmolekyler som sitter ihop med varandra på olika sätt. Här visas monosackariderna med olika färg.
Plaster
Plaster är polymerer som framställs på konstgjord väg av människan. Den första plasten att produceras i industriell skala var bakelit. Den uppfanns i början av 1900-talet och användes bland annat för att tillverka dåtidens telefoner. Därefter har andra sorters plaster utvecklats och en egentlig massproduktion kom inte igång förrän på 1950-talet. Sedan dess har produktionen av plast ökat för varje år. Idag tillverkas mer än 200 gånger så mycket som på 1950-talet. Huvuddelen används för tillverkning av förpackningar, byggnadsmaterial och textilier.
Beroende på vilka molekyler som sammanfogas och vilka tillsatser som används kan en mängd olika typer av plaster framställas. Plaster används ofta till förpackningar. Detta beror på att de är både starka och lufttäta. Eftersom förpackningarna kan vara lufttäta ökar hållbarheten för olika livsmedel, vilket i sin tur kan minska matsvinnet. Den mest tillverkade plasten idag är polyeten (PE). Den tillverkas genom att etenmolekyler sammanlänkas till en lång kedja (polymer) av molekyler. Polyeten används bland annat för att tillverka plastpåsar och plastfolie. Andra vanliga plaster är PVC (polyvinylklorid) och PET (polyetentereftalat). PVC har många användningsområden. De används bland annat till att göra vatten- och avloppsrör. PET används till att göra en typ av plastflaskor kallade PET-flaskor.

Många plaster tillverkas av ämnen som utvinns från råolja och naturgas. När plastavfallet bränns bildas koldioxid som är en växthusgas.

En kemisk reaktion där mindre molekyler sammanlänkas till en lång kedja kallas för en polymerisation. I reaktionen till vänster sammanlänkas etenmolekyler till en lång kedja av polyeten. Eten Polyeten (PE)
En av plasternas påverkan på miljön beror på att de tillverkas av ämnen som utvinns från råolja och naturgas. Under senare år har det börjat dyka upp alternativ i form av biobaserade plaster. Ett exempel är biobaserad polyeten (PE) som kan användas till bärkassar. Råvarorna till biobaserade plaster kommer i regel från växtriket och utgörs av majsstärkelse eller cellulosa. Det sker också försök med att tillverka biobaserade plaster från alger. Att en plast är biobaserad är ingen garanti för att den är biologiskt nedbrytbar. Biobaserade plaster kan dock göras både fossilfria och biologiskt nedbrytbara.

Spöknät är kommersiella fiskenät som har förlorats, övergivits eller kasserats till sjöss. Varje år är de ansvariga för att fånga och döda miljontals marina djur i havet.
Många plastprodukter används bara under en begränsad tid, engångsprodukter används bara vid ett enda tillfälle. Det i kombination med att plast kan ha en lång livslängd resulterar i att det varje år bildas stora mängder plastskräp som måste tas omhand på ett ansvarsfullt sätt. Omkring två tredjedelar av all plast som årligen produceras varken material- eller energiåtervinns. Istället hamnar den på sopdeponi eller slängs i naturen. I dagsläget finns uppskattningsvis omkring 150 miljoner ton plastskräp i världshaven och mängden ökar för varje år. Plastskräp kan påverka miljön på flera olika sätt. Många marina djur, exempelvis havsfåglar, fiskar, havssköldpaddor, sälar och valar kan fastna i gamla fiskenät och rep. Plastbitar kan också misstas för mat. Plasten kan då både skada matsmältningskanalen och ge falsk mättnadskänsla vilket leder till att djuren svälter. Med tiden bryts stora plastbitar ner till mindre på grund av nötning och UV-ljus. När plastbitarna är mindre än 5 millimeter stora kallas de för mikroplast. Sådana små plastbitar kan ätas av djurplankton och fiskyngel och leda till att de svälter. Om nedbrytningen fortsätter kan mikroplasten omvandlas till ännu mindre plastbitar, så kallad nanoplast. Forskning tyder på att de kan ha en negativ påverkan på både miljö och hälsa.
TESTA DIG SJÄLV
1. Vilka grundämnen är de organiska föreningarna i metanserien uppbyggda av?
2. Hur många väteatomer är bundna till varje kolatom i en metanmolekyl?
3. Ange en källa till metanutsläpp.
4. Vad heter de organiska föreningar som har en hydroxylgrupp (-OH)?
5. Vad heter den metod med vilken etanol separeras från vatten i en blandning?
6. Vilken disackarid består av glukos och fruktos?
7. Vad kallas fettsyror som saknar dubbelbindningar?
8. Ange två sätt på vilka plastskräp i havet kan påverka exempelvis sjöfåglar.
Biogas och naturgas
Metan är huvudbeståndsdelen i både biogas och naturgas (fossilgas). Trots att båda bränslena kemiskt sett är identiska har de olika miljöpåverkan. Biogas är ett biobränsle som framställs genom att matavfall, gödsel och restprodukter rötas med hjälp av bakterier i en syrefri miljö. Eftersom materialet har sitt ursprung i växter som nyligen har tagit upp koldioxid genom fotosyntes, ingår dess kolatomer i den snabba kolcykeln. Därför leder förbränning av biogas inte till någon nettoökning av koldioxid i atmosfären.
Koldioxid i atmosfären
Fotosyntes
Förbränning, respiration och nedbrytning av dött organiskt material
Naturgas är ett fossilt bränsle som utvinns ur gasfyndigheter i berggrunden. Det innebär att gasen har bildats av organiskt material från organismer som levde för miljontals år sedan. Eftersom dessa kolatomer inte har varit en del av biosfären på mycket lång tid, ingår de i den långsamma kolcykeln. När naturgas förbränns frigörs koldioxid som orsakar en nettoökning av koldioxid i atmosfären, vilket bidrar till den globala uppvärmningen.

Växter omvandlar koldioxid till glukos och andra energirika föreningar.
Organiskt material i organismer. Jord
Förbränning av biogas
Biogas
Rötning av organiskt avfall.
Förbränning av naturgas
LÅNGSAMMA KOLCYKELN
Naturgas
Gasfyndighet
Organiskt material från förhistoriska organismer. Fossila bränslen
Kolatomerna i biogas har, till skillnad från dem i naturgas, sitt ursprung i dött organiskt material från organismer som levt i nutid. Det innebär att kolatomerna ingår i den snabba kolcykeln och att biogas kan förbrännas utan att det leder till en nettoökning av koldioxid i atmosfären. När naturgas (fossilgas) förbränns frigörs kolatomer som inte varit en del av biosfären på miljontals år. Det leder till en nettoökning av koldioxid i atmosfären. Att ersätta naturgas med biogas kan därför vara en del av klimatomställningen.
Miljöföroreningar
Miljöföroreningar är ett samlingsnamn för skadliga ämnen som påverkar klimat, ekosystem och människors hälsa negativt. Även om vissa föroreningar har naturligt ursprung, som de från vulkanutbrott och skogsbränder, kommer merparten från mänskliga aktiviteter som jordbruk, transport och industri. Vissa ämnen som förekommer naturligt klassas som föroreningar när mänskliga aktiviteter ökar deras förekomst i naturen så att de påverkar klimatet eller ekosystemen negativt. Ett exempel är koldioxid. Utsläpp från förbränning av fossila bränslen och avskogning har lett till ökade halter i atmosfären, vilket driver på den globala uppvärmningen. På liknande sätt räknas även kväve- och fosforföreningar som miljöföroreningar när de orsakar övergödning, algblomning och bottendöd.
En annan typ av föroreningar utgörs av den grupp kemikalier som går under samlingsnamnet miljögifter. Hit räknas vissa giftiga metaller samt en del svårnedbrytbara organiska ämnen som tillverkas industriellt. Om dessa ämnen sprids i luft, mark och vatten kan de påverka både människors hälsa och miljön negativt.
Luftföroreningar
Markföroreningar
• Gaser från förbränning av fossila bränslen (koldioxid, svaveldioxid och kväveoxider).
• Metanutsläpp från boskap, oljeutvinning och avfallsdeponier.
• Partiklar (sot).
• Tungmetaller från transport och industri.
• Industriavfall (tungmetaller och kemikalier).
• Kemikalier från jordbruket (konstgödsel och bekämpningsmedel).
• Läckage från avfallsdeponier (tungmetaller, kemikalier och mikroplast).
Vattenföroreningar
• Ämnen från jordbruket (läckage av näringsämnen och bekämpningsmedel).
• Utsläpp från industrier (tungmetaller och kemikalier).
• Orenat avloppsvatten (näringsämnen, bakterier och medicinrester).
• Avfall (plast och mikroplast).
• Oljeutsläpp.
Industriell kvävefixering
Ärtväxt
Kvävefixering
Kvävets kretslopp
Trots att atmosfären till största delen består av kvävgas är kväve ändå ofta en bristvara i många ekosystem. Det beror på att kvävgasen först måste omvandlas till andra typer av kväveföreningar för att kunna tas upp av växter. Omvandlingen kan ske på olika sätt men den mest betydelsefulla processen är genom kvävefixerande bakterier. De lever antingen fritt i jorden eller i rotknölar på exempelvis baljväxter. Bakterierna bildar ammonium som i sin tur omvandlas till nitrat av nitrifikationsbakterier.
Nitratjonerna kan tas upp av växter, som använder kvävet för att bilda DNA och aminosyror. Därefter blir kvävet även tillgängligt för konsumenter. Döda organismer och djurs avföring innehåller kväveföreningar som nedbrytare omvandlar tillbaka till nitrat. En del av detta nitrat tas upp av växter. En annan del kommer istället omvandlas till kvävgas igen via denitrifikationsbakterier som trivs i syrefria miljöer i exempelvis våtmarker.

Biologisk kvävefixering
Konstgödsel
Urin och dött organiskt material bryts ner av bakterier
Upptag av växter
Luftburna kväveföreningar
Kväveoxider
Våtmark
Denitrifikation av bakterier i syrefri miljö
Omvandling av bakterier genom nitrifikation
Hur grundämnet kväve rör sig genom naturen, från atmosfären till närsalter, levande organismer och tillbaka igen, beskrivs av de olika stegen i kvävets kretslopp. Tillverkning av konstgödsel och förbränning av fossila bränslen (röda pilar) har rubbat kretsloppet. Idag omvandlas sammantaget mer kvävgas till närsalter genom mänskliga aktiviteter än genom naturliga processer. Det är något som förklarar varför det ofta finns ett överskott av kväveföreningar i många ekosystem, vilket kan orsaka övergödning.
Fosforns kretslopp
Fosfor har till skillnad mot kväve sitt ursprung i fosfatmineraler i berggrunden. När berggrunden vittrar frigörs fosfatjoner. I ett ekosystem kan fosfatjonerna tas upp av växter och bli tillgängliga för konsumenter och nedbrytare. Fosfor behövs för att levande organismer ska kunna bygga DNA och fosfolipider (molekyler som bygger upp cellmembranet). Nedbrytare omvandlar de organiska föreningarna i avföring och döda kroppar tillbaka till fosfatjoner. Fosfat kan också transporteras till vattendrag och till hav genom urlakning från jorden. Där kan de tas upp av producenter och på motsvarande sätt, som på land, bli tillgängliga för konsumenter och nedbrytare. En del dött organiskt material kan hamna som sediment på botten. Där kan sedimentet genom långsamma geologiska processer omvandlas tillbaka till fosformineral och berggrund igen.

Bergart med fosfatmineral
Gruvdrift
Vittring Växter
Upptag på land
Konstgödsel
organiskt material
Transport till havet
Urlakning av näringsämnen
Upptag i havet
organiskt material
Sedimentation och bergartsbildning
Tektoniska processer vilka leder till att havsbotten blir land
Hur grundämnet fosfor rör sig genom naturen, från berggrund, levande organismer och tillbaka igen, beskrivs av de olika stegen i fosforns kretslopp. Människan har rubbat fosforns kretslopp genom att bryta fosformineral för att tillverka konstgödsel (röd pil). Idag tillförs mer fosfat från gruvbrytning för att tillverka konstgödsel än från naturliga processer genom vittring. Då överskottet läcker ut i sjöar och hav har det bidragit till att orsaka övergödning.
Våtmarker fungerar som naturliga reningsverk då växterna effektivt tar upp kväve och fosfor från vattnet. På botten i våtmarker finns syrefria miljöer där denitrifikationsbakterier omvandlar nitrat till atmosfärisk kvävgas igen. Att anlägga våtmarker i anslutning till jordbruksmark kan därför vara ett effektivt sätt att motverka övergödning.
Människan påverkar kretsloppen
Människan påverkar näringsämnenas kretslopp på flera sätt. Under det senaste århundradet har produktionen av billig konstgödsel inom jordbruket lett till en ökad mängd näringsämnen i omlopp. För att öka grödornas avkastning används antingen industriellt tillverkat konstgödsel eller naturgödsel, som urin och djurspillning. Näringsämnen som urlakas ur jorden kan följa med markvattnet ut i sjöar, floder och hav. Ett överskott av näringsämnen kan där orsaka övergödning, vilket i sin tur kan leda till algblomning och bottendöd.
Även orenat avloppsvatten kan bidra till övergödning, eftersom det innehåller höga halter av kväve- och fosforföreningar.
Därför är det viktigt att avloppsvatten renas i godkända avloppsreningsverk innan det släpps ut i naturen. En del kväveföreningar kommer också från luftföroreningar. Vid förbränning av fossila bränslen bildas kväveoxider, som reagerar med ämnen i luften och bildar salpetersyra. Syran kan blandas med nederbörden och falla ned som surt regn, vilket även innehåller nitrat som kan bidra till övergödning. Utsläppen av kväveoxider från biltrafiken kan minskas genom att bensindrivna bilars avgaser renas med katalysatorer.

På grund av biomagnifikation ökar koncentrationerna av ett miljögift i en näringskedja. Det beror på att organismerna får i sig mer av ämnet än de kan göra sig av med. Biomagnifikation förklarar varför isbjörnar kan ha höga halter av perfluorerade kolväten i sin fettrika lever trots att de lever långt från de fabriker som producerar dem. Perfluorerade kolväten (PFAS) används bland annat i vattenavvisande kläder, i non-stick-beläggningar i stekpannor och i skidvallor.
inom jordbruket. Det gäller också blykulor i jaktammunition. Kemikalier kan också spridas från en produkt när den blivit avfall. Det gäller exempelvis metallerna i batterier och elektronik, om avfallet inte tas omhand på ett säkert sätt. Miljögifter kan också bildas när avfallsprodukterna förbränns på en avfallsanläggning. Det gäller till exempel vissa plastsorter. Om det finns rökgasrening kan huvuddelen av alla miljögifter avlägsnas. Metaller som sprids i naturen bryts inte ner eftersom de är grundämnen. De metaller som hamnar i luften vid förbränning kommer med tiden falla ner och ansamlas i markens översta lager. Med tiden kan de med hjälp av regnvattnet transporteras till sjöar och vattendrag där de med tiden hamnar i bottensedimentet. Både giftiga metaller och många svårnedbrytbara organiska ämnen är fettlösliga och ansamlas i alger och djurs fettvävnad. Eftersom ämnena inte bryts ner kommer koncentrationen av ämnen att öka under organismens levnad. Detta kallas för bioackumulation. När organismerna sedan äts av djur högre upp i näringskedjan ökar koncentrationen av miljögifter. Det här kallas biomagnifikation och kan förklara varför djur högt upp i näringskedjan kan ha halter av miljögifter i sin fettvävnad som är fler miljoner gånger högre än i havet.
Koncentration av ämnet i vattnet är låg

Miljögift
Producent (Fytoplankton)
Förstahandskonsument (Zooplankton)
Toppkonsument (Isbjörn)
Koncentration av ämnet hos toppkonsumenten är hög
Fjärdehandskonsument (Säl)
Tredjehandskonsument (Rovfisk)
Andrahandskonsument (Planktonätande fisk)
Naturligtvis NATURKUNSKAP 2
Naturligtvis naturkunskap 2 är ett läromedel i gymnasieämnet Naturkunskap, nivå 2 (100 p), som utgår från den uppdaterade ämnesplanen Gy25.
Boken har följande kapitelindelning:
A Materia i miljö och samhälle
B Universum och materians uppkomst
C Livet utvecklas
D Transport och ämnesomsättning
E Försvar och kommunikation


Karl-Niklas Hult har många års erfarenhet av att undervisa i naturkunskap på gymnasiet. Han har även en masterexamen i biologi, erfarenhet av fiskodling och har deltagit i ett projekt finansierat av WWF med syfte att kartlägga vithajsbeståndet utanför Sydafrikas kust. Karl-Niklas har även erfarenhet av att undervisa på IB-programmet.
Peter Olsson arbetar som gymnasielärare med undervisning i naturkunskap, biologi och även på IB-programmet. Tidigare har han doktorerat och forskat om fåglars syn vid Lunds universitet samt undervisat på universitetsnivå. Han har även medverkat i den populära Biologishowen som anordnas av naturvetenskapliga fakulteten i Lund.
