JChoroby mięśnia sercowego
Zofia T. Bilińska (J.1), Łukasz Małek (J.1), Katarzyna Elżbieta Biernacka (J.2), Jan Wodniecki (J.2)
1. Zapalenie mięśnia sercowego
ang. myocarditis
➔ DEFINICJA
Zapalenie mięśnia sercowego (ZMS) jest chorobą o różnej etiologii, w której proces zapalny obejmuje kardiomiocyty, tkankę śródmiąższową, naczynia, niekiedy też osierdzie, i może doprowadzić do kardiomiopatii zapalnej i niewydolności serca (NS). Kardiomiopatię zapalną definiuje się jako ZMS, któremu towarzyszy dysfunkcja mięśnia sercowego. Według WHO i ISFC ZMS definiuje się na podstawie kryteriów histologicznych, immunologicznych i immunohistochemicznych. Kryterium histologicznym jest stwierdzenie rozsianego nacieku zapalnego z towarzyszącym zwyrodnieniem i nie niedokrwienną martwicą przyległych kardiomiocytów, natomiast kryterium immunohistochemiczne (wg stanowiska ESC 2013) stanowi liczba komórek w nacieku zapalnym (na mm2 tkanki mięśnia sercowego) >14 leukocytów, w tym do 4 monocytów, z obecnością ≥7 limfocytów T CD3+.
➔ EPIDEMIOLOGI A
Na świecie rocznie rejestr uje się ~500 000 przypadków ostrego i podostrego ZMS. Częstość występowania ZMS i nasilenie objawów zależą od wieku i płci. U dzieci występują 2 szczyty zachorowań – w okresie niemowlęcym i wczesnego dzieciństwa, następnie w okresie nastoletnim, przy większym ryzyku u mężczyzn niż u kobiet. Ryzyko ZMS pozostaje zwiększone u mężczyzn aż do 35.–40. rż. Po 40. rż. częstość występowania ZMS maleje u obu płci, ale ponownie się zwiększa u kobiet po menopauzie.
➔ ETIOLOGIA I PATOGENEZA
W większości przypadków ZMS nie udaje się zidentyfikować czynnika etiologicznego. Oprócz zakażenia de novo możliwa jest reaktywacja zakażenia utajonego.
ZMS mogą wywołać: 1) czynniki infekcyjne a) wirusy (najczęstsza przyczyna) – parwowirus B19, ludzki herpeswirus typu 6 [HHV6], Coxsackie B, ade
nowirusy, inne herpeswirusy (wirus Epsteina i Barr, wirus cytomegalii, wirus ospy wietrznej i półpaśca), wirus zapalenia wątroby (WZW) typu C, wirusy ECHO, wirusy grypy A i B, wirus różyczki; możliwe są zakażenia więcej niż 1 wirusem, np. parwowirusem
B19 i HHV 6; ZMS w przebiegu COVID19 – rozdz. XI.D.15.2
b) inne czynniki infekcyjne
– bakterie – Borrelia burgdorferi, Coxiella burnetii, prątek gruźlicy, pneumokoki, gronkowce, Haemophilus spp , Salmonella spp , Legionella spp. i in.
– riketsje, mykoplazmy, chlamydie
– robaki – włosień kręty, glista ludzka, tasiemiec bąblowcowy ludzki, glista psia
– grzyby ( Aspergillus spp , Candida spp. i in.)
– pierwotniaki – Toxoplasma gondii, Entamoeba histolytica, Trypanosoma cruzi (choroba Chagasa)
2) czynniki autoimmunizacy jne i in.
a) wobec alergenów (toksyna tężcowa, szczepionki, leki) b) wobec alogenów (odrzucanie przeszczepu serca) c) wobec własnych antygenów – w przebiegu chorób układowych, np. tocznia rumieniowatego układowego, reumatoidalnego zapalenia stawów, zapalenia naczyń ANCAdodatniego, celiakii i innych chorób autoimmunologicznych d) wywołujące sarkoidozę Olbrzymiokomórkowe ZMS współistnieje z chorobami autoimmunologicznymi u 19% chorych. Eozynofilowe ZMS (szczególna postać ZMS) może być spowodowane reakcją nadwrażliwości na leki lub wystąpić w przebiegu układowego zapalenia naczyń (m.in. eozynofilowej ziarniniakowatości z zapaleniem naczyń) i innych chorób układowych.
3) czynniki toksyczne a) leki – antybiotyki – amfoterycyna B, ampicylina, penicylina, tetracyklina, streptomycyna oraz sulfonamidy – leki przeciwgruźlicze – izoniazyd, kwas paraaminosalicylowy
– leki przeciwdrgawkowe – zwłaszcza karbamazepina i fenytoina
– niesteroidowe leki przeciwzapalne (NSLPZ) –mesalazyna
– diuretyki – acetazolamid, chlortalidon, hydrochlorotiazyd, spironolakton
J Choroby mięśnia sercowego
– pochodne sulfonylomocznika
– leki przeciwnowotworowe (przeciwciała monoklo nalne – inhibitory punktów kontrolnych układu odpornościowego), antracykliny, 5‑fluorouracyl – inne leki – metylodopa, amitryptylina, klozapina b) inne substancje i czynniki – alkohol, amfetamina, kokaina, metale ciężkie, nadmiar katecholamin (guz chromochłonny), promieniowanie jonizujące, azydek sodu, jady owadów i węży Z MS charakteryzuje się różnego stopnia nacieczeniem mięśnia sercowego przez komórki immunokompetentne. Najczęściej występuje limfocytowe ZMS, z naciekiem zapal nym składającym się głównie z limfocytów T, uszkadza jącym przyległe kardiomiocyty, z ogniskową martwicą i obrzękiem śródmiąższowym. W fazie gojenia naciek zapalny ustępuje i pojawia się włóknienie. Znacznie rza dziej występują eozynofilowe i olbrzymiokomórkowe ZMS. Eozynofilowe ZMS jest następstwem naciekania mięś nia sercowego przez eozynofile, które uwalniają substancje uszkadzające kardiomiocy ty, przede wszystkim główne białko zasadowe (MBP) i białko kationowe eozynofilów (ECP) o działaniu cytotoksycznym.
W olbrzymiokomórkowym ZMS stwierdza się: inten sywny naciek zapalny złożony głównie z limfocytów T, eozynofilów, makrofagów i wywodzących się z makrofagów komórek olbrzymich oraz masywną destrukcję mięśnia sercowego
Patogeneza ZMS jest różna w zależności od typu wirusa.
Uszkodzenie mięśnia sercowego może być:
1) bezpośrednie – przez wirusy kardiotropowe i wasku lotropowe
2) pośrednie – przez
a) wirusy limfotropowe, które zakażają komórki serca inne niż kardiomiocyty
b) wirusy, które nie muszą zakażać komórek serca, ale poprzez burzę cytokinową mogą powodować uszko dzenie serca lub oddziaływać inotropowo ujemnie.
Do wirusów kardiotropowych należą enterowirusy i ade nowirusy; mogą one zostać usunięte z mięśnia sercowe go dzięki odpowiedzi immunologicznej chorego. Wirusy waskulotropowe (np. parwowirus B19, który zakaża ko mórki śródbłonka naczyń) i wirusy limfotropowe (należące do herpeswirusów) prawdopodobnie pozostają w organiz mie przez całe życie.
HIV, HCV oraz wirusy grypy A i B wywołują ZMS pośrednio poprzez aktywację układu immunologicznego. SARS‑CoV‑2 może bezpośrednio uszkadzać serce lub działać kardiotoksycznie za pośrednictwem cytokin lub wywoływać odpowiedź autoimmunologiczną przeciwko komórkom serca.
Wirusowe ZMS rozpoczyna się od ostrej fazy (1–7 dni), kiedy wirus dostaje się do komórki i dochodzi do akty wacji w rodzonej odpowiedzi immunologicznej. Wrodzona, natychmiastowa i nieswoista odpowiedź immunologiczna zostaje aktywowana, gdy wzorce molekularne związane z patogenami ( pathogen‑associated molecular patterns –PAMP) i wzorce uwalniane z uszkodzonych komórek (damage‑associated molecular patterns – DAMP) zostaną rozpoznane przez receptory, np. receptory toll‑podobne, na komórkach serca. Następnie są uwalnia ne cytoki ny,
chemokiny i alarminy, co prowadzi do aktywacji i skiero wania wrodzonych komórek odpornościowych (mastocy tów, neutrofilów, monocytów i komórek dendrytycznych) do serca. Ponadto dochodzi do aktywacji pozaszpikowej monocytopoezy w śledzionie i przemieszczenia monocytów prozapalnych do uszkodzonego serca. W fazie 2. (faza podostra, 1–4 tyg.) dochodzi do uruchomienia odporności nabytej, antygenowo ‑swoistej (przeciwciała przeciwwi rusowe, limfocyty T, w tym cytotoksyczne, które bezpo średnio niszczą zakażone kardiomiocyty). W fazie 3. (faza przewlekła, miesiące–lata) opóźnione lub nieskuteczne usuwanie wirusa, przewlekły stan zapalny i przebudowa serca mogą prowadzić do kardiomiopatii rozstrzeniowej. O ile aktywacja wrodzonej odpowiedzi immunologicznej w sercu jest korzystna, ponieważ eliminuje wirusa, o tyle nadmierny lub przedłużający się proces zapalny uszka dza mięsień sercowy. Następstwa choroby zależą przede wszystkim od równowagi w odpowiedzi immunologicznej lub jej braku. Wystąpienie ZMS i jego następstwa zale żą m.in. od płci i prawdopodobnie od podatności gene tycznej (genotyp HLA, czynniki wielogenowe). Ponadto u 3–30% chorych na ZMS można zidentyfikować monoge nowe podłoże dziedziczne, takie jak w kardiomiopatiach. Do 30% chorych z arytmogenną kardiomiopatią prawej komory na podłożu desmoplakinopatii ma ból w klatce piersiowej, nieprawidłowości w EKG i zwiększone stężenie troponin (TnT i TnI) w surowicy, przy prawidłowych angio graficznie tętnicach wieńcowych. Takie fazy gorące (hot phases) mogą również w ystąpić u bezobjawowych nosicieli patogennych/prawdopodobnie patogennych wariantów genów kodujących filaminę C, tytynę, Bag3, RBM20 (RNA binding motif protein 20 ) i mogą tłumaczyć hipotezę tzw. drugiego uderzenia (second hit hypothesis). Według tej hipotezy osoby z patogennymi wariantami genów mają predyspozycję genetyczną do dysfunkcji mięśnia sercowego i są bardziej narażone na drugie uderzenie, jakim jest zakażenie wirusowe. W ten sposób czynnik środowiskowy jest przyczyną ujawnienia się fenotypu kardiomiopatii.
Autoimmunologiczne ZMS może się rozwijać jako izolowana choroba serca lub w przebiegu ogólnoustrojo wych chorób autoimmunologicznych. Choroba ta rozwija się wskutek nierównowagi pomiędzy cytokinami działa jącymi prozapalnie i cytokinami hamującymi zapalenie, która powoduje utratę tolerancji dla własnych antygenów. W przebiegu autoimmunologicznego ZMS obserwuje się zwiększenie liczby obwodowych efektorowych limfocy tów T. Proponuje się, że głównym autoantygenem jest łań cuch ciężki α miozyny, a przeciwciała przeciwko miozynie reagują także krzyżowo z receptorami adrenergicznymi β, przez co aktywują układ adrenergiczny i przyczyniają się do dalszego uszkodzenia serca
➔ OBRAZ KLINICZNY
Objawy ZMS są różnorodne i nieswoiste. U większości chorych z ostrym lub piorunującym ZMS stwierdza się w wywiadzie niedawne przebycie zakażenia wirusowego. Objawy zwiastunowe (występują nawet u 90% chorych) zależą od wrót zakażenia (górne drogi oddechowe lub prze
wód pokarmowy) i wyprzedzają objawy sercowe o kilka dni lub tygodni. Wyróżnia się 4 manifestacje kliniczne ZMS:
1) naśladujące przebieg ostrego zespołu wieńcowego – ból w klatce piersiowej, zmiany ST T w EKG, niekiedy zaburzenia kurczliwości i zwiększone stężenia troponin sercowych
2) ostry początek – objawy NS bez choroby wieńcowej i innych przyczyn NS
3) przewlekła NS bez choroby wieńcowej i innych przyczyn NS
4) stan bezpośredniego zagrożenia życia – groźne zaburze nia rytmu serca lub przewodzenia, nagłe zatrzymanie krążenia, wstrząs kardiogenny, skrajnie mała frakcja wyrzutowa lewej komory (LVEF).
Typowe objawy podmiotowe:
1) duszność (wysiłkowa, w ciężkiej NS – spoczynkowa), związana z NS
2) ból w klatce piersiowej, związany ze skurczem tętnic wieńcowych, martwicą kardiomiocytów lub towarzy szącym zapaleniem osierdzia
3) kołatanie serca, związane z tachykardią lub arytmią. Objawy przedmiotowe:
1) objawy NS
2) objawy zapalenia osierdzia, jeśli towarzyszy ZMS (np. tarcie osierdziowe)
3) objawy zatoru obwodowego (może być pierwszym obja wem ZMS).
W eozynofilowym ZMS mogą wystąpić objawy aler giczne – osutka i eozynofilia krwi obwodowej, ale nie obecność eozynofilii nie wyklucza eozynofilowego ZMS. Najcięższą postacią eozynofilowego ZMS jest ostre mar twicze eozynofilowe ZMS z NS o piorunującym przebiegu.
W olbrzymiokomórkowym ZMS najczęściej (u ¾ chorych) stwierdza się objawy NS , mogą występować bloki prze wodzenia i oporne na leczenie częstoskurcze komorowe.
➔ PRZEBIEG NATURALNY
ZMS o piorunującym przebieg u cechuje się nagłym, wyraźnym początkiem i szybkim narastaniem objawów NS, do wstrząsu kardiogennego włącznie. Dysfunk cja mięśnia sercowego ustępuje samoistnie albo – rza dziej – prowadzi do zgonu. Ostre ZMS ma mniej wyraźny początek, a u części chorych dysfunkcja mięśnia lewej komory postępuje do kardiomiopatii rozstrzeniowej. Podostre lub przewlekłe ZMS jest nie do odróżnienia od kardiomiopatii rozstrzeniowej; najczęściej powoduje postępującą NS.
Przebieg ZMS może być także bezobjawowy. U chorych na ZMS naśladujące świeży zawał serca (uniesienie odcinka ST, zwiększone wskaźniki martwicy mięśnia sercowego, odcinkowe zaburzenia kurczliwości), ale z prawidłowym obrazem tętnic w koronarografii – zaburzenia kurczliwości najczęściej ustępują. U chorych z opornymi na leczenie częstoskurczami komorowymi przebieg choroby nie został poznany; u części chorych arytmie ustępują jednak samoist nie. ZMS może spowodować pojedyncze lub mnogie mikrotęt niaki lewej komory. U chorych z mikrotętniakami globalna czynność lewej komory jest prawidłowa, natomiast mogą wystąpić epizody nietrwałego częstoskurczu komorowego.
➔ ROZPOZNANIE
Badania pomocnicze
1. Badania laboratoryjne: stwierdzane nieprawidło wości nie są swoiste dla ZM S
1) zwiększone stężenie CRP w surowicy (u 80–90% chorych) 2) leukocytoza z przewagą neutrofilów (u 50% chorych); duża eozynofilia w ZMS w przebiegu większości roba czyc i układowych zapaleń naczyń
3) zwiększone stężenie sercowej troponiny T lub I w osoczu (u 30% chorych) z dynamiką w seryjnych oznaczeniach 4) 4‑krotny wzrost miana wirusowoswoistej immunoglo buliny G w fazie zdrowienia (u 20% chorych); u chorych z podejrzeniem ZMS badanie serologiczne w kierunku wirusów nie ma znaczenia dla rozpoznania (spośród chorych, u których zakażenie wirusem zidentyfikowano w biopsji endomiokardialnej, tylko u 4% udało się stwier dzić to zakażenie za pomocą badania serologicznego).
2. EKG : prawie zawsze jest nieprawidłowy, może wykazywać cechy ostrego uszkodzenia mięśnia sercowe go, najczęściej zmiany odcinka ST i załamka T w wielu odprowadzeniach, arytmie nadkomorowe i komorowe, zaburzenia przewodzenia przedsionkowo komorowego (AV) i śródkomorowego.
3 . Echokardiografia: zwykle ujawnia nowe zmiany strukturalne i/lub czynnościowe: prawidłowe lub nieznacz nie zwiększone objętości rozkurczowe, uogólnione lub regio nalne zaburzenia kurczliwości lewej komory, pogrubiałą ścianę mięśnia obu komór (prawdopodobnie w następstwie obrzęku śródmiąższowego), płyn w worku osierdziowym, czasem skrzepliny wewnątrzsercowe. W miarę rozwijania się NS – obraz taki jak w kardiomiopatii rozstrzeniowej
4 . MR serca: powinno się wykonywać u chorych z kli nicznie uzasadnionym podejrzeniem ZMS obejmującym objawy kliniczne oraz zmiany w ≥1 z badań pomocniczych (EKG, badania laboratoryjne, echokardiografia) po wy kluczeniu lub przy małym prawdopodobieństwie choroby wieńcowej. Ocenę należy opierać na zaktualizowanych kryteriach z Lake Louise (2018), które wymagają speł nienia w fazie ostrej 1 kryterium (charakterystycznych nieprawidłowości) w obrazowaniu T2 ‑zależnym i 1 kryte rium w obrazowaniu T1‑zależnym. Obrazowanie T2 ‑zależne pozwala wykryć obrzęk mięśnia sercowego (ryc. I.J.1 1A). Mapowanie czasu T1 z oceną przestrzeni pozakomórkowej umożliwia dodatkowo wykr ycie przekrwienia i przecieku włośniczkowego oraz włóknienia (następstwo uszkodze nia kardiomiocytów). Klasyczne obrazowanie T1‑zależne z oceną późnego wzmocnienia wykrywa głównie włók nienie (ryc. I.J.1 1B). Ogniska późnego wzmocnienia są w ZMS położone śródmięśniowo lub podnasierdziowo. Dodatkowe kryteria rozpoznania ZMS w MR to: obecność płynu w jamie osierdzia i pogorszenie czynności skurczo wej lewej komory. MR może ułatwić wykonanie biopsji endomiokardialnej, ale nie może jej zastąpić, zwłaszcza u chorych z piorunującym przebiegiem choroby, nie wnosi bowiem informacji o rodzaju nacieku zapalnego (limfocy towy, olbrzymiokomórkowy, eozynofilowy) ani o obecności patogenu. Rozmieszczenie ognisk późnego wzmocnienia może wskazywać na określoną etiologię (np. niejednolite w sarkoidozie, rozległe dolno ‑boczne w dystrofinopatiach,
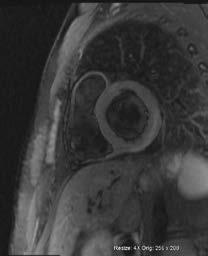
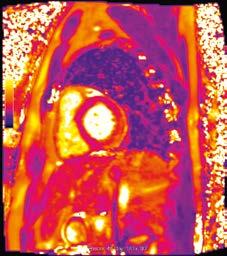
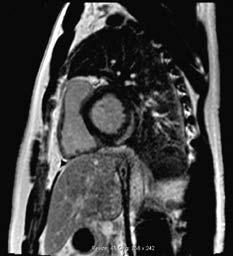
Ryc. I.J.1-1. MR serca u osoby z podejrzeniem ostrego zapalenia mięśnia sercowego (ZMS), projekcja w osi krótkiej na wysokości segmentów podstawnych. Spełnione są oba kryteria rozpoznania ostrego ZMS. A – cechy obrzęku mięśnia sercowego (s trzał ka), kryterium T 2‑zależne, obra zy T 2‑zależne B – cechy obrzęku mięśnia sercowego (strzałka), kryterium T 2‑zależne, mapowanie czasu T 2 C – obecność typowego podnasier dziowego obszaru późnego wzmocnienia kontrastowego w tej samej lokalizacji, co obrzęk (strzał ka) – kryterium T1‑zależne
śródmięśniowe w przegrodzie międzykomorowej u nosicieli mutacji LMNA , a pierścieniowate u nosicieli mutacji genu DSP lub FLNC ).
5. Koronarografia lub angio‑TK tętnic wieńco wych: w ykorzystuje się je w celu wykluczenia choroby wieńcowej.
6. Biopsja endomiokardialna: w ostrym infekcyjnym ZMS rzadko wykonywana Biopsję wykonuje się w celu wykrycia przyczyny poddającej się leczeniu (np. olbrzymiokomórkowego czy eozynofilowego ZMS). Wskazaniem do biopsji jest postępująca lub utrzymująca się NS i/ lub zag rażająca życiu arytmia komorowa, i/lub blok przewodzenia AV II° typu Mobitz II lub zaawansowany przy braku odpowiedzi na typowe leczenie w krótkim czasie (<1–2 tyg.). Należy pobrać ≥5 wycinków z lewej i/lub prawej komory, a najlepiej 7, w tym 3 do oceny histologicznej, 2 do oceny zakażenia (DNA, PCR) i 2 w kierunku wirusów RNA/ replikacji. W celu wyboru miejsca biopsji można wykorzystać MR serca. Stwierdza się martwicę kardiomiocytów i naciek zapalny o różnym nasileniu (rozdz. I.B.11). Przyjęto (tzw. kryteria Dallas), że do rozpoznania aktywnego ZMS konieczne jest stwierdzenie rozsianego lub wieloogniskowego nacieku zapalnego (nietypowego dla świeżego zawału serca) z towarzyszącym zwyrodnieniem lub martwicą przylegających kardiomiocytów. Czułość biopsji endomiokardialnej w wykrywaniu nacieku limfocytowego (najczęstszego) z towarzyszącym uszkodzeniem przyległych kardiomiocytów wynosi 30–40%, zatem ujemny wynik biopsji nie wyklucza ZMS. Częstość ZMS rozpoznanego na podstawie biopsji endomiokardialnej wykonanej u osób z niewyjaśnioną NS trwającą <2 lata, z LVEF <45% – wynosi ~10%. Do wiarygodnego rozpoznania ZMS konieczne jest stwierdzenie nacieku z limfocytów T. U 40% chorych na ZMS w bioptacie mięśnia sercowego wykrywa się metodami biologii molekularnej genomy wirusów, najczęściej Coxsackie B, adenowirusów i parwowirusa B19. Wykrycie obecności genomu wirusa nie dowodzi jednak, że wirus ten jest czynnikiem etiologicznym ZMS.
7. Pozytonowa tomografia emisyjna (PET): badanie z użyciem 18Ffluorodeoksyglukozy (18FFDG) jest pomocne w diagnostyce ZMS powiązanego z aktywną sarkoidozą i potencjalnie w innych nietypowych postaciach ZMS. Wynik ujemny nie wyklucza nieaktywnej postaci sarkoidozy.
8. Badania genetyczne: u chorych z ZMS w wywiadzie rodzinnym lub z kardiomiopatią pozapalną.
Kryteria rozpoznania
Pewne rozpoznanie ZMS można postawić jedynie na podstawie wyniku biopsji endomiokardialnej (kryteria histologiczne i immunohistochemiczne).
Możliwe subkliniczne ZMS można rozpoznać w przypadku nieprawidłowego wyniku jednego z badań pomocniczych, sugerującego ZMS (p. niżej), a prawdopodobne ostre ZMS, jeśli występują objawy i nieprawidłowe wyniki badań pomocniczych.
Kryteria rozpoznania klinicznego ZMS: 1) objawy
a) ostry ból w klatce piersiowej o charakterze osierdziowym lub pseudoniedokrwiennym
b) świeża (do 3 mies.) lub narastająca duszność spoczynkowa lub wysiłkowa i/lub zmęczenie z objawami podmiotowymi NS lub bez tych objawów
c) podostra lub przewlekła (utrzymująca się >3 mies.) duszność spoczynkowa lub wysiłkowa i/lub zmęczenie z objawami podmiotowymi NS lub bez tych objawów
d) kołatanie serca i/lub objawy arytmii/zaburzeń przewodzenia o nieznanej przyczynie, i/lub omdlenie, i/lub nagłe zatrzymanie krążenia
e) wstrząs kardiogenny o nieznanej przyczynie
2) wyniki badań pomocniczych
a) nowe nieprawidłowości EKG (spoczynkowego, 24 godzinnego metodą Holtera lub wysiłkowego) –blok AV lub blok odnogi, zmiany odcinka STT (uniesienie odcinka ST, odwrócenie załamka T), zahamo
wanie zatokowe, częstoskurcz komorowy, migotanie komór, asystolia, migotanie przedsionków, zmniej szenie amplitudy załamka R, zwolnienie przewo dzenia śródkomorowego (poszerzenie zespołu QRS), patologiczny załamek Q, niski woltaż załamków, częste pobudzenia dodatkowe, częstoskurcz nad komorowy
b) zwiększenie stężenia markerów uszkodzenia mięśnia sercowego – TnT i TnI
c) nieprawidłowości czynnościowe lub strukturalne w badaniach obrazowych (echokardiografii, MR) –nowe, niewyjaśnione w inny sposób, zaburzenia czyn ności i budowy lewej i/lub prawej komory (w tym przypadkowo stwierdzone u osób bez objawów podmio towych): zaburzenia czynności skurczowej globalnej i regionalnej oraz czynności rozkurczowej z poszerze niem komory lub bez takiego poszerzenia, z pogru bieniem ściany lub bez jej pogrubienia, z płynem w worku osierdziowym lub bez płynu, ze skrzepliną wewnątrz jamy komory lub bez skrzepliny d) obraz tkanek w MR – obrzęk lub charakterystyczny dla ZMS obraz późnego wzmocnienia po gadolinie. Należy podejrzewać ZMS, jeśli występuje ≥1 manifesta cja kliniczna (spośród 1a–d) i ≥1 nieprawidłowość w bada niach pomocniczych, pod warunkiem wykluczenia choroby wieńcowej i innych chorób, które mogą wywoływać podobne objawy (m.in. wad serca, nadczynności tarczycy). Podejrze nie jest tym silniejsze, im więcej kryteriów jest spełnionych. U chorych bezobjawowych (niespełnione żadne z kryte riów 1a–d) muszą być obecne ≥2 nieprawidłowości w bada niach pomocniczych (z różnych grup 2a–d).
Ostre ZMS trzeba podejrzewać zwłaszcza u młodych osób z nagle pojawiającymi się: NS, uporczywymi aryt miami lub zaburzeniami przewodzenia bądź cechami zawału serca przy prawidłowym obrazie koronarograficz nym. Większość chorych na ostre ZMS podaje w wywia dach przebyte zakażenie wirusowe. Rozpoznanie ostrego ZMS można potwierdzić za pomocą MR serca. U chorych z objawami NS i niejasnym początkiem choroby należy wykluczyć inne przyczyny kardiomiopatii rozstrzeniowej (rozdz. I.J.2 3). U tych chorych rozpoznanie ZMS można ustalić jedynie na podstawie biopsji endomiokardialnej. Rozpoznawanie postaci ZMS na podstawie wyników biopsji endomiokardialnej i badań serologicznych:
1) wirusowe ZMS – histologiczne cechy ZMS i dodatni wynik badania PCR komórek mięśnia sercowego na obecność genomu wirusa
2) autoimmunologiczne ZMS – histologiczne cechy ZMS, ujemny wynik badania PCR komórek mięśnia serco wego na obecność genomu wirusa; mogą występować autoprzeciwciała przeciwsercowe w surowicy
3) wirusowe i immunologiczne ZMS – histologiczne cechy ZMS, dodatni wynik badania PCR komórek mięśnia ser cowego na obecność genomu wirusa i obecne autoprze ciwciała przeciwsercowe w surowicy.
Rozpoznanie różnicowe
Ostre ZMS trzeba różnicować ze świeżym zawałem serca. Nagłe wystąpienie objawów zwykle u osoby młodej, często
z nietypowym bólem w klatce piersiowej i ze zmianami w EKG w wielu odprowadzeniach – przemawia za ostrym ZMS. W przypadkach wątpliwych decydujące znaczenie ma wynik koronarografii. Konieczność oceny pod kątem ostrego ZMS za pomocą echokardiografii, MR serca czy biopsji endomiokardialnej pojawia się także u chorych z podejrzeniem zawału serca z uniesieniem odcinka ST (STEMI), u których pomimo zwiększenia stężenia marke rów martwicy mięśnia sercowego nie stwierdzono w pil nej koronarografii istotnych zwężeń (≥50%) w tętnicach wieńcowych (MINOCA – rozdz. I.F.5).
ZMS o piorunującym przebiegu trzeba różnicować z sepsą, ostrą niedomykalnością mitralną, kardiomiopa tią tachyarytmiczną i innymi przyczynami kardiomiopatii rozstrzeniowej.
W różnicowaniu ZMS przebiegającego skrycie z objawa mi NS trzeba brać pod uwagę inne przyczyny NS.
➔ LECZENIE
Zalecenia ogólne
1. Wszyscy chorzy na ostre ZMS powinni znacznie ograniczyć aktywność fizyczną, zwłaszcza gdy występują gorączka i inne ogólnoustrojowe objawy zakażenia lub NS. Uważa się, że w wirusowym ZMS wysiłek fizyczny zwiększa tempo replikacji wirusa.
2. Ograniczenie picia alkoholu.
3 . Należy unikać stosowania NSLPZ, które mogą nasilać ZMS (zwłaszcza w pierwszych 2 tyg. zapalenia wirusowego) oraz leków mogących wywołać lub nasilić zaburzenia mikrokrążenia wieńcowego.
4 W ZMS z nadwrażliwości należy odstawić lek, który wywołał chorobę i ew. zastosować GKS.
5. Chorych z potwierdzonym lub podejrzewanym ostrym ZMS z towarzyszącymi zagrażającymi życiu komorowymi zaburzeniami rytmu i/lub szybko narastającymi objawami NS należy leczyć w ośrodkach specjalistycznych. Można rozważyć zastosowanie kamizelki defibrylującej u cho rych z NS, u których istnieje duże ryzyko nagłego zgonu sercowego.
Leczenie objawowe
1. NS w przebiegu ZMS leczy się standardowo (rozdz. I.Ł.1). Wykazano, że u chorych na ZMS lub z kar diomiopatią rozstrzeniową i objawami NS trwającymi <6 mies. można uzyskać spektakularną poprawę (średni wzrost LVEF o 17%; przeżycie 4 lat bez konieczności hospi talizacji u ~80% chorych), stosując leczenie konwencjonalne (inhibitor konwertazy angiotensyny [ACEI ] / bloker recep tora angiotensynowego [ARB] i β‑bloker). Leczenie należy kontynuować przez ≥6 mies. po normalizacji czynności skurczowej lewej komory (LVEF >50%).
W tej samej grupie chorych nie wykazano korzystnego wpływu wczesnego (w ciągu 6 mies.) rutynowego wszcze pienia kardiowertera‑defibrylatora (ICD) na przeżycie chorych.
2 . Konieczne jest leczenie ciężkich komorowych zaburzeń rytmu. U chorych z nietrwałymi lub trwałymi komorowymi zaburzeniami rytmu należy rozważyć stosowanie leków
aorta piersiowaa
aorta wstępująca
aorty krąg Th6
aorta brzuszna odcinek nadnerkowy odcinek okołonerkowy odcinek podnerkowy
0–11 – segmenty aorty wg szczegółowego podziału a Według wytycznych obejmuje aortę wstępującą, łuk aorty i aortę zstępującą. Uwaga: mianownictwo anatomiczne różni się od powyżej przedstawionego, gdyż wyróżnia aortę wstępującą, łuk aorty i aortę zstępującą (obejmującą aortę piersiową i brzuszną).
PRG – pień ramienno-głowowy, PT – pień trzewny, TKG – tętnica krezkowa górna, TNL – tętnica nerkowa lewa, TNP – tętnica nerkowa prawa, TPL – tętnica podobojczykowa lewa, TSzWL – tętnica szyjna wspólna lewa
Ryc. I.O.1-1. Podział aorty na segmenty i strefy (na podstawie wytycznych ESC 2024, zmodyfikowane)
2) ze względu na kształt
a) wrzecionowate (znacznie częstsze)
b) workowate (zwykle w okolicy tętnicy podobojczykowej lewej lub dolnej k rzywizny łuku aorty)
3) ze względu na budowę ściany
a) prawdziwe
b) rzekome (ścianę tworzy przydanka z otaczającymi tkankami po przerwaniu błony wewnętrznej i środ kowej; najczęściej pourazowe)
4) ze względu na obraz kliniczny
a) bezobjawowe
b) objawowe
c) pęknięte.
Powstawanie tętniaków jest związane z wzajemnym oddziaływaniem sił ścinających zależnych od objętości wyrzutowej lewej komory, sił rozciągających zależnych od średnicy aorty i ciśnienia wewnątrzaortalnego oraz procesów patologicznych zachodzących w ścianie aorty. Oddziaływania fizyczne strumienia krwi na ścianę aorty zwiększają się u chorych z niedomykalnością zastawki aorty lub z nadciśnieniem tętniczym. W ścianie aorty zmie nionej tętniakowato wykazano zwiększoną aktywność enzymów proteolitycznych, zwłaszcza elastazy i metalo proteinaz, oraz upośledzenie ich hamowania przez swoiste inhibitory (α‑antytrypsynę i tkankowe inhibitory meta loproteinaz), co może tłumaczyć częstsze występowanie tętniaków aorty u chorych na przewlekłą obturacyjną chorobę płuc (POChP) i u osób palących tytoń (5‑krotnie większe ryzyko tętniaka aorty brzusznej).
Istnieje predyspozycja genetyczna do rozwoju tęt niaka aorty. Tętniak aorty brzusznej występuje 11 razy częściej u potomków osoby chorej, a ryzyko jego wystąpie nia zwiększa się istotnie wraz ze zwiększeniem się liczby chorujących krewnych. Tętniaki aorty piersiowej wystę pują szczególnie często u chorych z zespołem Marfana (rozdz. I.T.1 ☚a7b), zespołem Ehlersa i Danlosa naczynio wym (rozdz. I.T.2 ☚aoq ), zespołem Loeysa i Dietza (triada objawów: krętość tętnic, tętniaki w całym układzie naczy niowym, hiperteloryzm) i ze zwyrodnieniem torbielowatym aorty, w których ściana aorty jest istotnie osłabiona.
Za czynniki wykazujące silny związek z występowaniem tętniaka aorty brzusznej uznaje się: starszy wiek, płeć męską, nadciśnienie tętnicze i miażdżycę. Ta ostatnia odgrywa prawdopodobnie większą rolę w powstawaniu tętniaków aorty brzusznej niż aorty piersiowej, co tłumaczy się ubogim unaczynieniem podnerkowego odcinka aorty przez naczynia odżywcze. Znaczenie dyslipidemii jako czynnika ryzyka jest słabiej udokumentowane.
Zapalenia aorty – choroba Takayasu, olbrzymio komórkowe zapalenie tętnic, zapalenie w przebiegu cho rób układowych (zwłaszcza zesztywniającego zapalenia stawów kręgosłupa i reumatoidalnego zapalenia stawów), kiła sercowo‑naczyniowa i zakażenia krwiopochodne, takie jak infekcyjne zapalenie wsierdzia i sepsa – prowadzą do powstawania tętniaków aorty.
Czynniki ryzyka progresji i pęknięcia tętniaka aorty brzusznej: średnica tętniaka, wiek chorego, aktualne palenie tytoniu (czynnik środowiskowy najsilniej związany z ryzykiem szybkiego powiększania się tętniaka), POChP, nadciśnienie tętnicze i uwarunkowania genetyczne. Przy danej wielkości tętniaka ryzyko jego pęknięcia jest więk sze u kobiet – występuje zwykle przy średnicy tętniaka o 10 mm mniejszej niż u mężczyzn.
Worek tętniaka najczęściej jest w ypełniony przyścien ną skrzepliną różnej grubości, która może być źródłem zatorów obwodowych.
Ryc. I.O.1-2. Klasyfikacja tętniaków piersiowo ‑brzusznych wg Crawforda (na podstawie wytycznych E SC 2024, zmodyfikowane)
1.1.1. Tętniak aorty piersiowej
➔ O BRAZ KLINICZNY
1. Objawy podmiotowe:
1) ból w klatce piersiowej i ból pleców (u 25% chorych bez rozwarstwienia) – wskutek ucisku narządów wewnątrz klatki piersiowej lub ściany klatki piersiowej, bądź wskutek nadżerek w kościach; zwykle stały, przeszywający, często silny; pęknięcie tętniaka wywołuje silny stały ból w klatce piersiowej z szybko rozwijającym się wstrząsem hipowolemicznym
2) dysfagia – rzadko, wywołana uciskiem przełyku
3) chrypka – wywołana uciskiem nerwu krtaniowego wstecznego
4) kaszel, duszność (niekiedy zależne od pozycji ciała), krwioplucie i nawracające zapalenia płuc – wskutek ucisku tchawicy lub oskrzeli głównych przez tętniaka łuku aorty lub aorty zstępującej
5) objaw Hornera.
2. Objawy przedmiotowe: w tętniaku aorty wstępującej lub łuku aorty mogą wystąpić
1) objawy niedomykalności zastawki aortalnej (rozdz. I.H.2), często z objawami niewydolności serca
2) objawy zespołu żyły głównej górnej wywołane uciśnięciem tej żyły (rozdz. X.F.1)
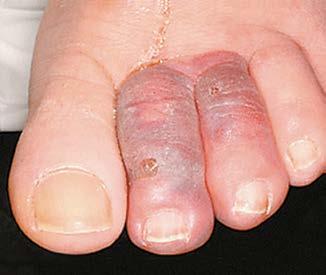
3) czasem pierwszym objawem tętniaka jest incydent zatorowy pod postacią udaru mózgu, niedokrwienia kończyn dolnych lub jelit bądź zawału nerki. Niekiedy występuje tzw. zespół sinych palców (blue toe syndrome) – ostre niedokrwienie palców stóp wywołane drobnymi zatorami wywodzącymi się z worka tętniaka (ryc. I.O.1-3), mogące doprowadzić do martwicy palców przy obecnym tętnie na tętnicach piszczelowej tylnej i grzbietowej stopy.
➔ PRZEBIEG NATURALNY
Tętniaki aorty wstępującej powiększają się średnio o 1 mm/rok, a tętniaki aorty zstępującej o 3 mm/rok.
Rodzinne tętniaki aorty piersiowej powiększają się do 2,1 mm/rok (średnio dla aorty wstępującej i zstępującej), w zespole Marfana o 0,5–1 mm/rok, a w zespole Loeysa i Dietza nawet szybciej niż 10 mm/rok, co skutkuje wczesnym zgonem (średnio w wieku 26 lat). Prawdopodobieństwo rozwarstwienia lub pęknięcia aorty gwałtownie się zwiększa przy średnicy aorty wstępującej >60 mm, a aorty zstępującej >70 mm (dla tętniaka aorty piersiowej o średnicy >60 mm wynosi 7%/rok, a o średnicy <50 mm 2%/rok).
➔ ROZPOZNANIE
Badania pomocnicze
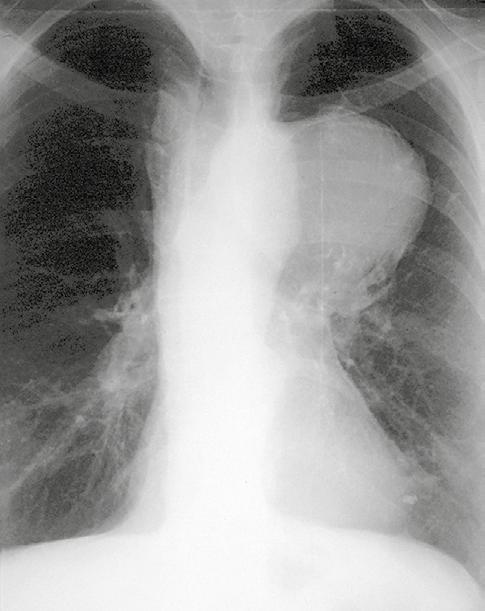
1. RTG klatki piersiowej: uwidacznia poszerzenie aorty (ryc. I.O.1-4 A i ryc. I.O.1-4B); badanie o małej czułości i swoistości. Prawidłowa sylwetka aorty nie pozwala na wykluczenie obecności tętniaka aorty wstępującej.
2. Echokardiografi a : badanie przezklatkowe wykorzystuje się w diagnostyce i monitorowaniu niektórych segmentów aorty, zwłaszcza proksymalnych: korzenia aorty (ocena w projekcji przymostkowej w osi długiej i zmodyfikowanej koniuszkowej projekcji pięciojamowej), łuku i odchodzących od niego dużych naczyń (w projekcji nadmostkowej). Umożliwia również wizualizację aorty zstępującej w wymiarze poprzecznym (za lewym przedsionkiem w projekcji przymostkowej w osi długiej oraz w projekcji czterojamowej) i podłużnym – po zrotowaniu sondy. Jest to użyteczna przesiewowa metoda badania aorty wstępującej. Umożliwia seryjne (w czasie) pomiary maksymalnej średnicy korzenia aorty oraz ocenę niedomykalności zastawki aortalnej. Informacje uzyskane podczas kolejnych badań są pomocne w określeniu odpowiedniego momentu przeprowadzenia planowej operacji tętniaka.
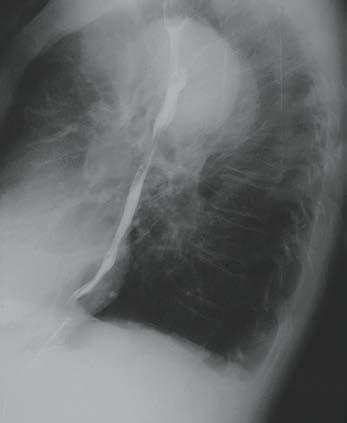
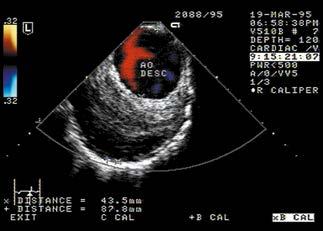
Ryc. I.O.1- 4 Tętniak aorty zstępującej. RTG klatki piersiowej w projekcji P‑A ( A ) i lewobocznej (B) oraz USG przezprzełykowa z kolorowym dople rem (C ) (fot. dr Marek Krzanowski)
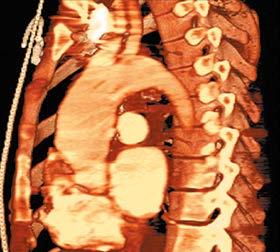
3. Angio‑TK : pozwala dokładnie ocenić wielkość i morfologię tętniaka oraz zależności anatomiczne między tętniakiem a sąsiednimi narządami i tętnicami odchodzącymi od aorty (ryc. I.O.1-5). Zwykle wystarcza do oceny przedoperacyjnej chorego. Zalety w porównaniu z innymi metodami obrazowania: szeroka dostępność badania, krótki czas akwizycji i przetwarzania obrazów, możliwość obrazowania 3D całej aorty, możliwość wykrycia współistniejącego rozwarstwienia, krwiaka śródściennego (TK bez środka kontrastowego) lub wrzodu drążącego aorty (TK ze środkiem kontrastowym).
4. Angio‑MR: wskazana do oceny średnicy, kształtu i rozległości tętniaka u chorych, u których nie można wykonać angio -TK (rozdz. I.B.4.2.2.3). Angio -MR jest
Echokardiografia przezprzełykowa (ryc. I.O.1- 4C) pozwala na dokładną ocenę zastawki aortalnej i aorty od korzenia do pnia trzewnego. Z uwagi na przebieg anatomiczny prawego oskrzela i tchawicy krótki segment dystalnego odcinka aorty wstępującej nie jest widoczny przy użyciu tej techniki. Badanie to jest przydatne do kontroli i optymalizacji przebiegu interwencji wewnątrznaczyniowej na tętniakach aorty piersiowej.
AB Ryc. I.O.1-5 A – TK, tętniak aorty piersiowej. B – rekonstrukcja 3D
szczególnie uzasadniona w ramach seryjnych badań kont rolnych wykonywanych u młodszych chorych, gdyż nie wiąże się z ekspozycją na promieniowanie jonizujące ani nie wymaga użycia jodowego środka kontrastowego. Ba danie to jest mniej przydatne w stanach ostr ych z powodu ograniczonej dostępności, trudności w monitorowaniu stanu chorego w trakcie badania i dłuższej rejestracji obrazów. Nie pozwala na ocenę zwapnień w zastawce aortalnej ani w tzw. strefach kotwiczenia stentgraftów.
5. PET: badanie przydatne w diagnostyce chorób zapal nych aorty (choroba Takayasu, olbrzymiokomórkowe zapa lenie tętnic), w których mogą wystąpić tętniaki aorty pier siowej, oraz w diagnostyce zakażenia stentgraftu. Może stanowić składową obrazowania hybrydowego (PET‑TK).
6. Aortografia : u niektórych chorych kwalifikowa nych do interwencji wewnątrznaczyniowej (wszczepie nia stentgraftu) wskazane jest wykonanie angiografii z zastosowaniem cewnika kalibrowanego Badanie nie pozwala na ocenę ściany naczynia ani niewielkich tęt niaków wypełnionych skrzepliną.
7. Ultrasonografia wewnątrznaczyniowa (IVUS): pozwala na optymalizację obrazu ściany aorty podczas leczenia wewnątrznaczyniowego.
Kryteria rozpoznania
Rozpoznanie wstępne ustala się zazwyczaj na podsta wie wyniku badań obrazowych (RTG klatki piersiowej, USG jamy brzusznej, echokardiografii) wykonywanych z innych wskazań. Przypadkowo w okresie bezobjawowym rozpoznaje się obecnie ~50% tętniaków aorty piersiowej. W razie wykrycia u chorego tętniaka aorty na jakimkol wiek poziomie należy przeprowadzić badanie całej aorty, aby wykluczyć współistnienie tętniaków w innych odcinkach. Jednocześnie zaleca się ocenę zastawki aortalnej, zwykle echokardiograficzną. Dodatkowo należy rozważyć badanie ultrasonograficzne (doplerowskie) tętnic obwodowych w ra mach przesiewowej oceny w kierunku tętniaków tych naczyń.
➔ LECZENIE
Postępowanie zależy od lokalizacji tętniaka, jego średnicy i czynników ryzyka pęknięcia (tab. I.O.1 2).
Tabela I.O.1-2. Dodatkowe (inne niż średnica tętniaka) czynniki dużego ryzyka pęknięcia tętniaka korzeń aorty i aorta wstępująca wzrost <1,69 m średnica aorty w zakresie wartości górnej granicy normy w stosunku do wieku
niekontrolowane oporne nadciśnienie tętnicze
długość aorty wstępującej >11 cm szybkie poszerzanie się tętniaka (≥3 mm/rok) lokalizacja tętniaka (w obrębie korzenia aorty) w przypadku dwupłatkowej zastawki aortalnej dodatkowo koarktacja aorty lub ostre zespoły aortalne w wywiadzie rodzinnym
aorta piersiowa zstępująca tętniak workowaty związany z wrzodem drążącym aorty przewlekła obturacyjna choroba płuc niekontrolowane oporne nadciśnienie tętnicze szybkie poszerzanie się tętniaka (≥10 mm/rok lub ≥5 mm/6 mies.)
aorta piersiowo ‑brzuszna predyspozycja genetyczna występowanie objawów: ból brzucha, ból klatki piersiowej szybkie powiększanie się tętniaka (≥10 mm/rok lub ≥5 mm/6 mies.)
na podstawie wytycznych ESC (2024), zmodyfikowane
Leczenie zachowawcze
Podstawowe znaczenie ma eliminacja czynników ryzyka chorób sercowo‑naczyniowych, ze szczególnym uwzględnie niem zaprzestania palenia tytoniu i normalizacji ciśnienia tętniczego, które powinno wynosić ≤120–129/70–79 mm Hg. Udokumentowano skuteczność β‑blokerów w spowalnia niu tempa powiększania się tętniaka aorty i w ograniczaniu powikłań w zespole Marfana oraz zespole Loyesa i Dietza. Powszechną praktyką jest stosowanie β‑blokerów u chorych z dwupłatkową zastawką aortalną i poszerzeniem korzenia aorty >40 mm, chociaż nie ma jednoznacznych dowodów na skuteczność tego postępowania. β‑blokery stosowane przewlekle p.o. zmniejszają częstość zdarzeń wieńcowych u chorych operowanych z powodu tętniaka Leki te zaleca się również chorym z zespołem Marfana (rozdz. I.T.1 ☚a7b). Badania potwierdzają także wpływ losartanu na posze rzanie się korzenia aorty u chorych z zespołem Marfana (rozdz. I.T.1 ☚a7b).
6) przewlekła biegunka (podejrzenie celiakii lub innej choroby jelita cienkiego)
7 ) choroby, w których stwierdzenie zmian patolog icz nych w górnym odcinku przewodu pokarmowego może wpływać na dalsze postępowanie (np. chorzy z chorobą wrzodową lub krwawieniem z górnego odcinka prze wodu pokarmowego w wywiadach, u których planu je się przeszczepienie narządu, przewlekłe leczenie NSLPZ, przeciwpłytkowe lub przeciwkrzepliwe, chorzy na nowotwór głowy i szyi)
8) rodzinna polipowatość gruczolakowata
9) weryfikacja i dalsza diagnostyka zmian w górnym odcinku przewodu pokarmowego stwierdzanych w ba daniu obrazow ym (podejrzenie nowotworu, owrzodze nia, zwężenia)
10) konieczność pobrania materiału do badania histolo gicznego lub cytologicznego
11) podejrzenie nadciśnienia wrotnego (m.in. marskość wątroby, zakrzepica żyły wrotnej, zespół Budda i Chia riego) – w celu oceny występowania żylaków przełyku i / lub żołądka oraz kwalifikacji do leczenia
12) oparzenia chemiczne po połknięciu środków żrących –w celu oceny stopnia uszkodzenia (<24 h od spożycia substancji żrącej).
2. Wskazania do EGD terapeutycznej:
1) tamowanie krwawienia z zastosowaniem odpowied nich metod (termiczna, iniekcyjna, mechaniczna, z użyciem środków działających powierzchniowo –rozdz. III.Ł)
2) pierwotna lub wtórna profilaktyka krwawienia z żyla ków przełyku lub dna żołądka (opaskowanie, oblite racja klejem akrylowym)
3) usuwanie ciał obcych
4) polipektomia, mukozektomia (endoskopowa resekcja błony śluzowej [endoscopic mucosal resection – EM R]), endoskopowa dyssekcja podśluzówkowa (endoscopic submucosal dissection – ESD) lub endoskopowa resek cja pełnościenna (endoscopic full‑thickness resection –EFTR) polipów, zmian przedrakowych oraz małych lub powierzchownych raków przewodu pokarmowego
5) ablacja segmentu metaplastycznego przełyku Barretta
6) wprowadzanie zgłębników żywieniowych (zgłębniki dojelitowe, przezskórna gastrostomia endoskopowa, jejunostomia endoskopowa)
7) leczenie achalazji (poszerzanie balonem pneumatycz nym, przezustna miotomia endoskopowa [ peroral endoscopic myotomy – POEM ], wyjątkowo wstrzyk nięcie toksyny botulinowej)
8) poszerzanie i protezowanie nienowotworowych i no wotworowych zwężeń górnego odcinka przewodu po karmowego (np. paliatywne leczenie raka przełyku)
9) leczenie zwężeń i przetok – samoistnych i poopera cyjnych górnego odcinka przewodu pokarmowego
10) leczenie uchyłku Zenkera (septotomia, Z‑POEM)
11) zabiegi bariatryczne
3. Wskazania do kontrolnej endoskopii:
1) ocena wygojenia zmian o potencjalnie nowotworowym charakterze (wrzód przełyku, żołądka, zespolenia żołądkowo‑jelitowego)
2) ocena wygojenia powikłanego (krwawienie, perforacja) wrzodu trawiennego
3) ocena wygojenia refluksowego zapalenia przełyku o dużym nasileniu (Los Angeles C lub D)
4) ocena skuteczności wybranych zabiegów terapeutycz nych, takich jak usunięcie niektórych zmian naczynio wych, endoskopowa resekcja i ablacja zmian przedno wotworowych i nowotworów.
4. Wskazania do okresowo powtarzanej endoskopii (tzw. nadzór endoskopowy; jego częstotliwość określają szczegółowe wytyczne):
1) zwiększone ryzyko raka przewodu pokarmowego (np. przełyk Barretta, rodzinna polipowatość gruczolako wata, gruczolaki żołądka, zapalenie zanikowe błony ślu zowej lub metaplazja jelitowa żołądka, przebyte oparzenie substancjami żrącymi, achalazja, stan po częściowej resekcji żołądka, nowotwory głowy i szyi w wywiadzie) 2) nadciśnienie wrotne
➔ P R ZECIWWSKAZANIA
P. rozdz. III.B.4.1, Zasady ogólne.
➔ P O WIKŁANIA
Częstość powikłań szacuje się na ~0,5% (rzadziej w zabie gach diagnostycznych, częściej w terapeutycznych) i znacz ną ich część stanowią powikłania sedacji. Częstość swoistych powikłań diagnostycznej EGD jest bardzo mała: krwawienie ~0,15%, perforacja (głównie gardła i przełyku) ~ 0,01%
W EGD zabiegowej krwawienia występują najczęściej po zabiegach resekcyjnych (polipektomia, EMR, ESD): 4% w przełyku, 7% w żołądku, ~ 9% w dwunastnicy. Perforacja jest powikłaniem ~1% zabiegów resekcyjnych w żołądku i ~2% w przełyku i dwunastnicy
Ryzyko bakteriemii jest zbliżone do występującego przy myciu zębów, większe w przypadku skleroterapii żylaków i poszerzania przełyku.
➔ OCENA OBRAZU ENDOSKOP O W EGO
Przeprowadzając endoskop od przełyku do części zstępują cej lub poziomej dwunastnicy, w każdym z tych odcinków przewodu pokarmowego ocenia się jego kształt, średnicę, podatność ścian na rozdymanie, motor ykę, zawartość i –co najważniejsze – wygląd błony śluzowej.
1. Przełyk: do najczęściej stwierdzanych zmian należą zapalenie nadżerkowe (refluksowe), kandydoza, przełyk Barretta oraz żylaki. Rzadziej spotyka się nowotwory zło śliwe (rak płaskonabłonkowy, rak gruczołowy rozwijający się na podłożu przełyku Barretta) i niezłośliwe (np. bro dawczak).
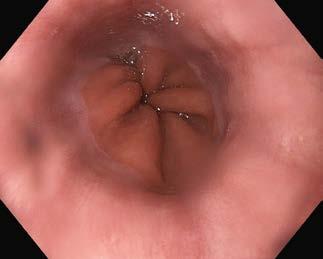
We wpuście ocenia się jego szczelność oraz położenie linii Z (granica nabłon ków przełyku i żołądka), która powinna się znajdować na górnej granicy fałdów błony śluzowej żołądka. Najczęstszą patologią wpustu jest prze puklina rozworu przełykowego.
Prawidłowy obraz dolnego odcinka przełyku i wpu stu – ryc. III.B.4 2 Przykłady obrazów nieprawidłowych i zabiegów terapeutycznych w obrębie przełyku i wpustu –ryc. III.B.4 3 ☚dp6, ryc. III.B.4 4 ☚dsv, ryc. III.B.4 5 ☚d7r,
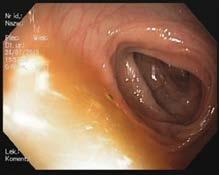
Ryc. III.B.4 -2 Ezofagogastroduodenoskopia – prawidłowy dolny odcinek przełyku i wpust; strzałki wskazują linię Z

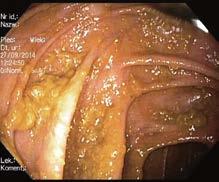
Ryc. III.B.4-10. Ezofagogastroduodenoskopia – prawidłowy trzon żołądka
ryc. III.B.4-6 ☚ea7, ryc. III.B.4-7 ☚ecp, ryc. III.B.4-8 ☚d7p, ryc. III.B.4-9 ☚evr.
2. Żołądek: w żołądku należy wykonać manewr inwersji (gastroskopii odwróconej) w celu uwidocznienia wpustu od dołu i dna żołądka. Najczęściej w żołądku stwierdza się gastropatię (rumieniową , aftową , grudkową , zanikową , przerostową ), a ocena histologiczna wycinków błony śluzowej pozwala rozpoznać zapalenie żołądka (związane z zakażeniem H. pylori, zanikowe, w tym z metaplazją jelitową ). Gastropatia wrotna i żylaki żołądka są zmianami typowymi dla nadciśnienia wrotnego. Można stwierdzić nadżerki lub wrzody żołądka (rozdz. III.D.4) oraz polipy (rozdz. III.D.6.4). Najczęstszymi nowotworami złośliwymi są gruczolakoraki i nowotwory neuroendokrynne. Często spotyka się zmiany podnabłonkowe (z reguły nowotwory podścieliskowe).
P rawidłowy obraz trzonu żołądka – ryc. III.B.4-10). Przykłady obrazów nieprawidłowych i zabiegów terapeutycznych
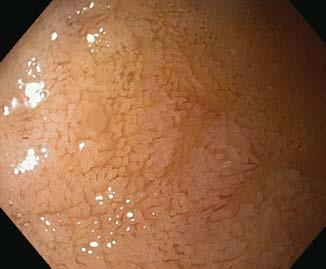
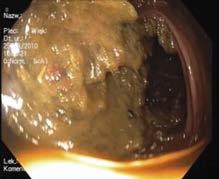
Ryc. III.B.4-23. Ezofagogastroduodenoskopia. Prawidłowa błona śluzowa dwunastnicy z widocznymi kosmkami
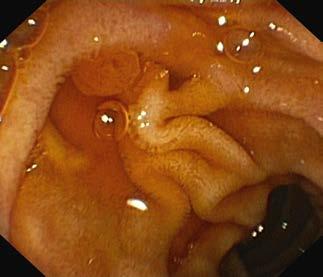
Ryc. III.B.4-24. Ezofagogastroduodenoskopia. Prawidłowa brodawka dwunastnicza większa (Vatera; s trzałka), widoczne również okrężne fałdy błony śluzowej w części zstępującej dwunastnicy
wykonywanych w obrębie żołądka – ryc. III.B.4-11 ☚d7s, ryc. III.B.4-12 ☚fhf, ryc. III.B.4-13 ☚fek, ryc. III.B.4-14 ☚fhg, ryc. III.B.4-15 ☚fhh, ryc. III.B.4-16 ☚fhi, ryc. III.B.4-17 ☚fhj, ryc. III.B.4-18 ☚fhk, ryc. III.B.4-19 ☚fhl, ryc. III.B.4-20 ☚fhm, ryc. III.B.4-21 ☚fi2, ryc. III.B.4-22 ☚fhn
3. Dwunastnica: należy ocenić wygląd fałdów okrężnych ( Kerckringa) i, jeśli to możliwe, uwidocznić brodawkę dwunastniczą większą (Vatera). Można stwierdzić duodenopatię, wrzody trawienne lub zniekształcenie dwunastnicy, które powstaje w wyniku gojenia wrzodów, zmiany nasuwające podejrzenie celiakii, polipy i zmiany naciekowe (w przebiegu nowotworów brodawki Vatera lub dróg żółciowych). W okolicy okołobrodawkowej częste są uchyłki. Obrazy prawidłowe dwunastnicy – ryc. III.B.4-2 3 i ryc. III.B.4-24 . Przykłady obrazów nieprawidłowych i zabiegów terapeutycznych wykonywanych w obrębie
dwunastnicy – ryc. III.B.4-25 ☚fhp, ryc. III.B.4-26 ☚fhx, ryc. III.B.4-27 ☚fhy, ryc. III.B.4-28 ☚fhz, ryc. III.B.4-29 ☚fh2, ryc. III.B.4-3 0 ☚fh3
4.3. Endoskopia jelita grubego (rektoskopia, rektosigmoidoskopia, kolonoskopia)
Złotym standardem w diagnostyce chorób jelita grubego jest kolonoskopia, czyli badanie jelita endoskopem giętkim. Badanie dystalnego odcinka jelita grubego endoskopem sztywnym (rektoskopia) wykonuje się bardzo rzadko.
➔ OPIS BADANIA
Kolonoskopię z reguły rozpoczyna się u pacjenta w pozycji na lewym boku z podkurczonymi nogami W trakcie badania pozycja może być zmieniona na ułożenie na plecach lub na prawym boku, co ułatwia badanie w przypadku trudności z wprowadzeniem kolonoskopu do dalszych części okrężnicy. Przed wprowadzeniem endoskopu należy dokładnie obejrzeć okolicę odbytu i ocenić, czy nie występują zmiany okołoodbytowe (ropnie, przetoki, pęknięcia, guzki krwawnicze) oraz wykonać badanie palcem per rectum
Instrument należy wprowadzać powoli, tylko wtedy, gdy widoczne jest światło jelita. Należy minimalizować insuflację gazu (preferuje się użycie CO2).
Endoskop należy wprowadzić do kątnicy, identyfikując ją poprzez uwidocznienie zbiegających się fałdów z ujściem wyrostka robaczkowego w miejscu ich połączenia oraz zastawki Bauhina, a następnie przez zastawkę do końcowego odcinka jelita krętego (ileokolonoskopia), jeśli jest
Ryc. III.B.4-31. Oczyszczenie jelita w skali Boston: A – 0 pk t B – 1 pk t C – 2 pk t D – 3 pkt (fot. lek. Mateusz Szmit, dr Marek Bugajski, prof. Michał. F. Kamiński)
to możliwe. Dokładnej oceny jelita dokonuje się w trakcie wycofywania endoskopu, co powinno trwać ≥6 min. Podczas badania należy ocenić przygotowanie jelita do badania za pomocą zwalidowanej skali, np. skali Boston (Boston Bowel Preparation Scale – BBPS). BBPS określa w punktach jakość przygotowania 3 segmentów jelita, ( kątnica-wstępnica, poprzecznica i zstępnica- odbytnica), w skali 0–3 (ryc. III.B.4-31: 3 pkt – dobrze widoczna błona śluzowa, bez resztek kału i mętnego płynu; 2 pkt – błona śluzowa dobrze widoczna, w niewielkim stopniu pokryta grudkami kału i/lub mętnym płynem; 1 pkt – błona śluzowa tylko częściowo widoczna z powodu dużej ilości stałego kału lub mętnego płynu; 0 pkt – jelito nieprzygotowane i błona śluzowa pokryta stałym, niedającym się spłukać kałem. Wynik stanowi suma punktów ze wszystkich segmentów jelita (np. BBPS 3+3+3/9). Za dobre przygotowanie uznaje się wynik ≥6 pkt dla całego jelita i ≥2 pkt dla każdego z segmentów Należy wykonać dokumentację fotograficzną, obejmującą m.in. obszary pozwalające na ocenę głębokości wprowadzenia endoskopu (jelito kręte, zastawka krętniczo-kątnicza, dno kątnicy) i czasu jego wycofywania (odbytnica podczas wycofywania), oraz udokumentować wszystkie zmiany patologiczne i wykonane zabiegi terapeutyczne.
Najczęstszym zabiegiem terapeutycznym w kolonoskopii jest polipektomia. Ze względu na częstoś ć występowania polipów każdą kolonoskopię diagnostyczną powinno się traktować jak badanie z ewentualnym wykonaniem polipektomii, co powinno zostać uwzględnione podczas uzyskiwania świadomej zgody pacjenta na badanie.
➔ PRZYGOTOWANIE PACJENTA
Przed sigmoidoskopią, kolonoskopią i przed wszystkimi zabiegami terapeutycznymi konieczne jest zastosowanie
opcjonalnie:
wprowadzenie diety ubogoresztkowej u pacjentów z czynnikami ryzyka złego przygotowania
dodatkowa dawka preparatu przeczyszczającego u pacjentów z czynnikami ryzyka złego przygotowania lub po złym przygotowaniu
3 dni przed badaniem 2 dni przed badaniem
dieta ubogoresztkowa u wszystkich pacjentów
rozpoczęcie przyjmowania preparatu przeczyszczającego –1. porcja
ostatni posiłek (płynny, np. zupa) 2. porcja preparatu przeczyszczającego
zakończenie przyjmowania preparatu przeczyszczającego
godz. 13.00 od rana godz. 16.00 rozpoczęcie 3–5 h przed badaniem ≥2 h przed badaniem
1 dzień przed badaniem w dniu badania
badanie endoskopowe (2–5 h od zakończenia przygotowania)
Ryc. III.B.4-32. Schemat przygotowania jelita do badania z uwzględnieniem diety i stosowania preparatu przeczyszczającego w dawce podzielonej (przedruk z: Med. Prakt., 2020; 3: 70)
diety i leków przeczyszczających. Schemat przygotowania – ryc. III.B.4-32
W przygotowaniu do sigmoidoskopii i kolonoskopii zaleca się dietę ubogoresztkową (dieta płynna jest gorzej tolerowana, a nie poprawia jakości przygotowania) Przez 3 dni przed badaniem nie należy spożywać owoców pestkowych, zwłaszcza z drobnymi pestkami ( kiwi, truskawki, winogrona), pieczywa z ziarnami, musli, siemienia lnianego, maku czy sezamu. W dniu poprzedzającym badanie należy zastosować dietę ubogoresztkową, ostatni posiłek należy spożyć ~13 .00 w przypadku badania wykonywanego w godzinach porannych, a ~17.00, jeśli badanie ma być wykonane w godzinach popołudniowych.
Do przygotowania jelita dostępne są preparaty przeczyszczające o dużej objętości (3–4 l), czyli izoosmotyczne i zrównoważone elektrolitowo roztwory glikolu polietylenowego ( polyethylene glycol – PEG) oraz tzw. preparaty o małej objętośc i (1–2 l), czyli roztwory PEG z askorbinianem, cytrynianem lub bisakodylem, roztwory pikosiarczanu sodu z cytrynianem magnezu oraz roztwory siarczanów sodu, magnezu i potasu. W przypadku zastosowania preparat ów o małej objętości konieczne jest dodatkowe wypicie wody, aby osiągnąć łączną objętość 3–4 l płynu.
Skuteczność przygotowania preparatami o małej objętości i preparatami o dużej objętości jest podobna, przy czym te pierwsze są lepiej tolerowane, a preparaty PEG o dużej objętości uznaje się za bezpieczniejsze i zalecane u pacjentów obciążonych ryzykiem wystąpienia zaburzeń wodno -elektrolitowych (np. z przewlekłą chorobą nerek lub niewydolnością serca), u chorych w wieku podeszłym, u kobiet ciężarnych, u chorych na nieswoistą chorobę zapalną jelit, a także przed badaniami wykonywanymi w trybie pilnym z powodu krwawienia z dolnego odcinka przewodu pokarmowego.
Dodanie simetykonu do preparatu przeczyszczającego poprawia przygotowanie jelita. Nie zaleca się natomiast rutynowego stosowania dodatkowych środków, takich jak bisakodyl czy leki prokinetyczne, ale można je rozważyć u pacjentów z czynnikami ryzyka niewystarczającego przy-
gotowania do kolonoskopii, takimi jak cukrzyca, zaparcie, przyjmowanie opioidów i uszkodzenie rdzenia kręgowego. Z e względu na duże ryzyko powikłań nie stosuje się obecnie doustnych preparatów fosforanów (mogą powodować zaburzenia elektrolitowe i uszkodzenie nerek oraz nadżerki błony śluzowej jelita utrudniające ocenę endoskopową i histologiczną).
Środek przeczyszczający należy przyjąć w dawkach podzielonych, tj. ½ dawki leku wieczorem w dniu poprzedzającym badanie i ½ dawki wcześnie rano w dniu badania, tak aby ukończyć przygotowanie 2 –3 h przed wykonaniem kolonoskopii Przygotowanie takie jest lepiej tolerowane i zapewnia lepsze oczyszczenie jelita, a w konsekwencji większą skuteczność diagnostyczną badania. Jedynym wyjątkiem od tej zasady jest przygotowanie do badania zaplanowanego na godziny popołudniowe, kiedy można całą dawkę środka przeczyszczającego podać w dniu badania Jakość przygotowania do badania poprawia przekazanie pacjentowi oprócz wyczerpującej informacji ustnej także informacji pisemnej lub w formie elektronicznej Przygotowanie doustne nie jest wymagane do rektoskopii diagnostycznej; pacjenta można przygotować wykonaniem wlewki doodbytniczej ze 150 ml roztworu fosforanów sodu lub czystej wody.
➔ WSKAZANIA
1. Wskazania do kolonoskopii przesiewowej: (badanie w celu poszukiwania stanów przedrakowych i raka jelita grubego w zdrowej populacji)
1) osoby bez czynników ryzyka – od 50. rż.; w programie badań przesiewowych określona jest też górna granica wieku – aktualnie w Polsce 65. rż.
2) osoby z dodatnim wywiadem rodzinnym w kierunku raka jelita grubego u krewnego 1. stopnia – od 40. rż. (lub o 10 lat wcześniej niż wiek zachorowania u krewnego)
3) nowotwory jelita grubego uwarunkowane genetycznie (wiek rozpoczęcia badań zależy od zespołu i jest określony w odnośnych wytycznych).
2. Wskazania do kolonoskopii diagnostycznej:
1) krwawienie z przewodu pokarmowego (obecność krwi w stolcu lub smolisty stolec [po wykluczeniu przyczy ny w górnym odcinku przewodu pokarmowego], dodatni wynik badania kału na krew utajoną, niedokrwistość z niedoboru żelaza o nieznanej przyczynie – p. rozdz. VI.D.3, Postępowanie diagnostyczne)
2) zmiana rytmu wypróżnień
3) przewlekła choroba zapalna jelita grubego (weryfikacja rozpoznania, określenie zasięgu i nasilenia zmian)
4) istotna klinicznie biegunka o niejasnej przyczynie
5) wynik badania radiologicznego jelita nasuwający podejrzenie zmiany organicznej
3 . Wskazania terapeutyczne:
1) usuwanie polipów i powierzchownych zmian nowotworowych (polipektomia, mukozektomia, dyssekcja podśluzówkowa, resekcja pełnościenna)
2) tamowanie krwawień z malformacji naczyniowych, owrzodzeń, uchyłków i guzów oraz krwawienia po polipektomii (techniki jak w górnym odcinku przewodu pokarmowego)
3) poszerzanie i/lub protezowanie zwężeń nienowotworowych i nowotworowych
4) znakowanie zmian kwalifikowanych do usunięcia chirurgicznego lub wymagających szczególnego nadzoru endoskopowego
5) odbarczenie ostrej niedrożności rzekomej (atonia i rozdęcie okrężnicy mogące wystąpić w ciężkich chorobach ogólnoustrojow ych lub po operacjach) i skrętu jelita (w wyjątkowych przypadkach)
6) usuwanie ciał obcych
4 . Wskazania do kolonoskopii nadzorczej (powtarzanej okresowo):
1) stan po leczeniu z powodu raka jelita grubego
2) stan po endoskopowym usunięciu polipów jelita grubego – ryc. III.F.10 -5
3) nieswoiste choroby zapalne jelit
4) zwiększone ryzyko nowotworów jelita grubego uwarunkowane genetycznie.
Kryteria kwalifikacji, czas rozpoczęcia i zaprzestania nadzoru oraz częstotliwość wykonywania badań określają osobne wytyczne – p. odnośne rozdziały.
➔ PRZECIWWSKAZANIA
Swoiste przeciwwskazania do wykonania kolonoskopii stanowią:
1) zapalenie otrzewnej
2) perforacja jelita
3) ostre zapalenie uchyłków jelita grubego
4) piorunujące zapalenie jelita grubego.
Przeciwwskazanie względne stanowią ciąża i duży tętniak aorty brzusznej ze skrzepliną.
➔ POWIKŁANI A
Istotne powikłania sercowo-naczyniowe związane z przygotowaniem i sedacją do kolonoskopii występują u 0,1–0,2% badanych.
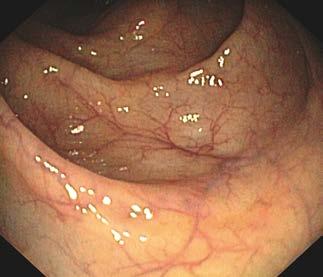
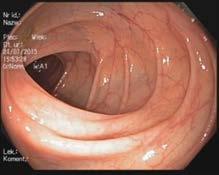
Ryc. III.B.4-33 Kolonoskopia. Prawidłowa błona śluzowa jelita grubego – gładka, lśniąca, z widocznym rysunkiem naczyniowy m
Częstość swoistych powikłań diagnostycznej kolonoskopii jest mała. Do perforacji (najczęściej esicy) dochodzi w <0,1% bada ń; do czynników ryzyka zalicza się starszy wiek, chorobę uchyłkową, choroby zapalne jelit W kolonoskopii zabiegowej ryzyko powikłań zależy od lokalizacji zmian i rodzaju zabiegu (większe w przypadku zabiegów w prawej połowie jelita i usuwania zmian o większej średnicy):
1) krwawienie – ~1% po standardowej polipektomii, 6–7% po EM R , do 10% po ESD zmian o dużej średnicy
2) perforacja – 0,1% po polipektomii, 1% po EMR i ~5% po ESD
3) zespół oparzenia ściany jelita po polipektomii (tzw. zespół po polipektomii) – ~1%.
Rzadkim, ale istotnym powikłaniem kolonoskopii jest uszkodzenie śledziony.
➔ OCENA OBRAZU ENDOSKOPOWEGO
Prawidłowa błona śluzowa jelita grubego jest gładka, lśniąca, z widocznym rysunkiem naczyniowym (ryc. III.B.4-33). W kątnicy widać charakterystyczny układ fałdów i zastawkę krętniczo -kątniczą (ryc. III.B.4-34), a w końcowym odcinku jelita krętego – kosmki. W chorobach zapalnych jelit można stwierdzić zatarcie rysunku naczyniowego, przekrwienie błony śluzowej, jej kruchość (skłonność do krwawienia po dotknięciu endoskopem) lub samoistne krwawienie, nadżerki i owrzodzenia, zwężenia i przetoki. W jelicie mogą występować uchyłki, zmiany naczyniowe (angiodysplazje, teleangiektazje, żylaki), polipy różnego rodzaju (rozdz. III.F.10.1); rak jelita grubego może mieć postać polipowatą albo płaskiego nacieku. Przykłady zmian patologicznych w obrębie jelita grubego –ryc. III.B.4-35 ☚fh5, ryc. III.B.4-36 ☚fi4, ryc. III.B.4-37 ☚fh6, ryc. III.B.4-38 ☚fh7, ryc. III.B.4-39 ☚fia, ryc. III.B.4-40 ☚fib, ryc. III.B.4-41 ☚fi5, ryc. III.B.4-42 ☚fic, ryc. III.B.4-43 ☚fiw, ryc. III.B.4-44 ☚fid.
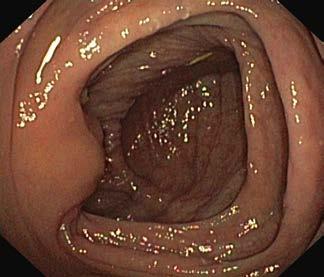
Ryc. III.B.4-34 Kolonoskopia. Prawidłowa kątnica; widoczna zastaw ka krętniczo ‑kątnicza (strzałka) i typowy układ fałdów
4.4. Endoskopia jelita cienkiego
Jelito cienkie jest odcinkiem przewodu pokarmowego trudnym do badania endoskopowego. Do bezpośredniej oceny błony śluzowej jelita czczego i krętego może być wykorzystana enteroskopia wspomagana balonem (jedno- lub dwubalonowa) oraz endoskopia kapsułkowa (video capsule endoscopy – VCE). VCE i enteroskopia są metodami uzupełniającymi się, ale niestety nadal nie są one powszechnie dostępne. Enteroskopię powinno się wykonywać, gdy VCE jest niedostępna, występują przeciwwskazania do jej wykonania ( p niżej), jej wynik nie pozwala na usta lenie rozpoznania lub konieczne jest uzyskanie materiału do badania histologicznego, a także w przypadku dużego prawdopodobieństwa konieczności wykonania zabiegu terapeutycznego (zatrzymania krwawienia lub wykonania polipektomii).
➔ OPIS BADANIA
1. Endoskopia kapsułkowa: VCE przeprowadza się za pomocą połykanej przez pacjenta jednorazowej, bezprzewodowej kapsułki (z kamerą cyfrową i oświetleniem LED) o długości 24–28 mm i średnicy 11–13 mm, która dzięki ruchom perystaltycznym biernie przemieszcza się przez przewód pokarmow y, wykonując 2–6 zdjęć jelita na sekundę. Obrazy są transmitowane do noszonego przez pacjenta rejestratora. Kapsułka rejestruje obraz przez 8 –12 h. W tym czasie pacjent może pić przejrzyste płyny (>2 h po połknięciu kapsułki), a spożyć posiłek i przyjąć leki – 4 h po połknięciu kapsułki. Pacjent może w czasie badania normalnie funkcjonować (np. prowadzić samochód, używać komputera czy telefonu komórkowego). Po przesłaniu obrazów z rejestratora do stacji roboczej dokonywana jest analiza obrazów. Kapsułka ulega wydaleniu ze stolcem zwykle do 48 h od połknięcia.
➔ PRZYGOTOWANIE PACJENTA
1. Endoskopia kapsułkowa : zaleca się płynną dietę w dniu poprzedzającym badanie i powstrzymanie się od spożywania posiłków przez 8–12 h przed połknięciem kapsułki. Optymalnym sposobem przygotowania jest wypicie 1–2 l roztworu PEG na 4 h przed badaniem oraz przyjęcie 200–320 mg simetykonu 30 min przed badaniem. Nie ma wskazań do rutynowego stosowania leków prokinetycznych. Na 5 dni przed badaniem należy odstawić preparaty żelaza, a w przeddzień i w dniu badania – leki pokrywające błonę śluzową (np. sukralfat). Zaleca się, aby pacjent nie stosował NSLPZ przez miesiąc przed zaplanowanym badaniem, ponieważ mogą powodować uszkodzenie jelita.
2. Enteroskopia: optymalne przygotowanie do enteroskopii d rogą przezustną nie jest ustalone. Zazwyczaj zaleca się takie przygotowanie jak do VCE Przed badaniem drogą przezodbytową należy wykonać pełne przygotowanie jelita jak do kolonoskopii.
➔ W S KAZANIA
1) krwawienie z przewodu pokarmowego o niewyjaśnionej przyczynie (po wykluczeniu krwawienia z górnego i dolnego odcinka przewodu pokarmowego w rutynowych badaniach endoskopowych)
2) niedokrwistość z niedoboru żelaza po wykluczeniu innych przyczyn
3) podejrzenie choroby zapalnej jelita cienkiego (choroba Leśniowskiego i Crohna)
4) uszkodzenie jelita w wyniku przyjmowania NSLP Z 5) celiakia (zwłaszcza oporna na leczenie) i inne zespoły upośledzonego wchłaniania
6) zespoły polipowatości przewodu pokarmowego (rodzinna polipowatość gruczolakowata, zespół Peutza i Jeghersa)
7 ) podejrzenie nowotworu jelita cienkiego
8) radiologiczne rozpoznanie patologii jelita cienkiego wymagające weryfikacji
➔ P R ZECIWWSKAZANIA
1. Przeciwwskazania do VCE : zaburzenia połykania, zaburzenia perystaltyki, zwężenie jelita (ryzyko uwięźnięcia kapsułki), ciąża. Kapsułka endoskopowa nie zakłóca pracy wszczepialnych urządzeń kardiologicznych (rozrusznik, kardiowerter-defibrylator, układ resynchronizujący) czy pomp insulinowych.
2. Enteroskopia: wykonuje się endoskopami o długości 150–200 cm, wyposażonymi w urządzenia służące do fałdowania jelita (tubę zewnętrzną z balonem i ew. dodatkowy balon na końcówce endoskopu). Konieczność wielokrotnego powtarzania sekwencji wprowadzania endoskopu i tuby zewnętrznej oraz ich wycofywania, a także zasięg badania powodują, że enteroskopia wspomagana balonem trwa 60–90 min i powinna być wykonywana w sedacji i.v. Wykonanie badania z dostępu przezustnego i przezodbytowego pozwala na ocenę całego jelita cienkiego u ~60% pacjentów. Enteroskopia umożliw ia pobieranie materiału do bada ń i wykonywanie zabiegów terapeutycznych.
D Choroby kory nadnerczy
1) u chorych z nierozpoznaną N KN (pierwszy objaw cho roby, najczęściej w sytuacjach stresowych), w tym także z nierozpoznaną posteroidową NKN – p. rozdz. IV.D.3.3
2) u chorych z rozpoznaną i leczoną NKN (w tym także posteroidową – p. rozdz. IV.D.3.3)
a) po odstawieniu leczenia substytucyjnego przez cho rego
b) w sytuacjach stresowych, bez osłony dostateczną dawką hydrokortyzonu albo w wyniku niedostatecz nego wchłaniania hydrokortyzonu z powodu biegunki lub wymiotów, często w przebiegu zakażenia prze wodu pokarmowego
c) w razie zwiększonego metabolizmu GKS pod wpły wem stosowanych równocześnie leków (fenytoina, barbiturany, ryfampicyna, mitotan) lub w nadczyn ności tarczycy
3) u osób z dotychczas prawidłową czynnością wydzielniczą nadnerczy
a) w następstwie uszkodzenia zdrowych nadnerczy przez uraz lub wylew krwi w przebiegu zespołu r ozsianego krzepn ięcia wewnątrznaczyniowego (np. w sepsie), leczenia przeciwzakrzepowego lub rzucawki ciężarnych
b) szczególna postać – tzw. czynnościowa niewydol noś ć kory nadnerczy opisywana u chorych z sepsą; istotą tych zmian są zaburzenia czynności układu podwzgórzowo ‑przysadkowo ‑nadnerczowego połą czone z tkankową opornością na kortykosteroidy i wygórowaną reakcją zapalną.
➔ OBRAZ KLINICZNY I ROZPOZNANIE
Przełom nadnerczowy stanowi bezpośrednie zagrożenie życia. Natychmiastowe leczenie ma zasadnicze znaczenie dla przeżycia chorego
W tzw. zagrażającym przełomie nadnerczowym (faza przed wstrząsem) występują: nasilające się osłabienie, nudności i wymioty, czasem luźne stolce, grypopodobny ból mięśni, stopniowo obniża się ciśnienie tętnicze. Może też dojść do wzrostu temperatury ciała wywołanego przez cytokiny uwalniane przy niedoborze kortyzolu.
R ozwinięty przełom nadnerczowy przebiega pod postacią hipotensji lub wstrząsu hipowolemicznego opor nego na leczenie katecholaminami, z towarzyszącym ≥1 z objawów: nudności lub wymioty, poważne zmęczenie lub osłabienie, podwyższona temperatura ciała, zaburzenia świadomości (w tym letarg, dezorientacja, senność, zapaść, majaczenie, śpiączka i drgawki).
Wstrząs hipowolemiczny w przełomie nadnerczowym ma typowo nieproporcjonalnie ciężki przebieg względem nasi lenia czynnika wyzwalającego (jeśli go zidentyfikowano), słabo reaguje na podanie leków działających inotropowo dodatnio i na resuscytację płynową, natomiast widoczną poprawę przynosi pozajelitowe podanie GKS.
W przełomie nadnerczowym spowodowanym przez roz siane krzepnięcie wewnątrznaczyniowe w przebiegu sepsy, zwłaszcza meningokokowej, objawom ostrej niewydolności kory nadnerczy towarzyszą rozległe wylewy krwi w skórze (zespół Waterhouse’a i Friderichsena).
Badania pomocnicze
1. Badania laboratoryjne:
1) podstawowe badania biochemiczne – hiponatre mia, hiperkaliemia (częściej w pierwotnej NKN [rozdz. IV.D.3.1.1], w której dodatkowo upośledzone jest wydzie lanie aldosteronu, niż we wtórnej [rozdz. IV.D.3.1.2] lub posteroidowej [rozdz. IV.D.3.3] NKN, w których jest ono zachowane), ponadto hipoglikemia, cechy odwodnienia, możliwe zwiększone stężenia mocznika i kreatyniny w surowicy (w przebiegu odwodnienia), limfocytoza, eozynofilia
2) badania hormonalne – zmniejszone stężenie korty zolu w surowicy (leczenie rozpoczyna się przed otrzy maniem wyniku oznaczania kortyzolu).
2. Badania obrazowe: wykonuje się zależnie od podej rzewanej przyczyny przełomu nadnerczowego.
➔ LECZENIE
Leczenie ma na celu uzupełnienie niedoboru kortyzolu, płynów i glukozy, wyrównanie zaburzeń elektrolitowych oraz opanowanie ewentualnego zakażenia lub innego stanu stymulującego rozwój przełomu.
W leczeniu ostrej niewydolności kory nadnerczy, które należy rozpocząć niezwłocznie po pobraniu próbek krwi do badań podstawowych (glukoza, sód, potas, kreatynina) i hormonalnych (kortyzol, ACTH) oraz ew. w kierunku zakażenia, stosuje się:
1) hydrokortyzon – 50–100 mg niezwłocznie we wstrzyk nięciu i.v., następnie 100–200 mg/d we wlewie i.v , ew. 25–50 mg i.v. co 6 h
2) 0,9% NaCl + ew. 10% roztwór glukozy (w razie małego stężenia glukozy w surowicy), początkowo 1 l/h, łącznie 2–4 l w ciągu 24 h
3) w nasilonej hipowolemii konieczne może być przetacza nie większych objętości płynów (rozdz. XII.H). Ilość i rodzaj przetaczanych płynów zależą od bilansu płynów, nasilenia zaburzeń elektrolitowych, wydolności układu sercowo‑naczyniowego i nerek.
Należy pamiętać o ścisłym monitorowaniu natremii, ponieważ zbyt szybkie jej wyrównanie może prowa dzić do ciężkich powikłań neurologicznych (osmotyczny zespół demielinizacyjny – rozdz. X I I.C.2).
4) w przypadku stężenia potasu >7 mmol/l lub stwierdzenia zmian w EKG charakterystycznych dla hiperkaliemii (rozdz. X I I.D.3) należy rozważyć podanie glukonianu wapnia albo wlewu glukozy z insuliną (postępowanie w hiperkaliemii – p. rozdz. X I I.D.3).
W zagrażającym przełomie nadnerczowym może wystar czyć wczesne wstrzyknięcie i.v., s.c. lub i.m. 100 mg hydro kortyzonu, aby zapobiec dalszym nasilonym objawom.
➔ ROKOWANIE
Właściwie prowadzone leczenie przełomu nadnerczowego ratuje choremu życie, ale rokowanie może być niepewne w przypadku współistnienia innych zaburzeń, odpowie dzialnych za wystąpienie przełomu.
Tabela IV.D.3-1. Charakterystyka farmakologiczna glikokortykosteroidów (GKS) o działaniu ogólnoustrojowym zarejestrowanych i dostępnych w Polsce
GKS Przybliżona dawka odpowiadająca fizjologicznej (mg)a
Siła działania GKS (w odniesieniu do hydrokortyzonu)a,b
Biologiczny okres półtrwania ( h)a
krótko działające GKS o słabszym działaniu hydrokortyzon 20 1,0 8–12
GKS o średnio długim czasie działania i umiarkowanej sile działania
prednizon 5 4,0 12–36
Działanie i wskazania terapeutyczne
substytucja w NKN
przeciwzapalne, immunosupresyjne substytucja w NKN prednizolon 5 4,0 12–36
przeciwzapalne, immunosupresyjne substytucja w NKN triamcynolon 4 5,0 12–36 przeciwzapalne, immunosupresyjne metyloprednizolon 4 5,0 12–36 przeciwzapalne, immunosupresyjne długo działające GKS o największej sile działania deksametazon 0,5c 30–60 36–72
przeciwzapalne, immunosupresyjne zwykle do krótkotrwałego stosowania w ciężkich, ostrych stanach betametazon 0,5c 25–40 36–72
przeciwzapalne, immunosupresyjne zwykle do krótkotrwałego stosowania w ciężkich, ostrych stanach a Oznacza jedynie szacunkowy ekwiwalent dawki, obliczony na podstawie historycznie przyjętych współczynników konwersji, który należy traktować wyłącznie jako wskazówkę. Mogą występować znaczne różnice w zależności od różnych czynników, takich jak droga podania, metabolizm i indywidualna wrażliwość danego pacjenta.
b Równoważniki siły działania GKS odnoszą się do podania doustnego i/lub dożylnego. Nie uwzględniono działania mineralokortykosteroidowego. c lub nieco mniejsza; podczas odstawiania długo działającego GKS lepiej zamienić go na równoważną dawkę słabszego GKS, np. prednizonu (p. też tab. IV.D.3-6 )
NKN – niedoczynność kory nadnerczy na podstawie zaleceń ESE i ES (2024), zmodyfikowano
3.3. Niedoczynność kory nadnerczy wywołana stosowaniem glikokortykosteroidów
➔ DEFINICJA
Niedoczynność kory nadnerczy (NKN) wywołana stosowaniem glikokortykosteroidów (GKS; posteroidowa) jest stanem niedoboru hormonów nadnerczy, głównie kortyzolu, wynikającym z zahamowania osi podwzgórze–przysadka–nadnercza (HPA) wskutek przewlekłego stosowania egzogennych GKS w dawkach przekraczających zapotrzebowanie fizjologiczne.
➔ EPIDEMIOLOGIA
Częstość występowania NKN wywołanej GKS jest trudna do określenia ze względu na heterogenność badań, różnice w metodach diagnostycznych oraz odmienność badanych populacji. Szacuje się, że przewlekła terapia GKS obejmuje 1–3% populacji ogólnej, natomiast doustne GKS przewlekle przyjmuje 0,5–1,8% dorosłych, częściej kobiety (z powodu częstszego występowania chorób o podłożu autoimmunologicznym) i osoby starsze (częściej wymagające leczenia przeciwzapalnego i przeciwbólowego). Ryzyko NKN po odstawieniu doustnych GKS stosowanych w dawkach większych niż fizjologiczne przez >3–4 tyg. wynosi ~49% (na podstawie badań hormonalnych, a nie występujących objawów), natomiast ryzyko jest znacznie mniejsze (~4–8%) u osób przyjmujących GKS wziewnie,
miejscowo lub donosowo. Szczególnie narażeni na rozwój NKN po odstawieniu GKS są chorzy po przeszczepieniu nerki, z nieswoistą chorobą zapalną jelit lub reumatyczną chorobą układową.
➔ ETIOLOGIA I PATOGENEZA
Długotrwałe stosowanie GKS (tab. IV.D.3-1) może prowadzić do zahamowania osi HPA, czego konsekwencją jest upośledzona synteza i wydzielanie hormonów kory nadnerczy – przede wszystkim kortyzolu, ale także androgenów nadnerczowych, takich jak siarczan dehydroepiandrosteronu (DHEA- S). Mechanizm tego zahamowania opiera się na ujemnym sprzężeniu zwrotnym, w którym egzogenne GKS hamują wydzielanie kortykoliberyny (CRH) oraz ACTH, co prowadzi do ograniczenia stymulacji kory nadnerczy. W efekcie dochodzi do jej zaniku, a po zmniejszeniu dawki lub odstawieniu GKS synteza kortyzolu staje się niewystarczająca do pokrycia fizjologicznego zapotrzebowania (zwłaszcza w sytuacjach stresowych), co prowadzi do rozwoju NKN wywołanej stosowaniem GKS. Niedobór kortyzolu nie wiąże się z deficytem aldosteronu, ponieważ jego wydzielanie pozostaje regulowane głównie przez układ renina–angiotensyna. Przyjmuje się, że każda dawka GKS przekraczająca 15–25 mg/d hydrokortyzonu, 4–6 mg/d prednizonu lub prednizolonu, 3–5 mg/d metyloprednizolonu i 0,25–0,5 mg/d deksametazonu (przedziały uwzględniają indywidualne różnice wrażliwości) jest większa niż fizjologiczne zapotrzebowanie, odpowiadające średniej dobowej produkcji kortyzolu (~9–10 mg/d) i może prowadzić do NKN po odsta-
Tabela IV.D.3-2. Czynniki ryzyka rozwoju niedoczynności kory nadnerczy (NKN) i wystąpienia przełomu nadnerczowego podczas i po zakończeniu leczenia glikokortykosteroidami (GKS) (zarejestrowanymi w Polsce)
Czynniki wpływające na stopień ryzyka
Ryzyko wystąpienia NKN i przełomu nadnerczowego małe umiarkowane duże
siła działania GKS hydrokortyzon prednizon prednizolon metyloprednizolon triamcynolon
droga podania GKS donosowo miejscowoc okulistycznie
wziewnie
deksametazon betametazon flutykazona klobetazolb
ogólnoustrojowo (doustnie, domięśniowo, dożylnie) wewnątrzstawowo jednoczesne stosowanie GKS podawanych w inny sposób
dawka GKS mała średnia duża czas stosowania <3–4 tyg. od 3–4 tyg. do 3 mies. >3 mies.
wskaźnik masy ciała (BMI) prawidłowy 25–29,9 kg/m2 (nadwaga) ≥30 kg/m2 (otyłość)
wiek dorośli w młodszym wieku –
dorośli w starszym wieku
a W Polsce zarejestrowane i dostępne są wyłącznie preparaty flutykazonu w postaci wziewnej, donosowej albo do stosowania na skórę.
b W Polsce zarejestrowane i dostępne są wyłącznie preparaty do stosowania na skórę.
c Ryzyko zwiększa się w razie stosowania na większą powierzchnię skóry (przez zwiększoną dawkę GKS) oraz na zmiany zapalne skóry z uszkodzeniem bariery ochronnej (przez zwiększenie wchłaniania i biodostępności GKS).
przedruk z: Med. Prakt., 2025; 5: 41
wieniu GKS. Zahamowanie osi HPA może wystąpić niezależnie od drogi podania leku: p.o., i.v., i.m., dostawowo, miejscowo na skórę, wziewnie, donosowo.
Czynniki ryzyka
Ocena ryzyka wystąpienia NKN podczas terapii GKS lub po jej zakończeniu powinna uwzględniać dawkę, częstotliwość i drogę podania, czas trwania terapii, siłę działania stosowanego GKS, a także równoczesne stosowanie leków wpływających na metabolizm GKS oraz indywidualną wrażliwość na ich działanie. Czynniki ryzyka rozwoju NKN i przełomu nadnerczowego w trakcie oraz po zakończeniu leczenia GKS – p. tab. IV.D.3-2
➔
OBRAZ KLINICZNY
Obraz kliniczny NKN wywołanej stosowaniem GKS jest zróżnicowany – obejmuje zarówno postaci bezobjawowe, jak i przypadki z niedoborem kortyzolu o różnym stopniu nasilenia, aż do zagrażającego życiu przełomu nadnerczo-
Tabela IV.D.3-3. Czynniki stresowe mogące wywołać objawy niedoczynności kory nadnerczy (NKN) i przełom nadnerczowy
czynniki ogólne – niezależne od przyczyny NKN
– zakażenie (np. układu pokarmowego, oddechowego, sepsa)
– choroba o ostrym przebiegu (w tym z gorączką)
– intensywna aktywność fizyczna
– zabieg chirurgiczny lub inne procedury wymagające znieczulenia ogólnego, regionalnego lub miejscowego, w tym stomatologiczne – poród i połóg
– silny stres i ból (w tym silny lęk i żałoba)
– uraz fizyczny
czynniki specyficzne dla NKN wywołanej stosowaniem GKS
– nagłe odstawienie GKS u osoby długotrwale przyjmującej GKS
– zmniejszanie dawki GKS poniżej zapotrzebowania fizjologicznego
– zmiana preparatu lub dawki wziewnego GKS (różnice we wchłanianiu)
– rozpoczęcie stosowania silnych stymulatorów cytochromu P450 3A4 (np. karbamazepina, enzalutamid, mitotan, fenobarbital, fenytoina, ryfampicyna), co prowadzi do nasilenia metabolizmu wątrobowego GKS
GKS – glikokortykosteroidy
wego (rozdz. IV.D.3.2). Ryzyko wystąpienia NKN zależy od szeregu czynników (p. tab. IV.D.3-2) decydujących o stopniu supresji osi HPA, a także od indywidualnej wrażliwości. W warunkach stabilnych wielu chorych pozostaje bez dolegliwości lub występują u nich objawy, które często mają niespecyficzny charakter i mogą narastać stopniowo. Dopiero pod wpływem czynników stresowych (tab. IV.D.3-3), gdy istotnie zwiększa się zapotrzebowanie na GKS, objawy ulegają zaostrzeniu; w skrajnych przypadkach może się też rozwinąć przełom nadnerczowy. Przebieg NKN wywołanej stosowaniem GKS jest jednak zazwyczaj łagodniejszy niż w postaci pierwotnej NKN, ponieważ zachowane wydzielanie mineralokortykosteroidów ogranicza ryzyko ciężkich zaburzeń elektrolitowych i wstrząsu.
Objawy NKN mogą współistnieć z objawami wcześniejszego nadmiaru GKS, co utrudnia rozpoznanie i może prowadzić do błędnej interpretacji obrazu klinicznego. Zbyt szybkie odstawienie lub zmniejszenie dawki GKS do mniejszej niż fizjologiczna może w ywołać objawy NKN także u chor ych z objawami jatrogennego zespołu Cushinga , które rozwinęły się podczas długotrwałej kortykoterapii. Do objawów tych zalicza się: osłabienie i zanik mięśni proksymalnych, otyłość centralną , nagromadzenie tkanki tłuszczowej w dołach nadobojczykowych i na karku, zaokrąglenie twarzy, występowanie szerokich czerwono-sinych rozstępów, łatwe powstawanie siniaków i wylewów podskórnych, słabe gojenie się ran, trądzi k (p. też rozdz. IV.D.4); dopiero z czasem obserwuje się stopniowe zanikanie cech nadmiaru GKS, takich jak zaokrąglone rysy twarzy czy nadmierna masa ciała.
1. Objawy podmiotowe NKN:
1) przewlekłe zmęczenie i osłabienie, zmniejszona tolerancja wysiłku
2) brak apetytu – konsekwencja upośledzonego metabolizmu białek i tłuszczów oraz zmniejszonej stymulacji ośrodka łaknienia
3) zawroty głowy – szczególnie przy wstawaniu z pozycji siedzącej lub leżącej
4) ból brzucha, nudności, uczucie dyskomfortu w nadbrzuszu, wzdęcia, biegunki lub zaparcia
5) obniżenie nastroju, depresja, zaburzenia koncentracji
6) ból mięśni – zwłaszcza w proksymalnych grupach mięśniowych, nasilający się po wysiłku
7) ból stawów.
2. Objawy przedmiotowe NKN:
1) obniżone ciśnienie tętnicze i hipotensja ortostatyczna
2) osłabienie mięśni
3) utrata masy ciała
4) blada, sucha skóra (w odróżnieniu od pierwotnej NKN nie występuje hiperpigmentacja, ponieważ stężenie ACTH nie jest zwiększone).
➔ ROZPOZNANIE
Badania pomocnicze
1. Badania hormonalne (rozdz. IV.D.2.1):
1) oznaczanie porannego stężenia kortyzolu w surowicy jest podstawową metodą oceny czynności osi HPA. Aby uniknąć wpływu egzogennych GKS na wynik, badanie należy wykonać po odpowiednio długiej przerwie w ich przyjmowaniu, która w zależności od siły i czasu działania GKS wynosi ≥12 h dla hydrokortyzonu, 24 h dla prednizonu i prednizolonu oraz 72 h dla deksametazonu (który najlepiej już wcześniej zamienić na równoważną dawkę krócej działającego GKS, np. prednizonu). Wynik można w przybliżeniu ocenić według następujących kryteriów – stężenie kortyzolu w surowicy o godz. 8:00 rano:
a) >10 μg/dl (300 nmol/l) → prawidłowa czynność osi HPA, z dużym prawdopodobieństwem nie ma NKN
b) 5–10 μg/dl (150–300 nmol/l) → wynik niejednoznaczny, do rozważenia dalsza diagnostyka czynnościowa w celu oceny rezerwy wydzielniczej kory nadnerczy
c) <5 μg/dl (150 nmol/l) → duże prawdopodobieństwo NKN, należy kontynuować leczenie substytucyjne (za wtórną NKN dodatkowo przemawia zmniejszone lub blisko dolnej granicy przedziału referencyjnego stężenie ACTH w osoczu, oznaczone z próbki pobranej rano, w tym samym czasie co oznaczenie stężenia kortyzolu).
Interpretacja wyniku wymaga uwzględnienia czynników mogących wpływać na stężenie kortyzolu (p. rozdz. IV.D.2.1.1).
2) oznaczenie stężenia DHEA‑ S w surowicy, które może być zmniejszone
3) badania czynnościowe – w razie uzyskania niejednoznacznych wyników porannego stężenia kortyzolu w surowicy (5–10 μg/dl) w pierwszej kolejności należy rozważyć test stymulacji z syntetycznym ACTH (250 μg) – stężenie kortyzolu w surowicy oznacza się przed podaniem ACTH i.m. lub i.v. oraz 30 i 60 min po jego podaniu, po ≥24 h od odstawienia GKS (p. też rozdz. IV.D.2.1.3). Interpretacja: stężenie kortyzolu ≥18,1 μg/dl (500 nmol/l) w dowolnym punkcie testu wyklucza NKN, a stężenie <18,1 μg/dl (500 nmol/l) wskazuje na NKN (p. też ryc. IV.D.3-4). Jeśli podej-
rzenie wtórnej NKN jest silne, a wynik testu z 250 μg ACTH jest prawidłowy, warto rozważyć użycie jednego z alternatywnych testów dynamicznych, takich jak: a) test z CRH (rozdz. IV.D.2.1.4) – ocenia zdolność wydzielania ACTH w odpowiedzi na podanie CRH b) test z metyraponem – ocenia zdolność przysadki do pobudzenia wydzielania ACTH po zahamowaniu syntezy kortyzolu
c) test hipoglikemii poinsulinowej – wymaga wywołania hipoglikemii i oceny reakcji kortyzolu, jednak z uwagi na możliwe groźne powikłania jest bardzo rzadko wykonywany.
2. Inne badania laboratoryjne: 1) podstawowe badania biochemiczne krwi – hiponatremia (wywołana zwiększonym pod wpływem niedoboru kortyzolu wydzielaniem wazopresyny), hipoglikemia, zwiększone stężenia mocznika i kreatyniny w surowicy (w razie odwodnienia)
2) morfologia krwi – możliwa eozynofilia i/lub limfocytoza.
3. Badania obrazowe: nie odgrywają zasadniczej roli w diagnostyce posteroidowej NKN, jednak mogą być przydatne do wykluczenia innych przyczyn NKN. MR lub TK przysadki mogą ujawnić zmiany ogniskowe okolicy podwzgórzowo-przysadkowej albo obraz pustego lub częściowo pustego siodła.
Kryteria rozpoznania
Rozpoznanie NKN wywołanej stosowaniem GKS wymaga oceny pod kątem objawów klinicznych (które jednak w warunkach podstawowych często nie występują) i badań biochemicznych (zmniejszone poranne stężenie kortyzolu w surowicy lub nieprawidłowy wynik testu stymulacyjnego z syntetycznym ACTH).
Rozpoznanie różnicowe
W diagnostyce różnicowej NKN wywołanej stosowaniem GKS należy uwzględnić możliwość wystąpienia zespołu odstawienia GKS, którego objawy są niespecyficzne i mogą przypominać zarówno NKN, jak i nawrót choroby podstawowej, z powodu której włączono GKS.
Zespół odstawienia GKS obejmuje objawy występujące po zmniejszeniu ponadfizjologicznej dawki GKS, które nie są wywołane chorobą podstawową (w której leczeniu są stosowane) ani, z definicji, nie są spowodowane NKN, ponieważ całkowita dawka dobowa GKS nadal jest większa niż fizjologiczna. Objawy są niespecyficzne i w większości podobne do występujących w NKN – osłabienie, zmęczenie, senność, ból mięśni i stawów, hipotensja ortostatyczna, utrata łaknienia, nudności, wymioty, stan podgorączkowy, zaburzenia nastroju, lęk i napady paniki. Rozwój tego zespołu jest skutkiem adaptacji organizmu do przewlekłej hiperkortyzolemii i związanej z nią zależności od egzogennych GKS. Patofizjologia zespołu odstawienia GKS jest złożona i obejmuje zahamowanie wydzielania CRH oraz wtórne zmniejszenie aktywności osi HPA, dysfunkcję układów noradrenergicznego i dopaminergicznego, zmniejszenie stężenia proopiomelanokortyny (POMC) oraz zwiększenie stężenia cytokin prozapalnych (IL - 6, TNF- α) i prostaglandyn.
Objawy NKN u chorego, który zmniejszył dawkę lub niedawno odstawił GKS
Czy chory przyjmuje dawkę GKS odpowiadającą fizjologicznej lub większą?
prawdopodobnie zespół odstawienia GKS, NKN mało prawdopodobna
ACTH – hormon adenokortykotropowy, GKS – glikokortykosteroidy, NKN – niedoczynność kory nadnerczy
kortyzol >10 μg/dl (>300 nmol/l)
NKN mało prawdopodobna
oznaczyć stężenie kortyzolu o godz. 8:00 rano
kortyzol 5–10 μg/dl (150–300 nmol/l)
wynik niejednoznaczny
test stymulacji syntetycznym ACTH (250 μg)
oznaczyć stężenie kortyzolu wyjściowo i po 30 i 60 min
kortyzol ≥18,1 μg/dl (500 nmol/l)
NKN mało prawdopodobna
kortyzol <5 μg/dl (<150 nmol/l)
NKN potwierdzona
kortyzol <18,1 μg/dl (500 nmol/l)
duże prawdopodobieństwo NKN
Ryc. IV.D.3-4 Postępowanie diagnostyczne przy podejrzeniu niedoczynności kory nadnerczy wywołanej stosowaniem glikokortykosteroidów
W praktyce klinicznej odróżnienie NKN od zespołu odstawienia GKS u chorych przyjmujących GKS w dawkach zbliżonych do fizjologicznych jest trudne i często niemożliwe W różnicowaniu pomocna może być ocena dawki dobowej przyjmowanych GKS. W NKN objawy występują zwykle po zmniejszeniu dawki do fizjologicznej lub poniżej, natomiast w zespole odstawienia GKS objawy mogą pojawić się przy dawkach nadal ponadfizjologicznych.
W niektórych przypadkach pomocne mogą być badania laboratoryjne: w NKN można stwierdzić hiponatremię, czasami hipoglikemię, podczas gdy w zespole odstawienia GKS parametry te pozostają zwykle prawidłowe. W badaniach hormonalnych w NKN początkowo stężenia ACTH w osoczu i kortyzolu w surowicy są niskie, następnie, w miarę leczenia (gdy dawka GKS nie przekracza fizjologicznej), w pierwszej kolejności zwiększa się stężenie ACTH. W zespole odstawienia GKS z reguły nie ma wskazań do oznaczania stężeń ACTH i kortyzolu (ponieważ dawka GKS jest ponadfizjologiczna), jednak gdyby je oznaczyć, to ich wartości byłyby małe lub nieoznaczalne.
Postępowanie diagnostyczne
Algorytm postępowania przy podejrzeniu NKN wywołanego stosowaniem GKS – p. ryc. IV.D.3-4 .
➔ LECZENIE
Zasady ogólne
W potwierdzonej NKN należy zapewnić substytucję GKS i nie zmniejszać dawki leku poniżej dolnej granicy przedziału odpowiadającego dawkom fizjologicznym, a także przeszkolić chorego w zakresie samodzielnego zwiększania dawki w sytuacjach stresowych (p. tab. IV.D.3-3 i tab. IV.D.3-4). Utrzymywanie bezpiecznej, ale możliwie najmniejszej dawki GKS pozwala na stopniowe zwiększenie wydzielania ACTH, które będzie pobudzać korę nadnerczy do regeneracji i powinno doprowadzić do zwiększenia wydzielania kortyzolu. Po kilku miesiącach należy powtórzyć diagnostykę hormonalną – dalsze istotne zmniejszanie dawki GKS jest możliwe wyłącznie w razie stwierdzenia powrotu czynności osi HPA. U niewielkiej części chorych może się utrzymywać przewlekły niedobór kortyzolu.
Tabela IV.D.3-4. Zalecane schematy stosowania glikokortykosteroidów (GKS) u chorych z podejrzewaną lub rozpoznaną niedoczynnością kory nadnerczy (NKN) wywołaną stosowaniem GKS w sytuacjach występowania czynnika stresowego o niewielkim nasileniu
Jeśli chory już przyjmuje hydrokortyzon ≥40 mg/d, prednizon ≥10 mg/d lub deksametazon ≥1 mg/d, zwykle nie ma potrzeby zwiększania dawki GKS , chyba że pojawią się objawy niestabilności hemodynamicznej.
Czynnik stresowy o niewielkim nasileniu – przykłady
choroba wymagająca leżenia w łóżku choroba z gorączką (poza szpitalem) choroba wymagająca antybiotykoterapii (poza szpitalem) silny stres emocjonalny (np. żałoba)
drobne zabiegi chirurgiczne (w tym procedury wymagające znieczulenia miejscowego)
jeśli chory nie przyjmuje codziennie GKS
hydrokortyzon 40 mg/d w 3 dawkach podzielonych (np. 20 mg rano, 10 mg w południe, 10 mg po południu) przez 2–5 dni, aż do ustąpienia objawów (lub przez cały okres antybiotykoterapii)
hydrokortyzon 40 mg/d w 3 dawkach podzielonych (np. 20 mg – 1 h przed zabiegiem, 10 mg – 6 h po zabiegu, 10 mg –po kolejnych 6 h)
jeśli chory stosuje hydrokortyzon <40 mg/d
zwiększyć dawkę do 40 mg/d, w 3 dawkach podzielonych (np. 20 mg rano, 10 mg w południe, 10 mg po południu) przez 2–5 dni, aż do ustąpienia objawów (lub przez cały okres antybiotykoterapii)
zwiększyć dawkę do 40 mg/d w 3 dawkach podzielonych (np. 20 mg –1 h przed zabiegiem, 10 mg – 6 h po zabiegu, 10 mg – po kolejnych 6 h)
jeśli chory stosuje prednizon <10 mg/d
zwiększyć dawkę do 10 mg/d, podawaną w 1 lub 2 dawkach podzielonych przez 2–5 dni, aż do ustąpienia objawów (lub przez cały okres antybiotykoterapii)
prednizon 10 mg – podać 1 h przed zabiegiem, a następnie kontynuować w tej dawce, jeśli chory czuje się źle po zabiegu, aż do stabilizacji klinicznej
jeśli chory stosuje deksametazon <1 mg/d
zwiększyć dawkę do 1 mg/d (raz dziennie), przez 2–5 dni, aż do ustąpienia objawów
deksametazon 1 mg –podać 1 h przed zabiegiem, a następnie kontynuować w tej dawce, jeśli chory czuje się źle po zabiegu, aż do stabilizacji klinicznej
zabiegi endoskopowe jelita grubego wykonywane bez znieczulenia ogólnego
i.v. – dożylnie, p.o. – doustnie na podstawie wytycznych ESE i ES (2024)
hydrokortyzon 20 mg/d w 3 dawkach podzielonych (np. 10 mg – 1 h przed zabiegiem, 5 mg – 6 h po zabiegu, 5 mg –po kolejnych 6 h)
kontynuować stosowaną dawkę GKS p.o. lub (jeśli konieczne długotrwałe pozostawanie na czczo) podać równoważną dawkę i.v.
Leczenie farmakologiczne
1. Standardowe doustne leczenie substytucyjne: hydrokortyzon 15–25 mg/d w 2–3 dawkach podzielonych (np. 10 mg rano, 5 mg w południe, 5 mg po południu).
2. Alternatywne doustne leczenie substytucyjne: 1) prednizon 4–6 mg/d w 1 dawce rano 2) metyloprednizolon 3–5 mg/d 3) deksametazon 0,25–0,5 mg/d (rzadziej stosowany, czasami bardzo duża wrażliwość na lek i większe ryzyko skutków niepożądanych).
3. Leczenie w sytuacjach stresowych o niewielkim nasileniu – tab. IV.D.3-4 .
4. Leczenie w sytuacjach stresowych o umiarkowanym i ciężkim nasileniu – tab. IV.D.3-5.
➔ MONITOROWANIE
1. Ocena kliniczna: odgrywa zasadniczą rolę w monitorowaniu chorych z NKN wywołaną stosowaniem GKS, ponieważ wyniki badań laboratoryjnych nie zawsze odzwierciedlają rzeczywisty stan czynnościowy osi HPA. Szczególną uwagę należy zwrócić na chorych, u których stopniowo zmniejsza się dawki GKS ze stosowanych wcześniej dawek ponadfizjologicznych, ponieważ w tej grupie ryzyko wystąpienia objawów NKN jest największe. Dotyczy to np. osób poddawanych długotrwałej terapii immunosupresyjnej lub przeciwzapalnej.
2. Ocena biochemiczna: u chorych przewlekle przyjmujących duże dawki GKS nie zaleca się rutynowej oceny czynności osi HPA, natomiast oznaczenie porannego stężenia kortyzolu może stanowić przydatne narzędzie diagnostyczne w ocenie możliwości bezpiecznego odsta-
wienia GKS. Badanie należy wykonać po osiągnięciu fizjologicznej dawki GKS (p. tab. IV.D.3-1) oraz po upływie 24 h od przyjęcia ostatniej dawki GKS. Interpretacja stężenia kortyzolu powinna uwzględniać następujące wartości decyzyjne:
1) >10 μg/dl (300 nmol/l) – sugeruje prawidłową czynność osi HPA i pozwala zwykle na bezpieczne odstawienie GKS
2) 5–10 μg/dl (150–300 nmol/l) – wynik niejednoznaczny, wymaga dalszej obserwacji i ewentualnych testów dynamicznych; zaleca się kontynuację terapii GKS w dawce fizjologicznej oraz powtórzenie badania po kilku tygodniach lub miesiącach
3) <5 μg/dl (150 nmol/l) – sugeruje utrzymującą się niewydolność osi HPA i konieczność kontynuacji leczenia substytucyjnego GKS; badanie należy powtórzyć po kilku miesiącach. U chorych, u których pomimo stosowania dawek fizjologicznych GKS przez ≥1 rok nie nastąpiło przywrócenie prawidłowej funkcji osi HPA, wskazana jest konsultacja endokrynologiczna, zwłaszcza jeśli się planuje zakończenie kortykoterapii. Głównym celem diagnostyki endokrynologicznej jest wykluczenie innych przyczyn NKN, np. chorób przysadki.
➔ POWIKŁANIA
Przełom nadnerczowy (rozdz. IV.D.3.2) jest stanem zagrożenia życia wymagającym natychmiastowego leczenia. U chorych z NKN wywołaną stosowaniem GKS jest skutkiem niedostosowania dawki leku do zwiększonego zapotrzebowania na GKS w sytuacjach streso-
