35 ans d’engagement : repousser les limites, redéfinir les possibilités
Une publication de l’International Myeloma Foundation
Celebrating 35 Years:
Defying Boundaries, Redefining Possibilities

35 ans d’engagement : repousser les limites, redéfinir les possibilités
Une publication de l’International Myeloma Foundation
Celebrating 35 Years:
Defying Boundaries, Redefining Possibilities

Découvrez les principaux points à retenir du Sommet 2025 de l’International Myeloma Working Group (Groupe de travail international sur le myélome) de l’IMF et du congrès annuel de l’American Society of Clinical Oncology (ASCO) et de l’European Hematology Association (EHA)
PAGE 4
ÉGALEMENT DANS CE NUMÉRO :
Le nouvel anticorps bispécifique Lynozyfic™ (linvoseltamab-gcpt) a été approuvé par la Food and Drug Administration (FDA) américaine pour le traitement du myélome récidivant ou réfractaire PAGE 2
Ce numéro de Myeloma Today a été cofinancé par AbbVie Oncology • GSK • Johnson & Johnson • Pfizer • Regeneron Pharmaceuticals • Sanofi • Takeda Oncology
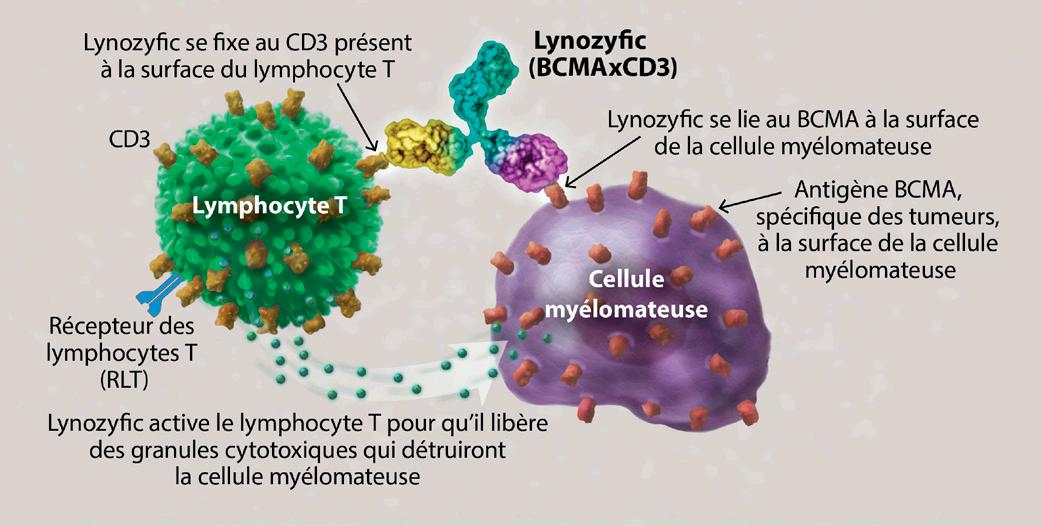
Le 2 juillet 2025, la Food and Drug Administration (FDA) américaine a accordé une autorisation accélérée pour Lynozyfic™ (linvoseltamab-gcpt), un nouvel anticorps bispécifique destiné au traitement des patients adultes atteints d’un myélome multiple récidivant ou réfractaire (MMRR), ayant déjà reçu quatre lignes antérieures de traitement ou plus, parmi lesquelles un inhibiteur du protéasome, un agent immunomodulateur et un anticorps monoclonal anti-CD38.
L’immunothérapie est un traitement qui mobilise le système immunitaire du patient pour qu’il attaque son myélome. Les traitements par anticorps bispécifiques utilisent deux (« bi ») bras qui se fixent aux cellules du patient. Un bras se fixe à une cellule myélomateuse, tandis que l’autre se lie à une cellule immunitaire proche. Les anticorps bispécifiques représentent une double menace pour le myélome.
Lynozyfic est un anticorps bispécifique qui se lie à l’antigène de maturation des lymphocytes B (BCMA) à la surface des cellules myélomateuses, ainsi qu’au CD3 présent sur les lymphocytes T du patient. Il rapproche ainsi ces cellules et stimule la destruction des cellules myélomateuses par les lymphocytes T. L’approbation de Lynozyfic par la FDA élargit les options thérapeutiques disponibles pour les patients atteints de MMRR.
Dr Richter, quelle est votre expérience
avec Lynozyfic ?
Dans le traitement du myélome, nous nous efforçons toujours d’améliorer les taux de réponse et de réduire les effets indésirables. L’approbation par la FDA se base sur les données issues de l’essai clinique de phase I/II LINKER-MM1 portant sur 117 patients traités par 200 mg de Lynozyfic. L’âge médian était de 70 ans ; 39 % des patients présentaient un risque cytogénétique élevé et 28 % une maladie pentaréfractaire.
Après un suivi médian de 14,3 mois, le taux de réponse globale (TRG) était de 71 %, dont 50 % ont au moins obtenu une réponse complète (RC). Chez 104 patients traités par 50 mg, après un suivi médian de 7,4 mois, le TRG était de 48 %, dont 21 % ont au moins obtenu une RC. Lynozyfic 200 mg a induit des réponses profondes et durables chez des patients atteints de MMRR ayant déjà reçu de lourds
traitements. La durée de réponse (DR) médiane était de 29,4 mois.
Lynozyfic est administré par perfusion intraveineuse (IV).
Après une augmentation progressive de la dose visant à réduire le risque d’effets indésirables, le protocole prévoit l’administration de Lynozyfic une fois par semaine (11 doses), puis toutes les deux semaines (5 doses).
Après ces doses, le médecin évaluera la réponse au traitement et décidera si le patient doit poursuivre le protocole toutes les deux semaines ou recevoir Lynozyfic une fois toutes les 4 semaines.

Joshua Richter, MD
Professeur associé de médecine, Tisch Cancer Institute
Director of Multiple Myeloma, Blavatnik Family Chelsea Medical Center
Mount Sinai Health System New York, NY (États-Unis)
Le médecin déterminera également la durée du traitement.
Lynozyfic est-il différent des autres médicaments bispécifiques ?
Plusieurs traitements bispécifiques ont déjà été approuvés par la FDA pour les patients atteints de MMRR et les taux de réponse avec Lynozyfic sont légèrement supérieurs. Il est toutefois difficile de comparer les médicaments bispécifiques entre eux en raison des différences au niveau des protocoles d’essais cliniques et des populations de patients. Je peux néanmoins présenter certains des avantages spécifiques de Lynozyfic.
Avec Lynozyfic, l’augmentation progressive de la dose est à bien des égards plus facile pour le patient. Avec d’autres médicaments bispécifiques, les doses progressives sont administrées à intervalles de 48 à 72 heures, ce qui peut entraîner une hospitalisation de 5 à 9 jours. Avec Lynozyfic, le patient peut être hospitalisé pendant 24 heures pour recevoir sa première dose. Puis, une semaine plus tard, le patient peut être à nouveau hospitalisé pendant 24 heures… ou non.
Les directives du National Comprehensive Cancer Network (NCCN, Réseau américain de lutte contre le cancer) nous autorisent à donner du tocilizumab en prophylaxie avant d’administrer un médicament bispécifique. Les données montrent que les personnes ayant reçu du tocilizumab avant Lynozyfic n’ont présenté aucun effet indésirable préoccupant par la suite. Ma stratégie consiste à administrer du tocilizumab en prophylaxie, en ambulatoire, puis à administrer la première dose de Lynozyfic et à hospitaliser le patient pendant 24 heures. Après cela, il n’y a plus d’hospitalisation.
Nous administrons Lynozyfic une fois par mois, car il est mieux toléré. De plus, cela améliore le confort des patients. En raison de la conception de l’essai clinique sur Lynozyfic, les patients ayant obtenu une réponse partielle (RP) ou supérieure avec la dose de 200 mg ont reçu à la place une administration mensuelle. Bien que l’administration des autres médicaments bispécifiques approuvés par la FDA puisse également être réduite à une administration par mois, ces essais cliniques n’ont pas été conçus pour évaluer correctement cette administration mensuelle.
Qu’en est-il des effets indésirables de Lynozyfic ?
Les effets indésirables les plus fréquents comprenaient le syndrome de relargage des cytokines (SRC), la neutropénie et l’anémie. Un syndrome de neurotoxicité associé aux cellules effectrices immunitaires (ICANS) est survenu chez 7,7 % des patients. Des infections ont été signalées chez 74,4 % des patients, leur fréquence et leur gravité diminuant avec le temps.
Dans le traitement du myélome, nous nous efforçons toujours d’améliorer les taux de réponse et de réduire les effets indésirables.
Il convient toutefois de distinguer les effets indésirables précoces des effets indésirables tardifs. Lorsque les immunothérapies rendent le système immunitaire trop actif, les patients peuvent développer un SRC ou un ICANS, mais le schéma posologique progressif de Lynozyfic réduit ce risque. De plus, les patients sont traités au préalable par tocilizumab et surveillés après avoir été perfusés. Dès les premiers signes de SRC, des soins de support sont administrés en fonction de la gravité du SRC, et le traitement par Lynozyfic peut être interrompu ou arrêté.
Les effets indésirables à plus long terme sont notamment une diminution de la numération formule sanguine et des infections, car la destruction des cellules immunitaires néfastes (cellules myélomateuses) peut également détruire certaines cellules immunitaires saines. Être à jour de ses vaccins est une façon de se prémunir contre d’éventuelles infections. Une autre solution consiste à utiliser des médicaments préventifs contre les infections connues. Chaque mois, nous administrons également des immunoglobulines par voie intraveineuse (IgIV) pour fournir aux patients des anticorps sains jusqu’à ce que leur organisme soit capable de combattre les infections.
En quoi les médicaments bispécifiques diffèrent-ils des cellules CAR-T ?
Les traitements par anticorps bispécifiques et par cellules CAR-T utilisent tous deux le système immunitaire du patient pour attaquer son myélome. Le traitement par cellules CAR-T implique le prélèvement des lymphocytes T du patient, leur modification génétique et leur multiplication en laboratoire, avant leur réinjection au patient pour qu’ils attaquent le myélome.
Si je reçois un nouveau patient aujourd’hui, il faudra peut-être attendre au moins 2 à 3 mois avant que le traitement par
(suite à la page 7)
Sundar Jagannath, MD
Professeur de médecine, Tisch Cancer Institute
Network Director, Center of Excellence for Multiple Myeloma
Mount Sinai Health System
New York, NY (États-Unis)

Je suis ravi que le nouvel anticorps bispécifique linvoseltamab ait été approuvé par la FDA pour le traitement du myélome multiple récidivant avancé. Il s’agit d’une nouvelle étape majeure vers la guérison du myélome.
D’après mon expérience, le linvoseltamab présente un taux de réponse impressionnant de 70 %, durable et significatif pour les patients. Même les myélomes présentant des profils génétiques à haut risque ont répondu avec la même efficacité.
Bien que le SRC soit commun à tous les anticorps bispécifiques, il était généralement moins grave et facile à contrôler. Les effets indésirables neurologiques étaient rares et se sont rapidement résorbés avec une prise en charge appropriée.
Ce qui distingue le linvoseltamab, c’est que la posologie est ajustée en fonction de la réponse du patient ; cette approche est plus confortable pour le patient et induit moins d’effets indésirables tout en maintenant une efficacité optimale.
Par le Dr Joseph Mikhael
Directeur médical au sein de l’IMF
Chaque année, trois événements annuels se succèdent rapidement et revêtent une importance particulière pour les chercheurs et les cliniciens travaillant dans le domaine du myélome. Le congrès annuel 2025 de l’American Society of Clinical Oncology (ASCO), le plus grand rassemblement mondial de spécialistes du cancer auquel participent 45 000 médecins, s’est tenu du 30 mai au 3 juin à Chicago, dans l’Illinois (États-Unis). Le Sommet 2025 de l’International Myeloma Working Group (IMWG, Groupe de travail international sur le myélome) de l’IMF, qui a réuni une centaine des 360 experts mondiaux du myélome environ, s’est déroulé du 10 au 12 juin à Milan, en Italie. Le congrès annuel 2025 de l’European Hematology Association (EHA) a eu lieu du 12 au 15 juin, également à Milan, et a attiré 18 000 médecins spécialisés dans tous les domaines de l’hématologie.
Il est impossible de détailler tous les sujets abordés lors de ces trois événements marquants dans les pages de Myeloma Today. Je vous résume dans cet article les éléments majeurs porteurs d’espoir pour les patients atteints de myélome. Pour plus d’informations, veuillez consulter le site myeloma.org et les vidéos archivées sur le site videos.myeloma.org.
Dépistage
L’essai clinique iStopMM (Iceland Screens, Treats, or Prevents Multiple Myeloma [étude islandaise pour le dépistage, le traitement ou la prévention du myélome multiple]) consacré à la détection précoce et à la prévention est un projet d’envergure qui nous informe sur la faisabilité et l’utilité du dépistage. L’âge, la génétique et les antécédents familiaux sont des facteurs importants dans tous les programmes de dépistage. C’est probablement le cas aussi pour le myélome, qui est d’ailleurs deux fois plus fréquent chez les patients d’origine africaine. Au cours des deux prochaines années, l’étude iStopMM déterminera probablement si le dépistage du myélome permet de sauver des

vies ou non, une question clé dont nous attendons tous la réponse avec impatience.
Myélome multiple indolent (MMI)
Le MMI est un précurseur asymptomatique du myélome actif. Présenté lors du Sommet de l’IMWG, le modèle 20-2-20 définit le myélome multiple indolent à haut risque (MMI-HR) par la présence d’au moins deux des caractéristiques suivantes : 20 % de plasmocytes dans la moelle osseuse, un pic monoclonal (pic M) d’au moins 2 g/dl et un ratio entre chaînes légères libres impliquées et non impliquées supérieur à 20. Bien que les définitions ne soient pas définitivement établies, ce modèle permet de situer le MMI dans le spectre du myélome.
L’essai clinique AQUILA, présenté lors du congrès annuel de l’American Society of Hematology (ASH) en décembre 2024, a comparé un traitement précoce par Darzalex® (daratumumab) à une observation étroite des patients présentant un MMI-HR. Après 5 ans, chez 63 % des patients traités, la maladie n’avait pas progressé, tandis que chez 40 % des patients du groupe d’observation, la maladie avait évolué en myélome actif. La surveillance a montré une durée médiane jusqu’à la progression d’environ 3 ans, un délai qui n’était pas encore atteint dans le bras traité.
L’étude AQUILA a permis de démontrer qu’il est possible de retarder la progression en myélome actif, voire d’améliorer la survie des patients avec 3 ans de traitement par Darzalex. Bien qu’une intervention précoce puisse retarder la progression, elle ne prévient pas nécessairement le développement d’un myélome actif. En l’absence de traitement approuvé par la FDA pour le MMI-HR, les patients devraient envisager de participer à des essais cliniques et en discuter avec leur médecin.
Actuellement, le recrutement est ouvert pour des études portant sur des médicaments approuvés pour le traitement du myélome actif, ainsi que pour des études visant à guérir le myélome. La meilleure stratégie associe finalement les préférences du patient


à des données claires pour orienter une prise en charge véritablement individualisée.
Les experts s’accordent à dire qu’aucun essai clinique n’est nécessaire pour le MMI à faible risque. Pour le MMI à risque intermédiaire, il est nécessaire de réaliser des études sur des approches innovantes permettant d’empêcher ou de retarder la progression en myélome actif. Les recherches actuelles visant à identifier les facteurs de risque à l’entrée dans l’étude pourraient classifier les patients atteints de MMI-HR dans la catégorie des myélomes précoces.
Thérapie initiale
Le traitement des patients présentant un myélome multiple nouvellement diagnostiqué (MMND) a été abordé dans trois études clés.
L’essai clinique PERSEUS a révolutionné la prise en charge du MMND en démontrant que les trithérapies (3 médicaments) sont moins efficaces que les quadrithérapies (4 médicaments) chez les patients éligibles à une autogreffe de cellules souches (AGCS). Plus précisément, les données fournies cette année par l’ASCO et l’EHA ont montré que l’association Darzalex + Velcade® (bortézomib) + Revlimid® (lénalidomide) + dexaméthasone [DVRd] combinée à une AGCS et à un double traitement d’entretien par Darzalex + Revlimid (D-R) a permis d’obtenir des résultats exceptionnels pour les patients. Plus de la moitié des patients sous DVRd sont parvenus à une maladie résiduelle minimale (MRM) négative pendant plus de deux ans.
L’essai clinique MIDAS a étudié la quadrithérapie Sarclisa® (isatuximab) + Kyprolis® (carfilzomib) + Revlimid + dexaméthasone [Isa-KRd]. Après cette induction par quadrithérapie, les patients MRM-négatifs ont reçu un traitement moins intensif que les patients MRM-positifs. Il est trop tôt pour tirer une conclusion définitive, mais la MRM orientera incontestablement davantage les traitements à l’avenir. En attendant, nous constatons déjà que les patients parvenus à une MRM négative pourraient ne pas avoir besoin d’AGCS. Toutefois, il nous faudra vérifier d’abord si ces résultats relatifs à la MRM se confirment pour la survie sans progression (SSP) avant d’arrêter les greffes chez les patients MRM-négatifs après induction. Pour les patients MRM-positifs, il semble que les greffes en tandem (deux greffes consécutives) ne soient plus nécessaires. Nous attendons avec impatience les données plus matures qui seront publiées à l’issue de cet essai clinique.

L’essai clinique GMMG-CONCEPT s’est concentré sur les patients atteints d’un myélome multiple à haut risque (MMHR). Environ 20 % des patients nouvellement diagnostiqués présentent un MMHR. Historiquement, le traitement de ces patients a toujours été complexe, car leur maladie a tendance à récidiver rapidement. Le schéma thérapeutique plus intensif à 4 médicaments avec Isa-KRd suivi d’une AGCS, se poursuit par la quadrithérapie, puis par l’arrêt du stéroïde dexaméthasone, et l’administration d’Isa-KR. Les résultats se sont révélés bien meilleurs que ceux observés précédemment avec le MMHR et pourraient démontrer l’intérêt d’une approche thérapeutique plus intensive pour les formes à haut risque.
En conclusion, les quadrithérapies sont désormais le traitement le plus efficace que nous puissions proposer pour le MMND, ce qui en fait le nouveau traitement de référence. Nous évoluons vers un double traitement d’entretien associant Darzalex + Revlimid [D-R], qui offre la meilleure MRM durable. Nous pourrions commencer très prochainement à utiliser des approches guidées par la MRM.
Bien que les nouvelles approches thérapeutiques du MMND donnent d’excellents résultats pour de nombreux patients, avec des rémissions plus longues, le myélome est une maladie qui récidive généralement.
Des études menées auprès de patients ayant reçu une à trois lignes de traitement antérieures incluaient le bélantamab mafodotin, un médicament approuvé initialement par la FDA, puis retiré du marché. Deux études importantes ont porté sur le bélantamab : DREAMM-7 et DREAMM-8. Les patients de l’une des études ont connu en moyenne une rémission de 3 ans !
L’étude DREAMM-7 associait bélantamab + Velcade + dexaméthasone [BVd], démontrant une amélioration de la survie sans progression (SSP) ainsi qu’une tendance à une meilleure survie globale (SG). L’étude DREAMM-8 associait bélantamab + Pomalyst® (pomalidomide) + dexaméthasone [BPd], démontrant une SSP médiane (SSPm) significativement plus longue. Nous espérons également que le bélantamab sera de nouveau utilisé en clinique très prochainement, car il s’agit d’un traitement facile à administrer et très efficace.
Une étude intéressante a été menée sur l’administration de Sarclisa. Historiquement, ce médicament était administré par
(suite à la page


#WHEREISDRJOE - SUITE DE LA PAGE 5
perfusion intraveineuse (IV). La nouvelle forme d’administration sous-cutanée utilise un dispositif appelé injecteur sur le corps (OBI, on-body injector). Fixé à la peau, ce dispositif administre Sarclisa à l’aide d’une minuscule aiguille pendant 12 à 13 minutes environ. Le profil de sécurité d’Isa administré au moyen de l’OBI était similaire à celui d’Isa par voie IV. Les patients ont apprécié cette méthode d’administration, ce qui pourrait présager d’une administration à domicile à l’avenir.
Une série d’études a porté sur l’utilisation des anticorps bispécifiques, des médicaments prêts à l’emploi, dans le cadre des rechutes précoces au lieu de les réserver aux rechutes tardives. Il est très encourageant de disposer d’un plus grand nombre d’options pour traiter les patients en rechute précoce grâce à ces traitements très efficaces.
Rechute tardive
Les traitements destinés aux patients ayant reçu au moins quatre lignes de traitement antérieures font l’objet de nombreux essais cliniques remarquables. Vous trouverez ci-dessous un aperçu de quelques-uns des domaines actuels de recherche.
Traitement par cellules CAR-T
Le traitement de référence par cellules CAR-T s’impose comme le traitement le plus efficace du myélome récidivant, même chez les patients lourdement traités au préalable. Parmi tous les résumés présentés aux congrès de l’ASCO et de l’EHA, le suivi à long terme de l’essai clinique CARTITUDE-1 a sans doute été le plus marquant et le plus prometteur. Les patients de l’étude ont reçu Carvykti® (cilta-cel) sous forme d’une perfusion unique de cellules CAR-T. Fait notable, 33 % des patients ayant reçu Carvykti sont toujours totalement exempts de maladie 5 ans plus tard. Je n’affirme pas que ces patients sont guéris, mais ce résultat sans précédent nous interroge sur la définition de la guérison du myélome.
Le développement de nouveaux traitements par cellules CAR-T représente un autre domaine de recherche particulièrement prometteur dans le cadre des rechutes tardives. Un médicament en particulier, appelé anitocabtagène autoleucel (anito-cel), présente une conception différente de celle des traitements précédents par cellules CAR-T et semble induire un taux de réponse aussi élevé que ces derniers, mais avec moins d’effets indésirables neurologiques.
Association d’anticorps bispécifiques
Les anticorps bispécifiques comportent deux bras : un bras du médicament se fixe à la cellule myélomateuse, tandis que l’autre se lie à un lymphocyte T. L’essai clinique RedirecTT-1 a étudié l’association de deux traitements bispécifiques, Tecvayli® (teclistamab) et Talvey® (talquetamab), administrés ensemble à des patients dont le myélome a toujours été très difficile à traiter et à contrôler. Chez les patients atteints d’une maladie extramédullaire (MEM), le myélome est situé en dehors de l’os. Fait notable, lorsque l’étude RedirecTT-1 a associé ces deux traitements bispécifiques pour traiter la MEM, le taux de réponse
a dépassé 80 %, un taux jamais observé auparavant pour le myélome. Cette approche pourrait constituer une excellente option pour traiter la MEM. Il est à noter qu’un nouvel anticorps bispécifique a été approuvé par la FDA en juillet 2025. Pour en savoir plus sur l’immunothérapie par Lynozyfic™ (linvoseltamab-gcpt), consultez la page 2 de ce numéro de Myeloma Today. Anticorps trispécifiques
Les anticorps trispécifiques comportent deux bras qui se fixent à la cellule myélomateuse, tandis que le troisième bras se lie à un lymphocyte T. Grâce à cela, le médicament est encore plus précis que les anticorps bispécifiques. Des études sur les médicaments trispécifiques ont démontré des taux de réponse élevés, avec des effets indésirables réduits par rapport aux médicaments bispécifiques. Cela pourrait signifier que nous serons en mesure de proposer des traitements plus efficaces et plus sûrs dans un avenir proche.
L’anticorps trispécifique BCMA-GPRC5D a démontré une puissante efficacité et une toxicité nettement inférieure à celle d’une association de médicaments. Il pourrait supplanter l’utilisation séquentielle des anticorps bispécifiques.
L’anticorps trispécifique BCMA-CD38 présente également une efficacité et une tolérance impressionnantes, et pourrait constituer une autre option pour les rechutes tardives du myélome.
Le traitement du myélome multiple à haut risque (MMHR) reste complexe et nécessite une approche intensive visant une MRM durable. Un consensus sur la définition du MMHR constitue une étape essentielle vers des approches thérapeutiques stratifiées en fonction du risque, ainsi que pour le développement d’essais cliniques ciblant les patients atteints de MMHR.
Les membres de l’IMWG et de l’International Myeloma Society (IMS) sont désormais parvenus à un consensus sur la définition du MMHR et recommandent son utilisation dans tous les essais cliniques à venir, ainsi que dans la pratique clinique. Selon cette nouvelle définition, le sous-groupe de patients atteints de MMHR représente environ 20 % des patients présentant un MMND.
Tous les développements mentionnés ci-dessus ouvriront la voie à de nouvelles options thérapeutiques plus efficaces pour les patients atteints de myélome. L’IMF poursuit sa mission qui est d’améliorer la qualité de vie des patients atteints de myélome, tout en œuvrant pour la prévention et, à terme, la guérison de la maladie. Notre vision est celle d’un monde où chaque patient atteint de myélome peut vivre pleinement sa vie, libéré du fardeau de la maladie. MT
LYNOZYFIC - SUITE DE LA PAGE 3
cellules CAR-T puisse lui être administré par perfusion. Les médicaments bispécifiques sont des produits prêts à l’emploi, immédiatement disponibles. Le confort du patient s’en trouve amélioré puisqu’il n’est pas nécessaire de procéder à un prélèvement ni à une réinjection. Aux États-Unis, environ 80 % des cas de myélome sont traités en structure de soins de proximité, et non dans des centres spécialisés pour le myélome comme celui dans lequel je travaille. En réalité, comme le traitement par cellules CAR-T est complexe, les établissements ne sont pas tous en mesure de le proposer. En revanche, théoriquement, un médicament bispécifique pourrait être administré n’importe où, à n’importe qui. À mes yeux, l’un des avantages extraordinaires des médicaments bispécifiques (un traitement de nouvelle génération extrêmement efficace) est leur administration possible aux patients trop fragiles ou trop malades pour bénéficier d’une greffe ou d’un traitement par cellules CAR-T.
La capacité à réagir immédiatement à la progression du myélome constitue un avantage par rapport à la préparation fastidieuse nécessaire pour les autres traitements. MT
Note du rédacteur : Les Drs Joshua Richter et Sundar Jagannath dirigent l’étude clinique de phase I/II LINKER-MM1 sur le linvoseltamab administré en monothérapie, menée chez 282 patients atteints de MMRR réfractaire aux trois principales classes thérapeutiques.
Lynozyfic est disponible via un programme de stratégie d’évaluation et d’atténuation des risques (REMS), exigé par la FDA pour les traitements susceptibles de présenter de graves problèmes de sécurité d’emploi. Les programmes REMS recommandent l’utilisation de ces traitements et contribuent à garantir des bénéfices potentiels supérieurs aux risques.
Les patients à qui Lynozyfic est prescrit recevront une Carte d’alerte Patient résumant les signes et symptômes des problèmes potentiels associés au traitement. Les patients qui développent un ou plusieurs des signes et symptômes mentionnés sur la Carte d’alerte Patient pour Lynozyfic doivent immédiatement consulter un médecin.
Lynozyfic Surround™, un programme de soutien proposé par Regeneron, fournit des ressources financières et pédagogiques pour accompagner les patients tout au long de leur traitement par Lynozyfic. Pour plus d’informations, appelez le +1 844 746 4363 et consultez le site regeneron.com.