Wir feiern 35-jähriges Bestehen: Wir überwinden Grenzen und definieren Möglichkeiten neu
Herausgegeben von der International Myeloma Foundation
Celebrating 35 Years:
Defying Boundaries, Redefining Possibilities

Wir feiern 35-jähriges Bestehen: Wir überwinden Grenzen und definieren Möglichkeiten neu
Herausgegeben von der International Myeloma Foundation
Celebrating 35 Years:
Defying Boundaries, Redefining Possibilities

Informieren Sie sich über die wichtigsten Erkenntnisse des IMWG Summit 2025 der International Myeloma Foundation (IMF) sowie der Jahrestagungen der American Society of Clinical Oncology (ASCO) und der European Hematology Association (EHA)
SEITE 4
EBENFALLS IN DIESER AUSGABE: Lynozyfic™ (Linvoseltamab-gcpt), ein neuer bispezifischer Antikörper, wurde von der FDA (United States Food and Drug Administration) zur Behandlung von rezidiviertem bzw. refraktärem Myelom zugelassen
SEITE 2
Diese Ausgabe von Myeloma Today wird unterstützt von AbbVie Oncology
Am 2. Juli 2025 erteilte die FDA die beschleunigte Zulassung für Lynozyfic™ (Linvoseltamab-gcpt), einen neuen bispezifischen Antikörper zur Behandlung von Erwachsenen mit rezidiviertem oder refraktärem Multiplem Myelom (RRMM), die zuvor mindestens vier Therapielinien erhalten haben, unter anderem mit einem Proteasom-Inhibitor, einem Immunmodulator und einem monoklonalen Anti-CD38-Antikörper.
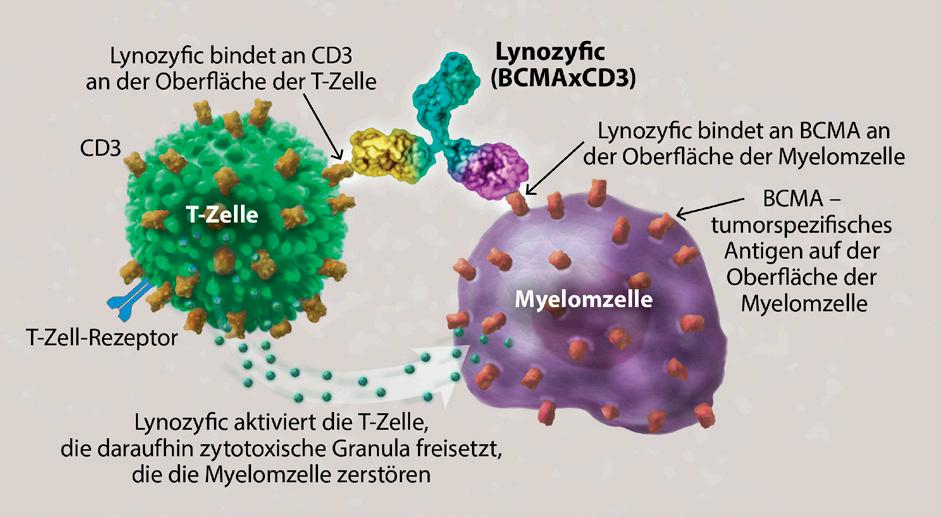
Immuntherapien regen das körpereigene Immunsystem dazu an, das Myelom zu bekämpfen. Bispezifische Antikörper nutzen zwei unterschiedliche „Bindungsarme“, mit denen sie an Körperzellen binden können. Der Antikörper bindet mit einem Arm an eine Myelomzelle und mit dem anderen Arm an eine lokale Immunzelle. Bispezifische Antikörper greifen das Myelom also in zweifacher Weise an.
Lynozyfic ist ein bispezifischer Antikörper, der an das auf der Oberfläche von Myelomzellen exprimierte B-ZellReifungsantigen (BCMA) und an den CD3-Rezeptor auf der Oberfläche von T-Zellen bindet, zwischen diesen Zellen eine Verbindung herstellt und die T-Zellen dazu anregt, die Myelomzellen abzutöten. Die FDA-Zulassung für Lynozyfic erweitert die Behandlungsmöglichkeiten für RRMM-Patienten.
Dr. Richter, welche Erfahrungen haben Sie mit Lynozyfic?
Bei der Behandlung von Myelomen liegt unser Hauptaugenmerk darauf, die Ansprechraten zu erhöhen und gleichzeitig die Nebenwirkungen zu kontrollieren. Die FDAZulassung basiert auf Daten aus der klinischen Phase-I/IIStudie LINKER-MM1 mit 117 Teilnehmenden, die mit 200 mg Lynozyfic behandelt wurden. Das mediane Alter der Teilnehmenden lag bei 70 Jahren. Bei 39 % handelte es sich um Patienten mit hohem zytogenetischen Risiko; 28 % hatten eine penta-refraktäre Erkrankung.
Nach einer medianen Nachbeobachtungszeit von 14,3 Monaten lag die objektive Ansprechrate (ORR) bei 71 %. 50 % der Patienten erreichten ein komplettes Ansprechen (CR) oder ein noch besseres Ergebnis. Bei 104 Teilnehmenden, die mit einer Dosis von 50 mg behandelt wurden, betrug die ORR bei einer medianen Nachbeobachtungszeit von 7,4 Monaten 48 %, wobei 21 % CR-Status (oder ein besseres Ergebnis) erreichten. Mit Lynozyfic 200 mg erreichten intensiv
vorbehandelte RRMMPatienten ein signifikantes und anhaltendes Ansprechen. Die mediane Ansprechdauer (DoR) lag bei 29,4 Monaten.

Lynozyfic wird als intravenöse (i.v.) Infusion verabreicht. Zur Reduktion potenzieller Nebenwirkungen wird die Dosierung zunächst stufenweise erhöht („Stepup“-Schema); danach wird Lynozyfic einmal wöchentlich (insgesamt 11 Dosen) und anschließend alle zwei Wochen (insgesamt 5 Dosen) verabreicht. Der Arzt beurteilt anschließend das Ansprechen auf die Behandlung und entscheidet dann, ob die Therapie mit Lynozyfic im Zweiwochen-Rhythmus fortgesetzt werden soll oder ob es sich empfiehlt, auf längere Intervalle umzustellen (alle vier Wochen). Der Arzt entscheidet außerdem, wie lange die Behandlung insgesamt fortgesetzt werden soll.
Mount Sinai Health System New York, NY
Unterscheidet sich Lynozyfic von anderen bispezifischen Antikörpern?
Es gibt bereits einige von der FDA zugelassene bispezifische Therapien für RRMM. Die Ansprechraten waren mit Lynozyfic zwar etwas höher, aber es ist generell schwierig, bispezifische Wirkstoffe miteinander zu vergleichen, da sich klinische Studien, Prüfpläne und Patientengruppen immer etwas
unterscheiden. Ich kann aber gerne einige der Vorteile der Behandlung mit Lynozyfic nennen. Die stufenweise Dosierung ist in vielerlei Hinsicht ein Vorteil für Patienten. Da die Step-up-Dosierungen bei anderen bispezifischen Antikörpern im Abstand von 48 bis 72 Stunden erfolgen, ist häufig ein stationärer Aufenthalt von 5 bis 9 Tagen erforderlich. Bei der Behandlung mit Lynozyfic kann eine stationäre Aufnahme für 24 Stunden zur Verabreichung der ersten Dosis erforderlich sein. Eine Woche später kann gegebenenfalls eine weitere stationäre Aufnahme für 24 Stunden erfolgen; dies muss aber nicht zwingend notwendig sein.
Die Richtlinien des National Comprehensive Cancer Networks (NCCN) erlauben die prophylaktische Gabe von Tocilizumab vor der Verabreichung eines bispezifischen Antikörpers. Die Daten zeigen, dass später keine bedenklichen unerwünschten Ereignisse auftraten, wenn Tocilizumab vor Lynozyfic verabreicht wurde. Ich würde Tocilizumab ambulant als Prophylaxe und anschließend die erste Dosis von Lynozyfic verabreichen, gefolgt von einem 24-stündigen stationären Aufenthalt. Danach ist keine stationäre Aufnahme mehr erforderlich.
Wir verabreichen Lynozyfic einmal pro Monat, da es so besser vertragen wird und die Behandlung für Patienten insgesamt angenehmer ist. In der Lynozyfic-Studie wurden Teilnehmende, die mit einer Dosis von 200 mg ein partielles (PR) oder besseres Ansprechen erreichten, auf eine Dosierung einmal pro Monat umgestellt. Obwohl bei anderen von der FDA zugelassenen bispezifischen Antikörpern die Verabreichung auf eine monatliche Dosis reduziert werden kann, wurde dieses Dosierschema in den entsprechenden klinischen Studien nicht systematisch untersucht.
Wie sieht es mit den Nebenwirkungen von Lynozyfic aus?
Zu den häufigsten unerwünschten Ereignissen zählten das Zytokin-Freisetzungssyndrom (CRS), Neutropenie sowie Anämie. Bei 7,7 % der Teilnehmenden kam es zu Immuneffektorzell-assoziiertem Neurotoxizitätssyndrom
(ICANS). Bei 74,4 % der Teilnehmenden kam es zu Infektionen, deren Häufigkeit und Schweregrad sich mit der Zeit verringerten.
Bei der Behandlung von Myelomen liegt unser Hauptaugenmerk darauf, die Ansprechraten zu erhöhen und gleichzeitig die Nebenwirkungen zu kontrollieren.
Sehen wir uns jetzt die frühen und langfristigen Nebenwirkungen genauer an. Wenn Immuntherapien unser Immunsystem zu stark aktivieren, können sich Syndrome wie CRS oder ICANS entwickeln. Das stufenweise Dosierschema von Lynozyfic verringert dieses Risiko. Darüber hinaus wird vor der eigentlichen Behandlung Tocilizumab verabreicht und im Anschluss an die Infusion erfolgt eine Nachbeobachtung. Beim ersten Anzeichen von CRS wird je nach Schweregrad eine geeignete Behandlung eingeleitet; dabei kann die Lynozyfic-Therapie entweder unterbrochen oder abgesetzt werden.
Langfristige Nebenwirkungen sind beispielsweise schlechte Blutwerte und Infektionen, denn bei der Zerstörung bösartiger Zellen (Myelomzellen) werden oft auch einige gute Immunzellen angegriffen. Eine Möglichkeit, potenzielle Infektionen zu vermeiden, besteht darin, den Impfschutz immer auf dem neuesten Stand zu halten. Eine weitere Möglichkeit ist die Verwendung von vorbeugenden Medikamenten gegen bekannte Infektionen. Wir verabreichen außerdem einmal monatlich intravenöses Immunglobulin (IVIG), um den Körper mit gesunden Abwehrstoffen zu versorgen, bis das körpereigene Immunsystem in der Lage ist, Infektionen abzuwehren.
Wie unterscheiden sich bispezifische Antikörper von CAR-T-Zell-Therapien?
Sowohl bispezifische Antikörper als auch CAR-T-Zell-Therapien nutzen das körpereigene Immunsystem zur Bekämpfung des Myeloms. Bei der CAR-T-Zell-Therapie werden körpereigene T-Zellen aus dem Blut extrahiert und dann im Labor
(fortsetzung auf Seite 7)
Sundar Jagannath
Professor
für Medizin, Tisch Cancer Institute
Network Director, Center of Excellence
for Multiple Myeloma
Mount Sinai Health System
New York, NY

Ich freue mich sehr, dass Linvoseltamab, ein neuer bispezifischer Antikörper zur Behandlung des fortgeschrittenen rezidivierten Multiplen Myeloms, die FDA-Zulassung erhalten hat. Dies ist ein weiterer wichtiger Meilenstein in der Myelom-Therapie.
In der klinischen Anwendung lag die Ansprechrate von Linvoseltamab bei etwa 70 % und erwies sich als langfristig stabil, was für Betroffene besonders relevant ist. Bemerkenswert ist, dass selbst Patienten mit hohem zytogenetischen Risiko ein ähnliches Ansprechen erreichten wie Patienten mit Standardrisiko.
Das bei der bispezifischen Antikörpertherapie häufig auftretende CRS war mit Linvoseltamab meist weniger schwerwiegend und gut behandelbar. Neurologische Nebenwirkungen traten selten auf und klangen nach entsprechender Behandlung schnell ab.
Das Besondere an Linvoseltamab ist, dass die Dosierung je nach Ansprechen angepasst werden kann; dies verbessert die Patientenfreundlichkeit und minimiert die Nebenwirkungen, ohne dass dabei Einbußen hinsichtlich der therapeutischen Wirksamkeit in Kauf genommen werden müssen.
Von Dr.
Joseph Mikhael, Chief Medical Officer der IMF
Jedes Jahr finden drei Veranstaltungen statt, die für forschende und praktizierende Ärzte im Bereich der Myelom-Therapie besonders relevant sind. Die Jahrestagung der ASCO (American Society of Clinical Oncology), der weltweit größte Kongress von Expertinnen und Experten im Bereich der Krebsforschung mit 45.000 Teilnehmenden, wurde vom 30. Mai bis 3. Juni 2025 in Chicago (Illinois, USA) abgehalten. Der IMWG Summit 2025 der International Myeloma Foundation (IMF) fand vom 10. bis 12. Juni in Mailand (Italien) statt; rund 100 der weltweit über 360 anerkannten Expertinnen und Experten aus der MyelomForschung nahmen an der Veranstaltung teil. An der Jahrestagung der EHA (European Hematology Association), die vom 12. bis 15. Juni 2025, ebenfalls in Mailand, stattfand, nahmen 18.000 Fachleute aus der Hämatologie teil.
Leider können wir nicht alle wichtigen Inhalte aus diesen drei Veranstaltungen in Myeloma Today berücksichtigen. Mit meinem heutigen Artikel möchte ich aber jene Erkenntnisse zusammenfassen, die für die Behandlung des Multiplen Myeloms besonders relevant sind. Für weiterführende Informationen besuchen Sie bitte die Website myeloma.org, über die Sie unter anderem auf archivierte Videos zugreifen können: videos. myeloma.org.
Myeloma-Screening
Die klinische Studie „Iceland Screens, Treats, or Prevents Multiple Myeloma (iStopMM)“ zur Früherkennung und Prävention ist ein groß angelegtes Projekt, das uns über die Durchführbarkeit und den Nutzen von Vorsorgeuntersuchungen aufklärt. Alter, genetische Prädisposition und Familienanamnese zählen seit jeher zu den zentralen Faktoren in der Gesundheitsvorsorge. Wir müssen diese Faktoren daher auch im Zusammenhang mit dem Multiplen Myelom berücksichtigen, insbesondere, da beispielsweise Menschen afrikanischer Abstammung – im Vergleich zum Rest der Bevölkerung – etwa doppelt so häufig von der Erkrankung betroffen sind. In den nächsten zwei Jahren wird die iStopMM-Studie wahrscheinlich die entscheidende

Frage beantworten, ob Myelom-Vorsorgeuntersuchungen Leben retten können. Wir alle sind schon sehr gespannt auf die Ergebnisse.
Schwelendes multiples Myelom (SMM)
SMM ist eine asymptomatische Vorstufe des aktiven Myeloms. Das beim IMWG Summit diskutierte 20-2-20-Modell definiert das Schwelende Multiple Myelom mit hohem Risiko (HR SMM) als ein Myelom, bei dem mindestens zwei der folgenden Kriterien erfüllt sind: 20%ige Infiltration von Plasmazellen im Knochenmark, monoklonaler Spike (M-Spike) von mind. 2 g/dL und ein Quotient involvierter und nicht-involvierter freier Leichtketten von >20. Dieses Modell hilft dabei, SMM innerhalb des Myelom-Spektrums einzuordnen, auch wenn sich die spezifischen Definitionen derzeit noch weiterentwickeln.
Die klinische Studie AQUILA, die im Dezember 2024 anlässlich der Jahrestagung der American Society of Hematology (ASH) präsentiert wurde, verglich die frühe Verabreichung von Darzalex® (Daratumumab) mit der „aktiven Überwachung“ von Patienten mit HR SMM. Nach 5 Jahren zeigten 63 % der Teilnehmenden in der Behandlungsgruppe keine Progression, wohingegen 40 % der Teilnehmenden in der Beobachtungsgruppe ein aktives Myelom entwickelten. In der Beobachtungsgruppe betrug die mediane Zeit bis zur Progression etwa 3 Jahre; in der Behandlungsgruppe war dieser Median zum Zeitpunkt der Analyse noch nicht erreicht.
Die AQUILA-Studie zeigte, dass mit einer 3-jährigen DarzalexBehandlung der Krankheitsprogress zum aktiven Myelom verzögert und die Überlebensrate verbessert werden kann. Eine frühzeitige Intervention kann zwar das Fortschreiten der Erkrankung verzögern, verhindert jedoch nicht zwangsläufig die Entwicklung eines aktiven Myeloms. Da es derzeit keine von der FDA zugelassene Behandlung für HR SMM gibt, sollten Betroffene klinische Studien in Betracht ziehen und diese Option mit ihrem Ärzteteam besprechen. Derzeit wird für Studien rekrutiert, die zugelassene Wirkstoffe zur Behandlung von aktivem Myelom untersuchen, darunter auch Studien mit kurativer Zielsetzung. Die beste Behandlungsstrategie wird letztendlich jene sein, die


eine individualisierte Betreuung ermöglicht, indem wir die Patientenperspektive berücksichtigen und klare Daten analysieren. In der Fachwelt ist man sich einig: Für SMM mit niedrigem Risiko benötigen wir derzeit keine klinischen Studien. Für SMM mit intermediärem Risiko besteht jedoch durchaus ein Bedarf, denn um die Weiterentwicklung zum aktiven Myelom zu unterbinden, müssen innovative Ansätze untersucht und identifiziert werden. Laufende Forschungen zur Ermittlung der Basis-Risikofaktoren können dazu führen, dass eine HR-SMM-Diagnose als „frühes aktives Myelom“ eingestuft wird.
Erstlinientherapie
Die Behandlung von Patienten mit neu diagnostiziertem Multiplem Myelom (NDMM) wurde in drei wichtigen Studien untersucht. Die klinische Studie PERSEUS hat die Behandlung von NDMM grundlegend verändert, indem sie gezeigt hat, dass „Triplet“Kombinationstherapien (mit drei Wirkstoffen) bei Patienten, die sich einer autologen Stammzelltransplantation (ASCT) unterziehen, weniger wirksam sind als „Quadruplet“Kombinationen (mit vier Wirkstoffen). Insbesondere haben die diesjährigen ASCO- und EHA-Daten gezeigt, dass die Kombination von Darzalex + Velcade® (Bortezomib) + Revlimid® (Lenalidomid) + Dexamethason [DVRd] mit ASCT und dualer Erhaltungstherapie mit Darzalex + Revlimid (D-R) zu außergewöhnlichen Ergebnissen führte. Bei mehr als der Hälfte der DVRd-Patienten kam es für über 2 Jahre zu einer MRD-Negativität.
Die MIDAS-Studie untersuchte eine „Quadruplet“-Kombination aus Sarclisa® (Isatuximab) + Kyprolis® (Carfilzomib) + Revlimid + Dexamethason [Isa-KRd]. Im Anschluss an diese Vierfach-Induktion erhielten MRD-negative Patienten eine weniger intensive Therapie als MRD-positive Patienten. Für eine endgültige Schlussfolgerung ist es noch zu früh, aber es ist klar, dass der MRD-Status im Laufe der Zeit immer mehr an Bedeutung gewinnen wird, wenn es darum geht, die richtige Behandlung zu wählen. Mittlerweile deutet vieles darauf hin, dass bei MRD-Negativität möglicherweise vollständig auf eine ASCT verzichtet werden kann. Dennoch benötigen wir mehr Zeit, um zu beobachten, ob diese MRD-Ergebnisse langfristig mit einem verbesserten progressionsfreien Überleben (PFS) einhergehen. Erst danach kann eine Änderung der Transplantationsstrategie bei Patienten mit MRD-Negativität nach Induktion in Betracht gezogen werden. Bei MRD-Positivität scheint eine Tandem-ASCT (zwei aufeinanderfolgende Transplantationen) nicht mehr zwingend erforderlich zu sein. Wir sind gespannt auf die aussagekräftigen Daten, die aus dieser klinischen Studie hervorgehen werden.

Die Studie GMMG-CONCEPT untersuchte Patienten mit Multiplem Myelom mit hohem Risiko (HRMM). Bei ca. 20 % aller neu diagnostizierten MM-Fälle handelt es sich um HRMM. Die Behandlung von HRMM-Patienten gestaltet sich grundsätzlich schwierig, da sie ein erhöhtes Rezidivrisiko aufweisen. Zunächst wird die intensive Quadruplet-Kombination mit Isa-KRd angewendet, gefolgt von einer autologen
Stammzelltransplantation (ASCT). Anschließend wird die Quadruplet-Therapie fortgesetzt, wobei im weiteren Verlauf Dexamethason abgesetzt wird und die Patienten nur noch Isa-KR erhalten. Die Ergebnisse sind deutlich besser als jene, die wir von bisherigen HRMM-Behandlungen kennen, was darauf hindeuten könnte, dass ein intensiverer Ansatz bei Hochrisikoerkrankungen durchaus von Vorteil ist.
Zusammenfassend lässt sich sagen, dass eine Vierfachkombination die wirksamste Therapie bei NDMM darstellt und damit als neuer Behandlungsstandard gilt. Bei der Erhaltungstherapie geht die Tendenz hin zu einer Kombination aus Darzalex und Revlimid (D-R), die in Sachen MRD (minimale Resterkrankung) die nachhaltigsten Ergebnisse liefert. Bei der Wahl der richtigen Therapie könnte der MRD-Status künftig eine entscheidende Rolle spielen.
Frühes Rezidiv
Auch wenn neue NDMM-Therapien häufig hervorragende Remissionszeiten ermöglichen, bleibt das Myelom eine Erkrankung, die typischerweise mit Rezidiven einhergeht.
In einer Reihe von Studien mit Teilnehmenden, die zuvor bereits 1 bis 3 Therapielinien erhalten hatten, wurde das Medikament Belantamab Mafodotin untersucht, das zunächst von der FDA zugelassen, aber anschließend wieder vom Markt genommen wurde. Zwei sehr wichtige Belantamab-Studien waren DREAMM-7 und DREAMM-8. In einer der Studien wurde eine durchschnittliche Remissionszeit von 3 Jahren erreicht!
In DREAMM-7 wurde eine Kombination aus Belantamab + Velcade + Dexamethason [BVd] untersucht, die eine Verlängerung des progressionsfreien Überlebens (PFS) und einen positiven Trend hinsichtlich des Gesamtüberlebens (OS) zeigte. In DREAMM-8 wurde eine Kombination aus Belantamab + Pomalyst® (Pomalidomid) + Dexamethason [BPd] untersucht, die eine signifikante Verlängerung des medianen PFS (mPFS) ergab. Wir hoffen, dass wir Belantamab bald wieder einsetzen können, da es sich um eine problemlos zu verabreichende und hochwirksame Therapie handelt.
Es gab auch eine interessante Studie zur Verabreichung von Sarclisa. Dieses Medikament ist grundsätzlich als intravenöse


#WHEREISDRJOE – FORTSETZUNG DER VORANGEHENDEN SEITE
Infusion erhältlich. Es gibt aber mittlerweile eine neue Form der Verabreichung, nämlich subkutan über einen On-Body-Injektor (OBI). Dabei handelt es sich um ein Gerät, das an der Haut angebracht wird und den Wirkstoff (in diesem Fall Sarclisa) über eine feine Nadel subkutan injiziert. Der gesamte Vorgang dauert etwa 12 bis 13 Minuten. Das Sicherheitsprofil der subkutanen Anwendung mittels OBI-Gerät, das von Patienten gut angenommen wird, ist mit der intravenösen Version von Sarclisa (Isatuximab) durchaus vergleichbar. Das bedeutet, dass sich viele Patienten dieses Arzneimittel möglicherweise schon bald zu Hause selbst verabreichen können.
„Gebrauchsfertige“ bispezifische Antikörper, die bislang vor allem bei späten Rezidiven eingesetzt werden, werden nun in aktuellen Studien im Zusammenhang mit früh auftretenden Rezidiven untersucht. Die Tatsache, dass nun auch für ein frühes Rezidiv eine größere Bandbreite an hochwirksamen Therapien verfügbar ist, stellt eine sehr positive Entwicklung dar. Spätes Rezidiv
Es gibt einige vielversprechende klinische Studien, die sich auf Patienten konzentrieren, die bereits 4 oder mehr Therapielinien durchlaufen haben. Nachfolgend finden Sie eine Übersicht über einige dieser Studienbereiche.
CAR-T-Zell-Therapie
Die CAR-T-Zell-Therapie ist ein Therapiestandard, der bei der Behandlung des rezidivierten Myeloms hochwirksam ist, selbst bei intensiv vorbehandelten Patienten. Ein echtes Highlight der ASCO- und EHA-Tagungen war die Zusammenfassung der Ergebnisse aus der LangzeitNachbeobachtung der Studie CARTITUDE-1. Die Teilnehmenden erhielten Carvykti® (Cilta-Cel) als EinmalInfusion im Rahmen einer CAR-T-Zell-Therapie. Bemerkenswert ist, dass 33 % der mit Carvykti Behandelten nach 5 Jahren noch immer in Remission sind. Ich will damit nicht sagen, dass diese Patienten „geheilt“ sind, sondern eher darauf aufmerksam machen, dass diese neuen Daten die Frage aufwerfen, wie wir den Begriff „Heilung“ im Kontext des Myeloms künftig definieren sollen.
Neuartige CAR-T-Zell-Therapien zur Behandlung von späten Rezidiven sind natürlich ebenfalls sehr spannende Themen. Ein Beispiel ist der Wirkstoff Anitocabtagene Autoleucel (Anito-Cel), der sich in seiner Zusammensetzung von früheren CAR-T-Zell-Therapien unterscheidet. Er zeigt vergleichbar hohe Ansprechraten, geht jedoch mit weniger neurologischen Nebenwirkungen einher.
Kombinationstherapien mit bispezifischen Antikörpern
Bispezifische Antikörper nutzen zwei unterschiedliche „Bindungsarme“,mit denen sie einerseits an Myelomzellen, andererseits an T-Zellen binden können. Die klinische Studie RedirecTT-1 untersuchte die Kombination zweier bispezifischer Wirkstoffe, Tecvayli® (Teclistamab) und Talvey® (Talquetamab), zur Behandlung von Myelomen, die sich zuvor als schwer behandelbar und kontrollierbar erwiesen hatten. Bei der extramedullären Erkrankung (EMD) befinden sich Myelomzellen außerhalb des Knochenmarks. In der klinischen Studie RedirecTT-1 wurden diese beiden bispezifischen Therapien
kombiniert, um EMD zu behandeln, und die Ansprechrate betrug mehr als 80 % – ein Ergebnis, das im Kontext der Myelom-Behandlung absolut außergewöhnlich ist. Dieser innovative Ansatz könnte neue, vielversprechende Möglichkeiten im Bereich der EMD-Behandlung bieten.
Wir möchten Sie darauf hinweisen, dass im Juli 2025 ein neuer bispezifischer Antikörper die FDA-Zulassung erhalten hat. Erfahren Sie mehr über die Immuntherapie mit Lynozyfic™ (Linvoseltamab-gcpt) auf Seite 2 dieser Ausgabe von Myeloma Today
Trispezifische Antikörper
Trispezifische Antikörper binden dreifach: zweifach an die Myelomzelle und einmal an die T-Zelle. Der Wirkmechanismus ist hier also noch präziser als bei bispezifischen Antikörpern. Studien zu trispezifischen Antikörpern zeigen bisher hohe Ansprechraten und im Vergleich zu bispezifischen Antikörpern sogar weniger Nebenwirkungen. Das heißt, dass wir in naher Zukunft vermutlich wirksamere und sicherere Therapien zur Verfügung haben werden.
Ein Beispiel ist BCMA-GPRC5D, ein trispezifischer Antikörper, der starke Wirksamkeit zeigt, während die Toxizität deutlich geringer ist als bei einer Kombinationstherapie. Therapien, die eine sequenzielle Verabreichung von mehreren bispezifischen Antikörpern umfassen, könnten damit ersetzt werden.
Der trispezifische Antikörper BCMA-CD38 weist ebenfalls eine sehr gute Wirksamkeit und Verträglichkeit auf und könnte eine weitere Option zur Behandlung eines spät auftretenden Rezidivs beim Myelom darstellen.
Die richtige Definition von HRMM
Das Multiple Myelom mit hohem Risiko (HRMM) ist nach wie vor schwer zu behandeln und erfordert einen intensiven Ansatz, bei dem die langfristige Stabilisierung des MRD-Status im Vordergrund steht. Um risikostratifizierte Therapieansätze zu bestimmen und geeignete klinische Studien entwickeln zu können, ist es wichtig, dass alle Interessengruppen die gleiche Definition für den Begriff „Multiples Myelom mit hohem Risiko (HRMM)“ verwenden.
Mitglieder der IMWG und der International Myeloma Society (IMS) haben sich auf eine Definition für HRMM geeinigt und empfehlen, diese künftig in allen klinischen Studien sowie in der klinischen Praxis zu verwenden. Laut dieser neuen Definition fallen rund 20 % der NDMM-Patienten in die HRMM-Kategorie.
Ausblick
Die im vorliegenden Text dargestellten Ansätze eröffnen Perspektiven für neue und effektive Therapieoptionen beim Multiplen Myelom. Die IMF bemüht sich, die Lebensqualität von Myelompatienten zu verbessern und arbeitet gleichzeitig an Vorbeugung und Heilung. Unsere Vision ist eine Welt, in der alle Menschen, die an Multiplem Myelom leiden, ein erfülltes Leben führen können – frei von der Belastung durch die Krankheit. MT
LYNOZYFIC - FORTSETZUNG VON SEITE 3
gentechnisch verändert und vermehrt. Die veränderten Zellen werden reinfundiert, um die Myelomzellen zu bekämpfen.
Bei neuen Patienten kann es zwei bis drei Monate oder sogar länger dauern, bis die gentechnisch veränderten T-Zellen reinfundiert werden können. Bispezifische Antikörper hingegen sind „gebrauchsfertig“ und sofort einsetzbar. Die Behandlungserfahrung ist für Patienten angenehmer, da wir kein Harvesting und keine Reinfundierung vornehmen müssen.
Etwa 80 % der Myelom-Behandlungen in den Vereinigten Staaten finden regional statt, also außerhalb der hochspezialisierten Zentren. Die CAR-T-Zell-Therapie ist ein kompliziertes Verfahren und daher nicht in jeder Einrichtung und in jedem Krankenhaus verfügbar. Bispezifische Antikörpertherapien hingegen können theoretisch überall angeboten werden. Einer der größten Vorteile ist, dass die bispezifischen Antikörper hocheffektiv sind und auch jenen Menschen helfen können, die möglicherweise zu schwach oder zu krank sind, um sich einer Stammzelltransplantation oder einer CAR-T-Zelltherapie zu unterziehen. Gerade beim Myelom ist es von großem Vorteil, wenn eine Behandlung ohne lange Vorlaufzeit direkt verfügbar ist, denn wir wissen nie, mit welchen neuen Symptomen man bei dieser Erkrankung als nächstes rechnen muss. MT
Anmerkung des Redakteurs: Dr. Joshua Richter und Dr. Sundar Jagannath sind maßgeblich an der Erforschung der LinvoseltamabMonotherapie im Rahmen der klinischen Phase-I/II-Studie LINKER-MM1 beteiligt, die 282 Teilnehmende mit dreifach refraktärem/rezidiviertem Multiplem Myelom umfasst. Lynozyfic ist nur im Rahmen des von der FDA vorgeschriebenen REMSProgramms (Risk Evaluation and Mitigation Strategy) erhältlich, das für Therapien vorgesehen ist, die potenziell mit schwerwiegenden sicherheitsrelevanten Risiken verbunden sind. REMS-Programme unterstützen diese Therapien, stellen jedoch gleichzeitig sicher, dass deren Nutzen die Risiken überwiegt.
Personen, denen Lynozyfic verschrieben wird, erhalten einen Patientenpass, in dem die Symptome und gesundheitlichen Probleme zusammengefasst sind, die im Zusammenhang mit der Behandlung auftreten können. Beim Auftreten von im Patientenpass aufgeführten Symptomen muss umgehend medizinische Hilfe in Anspruch genommen werden.
Lynozyfic Surround™ ist ein Support-Programm von Regeneron, das Patienten im Laufe ihrer Lynozyfic-Behandlung durchgehend mit finanziellen und informativen Ressourcen zur Seite steht. Weitere Informationen dazu erhalten Sie unter der Rufnummer 1-844-746-4363 oder auf der Website regeneron.com