Ajo negro, valor añadido y potencial saludable
Alicia Moreno-Ortega, José Manuel Moreno-Rojas * y Gema Pereira-Caro
Área de Agroindustria y Calidad Alimentaria, Instituto Andaluz de Investigación y Formación Agraria, Pesquera, Alimentaria y de la Producción Ecológica
Grupo Foods for Health, Instituto Maimónides de Investigación Biomédica de Córdoba (IMIBIC)

* josem.moreno.rojas@juntadeandalucia.es Índice 1. Introducción .............................................................................................................................. 1 1.1. El ajo en la historia ............................................................................................................. 1 1.2. Producción y consumo de ajo 2 1.3. Composición nutricional del ajo 2 1.4. Compuestos fitoquímicos en ajo 3 1.5. Ajo negro 4 1.6. Evaluación de la bioaccesibilidad y la biodisponibilidad.................................................... 8 2. Materiales y métodos ............................................................................................................... 9 2.1. Estudio de bioaccesibilidad................................................................................................ 9 2.1. Estudio de metabolismo colónico 10 2.3. Estudio de intervención en humanos 11 3. Resultados y discusión 12 3.1. Evaluación de la bioaccesibilidad y la estabilidad gastrointestinal in vitro del perfil fitoquímico del ajo negro........................................................................................................ 12 3.2. Evaluación del impacto de la fermentación colónica in vitro sobre el perfil fitoquímico del ajo negro 13 3.3. Evaluación de la biodisponibilidad in vivo de los compuestos organosulfurados del ajo negro 15 4. Conclusiones............................................................................................................................ 17 INFORMACIÓN COMERCIAL ........................................................................................................ 26 LA ABUELA CARMEN ............................................................................................................... 27 ISBN: 978-84-16909-48-3 Esta obra está bajo una licencia de Creative Commons ReconocimientoNoComercial-SinObraDerivada 4.0 Internacional (CC BY-NC-ND 4.0)
- Alimentación Saludable, Hortalizas
1. Introducción
El ajo (Allium sativum L.) es un vegetal perteneciente al género Allium, que forma parte de la mayoría de los platos tradicionales de la gastronomía de la cuenca Mediterránea. Es un ingrediente básico del sofrito, sopas, adobos y salsas de multitud de platos propios de la dieta mediterránea. Históricamente, el consumo de ajo se ha asociado con diversos efectos beneficiosos para la salud, por lo que era una práctica habitual su empleo en remedios caseros y su mención en la mitología y cultura de diferentes civilizaciones. En los últimos años, diferentes estudios han permitido relacionar el consumo habitual de ajo y el efecto protector frente algunas enfermedades, con la presencia en su composición de algunos compuestos con actividad biológica, entre los que destacan los polifenoles y los compuestos organosulfurados.
No obstante, lo más habitual es que el consumo de ajo no se realice en fresco, sino tras un tratamiento culinario que modifique, en mayor o menor medida, su composición y sus propiedades organolépticas. Este tipo de tratamientos, normalmente, pueden provocar una transformación o degradación de los compuestos bioactivos de interés, modificando su potencial saludable. Por otro lado, el avance en la industria alimentaria y el desarrollo de nuevos procesos ha permitido que se obtengan derivados del ajo fresco para su uso en cocina, como el ajo en polvo, el ajo secado o el ajo negro, entre otros. Este último ha tomado especial relevancia en los últimos años ya que se trata de un producto con características físico-químicas y sensoriales radicalmente diferentes a las del producto original y cuyo objetivo es su consumo en fresco. Durante el proceso de producción de ajo negro, también se van a producir transformaciones en el perfil de compuestos bioactivos lo que puede llevar a modificaciones en los mecanismos de acción de estos compuestos en el organismo. Con el fin de conocer las transformaciones ocasionadas durante el proceso industrial de producción y estudiar el potencial bioactivo de los compuestos presentes en la nueva matriz alimentaria, en los últimos años se ha incrementado el interés científico por el ajo negro, habiendo sido objeto también de estudios realizados en nuestro grupo de investigación.
1.1. El ajo en la historia
El ajo es originario de Asia Central, desde donde se extendió por China y Asia Menor hasta Mesopotamia donde los sumerios comenzaron a utilizarlo como remedio frente a varias enfermedades (Block, 1985).
Desde entonces, han sido muchas las civilizaciones que han incorporado el ajo a sus remedios caseros para tratar ciertas enfermedades. Los sumerios (2300 a.C.) ya utilizaban el ajo para aliviar algunas molestias estomacales e intestinales, así como para reducir la inflamación y frente a algunos parásitos (Heinerman, 1995). Por otro lado, el ajo se ha encontrado como parte de fórmulas descritas en el Papiro de Ebers (s. XVI a.C.) para el tratamiento de cardiopatías, caries, mordeduras, infecciones e incluso tumores (De Luis y Aller, 2008). También se ha documentado que a los esclavos que construían las Pirámides en Egipto se les daba de comer ajo, entre otros vegetales, ya que se le consideraba un alimento vigorizante. Los griegos también mencionan en sus obras que el ajo era un alimento que habitualmente consumían los atletas en las competiciones olímpicas para mantener sus fuerzas (Torija Isasa et al., 2014). También se menciona el uso del ajo como antídoto contra la peste en la Edad Media (López Luengo, 2007). De hecho, en la actualidad, todavía es usado en la elaboración de diferentes remedios caseros, como para el alivio de las callosidades, eccemas, verrugas o la pérdida de pelo.
Consumo
www.bibliotecahorticultura.com 1
1.2. Producción y consumo de ajo
La producción mundial de ajo en 2021 se encontró principalmente en Asia, siendo los principales países productores China e India (Figura 1). En 2021 se produjeron más de 28 millones de toneladas de ajo en el mundo, siendo España el 5º país productor. En Europa, España es el primer país productor, responsable de más del 34% del total de la producción de ajo (Figura 1) (Food and Agriculture Organization of the United Nations (FAOSTAT), 2021).
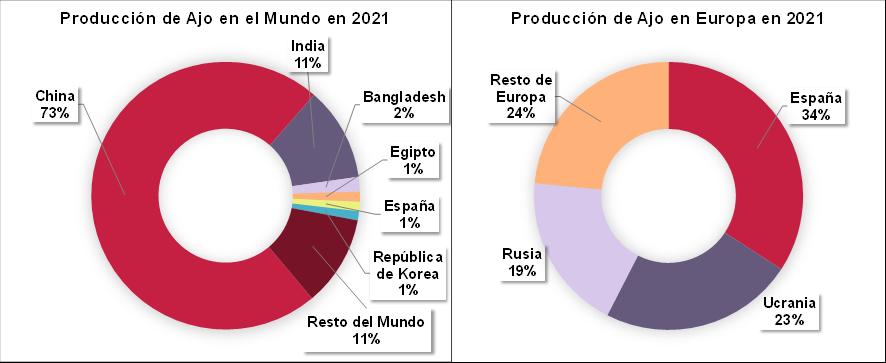
1. Producción de ajo a nivel mundial y europeo en 2021 (FAOSTAT, 2021)
En España, en 2021, los principales productores de ajo fueron Castilla-La Mancha y Andalucía con más del 86% de la producción de ajo (Figura 2). Mientras que, en Andalucía, Córdoba fue la principal provincia productora con más de 24 mil toneladas (35%), seguida de Sevilla (25%) y Granada (20%) (Ministerio de Agricultura, 2021).

1.3. Composición nutricional del ajo
La composición nutricional del ajo se encuentra recogida en la Tabla 1 basado en las tablas de composición de alimentos de la Base Española de Datos de Composición de Alimentos (BEDCA). Siempre se debe tener en cuenta que esta distribución de los componentes nutricionales es aproximada ya que se puede ver modificada por diferentes factores como el tipo de producto, la variedad, la procedencia o el tiempo poscosecha.
saludable www.bibliotecahorticultura.com 2
Ajo negro, valor añadido y potencial
Figura
Figura 2. Gráficos de producción de España y de Andalucía en 2021 (MAPA, 2021)
Alimentación Saludable, Hortalizas
1. Composición Nutricional del Ajo según la Base Española de Datos de Composición de Alimentos (BEDCA)
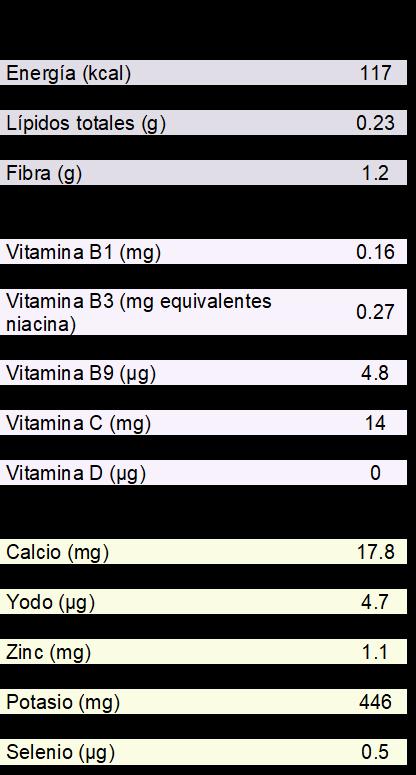
Ya que se trata de un producto fresco, el contenido de agua es elevado (70,4%), lo que ocasiona que sea un producto con un valor energético bajo, en torno a 117 kcal por cada 100g. Estas calorías provienen fundamentalmente de los hidratos de carbono, principalmente complejos como el almidón. El contenido proteico es bajo y el contenido lipídico es anecdótico. Finalmente, en cuanto al contenido en vitaminas y minerales, es reseñable el contenido de selenio, ya que contribuirá al potencial antioxidante del ajo (Põldma et al., 2011).
Sin embargo, el interés por este vegetal no radica exclusivamente en su composición nutricional, sino también en su perfil de compuestos bioactivos.
1.4. Compuestos fitoquímicos en ajo
Los principales compuestos bioactivos en ajo son los polifenoles y los compuestos organosulfurados.
Compuestos fenólicos del ajo
Los compuestos fenólicos son un gran grupo de compuestos orgánicos naturales cuya característica principal es que poseen al menos un grupo funcional fenol. Hasta ahora se han
Consumo-
www.bibliotecahorticultura.com 3
Tabla
Ajo negro, valor añadido y potencial saludable
descrito más de 8000 compuestos fenólicos diferentes, y en la naturaleza los podemos encontrar esterificados, unidos en formas insolubles o libres (Pandey y Rizvi, 2009).
Estos compuestos conforman un grupo minoritario, normalmente conocidos como metabolitos secundarios de las plantas, cuya principal función es la de proteger a la planta de agentes externos. Sin embargo, en los alimentos, serán los principales responsables de sus características organolépticas (color, sabor y aroma) (Shahidi y Ambigaipalan, 2015; Tuladhar et al., 2021).
Se han realizado multitud de estudios que evalúan la capacidad de estos compuestos para ejercer un efecto beneficioso para la salud, de forma que se ha evidenciado que el consumo habitual de compuestos fenólicos en la dieta está relacionado con un efecto protector frente a enfermedades cardiovasculares y degenerativas, y frente algunos tipos de cáncer (TomásBarberán, 2003; Ebrahimi y Schluesener, 2012; Cory et al., 2018).
Los ácidos fenólicos, los flavanoles, los flavonoles y las flavonas son los grupos mayoritarios de polifenoles en el ajo.
Compuestos organosulfurados en ajo
El azufre es un elemento que se puede encontrar en los alimentos formando parte de diferentes compuestos. Los que se consumen en mayor cantidad son los aminoácidos azufrados como la cisteína, la metionina o la taurina. En segundo lugar, se encontrarían los sulfitos o sulfatos, que habitualmente encontramos en los alimentos como aditivos. Y, por último, los compuestos organosulfurados.
Estos compuestos también son metabolitos secundarios de las plantas, cuya función principal es la protección frente agentes externos, siendo los principales responsables del olor y sabor característico de algunos alimentos como el ajo o la cebolla (Kohlmeier, 2015). El consumo regular de compuestos organosulfurados se ha relacionado con ciertas propiedades beneficiosas para la salud como: antioxidante, antiinflamatoria, antihiperlipidémica o antibacteriana, entre otras (Walag et al., 2020).
Los compuestos organosulfurados en el género Allium, en general, se caracterizan por presentar una estructura en la que se encuentra el azufre unido a un grupo cianato (Barba y Orlien, 2017). Destacarán los derivados del γ-glutamil-S-alqu(en)il-L-cisteína y los derivados del S-alqu(en)il-Lcisteína. Estos compuestos se encuentran en el citosol de las células vegetales, pero cuando se produce una lesión en los tejidos de estos vegetales, estos compuestos entran en contacto con la enzima aliinasa, que se encuentra en las vacuolas. La enzima aliinasa transforma estos compuestos en ácidos sulfénicos, que son compuestos muy inestables, por lo que finalmente se transforman en tiosulfinatos (Poojary et al., 2017; Yoshimoto y Saito, 2019).
1.5. Ajo negro
Como se comentó anteriormente, a pesar de las numerosas propiedades beneficiosas para la salud con las que se ha relacionado el consumo regular de ajo fresco, la ingesta se realizará mayoritariamente tras algún tratamiento culinario. Esta práctica es habitual ya que reduce la pungencia y el picor que caracteriza a este producto, y las consiguientes molestias estomacales que puede ocasionar su ingesta. Sin embargo, el tratamiento culinario suele conllevar la pérdida de alguno de los compuestos de interés previamente descritos.
www.bibliotecahorticultura.com 4
Alimentación Saludable, Hortalizas
Por ello, una alternativa es su consumo en forma de ajo negro (Figura 3), que es obtenido tras someter el ajo fresco a un proceso de maduración o envejecimiento en el que no intervienen microorganismos ni aditivos, solo condiciones de temperatura y humedad controladas.

El éxito detrás de este producto se encuentra en el potencial bioactivo asociado a su consumo. En este sentido, se ha observado que el ajo negro presenta potencial anticancerígeno en ratones que ingirieron ajo negro, pero no ajo fresco (Kimura et al., 2017). El interés científico y las publicaciones sobre el potencial saludable de este producto han hecho que su fama, su producción y su consumo se extiendan por todo el mundo.
Actualmente, el ajo negro también es considerado un producto gourmet, formando parte incluso de diferentes elaboraciones de alta cocina. Esto se debe, principalmente, al aumento del valor de este producto en el mercado frente a su producto de origen, el ajo fresco, llegando a multiplicarse entre 40 y 50 veces su precio en el mercado.
Por otro lado, la elaboración de ajo negro es una importante salida a la sobreproducción de ajo fresco. El ajo fresco presenta ciertas limitaciones a la hora de ser almacenado, pudiéndose conservar cómo máximo 1 año a 0 °C y con una humedad relativa de entre el 65 y el 70% (Cantwell, 2004; Dhall y Ahuja, 2013). Además, durante el almacenamiento se ven afectadas características de la calidad de los bulbos y se producen pérdidas del potencial bioactivo del ajo fresco. De esta forma, la temperatura, la humedad relativa, la ventilación y las atmósferas modificadas o controladas son factores que puede afectar a la conservación del ajo fresco. De hecho, deficiencias en el control de estos parámetros pueden dar lugar a algunas enfermedades del ajo fresco como la aparición de ácaros, pudrición del moho azul (Penicillium) o la descomposición cerosa (Madhu et al., 2019), con las consiguientes pérdidas económicas.
De esta forma, dados los excedentes de producción de ajo fresco y las potenciales problemáticas de su almacenamiento, la elaboración de ajo negro se convierte en una interesante alternativa para aprovechar el producto, aumentar su vida útil y su valor en el mercado.
www.bibliotecahorticultura.com 5
Consumo-
Figura 3. Ajo negro
Ajo negro, valor añadido y potencial saludable
Proceso de elaboración del ajo negro
El ajo negro es un producto derivado del ajo fresco que se obtiene al someter el producto fresco a condiciones controladas de temperatura y humedad durante un periodo de tiempo. En el sector, este proceso ha recibido el nombre de fermentación, sin embargo, se trata de una maduración o envejecimiento ya que es un proceso en el que no intervienen microorganismos ni aditivos. Durante este tratamiento, se producen cambios en las propiedades físico-químicas del ajo, produciéndose también cambios en las características sensoriales del producto.
En la literatura científica, se pueden encontrar datos para el proceso de obtención que oscilan para la temperatura entre los 40 y 90 °C, y para la humedad relativa entre el 80 y el 95%. El tiempo varía entre los 10 y los 40 días, en función de las condiciones anteriores (Jang et al., 2008; Kang, 2016; Ahmed y Wang, 2021). El proceso exacto para obtener el producto variará según la experiencia y los conocimientos técnicos de cada empresa, siendo, por tanto, información sujeta a secreto profesional/industrial.
El desarrollo de ajo negro en Andalucía se encuentra ligado al Instituto Andaluz de Investigación y Formación Agraria, Pesquera, Alimentaria y de la Producción Ecológica (IFAPA) y a las empresas de municipios próximos de alta producción de ajo fresco, como Montalbán (Córdoba). IFAPA, en colaboración con las empresas, optimizó en sus inicios la producción de ajo negro, permitiendo su adaptación y escalado a nivel industrial.
Cambios durante el proceso de elaboración del ajo negro
Las transformaciones químicas que se producen durante el proceso de elaboración del ajo negro han sido de interés para la comunidad científica en los últimos años.
Las propiedades organolépticas del ajo negro son el rasgo más característico de este producto, debiéndose a transformaciones en la composición del producto durante la elaboración. El ajo negro se caracteriza por presentar una nula pungencia o picor a diferencia del producto de partida, un sabor marcadamente dulce, una textura más blanda y un color oscuro, entre negro y marrón (Ríos-Ríos et al., 2019).
Entre los cambios composicionales que tienen lugar durante el proceso de producción del ajo negro, se puede encontrar las transformaciones del principal compuesto organosulfurado del ajo negro, la aliína. Cuando se produce una rotura de tejidos, como al cortar o machacar el ajo, una enzima denominada aliinasa entra en contacto con dicho compuesto (aliína), produciéndose su metabolización y transformación en alicina. Este compuesto también es característico del ajo y responsable de su pungencia y olor característico. Sin embargo, durante el proceso de elaboración del ajo negro, debido a las condiciones de temperatura y humedad, sostenidas en el tiempo, se produce la inactivación de la enzima aliinasa, disminuyendo la pungencia del producto final. A pesar de esto, se producirán otras transformaciones durante este proceso, resultando en la síntesis de otros compuestos bioactivos como la S-alil-L-cisteína (SAC), siendo este el principal compuesto organosulfurado que se encuentra en el ajo negro (Ahmed y Wang, 2021).
Por otro lado, durante la elaboración del ajo negro se produce la hidrólisis de los azúcares más complejos presentes en el ajo fresco, como la sacarosa, aumentando significativamente la concentración de fructosa y glucosa, y, por tanto, potenciando el dulzor del producto final
www.bibliotecahorticultura.com 6
Consumo- Alimentación Saludable, Hortalizas
(Zhang et al., 2015; Yuan et al., 2018). Además, las reacciones entre los azúcares y los aminoácidos sometidos a las condiciones de temperatura, humedad y tiempo del proceso de elaboración son las responsables del color oscuro característico de este producto, ya que formarán parte de las reacciones de Maillard y de caramelización (Yuan et al., 2016).
Durante el proceso de elaboración del ajo negro también se observa un descenso del pH, siendo el ácido cítrico el principal ácido orgánico determinado en el producto final (Bae et al., 2014). Por otro lado, también se producen cambios en el contenido de otros compuestos como del hidroximetilfurfural (HMF), siendo uno de los responsables de la capacidad antioxidante que muestra el ajo negro (Zhang et al., 2016).
A modo de resumen, se puede concluir que la transformación de ajo fresco en ajo negro conlleva un aumento significativo en el contenido de polifenoles totales, de azúcares, de acidez y de potencial antioxidante (Toledano Medina et al., 2016).
Propiedades beneficiosas para la salud relacionadas con el consumo de ajo negro
El ajo negro ha suscitado el interés de la comunidad científica, ya que son muchas las propiedades saludables relacionadas con el consumo regular del producto de partida, el ajo fresco. Los cambios en la composición que se producen durante el proceso de elaboración del ajo negro y la presencia de ciertos compuestos bioactivos han sido el foco de atención de diferentes investigaciones científicas.
En la actualidad, existen evidencias científicas que permiten establecer una correlación positiva entre el consumo regular de los compuestos saludables presentes en el ajo negro con la prevención o el tratamiento de ciertas enfermedades no transmisibles.
Enfermedades neurodegenerativas
El consumo de ajo negro se ha relacionado con un efecto protector frente a la neurodegeneración, fundamentalmente por la presencia de S-alil-L-cisteína (SAC) entre sus componentes. Se han llevado a cabo estudios que relacionan el consumo de ajo negro o la administración continuada de S-alil-L-cisteína (SAC) con un efecto neuroprotector frente a las condiciones agravantes del Alzheimer, el Parkinson o la isquemia cerebral (Rojas et al., 2011; Ashafaq et al., 2012; Jeong et al., 2013; Gomez et al., 2019). Sin embargo, hasta el momento estos estudios se han realizado exclusivamente en modelos animales y celulares por lo que se debe tener cierta prudencia a la hora de extrapolar estas conclusiones al consumo en humanos.
Cáncer
Los estudios realizados con ajo negro en este campo se limitan exclusivamente a estudiar el potencial anticancerígeno de los compuestos bioactivos del ajo negro en líneas celulares. Estos compuestos van a estar relacionados con ciertos mecanismos asociados con la reducción de la inflamación, del crecimiento de las células cancerígenas, de la producción de nuevos vasos sanguíneos o mecanismos que promueven la destrucción de las células cancerígenas. Basado en estos mecanismos, se ha visto que el compuesto denominado S-alilmercaptocisteína (SAMC), presente en el ajo negro, se relaciona con un efecto protector frente a algunos tipos de cáncer como el de próstata, ovario, vejiga, tiroides e hígado (Chu et al., 2006; Hu et al., 2011; Tong et al., 2014; Wu et al., 2016). El consumo de ajo negro también ha demostrado cierto potencial
www.bibliotecahorticultura.com 7
Ajo negro, valor añadido y potencial saludable
anticancerígeno frente al cáncer de colon, de pulmón, de estómago y de mama (Shin et al., 2010; Dong et al., 2014; Jikihara et al., 2015; Alkreathy et al., 2020)
Enfermedades cardiovasculares
El consumo regular de ajo negro se relaciona con una reducción del riesgo de padecer una enfermedad cardiovascular. Esto principalmente se debe a los mecanismos de acción por lo que se ven afectados tres factores de riesgo de esta enfermedad: la hipertensión, la aterosclerosis y la agregación plaquetaria (Rahman y Billington, 2000; Castro et al., 2010; Wlosinska et al., 2020).
Diabetes Mellitus
Estudios en modelos animales (ratas y ratones) han permitido relacionar el consumo regular de ajo negro con cierto efecto antidiabético. Esto se debe a que se han observado mecanismos por los que se ven disminuidos algunos marcadores de la diabetes: glucemia, colesterolemia y la concentración de triglicéridos o fructosamina (Seo et al., 2009; Thomson et al., 2016).
Enfermedades digestivas
El consumo de ajo negro también se ha relacionado con una mejora de varias patologías relacionadas con el sistema digestivo mejorando la motilidad gastrointestinal, el estreñimiento, el reflujo esofágico, la aparición de úlceras y presentando un efecto protector del hígado (Badr y Al-Mulhim, 2014; Chen et al., 2018; Kim et al., 2019; Jiang et al., 2021).
1.6. Evaluación de la bioaccesibilidad y la biodisponibilidad
Se sabe que para que un compuesto bioactivo ejerza su potencial efecto saludable, éste debe ser absorbido y asimilado por el organismo, es decir que sea bioaccesible y biodisponible, de forma que ejerzan su acción en el tejido diana, denominándose ese proceso bioactividad.
La biodisponibilidad dependerá de factores extrínsecos e intrínsecos. Los factores extrínsecos al individuo son la estructura química del compuesto y la matriz alimentaria en la que se encuentren (Selby-Pham et al., 2017). Por otro lado, encontramos los factores intrínsecos del individuo como la edad, el sexo, el estado nutricional y la etapa de la vida en la que se encuentre (Heaney, 2001).
Debido a estas fuentes de variación, la mayor parte de las definiciones propuestas para biodisponibilidad van a asumir que la fracción biodisponible de un compuesto será la que haya sido absorbida tras el proceso digestivo y la acción de la microbiota colónica.
Estudios de bioaccesibilidad y biodisponibilidad en ajo negro
Los compuestos fenólicos son uno de los grupos de compuestos bioactivos estudiados en mayor profundidad en la actualidad, siendo muchos los estudios que evalúan su bioaccesibilidad y biodisponibilidad, tanto de los compuestos aislados como formando parte de la matriz alimentaria (Del Rio et al., 2010; Pereira-Caro et al., 2014; Almeida et al., 2018). Entre otras matrices alimentarias, el ajo ha sido objeto de estudio para la determinación de la bioaccesibilidad y la biodisponibilidad de los compuestos fenólicos de su matriz (Ceccanti et al., 2021).
www.bibliotecahorticultura.com 8
Consumo- Alimentación Saludable, Hortalizas
En cuanto a los compuestos organosulfurados, los estudios de bioaccesibilidad y biodisponibilidad son más limitados. Principalmente se han realizado estudios en las que se evalúan estos parámetros en compuestos aislados, no obstante, la mayoría de estos estudios se han realizado mediante análisis por cromatografía de gases, evaluando de esta forma el perfil de compuestos volátiles (Rosen et al., 2000; Scheffler et al., 2019; Qin et al., 2020).
Hasta la fecha, no existen estudios que determinen la bioaccesibilidad y la biodisponibilidad de los compuestos bioactivos de interés del ajo negro, lo que hace necesario que se evalúe el impacto de la digestión gastrointestinal, del metabolismo colónico y la biodisponibilidad, de forma que se pueda tener más información sobre el metabolismo de estos compuestos y su potencial bioactividad. Por ello, nuestro grupo de investigación se ha enfocado en estudiar cómo se transforman los compuestos del ajo negro en nuestro organismo, durante la digestión y la fermentación colónica, de forma que se pueda explicar qué compuestos transformados llegan a la sangre y pueden ejercer ese efecto potencialmente beneficioso para la salud.
2. Materiales
y métodos
El estudio se llevó a cabo para determinar cómo se liberan en el organismo los compuestos presentes en el ajo negro una vez es consumido y como son transformados por la microbiota intestinal. Para ello se llevó a cabo una digestión gastrointestinal in vitro seguida de una fermentación colónica por etapas. Finalmente, para la determinación de la biodisponibilidad, se realizó un estudio de intervención de ingesta aguda en voluntarios sanos, recogiendo la orina excretada durante 24h tras la ingesta de ajo negro.
2.1. Estudio de bioaccesibilidad
Preparación de la muestra
El ajo negro fue proporcionado por una empresa local, La Abuela Carmen® (Córdoba, España). Este ajo negro se obtuvo a partir de ajo fresco siguiendo el proceso de elaboración que se ha descrito previamente (Toledano Medina, 2017). Se peló el ajo negro y se utilizó un molino criogénico para molturar los dientes hasta un tamaño de partícula de 10 μm, posteriormente se almacenó a -80 °C hasta que se llevó a cabo el proceso digestivo in vitro
Digestión gastrointestinal in vitro
El protocolo seguido para la digestión gastrointestinal in vitro fue el descrito por Juániz et al. (2017) con algunas modificaciones. Se utilizaron 2 g de muestra para cada digestión y se realizó la experimentación por triplicado. La digestión oral consistió en la adición de la solución simuladora salival y la enzima α-amilasa y se mantuvo durante 3 min en el baño termostático. Tras esto, se ajustó el pH a 3 para simular las condiciones de la digestión gástrica, se le añadió la solución simuladora gástrica junto con la pepsina durante 2h en el baño termostático. Finalmente, se le añadió la solución simuladora intestinal, la pancreatina y las sales biliares; y se ajustó el pH a 7 para imitar las condiciones intestinales y se mantuvo durante 2h más en el baño termostático. Se tomaron muestras antes de la digestión, y tras cada una de las digestiones (oral, gástrica e intestinal), se liofilizaron y se almacenaron a -80 °C hasta su extracción y análisis cromatográfico.
www.bibliotecahorticultura.com 9
Ajo negro, valor añadido y potencial saludable
La separación de los compuestos fenólicos se llevó a cabo en una columna de fase reversa Zorbax SB-C18 RRHD 100 x 2,1 mm i.d. 1,8 μm de tamaño de partícula (Agilent, Santa Clara, CA, USA) precedida por una precolumna de la misma fase estacionaria y mantenida a 40 °C. Las fases móviles fueron A: agua acidificada con un 0,1% de ácido fórmico y B: con acetonitrilo, con un flujo de 0,15 mL/min durante 33 min, con un gradiente que empieza con un 3% B se mantiene durante 1 min, aumenta hasta un 60%B durante 24 min, se mantiene 3 min y alcanza 70% en 5 min. Tras esto, la columna recupera las condiciones iniciales en 5 min.
La separación de los compuestos organosulfurados se llevó a cabo utilizando una columna ACQUITY UPLC 1,7 μm BEH amide 2,1 x 150 mm (Waters, Spain), equipada con una precolumna de la misma fase estacionaria y mantenida a 35 °C. Las fases móviles que se utilizaron fueron A (agua desionizada con 5 mM de acetato de amonio, 5 mM de formato de amonio y 0,1% de ácido fórmico) y B (acetonitrilo). El flujo fue de 0,4 mL/min con un gradiente de 20 min, comenzando con 5% de A y aumentándolo hasta 10% A en 30 s, luego alcanza el 30%A durante 8 min, seguido de 4,5 min aumentando hasta 46% A y volviendo a las condiciones iniciales en 3 min y manteniéndolas durante 4 min.
Tras pasar por el detector PDA, el flujo pasa directamente al espectrómetro de masas Exactive Orbitrap (Thermo Scientific, San José, CA, USA) con una fuente de ionización de electrospray (HESI) que opera en modo de ionización positivo para compuestos organosulfurados y en modo de ionización negativa para la determinación de compuestos fenólicos.
Se llevó a cabo la identificación y cuantificación de los compuestos de interés.
Cálculo del Índice de Bioaccesibilidad
El índice de bioaccesibilidad se usa para determinar el porcentaje de compuestos bioaccesibles tras la digestión gastrointestinal in vitro
���� = ���� ���� ×100
Donde:
- IB es el Índice de Bioaccesibilidad
- CF es la Concentración Final del compuesto (tras la digestión gastrointestnal in vitro).
- CI es la Concentración Inicial del compuesto (antes de la digestión gastrointestinal in vitro).
2.1. Estudio de metabolismo colónico
Preparación de la muestra
Para la fermentación colónica se usaron las muestras de ajo negro obtenidas tras la digestión gastrointestinal in vitro. Estas muestras fueron liofilizadas, molturadas y almacenadas a -80 °C hasta la fermentación colónica in vitro.
Fermentación colónica in vitro
La solución fecal se preparó a partir de las muestras fecales proporcionadas por tres voluntarios sanos sin enfermedades intestinales que no habían consumido antibióticos en los últimos tres meses. Estos individuos siguieron una dieta estricta sin polifenoles ni compuestos
www.bibliotecahorticultura.com 10
Consumo- Alimentación Saludable, Hortalizas
organosulfurados durante las 48 h previas a la recogida del material fecal. Se tomaron de muestra fecal de cada voluntario y se homogeneizaron con PBS esterilizado para obtener una solución fecal al 10%. Además, se preparó el medio de cultivo siguiendo la composición previamente reportada por Bresciani et al (2018).
Las muestras digeridas de ajo negro se prepararon para la fermentación colónica diluyendo 100 mg de muestra en PBS con sales biliares, manteniéndolo en agitación durante 2h a temperatura ambiente.
La fermentación colónica in vitro se llevó a cabo durante 48 h, tomando muestras a las 2,4,8 y 24 h siguiendo el protocolo establecido por Dall’Asta et al. (2012) con algunas modificaciones (Moreno-Ortega et al., 2021). Estas muestras fueron analizadas mediante cromatografía líquida de ultra alta resolución (UHPLC) acoplada a espectrometría de masas (MS) equipado con trampa iónica lineal (LIT-MS) dotada de una sonda de ionización (H-ESI-II) (Thermo Fisher Scientific Inc.).
El análisis de los compuestos fenólicos y sus metabolitos en los extractos de las muestras fermentadas de ajo negro se llevó a cabo utilizando una columna C18 Kinetex Evo (100 × 2,1 mm; tamaño de partícula 2,6 μm, Phenomenex, CA, EE. UU.) con una precolumna (Phenomenex). El volumen de inyección fue 5 μL y la temperatura de trabajo de 35 °C. Las fases móviles utilizadas fueron A: acetonitrilo acidificado (ácido fórmico 0,01%, v/v) y B: agua acidificada (ácido fórmico 0,01%, v/v) con un flujo de 500 μL/min. El método tenía un gradiente de 14 min, comenzando con un 5% de A que se mantenía 30 s, alcanzaba el 40% A en 7 min, tras lo que alcanzaba el 80% en 1 min y lo mantenía durante 2 min. Tras esto, se volvían a las condiciones iniciales en 30 s y se mantenían durante 3 min para reequilibrarlo.
La separación de compuestos organosulfurados se realizó utilizando una columna ACQUITY UPLC 1,7 µm BEH amide (150 x 2,1 mm; tamaño de partícula 1,7 μm, Waters, Milford, MA, EE.UU.). La temperatura se mantuvo a 35 °C y el volumen de inyección fue 2 μL. La fase móvil consistió en una mezcla de acetonitrilo acidificado (ácido fórmico 0,1%, v/v) (fase A) con agua acidificada (ácido fórmico 0,1%, v/v) (fase B) y con formato de amonio (20 mmol/L) acidificado (ácido fórmico 1%, v/v) (fase C). El flujo fue de 400 μL/min y siguió este gradiente: comenzó con un 5%B y 5%C durante 1 min, la proporción de B aumentó hasta el 30% en 7 min y luego alcanzó un 45% en 4 min. Se volvió a las condiciones iniciales en 3 min y se mantuvieron durante 4 min para reequilibrar la columna.
2.3. Estudio de intervención en humanos
Diseño del estudio de intervención
Se realizó un estudio de intervención de ingesta aguda de ajo negro con voluntarios sanos. Los criterios de inclusión de los voluntarios sanos fue que no presentarán alergia al producto (ajo negro), una edad comprendida entre los 18 y los 50 años, de ambos sexos y que no presentaran patologías o enfermedades crónicas como enfermedades cardiovasculares, diabetes, entre otras. En cuanto a los criterios de exclusión fueron el embarazo y la lactancia, alergias a fármacos y haber tenido un tratamiento crónico con medicamentos y/o antibióticos durante los 6 meses previos al estudio. Todos los participantes del estudio firmaron un consentimiento informado. Y el protocolo del estudio fue aprobado por el comité ético de la Unidad de Investigación Clínica Humana del Hospital Universitario Arnau Vilanova, Lleida, España (Número de Aprobación: CEiC1790).
www.bibliotecahorticultura.com 11
En el estudio participaron 12 voluntarios sanos (siete mujeres y cinco hombres) con una edad media de 29.0 ± 8.9 años, con un índice de masa corporal (IMC) medio de 23,5 ± 2,2 kg/m2 .
Antes de comenzar el estudio de intervención se les pidió a los participantes que siguieran una dieta sin compuestos organosulfurados durante dos días, principalmente evitando el consumo de vegetales del género Allium. La mañana del día del ensayo, los voluntarios proporcionaron la orina recogida las 12 h previas, durante la noche (basal). Luego consumieron 20 g de ajo negro en ayunas y continuaron con la dieta libre de compuestos organosulfurados hasta la mañana siguiente, cuando se recogía orina por última vez. Se recogió la orina por intervalos de tiempo: 0-2 h, 2-4 h, 4-8 h y 8-24 h tras la ingesta de ajo negro y se analizó por cromatografía de líquidos para la determinación de los metabolitos excretados.
3. Resultados y discusión
3.1. Evaluación de la bioaccesibilidad y la estabilidad gastrointestinal in vitro del perfil fitoquímico del ajo negro
La determinación del índice de bioaccesibilidad permite conocer el porcentaje del compuesto presente en la matriz que se libera en el tracto gastrointestinal durante la digestión, quedando disponible para ser absorbido. En este estudio, el objetivo fue determinar la influencia de la digestión gastrointestinal in vitro en el perfil fitoquímico del ajo negro.
Durante la digestión gastrointestinal in vitro, el contenido fenólico total disminuyó significativamente, siendo el ácido cafeico el único que resultó bioaccesible tras el proceso digestivo. El índice de bioaccesibilidad del contenido total de compuestos fenólicos fue 42,7%.
En cuanto a los compuestos organosulfurados, el contenido total disminuyó progresivamente durante toda la digestión gastrointestinal in vitro. Se observó un marcado descenso del contenido total de compuestos derivados del γ-glutamil-S-alqu(en)in-L-cisteína (GSAk) durante la digestión intestinal, principalmente debido a que estos compuestos presentan una menor estabilidad química a pH básicos (Verhagen et al., 2001). Al final del proceso digestivo, estos compuestos mostraron un índice de bioaccesibilidad medio total del 55% (Figura 4).
Entre los derivados del SAk, los compuestos mayoritarios fueron la aliína, S-alil-L-cisteína (SAC) y el sulfóxido de metionina, suponiendo el 60% del total de compuestos organosulfurados determinados tras el proceso digestivo, mientras que el γ-glutamil-S-(1-propenil)-L-cisteína sulfóxido (G1PCS) y el γ-glutamil-S-alil-L-cisteína (GSAC) fueron los mayoritarios entre los derivados del GSAk, suponiendo el 23% del total de compuestos. Sin embargo, los compuestos organosulfurados que presentaron los índices de bioaccesibilidad más altos fueron el sulfóxido de metionina (262%), el S-(1-propenil)-L-cisteína (S1PC) (151%), el S-alil-mercaptocisteína (SAMC) (106%) y el γ-glutamil-S-metil-L-cisteína sulfóxido (GSMCS) (89%). El compuesto organosulfurado que experimentó el mayor aumento fue el sulfóxido de metionina, el cuál aumentó su contenido casi 3 veces, esto puede deberse a reacciones de oxidación de la metionina durante el proceso digestivo (Lee and Gladyshev, 2011).
www.bibliotecahorticultura.com 12
Ajo negro, valor añadido y potencial saludable

Figura 4. Índices de Bioaccesibilidad (%) del total de compuestos fenólicos y organosulfurados tras la digestión gastrointestinal in vitro del ajo negro
La bioaccesibilidad de los compuestos organosulfurados en ajo negro fue significativamente mayor que la mostrada en ajo fresco, lo que indica que el proceso de elaboración de este producto potencialmente aumenta el porcentaje de compuestos organosulfurados disponibles para ser absorbidos en el tracto gastrointestinal (Moreno-Ortega et al., 2020).
3.2. Evaluación del impacto de la fermentación colónica in vitro sobre el perfil fitoquímico del ajo negro
La fermentación colónica constituye el siguiente paso en el proceso digestivo, tras la digestión gastrointestinal, donde los compuestos serán transformados por la acción de la microbiota colónica, antes de ser absorbidos. En este estudio, se evaluó la evolución del perfil de compuestos bioactivos del ajo negro durante el proceso de fermentación colónica in vitro (Figura 5).
En cuanto al perfil de compuestos fenólicos, los ácidos hidroxicinámicos, los derivados del ácido fenilpropílico, del ácido fenilacético y el bencenotriol disminuyeron significativamente durante la fermentación colónica in vitro. Por otro lado, el contenido total de flavonoles y de derivados del ácido benzoico aumentaron su contenido durante este proceso.
Por otra parte, el aumento en el contenido de flavonoles también puede ser debido a una liberación derivada de la fermentación de la fibra dietética, donde se pueden encontrar retenidos estos compuestos (Edwards et al., 2017). En cuanto al aumento del contenido de los polifenoles derivados del ácido benzoico, esto puede deberse a que este grupo de compuestos está conformado por los principales catabolitos finales de las rutas de degradación de los polifenoles. De esta forma, el aumento significativo del contenido de ácido 4-hidroxibenzoico puede ser debido a la pérdida del grupo hidroxilo del ácido 3,4-dihidroxibenzoico, que a su vez deriva de la oxidación del ácido 3-(3’,4’-dihidroxifenil) propiónico (Ludwig et al., 2013; Di Pede et al., 2020). Por último, el 1,3,5-bencenotriol mostró un aumento durante las primeras 8 h de la fermentación colónica, lo que puede deberse a que se trata de un catabolito de la degradación de la quercetina (Aura, 2008; Dueñas et al., 2015). Tras esto, este compuesto se degrada produciendo ácidos grasos de cadena corta, disminuyendo su concentración final, y convirtiéndose en sustrato energético para la microbiota intestinal (Braune y Blaut, 2016).
Consumo-
www.bibliotecahorticultura.com 13
Alimentación Saludable, Hortalizas
Ajo negro, valor añadido y potencial saludable
Finalmente, los principales compuestos fenólicos tras la fermentación colónica in vitro del ajo negro fueron el ácido 4-hidroxifenilacético, el ácido 4-hidroxibenzoico, el 1,3,5-bencenotriol, el ácido 3,4-dihidroxibenzoico, el ácido benzoico y el ácido 4-hidroxi-3-metoxibenzoico, suponiendo el 91% del contenido fenólico total.
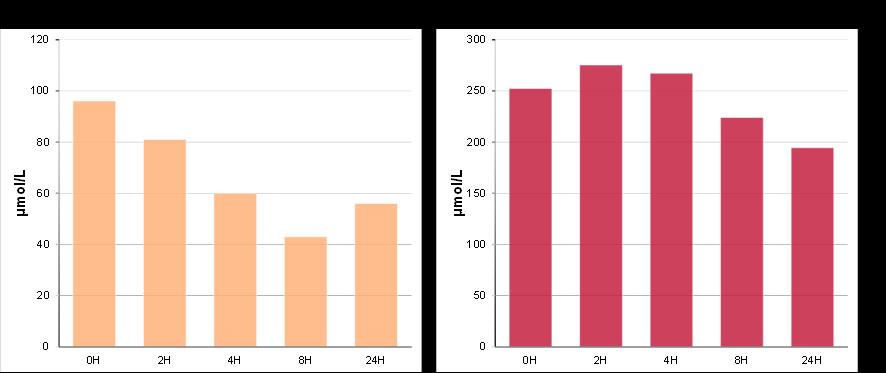
Figura 5. Evolución del perfil de compuestos fenólicos y organosulfurados durante la fermentación colónica in vitro del ajo negro
La presencia de algunos de estos compuestos a nivel colónico se ha relacionado con un potencial efecto beneficioso para la salud. En este sentido, la presencia de ácido benzoico y ácido 4hidroxibenzoico se ha relacionado con un efecto protector frente al proceso de transformación de las células normales en células cancerosas, ya que se relacionan con mecanismos de activación de enzimas detoxificantes (Dobani et al., 2021). Por otro lado, la presencia de 1,3,5bencenotriol a nivel colónico puede prevenir el crecimiento de células de cáncer de colon, ya que es capaz de inducir la muerte celular en estas líneas celulares (Kang et al., 2014). Por último, Tanaka et al (2011) han reportado un efecto preventivo del ácido 3,4-dihidroxibenzoico frente al cáncer de colon inducido químicamente.
Por otro lado, respecto a los compuestos organosulfurados, el contenido total se vio significativamente afectado durante la fermentación colónica in vitro, disminuyendo un 23 % durante todo el proceso fermentativo. Sin embargo, se observó un aumento significativo en el contenido de sulfóxido de metionina. Este aumento puede estar relacionado con las interacciones entre los radicales libres y la metionina liberada de los complejos proteicos. Estos radicales libres se encuentran presentes a nivel colónico por las posibles reacciones de reducción de oxígeno incompletas que se producen durante la fermentación colónica. Al reaccionar con la metionina, se produce la formación del sulfóxido de metionina (Jones et al., 2012; Campbell et al., 2016).
Los compuestos organosulfurados mayoritarios encontrados tras la fermentación colónica in vitro del ajo negro fueron el SAC y el sulfóxido de metionina, suponiendo el 94% del contenido total de compuestos organosulfurados.
Estos compuestos organosulfurados a nivel colónico también presentan algunos efectos potencialmente beneficiosos para la salud. De hecho, la formación de sulfóxido de metionina por la interacción entre la metionina y los radicales libres, evita que estos entren en contacto con las células colónicas y puedan ejercer daño celular. Finalmente, este sulfóxido de metionina
www.bibliotecahorticultura.com 14
Consumo- Alimentación Saludable, Hortalizas
puede ser metabolizado por la microbiota colónica, gracias a las enzimas metionina sulfóxido transferasas (Pamplona y Barja, 2006; Luo y Levine, 2009). Por último, el SAC también ha sido relacionado con la prevención de la aparición de cáncer por su acción detoxificante de algunos compuestos carcinogénicos en modelos animales (Agbana et al., 2020).
La mayoría de los compuestos mencionados podrían ser los responsables de los potenciales efectos beneficiosos para la salud que se relacionan con el consumo regular de ajo negro, entre los que se pueden incluir la participación en mecanismos que evitan o retrasan el crecimiento de las células cancerosas o cierto efecto protector frente a compuestos que son capaces de transformar las células sanas en células cancerosas.
3.3. Evaluación de la biodisponibilidad in vivo de los compuestos organosulfurados del ajo negro
Una vez que se realizaron los estudios de digestión gastrointestinal y metabolismo colónico in vitro, se evaluó la biodisponibilidad in vivo de los compuestos organosulfurados del ajo negro, con el objetivo de aumentar el conocimiento sobre la metabolización, distribución y excreción de estos compuestos en humanos.
Para ello, se realizó un estudio de intervención de ingesta aguda con 12 participantes sin ninguna patología previa y con edades comprendidas entre los 22 y los 49 años. Estos voluntarios siguieron una dieta sin vegetales de los géneros Allium y Cruciferous durante los 2 días previos al estudio, e ingirieron 20 g de ajo negro a primera hora de la mañana el día del estudio. Se recogió la orina excretada durante las 12h previas al consumo del producto y durante las 24h del estudio de intervención.
Se identificaron 33 compuestos organosulfurados en orina durante las 24h posteriores a la ingesta de ajo negro, suponiendo una concentración total excretada de 64.3 ± 26.5 μmol. El contenido total de compuestos organosulfurados excretados en orina supuso el 13% del contenido total de compuestos organosulfurados presentes en ajo negro (510 ± 1.6 μmol). Este bajo porcentaje se puede deber a la formación de metabolitos intermedios y/o compuestos volátiles que no pudieron ser determinados por el análisis cromatográfico dirigido (Marchese et al., 2016; Scheffler et al., 2016).
Los compuestos organosulfurados mayoritarios determinados en orina fueron metiína, isoaliína S-(2-carboxipropil)-L-cisteína y S-propil-L-cisteína (deoxipropiína), suponiendo el 76% del total de compuestos organosulfurados excretados. También se encontraron cantidades significativas de SAC, S1PC, sulfóxido de metionina y aliina. La presencia de estos compuestos en orina viene respaldada por los resultados de estudios previos en los que identificamos aliin y SAC tras la digestión gastrointestinal in vitro y el sulfóxido de metionina, SAC y la propiína tras la fermentación colónica in vitro (Moreno-Ortega et al., 2020, 2022).
Si observamos la excreción urinaria de compuestos organosulfurados por horas, observamos que la mayor excreción se produjo durante las primeras dos horas tras el consumo de ajo negro. Sin embargo, en la excreción urinaria por intervalos, el 59% del total de compuestos organosulfurados fueron excretados entre las 8 y las 24h tras la ingesta de ajo negro, lo que puede significar que la absorción de estos compuestos se esté realizando principalmente a nivel de intestino grueso (Figura 6).
www.bibliotecahorticultura.com 15

Figura 6. Excreción urinaria de compuestos organosulfurados por horas y por intervalos tras la ingesta aguda de ajo negro
Entre los compuestos derivados del metabolismo de los compuestos organosulfurados a nivel sistémico, se identificaron en orina los derivados N-acetilados de algunos de los compuestos organosulfurados mayoritarios que encontramos en ajo negro. La reacción de N-acetilación (unión de un grupo N-acetil) se produce a nivel hepático y renal, por la acción de la enzima Nacetiltransferasa. Esta enzima reacciona con la SAC, la aliína y la S-(2-carboxipropil)-L-cisteína, resultando en la producción de N-acetil-S-alil-L-cisteína (NASAC), el N-acetil-S-alil-L-cisteína sulfóxido (NASACS) y el N-acetil-S-(2-carboxipropil)-L-cisteína (NACPC), respectivamente (Figura 7) (Colín-González et al., 2012). De hecho, NASAC y NASACS son reconocidos biomarcadores del consumo de ajo, ya que varios estudios han reportados su aparición en orina tras la ingesta de ajo o la administración oral de SAC (Nagae et al., 1994; Verhagen et al., 2001).
Sin embargo, el metabolismo de estos compuestos es complejo y se ha observado que en hígado y riñón también se pueden producir reacciones de deacetilación (pérdida del grupo N-acetil). En este sentido, Amano et al. (2015) evaluaron la actividad de N-acetilación y deacetilación del hígado en modelos animales (ratas y perros). Estos investigadores observaron que las ratas mostraban una elevada actividad de N-acetilación en hígado y riñón mientras que el perro mostró una actividad significativamente más alta de deacetilación que de N-acetilación del NASACS en el hígado. En base a esto, la presencia de SAC en una elevada concentración en orina tras la ingesta de ajo negro sugiere que es posible que en humanos se presente una elevada actividad de deacetilación a nivel hepático y renal. Además, también puede estar relacionado con una reabsorción activa de los aminoácidos vía urinaria mediante varios tipos de transportadores en el riñón (Silbernagl et al., 1975; Bröer, 2008). De la misma forma, la alta concentración de SAC en orina puede deberse también a la degradación de moléculas más complejas como el GSAC, γ-glutamil-S-alil-L-cisteína sulfóxido (GSACS), aliín o S-(2carboxipropil)-L-cisteína (Yamaguchi and Kumagai, 2020). En cuanto al NACPC, también ha sido identificado como biomarcador del consumo de vegetales del género Allium (Praticò et al., 2018).
Ajo negro, valor añadido y potencial saludable www.bibliotecahorticultura.com 16
Alimentación Saludable, Hortalizas
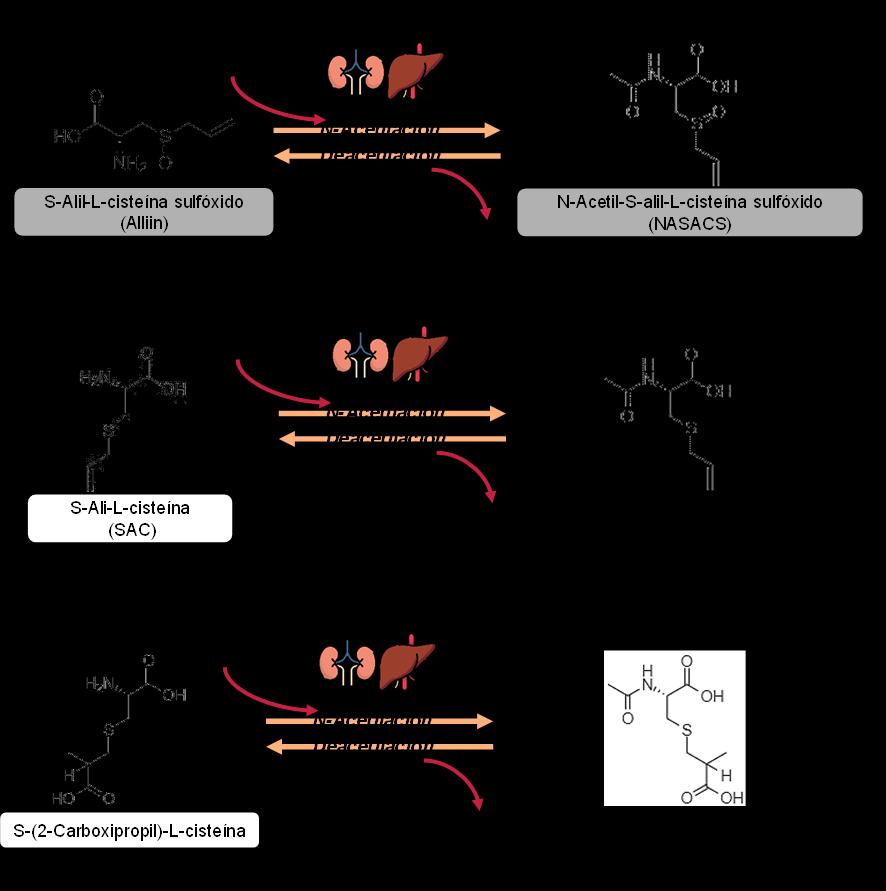
Figura 7. Reacciones de N-acetilación y deacetilación de los compuestos mayoritarios en ajo negro
El perfil de compuestos organosulfurados excretados en orina durante las 24 h posteriores al consumo de ajo negro ha permitido proponer rutas de metabolización de los principales compuestos organosulfurados presentes en este producto (Moreno-Ortega et al., 2023). Esto da la oportunidad a futuras investigaciones de ahondar en el metabolismo, distribución y excreción de estos compuestos, así como de determinar el potencial saludable de este derivado del ajo
4. Conclusiones
Los estudios que se han llevado a cabo han permitido aumentar el conocimiento sobre el impacto de la digestión gástrica y del metabolismo colónico in vitro sobre el perfil de compuestos bioactivos presentes en el ajo negro, así como evaluar la excreción urinaria de los compuestos organosulfurados y sus metabolitos.
Consumo-
www.bibliotecahorticultura.com 17
Ajo negro, valor añadido y potencial saludable
La digestión gastrointestinal in vitro afectó significativamente el contenido fenólico total, presentando un índice de bioaccesibilidad del 47%. Mientras que el contenido de compuestos organosulfurados presentó un índice de bioaccesibilidad del 55%.
En cuanto al metabolismo colónico, durante la fermentación colónica in vitro el contenido fenólico del ajo negro disminuyó un 42%, siendo el ácido 4-hidroxibenzoico y el 4hidroxifenilacético los compuestos fenólicos mayoritarios tras la acción de la microbiota intestinal. El contenido total de compuestos organosulfurados también disminuyó un 23% durante la fermentación colónica, siendo la S-alil-L-cisteína (SAC) y el sulfóxido de metionina los principales compuestos encontrados tras el proceso fermentativo
Finalmente, se han propuesto tres rutas de degradación en base a los diferentes compuestos organosulfurados encontrados en ajo negro y los principales compuestos excretados en orina tras su ingesta aguda por humanos sanos. Los principales compuestos organosulfurados determinados en orina fueron metiína, isoaliína, S-(2-carboxipropil)-L-cisteína y S-propil-Lcisteína, suponiendo el 76% del total de compuestos organosulfurados excretados. Además, se identificaron los metabolitos N-acetilados derivados de los principales compuestos organosulfurados encontrados en ajo negro, SAC y alliin. La identificación de estos compuestos organosulfurados como biomarcadores urinarios del consumo de ajo negro brinda la oportunidad de estudiar el papel de este producto en la salud humana. De la misma forma, constituye las bases para futuras investigaciones sobre la función biológica y el potencial saludable de estos metabolitos secundarios de las plantas en humanos.
Bibliografía
Agbana, Y.L. et al. (2020) ‘Garlic-derived bioactive compound S-allylcysteine inhibits cancer progression through diverse molecular mechanisms’, Nutrition Research, 73, pp. 1–14. https://doi.org/10.1016/J.NUTRES.2019.11.002
Ahmed, T.; Wang, C.-K. (2021) ‘Black Garlic and Its Bioactive Compounds on Human Health Diseases: A Review’, Molecules, 26(16), pp. 1–38. https://doi.org/10.3390/MOLECULES26165028
Alkreathy, H.M. et al. (2020) ‘Aged garlic extract potentiates doxorubicin cytotoxicity in human breast cancer cells’, Tropical Journal of Pharmaceutical Research, 19(8), pp. 1669–1676. https://doi.org/10.4314/tjpr.v19i8.15
Almeida, A.F. et al. (2018) ‘Bioavailability of Quercetin in Humans with a Focus on Interindividual Variation’, Comprehensive Reviews in Food Science and Food Safety, 17(3), pp. 714–731. https://doi.org/10.1111/1541-4337.12342
Amano, H. et al. (2015) ‘Metabolism, Excretion, and Pharmacokinetics of S-Allyl-l-Cysteine in Rats and Dogs’, Drug Metabolism and Disposition, 43(5), pp. 749–755. https://doi.org/10.1124/DMD.115.063230
Ashafaq, M. et al. (2012) ‘S-allyl cysteine mitigates oxidative damage and improves neurologic deficit in a rat model of focal cerebral ischemia’, Nutrition Research, 32(2), pp. 133–143. https://doi.org/10.1016/J.NUTRES.2011.12.014
www.bibliotecahorticultura.com 18
Consumo- Alimentación Saludable, Hortalizas
Aura, A.-M. (2008) ‘Microbial metabolism of dietary phenolic compounds in the colon’, Phytochemistry Reviews 2008 7:3, 7(3), pp. 407–429. https://doi.org/10.1007/S11101008-9095-3
Badr, G.M. and Al-Mulhim, J.A. (2014) ‘The protective effect of aged garlic extract on nonsteroidal anti-inflammatory drug-induced gastric inflammations in male albino rats’, Evidence-based Complementary and Alternative Medicine, 2014, pp. 1–10. https://doi.org/10.1155/2014/759642
Bae, S.E. et al. (2014) ‘Changes in S-allyl cysteine contents and physicochemical properties of black garlic during heat treatment’, LWT - Food Science and Technology, 55(1), pp. 397–402. https://doi.org/10.1016/J.LWT.2013.05.006
Barba, F.J.; Orlien, V. (2017) ‘Processing, bioaccessibility and bioavailability of bioactive sulfur compounds: Facts and gaps’, Journal of Food Composition and Analysis, 61, pp. 1–3. https://doi.org/10.1016/J.JFCA.2017.05.013
Block, E. (1985) ‘Química del ajo y la cebolla’, Investigación y Ciencia, 103, pp. 86–91.
Braune, A.; Blaut, M. (2016) ‘Bacterial species involved in the conversion of dietary flavonoids in the human gut’, Gut Microbes, 7(3), pp. 216–234. https://doi.org/10.1080/19490976.2016.1158395
Bresciani, L. et al. (2018) ‘An in vitro exploratory study of dietary strategies based on polyphenol-rich beverages, fruit juices and oils to control trimethylamine production in the colon’, Food and Function, 9(12), pp. 6470–6483
https://doi.org/10.1039/c8fo01778f
Bröer, S. (2008) ‘Amino acid transport across mammalian intestinal and renal epithelia’, Physiological Reviews, 88(1), pp. 249–286.
https://doi.org/10.1152/PHYSREV.00018.2006/ASSET/IMAGES/LARGE/Z9J0010824550 005.JPEG
Campbell, K. et al. (2016) ‘Methionine Metabolism Alters Oxidative Stress Resistance via the Pentose Phosphate Pathway’, Antioxidants & Redox Signaling, 24(10), pp. 543–547. https://doi.org/10.1089/ARS.2015.6516
Cantwell, M.I. (2004) Garlic. Recommendations for maintaining postharvest quality., Vegetables English - UC Postharvest Technology Center.
Castro, C. et al. (2010) ‘Garlic components inhibit angiotensin II-induced cell-cycle progression and migration: Involvement of cell-cycle inhibitor p27Kip1 and mitogen-activated protein kinase’, Molecular Nutrition & Food Research, 54(6), pp. 781–787.
https://doi.org/10.1002/MNFR.200900108
Ceccanti, C. et al. (2021) ‘Comparative phytochemical profile of the elephant garlic (Allium ampeloprasum var. holmense) and the common garlic (Allium sativum) from the Val di Chiana area (Tuscany, Italy) before and after in vitro gastrointestinal digestion’, Food Chemistry, 338(128011), pp. 1–9. https://doi.org/10.1016/J.FOODCHEM.2020.128011
www.bibliotecahorticultura.com 19
Ajo negro, valor añadido y potencial saludable
Chen, Y.A. et al. (2018) ‘Extracts of black garlic exhibits gastrointestinal motility effect’, Food Research International, 107, pp. 102–109. https://doi.org/10.1016/J.FOODRES.2018.02.003
Chu, Q. et al. (2006) ‘A novel anticancer effect of garlic derivatives: inhibition of cancer cell invasion through restoration of E-cadherin expression’, Carcinogenesis, 27(11), pp. 2180–2189. https://doi.org/10.1093/CARCIN/BGL054
Colín-González, A.L. et al. (2012) ‘The Antioxidant Mechanisms Underlying the Aged Garlic Extract-and S-Allylcysteine-Induced Protection’, Oxidative Medicine and Cellular Longevity, 2012, p. 16. https://doi.org/10.1155/2012/907162
Cory, H. et al. (2018) ‘The Role of Polyphenols in Human Health and Food Systems: A MiniReview’, Frontiers in Nutrition, 5(87), pp. 1–9. https://doi.org/10.3389/FNUT.2018.00087
Dall’Asta, M. et al. (2012) ‘Identification of microbial metabolites derived from in vitro fecal fermentation of different polyphenolic food sources’, Nutrition, 28(2), pp. 197–203. https://doi.org/10.1016/J.NUT.2011.06.005
Dhall, R.K.; Ahuja, S. (2013) ‘Post-harvest Management of Garlic’, in National Seminar on ‘HighTech Cultivation of Vegetables and its Postharvest Management’. Karnal, India, pp. 117–121
Dobani, S. et al. (2021) ‘Ex vivo fecal fermentation of human ileal fluid collected after raspberry consumption modifies (poly)phenolics and modulates genoprotective effects in colonic epithelial cells’, Redox Biology, 40(101862), pp. 1–11. https://doi.org/10.1016/J.REDOX.2021.101862
Dong, M. et al. (2014) ‘Aged black garlic extract inhibits Ht29 colon cancer cell growth via the PI3K/Akt signaling pathway’, Biomedical Reports, 2(2), pp. 250–254. https://doi.org/10.3892/BR.2014.226.
Dueñas, M. et al. (2015) ‘A survey of modulation of gut microbiota by dietary polyphenols’, BioMed research international, 2015, pp. 1–15. https://doi.org/10.1155/2015/850902
Ebrahimi, A.; Schluesener, H. (2012) ‘Natural polyphenols against neurodegenerative disorders: Potentials and pitfalls’, Ageing Research Reviews, 11(2), pp. 329–345. https://doi.org/10.1016/J.ARR.2012.01.006
Edwards, C.A. et al. (2017) ‘Polyphenols and health: Interactions between fibre, plant polyphenols and the gut microbiota’, Nutrition Bulletin, 42(4), pp. 356–360. https://doi.org/10.1111/NBU.12296
Food and Agriculture Organization of the United Nations (FAOSTAT) (2021) Data Crops and Livestock Products, Food and Agriculture Organization of the United Nations (FAOSTAT).
Gomez, C.D. et al. (2019) ‘Aged garlic extract and S-allylcysteine increase the GLUT3 and GCLC expression levels in cerebral ischemia’, Advances in Clinical and Experimental Medicine, 28(12), pp. 1609–1614. https://doi.org/10.17219/ACEM/110328
www.bibliotecahorticultura.com 20
Consumo- Alimentación Saludable, Hortalizas
Heaney, R.P. (2001) ‘Factors Influencing the Measurement of Bioavailability, Taking Calcium as a Model’, The Journal of Nutrition, 131(4), pp. 1344S-1348S. https://doi.org/10.1093/JN/131.4.1344S
Heinerman, J. (1995) El ajo y sus propiedades curativas : historia, remedios y recetas. Ediciones Paidós.
Hu, H. et al. (2011) ‘Identification of a novel function of Id-1 in mediating the anticancer responses of SAMC, a water-soluble garlic derivative, in human bladder cancer cells’, Molecular Medicine Reports, 4(1), pp. 9–16. https://doi.org/10.3892/MMR.2010.380
Jang, E.K.; Seo, J.H.; Lee, S.P. (2008) ‘Physiological activity and antioxidative effects of aged black garlic (Allium sativum L.) extract’, Korean Journal of Food Science and Technology, 40, pp. 443–448.
Jeong, J.H. et al. (2013) ‘Ameliorating effects of aged garlic extracts against Aβ-induced neurotoxicity and cognitive impairment’, BMC Complementary and Alternative Medicine, 13(1), pp. 1–11. https://doi.org/10.1186/1472-6882-13-268
Jiang, G. et al. (2021) ‘Synergistic effects of black ginseng and aged garlic extracts for the amelioration of nonalcoholic fatty liver disease (NAFLD) in mice’, Food Science & Nutrition, 9(6), pp. 3091–3099. https://doi.org/10.1002/FSN3.2267
Jikihara, H. et al. (2015) ‘Aged garlic extract inhibits 1,2-dimethylhydrazine-induced colon tumor development by suppressing cell proliferation’, Oncology Reports, 33(3), pp. 1131–1140. https://doi.org/10.3892/OR.2014.3705
Jones, R.; Mercante, J.; Neish, A. (2012) ‘Reactive oxygen production induced by the gut microbiota: pharmacotherapeutic implications’, Current medicinal chemistry, 19(10), pp. 1519–1529. https://doi.org/10.2174/092986712799828283
Juániz, I. et al. (2017) ‘Bioaccessibility of (poly)phenolic compounds of raw and cooked cardoon (Cynara cardunculus L.) after simulated gastrointestinal digestion and fermentation by human colonic microbiota’, Journal of Functional Foods, 32, pp. 195–207. https://doi.org/10.1016/j.jff.2017.02.033
Kang, M.-H.; Kim, I.-H.; Nam, T.-J. (2014) ‘Phloroglucinol induces apoptosis through the regulation of insulin-like growth factor 1 receptor signaling pathways in human colon cancer HT-29 cells’, International Journal of Oncology, 45(3), pp. 1036–1042. https://doi.org/10.3892/IJO.2014.2521
Kang, O.-J. (2016) ‘Physicochemical Characteristics of Black Garlic after Different Thermal Processing Steps’, Preventive Nutrition and Food Science [Preprint]. https://doi.org/10.3746/pnf.2016.21.4.348
Kim, K.J. et al. (2019) ‘Protective effect of S-allyl cysteine-enriched black garlic on reflux esophagitis in rats via NF-κB signaling pathway’, Journal of Functional Foods, 58, pp. 199–206. https://doi.org/10.1016/J.JFF.2019.04.040
Kohlmeier, M. (2015) ‘Minerals and Trace Elements’, in Nutrient Metabolism. Academic Press, pp. 673–807. https://doi.org/10.1016/B978-0-12-387784-0.00011-0
www.bibliotecahorticultura.com 21
Ajo negro, valor añadido y potencial saludable
Lee, B.C.; Gladyshev, V.N. (2011) ‘The biological significance of methionine sulfoxide stereochemistry’, Free Radical Biology and Medicine, 50(2), pp. 221–227. https://doi.org/10.1016/j.freeradbiomed.2010.11.008
López Luengo, M.T. (2007) ‘El ajo: propiedades farmacológicas e indicaciones terapéuticasDialnet’, Offarm: farmacia y sociedad, 26(1), pp. 78–81.
Ludwig, I.A. et al. (2013) ‘Catabolism of coffee chlorogenic acids by human colonic microbiota’, BioFactors, 39(6), pp. 623–632. https://doi.org/10.1002/biof.1124
De Luis, D.A.; Aller, R. (2008) ‘Ajo y riesgo cardiovascular’, Anales de Medicina Interna, 25(5), pp. 237–240.
Luo, S.; Levine, R.L. (2009) ‘Methionine in proteins defends against oxidative stress’, The FASEB Journal, 23(2), pp. 464–472. https://doi.org/10.1096/FJ.08-118414
Madhu, B.; Mudgal, V.D.; Champawat, P.S. (2019) ‘Storage of garlic bulbs (Allium sativum L.): A review’, Journal of Food Process Engineering, 42(6), pp. 1–6. https://doi.org/10.1111/JFPE.13177
Marchese, A. et al. (2016) ‘Antifungal and antibacterial activities of allicin: A review’, Trends in Food Science & Technology, 52, pp. 49–56. https://doi.org/10.1016/J.TIFS.2016.03.010
Ministerio de Agricultura, P. y A. (MAPA) (2021) Superficies y producciones anuales de cultivos. Avance de datos de Hortalizas, 2021, Ministerio de Agricultura, Pesca y Alimentación (MAPA).
Moreno-Ortega, A. et al. (2020) ‘Bioaccessibility of Bioactive Compounds of “Fresh Garlic” and “Black Garlic” through In vitro Gastrointestinal Digestion’, Foods, 9(11), p. 1582. https://doi.org/10.3390/foods9111582
Moreno-Ortega, A. et al. (2022) ‘In vitro Colonic Fermentation of (Poly)phenols and Organosulfur Compounds of Fresh and Black Garlic’, Journal of Agricultural and Food Chemistry, 70(12), pp. 3666–3677.
https://doi.org/10.1021/ACS.JAFC.1C08081/SUPPL_FILE/JF1C08081_SI_001.PDF
Moreno-Ortega, A. et al. (2023) ‘Bioavailability of Organosulfur Compounds after the Ingestion of Black Garlic by Healthy Humans’, Antioxidants, 12(4)(925), pp. 1–17. https://doi.org/10.3390/ANTIOX12040925
Nagae, S. et al. (1994) ‘Pharmacokinetics of the garlic compound S-allylcysteine’, Planta Medica, 60(3), pp. 214–217. https://doi.org/10.1055/S-2006-959461/BIB
Pamplona, R.; Barja, G. (2006) ‘Mitochondrial oxidative stress, aging and caloric restriction: The protein and methionine connection’, Biochimica et Biophysica Acta (BBA)Bioenergetics, 1757(5–6), pp. 496–508. https://doi.org/10.1016/J.BBABIO.2006.01.009
Pandey, K.B.; Rizvi, S.I. (2009) ‘Plant polyphenols as dietary antioxidants in human health and disease’, Oxidative Medicine and Cellular Longevity, 2(5), pp. 270–278.
https://doi.org/10.4161/OXIM.2.5.9498
www.bibliotecahorticultura.com 22
Consumo- Alimentación Saludable, Hortalizas
Di Pede, G. et al. (2020) ‘The human microbial metabolism of quercetin in different formulations: An in vitro evaluation’, Foods, 9(8), pp. 1–13. https://doi.org/10.3390/foods9081121
Pereira-Caro, G. et al. (2014) ‘Orange juice (poly)phenols are highly bioavailable in humans’, 100(5), pp. 1378–1384. https://doi.org/10.3945/AJCN.114.090282
Põldma, P. et al. (2011) ‘Effect of Selenium Treatment on Mineral Nutrition, Bulb Size, and Antioxidant Properties of Garlic (Allium sativum L.)’, Journal of Agricultural and Food Chemistry, 59(10), pp. 5498–5503. https://doi.org/10.1021/JF200226P
Poojary, M.M. et al. (2017) ‘Stability and extraction of bioactive sulfur compounds from Allium genus processed by traditional and innovative technologies’, Journal of Food Composition and Analysis, 61, pp. 28–39. https://doi.org/10.1016/J.JFCA.2017.04.007
Praticò, G. et al. (2018) ‘Biomarkers of food intake for Allium vegetables’, Genes & Nutrition, 13(1), pp. 1–12. https://doi.org/10.1186/S12263-018-0624-4
Qin, W. et al. (2020) ‘Quantification of Allyl Methyl Sulfide, Allyl Methyl Sulfoxide, and Allyl Methyl Sulfone in Human Milk and Urine After Ingestion of Cooked and Roasted Garlic’, Frontiers in Nutrition, 7(167), pp. 1–13. https://doi.org/10.3389/FNUT.2020.565496/BIBTEX
Rahman, K.; Billington, D. (2000) ‘Dietary Supplementation with Aged Garlic Extract Inhibits ADP-Induced Platelet Aggregation in Humans’, The Journal of Nutrition, 130(11), pp. 2662–2665. https://doi.org/10.1093/JN/130.11.2662
Del Rio, D.; Borges, G.; Crozier, A. (2010) ‘Berry flavonoids and phenolics: bioavailability and evidence of protective effects’, British Journal of Nutrition, 104(S3), pp. S67–S90. https://doi.org/10.1017/S0007114510003958
Ríos-Ríos, K.L. et al. (2019) ‘Physicochemical changes and sensorial properties during black garlic elaboration: A review’, Trends in Food Science & Technology, 88, pp. 459–467.
Rojas, P. et al. (2011) ‘S-Allylcysteine, a garlic compound, protects against oxidative stress in 1methyl-4-phenylpyridinium-induced parkinsonism in mice’, The Journal of Nutritional Biochemistry, 22(10), pp. 937–944. https://doi.org/10.1016/J.JNUTBIO.2010.08.005
Rosen, R.T.T. et al. (2000) ‘The determination of metabolites of garlic preparations in breath and human plasma’, BioFactors, 13(1–4), pp. 241–249. https://doi.org/10.1002/BIOF.5520130137
Scheffler, L. et al. (2016) ‘Detection of Volatile Metabolites Derived from Garlic (Allium sativum) in Human Urine’, 6, pp. 1–23. https://doi.org/10.3390/METABO6040043
Scheffler, L.; Sharapa, C.; Buettner, A. (2019) ‘Quantification of volatile metabolites derived from garlic in human breast milk’, Food Chemistry, 274, pp. 603–610. https://doi.org/10.1016/J.FOODCHEM.2018.09.039
www.bibliotecahorticultura.com 23
Ajo negro, valor añadido y potencial saludable
Selby-Pham, S.N.B. et al. (2017) ‘Physicochemical properties of dietary phytochemicals can predict their passive absorption in the human small intestine’, Scientific Reports, 7(1), pp. 1–15. https://doi.org/10.1038/s41598-017-01888-w
Seo, Y.-J. et al. (2009) ‘Effect of Garlic and Aged Black Garlic on Hyperglycemia and Dyslipidemia in Animal Model of Type 2 Diabetes Mellitus’, Preventive Nutrition and Food Science, 14(1)(1), pp. 1–7. https://doi.org/10.3746/jfn.2009.14.1.001
Shahidi, F.; Ambigaipalan, P. (2015) ‘Phenolics and polyphenolics in foods, beverages and spices: Antioxidant activity and health effects – A review’, Journal of Functional Foods, 18, pp. 820–897. https://doi.org/10.1016/J.JFF.2015.06.018
Shin, D.-Y. et al. (2010) ‘Effects of Aged Black Garlic Extracts on the Tight Junction Permeability and Cell Invasion in Human Gastric Cancer Cells’, Journal of Life Science, 20(4), pp. 528–534. https://doi.org/10.5352/JLS.2010.20.4.528
Silbernagl, S.; Foulkes, E.C.; Deetjen, P. (1975) ‘Renal transport of amino acids’, Reviews of Physiology, Biochemistry and Pharmacology, 74, pp. 105–167. https://doi.org/10.1007/3-540-07483-X_20
Tanaka; Takuji; Tanaka; Takahiro; Tanaka, M. (2011) ‘Potential Cancer Chemopreventive Activity of Protocatechuic Acid’, Journal of Experimental & Clinical Medicine, 3(1), pp. 27–33. https://doi.org/10.1016/J.JECM.2010.12.005
Thomson, M. et al. (2016) ‘Anti-diabetic and anti-oxidant potential of aged garlic extract (AGE) in streptozotocin-induced diabetic rats’, BMC Complementary and Alternative Medicine 2016 16:1, 16(1), pp. 1–9. https://doi.org/10.1186/S12906-016-0992-5
Toledano Medina, M.A. et al. (2016) ‘Evolution of some physicochemical and antioxidant properties of black garlic whole bulbs and peeled cloves’, Food Chemistry, 199, pp. 135–139. https://doi.org/10.1016/j.foodchem.2015.11.128
Toledano Medina, M.Á. (2017) Optimización del proceso de elaboración y caracterización fisiológica y físico-química del ajo negro. Universidad de Córdoba, UCOPress.
Tomás-Barberán, F.A. (2003) ‘Los polifenoles de los alimentos y la salud’, ANS. Alimentación, nutrición y salud, 10(2), pp. 41–53.
Tong, D. et al. (2014) ‘S-allylmercaptocysteine promotes MAPK inhibitor-induced apoptosis by activating the TGF-β signaling pathway in cancer cells’, Oncology Reports, 32(3), pp. 1124–1132. https://doi.org/10.3892/OR.2014.3295
Torija Isasa, M.E.; Matallana González, M.C.; Chalup, N. (2014) ‘El ajo y la cebolla: de las medicinas antiguas al interés actual - Dialnet’, Boletín de la Real Sociedad Española de Historia Natural. Sección biológica., 107, pp. 29–37.
Tuladhar, P.; Sasidharan, S.; Saudagar, P. (2021) ‘Role of phenols and polyphenols in plant defense response to biotic and abiotic stresses’, in Biocontrol Agents and Secondary Metabolites. Woodhead Publishing, pp. 419–441. https://doi.org/10.1016/B978-0-12822919-4.00017-X
www.bibliotecahorticultura.com 24
Consumo- Alimentación Saludable, Hortalizas
Verhagen, H. et al. (2001) ‘Biomonitoring the intake of garlic via urinary excretion of allyl mercapturic acid’, British Journal of Nutrition, 86(S1), pp. S111–S114. https://doi.org/10.1079/BJN2001343
Walag, A.M.P. et al. (2020) ‘Health Benefits of Organosulfur Compounds’, in Functional Foods and Nutraceuticals. Springer, Cham, pp. 445–472. https://doi.org/10.1007/978-3-03042319-3_21
Wlosinska, M. et al. (2020) ‘The effect of aged garlic extract on the atherosclerotic process-A randomized double-blind placebo-controlled trial’, BMC Complementary Medicine and Therapies, 20(1). https://doi.org/10.1186/s12906-020-02932-5
Wu, J. et al. (2016) ‘Over-expression of survivin is a factor responsible for differential responses of ovarian cancer cells to S-allylmercaptocysteine (SAMC)’, Experimental and Molecular Pathology, 100(2), pp. 294–302. https://doi.org/10.1016/J.YEXMP.2016.02.003
Yamaguchi, Y.; Kumagai, H. (2020) ‘Characteristics, biosynthesis, decomposition, metabolism and functions of the garlic odour precursor, S allyl l cysteine sulfoxide (Review)’ , Experimental and Therapeutic Medicine, 19(2), pp. 1528–1535. https://doi.org/10.3892/ETM.2019.8385
Yoshimoto, N.; Saito, K. (2019) ‘S-Alk(en)ylcysteine sulfoxides in the genus Allium: proposed biosynthesis, chemical conversion, and bioactivities’, Journal of experimental botany, 70(16), pp. 4123–4137. https://doi.org/10.1093/JXB/ERZ243
Yuan, H. et al. (2016) ‘The Comparison of the Contents of Sugar, Amadori, and Heyns Compounds in Fresh and Black Garlic’, Journal of food science, 81(7), pp. 1662–1668. https://doi.org/10.1111/1750-3841.13365
Yuan, H. et al. (2018) ‘An analysis of the changes on intermediate products during the thermal processing of black garlic’, Food Chemistry, 239(January), pp. 56–61. https://doi.org/10.1016/j.foodchem.2017.06.079
Zhang, X. et al. (2016) ‘Effects of temperature on the quality of black garlic’, Journal of the Science of Food and Agriculture, 96(7), pp. 2366–2372.
Zhang, Z. et al. (2015) ‘Evaluation of Alliin, Saccharide Contents and Antioxidant Activities of Black Garlic during Thermal Processing’, Journal of Food Biochemistry, 39(1), pp. 39–47. https://doi.org/10.1111/jfbc.12102
www.bibliotecahorticultura.com 25
Ajo negro, valor añadido y potencial saludable
INFORMACIÓN COMERCIAL
www.bibliotecahorticultura.com 26


ESPECIALISTES EN SERVEIS PER A LA PRODUCCIÓ EDITORIAL, SL
Doctor Manuel Candela 26, 11ª 46021 VALENCIA – ESPAÑA
Tel.: +34-649 48 56 77 / info@poscosecha.com NIF: B-43458744
www.poscosecha.com www.postharvest.biz www.bibliotecahorticultura.com www.tecnologiahorticola.com www.actualfruveg.com
28
www.bibliotecahorticultura.com














