
Perfil fisicoquímico y nutricional de diez nuevas variedades de níspero
Nariane Q. Vilhena1, Almudena Bermejo2, Raquel Poveda1, Esteban Soler3, Alejandra
Salvador1
1Centro de Tecnología Postcosecha, Instituto Valenciano de Investigaciones Agrarias (IVIA), Valencia, España
2Centro de Citricultura y Producción Vegetal, Instituto Valenciano de Investigaciones Agrarias (IVIA), Valencia, España
3Cooperativa Agrícola de Callosa d'en Sarrià, Alicante, España

wwww.bibliotecahorticultura.com
Perfil fisicoquímico y nutricional de diez nuevas variedades de níspero
Nariane Q. Vilhena1, Almudena Bermejo2, Raquel Poveda1, Esteban Soler3, Alejandra Salvador1* *salvador_ale@gva.es
1Centro de Tecnología Postcosecha, Instituto Valenciano de Investigaciones Agrarias (IVIA), Valencia, España
2Centro de Citricultura y Producción Vegetal, Instituto Valenciano de Investigaciones Agrarias (IVIA), Valencia, España
3Cooperativa Agrícola de Callosa d'en Sarrià, Alicante, España
Indice
1. Introducción
2. Materiales y métodos
2.1. Material vegetal
2.2. Determinación de los parámetros fisicoquímicos
2.3. Análisis de biocomponentes
2.4. Análisis estadístico
3. Resultados y discusión
3.1. Solidos Solubles Totales, Acidez y Taninos Solubles
3.2. Azúcares, ácidos orgánicos y compuestos fenólicos
3.3. Análisis de componentes principales
4. Conclusiones
Resumen
En el presente estudio se llevó a cabo un análisis comparativo de 10 variedades de níspero con el objetivo de identificar diferencias significativas entre ellas y clasificarlas en función de sus principales propiedades fisicoquímicas y fitoquímicas. Para cada variedad se evaluaron las concentraciones de taninos solubles, sólidos solubles totales, acidez titulable y los principales biocomponentes (azúcares individuales, ácidos orgánicos y compuestos fenólicos) en frutos cosechados en estado de madurez comercial. Los resultados revelaron diferencias significativas en la calidad fisicoquímica y nutricional de los cultivares. El análisis de componentes principales permitió agrupar las variedades en cuatro grupos bien diferenciados, especialmente en términos de ácidos orgánicos, compuestos fenólicos y azúcares. Estos resultados revelan la diversidad de la composición fisicoquímica y nutricional del níspero y proporcionan información valiosa sobre el potencial comercial de las nuevas variedades. Además, esta información es útil para los programas de mejora genética, ya que los cultivares con características específicas pueden utilizarse como material parental en futuros cruzamientos.
Palabras clave: Eriobotrya japónica, calidad fisicoquímica, compuestos nutricionales, mejora genética.
www.bibliotecahorticultura.com
1. Introducción
España es el segundo mayor productor de níspero a nivel mundial, por detrás de China, con una producción total estimada de 27.249 toneladas, destinada principalmente al consumo en fresco (MAPA, 2024). La principal zona productora de níspero en España se encuentra en el valle de los ríos Algar y Guadalest, en la provincia de Alicante, donde las condiciones ambientales mediterráneas favorecen su cultivo (MAPA, 2024). En esta región, la producción se centra en la variedad Algerí y sus mutaciones (‘Nadal’, ‘Golden’ y ‘Magda’), que representan alrededor del 95 % de la producción total, y se incluye dentro de la Denominación de Origen Protegida (DOP) “Nísperos Callosa d’En Sarrià” (R(EU)1992/2081) (López-Lluch et al. 2020).
Esta producción concentrada en un número reducido de variedades constituye uno de los principales problemas de la industria del níspero, ya que limita el período de recolección y aumenta el riesgo fitosanitario. En consecuencia, la Cooperativa Agrícola de Callosa d’en Sarrià, miembro mayoritario del Consejo Regulador de Níspero Callosa d’En Sarrià (DOP), con el apoyo del Conselleria de Agricultura y el Instituto Valenciano de investigaciones Agrarias (IVIA), puso en marcha un programa de mejora. Este programa incluye material vegetal procedente de otros países productores, como China y Japón, además de mutaciones espontáneas y líneas derivadas de semilla. De este programa se han seleccionado nueve variedades de interés potencial por su comportamiento agronómico y por las características del fruto.
Además de sus cualidades organolépticas, el níspero destaca por sus elevados contenidos de compuestos de interés nutricional. Este fruto es una fuente rica en carbohidratos, vitaminas, ácidos orgánicos, minerales y compuestos bioactivos, incluidos compuestos fenólicos, que pueden contribuir a la prevención de enfermedades cardiovasculares y diabetes (Cai et al., 2019, Costa et al., 2022, Dhiman et al., 2022, Sagar et al., 2020).
La introducción de nuevas variedades de níspero no solo exige comprobar su adaptación agronómica, sino también evaluar de forma rigurosa la calidad del fruto y su composición nutricional, puesto que son aspectos determinantes en su éxito comercial. El Centro de Tecnología Postcosecha del IVIA ha llevado a cabo diversos estudios para caracterizar algunas de las variedades obtenidas en el Programa de Mejora (Besada et al., 2013; 2017; Gil et al., 2018). Sin embargo, la información sigue siendo limitada y no se disponen de suficientes datos sobre la calidad nutricional de las nuevas variedades que se van seleccionando por su interés agronómico y comercial. En este contexto, el objetivo del presente trabajo es la caracterización de la calidad fisicoquímica y nutricional de nueve variedades seleccionadas del Programa de Mejora, comparándolas con la variedad Algerí para poder proporcionar información útil para productores, comercializadores y futuros programas de Mejora.
2. Materiales y métodos
2.1. Material vegetal
Se trabajó con las siguientes variedades seleccionadas en el marco del Programa de Mejora desarrollado por la cooperativa de Callosa d’en Sarrià (Alicante, España): ‘Algar 158’ (‘Algerí’ × ‘Magdal’, híbrido), ‘Algar 15’ (‘Algerí’ × ‘Magdal’, híbrido), ‘Algar 72’ (‘Algerí’ × ‘Zaozhong’, híbrido), ‘Algar 5’ (‘Algerí’ × ‘Zaozhong’, híbrido) y cinco mutaciones espontáneas de ‘Algerí’ (‘Juliana’, ‘Siscar’, ‘Andrés’, ‘Ruchey’ y ‘Xirlero’), además de la variedad ‘Algerí’.
Del 10 de abril al 16 de mayo se recolectaron los 10 cultivares de níspero de la Estación Experimental de la Cooperativa Agrícola de Callosa d’en Sarrià (Alicante, España). El momento de recolección de cada variedad se
estableció siguiendo las indicaciones de los técnicos responsables del Programa. La fruta se cosechó manualmente y se transportó a las instalaciones del Centro de Tecnología Postcosecha del IVIA, donde se seleccionaron los frutos en función de la uniformidad de tamaño, forma y color externo. Posteriormente, se constituyeron lotes de 30 frutos para las determinaciones fisicoquímicas y el análisis de biocomponentes.
2.2. Determinación de los parámetros fisicoquímicos
Los sólidos solubles totales (SST) se determinaron en tres muestras de seis frutos cada una, trituradas hasta obtener zumo con un mortero y filtrados con gasa. El contenido en SST de cada muestra se midió por duplicado con un refractómetro (Atago, mod. PR-1) y los resultados se expresaron en °Brix. La acidez total se determinó por valoración ácido-base con NaOH 0,10 N, de acuerdo con Besada et al. (2013), y se expresó como gramos de ácido málico por 100 mL de zumo. Para la determinación de taninos solubles (TS) se tomaron tres muestras independientes de seis frutos cada una. La pulpa se troceó y se congeló a −20 °C para su posterior evaluación mediante el método de Folin-Denis (Arnal y Del Río, 2004). Los resultados se expresaron como porcentaje de peso fresco.
2.3. Análisis de biocomponentes
Los análisis por HPLC se realizaron con un sistema de cromatografía líquida de alta resolución, con las muestras termostatadas, utilizando un equipo Alliance (Waters, Barcelona, España) equipado con un detector de fotodiodos, de masas e índice de refracción, utilizando columnas de separación específicas. En todos los casos la cuantificación se realizó mediante calibración con los patrones correspondientes, y para el tratamiento de datos se utilizó el Software Empower 2 (Waters, España). Todos los solventes empleados fueron de calidad LC-MC.
La extracción de ácidos orgánicos se realizó según el método descrito por Bermejo et al. (2016), y los compuestos se analizaron mediante HPLC-DAD y HPLC-MS de acuerdo con Morales et al. (2021b). Las concentraciones fueron determinadas utilizando una curva de calibración externa con ácido cítrico, málico, succínico y fumárico de Sigma (Sigma Co., Barcelona, España). Los resultados se expresaron en mg/100 mL de zumo.
El método de extracción y análisis de los azúcares individuales fue el descrito por Bermejo et al. (2016), y los carbohidratos fueron analizados por HPLC de acuerdo con Morales et al. (2021a). Los compuestos se cuantificaron identificaron utilizando una curva de calibración externa con fructosa, glucosa y sacarosa de Sigma (Sigma Co., Barcelona, España). Los resultados obtenidos fueron expresados en g/L.
Los compuestos fenólicos principales se extrajeron y analizaron mediante HPLC-DAD y HPLC-MS siguiendo el procedimiento descrito por Gómez-Martínez et al. (2021) y Morales et al. (2021b). Las concentraciones fueron determinadas utilizando una curva de calibración externa con ácidos clorogénico, neoclorogénico y ortocumárico, obtenidos de Sigma-Aldrich. Los resultados fueron expresados en mg/100 mL.
2.4. Análisis estadístico
Los análisis estadísticos se realizaron con el software Statgraphics Centurion (Manugistics, Inc., Rockville, MD, EE. UU.). Los datos se sometieron a análisis de varianza (ANOVA) y las medias se compararon mediante la prueba de la diferencia mínima significativa (LSD) (p ≤ 0,05). Además, se efectuó un análisis de componentes principales (PCA) para identificar los componentes que pueden contribuir a la variación entre las diferentes variedades.
www.bibliotecahorticultura.com
3. Resultados y discusión
3.1. Solidos Solubles Totales, Acidez y Taninos Solubles
En el níspero, una de las características sensoriales más valoradas es el equilibrio entre dulzor y acidez. Se ha establecido un contenido mínimo de sólidos solubles totales (SST) en torno a 10 °Brix como estándar de calidad para garantizar un balance dulce-ácido adecuado (Besada et al., 2013; Kurnaz et al., 2023). En el presente estudio, los cultivares ‘Algar 15’, ‘Algar 158’ y ‘Algar 72’ mostraron los valores más elevados de SST, alrededor de 13 °Brix, mientras que ‘Juliana’ y ‘Algerí’ presentaron valores próximos a 10 °Brix (Figura 1a).
En cuanto a la acidez, el valor más alto correspondió a ‘Algar 72’ (1,20 g/100 mL), y el más bajo a ‘Siscar’ (0,68 g/100 mL) (Figura 1b). Estos resultados concuerdan con Kurnaz et al. (2023), quienes señalaron que los niveles de SST y acidez dependen en gran medida del cultivar y constituyen criterios clave de selección varietal en níspero.
En algunos cultivares de níspero, al igual que en otras frutas, la astringencia se asocia al contenido de taninos solubles (TS) (Besada et al., 2013). En el presente estudio, la concentración de TS dependió marcadamente del cultivar (Figura 1c). ‘Algar 158’ y ‘Xirlero’ presentaron los valores más altos (0,06 %), mientras que ‘Algar 5’, ‘Ruchey’ y ‘Siscar’ mostraron los más bajos, próximos a 0,01 %.

Figura 1. Sólidos solubles totales (a), taninos solubles (b) y acidez titulable (c) de 10 cultivares de níspero. Las barras verticales representan los intervalos de diferencia mínima significativa (LSD) (p ≤ 0,05)
3.2. Azúcares, ácidos orgánicos y compuestos fenólicos
Numerosos estudios han demostrado que la glucosa, la fructosa y la sacarosa son los principales azúcares que se acumulan durante la maduración del níspero, si bien su proporción puede variar entre variedades (Ali et al., 2022; Song et al., 2024). En el presente estudio, el azúcar mayoritario en todas las variedades fue la sacarosa, con valores dentro del rango reportado para otros cultivares de níspero (Okatan et al., 2022). La variedad ‘Andrés’ presentó el mayor contenido de sacarosa (63,4 g/L), mientras que ‘Algar 5’, ‘Ruchey’ y ‘Siscar’ registraron las menores concentraciones (36,5 g/L) (Figura 2a). En cuanto a la fructosa, ‘Algar 5’ destacó por su alto contenido (30,03 g/L), y ‘Ruchey’ y ‘Juliana’ mostraron los valores más bajos (13,54 y 14,73 g/L, respectivamente) (Figura 2b). ‘Algar 158’ obtuvo el mayor valor de glucosa (31,61 g/L), mientras que las variedades ‘Juliana’ y ‘Ruchey’ fueron las que presentaron de nuevo los valores más bajos, próximos a 10 g/L (Figura 2c).
El metabolismo de los ácidos orgánicos en los frutos es muy interesante desde un punto de vista fisiológico debido a que suelen acumularse en fases tempranas del desarrollo y posteriormente se utilizan como sustratos respiratorios durante la maduración (Chen et al., 2009). En este trabajo se evaluaron los ácidos málico, cítrico y succínico, identificados en estudios previos como predominantes durante la maduración del níspero (Liu et al., 2024). El ácido málico fue el principal en todas las variedades estudiadas. De forma general, este ácido representa alrededor del 90 % de los ácidos totales en la mayoría de los cultivares de níspero (Dhiman et al., 2022). ‘Algar 72’ y ‘Ruchey’ registraron las mayores concentraciones (1213 y 1171 mg/100 mL, respectivamente), mientras que ‘Siscar’ y ‘Andrés’ presentaron las menores (alrededor de 870 mg/100 mL) (Figura 2d). En cuanto al ácido cítrico, se observaron diferencias más marcadas entre variedades: ‘Algar 158’ alcanzó un valor cercano a 160 mg/100 mL, mientras que ‘Algar 5’ y ‘Siscar’ mostraron 54 y 62 mg/100 mL, respectivamente (Figura 2e). El ácido succínico se detectó en menor proporción en todos los cultivares, con valores desde 14,11 mg/100 mL en ‘Algar 5’ hasta 57 mg/100 mL en ‘Algerí’, ‘Juliana’ y ‘Siscar’ (Figura 2f).
El níspero contiene una amplia gama de compuestos fenólicos cuyas concentraciones dependen en gran medida de factores genéticos y ambientales (Zhang et al., 2023). En el presente estudio, el ácido clorogénico fue el compuesto mayoritario en los 10 cultivares analizados, seguido de los ácidos neoclorogénico y orto-cumárico, en concordancia con estudios previos en níspero (Sagar et al., 2020). También se detectaron trazas de los ácidos 4hidroxibenzoico y cripto-clorogénico, que no se cuantificaron por encontrarse por debajo del límite de detección del HPLC-DAD.
La concentración de ácido clorogénico se situó entre 3 y 49 mg/100 mL (Figura 2g). Los valores más bajos correspondieron a ‘Siscar’ y ‘Algar 5’, mientras que el más elevado se observó en ‘Algar 158’. En cuanto al ácido neoclorogénico, ‘Algar 15’ y ‘Xirlero’ presentaron las mayores concentraciones (en torno a 13 mg/100 mL), y ‘Siscar’ mostró la más baja (4 mg/100 mL) (Figura 2h). Las variedades ‘Juliana’ y ‘Xirlero’ registraron los contenidos más altos de ácido orto-cumárico (0,65 y 0,56 mg/100 mL, respectivamente), mientras que ‘Algar 72’ y ‘Siscar’ destacaron por sus concentraciones más reducidas, próximas a 0,1 mg/100 mL (Figura 2i).
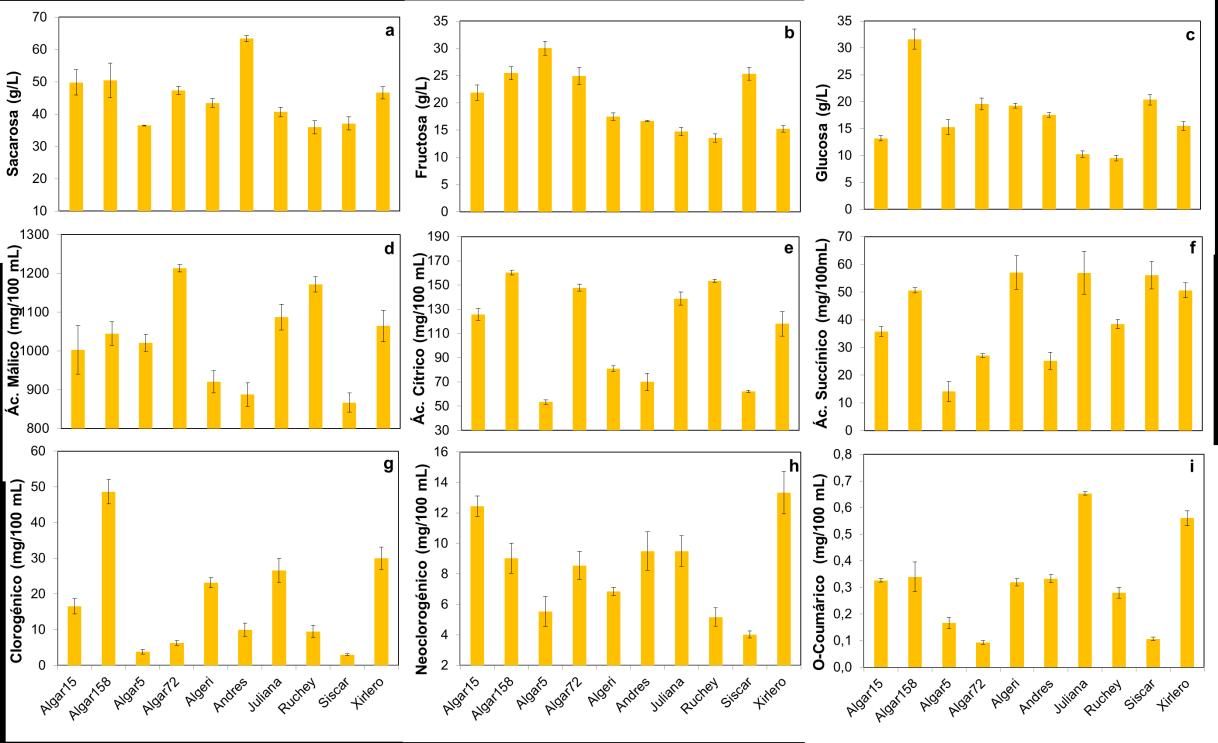
Figura 2. Azúcares individuales (sacarosa (a), fructosa (b) y glucosa (c)); ácidos orgánicos (málico (d), cítrico (e) y succínico (f)) y compuestos fenólicos (ácido clorogénico (g), neoclorogénico (h) y orto-coumárico (i)) de 10 cultivares de níspero. Las barras verticales representan los intervalos de diferencia mínima significativa (LSD) (p ≤ 0,05)
3.3. Análisis de componentes principales
El análisis de componentes principales (PCA) se realizó para identificar las posibles relaciones entre los 10 cultivares y sus patrones de agrupación según sus características fisicoquímicas y nutricionales. Las dos primeras componentes explicaron el 59,7 % de la varianza total (35,3 % y 24,4 % para los componentes 1 y 2, respectivamente). La componente 1 se asoció positivamente principalmente con los compuestos fenólicos (ácidos clorogénico y neoclorogénico), el ácido cítrico, el contenido en TS, y en menor medida con la sacarosa. La componente 2 se relacionó positivamente con los azúcares reductores (glucosa y fructosa) y el contenido en SST, y negativamente con la acidez y el ácido málico (Figura 3).
El análisis permitió separar los cultivares estudiados en cuatro grupos. El primer grupo formado por ‘Algar 5’ y ‘Siscar’, se situó en valores negativos de la componente 1 y se caracterizó por bajas concentraciones de ácido cítrico, TS y compuestos fenólicos, coherentes con perfiles de fenoles y acidez más reducidos. En la zona intermedia un segundo grupo que incluye ‘Algerí’, ‘Algar 72’, ‘Andrés’ y ‘Ruchey’ se situó con valores de la componente 1 cercanos a cero o ligeramente negativos, reflejando concentraciones bajas o intermedias de compuestos fenólicos y TS. En el eje de la componente 2 este grupo mostró un gradiente hacia valores negativos, indicativo de menores concentraciones de glucosa y mayor acidez. Este patrón fue más pronunciado en ‘Ruchey’, que combinó bajo contenido de azúcares con niveles elevados de ácidos cítrico y málico. El tercer grupo, situado hacia la derecha en la componente 1, estuvo formado por ‘Algar 15’, ‘Xirlero’ y ‘Juliana’. Estas variedades se agruparon por presentar valores intermedios a altos de compuestos fenólicos y TS, con una contribución moderada de la sacarosa. Finalmente, ‘Algar 158’ se ubicó en el cuadrante positivo de ambas componentes, destacándose por sus elevados contenidos de TS y ácido clorogénico, el principal compuesto fenólico, así como por una mayor contribución de glucosa y SST.
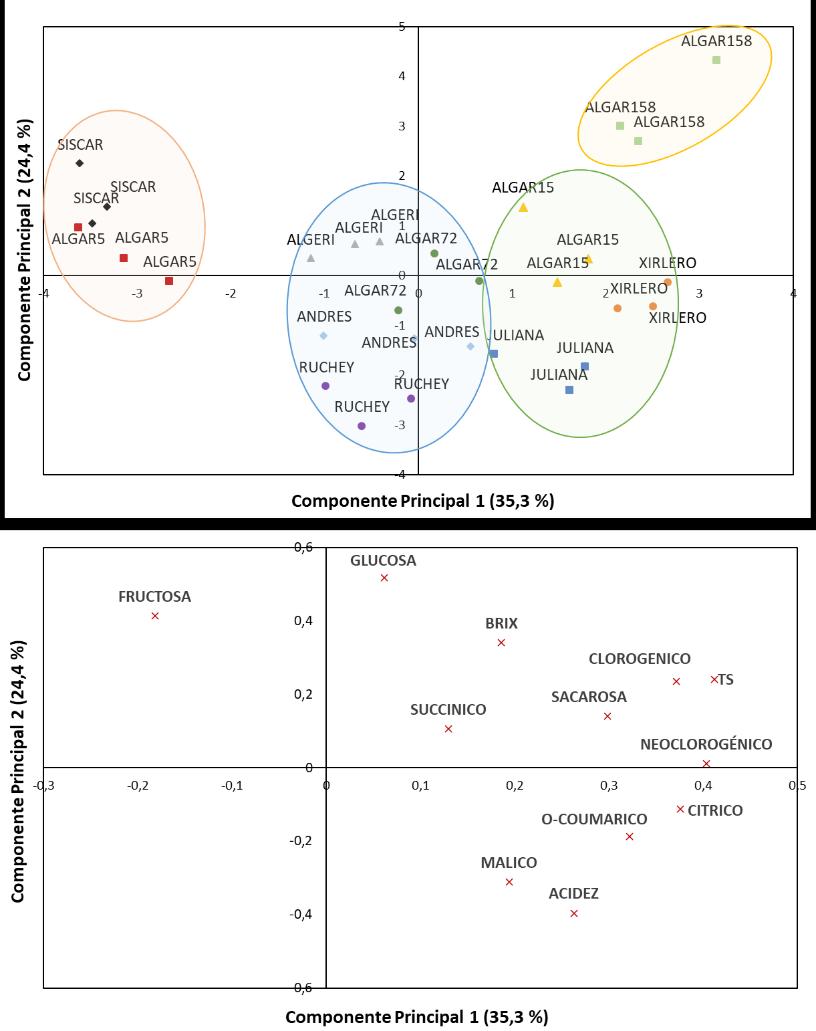
Figura 3. Análisis de componentes principales a partir de los parámetros fisicoquímicos y nutricionales de 10 cultivares de níspero
4. Conclusiones
El presente estudio ofrece una caracterización integral de la calidad fisicoquímica y el perfil nutricional de los 10 cultivares de níspero estudiados, revelando diferencias entre variedades en solidos solubles totales (SST), acidez, taninos solubles (TS), azúcares individuales, ácidos orgánicos y compuestos fenólicos. El estudio permitió, además, identificar cuatro patrones de agrupación entre los cultivares estudiados según sus características fisicoquímicas y nutricionales: 1) ‘Algar 5’ y ‘Siscar’, caracterizados por bajas concentraciones de taninos, compuestos fenólicos y ácido cítrico; 2) ‘Algerí’, ‘Algar 72’, ‘Andrés’ y ‘Ruchey’, con niveles intermedios de fenoles y taninos, y una mayor acidez; Grupo 3) ‘Algar 15’, ‘Xirlero’ y ‘Juliana, con un contenido en fenoles y taninos de intermedios a altos, y elevada concentración de sacarosa; Grupo 4) ‘Algar 158’. destacado por su elevado contenido de taninos y ácido clorogénico, así como por mayores niveles de glucosa y sólidos solubles totales. En conclusión, los resultados obtenidos proporcionan información novedosa y criterios objetivos que pueden orientar los programas de mejora del níspero. Los cultivares que presentan características fisicoquímicas y nutricionales favorables constituyen un material vegetal valioso para la selección y el cruzamiento de nuevas variedades. Asimismo, esta información puede contribuir a optimizar la oferta comercial de níspero en España, adaptándola a las preferencias de consumo y a la calidad nutricional demandada por los consumidores.
www.bibliotecahorticultura.com
Agradecimientos
Este trabajo ha sido financiado por los Proyectos IVIA-GVA 52201 (proyecto cofinanciado por la Unión Europea a través del Programa FEDER 2021-2027 Comunitat Valenciana), CIPROM/021/014 y por el Proyecto 2020/VALORIZA/VSC/002 de la Generalitat Valenciana. Los autores agradecen a la Cooperativa Agrícola de Callosa d'En Sarrià (Alicante, España) por el material vegetal
Bibliografía
Ali, M. M., Anwar, R., Rehman, R. N. U., Ejaz, S., Ali, S., Yousef, A. F., … Chen, F. (2022). Sugar and acid profile of loquat (Eriobotrya japonica Lindl.), enzymes assay and expression profiling of their metabolism-related genes as influenced by exogenously applied boron. Frontiers in Plant Science, 13, 1039360.
Arnal, L., & Del Río, M. A. (2004). Effect of cold storage and removal astringency on quality of persimmon fruit (Diospyros kaki, L.) cv. Rojo Brillante. Food Science and Technology International, 10(3), 179–185.
Besada, C., Gil, R., Sdiri, S., & Salvador, A. (2013). Relationship between external color and physiological changes during loquat maturation. Acta Horticulturae, 1012(1), 193–199.
Besada, C., Sanchez, G., Gil, R., Granell, A., & Salvador, A. (2017). Volatile metabolite profiling reveals the changes in the volatile compounds of new spontaneously generated loquat cultivars. Food Research International, 100, 234–243.
Bermejo, A., Pardo, J., Morales, J., & Cano, A. (2016). Comparative study of bioactive components and quality from juices of different mandarins: Discriminant multivariate analysis of their primary and secondary metabolites. Agricultural Sciences, 7(6), 341-351.
Cai, J., Chen, T., Zhang, Z., Li, B., Qin, G., & Tian, S. (2019). Metabolic dynamics during loquat fruit ripening and postharvest technologies. Frontiers in Plant Science, 10, 619.
Chen, F.-X., Liu, X.-H., & Chen, L.-S. (2009). Developmental changes in pulp organic acid concentration and activities of acid-metabolising enzymes during the fruit development of two loquat (Eriobotrya japonica Lindl.) cultivars differing in fruit acidity. Food Chemistry, 114, 657–664.
Costa, B. P., Ikeda, M., Maciel de Melo, A., Silva Bambirra Alves, F. E., Carpin´e, D., & Hoffmann Ribani, R. (2022). Eriobotrya japonica fruits and its by-products: A promising fruit with bioactive profile and trends in the food application – a bibliometric review. Food Bioscience, 50(B), 102099.
Dhiman, A., Suhag, R., Thakur, D., Gupta, V., & Prabhakar, P. K. (2022). Current status of loquat (Eriobotrya Japonica Lindl.): Bioactive functions, preservation approaches, and processed products. Food Reviews International, 38(1), 286–316.
Gil, R., Salvador, A., Bermejo, A., Navarro, P., & Besada, C. (2018). Evolution of sugars and acids during the maturation of two mutations of ‘Algerí’ loquat. Acta Horticulturae, 1194, 59–66.
Gómez-Martínez, H., Bermejo, A., Zuriaga, E., & Badenes, M. L. (2021). Polyphenol content in apricot fruits. Scientia Horticulturae, 277, 109828.
Kurnaz, O. C., Ozturk, A., Faizi, Z. A., Ates, U., & Ozturk, B. (2023). Pomological, bioactive compounds, and antioxidant activity of selected superior genotypes from a highly diversified loquat population. Genetic Resources and Crop Evolution, 71(4), 1507–1520.
Liu, X., Song, L., Xue, B., Chi, Z., Wang, Y., Wen, S., … Jing, D. (2024). Organic acid and sugar components accumulation and flavor associated metabolites dynamic changes in yellow-and white-fleshed seedless loquats (Eriobotrya japonica). Food Chemistry X, 21, 101046.
Lopez-Lluch, D. B., Cano-Lamadrid, M., Hernández, F., Zimmer, A., Lech, K., Figiel, A., Carbonell-Barrachina, A. A., & Wojdyło, A. (2020). Hydroxycinnamic acids and carotenoids of dried loquat fruit cv. ‘Algar’ affected by freeze-, convective-, vacuum- microwave- and combined-drying methods. Molecules, 25(16), 3643.
Ministerio de Agricultura, Pesca y Alimentación-MAPA. (2024). Encuesta de superficies y producciones de cultivos (datos de frutales no cítricos).
Morales, J., Bermejo, A., Navarro, P., Forner-Giner, M. Á., & Salvador, A. (2021a). Rootstock effect on fruit quality, anthocyanins, sugars, hydroxycinnamic acids and flavanones content during the harvest of blood oranges ‘Moro’and ‘Tarocco Rosso’grown in Spain. Food Chemistry, 342, 128305.
Morales, J., Salvador, A., Besada, C., Navarro, P., & Bermejo, A. (2021b). Physico-chemical, sensorial and nutritional quality during the harvest season of ‘Tango’ mandarins grafted onto Carrizo Citrange and Forner-Alcaide no. 5. Food Chemistry, 339, 127781.
Okatan, V., Kaki, B., Gündes¸li, M. A., Usanmaz, S., Najda, A., Ercis¸li, S., Merto˘glu, K., Mariod, A. A., & Hajizadeh, H. S. (2022). Morphological and biochemical characteristics of wild Loquat (Eriobotrya japonica Lindl.) genotypes in Turkey. Agriculturae Conspectus Scientificus, 87(3), 201–211.
Sagar, N. A., Pareek, S., Bhardwaj, R., & Vyas, N. (2020). Bioactive compounds of loquat (Eriobotrya japonica (Thunb.) L.). In H. Murthy, & V. Bapat (Eds.), Bioactive compounds in underutilized fruits and nuts. Reference Series in Phytochemistry. Cham: Springer.
Song, H. Y., Zhao, K., Pei, Y. G., Chen, H. X., Wang, X. A., Jiang, G. L., … Gong, R. G. (2024). Multi-omics analysis provides new insights into the changes of important nutrients and fructose metabolism in loquat bud sport mutant. Frontiers in Plant Science, 15, 1374925.
Zhang, K., Zhou, J., Song, P., Li, X., Peng, X., Huang, Y., … Deng, Q. (2023). Dynamic changes of phenolic composition, antioxidant capacity, and gene expression in ‘snow white’ loquat (eriobotrya japonica Lindl.) fruit throughout development and ripening. International Journal of Molecular Sciences, 25(1), 80
www.bibliotecahorticultura.com
