
Julia Morales, Juana Ramírez y Almudena Bermejo
Instituto Valenciano de Investigaciones Agrarias (IVIA)

wwww.bibliotecahorticultura.com
Julia Morales1, Juana Ramírez2 y Almudena Bermejo2*
1Centro para el Desarrollo de la Agricultura Sostenible, Instituto Valenciano de Investigaciones Agrarias (IVIA)
2Centro de Citricultura y Producción Vegetal, Instituto Valenciano de Investigaciones Agrarias (IVIA)

Esta obra está bajo una licencia de Creative Commons ReconocimientoNoComercial-SinObraDerivada
Contenido de antocianinas en diferentes variedades de albaricoque de la colección del IVIA
1. Introducción
El albaricoque (Prunus armeniaca L.) pertenece a la familia Rosaceae y es originario de China, aunque se ha adaptado ampliamente a las condiciones del área mediterránea (Ali et al., 2015). En la actualidad se encuentranalbaricoques en los 5 continentes, y a pesar de suamplia difusión geográfica, se trata de una especie con unos requerimientos ecológicos muy concretos, y cada país o región cultiva sus propias variedades (Badenes & Zuriaga, 2016). Se trata de una de las especies mediterráneas más relevantes dentro de los frutales de hueso, debido a su diversidad genética y a la presencia de fitoquímicos que contribuyen significativamente a sus propiedades beneficiosas para la salud, su alto valor nutricional y sus apreciadas características sensoriales (Dulf et al., 2017; Göttingerová et al., 2021). El estudio del perfil metabolómico del albaricoque puede proporcionar información valiosa sobre las rutas bioquímicas subyacentes a sus atributos de calidad, lo que podría facilitar la selección de cultivares con características agronómicas y funcionales deseables (Ortuño-Hernández et al., 2025). Diversos estudios han demostrado que los frutos de albaricoque contienen cantidades apreciables de compuestos fenólicos, lo que incrementa su valor como alimento funcional (Ali et al., 2015). Estos compuestos incluyen flavonoides con diferentes estructuras químicas― particularmenteflavonoles y antocianinas (en especial en las variedades de color rojo más intenso) ―, así como compuestos no flavonoides como los ácidos clorogénico y neoclorogénico (Ali et al., 2015; Dulf et al., 2017). Los niveles de estos compuestos varían considerablemente según el cultivar y los tejidos estudiados de la fruta (piel o pulpa); en general, la acumulación de compuestos fenólicos es notablemente mayor en los tejidos externos del fruto (Schmitzer et al., 2011; Veberic et al., 2005). Todos estos compuestos están interrelacionados a través de la ruta del ácido shikímico, una vía metabólica esencial en las plantas que constituye la base para la síntesis de diversos metabolitos secundarios, incluidos los ácidos fenólicos y los flavonoides (Figura 1) (Liga et al., 2023; Paul et al., 2023). Los ácidos fenólicos derivan de la ruta de los fenilpropanoides, que se inicia con la desaminación de la fenilalanina― producto de la ruta del ácido shikímico―, generando ácido cinámico, ácido 4-cumárico y, posteriormente, 4-cumaril-CoA. Este último constituye un precursor clave en la biosíntesis de flavonoides, al originar el esqueleto de la chalcona e iniciar la ruta de los flavonoides, de la que derivan distintas clases de compuestos, como flavanonas, dihidroflavonoles, flavonoles y antocianinas, dependiendo del grado de oxidación, saturación y sustitución aromática (Liga et al., 2023; Paul et al., 2023).
Los compuestos fenólicos desempeñan funciones fisiológicas esenciales en las plantas, incluyendo la respuesta frente a factores de estrés abiótico (como sequía y salinidad), la pigmentación y, además, su capacidad antioxidante ayuda a mitigar el estrés oxidativo con importantes implicaciones tanto en la agricultura como en la nutrición humana (Khan et al., 2025). En este sentido, se ha demostrado que los polifenoles exhiben una amplia gama de beneficios para la salud, entre ellos la capacidad de neutralizar radicales libres, la protección y regeneración de otros antioxidantes dietéticos, incluso la quelación de metales prooxidantes (Lima et al., 2014). Dichas propiedades se asocian con efectos beneficiosos para la salud, como actividadanticancerígena, cardioprotectora y antiviral (Yaoetal., 2004). Enconsecuencia, existe un creciente interés en los polifenoles debido a su estrecha relación con la calidad de la fruta y su potencial impacto en la dieta humana, particularmente por su elevada capacidad antioxidante.
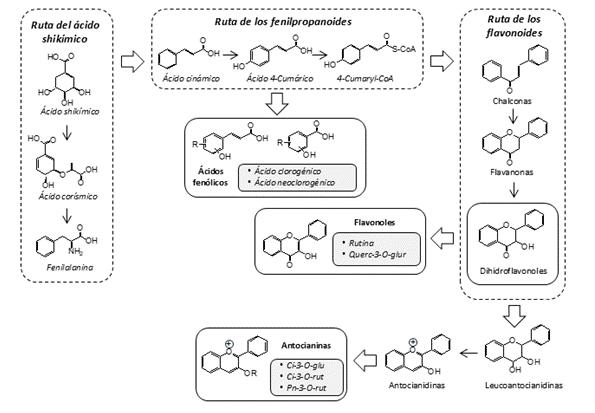
Figura 1. Esquema general de las principales etapas de la ruta de biosíntesis de compuestos fenólicos (Liga et al., 2023; Paul et al., 2023): Ci-3-O-glu, cianidina-3-O-glucósido; Ci-3-O-rut, cianidina-3-Orutinósido; Pn-3-O-rut, peonidina-3-O-rutinósido; Querc-3-O-glur, quercetina-3-O-glucurónido
Numerosos estudios han puesto de manifiesto la amplia variabilidad del contenido de compuestos bioactivos en los albaricoques en función del cultivar y del origen geográfico. En las dos regiones productoras de albaricoquero más importantes de España, Región de Murcia y Comunidad Valenciana, se desarrollan programas públicos de mejora de la especie desde hace más de un cuarto de siglo (Badenes & Zuriaga, 2016). Durante años, el Instituto Valenciano de Investigación Agraria (IVIA) en Moncada (Valencia, España) ha llevado a cabo un programa de mejora genética orientado a la obtención de nuevos genotipos de albaricoque resistentes al virus de la Sharka (PPV), una de las enfermedades más devastadoras de las especies de Prunus (Badenes et al., 2018; Llácer, 2000; Martínez-Calvo et al., 2009]. Tras la aparición de la Sharka y su difusión en Europa, la mayor parte de los programas de mejora incluyeron como su principal objetivo la obtención de variedades resistentes, utilizando variedades norteamericanas resistentes y variedades autóctonas, con el fin de introgresar la resistencia sin perder la adaptabilidad y las características del material autóctono (Badenes & Zuriaga, 2016). Entre los híbridos obtenidos, se han seleccionado diversos cultivares de posible interés comercial por su buen rendimiento agronómico, con frutos de buen calibre y calidad gustativa. No obstante, la introducción de resistencia al PPV en los albaricoques puede afectar la calidad del fruto y su adaptabilidad a las condiciones mediterráneas. Badenes et al. (2018) observaron que, entre los cultivares resistentes al PPV, ‘Goldrich’ mostraba la mejor adaptación al clima mediterráneo, motivo por el que se ha empleado este genotipo como principal donante de resistencia en el programa de mejora del IVIA. En estudios previos, Gómez-Martínez et al. (2021a, 2021b) determinaron que ‘Goldrich’ contribuía significativamente al contenido de flavonoles y ácidos
Contenido de antocianinas en diferentes variedades de albaricoque de la colección del IVIA
fenólicos mayoritarios en las accesiones evaluadas, sugiriendo su idoneidad en el programa de mejora. Sin embargo, en dichos trabajos no se evaluó el contenido de antocianinas.
Los polifenoles, y en particular las antocianinas, desempeñan un papel crucial en diversos mecanismos de las plantas y son cada vez más valorados en la nutrición humana, siendo por ello indicadores clave de la calidad de la fruta (Lakshmikanthan et al., 2024; Saini et al., 2024). En este contexto, el presente estudio tuvo como objetivo cuantificar las antocianinas mayoritarias en los nuevos genotipos de albaricoque desarrollados a través del programa de mejora del IVIA. Los resultados confirman el potencial del cultivar ‘Goldrich’ como valiosa fuente parental para aumentar el contenido de antioxidantes, y en consecuencia, contribuir así a mejorar la calidad del fruto. Se llevó a cabo una extracción rápida a escala de laboratorio de compuestos fenólicos mediante métodos asistidos por ultrasonidos, y el análisis cromatográfico se realizó mediante cromatografía líquida de ultra alta resolución (UHPLC) acoplada a un detector de masas y detector de diodos. Se analizaron doce cultivares de albaricoque seleccionados resistentes al PPV, centrándose el estudio en la piel del fruto, principal fuente de polifenoles en el albaricoque
2. Material y métodos
2.1. Material vegetal
El material vegetal, proporcionado por el Grupo de Frutales del Centro de Citricultura y Producción vegetal del IVIA, consistió en un conjunto de cultivares y selecciones del Programa de Mejora Genética del IVIA (Badenes et al., 2018; Martínez-Calvo et al., 2009). Dos cultivares mediterráneos (‘Canino’ y ‘Mitger’); una variedad norteamericana (‘Goldrich’); y nueve híbridos del programa demejora: ‘Dama rosa’ (‘Goldrich’ x ‘Ginesta’), ‘Dama taronja’ (‘Goldrich’ x ‘Katy’), ‘GG9310’ (‘Goldrich’ x ‘Ginesta’), ‘GG979’ (‘Goldrich’ x ‘Ginesta’), ‘GP9817’ (‘Goldrich’ x ‘Palau’), ‘HG9821’ (‘Harcot’ x ‘Ginesta’), ‘HG9850’ (‘Harcot’ x ‘Ginesta’), ‘HM964’ (‘Harcot’ x ‘Mitger’) y ‘SEOP934’ (‘Seo x Palau’). ‘Goldrich’, utilizado como principal donante de resistencia al PPV en el programa de mejora, es uno de los progenitores en la mayoría de los híbridos resistentes obtenidos, mientras ‘Canino’ y ‘Mitger’, son dos variedades autóctonas utilizadas para la introgresión de la adaptabilidada las condiciones mediterráneas (Gómez-Martínez et al., 2021a, 2021b].
Los albaricoques se recogieron aleatoriamente en su punto óptimo de madurez comercial, concretamente en la fase de maduración “listos para el consumo”, con sus características sensoriales y de color óptimas, a principios de junio de 2023. Tras cada recolección (5 frutos por árbol), los frutos se transportaron al IVIA donde se realizaron análisis fisicoquímicos, la piel de cada fruto se separó con un pelador, y las muestras se congelaron con nitrógeno líquido, se liofilizaron, se trituraron y pulverizaron, conservándose a −80 °C hasta su procesamiento para la extracción y análisis de biocomponentes.
2.2. Extracción y análisis de antocianinas
Las antocianinas mayoritarias se extrajeron disolviendo 100 mg de la muestra seca y pulverizada en 0,5 mL de una solución de metanol con un 3 % de ácido fórmico y 0,5 % de 2,6-di-terc-butil4-metilfenol (BHT). La mezcla se agitó y se extrajo mediante ultrasonidos durante 1 h a 20 °C y las mezclas resultantes se centrifugaron a 4 °C durante 30 min a 12000 rpm. El precipitado se
descartó y los sobrenadantes se filtraron a través de un filtro de nailon de 0,45 μm, se transfirieron a viales de cromatografía y se almacenaron a −20 °C hasta su análisis por UHPLC.
Las muestras fueron analizadas mediante un sistema ultra-cromatografía líquida de alta resolución (UHPLC) equipado con módulos de separación Vanquish, detectores de diodos y de espectrometría de masas de triple cuadripolo TSQ Fortis (Thermo Fisher Scientific, Madrid, España), utilizando una columna Acquity Premier HSS T3 C18 (100 × 2,1 mm, 1,8 μm, Waters), y el software Chromeleon, versión 7.3, para el tratamiento de datos cromatográficos.
Los compuestos individuales se identificaron comparando sus tiempos de retención, espectros UV-Vis y datos de espectrometría de masas con estándares auténticos y se cuantificaron utilizando una curva de calibración externa. Se analizaron tres réplicas por muestra y los resultados se expresaron en mg∙100 g 1 de peso seco (PS). Las concentraciones se determinaron mediante una curva de calibración externa con estándares auténticos de cianidina-3-Oglucósido (Ci-3-O-glu) y cianidina-3-O-rutinósido (Ci-3-O-rut); peonidina-3-O-rutinósido (Pn-3-Orut), debido a la falta de disponibilidad del estándar, se cuantificó como equivalentes de Ci-3-Orutinósido.
Por otra parte, el contenido total de compuestos fenólicos se determinó mediante el sumatorio de las antocianinas individuales (Ci-3-O-glu, Ci-3-O-rut y Pn-3-O-rut), flavonoles individuales (rutina y quercetina-3-O-glucurónido) y ácidos fenólicos individuales (ácidos clorogénico y neoclorogénico), determinadas mediante UHPLC. En todos los casos la cuantificación se realizó en UHPLC mediante calibración con los patrones correspondientes, y para el tratamiento de datos se utilizó el software Chromeleon, versión 7.3. Todos los solventes empleados fueron de calidad UHPLC-MC.
2.3. Análisis estadístico
Los análisis estadísticos se realizaron con Statgraphics Centurion (versión 18, Manugistics Inc., Rockville, MD, EE. UU.). Todos los datos se sometieron a un análisis de varianza y las medias se compararon mediante una prueba LSD con un nivel de significación de p ≤ 0,05
3. Resultados y discusión
El albaricoque, apreciado por su alta calidad organoléptica, también destaca por su contenido en compuestos fenólicos, los cuales contribuyen tanto a sus propiedades nutricionales como a sus potenciales beneficios para la salud. Los compuestos fenólicos son metabolitos secundarios esenciales en las plantas, implicados en una amplia gama de funciones fisiológicas, y son considerados una de las principales fuentes de antioxidantes de la fruta fresca. Numerosos estudios han descrito la presencia de metabolitos fenólicos en el albaricoque, observándose concentraciones notablemente más elevadas de ácidos fenólicos y flavonoles en la piel que en la pulpa. Además, sehandetectadodiferencias significativas entrecultivares, loquesugiereque, desde el punto de vista nutricional, resulta recomendable el consumo del fruto con piel o su aprovechamiento íntegro en la industria transformadora (Ruiz, et al., 2005; Schmitzer, et al., 2011; Veberic et al., 2005).
La composición fenólica del albaricoque se ha estudiado ampliamente mediante diferentes técnicas de extracción, y diversos autores han señalado que parámetros como el pH y el tipo de
Contenido de antocianinas en diferentes variedades de albaricoque de la colección del IVIA
disolvente influyen notablemente en la eficiencia de extracción de los polifenoles, en particular de las antocianinas (Taghavi et al., 2023). Por ejemplo, Iglesias-Carres et al. (2019) optimizaron un protocolo de extracción con metanol y ácido fórmico que permitió caracterizar con precisión el perfil fenólico del albaricoque. En investigaciones previos, nuestro grupo utilizó una mezcla de metanol y dimetilsulfóxido para extraer compuestos fenólicos, cuantificando flavonoles y ácidos fenólicos mayoritarios. No obstante, bajo estas condiciones de extracción, no se detectaron antocianinas en la piel de albaricoque en cantidades suficientes (Gómez-Martínez et al., 2021a, 2021b). En el presente estudio, se empleó una solución metanólica acidificada y un proceso de extracción rápida asistido por ultrasonidos a escala de laboratorio, seguido de un análisis cromatográfico por UHPLC de fase reversa en muy poco tiempo. Este procedimiento permitió la detección y cuantificación eficiente de antocianinas, sin alterar el perfil fenólico previamente descrito por Gómez-Martínez et al. (2021a, 2021b).
La identificación de antocianinas resulta particularmente compleja debido a la gran diversidad estructural de estos compuestos, la disponibilidad limitada de estándares analíticos y las diferencias en las condiciones experimentales entre estudios, lo que dificulta la comparación directa entre matrices alimentarias (Wu et al., 2005). En este trabajo, la separación se realizó mediante UHPLC de fase reversa, y la identificación de los compuestos se basó en los espectros UV-Vis, los datos de espectrometría de masas y la comparación con referencias bibliográficas y estándares auténticos. El análisis cromatográfico mostró un perfil fenólico similar en todos los cultivares, aunque con una notable variabilidad cuantitativa. Esta variabilidad probablemente se deba a diferencias genéticas entre los genotipos analizados, dado que los materiales estudiados proceden de cruzamientos con progenitores de distinto origen genético.
Las antocianinas desempeñan un papel importante en la variación del color de la piel y son responsables de su coloración característica, especialmente en las variedades de tonos más rojizos. Si bien los albaricoques son ricos en compuestos fenólicos, los estudios centrados en su contenido en antocianinas son aún escasos en comparación con otras especies del género Prunus (Bureau et al., 2009; Huang et al., 2019; Jang et al., 2018; Wu et al., 2005). En frutas como cerezas dulces, melocotones o nectarinas, las principales antocianinas son la Ci-3-O-glu o Ci-3-O-rut, dependiendo de la fruta, junto con componentes minoritarios como los glucósidos de pelargonidina o peonidina (Wu et al., 2005). Se observaron diferencias cuantitativas en las concentraciones de antocianinas entre los 12 cultivares de albaricoque estudiados (Figura 2). De manera similar con lo descrito por Bureau et al. (2009) y Ruiz et al. (2005), nuestros resultados confirmaron que Ci-3-O-rut fue la antocianina mayoritaria en todos los genotipos estudiados, seguida de Ci-3-O-glu y, en menor proporción, de Pn-3-O-rut. El cromatograma UHPLC de los extractos de piel de albaricoque, registrado a 550 nm, mostró tres picos principales correspondientes a estas moléculas, con longitudes de onda máximas de absorción en el rango de 515–520 nm.
Entre las variedades evaluadas, ‘SEOP934’ (‘Seo’ × ‘Palau’) presentó el contenido más elevado de Ci-3-O-rut (alrededor de 25.00 mg∙100 g 1 PS), seguida de ‘GG979’ (‘Goldrich’ × ‘Ginesta’) y ‘Mitger’ (Desconocido) consecutivamente (Figura 2), con diferencias significativas entre ellas. Por el contrario, ‘Canino’ presentó los niveles más bajos de Ci-3-O-rut, cercano a 0.50 mg∙100 g 1 PS (Figura 2). Estos resultados concuerdan con los valores reportados para variedades de albaricoque rojo (Bureau et al., 2009). Las concentraciones de Ci-3-O-glu siguieron una
tendencia similar, lo que refuerza la relación biosintética entre ambas moléculas. En este caso, ‘SEOP934’, ‘GG979’ y ‘Mitger’ fueron también los cultivares con mayor contenido de antocianinas, con pocas variaciones, dado que ‘Mitger’ fue el cultivar con los niveles más altos. El contenido en estos cultivares osciló alrededor de 6.00 y 9.00 mg∙100 g 1 PS. La concentración más baja también se observó en ‘Canino’, que carecía notablemente de Ci-3-O-glu detectable. Estos resultados confirman la alta dependencia entre estos dos compuestos también en los cultivares de albaricoque. Finalmente, se identificó Pn-3-O-rut solo en cantidades traza y no estuvo presente en todas las variedades. No obstante, fue también el cultivar ‘SEOP934’ el que presentó la mayor cantidad.

Figura 2. Concentraciones de antocianinas (mg · 100 g-1 PS) en piel de albaricoque. Los resultados se expresan como la media (n = 3); diferentes letras minúsculas en cada fila indican valores significativamente diferentes. ND: no detectado. Ci-3-O-glu, cianidina-3-O-glucósido; Ci-3-O-rut, cianidina-3-O-rutinósido; Pn-3-O-rut, peonidina-3-O-rutinósido; (1) Identificados usando estándares auténticos; (2) Cuantificado como equivalentes de Ci-3-O-glu
Las especies de albaricoque presentan una gran variabilidad en el color de la cáscara, que va del blanco al naranja y a un intenso rubor rojo. La relación entre los niveles de antocianinas y la coloración externa e interna del fruto ya se ha descrito, observándose que las concentraciones de antocianinas están fuertemente influenciadas por factores genéticos (Bureau et al., 2009; Huang etal., 2019). En este sentido, considerando el contenido total de antocianinas (sumatorio de antocianinas individuales), se ha encontrado que ‘SEOP94’ presentó la mayor concentración total de antocianinas (superior a 35.00 mg∙100 g 1 PS), seguida de ‘Mitger’ y de ‘GG979’ (cercano a 30.00 mg∙100 g 1 PS). No obstante, entre estos tres cultivares, el progenitor no coincidía en ningún caso, y todas estas variedades mostraron colores de cáscara que variaban de amarillentos a naranjas, según Gómez-Martínez et al. (2021c) y también mostró una intensidad de oscura a media en un color que va del rosa al púrpura. Además, el efecto inconsistente del progenitor también se aprecia en los cultivares donde los progenitores son los mismos: ‘GG9310’/‘GG979’/‘Dama rosa’ (‘Goldrich’ × ‘Ginesta’) y ‘HG9850’/’HG9821’ (‘Harcot’ × ‘Ginesta’). Entre cada grupo de cultivares, siempre hubo diferencias significativas en las antocianinas determinadas. Por otro lado, cabe destacar la relevancia de combinar el progenitor
Contenido de antocianinas en diferentes variedades de albaricoque de la colección del IVIA
‘Goldrich’ con ‘Ginesta’ (‘Dama rosa’, ‘GG9310’, ‘GG979’), ya que todas estas combinaciones aumentan las concentraciones de antocianinas en la cáscara del albaricoque. Por el contrario, las variedades restantes con niveles más bajos de antocianinas eran predominantemente de color amarillo verdoso, a excepción de la variedad ‘Goldrich’, que presentaba una piel anaranjada según Gómez-Martínez et al. (2021c). Curiosamente, incluso pequeñas cantidades de antocianinas influyen significativamente en la coloración de la piel del albaricoque. Esto pone de relieve la importancia de estos compuestos no solo para definir la calidad de la fruta, sino también para realzar el atractivo estético y nutricional de los albaricoques. Asimismo, el contenido total de compuestos fenólicos varió ampliamente entre los cultivares, y los resultados de este estudio mostraron que ‘Goldrich’ contribuye significativamente al aumento de compuestos polifenólicos en comparación con los demás cultivares estudiados (Figura 3). Los cultivares ‘GG9310’ y ‘GG979’ presentaron los valores más elevados, cercanos a 700 y 800 mg∙100 g 1 PS en piel, respectivamente. Este hecho corrobora que el cruzamiento de los parentales ‘Goldrich’ con ‘Ginesta’ puede potenciar la ruta del ácido shikímico eincrementar el perfil fenólico de los frutos de albaricoque, dominado por la rutinas y los ácidos neoclorogénico y clorogénico. Sin embargo, esto no se repite en todos los casos, como se observa en el cultivar ‘Dama rosa’. Por otro lado, ‘Mitger’ y ‘HG9850’, dos cultivares no relacionados con ‘Goldrich’ como donante, mostraron los niveles más bajos, inferiores a 300 mg∙100 g 1 PS (Figura 3). Curiosamente, aparte de ‘GG979’, no se observó una correlación fuerte entre un alto contenido total de fenólicos y altos niveles de antocianinas. Esto sugiere que, si bien tanto los ácidos fenólicos como los flavonoles contribuyen significativamente al perfil fenólico total, su abundancia no predice necesariamente el contenido de antocianinas, y posiblemente respondan de manera independiente a la regulación genética y ambiental.
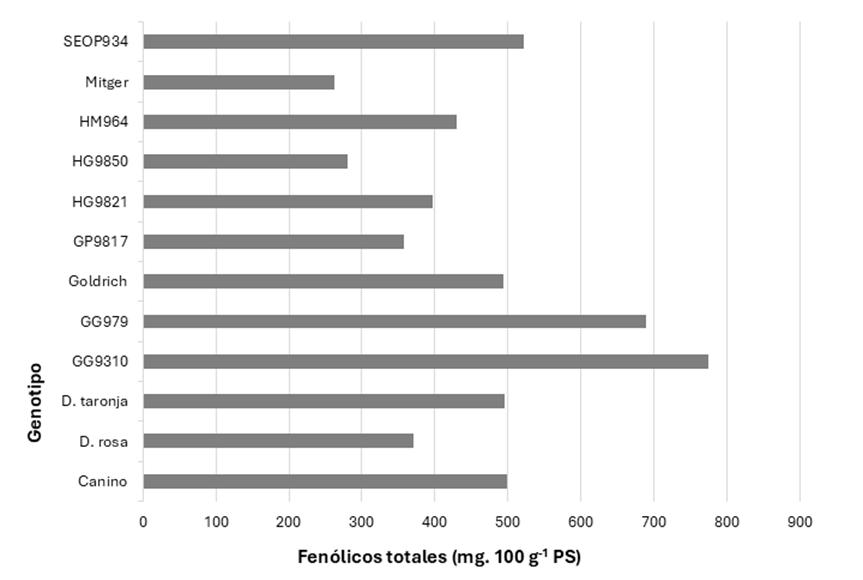
Figura 3. Concentración de compuestos fenólicos totales (mg · 100 g-1 PS) en piel de albaricoque, cuantificados como sumatorio de antocianinas individuales (Ci-3-O-glu, Ci-3-O-rut y Pn-3-O-rut), flavonoles individuales (rutina y quercetina-3-O-glucurónido) y ácidos fenólicos individuales (ácidos clorogénico y neoclorogénico)
4. Conclusiones
En resumen, la composición fenólica de los genotipos de albaricoque analizados depende en gran medida del componente genético, lo que confirma la alta diversidad entre cultivares. El cultivar ‘Goldrich’, empleado como progenitor donante de resistencia al virus de la Sharka (PPV) en el programa de mejora del IVIA, mostró una contribución significativa al contenido total de polifenoles en sus descendientes, aunque este efecto no fue uniforme en todos los cruzamientos. La piel del albaricoque se confirma como una excelente fuente de compuestos nutracéuticos, en particular de antocianinas, entre las que destacan la cianidina-3-O-rutinósido y la cianidina-3-O-glucósido como compuestos predominantes. Estas moléculas no solo determinan la coloración de la piel un rasgo de interés comercial y estético , sino que también contribuyen al valor antioxidante y funcional de la fruta, lo que subraya su potencial para aplicaciones enfocadas en la salud. Los resultados de este estudio proporcionan información útil para la selección de cultivares con perfiles fenólicos deseables, lo que podría orientarse tanto al desarrollo de nuevas variedades con mayor calidad funcional como al establecimiento de marcadores de autenticidad y calidad en los programas de mejora genética y en la industria agroalimentaria.
Agradecimientos
Este trabajo ha sido financiado a través del proyecto IVIA-GVA 52201 del Instituto Valenciano de Investigaciones Agrarias (IVIA), cofinanciado por la Unión Europea a través del Fondo de Desarrollo Europeo Regional (ERDF) Programa 2021–2027 de la Generalitat Valenciana. Los autores agradecen al Grupo de Frutales del Centro de Citricultura y Producción Vegetal del IVIA, su ayuda desinteresada y el material vegetal utilizado en este estudio
Bibliografía
Ali, S., Masud, T., Abbasi, S.K., Mahmood, T., Hussain, A., (2015). Apricot: Nutritional potentials and health benefits-a review. Ann. Food Sci. Technol., 16, 175–189.
Badenes, M. L., Zuriaga, E., (2016). 13. Frutales de hueso. En Las variedades locales en la mejora genética de plantas, pp. 239–258
Badenes, M.L., Martínez-Calvo, J., Gómez, H., Zuriaga, E., (2018). ‘Dama Taronja’ and ‘Dama Rosa’ apricot cultivars that are resistant to sharka (Plum pox virus). HortScience, 53, 1228–1229. https://doi.org/10.21273/HORTSCI13155-18
Bureau, S., Renard, C.M.G.C., Reich, M., Ginies, C., Audergon, J.M., (2009). Change in anthocyaninconcentrations inredapricotfruits during ripening. LWT-FoodSci. Technol., 42, 373–377. https://doi.org/10.1016/j.lwt.2008.03.010
Dulf, F.V., Vodnar, D.C., Dulf, E.H., Pintea, A., (2017). Phenolic compounds, flavonoids, lipids and antioxidant potential of apricot (Prunus armeniaca L.) pomace fermented by two filamentous fungal strains in solid state system. Chem. Cent. J., 11, 92. https://doi.org/10.1186/s13065-017-0323-z
Contenido de antocianinas en diferentes variedades de albaricoque de la colección del IVIA
Gómez-Martínez, H., Bermejo, A., Zuriaga, E., Badenes, M.L., (2021a). Polyphenol content in apricot fruits. Sci. Hortic., 277, 109828. https://doi.org/10.1016/j.scienta.2020.109828
Gómez-Martínez, H., Gil-Munoz, F., Bermejo, A., Zuriaga, E., Badenes, M.L., (2021b). Insights of phenolic pathway in fruits. Transcriptional and metabolic profiling in apricot (Prunus armeniaca). Int. J. Mol. Sci., 22, 3411. https://doi.org/10.3390/ijms22073411
Gómez-Martínez, H., Bermejo, A., Zuriaga, E., Badenes, M.L., (2021c). Nutraceutical profiles of apricots (Prunus armeniaca L.) as a source of fruit quality traits for breeding. Span. J. Agric. Res., 19, e0703. https://doi.org/10.5424/sjar/2021194-18331
Göttingerová, M., Kumsta, M., Rampackova, E., Kiss, T., Necas, T., (2021). Analysis of Phenolic Compounds and Some Important Analytical Properties in Selected Apricot Genotypes. Hortscience, 56, 1446–1452. https://doi.org/10.21273/HORTSCI16139-21
Huang, H., Wang, Q., Xia, L., Hui, J., Li, J., Feng, Y., Chen, Y., (2019). Preliminarily exploring of the association between sugars and anthocyanin accumulation in apricot fruit during ripening. Sci. Hortic., 248, 112–117. https://doi.org/10.1016/j.scienta.2019.01.012
Iglesias-Carres, L., Mas-Capdevila, A., Bravo, F.I., Bladé, C., Arola-Arnal, A., Muguerza, B., (2019). Optimization of extraction methods for characterization of phenolic compounds in apricot fruit (Prunus armeniaca). Food Funct., 10, 6492–6502. https://doi.org/10.1039/c9fo00353c
Jang, G.H., Kim, H.W., Lee, M.K., Jeong, S.Y., Bak, A.R., Lee, D.J., Kim, J.B., (2018). Characterization andquantification of flavonoidglycosides in the Prunus genus by UPLCDAD-QTOF/MS. Saudi J. Biol. Sci., 25, 1622–1631. https://doi.org/10.1016/j.sjbs.2016.08.001
Khan, A., Kanwal, F., Ullah, S., Fahad, M., Tariq, L., Altaf, M.T., Riaz, A., Zhang, G., (2025). Plant secondary metabolites Central regulators against abiotic and biotic stresses. Metabolites, 15, 276. https://doi.org/10.3390/metabo15040276
Lakshmikanthan, M., Muthu, S., Krishnan, K., Altemimi, A. B., Haider, N. N., Govindan, L., Selvakumari, J., Alkanan, Z.T., Cacciola, F., Francis, Y. M. (2024). A comprehensive review on anthocyanin-rich foods: Insights into extraction, medicinal potential, and sustainable applications. J. Agr. Food Res., 17, 101245. https://doi.org/10.1016/j.jafr.2024.101245
Liga, S., Paul, C., Peter, F., (2023). Flavonoids: Overview of biosynthesis, biological activity, and current extraction techniques. Plants, 12, 2732. https://doi.org/10.3390/plants12142732
Lima, G.P.P., Vianello, F., Correa, C.R., Campos, R.A.D.S., Borguini, M.G., (2014). Polyphenols in fruits and vegetables and its effect on human health. Food Nutr. Sci., 5, 1065–1082. https://doi.org/10.4236/fns.2014.511117
Llácer, G., (2000). La elección de variedades de albaricoque en la Comunidad Valenciana. Comunitat Valenciana Agraria, (17), 26-32.
Martínez-Calvo, J., Font, A., Llácer, G., Badenes, M.L., (2009). Apricot and peach breeding programs from the IVIA. In XII EUCARPIA Symposium on Fruit Breeding and Genetics,
ISHS Acta Horticulturae (Vol. 814, pp. 185–188). https://doi.org/10.17660/ActaHortic.2009.814.23
Ortuño-Hernández, G., Silva, M., Toledo, R., Ramos, H., Reis-Mendes, A., Ruiz, D., MartínezGómez, P., Ferreira, I.M.P.L.V.O., Salazar, J.A., (2025). Nutraceutical Profile Characterization in Apricot (Prunus armeniaca L.) Fruits. Plants, 14, 1000. https://doi.org/10.3390/plants14071000.
Paul, A., Acharya, K., Chakraborty, N., (2023). Involvement of Phenylpropanoid pathway and Shikimic acid pathway in environmental stress response. In Biology and Biotechnology of Environmental Stress Tolerance in Plants; Roychoudhury, A., Ed.; Apple Academic Press, Inc.: Palm Bay, FL, USA; CRC Press (Taylor & Francis): Boca Raton, FL, USA (Vol. 1, pp. 27–66).
Ruiz, D., Egea, J., Gil, M.I., Tomás-Barberán, F.A., (2005). Characterization and quantitation of phenolic compounds in new apricot (Prunus armeniaca L.) varieties. J. Agric. Food Chem., 53, 9544–9552. https://doi.org/10.1021/jf051539p
Saini, R. K., Khan, M. I., Shang, X., Kumar, V., Kumari, V., Kesarwani, A., Ko, E. Y. (2024). Dietary sources, stabilization, health benefits, and industrial application of anthocyanins A review. Foods, 13(8), 1227. https://doi.org/10.3390/foods13081227
Schmitzer, V., Slatnar, A., Mikulic-Petkovsek, M., Veberic, R., Krskab, B., Stampar, F., (2011). Comparative study of primary and secondary metabolites in apricot (Prunus armeniaca L.) cultivars. J. Sci. Food. Agric., 91, 860–866. https://doi.org/10.1002/jsfa.4257
Taghavi, T., Patel, H., Rafie, R., (2023). Extraction Solvents Affect Anthocyanin Yield, Color, and Profile of Strawberries. Plants, 12, 1833. https://doi.org/10.3390/plants12091833
Veberic, R., Stampar, F., (2005). Selected polyphenols in fruits of different cultivars of genus Prunus. Phyton Ann. Rei Botan., 45, 375–383.
Wu, X., Prior, R.L., (2005). Systematic Identification and Characterization of Anthocyanins by HPLC-ESI-MS/MS in Common Foods in the United States: Fruits and Berries. J. Agric. Food Chem., 53, 2589–2599. https://doi.org/10.1021/jf048068b
Yao, L.H., Jiang, Y.M., Shi, J., Tomás-Barberán, F.A., Datta, N., Singanusong, R., Chen, S.S., (2004). Flavonoids in food and their health benefits. Plant Foods Hum. Nutr., 59, 113–122. https://doi.org/10.1007/s11130-004-0049-7

ESPECIALISTES EN SERVEIS PER A LA PRODUCCIÓ EDITORIAL, SL
Doctor Manuel Candela 26, 11ª 46021 VALENCIA – ESPAÑA
Tel.: +34-649 48 56 77 / info@poscosecha.com NIF: B-43458744
www.poscosecha.com www.postharvest.biz www.bibliotecahorticultura.com www.tecnologiahorticola.com www.actualfruveg.com
