LIZENTZIA
2
J. M. Vílchez González, A. M.a Morales Cas, G. Villalobos Galdeano

FISIKA ETA KIMIKA
12HILEKO
PROIEKTU DIGITALA DAUKA
DBH Munduahelburu LAGINA
Aurkibidea
Metodologia zientifikoa
Zoro baten hipotesia ala aitzindari batena?
1. Ezagutza zientifikoa
2. Aldaketa fisikoak eta kimikoak
3. Magnitude fisikoak. Unitateak eta neurria
4. Zientziaren hizkuntza
5. Laborategiko materiala. Segurtasunarauak
6. Zientzia, teknologia eta gizartea
Jolaserako zientzia
Txosten zientifikoa. Elur-panpina
Lan praktikoa
Neurketen erroreak
1 Materia
Dekantazioa erromaren garaian
1. Materiaren propietateak
2. Substantzia puruak eta nahasteak
3. Egoera likidoko disoluzioak
4. Nahasteak bereizteko teknikak
5. Esekidurak eta koloideak
Jolaserako zientzia
Solidoa ala likido likatsua?
Lan praktikoa
Disoluzioa, koloidea edo esekidura?
Amaitzeko
2 A gregazio-egoerak
Berotegi-efektuko gasak
1. Agregazio-egoeren ezaugarriak
2. Materiaren teoria zinetikoa, TZM
3. Presioa eta tenperatura
4. Gasen legeak
5. Egoera-aldaketak
6. Egoera-aldaketen grafikoak
Jolaserako zientzia
Olio-koskorrak

Lan praktikoa
Nahaste baten irakitea
Amaitzeko
10
IKASKUNTZA-EGOERA ITZALA UZTEN DUEN ERRONKAK Sua ala laba? 30
Amaitzeko
32
50
Ikasturteko
oinarrizko jakintzak
3 S ubstantzia kimikoak 74
Elementu kimikoen izena eta ikurra
1. Elementu kimikoen sistema periodikoa
2. Substantzia sinpleak eta konposatuak
3. Molekulak eta kristalak
4. Elementu kimikoen erabilerak
Jolaserako zientzia
Sistema periodikoa buruz ikastea
Lan praktikoa
Materiaren jarraitutasunik eza (II)
Amaitzeko
4 A ldaketa kimikoak s istema
Nekazaritza moderna
1. Aldaketak sistema materialetan
2. Erreakzio kimikoak
3. Erreakzio kimikoen ezaugarriak
4. Jatorri natural eta artifizialeko produktu kimikoak
5. Kimika jasangarria eta GJH konpromisoak
6. Erreakzio kimikoak eta ingurumena
Jolaserako zientzia
Etxeko lika
Lan praktikoa
5 I ndarrak eta higidurak
Unibertsoak liluratuta
1. Indarrak
2. Eguneroko indarrak
3. Indarren izaera
4. Higiduraren azterketa
5. Deformazio elastikoak. Hookeren legea
6. Makina sinpleak
Jolaserako zientzia
Denboraren faktorea indarretan
Lan praktikoa
Hookeren legea
Amaitzeko
6 E nergia. Energia mekanikoa
Hondamendi naturala ala Jainkoaren zigorra?
1. Energia
2. Energiaren agerpenak
3. Energia-trukeak
4. Uhin mekanikoak
5. Soinua
Jolaserako zientzia
Harizko telefonoa
Lan praktikoa
Zeren araberakoa da energia mekanikoa? Amaitzeko
Irrati-uhinen aurkikuntza
1. Energia termikoa eta tenperatura
2. Oreka termikoa
3. Beroaren efektuak
4. Beroaren hedapena
5. Uhin magnetikoak
6. Argia
Jolaserako zientzia
Bide zuzena
1. Energia-iturriak
2. Energiaren erabilera nagusiak
3. Energiaren erabilerak eragindako arazoak
4. Energia-arazoaren balizko soluzioak
5. Garapen jasangarria
Jolaserako zientzia
Energia eolikoa
Lan praktikoa
Makina termikoak
Ikaskuntza-egoera. Portfolioa 70 IKASKETA-EGOERA ITZALA UZTEN DUEN ERRONKAK Albistegia 72
materialetan
92
Amaitzeko
Erreakzio kimikoak
110
Ikasketa-egoera. Portfolioa 130 IKASKUNTZA-EGOERA ITZALA UZTEN DUEN ERRONKAK Nire etxea, esploratzeko moduko tokia 132
134
E nergia termikoa
7
152
Newtonen diskoa Lan praktikoa Beroaren hedapena Amaitzeko
nergia-iturriak
8 E
172
Amaitzeko Ikasketa-egoera. Portfolioa 192
Antzinako Erroman, materiari buruzko ezagutza modu arrakastatsuan erabili zen; izan ere, presioaren efektua, nahasketen dentsitate ezberdina eta nahasteak banatzeko teknikak (esaterako, dekantazioa), normalean erabiltzen ziren kontzeptuak ziren. Eta nahikoa da erromatarren eraikuntza harrigarriak behatzea eta aztertzea hala zela egiaztatzeko. Adibide garbia dira, kasurako,

Zibilizazio erromatarrek, euri-ura erabiltzeko, ur hori depositu handi batzuetan biltegiratzen eta gordetzen zuten, normalean hiri inguruetan, akueduktuak amaitzen edo altxatzen ziren tokietan; horrelakoak dira, adibidez, Monturqueko zisterna (Kordoba) edo Teodosioko zisterna (Istanbul). Eta denbora luzez pentsatu izan zen biltegi horiek helburu hori baino ez zutela. Hala ere, oraintsuko ikerketek erakutsi dute oso bestelako helburu bat ere izan zezaketela: antza denez, andel handi horiek dekantagailu gisa jarduten zuten, uretan esekiduran zeuden partikula solidoak bereizteko. Gertaera horrek, akueduktuaren barruko hormak estaltzen zituen pintura gorrixkarekin batera (duela gutxi egindako hipotesi batzuen arabera funtzio bakterizida eta fungizida zuten), agerian uzten du zibilizazio erromatarrak uraren saneamenduari emandako garrantzia.
1. Bilatu webgunean zer ekimen dauden egun uraren kalitatea hobetzeko eta/edo zingira, ibai, itsaso edo ozeanoetako elementu kutsatzaileen kopurua murrizteko.



2. Ura eskuratzea lehentasuna zen dagoeneko erromatar zibilizazioarentzat. Baina 2 000 urte geroago, oraindik ere 2 000 milioi pertsona daude oinarrizko ur- eta saneamendu-zerbitzurik gabe. Kontsultatu anayaharitza.es webgunean GJHen 6.4 helburuari buruzko bideoa, eta zerrendatu zer ekintza egin ditzakezun jomuga hori lortzeko (laguntza: bilatu NBEk GJHei buruz duen webgunean «170 eguneroko ekintza gure mundua aldatzeko» dokumentua).
3. Erabili lankidetza ikaskuntzako Mahai-ingurua teknika, eta pentsatu zuen herriko ur-saneamendua hobetzeko modua emango duen estrategia bat. Gero, erakutsi infografia baten bidez, eta adierazi zer inpaktu izango lukeen 6. GJHetan.
32
1
GJH KONPROMISOA
Zer aurkituko duzu?
Unitate honetan




Dekantazioa Erromaren garaian
1. Materiaren propietateak






2. Substantzia puruak eta nahasteak
3. Disoluzioak egoera likidoan
4. Nahasteak bereizteko teknikak
5. Esekidurak eta koloideak
Zientzia-lantegia
Jolaserako zientzia. Solidoa edo likido likatsua?
Lan praktikoa. Disoluzioa, koloidea edo esekidura?
anayaharitza.es webgunean
Motibazioari eragiteko:
• Dokumentua: «Ezagutzen duzu uraren kudeaketari buruzko goi-mailako prestakuntza zikloa?».
Aurretik zer dakizun hautemateko:
• Ariketa interaktiboa: Hasierako autoebaluazioa.
• Aurkezpena: «Zer jakin behar duzun».
Ikasteko:
• Aurkezpenak: «Likidoen bolumena neurtzeko ontziak», «Materiaren sailkapena», «Disoluzioak prestatzeko laborategiko materiala», «Neurtzeko tresnak eta laborategiko materiala» eta «Ikasteko».
• Simulazioa: «Disoluzio baten kontzentrazioa».
Ebaluatzeko:
• Ariketa interaktiboa: Amaierako autoebaluazioa.
• Zenbakizko ariketen soluzioak.
Eta, gainera, proiektuaren gakoak aplikatzeko beharrezko informazio guztia.
IKASKUNTZA-EGOERA
IKASKUNTZAREN SEGIDA
IKERKETA-TALDEAK.
1.1 Ikasgelan zenbat neska-mutil zareten kontuan izanda, egin lanerako taldeak. Egokia litzateke lantalde bakoitzean 4 edo 5 kide egotea.
1.2 Ondoren, aurreneko zeregina da lehen erronka: ideia-zaparrada bat egitea «zer da sumendi bat?» galderari erantzunez. Talde bakoitzak mapa mental batean adieraziko du fenomeno natural horren gainean bururatzen zaion guztia, honako galdera hauei erantzuten saiatuz:
• Zer zerikusi du sumendi batek kimikarekin eta fisikarekin?
• Ba al dago substantzia pururik eta nahasterik laban?
• Materiaren zer propietate dituzte sumendiak botatzen dituen elementuek?





ZER BOTATZEN DU SUMENDI BATEK?
Hurrengo urratsa da bildutako ideiak antolatzea, eta bilaketa bat egitea falta den informazioa osatzeko:
• Zer da sumendi bat?
• Zer elementu jaurtitzen ditu?
• Solidoak dira, likidoak, gasak?












• Zer gertatzen da magma multzo hori guztia itsasora iristean? Neutralizazioa esanda, zer datorkizue burura?
• Nola dago kimikoki osatuta laba?
• Eta gasak? Zer gas kanporatzen ditu sumendi batek? Ikertu horri guztiari buruz.
POSTER ZIENTIFIKOA.
Plataforma digitalean egingo dugun maketa azaltzen duen posterra lantzen hasiko gara. Idatzi modu eskematikoan 1. eta 2. ariketetan bildutako informazio guztia. Ez ahaztu informazio horrek guztiak zerikusia izan behar duela diseinatuko dugun sumendiarekin.
+ orientabideak anayaharitza.es webgunean
33
1
Materiaren propietateak




Materia da gu osatzen gaituen eta gu inguratzen gaituen guztia. Lurrazalean ditugun baldintzetan, materia hiru agregazio-egoeratan egon liteke, baina materia guztiak ezaugarri komun batzuk ditu.
Materia edo sistema materiala da masa izeneko oinarrizko propietatea duen oro, eta espazio bat betetzen du, hau da, bolumen bat.
Egoera solidoan dagoen materiaz ari garenean, muga zehatzak dituen materiaz, gorputza esaten diogu; eta izan liteke erregularra, forma geometriko ezagun bat badu (kuboa, esfera, zilindroa, etab.), edo irregularra, bestelako formaren bat badu. Egoera likidoan edo gaseosoan dagoen materia-zati bat aipatu behar dugunean, sistema materiala erabiliko dugu. Materiari buruz dugun pertzepzioa materiak dituen propietateen ondorioa ere bada. Beraz, bereizketa hau egiten dugu:
• Propietate orokorrak. Propietate horiei esker, materia zer den eta zer ez den bereizten dugu, baina ez digute balio material batzuk eta besteak bereizteko. Garrantzitsuenak masa eta bolumena dira.
• Propietate bereizgarriak edo espezifikoak. Materia mota bat eta bestea bereizteko modua ematen diguten propietateak dira. Horietako batzuk hauek dira: dentsitatea, egoera-aldaketarako tenperaturak, eroankortasun elektrikoa edo eroankortasun termikoa, besteak beste.
1.1 Propietate orokorrak: masa eta bolumena
Hurrengo ikasturteetan aztertuko dugun bezala, gorputz baten masa beste aldagai batzuekin erlazionatuta dago; hala nola substantzia kantitatearekin, Lurrak eragiten duen erakarpen-indarrarekin (pisua) edo gorputz batek abiadura aldatzeko duen zailtasunarekin (inertzia).
Masa da gorputz batek edo sistema material batek duen materia-kantitatea. Oinarrizko magnitude bat da.
Masa balantza batekin neurtzen da, eta SIko bere unitatea kilogramoa da.
Balantza-motak
Bi besoko balantza Beso bateko balantza Balantza digitala edo elektronikoa
Objektu baten masa neurtzeko, gorputza plateretako batean jartzen da, eta beste platerean pisuak jartzen dira, balio handienetik txikienera, balantza orekatzea lortu arte. Objektuaren masa erabilitako pisuen masen batura da.
Kasu honetan, objektua platertxoan jartzen da, eta gidetan dauden pisuak mugitzen dira, balio handienetik txikienera, orekatu arte. Objektuaren masa pisuen posizioetan adierazitako balioen batura da.
Balantza mota honen funtzionamendua askoz errazagoa da balantza analogikoena baino. Objektua platerean jarri eta, sentsoreen bidez, pisu indarrak eragindako ekintzaren arabera neurtzen da masa. Neurriaren balioa pantaila digitalean agertuko da.
34
Materiaren beste propietate orokorra bolumena da, hau da, materiak betetzen duen espazioa. Kasu honetan, magnitude deribatu bat da. Bere SIko unitatea metro kubikoa da, m3
Bolumena da gorputz edo sistema material batek betetzen duen espazioa.
Likido baten bolumena neurtzeko, ontzi batean sartu behar da; ontzi batek izan dezakeen gehienezko bolumena bere edukiera da, eta edukiera-unitatea litroa da (L).
Litro bat da 1 dm-ko ertza duen ontzi kubiko batek izan dezakeen bolumen maximoa. Dena dela, sarritan litroaren multiploak eta azpimultiploak erabiltzen dira:
Likidoen eta solidoe n bolumenen neurria
Likidoen bolumenak neurtzeko, material graduatua erabiltzen dugu; esaterako, probeta graduatuak, pipetak edo buretak. Aldiz, likidoen bolumen zehatzak neurtzeko, material aforatua erabiltzen dugu, hala nola matrazeak eta pipeta aforatuak; eta horien edukiera neurtutako bolumenari dagokio.



Kontsultatu likidoen bolumenak neurtzeko laborategiko materiala anayaharitza.es webgunean ageri den aurkezpenean.

1 Pentsatu eta binaka jarrita komentatu. Argia materia al da? Galdera horri erantzun eta arrazoitzeko, abiatu materiaren propietate orokorretatik.
2 Zer magnitude neurtu da kuboaren irudian? SIko unitateetan adierazitako neurri bat da? Zure erantzuna ezetz bada, idatzi neurri horren balioa SIko unitateetan.
Solido irregular baten bolumena bat dator desplazatzen duen ur-bolumenarekin; beraz, solidoak zer bolumen duen jakiteko, nahikoa da urak solidoa sartuta eta sartu gabe betetzen dituen bolumenen kenketa egitea.
Solido erregular baten bolumena lortzeko, solidoaren dimentsioak neurtu eta dagokion adierazpen matematikoa ezarri behar da; esaterako, r erradioko eta L altuerako zilindro baten bolumena hau da:
3 Laborategian dagoen beirazko material guztia ez da erabiltzen bolumenak neurtzeko. Identifikatu, beirazko materialei buruzko argazkian, beste erabilera batzuk dituen materiala; marraztu eta azaldu zertarako erabiltzen den.

4 Sarri egiten den akats bat da zentilitroa, cL, eta zentimetro kubikoa, cm3, nahastea. Ikusi ditugun baliokidetasunak erabilita, adierazi zer erlazio dagoen bi unitate horien artean.

35 U 1
1 cm 1 L = 1 dm3 1 mL = 1 cm3 1 dm Bolumen- eta edukiera-unitateak Matraze aforatua Probeta Pipeta 200 mL 210 mL
1 L = 1 dm3 ; 1 mL = 1 cm3 ; 1 kL = 1 m3
∙ r 2 ∙ L
V = π
ULERTU, PENTSATU, IKERTU…
EBATZITAKO ARIKETA
1.2 Propietate espezifiko bat: dentsitatea
Dentsitatea magnitude deribatu bat da, eta propietate horren balioak modua ematen digu substantzia batzuk beste batzuetatik bereizteko.
Dentsitatea da gorputz batek, edo sistema material batek, duen masaren eta betetzen duen bolumenaren arteko erlazioa.
Erlazio hori, hizkuntza matematikoan, zatiketa baten bidez adierazten da: d V m =
Aurreko adierazpen horretan, m da masa, eta SIko unitateetan kg-tan neurtzen da; V da bolumena, eta m3-tan adierazten da; eta d da dentsitatea, eta SIko unitatea, magnitude deribatu horrentzat, kg/m3 da.
Eguneroko hizkuntzan, dentsitatearen kontzeptua modu okerrean erabili ohi dugu. Adibidez, «zerbaitek uretan pisu gutxi duelako flotatzen duela» esaten dugunean, masa txikia izateari soilik egiten diogu erreferentzia. Baina hori ez da zuzena, izan ere, sistema material batek beste baten gainean flotatzeko, gertatu behar dena da lehenengo sistemako masa-bolumena erlazioa bigarren sistemakoa baino txikiagoa izatea. Hau da, lehenengo sistemak izatea dentsitate txikiagoa bigarrenak baino.
1 Asmatu bi objektu zein materialez eginak dauden zehazteko modu bat, gure susmoa izanik horietako bat burdinazkoa eta bestea berunezkoa dela.
Datuak:
A objektua: masa = 36,2 g; bolumena = 3,20 mL
B objektua: masa = 33,8 g; bolumena = 4,30 mL
Probleman planteatutakoa ebazteko modu bat izan daiteke horien dentsitateak kalkulatzea, eta lortutako emaitzak dentsitate-taulan burdinaren eta berunaren kasuan zehaztutako balioekin alderatzea.
Dentsitatea SIko unitateetan lortzeko, masa eta bolumena ere SIko unitateetan adierazi behar ditugu; hurrenez hurren, kg eta m3.
Masa kg-tan adierazteko, zati 103 egingo dugu:
mA = 36,2 g = 0,036 2 kg = 3,62 · 10–2 kg
mB = 33,8 g = 0,033 8 kg= 3,38 · 10–2 kg
ULERTU, PENTSATU, IKERTU…
5 Erabili bihurketa-faktoreak eta notazio zientifikoa aurreko ariketa ebatzian adierazitako neurrien unitate-aldaketak egiteko.
6 Ikuspegi-zirkulua. Adierazi nola neurtuko zenukeen ebatzitako ariketan ageri diren objektuen bolumenak. Zergatik uste duzu ematen dutela datu hori mililitrotan adierazita?
7 Gorde ahalko genituzke 8 kg etanol 7 L-ko txanbil batean? Kalkulatu etanola sobera geratuko den edo faltan.
Badakigu 1 mL = 1 cm3 dela. Bolumena m3-tan adierazteko, zati 106 egin behar dugu:
VA = 3,20 mL = 3,20 · 10–6 m 3
VB = 4,30 mL = 4,30 · 10–6 m 3

Masa zati bolumena eginez, dentsitateak lortuko ditugu:
–==
2 3 –
63
–==
2 3 –
,· d 43010 33810 7 860 m kg m kg B 63

,·
Emaitza horiek eta taulan ageri direnak alderatuta, ikusten dugu A materiala berunari dagokiola, eta B, burdinari.
8 Orri birakaria. Balsa zura ( Ochroma piraminade ) oso zur preziatua eta estimatua da, dentsitate txikia baitu ( d = 160 kg/m 3) eta, aldi berean, oso sendoa baita. Zer erabilera uste duzu duela horrelako zur-mota batek?
9 Kalkulatu zer masa duen gutxi gorabehera 60 dm3-ko bolumeneko surf-taula batek, aurreko ariketako datuetatik abiatuta.
36 1 Materiaren propietateak
MATERIAL MOTA BATZUEN DENTSITATEA Materia Dentsitatea (kg/m3) Ura (4 ºC) 1 000 Itsasoko ura (batezbesteko balioa) 1 027 Etanola 789 Beruna 11 340 Burdina 7 870 Merkurioa 13 600 Karbono dioxidoa 1,96
d V m = ,· ,· d 32010 36210 11
m
m
A
343
kg
kg
1.3 Dentsitatearen neurria
■ Dentsitatea zuzenean neurtzea
Likido baten dentsitatea zuzenean neur daiteke dentsimetroa erabiliz. Dentsimetroa beirazko tresna bat da, zilindro huts bat, mutur batean erraboil astun bat duena eta posizio bertikalean flotatu dezakeena. Dentsitatearen balioa neurtzeko, bertikal jarri behar dugu likidoan, eta libre utzi, flotatzen. Likidoa dentsitate txikiagokoa edo handiagokoa izan, gehiago edo gutxiago hondoratuko da. Dentsitatearen balioa dentsimetroaren eskalan irakurtzen da (ikusi irudia).
■ Dentsitatea zeharka neurtzea


Dentsitatea magnitude deribatu bat da, eta, beraz, magnitude deribatu hori definitzen duten oinarrizko magnitudeen balioetatik abiatuta kalkula daiteke: masa eta bolumena. Horretarako, gorputzaren masaren eta bolumenaren balioak modu independentean neurtuko ditugu, eta balio horien zatiketa eginda, dentsitatearen balioa lortuko dugu.
Masa neurtzeko balantza bat erabiliko dugu, eta bolumena neurtzeko, kontuan izango dugu solidoa erregularra, irregularra edo likidoa den.
• Balantza erabiltzeko jarraibideak
Balantza analogikoak erabil ditzakegu (beso batekoak edo bikoak), edo balantza digitalak. Lehenago deskribatu dugu nola erabiltzen diren. Zeroko errorea ekidin behar dugu: platerak hutsik daudenean, balantzak zero markatu behar du. Besoen muturretan torloju batzuk daude, besoak erregulatzeko. Balantza elektronikoen kasuan, pisaldi bat egiten den bakoitzean zeroko tara zehaztu beharko da.
• Probeta erabiltzeko jarraibideak
Tresna graduatuak erabiltzen ditugunean, probeta kasurako, garrantzitsua da paralajeko errorea ekiditea (beheko irudia).
Prozedura esperimentala
Balantza batekin, objektu baten dentsitatea jakiteko beharrezkoa dugun masa neurtuko dugu.
Probeta batekin, bolumena kalkulatuko dugu (anayaharitza.es webgunean, nola egin azaltzen da).
Ikertu dentsimetroaren oinarriak
Zer propietatetan oinarritzen da irudian ageri den dentsitatearen neurketa? Ikertu flotagarritasunaren gainean, eta partekatu ateratako ondorioak zure lantaldeko kideekin.
m = 24 g = 0,024 kg


V = 8 mL = 0,000 008 m3

d = m V
d = d 0, 00000m 0, 24 kg 3kg/m 000 8 3 3
Amaitzeko, objektuaren masa bere bolumenaren zatituko dugu, eta biribiltze-erregelak ezarriko ditugu.
U 1
==
2
Substantzia puruak eta nahasteak
Sistema material bat aztertzen dugunean, bi egoera desberdin aurki ditzakegu: substantzia purua izatea, hau da, beste substantzia batzuekin nahastuta ez egotea, edo substantzia puru batzuen nahasketa izatea.
Substantzia puru bat da metodo fisikoen bidez materia-mota sinpleagoetan deskonposatu ezin dena. Aitzitik, nahaste bat da hainbat substantzia puruz osatutako sistema material bat, eta substantzia horiek metodo fisikoen bidez banandu daitezke.

2.1 Substantzia puruak: sinpleak eta konposatuak
Substantzia puruak bi motatakoak daude: substantzia sinpleak edo oinarrizkoak, eta konposatuak.
• Substantzia sinpleak dira elementu kimiko bereko atomoz osatuta daudenak, eta, beraz, ezin dira deskonposatu aldaketa kimiko baten bidez (ez dira berriak eratzen). Adibidez, O2 substantzia sinple bat da, eta elementu kimiko bakarrak osatzen du: O oxigenoak.

• Konposatuak dira metodo kimikoen bidez beste substantzia batzuetan deskonposatzen diren substantziak. Ondorengo koadro honetan, uraren kasu zehatz bat azaltzen da.
Substantzia puruak
Substantzia sinplea
Deskonposizio baten adibidea: uraren elektrolisia
Urrea substantzia sinple bat da, eta, beraz, bere ezaugarri bereizgarriak konstanteak dira. Gainera, ez da aldaketa kimikoen bitartez deskonposatzen.
Substantzia konposatua
Sendagai asko substantzia konposatuak dira, eta gure organismoan sartzen ditugunean, betiere tratamendu medikoan emandako jarraibideei kasu eginez, ahotik, muskulu barnetik, eta abar, substantzia sinpleagoetan deskonposatzen dira.
Elektrolisi-prozesuan zehar (aurrerago aztertuko duzu), korronte elektriko baten eraginez, ura (H2O) bi substantzia sinpletan deskonposatzen da: hidrogenoa, H2, eta oxigenoa, O2. Aldaketa kimiko bat da.

38
2.2 Nahastea heterogeneoak
Nahaste mota hauek osatzen dituzten substantziak, batzuetan, begi hutsez bereizten dira. Propietate fisikoak aldatu egiten dira alde batetik bestera, eta horregatik dira heterogeneoak.
Nahaste heterogeneoak egoera solidoan egoten dira (adibidez, harea), baina baita egoera likidoan eta gas-egoeran ere. Esekidurak, kasurako, nahaste heterogeneoak dira, geroago ikusiko dugunez.




2.3 Nahaste homogeneoak
Nahaste hauei disoluzio ere esaten zaie. Begiratu batean ezin ditugu bereizi substantzia puru bat eta nahaste homogeneo bat, beren propietateak berdinak baitira zati guztietan. Disoluzioak egoera solidoan, likidoan eta gaseosoan egon daitezke («Nahaste motak» laukian kasu bakoitzaren adibide bat ageri da).

Disoluzio baten edo substantzia puru baten aurrean gauden jakiteko, nahastea osatzen duten substantziak bereizi behar ditugu nolabait, edo bestela, aldez aurretik substantziaren konposizioa ezagutu.
Nahaste bateko substantziak bereizi ahal izateko, aldaketa eragiten da substantzia horietako baten egoeran, nahastea berotuz.
Nahaste motak
Harea: nahaste heterogeneoa

Begi hutsez ikusten denez, harea osatzen duten materialak bereiz daitezke, tamaina, egitura, kolore eta abar desberdinak baitituzte.
Edateko ura: disoluzioa egoera likidoan
Edateko ura da egoera likidoan dagoen gatz eta ur disoluzio bat. Ur purua hartuko bagenu, desoreka sortuko litzateke gure gorputzean.
Airea: disoluzioa egoera gaseosoan
Airea gas-nahaste bat da. Gas-egoeran dagoen disoluzio bat da. Airearen konposizioa da, gutxi gorabehera, % 79 nitrogenoa eta % 21 oxigenoa.

10 Mahai-ingurua. Botilako urak, ontzian itsatsita egoten den etiketan, analisi kimiko bat erakusten du, eta bertan zehazten da zer substantzia dauden uretan. Esan dezakegu botilako ura substantzia purua dela? Arrazoitu.
11 Segida-katea. Esnea substantzia purua da? Asmatu zure erantzuna egiaztatzeko metodo bat, eta azaldu metodo horren etapak eta ondorioak.
12 Ispilua. Azaldu zer desberdintasun dagoen mineral baten eta arroka baten artean. Zein da substantzia puru bat eta zein nahaste bat? Nola egiaztatu liteke esperimentu baten bidez? Eman bakoitzeko adibide bat.
13 Ikertu «elektrolisi» hitzaren etimologiari buruz, eta erlazionatu aurreko orrialdeko irudian behatutakoarekin. Zer erabilera ditu uraren elektrolisiak?
Altzairua: aleazioa (disoluzioa egoera solidoan)
Altzairua burdinazko eta karbonozko disoluzio solido bat da. Egoera solidoan dauden metalen disoluzioei aleazioak esaten zaie, eta beren propietateak ez dira osagaien propietateen berdinak izaten; esaterako, erresistentzia handiagoa eta arintasun handiagoa izaten dute.
Aleazioen propietate desberdin horien ondorioz, ugari erabiltzen dira eraikuntzaren industrian, automobilgintzan eta inplanteetan eta protesietan, besteak beste.
Aleazio batzuk Antzinarotik ezagutzen dira, eta oraindik ere erabiltzen ditugu; hona hemen horietako batzuk:
• Brontzea: kobrearen eta eztainuaren nahastea.

• Letoia: kobrearen eta zinkaren nahastea.
• Alpaka: kobrearen, nikelaren eta zinkaren nahastea.
39 U 1
ULERTU, PENTSATU, IKERTU…
3
Egoera likidoko disoluzioak
DISOLUZIOEN ADIBIDEAK AGREGAZIO-EGOERAREN ARABERA
Egoera
fisikoa Disolbatzailea Solutua Adibidea
Solidoa Solidoa Solidoa Altzairua
Gasa Oxigenoa uretan


3.1 Disoluzioak

Ikusi dugunez, zenbait substantzia pururen nahaste homogeneoei disoluzio ere esaten zaie. Disoluzio guztietan, honela izendatzen ditugu disoluzioa osatzen duten osagaiak:
• Disolbatzailea da disoluzioan proportzio handienean dagoen substantzia. Disoluzioan ura badago, disoluzio akuoso edo ur-disoluzio esaten diogu, eta disolbatzailetzat ura hartuko dugu beti, nahiz eta proportzio txikiagoan egon.
• Solutua da disolbatzailean disolbatzen den substantzia. Normalean, disolbatzailea baino proportzio txikiagoan egoten da. Disoluzioetan solutu bat baino gehiago egon litezke.
Likidoa Likidoa
Likidoa Alkohola uretan
Solidoa Azukrea uretan
Gasa Gasa Gasa Airea
Disoluzioak egoera solidoan, likidoan eta gaseosoan daude; orrialde honetako taulan horien guztien adibideak jasotzen dira, baina epigrafearen gainerako zati guztian, egoera likidoan dauden disoluzioak aztertuko ditugu. anayaharitza.es webgunean, egoera likidoan dagoen disoluzio bat prestatzeko behar den laborategiko materialaren berri ematen duen aurkezpen bat aurkituko duzu.
Disoluzio bat prestatzeko prozedura
Laborategian solido eta likido baten disoluzio bat prestatu behar dugunean, lau urratseko prozedura bat jarraituko dugu. Ikus dezagun, adibide gisa, nola prestatu 4 g soluturen disoluzioa 100 mL-ko disoluzioan.



1. Solutuaren masa balantza bat erabiliz neurtuko dugu, ahalik eta zehatzen jokatuta.
2. Solidoa prezipitatuen ontzi batera botako dugu, eta ur destilatuarekin disolbatuko dugu.
3. Disoluzioa prezipitatuen ontzitik matraze aforatura aldatuko dugu, inbutuaren laguntzarekin.
4. Amaitzeko, ontzi garbitzaile batekin eta tanta-kontagailu batekin ur destilatua gehituko dugu, arrasean jarri arte.
40
1 3 2 4
3.2 Disoluzio baten kontzentrazioa
Zenbait disoluziok substantzia berak izan ditzakete, baina proportzio desberdinetan. Horrelakoetan, disoluzioek kontzentrazio desberdina dutela esaten dugu.
Disoluzio baten kontzentrazioa da disoluzio-kantitate jakin batean dagoen solutu-kantitatea.
Aurreko orrialdeko adibidean, kontzentrazioa masa/bolumen eran adierazita dago, eta honela kalkulatzen dugu:
14 Airea batez ere nitrogenoz eratuta dago (% 79 da nitrogenoa); proportzio handieneko solutua oxigenoa da. Aireak ba al du solutu gehiagorik?
15 Lan egin anayaharitza.es webgunean kontzentrazioari buruz agertzen den simulazioarekin. Ondoren, kalkulatu aurreko orrialdeko argazkietan ageri diren disoluzioen kontzentrazioak, g/L-tan adierazita.

Adierazpen horretan, ms da solutuaren masa, gramotan adierazita, g; VT da disoluzioaren bolumen totala, litrotan neurtuta, L; eta K da kontzentrazioa, gramo litroko, g/L.


3.3 Disoluzio diluituak, kontzentratuak eta aseak



Disoluzio batek beste batek baino kontzentrazio handiagoa badu, lehenengoa bigarrena baino disoluzio kontzentratuagoa dela esaten dugu, eta bigarrena lehena baino disoluzio diluituagoa dela.
Disoluzio batek izan dezakeen kontzentrazio handiena lortu duenean, solutua gehitu eta ez da disolbatuko; hori gertatzen denean, disoluzio ase bat daukagu. Disoluzio ase bati solutu gehiago botatzen badiogu, prezipitatu bat lortuko dugu, alegia, disolbatzea lortzen ez dugun solutua.
Disolbagarritasuna da disoluzio asearen kontzentrazioa. Kontzentrazio horren balioa solutuaren, disolbatzailearen eta tenperaturaren araberakoa da.
Disoluzio-motak, kontze ntrazioaren arabera
Diluitua Kontzentratua Asea
16 Konparatu dentsitatearen adierazpen matematikoa eta kontzentrazioarena. Zertan dira berdinak eta zertan desberdinak? Magnitude bera da? Egin Vennen diagrama bat zure erantzunarekin.
Gainasea
Disoluzio baten kontzentrazioa bere disolbagarritasuna baino askoz txikiagoa bada, disoluzioa diluitua da.
Kontzentrazioaren balioa disolbagarritasunaren balioaren parekoa denean, disoluzioa kontzentratua da.
Disolbagarritasunaren baliora iristen denean, disoluzioak ez du solutu gehiagorik onartzen, eta asea dela diogu.
Disolbatzaile bolumen horretan eta tenperatura horretan ezin da solutu gehiago disolbatu. Solutua prezipitatu egiten da.
41 U 1
V
=
m K T s
ULERTU, PENTSATU, IKERTU…
4


Nahasteak bereizteko teknikak
4.1 Nahaste heterogeneoen kasuan
Askotariko teknikak daude nahaste heterogeneo baten osagaiak bereizteko. Teknika horiek guztiak metodo fisikoak dira, eta nahastea eratzen duten osagaien propietate batek har ditzakeen balio desberdinetan oinarritzen dira, hala nola agregazio-egoera berean edo desberdinean egotea, dentsitatea edo tamaina. Teknika horietako batzuk beheko laukian bilduta ageri dira, baina beste asko aurrerago ikasiko dituzu.
Nahaste heterogeneoak bereizteko teknikak

DEKANTAZIOA
Nahaste heterogeneo baten osagaiak bereiztean datza, osagaiek dentsitate desberdina badute. Adibidez, likido nahasezinen nahaste bat (disolbatzen ez direnak, ura eta olioa kasurako), edo likido edo gas baten eta bertan esekiduran dagoen solido baten nahastea.

Bi likido nahasezin bereizteko, nahastea dekantazio-inbutura botako dugu. Handik denbora batera, dentsitate txikieneko likidoak flotatu egingo du. Une horretan, giltza irekiko dugu dentsitate handieneko likidoa bereizteko, eta prezipitatuen ontzi batean jasoko dugu.
IRAGAZKETA B
Solido eta likido batek eraturiko nahaste bat badugu, solidoaren partikulak bereizteko (tamainaz handiagoak direnak), iragazki bat edo bitarteko iragazle bat erabiliko dugu. Irudiko iragazpaperak solido partikulak harrapatzen ditu, eta urari, berriz, igarotzen uzten dio.
ZENTRIFUGAZIOA C

Nahasteko osagaiek dentsitate desberdina dutelako lortzen da bereiztea.
Kasu honetan, nahastea ezartzen da abiadura handiko biraketa-higidura batek eragindako indar zentripetu baten mende.
Teknika hau erabiltzen da dekantazio edo iragazketa bidez bereizi ezin diren nahaste heterogeneoak bereizteko; esate baterako, odoleko plasma bereizteko.
42
A
A
C B
Ura
Ura eta harea
Olioa
Ura
4.2 Nahaste homogeneoen kasuan
Nahaste homogeneoak bereizteko teknikek disolbatzailea solututik edo solutuetatik bereizteko modua ematen dute. Gehien erabiltzen diren biak jarraian agertzen dira.
Nahaste homogeneoak bereizteko teknikak
KRISTALIZAZIOA
Teknika hau solutua solidoa denean erabiltzea komeni da; adibidez, gatz bat uretan disolbatuta.
Disolbatzailea lurruntzean datza, disoluzio ase bat lortzeko eta, horrela, solidoa prezipitatzen hasteko. Horretarako, disoluzioa kristalizadore batera botako dugu. Disolbatzailea lurrundu denean, gatz-kristalak lortuko ditugu.
DESTILAZIOA
Destilazioak aukera ematen du irakite-tenperatura desberdina duten bi likidoz osatutako disoluzio bat bereizteko.
Horretarako, disoluzioa hondo biribileko matraze batean sartu eta berotzen da. Substantzia lurrunkorrenaren irakite-tenperaturara iristean, substantzia hori gas-egoerara pasatuko da. Sortutako lurrunak hozgarria dagoen barne-hodira igarotzen dira, eta han kondentsatu eta kolektorean biltzen dira. Hozgarriaren kanpo-hoditik hozteko ura dabil; lurrunak hozten ditu, baina ez ditu zuzenean ukitzen.


Kontsultatu berriro anayaharitza.es webgunean ageri den aurkezpena, laborategiko materiala nola erabili behar den gogoratzeko.

ULERTU, PENTSATU, IKERTU…
17 Egin diagrama hierarkiko bat, eta zehaztu nahasteen sailkapena eta kasu bakoitzean erabil daitezkeen bereizketa-teknikak, kontuan izanda zein diren nahastea osatzen duten substantzien agregazio-egoerak eta bereizketa-teknika bakoitza zer propietatetan oinarritzen den. Erabili eskuineko eskema.


18 Buru pentsalariak. Hondakin baten lagina daukagu, batik bat hareaz eta urez eraturik. Baina nahaste horretan likido likatsu bat ere ageri da, olioa edo haren antzekoa. Horrez gain nahaste horretan gatzik disolbatuta dagoen zehazteko eskatu dizute. Nola jokatuko zenuke nahasteko osagaiak bereizteko?
Nahastemotak ?
Homogeneoak
Solutu solidoa ? ? ?
? ?
Tamainaren arabera
Iragazketa Destilazioa
43 U 1
1
1 2 2
Hozgarria Alkohola eta ura Hustubidea Ur hotza Alkohola
Alkohollurrunak
Esekidurak eta koloideak
Ikusi dugun bezala, nahaste homogeneo bat da osagaiak begi hutsez bereizteko modurik ematen ez duen nahaste mota; baina batzuetan gerta liteke nahaste bat homogeneoa dela pentsatzea, eta aurrean duguna esekidura edo koloide bat izatea.
5.1 Esekidurak
Pentsa dezagun, adibidez, oso fin zatituta dagoen solido bat (hautsa) likido batean edo gas batean sakabanatuta dagoela. Agitaziorik ez badago, eta behar besteko denborarekin, solidoa jalki eta erori egingo da.
Nahaste heterogeneo horri esekidura esaten zaio. Esekidura ohikoenak dira solidoenak gasetan zein likidoetan. Sakabanaketa gertatzen den faseari fase sakabanatzailea deitzen zaio, eta esekiduran dagoen solidoari fase sakabanatua esaten zaio.
5.2 Koloideak
Esekiduraren (heterogeneoa) eta disoluzioaren (homogeneoa) erdibideko ezaugarriak dituen nahasteari koloide esaten zaio.
Kasu honetan, partikulak ez dira denboraren poderioz hondoan jalkitzen. 100 nm-tik beherako tamaina duten partikulak izaten dira, fase sakabanatzailetik bereizteko oso zailak direnak.
Zorrotz esanda, koloidea ez da disoluzioa, ezta nahaste heterogeneoa ere. Hala ere, kasu askotan disoluzioen berezko terminologia erabiltzen da koloide bati erreferentzia egiteko. Adibidez, horrelako nahasteetan proportzio txikiagoan dagoen substantzia aipatzeko, solutuaz hitz egiten dugu.

Koloide batzuk solido edo likido bat gas edo likido batean sakabanatuta eratzen dira; beste batzuk, gas bat beste fase gaseoso batean kondentsatuta, hodeien kasuan bezala.
Esekiduren eta koloideen eguneroko adibideak
Esekidura Koloidea
Haurren antibiotikoak ez dira uretan disolbagarriak. Sendagaiaren uretako esekidura eginez prestatzen dira, modu likidoan hartu ahal izateko.

Koloideen adibide bat etxeko gelatinak dira. Sukaldean, koloideen hainbat adibide daude, substantzia guztiak ez baitira disolbatzailean disolbatzen.

44
5
ESEKIDUREN ADIBIDEAK
Egoera fisikoa Fase sakabanatzailea Fase sakabanatua Adibidea
Gasa Gasa Solidoa Kutsadura atmosferikoa
Likidoa Likidoa Solidoa Hortxata
KOLOIDEEN ADIBIDEAK
Egoera fisikoa Fase sakabanatzailea Fase sakabanatua Adibidea
Gasa Gasa
Likidoa Hodeiak
Solidoa Keak
Likidoa Likidoa Likidoa Esnea, maionesa
Nola bereizi koloide ba t eta disoluzio bat
Diseinatu esperimentu bat Tyndall efektuari buruz ikasitakotik abiatuta, pentsatu eta azaldu gelatina benetan koloide bat dela frogatzeko esperimentu bat.
Koloide bat osatzen duten partikula solidoak handiagoak dira disoluzio batean disolbatuta dagoen solutuarenak baino. Horregatik, partikula horiek gai dira argiaren hedapen-norabidea aldatzeko, argia barreiatuz. Hori gertatzen da fase sakabanatua osatzen duten partikula txikietako bakoitzak argi-igorle baten moduan jokatzen duelako, ondorioz argiaren norabidea aldatuz, eta argi-izpiak ikusgarri eginez.
Fenomeno horri Tyndall efektua esaten zaio, eta argi ikus daiteke zeru hodeitsuetan, hodeiak koloideen adibide bat baitira.
ULERTU, PENTSATU, IKERTU…
19 Egiaztatu. Adierazi zer teknika erabiliko zenukeen nahaste hauetako osagaiak bereizteko. Zer dira: disoluzioak, esekidurak edo koloideak?
a) Ur gazia.

b) Hauts-hodeia.
c) Esnea.
d) Odol-lagin bat.
e) Hormetako pintura.
20 Eman honako termino hauetako bakoitzaren definizio bat: esekidura eta koloidea. Bilatu «emultsio» terminoari buruzko informazioa eta azaldu zer esan nahi duen, zure hitzak erabilita. Eman kasu horietako bakoitzaren adibide bat, etxean dituzun sistema materialak erabilita.
21 Ideia-biltzarra. Maionesa, esnea bezala, emultsio bat da. Saltsa horren bertsio bat esnea eta oliba-olioa erabilita egiten da. Zergatik uste duzu irabiatu behar dela nahastea saltsa lortzeko? Zer gertatzen da saltsa «mindu» edo «garraztu» dela esaten dugunean?
22 Bilatu zure etxean honako material hauek, eta sailkatu nahaste homogeneoak, heterogeneoak edo koloideak diren kontuan hartuta:



a) Kontzentratutik abiatuta egindako zukua.
b) Esne osoa.
c) Esprai-desodorantea.
d) Kamamila-infusioa.
e) Ur oxigenatua.
f) Gorputzeko krema.
g) Esnegaina.
45 U 1
Zientzia-lantegia
Jolaserako
zientzia
Aztertu
• Zer gertatzen da gainazal baten gainera ura, olioa edo eztia botaz gero? Ikusiko dugunez, oso bestelako jokabideak dituzte: ura, isurtzean, olioa eta eztia baino gehiago barreiatzen da. Ura biskositate txikiagokoa delako gertatzen da hori.
• Inoiz jolas egin baduzu bromak egiteko saltzen duten ore berdexka horrekin, igarriko zenuen likidoek eta solidoek ez bezalako jokabidea duela.
Solidoa edo likido likatsua?
Sarrera
Hiru agregazio-egoerak bereizteko modua ematen digun ezaugarrietako bat biskositatea da; hau da, gasek eta likidoek jariatzeari ezartzen dioten erresistentzia. Hurrengo ariketa hoetan, biskositatea identifikatzen ikasiko dugu.
Materiala
• Almidoi-hautsa • Kola zuria • Elikagai-koloratzailea • Ura • Koilara bat
• Edalontzi bat • Kaiku bat • Autozigiludun poltsa bat.
Eraiki
Ore berdexka hori guk geuk egingo dugu.
• Baso erdi ur epeletan, almidoi koilarakadatxo bat diluituko dugu.
• Kaiku batean, disoluzio horren koilarakada bat eta kola zuriaren bi koilarakada botako ditugu. Elikagai-koloratzailearen tanta batzuk gehitu daitezke.

• Nahastea irabiatuko dugu, hasieran koilararekin eta gero hatzekin. Orea autozigiludun poltsan gorde, eta hozkailuan sartuko dugu.

• Prestatu dugun orea, isurtzen al da? Eztiaren aldean, gehiago ala gutxiago? Eta olioaren aldean? Likidoa da ala solidoa da? Gauza bera al dira biskositatea eta dentsitatea?
• Orea edalontzi batera botako dugu kontuz, eta irristatzen utziko diogu. Ertzera iristeko zenbat denbora behar duen neurtuko dugu. Berdin egingo dugu olioarekin eta urarekin; horrela, material horien biskositatea alderatuko dugu.
• Orea eskuekin zapaldu eta landuko dugu, eta bola bat egingo dugu. Ikusiko dugunez, zenbat eta indar handiagoa egin, orduan eta antz txikiagoa likido baten jokabidearekin; hau da, biskositatea handitzen du.
Prestatu dugun oreak likido likatsu baten antzera jokatzen du. Gainera, biskositatea areagotu egiten da esfortzuren bat ezartzen diogunean, hala nola tentsioa edo bihurdura, edota kolpatzen badugu. Horregatik esaten dugu jariakin batzuek solidoek bezala joka dezaketela; adibidez, egin dugunak. Jariakin horiei ez-newtondarrak esaten zaie, eta oso ohikoak dira.
Bilatu eguneroko jariakin ez-newtondarrei buruzko informazioa, eta lotu ketchuparen eta txokolatearen portaerarekin.
46
Eraiki
Ondorioak
Lan praktikoa
Disoluzioa, koloidea edo esekidura?
Problemaren planteamendua
Jarduera honen helburua da eguneroko substantzien nahasteak sailkatzea, disoluzio, koloide eta suspentsioak diren aintzat hartuta.
Zure proposamena
Nola bereiz ditzakegu esekidura bat eta disoluzio bat? Eta koloide bat eta disoluzio bat? Zer proba planteatu ditzakegu nahaste mota horietako baten aurrean gauden zehazteko?

Gure proposamena
Esekidura, disoluzioa eta koloidea bereizteko modua ematen diguten propietate batzuei erreparatuko diegu:
• Nahastea geruzatan bereizten den denbora batez mugitu gabe uzten denean.

• Nahaste osoak zeharkatzen duen iragazpapera, edo zatiren bat iragazi gabe geratzen den.
• Laser-erakusle baten argitan gardena den edo, aitzitik, argi hori barreiatzen duen, eta orduan ikus daitekeen.
Materiala

• Ura • Irina • Kafea • Esnea • Iragazpapera • Inbutua • Balantza
• Probeta • Prezipitatu-ontziak • Laser-erakuslea edo linterna.
Esperientzia egiteko jarraibideak
Nahasteak prestatzea
Hiru nahaste prestatuko ditugu: bata, uraz eta irinaz; bestea, uraz eta kafeaz; eta, azkena, uraz eta esneaz. Azken bi horien kasuan, erabili kafe- edo esne-tanta batzuk baino ez.
Proben segida
• Iragazketa. Lehenik eta behin, nahasteak iragazpaperetik pasaraziko ditugu, inbutua erabiliz (4. epigrafean erakutsitako muntaia). Ikusi desberdintasunik dagoen jatorrizko nahastearen, iragazpenaren eta iragazpaperean atxikita geratu den zatiaren artean.
• Sedimentazioa. Jarraian, laginak geldi utziko ditugu, bakoitza ontzi batean, hainbat orduz; geldialdiaren aurretik eta ondoren alderik dagoen aztertuko dugu.
• Tyndall efektua. Laser-erakusle baten argia nahasteetan zehar pasaraziko dugu. Hobeto ikusteko, laborategiko argiak itzaliko ditugu. Argi-izpia, nahastea zeharkatzen duenean, antzematen den ala ez aztertuko dugu.
BAI EZ
Esekidura
Tyndall efektua ageri da?
BAI EZ
Koloidea Disoluzioa
ATERA ONDORIOAK
1 Erabili aurreko eskema hori eta atera egindako esperientziei buruzko ondorioak.
2 Azaldu zergatik ikusten den argi-izpi bat koloide batean zehar, baina ez esekidura batean zehar.
47 U 1
Ura eta irina (bereizita)
Ura eta kafea
Ura eta esnea
Osagaiak iragazketa bidez bereiz ditzakegu?
Amaitzeko
ULERTU
Antolatu zure ideiak Kontzeptu-mapa hierarkikoa
1 Lan egin eskemarekin. Kopiatu eskema zure koadernoan, eta erantsi adar eta lauki berriak honako ideia hauetatik abiatuta:
a) Gehitu substantzia sinpleen eta konposatuen hiruna adibide.
Materia
b) «Homogeneoak edo disoluzioak» koadrotik abiatuta, erantsi adar bat disoluzio akuosoen bereizgarriak deskribatzeko, eta beste adar bat kontzentrazioaren kontzeptua zer den azaltzeko eta solutu-kantitatearen arabera zenbat mota dauden zehazteko.
Propietate orokorrak
hauen bidez definituta hauek dira
Propietate espezifikoak esaterako
hauekin bereizten dira
honela sailkatzen da
Nahasteak izan daitezke
Substantzia puruak esaterako
• Masa
• Bolumena
• Dentsitatea
• Eroankortasun elektrikoa
Nahasteak bereizteko teknikak esaterako
• Dekantazioa
• Iragazketa
• Destilazioa
Gogoan izan zenbakizko ariketen soluzioak anayaharitza.es webgunean kontsultatu ditzakezula.

Materiaren propietateak
1 Adierazi honako hauek zeren neurriak diren: masa, dentsitatea, bolumena edo horietako bat ere ez: a) 3 kg; b) 4 cL; c) 27 m3; d) 3 g/L; e) 690 mm.
2 7 L-ko zenbat txanbil behar dira 3 m3-ko igerileku bat betetzeko? Jar al dezakegu igerileku hori 1 500 kg-ko masa maximoa jasan dezakeen terraza batan? Uraren dentsitatea = 1 kg/L.
3 Zuraren eroankortasun termikoa metalena baino askoz txikiagoa da. Zergatik egiten dira zartaginak metalez, eta kirtenak, berriz, egurrezkoak? Eroankortasun termikoa ezaugarri bereizgarria al da?
Heterogeneoak Koloideak
Sinpleak Konposatuak
Homogeneoak edo disoluzioak
hauekin osatuta
Solutua Disolbatzailea
4 Gurpil logikoa. Material ezberdineko bi barra ditugu, biak luzera eta bolumen berekoak. Horietako batek besteak baino masa handiagoa badu, jakin genezake zer material den? Demagun enuntziatuan aipatzen diren magnitudeen balioak ematen dizkigutela.
Substantzia puruak eta nahasteak
5 Sailkatu material hauek substantzia puruak, nahaste homogeneoak edo nahaste heterogeneoak diren kontuan izanda:



a) Airea c) Burdina
b) Kuartzoa d) Laranja-zukua
6 1-2-4. Adierazi zer alde dagoen substantzia sinple eta elementu kimikoaren artean.
48
Disoluzioak

7 Laborategian 70 g alkohol eta 100 mL ur dituen disoluzio bat prestatu dugu. Adierazi zein den solutua eta zein disolbatzailea.

8 Kalkulatu aurreko ariketako disoluzioaren kontzentrazioa, g/L-tan adierazita.
9 Beste disoluzio bat prestatzen badugu, baina kasu honetan 20 g alkohol erabiliz, zer izango da: aurrekoa baino disoluzio kontzentratuagoa ala disoluzio diluituagoa?
10 Ikuspegi-zirkulua. Ba al dago egoera solidoan dagoen nahasterik? Nahaste homogeneoak ala heterogeneoak dira?
11 Adierazi laborategiko zer material behar duzun 250 mL disoluzioko 10 g gatz dituen disoluzio akuoso bat prestatzeko. Zein da disoluzio horren kontzentrazioa?

12 Talde izenduna. Konparatu dezakegu bi gatzek uretan duten disolbagarritasuna? Garatu bi gatzen artean disolbagarriena zein den aztertzeko prozedura bat.
13 Etxean limoi-ur azukreduna prestatu eta hozkailuan sartzen dugunean, batzuetan ontziaren hondoan azukre multzo handia egin dela ikusten dugu. Azal dezakezu gertakari hori? Gogoratu disolbagarritasuna aldatu egiten dela tenperaturaren arabera.
IKASKUNTZA-EGOERA
HAUSNARTU
14 Gasen disolbagarritasuna jaitsi egiten da tenperatura igotzean. Erabili ebidentzia hori eta azaldu zergatik hiltzen diren arrainak ur beroen isurketen ondorioz.
Nahasteak bereizteko teknikak
15 Adierazi material hauen izenak, eta esan nahaste homogeneoak edo heterogeneoak bereizteko tekniketan erabiltzen diren. a) b)






















16 Diseinatu metodo bat olio, ozpin eta gatz nahaste bat bereizteko. Azaldu erabiliko zenukeen materiala, jarraituko zenituzkeen etapak eta horietako bakoitzak izango lukeen helburua.
17 Zein propietatetan oinarritzen da dekantazio bidezko bereizketa? Gatz-urak bereizi ditzakegu teknika horren bidez? Azaldu zure erantzuna.
18 Solido baten esekidura bat dugu uretan, eta solido-partikulek oso tamaina txikia dute (hautsa). Esekidura hori ontzi batean utzi dugu, eta ikusi dugu partikulek denbora asko behar dutela hondoan jalkitzeko. Zer bereizketa-teknika erabiliko zenuke prozesua bizkortzeko?
Posterraren lehen zatia sortu duzu, beraz, has zaitezke zure gaitasunak hobetzeko gogoeta egiten. Egin anayaharitza.es webgunean eskaintzen dizugun autoebaluazioa, eta eskatu ebaluatu zaitzatela beste talde batzuetako bi pertsonari gutxienez. Zuk beste pertsona bat ebaluatzen duzunean, maila adierazteaz gain, emaizkiozu ideiak, ahulago nabaritu dizkiozun alderdiak nola hobetuko zenituzkeen zehaztuz.
PROBATU ZURE KONPETENTZIAK
Egin anayaharitza.es webgunean konpetentziei buruz dagoen ebaluazioa.
49 U 1
Alderdiak Zeharo lortuta Ondo lortuta Lortuta Ia lortuta
Sumendi bat zer den azaltzeko ikerketa osoa eta zehatza da.
lehen zientzialaritzat, nahiz eta Tyndallen ikerketak Footenak baino hiru urte geroagokoak izan. Berrogei urte igarota, Svante A. Arrheniusek gure planetako berotegi-efektuari buruzko ikerketa horiekin jarraitu zuen.

Gaur egun, badakigu berotegi-efektuko beste gas batzuk (BEG) daudela; esaterako, metanoa, oxido nitrosoa eta gas fluordunak. Berotegi-efektuko gasek Lurraren berotzeari nola egiten dioten bi faktorek baldintzatzen dute: gas horiek atmosferan duten kontzentrazioak eta berotze globalerako potentzialak (BGP). Azken hori kalkulatzeko, kontuan hartzen dira BEGek erradiazio infragorria xurgatzeko duten gaitasuna eta atmosferan irauten duten denbora.
Erantzun honako galdera hauei taldean:
1. Ikuspegi-zirkulua. Eunice Foote zientzialariak ezin izan zuen Circumstances Affecting the Heat of Sun’s Rays izeneko bere ikerketa aurkeztu Zientziaren Aurrerapenerako Amerikar Elkarteak (AAAS) 1856ko abuztuan egindako Urteko Zortzigarren Bileran, emakumea zelako. Bilatu Interneten kasu horri eta komunitate zientifikoan gertatu diren antzeko beste batzuei buruzko informazioa. Gero, eztabaidatu berdintasunaren arloan lortutako gizarte-aurrerapenei buruz, eta erlazionatu 5.5 helburuarekin.


2. Bilatu informazioa Eunice Footek egin zuen esperimentuari buruz, eta azaldu nola egiaztatu ahal izan zituen CO2-k eta ur-lurrunak kliman zituzten ondorioak. Konparatu John Tyndallek erabili zuen muntaiarekin.

3. Zein da karbono dioxidoaren BGPa? Zer BEGek dauka BGP handiena?
4. Diseinatu infografia bat BEGek kliman duten inpaktua lantzeko, eraginari heltzeko, 13.3 helburua lortzeko bidean.
50
2
GJH KONPROMISOA
Zer aurkituko duzu?
Unitate honetan







Berotegi-efektuko gasak
1. Agregazio-egoeren ezaugarriak
2. Materiaren teoria zinetikoa, TZM















3. Presioa eta tenperatura
4. Gasen legeak





5. Egoera-aldaketak
6. Egoera-aldaketen grafikoak
Zientzia-lantegia
Jolaserako zientzia. Olio-koskorrak
Lan praktikoa. Nahaste baten irakitea
anayaharitza.es webgunean
Motibazioari eragiteko:
• Dokumentua: «Ezagutzen al dituzu berotze globalarekin lotutako lanbideak, berotze horren ondorioak gelditzen lagunduko dutenak?».
Zer dakizun argitzeko:
• Ariketa interaktiboa: Hasierako autoebaluazioa.
• Aurkezpena: «Zer jakin behar duzun».
Ikasteko:
• Aurkezpenak: «Urtzea eta baporizazioa» eta «Ikasteko».
• Simulazioa: «Gasen propietateak».
Ebaluatzeko:
• Ariketa interaktiboa: Amaierako autoebaluazioa.
• Zenbakizko ariketen soluzioak.
Eta, gainera, proiektuaren gakoak aplikatzeko beharrezko dokumentazio guztia.
IKASKUNTZAREN SEGIDA
SUMENDIA ERAIKIKO DUGU.
Sumendiaren maketa egiten hasteko unea da, baina aurrena zirriborro bat egin behar duzue. Gainerako taldekideekin batera, erabaki zer diseinu izango duen zuen maketak, eta, horren arabera, aukeratu beharrezkoak dituzuen materialak: kartoia, buztina, egurra, etab. Ados jarri ondoren, hurrengo urratsean eraikitzen hasiko zarete.
KONOA.
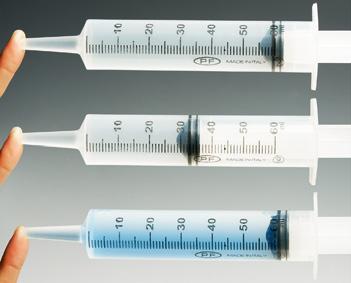
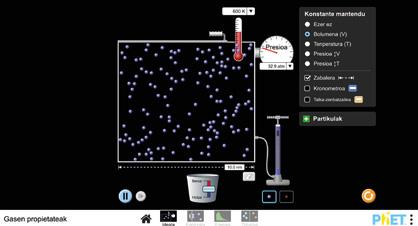
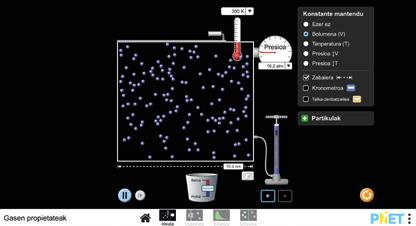
Argi dago sumendia ez dela magma bakarrik, eta osagai gehiago dituela, hainbat egoeratan. Zuen lehen zeregina da aztertzea nola eragiten dion gas baten presioari tenperatura-aldaketa batek, eta gas baten bolumena handitzean bere tenperatura jaisten den. anayaharitza.es webgunean dagoen simulagailu birtuala erabiliz, aztertu nola aldatzen diren tenperatura eta presioa bolumena konstante mantentzen bada, nola aldatzen diren bolumena eta presioa tenperatura konstante mantentzen bada, eta, azkenik, nola aldatzen diren tenperatura eta bolumena presioa konstante mantentzen bada. Hartu hainbat datu eta idatzi porfolioan.
Datu horiekin, saia zaitezte erantzuten ea konoaren tamainak eraginik izango duen sumendiko gasen presioan eta tenperaturan, eta erabili lortutako informazio hori zuen maketaren kasuan.
POSTERRA ETA AMAIERAKO MAKETA.
Eraman posterrera sumendiari buruz izan nahi dugun informazio guztia. Laguntza moduan, erantsi landutako alderdiei buruzko irudiak: sumendiei buruzko argazkiak, labaren irudi termikoak, zein laba solidotuaren mikroskopia-irudiak. Maketa amaitzeko unea ere bada, zuen proiektuari bukatzeko.
+ orientabideak anayaharitza.es webgunean
51
IKASKUNTZA-EGOERA
1
Agregazio-egoeren ezaugarriak
Materia hiru agregazio-egoeratan ager daiteke lurrazaleko presio eta tenperatura baldintzetan: solidoa, likidoa eta gaseosoa. Agregazio-egoera bat beste batetik bereizteko, nahikoa da gure esperientziara jotzea. Hala ere, komenigarria da desberdintasun horiek ezaugarri batzuk aintzat hartuta sistematizatzea.
1.1 Forma, bolumena eta jariatzeko gaitasuna
■ Forma eta bolumena
Egoera solidoan dagoen materiaren forma konstantea da, berdin dio non dagoen; likidoek, berriz, ontziaren formara egokitzen dute bere forma. Biek, solidoek eta likidoek, bolumen propioa dute.


Bestalde, gasek erabilgarri dagoen bolumen guztia hartzen dute; beraz, esango dugu ez dutela ez forma, ez bolumen propiorik.
■ Jariatzeko gaitasuna
Azaldu solidoen forma

Aztertu solidoen forma azaltzeko erabili dugun argazkia; ontzi barruan harri bat jarri beharrean, ontzia hondartzako hareaz betetzen badugu, esan genezake solidoek ere hartzen dutela ontziaren forma?
Gas-egoeran edo egoera likidoan dagoen materiari materia jariakorra ere deitzen zaio, leku batetik bestera modu progresiboan mugitzeko gaitasuna baitu. Materia jariakorraren egoeren arteko desberdintasun nagusia da likidoek bolumen propioa dutela, eta gasek, aldiz, ez. Likido bat ontzitik ateratzen bada, zeukan forma galtzen du, baina ez du aukeran daukan bolumen guztia hartzen; gas batek, ordea, bai, aukeran daukan bolumen guztia hartzen du.

Agregazio-egoeren forma eta bolumena
Materiak egoera solidoan daukan forma ez dago ontziaren formarekin lotuta; solidoek forma propioa dutela esaten dugu. Bolumena ere ez dute aldatzen.
Gasak ontziaren bolumenera egokitzen dira, eta aukeran duten bolumen guztia hartzen dute; horregatik esaten dugu gasek ez dutela bolumen propiorik.
Likidoak ontziaren bolumenera egokitzen dira, baina konstante eusten diote bere bolumenari, likidoa hartzeko ontziaren forma nolakoa den gorabehera.
52
Solidoak Gasak Likidoak
1.2 Konprimatzeko gaitasuna
Konprimitu daitezkeen sistema materialak dira indar baten eraginez bolumena murrizteko gaitasuna dutenak. Beraz, solidoak ezin dira konprimitu, likidoak nekez konprimitzen dira, eta gasak oso konprimagarriak dira.
1.3 Barreiatzeko gaitasuna
Barreiadura da substantzia bat beste batekin nahastu daitekeenean gertatzen den fenomenoa. Gas bat oso azkar barreiatzen da beste batean; horregatik hautematen ditugu hain erraz usainak. Likidoak ere barreiatu daitezke, baina gasak baino motelago. Solidoetan, barreiadura oso motela da; beraz, egongo ez balitz bezala onartzen dugu.
1.4 Biskositatea
Biskositatea da fluidoek mugimenduari jartzen dioten erresistentzia; beraz, zenbat eta biskositate handiagoa izan sistema material batek, orduan eta zailagoa da jarioa. Badira ura baino biskositate handiagoa duten likidoak, esaterako olioa edo eztia. Oso garrantzitsua da biskositatea eta dentsitatea ez nahastea.
Materiaren
Elikagai baten zaporea hautematen dugunean, eragin handia du haren usainak; izan ere, dastamen-papilek ez ezik, usaimenak ere jokatzen du aldi berean, dastamena indartzeko.
ULERTU, PENTSATU, IKERTU
Bi xiringa betetzen baditugu, bata likido batekin eta bestea gas batekin, irteerak itxi eta presioa egiten badiegu, bolumena nabarmen txikituko da gasaren kasuan, baina apenas likidoaren kasuan.
1 Azaldu zer esan nahi duen materia zati bat konprimagarria izateak.
2 Ispilua. Zer alde dago jariatzearen eta barreiatzearen artean? Azaldu adibide baten bidez.
3 Etxe askotan, galdarek erabiltzen duten erregaia hodien bidez iristen da. Erregai solidoa da? Lortu informazioa eta esan zein erregai den eta nondik datorren.
Atera ondorioak gasen dentsitateari buruz
Gasek ez dute bolumen propiorik, presioaren eta tenperaturaren araberakoa baizik. Horregatik, tenperaturaren eta presioaren arabera, gas-masa zehatz batek bolumen handiagoa edo txikiagoa hartuko du. Dentsitatea zein magnituderen mende dagoen kontuan hartuta, beraz, ondoriozta dezakegu gas baten dentsitatea presio- eta tenperatura-baldintzen araberakoa dela?
Fluido batzuek hainbeste handitzen dute biskositatea tentsioa ezartzen zaienean, baldintza horietan solidoen pareko portaera izaten dutela; jariakin ez-newtondarrak esaten zaie.




4 Egin ezaugarri-gurpil bat materiak egoera likidoan dituen ezaugarriei buruz.


5 Zer dela eta diozu hori? Likidoak barreiatu egiten dira? Galdera horri erantzuteko, egin ikerketa txiki bat, tinta eta urez beteriko edalontzi bat erabilita.
6 Lapitzak erdira. Globo aerostatikoek barruko airea berotuta egiten dute gorantz. Jarri taldeka eta eman azalpen bat behaketa horri.
53 U 2 Barreiadura Konpresioa Gasa Gas konprimatua Likidoa Biskositatea
ezaugarriak
2
Materiaren teoria zinetikoa, TZM

Ikusi ditugun ezaugarri guztiak materia deskribatzeko eredu bat erabiliz azal daitezke: teoria zinetiko-molekularra edo materiaren teoria zinetikoa, TZM.

2.1 Teoria zinetikoaren postulatuak
TZM, batez ere, hiru ideiatan oinarritzen da materia deskribatzeko:
1. Materia partikulaz eratuta dago, eta partikula horiek molekulak, atomoak edo ioiak izan daitezke. Garrantzitsua da azpimarratzea materia osatzen duten partikulak substantziaren beraren bereizgarriak direla, ez haren agregazio-egoeraren ezaugarriak. Adibidez, ur likidoa osatzen duten ur-molekulak eta izotza edo lurruna osatzen dutenak berdinak dira.
Nola mugitzen dira partikulak gas batean ?
Gas baten partikulak lerro zuzenean mugitzen dira erabilgarri dagoen bolumen osoan zehar, eta haien ibilbidea librea da, harik eta beste partikula baten kontra edo ontziaren hormen kontra talka egiten duten arte; hori gertatzen bada, norabidea aldatzen dute.
2. Materia osatzen duten partikulak etengabe mugitzen ari dira. Partikulen mugimendua oso bestelakoa da solido, likido eta gas egoeran dauden kontuan izanda; askeagoa da gas-egoeran, eta bibrazioak dira egoera solidoan.
3. Materia osatzen duten partikulek elkar erakartzen dute. Erakarpen-indar horien intentsitatea desberdina da agregazio-egoeraren arabera; egoera solidoan handiagoa da, eta gas-egoeran, berriz, apenas dago erakarpenik.
2.2 Agregazio-egoerak TZMren arabera
Agregazio-egoerak hiru ezaugarriren arabera deskriba daitezke: materia osatzen duten partikulen mugimendua, partikulen arteko erakarpen-indarrak eta partikula horiek oro har daukaten ordena edo desordena.
Beraz, substantzia baten partikulen arteko erakarpen-indarraren intentsitatearen arabera, partikulen mugimendua askeagoa edo mugatuagoa izango da, eta ondorioz, egitura ordenatuagoa edo desordenatuagoa egongo da.
Materiaren ezaugarriak

• Partikulen arteko erakarpen-indarrak oso sendoak dira.
• Partikulen mugimendua bibrazioa baino ez da, ez dira batzuk besteen inguruan mugitzen.
• Egitura ordenatuak dira.

• Partikulen arteko erakarpen-indarrak erdi-mailakoak dira.
• Partikula batzuk besteen inguruan mugitzen dira.
• Solidoek baino egitura desordenatuagoa dute.
• Partikulen artean apenas dago erakarpen-indarrik.
• Partikulen mugimendua askea da ia, eta ez dute norabide eta noranzko zehatzik.
• Egoera desordenatuena da.
54
Solidoa Likidoa Gasa
Agregazio-egoeren ezaugarriak TZMren arabera
JARIATZEKO GAITASUNA
Solidoek forma finkoa dute, bere partikulak ezin baitira bata bestearen inguruan mugitu. Likidoak ontziaren formara egokitzen dira, haien partikulak mugitu egiten baitira, eta, ondorioz, ontziaren hondotik jariatzen dira. Gasetan, apenas dago partikulen arteko erakarpen-indarrik eta, beraz, askatasun osoz mugitzen dira bolumen erabilgarri guztia hartuz.
BARREIATZEKO GAITASUNA
Likidoetan eta solidoetan, partikulen artean dagoen espazioa oso txikia da. Aldiz, gasetan, partikulen artean oso tarte handia geratzen da partikulen tamainarekin alderatuta. Beraz, hutsune horiek beste substantzia baten partikulek har ditzakete, eta, ondorioz, gas bat beste batean barreiatu.
ULERTU, PENTSATU, IKERTU…
7 Bilatu «eten» hitzaren esanahia, eta azaldu honako enuntziatu hau: «TZMren ideietatik abiatuta, materia etena dela baieztatu dezakegu».
8 Pentsatu eta binaka jarrita komentatu. Nabari da partikulen mugimendua solidoetan? Zure esperientziatik abiatuta, esango zenuke TZM oker dabilela egoera solidoa deskribatzean?
9 Nola azaldu zenezake zer den «eredu» bat testuinguru zientifiko batean? Erabili aurreko orrialdean azaldutakoa eta osatu zure azalpena, zientziak ikasi dituzunean erabili izan dituzun beste eredu batzuekin.
10 Azaldu, TZMren ideiak erabilita:
a) Zergatik solidoak ez dira jariatzen?
b) Zergatik gasek ez dute bolumen propiorik, eta likidoek, berriz, bai?
KONPRIMATZEKO GAITASUNA
Sistema material bat konprimitzeko, sistemaren bolumena murriztu egin behar da, eta, beraz, baita materiala osatzen duten partikulen artean geratzen den espazioa ere. Solidoen kasuan, konpresioa hautemanezina da, eta likidoen kasuan, gerta daiteke, baina ia ez da nabarituko. Gasak, berriz, oso erraz konprimatzen dira.
11 Esan honako baieztapen hauek zuzenak ala okerrak diren, eta azaldu zergatik:
a) Egoera solidoan dagoen materia eratzen duten partikulak ez dira mugitzen.
b) Substantzia baten partikulak ez dira berdinak egoera gaseosoan dagoenean eta substantzia hori berori egoera likidoan dagoenean.
c) Gasak oso erraz konprimatzen dira, egoera gaseosoan dauden partikulak txikiagoak direlako egoera likidoan edo solidoan daudenak baino.

12 Bilatu osmosiari buruzko informazioa. Nola erlazionatu dezakezu prozesu hori barreiadurarekin? Azpimarratu partikulen bi mugimendu horiek gure gorputz barruan daukaten garrantzia.
13 Zer da eredu zientifiko bat? Azaldu eta erlazionatu TZMri buruz dakizunarekin.
55 U 2
3


Presioa eta tenperatura
Erabili presioari buruz dakizuna
Zergatik dituzte traktore eta obretako makina batzuek kateak gurpilak eduki beharrean? Azaldu presioari buruz ikasi duzuna erabilita.
Materiaren teoria zinetikoak azalpen bat ematen digu modu makroskopikoan beha ditzakegun magnitudeei buruz. Epigrafe honetan, horietako bi landuko ditugu, presioa eta tenperatura.

3.1 Presioa

Presioa magnitude deribatu bat da, eta honela definitzen dugu: azalera-unitate baten gainean eragiten den indarra. Presioaren SIko unitatea pascala da (Pa), hau da, newton batek metro koadro bateko azaleran eragiten duen indarra: 1 Pa = 1 N/m2
Elurretan gabiltzanean, botekin zapaltzean uzten ditugun arrastoak askoz sakonagoak dira erraketak jantzita ibiltzen garenean uzten ditugunak baino. Gure oinek elurretan eragiten duten indarra berdina da bi kasuetan, baina erraketen azalera boten azalera baino handiagoa da, eta, beraz, ezarritako presioa txikiagoa da erraketen kasuan.
Pentsa dezagun, orain, gas bat daukagula horma zurrunak dituen ontzi batean itxita. Gas horrek presioa eragiten dio ontziari, partikulen mugimenduaren intentsitatearekin zuzenean lotuta dagoen presioa; zenbat eta handiagoa izan presioa, orduan eta handiagoa da partikulen mugimendua, eta handiagoa da partikulen artean eta ontziaren hormen kontra egongo den talka-kopurua ere.
3.2 Presio atmosferikoa
Atmosfera eratzen duen aire-masak lurrazalaren eta lurrazalean dauden sistema material guztien gainean eragiten duen presioari presio atmosferikoa deitzen zaio. Presio horren balioa jaitsi egiten da altitudearekin; izan ere, goraka egiten dugun heinean, gure gainean presioa egiten duen aire-masa txikiagoa da. Itsas mailan, presio atmosferikoak 101 300 Pa-ko balioa du.
Presio atmosferikoaren balioa adierazteko, SIkoak ez diren beste unitate batzuk erabiltzen dira, hala nola atmosferak (atm) edo barrak (bar).
1 atm = 101 300 Pa ; 1,013 bar = 101 300 Pa
56
p2 < p1 p1 p2
Solido baten presioa Gas baten presioa
Presioaren efektuak
3.3 Tenperatura
Presioa bezala, tenperatura ere azal daiteke TZM erabiliz. Tenperatura oinarrizko magnitude bat da, eta SIko bere unitatea kelvina da, K.
Tenperatura zuzenean lotuta dago sistema materiala osatzen duen partikula multzoaren batezbesteko energia zinetikoarekin.
Sistema material baten gaineko tenperaturaren aldaketak eragin desberdinak izan ditzake; adibidez, bolumena aldatzea. Ezaugarri hori gorputzen eta sistema materialen tenperatura neurtzeko erabiltzen da.


3.4 Tenperaturen eskalak
Termometroak tenperatura neurtzen duten tresnak dira. Duela gutxi arte, termometro digitalak ez ziren existitzen, eta, beraz, betikoak erabiltzen ziren: beirazko hoditxo batean itxita likido bat zutenak (merkurioa edo alkohol koloreztatua). Termometroa gorputzarekin kontaktuan jartzean, likidoak hoditxoan gora edo behera egiten zuen, tenperatura igo edo jaitsi ahala.
Zentigradu izeneko tenperatura- eskalak ehun unitatetan banatuta daude, uraren urtze-tenperaturaren eta irakite-tenperaturaren artean.
• Celsius eskalan, uraren urtze- eta irakite-tenperaturak dira, hurrenez hurren, 0 ºC eta 100 ºC, eta honela irakurtzen dira: «zero gradu Celsius» eta «ehun gradu Celsius».
• Kelvin eskalan, uraren urtze- eta irakite-tenperaturak dira, hurrenez hurren, 273 K eta 373 K, eta honela irakurtzen dira: «273 kelvin» eta «373 kelvin».
Celsius eta Kelvin eskalen arteko erlazioa
Energia zinetikoa
Energia zinetikoa da sistema material bati lotzen dioguna m masa edukitzeagatik eta v abiadura jakin batean mugitzeagatik. Honela kalkulatzen da:
v 2 1 c 2 =
TZMren arabera, sistema material baten tenperatura handitzen dugunean, bere partikulen energia zinetikoak ere gora egiten du.
Irudi honetan bi eskala termometrikoen artean dagoen erlazioa ikus dezakezu; elkarrekin erlazionatzeko adierazpen matematiko bat lortzen lagunduko dizu.
14 Egin eskema bat, kontzeptu hauek erlazionatuz: partikulen energia zinetikoa; partikulen abiadura; talka-kopurua; talken intentsitatea; presioa; tenperatura.

15 Azaldu zergatik erabiltzen den presioa neurtzeko tresna bat gurpil baten barruan dagoen aire-kantitatea neurtzeko.
16 Pentsatu eta binaka jarrita komentatu. Zer balio izaten du, normalean, bizikleta bateko gurpilaren presioak? Egokia iruditzen zaizun bizikleta bateko gurpilaren presioa SIko unitateetan adieraztea?
17 Erabili bihurketa-faktoreak honako neurri hauek SIko unitateetan adierazteko, eta atera ondorioak azkeneko bietatik:
a) 0,98 atm b) 1 mbar c) 1 hPa
18 1-2-4. Lortu adierazpen bat Celsius graduetan adierazitako neurri batetik abiatuta tenperatura kelvinetan lortzeko, eta alderantziz. Konparatu zure ondoko ikaskideak lortu duen adierazpenarekin, eta bateratu iritziak. Gero, azaldu ikasgelako beste bikote bati.
19 Erabili aurreko ariketan lortu duzun adierazpena honako tenperatura hauek kelvinetan adierazteko:
a) –10 ºC b) 5 ºC c) 0 ºC
57 U 2
373 K 100 °C 310 K 298 K 273 K 37 °C 25 °C 0 °C Celsius Kelvin
Em
ULERTU, PENTSATU, IKERTU…
4
Gasen legeak
Gas ideala
Lege hauek aztertzeko, gasek modu idealean jokatzen dutela onartuko dugu; hau da, gasa osatzen duten partikulek bolumen gutxiesgarria betetzen dutela ontziaren bolumenaren aldean, eta haien arteko erakarpen-indarrak nuluak direla.
4.1 Gas idealen legeak

Gas idealen legeek gas baten presioaren, bolumenaren eta tenperaturaren arteko erlazioa erakusten dute. Hiru magnitude horietako bat (mendeko magnitudea) nola aldatzen den ikusteko, beste bat (magnitude kontrolatua) konstante mantentzen da, eta hirugarrena aldarazten da (magnitude independentea). Horrela, bada, gas idealen legeak lege enpirikotzat hartzen dira, esperientzian oinarrituta baitaude; hau da, ebidentzia esperimentalak dira. Materiaren teoria zinetikotik abiatuta, behaketa horiei azalpen bat eman dakieke. Ondorengo informazio hau oinarri hartuta, egin hurrengo orrialdeetan ageri den proiektua.


• Boyle eta Mariotteren legea. 1662an, R. Boylek eta E. Mariottek gas baten presioaren eta bolumenaren arteko erlazioa aztertu zuten, tenperatura konstante mantenduz, eta ikusi zuten ontziko bolumena gutxitzean presioa handitzen zela, eta alderantziz.
• Charles eta Gay-Lussacen lehenengo legea. 1802an, J. L. Gay-Lussacek bere izena daraman lege enpirikoa argitaratu zuen, J. Charlesen 1787ko artikulu batean oinarrituta. Lege honek jasotzen du nola aldatzen den gas baten bolumena bere tenperatura igotzean edo jaistean, presioa konstante mantenduz.

• Charles eta Gay-Lussacen bigarren legea. Bolumen konstanteko ontzi batean itxita dagoen gas baten tenperatura handitzean edo gutxitzean presioa nola aldatzen den zehazten du.
Gasen legeak
Pistoiari bultza egitean, punpa barruko bolumena gutxitzen dugu, eta, ondorioz, presioa handitu eta airea irtenarazi.
Airearen tenperatura igotzean, bolumena ere handitu egiten da, eta, ondorioz, dentsitatea txikiagotu egiten da eta globoa igo.
Airearen tenperatura igotzean, lapiko barruko presioa handitu egiten da, ontzia zurruna denez bolumena ezin baita handitu.
58
Boyle eta Mariotteren legea Charles eta Gay-Lussacen 1. legea Charles eta Gay-Lussacen 2. legea
IKT proiektua: Gasen legeak eta TZM
OHAR OROKORRAK
Proiektu hau egiteko, TZMn oinarritu eta gas baten portaeraren simulagailu bat erabiliko dugu, «Gasen propietateak» izenekoa (anayaharitza.es webgunean daukazu). Hiru esperimentuetan, praktika hasteko, gas urdinaren partikulak sartuko ditugu ontzian, eta hasierako presioaren, tenperaturaren eta bolumenaren balioak neurtuko ditugu.
BOYLE ETA MARIOTTEREN LEGEA
1. Tenperatura konstante mantenduko dugu prozesu osoan.
2. Bolumena aldatuko dugu, eta presioarekin zer gertatzen den aztertuko dugu. Lortutako balioak koadernoan idatziko ditugu.
ONDORIOAK
Presioaren eta bolumenaren arteko erlazio matematikoa alderantziz proportzionala da:
p · V = kte. p1 · V1 = p2 · V2
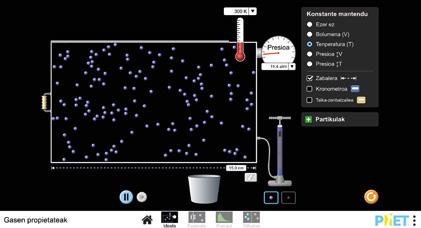
TZMren arabera, zenbat eta abiadura handiagoa izan partikulek, orduan eta talka gehiago partikulen artean eta ontziko hormen kontra. Zer ikusten duzu ontziko bolumena handitzean? Eta gutxitzean? Nola aldatzen da gasaren dentsitatea?
EBATZITAKO ARIKETA
1 Enbolo mugikorra duen zilindro batean gas bat dago itxita, 2,25 atm-ko presioan. Enboloa 13,9 dm3-ko bolumena utzi arte mugituz gero, presioa 0,98 atm-raino jaisten da. Zer bolumen hartzen zuen gasak hasieran?
Ondorengo eskemak aukera ematen digu eskura ditugun datuak eta kalkulatu beharreko magnitude fisikoa bistaratzeko:
p1 = 2,25 atm
V1 = ?
p2 = 0,98 atm
V2 = 13,9 dm3
Boyle eta Mariotteren legetik abiatuta, hau lortzen dugu:
p1 · V1 = p2 · V2
2,25 atm · V1 = 0,98 atm · 13,9 dm3



V1 = 6,05 dm3
20 Ikasle talde batek ikusi du, enbolo mugikorra duen zilindro baten barruan itxita dagoen gas baten bolumena 2,5 dm3-koa denean, eragiten duen presioa 2,0 atm-koa dela. Datu hori jakinda, osatu honako taula honetako balioak, presioa atm-tan eta bolumena dm3-tan adieraziz.
Taula osatu ondoren, irudikatu grafiko bat kalkulatutako datuekin, bolumena X ardatzean jarriz, eta presioa, Y ardatzean.
21 Egiaztatu. Gas bat 3,7 atm-ko presioan itxita badago 4,5 L-ko ontzi batean, eta bolumena 18,5 L-raino handitzen badugu, zer presio izango du gasak orduan? Zer gertatuko litzateke presioa 8,5 atm-raino handituz gero?
59 U 2
p/atm 2,2 0,90 V/dm3 2,5 3,0 6,0
ULERTU, PENTSATU, IKERTU…
IKT proiektua: Gasen legeak eta TZM
CHARLES ETA GAY-LUSSACEN LEHENENGO LEGEA
1. Aktibatu zabaleraren neurriaren bistaratzea.
2. Finkatu presio konstantea eta bolumen aldaketa (azken-aurreko aukera), eta igo eta jaitsi tenperatura. Aztertu zer gertatzen den bolumenarekin.
3. Ondoren, finkatu presio konstantea eta tenperatura aldaketa, eta aldatu bolumena, ganbara zabalagoa edo estuagoa eginez. Aztertu zer balio hartzen dituen tenperatuk bolumenaren balio bakoitzerako.
ONDORIOAK
Tenperaturaren eta bolumenaren arteko erlazio matematikoa zuzenean proportzionala da:
Ondo dakigunez, gas baten partikulek eskuragarri duten bolumen osoa hartzen dute. Tenperatura igotzean, TZMren arabera, partikulen abiadura handitu egiten da. Beraz, talken kopurua eta intentsitatea aldatzen ez badira (presioa konstantea da), horrek esan nahi du partikulek leku handiagoa zeharkatzen dutela? Nola eragiten dio horrek bolumenari? Eta gasaren dentsitateari?
EBATZITAKO ARIKETA
2 15,0 m-ko altuera eta 2,5 m-ko erradioa duen zilindro batek hormetako bat mugikorra du, eta -10 ºC-ra dagoen gas bat dauka barruan. Gasa 0 ºC-raino berotzen bada, zer bolumen hartuko du orain gasak?
Problema hau ebatzitako 1. ariketan egin dugun bezala planteatuko dugu, eta aurrena zilindroaren bolumena kalkulatuko dugu:
Hasierako egoera
V1 = 294,4 m3
T1 = –10 + 273 = 263 K

ULERTU, PENTSATU, IKERTU…
22 Gas-masa batek berotu ahala zer bolumen hartzen duen neurtu dugu, termometro bat akoplatuta duen enbolo mugikorreko zilindro batekin. Lortutako balioak taulan agertzen dira:
Amaierako egoera
V2 = ?
T2 = 0 + 273 = 273 K
Charles eta Gay-Lussacen lehenengo legea erabilita, emaitza hau lortzen dugu:
a) Egiaztatu V/ T koefizientea konstantea dela.
b) Adierazi grafikoki balio-bikoteak, kontuan izanda tenperaturak kelvinetan egon behar duela.
c) Kalkulatu, grafikotik abiatuta, zer bolumen beteko lukeen gasak t = 35 ºC-ra.
23 Hormetako bat mugikorra duen ontzi zurrun batean, 40 L-ko bolumena hartzen duen gas bat sartu dugu 60 °C-an. Presioa konstantea bada eta tenperatura 130 °C-raino igo bada, zer gertatu zaio gasari: hedatu edo konprimatu egin da?
60 4 Gasen legeak
k T V T V T V te 1 1 2 2 ==
V 7 263 K 294, 4m 23 K 2 3 = ⟶ , V 3056 m 2 3 =
t/º C 10 25 40 60 85 V/dm3 15,0 15,9 16,7 17,5 19,1
CHARLES ETA GAY-LUSSACEN BIGARREN LEGEA
1. Bolumena konstante finkatuko dugu.
2. Ondoren, tenperatura igo eta jaitsiko dugu, eta presioarekin zer gertatzen den aztertuko dugu.
ONDORIOAK
Kasu honetan, tenperaturaren eta presioaren arteko erlazio matematikoa zuzenean proportzionala da:
Presioa aldatu egiten da tenperaturaren eraginez. Ikusten dugun bezala, presioa handitu egiten da tenperatura igotzen bada, baina beste zer eratara handitu genezake presioa tenperatura eta bolumena aldatu gabe? Azaldu zergatik erabiltzen den presioaren neurri bat pneumatiko batek duen aire-kantitatea kuantifikatzeko.
EBATZITAKO ARIKETA
3 Horma finkoak dituen zilindro batek gas-masa jakin bat dauka, 12,5 atm eta 40 ºC-tan. Jasan dezakeen presio maximoa 25,0 atm-koa bada, zein tenperaturaraino berotu ahal izango da arriskurik gabe?
Problemaren planteamendua honako eskema honetan ageri da, kontuan izanda tenperatura kelvinetan adierazi behar dela:
Hasierako egoera
p1 = 12,5 atm
T1 = 40 + 273 = 313 K
Amaierako egoera
p2 = 25,0 atm
T2 = ?
, T 313 25 0 K 12,5 atmatm 2 = ⟶ T 626K (353 ºC) 2 =

Beraz, presioa bikoiztu bada, tenperatura ere bikoiztu egin delako da. Horretarako, ariketa Kelvin eskalan ebatzi behar da, orduan soilik gertatzen baita.
24 Zer presiotan dago gas bat 70 °C-ko tenperaturan, 20 °C-an zegoela 1 atm-ko presioan bazegoen eta bolumena aldatu ez bada?
25 Bolumen konstantea duen ontzi batean itxita dagoen gas batek honako jarrera hau du:
Kalkulatu grafikoa osatzeko falta diren magnitudeen balioak, eta irudikatu dagokien grafikoa, presioa X ardatzean eta tenperatura Y ardatzean jarriz.
26 Globo baten barruan gas baten 35 L daude, 1,3 atm-ko presioan. Badakigu izan dezakeen bolumen maximoa 55 L-koa dela. Zer presio izango du gehienez egoera horretan?
61 U 2
k T p T p T p te 1 1 2 2 ==
p/atm 0,1 0,5 2,0 2,7 T/K 30 300
ULERTU, PENTSATU, IKERTU…
5.1 Egoera-aldaketak
Presio- eta tenperatura-baldintzak era batekoak edo bestekoak diren kontuan izanda, substantzia bera agregazio-egoera batean edo bestean ager daiteke; beraz, baldintza horiek aldatuz gero, egoera-aldaketa eragin daiteke.

Egoera-aldaketa da sistema material batek jasaten duen aldaketa fisikoa agregazio-egoera batetik bestera pasatzen denean.
5.2 Egoera-aldaketen ezaugarriak
Egoera-aldaketa edozein dela ere, hau betetzen da:
• Presio-balio jakin baterako, egoera-aldaketa tenperatura-balio finko batean gertatzen da, eta balio horri egoera-aldaketaren tenperatura deritzo. Substantzia bakoitzak bere balioa du.
• Egoera-aldaketa gertatu bitartean, tenperatura ez da aldatzen, nahiz eta hozten edo berotzen aritu.
• Egoera-aldaketak itzulgarriak dira; kontrako aldaketa egiten badugu, berotuz edo hoztuz, materia jatorrizko egoerara itzuliko da.
Egoera-aldaketa bat gerta dadin, beharrezkoa da:
• Sistema hoztea egoera-aldaketa gertatzeko tenperaturara iritsi arte, eta egoera-aldaketa gertatu bitartean hozten jarraitzea. Horrelakoak egoera-aldaketa erregresiboak dira, eta hiru dira: alderantzizko sublimazioa, kondentsazioa eta solidotzea. Egoera-aldaketa horietan, abiapuntuko agregazio-egoera desordenatuagoa da sistemak egoera-aldaketa gertatu ondoren daukana baino.
• Sistema berotzea egoera-aldaketa gertatzeko tenperaturara iritsi arte. Horrelakoak egoera-aldaketa progresiboak dira, eta hiru dira: sublimazioa, baporizazioa eta urtzea edo fusioa. Erregresiboetan gertatzen den kontrara, kasu honetan abiapuntuko egoera ordenatuagoa da, eta aldaketaren ondoren dagoena, desordenatuagoa.
Urtzea Solidotzea
62
Gasa
Kondentsazioa Alderantzizkosublimazioa Baporizazioa Sublimazioa
Solidoa
Likidoa
Egoera-aldaketak
Egoera-aldaketak 5
5.3 Egoera-aldaketen tenperaturak
Aldaketa progresibo bakoitzari erregresibo bat dagokio. Emandako presio baterako, egoera-aldaketa bikote bakoitza gertatzeko behar den tenperatura bereizgarria da substantzia bakoitzean, eta beti da berdina.
• Urtze-tenperatura (Tu) da urtzea eta solidotzea gertatzen diren tenperatura, bi egoera-aldaketak tenperatura berean gertatzen baitira. Uraren kasuan, solidotze- eta urtze-tenperatura 0 °C da presio atmosferikoaren kasuan. Beraz, 0 °C-an ura egoera likidoan eta egoera solidoan (izotza) dago.
• Irakite-tenperatura (Ti) da baporizazioa izeneko egoera-aldaketa likidoaren masa osoan gertatzen den tenperatura (irakitea). Tenperatura horretan, gasetik likidorako kondentsazioa ere aldi berean gertatzen da. Urak 100 ºC-ko irakite-tenperatura du presio atmosferikoan. Presioa txikiagoa bada irakite-tenperatura txikiagoa da, eta presioa handiagoa bada irakite-tenperatura handiagoa da.
Urtze- eta irakite-tenperaturak bereizgarriak dira substantzia bakoitzean; beraz, propietate espezifikoak dira, eta substantzia bat beste batetik bereizteko modua ematen digute.
5.4 Baporizazio-moduak: irakitea eta lurruntzea
Likidotik gaserako egoera-aldaketa bi modutakoa izan liteke: irakitea eta lurruntzea. Presio jakin batean, irakitea beti gertatzen da tenperatura-balio finko batean; lurruntzea, berriz, azalekoa da eta tenperatura-tarte zabal batean gertatzen da. Irakitea fenomeno azkarra da, eta likidoaren masa osoan aldi berean gertatzen da. Lurruntzea, berriz, askoz motelagoa da eta likidoaren gainazalean bakarrik gertatzen da. Aztertu ondoren ageri diren adibide hauek:
Baporizazioaren bi moduak: lurruntzea eta irakitea
Lurruntzea Irakitea
ULERTU, PENTSATU, IKERTU…
27 Bilatu uraren, etanolaren eta merkurioaren urtze- eta irakite-tenperaturak. Erantzun honako galdera hauei:
a) Zer agregazio-egoeratan dauden substantzia horiek –10 °C, –50 °C, 10 °C eta 120 °C-tan?


b) Zer agregazio-egoeratan dago ura 0 °C-an? Eta etanola –114 °C-an?
28 Kontsultatu anayaharitza.es webgunean, urtzea eta baporizazioa TZMtik abiatuta azalduz ageri diren aurkezpenak. Gero, definitu zure hitzak erabiliz:


a) Solidotzea.
b) Sublimazioa.
c) Baporizazioa.
29 Substantzia guztiak ez dira sublimatzen. Bilatu sublimatzen den substantzia bati buruzko informazioa, eta azaldu.
30 Bilatu -t(z)ea eta -zio atzizkien esanahia. Zer aditzetatik abiatuta eratzen dira egoera-aldaketak izendatzeko erabiltzen dituzun izenak?
63 U 2
Aldaketa progresiboa da eta likidoaren gainazalean gertatzen da, tenperatura-tarte zabal batean, urtze-tenperaturatik irakite-tenperaturaraino.
Bat-bateko aldaketa da, eta likidoa bat-batean pasatzen da gas-egoerara. Partikula bereizien agregatuak sortzen dira, gas-egoeran, likidoaren masa osoan.
6

Egoera-aldaketen grafikoak
6.1 Bero eta tenperatura nozioak
Egoera-aldaketak gertatzeko modu bat da sistemaren tenperatura aldatzea. Horretarako, energia trukatu behar da bero moduan sistemaren eta inguruaren artean.
• Bero moduan trukatzen den energia kanpotik sistemara egiten bada, sistema berotzen dugula diogu. Sistemaren energia termikoa handitu egiten da.
• Aldiz, bero transferentzia sistematik kanpora (ingurura) egiten bada, sistema hozten dugula diogu, eta energia termikoa murrizten dela.
6.2 Egoera-aldaketa progresiboen grafikoa
Energia termikoa
Aurrerago ikusiko dugunez, energia termikoa sistema material bat osatzen duten partikulen mugimenduarekin lotuta dago; beraz, lotura zuzena du partikula horien energia zinetikoarekin.
Sistemaren energia termikoa handitzen dugunean, partikulen energia zinetikoa handitu egiten da eta bi egoera gerta daitezke:
• Partikulen energia zinetikoa handitzearen ondorioz tenperaturaren igoera gertatzen da.
• Partikulen energia zinetikoa handitzearen ondorioz, aldatu egiten da partikula batzuek besteekiko duen mugimendua, baita haien arteko erakarpen-indarren intentsitatea ere, eta, beraz, egoera-aldaketa gertatzen da.
Hurrengo grafikoa hau lortu dugu uraren lagin solido bat (izotza) gas-egoerara arte etengabe berotuta. Horretarako, tenperatura denbora-tarte konstantetan neurtuko dugu. Ikusten duzunez, tenperaturak goraka egiten du, egoera-aldaketa gertatzen denean izan ezik; aldaketa dagoenetan, tenperaturak konstante irauten du denbora batez.
1 Hornitutako energiak solidoaren partikulen agitazioa areagotzen du, eta bere tenperatura igotzen du.
2 Urtze-tenperatura. Energia erabiltzen da partikulei askatasuna emateko, likidoa bihurtuz. Tenperatura ez da aldatzen egoera-aldaketa gertatu bitartean.
3 Solido guztia urtu ondoren, energia erabiltzen da tenperatura igotzeko, hau da, partikulen abiadura handitzeko.
4 Irakite-tenperatura. Baporizazioa bat-batean gertatzen da. Tenperatura baxuagoetan, gainazalaren lurruntzea gertatu da, baina orain tenperaturak konstante iraungo du irakitea gertatu bitartean.
5 Berotzen jarraitzen badugu, tenperatura gero eta handiagoa duen lurruna lortuko dugu (lurrun gainberotua).
64
Uraren beroketaren grafikoa t/min –25 25 50 75 100 125 0 T/°C Tenperatura (ºC) Solidoa Solidoa eta likidoa Likidoa Likidoa eta gasa Gasa 1 2 3 4 5
6.3 Egoera-aldaketa erregresiboen grafikoa
Demagun kontrako esperimentua egiten dugula, hau da, abiapuntua gas-egoeran dagoen sistema material bat dela, eta sistemaren tenperatura murrizten goazela, egoera-aldaketa gertatzeko tenperaturara iritsi arte. Egoera-aldaketa gertatu bitartean, tenperaturak konstante iraungo du, egoera-aldaketa progresibo bat gertatzen denean bezala.
Egoera-aldaketa progresibo baten tenperatura eta horri dagokion egoera-aldaketa erregresiboarena berdinak da. Esan dezakegu tenperatura horretan bi agregazio-egoerak batera daudela.
Substantzia baten urtze- eta irakite-tenperaturetatik abiatuta, modua dago egoera-aldaketa progresiboen eta erregresiboen grafikoa eskematikoki marrazteko. Aztertu ondorengo ariketa ebatzia.
Konparatu bi substantziaren egoera-aldaketaren tenperaturak
Aztertu azetonaren urtze- eta irakite-tenperaturen balioak (4. ariketa ebatzian) eta urarenak. Imajinatu azetona eta ura ditugula 10 °C-an, eta berotu egiten ditugula. Egoera-aldaketa maila energetiko txikiagoan gertatuko da azetonaren kasuan. Informazio hori oinarri hartuta, aurreikusi zein substantziatan (ura edo azetona) diren handiagoak partikulen arteko erakarpen-indarrak.
4 Azetonaren urtze- eta irakite-tenperaturak –95 °C eta 56 °C dira, hurrenez hurren.
Marraztu eskematikoki substantzia horren berotze-kurba eta, hortik abiatuta, adierazi zein agregazio-egoeratan egongo den tenperatura hauetan:
a) 0 °C.
b) 100 °C.
Hozte-kurbaren eskema bat eraikiko dugu, eskuineko irudian adierazitako horren modukoa. Ez dakigu zein den substantzia horrek hozten ari denean edo egoera-aldaketa erregresiboetan askatzen duen energiaren balioa; beraz, abzisa-ardatzeko eskala arbitrarioa da (energia erritmo konstantean xurgatzen dela suposatzen badugu, abzisa-ardatzean prozesuak irauten duen denbora jar dezakegu, xurgatutako energiaren ordez, eta, horrela, grafikoa esperimentalki egiteko, tenperatura denbora-tarte finkoetan neurtuko dugu).
0 °C-an, azetona egoera likidoan egongo da, eta 100 °C-an gas egoeran egongo da.
ULERTU, PENTSATU, IKERTU…
31 Azaldu honako baieztapen hau zuzena ala okerra den: «Substantzia guztiak izozten dira 0 °C-an eta denek irakiten dute 100 °C-an».
32 Eraiki etanolaren berotze- eta hozte-grafikoak, jakinda substantzia horren urtze-tenperatura –117 °C-koa dela, eta irakite-tenperatura, 79 °C-koa.
65 U 2
EBATZITAKO ARIKETA t/min –140 –100 –80 –120 –20 20 40 0 60 80 100 120 140 160 –60 –40 T/°C
Zientzia-lantegia
Jolaserako zientzia
Olio- eta ur-koskorrak: substantzien dentsitateak agregazio-egoera desberdinetan
Sarrera
Eskura dugun substantzia ohikoena ura da. Bere formula kimikoa H2O da, eta ezinbestekoa da planetarentzat eta gure mantenugai nagusietako bat da. Uraren ezaugarri asko aldendu egiten dira gainerako substantzien ezaugarrietatik, nahiz eta egunero erabiltzen dugun substantzia izanik ezagunak zaizkigun. Izan ere, ura salbuespena da ia edozertarako.

Aztertu
Izotzak flotatu egiten du ur likidoan. Hala ikusten dugu kasu hauetan:
• Izotz eta guzti daukan freskagarri bat edatean; izotzek flotatu egiten dute, ez dira hondoan geratzen.
• Aintzira edo putzu batean gogortu den izotza ukitzean dugunean; izotza putzuaren ur-azalean eratzen da eta ez da hondoratzen.
Materiala

• Ura • Oliba-olioa • Izotz-koskorrak egiteko ontzia • Izozkailua
• Bi edalontzi • Plastikozko koilara.
Egin esperimentua
• Bete izotz-koskorrak egiteko ontziaren erdia urez, eta beste erdia, oliba-olioz.
• Sartu ontzia izozkailuan eta eduki han egun bat.
• Atera ur-koskor solidoak eta bota goraino urez beteta dagoen edalontzi batera.
• Bete edalontzi bat oliba-olioz eta, kontu handiz, bota olio-koskor solidoak barrura.
Hausnartu
Konparatu urez beteriko edalontzian eta olioz beterikoan gertatzen dena. Lehenengoan, solidoak likidoan flotatzen du, eta bigarrenean, solidoa likidoan hondoratzen da. Beraz, argi dago ur solidoaren (izotza) dentsitatea ur likidoarena baino txikiagoa dela, eta kontrara gertatzen dela olioaren kasuan.
Ondorioak
Normalean, substantzia batek dentsitate handiagoa du egoera solidoan egoera likidoan baino, substantzia eratzen duten partikulak banatuago daudelako egoera likidoan, eta bolumen handiagoa betetzen dutelako masa bera izanik. Hori gertatzen da olioaren kasuan. Baina uraren kasuan, molekulek itxura berezia eta aparteko propietate elektrikoak dituztenez, egoera solidoan egitura irekiagoa eta dentsitate txikiagokoa eratzen dute.
Urrats bat gehiago...
Nire lehengo eta oraingo iritzia. 13.2 helburutik abiatuta, erantzun:
1. Azken hamarkadetako joeraren arabera, itsas mailak gora egiten jarraituko du. Zergatik gerta liteke?
2. Nola eragiten dio kontinenteetako eta ozeanoetako izotzen urtzeak itsasoaren mailari?
66
Lan praktikoa
Nahaste baten irakitea
Problemaren planteamendua. Helburua
Lan praktiko honen helburua da etanolaren eta uraren nahaste baten egoera-aldaketa bat behatzea eta zer tenperaturatan gertatzen den erregistratzea.
Hasi aurretik
Irakurtzen jarraitu baino lehen, bilatu etanolaren eta uraren irakite-tenperaturei buruzko informazioa, baita nahaste baten egoera-aldaketaren tenperaturak izaten duen bilakaerari buruzkoa ere.
Prozedura
Substantzia puru baten egoera-aldaketan, tenperatura ez da aldatzen. Baina nahaste bat bada, tenperatura aldatu egiten da pixkanaka. Behatu eta erregistratu etanolaren eta uraren nahaste baten irakite-tenperatura, esperientzian zehaztutako urratsei jarraituz.

Materialak





• Hondo biribila eta alboko adarra dituen matrazea
• Hozgarria
• Termometroa



• Euskarria
• Tapoi zuloduna
• Pintza • Intxaur bikoitza

Beharrezko materiala.
Esperientzia egiteko jarraibideak
• Bero iturria • Goma konektoreak • Ur txorrota.
• Prestatu nahaste bat, ura eta etanola bolumen berdinetan dituena. Proportzioa gutxi gorabeherakoa da.
• Bota nahastea hondo biribileko matrazera. Sartu termometroa zulodun tapoian eta itxi matrazea.
• Sartu matrazearen alboko adarra hozgarrian eta konektatu hozteko ura.
• Ezarri bero iturria matrazeari; aurrez, lotu euskarrira intxaur bikoitzaren eta pintzaren laguntzaz.
• Erregistratu tenperatura denbora-tarte berdinetan, berotze-abiadurari konstante eutsiz. Markatu zer tenperaturatan hasi den irakitea.
• Bildu emaitzak taula batean.
ATERA ONDORIOAK
1 Zer tenperaturatan hasi da irakiten nahastea? Ikusi duzu lurruna askatu ote den irakiten hasi baino lehen? Nola azalduko zenuke gertakari hori? Zer likidok irakiten du lehenengo?
2 Egin grafiko bat esperimentuan lortutako emaitzekin. Adierazi zer tenperaturatan hasi den nahastea irakiten.
3 Grafikotik abiatuta, esan tenperaturak konstante irauten duen egoera-aldaketa gertatu bitartean.
4 Bilatu uraren eta etanolaren egoera-aldaketaren grafikoari buruzko informazioa, eta konparatu esperientzia honetan lortu duzunarekin.
5 Zer alde egongo litzateke emaitzetan esperientzia hau etanol puruarekin egin izan bagenu?
67 U 2
Esperientzia egiteko muntaia.
Amaitzeko
ULERTU
Antolatu zure ideiak Kontzeptu-mapa sistemikoa
1 Kopiatu eskema zure koadernoan, eta osatu zuriuneak unitatean zehar ikasitakoarekin.
2 Idatzi testu bat presioaren eta teoria zinetikoarekin ideien arteko lotura azalduz.

agertzeko moduak
agregazio-egoerak
deskribatzeko
Teoria zinetiko-molekularra
hau ere azaltzen du
Ideia nagusiak
Partikulaz eratutako materia Partikulak mugimenduan Partikulak elkarri eragiten
Solidoa ? ?
presioa konstantea bada, honen araberakoa
Agregazio-egoeren ezaugarriak
hiru dira
Tenperatura
aldatuz gero, hauek gertatzen dira
Egoera-aldaketak
Solidotzea
Alderantzizko sublimazioa
Gogoan izan zenbakizko ariketen soluzioak anayaharitza.es webgunean kontsultatu ditzakezula.


1 Taldeka interpretatu. Adierazi ondorengo baieztapen hauek zuzenak ala okerrak diren, eta arrazoitu:
a) Bai likidoak, bai gasak, erraz konprimatzen dira; hau da, bolumena murriztu diezaiekegu, presioa ezarrita.
b) Gasek ez dutela forma propiorik esaten dugu, jariatu daitezkeelako.
hau betetzen dute
Gasen legeak
adierazteko, grafiko hauek
Progresiboak
Urtzea
Materiaren teoria zinetikoa
Berotzea
Hoztea
Materia ? ? ? ? ? ? ?
2 Esan baieztapen hauetako zein diren okerrak:
a) Materia jarraitua da.
b) Egoera solidoa eratzen duten partikulak ez dira ezertxo ere mugitzen.
c) Substantzia jakin bat eratzen duten partikulak desberdinak dira substantzia egoera solidoan, likidoan edo gaseosoan egon.
d) Materia eratzen duten partikulen arteko erakarpen-indarrak oso indartsuak dira gas egoeran, eta apenas daude egoera solidoan.
68
Presioa eta tenperatura
3 Egin lauren arteko eskema bat, eta erlazionatu egoera gaseosoan dagoen materia nolakoa den TZMren arabera (partikulak, abiadura, talkak) eta behagarriak diren presio eta tenperatura magnitudeak.

Gasen legeak
4 Azaldu gasen jokabideari buruzko honako baieztapen hauek zuzenak ala okerrak diren:
a) Ontzi zurrun batean itxita dagoen gas baten tenperatura handitzean, bere presioa txikitu egiten da.
b) Ontzi batean itxita dagoen gas baten bolumena txikitzean, tenperatura konstante mantenduz gero, gasak egiten duen presioa handitu egiten da.
5 Adierazi grafiko batean taulan gas bati buruz ageri diren presio- eta bolumen-balioak.
p/atm 1,5 1,2 0,9 0,6 0,3 V/L 0,18 0,225 0,3 0,45 0,9




















Adierazpenetik abiatuta, kalkulatu zer presio eragingo duen gutxi gorabehera gasak, SIko unitateetan, bolumena 0,7 L-koa denean.
6 Enbolo mugikorra duen 2,5 m3-ko zilindro batean nitrogenoa dago. Hasieran p = 13,0 atm bada, eta presioa 19,5 atm-raino handitu badugu, zer egingo du enboloak: igo ala jaitsi? Zer bolumen beteko du gasak?
7 Zer gertatuko litzateke sukaldeko presio-lapiko bat asko berotuko balitz eta segurtasun-balbulak huts egingo balu?
IKASKUNTZA-EGOERA
HAUSNARTU
8 Enbolodun zilindro bat 15 °C-ra dagoen 25 cm3 airez bete dugu. Ontziaren bolumen maximoa 30 cm3-koa bada, zer tenperaturaraino berotu dezakegu p = kte izanik?
Egoera-aldaketak
9 Azaldu uraren zikloa, gertatzen diren egoera-aldaketak aipatuz. Zer tenperatura-tartetan gertatzen da ziklo osoa? Zein da uraren irakite-tenperaturaren balioa? Zergatik ez dago tenperatura hori uraren ziklo osoaren tenperatura-tartean barneratuta?
Egoera-aldaketen grafikoak
10 Adierazi grafiko honetan zer tarte dagozkion tenperatura igoera bati eta zeinetan gertatzen den egoera-aldaketa bat. Idatzi zein den kasu bakoitzean gertatzen den egoera-aldaketa

Osatu ariketa, TZM erabili eta grafikoaren tarte bakoitzean zer gertatzen den azalduz. Marraztu substantzia horren hozte-grafiko osagarria, eta partekatu zure ondorioak gainerako ikaskideekin.
Urratsez urrats zure ikerketaren amaierara heldu zara. Deskargatu anayaharitza.es webgunean eskaintzen dizugun autoebaluazioa, eta eskatu ebaluatu zaitzatela zure taldeko gutxienez bi pertsonari. Informazio horrekin, hausnartu zer alderdiri eutsi behar diezun orain arte bezala eta zein hobetu beharko zenituzkeen; pentsatu garatu nahi dituzun alderdi horietan emaitza hobeak lortzeko ekintza zehatzak.
PROBATU ZURE KONPETENTZIAK
Egin anayaharitza.es webgunean konpetentziei buruz dagoen ebaluazioa.
69 U 2
Alderdiak Zeharo lortuta Ondo lortuta Lortuta Ia lortuta
Sumendiari buruzko ikerketa osoa eta zehatza izan da.
t/min –25 25 50 75 100 0 T/°C 85 10
© GRUPO ANAYA, S.A., 2022 - C/ Valentín Beato, 21 - 28037 Madrid.
Eskubide guztiak gordeta. Legeak lan honen edukia babestu eta espetxe-zigorrak edota isunak eta kalte-galeren ondoriozko kalte-ordainak ezartzen ditu honako hauentzat: edozein literatura-lan, artelan zein zientzia-lan, edo horren eraldaketa, interpretazioa edo gauzapena (edozein euskarritan finkatuta edo edozein eratan komunikatuta), oso-osorik edo zati batean, baimenik gabe erreproduzitu, plagiatu, banatu edo komunikatzen dutenentzat.


















































































































