INCLÚE PROXECTO DIXITAL
LICENZA 12 MESES
QUÍMICA

José Illana Rubio
José Antonio Araque Guerrero, Alfredo Liébana Collado
José M.ª Teijón Rivera

INCLÚE PROXECTO DIXITAL
LICENZA 12 MESES

José Illana Rubio
José Antonio Araque Guerrero, Alfredo Liébana Collado
José M.ª Teijón Rivera
Desafíos que deixan pegada
• A miña casa está feita de química
• Constrúe un reloxo químico
• Aire limpo
• Natural é mellor
10
As reaccións químicas e o seu control
1. Composición da materia
2. Unidade da cantidade de substancia: o mol
3. O estudo dos gases
4. Determinación de fórmulas químicas
5. Disolucións. Unidades de concentración
6. Estequiometría das reaccións químicas
Cultura científica. A alquimia
Estratexias de resolución de problemas
Os isótopos na agricultura e a alimentación
1. Evolución dos modelos atómicos
2. Natureza electromagnética da luz
3. Espectros atómicos
4. Orixes da teoría cuántica
5. O efecto fotoeléctrico
6. Modelo atómico de Bohr
7. Mecánica cuántica
8. Orbitais atómicos. Números cuánticos
9. Partículas subatómicas. Orixe do universo
Cultura científica. O LHC e o bosón de Higgs
TIC. O estudo do efecto fotoeléctrico Estratexias de resolución de problemas
A táboa periódica dos elementos químicos
1. Cronoloxía dos elementos químicos
2. Lei de Moseley
3. Configuracións electrónicas dos átomos
4. Sistema periódico actual
5. Propiedades periódicas dos elementos
6. Táboa periódica e reactividade química
Cultura científica. D. I. Mendeléiev
Estratexias de resolución de problemas
Nanotecnoloxía e novos materiais
1. Átomos unidos por enlace químico
2. Enlace iónico
3. Enlace covalente
4. Teoría do enlace de valencia
5. Teoría da hibridación de orbitais atómicos
6. Teoría de repulsión dos pares electrónicos da capa de valencia
7. Enlace metálico
8. Forzas intermoleculares
9. Enlaces presentes en substancias con interese biolóxico
Cultura científica. Novos materiais
TIC. Xeometría molecular
Estratexias de resolución de problemas
Termodinámica e vulcanoloxía
1. Sistemas termodinámicos
42
6
82
2. Primeiro principio da termodinámica
3. Aplicación do primeiro principio da termodinámica ás reaccións químicas
4. Ecuacións termoquímicas. Entalpía de reacción. Diagramas entálpicos
5. Entalpías de formación. Entalpías de enlace
6. Segundo principio da termodinámica
7. Criterios de espontaneidade
8. Consecuencias sociais e ambientais das reaccións químicas de combustión
Estratexias de resolución de problemas
Traballa co aprendido
As reaccións explosivas
1. Velocidade dunha reacción química
2. Ecuación de velocidade
3. Teoría de colisións e teoría do estado de transición
4. Mecanismo de reacción
5. Factores que afectan a velocidade de reacción
6. Catálise
7. Aplicacións da catálise
Cultura científica. Cinética dunha reacción
Estratexias de resolución de problemas
188
168
Os equilibrios na vida diaria
1. Reaccións químicas reversibles
2. Estudo do equilibrio químico
3. Formas de expresión da constante de equilibrio
4. Cociente de reacción e sentido da reacción
5. Equilibrio en varias etapas
6. Grao de disociación: outra aplicación da lei de masas
7. Factores que afectan o equilibrio: principio de Le Châtelier
8. Equilibrios heteroxéneos: formación de precipitados
9. Factores que afectan a solubilidade dos precipitados
10. Precipitación fraccionada
11. Os equilibrios na vida cotiá e na natureza
Cultura científica. Síntese industrial do amoníaco Estratexias
Os ácidos e as bases na vida diaria
1. Conceptos de ácido e de base
2. Forza dos ácidos e das bases
3. Medida da acidez. Concepto de pH
4. Hidrólise de sales
5. Disolucións reguladoras
6. Volumetrías de neutralización ácido-base
7. Ácidos e bases na industria
Cultura científica. Biografías
Estratexias de resolución de problemas
O papel antioxidante dos alimentos
1. Reaccións de oxidación-redución
2. Número de oxidación
3. Axuste redox polo método do ión-electrón
4. Estequiometría das reaccións redox
5. Celas electroquímicas
6. Potenciais de electrodo e potencial dunha cela
7. Espontaneidade das reaccións redox
8. Valoracións redox
9. Electrólise
10. Proxectos industriais de electrólise
11. Aplicacións e repercusións das reaccións redox
Cultura científica. Reaccións redox na vida cotidiana
TIC. Simulador de electrólise
Estratexias de resolución de problemas
202
Produtos derivados do carbono
1. Características dos enlaces do carbono
2. Representación das moléculas orgánicas
3. Hibridación de orbitais
4. Isomería
5. Grupos funcionais e series homólogas
6. Nomenclatura e formulación orgánica
7. Hidrocarburos
8. Compostos osixenados
9. Compostos nitroxenados
10. Tioles e perácidos
11. Compostos orgánicos polifuncionais
Cultura científica. Historia da química orgánica
TIC. Moléculas orgánicas. Molview
Estratexias de resolución de problemas
234
Importancia das reaccións dos compostos do carbono
1. As reaccións orgánicas
2. Mecanismos das reaccións orgánicas
3. Tipos de reaccións orgánicas
4. Reaccións de hidrocarburos
5. Reaccións dos derivados haloxenados
6. Reaccións de alcohois e fenois
7. Reaccións de aldehidos e cetonas
8. Reaccións de ácidos carboxílicos
9. Reaccións de compostos nitroxenados
10. Compostos orgánicos de interese industrial Cultura científica. Deseño de medicamentos
Estratexias de resolución de problemas
262
Os plásticos: impacto ambiental
1. Conceptos de macromoléculas e de polímero. Propiedades
2. Reaccións de polimerización
3. Polímeros de interese industrial
4. Aplicacións de polímeros de alto interese biolóxico, biomédico e tecnolóxico
5. Macromoléculas e polímeros de orixe natural. Propiedades biolóxicas e médicas
6. Importancia da química do carbono Cultura científica. Biotecnoloxía
Estratexias de resolución de problemas

A nanotecnoloxía é a ciencia que traballa a escala nanométrica (1 nm = 10–9 m), é dicir, practicamente a nivel atómico e molecular. Isto implica que as partículas teñan propiedades físicas e químicas diferentes ás habituais a escala macroscópica. O desenvolvemento da nanotecnoloxía está provocando un cambio nas técnicas e nos procesos de produción industrial e, en consecuencia, no desenvolvemento económico e social.
A primeira referencia das posibilidades da tecnoloxía débese a Richard Feynman (Premio Nobel de Física, 1965), quen xa en 1959 predicía a posibilidade de que se puidese manipular a materia a escala molecular e atómica, e isto debería producir unha nova revolución tecnolóxica. Coa invención do microscopio de efecto túnel ou STM (Gerd Binnig, 1981) comezou a albiscarse a posibilidade non só de ver, senón de manipular verdadeiramente os átomos.
Así, por exemplo, a nanotecnoloxía na industria alimentaria está tendo un grande avance nos últimos anos, a pesar de estar aínda en fase de desenvolvemento. Unha das principais aplicacións é no envasado de alimentos, onde destacan os nanorrecubrimentos para aumentar as propiedades dos alimentos frescos, co fin de atrasar a súa maduración e alongar a súa vida útil. Tamén se usan certos nanocompostos como material de envasado para controlar a difusión de gases e prolongar o tempo de conservación dalgúns produtos.
Facede estas actividades en grupos:
1 Na actualidade, a poboación mundial alcanza os 7 600 millóns. Unha elevada porcentaxe dos habitantes en países en vías de desenvolvemento sofren carencia de alimentos. Investigade brevemente como na actualidade a nanotecnoloxía pode servir para mellorar as producións dos cultivos de acordo co obxectivo 2 e coa meta 2.3 para o desenvolvemento sostible.
2 A detección temperá de enfermidades, o seu tratamento personalizado e un preciso seguimento da súa evolución serán posibles, nos próximos anos, grazas aos nanomateriais. Buscade información sobre terapias que se usan en medicina baseadas en nanopartículas e enumerade algunhas das súas aplicacións. En que consiste o nanodiagnóstico? Analizade a influencia deste novo tipo de técnicas na consecución das diferentes metas asociadas ao ODS 9.

Nesta unidade
• Nanotecnoloxía e novos materiais


1. Átomos unidos por enlace químico
2. Enlace iónico









3. Enlace covalente
4. Teoría do enlace de valencia
5. Teoría da hibridación de orbitais atómicos
6. Teoría de repulsión dos pares electrónicos da capa de valencia
7. Enlace metálico
8. Forzas intermoleculares
9. Enlaces presentes en substancias con interese biolóxico
• Cultura científica. Novos materiais
• TIC. Xeometría molecular





• Estratexias de resolución de problemas
Para motivarte:
• Vídeo: «Antes de empezar».
Para detección previa de ideas:
• Presentación: «Que necesitas saber?».
Para estudar:
• Presentación: «Para estudar».
• Simulacións:
«Interaccións atómicas»
«Polaridade da molécula»
«Forma da molécula»
«Forma da molécula: xeometría molecular e TRPECV»
«Estrutura de bandas».
AS SUBSTANCIAS QUE NOS RODEAN
Os contidos e as actividades desta unidade poden resultar de utilidade para a realización do proxecto que se propón no anexo situado nas páxinas iniciais do libro.
Para avaliarte:
• Autoavaliación final.
• Solucións das actividades numéricas.

E, ademais, toda a documentación necesaria para aplicar as claves do proxecto.

Chámaselle enlace químico a calquera das formas de unión química entre átomos.
Un enlace químico fórmase entre dous átomos se a disposición resultante dos dous núcleos e os seus electróns ten unha enerxía menor que a enerxía total dos dous átomos por separado.
A forza que mantén unidos os átomos é a resultante das interaccións electrostáticas (atracción e repulsión) que se dan entre os núcleos e as codias electrónicas dos átomos implicados. Cando dous átomos se aproximan para formar un enlace, os electróns redistribúense de maneira que as forzas de atracción superen as forzas de repulsión.
Os átomos combínanse co fin de alcanzar unha configuración electrónica máis estable, é dicir, de menor enerxía. A estabilidade máxima conséguese cando un átomo é isoelectrónico cun gas nobre.
Esta estabilidade enerxética pódese lograr mediante:
• A transferencia completa de electróns dun átomo ao outro, formándose ións que permanecen unidos por interaccións de tipo electrostático denominadas enlaces iónicos.
• A compartición de electróns entre dous átomos. Neste caso, os átomos únense mediante enlaces covalentes e fórmanse moléculas individuais.
• A compartición de electróns, de xeito colectivo, con outros átomos no enlace metálico.
Calquera teoría sobre o enlace químico debe ser capaz de explicar varios aspectos fundamentais:
• Os diferentes tipos de enlace que poden darse entre os átomos.
• As proporcións en que os átomos se achan en cada substancia.
• As propiedades dunha substancia en función do seu enlace. Estas relaciónanse, entre outros factores, coa enerxía do enlace que mantén ligados os átomos.
• A disposición no espazo que adoptan os átomos entrelazados (xeometría molecular).
1.2. Formación de enlaces e estabilidade enerxética
Para visualizar a formación e as características enerxéticas dos enlaces químicos, podemos utilizar as curvas de Morse. Estas curvas mostran a variación de enerxía que experimenta un sistema formado por dous átomos en función da distancia que hai entre eles. Consideremos o diagrama, ou curva, de Morse correspondente á formación da molécula de hidróxeno, H2:
1. Inicialmente os dous átomos de hidróxeno están moi separados (r = ∞), e non existe interacción entre eles. A enerxía inicial do sistema pódese considerar nula.
2. Segundo aproximamos os dous átomos, as forzas atractivas dos núcleos sobre a nube electrónica producen unha diminución enerxética que orixina que o sistema se estabilice.
A medida que se aproximan, a enerxía diminúe ata alcanzar un míni-
Dúas especies (átomos, ións ou moléculas) son isoelectrónicas se teñen igual número de electróns de valencia, sendo estes os únicos que participan na formación dos enlaces químicos.
En 1819, Jöns Jakob Berzelius (17791848) desenvolveu unha teoría de combinación química, introducindo indirectamente o carácter electropositivo e electronegativo dos átomos que se combinan.

mo. A distancia á que a enerxía potencial adquire un valor mínimo, r0, recibe o nome de distancia de enlace. A enerxía desprendida cando o enlace se forma ou a que se debe achegar para rompelo denomínase enerxía de enlace.
3. Se continuamos aproximando aínda máis os átomos, a distancia interatómica diminuirá de tal modo que empezarán a interaccionar os núcleos entre si, orixinando forzas de repulsión. Isto producirá inestabilidade que dará orixe a un aumento do valor da enerxía.
Forzas de atracción
A temperatura ambiente, o amoníaco (NH3) é un gas incoloro de olor moi penetrante. É moi soluble en auga, polo que habitualmente se usa en disolución.
Unha parte moi importante do amoníaco utilízase na fabricación de fertilizantes, e o resto ten usos diversos como a fabricación de explosivos, tinguiduras, etc.
Curva de enerxía de enlace para a formación da molécula de hidróxeno.
1.3. Tipos de enlace químico
Atendendo á electronegatividade dos elementos que se enlazan, pódense formar tres tipos de enlace:
• Enlace iónico: fórmase entre elementos de electronegatividade moi diferente. Ten lugar entre un metal con baixa enerxía de ionización (grupos 1, 2) e un non metal con alta afinidade electrónica (grupos 16, 17). Prodúcese unha transferencia de electróns do metal ao non metal, coa conseguinte formación de anións e catións que interaccionan electrostaticamente. Exemplos: KCl, NaF, etc.
• Enlace covalente: fórmase entre dous non metais que teñen alta afinidade electrónica e os dous teñen tendencia a ganar electróns. A unión entre os átomos é debida á compartición de electróns. Exemplos: NH3, H2O, etc.
• Enlace metálico: fórmase en elementos de baixa electronegatividade (metais) e, polo tanto, con gran tendencia a formar catións. Neste enlace compártense electróns, pero dunha forma colectiva.
1 Dadas as moléculas HCl, KF e CH2Cl2, razoa o tipo de enlace presente en cada unha delas utilizando os datos de electronegatividade.
Datos: E.N.: K = 0,8; H = 2,1; C = 2,5; Cl = 3,0; F = 4,0.
O fluoruro de sodio ten usos industriais na fabricación de vidro, adhesivos e pegamentos, insecticidas, pastas de dentes, etc.
2 Dados os seguintes compostos: NaH, CH4, H2O, CaH2 e HF, cales teñen enlace iónico e cales enlace covalente?

Podemos definir o enlace iónico como a unión química formada pola atracción electrostática entre ións de carga oposta.
Se combinamos un elemento moi electropositivo (metal) cun elemento moi electronegativo (non metal), producirase unha transferencia de electróns desde o metal ao non metal (un dos átomos perde electróns e o outro gánaos) ata que os dous alcancen a configuración de gas nobre.
Ao orixinarse ións con carga de signo contrario (anións e catións), entre eles establécense intensas forzas atractivas electrostáticas que manteñen unidos os ións no composto iónico.






A formación dun enlace iónico é favorable se a enerxía necesaria para ionizar os átomos é compensada pola enerxía liberada polas atraccións electrostáticas entre catión e anión. Así, cando un átomo de Cl se acha en presenza dun átomo de Na, o sodio cede un electrón formando o catión Na+, e o cloro acepta o electrón, orixinando un anión, Cl
Compostos iónicos na vida diaria
O CaCl2 é un composto iónico utilizado principalmente para evitar a formación de xeo e como deshumidificador.
O MgBr2 é usado como acelerador de partículas e a fluorita (CaF2) considérase unha pedra preciosa.

Cloro: Cl– Sodio: Na+ Formación dun par iónico.
Na (g) + E. I.→ Na+ (g) + 1e E. I. = 495,4 kJ · mol–1
[Ne]3s 1 [Ne]
Cl (g) + 1e → Cl (g) + A. E. A. E. = −348,8 kJ · mol–1 [Ne] 3s23p 5 [Ne] 3s23p 6
Ao producirse a transferencia dun electrón do átomo do Na ao de Cl, os dous átomos quedaron ionizados. Terase formado un par iónico. Este proceso de transferencia de electróns está desfavorecido enerxeticamente, é dicir, a cantidade de enerxía desprendida na formación do ión Cl é menor que a enerxía necesaria para formar o ión sodio Na+. Non obstante, a enerxía que se libera cando os dous ións se atraen por forzas electrostáticas fai que o balance enerxético do proceso global sexa exotérmico.
Na+ (g) + Cl (g) → Na+Cl (g) + Enerxía
Denomínase valencia iónica ou electrovalencia o número de electróns que un átomo gana ou perde para formar un ión estable (configuración de gas nobre).
No LiCl, a valencia iónica do Li é +1 e a do Cl é −1. No MgF2, a valencia iónica do Mg é +2 e a do F é −1.
3 Que che fai dicir iso? Xustifica a partir da configuración electrónica en estado fundamental que ións forman os elementos: berilio, rubidio, cloro, boro e selenio.
4 Que condicións enerxéticas deben cumprirse para que se poida afirmar que se formou un enlace?
Nos compostos iónicos, cada ión tende a rodearse do maior número posible de ións de carga contraria, resultando que, en condicións normais, estes compostos son sólidos con catións e anións en posicións fixas, que se alternan nunha rede tridimensional denominada cristal iónico. O cristal está formado por unha cela unidade que se repite indefinidamente nas tres direccións.
A descrición xeométrica dos cristais iónicos faise en función de:
• O tipo de malla ou ordenación regular que adoptan.
• O índice de coordinación, que é o número de ións dun signo que rodean un ión de signo oposto. Este índice determina a orde e a disposición espacial dos ións, así como o tipo de rede que se forma. O seu valor depende de:
• A neutralidade eléctrica: conséguese sempre que o número de cargas positivas sexa igual ao número de cargas negativas.
• A simetría: os ións dun signo que rodean outro de signo oposto dispóñense de xeito simétrico para que a repulsión entre os ións do mesmo signo sexa mínima.
• A compactación: os ións están dispostos da forma máis compacta posible, para o cal cada ión se rodea do maior número posible de ións de carga oposta (índice de coordinación máximo).
• O tamaño dos ións: o tamaño dos ións limita o número de ións de signo oposto que poden rodear cada tipo de ión.

Así, por exemplo, na rede de CsCl as relacións de tamaño permiten que cada ión se rodee de oito ións de carga oposta; en cambio, na rede de NaCl a relación entre o tamaño dos ións só permite que cada ión se poida rodear de seis ións de carga oposta.
A xeometría dos cristais iónicos indica que nun composto iónico non podemos falar de moléculas, pois o cristal está constituído por un número moi grande de ións de cargas opostas. A relación estequiométrica entre os anións e os catións que forman a rede cristalina dun composto iónico exprésase na súa fórmula empírica.
Unha fórmula como o CaF2 indica que o número de ións fluoruro será o dobre que de ións calcio, xa que a súa fórmula empírica expresa que a relación é de 1:2. No CaF2, cada ión Ca2+ está rodeado por oito ións F–situados nos vértices dun cubo.
Recorda que...
O enlace iónico se estabiliza polas forzas atractivas de tipo electrostático entre as cargas opostas de anións e catións.
Tres cristais iónicos: NaCl, CsCl e CaF2
Unha medida da estabilidade dun sólido iónico é a súa enerxía reticular, (ou enerxía de rede) que se define como:
A enerxía requirida para separar completamente un mol dun composto iónico sólido nos seus ións en estado gasoso:
AB (s) → A+ (g) + B− (g) Ereticular
A enerxía reticular tamén pode definirse como:
A enerxía desprendida ao formarse un cristal iónico a partir dos seus ións constituíntes en estado gasoso.
A enerxía reticular dun sólido iónico é unha medida da forza de atracción entre os ións dese sólido. Canto maior sexa a enerxía reticular, os enlaces iónicos serán máis fortes e, en xeral, o sólido será máis duro e fundira maior temperatura.
Os valores das enerxías reticulares dependen das cargas e do tamaño dos ións implicados; así, canto maior sexa a carga eléctrica do ión e menor o seu tamaño, maior será a enerxía reticular dos compostos iónicos que forme.
A enerxía reticular foi calculada por primeira vez en 1918 por Max Born (1882-1970) e Alfred Landé (1888-1976). Os dous desenvolveron unha ecuación que permite calcular o cambio de enerxía asociado á formación dun mol dun composto MN cristalino a partir dun mol de ións M+ e un mol de ións N , en estado gasoso:
M+ (g) + N (g) → MN (s)
Max Born e Alfred Landé estableceron a seguinte expresión para a enerxía reticular:
Táboa 2. Enerxías reticulares. Os ións pequenos e de carga elevada presentan enerxías reticulares grandes. Para unha mesma carga, os ións grandes xeran enerxías de rede inferiores.
A constante de Madelung
A constante de Madelung, A, ten en conta as atraccións e as repulsións entre os ións de distinta carga que compoñen o cristal segundo a súa disposición xeométrica.
Nesta ecuación, NA é o número de Avogadro, Z+ e Z son as cargas dos ións; e é a carga do electrón; K é a constante de Coulomb; A é a constante de Madelung, que depende do tipo de rede cristalina; r0 é a distancia internuclear, e n é o factor de compresibilidade de Born. Os valores de Ur que se obteñen utilizando a ecuación de Born-Landé son teóricos, baseados nun modelo, e resultan inexactos. Para poder avaliar a calidade deste modelo, hai que comparar o valor teórico da enerxía desprendida no proceso M+ (g) + N (g) → MN (s) cun valor medido experimentalmente.
Agora ben, a reacción anterior é imposible de levar a cabo no laboratorio. Non se pode ter por un lado un mol de ións M+ en estado gasoso, entre os que non exista ningún tipo de interacción, e, por outro, un mol de ións N nas mesmas condicións, para logo poñelos en contacto e obter un cristal. Por iso, adóitase recorrer a un método baseado no balance enerxético do proceso de formación do cristal, coñecido como ciclo de Born-Haber.
5 Utiliza os seguintes datos para calcular a enerxía da rede cristalina do cloruro de sodio, NaCl, mediante a ecuación de Born-Landé.
Datos: A = 1,74756;
NA = 6,022 · 1023 mol−1; ZNa = 1;
ZCl = −1; e = 1,6021 · 10−19 C;
K = 9 · 10 9 N · m 2 · C –2 ; r 0 = 2,81 · 10 −10 m; n = 8.
O estudo do proceso enerxético asociado á reacción de formación dun composto iónico dános unha idea da estabilidade do composto fronte aos seus elementos.
O ciclo de Born-Haber é un ciclo de reaccións químicas desenvolvido por Max Born (1882-1970) e Fritz Haber (1868-1934) en 1917. Mediante el, pode calcularse o valor da enerxía reticular (enerxía que representa, teoricamente, a formación dun composto iónico a partir dos seus ións gasosos) de forma indirecta, pois non pode ser calculada experimentalmente. Este ciclo comprende a formación dun composto iónico desde a reacción dun metal (xeralmente un elemento do grupo dos alcalinos ou alcalinotérreos) cun non metal (como halóxenos, osíxeno...).
Así, por exemplo, a reacción de formación do LiF (s) descrita nun só paso é un proceso complicado no que ten lugar a ruptura e a formación de enlaces.
Li (s) + 2 1 F2 (g) → LiF (s) ΔHf = −617 kJ · mol–1
O ciclo de Born-Haber consiste no estudo enerxético deste proceso a través de varias etapas:
1. Sublimación do sólido: cambia o estado dunha substancia desde o estado sólido ao gasoso.
Li (s) → Li (g) Entalpía de sublimación, ΔHs = 161 kJ · mol–1
2. Ionización do átomo: ionízase Li para dar Li+ na fase gasosa. É a enerxía necesaria para xerar un mol de ións Li+ gasosos a partir dun mol de átomos de Li en estado gasoso.
Li (g) → Li+ (g) + 1 e E. I. = 520 kJ · mol–1
3. Disociación da molécula gasosa: é a enerxía necesaria para xerar un mol de átomos de F a partir de moléculas de F2
2 1 F2 (g) → F (g) 2 1 Edisociación = −77 kJ · mol–1
4. Formación de F gasoso: representa a afinidade electrónica do flúor. É dicir, é a enerxía que se desprende (neste caso, ao ser o signo negativo) cando un mol de átomos de flúor en estado gasoso capta un mol de electróns para transformarse nun mol de ións fluoruro (gas).
F (g) + 1 e → F (g) A. E. = −328 kJ · mol–1
5. Formación do sólido a partir de ións gasosos:
Li+ (g) + F (g) → LiF (s) Ureticular = ?
A suma das cinco etapas dá a reacción global e calculamos a entalpía de formación do LiF. Tendo en conta a lei de Hess, podemos determinar a enerxía reticular do LiF.
ΔHf = ΔHs + E. I. + 2 1 Edisociación + A. E. + Ureticular
Cl2 (g)
Na (s)
+ Enerxía de disociación
Na (g) Cl (g)
Cl– (g)
+ Enerxía se sublimación
− Afinidade electrónica + Enerxía de ionización − Enerxía reticular
Ciclo de Born-Haber para o NaCl.
Exercicios
6 Calcula a enerxía reticular do KI (s) e representa nun ciclo de Born-Haber o proceso de formación do KI (s).
Datos: ΔHf (KI) = −327 kJ · mol–1
Esub. K (s) = 90 kJ · mol–1l
Esub. I2 (s) = 62 kJ · mol–1
Edis. I2 (g) = 149 kJ · mol–1
Eionización K (g) = 418 kJ · mol–1
A. E. I (g) = −308 kJ · mol–1
7 Calcula a calor de sublimación do calcio a partir dos seguintes datos:
ΔHf CaBr2 (s) = −675 kJ · mol–1
Evap. Br2 (l) = 315 kJ · mol–1
Edis. Br2 (g) = 193 kJ · mol–1
1.ª E. I. Ca (g) = 590 kJ · mol–1
2.ª E. I. Ca (g) = 1 143 kJ · mol–1
Así:
A. E. Br (g) = −324 kJ · mol–1
Ereticular CaBr2(s) = −2 391 kJ · mol–1
As propiedades dos compostos iónicos explícanse polas intensas forzas electrostáticas que se establecen entre os anións e os catións da rede cristalina.
• Estado de agregación: as forzas electrostáticas que manteñen unidos os ións nun composto iónico son moi fortes, polo que son sólidos a temperatura ambiente e teñen un punto de fusión elevado (maiores de 400 ºC). Só a temperaturas elevadas se consegue achegar a suficiente enerxía para vencer as interaccións electrostáticas e separar os ións da rede cristalina.
• Dureza: os compostos iónicos son duros, xa que as intensas forzas electrostáticas entre os ións da rede fan que sexa moi difícil romper os enlaces. A maior enerxía reticular do composto iónico, maior dureza.
• Fraxilidade: tamén son fráxiles e quebradizos. A aplicación dunha forza sobre o cristal iónico produce un desprazamento dunha capa de ións sobre outra, poñéndose en contacto ións do mesmo signo. As repulsións electrostáticas fan que rompa o cristal.
Ao disolverse o cristal de NaCl en auga, as moléculas desta rodean cada ión e oriéntanse en función da carga do Na+ ou do Cl
• Solubilidade: os compostos iónicos só son solubles en disolventes polares, como a auga e o alcohol, pero son insolubles en disolventes apolares. Un disolvente polar fai máis débiles as unións entre os ións da rede, provocando o seu derrubamento. Unha vez separados, os ións rodéanse de moléculas de auga, o que impide que interaccionen entre eles.
• Condutividade eléctrica: os compostos iónicos non conducen a electricidade en estado sólido, xa que é necesario que haxa cargas eléctricas libres (electróns e ións), e, ao ocupar posicións fixas na rede, os ións non se poden mover. Cando se encontran fundidos ou disoltos en auga, os compostos iónicos son bos condutores da corrente eléctrica debido a que os ións teñen liberdade de movemento. A dureza, o punto de fusión e o punto de ebulición dos compostos iónicos aumentan cando crece a enerxía reticular desprendida na formación dun cristal.
8 Predí a fórmula empírica do composto iónico formado polas seguintes parellas de elementos:
a) K e I; b) Mg e S; c) Al e N; d) Na e C.
9 Para os sales RbI, CsI, KI e NaI, explica xustificando as resposta: a) Cal terá maior enerxía de rede?, b) Cal terá maior punto de fusión?
Táboa 3. Puntos de fusión dos cloruros dos elementos alcalinos. Canto maior é o catión, a forza do enlace é menor e o punto de fusión, tamén.
En 1916, Lewis propuxo que a formación dun enlace covalente se produce por compartición de pares de electróns externos. Ten lugar entre átomos de elementos non metálicos cunha electronegatividade similar (a diferenza é menor de 1,7), dando lugar á formación de moléculas.
Un átomo pode adquirir a configuración electrónica de gas nobre compartindo electróns con outros átomos (regra do octeto). Os electróns compartidos (un ou varios pares) chámanse enlazantes, os cales, unha vez formado o enlace, pertencen á vez aos dous átomos que se unen, mentres que os electróns que non participan no enlace se chaman non enlazantes.


Por exemplo, a configuración electrónica do cloro
Así, ao cloro só lle falta un electrón para completar o octeto
súa capa de valencia. Se dous átomos de cloro achegasen un electrón cada un e compartisen o par de electróns, os dous conseguirían ter os electróns necesarios e o resultado sería unha molécula Cl2
Enlace covalente normal: enlaces simples, dobres e triplos
En todo tipo de unión covalente, os átomos quedan enlazados mediante pares de electróns comúns. Se os átomos comparten un só par de electróns, forman un enlace simple ou sinxelo; se comparten dous pares de electróns, forman un enlace dobre, e se comparten tres pares de electróns, constitúen un enlace triplo.
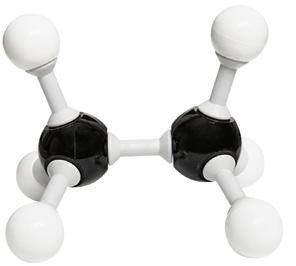
A formación dun enlace dobre ou triplo implica unha unión máis forte entre os átomos, xa que, ao aumentar os pares de electróns compartidos, se incrementan as forzas de atracción entre estes e os núcleos. Nun enlace múltiple, a distancia entre os núcleos (lonxitude de enlace) é menor que nun enlace sinxelo e a enerxía de disociación (enerxía necesaria para romper o enlace) é maior que nun enlace simple.
• O exemplo máis sinxelo de enlace covalente simple é a combinación de dous átomos de hidróxeno para formar unha molécula de H2. Cada átomo de hidróxeno necesita un electrón para ter a súa capa de valencia completa; por este motivo, os dous átomos de hidróxeno comparten mutuamente os seus electróns.
O par compartido pertence aos dous, cada átomo de hidróxeno ganou un electrón e adquiriu a configuración electrónica do helio. Unha vez que se formou o enlace covalente, os dous electróns enlazantes son atraídos polos dous núcleos, en vez de por un, e por iso o estado enlazado é máis estable que o non enlazado.
• O exemplo máis sinxelo de enlace covalente dobre é a combinación de dous átomos de osíxeno para formar unha molécula de O2; neste caso, compártense dous pares de electróns.
En átomos polielectrónicos só participan os electróns de valencia na formación de enlaces covalentes. Os pares de electróns de valencia que non participan no enlace, ou electróns non compartidos, denomínanse pares solitarios.
Enlace covalente dativo
Nas substancias covalentes máis habituais, cada átomo que toma parte na formación dun enlace contribúe ao par compartido cun electrón. Noutros casos, o par de electróns compartido entre dous átomos pode ter sido achegado só por un deles; este tipo de enlace denomínase enlace covalente dativo ou coordinado.
O enlace coordinado é só un medio para lograr a estrutura adecuada, pero, unha vez establecida, a unión é indistinguible do enlace covalente común. O enlace dativo ou coordinado represéntase mediante unha frecha " que se orixina no átomo que achega os dous electróns ao enlace. Un exemplo é o dióxido de xofre:
No SO2, cada un dos átomos que interveñen ten seis electróns de valencia. Para que todos os átomos consigan a configuración de gas nobre, prodúcese a unión dun átomo de osíxeno cun átomo de xofre mediante unha covalencia dativa deste.
As representacións gráficas que se utilizan na descrición das moléculas dos compostos covalentes denomínanse estruturas de Lewis. Así mesmo, permiten explicar tamén os enlaces iónicos.
G. Lewis introduciu un simbolismo moi útil que consiste en representar por un punto (ou unha pequena cruz) cada un dos electróns da capa de valencia rodeando o símbolo do elemento; o par electrónico compartido indícase con liñas ou como pares de puntos entre átomos, e os pares libres, non compartidos, sinálanse como pares de puntos ou liñas nos átomos individuais.
Algúns exemplos de estruturas de Lewis son:
10 O dióxido de xofre (SO2) é un gas incoloro que resulta irritante a concentracións elevadas. Trátase dun contaminante primario cuxa orixe hai que buscala nos procesos de combustión de combustibles fósiles. Cales son os principais focos emisores de SO2? Investiga e enumera os efectos do SO2 sobre a saúde das persoas. Que tipo de medidas preventivas se poderían tomar para reducir a contaminación por SO2 e contribuír na consecución das metas 3.9 e 12.4 dos obxectivos de desenvolvemento sostible?

A representación das estruturas de Lewis para moléculas sinxelas non presenta dificultades. Non obstante, para moléculas e ións máis complexos convén seguir unha serie de regras que facilitan a resolución do problema formulado:
1. Facemos un balance do número de electróns de valencia que cada átomo achega á molécula. Todos eles deben aparecer na estrutura final, ben como electróns enlazantes ou como pares solitarios.
Se se trata dun anión, ademais hai que sumar tantos electróns como cargas teña, e, se é un catión, quítanse tantos electróns como cargas. Así, no caso do SO42− e do H3O+, temos:
SO42− : [1 · 6 (S)] + [4 · 6 (O)] + 2 = 32 e
H3O+ : [3 · 1 (H)] + [1 · 6 (O)] − 1 = 8 e
2. Representamos a posición relativa dos átomos unidos por enlaces sinxelos. Eliximos o átomo de maior covalencia ou menos electronegativo como átomo central e o resto dos átomos poñémolos arredor del.
3. Colócanse rodeando cada átomo pares de electróns de acordo coa regra do octeto. É dicir, para o H2O, por exemplo:
4. Se o átomo central non cumpre a regra do octeto porque hai poucos electróns para distribuír, formamos enlaces dobres ou triplos ata que a súa capa de valencia estea completa. Por exemplo, para o HCN.
5. Calculamos o número de electróns compartidos (EC) como a diferenza entre o número de electróns necesarios para que todos os átomos alcancen a configuración óptima (8 ou 2 e ) (EN) e o número de electróns de valencia dispoñibles (ED). Temos: EC = EN − ED.
6. Calculamos tamén o número de electróns non compartidos ou solitarios (ES) como a diferenza entre os electróns dispoñibles (ED) e os electróns compartidos (EC), así ES = ED − EC.
En xeral, o número de enlaces nunha especie química vén dado por:
úmerodeenlaces 2 EN –ED N=

Nalgún momento encontramos, comendo améndoas, algunha amarga. Este sabor tan desagradable é debido á amigdalina, un composto de cianuro e glicosa que, a grandes doses, resulta moi prexudicial para o noso organismo. Cando comemos unha améndoa amarga, poñemos en contacto os dous compostos, cuxo resultado é a descomposición da amigdalina en ácido cianhídrico (HCN), D-glicosa e benzaldehido.
Exercicios
11 Representa mediante estruturas de Lewis as seguintes moléculas: H2O, HF, H2, CH4 e NH3
12 Dadas as moléculas HCl, KF, CH2Cl2 e CCl4, escribe as estruturas de Lewis.
13 Dadas as seguintes substancias: CO2, CF4, H2CO, escribe as estruturas de Lewis das súas moléculas.
14 Describe, razoadamente, as estruturas de Lewis das seguintes moléculas: S2C, HCN e SiO44−
15 Considera as substancias Br2,HF, Al e KI. Contesta, razoadamente, as seguintes cuestións:
a) Indica o tipo de enlace presente en cada unha delas.
b) Escribe as estruturas de Lewis daquelas que sexan covalentes.
16 Escribe as estruturas electrónicas de Lewis das seguintes substancias: F , NH4+, etano, eteno e etino.
Excepcións á regra do octeto
A regra do octeto ten as súas limitacións. Estas excepcións son fundamentalmente de tres tipos:
1. Moléculas cun número impar de electróns
Se unha molécula ten un número impar de electróns, ningunha estrutura pode cumprir a regra do octeto. En moléculas como ClO2 (19 e ), NO (11 e ) e NO2 (17 e ), o número total de electróns de valencia é impar. É imposible aparear totalmente e lograr un octeto arredor de cada átomo.
As especies cun número impar de electróns denomínanse radicais e son moi reactivas, porque poden utilizar o electrón desapareado para formar un novo enlace.
17 O smog fotoquímico resulta da combinación de óxidos de nitróxeno e compostos orgánicos volátiles que, tras ser catalizados pola radiación solar, xeran nitratos e ozono troposférico. Investiga, facendo uso de ferramentas TIC, acerca dos efectos prexudiciais do smog fotoquímico na saúde das persoas. Indica que medidas se poderían adoptar para alcanzar as metas 13.1 e 13.2 dos obxectivos de desenvolvemento sostible.
18 Debuxa as estruturas de Lewis para os seguintes compostos: a) AlI3, b) IF5, c) SeF4
Algúns elementos lixeiros como o Be, B e Al forman compostos nos que hai menos de oito electróns arredor do átomo central. Incumpren a regra do octeto por defecto. Algúns exemplos de hipovalencia son o BF3, BeF2 e BH3.
19 Que especies teñen un número impar de electróns: a) Br, b) OH , c) PCl2, d) PCl3?
20 Que especies son deficientes en electróns: a) BeH2, b) CH3+, c) CH4, d) NH3, e) NH4+?
Nalgunhas moléculas, o átomo central incumpre a regra do octeto por exceso, o octeto está expandido.
Os átomos de elementos do terceiro período da táboa periódica, e de elementos posteriores, forman algúns compostos nos que hai máis de oito electróns arredor do átomo central (o átomo dispón de orbitais d no mesmo nivel e é posible a promoción electrónica). Por exemplo, no SF6, cada un dos seis electróns de valencia do xofre forma enlace covalente cun átomo de flúor, deste xeito hai doce electróns, seis pares en total arredor do átomo de xofre.
Outros exemplos son: PCl5, SF6, I3 e ClF3
3.4. Polaridade dos enlaces covalentes
Cando o enlace covalente se establece entre dous átomos cuxa electronegatividade é diferente, o máis electronegativo despraza o par electrónico cara a el, adquirindo certa carga negativa δ–. Por outro lado, o menos electronegativo adquirirá certa carga positiva δ+, orixinándose un dipolo eléctrico.
O dipolo simbolízase por medio de + –onde a frecha apunta cara ao polo negativo. A polaridade nun enlace covalente mídese a través do momento dipolar, representado pola letra grega μ
Nesta expresión, q é a carga efectiva e d é a distancia entre os centros de cargas opostas.
A unidade do momento dipolar no sistema internacional é o C · m, aínda que normalmente se utiliza o debye (D) en honor a Peter Debye, que realizou os primeiros traballos sobre polaridade molecular (1D = 3,3 · 10−30 C · m).
O momento dipolar é unha magnitude vectorial que mide tamén o carácter iónico dun enlace covalente, xa que está relacionado coa diferenza de electronegatividades.
O momento dipolar das moléculas diatómicas homonucleares (átomos iguais) é cero, posto que a diferenza de electronegatividades é nula e non existe desprazamento de carga (H2, O2, N2).
Xeometría e polaridade das moléculas
Para que unha molécula sexa polar, é necesario, pero non suficiente, que conteña enlaces covalentes polarizados. Cando nunha molécula polar hai máis dun enlace, o momento dipolar molecular é a suma vectorial dos momentos dipolares de enlace; por iso, é necesario para determinalo, coñecer a xeometría molecular e os ángulos de enlace.
As moléculas con polaridade no enlace pero cuxa suma vectorial de momentos dipolares de enlace é cero non son polares n 0 = . Este é o caso de moléculas lineais, como a de CO2 ; de moléculas triangulares, como o BF3 , ou de moléculas tetraédricas con catro enlaces iguais, como o CH4
As moléculas angulares (SO2) e piramidais (NH3) con polaridade no enlace presentan sempre momento dipolar molecular ( n 0 = Y ).
Momentos dipolares das moléculas de HF e F2
21 Cal é a orixe da polaridade nos enlaces covalentes? Xustifica a polaridade das moléculas de BCl3 e NCl3
22 Para as moléculas H2O, NH3, CH4 e HCl, indica, razoando a resposta: a) a estrutura de Lewis, b) a polaridade.
23 Dadas as moléculas de CH4, NH3, Cl2 e CO2: a) clasifícaas en polares ou apolares, b) que composto formará unha molécula tetraédrica?
24 Considera as seguintes especies químicas das que se indica a súa xeometría entre paréntese: Cl4 (tetraédrica), HCN (lineal) e BF3 (trigonal). a) Representa a estrutura de Lewis de cada unha destas especies. b) Xustifica a polaridade de cada unha.
25 Xustifica se as moléculas PCl3, OF2, H2CO e CH3Cl son polares ou apolares.
Determinación da polaridade dunha molécula
Para establecer a polaridade dunha molécula, débese:
1. Obter as estruturas óptimas de Lewis e aplicar o método RPECV para determinar a súa xeometría.
2. Identificar os enlaces polarizados.
3. Sumar vectorialmente os momentos dipolares de todos os enlaces individuais. Obtense así a resultante, que determinará o momento dipolar molecular. Este será reforzado ou debilitado pola presenza de pares de electróns non enlazantes sobre o átomo central.
3.5. Parámetros moleculares ou de enlace
Chámaselles parámetros de enlace a aquelas propiedades características dos enlaces que dependen dos átomos específicos que se enlazan pero que varían de composto a composto. Son catro:
Lonxitude do enlace
Defínese como a distancia media de separación entre os núcleos dos átomos enlazados. Tamén se pode definir como a distancia internuclear na que o composto é máis estable (mínima enerxía). Ao aumentar a multiplicidade do enlace, redúcese a lonxitude de enlace.
Orde do enlace
Indica o número de enlaces covalentes que se forman entre dous átomos.
Enerxía do enlace
Defínese como a enerxía desprendida na formación dun mol de enlaces covalentes entre dous átomos en estado gasoso. Existe unha relación entre a enerxía de enlace e a fortaleza do enlace. A maior número de enlaces, a enerxía de enlace é maior.
Ángulo do enlace
É o ángulo formado polas liñas imaxinarias que unen os núcleos dos átomos.
Unha molécula presenta resonancia (antigamente denominada mesomería) se pode representarse por máis dunha estrutura de Lewis.
Ás veces as propiedades dunha molécula interprétanse mellor supoñendo que a súa distribución electrónica é intermedia entre varias estruturas de Lewis. Así, para o ozono, O3, temos dúas fórmulas equivalentes:
As dúas estruturas de resonancia do ozono teñen idéntica enerxía e participan por igual na descrición do híbrido.
Os experimentos mostran que a estrutura real é unha media das dúas. A esta media chámaselle resonancia e a estrutura resultante é un híbrido de resonancia.
A OMS estableceu que cando a concentración de ozono, O3, no aire que se respira é superior a 240 μg · m –3 existe un claro risco para a saúde. A calor, o sol e a contaminación producida pola industria e o tráfico son os factores máis importantes que contribúen a aumentar a formación de ozono no aire que se respira. Debemos, neste sentido, fixar a atención en controlar eses factores para lograr a meta 3.9 proposta pola ONU nos seus ODS para o ano 2030.
As estruturas de resonancia só se diferencian na asignación da posición dos pares electrónicos, nunca nas posicións dos átomos. A resonancia entre varias estruturas indícase mediante unha frecha de dúas puntas (↔).
O híbrido de resonancia ten unha enerxía menor que cada unha das formas resoantes, e, canto maior sexa o número de estruturas resoantes, maior será a estabilidade da molécula.
Esta diferenza de enerxía recibe o nome de enerxía de resonancia.
A diferenza do enlace iónico, o enlace covalente, segundo se estableza entre átomos que forman moléculas discretas (illadas) ou redes tridimensionais, fai que as substancias presenten propiedades moi diferentes.
Están formadas por moléculas que, en determinadas condicións de presión e temperatura, poden unirse entre si formando cristais moleculares. Os átomos destas moléculas están unidos por enlaces covalentes fortes, pero as forzas entre as moléculas son débiles. Estas forzas intermoleculares son as responsables das propiedades deste tipo de substancias e estudarémolas ao final da unidade.
As propiedades destas substancias son:
• Estado de agregación: teñen baixa densidade e son gases, líquidos volátiles ou sólidos brandos de baixo punto de fusión ou que subliman doadamente.
• Solubilidade: depende das forzas intermoleculares que as súas moléculas poidan establecer coas moléculas do disolvente. A substancia disolverase se as forzas entre as súas moléculas e as do disolvente son máis intensas que as forzas das súas moléculas entre si.
• Condutividade eléctrica: non conducen a corrente eléctrica debido a que os electróns compartidos nos enlaces covalentes están moi unidos e non poden desprazarse. Algúns cristais moleculares disoltos en auga ionízanse e a disolución vólvese condutora.
Substancias atómicas
Nestas substancias, todos os átomos están unidos mediante enlaces covalentes formando unha rede cristalina estable (cristal atómico). Son substancias covalentes atómicas o diamante ou o grafito (C), o cuarzo (SiO2)…


As propiedades que presentan estas substancias veñen caracterizadas por:
• Estado de agregación: son sólidos con puntos de fusión xeralmente elevados e moi duros (con algunhas excepcións, como o grafito). Para fundir unha cantidade pequena de substancia, é necesario romper unha gran cantidade de enlaces.
• Solubilidade: son insolubles en calquera disolvente.
• Condutividade eléctrica: ao non teren electróns libres, son malos condutores da electricidade, a excepción do grafito (ten electróns libres entre as láminas de carbono).

Unha das teorías cuánticas máis importantes sobre o enlace covalente é a teoría do enlace de valencia (TEV). A teoría de enlace covalente de Lewis-Langmuir baseábase nas teorías atómicas clásicas do modelo de Bohr-Sommerfeld, que se introduciron con anterioridade á chegada da mecánica cuántica. Por outro lado, as estruturas de Lewis non proporcionan información acerca dos orbitais que son ocupados polos electróns nin a enerxía destes nas moléculas.
A teoría do enlace de valencia foi proposta por Linus Pauling e J. C. Slater e explica os enlaces covalentes en termos de orbitais atómicos. Supón que os electróns dunha molécula ocupan os orbitais atómicos dos átomos individuais e os enlaces se forman como consecuencia do solapamento dos orbitais atómicos.
Na teoría do enlace de valencia (TEV), un enlace covalente sinxelo entre dous átomos fórmase por solapamento de orbitais atómicos que teñan electróns desapareados e con spins antiparalelos (spins opostos). O solapamento permítelles aos dous electróns compartir o espazo común entre os núcleos e formar o enlace covalente. Os electróns da rexión de solapamento son atraídos simultaneamente polos dous núcleos, o que mantén unidos os átomos no enlace.
A simetría dos orbitais moleculares formados por solapamento dos orbitais atómicos depende do tipo de orbitais atómicos que participen no enlace e de que xeito solapen. As dúas superposicións máis frecuentes son:
Enlace tipo sigma (σ)
Dáse cando os orbitais atómicos solapan frontalmente. Refírese ás superposicións producidas no segmento que une os núcleos dos átomos. A rexión de densidade electrónica máxima rodea o eixe internuclear. Dáse entre orbitais atómicos s-s (H—H), s-p (H—Cl) e p-p (Cl—Cl).
Os enlaces establecidos son estables e permiten a rotación dos átomos respecto ao eixe de xiro. Todos os enlaces covalentes sinxelos consisten nun enlace sigma (σ). Neste tipo de enlace, dous electróns apareados encóntranse entre os dous átomos.
Enlace σ
John Clarke SlaterJ. C. Slater (1900-1976) impartiu clase de física durante case 30 anos no Instituto de Tecnoloxía de Massachusetts (MIT). Realizou achegas importantes no cálculo das funcións matemáticas que describen os orbitais atómicos.

As estruturas de Lewis non nos din nada acerca da forma dunha molécula, só indican as localizacións aproximadas dos electróns de enlace e os pares solitarios da molécula.
Solapamento frontal de orbitais atómicos para dar enlaces tipo σ.
Enlace tipo pi (π)
Prodúcese cando os orbitais atómicos solapan lateralmente. Dáse entre orbitais atómicos p-p. O enlace π non rodea completamente o eixe internuclear, deixa unha zona de densidade electrónica nula. Non pode existir un xiro dun átomo con respecto ao outro, xa que a zona de solapamento entre as nubes electrónicas desaparecería e rompería o enlace. O plano de simetría, no cal a probabilidade de encontrar o electrón é nula, denomínase plano nodal (π).
Os enlaces sigma (σ) son máis estables que os enlaces pi (π).
4.2. Exemplos da teoría do enlace de valencia (TEV)
Molécula de hidróxeno (H2)
A configuración electrónica do hidróxeno é 1s1. O hidróxeno formará un enlace sinxelo, posto que ten un electrón desapareado. O enlace é de tipo σ e conséguese por solapamento frontal dos dous orbitais atómicos (OA) semicheos dos dous hidróxenos.
Molécula de osíxeno (O2)
Solapamento lateral de dous orbitais atómicos p para dar un enlace π
A configuración electrónica do osíxeno é
p
1. O osíxeno formará dous enlaces, posto que ten dous electróns desapareados. O primeiro será un enlace tipo σ entre os orbitais 2py de cada átomo, pero o segundo terá que ser lateral (enlace tipo π) entre os orbitais 2pz. Esta superposición lateral é menor, o que dá lugar a enlaces máis débiles.
O enlace entre os átomos de osíxeno é dobre, pero os dous enlaces non son iguais; o enlace sigma (σ) é máis forte que o enlace pi (π).
Formación dunha molécula de H2 e outra de O2
26 Responde as seguintes cuestións:
a) En que se basea a teoría do enlace de valencia?
b) En que se diferencia a TEV do concepto de Lewis sobre o enlace químico?
27 Cando se forman os enlaces tipo sigma (σ)? E os enlaces tipo pi (π)?
28 Explica a existencia de moléculas de N2 e PCl5 segundo a teoría do enlace de valencia (TEV).
As discrepancias xurdidas entre os ángulos das moléculas preditos pola teoría do enlace covalente e os ángulos medidos experimentalmente resólvense mediante a teoría de hibridación de orbitais atómicos. Esta teoría foi formulada por Pauling e Slater, e utiliza como ferramenta fundamental o concepto de orbital híbrido (OH).
5.1. Hibridación: concepto e tipos
















A hibridación é o proceso mediante o cal orbitais atómicos puros de enerxía parecida se combinan entre si, transformándose noutros orbitais denominados orbitais atómicos híbridos (OH).
Estes orbitais híbridos caracterízanse polo seguinte:
1. Fórmanse tantos orbitais híbridos como orbitais atómicos puros se combinan.
2. Os orbitais híbridos dun mesmo tipo son de igual enerxía e forma, pero distintos en orientación espacial.
3. Os enlaces que se obteñen con eles son máis fortes que utilizando orbitais atómicos puros.
4. Os ángulos entre eles son iguais e dirixidos de maneira que facilitan o solapamento cos orbitais do outro átomo ao formar o enlace.
Hibridación sp
Para estudar esta hibridación, imos utilizar como exemplo a molécula de BeF2. A configuración electrónica do F é 1s 2 2s 2 2p5, e a do Be, [He] 2s 2 . A cada unha correspóndenlle os seguintes diagramas para os electróns de valencia:
A falta de electróns desapareados do Be impide nun principio a formación de enlaces, pero a proximidade enerxética dos seus orbitais 2s e 2p permite promover un electrón dun orbital 2s a un orbital 2p (estado excitado).
O berilio ten dous orbitais dispoñibles para formar enlaces cos átomos de flúor, pero estes enlaces Be—F non serían idénticos, e os experimentos demostran que eses enlaces son equivalentes. Para logralo, os orbitais 2s e 2p do Be débense combinar para dar lugar a dous orbitais híbridos sp equivalentes, cada uns dos cales se combina cun orbital p do F que ten un electrón desapareado, formándose a molécula de BeF2
29 Dadas as seguintes substancias CO2, CF4, H2CO e HF: a) escribe as estruturas de Lewis das súas moléculas, b) explica as súas xeometrías utilizando a teoría de hibridación. Datos: Números atómicos: H = 1, C = 6, O = 8, F = 9.
30 Para as moléculas BF3 e CHF3: a) establece as súas estruturas de Lewis, b) establece a súa xeometría molecular, indicando a hibridación do átomo central. Datos: Números atómicos: H = 1, B = 5, C = 6, F = 9
31 Organizo e defendo a postura. Xustifica se son verdadeiras ou falsas as seguintes afirmacións: a) unha molécula que conteña enlaces polares é necesariamente polar, b) un orbital híbrido sp 2 obtense por combinación de dous orbitais s e dous orbitais p, c) os compostos iónicos en disolución acuosa son condutores da electricidade.
Un quilogramo de hidróxeno (H2) pode liberar máis enerxía que un quilogramo de calquera outro combustible (case o triplo que a gasolina ou o gas natural) e para liberar esa enerxía non emite nada de dióxido de carbono (CO2), tan só vapor de auga (H2O). Deste xeito conséguese que o impacto ambiental sexa nulo, contribuíndo a acadar os ODS 7 e 13 propostos pola ONU.
Hibridación sp 2
Para estudar este tipo de hibridación, consideramos a molécula de AICl3 , para a cal a teoría RPECV predí unha xeometría plana trigonal. A configuración electrónica do aluminio: [He] 2s 2 2p 1 e a do Cl: [Ne] 3s 2 3p
Neste caso, promove un electrón 3s
Combínase o orbital 3s cos dous orbitais 3p do Al e xéranse tres orbitais híbridos sp2, que están orientados cara aos vértices dun triángulo equilátero (ángulos de 120º), os cales se solapan cos orbitais 3p do Cl dando lugar á molécula de AlCl3.
32 Que che fai dicir iso? Explica, razoadamente, se a seguinte afirmación é verdadeira: «O BF3 é un composto no que o átomo de boro presenta hibridación sp 3 ».
33 a) Deduce a estrutura de Lewis do ácido cianhídrico (HCN) e do metanal (H2CO). b) Indica nas dúas moléculas, cal é a hibridación de orbitais atómicos que presenta o átomo de carbono.
Formación da molécula de AlCl3
Hibridación sp 3
Tomamos como exemplo o metano, CH4. A configuración electrónica do C: [He] 2s 2 2px 1 2py 1 e a do H: 1s


























Neste caso, promove un electrón 2s do C a un orbital baleiro 2p
Sabías que...?
O traballo polo cal Linus Carl Pauling (1901-1994) recibiu o seu primeiro Premio Nobel trataba de aspectos relacionados coa estrutura molecular. Foi pioneiro en utilizar os principios da teoría cuántica para explicar a estrutura molecular baseada no concepto de enlace de valencia, así como outros conceptos relacionados con este, que lle permitiron calcular as enerxías de enlace, a súa forma, lonxitude, ángulo e propiedades magnéticas. Utilizou técnicas de raios X e creou unha escala que permitía predicir as forzas de enlace.

Combínase o orbital 2s cos tres orbitais 2p do C e xéranse catro orbitais híbridos sp3, que están orientados cara aos catro vértices dun tetraedro regular formando ángulos de 109,5 º; os cales, ao solaparse con dous orbitais 1s do H xeran os catro enlaces idénticos da molécula de CH4
Formación da molécula de CH4.
As propiedades das substancias moleculares están determinadas non só polos átomos que forman as súas moléculas, senón tamén pola forma en que estes átomos se distribúen no espazo. Os dous factores fan que a esa molécula lle corresponda unha xeometría molecular determinada caracterizada polos seus correspondentes parámetros moleculares: lonxitudes e ángulos de enlace.
A xeometría molecular é a distribución tridimensional dos átomos dunha molécula. A xeometría que adopta unha molécula é aquela na que a repulsión electrónica é mínima.
Para explicar a xeometría molecular, utilízase a TRPECV. Trátase dun modelo puramente electrostático, que considera os electróns como se fosen cargas puntuais. Segundo este modelo, todos os electróns arredor do átomo central, tanto os pares enlazantes como os pares solitarios, se dispoñen arredor do átomo central de forma que experimenten a mínima repulsión.
Os postulados básicos do modelo RPECV son:
1. O factor determinante da xeometría dunha molécula é o número de pares de electróns de valencia (enlazantes e non enlazantes) arredor do átomo central.
2. Os pares de electróns (compartidos e non compartidos) repélense entre si e distribúense espacialmente á maior distancia angular posible. O poder de repulsión non é igual entre todos eles: os pares non enlazantes teñen maior poder de repulsión; por iso, a repulsión máis intensa dáse entre estes pares, despois, entre un par non enlazante e un enlazante, e a menor establécese entre os pares enlazantes.
3. Os pares de electróns non compartidos (non enlazantes) ocupan maior lugar no espazo que os pares de electróns compartidos (enlazantes).
4. Para a determinación da xeometría molecular, os dobres e os triplos enlaces considéranse simples. Todos son zonas de alta densidade electrónica que tenden a repelerse entre si.
6.2. Predición da xeometría molecular
Para predicir a xeometría molecular no modelo RPECV:
1. Escríbese a estrutura óptima de Lewis para a molécula ou ión estudado.
2. Cóntase o número de zonas de alta densidade electrónica arredor do átomo central sen distinguir entre enlaces e pares de electróns solitarios.
3. Represéntanse graficamente as orientacións espaciais de mínima repulsión (os pares non compartidos ocupan máis espazo que os compartidos).
4. Colócanse os átomos que rodean ao átomo central nos extremos das nubes electrónicas.
5. Obtense a xeometría molecular a partir da disposición espacial dos núcleos dos átomos presentes (non das nubes electrónicas). A xeometría real predise tendo en conta as distorsións angulares xeradas polos diferentes pares de enlace ou pares solitarios.
34 Escribe a estrutura de Lewis de cada unha das seguintes moléculas e predí, xustificando a resposta, a súa xeometría molecular: PCl3, OF2, H2CO, CH3Cl. Datos: Números atómicos: H = 1, C = 6, O = 8, F = 9, P = 15, Cl = 17.
35 a) Escribe a estrutura de Lewis para as moléculas NF3 e CF4, b) debuxa a xeometría de cada molécula segundo a teoría de repulsión de pares de electróns da capa de valencia, c) considerando as xeometrías moleculares, razoa acerca da polaridade de ambas as dúas moléculas.
36 Que xeometría terán as moléculas C2, NH3 e CF4? Cales delas teñen momento dipolar non nulo?
Repulsións electrónicas
Péchase o ángulo
180°
As repulsións electrónicas entre os pares non enlazantes e enlazantes-non enlazantes na molécula de auga fan que o ángulo «teórico» de 180o se peche, quedando nun ángulo real de 104,5o. Así, a xeometría molecular é angular e non lineal.
6.3. Xeometría de moléculas cuxo átomo central carece de pares de electróns solitarios
Supoñeremos que as moléculas ou ións moleculares conteñen dous elementos diferentes A e B, onde A é o átomo central (este é o que ten maior valencia covalente). O hidróxeno é sempre periférico.
Se non hai pares de electróns solitarios, a xeometría electrónica coincide coa xeometría molecular. A fórmula xeral destas moléculas é ABn, onde n pode variar de 2 a 6.
Molécula de tipo AB2
As moléculas do tipo AB2 son lineais, cun ángulo de enlace de 180º. A xeometría lineal prodúcese cando o átomo central A está rodeado por dous grupos de electróns ou zonas de alta densidade electrónica.
Algúns exemplos de moléculas ou especies iónicas con esta xeometría son MgCl2, CO2, BeH2, CdBr2 e N3 .
Molécula de tipo AB3
As moléculas de tipo AB 3 son planas e trigonais, con ángulos de enlace de 120º. A xeometría plana trigonal dáse cando o átomo central A está rodeado por tres grupos de electróns. Hai tres zonas de alta densidade electrónica orientadas cara aos vértices dun triángulo equilátero.
Algúns exemplos de moléculas ou especies iónicas con esta xeometría son BCl3, NO3 , CO32− BI3 e BH3.
Molécula de tipo AB4
As moléculas de tipo AB4 son tetraédricas, con ángulos de enlace de 109,5º. A xeometría tetraédrica ten lugar cando o átomo central A está rodeado por catro grupos de electróns.
Hai catro zonas de alta densidade electrónica arredor do átomo central A que se orientan cara aos vértices dun tetraedro. Son moléculas tridimensionais.
Algúns exemplos de moléculas ou especies iónicas con esta xeometría son CH4, NH4+, CCl4, SO42–
Molécula de tipo AB5
O caso máis común é a xeometría tipo bipirámide trigonal. Hai cinco zonas de alta densidade electrónica arredor do átomo central A que se orientan cara aos vértices dunha bipirámide trigonal. Coexisten dous tipos de ángulos de enlace: uns de 120º e outros de 90º. Un exemplo de molécula con esta xeometría é o PCl5
Molécula de tipo AB6
As moléculas do tipo AB 6 teñen unha forma octaédrica con ángulos de enlace de 90º. Hai seis zonas de alta densidade electrónica arredor do átomo central A que se orientan cara aos vértices dun octaedro. Exemplos dunha molécula e un grupo aniónico con esta xeometría son SF 6, PCl 6
6.4. Xeometría de moléculas cuxo átomo central ten pares de electróns solitarios
A presenza de pares non enlazantes nunha molécula varía o ángulo de enlace por efecto da repulsión electrónica e, polo tanto, modifica a xeometría molecular predita polo modelo. Os ángulos de enlace diminúen a medida que aumenta o número de pares de electróns non enlazantes ou solitarios.
Se usamos o símbolo X para describir os pares de electróns non enlazantes do átomo central, a fórmula xeral destas moléculas será ABnXm onde n = 2, 3 e m = 1 ou 2.
Molécula de tipo AB2X
O ángulo de enlace das moléculas do tipo AB2X é algo menor de 120º porque os pares de electróns non compartidos exercen unha maior forza de repulsión que os pares de electróns enlazantes e por este motivo o ángulo de enlace péchase un pouco. Neste caso temos tres nubes electrónicas, unhas das cales é un par de electróns solitarios. O tipo de xeometría que corresponde a estas moléculas é angular. Algúns exemplos son SO2, O3, NO2 , SnCl2, IBr2 , ClO2
Molécula de tipo AB3X
O ángulo de enlace destas moléculas é menor que 109,5º polo mesmo motivo que no caso anterior. Agora temos catro nubes de electróns, unha das cales é un par de electróns solitarios. O tipo de xeometría que lles corresponde ás moléculas AB3X é unha xeometría de pirámide trigonal. Algúns exemplos son NH3, H3O+, AsH3, PH3, NF3, PBr3, PF3 e ClO3
Molécula de tipo AB2X2
Neste caso temos catro nubes electrónicas, dúas das cales corresponden a pares solitarios. Os dous pares solitarios producen unha maior repulsión, o que se traduce en que as nubes enlazantes se pechen e o seu ángulo de enlace sexa menor que no caso AB3. O tipo de xeometría que lles corresponde ás moléculas AB2X2 é unha xeometría angular. Algúns exemplos de moléculas con esta xeometría son H2O, H2S e SF2
Exercicio resolto
1 Considera as moléculas OF2, BF3, CCl4 e C2H2. Responde as seguintes cuestións: a) escribe as súas representacións de Lewis, b) indica as súas xeometrías moleculares utilizando a teoría RPECV.
37 Dadas as moléculas HCN, F2O, NH,3, NCl3, SiCl4, BCl3, responde razoadamente as seguintes cuestións: a) representa a estrutura de Lewis de cada unha delas, b) predí a súa xeometría molecular, c) explica en cada caso se a molécula ten ou non momento dipolar.
b) OF2: xeometría angular, BF3: xeometría plana triangular, CCl4: xeometría tetraédrica, C2H2: xeometría lineal.
Datos: Números atómicos: H = 1, C = 6, N = 7, O = 8, F = 9, Si = 14, Cl = 17.
7.1. Modelo do gas de electróns ou modelo de Drude
É un modelo sinxelo que non está baseado na mecánica cuántica. Os metais teñen unha baixa enerxía de ionización; polo tanto, tenden a perder electróns para quedar coa capa máis externa completa (regra do octeto). Segundo Drude, estes electróns non están unidos a ningún átomo en particular e tampouco forman pares, senón que están deslocalizados (quedan libres) pola rede cristalina. Estableceu así un modelo segundo o cal podemos considerar un metal como un conxunto de catións metálicos formando unha rede cristalina en cuxo interior hai unha nube de electróns de valencia que se moven libremente actuando como unión entre os ións positivos. A atracción electrostática entre os electróns e os catións mantén fortemente unidos todos os átomos do metal.
Os catións positivos dos metais forman unha rede tridimensional de esferas ordenada e compacta (son estruturas típicas a rede cúbica compacta e a hexagonal compacta). O feito de que os catións formen unha rede moi compacta reflíctese en números de coordinación moi altos (cada ión está rodeado de moitos ións de signo contrario) e elevadas porcentaxes de ocupación dos catións en relación co volume total do cristal.
Rede cúbica compacta
Enlace metálico segundo o modelo de Drude.
Este modelo explica algunhas propiedades dos metais, por exemplo, a condutividade eléctrica, o brillo metálico, a baixa enerxía de ionización, etc., pero non outras, como o comportamento dos semicondutores. Estas limitacións son resoltas polos modelos cuánticos, como a teoría de bandas.
A teoría de bandas é un modelo cuántico que se basea na aplicación da teoría dos orbitais moleculares ao caso dos metais.
A medida que aumenta o número de orbitais atómicos, aumenta o número de orbitais moleculares, e, se este é o suficientemente grande, os niveis de enerxía sucédense de xeito case continuo dando lugar a bandas de enerxía.
Como na teoría de Drude, os electróns de valencia que ocupan un orbital molecular pertencen a todo o conxunto, estando completamente deslocalizados.
Teoría de bandas para o magnesio (Z = 12): 1s2 2s2 2p6 3s2
Analicemos o caso do magnesio segundo esta teoría. Cada átomo ten dous electróns de valencia situados no orbital 3s, quedando os orbitais 3p baleiros.
Se consideramos o metal como moitos átomos de magnesio xuntos, podemos imaxinar a aparición de bandas, formadas por moitos orbitais superpostos. Unha banda, correspondente á superposición dos orbitais 3s, estará chea de electróns e chamarase banda de valencia, e outra banda composta polos orbitais do subnivel 3p estará baleira e denominarase banda de condución.
Estas bandas, en xeral, están separadas por rexións de enerxía prohibidas (denominadas «gap»), aínda que nalgúns casos se pode producir a superposición entre bandas con solapamento enerxético.
Banda de valencia
Rede hexagonal compacta
Banda de condución
Magnesio
Bandas de valencia e de condución para o magnesio.
Con esta teoría pódese comprender doadamente o comportamento como condutores, semicondutores, illantes e supercondutores que mostran estes elementos. A distancia enerxética entre as bandas de valencia e as bandas de condución determina as diferenzas da condutividade eléctrica.
38 Debuxa o diagrama de banda de valencia e de condución para os seguintes metais:
a) Na (Z=11),
b) Li (Z=3)
Bandas de condución eléctrica en condutores, semicondutores e illantes.
Metais
Nun metal, as bandas de valencia e de condución están moi próximas entre si; a enerxía necesaria para que un electrón pase da banda de valencia á de condución é desprezable.
Nos metais, a banda de valencia está semichea (os electróns poden moverse dentro con liberdade) ou está chea pero solapada coa banda de condución que está baleira. Tanto nun caso como noutro, os electróns dispoñen de orbitais moleculares baleiros que se poden ocupar coa achega dun mínimo de enerxía (para que un metal conduza a corrente, debe acontecer o salto de electróns da banda de valencia á de condución).
Semicondutores
Estes elementos teñen a banda de valencia chea e a de condución baleira, e a diferenza de enerxías entre unha e outra é pequena (a zona prohibida é moi estreita), de maneira que un pequeno incremento da temperatura é suficiente para promover os electróns cara á banda de condución (estas especies son condutoras só baixo certas condicións).
Algúns exemplos de semicondutores son o silicio (Si), o xermanio (Ge) e o selenio (Se).
Illantes
Nos elementos illantes, a banda de valencia e a de condución están moi afastadas enerxeticamente. A banda prohibida é tan ancha que ningún electrón pode saltala. Os electróns non poden moverse pola banda de valencia nin poden promover a banda de condución, non son electróns libres e o sólido non conduce a corrente eléctrica, aínda que apliquemos un campo eléctrico externo. Algúns exemplos de materiais illantes son o diamante (C) e o óxido de silicio (SiO2).
Caracterízanse por conduciren a electricidade sen resistencia. Os primeiros que se descubriron eran metais que necesitaban temperaturas de 0 K para ter estas características.
Os elementos semicondutores utilízanse frecuentemente na construción de compoñentes electrónicos.

As propiedades dos metais pódense explicar grazas aos electróns deslocalizados e á súa rede cristalina compacta.

Brillo
Ao incidir a luz sobre a superficie dos metais, os electróns vibran, polo que se orixinan ondas electromagnéticas da mesma frecuencia que a luz incidente, o que xustifica o brillo característico de todos os metais.
Estados de agregación. Puntos de fusión e ebulición
Xeralmente, os metais son sólidos cristalinos cun número de coordinación elevado, aínda que tamén podemos encontrar metais en estado líquido moi densos como o mercurio.
Os puntos de fusión son moi variables, aínda que a maioría dos metais presentan puntos de fusión altos.
Para fundir o metal, debemos proporcionar a calor suficiente para que o movemento de vibración dos átomos se faga máis intenso. Canto máis fortes son os enlaces entre os átomos, maior será a enerxía calorífica para separalos e o punto de fusión será máis elevado.


Densidade
Teñen unha densidade grande debida a que os catións metálicos teñen un índice de coordinación elevado.
Os metais son dúctiles (capacidade de deformarse en forma de fíos) e maleables (capacidade de deformarse en forma de láminas), o que permite traballar con eles con relativa facilidade.
Estas propiedades indican que os átomos son capaces de desprazarse uns respecto dos outros.
Os metais son bos condutores da electricidade e da calor tanto en estado sólido como fundidos. Os metais conducen a corrente eléctrica debido a que os electróns se desprazan doadamente cando se aplica unha diferenza de potencial.
Tamén son bos condutores da calor, porque ao elevar a temperatura aumentan a velocidade dos electróns (maior número de choques) e a transmisión de enerxía.
Emisión de electróns
Os electróns están relativamente libres dentro do cristal; pódense arrancar doadamente pola acción de luz dunha determinada frecuencia (efecto fotoeléctrico) ou se se quentan (efecto termoiónico).
Solubilidade
Os metais son insolubles nos disolventes moleculares (auga, acetona...) polares ou apolares. Disólvense moi ben uns noutros, orixinando aliaxes e amálgamas.
As moléculas dos compostos interaccionan entre si por medio de forzas atractivas (forzas intermoleculares), en xeral moito máis débiles que as que manteñen enlazados os átomos nas moléculas (forzas intramoleculares) ou os anións e catións na rede iónica (forzas electrostáticas), aínda que suficientemente intensas como para mantelas unidas nos estados líquido e sólido.
Denomínase forza intermolecular calquera tipo de interacción entre moléculas que non implique enlace químico.
Estas forzas intermoleculares determinan se unha substancia existirá en forma gasosa, líquida ou sólida a certa temperatura e presión.
A intensidade das atraccións intermoleculares diminúe ao aumentar a distancia entre as moléculas, polo que non son forzas relevantes nos gases pero si en líquidos e en sólidos.
Hai varios tipos de forzas intermoleculares:
Forzas de dispersión ou de London
Forzas de Van der Waals
Forzas dipolo-dipolo
Forzas dipolo-dipolo inducido
Enlaces por pontes de hidróxeno
Forzas de Van der Waals
Son forzas de atracción débiles causadas pola interacción entre dipolos eléctricos moleculares e aumentan canto maior sexa o número de electróns da molécula e a súa masa. Dentro delas, encontramos:
As forzas de London xorden da atracción entre dous dipolos instantáneos. Os dipolos xéranse debido a flutuacións na localización dos electróns nas moléculas. As flutuacións aleatorias das nubes electrónicas son moi rápidas (10−12 s) e provocan anomalías na distribución da carga eléctrica (un extremo da molécula terá carga parcial negativa e o outro extremo, carga parcial positiva, tamén pasaxeira), orixinando o dipolo instantáneo. Cando as moléculas dun composto se aproximan, prodúcese unha separación entre os núcleos e as nubes electrónicas como consecuencia das cargas de signo oposto. Estas forzas foron definidas en 1930 por F. London e orixínanse entre calquera tipo de moléculas, polares e apolares, dependendo principalmente das distancias entre os átomos ou grupos de átomos que interaccionan.
A intensidade das forzas de London aumenta coa masa e o volume molecular. Isto explica por que o F2 e Cl2 son gases, o Br2 é líquido e o I2 é un sólido a temperatura ambiente.
Non debes confundir as unións intramoleculares (como o enlace covalente) coas unións intermoleculares (como as forzas de Van der Waals).
Enlaces covalentes F. Van der Waals
Direccionalidade Si Non
Distancia de enlace Menor Maior
Fortaleza Fortes
Débiles e aumentan coa masa e o volume moleculares
Táboa 4. Comparación entre os enlaces covalentes e as forzas de Van der Waals.
Johannes Diderick van der WaalsJ. D. van der Waals (1837-1923) foi galardoado co Premio Nobel de Física en 1910, polo seu traballo sobre a ecuación de estado dos gases e os líquidos. Tamén investigou sobre a disociación electrolítica, a teoría termodinámica da capilaridade e sobre estática de fluídos.
En 1880 enunciou, tras varios anos de investigación, a súa teoría molecular da substancia composta por dous tipos distintos de materia, na que establecía unha serie de fórmulas e ecuacións coas que, entre outros experimentos, se conseguiu posteriormente licuar o hidróxeno e o helio.
Forzas de London entre dúas moléculas de I2
Forzas intermoleculares de London entre dúas moléculas de iodo.
Forzas dipolo-dipolo
As interaccións dipolo-dipolo permanentes existen entre as moléculas covalentes polares debido á atracción da zona de densidade positiva dunha molécula e a zona de densidade negativa da outra.
Estas moléculas polares teñen cargas parciais permanentes, ademais das cargas parciais instantáneas, debido ás flutuacións das súas nubes electrónicas. Por iso, a interacción dipolo-dipolo súmase ás forzas de dispersión (sempre presentes).
A magnitude desta forza adicional depende das magnitudes dos dipolos que interaccionan e da forma da molécula. Afecta tanto máis canto máis polar sexa a molécula. As moléculas polares forman líquidos e sólidos como resultado das interaccións dipolo-dipolo.
Forzas dipolo-dipolo inducido
Aparecen cando mesturamos unha substancia con moléculas apolares e outra con moléculas con momento dipolar permanente.
Se a molécula polar se aproxima o suficiente a unha molécula apolar, pode inducir nela un desprazamento da nube electrónica e provocar a aparición de dipolos inducidos. Deste xeito, prodúcese unha forza intermolecular adicional.
Enlaces por pontes de hidróxeno
O enlace por ponte de hidróxeno é un tipo especial de interacción intermolecular que existe entre o átomo de hidróxeno dun enlace polar (H—F, H—O, H—N) e un par de electróns non compartidos nun ión ou átomo próximo de volume pequeno e electronegatividade elevada (xeralmente un átomo de flúor, osíxeno ou nitróxeno doutra molécula).
Os puntos de fusión do HF, H2O e NH3 son máis altos do que cabería esperar debido a que entre as moléculas destes compostos existen forzas de atracción máis intensas que no resto dos hidruros do grupo.
A aparición dunha carga parcial positiva sobre o átomo de hidróxeno e unha carga parcial negativa sobre o outro átomo orixina o establecemento dunha atracción electrostática entre os hidróxenos dunha molécula e os átomos electronegativos da molécula veciña.
Este tipo de atraccións son as responsables, entre outras cousas, de que a auga (masa molecular = 18 u) sexa líquida a temperatura ambiente, mentres que o H2S (masa molecular = 34 u) sexa un gas.
Os enlaces por pontes de hidróxeno aínda que son máis fortes que as interaccións dipolo-dipolo (inferiores a 2 kJ · mol–1), son moito máis débiles que os enlaces ordinarios (da orde de 150 kJ · mol–1). A enerxía do enlace por ponte de hidróxeno oscila no intervalo de 10 a 40 kJ · mol–1
a) b)
Dipolos permanentes (Moléculas covalentes polares)
d d+ d d
dipolo dipolo inducido
Forzas intermoleculares dipolo-dipolo, entre dous dipolos permanentes (a) e entre dipolo permanente-dipolo inducido (b).
O HF constitúe un exemplo importante de presenza de pontes de hidróxeno. Neste caso, debido á maior electronegatividade do flúor, os electróns da unión pasan a maior parte do tempo sobre o átomo de flúor, xerando así unha alta densidade de carga positiva sobre o hidróxeno e unha alta densidade de carga negativa sobre o flúor. Esta carga negativa atrae o hidróxeno dunha molécula veciña compartindo con el un dos seus pares de electróns libres. Así, a ponte de hidróxeno manterá unidas as dúas moléculas e estenderase a outras moléculas veciñas formando unha cadea molecular.
Son substancias moleculares aquelas constituídas por moléculas unidas entre si por forzas intermoleculares. As súas propiedades son, polo tanto, o resultado do tipo de forzas intermoleculares que presenten.
As substancias moleculares teñen puntos de fusión e ebulición baixos. A temperatura ambiente, a maior parte destas substancias encóntranse en estado gasoso (H2, N2, O2, CH4, CO2), outras son líquidas (Br2, H2O) e outras encóntranse en estado sólido, como o I2, o S8 e a glicosa (C6H12O6). Ao seren moi débiles as forzas intermoleculares, unha pequena axitación térmica é suficiente para desordenar e separar as moléculas.

Propiedades mecánicas
As substancias moleculares tenden a ser brandas, compresibles e doadamente deformables; isto é debido ao carácter non direccional das forzas de Van der Waals.
Solubilidade
As substancias apolares son insolubles en disolventes polares como a auga, pero disólvense ben en disolventes apolares como o CCl4. As substancias polares son máis solubles en auga.
Unha substancia disolverase se as forzas entre as súas moléculas e as do disolvente son máis intensas que as forzas das súas moléculas entre si.
Exercicios
39 Dada a molécula CCI4: a) represéntaa mediante a estrutura de Lewis, b) por que a molécula é apolar se os enlaces están polarizados? c) por que a temperatura ambiente o CCI4 é líquido e o CI4 é sólido?
O aceite (substancia apolar) é insoluble en auga (substancia polar). Adóitase utilizar tamén o termo hidrófobo para unha substancia apolar.

Condutividade eléctrica
As substancias que forman cristais moleculares son, en xeral, bos illantes eléctricos. As moléculas en si non posúen carga eléctrica neta e non poden transportar a enerxía. Ademais, os electróns que forman os enlaces covalentes tenden a estar localizados (os electróns compartidos nos enlaces covalentes están fortemente unidos e non poden desprazarse). Non obstante, algunhas substancias moleculares disoltas en auga ionízanse e a disolución vólvese condutora.
40 O trifluoruro de boro e o amoníaco son compostos gasosos en condicións normais. Explica: a) a forma xeométrica das súas moléculas, b) cal das dúas moléculas é máis polar, c) como serán os enlaces intermoleculares en cada un dos compostos, d) cal dos dous compostos terá un punto de ebulición máis alto.
Datos: Números atómicos: H = 1, B = 5, N = 7, F = 9.
Os átomos de C, H, O e N, moi abundantes nos seres vivos, teñen de 4 a 6 electróns na capa de valencia e son elementos pequenos (masas atómicas baixas) capaces de formar doadamente enlaces covalentes estables. Estes enlaces poden ser simples, dobres ou triplos dando lugar a multitude de moléculas orgánicas con diversos grupos funcionais susceptibles de reaccionar con outras moléculas xerando novas moléculas e estruturas moleculares máis complexas. Por outro lado, moitas destas moléculas biolóxicas son monómeros (glicosa, aminoácidos...) que, á súa vez, se unen mediante enlaces covalentes formando polímeros (amidón, proteínas...). Todo iso resulta útil para as continuas reaccións do metabolismo dos seres vivos. A continuación, veremos algunhas moléculas importantes desde o punto de vista biolóxico.
Biomoléculas orgánicas formadas por carbono, hidróxeno e osíxeno. Son compostos que teñen varios grupos hidroxilo (OH) e un grupo carbonilo, ben aldehido (CHO), ou ben cetona (C O). Algúns exemplos son a ribosa, que forma parte da estrutura do ARN, así como de nucleótidos capaces de transferir enerxía (como o ATP); a desoxirribosa, que forma parte da estrutura do ADN; a glicosa, utilizada como fonte de enerxía por todas as células; a frutosa, azucre presente nas froitas, que ten o mesmo valor enerxético que a glicosa, etc.
Estrutura do ADN
O ADN (ácido desoxirribonucleico) é unha macromolécula cunha estrutura de dobre hélice enrolada en forma de espiral. Cada cadea da dobre hélice é, á súa vez, un polímero constituído pola unión de nucleótidos de desoxirribosa mediante enlaces fosfodiéster.
A estabilización da dobre hélice é posible grazas ao establecemento de enlaces por pontes de hidróxeno entre as bases nitroxenadas.
Formación da molécula de sacarosa por unión mediante un enlace covalente denominado O-glicosídico dunha molécula de glicosa e outra de frutosa, azucre presente nas froitas.
Biomoléculas orgánicas compostas, basicamente, por carbono, hidróxeno, osíxeno, e ás veces tamén por outros elementos, como fósforo, nitróxeno e xofre. Desempeñan as seguintes funcións biolóxicas: enerxética, estrutural, protectora, transportadora e reguladora.
As proteínas pódense definir como polímeros formados pola unión mediante enlaces peptídicos de moléculas de baixa masa molecular chamadas aminoácidos. As proteínas son as moléculas orgánicas máis abundantes nas células; están formadas basicamente por carbono, hidróxeno, osíxeno e nitróxeno, ademais de xofre, en moitas delas.
As proteínas son as moléculas específicas que marcan a individualidade de cada ser vivo, realizan funcións de vital importancia nel e son tamén as moléculas mediante as que se expresa a información xenética contida no ADN.
Actualmente, o termo «intelixente» adoptouse como un modo válido de describir unha clase de materiais que presentan a capacidade de cambiar as súas propiedades físicas (viscosidade, forma, rixidez, cor...) en presenza dun estímulo concreto.
Algunhas das súas aplicacións son:
• Existen e comercialízanse lentes cuxas monturas están construídas cunha aliaxe con memoria de forma. Así, se a montura resulta dobrada ou deformada pódese recuperar a súa forma inicial tan só quentándoa.
• No campo da enxeñería sísmica existen aplicacións para diminuír as vibracións producidas durante un terremoto e garantir a seguridade estrutural dun edificio.
• A industria aeronáutica encóntrase desenvolvendo alas de rixidez variable que responden á carga do vento de forma activa para conseguir distintos obxectivos como a diminución de cargas de fatiga, optimización aerodinámica, etc.
• O nitinol (aliaxe de níquel e titanio) pode empregarse para fabricar arames superelásticos que se poden tecer en formas cilíndricas para varios usos.
Unha das aplicacións máis habituais son os «stents» vasculares para reforzar os vasos sanguíneos.

Lentes con montura de titanflex (aliaxe de titanio).

• Investigadores europeos desenvolveron materiais innovadores con aplicacións á enxeñería de tecidos.
Estes materiais están deseñados para responder a estímulos concretos, como infeccións bacterianas, e poden ter múltiples aplicacións médicas.
Stent.
Cuestións
1 Os enxeñeiros de materiais estudan as calidades, características e usos dos materiais, e aplican os seus coñecementos para investigar e desenvolver novos materiais. Investiga acerca das competencias e do perfil profesional dun enxeñeiro de materiais.
2 Busca información sobre os fluídos electrorreolóxicos e as súas aplicacións.
3 Unha das liñas de investigación máis importantes sobre materiais intelixentes refírese aos «metamateriais». Responde as seguintes preguntas, investigando en Internet: a) como funciona un metamaterial?, b) aplicacións actuais dos metamateriais.
Microscopia electrónica de varrido dun tecido de algodón recuberto de partículas de ZnO.
4 No ano 2000, os químicos Alan Heeger, Hideki Shirakawa e Alan MacDiarmid recibiron o Premio Nobel de Química polo descubrimento e desenvolvemento de polímeros sintéticos condutores da electricidade. Busca información sobre as aplicacións deste tipo de polímeros sintéticos.

As propiedades das substancias moleculares están determinadas non só polos átomos que forman as súas moléculas, senón tamén pola forma en que estes átomos se distribúen no espazo. Os dous factores fan que a esa molécula lle corresponda unha xeometría molecular determinada caracterizada polos seus correspondentes parámetros moleculares: lonxitudes e ángulos de enlace.
Nesta sección imos usar un applet que nos permitirá visualizar a molécula tridimensionalmente, así como determinar a súa xeometría.
Para localizar este applet en primeiro lugar tes que ir á páxina web da Universidade de Colorado: https://phet. colorado.edu/sims/html/molecule-shapes/latest/molecule-shapes_es.html. É un programa interactivo que está en castelán e nos ofrece múltiples opcións tales como traballar con moléculas reais predeterminadas ou experimentar construíndo os nosos propios modelos moleculares.


Este applet ofrécenos dúas opcións de traballo:
A) Modelo
Neste caso podemos incorporar enlaces simples, dobres e triplos ao átomo central, así como engadir pares de electróns non enlazantes ou solitarios. Para iso cliqueamos o tipo de unión que queremos engadir e o número de electróns solitarios.
Unha vez establecido o número de pares de electróns enlazantes e non enlazantes, poderemos visualizar o valor dos diferentes ángulos de enlace. Tamén poderemos determinar tanto a xeometría molecular como a xeometría electrónica do noso modelo.
O programa permítenos orientar a molécula e visualizala de xeito tridimensional.
B) Molécula real
Neste caso podemos traballar con exemplos concretos das diferentes xeometrías moleculares (lineal, plana trigonal, tetraédrica, bipirámide trigonal, octaédrica, angular e pirámide trigonal), pero non podemos incorporar enlaces simples, dobres e triplos ao noso átomo central nin engadir pares de electróns non enlazantes ou solitarios.
O programa permítenos orientar a mol écula nas diferentes direccións do espazo, visualizar os ángulos de enlace e determinar, ademais, a súa xeometría electrónica.
Entre os obxectivos a alcanzar mediante o uso desta ferramenta TIC están:
a) Recoñecer que a xeometría molecular se debe á repulsión entre os grupos de electróns.
b) Describir como os pares de electróns solitarios afectan a ángulos de enlace en moléculas reais.
c) Determinar a xeometría molecular e a xeometría electrónica da molécula.
A xeometría molecular refírese á disposición tridimensional dos átomos que constitúen unha molécula. É un determinante de moitas das propiedades do composto.
A xeometría electrónica é a forma na que os electróns se dispoñen no espazo, considerando todos os pares de valencia do átomo central. Xeralmente coincide coa xeometría molecular pero non sempre.
Cuestións
1 Utilizando o programa interactivo estudado, determina a xeometría molecular, ángulos de enlace e xeometría electrónica para os seguintes casos: a) molécula con tres enlaces simples, b) molécula con tres enlaces simples e un par de electróns solitarios, c) molécula con dous enlaces simples e un enlace dobre, d) molécula con dous enlaces simples, un enlace dobre e un par de electróns solitarios, e) molécula con dous enlaces simples, un enlace dobre e dous pares de electróns solitarios.
2 Agora, faino de novo para as seguintes moléculas: a) H2O, b) NH3, c) BF3, d) XeF4, e) SF6
1 Considera os compostos NH3, CH4 e HF e indica razoadamente:
a) As xeometrías de cada unha das moléculas.
b) Cal ou cales son polares.
c) Cal dos compostos é máis ácido, baseándose en criterios de electronegatividade.
Datos: Números atómicos: N (Z = 7), H (Z = 1), C (Z = 6), F (Z = 9).
Proposta e resolución
Femtoquímica
a) Para determinar a xeometría molecular, imos utilizar a teoría de repulsión dos pares electrónicos da capa de valencia (TRPECV). A xeometría molecular é a distribución tridimensional dos átomos dunha molécula e é aquela na que a repulsión electrónica é mínima.
Estas moléculas pódense representar coas estruturas de Lewis:
H
H-N-H H—C—H H—F
H H
NH3: Neste caso o átomo central ten pares de electróns solitarios. No amoníaco hai catro nubes de electróns, unir das cales é un par solitario.
Presenta unha xeometría de pirámide trigonal.
CH4: Neste caso o átomo central carece de pares de electróns solitarios. Hai catro zonas de alta densidade electrónica arredor do átomo central de carbono que se orientan cara aos vértices dun tetraedro.
A molécula presenta unha xeometría tetraédrica con ángulos de enlace de 109,5º.
HF: Neste caso non hai átomo central.
A molécula presenta unha xeometría lineal.
b) NH3: É unha molécula polar, os tres momentos dipolares de enlace N—H son iguais, pero, ao ter xeometría piramidal, non se anulan entre si ( 0 ! n ).
CH4: É unha molécula apolar, os catro momentos dipolares de enlace C—H son iguais, pero, ao teren xeometría tetraédrica, anúlanse entre si ( 0 ! n ).
HF: É unha molécula polar, existe momento dipolar de enlace H—F. A molécula presenta xeometría lineal.
c) O ácido fluorhídrico (HF) é o composto máis ácido, xa que o flúor presenta maior diferenza de electronegatividade co hidróxeno que o resto de elementos.
A maior diferenza de electronegatividade, maior será a acidez.
En todo tipo de unión covalente, os átomos quedan enlazados mediante pares de electróns comúns. As representacións gráficas que se utilizan na descrición das moléculas dos compostos covalentes denomínanse estruturas de Lewis.
Para que unha molécula sexa polar, é necesario, pero non suficiente, que conteña enlaces covalentes polarizados. Cando nunha molécula polar hai máis dun enlace, o momento dipolar molecular é a suma vectorial dos momentos dipolares de enlace; por iso, é necesario, para determinala, coñecer a xeometría molecular e os ángulos de enlace.
Para comprobar que o resultado é correcto, pódese determinar a xeometría das moléculas utilizando outras teorías, ben a través da teoría da hibridación de orbitais atómicos, ou ben a través da teoría do enlace de valencia (TEV).
No desenvolvemento do problema tamén se pode comprobar cal deles é máis ácido tendo en conta as diferentes teorías relativas ao carácter ácido-base dunha substancia dependendo do caso a analizar: teoría de Brønsted-Lowry e a teoría de Lewis.
Hai que ter en conta que a electronegatividade é a capacidade que ten un átomo de atraer cara a si os pares de electróns que comparte nun enlace covalente. Canto máis electronegativo sexa, con maior forza atraerá ese par de electróns.
As electronegatividades mídense de forma comparativa entre os elementos. Utilízanse escalas relativas como a escala de Pauling, que relaciona a electronegatividade coas enerxías de enlace.
O descubrimento do metano (CH 4) sucedeu de forma accidental en 1776 cando Alessandro Volta descubriu en Angera (Italia) que o aire dos pantanos era inflamable. Esta primeira idea do que podería ser o metano foi denominada inicialmente «gas dos pantanos» e levouno a afondar nesta cuestión con estudos e investigacións sobre o dito aire inflamable.
Os estudos de Alessandro Volta permitiron descubrir que o metano (CH4) é o resultado da descomposición dalgunhas substancias orgánicas en ausencia de osíxeno.
2 a) Ordena, segundo polaridade crecente, baseándote nos valores das electronegatividades da táboa adxunta, os seguintes enlaces: HF, HO, HN, HC, CO e CCl
b) A polaridade da molécula de CH4 será igual ou distinta que a do CCl4?
c) Para a molécula de H2O, indica a hibridación que presenta o átomo central e a súa xeometría.
Proposta e resolución
a) Todos os enlaces son covalentes, ao tratarse da unión entre dous non metais, ou entre un non metal e hidróxeno. Canto maior sexa a diferenza de electronegatividade, máis polar será o enlace, xa que o par de electróns compartidos será máis atraído polo elemento máis electronegativo, aumentando tamén a porcentaxe do carácter iónico do enlace. Polo tanto, a orde segundo polaridade crecente será:
H—C < C—Cl< H—N < C-O < H—O <H—F
b) Debido á maior diferenza de electronegatividade, é máis polar o enlace C—Cl que o enlace C—H
Por outro lado, as dúas moléculas presentan xeometría tetraédrica segundo a teoría de repulsión dos pares electrónicos da capa de valencia (TRPECV) co carbono no centro e os átomos de hidróxeno, ou de cloro, nos vértices. C
Para establecer a polaridade dunha molécula:
1) Obtéñense as estruturas óptimas de Lewis e aplícase o método TRPECV.
2) Identifícanse os enlaces polarizados.
3) Súmanse vectorialmente os momentos dipolares de todos os enlaces individuais, dando lugar ao momento dipolar molecular.
A electronegatividade está directamente relacionada co potencial de ionización e a afinidade electrónica. Na táboa periódica, aumenta de esquerda a dereita dentro dun mesmo período; e de abaixo cara a arriba dentro dun mesmo grupo. Así, o elemento máis electronegativo nesta táboa é o flúor (4,0) e o menos electronegativo é o H (2,1).
DISCUSIÓN DE RESULTADOS
Para determinar a orde de polaridade, tívose en conta a diferenza de electronegatividades entre os átomos que forman o enlace.
A electronegatividade é a tendencia que ten un átomo dun elemento de atraer os electróns compartidos con outro átomo cando está combinado quimicamente con el.
Nos enlaces do problema, o menos electronegativo adquirirá certa carga positiva δ+ e o máis electronegativo desprazará o par electrónico cara a el, adquirindo certa carga negativa δ– , orixinándose un dipolo eléctrico.
E ADEMAIS...
Esta simetría tetraédrica provoca que o vector momento dipolar resultante sexa nulo ( 0 n = ), tratándose, en consecuencia, de dúas moléculas apolares.
b) O osíxeno ten seis electróns de valencia e presenta dous enlaces, polo que ten dous electróns enlazantes, un en cada enlace simple, e un par de electróns libres.
O osíxeno presenta unha hibridación con catro orbitais sp3, dous deles forman enlaces simples co orbital 1s do hidróxeno, e nos outros dous ten pares de electróns libres, polo que a súa xeometría é angular.ú
O tetracloruro de carbono (CCl4) usouse no pasado na produción de líquido refrixerante e propulsor de aerosois, como desengraxante, como praguicida, como axente limpador e en extintores. Debido aos seus efectos prexudiciais, estes usos están prohibidos e actualmente emprégase soamente en certas aplicacións industriais:
a) Disolvente na extracción de aceites, graxas e ceras.
b) Na industria química de pinturas e artes gráficas.
c) Na industria do caucho e o coiro.
d) Na industria farmacéutica (antihelmíntico, desengraxante capilar).
1 Dadas as enerxías reticulares das seguintes substancias, U (kJ · mol–1): NaF = −914, NaCl = −770, NaBr = −728, razoa como varían: a) os seus puntos de fusión, b) a súa dureza, c) a súa solubilidade en auga.
2 En estado sólido os compostos KF e CaO presentan o mesmo tipo de estrutura cristalina e distancias interiónicas similares. Non obstante, os valores das enerxías de rede son ∆Hrede (CaO) = −3461 kJ · mol–1, ∆Hrede (KF) = –826 kJ · mol–1. Indica, de xeito razoado, o factor ou factores que xustifican a diferenza existente entre os dous valores da enerxía de rede.
3 Supoñamos que os sólidos cristalinos NaF, KF e LiF cristalizan no mesmo tipo de rede: a) escribe o ciclo de Born-Haber para o NaF, b) razoa como varía a enerxía reticular dos sales mencionados, c) razoa como varían as súas temperaturas de fusión.
4 a) Escribe os procesos aos que corresponden os seguintes datos: potencial de ionización de potasio = 100 kcal · mol–1, entalpía de formación do cloruro de potasio = −101,5 kcal · mol–1, enerxía de sublimación do potasio = 21,5 kcal · mol–1, enerxía de disociación do cloro = 57 kcal · mol–1, enerxía de rede do cloruro de potasio = −168 kcal · mol–1 b) a partir deles, determina o valor da afinidade electrónica do cloro, escribindo para iso o correspondente ciclo de Born-Haber.
5 Grupo nominal. As enerxías de rede do LiF e do KF son −1 046 kJ mol–1 e −826 kJ mol–1, respectivamente. Xustifica a diferenza entre estes valores se os dous compostos presentan o mesmo tipo de estrutura cristalina. Indica, de forma razoada, o compoñente que presentará o valor máis elevado do punto de fusión normal.
Xeometría molecular. Polaridade
6 Considera as moléculas CS2, CH3Cl, H2Se e NCl3 , e responde razoadamente a seguintes cuestións: a) representa a estrutura de Lewis de cada unha destas moléculas, b) predí a súa xeometría molecular, c) explica, en cada caso, se a molécula ten ou non momento dipolar. Datos: Números atómicos: H = 1, C = 6, N = 7, S = 16, Cl = 17, Se = 34.
7 Considerando as moléculas H2CO (metanal) e Br2O (óxido de dibromo): a) representa as súas estruturas de Lewis, b) xustifica a súa xeometría molecular, c) razoa se cada unha destas moléculas ten ou non momento dipolar. Datos: Números atómicos: C = 6, O = 8, H = 1 e Br = 35.
8 Xustifica a xeometría das seguintes moléculas covalentes a partir do modelo de repulsión entre os pares de electróns da capa de valencia (RPECV): a) BeF2 , b) BCl3 , c) CCl4.
Datos: Números atómicos: Be = 4, F = 9, B = 5, Cl = 17 e C = 6.
9 Dadas as seguintes parellas de substancias químicas: CCl4 e CHCl3 , BCl3 e NCl3 , a) explica razoadamente a xeometría destas moléculas de acordo coa teoría de repulsión de pares electrónicos da capa de valencia, b) estuda a polaridade das moléculas en cada parella.
10 a) Escribe as estruturas de Lewis para o BF3, NF3 e F2CO , b) cal será a xeometría destas moléculas?, c) que enlace dos que forman o flúor nas moléculas anteriores é máis polar?, d) cal ou cales destas moléculas son polares?
Datos: Números atómicos: C = 6, N = 7, O = 8, F = 9.
11 a) Escribe as estruturas de Lewis das seguintes especies químicas e predí a súa xeometría molecular: AlCl3 , PCl3 e SnCl2 , b) indica, razoando a resposta, se algunha das moléculas anteriores é polar.
Datos: Números atómicos: H = 1, Al = 13, P = 15, Cl = 17, Sn = 50
12 Considera as moléculas OF2, BI3 , CCl4, C2H2, a) escribe as representacións de Lewis, b) indica as súas xeometrías moleculares utilizando a teoría RPECV, c) xustifica cales son moléculas polares, d) que moléculas presentan enlaces múltiples?
Forzas intermoleculares
13 a) En cales das seguintes substancias existirán pontes de hidróxeno: NH3, CH4, CCl4?, b) por que os metais alcalinos son incapaces de formar enlaces covalentes?, c) por que as substancias moleculares non conducen a corrente eléctrica?
14 Indica, razoadamente, cal ou cales das seguintes especies químicas poden formar enlaces de hidróxeno coa auga: a) cloruro de sodio, b) fluoruro de hidróxeno, c) metano.
15 a) Razoa claramente cal das seguintes substancias presenta forzas intermoleculares maiores: NH3, PH3, AsH3, H2O, H,2 ; b) explica cales son as consecuencias diso, c) pódense licuar e solidificar todas as especies citadas anteriormente? Razoa por que.
Datos: Números atómicos: H = 1, O = 8, N = 7, P = 15, As = 33.
Recorda seleccionar o material de traballo desta unidade para o teu portafolio.16 a) Deduce se a molécula de amoníaco presenta momento dipolar, b) ordena as substancias NH3, CH4 e H2O segundo a súa temperatura de ebulición baseándote no tipo e intensidade das súas forzas intermoleculares. Datos: Números atómicos: H = 1, C = 6, N = 7, O = 8.
17 a) Xustifica a xeometría das moléculas de CS2 e H2S mediante o modelo de repulsión de pares de electróns da capa de valencia, b) cal das dúas moléculas anteriores é soluble en auga? (razoa a resposta), c) que forzas de atracción hai que romper para evaporar o H2S (l)?
18 Sábese que os puntos de ebulición normais de HF e HBr son, respectivamente, 19,5 ºC e –67 ºC. Explica por que sendo a masa molecular de HBr maior que o do HF, a súa temperatura de ebulición normal é menor.
19 Dadas as seguintes substancias: CO2, CF4, H2CO e HF, a) escribe as estruturas de Lewis das súas moléculas, b) explica as súas xeometrías pola teoría de repulsión de pares de electróns da capa de valencia ou pola teoría de hibridación, c) xustifica cales delas teñen momento dipolar distinto de cero, d) xustifica cales destas substancias presentan enlace de hidróxeno.
Datos: Números atómicos: H = 1, C = 6, O = 8, F = 9, S = 16 e Cl = 17.
20 Explica que tipo de enlace químico debe romper ou que forza de atracción debe vencerse para: a) fundir NaCl, b) ferver auga, c) fundir ferro, d) evaporar nitróxeno líquido.
21 Contesta, razoando a resposta, as seguintes cuestións: a) que tipo de enlace cabe esperar en cada unha das seguintes substancias químicas: NaCl, Cl2, CH4 e Fe?, b) cal será o estado de agregación de cada unha das especies anteriores?, c) cales se disolverán en auga?
22 Explica que tipo de forzas de atracción deben vencerse para levar a cabo os seguintes procesos: a) fundir bromuro de calcio, CaBr2 (s); b) ferver auga, H2O (l); c) evaporar osíxeno, O2 (l); d) fundir cesio, Cs (s).
23 Contesta, razoadamente, as seguintes cuestións: a) por que a 25 ºC e 1 atm a auga é líquida e o sulfuro de hidróxeno non?, b) cal dos compostos seguintes será máis soluble en auga: o óxi-
do de calcio ou o cloruro de cesio?, c) que metal ten maior punto de fusión, o sodio ou o cobre?, d) que conduce mellor a corrente eléctrica, un cristal de nitrato de aluminio ou unha disolución deste?
24 Explica razoadamente os seguintes feitos: a) o cloruro de sodio ten un punto de fusión de 801 ºC, mentres que o cloro é un gas a temperatura ambiente, b) o cobre e o iodo son sólidos a temperatura ambiente pero o cobre conduce a corrente eléctrica, mentres que o iodo non, c) o etano ten un punto de ebulición máis alto que o metano.
25 Indica o tipo de enlace ou forza intermolecular que é necesario vencer para fundir os seguintes compostos: a) cloruro de sodio, b) dióxido de nitróxeno, c) ferro.
26 O grafeno é un material constituído por átomos de carbono que, desde o seu descubrimento en 2004 por A. Geim e K. Novoselov, foi aumentando os seus campos de aplicación grazas ás súas excelentes propiedades. Elabora un traballo usando algunha ferramenta TIC no que se relacionen esas propiedades coas metas 7.2 e 7.3 dos ODS.
27 Indica, razoadamente, cantos enlaces π e cantos σ teñen as seguintes moléculas: a) hidróxeno, b) nitróxeno, c) osíxeno.
28 O PCl3 é unha molécula polar, mentres que o BCl3 ten un momento dipolar nulo: a) escribe as estruturas de Lewis para as dúas moléculas, b) xustifica a distinta polaridade que posúen, c) indica a hibridación do átomo central.
29 Indica, razoadamente, cal é a hibridación que presenta o átomo de carbono nas moléculas H2C O e CCl4
30 a) Deduce a xeometría das moléculas BCl3 e H2S aplicando a teoría RPECV, b) explica se as moléculas anteriores son polares, c) indica a hibridación que presenta o átomo central.
31 Responde as seguintes cuestións: a) para a molécula de NF3, indica a hibridación do átomo central, número de orbitais híbridos e número de electróns en cada orbital híbrido, b) xustifica se a molécula NF3 é polar ou apolar.
32 Considera as moléculas CH4, BF3 e NH3: a) describe para cada molécula a hibridación do átomo central, b) indica as forzas intermoleculares presentes en cada unha delas.
Os antioxidantes son substancias que impiden ou atrasan a oxidación das moléculas (principalmente dos ácidos graxos). A oxidación pode xerar unha produción de radicais libres, capaces de crear unha reacción en cadea que dane a célula.
Os antioxidantes poden ser proporcionados polos alimentos ou ser producidos polo noso propio corpo, como mecanismo de defensa. A súa función é neutralizar a acción dos radicais libres, previndo o dano que puidesen causar producindo serias alteracións fisiolóxicas e enfermidades. A inxestión de alimentos ricos en antioxidantes é a mellor forma de contrarrestar o efecto dos radicais libres.
Entre os antioxidantes máis importantes nos alimentos destacan a vitamina C (ácido ascórbico), a vitamina A (betacaroteno), a vitamina E (tocoferol), os carotenoides (licopeno), os flavonoides (polifenois) e algúns minerais como o selenio e o cobre.

Así, por exemplo, a vitamina C é importante no metabolismo dos glícidos, na absorción intestinal do ferro, na formación de cartilaxes, ósos e dentes, e no funcionamento corticosuprarrenal. O selenio protexe os tecidos corporais da oxidación e, entre as súas funcións biolóxicas, inclúense a defensa contra o estrés oxidativo, a regulación da acción da hormona tiroidea e a regulación do estado redox da vitamina C.
COMPROMISO
Facede estas actividades en grupos:

1 O 16 de novembro de 2010, a UNESCO declarou a dieta mediterránea como Patrimonio Cultural Inmaterial da Humanidade para salvagardar a súa herdanza. A dieta mediterránea promove a produción alimentaria e os patróns de consumo local, así como o fomento da agricultura sostible. En que consiste esta dieta? Que alimentos forman a dieta mediterránea?
Buscade información acerca dos beneficios desta dieta e elaborade un informe acerca de como estes contribúen ao cumprimento dos obxectivos 3 e 12 para o desenvolvemento sostible.
Nesta unidade
• O papel antioxidante dos alimentos

1. Reaccións de oxidación-redución
2. Número de oxidación
3. Axuste redox polo método do ión-electrón

4. Estequiometría das reaccións redox



5. Celas electroquímicas

6. Potenciais de électrodo e potencial dunha cela

7. Espontaneidade das reaccións redox
8. Valoracións redox
9. Electrólise
10. Proxectos industriais de electrólise
11. Aplicacións e repercusións das reaccións redox
• Cultura científica. Reaccións redox na vida cotiá
• TIC. Simulador de electrólise
• Estratexias de resolución de problemas
En anayaeducacion.es
Para motivarte:
• Vídeo: «Antes de empezar».
Para detección previa de ideas:
• Presentación: «Que necesitas saber?».
Para estudar:
• Presentación: «Para estudar».
AIRE LIMPO?
Os contidos e as actividades desta unidade poden resultar de utilidade para a realización do proxecto que se propón no anexo situado nas páxinas iniciais do libro.
• Simulacións: «Voltaxe de batería».
Para avaliarte:
• Autoavaliación final.
• Solucións das actividades numéricas.











E, ademais, toda a documentación necesaria para aplicar as claves do proxecto.

Concepto tradicional
Tradicionalmente, entendíase por oxidación calquera proceso onde unha substancia ganaba osíxeno, e por redución, o proceso polo cal unha substancia perdía osíxeno. Así, se o Na reacciona con O2 dando Na2O, dicimos que o sodio se oxidou. En cambio, o CuO ao reaccionar con H2 transfórmase en cobre metálico, e dicimos que o monóxido de cobre se reduciu.




Oxidación: 4 Na + O2 → 2 Na2O
Redución: CuO + H2 → Cu + H2O
Posteriormente, observando as reaccións onde interviña o hidróxeno, o concepto foi ampliado, de maneira que para unha substancia que contiña hidróxeno, a oxidación era o proceso onde se perdía hidróxeno e a redución era aquel onde se ganaba hidróxeno. Este concepto é particularmente útil en reaccións orgánicas:
CH3CH2OH → CH3CHO + H2 Oxidación etanol etanal
En cambio, a formación de etanol a partir do etanal por ganancia de hidróxeno supón un proceso de redución:
CH3CHO + H2 → CH3CH2OH Redución
Concepto electrónico
Na actualidade, enténdese que unha reacción redox se produce cando hai unha transferencia de electróns dunha substancia a outra (unha cede electróns e a outra acéptaos).
• Oxidación: proceso químico que implica unha perda de electróns ou aumento do número de oxidación dunha especie. Tamén se pode definir como o proceso polo cal un redutor perde electróns.
• Redución: proceso químico que implica unha ganancia de electróns ou diminución do número de oxidación dunha especie. Tamén se pode definir como o proceso polo cal un oxidante gana electróns. Estudemos a seguinte reacción de formación do ioduro de aluminio:
2 Al (s) + 3 I2 (s) → 2 AlI3 (s)
Neste proceso, cada átomo de aluminio perde os seus tres electróns de valencia, que ganará a outra especie coa que reacciona, o iodo. O proceso global pódese descompoñer en:
Semirreacción de redución: 3 I2 + 6 e → 6 I
Semirreacción de oxidación: 2 Al → 2 Al3+ + 6 e−
Reacción global: 3 I2 + 2 Al3+ → 2 AlI3
A reacción que experimenta o oxidante (I2) denomínase semirreacción de redución e aquela que experimenta o redutor (Al) denomínase semirreacción de oxidación.
Os procesos de oxidación-redución son simultáneos; é dicir, para que unha especie química perda electróns, é necesaria a presenza doutra que os acepte. Existe unha transferencia de electróns desde a substancia que se oxida ata a que se reduce.


Os termos «oxidación» e «redución» empezaron a utilizarse a partir da síntese conceptual levada a cabo por Lavoisier con relación á súa nova teoría da combustión. En 1772, Lavoisier conseguiu demostrar que tanto na combustión como na calcinación en atmosfera de aire se producía unha combinación dun elemento ou composto co osíxeno do aire.
Co tempo, o concepto de oxidación e redución adoptou un significado máis amplo, ao comprobarse que había moitas reaccións semellantes ás anteriores, pero nas que o papel do osíxeno era suplido por outro elemento.
Oxidación (átomo perde un electrón)
Redución (átomo gana un electrón)
Concepto electrónico de oxidación e redución.
Oxidante é toda especie química que toma electróns doutra. Ten facilidade para oxidar outras especies e ela mesma sofre reaccións de redución.
Axentes oxidantes moi habituais son: a auga osixenada (H2O2), o ión permanganato (MnO4 ) e o ión dicromato (Cr2O72−).
Redutor é toda especie química que cede electróns a outra. Ten facilidade para reducir outras especies e ela mesma sofre reaccións de oxidación.
Axentes redutores habituais son o carbono (C) e os elementos metálicos (Mg, Al, Zn).
Polo tanto, o oxidante, ao tomar electróns, redúcese, e o redutor, ao ceder electróns, oxídase.
Oxidación Redución
Ganancia de osíxeno Perda de osíxeno Perda de hidróxeno Ganancia de hidróxeno Perda de electróns Ganancia de electróns
Táboa 1. Evolución dos conceptos de oxidación e de redución.
Oxidantes Redutores
Halóxenos: F2, Cl2, I2, Br2
Osíxeno: O2
Oxoanións:
NO3 ,IO3 , MnO4 ,Cr2O72−
Metais: Li, Na, Mg, Zn, Fe, Sn
Oxoanións: SO32−
Non metais: H2, C
Táboa 2. Algúns oxidantes e redutores habituais nas reaccións redox.
Arte e química
Esquema xeral dun proceso redox e exemplo.
Identificación do oxidante e do redutor
Nas reaccións redox cambia o estado ou grao de oxidación das especies reaccionantes porque se produce un intercambio de electróns entre os reactivos (oxidante e redutor).
• Se o número de oxidación dun átomo aumenta, significa que se oxida, e actúa como unha especie redutora.
• Se o número de oxidación dun átomo diminúe, significa que se reduce, e, polo tanto, actúa como unha especie oxidante.
Unha substancia tamén pode actuar como oxidante e redutor ao mesmo tempo, dando lugar a unha reacción de oxidación-redución á que denominamos dismutación. Un exemplo deste tipo de reaccións é:
2 H2O2 → 2 H2O + O2
Pares redox
Como acabamos de ver, para que se produza unha reacción redox, é necesaria a presenza dunha especie que ceda electróns (redutor) e outra especie que acepte electróns (oxidante). A todo oxidante se lle pode asignar unha forma reducida, e viceversa. Estas dúas substancias constitúen un par redox, que se adoitan citar na orde oxidante/redutor.
As reaccións redox de diferentes tipos que se suceden ao combinar distintos ácidos, anilinas, nitratos, etc., producen un intercambio de electróns que estabilizan a reacción dando como resultado variedade de texturas, tons harmónicos e formas moi suxestivas.
Variación do número de oxidación.
Tras a reacción redox, o redutor transfórmase na súa forma oxidada, e o oxidante, na súa forma reducida. Podemos dicir que, nunha reacción de oxidación-redución, o redutor cede electróns e se transforma no seu oxidante conxugado (par conxugado redox), mentres que o oxidante gana electróns e se converte no seu redutor conxugado (par conxugado redox).
Semirreacción de oxidación: Redutor (1) → Oxidante (1) + n e
Semirreacción de redución: Oxidante (2) + n e → Redutor (2)
A reacción global será:
Redutor (1) + Oxidante (2) → Oxidante (1) + Redutor (2)
Forza dun oxidante e dun redutor
A forza dun oxidante ou dun redutor é relativa, dependerá do redutor ou oxidante ao que se en fronte. Unha mesma especie química pode actuar unhas veces como oxidante e outras como redutor. Non existen oxidantes nin redutores absolutos.
Se un oxidante ten gran tendencia a captar electróns, é dicir, é forte, o seu redutor conxugado mostrará moi pouca tendencia a ceder electróns, será un redutor débil. Do mesmo xeito, se un redutor ten gran tendencia a ceder electróns, é dicir, é forte, terá como conxugado un oxidante débil. Os átomos moi electronegativos son oxidantes, mentres que os pouco electronegativos son redutores.
1 Considera a reacción redox: Cr2O72− + Fe2+ + H+ → Cr3+ + Fe3+ + H2O
a) Que especie é o oxidante e a que se reduce? Perde ou gana electróns?
b) Que especie é o redutor e a que se oxida? Perde ou gana electróns?


Solución
Á vista da ecuación iónica podemos observar:
a) O oxidante é Cr2O72− gana electróns e redúcese a Cr3+
b) O redutor é Fe2+, perde electróns e oxídase a Fe3+
Exercicios
1 Dadas as seguintes reaccións redox, sinala o axente oxidante e o axente redutor:
a) Zn + 2 H+ → Zn2+ + H2
b) Cu + 2 H+ → Cu2+ + H2
c) I2 + 2 Fe2+ → 2 I + 2 Fe3+
d) Cr + 3 Fe3+ → Cr3+ + 3 Fe2+
2 Dada a reacción química: Co3+ (aq) + Br (aq) → Co2+ (aq) + Br2 (l)
a) Xustifica se se trata dunha reacción de oxidación-redución.
b) Que especie se oxida? Cal se reduce? Quen é o oxidante e o redutor?
Para distinguir rapidamente se unha reacción química é un proceso redox e identificar cal é o oxidante e cal é o redutor, recorremos ao concepto de número ou estado de oxidación.
O número de oxidación dun átomo nun composto covalente representa o número de cargas eléctricas que lle corresponderían a ese átomo considerando os desprazamentos electrónicos derivados da diferente electronegatividade dos átomos enlazados.
Outro xeito de definir o número de oxidación sería:
O número de oxidación ou estado de oxidación representa a carga que tería un átomo considerando que os únicos enlaces que se forman na especie química na que intervén ese elemento son iónicos.
En compostos covalentes, polo tanto, o estado de oxidación representa unha carga eléctrica ficticia, xa que neste enlace non hai transferencia de electróns, senón compartición dos electróns do enlace.
Por exemplo, na molécula de HF, o F é máis electronegativo que o H e atraerá cara a si os electróns do enlace. Por iso, o seu número de oxidación (n.o.) é −1 e o do hidróxeno, +1.
Nos compostos iónicos si hai transferencia total de electróns; polo tanto, o número de oxidación coincide coa carga eléctrica dos ións. Así, no NaCl, o Na ten número de oxidación +1, e o Cl, −1.
Nun estudo realizado en 2017 por investigadores do CSIC e da NASA determinouse que a cor vermella da superficie de Marte podía deberse á forte oxidación xerada pola disolución de micropartículas de pirita nunha atmosfera sen osíxeno, o que xerou radicais libres que, á súa vez, induciron a precipitación de óxidos e sulfatos de ferro.

HF
(1)(–1) : # + Na Cl (1) (–1) –: + +
A determinación do número de oxidación lévase a cabo aplicando as seguintes regras:
• O estado de oxidación dos elementos en estado fundamental ou sen combinar é nulo. Exemplo: Li, Mg, H2, P4
• O estado de oxidación dun ión monoatómico é igual á súa carga eléctrica. Así, o número de oxidación do ión Li+ é +1, o do ión Be2+ é +2 e o número de oxidación do Al3+ é +3.
• O número de oxidación do osíxeno en todos os seus compostos é –2. salvo nos peróxidos, que é −1; nos superóxidos, O2 , que é −1/2, e na súa combinación co flúor, onde é +2.
• O número de oxidación do hidróxeno en todos os seus compostos é +1, salvo nos hidruros metálicos (MgH2, KH...), que é −1.
• O número de oxidación dos metais é positivo; así, o dos metais alcalinos é +1 e o dos metais alcalinotérreos é +2.
• O número de oxidación dos non metais pode ser positivo ou negativo. Nos compostos formados por non metais nos que non intervén o osíxeno, o elemento máis electronegativo ten un número de oxidación negativo, cun valor numérico igual ao da carga do seu ión negativo máis frecuente.
A implantación do hidróxeno como combustible require encontrar sistemas con elevadas capacidades volumétricas e gravimétricas capaces de almacenalo de forma segura e reversible. Desde hai anos investígase na preparación e caracterización de hidruros metálicos como o MgH2, capaces de almacenar grandes cantidades de hidróxeno nesas condicións.
• O número de oxidación do flúor é sempre −1. O resto dos halóxenos (Cl, Br, I) teñen números de oxidación negativos se están unidos a átomos menos electronegativos e positivos se se combinan con átomos máis electronegativos. No caso dos haluros, o halóxeno ten sempre número de oxidación −1.
• A suma alxébrica dos números de oxidación dos átomos, dun composto neutro, multiplicada polos correspondentes subíndices debe ser cero. Nos ións poliatómicos, a suma dos números de oxidación debe coincidir coa carga eléctrica do ión.
A valencia dun elemento é a capacidade que ten ese elemento para combinarse con outro.
Así, nos seguintes compostos CH4, CH3I e CCl4, o carbono actúa sempre con valencia +4, mentres que o número de oxidación varía duns compostos a outros e poderiamos consideralo como unha carga ficticia que se asigna a un elemento nun determinado composto.
2 Asigna os estados de oxidación a todos os átomos das seguintes moléculas: a) CO2, b) SF6
Solución
a) Neste caso, o osíxeno ten estado de oxidación −2. Determinamos o estado de oxidación do carbono tendo en conta que como CO2 é neutra, cada osíxeno é −2 e hai dous átomos; polo tanto, hai que asignarlle ao átomo de carbono un número de oxidación +4.
b) Como o flúor ten maior electronegatividade que o xofre, o seu número de oxidación é −1. Determinamos o estado de oxidación do xofre tendo en conta que SF6 é neutra. Cada flúor é −1 e hai seis átomos; polo tanto, hai que asignarlle ao átomo de xofre un número de oxidación +6.
Exercicios
3 O hexafluoruro de xofre (SF6) é un dos gases causantes do efecto invernadoiro catalogado cun índice GWP (Global Warning Potential), unhas 20 000 veces maior que o CO2. Isto alerta da necesidade de avanzar na erradicación do uso do hexafluoruro de xofre a nivel industrial. Investiga acerca das propiedades do SF6 e o seu uso na vida cotiá. Establece catro liñas de acción para reducir as emisións de gases de efecto invernadoiro (GEI) de acordo coas metas 13.2 e 13.3 dos obxectivos de desenvolvemento sostible.
4 Indica o número de oxidación do nitróxeno en cada un dos seguintes compostos: N2, NO, NO2, KNO3, NH3. Xustifica cal deles ten o maior carácter oxidante.
Molécula ou ión Carga N.º oxidación
H2SO4 0 H: 1, O: −2, S: 6
H3O+ +1 H: 1 , O: −2
BrO3 −1 Br: 5 , O: −2
PCl5 0 P: 5, Cl: −1
Os gases de efecto invernadoiro causan un aumento da temperatura da atmosfera e orixinan secas. Encoro de Zahara-El Gastor, serra de Grazalema, Cádiz.

5 a) Indica o número de oxidación de todos os átomos dos compostos AgNO3 e Al2(SO4)3
b) Indica o número de electróns transferidos na semirreacción: MnO4 → MnO2. Trátase dunha oxidación ou dunha redución?
6 Dadas as seguintes reaccións:
a) NaOH + HNO3 → NaNO3 + H2O
b) Cu + Cl2 → CuCl2
c) CH4 + 2 O2 → CO2 + 2 H2O
Responde: a) Xustifica se todas son de oxidaciónredución. b) Identifica o axente oxidante e o redutor onde proceda.
Un dos métodos máis utilizados para realizar o axuste das ecuacións químicas de oxidación-redución é o método do ión-electrón, desenvolvido en 1927. Este método baséase nas reaccións que teñen lugar nos électrodos dos procesos electroquímicos. O proceso redox global descomponse nunha semirreacción de oxidación e outra de redución, que se axustan por separado. Na reacción axustada, débese cumprir:
• A conservación da carga: no balance final de cargas, a carga neta debe ser nula.
• A conservación da masa: o número de átomos de cada especie debe ser igual en cada un dos membros da ecuación química.
• O número de electróns cedidos polo axente redutor é igual ao número de electróns captados polo axente oxidante.
Este método ten lixeiras diferenzas se a reacción que se vai axustar ten lugar en medio ácido ou en medio básico. Nel escríbense en forma iónica os ácidos, as bases e os sales, e escríbense en forma molecular os elementos e os sólidos.
No método do ión-electrón, considéranse os seguintes pasos:
1. Escríbese a reacción completa sen axustar e asignámoslle a cada un dos elementos o seu número de oxidación. Determínanse os elementos que se oxidan e os que se reducen.
2. Identifícanse as especies oxidante e redutora, e escríbense os pares conxugados (oxidante/redutor).
3. Escríbense as semirreaccións de oxidación e redución, de maneira que aparezan as especies que realmente interveñen no proceso (en forma molecular ou iónica) e que conteñan o elemento cuxo número de oxidación cambia. Na semirreacción de redución colócase á esquerda da frecha a forma oxidada e á dereita a súa forma reducida. Na semirreacción de oxidación, a forma reducida está á esquerda da frecha, e a súa forma oxidada, á dereita.
4. Axústanse todos os átomos que non sexan osíxeno e hidróxeno.
5. Axústanse os átomos de hidróxeno e osíxeno na forma:
• Medio ácido: se a reacción ten lugar en medio ácido, os H axústanse engadindo ións H+ e os O axústanse engadindo moléculas de H2O. O O axústase poñendo no membro con defecto de osíxeno tantas moléculas de H2O como átomos de osíxeno faltan e axustando os hidróxenos engadidos con protóns H+ no outro membro.
• Medio básico: se a reacción ten lugar en medio básico, os H axústanse engadindo moléculas de H2O e os O axústanse engadindo grupos OH . O osíxeno axústase poñendo no membro con defecto de osíxeno o dobre de OH que oxíxenos falten, e o exceso de O e H axústase no outro membro con auga.
6. Axústanse as cargas eléctricas en cada semirreacción por medio de electróns. Estes estarán sempre no lado onde se encontre a forma oxidada; na semirreacción de oxidación, á dereita, e na de redución, á esquerda.
7 Dada a seguinte ecuación: KBrO3 + Cu + H2SO4 → → Br2 + CuSO4 + K2SO4 + H2O a) Escribe e axusta a reacción redox correspondente, b) indica as substancias que se oxidan e as que se reducen na ecuación.
8 Un dos beneficios máis importantes do café é a presenza de substancias químicas que se caracterizan polas súas propiedades antioxidantes, tales como o ácido cloroxénico (C16H18O9), o ácido cafeico (C9H8O4), o cafetol (C20H28O3) e o kahweol (C20H26O3). Tomar entre unha e tres cuncas de café ao día reduce nun 24 % o risco de padecer enfermidades cardiovasculares. Busca información acerca das propiedades antioxidantes do ácido cloroxénico e do ácido cafeico e enumera algunha delas. O «comercio xusto» do café fomenta patróns produtivos e de consumo alternativos e solidarios, garantindo un comercio en mellores condicións. En grupos, analizade como a través do «comercio xusto» poden lograrse os obxectivos 1, 8 e 12 para o desenvolvemento sostible.

7. Iguálase o número de electróns nas dúas semirreaccións, para o cal se multiplican os coeficientes estequiométricos de cada semirreacción por un número enteiro tal que iguale o número de electróns ganados pola especie oxidante cos electróns perdidos pola especie redutora.
A continuación, sumamos as semirreaccións eliminando os electróns e, se algunha especie química aparece en ambos os dous lados da ecuación, simplifícase. Así, obtemos a reacción iónica axustada.
8. Para escribir a reacción molecular axustada:
a) Colocamos as moléculas de ácido ou de base necesarias para axustar correctamente os H+ ou os OH
b) Engadimos e axustamos os ións espectadores, comprobando que non desaxustásemos ningunha especie que xa o estaba. Se fose así, axustariámola por tenteo.
3 Axusta a seguinte reacción química: HNO3 + Cu → Cu(NO3)2 + NO2 + H2O
Solución
1. Asignamos a cada elemento o seu número de oxidación:
O átomo de N pasa de ter n. o. +5, no HNO3, a +4 no NO2 (cada átomo de N gana un electrón). Polo tanto, ao diminuír o valor do seu n. o. reduciuse (oxidante).
O átomo de Cu aumenta o seu n. o. e pasa de 0 a +2 no Cu(NO3)2. Para iso, cada átomo de Cu cede 2 electróns, polo que se oxida (redutor).
2. A especie redutora será o cobre, Cu, que se oxida a Cu2+. O par conxugado é Cu2+/Cu.
A especie oxidante é o ión NO3 (en disolución acuosa, o HNO3 encóntrase disociado nos seus ións), que se reduce a NO2. O par conxugado é NO3 /NO2
3. Escribimos as semirreaccións que experimentan os dous pares redox:
Semirreacción de redución: NO3 → NO2
Semirreacción de oxidación: Cu → Cu2+
4. Axustamos todos os átomos, agás O e H. Neste caso, están axustados.
Exercicios
9 Axusta, polo método do ión-electrón, a reacción:
K2Cr2O7 + SnCl2 + HCl → SnCl4 + CrCl3 + H2O + KCl
a) Cal é a especie oxidante e cal é a redutora?, que especie se oxida e cal se reduce?
b) Axusta a reacción iónica e a reacción global.
Os ións que non experimentan cambios no seu número de oxidación non interveñen na reacción redox. Denomínanse ións espectadores e para o axuste déixanse á parte inicialmente. Unha vez obtida a reacción iónica axustada, engadiranse para obter a reacción molecular axustada (paso 8).
5. Axustamos os átomos de H e de O. Para iso, engadimos unha molécula de H2O á dereita da semirreacción de redución, o que nos obriga a poñer 2 H+ á esquerda.
Semirreacción de redución: 2 H+ + NO3 → NO2 + H2O
Semirreacción de oxidación: Cu → Cu2+
6. Axustamos a carga en cada semirreacción por medio de electróns. Así, tendo en conta o paso 1.
Semirreacción de redución:
2 H+ + NO3 + 1e → NO2 + H2O
Semirreacción de oxidación: Cu → Cu2+ + 2 e
7. Igualamos o número de electróns nas dúas semirreaccións, multiplicando a primeira por 2 e sumámolas:
Semirreacción de redución:
4 H+ + 2 NO3 + 2 e → 2 NO2 + 2 H2O
Semirreacción de oxidación: Cu → Cu2+ + 2 e Reacción iónica:
4 H+ + 2 NO3 + Cu → 2 NO2 + Cu2+ + 2 H2O
8. Escribimos a reacción molecular completa:
4 HNO3 + Cu → 2 NO2 + Cu (NO3)2 + 2 H2O Neste caso, non temos que volver axustar a ecuación.
10 O hidróxido de cromo (III) é oxidado polo cloro gasoso (Cl2) en presenza de hidróxido de potasio, obténdose cromato de potasio, cloruro de potasio e auga como produtos da reacción. Axusta as ecuacións iónica e molecular polo método do ión-electrón.
O axuste dunha reacción redox mediante o método do ión-electrón permite non só coñecer a ecuación axustada, senón tamén a determinación das cantidades en masa e volume de todas as substancias participantes nun proceso deste tipo.
Así, por exemplo, na reacción redox:
4 HCl + MnO2 → MnCl2 + Cl2 + 2 H2O podemos dicir:
• Por cada mol de MnO2 reaccionan catro mol de HCl.
• Por cada mol de MnO2 obtemos un mol de Cl2
En moitas ocasións, utilízanse estes cálculos estequiométricos ante a necesidade de facer unha determinación analítica dunha substancia presente nunha mostra. Dous dos axentes oxidantes que máis se adoitan empregar nestas análises son o K2Cr2O7 e o KMnO4. Cando a reacción é completa, é dicir, os reactivos oxidante e redutor reaccionaron completamente, dise que se alcanzou o punto de equivalencia.
Exercicios resoltos
4 O dicromato de potasio oxida o ioduro de sodio en medio ácido sulfúrico, formándose, entre outros, sulfato de sodio, sulfato de potasio, sulfato de cromo (II) e iodo molecular. Cuestións: a) formula as semirreaccións de oxidación e redución, b) formula a reacción iónica e di cales son as especies oxidante e redutora, c) formula a reacción molecular, d) se temos 120 mL de disolución de ioduro de sodio e se necesitan para a súa oxidación 100 mL de disolución de dicromato de potasio 0,2 M, cal é a molaridade da disolución de ioduro de potasio?

Solución
a) Escribimos as semirreaccións de oxidación e redución:
Semirreacción de oxidación: 2 I → I2 + 2 e
Semirreacción de redución:
Cr2O72− + 14 H+ + 6 e → 2 Cr3+ + 7 H2O
b) Axustamos as cargas, así:
Semirreacción de oxidación: 6 I → 3 I2 + 6 e
11 O dicromato de potasio reacciona, en medio ácido, con estaño segundo a seguinte reacción:
Sn + HCl + K2Cr2O7 → SnCl4 + CrCl3 + KCl + H2O
a) Axusta a reacción polo método do ión-electrón,
b) determina as masas de CrCl3 e SnCl4 obtidas a partir de 15 g de Sn puro e 45 g de K2Cr2O7, c) determina a riqueza dunha aliaxe de estaño se 1 g desta necesita 25 mL de K2Cr2O7 0,1 M para reaccionar completamente.
Datos: Cr = 52 u, Cl = 35,5 u, Sn = 118,7 u, K = 39,1 u, O = 16 u, H = 1 u.
Dúas disolucións de dicromato de potasio (oxidante) de distinta concentración.
Semirreacción de redución:
Cr2O72− + 14 H+ + 6 e → 2 Cr3+ + 7 H2O
A reacción iónica vén dada por:
6 I + Cr2O72− + 14 H+ → 3 I2 + 2 Cr3+ + 7 H2O
A especie oxidante é K2Cr2O7 e a redutora o NaI.
c) A reacción molecular vén dada por:
K2Cr2O7 + 6 NaI + 7 Na2SO4 →
→ Cr2(SO4)3 + 3 Na2SO4 + K2SO4 + 3 I2 + 7 H2O
d) En 100 mL de disolución 0,2 M de K2Cr2O7 hai:
n = M · V = 0,1 M ∙ 0,2 L = 0,02 mol de K2Cr2O7
Se nos fixamos na estequiometría da reacción: , n molNal molK Cr O mol molK Cr O 6 10 02 22 72 27 = ; n = 0,12 mol de NaI
Tendo en conta que o volume da disolución de ioduro de sodio é 120 mL, calculamos a súa molaridade:
, , mol M M L 012 012 1 ==
12 Ao mesturar sulfuro de hidróxeno con ácido nítrico fórmase xofre, dióxido de nitróxeno e auga: a) formula as semirreaccións de oxidación e redución, b) formula a reacción molecular global indicando as especies oxidante e redutora, c) cantos gramos de xofre se obterán a partir de 24 cm3 de ácido nítrico comercial de 65 % en masa e densidade 1,39 g · cm–3?, d) calcula o volume de dióxido de nitróxeno que se obtén, medido a 700 mm de Hg e 25 ºC. Datos: R = 0,082 atm · L · mol–1 · K–1. Masas atómicas: H = 1 u, N = 14 u, O = 16 u, S = 32 u.
Unha cela electroquímica, tamén denominada cela galvánica ou voltaica, é un dispositivo no que se obtén unha corrente eléctrica a partir dunha reacción redox espontánea.
Nas reaccións redox hai unha transferencia de electróns da especie redutora á especie oxidante que ten lugar directamente entre os reactivos en contacto. Este proceso de transferencia é directo, é dicir, de especie química a especie química e pode aproveitarse para realizar traballo eléctrico; para iso, debemos conseguir que os electróns circulen por un circuíto exterior, xerando así unha corrente eléctrica.
Unha cela electroquímica consta dos seguintes elementos:
• Eléctrodos: son dous condutores, cada uns dos cales se acha somerxido nunha disolución acuosa dun dos seus sales. O cátodo é o eléctrodo onde ten lugar a redución e o ánodo é o eléctrodo no que se produce a oxidación.
• Un fío condutor externo que conecta os dous eléctrodos e que permite o paso de electróns desde o polo negativo (ánodo) ao polo positivo (cátodo).
• Un sistema que separa as dúas zonas onde teñen lugar as dúas semirreaccións redox. Utilízase ben un tabique poroso, ou ben unha ponte salina. A función dos dous é impedir a acumulación de cargas e evitar que se mesturen as disolucións.
– Tabique poroso: consiste nunha membrana semipermeable que permite o fluxo de ións.
– Ponte salina: é un tubo de vidro en forma de U cheo dun xel dun electrólito que non inflúe na reacción da cela. Os extremos do tubo en U tápanse con discos porosos, o que permite unha libre difusión dos ións, minimizando, á vez, a mestura das disolucións interior e exterior da ponte.
• Voltímetro: conectado ao fío condutor externo para medir a diferenza de potencial ou voltaxe entre os dous eléctrodos. Esta diferenza de potencial é unha medida da tendencia da reacción global da cela para avanzar cara ao equilibrio.

A notación que representa unha cela electroquímica denomínase diagrama de cela e é a seguinte:
Ánodo | disolución anódica || ponte salina || disolución catódica | Cátodo
Empézase sempre escribindo á esquerda o proceso de oxidación (ánodo) e á dereita o proceso de redución (cátodo), de forma que os electróns circulen de esquerda a dereita. A barra vertical simple (|) indica a existencia dunha interfase (separación de fases), mentres que a barra vertical dobre (||) indica unha ponte salina. Por exemplo: Zn
As celas electroquímicas foron desenvolvidas a finais do século xviii polos científicos Luigi Galvani e Alessandro Volta, polo que tamén se denominan celas galvánicas ou voltaicas no seu honor.
A diario usamos diferentes tipos de pilas para facer que funcionen distintos dispositivos; en todos os casos, o traballo eléctrico conséguese grazas á produción dunha reacción redox na pila correspondente.
Denomínase así en honor do seu inventor J. F. Daniell. É a máis sinxela das celas electroquímicas e está formada por dous compartimentos, nun deles introducimos un eléctrodo de Zn nunha disolución de ZnSO4, e no outro poñemos un eléctrodo de Cu nunha disolución de CuSO4. As dúas disolucións encóntranse unidas mediante unha ponte salina (que contén KCl) cuxa finalidade é manter as dúas disolucións en contacto eléctrico, evitando o contacto físico (pechar o circuíto), e acumulacións de carga. Mediante un fío condutor externo realízase a transferencia de electróns dun eléctrodo a outro e intercalando un voltímetro no circuíto mídese a diferenza de potencial entre os dous eléctrodos.
John Frederic DaniellJ. F. Daniell (1790-1845) é o científico inglés que obtivo máis medallas polos seus descubrimentos. Antes de 1901, data do primeiro Premio Nobel, os méritos científicos valorábanse coa entrega de medallas.

Pila Daniell con ponte salina e con tabique poroso.
No eléctrodo de Zn (ánodo) prodúcese a oxidación:
Zn (s) → Zn2+ (aq) + 2 e No eléctrodo de Cu (cátodo) prodúcese a redución:
Cu2+ (aq) + 2 e → Cu (s)
A reacción global da pila é a suma dos dous procesos:
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
A medida que transcorre a reacción, o eléctrodo de cinc vaise disolvendo (a lámina de Zn diminúe a súa masa) e os ións Cu2+ deposítanse sobre o eléctrodo de cobre como cobre metálico (a lámina de Cu aumenta a súa masa). A disolución de Zn2+ vólvese máis concentrada, e a disolución de Cu2+, máis diluída. A corrente eléctrica flúe do eléctrodo de Zn (polo negativo da pila) ao eléctrodo de Cu (polo positivo).
No compartimento onde temos o cinc é onde se produce a oxidación, polo que a súa disolución quedará cargada positivamente, perdendo a neutralidade eléctrica. No compartimento onde temos o cobre ocorre a redución, polo que a súa disolución iría perdendo progresivamente cargas positivas.
Prodúcese entón un desequilibrio de carga eléctrica que se compensa polo desprazamento dos ións da ponte salina: ións Cl cara á disolución de Zn2+ e ións K+ cara á de Cu2+.
13 Explica que é unha ponte salina e que función ten nunha cela electroquímica.
14 A partir da representación Cu(s)|Cu2+(1M)||Ag+(1M)|Ag(s), indica as semirreaccións que teñen lugar no ánodo e no cátodo, así como o sentido do movemento dos electróns e dos ións presentes.
15 Os enxeñeiros químicos traballan nos procesos de transformación de substancias para a industria química ou física. Usan os seus coñecementos para producir unha ampla gama de produtos de uso cotián, como plásticos, fibras, pinturas, fármacos, produtos de limpeza, deterxentes, etc. Investiga acerca das competencias e do perfil profesional dun enxeñeiro químico.
Ao introducir un metal nunha disolución dos seus ións aparece inmediatamente unha diferenza de potencial entre o metal e a disolución, chamada potencial de contacto ou potencial de eléctrodo. Ese potencial depende da natureza do metal e da concentración da disolución, así como da temperatura, por tratarse dun equilibrio químico. No caso da pila Daniell, experimentalmente encóntrase que, cando as concentracións dos ións Cu2+ e Zn2+ son 1,0 M, o potencial da pila é 1,1 V.
A corrente eléctrica flúe espontaneamente do ánodo ao cátodo porque hai unha diferenza de potencial eléctrico entre os électrodos. A enerxía potencial dos electróns é maior no ánodo que no cátodo e por este motivo os electróns flúen espontaneamente do ánodo ao cátodo a través do circuíto externo.
A diferenza de potencial eléctrico entre o ánodo e o cátodo mídese experimentalmente cun voltímetro onde a lectura en voltios é o potencial da cela.
A diferenza de potencial entre os dous eléctrodos da cela electroquímica proporciona a forza motriz que empurra os electróns a través do circuíto externo. A esta diferenza de potencial chamámoslle forza electromotriz (f. e. m.).
Ecela = f. e. m. = E+ − E = Ecátodo − Eánodo
Ecátodo e Eánodo son os potenciais de redución dos eléctrodos. É imposible medir o potencial dun eléctrodo illado, pero, se asignamos o valor cero a un eléctrodo concreto, este pode servir de eléctrodo de referencia para determinar os potenciais relativos do resto dos eléctrodos.
Como eléctrodo de referencia ao que se lle asigna o valor cero elixiuse o eléctrodo de hidróxeno, formado por un eléctrodo de platino somerxido nunha disolución que contén ións H3O+ en concentración
1 M, onde se burbulla H2 gas a unha presión de 1 atm.
Pt (s) | H2 (g, 1 atm) | H+ (aq, 1M)
A reacción no eléctrodo é: 2 H+ (aq) + 2 e → H2 (g) E° = 0 V
Estas condicións denomínanse estándar, e o potencial, potencial estándar de redución, que se representa por E°.
Potencial redox dos solos
Denomínase potencial redox dun solo a súa capacidade redutora e oxidante. O potencial redox afecta a aqueles elementos que poden existir no chan en dous ou máis estados de oxidación (O, C, N, S, Fe, Mn, Cu). As condicións de oxidación-redución resultan ser de vital importancia nos procesos de meteorización ou alteración dos minerais do solo e as rochas das que proceden, repercutindo directamente na formación dos tipos de chan, así como na actividade biolóxica deste. A cor dos solos é un bo indicador do seu potencial redox.
Pt (s) Burbullas H2 (g)
Exercicios
16 Explica o concepto de eléctrodo de referencia.
17 Para (Pt)/H2 (1atm)/H+ (1m) || Cu2+ (1M)/Cu: a) escribe as semirreaccións electródicas e a reacción global da pila, b) calcula o seu potencial global.
Dato: Eº (Cu2+/Cu) = 0,34 V.
18 Que che fai dicir iso? Discute, xustificando a túa resposta, se o eléctrodo de Fe3+/Fe2+ en condicións normais se oxidará ou se reducirá espontaneamente fronte ao eléctrodo normal de hidróxeno.
Dato: Eº (Fe3+/Fe2+) = 0,77 V.
Unha vez fixado este criterio, pódese determinar o potencial estándar (E° ) de calquera eléctrodo sen máis que achar a forza electromotriz da cela formada polo eléctrodo en cuestión somerxido nunha disolución 1 M dos seus ións e o eléctrodo normal de hidróxeno, efectuando a medida a 25 º C. O potencial normal dese eléctrodo é a diferenza de potencial entre o dito eléctrodo e o eléctrodo normal de hidróxeno.
A expresión mediante a que obtemos o potencial da cela electroquímica vén dada por:
E° cela = E° red. cátodo + E° ox. ánodo
Se traballamos con potenciais normais de redución, cúmprese que:
E° cela = E° red. cátodo − E° red. ánodo
Para que a cela electroquímica funcione, o potencial debe ser positivo:
E° cela = E° red. cátodo + E° ox. ánodo > 0
Denomínase serie electroquímica de potenciais estándar de redución a escala relativa dos potenciais de redución estándar.
Utilizando esta serie electroquímica, pódese explicar a tendencia dunha especie a reducirse ou oxidarse e calcular a forza electromotriz dunha cela formada por calquera parella de eléctrodos. Á hora de utilizar esta serie, debemos ter en conta:
• Os potenciais fan referencia ao proceso de redución, polo que, se se inverte o proceso, haberá que cambiar o signo ao potencial de redución (obtendo, así, o potencial de oxidación).
• Unha substancia é tanto máis oxidante canto maior é a súa tendencia a reducirse. Canto maior sexa o potencial de redución dunha semirreacción dada, maior será o poder oxidante da especie química escrita á esquerda. O flúor é o oxidante máis forte e o litio é o redutor máis forte.
• As semirreaccións descritas na serie electroquímica son reversibles. Dependendo de con que especie química reaccione, calquera eléctrodo pode actuar como ánodo (salvo o flúor) ou como cátodo (salvo o litio).
• O cambio dos coeficientes estequiométricos nunha semirreacción non afecta o valor do potencial.
A serie electroquímica serve para calcular a f. e. m. estándar dunha cela calquera, a partir dos potenciais coñecidos dos seus eléctrodos, tendo en conta que o eléctrodo de menor potencial de redución será o polo negativo (ánodo) no que ten lugar a oxidación, e o de maior potencial, o polo positivo (cátodo), onde ten lugar a redución.
A reacción global que ten lugar na cela será a suma das as dúas semirreaccións e a súa f. e. m. obterase sumando os correspondentes potenciais de eléctrodo.
Determinación do potencial estándar de eléctrodo do cinc.
H2 0,00
Cu2+ + 2 e → Cu +0,34
MnO4 + e → MnO42− +0,56
Fe3+ + e → Fe2+ +0,77
Ag+ + e → Ag +0,80
Cr2O72− + 14 H+ + 6 e− →

→ 2 Cr3+ + 7 H2O +1,33
Cl2 + 2 e → 2 Cl +1,36
MnO4 + 8 H+ + 5 e →
→ Mn2+ + 4 H2O +1,51
Pb4+ + 2 e → Pb2+ +1,67
Táboa 4. Algúns exemplos da serie electroquímica.
Desde o punto de vista cuantitativo, existe unha relación matemática entre o potencial dunha cela e a concentración de reactivos e produtos dunha reacción redox cando esta se realiza en condicións non estándar. Esta ecuación foi proposta por W.H. Nernst:
1 0, 059log (298, 15 K) EE n QT = = º
onde E° é o potencial de redución estándar; E é o potencial en condicións non estándar; Q, o cociente de reacción establecido no sentido no que é espontáneo o proceso, e n é a cantidade de substancia ou de electróns transferidos na reacción. Hai dous casos posibles:
• Se [produtos] >[reactivos] → Q > 1 → E < E°. A reacción da cela faise menos espontánea (a f. e. m. diminúe).
• Se [produtos]<[reactivos] → Q < 1 → E > E°. A reacción da cela faise máis espontánea (a f. e. m. aumenta).
Así, nunha pila de Daniell onde [Cu2+] = 5 M e [Zn2+] = 0,05 M, temos: Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s) E° = 1,1 V –
0, 059 log 5 0, 05 1, 16 V E == > 1,1 V (E°)
espontánea.
Exercicios resoltos
5 Considerando os seguintes metais: Zn, Mg, Pb e Fe, responde as seguintes cuestións e xustifica as respostas:
a) Ordénaos de maior a menor facilidade de oxidación.
b) Cales destes metais poden reducir Fe3+ a Fe2+ pero non Fe2+a Fe metálico?
Datos: E° (Zn2+/Zn) = −0,76V
E° (Mg2+/Mg) = −2,37V;E° (Pb2+/Pb) = −0,13 V
E° (Fe2+/Fe) = −0,44V;E° (Fe3+/Fe2+) = 0,77 V
Exercicios
19 Deduce razoadamente por que o ferro (II) pode ser oxidado en medio ácido a ferro (III) polo ión nitrato e, non obstante, este mesmo ión non pode oxidar o ouro no seu estado elemental a ouro (III). Xustifica a resposta desde o punto de vista electroquímico e escribe as reaccións correspondentes.
Datos: E° (NO3 /NO) = 0,96 V, E° (Fe3+/Fe2+) = 0,77 V,
E° (Au3+/Au) = 1,50 V.
20 Indica razoadamente o que acontecerá se a unha disolución de FeSO4 lle engadimos: a) anaquiños de
W. H. Nernst (1864-1941). Físico e químico alemán, recibiu o Premio Nobel de Química en 1920. Desenvolveu o teorema da calor, que posteriormente foi considerado como a terceira lei da termodinámica, segundo o cal: «Todos os cristais perfectos teñen a mesma entropía no cero absoluto».

Solución
1. a) Oxídase máis doadamente o que ten o potencial de redución máis negativo, neste caso, o magnesio. O que menos doadamente se oxida é o chumbo, xa que ten o potencial de redución menos negativo, é dicir, o maior potencial de todos. Así, a orde de maior a menor tendencia é a seguinte: Mg, Zn, Fe, Pb.
b) O chumbo, xa que todos poden reducir Fe3+ a Fe2+, pero só el non pode reducir o Fe2+ a Fe metálico porque ten un potencial de redución maior.
Pb + Fe2+ → Pb2+ + Fe
E° = E°red. + E° ox. = −0,44V + 0,13 V = −0, 31 V
cinc, b) limaduras de cobre. Datos: E° ( Fe2+/Fe) = −0,44V, E° (Zn2+/Zn) = − 0,76 V, E° (Cu2+/Cu) = 0,34 V.
21 Unha pila consta dunha semicela que contén unha barra de platino somerxida nunha disolución 1 M de Fe2+ e 1 M de Fe3+. A outra semicela consiste nun eléctrodo de talio somerxido nunha disolución 1 M de ión talio (I): a) escribe as semirreaccións no cátodo e no ánodo, e a reacción global, b) calcula o potencial estándar da pila.
Datos: E° (Fe3+/Fe2+) = 0,77 V, E° (Tl+/Tl)= −0,34 V.
Segundo a termoquímica, as reaccións químicas son espontáneas cando ΔG < 0 e a medida que a reacción transcorre, o seu ΔG vaise aproximando ao valor 0, que se alcanza no momento do equilibrio.
A termodinámica indica que para un proceso a presión e temperatura constante se cumpre:
ΔG = −P · ΔV = −ΔW [1]
Como o traballo eléctrico cumpre que ΔW = n · F · Ecelda sendo n o número de electróns transferidos e F a constante de Faraday (1F = 96 500 C), substituíndo quédanos:
ΔG = −n · F · Ecela
Esta expresión permítenos determinar a espontaneidade dos procesos redox. Como n e F son cantidades positivas, un valor de Ecela positivo orixina un valor negativo de ΔG, o que significa que a reacción é espontánea. Pola contra, se o valor de Ecela é negativo, a reacción non será espontánea. En condicións estándar, cúmprese que: ΔG° = −n · F · E° cela
Q ΔG E° Situación
< K + Espontánea
= K 0 0 Equilibrio
>K + Non espontánea
Táboa 5. Espontaneidade da reacción segundo os valores de Q, E° e ΔG
Exercicios resoltos
6 Completa e axusta, en medio ácido, as semirreaccións de oxidación e de redución, así como a reacción global. Indica se son espontáneas as reaccións globais en función dos potenciais normais redox.
a) Cr2O72− + S2− + H+ → Cr3+ + …
b) KMnO4 + HCl + SnCl2 → SnCl4 + …
Datos: E° (Cr2O72−/Cr3+) = 1,33 V ; E° (S/S2−) = 0,14
V; E° (MnO4 /Mn2+) = 1,51 V; E° (Sn4+/Sn2+) = 0,15 V.
Solución
a) Semirreacción redución:
Cr2O72− + 14 H+ + 6 e → 2 Cr3+ + 7 H2O; E° = 1,33 V
Semirreacción oxidación: S2− → S + 2 e E° = −0,14 V
Exercicios
22 a) Axusta a seguinte reacción segundo o método do ión-electrón no medio ácido:
KIO3 + KI + H2SO4 → I2 + H2OU + K2SO4
b) Deduce se a citada reacción será espontánea en condicións estándar e cal será a especie redutora.
Datos: E° (I2/I ) = 0,52 V, E° ( IO3 /I2) = 1,2 V.
A corrosión ordinaria é un proceso redox polo cal os metais se oxidan por medio do osíxeno, O2, en presenza de humidade. O osíxeno en estado gasoso é un axente oxidante, e a maioría dos metais teñen potenciais de redución menores ca el; polo tanto, pode oxidalos.

Reacción global:
Cr2O72− + 14 H+ + 3 S2− → 2 Cr3+ + 3 S + 7 H2O; E° = 1,19 V Polo tanto, como E° > 0, entón ΔG° < 0 e a reacción é espontánea.
b) Semirreacción redución: MnO4 + 8 H+ + 5 e → Mn2+ + 4 H2O; E° = 1,51 V Semirreacción oxidación: Sn2+ → Sn4+ + 2 e ; E° = −0,15 V
Reacción global:
2 KMnO4 + 16 HCl + 5 SnCl2 → 2 MnCl2 + 5 SnCl4 + 8 H2O + + 2 KCl E° = 1,36 V Polo tanto, como E° > 0, entón ΔG° < 0 e a reacción é espontánea.
23 Indica, de forma razoada, se a reacción: Sn (s) + Pb2+ (aq) → Sn2+ (aq) + Pb (s) transcorrerá de xeito espontáneo no sentido en que está escrita. Supón que reactivos e produtos se encontran en estados estándar.
Datos: E° (Sn2+/Sn) = −0,137 V.
E° (Pb2+/Pb) = −0,125 V.
A valoración redox é unha técnica analítica moi similar á valoración ácido-base, pero, neste caso, empregando axentes oxidantes e redutores.
Nas valoracións redox podemos determinar a concentración dun axente oxidante a partir da concentración coñecida dun axente redutor (valorante).
Para que unha reacción redox poida ser utilizada en análise volumétrica, ten que cumprir os seguintes requisitos:
• Debe ser unha reacción simple, cuantitativa, libre de reaccións secundarias e que se poida representar por unha ecuación química en relación estequiométrica ou de equivalencia química.
• O valorante debe ser o suficientemente «forte» como para que a reacción sexa completa.
• O valorante debe reaccionar rapidamente coa substancia de concentración descoñecida, é dicir, debe ser practicamente instantánea.
• As reaccións redox ás veces son lentas; este inconveniente resólvese mediante distintos procedementos: temperatura elevada, adición de catalizadores ou exceso de reactivos.
24 Sábese que o ión MnO4 oxida o Fe (II) a Fe (III) en presenza de H2SO4 mentres se reduce a Mn (II). a) Escribe e axusta polo método do ión-electrón a ecuación iónica global, indicando as semirreaccións correspondentes, b) que volume de KMnO4 0,02 M se require para oxidar 40 mL dunha disolución 0,1 M de FeSO4 en disolución de H2SO4?
25 O tetraoxomanganato (VII) de potasio, en medio ácido sulfúrico, transforma o ioduro de potasio en iodo molecular á vez que o primeiro se transforma en sulfato de manganeso (II) e se forma sulfato de potasio e auga. Pídese: a) formular, axustar polo método do ión-electrón e completar a reacción molecular citada, indicando o oxidante e redutor; b) calcular a concentración molar de ioduro de potasio presente en 50 mL de disolución se se consomen 25 mL de permanganato de potasio 0,5 M na valoración en exceso de medio ácido.
No matraz erlenmeyer colócase, por exemplo, unha disolución da substancia oxidante cuxa concentración descoñecemos. Na bureta, colocamos unha disolución de concentración coñecida da substancia redutora.

Ao ir vertendo pouco a pouco a disolución da bureta, a especie redutora irá reducindo a especie oxidante. Alcanzarase o punto de equivalencia cando toda a substancia oxidante pasase á súa forma reducida (e, á súa vez, toda a substancia redutora pasase á súa forma oxidada).
A partir do punto de equivalencia, xa teremos un exceso de substancia redutora na bureta, que non poderá oxidarse, pois xa non queda substancia oxidante no matraz erlenmeyer.
O punto de equivalencia dunha reacción tal como:
a Oxidante1 + b Redutor2 → c Redutor1 + d Oxidante2 alcánzase, cando o número de electróns ganados polo oxidante oxida completamente a especie redutora problema.
Cando facemos unha valoración redox, debemos ter moi en conta cal é a reacción de valoración e axustar a súa ecuación química para determinar a cantidade de substancia da especie oxidante e a cantidade de substancia da especie redutora que reaccionan entre si.
No punto de equivalencia da valoración, cúmprese que a cantidade de substancia de electróns (en mol) que cede a substancia redutora coincide coa que gana a substancia oxidante.
Así, para unha especie oxidante de concentración Mox., que acepta νox. electróns por cada molécula (ou cantidade de substancia de electróns (en mol) por cada mol de substancia), e unha especie redutora de concentración
Mred. que perde νred. electróns por cada molécula (ou cantidade de substancia de electróns (en mol) por cada mol de substancia) cúmprese que:
νred. ∙ Mred. ∙ Vred. = νox. ∙ Mox. ∙ Vox.
onde:
Vred. é o volume da disolución do redutor.
Mred. é a molaridade da disolución do redutor.
Vox. é o volume da disolución do oxidante.
Mox. é a molaridade da disolución do oxidante.
νox. é o número de electróns aceptados por cada molécula.
νred é o número de electróns perdidos por cada molécula.
No caso dunha disolución de Fe2+ que se oxida ata Fe3+ teremos:

Fe2+ → Fe3+ + 1 e– νred. = 1
No caso dunha disolución de Sn4+ que se reduce ata Sn2+, teremos: Sn4+ + 2 e– → Sn2+ νox.= 2
As substancias de concentracións coñecidas utilizadas como referencia nas valoracións redox son moi poucas. Trátase sempre de oxidantes e redutores fortes, estables en disolución e cuxas reaccións redox son estequiometricamente sinxelas. Entre os oxidantes máis usados están:
• Permanganato de potasio (KMnO4): é un excelente oxidante, que está dispoñible con facilidade, non é caro e non require indicador, a menos que se utilice en solución moi diluída.
O permanganato participa en varias reaccións químicas, xa que o manganeso pode existir en varios estados de oxidación (+2, +3, +4, +6 e +7). En xeral, emprégase para valoracións en medios fortemente ácidos.
• Dicromato de potasio (K2Cr2O7): é un axente oxidante menos forte que o KMnO4. É moi soluble en auga, e as disolucións resultantes son estables durante moito tempo se se protexen da evaporación.

• Sales de cerio (IV): o cerio é un elemento que forma parte das terras raras, e pode existir só en dous estados de oxidación, +4 e +3. No estado tetravalente é un axente oxidante forte, que pasa por unha soa reacción: Ce4+ + 1 e → Ce3+
• Iodo (I2): o iodo é un axente oxidante máis débil que o permanganato de potasio, os compostos de cerio (IV) e o dicromato de potasio. Nos procesos analíticos, o iodo emprégase como axente oxidante, e o ión ioduro, como axente redutor.
A determinación da concentración dunha substancia mediante valoracións redox adoita denominarse co nome do composto que se utiliza como oxidante. Por iso, podemos falar de iodometrías, permanganimetrías, etc.
Entre os redutores máis usados, temos:
• Oxalato de sodio (Na2C2O4) e ácido oxálico (H2C2O4): as dúas substancias poden obterse en estado puro e úsanse na valoración de permanganato e sulfato de cerio (IV).
As solucións de oxalato e ácido oxálico diminúen a súa forza co tempo, especialmente cando se expoñen á luz, por iso deben gardarse na escuridade (preferiblemente, en botellas de vidro escuro).
• Tiosulfato de sodio (Na2S2O3): é a solución que se utiliza na maioría dos procesos iodométricos. É excepcional polo feito de que a maioría dos demais oxidantes converten ión tiosulfato (S2O32− en sulfito (SO32− ou sulfato (SO42− e non en tetrationato (S4O26−).
O punto final da valoración pódese determinar mediante un indicador que presente distinta cor nas súas formas oxidada e reducida. Para a súa selección, un indicador debe cambiar de cor preto do potencial da disolución, ou potencial de equivalencia.
Un indicador redox xeral é un composto que cambia de cor cando pasa da súa forma oxidada a reducida, ou ao contrario.
A semirreacción á que se debe o cambio de cor pode escribirse: Inox. + n e ⟶ Inred.
Para que o ollo humano poida observar o cambio de cor da forma oxidada do indicador á forma reducida requírese que a proporción de concentracións de ambas as dúas varíe unhas cen veces.
Ce (III) con ferroína → Ce (IV) con ferroína + e (Azul) (Vermello)
Ce (IV) con ferroína → Ce (III) con ferroína + e (Vermello) (Azul)
Reacción de oxidación e redución do cerio en presenza da ferroína. Na seguinte táboa móstranse algúns dos indicadores redox máis importantes:
O ácido oxálico (H2C2O4) está en distintos alimentos de orixe vexetal como as espinacas, a remolacha, a col, a acelga e os froitos secos.
O consumo excesivo de alimentos ricos en oxalato pode favorecer a formación de cálculos renais.

1,25
Táboa 6. Indicadores redox máis importantes utilizados no laboratorio.
26 Para valorar 75 cm3 de disolución acuosa de sulfato de ferro (II) —previamente acidificado con ácido sulfúrico—, utilízanse 38 cm3 de dicromato de potasio 0,40 M como valorante. Que concentración ten o sulfato?
27 Nunha valoración, 31,25 mL dunha disolución 0,1 M de Na2C2O4 (oxalato de sodio) en medio ácido consómense 17,38 mL dunha disolución de KMnO4 de concentración descoñecida. Sabendo que o oxalato pasa a CO2 e o permanganato a Mn2+:
a) axusta a ecuación iónica polo método do ión-electrón, b) calcula a concentración da disolución de KMnO4
Datos: Masas atómicas: O = 16 u, K, = 39 u, Mn, = 55 u.
Se se somerxen dous condutores quimicamente inertes (por exemplo, platino ou grafito) nunha solución dun electrólito ou dun composto iónico fundido e se aplica unha determinada diferenza de potencial eléctrico entre eles, circulará unha corrente eléctrica porque hai especies cargadas capaces de moverse: os ións (no electrólito, ou o composto iónico fundido) e os electróns (nos condutores).
Este tránsito de cargas orixina unha reacción química non espontánea nos eléctrodos entre os cales se estableceu a diferenza de potencial. Este proceso denomínase electrólise e o sistema ao cal se lle subministra a diferenza de potencial eléctrico é a cuba ou cela electrolítica.
As celas electrolíticas están constituídas por un recipiente que contén o sistema químico reaccionante ou medio condutor (disolución ou electrólito fundido). Nel van somerxidos os dous eléctrodos conectados a unha fonte de corrente continua que subministra os electróns necesarios ao cátodo para que teña lugar unha reacción dada.
• Os electrólitos son as substancias que conducen a corrente eléctrica. Adoitan ser compostos iónicos fundidos ou disoltos, pero tamén pode ser un composto covalente que se ionice en disolución.
• O medio condutor, polo xeral, é o mesmo para os dous eléctrodos, polo que non se require ponte salina.
• Os dous eléctrodos son dun material condutor sólido (xeralmente, un metal ou grafito), un chámase cátodo, nel ten lugar a redución; o outro chámase ánodo e nel ten lugar a oxidación.
Nas celas electrolíticas prodúcense reaccións químicas termodinamicamente non espontáneas mediante un proceso denominado electrólise. A diferenza das celas galvánicas, para que unha cela electrolítica funcione, requírese unha fonte externa de enerxía eléctrica, por exemplo, unha batería, a cal forza a reacción non espontánea a ocorrer.
Esquema dunha cela electrolítica.
Para que se produza a electrólise, débese aplicar unha diferenza de potencial maior que a diferenza de potencial da reacción espontánea.
Así, por exemplo, se o ΔE° da reacción espontánea, con reactivos e produtos en estado estándar é 0,76 V, deberase aplicar unha diferenza de potencial maior que ese valor para inverter o sentido da corrente.
Os ións positivos da disolución (catións) moveranse cara ao eléctrodo negativo ou cátodo (onde se produce a redución) e os ións negativos (anións) cara ao eléctrodo positivo ou ánodo (onde se produce a oxidación).

28 Por unha cela electrolítica circulan 4,3 mol de electróns. Calcula a carga, expresada en coulombs, á que equivalen. Datos: carga electrón: 1,6022 · 10−19 C; NA = 6,022 · 1023
29 Realízase a electrólise dunha disolución acuosa de cloruro de potasio. Indica as especies químicas que se producirán no ánodo e no cátodo.
30 Nunha cela electrolítica con eléctrodos inertes, introdúcese cloruro de potasio fundido. Indica as especies químicas que se producirán no ánodo e no cátodo.
No interior da cuba existe un transporte de carga e de materia. Ao chegar aos eléctrodos, os ións poden ganar ou perder electróns e transformarse en átomos neutros ou moléculas.
Podemos interpretar a electrólise como o proceso oposto ao que ten lugar nunha cela galvánica. Mentres que nunha cela galvánica aproveitamos unha reacción química «redox» espontánea para producir unha diferenza de potencial eléctrico, na electrólise, por medio da aplicación dunha diferenza de potencial eléctrico externo xérase unha reacción química «redox» non espontánea.
Pila ou cela electroquímica Cela electrolítica
Reacción química espontánea. Reacción química non espontánea.
A partir dunha reacción química prodúcese enerxía eléctrica.
A partir de enerxía eléctrica prodúcese unha reacción química.
Dous electrólitos separados en contacto por unha ponte salina. Un electrólito.
O ánodo é o polo negativo e o cátodo, o positivo.
Prodúcese a semirreacción de oxidación no ánodo (–) e a de redución no cátodo (+).
O ánodo é o polo positivo e o cátodo, o negativo.
Prodúcese a semirreacción de oxidación no ánodo (+) e a de redución no cátodo (–).
Táboa 7. Comparativa entre unha cela electroquímica e unha cela electrolítica.
O cloruro de sodio sólido, NaCl, non conduce a corrente eléctrica debido a que os seus ións non poden moverse dentro da rede cristalina. En cambio, se se quenta o NaCl sólido por enriba do seu punto de fusión (808 ºC), si pode conducir a corrente eléctrica debido á presenza de ións Na+ e Cl , os cales teñen liberdade para desprazarse. No seu estado fundido, o cloruro de sodio pódese electrolizar para formar sodio metálico (Na) e cloro gasoso (Cl2).
Neste caso, a cela electrolítica está constituída por dous eléctrodos inertes (xeralmente de grafito) nun recipiente que contén cloruro de sodio fundido, conectados aos respectivos polos dun xerador de corrente continua. Deste xeito, o eléctrodo que está conectado ao polo negativo cárgase negativamente, provocando que os ións positivos Na+ se movan cara a el e se reduzan a sodio metálico. O eléctrodo conectado ao polo positivo cárgase positivamente, provocando que os ións negativos Cl se movan cara a el e se oxiden a Cl2.
As dúas semirreaccións e a reacción global son:
Redución (cátodo, −): 2 Na+ (l) + 2 e → 2 Na (l)
Oxidación (ánodo, +): 2 Cl (l) → Cl2 (g) + 2 e
E1° = −2,71 V
E2° = −1,36 V
Reacción global: 2 Na+ (l) + 2 Cl (l) → 2 Na (l) + Cl2 (g) E° = −4,07 V Neste caso, para que se produza a reacción no sentido indicado, débese aplicar unha diferenza de potencial superior a 4,07 V. Canto máis negativo é o valor da forza electromotriz, máis difícil será producir a reacción redox no sentido desexado.
31 Para lograr o obxectivo de desenvolvemento sostible 6, é esencial apoiar e fortalecer a participación das comunidades locais na mellora da xestión da auga e no saneamento. O proxecto iMETland é un dos proxectos financiados pola Unión Europea para demostrar que as augas residuais urbanas poden limparse de xeito sostible e ser aptas para a rega, cun custo enerxético nulo, mediante a utilización de bacterias que producen corrente eléctrica a partir dos contaminantes. Facendo uso das ferramentas TIC, investiga acerca dos obxectivos e características do proxecto, así como a súa contribución ás metas 6.3 e 6.4 dos ODS.
Electrólise do NaCl fundido. Este proceso é a fonte principal de sodio metálico e cloro gasoso.
A auga pura non é condutora da electricidade. Para facela condutora, engádeselle unha pequena cantidade de H2SO4 0,1 M que achegue os ións H+ necesarios para conducir a corrente eléctrica.
As dúas semirreaccións que teñen lugar e a reacción global son:
Redución (cátodo, −): 4 H+ (aq) + 4 e → 2 H2 (g)
Oxidación (ánodo, +): 2 H2O (l) → O2 (g) + 4 H+ (aq) + 4 e
E1° = 0 V
E2° = −1,23 V
E° = −1,23 V No ánodo pódense oxidar ións sulfato ou auga, pero se observamos os valores dos potenciais de redución, dedúcese que o fará a auga. No cátodo redúcense os ións H+
Reacción global: 2 H2O (l) → 2 H2 (g) + O2 (g)
Electrólise do NaCl en disolución acuosa Cando se efectúa unha electrólise facendo pasar unha corrente eléctrica por unha disolución, débese ter presente que especies poden oxidarse ou reducirse por efecto da corrente.
No caso que nos ocupa, ademais de ións Na+ e ións Cl , no medio temos auga, a cal tamén pode oxidarse e reducirse. Non obstante, ao ser o potencial de redución da auga, −0,83 V, maior que o do Na+, −2,71 V, producirase a redución da auga, H2O.
Electrólise en auga de cloruro sódico. Este proceso electrolítico é de grande importancia industrial, xa que nel se obteñen como produtos principais Cl2 (g) e H2 (g) e, como subproduto, NaOH.
As semirreaccións que teñen lugar son: Redución
O cloro e a sosa cáustica son coprodutos de fabricación conxunta por electrólise. A produción de sosa por esta vía vese limitada por un consumo de cloro que é cada vez menor por razóns ambientais.
Prodúcense a partir dunha solución purificada de salmoira, obténdose tamén hidróxeno:
2 NaCl (aq) + 2 H2O → Cl2 + H2 + 2 NaOH
En 1800, William Cruickshank describiu por primeira vez a electrólise de salmoira.
Electrólise do CuSO4 en disolución acuosa Neste caso, o sal CuSO4, en disolución acuosa, está totalmente disociado en Cu2+ e SO42−. Igual que no caso anterior, temos dúas especies que poden reducirse, Cu2+ e H2O. Ao ser o potencial de redución da auga, −0,83 V, menor que o do Cu2+, +0,34 V, producirase a redución do cobre. As semirreaccións que teñen lugar son:
R.
Michael Faraday (1791-1867) descubriu no século xix que existe unha relación sinxela entre a cantidade de substancia que se produce ou consome nun eléctrodo durante a electrólise e a carga eléctrica que circula pola cela. Estableceu dúas leis:
Primeira lei: a masa dun elemento depositada nun eléctrodo é proporcional á cantidade de electricidade que pasa a través da disolución.
Segunda lei: para unha mesma cantidade de electricidade que pasa por varias cubas conectadas en serie, as masas depositadas ou liberadas nos eléctrodos son proporcionais aos seus respectivos equivalentes químicos.
Dito doutra forma, un faradio deposita ou libera un equivalente de substancia (1F = 96 500 C).
Para realizar cálculos estequiométricos, necesitamos saber a cantidade de electricidade, Q, que pasou durante certo tempo t:
onde I é a intensidade de corrente e mídese en amperes, A. Combinando as dúas leis, resulta que a masa, m, de material depositado ou disolto en cada eléctrodo virá dada por:
onde m = masa que se deposita nun eléctrodo (gramos), I = intensidade de corrente (amperes), t = tempo de electrólise (segundos), M = masa molar do elemento (expresada en gramos, pois realmente fai referencia a un mol de átomos ou moléculas), n = número de electróns intercambiados e F = faradio (carga dun mol de electróns).
Tendo en conta que un faradio é a cantidade de electricidade que corresponde a un mol de electróns e que equivale, aproximadamente, a 96 500 C, temos: m n MI t 96 500 $ $$ =
SO42–Cu2+ Cu2+
Equivalente químico
Nas reaccións de oxidación-redución, un equivalente químico é igual ao cociente entre a masa dun mol de átomos ou moléculas dunha substancia e o número de electróns postos en xogo para oxidala ou reducila.

n M 1=
eq
Exercicios
7 Colócanse en serie unha cela electrolítica de AgNO3 e outra de CuSO4. Calcula:
a) Cantos gramos de Cu (s) se depositan na segunda cela mentres se depositan 2 g de Ag (s) na primeira?
b) Canto tempo estivo pasando corrente se a intensidade era de 10 A? Datos: masas atómicas Ag = 107,87 u e Cu = 63,54 u; 1 faradio = 96 500 C · mol–1.
Solución
a) Temos as seguintes semirreaccións:
Ag+ + 1 e → Ag Cu2+ + 2 e → Cu
Calculamos a cantidade de substancia de prata depositada: 107, 87gmol 2g 0, 0185 mol n –1 ==
Observamos que se deposita 1 mol de Cu por cada 2 mol de Ag, así: molAg molCu 2 1 = , n molAg Cu 00185
(Cu) 2 0, 0185 mol 9, 25 10 mol n –3 ==
m (Cu) = 9,25 ∙ 10−3 mol ∙ 63,54 g · mol–1
Polo tanto: m (Cu) = 0,59 g
b) O tempo que estivo pasando a corrente vén dado por: t l Q =
Así: · 10 A 0, 0185 mol96500C mol 178, 5s t –1 ==
33 Unha peza metálica de 4,11g que contén cobre introdúcese en ácido clorhídrico obténdose unha disolución que contén Cu2+ e un residuo sólido insoluble. Sobre a disolución resultante realízase unha electrólise pasando unha corrente de 5 A. Ao cabo de 656 s pésase o cátodo e obsérvase que se depositaron 1,08 g de cobre. Responde as seguintes cuestións:
a) Cal é a masa atómica do cobre?
b) Que volume de cloro se desprendeu durante o proceso electrolítico no ánodo (medido a 20 ºC e 760 mmHg)?
c) Cal era o contido real de Cu (en % en masa) na peza orixinal se ao cabo de 25 minutos de paso de corrente se observou que a masa do cátodo non variaba?
Datos: 1F = 96 500 C · mol–1; R = 0,082 atm ∙ L · mol–1 ∙ K–1
34 Que volume de cloro se obtén medido a 27 ºC e 670 mmHg de presión ao realizar a electrólise dunha disolución de NaCl facendo pasar unha corrente de 200 A durante 12 h?
Datos: Masa atómica Cl = 35,5 u, 1F = 96 500 C · mol–1
35 A electrólise dunha disolución acuosa de BiCl3 en medio neutro orixina Bi (s) e Cl2 (g). Resolve as seguintes cuestións:
a) Escribe as semirreaccións iónicas no cátodo e no ánodo e a reacción global do proceso.
b) Calcula o potencial estándar correspondente á reacción global.
c) Calcula a masa de bismuto metálico e o volume de cloro gasoso medido a 25 ºC e 1 atm, obtidos ao cabo de dúas horas cando se aplica unha corrente de 1,5 A.
Datos: masas atómicas: Cl = 35,5 ou, Bi = 209 u; 1F = 96 485 C · mol–1, R = 0,082 atm · L · mol–1 ∙ K–1; E° (Bi3+/Bi) = 0,29 V, E° (Cl2/Cl ) = 1,36 V.
36 a) Que cantidade de electricidade é necesaria para que se deposite no cátodo todo o ouro contido en 1 L de disolución 0,1 M de AuCl3?
b) Que volume de Cl2, medido á presión de 740 mmHg e 25 ºC, se desprenderá no ánodo?
Datos: 1F = 96 500 C · mol–1, R = 0,082 atm · L · mol–1 ∙ K–1

A industria moderna non podería funcionar como o fai hoxe en día sen as reaccións de electrólise. Diversos metais e non metais como o Al, Mg, Cl2 e F2 que na natureza se encontran formando compostos pódense obter por redución aplicando o proceso de electrólise. Entre os compostos químicos producidos por electrólise están o NaOH, K2Cr2O7, KMnO4 e un gran número de compostos orgánicos.
Algúns procesos importantes son o refino electrolítico de metais, o depósito electrolítico, a electrosíntese e a galvanotecnia.
10.1. Refino electrolítico de metais
O refino electrolítico de metais implica o depósito de metal puro nun cátodo, a partir dunha disolución que contén o ión metálico.
Así, o cobre que se obtén por tostación dos seus minerais ten bastante pureza para algunhas aplicacións, como tubaxes, pero non as suficientes para aplicacións que requiren unha gran condutividade eléctrica.
Tómase como ánodo un anaco de cobre impuro e como cátodo unha lámina delgada de cobre metálico puro. Durante a electrólise, o Cu2+ producido no ánodo desprázase a través dunha disolución de ácido sulfúrico e sulfato de cobre ata o cátodo, onde se reduce a Cu (s).

O cátodo de cobre puro aumenta o seu tamaño, mentres que o anaco de cobre impuro se consome.
10.2. Depósito electrolítico ou electrodeposición
No depósito, ou baño electrolítico, deposítase un baño de metal sobre outro por electrólise. Este procedemento lévase a cabo por motivos decorativos ou para protexer da corrosión o segundo metal.

Nun proceso de depósito electrolítico, o obxecto que se vai bañar constitúe o cátodo da cela electroquímica.
O cromado ou baño de cromo é moi útil pola súa resistencia á corrosión, así como pola súa beleza con fins decorativos. O aceiro pode cromarse mediante unha disolución acuosa de CrO3 e H2SO4.
Charles M. Hall e Paul Héroult, en 1886, descubriron case de xeito simultáneo un proceso electrolítico práctico para a obtención de aluminio que fixo posible dispoñer deste material para diversas aplicacións. Tras este descubrimento produciuse un descenso drástico no prezo do aluminio. O efecto do proceso de electrólise é transformar os ións Al3+ en átomos de Al neutros que forman aluminio metálico. O aluminio que se obtén no proceso electrolítico ten un 99,5 % de pureza. Almacénase en grandes bobinas que constitúen a materia prima na fabricación de multitude de pezas e obxectos deste metal.
Cromado das pezas dunha motocicleta.

10.3. Electrosíntese
É un procedemento para producir substancias por medio de reaccións de electrólise.
O dióxido de manganeso preséntase na natureza en forma de pirolusita, pero o pequeno tamaño dos cristais e as imperfeccións da rede fan que este material non sexa adecuado para algunhas aplicacións.
A electrólise de MnO2 lévase a cabo nunha disolución de MnSO4 en H2SO4 (aq) O MnO2 (s) puro fórmase por oxidación do Mn2+ sobre un eléctrodo inerte, como o grafito.
10.4. Galvanotecnia
Trátase dun proceso electroquímico mediante o cal se deposita unha capa fina de metal sobre unha base, xeralmente metálica.
Os obxectos galvanízanse para evitar a corrosión, para obter un acabado atractivo, para purificar metais, para reproducir moldes, etc.

Os metais que se utilizan, normalmente, en galvanotecnia son: cromo, cadmio, cobre, ouro, níquel, prata e estaño.
Material Nome
Cobre Cobreado
Cromo Cromado
Níquel Niquelado
Cadmio Cadmiado
Cinc Galvanizado

Estaño Estañado
Ouro Dourado
Prata Prateado
Ferro Aceirado
Táboa 8. Tipos de recubrimentos galvánicos.
As pilas utilízanse para producir reaccións redox e para calcular potenciais de eléctrodo. Non obstante, a súa maior utilidade é para producir correntes eléctricas de pequena intensidade, destinadas principalmente, ao funcionamento de reloxos, xoguetes, aparatos portátiles de radio... e tamén como fonte de enerxía nos satélites artificiais.
As pilas asócianse en baterías (serie) para conseguir unha forza electromotriz maior, e a intensidade de corrente xerada pode variar desde algúns miliamperes ata varios centos de amperes.
As pilas clasifícanse, fundamentalmente, en dous tipos:
• Primarias: as pilas son dispositivos xeradores de electróns, cunha vida limitada polo esgotamento das substancias redox reaccionantes, xa que, a medida que se xera corrente, se consomen produtos químicos. As pilas primarias non se poden recargar; unha vez que os produtos químicos se consumiron, non é posible ningunha reacción química posterior (proceso irreversible).
• Secundarias: nelas, o proceso de conversión de enerxía eléctrica é reversible, é dicir, os reactivos orixinais pódense rexenerar. Tamén se lles chama acumuladores, e a pila pódese recargar facendo pasar unha corrente continua a través dela no sentido oposto á corrente de descarga, proceso que se denomina carga, ou recarga, dunha batería.
Pilas primarias
Pila de Volta ou pila voltaica
É a pila máis antiga e foi ideada polo físico italiano Alessandro Volta (1745-1827). O ánodo da pila de Volta é unha lámina de cinc e o cátodo é unha lámina de cobre.
As reaccións que teñen lugar nesta pila son:
Ánodo (−): Zn (s) → Zn2+ (aq) + 2 e
Cátodo (+): 2 H+ (aq) + 2 e (s) → H2 (g)
Reacción global: Zn + 2 H+ → Zn2+ + H2
Os electróns pasan a través do circuíto externo desde o ánodo ao cátodo, onde descargan os ións H+ do ácido, desprendendo H2. O H2 é absorbido pola superficie de cobre facendo que a intensidade de corrente diminúa. Este fenómeno recibe o nome de polarización do eléctrodo e para evitalo introdúcense unhas substancias despolarizantes que reaccionan co hidróxeno formando auga.
A presenza do cobre nesta pila é para conducir a corrente eléctrica, polo que pode ser substituído por outro metal.
A notación da pila de Volta é: Zn | H2SO4 | Cu, e é unha pila húmida.
Aínda que foi empregada como xerador de corrente durante moito tempo, demostrouse que eran moito máis eficaces e prácticas as pilas sen disolución líquida no seu interior.
Os acumuladores son dispositivos que poden utilizarse indistintamente como xeradores de corrente e tamén como receptores. De aí que poidan cargarse de novo empregando a enerxía eléctrica dunha fonte exterior. Son especialmente útiles en aplicacións que precisan enerxía nun momento determinado, pero que producen enerxía noutras ocasións, como é o caso do automóbil.
Pila seca ou de Leclanché
É unha pila seca, común nas lanternas e aparatos de radio portátiles (pilas cilíndricas). O recipiente desta pila, feito de cinc, actúa como un dos eléctrodos. O outro eléctrodo é unha barra de carbono inerte no centro da cela. O recipiente de cinc está recuberto de papel poroso para separalo dos demais materiais da cela. O espazo entre os eléctrodos énchese cunha mestura de cloruro de amonio, dióxido de manganeso, cloruro de cinc e un filtro poroso e inerte. As pilas secas sélanse para evitar perdas de humidade por evaporación.

Unha vez conectados os eléctrodos externamente, o Zn metálico oxídase a Zn2+, e os electróns flúen ao longo do recipiente ata o circuíto exterior. As reaccións que teñen lugar nesta pila son:


Oxidación (ánodo): Zn (s) → Zn2+ (aq) + 2 e
Redución (cátodo): 2 NH4+ (aq) + 2 e → 2 NH3 (g) + H2 (g)
R. global: Zn (s) + 2 NH4+(aq) → Zn2+(aq) + 2 NH3 (g) + H2 (g) Ecela = 1,6 V Como os produtos da reacción de redución son gasosos, hai que eliminalos para evitar que se formen burbullas arredor do eléctrodo de carbono, impedindo o funcionamento da pila por polarización. Para impedilo, engádense despolarizantes como o dióxido de manganeso, que, ao reaccionar co hidróxeno, produce auga e mantén a humidade necesaria na pila:

2 MnO2 (s) + H2 (g) ⇄ Mn2O3 (s) + H2O (l)
O potencial que xera esta pila é duns 1,5 V, pero, debido á súa resistencia interna, diminúe. Cando se necesitan f. e. m. maiores, conéctanse en serie. Así, as chamadas pilas de petaca son en realidade tres pilas de Leclanché conectadas en serie producindo unha f. e. m. de 4,5 V.
Pilas alcalinas
As pilas alcalinas secas son parecidas á pila seca de Leclanché, agás que o electrólito é básico porque contén KOH, a superficie interior do recipiente de Zn é rugosa, o que proporciona maior área superficial, e ten unha vida máis longa que as pilas secas ordinarias, soportando mellor o uso continuado. Teñen como ánodo unha barra de cinc; como cátodo, dióxido de manganeso, e como electrólito, hidróxido de potasio.
Pilas de botón
Coñécense con este nome unha serie de pilas que polas súas dimensións se asemellan a un botón. Están formadas por capas separadas de fibras plásticas e os axentes oxidantes máis utilizados son o HgO e Ag2O. Unha pasta de hidróxido de potasio e óxido de cinc forman o electrólito.
Pilas de combustible
Todas as reaccións de combustión son reaccións redox e por iso as reaccións de combustión utilízanse para construír pilas, chamadas pilas de combustible, nas que se aproveita o 80 % da enerxía química dos combustibles utilizados e, ademais, non producen contaminación. Utilízanse para subministrar enerxía eléctrica en moitos satélites artificiais. Os eléctrodos son dous cilindros de carbono oco impregnado dun catalizador que pode ser platino, prata ou monóxido de cobalto. O electrólito utilizado é unha disolución concentrada de KOH.
Acumulador de chumbo
Consta dun grupo de placas de chumbo que conteñen chumbo esponxoso que se alterna con outro grupo de placas de chumbo que conteñen dióxido de chumbo. Os eléctrodos están somerxidos nunha disolución do 40 % en ácido sulfúrico (medio ácido) que achega os ións H+ necesarios para a reacción, así como ións SO42− que reaccionan con Pb2+ para formar PbSO4 sólido. As reaccións que teñen lugar son:
Ánodo: Pb (s) → Pb2+ (aq) + 2 e
Cátodo: PbO2 (s) + 4 H+ (aq) + 2 e → Pb2+ (aq) + 2 H2O

Reacción iónica global: Pb (s) + PbO2 (s) ⇄ 2 Pb2+ (aq)+ 2 H2O
Reacción molecular: Pb (s) + PbO2 (s) + 2 H2SO4 (aq) ⇄ 2 PbSO4 (s) + 2 H2O (l)
A medida que transcorre a reacción, prodúcese sulfato de chumbo e diminúe a concentración de ácido sulfúrico. Se se conecta o acumulador a unha fonte exterior, invértese o sentido da corrente e rexenéranse os compoñentes nas as dúas placas.
Os automóbiles utilizan este tipo de batería; esta proporciona enerxía para a posta en marcha do vehículo e, posteriormente, cárgase grazas ao alternador do coche.


37 Mesa redonda. Descuberto en 1817, o litio empezou a utilizarse a grande escala coa industria das baterías cando substituíu o níquel como substrato químico básico. Hoxe en día é coñecido como o «ouro branco» do século xxi
Utilizando as TIC investiga cales son as razóns da súa importancia e, a continuación, en pequenos grupos utilizade a técnica cooperativa «Mesa redonda» para debater e consensuar unha única resposta que se expoñerá oralmente ao resto de grupos mediante asemblea.
Acumulador de chumbo utilizado en automóbiles.
Baterías de níquel-cadmio (NICAD)
Teñen unha vida útil moito máis longa que as pilas secas ordinarias, xa que se poden recargar. Úsanse en calculadoras e reloxos electrónicos. O electrólito é unha disolución de KOH (medio básico), o ánodo é cadmio e o cátodo é un óxido de níquel. Os hidróxidos que se forman deposítanse sobre os eléctrodos e permiten a reversibilidade das reaccións durante a recarga.
Teñen ánodos de grafito e cátodos de óxido de litio-cobalto. Dominan o mercado de cámaras fotográficas e ordenadores portátiles. Utilízanse en vehículos eléctricos e híbridos movidos por baterías.
Coñécese co nome de corrosión o proceso redox polo cal os metais se oxidan en presenza de osíxeno e humidade.
Ademais da humidade e o osíxeno, hai outros factores como o pH da disolución, a presenza de sales ou o contacto con metais máis difíciles de oxidar que o ferro, que poden acelerar a oxidación.
O exemplo típico de corrosión é a formación dunha capa de óxido chamada ferruxe, que pode chegar a producir a destrución do metal segundo os procesos. Se a auga ten ións disoltos, é máis condutora e a ferruxe fórmase máis rapidamente. Por esta razón, o sal no aire das cidades costeiras (e nas cidades do interior se se botou sal nas estradas con ocasión das xeadas) pode ser tan daniña.
F. Al-Kharafi (1946 - actualidade): Química kuwaití, recibiu o Premio L'OréalUNESCO a Mulleres en Ciencia polos seus traballos sobre a corrosión, un problema de fundamental importancia para o tratamento da auga e a industria do petróleo. Profesora de química da Universidade de Kuwait e primeira muller en dirixila (1993-2002). En 2005, a revista Forbes nomeouna como unha das 100 mulleres máis poderosas do mundo.
As súas investigacións céntranse nos comportamentos electroquímicos do aluminio, cobre, platino, niobio, vanadio, cadmio, latón, cobalto e aceiro con pouco contido de carbono.

Barco coa maioría da superficie do casco cuberta de ferruxe. Costa de Lanzarote.
O modo máis simple de previr a corrosión é asegurar que a superficie do metal non estea exposta ao aire e á auga, e isto pódese conseguir mediante diferentes procedementos:

• Utilizando pinturas anticorrosivas, como, por exemplo, o cromato de cinc, que impiden o contacto do metal co osíxeno e a humidade.
• Recubrimento con outro metal, isto conséguese electroliticamente. A galvanostexia (ou galvanoplastia) consiste en recubrir os metais dunha capa metálica resistente para darlles un mellor aspecto ou para aumentar a súa duración e resistencia á corrosión. Entre as aplicacións podemos usar o galvanizado, cromado, latonado, prateado, etc.
• Mediante a pasivación, consistente en formar sobre a superficie dun metal unha película relativamente inerte que a protexe.
Así, o anodizado é o proceso ao que se somete o aluminio para xerar unha capa de óxido de aluminio na súa superficie que o protexe contra a corrosión.
Desde hai moito tempo coñécese o papel que desempeñan as bacterias nos procesos de corrosión metálica. Os primeiros traballos neste campo débense a Von Wolzogen-Kuhr, que en 1923 puxo en evidencia o mecanismo electroquímico do ataque do ferro polos microorganismos sulforredutores. A corrosión microbiana pode definirse como un proceso metabólico bacteriano que orixina ou acelera a destrución dos metais.
Corrosión microbiolóxica do aceiro inoxidable.
O corpo humano mantén un balance de óxido-redución constante, preservando o equilibrio entre a produción de pro-oxidantes que se xeran como resultado do metabolismo celular e os sistemas de defensa antioxidantes. A perda neste balance de óxido-redución leva a un estado de estrés oxidativo, que se caracteriza por un aumento nos niveis de radicais libres e especies reactivas, que non alcanza a ser compensado polos sistemas de defensa antioxidantes, causando dano e morte celular. Isto acontece en patoloxías dexenerativas, de tipo infeccioso, inflamatorio...
Os radicais libres son átomos ou grupos de átomos que teñen un electrón desapareado, polo que son moi reactivos, xa que tenden a captar un electrón doutros átomos co fin de alcanzar a súa estabilidade electroquímica. Ao ser sumamente reactivos, son capaces de danar outras moléculas transformándoas á súa vez en moléculas moi reactivas unha reacción en cadea que causa dano oxidativo desde as células ata os tecidos.
As especies reactivas inclúen as de osíxeno (ROS), as de ferro (RIS), as de cobre (RCS) e as de nitróxeno (RNS). Todas elas son moléculas oxidantes que se transforman doadamente en radicais libres, o que lles confire a característica de ser en compostos moi daniños para as células.
Proteína alterada Lesión Enfermidade neurodexenerativa
β-amiloide Formación de placa Enfermidade de Alzheimer
Proteína TAU Maraña neurofibrilar Demencia frontotemporal
Huntingtina Inclusións nucleares Enfermidade de Huntington
α-sinucleína Corpo de Lewy Enfermidade de Parkinson
Táboa 8. Relación entre a proteína alterada por estrés oxidativo, a lesión fisiopatolóxica e a enfermidade neurodexenerativa asociada.
Por exemplo, na enfermidade de Huntington prodúcese unha alteración no ADN do paciente, o cal ten un número moi elevado de repeticións do triplete de bases CAG, o que codifica unha proteína anormal, a huntingtina.
Xene correcto (menos de 35 repeticións de nucleótidos CAG)
Xene mutado (máis de 35 repeticións de nucleótidos CAG)
As especies reactivas danan tanto ao ADN como as proteínas transformadoras. Un estado de estrés oxidativo induce na célula efectos tóxicos por oxidación de lípidos, proteínas, carbohidratos e nucleótidos, o cal produce acumulación de agregados intracelulares, disfunción mitocondrial, excitotoxicidade e apoptose. Este dano oxidativo é común nas enfermidades neurodexenerativas.
Outra enfermidade moi común nos nosos días é a enfermidade de Alzheimer. Neste caso, a proteína alterada é a β-amiloide.
Nesta sección imos usar un simulador gratuíto para o estudo da electrólise. A ferramenta permitiranos visualizar e explicar a primeira lei de Faraday, segundo a cal a masa dun elemento depositada nun eléctrodo é proporcional á cantidade de electricidade que pasa a través da disolución. Para localizar esta aplicación, tes que ir á páxina: https://media.pearsoncmg.com/bc/bc_0media_chem/chem_sim/html5/ Electro/Electro.php




Observarás que está en inglés e que che permite traballar con varios parámetros claves no estudo da electrólise (corrente eléctrica, tempo, eléctrodos...).
Igualmente, podemos seleccionar mediante un cursor a intensidade de corrente e o tempo que dura o proceso. Deste xeito, poderase establecer unha relación directa entre a masa depositada nun eléctrodo (m) e a cantidade de electricidade (Q) que pasa a través da disolución.
Podemos establecer a relación entre a intensidade de corrente que circula e a carga eléctrica (Q = I · t) e a relación entre a cantidade de electróns que circulan e a masa dunha substancia sólida depositada nos eléctrodos. No simulador é posible elixir o material condutor do ánodo e do cátodo, seleccionando no despregable cada un deles. Esta aplicación permítenos traballar con diferentes metais (Fe, Al, Cu, Ag…).
O aspecto cuantitativo da electrólise é directo: coa axuda desta ferramenta, é posible observar que a cantidade dunha substancia producida durante unha electrólise é directamente proporcional á intensidade de corrente e ao tempo que circula por esta; é dicir, á cantidade de electricidade (carga eléctrica) que circula polo electrólito ou medio condutor.
Cuestións
Unha vez seleccionado o material do polo positivo (ánodo) e do polo negativo (cátodo), hai que elixir tamén o medio condutor, pois tamén é susceptible de oxidarse ou reducirse ao pasar a corrente.
1 Utilizando o programa interactivo baixo as mesmas condicións de intensidade de corrente eléctrica e tempo, estuda a masa depositada nun dos eléctrodos en cada un dos seguintes casos: a) Al (polo positivo), Ag (polo negativo) e Al(NO3)3 como disolución condutora, b) Al (polo positivo), Cu (polo negativo) e Al(NO3)3 como disolución condutora, c) Fe (polo positivo), Ag (polo negativo) e Fe (NO3)2 como disolución condutora, d) Fe (polo positivo), Cu (polo negativo) e Fe(NO3)2 como disolución condutora.
2 Utilizando a simulación estudada para unha electrólise onde o ánodo está formado por Zn, o cátodo por Ni e o medio condutor se trata dunha disolución de Zn(NO3)2 determina a masa depositada nun dos eléctrodos para as seguintes condicións de corrente eléctrica e tempo: a) 9 amperes e 4 minutos, b) 9 amperes e 36 minutos, c) 3 amperes e 6 minutos, d) 3 amperes e 55 minutos.
1 Na electrólise dunha disolución acuosa de cloruro de sodio faise pasar unha corrente de 3 000 A durante 2 horas. Mentres transcorre o proceso, obsérvase desprendemento de hidróxeno e obtense cloro no medio básico.
a) Escribe e axusta as semirreaccións que se producen no ánodo e no cátodo e a reacción molecular global. Utiliza o método de axuste do ión-electrón.
b) A 25 ºC e 1 atm, que volume de cloro se obtén?
c) Que masa de hidróxido de sodio se terá formado na cuba electrolítica nese tempo?
Datos: Eº (V): Na+/Na = –2,71; Cl2/Cl– = 1,36 ; H2O/H2 = = –0,83; masas atómicas (u): H = 1, O = 16, Na = 23; 1 F = 96 500 C · mol–1; R = 0,082 atm· L · mol–1·K–1
a) Analizamos os potenciais de redución estándar para ver cales son as especies que se oxidan e cales se reducen: Ao ser Eº (H2O/H2) > Eº (Na+/Na) producirase a redución da auga (H2O) e non do Na+. Na electrólise da disolución acuosa de NaCl prodúcense H2 e Cl2
Agora a partir dos datos achegados polo enunciado, podemos empezar a escribir as semirreaccións que teñen lugar no ánodo e no cátodo:
– O cátodo é o polo negativo e nel prodúcese a semirreacción de redución do H2O.
– O ánodo é o polo positivo e nel prodúcese a semirreacción de oxidación do Cl– . De acordo con iso, as semirreaccións que transcorren nos correspondentes eléctrodos en medio básico son:
Cátodo: 2 H2O + 2 e– → H2 + 2 OH– Eº 1 = –0,83 V
Ánodo: 2 Cl– → Cl2 + 2 e– Eºc= –1,36 V
A continuación, sumamos as semirreaccións e obtemos a reacción iónica axustada.
Reacción iónica global:
2 H2O + 2 Cl– → H2 + Cl2 + 2 OH– Eº = -2,19 V
Para escribir a reacción molecular global axustada, colocamos as moléculas de base necesarias para axustar correctamente os OH– e engadimos e axustamos os ións espectadores. Así, obtemos:
Reacción molecular global:
2 H2O + 2 NaCl → H2 + Cl2 + 2 NaOH
b) Para calcular o volume de cloro (Cl2) obtido no proceso electrolítico, debemos calcular previamente, de acordo cos datos do enunciado, a masa de hidróxeno que se desprende no cátodo. Mediante a ecuación de Faraday, obtemos:
A continuación, calculamos a cantidade de substancia de H2 obtida:
74,61 mol H2
Segundo a estequiometría da reacción, obtense a mesma cantidade de substancia de Cl2. Así pois:
74,61 mol Cl2
A partir da ecuación de estado dos gases ideais, á presión e temperatura indicadas, o volume de Cl2 que se obtén é:
VCl2 = 1823,17 L
c) Para calcular a masa de hidróxido de sodio que se formou na cuba electrolítica en 2 horas, atendemos á estequiometría da reacción. A cantidade de substancia de NaOH que se obtén é o dobre que de Cl2, polo tanto:
m (NaOH) = 74,62 mol · 2 · 40 g mol–1 = 5968,8 g
A electrólise pódese interpretar como o proceso oposto ao que ten lugar nunha cela galvánica. Mentres que nunha cela galvánica aproveitamos unha reacción redox espontánea para producir unha diferenza de potencial eléctrico, na electrólise, por medio da aplicación dunha diferenza de potencial eléctrico externo, xérase unha reacción química redox non espontánea.
Neste caso, para que se produza a reacción global no sentido indicado, débese aplicar unha diferenza de potencial superior a 2,19 V. Canto máis negativo sexa o valor da forza electromotriz, máis difícil será producir a reacción redox no sentido indicado.
Para comprobar que axustamos de xeito adecuado a reacción molecular global, podemos axustala tamén polo método alxébrico. É fundamental que a reacción global estea expresada e axustada correctamente para que os resultados obtidos sexan os correctos.
No desenvolvemento do problema é importante ter en conta tamén o número de cifras significativas para realizar os cálculos correctamente e que o resultado obtido sexa o máis aproximado posible.
2 Nunha valoración, 35 mL dunha disolución 0,2 M de Na2C2O4 (oxalato de sodio) en medio ácido, consómense 20 mL dunha disolución de KMnO4 de concentración descoñecida. Sabendo que o oxalato pasa a CO2 e o permanganato a Mn2+, a) axusta a ecuación iónica polo método do ión-electrón, b) calcula a concentración da disolución de KMnO4
Datos: masas atómicas (u): O= 16, K= 39, Mn= 55
Proposta e resolución
a) A partir dos datos do enunciado, escribimos as semirreaccións que se producen na valoración redox.
No caso da disolución de KMnO4, prodúcese un proceso de redución:
MnO4– + 8 H+ + 5 e– → Mn2+ + 4 H2O
No caso da disolución de oxalato de sodio, prodúcese un proceso de oxidación:
C2O42– → 2 CO2 + 2 e–
A continuación, procedemos a axustar a ecuación iónica polo método do ión-electrón, tendo en conta masa e carga. Así, multiplicamos por 2 a primeira ecuación, por 5 a segunda e sumamos:
Cátodo (redución):
2 MnO4– + 16 H+ + 10 e– → 2 Mn2+ + 8 H2O
Ánodo (oxidación): 5 C2O42– → 10 CO2 + 10 e–
Ecuación iónica global:
2 MnO4– + 16 H+ + 5 C2O42– → 2 Mn2+ + 8 H2O + 10 CO2
b) En 35 mL dunha disolución 0,2 M de Na2C2O4 , temos:
n (Na2C2O4) =
= = 7 ·10–3 mol de Na2C2O4
Pola estequiometría da reacción, temos que 5 mol de Na2C2O4 reaccionan con 2 mol de KMnO4, o que nos permite calcular a cantidade de substancia de KMnO4 que temos:
n (KMnO4) = molNaC O molK nO molNaC O M 5 27 10 22
n (KMnO4) = 2,8·10–3 mol KMnO4
Calculamos agora a concentración da disolución de KMnO4:
c (KMnO4) = ,· molKMO mL
= 0,14 mol · L–1
A valoración redox é unha técnica moi similar á valoración ácido-base, pero, neste caso, empregando axentes oxidantes e redutores.
Nas valoracións redox podemos determinar a concentración dun axente oxidante a partir da concentración coñecida dun axente redutor (valorante). No noso caso, a valoración prodúcese entre o oxalato de sodio (Na2C2O4) e o permanganato de potasio (KMnO4). Cando se fai unha valoración redox, débese ter moi en conta cal é a reacción de valoración e axustar a súa ecuación química para determinar a cantidade de substancia da especie oxidante e a cantidade de substancia da especie redutora que reaccionan entre si.
É imprescindible que a ecuación iónica global estea ben axustada para que o resultado obtido para a concentración da disolución de KMnO4 estea expresado correctamente.
No desenvolvemento do problema é moi importante ter en conta tanto os factores de conversión como o número de cifras significativas nos diferentes cálculos para que o resultado non sexa erróneo.
As capacidades oxidantes do permanganato de potasio (KMnO4) permiten o seu aproveitamento en procesos de potabilización de auga, principalmente en grandes plantas potabilizadoras e en acuarios. Este composto ofrece as seguintes vantaxes:
1. Elimina olores de materia orgánica en descomposición presente na auga.
2. Oxida o ferro e o magnesio da auga turbia.
3. Reduce a ferruxe arrastrada pola auga no seu paso polas tubaxes.
1 Explica razoadamente se son certas ou non cada unha das seguintes afirmacións: a) o número de oxidación do cloro en ClO3 é −1, b) un elemento redúcese cando o seu número de oxidación cambia de menos a máis negativo, c) unha especie oxídase cando gana electróns.
2 Indica, xustificando brevemente a resposta, se os procesos sufridos polo cloro, o xofre e o ferro nas seguintes semirreaccións corresponden a unha oxidación ou a unha redución.
a) ClO2 → Cl , b) S → SO42− c) Fe2+ → Fe3+
3 Indica o número de oxidación de todos os elementos nos compostos seguintes: K2S2O7, Ni (NO3)2, Li2S, Na2 B4O7, NH4Cl, KHSO4, PbCl4.
4 Para a reacción: I2 + HNO3 → HIO3 + NO + H2O, determina a especie que se oxida e a que se reduce, determina os produtos da oxidación e a redución e axusta a ecuación polo método do ión-electrón.
5 Axusta as seguintes reaccións polo método do ión-electrón:
a) K2Cr2O7 + HCl → CrCl3 + KCl + Cl2 + H2O
b) Na2S2O3 + HCl → SO2 + S + NaCl + H2O
c) MnO2 + As2O3 + HCl → MnCl2 + As2O5 + H2O
d) KClO3 + CrCl3 + KOH → K2CrO4 + KCl + H2O
6 No laboratorio pódese preparar cloro gas facendo reaccionar permanganato de potasio sólido con ácido clorhídrico concentrado.
a) No transcurso desta reacción redox fórmase cloro, cloruro de manganeso (II), cloruro de potasio e auga. Escribe e axusta a reacción molecular mediante o método do ión-electrón.
b) Calcula o volume de cloro (gas), a 20 ºC e 1 atm, que se obtén ao facer reaccionar 10 mL de ácido clorhídrico concentrado do 35,2 % en masa e densidade 1,175 g. mL–1 cun exceso de permanganato de potasio.
Datos: R = 0,082 atm · L · mol–1 · K–1.
7 O nitrato de potasio (KNO3) reacciona con dióxido de manganeso (MnO2) e hidróxido de potasio (KOH) para dar nitrito de potasio (KNO2), permanganato de potasio (KMnO4) e auga.
a) Axusta a reacción en medio básico polo método do ión-electrón.
b) A continuación, calcula os gramos de nitrato de potasio necesarios para obter 100 g de permanganato de potasio se o rendemento da reacción é do 75 %.
c) Un dos obxectivos da Unión Europea é protexer a calidade da auga en toda Europa, evitando a contaminación por nitratos procedentes de fontes agrícolas e promovendo o uso de boas prácticas agrícolas. Facendo uso das ferramentas TIC, investiga e realiza un debate en grupo acerca das directrices actuais da UE sobre nitratos.
8 A reacción de permanganato de potasio con ioduro de potasio en presenza de ácido sulfúrico conduce á formación de sulfato de manganeso (II) sulfato de potasio, iodo e auga.
a) Escribe a ecuación química molecular axustada, indicando que especie é a oxidante, e cal a redutora.
b) Canto iodo se pode obter cando se engaden 8 g de ioduro de potasio do 84 % a 60 mL dunha disolución de permanganato de potasio 1,2 M en presenza de H2SO4?
Datos: masas atómicas (u): O =16, S = 32, K = 39,1, Mn = 55, I = 127.
Celas electroquímicas
9 Indica razoadamente que sucederá cando a unha disolución de FeSO4 lle engadimos Zn.
Datos: E° (Fe2+/Fe) = –0,44 V, E° ( Zn2+/Zn) = − 0,76 V.
10 Supoñendo unha pila galvánica formada por un eléctrodo de Ag (s) somerxido nunha disolución de AgNO3 e un eléctrodo de Pb (s) somerxido nunha disolución de Pb(NO3)2, indica: a) a reacción que terá lugar no ánodo, b) a reacción que terá lugar no cátodo, c) a reacción global, d) o potencial da pila.
Datos: E° (Ag+/Ag) = 0,8 V, E° (Pb2+/Pb) = − 0,13 V.
11 Responde, razoando as respostas, que acontecerá cando: a) axítase cunha culleriña de cinc unha disolución de FeSO4, b) se introducen limaduras de ferro nunha disolución de sulfato de cobre (II), c) se engaden anacos de cinc sobre unha disolución de cloruro de calcio.
Datos: E° (Zn2+/Zn) = − 0,76 V, E° (Fe2+/Fe) = –0,44 V, E° (Cu2+/Cu) = 0,34 V, E° (Ca2+/Ca) = − 2,87 V.
Recorda seleccionar o material de traballo desta unidade para o teu portafolio.12 A partir dos potenciais normais de eléctrodo que se indican, escolle razoadamente un axente redutor que poida pasar o Fe3+ a Fe2+.
Datos: E° (Cl2/Cl ) = 1,36 V, E° (Sn2+/Sn) = −0,14 V, E° (Fe3+/Fe2+) = 0,77 V.
13 Dados os pares (Pb2+/Pb) e (Zn2+/ Zn), quérese construír unha pila galvánica: a) fai un esquema dela, sinalando cal é o cátodo e cal é o ánodo, b) escribe as reaccións que teñen lugar en cada un dos eléctrodos e a reacción global, c) calcula o potencial estándar da pila e escribe a súa notación, d) en que dirección circulan os electróns polo circuíto?
Datos: E° (Pb2+/Pb) = −0,13 V, E° (Zn2+/Zn) = −0,76 V.
14 Dadas as seguintes semipilas: Hg2+/Hg (l), Ni2+/Ni (s) e Cu2+/Cu (s), busca a combinación cuxa pila tería unha maior forza electromotriz e calcula o seu valor. Escribe as semirreaccións de oxidación e redución correspondentes a esa pila.
Datos: E° (Hg2+/Hg (l)) = 0,80 V, E° (Ni2+/Ni (s)) = = −0,25 V, E° (Cu2+/Cu (s)) = 0,34 V.
15 Indica se as seguintes reaccións son espontáneas e, en caso afirmativo, calcula o potencial normal da pila correspondente.
a) H2SO4 + Zn → ZnSO4 + H2
b) AgNO3 + Cu → Ag + Cu(NO3)2
c) FeSO4 + Sn → SnSO4 + Fe
Datos: E° (H+/H2) = 0,00 V, E° (Zn+2/Zn) = −0,76 V, E° (Ag+/Ag) = 0,84 V, E° (Cu2+/Cu) = 0,34 V, E° (Fe2+/Fe) = = −0,44V, E° (Sn2+/Sn) = −0,14 V.
16 Utilizando os valores dos potenciais de redución estándar, indica, xustificando brevemente a resposta, cal ou cales das seguintes reaccións se producirán de forma espontánea:
a) Fe2+ + Cu → Fe + Cu2+
b) Fe2+ + Cu → Fe3+ + Cu2+
c) Fe3+ + Cd → Fe2+ + Cd2+
d) Fe2+ + Cd → Fe + Cd2+
Datos: E° (Cu2+/Cu) = 0,34 V, E° (Fe2+/Fe) = −0,44V, E° (Fe3+/Fe2+) = 0,77V, E° (Cd2+/ Cd) = –0,40 V.
17 Para os pares redox: Cl2/Cl , I2/I e Fe3+/Fe2+:
a) Indica os axentes oxidantes e redutores en cada caso, b) xustifica se se producirá unha reacción redox espontánea ao mesturar Cl2 cunha disolución de KI, c) xustifica se se producirá unha reacción redox espontánea ao mesturar I2 cunha disolución que contén Fe2+, d) para a reacción redox espontánea dos apartados b) e c), axusta as semirreaccións de oxidación e redución e a reacción iónica global. Datos: E° (Cl2/Cl ) = 1,36 V, E° (I2/I ) = 0,53 V, E° (Fe3+/Fe2+) = 0,77 V.
18 Electrolízase unha disolución de cloruro de cobre (II) cunha corrente de 10 A: a) escribe a ecuación química do proceso que ocorre en cada eléctrodo, b) cantos gramos de cobre metálico se depositan en 20 minutos?, c) tras ese tempo, cantos litros de cloro (g) se liberan, medidos en condicións normais?
19 Unha cuba electrolítica contén 750 mL dunha disolución de CuSO4. O paso dunha corrente de 1,5 A durante 10 horas consegue depositar todo o cobre da disolución. Calcula: a) a cantidade de cobre depositado, expresándoa en gramos, así como en número de átomos, b) a molaridade da disolución inicial de CuSO4, c) a concentración molar de ións Cu2+ que queda en disolución se a corrente de 1,5 A se tivese aplicado soamente durante 1 hora. Datos: masas atómicas (u): S = 32, O = 16, Zn = 65,4, Cu = 63,5, NA = 6,023 ∙ 1023, R = 0,082 atm · L · mol–1 · K–1 = 8,3 J · mol–1 · K–1
20 O aluminio obtense por electrólise do óxido de aluminio fundido empregando como ánodo un eléctrodo de carbón, que se consome na reacción. As semirreaccións que se producen son:
Ánodo: C (s) + 2 O2− (aq) → CO2 (g) + 4 e
Cátodo: Al3+ (aq) + 3 e → Al (l)
a) Calcula a cantidade de carga necesaria para obter 0,75 kg de Al; b) cantos gramos de C se consomen no ánodo durante o proceso?
Datos: masas atómicas (u): Al = 27, C = 12; 1 F = 96 500 C · mol–1
21 Calcula a masa de níquel depositada sobre o cátodo e o volume de cloro (medido en condicións normais) que se desprende no ánodo nunha electrólise de NiCl2 cando pasa unha corrente de 0,1 A durante 20 horas. Datos: masas atómicas (u): Cl = 35,5, Ni = 58,7; 1F = 96 500 C. mol–1.
Reservados todos os dereitos. O contido desta obra está protexido pola Lei, que establece penas de prisión e/ou multas, amais das correspondentes indemnizacións por perdas e danos, para quen reproduza, plaxie, distribúa ou comunique publicamente, en todo ou en parte, unha obra literaria, artística ou científica, ou a súa transformación, interpretación ou execución artística fixada en calquera tipo de soporte ou comunicada a través de calquera medio, sen a preceptiva autorización.
© GRUPO ANAYA, S.A., 2022 - C/ Valentín Beato, 21 - 28037 Madrid.