BACHILLERATO 2
QUÍMICA

Alfredo Liébana Collado
José Antonio Araque Guerrero
José M.ª Teijón Rivera


Alfredo Liébana Collado
José Antonio Araque Guerrero
José M.ª Teijón Rivera
SITUACIÓN DE APRENDIZAJE
Desafíos que dejan huella
• Mi casa está hecha de química
• Construye un reloj químico
• Aire limpio
• Natural es mejor
10
Las reacciones químicas y su control
1. Composición de la materia
2. Unidad de la cantidad de sustancia: el mol
3. El estudio de los gases
4. Determinación de fórmulas químicas
5. Disoluciones. Unidades de concentración
6. Estequiometría de las reacciones químicas
Cultura científica. La alquimia Estrategias de resolución de problemas
Los isótopos en la agricultura y la alimentación
1. Evolución de los modelos atómicos
2. Naturaleza electromagnética de la luz
3. Espectros atómicos
4. Orígenes de la teoría cuántica
5. El efecto fotoeléctrico
6. Modelo atómico de Bohr
7. Mecánica cuántica
8. Orbitales atómicos. Números cuánticos
9. Partículas subatómicas. Origen del universo Cultura científica. EL LHC y el bosón de Higgs TIC. El estudio del efecto fotoeléctrico Estrategias de resolución de problemas
La tabla periódica de los elementos químicos
1. Cronología de los elementos químicos
2. Ley de Moseley
3. Configuraciones electrónicas de los átomos
4. Sistema periódico actual
5. Propiedades periódicas de los elementos
6. Tabla periódica y reactividad química
Cultura científica. D. I. Mendeléiev
Estrategias de resolución de problemas
Nanotecnología y nuevos materiales
1. Átomos unidos por enlace químico
2. Enlace iónico
3. Enlace covalente
4. Teoría del enlace de valencia
5. Teoría de la hibridación de orbitales atómicos
6. Teoría de repulsión de los pares electrónicos de la capa de valencia
7. Enlace metálico
8. Fuerzas intermoleculares
9. Enlaces presentes en sustancias con interés biológico
Cultura científica. Nuevos materiales
TIC. Geometría molecular
Estrategias de resolución de problemas
5 Termodinámica
Termodinámica y vulcanología
1. Sistemas termodinámicos
2. Primer principio de la termodinámica
3. Aplicación del primer principio de la termodinámica a las reacciones químicas
4. Ecuaciones termoquímicas. Entalpía de reacción. Diagramas entálpicos
5. Entalpías de formación. Entalpías de enlace
6. Segundo principio de la termodinámica
7. Criterios de espontaneidad
8. Consecuencias sociales y medioambientales de las reacciones químicas de combustión
Estrategias de resolución de problemas Trabaja
Las reacciones explosivas
1. Velocidad de una reacción química
2. Ecuación de velocidad
3. Teoría de colisiones y teoría del estado de transición
4. Mecanismo de reacción
5. Factores que afectan a la velocidad de reacción
6. Catálisis
7. Aplicaciones de la catálisis
Cultura científica. Cinética de una reacción
Estrategias de resolución de problemas
102
188
168
Los equilibrios en la vida diaria
1. Reacciones químicas reversibles
2. Estudio del equilibrio químico
202
3. Formas de expresión de la constante de equilibrio
4. Cociente de reacción y sentido de la reacción
5. Equilibrio en varias etapas
6. Grado de disociación: otra aplicación de la ley de masas
7. Factores que afectan al equilibrio: principio de Le Châtelier
8. Equilibrios heterogéneos: formación de precipitados
9. Factores que afectan a la solubilidad de los precipitados
10. Precipitación fraccionada
11. Los equilibrios en la vida cotidiana y en la naturaleza
Cultura científica. Síntesis industrial del amoníaco
Estrategias de resolución de problemas
Los ácidos y las bases en la vida diaria
1. Conceptos de ácido y de base
2. Fuerza de los ácidos y de las bases
3. Medida de la acidez. Concepto de pH
4. Hidrólisis de sales
5. Disoluciones reguladoras
6. Volumetrías de neutralización ácido-base
7. Ácidos y bases en la industria
Cultura científica. Biografías
Estrategias de resolución de problemas
9 Oxidación-reducción
El papel antioxidante de los alimentos
1. Reacciones de oxidación-reducción
2. Número de oxidación
3. Ajuste redox por el método del ion-electrón
4. Estequiometría de las reacciones redox
5. Celdas electroquímicas
6. Potenciales de electrodo y potencial de una celda
7. Espontaneidad de las reacciones redox
8. Valoraciones redox
9. Electrólisis
10. Proyectos industriales de electrólisis
11. Aplicaciones y repercusiones de las reacciones redox
Cultura científica. Reacciones redox en la vida cotidiana
TIC. Simulador de electrólisis
Estrategias de resolución de problemas
Productos derivados del carbono
1. Características de los enlaces del carbono
2. Representación de las moléculas orgánicas
3. Hibridación de orbitales
4. Isomería
5. Grupos funcionales y series homólogas
6. Nomenclatura y formulación orgánica
7. Hidrocarburos
8. Compuestos oxigenados
9. Compuestos nitrogenados
10. Tioles y perácidos
11. Compuestos orgánicos polifuncionales
Cultura científica. Historia de la química orgánica TIC. Moléculas orgánicas. Molview Estrategias de resolución de problemas
298
234
Importancia de las reacciones de los compuestos del carbono
1. Las reacciones orgánicas
2. Mecanismos de las reacciones orgánicas
3. Tipos de reacciones orgánicas
4. Reacciones de hidrocarburos
5. Reacciones de los derivados halogenados
6. Reacciones de alcoholes y fenoles
7. Reacciones de aldehídos y cetonas
8. Reacciones de ácidos carboxílicos
9. Reacciones de compuestos nitrogenados
332
262
10. Compuestos orgánicos de interés industrial Cultura científica. Diseño de medicamentos Estrategias de resolución de problemas
1 2 Po límeros y macromoléculas
Los plásticos: impacto medioambiental
1. Conceptos de macromoléculas y de polímero. Propiedades
2. Reacciones de polimerización
3. Polímeros de interés industrial
4. Aplicaciones de polímeros de alto interés biológico, biomédico y tecnológico
5. Macromoléculas y polímeros de origen natural. Propiedades biológicas y médicas
6. Importancia de la química del carbono Cultura científica. Biotecnología Estrategias de resolución de problemas

La nanotecnología es la ciencia que trabaja a escala nanométrica (1 nm = 10–9 m), es decir, prácticamente a nivel atómico y molecular. Esto implica que las partículas tengan propiedades físicas y químicas diferentes a las habituales a escala macroscópica. El desarrollo de la nanotecnología está provocando un cambio en las técnicas y los procesos de producción industrial y, en consecuencia, en el desarrollo económico y social.
La primera referencia de las posibilidades de la tecnología se debe a Richard Feynman (Premio Nobel de Física, 1965), quien ya en 1959, predecía la posibilidad de que se pudiera manipular la materia a escala molecular y atómica, y esto debería producir una nueva revolución tecnológica. Con la invención del microscopio de efecto túnel o STM (Gerd Binnig, 1981) comenzó a vislumbrarse la posibilidad no solo de ver, sino de manipular verdaderamente los átomos.
Así, por ejemplo, la nanotecnología en la industria alimentaria está teniendo un gran avance en los últimos años, a pesar de estar aún en fase de desarrollo. Una de las principales aplicaciones es en el envasado de alimentos, donde destacan los nanorecubrimientos para aumentar las propiedades de los alimentos frescos, con el fin de retrasar su maduración y alargar su vida útil. También se usan ciertos nanocompuestos como material de envasado para controlar la difusión de gases y prolongar el tiempo de conservación de algunos productos.
Haced estas actividades en grupos:
1 En la actualidad, la población mundial alcanza los 7 600 millones. Un elevado porcentaje de los habitantes en países en vías de desarrollo sufren carencia de alimentos. Investigad brevemente cómo en la actualidad la nanotecnología puede servir para mejorar las producciones de los cultivos de acuerdo al objetivo 2 y a la meta 2.3 para el desarrollo sostenible.
2 La detección temprana de enfermedades, su tratamiento personalizado y un preciso seguimiento de su evolución serán posibles, en los próximos años, gracias a los nanomateriales. Buscad información sobre terapias que se usan en medicina basadas en nanopartículas y enumerad algunas de sus aplicaciones. ¿En qué consiste el nanodiagnóstico? Analizad la influencia de este nuevo tipo de técnicas en la consecución de las diferentes metas asociadas al ODS 9.
Los contenidos y las actividades de esta unidad pueden resultar de utilidad para la realización del proyecto que se plantea en el anexo situado en las páginas iniciales del libro.
En esta unidad
• Nanotecnología y nuevos materiales



1. Átomos unidos por enlace químico
2. Enlace iónico












3. Enlace covalente
4. Teoría del enlace de valencia
5. Teoría de la hibridación de orbitales atómicos
6. Teoría de repulsión de los pares electrónicos de la capa de valencia
7. Enlace metálico
8. Fuerzas intermoleculares
9. Enlaces presentes en sustancias con interés biológico
• Cultura científica. Nuevos materiales
• TIC. Geometría molecular

• Estrategias de resolución de problemas
En anayaeducacion.es
Para motivarte:
• Vídeo: «Antes de empezar».
Para detección previa de ideas:
• Presentación: «Qué necesitas saber».
Para estudiar:
• Presentación: «Para estudiar».
• Simulaciones: «Interacciones atómicas», «Polaridad de la molécula», «Forma de la molécula», «Forma de la molécula: geometría molecular y TRPECV», «Estructura de bandas».
Para evaluarte:
• Autoevaluación final.
• Soluciones de las actividades numéricas.
Y, además, toda la documentación necesaria para aplicar las claves del proyecto.

Se llama enlace químico a cualquiera de las formas de unión química entre átomos.
Un enlace químico se forma entre dos átomos si la disposición resultante de los dos núcleos y sus electrones tiene una energía menor que la energía total de los dos átomos por separado.
La fuerza que mantiene unidos los átomos es la resultante de las interacciones electrostáticas (atracción y repulsión) que se dan entre los núcleos y las cortezas electrónicas de los átomos implicados. Cuando dos átomos se aproximan para formar un enlace, los electrones se redistribuyen de manera que las fuerzas de atracción superen las fuerzas de repulsión. Los átomos se combinan con el fin de alcanzar una configuración electrónica más estable, es decir, de menor energía. La estabilidad máxima se consigue cuando un átomo es isoelectrónico con un gas noble.
Esta estabilidad energética se puede lograr mediante:
• La transferencia completa de electrones de un átomo al otro, formándose iones que permanecen unidos por interacciones de tipo electrostático denominadas enlaces iónicos.
• La compartición de electrones entre dos átomos. En este caso, los átomos se unen mediante enlaces covalentes y se forman moléculas individuales.
• La compartición de electrones, de manera colectiva, con otros átomos en el enlace metálico.
Cualquier teoría sobre el enlace químico ha de ser capaz de explicar varios aspectos fundamentales:
• Los diferentes tipos de enlace que pueden darse entre los átomos.
• Las proporciones en que los átomos se hallan en cada sustancia.
• Las propiedades de una sustancia en función de su enlace. Estas se relacionan, entre otros factores, con la energía del enlace que mantiene ligados a los átomos.
• La disposición en el espacio que adoptan los átomos entrelazados (geometría molecular).
Para visualizar la formación y las características energéticas de los enlaces químicos, podemos utilizar las curvas de Morse. Estas curvas muestran la variación de energía que experimenta un sistema formado por dos átomos en función de la distancia que hay entre ellos. Consideremos el diagrama, o curva, de Morse correspondiente a la formación de la molécula de hidrógeno, H2:
1. Inicialmente los dos átomos de hidrógeno están muy separados (r = ∞), y no existe interacción entre ellos. La energía inicial del sistema se puede considerar nula.
2. Según aproximamos los dos átomos, las fuerzas atractivas de los núcleos sobre la nube electrónica producen una disminución energética que origina que el sistema se estabilice.
Dos especies (átomos, iones o moléculas) son isoelectrónicos si tienen igual número de electrones de valencia, siendo estos los únicos que participan en la formación de los enlaces químicos.
En 1819, Jöns Jakob Berzelius (17791848) desarrolló una teoría de combinación química, introduciendo indirectamente el carácter electropositivo y electronegativo de los átomos que se combinan.

A medida que se aproximan, la energía disminuye hasta alcanzar un mínimo. La distancia a la que la energía potencial adquiere un valor mínimo, r0, recibe el nombre de distancia de enlace. La energía desprendida cuando el enlace se forma o la que se debe aportar para romperlo, se denomina energía de enlace.
3. Si continuamos aproximando aún más los átomos, la distancia interatómica disminuirá de tal modo que empezarán a interaccionar los núcleos entre sí, originando fuerzas de repulsión. Esto producirá inestabilidad que dará origen a un aumento del valor de la energía.
A temperatura ambiente, el amoniaco (NH3) es un gas incoloro de olor muy penetrante. Es muy soluble en agua, por lo que habitualmente se usa en disolución.
Una parte muy importante del amoníaco se utiliza en la fabricación de abonos, y el resto tiene usos diversos como la fabricación de explosivos, tintes, etc.
Curva de energía de enlace para la formación de la molécula de hidrógeno.
Atendiendo a la electronegatividad de los elementos que se enlazan, se pueden formar tres tipos de enlace:
• Enlace iónico: se forma entre elementos de electronegatividad muy diferente. Tiene lugar entre un metal con baja energía de ionización (grupos 1, 2) y un no metal con alta afinidad electrónica (grupos 16, 17). Se produce una transferencia de electrones del metal al no metal, con la consiguiente formación de aniones y cationes que interaccionan electrostáticamente. Ejemplos: KCl, NaF, etc.
• Enlace covalente: se forma entre dos no metales que tienen alta afinidad electrónica y ambos tienen tendencia a ganar electrones. La unión entre los átomos es debida a la compartición de electrones. Ejemplos: NH3, H2O, etc.
• Enlace metálico: se forma en elementos de baja electronegatividad (metales) y, por tanto, con gran tendencia a formar cationes. En este enlace se comparten electrones, pero de una forma colectiva.

Ejercicios
1 Dadas las moléculas HCl, KF y CH2Cl2, razona el tipo de enlace presente en cada una de ellas utilizando los datos de electronegatividad.
Datos: E.N.: K = 0,8; H = 2,1; C = 2,5; Cl = 3,0; F = 4,0.
El fluoruro de sodio tiene usos industriales en la fabricación de vidrio, adhesivos y pegamentos, insecticidas, pastas de dientes, etc.
2 Dados los siguientes compuestos: NaH, CH4, H2O, CaH2 y HF, ¿cuáles tienen enlace iónico, y cuáles, enlace covalente?
Podemos definir el enlace iónico como la unión química formada por la atracción electrostática entre iones de carga opuesta.
Si combinamos un elemento muy electropositivo (metal) con un elemento muy electronegativo (no metal), se producirá una transferencia de electrones desde el metal al no metal (uno de los átomos pierde electrones y el otro los gana) hasta que ambos alcancen la configuración de gas noble.
Al originarse iones con carga de signo contrario (aniones y cationes), entre ellos se establecen intensas fuerzas atractivas electrostáticas que mantienen unidos los iones en el compuesto iónico.

La formación de un enlace iónico es favorable si la energía necesaria para ionizar los átomos es compensada por la energía liberada por las atracciones electrostáticas entre catión y anión. Así, cuando un átomo de Cl se halla en presencia de un átomo de Na, el sodio cede un electrón formando el catión Na+, y el cloro acepta el electrón, originando un anión, Cl 11+ 17+
Cloro: Cl– Sodio: Na+ Formación de un par iónico.



Na (g) + E. I. → Na+ (g) + 1e E. I. = 495,4 kJ · mol–1


[Ne]3s 1 [Ne]
Cl (g) + 1e → Cl (g) + A. E. A. E. = −348,8 kJ · mol–1 [Ne] 3s23p 5 [Ne] 3s23p 6
Al producirse la transferencia de un electrón del átomo del Na al de Cl, los dos átomos han quedado ionizados. Se habrá formado un par iónico. Este proceso de transferencia de electrones está desfavorecido energéticamente, es decir, la cantidad de energía desprendida en la formación del ion Cl es menor que la energía necesaria para formar el ion sodio Na+. Sin embargo, la energía que se libera cuando los dos iones se atraen por fuerzas electrostáticas hace que el balance energético del proceso global sea exotérmico.
Na+ (g) + Cl (g) → Na+Cl (g) + Energía
Se denomina valencia iónica o electrovalencia al número de electrones que un átomo gana o pierde para formar un ion estable (configuración de gas noble).
En el LiCl, la valencia iónica del Li es +1 y la del Cl es −1. En el MgF2, la valencia iónica del Mg es +2 y la del F es −1.
El CaCl2 es un compuesto iónico utilizado principalmente para evitar la formación de hielo y como deshumidificador.
El MgBr2 es usado como acelerador de partículas y la fluorita (CaF2) se considera una piedra preciosa.

Ejercicios
3 ¿Qué te hace decir eso? Justifica a partir de la configuración electrónica en estado fundamental qué iones forman los elementos: berilio, rubidio, cloro, boro y selenio.
4 ¿Qué condiciones energéticas han de cumplirse para que se pueda afirmar que se ha formado un enlace?
En los compuestos iónicos, cada ion tiende a rodearse del mayor número posible de iones de carga contraria, resultando que, en condiciones normales, estos compuestos son sólidos con cationes y aniones en posiciones fijas, que se alternan en una red tridimensional denominada cristal iónico. El cristal está formado por una celda unidad que se repite indefinidamente en las tres direcciones.
La descripción geométrica de los cristales iónicos se hace en función de:
• El tipo de malla u ordenación regular que adoptan.
• El índice de coordinación, que es el número de iones de un signo que rodean a un ion de signo opuesto. Este índice determina el orden y la disposición espacial de los iones, así como el tipo de red que se forma. Su valor depende de:
• La neutralidad eléctrica: se consigue siempre que el número de cargas positivas sea igual al número de cargas negativas.

• La simetría: los iones de un signo que rodean a otro de signo opuesto se disponen de manera simétrica para que la repulsión entre los iones del mismo signo sea mínima.
• La compactación: los iones están dispuestos de la forma más compacta posible, para lo cual, cada ion se rodea del mayor número posible de iones de carga opuesta (índice de coordinación máximo).
• El tamaño de los iones: el tamaño de los iones limita el número de iones de signo opuesto que pueden rodear cada tipo de ion.
Así, por ejemplo, en la red de CsCl las relaciones de tamaño permiten que cada ion se rodee de ocho iones de carga opuesta; en cambio, en la red de NaCl la relación entre el tamaño de los iones solo permite que cada ion se pueda rodear de seis iones de carga opuesta.
La geometría de los cristales iónicos indica que en un compuesto iónico no podemos hablar de moléculas, pues el cristal está constituido por un número muy grande de iones de cargas opuestas. La relación estequiométrica entre los aniones y los cationes que forman la red cristalina de un compuesto iónico se expresa en su fórmula empírica. Una fórmula como el CaF2 indica que el número de iones fluoruro será el doble que de iones calcio, ya que su fórmula empírica expresa que la relación es de 1:2. En el CaF2, cada ion Ca2+ está rodeado por ocho iones F– situados en los vértices de un cubo.
El enlace iónico se estabiliza por las fuerzas atractivas de tipo electrostático entre las cargas opuestas de aniones y cationes.
Una medida de la estabilidad de un sólido iónico es su energía reticular, (o energía de red) que se define como:
La energía requerida para separar completamente un mol de un compuesto iónico sólido en sus iones en estado gaseoso:
AB (s) → A+ (g) + B− (g) Ereticular
La energía reticular también puede definirse como:
La energía desprendida al formarse un cristal iónico a partir de sus iones constituyentes en estado gaseoso.
La energía reticular de un sólido iónico es una medida de la fuerza de atracción entre los iones de dicho sólido. Cuanto mayor sea la energía reticular, los enlaces iónicos serán más fuertes y, en general, el sólido será más duro y fundirá a mayor temperatura.
Los valores de las energías reticulares dependen de las cargas y del tamaño de los iones implicados; así cuanto mayor sea la carga eléctrica del ion y menor su tamaño, mayor será la energía reticular de los compuestos iónicos que forme.
La energía reticular fue calculada por primera vez en 1918 por Max Born (1882-1970) y Alfred Landé (1888-1976). Ambos desarrollaron una ecuación que permite calcular el cambio de energía asociado a la formación de un mol de un compuesto MN cristalino a partir de un mol de iones M+ y un mol de iones N , en estado gaseoso: M+ (g) + N (g) → MN (s)
Max Born y Alfred Landé establecieron la siguiente expresión para la energía reticular:
En esta ecuación, NA es el número de Avogadro, Z+ y Z son las cargas de los iones; e es la carga del electrón; K es la constante de Coulomb; A es la constante de Madelung, que depende del tipo de red cristalina; r0 es la distancia internuclear, y n es el factor de compresibilidad de Born. Los valores de Ur que se obtienen utilizando la ecuación de Born-Landé son teóricos, basados en un modelo, y resultan inexactos. Para poder evaluar la calidad de este modelo, hay que comparar el valor teórico de la energía desprendida en el proceso M+ (g) + N (g) → MN (s) con un valor medido experimentalmente.
Ahora bien, la reacción anterior es imposible de llevar a cabo en el laboratorio. No se puede tener por un lado un mol de iones M+ en estado gaseoso, entre los que no exista ningún tipo de interacción, y por otro, un mol de iones N en las mismas condiciones, para luego ponerlos en contacto y obtener un cristal. Por ello, se suele recurrir a un método basado en el balance energético del proceso de formación del cristal, conocido como ciclo de Born-Haber.
Tabla 2. Energías reticulares. Los iones pequeños y de carga elevada presentan energías reticulares grandes. Para una misma carga, los iones grandes generan energías de red inferiores.
La constante de Madelung, A, tiene en cuenta las atracciones y las repulsiones entre los iones de distinta carga que componen el cristal según su disposición geométrica.
5 Utiliza los siguientes datos para calcular la energía de la red cristalina del cloruro de sodio, NaCl, mediante la ecuación de Born-Landé.
Datos: A = 1,74756;
NA = 6,022 · 1023 mol−1; ZNa = 1;
ZCl = −1; e = 1,6021 · 10−19 C;
K = 9 · 10 9 N · m 2 · C –2 ; r 0 = 2,81 · 10 −10 m; n = 8.
El estudio del proceso energético asociado a la reacción de formación de un compuesto iónico nos da una idea de la estabilidad del compuesto frente a sus elementos.
El ciclo de Born-Haber es un ciclo de reacciones químicas desarrollado por Max Born (1882-1970) y Fritz Haber (1868-1934) en 1917. Mediante él, puede calcularse el valor de la energía reticular (energía que representa, teóricamente, la formación de un compuesto iónico a partir de sus iones gaseosos) de forma indirecta, pues no puede ser calculada experimentalmente.
Este ciclo comprende la formación de un compuesto iónico desde la reacción de un metal (generalmente un elemento del grupo de los alcalinos o alcalinotérreos) con un no metal (como halógenos, oxígeno…).
Así, por ejemplo, la reacción de formación del LiF (s) descrita en un solo paso es un proceso complicado en el que tiene lugar la ruptura y la formación de enlaces.
Li (s) + 2 1 F2 (g) → LiF (s)
ΔHf = −617 kJ · mol–1
El ciclo de Born-Haber consiste en el estudio energético de este proceso a través de varias etapas:
1. Sublimación del sólido: cambia el estado de una sustancia desde el estado sólido al gaseoso.
Li (s) → Li (g) Entalpía de sublimación, ΔHs = 161 kJ · mol–1
2. Ionización del átomo: se ioniza Li para dar Li+ en la fase gaseosa. Es la energía necesaria para generar un mol de iones Li+ gaseosos a partir de un mol de átomos de Li en estado gaseoso.
Li (g) → Li+ (g) + 1 e E. I. = 520 kJ · mol–1
3. Disociación de la molécula gaseosa: es la energía necesaria para generar un mol de átomos de F a partir de moléculas de F2.
2 1 F2 (g) → F (g) 2 1 Edisociación = −77 kJ · mol–1
4. Formación de F gaseoso: representa la afinidad electrónica del flúor. Es decir, es la energía que se desprende (en este caso, al ser el signo negativo) cuando un mol de átomos de flúor en estado gaseoso capta un mol de electrones para transformarse en un mol de iones fluoruro (gas).
F (g) + 1 e → F (g) A. E. = −328 kJ · mol–1
5. Formación del sólido a partir de iones gaseosos:
Li+ (g) + F (g) → LiF (s) Ureticular = ?
La suma de las cinco etapas da la reacción global y calculamos la entalpía de formación del LiF. Teniendo en cuenta la ley de Hess, podemos determinar la energía reticular del LiF.
Hf = ΔHs + E.
+ 2 1
disociación + A. E. + Ureticular
Na (s)
+ Energía de disociación + Energía de sublimación + Energía de ionización – Afinidad electrónica – Energía raticular
Ciclo de Born-Haber para el NaCl.
Ejercicios
6 Calcula la energía reticular del KI (s) y representa en un ciclo de Born-Haber el proceso de formación del KI (s).
Datos: ΔHf (KI) = −327 kJ · mol–1
Esub. K (s) = 90 kJ · mol–1l
Esub. I2 (s) = 62 kJ · mol–1
Edis. I2 (g) = 149 kJ · mol–1
Eionización K (g) = 418 kJ · mol–1
A. E . I (g) = −308 kJ · mol–1
7 Calcula el calor de sublimación del calcio a partir de los siguientes datos:
ΔHf CaBr2 (s) = −675 kJ · mol–1
Evap. Br2 (l) = 315 kJ · mol–1
Edis. Br2 (g) = 193 kJ · mol–1
1.ª E. I. Ca (g) = 590 kJ · mol–1
2.ª E. I. Ca (g) = 1 143 kJ · mol–1
A. E. Br (g) = −324 kJ · mol–1
Ereticular CaBr2(s) = −2391 kJ · mol–1
Las propiedades de los compuestos iónicos se explican por las intensas fuerzas electrostáticas que se establecen entre los aniones y los cationes de la red cristalina.
• Estado de agregación: las fuerzas electrostáticas que mantienen unidos a los iones en un compuesto iónico son muy fuertes, por lo que son sólidos a temperatura ambiente y tienen un punto de fusión elevado (mayores de 400 ºC). Solo a temperaturas elevadas se consigue aportar la suficiente energía para vencer las interacciones electrostáticas y separar los iones de la red cristalina.
• Dureza: los compuestos iónicos son duros, ya que las intensas fuerzas electrostáticas entre los iones de la red hacen que sea muy difícil romper los enlaces. A mayor energía reticular del compuesto iónico, mayor dureza.
• Fragilidad: también son frágiles y quebradizos. La aplicación de una fuerza sobre el cristal iónico produce un desplazamiento de una capa de iones sobre otra, poniéndose en contacto iones del mismo signo. Las repulsiones electrostáticas hacen que se rompa el cristal.
Al disolverse el cristal de NaCl en agua, las moléculas de esta rodean a cada ion y se orientan en función de la carga del Na+ o del Cl
Ejercicios
• Solubilidad: los compuestos iónicos solo son solubles en disolventes polares, como el agua y el alcohol, pero son insolubles en disolventes apolares. Un disolvente polar hace más débiles las uniones entre los iones de la red, provocando su desmoronamiento. Una vez separados, los iones se rodean de moléculas de agua, lo que impide que interaccionen entre ellos.
• Conductividad eléctrica: los compuestos iónicos no conducen la electricidad en estado sólido, ya que es necesario que haya cargas eléctricas libres (electrones e iones), y al ocupar posiciones fijas en la red, los iones no se pueden mover. Cuando se encuentran fundidos o disueltos en agua, los compuestos iónicos son buenos conductores de la corriente eléctrica debido a que los iones tienen libertad de movimiento. La dureza, el punto de fusión y el punto de ebullición de los compuestos iónicos aumentan cuando crece la energía reticular desprendida en la formación de un cristal.
8 Predice la fórmula empírica del compuesto iónico formado por las siguientes parejas de elementos:
a) K y I; b) Mg y S; c) Al y N; d) Na y C.
9 Para las sales RbI, CsI, KI y NaI, explica justificando las respuesta: a) ¿Cuál tendrá mayor energía de red? b) ¿Cuál tendrá mayor punto de fusión?
Tabla 3. Puntos de fusión de los cloruros de los elementos alcalinos. Cuanto mayor es el catión, la fuerza del enlace es menor, y el punto de fusión, también.
En 1916, Lewis propuso que la formación de un enlace covalente se produce por compartición de pares de electrones externos. Tiene lugar entre átomos de elementos no metálicos con una electronegatividad similar (la diferencia es menor de 1,7), dando lugar a la formación de moléculas.
Un átomo puede adquirir la configuración electrónica de gas noble compartiendo electrones con otros átomos (regla del octeto). Los electrones compartidos (uno o varios pares) se llaman enlazantes, los cuales, una vez formado el enlace, pertenecen a la vez a los dos átomos que se unen, mientras que los electrones que no participan en el enlace se llaman no enlazantes.
Por ejemplo, la configuración electrónica del cloro es 1s
2s
p
3s 2 3p 5 Así, al cloro solo le falta un electrón para completar el octeto 3s 2 3p 6 en su capa de valencia. Si dos átomos de cloro aportasen un electrón cada uno y compartieran el par de electrones, ambos conseguirían tener los electrones necesarios y el resultado sería una molécula Cl2
Enlace covalente normal: enlaces simples, dobles y triples

En todo tipo de unión covalente, los átomos quedan enlazados mediante pares de electrones comunes. Si los átomos comparten un solo par de electrones, forman un enlace simple o sencillo; si comparten dos pares de electrones, forman un enlace doble, y si comparten tres pares de electrones, constituyen un enlace triple.

La formación de un enlace doble o triple implica una unión más fuerte entre los átomos, ya que al aumentar los pares de electrones compartidos, se incrementan las fuerzas de atracción entre estos y los núcleos. En un enlace múltiple, la distancia entre los núcleos (longitud de enlace) es menor que en un enlace sencillo y la energía de disociación (energía necesaria para romper el enlace) es mayor que en un enlace simple.
• El ejemplo más sencillo de enlace covalente simple es la combinación de dos átomos de hidrógeno para formar una molécula de H2. Cada átomo de hidrógeno necesita un electrón para tener su capa de valencia completa; por este motivo, los dos átomos de hidrógeno comparten mutuamente sus electrones.
El par compartido pertenece a ambos, cada átomo de hidrógeno ha ganado un electrón y ha adquirido la configuración electrónica del helio. Una vez que se ha formado el enlace covalente, los dos electrones enlazantes son atraídos por los dos núcleos, en vez de por uno, y por ello, el estado enlazado es más estable que el no enlazado.
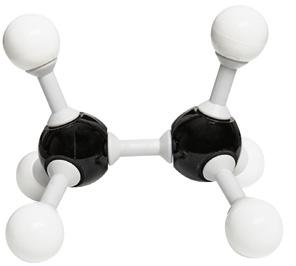
• El ejemplo más sencillo de enlace covalente doble es la combinación de dos átomos de oxígeno para formar una molécula de O2; en este caso, se comparten dos pares de electrones.
En átomos polielectrónicos, solo participan los electrones de valencia en la formación de enlaces covalentes. Los pares de electrones de valencia que no participan en el enlace, o electrones no compartidos, se denominan pares solitarios.
En las sustancias covalentes más habituales, cada átomo que toma parte en la formación de un enlace contribuye al par compartido con un electrón. En otros casos, el par de electrones compartido entre dos átomos puede haber sido aportado solo por uno de ellos; este tipo de enlace se denomina enlace covalente dativo o coordinado.
El enlace coordinado es solo un medio para lograr la estructura adecuada, pero una vez establecida, la unión es indistinguible del enlace covalente común. El enlace dativo o coordinado se representa mediante una flecha " que se origina en el átomo que aporta los dos electrones al enlace. Un ejemplo es el dióxido de azufre:
En el SO2, cada uno de los átomos que intervienen tiene seis electrones de valencia. Para que todos los átomos consigan la configuración de gas noble, se produce la unión de un átomo de oxígeno con un átomo de azufre mediante una covalencia dativa de este.
Las representaciones gráficas que se utilizan en la descripción de las moléculas de los compuestos covalentes se denominan estructuras de Lewis. Así mismo, permiten explicar también los enlaces iónicos.
G. Lewis introdujo un simbolismo muy útil que consiste en representar por un punto (o una pequeña cruz) cada uno de los electrones de la capa de valencia rodeando el símbolo del elemento; el par electrónico compartido se indica con líneas o como pares de puntos entre átomos, y los pares libres, no compartidos, se señalan como pares de puntos o líneas en los átomos individuales.
Algunos ejemplos de estructuras de Lewis son:
10 El dióxido de azufre (SO2) es un gas incoloro que resulta irritante a concentraciones elevadas. Se trata de un contaminante primario cuyo origen hay que buscarlo en los procesos de combustión de combustibles fósiles. ¿Cuáles son los principales focos emisores de SO2? Investiga y enumera los efectos del SO2 sobre la salud de las personas. ¿Qué tipo de medidas preventivas se podrían tomar para reducir la contaminación por SO2 y contribuir en la consecución de las metas 3.9 y 12.4 de los objetivos de desarrollo sostenible?

La representación de las estructuras de Lewis para moléculas sencillas no plantea dificultades. Sin embargo, para moléculas e iones más complejos conviene seguir una serie de reglas que facilitan la resolución del problema planteado:
1. Hacemos un balance del número de electrones de valencia que cada átomo aporta a la molécula. Todos ellos deben aparecer en la estructura final, bien como electrones enlazantes o como pares solitarios. Si se trata de un anión, además hay que sumar tantos electrones como cargas tenga, y si es un catión, se quitan tantos electrones como cargas. Así, en el caso del SO42− y del H3O+, tenemos:
SO42− : [1 · 6 (S)] + [4 · 6 (O)] + 2 = 32 e
H3O+ : [3 · 1 (H)] + [1 · 6 (O)] − 1 = 8 e
2. Representamos la posición relativa de los átomos unidos por enlaces sencillos. Elegimos el átomo de mayor covalencia o menos electronegativo como átomo central y el resto de los átomos los ponemos alrededor de él.
3. Se colocan rodeando cada átomo pares de electrones de acuerdo con la regla del octeto. Es decir, para el H2O, por ejemplo:
4. Si el átomo central no cumple la regla del octeto porque hay pocos electrones para distribuir, formamos enlaces dobles o triples hasta que su capa de valencia esté completa. Por ejemplo, para el HCN.
5. Calculamos el número de electrones compartidos (EC) como la diferencia entre el número de electrones necesarios para que todos los átomos alcancen la configuración óptima (8 o 2 e ) (EN) y el número de electrones de valencia disponibles (ED). Tenemos: EC = EN − ED.
6. Calculamos también el número de electrones no compartidos o solitarios (ES) como la diferencia entre los electrones disponibles (ED) y los electrones compartidos (EC), así ES = ED − EC.
En general, el número de enlaces en una especie química viene dado por:
úmerodeenlaces 2 EN –ED N=
Ejercicios
11 Representa mediante estructuras de Lewis las siguientes moléculas: H2O, HF, H2, CH4 y NH3
12 Dadas las moléculas HCl, KF, CH2Cl2 y CCl4, escribe las estructuras de Lewis.
13 Dadas las siguientes sustancias: CO2, CF4, H2CO, escribe las estructuras de Lewis de sus moléculas.
14 Describe, razonadamente, las estructuras de Lewis de las siguientes moléculas: S2C, HCN y SiO44−
En algún momento nos hemos encontrado, comiendo almendras, alguna amarga. Este sabor tan desagradable es debido a la amigdalina, un compuesto de cianuro y glucosa que, a grandes dosis, resulta muy perjudicial para nuestro organismo. Cuando comemos una almendra amarga ponemos en contacto ambos compuestos, cuyo resultado es la descomposición de la amigdalina en ácido cianhídrico (HCN), D-glucosa y benzaldehído.

15 Considera las sustancias Br2,HF, Al y KI. Contesta, razonadamente, a las siguientes cuestiones:
a) Indica el tipo de enlace presente en cada una de ellas.
b) Escribe las estructuras de Lewis de aquellas que sean covalentes.
16 Escribe las estructuras electrónicas de Lewis de las siguientes sustancias: F , NH4+, etano, eteno y etino.
Excepciones a la regla del octeto
La regla del octeto tiene sus limitaciones. Estas excepciones son fundamentalmente de tres tipos:
Si una molécula tiene un número impar de electrones, ninguna estructura puede cumplir la regla del octeto. En moléculas como ClO2 (19 e ), NO (11 e ) y NO2 (17 e ), el número total de electrones de valencia es impar. Es imposible aparear totalmente y lograr un octeto alrededor de cada átomo.
Las especies con un número impar de electrones se denominan radicales y son muy reactivas, porque pueden utilizar el electrón desapareado para formar un nuevo enlace.
17 El smog fotoquímico resulta de la combinación de óxidos de nitrógeno y compuestos orgánicos volátiles que, tras ser catalizados por la radiación solar, generan nitratos y ozono troposférico. Investiga, haciendo uso de herramientas TIC, acerca de los efectos perjudiciales del smog fotoquímico en la salud de las personas. Indica qué medidas se podrían adoptar para alcanzar las metas 13.1 y 13.2 de los objetivos de desarrollo sostenible.
18 Dibuja las estructuras de Lewis para los siguientes compuestos: a) AlI3, b) IF5, c) SeF4
Algunos elementos ligeros como el Be, B y Al forman compuestos en los que hay menos de ocho electrones alrededor del átomo central. Incumplen la regla del octeto por defecto. Algunos ejemplos de hipovalencia son el BF3, BeF2 y BH3.
19 ¿Qué especies tienen un número impar de electrones: a) Br, b) OH , c) PCl2, d) PCl3?
20 ¿Qué especies son deficientes en electrones: a) BeH2, b) CH3+, c) CH4, d) NH3, e) NH4+?
En algunas moléculas, el átomo central incumple la regla del octeto por exceso, el octeto está expandido.
Los átomos de elementos del tercer período de la tabla periódica, y de elementos posteriores, forman algunos compuestos en los que hay más de ocho electrones alrededor del átomo central (el átomo dispone de orbitales d en el mismo nivel y es posible la promoción electrónica). Por ejemplo, en el SF6, cada uno de los seis electrones de valencia del azufre forma enlace covalente con un átomo de flúor, de esta manera hay doce electrones, seis pares en total alrededor del átomo de azufre.
Otros ejemplos son: PCl5, SF6, I3 y ClF3
Cuando el enlace covalente se establece entre dos átomos cuya electronegatividad es diferente, el más electronegativo desplaza el par electrónico hacia él, adquiriendo cierta carga negativa δ–. Por otro lado, el menos electronegativo adquirirá cierta carga positiva δ+, originándose un dipolo eléctrico.
El dipolo se simboliza por medio de +
donde la flecha apunta hacia el polo negativo. La polaridad en un enlace covalente se mide a través del momento dipolar, representado por la letra griega μ
En esta expresión, q es la carga efectiva y d es la distancia entre los centros de cargas opuestas.
La unidad del momento dipolar en el sistema internacional es el C · m, aunque normalmente se utiliza el Debye (D) en honor a Peter Debye, que realizó los primeros trabajos sobre polaridad molecular (1D = 3,3 · 10−30 C · m).
El momento dipolar es una magnitud vectorial que mide también el carácter iónico de un enlace covalente, ya que está relacionado con la diferencia de electronegatividades.
El momento dipolar de las moléculas diatómicas homonucleares (átomos iguales) es cero, puesto que la diferencia de electronegatividades es nula y no existe desplazamiento de carga (H2, O2, N2).
Para que una molécula sea polar, es necesario, pero no suficiente, que contenga enlaces covalentes polarizados. Cuando en una molécula polar hay más de un enlace, el momento dipolar molecular es la suma vectorial de los momentos dipolares de enlace; por ello, es necesario para determinarlo, conocer la geometría molecular y los ángulos de enlace.
Las moléculas con polaridad en el enlace pero cuya suma vectorial de momentos dipolares de enlace es cero no son polares n 0 = . Este es el caso de moléculas lineales, como la de CO2 ; de moléculas triangulares, como el BF3 , o de moléculas tetraédricas con cuatro enlaces iguales, como el CH4
Las moléculas angulares (SO2) y piramidales (NH3) con polaridad en el enlace presentan siempre momento dipolar molecular ( n 0 = Y ).
Momentos dipolares de las moléculas de HF y F2
21 ¿Cuál es el origen de la polaridad en los enlaces covalentes? Justifica la polaridad de las moléculas de BCl3 y NCl3
22 Para las moléculas H2O, NH3, CH4 y HCl, indica, razonando la respuesta: a) la estructura de Lewis, b) la polaridad.
23 Dadas las moléculas de CH4, NH3, Cl2 y CO2: a) clasifícalas en polares o apolares, b) ¿qué compuesto formará una molécula tetraédrica?
24 Considera las siguientes especies químicas de las que se indica su geometría entre paréntesis: Cl4 (tetraédrica), HCN (lineal) y BF3 (trigonal). a) Representa la estructura de Lewis de cada una de dichas especies. b) Justifica la polaridad de cada una.
25 Justifica si las moléculas PCl3, OF2, H2CO y CH3Cl son polares o apolares.
Determinación de la polaridad de una molécula
Para establecer la polaridad de una molécula, se debe:
1. Obtener las estructuras óptimas de Lewis y aplicar el método RPECV para determinar su geometría.
2. Identificar los enlaces polarizados.
3. Sumar vectorialmente los momentos dipolares de todos los enlaces individuales. Se obtiene así la resultante, que determinará el momento dipolar molecular. Este será reforzado o debilitado por la presencia de pares de electrones no enlazantes sobre el átomo central.
3.5. Parámetros moleculares, o de enlace
Se llaman parámetros de enlace a aquellas propiedades características de los enlaces que dependen de los átomos específicos que se enlazan pero que varían de compuesto a compuesto. Son cuatro:
Longitud del enlace
Se define como la distancia media de separación entre los núcleos de los átomos enlazados. También se puede definir como la distancia internuclear en la que el compuesto es más estable (mínima energía). Al aumentar la multiplicidad del enlace, se reduce la longitud de enlace.
Orden del enlace
Indica el número de enlaces covalentes que se forman entre dos átomos.
Energía del enlace
Se define como la energía desprendida en la formación de un mol de enlaces covalentes entre dos átomos en estado gaseoso. Existe una relación entre la energía de enlace y la fortaleza del enlace. A mayor número de enlaces, la energía de enlace es mayor.
Ángulo del enlace
Es el ángulo formado por las líneas imaginarias que unen los núcleos de los átomos.
Una molécula presenta resonancia (antiguamente denominada mesomería) si puede representarse por más de una estructura de Lewis.
A veces las propiedades de una molécula se interpretan mejor suponiendo que su distribución electrónica es intermedia entre varias estructuras de Lewis. Así, para el ozono, O3, tenemos dos fórmulas equivalentes:
Las dos estructuras de resonancia del ozono tienen idéntica energía y participan por igual en la descripción del híbrido.
Los experimentos muestran que la estructura real es una media de las dos. A esta media se la llama resonancia y la estructura resultante es un híbrido de resonancia.
La OMS ha establecido que cuando la concentración de ozono, O3, en el aire que se respira es superior a 240 μg · m –3 existe un claro riesgo para la salud. El calor, el sol y la contaminación producida por la industria y el tráfico son los factores más importantes que contribuyen a aumentar la formación de ozono en el aire que se respira. Debemos, en este sentido, fijar la atención en controlar dichos factores para lograr la meta 3.9 propuesta por la ONU en sus ODS para el año 2030.
Las estructuras de resonancia solo se diferencian en la asignación de la posición de los pares electrónicos, nunca en las posiciones de los átomos. La resonancia entre varias estructuras se indica mediante una flecha de dos puntas (↔).
El híbrido de resonancia tiene una energía menor que cada una de las formas resonantes, y cuanto mayor sea el número de estructuras resonantes, mayor será la estabilidad de la molécula.
Esta diferencia de energía recibe el nombre de energía de resonancia.
A diferencia del enlace iónico, el enlace covalente, según se establezca entre átomos que forman moléculas discretas (aisladas) o redes tridimensionales, hace que las sustancias presenten propiedades muy diferentes.
Están formadas por moléculas que, en determinadas condiciones de presión y temperatura, pueden unirse entre sí formando cristales moleculares. Los átomos de estas moléculas están unidos por enlaces covalentes fuertes, pero las fuerzas entre las moléculas son débiles. Estas fuerzas intermoleculares son las responsables de las propiedades de este tipo de sustancias y las estudiaremos al final de la unidad.
Las propiedades de estas sustancias son:
• Estado de agregación: tienen baja densidad y son gases, líquidos volátiles o sólidos blandos de bajo punto de fusión o que subliman fácilmente.
• Solubilidad: depende de las fuerzas intermoleculares que sus moléculas puedan establecer con las moléculas del disolvente. La sustancia se disolverá si las fuerzas entre sus moléculas y las del disolvente son más intensas que las fuerzas de sus moléculas entre sí.
• Conductividad eléctrica: no conducen la corriente eléctrica debido a que los electrones compartidos en los enlaces covalentes están muy unidos y no pueden desplazarse. Algunos cristales moleculares disueltos en agua se ionizan y la disolución se vuelve conductora.
Sustancias atómicas
En estas sustancias, todos los átomos están unidos mediante enlaces covalentes formando una red cristalina estable (cristal atómico). Son sustancias covalentes atómicas el diamante o el grafito (C), el cuarzo (SiO2)…

Las propiedades que presentan estas sustancias vienen caracterizadas por:
• Estado de agregación: son sólidos con puntos de fusión generalmente elevados y muy duros (con algunas excepciones, como el grafito). Para fundir una cantidad pequeña de sustancia, es necesario romper una gran cantidad de enlaces.
• Solubilidad: son insolubles en cualquier disolvente.

• Conductividad eléctrica: al no tener electrones libres, son malos conductores de la electricidad, a excepción del grafito (tiene electrones libres entre las láminas de carbono).

Una de las teorías cuánticas más importantes sobre el enlace covalente es la teoría del enlace de valencia (TEV). La teoría de enlace covalente de Lewis-Langmuir se basaba en las teorías atómicas clásicas del modelo de Bohr-Sommerfeld, que se introdujeron con anterioridad a la llegada de la mecánica cuántica. Por otro lado, las estructuras de Lewis no proporcionan información acerca de los orbitales que son ocupados por los electrones ni la energía de estos en las moléculas.
La teoría del enlace de valencia fue propuesta por Linus Pauling y J. C. Slater y explica los enlaces covalentes en términos de orbitales atómicos. Supone que los electrones de una molécula ocupan los orbitales atómicos de los átomos individuales y los enlaces se forman como consecuencia del solapamiento de los orbitales atómicos.
En la teoría del enlace de valencia (TEV), un enlace covalente sencillo entre dos átomos se forma por solapamiento de orbitales atómicos que tengan electrones desapareados y con espines antiparalelos (espines opuestos). El solapamiento permite a ambos electrones compartir el espacio común entre los núcleos y formar el enlace covalente. Los electrones de la región de solapamiento son atraídos simultáneamente por ambos núcleos, lo que mantiene unidos a los átomos en el enlace.
La simetría de los orbitales moleculares formados por solapamiento de los orbitales atómicos depende del tipo de orbitales atómicos que participen en el enlace y de qué manera solapen. Las dos superposiciones más frecuentes son:
Enlace tipo sigma (σ)
Se da cuando los orbitales atómicos solapan frontalmente. Se refiere a las superposiciones producidas en el segmento que une los núcleos de los átomos. La región de densidad electrónica máxima rodea al eje internuclear. Se da entre orbitales atómicos s-s (H—H), s-p (H—Cl) y p-p (Cl—Cl).
Los enlaces establecidos son estables y permiten la rotación de los átomos respecto al eje de giro. Todos los enlaces covalentes sencillos consisten en un enlace sigma (σ). En este tipo de enlace, dos electrones apareados se encuentran entre los dos átomos.
John Clarke SlaterJ. C. Slater (1900-1976) impartió clase de física durante casi 30 años en el Instituto de Tecnología de Massachusetts (MIT). Realizó aportaciones importantes en el cálculo de las funciones matemáticas que describen los orbitales atómicos.

Las estructuras de Lewis no nos dicen nada acerca de la forma de una molécula, solo indican las localizaciones aproximadas de los electrones de enlace y los pares solitarios de la molécula.
Solapamiento frontal de orbitales atómicos para dar enlaces tipo σ.
Enlace tipo pi (π)
Se produce cuando los orbitales atómicos solapan lateralmente. Se da entre orbitales atómicos p-p. El enlace π no rodea completamente el eje internuclear, deja una zona de densidad electrónica nula. No puede existir un giro de un átomo con respecto al otro, ya que la zona de solapamiento entre las nubes electrónicas desaparecerían y se rompería el enlace. El plano de simetría, en el cual la probabilidad de encontrar el electrón es nula, se denomina plano nodal (π).
Los enlaces sigma (σ) son más estables que los enlaces pi (π).
4.2. Ejemplos de la teoría del enlace de valencia (TEV)
Molécula de hidrógeno (H2)
La configuración electrónica del hidrógeno es 1s1. El hidrógeno formará un enlace sencillo, puesto que tiene un electrón desapareado. El enlace es de tipo σ y se consigue por solapamiento frontal de los dos orbitales atómicos (OA) semillenos de los dos hidrógenos.
Molécula de oxígeno (O2)
La configuración electrónica del oxígeno es 1s 2 2s 2 2px 2 2py 1 2pz1. El oxígeno formará dos enlaces, puesto que tiene dos electrones desapareados. El primero será un enlace tipo σ entre los orbitales 2py de cada átomo, pero el segundo tendrá que ser lateral (enlace tipo π) entre los orbitales 2pz. Esta superposición lateral es menor, lo que da lugar a enlaces más débiles.
El enlace entre los átomos de oxígeno es doble, pero los dos enlaces no son iguales; el enlace sigma (σ) es más fuerte que el enlace pi (π).
Solapamiento lateral de dos orbitales atómicos p para dar un enlace π
Formación de una molécula de H2 y otra de O2
Ejercicios
26 Responde a las siguientes cuestiones:
a) ¿En qué se basa la teoría del enlace de valencia?
b) ¿En qué se diferencia la TEV del concepto de Lewis sobre el enlace químico?
27 ¿Cuándo se forman los enlaces tipo sigma (σ)? ¿Y los enlaces tipo pi (π)?
28 Explica la existencia de moléculas de N2 y PCl5 según la teoría del enlace de valencia (TEV).
Las discrepancias surgidas entre los ángulos de las moléculas predichos por la teoría del enlace covalente y los ángulos medidos experimentalmente se resuelven mediante la teoría de hibridación de orbitales atómicos. Esta teoría fue planteada por Pauling y Slater, y utiliza como herramienta fundamental el concepto de orbital híbrido (OH).
5.1. Hibridación: concepto y tipos
La hibridación es el proceso mediante el cual orbitales atómicos puros de energía parecida se combinan entre sí, transformándose en otros orbitales denominados orbitales atómicos híbridos (OH).
Estos orbitales híbridos se caracterizan por:
1. Se forman tantos orbitales híbridos como orbitales atómicos puros se combinan.
2. Los orbitales híbridos de un mismo tipo son de igual energía y forma, pero distintos en orientación espacial.
3. Los enlaces que se obtienen con ellos son más fuertes que utilizando orbitales atómicos puros.
4. Los ángulos entre ellos son iguales y dirigidos de manera que facilitan el solapamiento con los orbitales del otro átomo al formar el enlace.
Hibridación sp
Para estudiar esta hibridación, vamos a utilizar como ejemplo la molécula de BeF2. La configuración electrónica del F es 1s 2 2s 2 2p5, y la del Be, [He] 2s 2 . A cada una le corresponden los siguientes diagramas para los electrones de valencia:
La falta de electrones desapareados del Be impide en un principio la formación de enlaces, pero la cercanía energética de sus orbitales 2s y 2p permite promocionar un electrón de un orbital 2s a un orbital 2p (estado excitado).
El berilio tiene dos orbitales disponibles para formar enlaces con los átomos de flúor, pero estos enlaces Be—F no serían idénticos, y los experimentos demuestran que esos enlaces son equivalentes. Para lograrlo, los orbitales 2s y 2p del Be se deben combinar para dar lugar a dos orbitales híbridos sp equivalentes, cada uno de los cuales se combina con un orbital p del F que tiene un electrón desapareado, formándose la molécula de BeF2
29 Dadas las siguientes sustancias CO2, CF4, H2CO y HF: a) escribe las estructuras de Lewis de sus moléculas, b) explica sus geometrías utilizando la teoría de hibridación.
Datos: Números atómicos: H = 1, C = 6, O = 8, F = 9.
















30 Para las moléculas BF3 y CHF3: a) establece sus estructuras de Lewis, b) establece su geometría molecular, indicando la hibridación del átomo central.
Datos: Números atómicos: H = 1, B = 5 , C = 6, F = 9
31 Organizo y defiendo la postura. Justifica si son verdaderas o falsas las siguientes afirmaciones: a) una molécula que contenga enlaces polares es necesariamente polar, b) un orbital híbrido sp 2 se obtiene por combinación de dos orbitales s y dos orbitales p, c) los compuestos iónicos en disolución acuosa son conductores de la electricidad.
Un kilogramo de hidrógeno (H2) puede liberar más energía que un kilogramo de cualquier otro combustible (casi el triple que la gasolina o el gas natural) y para liberar esa energía no emite nada de dióxido de carbono (CO2), tan solo vapor de agua (H2O). De esta manera se consigue que el impacto ambiental sea nulo, contribuyendo a conseguir los ODS 7 y 13 propuestos por la ONU.
Hibridación sp 2
Para estudiar este tipo de hibridación, consideramos la molécula de AICl3 , para la cual la teoría RPECV predice una geometría plana trigonal. La configuración electrónica del aluminio: [He] 2s 2 2p 1 y la del Cl: [Ne] 3s
3p
32 ¿Qué te hace decir eso? Explica, razonadamente, si la siguiente afirmación es verdadera: «El BF3 es un compuesto en el que el átomo de boro presenta hibridación sp 3 ».
En este caso, promociona un electrón 3s a un orbital vacío 3
Se combina el orbital 3s con los dos orbitales 3p del Al y se generan tres orbitales híbridos sp2, que están orientados hacia los vértices de un triángulo equilátero (ángulos de 120º), los cuales se solapan con los orbitales 3p del Cl dando lugar a la molécula de AlCl3
33 a) Deduce la estructura de Lewis del ácido cianhídrico (HCN) y del metanal (H2CO). b) Indica en ambas moléculas, cuál es la hibridación de orbitales atómicos que presenta el átomo de carbono.
Formación de la molécula de AlCl3
Hibridación sp 3
Tomamos como ejemplo el metano, CH4. La configuración electrónica del C: [He] 2s 2 2px 1 2py 1 y la del H: 1s 1


























En este caso, promociona un electrón 2s del C a un orbital vacío 2p
Se combina el orbital 2s con los tres orbitales 2p del C y se generan cuatro orbitales híbridos sp3, que están orientados hacia los cuatro vértices de un tetraedro regular formando ángulos de 109,5 º; los cuales, al solaparse con dos orbitales 1s del H generan los cuatro enlaces idénticos de la molécula de CH4
¿Sabías
El trabajo por el cual Carl Linus Pauling (1901-1994) recibió su primer Premio Nobel trataba de aspectos relacionados con la estructura molecular. Fue pionero en utilizar los principios de la teoría cuántica para explicar la estructura molecular basada en el concepto de enlace de valencia, así como otros conceptos relacionados con este, que le permitieron calcular las energías de enlace, su forma, longitud, ángulo y propiedades magnéticas. Utilizó técnicas de rayos X y creó una escala que permitía predecir las fuerzas de enlace.

Formación de la molécula de CH4.
Las propiedades de las sustancias moleculares están determinadas no solo por los átomos que forman sus moléculas, sino también por la forma en que estos átomos se distribuyen en el espacio. Ambos factores hacen que a dicha molécula le corresponda una geometría molecular determinada caracterizada por sus correspondientes parámetros moleculares: longitudes y ángulos de enlace.
La geometría molecular es la distribución tridimensional de los átomos de una molécula. La geometría que adopta una molécula es aquella en la que la repulsión electrónica es mínima.
Para explicar la geometría molecular, se utiliza la TRPECV. Se trata de un modelo puramente electrostático, que considera los electrones como si fuesen cargas puntuales. Según este modelo, todos los electrones alrededor del átomo central, tanto los pares enlazantes como los pares solitarios, se disponen alrededor del átomo central de forma que experimenten la mínima repulsión.
Postulados
Los postulados básicos del modelo RPECV son:
1. El factor determinante de la geometría de una molécula es el número de pares de electrones de valencia (enlazantes y no enlazantes) alrededor del átomo central.
2. Los pares de electrones (compartidos y no compartidos) se repelen entre sí y se distribuyen espacialmente a la mayor distancia angular posible. El poder de repulsión no es igual entre todos ellos: los pares no enlazantes tienen mayor poder de repulsión; por ello, la repulsión más intensa se da entre estos pares, después, entre un par no enlazante y uno enlazante, y la menor se establece entre los pares enlazantes.
3. Los pares de electrones no compartidos (no enlazantes) ocupan mayor lugar en el espacio que los pares de electrones compartidos (enlazantes).
4. Para la determinación de la geometría molecular, los dobles y los triples enlaces se consideran simples. Todos son zonas de alta densidad electrónica que tienden a repelerse entre sí.
6.2. Predicción de la geometría molecular
Para predecir la geometría molecular en el modelo RPECV:
1. Se escribe la estructura óptima de Lewis para la molécula o ion estudiado.
2. Se cuenta el número de zonas de alta densidad electrónica en torno al átomo central sin distinguir entre enlaces y pares de electrones solitarios.
3. Se representan gráficamente las orientaciones espaciales de mínima repulsión (los pares no compartidos ocupan más espacio que los compartidos).
4. Se colocan los átomos que rodean al átomo central en los extremos de las nubes electrónicas.
5. Se obtiene la geometría molecular a partir de la disposición espacial de los núcleos de los átomos presentes (no de las nubes electrónicas). La geometría real se predice teniendo en cuenta las distorsiones angulares generadas por los diferentes pares de enlace o pares solitarios.
34 Escribe la estructura de Lewis de cada una de las siguientes moléculas y predice, justificando la respuesta, su geometría molecular: PCl3, OF2, H2CO, CH3Cl. Datos: Números atómicos: H = 1, C = 6, O = 8, F = 9, P = 15, Cl = 17.
35 a) Escribe la estructura de Lewis para las moléculas NF3 y CF4, b) dibuja la geometría de cada molécula según la teoría de repulsión de pares de electrones de la capa de valencia, c) considerando las geometrías moleculares, razona acerca de la polaridad de ambas moléculas.
36 ¿Qué geometría tendrán las moléculas C2, NH3 y CF4? ¿Cuáles de ellas tienen momento dipolar no nulo?
Repulsiones electrónicas
Se cierra el ángulo
180°
104,5°
Las repulsiones electrónicas entre los pares no enlazantes y enlazantes-no enlazantes en la molécula de agua hacen que el ángulo «teórico» de 180 º se cierre, quedando en un ángulo real de 104,5 º. Así, la geometría molecular es angular y no lineal.
6.3. Geometría de moléculas cuyo átomo central carece de pares de electrones solitarios
Supondremos que las moléculas o iones moleculares contienen dos elementos diferentes A y B, donde A es el átomo central (este es el que tiene mayor valencia covalente). El hidrógeno es siempre periférico.
Si no hay pares de electrones solitarios, la geometría electrónica coincide con la geometría molecular. La fórmula general de estas moléculas es ABn, donde n puede variar de 2 a 6.
Molécula de tipo AB2
Las moléculas del tipo AB2 son lineales, con un ángulo de enlace de 180º. La geometría lineal se produce cuando el átomo central A está rodeado por dos grupos de electrones o zonas de alta densidad electrónica.
Algunos ejemplos de moléculas o especies iónicas con esta geometría son MgCl2, CO2, BeH2, CdBr2 y N3
Molécula de tipo AB3
Las moléculas de tipo AB 3 son planas y trigonales, con ángulos de enlace de 120º. La geometría plana trigonal se da cuando el átomo central A está rodeado por tres grupos de electrones. Hay tres zonas de alta densidad electrónica orientadas hacia los vértices de un triángulo equilátero.
Algunos ejemplos de moléculas o especies iónicas con esta geometría son BCl3, NO3 , CO32−, BI3 y BH3
Molécula de tipo AB4
Las moléculas de tipo AB4 son tetraédricas, con ángulos de enlace de 109,5º. La geometría tetraédrica tienen lugar cuando el átomo central A está rodeado por cuatro grupos de electrones. Hay cuatro zonas de alta densidad electrónica en torno al átomo central A que se orientan hacia los vértices de un tetraedro. Son moléculas tridimensionales.
Algunos ejemplos de moléculas o especies iónicas con esta geometría son CH4, NH4+, CCl4, SO42–.
Molécula de tipo AB5
El caso más común es la geometría tipo bipirámide trigonal. Hay cinco zonas de alta densidad electrónica en torno al átomo central A que se orientan hacia los vértices de una bipirámide trigonal. Coexisten dos tipos de ángulos de enlace: unos de 120º y otros de 90º. Un ejemplo de molécula con esta geometría es el PCl5
Molécula de tipo AB6
Las moléculas del tipo AB6 tienen una forma octaédrica con ángulos de enlace de 90º. Hay seis zonas de alta densidad electrónica en torno al átomo central A que se orientan hacia los vértices de un octaedro. Ejemplos de una molécula y un grupo aniónico con esta geometría son SF6, PCl6
6 Teoría de repulsión de los pares electrónicos de la capa de valencia
La presencia de pares no enlazantes en una molécula varía el ángulo de enlace por efecto de la repulsión electrónica y, por tanto, modifica la geometría molecular predicha por el modelo. Los ángulos de enlace disminuyen a medida que aumenta el número de pares de electrones no enlazantes o solitarios.
Si usamos el símbolo X para describir los pares de electrones no enlazantes del átomo central, la fórmula general de estas moléculas será ABnXm donde n = 2, 3 y m = 1 o 2.
Molécula de tipo AB2X
El ángulo de enlace de las moléculas del tipo AB2X es algo menor de 120 º porque los pares de electrones no compartidos ejercen una mayor fuerza de repulsión que los pares de electrones enlazantes y por este motivo el ángulo de enlace se cierra un poco. En este caso tenemos tres nubes electrónicas, una de las cuales es un par de electrones solitarios. El tipo de geometría que corresponde a estas moléculas es angular. Algunos ejemplos son SO2, O3, NO2 , SnCl2, IBr2 , ClO2
Molécula de tipo AB3X
El ángulo de enlace de estas moléculas es menor que 109,5º por el mismo motivo que en el caso anterior. Ahora tenemos cuatro nubes de electrones, una de las cuales es un par de electrones solitarios. El tipo de geometría que corresponde a las moléculas AB3X es una geometría de pirámide trigonal. Algunos ejemplos son NH3, H3O+, AsH3, PH3, NF3, PBr3, PF3 y ClO3
Molécula de tipo AB2X2
En este caso tenemos cuatro nubes electrónicas, dos de las cuales corresponden a pares solitarios. Los dos pares solitarios producen una mayor repulsión, lo que se traduce en que las nubes enlazantes se cierren y su ángulo de enlace sea menor que en el caso AB3. El tipo de geometría que corresponde a las moléculas AB2X2 es una geometría angular. Algunos ejemplos de moléculas con esta geometría son H2O, H2S y SF2
1 Considera las moléculas OF2, BF3, CCl4 y C2H2. Responde a las siguientes cuestiones: a) escribe sus representaciones de Lewis, b) indica sus geometrías moleculares utilizando la teoría RPECV.
Solución
b) OF2: geometría angular, BF3: geometría plana triangular, CCl4: geometría tetraédrica, C2H2: geometría lineal.
37 Dadas las moléculas HCN, F2O, NH3, NCl3, SiCl4, BCl3, responde razonadamente a las siguientes cuestiones: a) representa la estructura de Lewis de cada una de ellas, b) predice su geometría molecular, c) explica en cada caso si la molécula tiene o no momento dipolar. Datos: Números atómicos: H = 1, C = 6, N = 7, O = 8, F = 9, Si = 14, Cl = 17.
7.1. Modelo del gas de electrones, o modelo de Drude
Es un modelo sencillo que no está basado en la mecánica cuántica. Los metales tienen una baja energía de ionización, por tanto, tienden a perder electrones para quedarse con la capa más externa completa (regla del octeto). Según Drude, estos electrones no están unidos a ningún átomo en particular y tampoco forman pares, sino que están deslocalizados (quedan libres) por la red cristalina. Estableció así un modelo según el cual podemos considerar un metal como un conjunto de cationes metálicos formando una red cristalina en cuyo interior hay una nube de electrones de valencia que se mueven libremente actuando como unión entre los iones positivos. La atracción electrostática entre los electrones y los cationes mantiene fuertemente unidos a todos los átomos del metal.
Los cationes positivos de los metales forman una red tridimensional de esferas ordenada y compacta (son estructuras típicas la red cúbica compacta y la hexagonal compacta). El hecho de que los cationes formen una red muy compacta se refleja en números de coordinación muy altos (cada ion está rodeado de muchos iones de signo contrario) y elevados porcentajes de ocupación de los cationes con relación al volumen total del cristal.
Red cúbica compacta
Enlace metálico según el modelo de Drude.
Este modelo explica algunas propiedades de los metales, por ejemplo, la conductividad eléctrica, el brillo metálico, la baja energía de ionización, etc., pero no otras, como el comportamiento de los semiconductores. Estas limitaciones son resueltas por los modelos cuánticos, como la teoría de bandas.
La teoría de bandas es un modelo cuántico que se basa en la aplicación de la teoría de los orbitales moleculares al caso de los metales.
A medida que aumenta el número de orbitales atómicos, aumenta el número de orbitales moleculares, y si este es lo suficientemente grande, los niveles de energía se suceden de manera casi continua dando lugar a bandas de energía.
Como en la teoría de Drude, los electrones de valencia que ocupan un orbital molecular pertenecen a todo el conjunto, estando completamente deslocalizados.
Teoría de bandas para el magnesio (Z = 12): 1s2 2s2 2p6 3s2
Analicemos el caso del magnesio según esta teoría. Cada átomo tiene dos electrones de valencia situados en el orbital 3s, quedando los orbitales 3p vacíos.
Si consideramos el metal como muchos átomos de magnesio juntos, podemos imaginar la aparición de bandas, formadas por muchos orbitales superpuestos. Una banda, correspondiente a la superposición de los orbitales 3s, estará llena de electrones y se llamará banda de valencia, y otra banda compuesta por los orbitales del subnivel 3p estará vacía y se denominará banda de conducción.
Dichas bandas, en general, están separadas por regiones de energía prohibidas (denominadas «gap»), aunque en algunos casos se puede producir la superposición entre bandas con solapamiento energético.
Banda de valencia
Red
Banda de conducción
Magnesio
Bandas de valencia y de conducción para el magnesio.
Con esta teoría se puede comprender fácilmente el comportamiento como conductores, semiconductores, aislantes y superconductores que muestran estos elementos. La distancia energética entre las bandas de valencia y las bandas de conducción determina las diferencias de la conductividad eléctrica.
38 Dibuja el diagrama de banda de valencia y de conducción para los siguientes metales:
a) Na (Z=11),
b) Li (Z=3)
Bandas de conducción eléctrica en conductores, semiconductores y aislantes.
Metales
En un metal, las bandas de valencia y de conducción están muy próximas entre sí; la energía necesaria para que un electrón pase de la banda de valencia a la de conducción es despreciable.
En los metales, la banda de valencia está semillena (los electrones pueden moverse dentro con libertad) o está llena pero solapada con la banda de conducción que está vacía. Tanto en un caso como en otro, los electrones disponen de orbitales moleculares vacíos que se pueden ocupar con el aporte de un mínimo de energía (para que un metal conduzca la corriente, debe ocurrir el salto de electrones de la banda de valencia a la de conducción).
Semiconductores
Estos elementos tienen la banda de valencia llena y la de conducción vacía, y la diferencia de energías entre una y otra es pequeña (la zona prohibida es muy estrecha), de manera que un pequeño incremento de la temperatura es suficiente para promocionar los electrones hacia la banda de conducción (estas especies son conductoras solo bajo ciertas condiciones). Algunos ejemplos de semiconductores son el silicio (Si), el germanio (Ge) y el selenio (Se).
Aislantes
En los elementos aislantes, la banda de valencia y la de conducción están muy alejadas energéticamente. La banda prohibida es tan ancha que ningún electrón puede saltarla. Los electrones no pueden moverse por la banda de valencia ni pueden promocionar a la banda de conducción, no son electrones libres y el sólido no conduce la corriente eléctrica, aunque apliquemos un campo eléctrico externo. Algunos ejemplos de materiales aislantes son el diamante (C) y el óxido de silicio (SiO2).
Se caracterizan porque conducen la electricidad sin resistencia. Los primeros que se descubrieron eran metales que necesitaban temperaturas de 0 K para tener estas características.
Los elementos semiconductores se utilizan frecuentemente en la construcción de componentes electrónicos.

Las propiedades de los metales se pueden explicar gracias a los electrones deslocalizados y a su red cristalina compacta.

Brillo
Al incidir la luz sobre la superficie de los metales, los electrones vibran, por lo que se originan ondas electromagnéticas de la misma frecuencia que la luz incidente, lo que justifica el brillo característico de todos los metales.
Estados de agregación. Puntos de fusión y ebullición Generalmente, los metales son sólidos cristalinos con un número de coordinación elevado, aunque también podemos encontrar metales en estado líquido muy densos como el mercurio.
Los puntos de fusión son muy variables, aunque la mayoría de los metales presentan puntos de fusión altos.
Para fundir el metal, debemos proporcionar el calor suficiente para que el movimiento de vibración de los átomos se haga más intenso. Cuanto más fuertes son los enlaces entre los átomos, mayor será la energía calorífica para separarlos y el punto de fusión será más elevado.
Densidad
Tienen una densidad grande debida a que los cationes metálicos tienen un índice de coordinación elevado.
Los metales son dúctiles (capacidad de deformarse en forma de hilos) y maleables (capacidad de deformarse en forma de láminas), lo que permite trabajar con ellos con relativa facilidad.

Estas propiedades indican que los átomos son capaces de deslizarse unos respecto de los otros.
Los metales son buenos conductores de la electricidad y del calor tanto en estado sólido como fundidos. Los metales conducen la corriente eléctrica debido a que los electrones se desplazan fácilmente cuando se aplica una diferencia de potencial.

También son buenos conductores del calor, porque al elevar la temperatura aumentan la velocidad de los electrones (mayor número de choques) y la transmisión de energía.
Los electrones están relativamente libres dentro del cristal; se pueden arrancar fácilmente por la acción de luz de una determinada frecuencia (efecto fotoeléctrico) o si se calientan (efecto termoiónico).
Los metales son insolubles en los disolventes moleculares (agua, acetona...) polares o apolares. Se disuelven muy bien unos en otros, originando aleaciones y amalgamas.
Las moléculas de los compuestos interaccionan entre sí por medio de fuerzas atractivas (fuerzas intermoleculares), en general, mucho más débiles que las que mantienen enlazados los átomos en las moléculas (fuerzas intramoleculares) o los aniones y cationes en la red iónica (fuerzas electrostáticas), aunque suficientemente intensas como para mantenerlas unidas en los estados líquido y sólido.
Se denomina fuerza intermolecular a cualquier tipo de interacción entre moléculas que no implique enlace químico.
Estas fuerzas intermoleculares determinan si una sustancia existirá en forma gaseosa, líquida o sólida a cierta temperatura y presión.
La intensidad de las atracciones intermoleculares disminuye al aumentar la distancia entre las moléculas, por lo que no son fuerzas relevantes en los gases pero sí en líquidos y en sólidos.
8.1. Tipos de fuerzas intermoleculares
Hay varios tipos de fuerzas intermoleculares:
Fuerzas de dispersión, o de London
Fuerzas de Van der Waals
Fuerzas dipolo-dipolo
Fuerzas dipolo-dipolo inducido
Enlaces por puentes de hidrógeno
Fuerzas
Son fuerzas de atracción débiles causadas por la interacción entre dipolos eléctricos moleculares y aumentan cuanto mayor sea el número de electrones de la molécula y su masa. Dentro de ellas, encontramos:
Las fuerzas de London surgen de la atracción entre dos dipolos instantáneos. Los dipolos se generan debido a fluctuaciones en la ubicación de los electrones en las moléculas. Las fluctuaciones aleatorias de las nubes electrónicas son muy rápidas (10−12 s) y provocan anomalías en la distribución de la carga eléctrica (un extremo de la molécula tendrá carga parcial negativa, y el otro extremo, carga parcial positiva, también pasajera), originando el dipolo instantáneo.
Cuando las moléculas de un compuesto se aproximan, se produce una separación entre los núcleos y las nubes electrónicas como consecuencia de las cargas de signo opuesto. Estas fuerzas fueron definidas en 1930 por F. London y se originan entre cualquier tipo de moléculas, polares y apolares, dependiendo principalmente de las distancias entre los átomos o grupos de átomos que interaccionan.
La intensidad de las fuerzas de London aumenta con la masa y el volumen molecular. Esto explica por qué el F2 y Cl2 son gases, el Br2 es líquido y el I2 es un sólido a temperatura ambiente.
¡Atención!
No debes confundir las uniones intramoleculares (como el enlace covalente) con las uniones intermoleculares (como las fuerzas de Van der Waals).
Enlaces covalentes F. Van der Waals
Direccionalidad Sí No
Distancia de enlace Menor Mayor
Fortaleza Fuertes
Débiles y aumentan con la masa y el volumen moleculares
Tabla 4. Comparación entre los enlaces covalentes y las fuerzas de Van der Waals.
Johannes Diderick Van der WaalsJ. D. Van der Waals (1837-1923) fue galardonado con el Premio Nobel de Física en 1910, por su trabajo sobre la ecuación de estado de los gases y los líquidos. También investigó sobre la disociación electrolítica, la teoría termodinámica de la capilaridad y sobre estática de fluidos.
En 1880 enunció, tras varios años de investigación, su teoría molecular de la sustancia compuesta por dos tipos distintos de materia, en la que establecía una serie de fórmulas y ecuaciones con las que, entre otros experimentos, se consiguió posteriormente licuar el hidrógeno y el helio.
Fuerzas de London entre dos moléculas de I2
Fuerzas intermoleculares de London entre dos moléculas de yodo.
Fuerzas dipolo-dipolo
Las interacciones dipolo-dipolo permanentes existen entre las moléculas covalentes polares debido a la atracción de la zona de densidad positiva de una molécula y la zona de densidad negativa de la otra.
Estas moléculas polares tienen cargas parciales permanentes, además de las cargas parciales instantáneas, debido a las fluctuaciones de sus nubes electrónicas. Por eso, la interacción dipolo-dipolo se suma a las fuerzas de dispersión (siempre presentes).
La magnitud de esta fuerza adicional depende de las magnitudes de los dipolos que interaccionan y de la forma de la molécula. Afecta tanto más cuanto más polar sea la molécula. Las moléculas polares forman líquidos y sólidos como resultado de las interacciones dipolo-dipolo.
Fuerzas dipolo-dipolo inducido
Aparecen cuando mezclamos una sustancia con moléculas apolares y otra con moléculas con momento dipolar permanente.
Si la molécula polar se aproxima lo suficiente a una molécula apolar puede inducir en ella un desplazamiento de la nube electrónica y provocar la aparición de dipolos inducidos. De esta manera, se produce una fuerza intermolecular adicional.
Enlaces por puentes de hidrógeno
El enlace por puente de hidrógeno es un tipo especial de interacción intermolecular que existe entre el átomo de hidrógeno de un enlace polar (H—F, H—O, H—N) y un par de electrones no compartidos en un ion o átomo cercano de volumen pequeño y electronegatividad elevada (generalmente un átomo de flúor, oxígeno o nitrógeno de otra molécula).
Los puntos de fusión del HF, H2O y NH3 son más altos de lo que cabría esperar debido a que entre las moléculas de estos compuestos existen fuerzas de atracción más intensas que en el resto de los hidruros del grupo.
La aparición de una carga parcial positiva sobre el átomo de hidrógeno y una carga parcial negativa sobre el otro átomo origina el establecimiento de una atracción electrostática entre los hidrógenos de una molécula y los átomos electronegativos de la molécula vecina.
Este tipo de atracciones son las responsables, entre otras cosas, de que el agua (masa molecular = 18 u) sea líquida a temperatura ambiente, mientras que el H2S (masa molecular = 34 u) sea un gas.
Los enlaces por puentes de hidrógeno aunque son más fuertes que las interacciones dipolo-dipolo (inferiores a 2 kJ · mol–1), son mucho más débiles que los enlaces ordinarios (del orden de 150 kJ · mol–1). La energía del enlace por puente de hidrógeno oscila en el intervalo de 10 a 40 kJ · mol–1
Dipolos permanentes (Moléculas covalentes polares)
dipolo dipolo inducido
Fuerzas intermoleculares dipolo-dipolo, entre dos dipolos permanentes (a) y entre dipolo permanente-dipolo inducido (b).
El HF constituye un ejemplo importante de presencia de puentes de hidrógeno. En este caso, debido a la mayor electronegatividad del flúor, los electrones de la unión pasan la mayor parte del tiempo sobre el átomo de flúor, generando así una alta densidad de carga positiva sobre el hidrógeno y una alta densidad de carga negativa sobre el flúor. Esta carga negativa atrae el hidrógeno de una molécula vecina compartiendo con él uno de sus pares de electrones libres. Así, el puente de hidrógeno mantendrá unidas las dos moléculas y se extenderá a otras moléculas vecinas formando una cadena molecular.
Cadenas de HF.
Enlaces de hidrógeno entre dos moléculas de agua.
Son sustancias moleculares aquellas constituidas por moléculas unidas entre sí por fuerzas intermoleculares. Sus propiedades son, por tanto, el resultado del tipo de fuerzas intermoleculares que presenten.
Puntos de fusión y ebullición
Las sustancias moleculares tienen puntos de fusión y ebullición bajos.
A temperatura ambiente, la mayor parte de estas sustancias se encuentran en estado gaseoso (H2, N2, O2, CH4, CO2), otras son líquidas (Br2, H2O) y otras se encuentran en estado sólido, como el I2, el S8 y la glucosa (C6H12O6). Al ser muy débiles las fuerzas intermoleculares, una pequeña agitación térmica es suficiente para desordenar y separar las moléculas.
Propiedades mecánicas
Las sustancias moleculares tienden a ser blandas, compresibles y fácilmente deformables; esto es debido al carácter no direccional de las fuerzas de Van der Waals.
Solubilidad
Las sustancias apolares son insolubles en disolventes polares como el agua, pero se disuelven bien en disolventes apolares como el CCl4. Las sustancias polares son más solubles en agua.
Una sustancia se disolverá si las fuerzas entre sus moléculas y las del disolvente son más intensas que las fuerzas de sus moléculas entre sí.
Ejercicios
39 Dada la molécula CCI4: a) represéntala mediante la estructura de Lewis, b) ¿por qué la molécula es apolar si los enlaces están polarizados? c) ¿por qué a temperatura ambiente el CCI4 es líquido y el CI4 es sólido?
El aceite (sustancia apolar) es insoluble en agua (sustancia polar). Se suele utilizar también el término hidrófobo para una sustancia apolar.

Las sustancias que forman cristales moleculares son, en general, buenos aislantes eléctricos.

Las moléculas en sí no poseen carga eléctrica neta y no pueden transportar la energía. Además, los electrones que forman los enlaces covalentes tienden a estar localizados (los electrones compartidos en los enlaces covalentes están fuertemente unidos y no pueden desplazarse). No obstante, algunas sustancias moleculares disueltas en agua se ionizan y la disolución se vuelve conductora.
40 El trifluoruro de boro y el amoníaco son compuestos gaseosos en condiciones normales. Explica: a) la forma geométrica de sus moléculas, b) cuál de las dos moléculas es más polar, c) cómo serán los enlaces intermoleculares en cada uno de los compuestos, d) cuál de los dos compuestos tendrá un punto de ebullición más alto.
Datos: Números atómicos: H = 1, B = 5, N = 7, F = 9.
Los átomos de C, H, O y N, muy abundantes en los seres vivos, tienen de 4 a 6 electrones en la capa de valencia y son elementos pequeños (masas atómicas bajas) capaces de formar fácilmente enlaces covalentes estables. Estos enlaces pueden ser simples, dobles o triples dando lugar a multitud de moléculas orgánicas con diversos grupos funcionales susceptibles de reaccionar con otras moléculas generando nuevas moléculas y estructuras moleculares más complejas.
Por otro lado, muchas de estas moléculas biológicas son monómeros (glucosa, aminoácidos…) que, a su vez, se unen mediante enlaces covalentes formando polímeros (almidón, proteínas...). Todo ello resulta útil para las continuas reacciones del metabolismo de los seres vivos. A continuación, veremos algunas moléculas importantes desde el punto de vista biológico.
Biomoléculas orgánicas formadas por carbono, hidrógeno y oxígeno. Son compuestos que tienen varios grupos hidroxilo (OH) y un grupo carbonilo, bien aldehído (CHO), o bien cetona (C O). Algunos ejemplos son la ribosa, que forma parte de la estructura del ARN, así como de nucleótidos capaces de transferir energía (como el ATP); la desoxirribosa, que forma parte de la estructura del ADN; la glucosa, utilizada como fuente de energía por todas las células; la fructosa, azúcar presente en las frutas, que tiene el mismo valor energético que la glucosa, etc.
El ADN (ácido desoxirribonucleico) es una macromolécula con una estructura de doble hélice enrollada en forma de espiral. Cada cadena de la doble hélice es, a su vez, un polímero constituido por la unión de nucleótidos de desoxirribosa mediante enlaces fosfodiéster.
La estabilización de la doble hélice es posible gracias al establecimiento de enlaces por puentes de hidrógeno entre las bases nitrogenadas.
Formación de la molécula de sacarosa por unión mediante un enlace covalente denominado O-glucosídico de una molécula de glucosa y otra de fructosa, azúcar presente en las frutas.
Biomoléculas orgánicas compuestas, básicamente, por carbono, hidrógeno, oxígeno, y a veces también por otros elementos, como fósforo, nitrógeno y azufre. Desempeñan las siguientes funciones biológicas: energética, estructural, protectora, transportadora y reguladora.
Las proteínas se pueden definir como polímeros formados por la unión mediante enlaces peptídicos de moléculas de baja masa molecular llamadas aminoácidos. Las proteínas son las moléculas orgánicas más abundantes en las células; están formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno, además de azufre, en muchas de ellas.
Las proteínas son las moléculas específicas que marcan la individualidad de cada ser vivo, realizan funciones de vital importancia en él y son también las moléculas mediante las que se expresa la información genética contenida en el ADN.

Actualmente, el término «inteligente» se ha adoptado como un modo válido de describir una clase de materiales que presentan la capacidad de cambiar sus propiedades físicas (viscosidad, forma, rigidez, color…) en presencia de un estímulo concreto.
Algunas de sus aplicaciones son:
• Existen y se comercializan gafas cuyas monturas están construidas con una aleación con memoria de forma. Así, si la montura resulta doblada o deformada se puede recuperar su forma inicial tan solo calentándola.
• En el campo de la ingeniería sísmica existen aplicaciones para disminuir las vibraciones producidas durante un terremoto y garantizar la seguridad estructural de un edificio.
• La industria aeronáutica se encuentra desarrollando alas de rigidez variable que responden a la carga del viento de forma activa para conseguir distintos objetivos como la disminución de cargas de fatiga, optimización aerodinámica, etc.
• El nitinol (aleación de níquel y titanio) puede emplearse para fabricar alambres superelásticos que se pueden tejer en formas cilíndricas para varios usos.
Una de las aplicaciones más habituales son los «stents» vasculares para reforzar los vasos sanguíneos.

Gafa con montura de titanflex (aleación de titanio).
• Investigadores europeos han desarrollado materiales innovadores con aplicaciones a la ingeniería de tejidos. Estos materiales están diseñados para responder a estímulos concretos, como infecciones bacterianas, y pueden tener múltiples aplicaciones médicas.
1 Los ingenieros de materiales estudian las cualidades, características y usos de los materiales, y aplican sus conocimientos para investigar y desarrollar nuevos materiales. Investiga acerca de las competencias y del perfil profesional de un ingeniero de materiales.
2 Busca información sobre los fluidos electrorreológicos y sus aplicaciones.
3 Una de las líneas de investigación más importantes sobre materiales inteligentes se refiere a los «metamateriales». Responde a las siguientes preguntas, investigando en Internet: a) ¿cómo funciona un metamaterial?, b) aplicaciones actuales de los metamateriales.
Microscopía electrónica de barrido de un tejido de algodón recubierto de partículas de ZnO.
4 En el año 2000, los químicos Alan Heeger, Hideki Shirakawa y Alan MacDiarmid recibieron el Premio Nobel de Química por el descubrimiento y desarrollo de polímeros sintéticos conductores de la electricidad. Busca información sobre las aplicaciones de este tipo de polímeros sintéticos.

Las propiedades de las sustancias moleculares están determinadas no solo por los átomos que forman sus moléculas, sino también por la forma en que estos átomos se distribuyen en el espacio. Ambos factores hacen que a dicha molécula le corresponda una geometría molecular determinada caracterizada por sus correspondientes parámetros moleculares: longitudes y ángulos de enlace.
En esta sección vamos a usar un applet que nos permitirá visualizar la molécula tridimensionalmente así como determinar su geometría.
Para localizar este applet en primer lugar tienes que ir a la página web de la Universidad de Colorado: https:// phet.colorado.edu/sims/html/molecule-shapes/latest/ molecule-shapes_es.html. Es un programa interactivo que está en castellano y nos ofrece múltiples opciones tales como trabajar con moléculas reales predeterminadas o experimentar construyendo nuestros propios modelos moleculares.

Este applet nos ofrece dos opciones de trabajo:
A) Modelo
En este caso podemos incorporar enlaces simples, dobles y triples al átomo central así como añadir pares de electrones no enlazantes o solitarios. Para ello cliqueamos el tipo de unión que queremos añadir y el número de electrones solitarios.
Una vez establecido el número de pares de electrones enlazantes y no enlazantes podremos visualizar el valor de los diferentes ángulos de enlace. También podremos determinar tanto la geometría molecular como la geometría electrónica de nuestro modelo.
El programa nos permite orientar la molécula y visualizarla de manera tridimensional.
B) Molécula real
En este caso podemos trabajar con ejemplos concretos de las diferentes geometrías moleculares (lineal, plana trigonal, tetraédrica, bipirámide trigonal, octaédrica, angular y pirámide trigonal) pero no podemos incorporar enlaces simples, dobles y triples a nuestro átomo central ni añadir pares de electrones no enlazantes o solitarios. El programa nos permite orientar la molécula en las diferentes direcciones del espacio, visualizar los ángulos de enlace y determinar, además, su geometría electrónica.
Entre los objetivos a alcanzar mediante el uso de esta herramienta TIC están:
a) Reconocer que la geometría molecular se debe a la repulsión entre los grupos de electrones.
b) Describir cómo los pares de electrones solitarios afectan a ángulos de enlace en moléculas reales.
c) Determinar la geometría molecular y la geometría electrónica de la molécula.
La geometría molecular se refiere a la disposición tridimensional de los átomos que constituyen una molécula. Es un determinante de muchas de las propiedades del compuesto.
La geometría electrónica es la forma en la que los electrones se disponen en el espacio, considerando todos los pares de valencia del átomo central. Generalmente coincide con la geometría molecular pero no siempre.
Cuestiones
1 Utilizando el programa interactivo estudiado, determina la geometría molecular, ángulos de enlace y geometría electrónica para los siguientes casos: a) molécula con tres enlaces simples, b) molécula con tres enlaces simples y un par de electrones solitarios, c) molécula con dos enlaces simples y un enlace doble, d) molécula con dos enlaces simples, un enlace doble y un par de electrones solitarios, e) molécula con dos enlaces simples, un enlace doble y dos pares de electrones solitarios.
2 Ahora, hazlo de nuevo para las siguientes moléculas: a) H2O, b) NH3, c) BF3, d) XeF4, e) SF6
1 Considera los compuestos NH3, CH4 y HF e indica razonadamente:
a) Las geometrías de cada una de las moléculas.
b) Cuál o cuáles son polares.
c) Cuál de los compuestos es más ácido, basándose en criterios de electronegatividad.
Datos: Números atómicos: N (Z = 7), H (Z = 1), C (Z = 6), F (Z = 9).
Planteamiento y resolución
Femtoquímica
a) Para determinar la geometría molecular, vamos a utilizar la teoría de repulsión de los pares electrónicos de la capa de valencia (TRPECV). La geometría molecular es la distribución tridimensional de los átomos de una molécula y es aquella en la que la repulsión electrónica es mínima. Estas moléculas se pueden representar con las estructuras de Lewis:
H
H—N—H H—C—H H—F
H H
NH3: En este caso el átomo central tiene pares de electrones solitarios. En el amoníaco hay cuatro nubes de electrones, una de las cuales es un par solitario. Presenta una geometría de pirámide trigonal.
CH4: En este caso el átomo central carece de pares de electrones solitarios. Hay cuatro zonas de alta densidad electrónica en torno al átomo central de carbono que se orientan hacia los vértices de un tetraedro.
La molécula presenta una geometría tetraédrica con ángulos de enlace de 109,5º.
HF: En este caso no hay átomo central. La molécula presenta una geometría lineal.
b) NH3: Es una molécula polar, los tres momentos dipolares de enlace N—H son iguales, pero al tener geometría piramidal, no se anulan entre sí ( 0 ! n ).
CH4: Es una molécula apolar, los cuatro momentos dipolares de enlace C—H son iguales, pero al tener geometría tetraédrica, se anulan entre sí ( 0 ! n ).
HF: Es una molécula polar, existe momento dipolar de enlace H—F. La molécula presenta geometría lineal.
c) El ácido fluorhídrico (HF) es el compuesto más ácido, ya que el flúor presenta mayor diferencia de electronegatividad con el hidrógeno que el resto de elementos.
A mayor diferencia de electronegatividad, mayor será la acidez.
En todo tipo de unión covalente, los átomos quedan enlazados mediante pares de electrones comunes. Las representaciones gráficas que se utilizan en la descripción de las moléculas de los compuestos covalentes se denominan estructuras de Lewis.
Para que una molécula sea polar, es necesario, pero no suficiente, que contenga enlaces covalentes polarizados. Cuando en una molécula polar hay más de un enlace, el momento dipolar molecular es la suma vectorial de los momentos dipolares de enlace; por ello, es necesario, para determinarla, conocer la geometría molecular y los ángulos de enlace.
Para comprobar que el resultado es correcto, se puede determinar la geometría de las moléculas utilizando otras teorías, bien a través de la teoría de la hibridación de orbitales atómicos, o bien a través de la teoría del enlace de valencia (TEV).
En el desarrollo del problema también se puede comprobar cuál de ellos es más ácido teniendo en cuenta las diferentes teorías relativas al carácter ácido-base de una sustancia dependiendo del caso a analizar: teoría de Brönsted-Lowry y la teoría de Lewis.
Hay que tener en cuenta que la electronegatividad es la capacidad que tiene un átomo de atraer hacia sí a los pares de electrones que comparte en un enlace covalente. Cuanto más electronegativo sea, con mayor fuerza atraerá dicho par de electrones.
Las electronegatividades se miden de forma comparativa entre los elementos. Se utilizan escalas relativas como la escala de Pauling, que relaciona la electronegatividad con las energías de enlace.
El descubrimiento del metano (CH4) sucedió de forma accidental en 1776 cuando Alessandro Volta descubrió en Angera (Italia) que el aire de los pantanos era inflamable. Esta primera idea de lo que podría ser el metano fue denominada inicialmente «gas de los pantanos» y le llevó a profundizar dicha cuestión con estudios e investigaciones sobre dicho aire inflamable.
Los estudios de Alessandro Volta permitieron descubrir que el metano (CH4) es el resultado de la descomposición de algunas sustancias orgánicas en ausencia de oxígeno.
2 a) Ordena, según polaridad creciente, basándote en los valores de las electronegatividades de la tabla adjunta, los siguientes enlaces: HF, HO, HN, HC, CO y CCl
ANÁLISIS DEL PROBLEMA
Para establecer la polaridad de una molécula:
1) Se obtienen las estructuras óptimas de Lewis y se aplica el método TRPECV.
2) Se identifican los enlaces polarizados.
b) La polaridad de la molécula de CH4, ¿será igual o distinta que la del CCl4?
c) Para la molécula de H2O, indica la hibridación que presenta el átomo central y su geometría.
Planteamiento y resolución
a) Todos los enlaces son covalentes, al tratarse de la unión entre dos no metales, o entre un no metal e hidrógeno. Cuanto mayor sea la diferencia de electronegatividad, más polar será el enlace, ya que el par de electrones compartidos será más atraído por el elemento más electronegativo, aumentando también el porcentaje del carácter iónico del enlace. Por tanto, el orden según polaridad creciente será:
H—C < C—Cl< H—N < C—O < H—O <H—F
b) Debido a la mayor diferencia de electronegatividad, es más polar el enlace C—Cl que el enlace C—H Por otro lado, ambas moléculas presentan geometría tetraédrica según la teoría de repulsión de los pares electrónicos de la capa de valencia (TRPECV) con el carbono en el centro y los átomos de hidrógeno, o de cloro, en los vértices.
3) Se suman vectorialmente los momentos dipolares de todos los enlaces individuales, dando lugar al momento dipolar molecular.
La electronegatividad está directamente relacionada con el potencial de ionización y la afinidad electrónica. En la tabla periódica, aumenta de izquierda a derecha dentro de un mismo período; y de abajo hacia arriba dentro de un mismo grupo. Así, el elemento más electronegativo en esta tabla es el flúor (4,0) y el menos electronegativo es el H (2,1).
Para determinar el orden de polaridad, se ha tenido en cuenta la diferencia de electronegatividades entre los átomos que forman el enlace.
La electronegatividad es la tendencia que tiene un átomo de un elemento de atraer a los electrones compartidos con otro átomo cuando está combinado químicamente con él.
En los enlaces del problema, el menos electronegativo adquirirá cierta carga positiva δ+ y el más electronegativo desplazará el par electrónico hacia él, adquiriendo cierta carga negativa δ–, originándose un dipolo eléctrico.
Esta simetría tetraédrica provoca que el vector momento dipolar resultante sea nulo ( 0 n = ), tratándose, en consecuencia, de dos moléculas apolares.
b) El oxígeno tiene seis electrones de valencia y presenta dos enlaces, por lo que tiene dos electrones enlazantes, uno en cada enlace simple, y un par de electrones libres.
El oxígeno presenta una hibridación con cuatro orbitales sp3, dos de ellos forman enlaces simples con el orbital 1s del hidrógeno, y en los otros dos tiene pares de electrones libres, por lo que su geometría es angular.
Y ADEMÁS…
El tetracloruro de carbono (CCl4) se usó en el pasado en la producción de líquido refrigerante y propulsor de aerosoles, como desengrasante, como plaguicida, como agente limpiador y en extintores. Debido a sus efectos perjudiciales, estos usos están prohibidos y actualmente se usa solamente en ciertas aplicaciones industriales:
a) Disolvente en la extracción de aceites, grasas y ceras.
b) En la industria química de pinturas y artes gráficas.
c) En la industria del caucho y el cuero.
d) En la industria farmacéutica (antihelmíntico, desengrasante capilar).
1 Dadas las energías reticulares de las siguientes sustancias, U (kJ · mol–1): NaF = −914, NaCl = −770, NaBr = −728. Razona cómo varían: a) sus puntos de fusión, b) su dureza, c) su solubilidad en agua.
2 En estado sólido los compuestos KF y CaO presentan el mismo tipo de estructura cristalina y distancias interiónicas similares. Sin embargo, los valores de las energías de red son ∆Hred (CaO) = −3461 kJ · mol–1, ∆Hred (KF) = –826 kJ · mol–1. Indica, de manera razonada, el factor o factores que justifican la diferencia existente entre los dos valores de la energía de red.
3 Supongamos que los sólidos cristalinos NaF, KF y LiF cristalizan en el mismo tipo de red: a) escribe el ciclo de Born-Haber para el NaF, b) razona cómo varía la energía reticular de las sales mencionadas, c) razona cómo varían sus temperaturas de fusión.
4 a) Escribe los procesos a los que corresponden los siguientes datos: potencial de ionización de potasio = 100 kcal · mol–1, entalpía de formación del cloruro de potasio = −101,5 kcal · mol–1, energía de sublimación del potasio = 21,5 kcal · mol–1, energía de disociación del cloro = 57 kcal · mol–1, energía de red del cloruro de potasio = −168 kcal · mol–1 b) A partir de ellos, determina el valor de la afinidad electrónica del cloro, escribiendo para ello el correspondiente ciclo de Born-Haber.
5 Grupo nominal. Las energías de red del LiF y del KF son −1 046 kJ · mol–1 y −826 kJ · mol–1, respectivamente. Justifica la diferencia entre estos valores si ambos compuestos presentan el mismo tipo de estructura cristalina. Indica, de forma razonada, el componente que presentará el valor más elevado del punto de fusión normal.
6 Considera las moléculas CS2, CH3Cl, H2Se y NCl3 , y responde razonadamente a las siguientes cuestiones: a) representa la estructura de Lewis de cada una de estas moléculas, b) predice su geometría molecular, c) explica, en cada caso, si la molécula tiene o no momento dipolar. Datos: Números atómicos: H = 1, C = 6, N = 7, S = 16, Cl = 17, Se = 34.
7 Considerando las moléculas H2CO (metanal) y Br2O (óxido de dibromo): a) representa sus estructuras de Lewis, b) justifica su geometría molecular, c) razona si cada una de estas moléculas tiene o no momento dipolar. Datos: Números atómicos: C = 6, O = 8, H = 1 y Br = 35.
8 Justifica la geometría de las siguientes moléculas covalentes a partir del modelo de repulsión entre los pares de electrones de la capa de valencia (RPECV): a) BeF2 , b) BCl3 , c) CCl4.
Datos: Números atómicos: Be = 4, F = 9, B = 5, Cl = 17 y C = 6.
9 Dadas las siguientes parejas de sustancias químicas: CCl4 y CHCl3 , BCl3 y NCl3 , a) explica razonadamente la geometría de estas moléculas de acuerdo con la teoría de repulsión de pares electrónicos de la capa de valencia, b) estudia la polaridad de las moléculas en cada pareja.
10 a) Escribe las estructuras de Lewis para el BF3, NF3 y F2CO , b) ¿cuál será la geometría de estas moléculas?, c) ¿qué enlace de los que forman el flúor en las moléculas anteriores es más polar?, d) ¿cuál o cuáles de estas moléculas son polares?
Datos: Números atómicos: C = 6, N = 7, O = 8, F = 9.
11 a) Escribe las estructuras de Lewis de las siguientes especies químicas y predice su geometría molecular: AlCl3 , PCl3 y SnCl2 , b) indica, razonando la respuesta, si alguna de las moléculas anteriores es polar.
Datos: Números atómicos: H = 1, Al = 13 , P = 15, Cl = 17, Sn = 50
12 Considera las moléculas OF2, BI3 , CCl4, C2H2, a) escribe las representaciones de Lewis, b) indica sus geometrías moleculares utilizando la teoría RPECV, c) justifica cuáles son moléculas polares, d) ¿qué moléculas presentan enlaces múltiples?
Fuerzas intermoleculares
13 a) ¿En cuáles de las siguientes sustancias existirán puentes de hidrógeno: NH3, CH4, CCl4?, b) ¿por qué los metales alcalinos son incapaces de formar enlaces covalentes?, c) ¿por qué las sustancias moleculares no conducen la corriente eléctrica?
14 Indica, razonadamente, cuál o cuáles de las siguientes especies químicas pueden formar enlaces de hidrógeno con el agua: a) cloruro de sodio, b) fluoruro de hidrógeno, c) metano.
15 a) Razona claramente cuál de las siguientes sustancias presenta fuerzas intermoleculares mayores: NH3, PH3, AsH3, H2O, H2 ; b) explica cuáles son las consecuencias de ello, c) ¿se pueden licuar y solidificar todas las especies citadas anteriormente? Razona por qué.
Datos: Números atómicos: H = 1, O = 8, N = 7, P = 15, As = 33.
Recuerda seleccionar el material de trabajo de esta unidad para tu porfolio.16 a) Deduce si la molécula de amoníaco presenta momento dipolar, b) ordena las sustancias NH3, CH4 y H2O según su temperatura de ebullición basándote en el tipo e intensidad de sus fuerzas intermoleculares. Datos: Números atómicos: H = 1, C = 6, N = 7, O = 8.
17 a) Justifica la geometría de las moléculas de CS2 y H2S mediante el modelo de repulsión de pares de electrones de la capa de valencia, b) ¿cuál de las dos moléculas anteriores es soluble en agua? (razona la respuesta), c) ¿qué fuerzas de atracción hay que romper para evaporar el H2S (l)?
18 Se sabe que los puntos de ebullición normales de HF y HBr son, respectivamente, 19,5 ºC y –67 ºC. Explica por qué siendo la masa molecular de HBr mayor que la del HF, su temperatura de ebullición normal es menor.
19 Dadas las siguientes sustancias: CO2, CF4, H2CO y HF, a) escribe las estructuras de Lewis de sus moléculas, b) explica sus geometrías por la teoría de repulsión de pares de electrones de la capa de valencia o por la teoría de hibridación, c) justifica cuáles de ellas tienen momento dipolar distinto de cero, d) justifica cuáles de estas sustancias presentan enlace de hidrógeno.
Datos: Números atómicos: H = 1, C = 6, O = 8, F = 9, S = 16 y Cl = 17.
20 Explica qué tipo de enlace químico debe romperse o qué fuerza de atracción debe vencerse para: a) fundir NaCl, b) hervir agua, c) fundir hierro, d) evaporar nitrógeno líquido.
21 Contesta, razonando la respuesta, a las siguientes cuestiones: a) ¿qué tipo de enlace cabe esperar en cada una de las siguientes sustancias químicas: NaCl, Cl2, CH4 y Fe?, b) ¿cuál será el estado de agregación de cada una de las especies anteriores?, c) ¿cuáles se disolverán en agua?
22 Explica qué tipo de fuerzas de atracción deben vencerse para llevar a cabo los siguientes procesos: a) fundir bromuro de calcio, CaBr2 (s); b) hervir agua, H2O (l); c) evaporar oxígeno, O2 (l); d) fundir cesio, Cs (s).
23 Contesta, razonadamente, a las siguientes cuestiones: a) ¿por qué a 25 ºC y 1 atm el agua es líquida y el sulfuro de hidrógeno no?, b) ¿cuál de los compuestos siguientes será más soluble en agua: el óxido de calcio o el cloruro de cesio?, c) ¿qué metal tiene mayor punto de fusión, el sodio o el cobre?,
d) ¿qué conduce mejor la corriente eléctrica, un cristal de nitrato de aluminio o una disolución de este?
24 Explica razonadamente los siguientes hechos: a) el cloruro de sodio tiene un punto de fusión de 801 ºC, mientras que el cloro es un gas a temperatura ambiente, b) el cobre y el yodo son sólidos a temperatura ambiente pero el cobre conduce la corriente eléctrica, mientras que el yodo no, c) el etano tiene un punto de ebullición más alto que el metano.
25 Indica el tipo de enlace o fuerza intermolecular que es necesario vencer para fundir los siguientes compuestos: a) cloruro de sodio, b) dióxido de nitrógeno, c) hierro.
26 El grafeno es un material constituido por átomos de carbono que, desde su descubrimiento en 2004 por A. Geim y K. Novoselov, ha ido aumentando sus campos de aplicación gracias a sus excelentes propiedades. Elabora un trabajo usando alguna herramienta TIC en el que se relacionen dichas propiedades con las metas 7.2 y 7.3 de los ODS.
27 Indica, razonadamente, cuántos enlaces π y cuántos σ tienen las siguientes moléculas: a) hidrógeno, b) nitrógeno, c) oxígeno.
28 El PCl3 es una molécula polar, mientras que el BCl3 tiene un momento dipolar nulo: a) escribe las estructuras de Lewis para ambas moléculas, b) justifica la distinta polaridad que poseen, c) indica la hibridación del átomo central.
29 Indica, razonadamente, cuál es la hibridación que presenta el átomo de carbono en las moléculas H2C O y CCl4
30 a) Deduce la geometría de las moléculas BCl3 y H2S aplicando la teoría RPECV, b) explica si las moléculas anteriores son polares, c) indica la hibridación que presenta el átomo central.
31 Responde a las siguientes cuestiones: a) para la molécula de NF3, indica la hibridación del átomo central, número de orbitales híbridos y número de electrones en cada orbital híbrido, b) justifica si la molécula NF3 es polar o apolar.
32 Considera las moléculas CH4, BF3 y NH3: a) describe para cada molécula la hibridación del átomo central, b) indica las fuerzas intermoleculares presentes en cada una de ellas.
Los antioxidantes son sustancias que impiden o retrasan la oxidación de las moléculas (principalmente de los ácidos grasos). La oxidación puede generar una producción de radicales libres, capaces de crear una reacción en cadena que dañe la célula.
Los antioxidantes pueden ser proporcionados por los alimentos o ser producidos por nuestro propio cuerpo, como mecanismo de defensa. Su función es neutralizar la acción de los radicales libres, previniendo el daño que pudieran causar produciendo serias alteraciones fisiológicas y enfermedades. La ingesta de alimentos ricos en antioxidantes es la mejor forma de contrarrestar el efecto de los radicales libres.
Entre los antioxidantes más importantes en los alimentos destacan la vitamina C (ácido ascórbico), la vitamina A (betacaroteno), la vitamina E (tocoferol), los carotenoides (licopeno), los flavonoides (polifenoles) y algunos minerales como el selenio y el cobre.

Así, por ejemplo, la vitamina C es importante en el metabolismo de los glúcidos, en la absorción intestinal del hierro, en la formación de cartílagos, huesos y dientes, y en el funcionamiento corticosuprarrenal. El selenio protege a los tejidos corporales de la oxidación, y entre sus funciones biológicas se incluyen la defensa contra el estrés oxidativo, la regulación de la acción de la hormona tiroidea y la regulación del estado redox de la vitamina C.
COMPROMISO ODS
Haced estas actividades en grupos:

1 El 16 de noviembre de 2010, la UNESCO declaró la dieta mediterránea como Patrimonio Cultural Inmaterial de la Humanidad para salvaguardar su herencia. La dieta mediterránea promueve la producción alimentaria y los patrones de consumo local, así como el fomento de la agricultura sostenible. ¿En qué consiste esta dieta?
¿Qué alimentos forman la dieta mediterránea?
Buscad información acerca de los beneficios de esta dieta y elaborad un informe acerca de cómo estos contribuyen al cumplimiento de los objetivos 3 y 12 para el desarrollo sostenible.
En esta unidad
• El papel antioxidante de los alimentos

1. Reacciones de oxidación-reducción
2. Número de oxidación
3. Ajuste redox por el método del ion-electrón
4. Estequiometría de las reacciones redox
5. Celdas electroquímicas

6. Potenciales de electrodo y potencial de una celda

7. Espontaneidad de las reacciones redox
8. Valoraciones redox






9. Electrólisis



10. Proyectos industriales de electrólisis




11. Aplicaciones y repercusiones de las reacciones redox
• Cultura científica. Reacciones redox en la vida cotidiana
• TIC. Simulador de electrólisis

• Estrategias de resolución de problemas
En anayaeducacion.es
Para motivarte:
• Vídeo: «Antes de empezar».
Para detección previa de ideas:
• Presentación: «Qué necesitas saber».
Para estudiar:
• Presentación: «Para estudiar».
Los contenidos y las actividades de esta unidad pueden resultar de utilidad para la realización del proyecto que se plantea en el anexo situado en las páginas iniciales del libro.
• Simulaciones: «Voltaje de batería».
Para evaluarte:
• Autoevaluación final.
• Soluciones de las actividades numéricas.
Y, además, toda la documentación necesaria para aplicar las claves del proyecto.

Concepto tradicional
Tradicionalmente, se entendía por oxidación cualquier proceso donde una sustancia ganaba oxígeno, y por reducción, el proceso por el cual una sustancia perdía oxígeno. Así, si el Na reacciona con O2 dando Na2O, decimos que el sodio se ha oxidado. En cambio, el CuO al reaccionar con H2 se transforma en cobre metálico, y decimos que el monóxido de cobre se ha reducido.
Oxidación : 4 Na + O2 → 2 Na2O
Reducción : CuO + H2 → Cu + H2O
Posteriormente, observando las reacciones donde intervenía el hidrógeno, el concepto fue ampliado, de manera que para una sustancia que contenía hidrógeno, la oxidación era el proceso donde se perdía hidrógeno y la reducción era aquel donde se ganaba hidrógeno. Este concepto es particularmente útil en reacciones orgánicas:
CH3CH2OH → CH3CHO + H2 Oxidación
etanol etanal
En cambio, la formación de etanol a partir del etanal por ganancia de hidrógeno, supone un proceso de reducción:
CH3CHO + H2 → CH3CH2OH Reducción
Concepto electrónico
En la actualidad, se entiende que una reacción redox se produce cuando hay una transferencia de electrones de una sustancia a otra (una cede electrones y la otra los acepta).
• Oxidación: proceso químico que implica una pérdida de electrones o aumento del número de oxidación de una especie. También se puede definir como el proceso por el cual un reductor pierde electrones.
• Reducción: proceso químico que implica una ganancia de electrones o disminución del número de oxidación de una especie. También se puede definir como el proceso por el cual un oxidante gana electrones. Estudiemos la siguiente reacción de formación del yoduro de aluminio:
2 Al (s) + 3 I2 (s) → 2 AlI3 (s)
En este proceso, cada átomo de aluminio pierde sus tres electrones de valencia, que ganará la otra especie con la que reacciona, el yodo. El proceso global se puede descomponer en:
Semirreacción de reducción: 3 I2 + 6 e → 6 I
Semirreacción de oxidación: 2 Al → 2 Al3+ + 6 e−
Reacción global: 3 I2 + 2 Al3+ → 2 AlI3
La reacción que experimenta el oxidante (I2) se denomina semirreacción de reducción y aquella que experimenta el reductor (Al) se denomina semirreacción de oxidación.
Los procesos de oxidación-reducción son simultáneos; es decir, para que una especie química pierda electrones, es necesaria la presencia de otra que los acepte. Existe una transferencia de electrones desde la sustancia que se oxida hasta la que se reduce.






Los términos «oxidación» y «reducción» empezaron a utilizarse a partir de la síntesis conceptual llevada a cabo por Lavoisier con relación a su nueva teoría de la combustión. En 1772, Lavoisier consiguió demostrar que tanto en la combustión como en la calcinación en atmósfera de aire se producía una combinación de un elemento o compuesto con el oxígeno del aire.
Con el tiempo, el concepto de oxidación y reducción adoptó un significado más amplio, al comprobarse que había muchas reacciones semejantes a las anteriores, pero en las que el papel del oxígeno era suplido por otro elemento.
Oxidación (átomo piede un electrón)
Reducción (átomo gana un electrón)
Concepto electrónico de oxidación y reducción.
Oxidante es toda especie química que toma electrones de otra. Tiene facilidad para oxidar a otras especies y ella misma sufre reacciones de reducción.
Agentes oxidantes muy habituales son: el agua oxigenada (H2O2), el ion permanganato (MnO4 ) y el ion dicromato (Cr2O72−).
Reductor es toda especie química que cede electrones a otra. Tiene facilidad para reducir a otras especies y ella misma sufre reacciones de oxidación.
Agentes reductores habituales son: el carbono (C) y los elementos metálicos (Mg, Al, Zn).
Por tanto, el oxidante, al tomar electrones, se reduce, y el reductor, al ceder electrones, se oxida.
Oxidación Reducción Ganancia de oxígeno Pérdida de oxígeno Pérdida de hidrógeno Ganancia de hidrógeno Pérdida de electrones Ganancia de electrones
Oxidantes Reductores
Halógenos: F2, Cl2, I2, Br2
Oxígeno: O2
Oxoaniones: NO3 ,IO3 , MnO4 ,Cr2O72−
Metales: Li, Na, Mg, Zn, Fe, Sn
Oxoaniones: SO32−
No metales: H2, C
Arte y química
Esquema general de un proceso redox y ejemplo.
Identificación del oxidante y del reductor
En las reacciones redox cambia el estado o grado de oxidación de las especies reaccionantes porque se produce un intercambio de electrones entre los reactivos (oxidante y reductor).
• Si el número de oxidación de un átomo aumenta, significa que se oxida, y actúa como una especie reductora.
• Si el número de oxidación de un átomo disminuye, significa que se reduce, y, por tanto, actúa como una especie oxidante.
Una sustancia también puede actuar como oxidante y reductor al mismo tiempo, dando lugar a una reacción de oxidación-reducción a la que denominamos dismutación. Un ejemplo de este tipo de reacciones es:
2 H2O2 → 2 H2O + O2
Pares redox
Como acabamos de ver, para que se produzca una reacción redox, es necesaria la presencia de una especie que ceda electrones (reductor) y otra especie que acepte electrones (oxidante). A todo oxidante se le puede asignar una forma reducida, y viceversa. Estas dos sustancias constituyen un par redox, que se suelen citar en el orden oxidante/reductor.
Las reacciones redox de diferentes tipos que se suceden al combinar distintos ácidos, anilinas, nitratos, etc., producen un intercambio de electrones que estabilizan la reacción dando como resultado variedad de texturas, tonos armónicos y formas muy sugerentes.
Variación del número de oxidación.
Tras la reacción redox, el reductor se transforma en su forma oxidada, y el oxidante, en su forma reducida. Podemos decir que en una reacción de oxidación-reducción, el reductor cede electrones y se transforma en su oxidante conjugado (par conjugado redox), mientras que el oxidante gana electrones y se convierte en su reductor conjugado (par conjugado redox).
Semirreacción de oxidación: Reductor (1) → Oxidante (1) + n e
Semirreacción de reducción: Oxidante (2) + n e → Reductor (2)
La reacción global será:
Reductor (1) + Oxidante (2) → Oxidante (1) + Reductor (2)
Fuerza de un oxidante y de un reductor
La fuerza de un oxidante o de un reductor es relativa, dependerá del reductor u oxidante al que se enfrente. Una misma especie química puede actuar unas veces como oxidante y otras como reductor. No existen oxidantes ni reductores absolutos.
Si un oxidante tiene gran tendencia a captar electrones, es decir, es fuerte, su reductor conjugado mostrará muy poca tendencia a ceder electrones, será un reductor débil. De la misma manera, si un reductor tiene gran tendencia a ceder electrones, es decir, es fuerte, tendrá como conjugado un oxidante débil.
Los átomos muy electronegativos son oxidantes, mientras que los poco electronegativos son reductores.
1 Considera la reacción redox: Cr2O72− + Fe2+ + H+ → Cr3+ + Fe3+ + H2O
a) ¿Qué especie es el oxidante y a qué se reduce? ¿Pierde o gana electrones?
b) ¿Qué especie es el reductor y a qué se oxida? ¿Pierde o gana electrones?

Solución
A la vista de la ecuación iónica podemos observar:
a) El oxidante es Cr2O72−, gana electrones y se reduce a Cr3+
b) El reductor es Fe2+, pierde electrones y se oxida a Fe3+

Ejercicios
1 Dadas las siguientes reacciones redox, señala el agente oxidante y el agente reductor:
a) Zn + 2 H+ → Zn2+ + H2
b) Cu + 2 H+ → Cu2+ + H2
c) I2 + 2 Fe2+ → 2 I + 2 Fe3+
d) Cr + 3 Fe3+ → Cr3+ + 3 Fe2+
2 Dada la reacción química: Co3+ (aq) + Br (aq) → Co2+ (aq) + Br2 (l)
a) Justifica si se trata de una reacción de oxidaciónreducción.
b) ¿Qué especie se oxida? ¿Cuál se reduce? ¿Quiénes son el oxidante y el reductor?
Para distinguir rápidamente si una reacción química es un proceso redox e identificar cuál es el oxidante y cuál es el reductor, recurrimos al concepto de número o estado de oxidación.
El número de oxidación de un átomo en un compuesto covalente representa el número de cargas eléctricas que corresponderían a ese átomo considerando los desplazamientos electrónicos derivados de la diferente electronegatividad de los átomos enlazados.
Otra manera de definir el número de oxidación sería:
El número de oxidación o estado de oxidación representa la carga que tendría un átomo considerando que los únicos enlaces que se forman en la especie química en la que interviene dicho elemento son iónicos.
En compuestos covalentes, por tanto, el estado de oxidación representa una carga eléctrica ficticia, ya que en este enlace no hay transferencia de electrones, sino compartición de los electrones del enlace.
Por ejemplo, en la molécula de HF, el F es más electronegativo que el H y atraerá hacia sí los electrones del enlace. Por eso, su número de oxidación (n.o.) es −1 y el del hidrógeno, +1.
En los compuestos iónicos sí hay transferencia total de electrones; por tanto, el número de oxidación coincide con la carga eléctrica de los iones. Así, en el NaCl, el Na tiene número de oxidación +1, y el Cl, −1.
HF (1)(–1) : # + Na Cl (1) (–1) –: + +
La determinación del número de oxidación se lleva a cabo aplicando las siguientes reglas:
• El estado de oxidación de los elementos en estado fundamental o sin combinar es nulo. Ejemplo: Li, Mg, H2, P4
• El estado de oxidación de un ion monoatómico es igual a su carga eléctrica. Así el número de oxidación del ion Li+ es +1, el del ion Be2+ es +2 y el número de oxidación del Al3+ es +3.
• El número de oxidación del oxígeno en todos sus compuestos es –2. salvo en los peróxidos que es −1; en los superóxidos, O2 , que es −1/2, y en su combinación con el flúor, donde es +2.
• El número de oxidación del hidrógeno en todos sus compuestos es +1, salvo en los hidruros metálicos (MgH2, KH…), que es −1.
• El número de oxidación de los metales es positivo; así, el de los metales alcalinos es +1 y el de los metales alcalinotérreos es +2.
• El número de oxidación de los no metales puede ser positivo o negativo. En los compuestos formados por no metales en los que no interviene el oxígeno, el elemento más electronegativo tiene un número de oxidación negativo, con un valor numérico igual al de la carga de su ion negativo más frecuente.
En un estudio realizado en 2017 por investigadores del CSIC y de la NASA se determinó que el color rojo de la superficie de Marte podía deberse a la fuerte oxidación generada por la disolución de micropartículas de pirita en una atmósfera sin oxígeno, lo que generó radicales libres que, a su vez, indujeron la precipitación de óxidos y sulfatos de hierro.

La implantación del hidrógeno como combustible requiere encontrar sistemas con elevadas capacidades volumétricas y gravimétricas capaces de almacenarlo de forma segura y reversible. Desde hace años se investiga en la preparación y caracterización de hidruros metálicos como el MgH2, capaces de almacenar grandes cantidades de hidrógeno en dichas condiciones.
• El número de oxidación del flúor es siempre −1. El resto de los halógenos (Cl, Br, I) tienen números de oxidación negativos si están unidos a átomos menos electronegativos y positivos si se combinan con átomos más electronegativos. En el caso de los haluros, el halógeno tiene siempre número de oxidación −1.
• La suma algebraica de los números de oxidación de los átomos, de un compuesto neutro, multiplicada por los correspondientes subíndices debe ser cero. En los iones poliatómicos, la suma de los números de oxidación debe coincidir con la carga eléctrica del ion.
La valencia de un elemento es la capacidad que tiene dicho elemento para combinarse con otro.
Así, en los siguientes compuestos CH4, CH3I y CCl4, el carbono actúa siempre con valencia +4, mientras que el número de oxidación varía de unos compuestos a otros y podríamos considerarlo como una carga ficticia que se asigna a un elemento en un determinado compuesto.
2 Asigna los estados de oxidación a todos los átomos de las siguientes moléculas: a) CO2, b) SF6
Solución
a) En este caso, el oxígeno tiene estado de oxidación −2. Determinamos el estado de oxidación del carbono teniendo en cuenta que como CO2 es neutra, cada oxígeno es −2 y hay dos átomos; por tanto, hay que asignar al átomo de carbono un número de oxidación +4.
b) Como el flúor tiene mayor electronegatividad que el azufre, su número de oxidación es −1. Determinamos el estado de oxidación del azufre teniendo en cuenta que SF6 es neutra. Cada flúor es −1 y hay seis átomos; por tanto, hay que asignar al átomo de azufre un número de oxidación +6.
Ejercicios
3 El hexafluoruro de azufre (SF6) es uno de los gases causantes del efecto invernadero catalogado con un índice GWP (Global Warning Potential), unas 20 000 veces mayor que el CO2. Esto alerta de la necesidad de avanzar en la erradicación del uso del hexafluoruro de azufre a nivel industrial. Investiga acerca de las propiedades del SF6 y su uso en la vida cotidiana. Establece cuatro líneas de acción para reducir las emisiones de gases de efecto invernadero (GEI) de acuerdo a las metas 13.2 y 13.3 de los objetivos de desarrollo sostenible.
4 Indica el número de oxidación del nitrógeno en cada uno de los siguientes compuestos: N2, NO, NO2, KNO3, NH3. Justifica cuál de ellos tiene el mayor carácter oxidante.
−2
PCl5 0 P: 5 , Cl: −1
Los gases de efecto invernadero causan un aumento de la temperatura de la atmósfera y originan sequías. Embalse de Zahara-El Gastor, sierra de Grazalema, Cádiz.

5 a) Indica el número de oxidación de todos los átomos de los compuestos AgNO3 y Al2(SO4)3
b) Indica el número de electrones transferidos en la semirreacción: MnO4 → MnO2. ¿Se trata de una oxidación o de una reducción?
6 Dadas las siguientes reacciones:
a) NaOH + HNO3 → NaNO3 + H2O
b) Cu + Cl2 → CuCl2
c) CH4 + 2 O2 → CO2 + 2 H2O
Responde: a) Justifica si todas son de oxidaciónreducción. b) Identifica el agente oxidante y el reductor donde proceda.
Uno de los métodos más utilizados para realizar el ajuste de las ecuaciones químicas de oxidación-reducción es el método del ion-electrón, desarrollado en 1927. Este método se basa en las reacciones que tienen lugar en los electrodos de los procesos electroquímicos. El proceso redox global se descompone en una semirreacción de oxidación y otra de reducción, que se ajustan por separado. En la reacción ajustada, se debe cumplir:
• La conservación de la carga: en el balance final de cargas, la carga neta debe ser nula.
• La conservación de la masa: el número de átomos de cada especie debe ser igual en cada uno de los miembros de la ecuación química.
• El número de electrones cedidos por el agente reductor es igual al número de electrones captados por el agente oxidante.
Este método tiene ligeras diferencias si la reacción a ajustar tiene lugar en medio ácido o en medio básico. En él se escriben en forma iónica los ácidos, las bases y las sales, y se escriben en forma molecular los elementos y los sólidos.
En el método del ion-electrón, se consideran los siguientes pasos:
1. Se escribe la reacción completa sin ajustar y asignamos a cada uno de los elementos su número de oxidación. Se determinan los elementos que se oxidan y los que se reducen.
2. Se identifican las especies oxidante y reductora, y se escriben los pares conjugados (oxidante/reductor).
3. Se escriben las semirreacciones de oxidación y reducción, de manera que aparezcan las especies que realmente intervienen en el proceso (en forma molecular o iónica) y que contengan al elemento cuyo número de oxidación cambia. En la semirreacción de reducción se coloca a la izquierda de la flecha la forma oxidada y a la derecha su forma reducida. En la semirreacción de oxidación, la forma reducida está a la izquierda de la flecha, y su forma oxidada, a la derecha.
4. Se ajustan todos los átomos que no sean oxígeno e hidrógeno.
5. Se ajustan los átomos de hidrógeno y oxígeno en la forma:
• Medio ácido: si la reacción tiene lugar en medio ácido, los H se ajustan añadiendo iones H+ y los O se ajustan añadiendo moléculas de H2O. El O se ajusta poniendo en el miembro con defecto de oxígeno tantas moléculas de H2O como átomos de oxígeno faltan y ajustando los hidrógenos añadidos con protones H+ en el otro miembro.
• Medio básico: si la reacción tiene lugar en medio básico, los H se ajustan añadiendo moléculas de H2O y los O se ajustan añadiendo grupos OH . El oxígeno se ajusta poniendo en el miembro con defecto de oxígeno el doble de OH que oxígenos falten, y el exceso de O e H se ajusta en el otro miembro con agua.
6. Se ajustan las cargas eléctricas en cada semirreacción por medio de electrones. Estos estarán siempre en el lado donde se encuentre la forma oxidada; en la semirreacción de oxidación, a la derecha, y en la de reducción, a la izquierda.
7 Dada la siguiente ecuación: KBrO3 + Cu + H2SO4 → → Br2 + CuSO4 + K2SO4 + H2O a) Escribe y ajusta la reacción redox correspondiente, b) indica las sustancias que se oxidan y las que se reducen en la ecuación.
8 Uno de los beneficios más importantes del café es la presencia de sustancias químicas que se caracterizan por sus propiedades antioxidantes tales como el ácido clorogénico (C16H18O9), el ácido cafeico (C9H8O4), el cafetol (C20H28O3) y el kahweol (C20H26O3). Tomar entre una y tres tazas de café al día reduce en un 24 % el riesgo de padecer enfermedades cardiovasculares. Busca información acerca de las propiedades antioxidantes del ácido clorogénico y del ácido cafeico y enumera alguna de ellas. El «comercio justo» del café fomenta patrones productivos y de consumo alternativos y solidarios, garantizando un comercio en mejores condiciones. En grupos, analizad cómo a través del «comercio justo» pueden lograrse los objetivos 1, 8 y 12 para el desarrollo sostenible.

7. Se iguala el número de electrones en ambas semirreacciones, para lo cual, se multiplican los coeficientes estequiométricos de cada semirreacción por un número entero tal que iguale el número de electrones ganados por la especie oxidante con los electrones perdidos por la especie reductora.
A continuación, sumamos las semirreacciones eliminando los electrones y si alguna especie química aparece en ambos lados de la ecuación, se simplifica. Así, obtenemos la reacción iónica ajustada.
8. Para escribir la reacción molecular ajustada:
a) Colocamos las moléculas de ácido o de base necesarias para ajustar correctamente los H+ o los OH
b) Añadimos y ajustamos los iones espectadores, comprobando que no hayamos desajustado alguna especie que ya lo estaba. Si fuese así, la ajustaríamos por tanteo.
3 Ajusta la siguiente reacción química: HNO3 + Cu → Cu(NO3)2 + NO2 + H2O
Solución
1. Asignamos a cada elemento su número de oxidación:
El átomo de N pasa de tener n. o. +5, en el HNO3, a +4 en el NO2 (cada átomo de N gana un electrón). Por tanto, al disminuir el valor de su n. o. se ha reducido (oxidante).
El átomo de Cu aumenta su n. o. y pasa de 0 a +2 en el Cu(NO3)2. Para ello, cada átomo de Cu cede 2 electrones, por lo que se oxida (reductor).
2. La especie reductora será el cobre, Cu, que se oxida a Cu2+. El par conjugado es Cu2+/Cu.
La especie oxidante es el ion NO3 (en disolución acuosa, el HNO3 se encuentra disociado en sus iones), que se reduce a NO2. El par conjugado es NO3 /NO2
3. Escribimos las semirreacciones que experimentan los dos pares redox:
Semirreacción de reducción: NO3 → NO2
Semirreacción de oxidación: Cu → Cu2+
4. Ajustamos todos los átomos, excepto O e H. En este caso, están ajustados.
9 Ajusta, por el método del ion-electrón, la reacción:
K2Cr2O7 + SnCl2 + HCl → SnCl4 + CrCl3 + H2O + KCl
a) ¿Cuál es la especie oxidante y cuál es la reductora?, ¿qué especie se oxida y cuál se reduce?
b) Ajusta la reacción iónica y la reacción global.
Los iones que no experimentan cambios en su número de oxidación no intervienen en la reacción redox. Se denominan iones espectadores y para el ajuste se dejan aparte inicialmente. Una vez obtenida la reacción iónica ajustada, se añadirán para obtener la reacción molecular ajustada (paso 8).
5. Ajustamos los átomos de H y de O. Para ello, añadimos una molécula de H2O a la derecha de la semirreacción de reducción, lo que nos obliga a poner 2 H+ a la izquierda.
Semirreacción de reducción: 2 H+ + NO3 → NO2 + H2O
Semirreacción de oxidación: Cu → Cu2+
6. Ajustamos la carga en cada semirreacción por medio de electrones. Así, teniendo en cuenta el paso 1.
Semirreacción de reducción:
2 H+ + NO3 + 1e → NO2 + H2O
Semirreacción de oxidación: Cu → Cu2+ + 2 e
7. Igualamos el número de electrones en ambas semirreacciones, multiplicando la primera por 2 y las sumamos:
Semirreacción de reducción:
4 H+ + 2 NO3 + 2 e → 2 NO2 + 2 H2O Semirreacción de oxidación: Cu → Cu2+ + 2 e
Reacción iónica:
4 H+ + 2 NO3 + Cu → 2 NO2 + Cu2+ + 2 H2O
8. Escribimos la reacción molecular completa:
4 HNO3 + Cu → 2 NO2 + Cu (NO3)2 + 2 H2O
En este caso, no tenemos que reajustar la ecuación.
10 El hidróxido de cromo (III) es oxidado por el cloro gaseoso (Cl2) en presencia de hidróxido de potasio, obteniéndose cromato de potasio, cloruro de potasio y agua como productos de la reacción. Ajusta las ecuaciones iónica y molecular por el método del ion-electrón.
El ajuste de una reacción redox mediante el método del ion-electrón permite no solo conocer la ecuación ajustada, sino también la determinación de las cantidades en masa y volumen de todas las sustancias participantes en un proceso de este tipo. Así, por ejemplo, en la reacción redox:
4 HCl + MnO2 → MnCl2 + Cl2 + 2 H2O podemos decir:
• Por cada mol de MnO2 reaccionan cuatro mol de HCl.
• Por cada mol de MnO2 obtenemos un mol de Cl2 En muchas ocasiones, se utilizan estos cálculos estequiométricos ante la necesidad de hacer una determinación analítica de una sustancia presente en una muestra. Dos de los agentes oxidantes que más se suelen emplear en estos análisis son el K2Cr2O7 y el KMnO4. Cuando la reacción es completa, es decir, los reactivos oxidante y reductor han reaccionado completamente, se dice que se ha alcanzado el punto de equivalencia.
Ejercicios resueltos
4 El dicromato de potasio oxida al yoduro de sodio en medio ácido sulfúrico formándose, entre otros, sulfato de sodio, sulfato de potasio, sulfato de cromo (II) y yodo molecular. Cuestiones: a) formula las semirreacciones de oxidación y reducción, b) formula la reacción iónica y di cuáles son las especies oxidante y reductora, c) formula la reacción molecular, d) si tenemos 120 mL de disolución de yoduro de sodio y se necesitan para su oxidación 100 mL de disolución de dicromato de potasio 0,2 M, ¿cuál es la molaridad de la disolución de yoduro de potasio?

Solución
a) Escribimos las semirreacciones de oxidación y reducción:
Semirreacción de oxidación: 2 I → I2 + 2 e
Semirreacción de reducción:
Cr2O72− + 14 H+ + 6 e → 2 Cr3+ + 7 H2O
b) Ajustamos las cargas, así:
Semirreacción de oxidación: 6 I → 3 I2 + 6 e
Ejercicios
11 El dicromato de potasio reacciona, en medio ácido, con estaño según la siguiente reacción:
Sn + HCl + K2Cr2O7 → SnCl4 + CrCl3 + KCl + H2O
a) Ajusta la reacción por el método del ion-electrón, b) determina las masas de CrCl3 y SnCl4 obtenidas a partir de 15 g de Sn puro y 45 g de K2Cr2O7, c) determina la riqueza de una aleación de estaño si 1 g de esta necesita 25 mL de K2Cr2O7 0,1 M para reaccionar completamente.
Datos: Cr = 52 u, Cl = 35,5 u, Sn = 118,7 u, K = 39,1 u, O = 16 u, H = 1u.
Dos disoluciones de dicromato de potasio (oxidante) de distinta concentración.
Semirreacción de reducción:
Cr2O72− + 14 H+ + 6 e → 2 Cr3+ + 7 H2O
La reacción iónica viene dada por:
6 I + Cr2O72− + 14 H+ → 3 I2 + 2 Cr3+ + 7 H2O La especie oxidante es K2Cr2O7 y la reductora el NaI.
c) La reacción molecular viene dada por: K2Cr2O7 + 6 NaI + 7 Na2SO4 → → Cr2(SO4)3 + 3 Na2SO4 + K2SO4 + 3 I2 + 7 H2O
d) En 100 mL de disolución 0,2 M de K2Cr2O7 hay: n = M · V = 0,1 M ∙ 0,2 L = 0,02 mol de K2Cr2O7 Si nos fijamos en la estequiometría de la reacción:
, n molNal molK Cr O mol molK Cr O 6 10 02 22 72 27 = ; n = 0,12 mol de NaI
Teniendo en cuenta que el volumen de la disolución de yoduro de sodio es 120 mL, calculamos su molaridad: , , mol M M L 012 012 1 ==
12 Al mezclar sulfuro de hidrógeno con ácido nítrico se forma azufre, dióxido de nitrógeno y agua: a) formula las semirreacciones de oxidación y reducción, b) formula la reacción molecular global indicando las especies oxidante y reductora, c) ¿cuántos gramos de azufre se obtendrán a partir de 24 cm3 de ácido nítrico comercial de 65 % en masa y densidad 1,39 g · cm–3?, d) calcula el volumen de dióxido de nitrógeno que se obtiene, medido a 700 mm de Hg y 25 ºC. Datos: R = 0,082 atm · L · mol–1 · K–1. Masas atómicas: H = 1 u, N = 14 u, O = 16 u, S = 32 u.
Una celda electroquímica, también denominada celda galvánica o voltaica, es un dispositivo en el que se obtiene una corriente eléctrica a partir de una reacción redox espontánea.
En las reacciones redox hay una transferencia de electrones de la especie reductora a la especie oxidante que tiene lugar directamente entre los reactivos en contacto. Este proceso de transferencia es directo, es decir, de especie química a especie química y puede aprovecharse para realizar trabajo eléctrico; para ello, debemos conseguir que los electrones circulen por un circuito exterior, generando así una corriente eléctrica.
Una celda electroquímica consta de los siguientes elementos:
• Electrodos: son dos conductores, cada uno de los cuales se halla sumergido en una disolución acuosa de una de sus sales. El cátodo es el electrodo donde tiene lugar la reducción y el ánodo es el electrodo en el que ocurre la oxidación.
• Un hilo conductor externo que conecta los dos electrodos y que permite el paso de electrones desde el polo negativo (ánodo) al polo positivo (cátodo).
• Un sistema que separa las dos zonas donde tienen lugar las dos semirreacciones redox. Se utiliza bien un tabique poroso, o bien un puente salino. La función de ambos es impedir la acumulación de cargas y evitar que se mezclen las disoluciones.
– Tabique poroso: consiste en una membrana semipermeable que permite el flujo de iones.
– Puente salino: es un tubo de vidrio en forma de U lleno de un gel de un electrolito que no influye en la reacción de la celda. Los extremos del tubo en U se tapan con discos porosos, lo que permite una libre difusión de los iones, minimizando, a la vez, la mezcla de las disoluciones interior y exterior del puente.
• Voltímetro: conectado al hilo conductor externo para medir la diferencia de potencial, o voltaje entre los dos electrodos. Esta diferencia de potencial es una medida de la tendencia de la reacción global de la celda para avanzar hacia el equilibrio.

La notación que representa una celda electroquímica se denomina diagrama de celda y es la siguiente:
Ánodo | disolución anódica || puente salino || disolución catódica
Se empieza siempre escribiendo a la izquierda el proceso de oxidación (ánodo) y a la derecha el proceso de reducción (cátodo), de forma que los electrones circulen de izquierda a derecha. La barra vertical simple (|) indica la existencia de una interfase (separación de fases), mientras que la barra vertical doble (||) indica un puente salino. Por ejemplo:
Las celdas electroquímicas fueron desarrolladas a finales del siglo xviii por los científicos Luigi Galvani y Alessandro Volta, por lo que también se las denomina celdas galvánicas o voltaicas en su honor.
Elementos de una celda electroquímica.
A diario usamos diferentes tipos de pilas para hacer que funcionen distintos dispositivos; en todos los casos, el trabajo eléctrico se consigue gracias a la producción de una reacción redox en la pila correspondiente.
Se denomina así en honor de su inventor J. F. Daniell. Es la más sencilla de las celdas electroquímicas y está formada por dos compartimentos, en uno de ellos introducimos un electrodo de Zn en una disolución de ZnSO4, y en el otro ponemos un electrodo de Cu en una disolución de CuSO4. Ambas disoluciones se encuentran unidas mediante un puente salino (que contiene KCl) cuya finalidad es mantener las dos disoluciones en contacto eléctrico, evitando el contacto físico (cerrar el circuito), y acumulaciones de carga. Mediante un hilo conductor externo se realiza la transferencia de electrones de un electrodo a otro, e intercalando un voltímetro en el circuito se mide la diferencia de potencial entre los dos electrodos.
John Frederic DaniellJ. F. Daniell (1790-1845) es el científico inglés que obtuvo más medallas por sus descubrimientos. Antes de 1901, fecha del primer Premio Nobel, los méritos científicos se valoraban con la entrega de medallas.

Pila Daniell con puente salino y con tabique poroso.
En el electrodo de Zn (ánodo) se produce la oxidación:
Zn (s) → Zn2+ (aq) + 2 e
En el electrodo de Cu (cátodo) se produce la reducción:
Cu2+ (aq) + 2 e → Cu (s)
La reacción global de la pila es la suma de ambos procesos:
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
A medida que transcurre la reacción, el electrodo de cinc se va disolviendo (la lámina de Zn disminuye su masa) y los iones Cu2+ se depositan sobre el electrodo de cobre como cobre metálico (la lámina de Cu aumenta su masa). La disolución de Zn2+ se vuelve más concentrada, y la disolución de Cu2+, más diluida. La corriente eléctrica fluye del electrodo de Zn (polo negativo de la pila) al electrodo de Cu (polo positivo).
En el compartimento donde tenemos el cinc es donde ocurre la oxidación, por lo que su disolución quedará cargada positivamente perdiendo la neutralidad eléctrica. En el compartimento donde tenemos el cobre ocurre la reducción, por lo que su disolución iría perdiendo progresivamente cargas positivas.
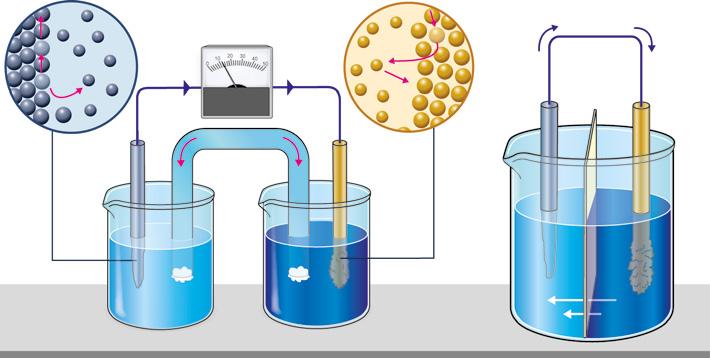
Se produce entonces un desequilibrio de carga eléctrica que se compensa por el desplazamiento de los iones del puente salino: iones Cl hacia la disolución de Zn2+ e iones K+ hacia la de Cu2+.
Ejercicios
13 Explica qué es un puente salino y qué función tiene en una celda electroquímica.
14 A partir de la representación Cu(s)|Cu2+(1M)||Ag+(1M)|Ag(s), indica las semirreacciones que tienen lugar en el ánodo y en el cátodo, así como el sentido del movimiento de los electrones y de los iones presentes.
15 Los ingenieros químicos trabajan en los procesos de transformación de sustancias para la industria química o física. Usan sus conocimientos para producir una amplia gama de productos de uso cotidiano, como plásticos, fibras, pinturas, fármacos, productos de limpieza, detergentes, etc. Investiga acerca de las competencias y del perfil profesional de un ingeniero químico.
Al introducir un metal en una disolución de sus iones aparece inmediatamente una diferencia de potencial entre el metal y la disolución, llamada potencial de contacto o potencial de electrodo. Dicho potencial depende de la naturaleza del metal y de la concentración de la disolución, además de la temperatura, por tratarse de un equilibrio químico. En el caso de la pila Daniell, experimentalmente se encuentra que cuando las concentraciones de los iones Cu2+ y Zn2+ son 1,0 M, el potencial de la pila es 1,1 V.
La corriente eléctrica fluye espontáneamente del ánodo al cátodo porque hay una diferencia de potencial eléctrico entre los electrodos. La energía potencial de los electrones es mayor en el ánodo que en el cátodo y por este motivo los electrones fluyen espontáneamente del ánodo al cátodo a través del circuito externo.
La diferencia de potencial eléctrico entre el ánodo y el cátodo se mide experimentalmente con un voltímetro donde la lectura en voltios es el potencial de la celda.
La diferencia de potencial entre los dos electrodos de la celda electroquímica proporciona la fuerza motriz que empuja a los electrones a través del circuito externo. A esta diferencia de potencial la llamamos fuerza electromotriz (f. e. m.).
Ecelda = f. e. m. = E+ − E = Ecátodo − Eánodo
Ecátodo y Eánodo son los potenciales de reducción de los electrodos. Es imposible medir el potencial de un electrodo aislado, pero si asignamos el valor cero a un electrodo concreto, este puede servir de electrodo de referencia para determinar los potenciales relativos del resto de los electrodos.
Como electrodo de referencia al que se le asigna el valor cero se ha elegido el electrodo de hidrógeno, formado por un electrodo de platino sumergido en una disolución que contiene iones H3O+ en concentración 1 M, donde se burbujea H2 gas a una presión de 1 atm.
Pt (s) | H2 (g, 1 atm) | H+ (aq, 1M)
La reacción en el electrodo es: 2 H+ (aq) + 2 e → H2 (g) E° = 0 V
Estas condiciones se denominan estándar, y el potencial, potencial estándar de reducción, que se representa por E°.
Ejercicios
16 Explica el concepto de electrodo de referencia.
17 Para (Pt)/H2 (1atm)/H+ (1M) || Cu2+ (1M)/Cu: a) escribe las semirreacciones electródicas y la reacción global de la pila, b) calcula su potencial global.
Dato: Eº (Cu2+/Cu) = 0,34 V.
Potencial redox de los suelos
Se denomina potencial redox de un suelo a su capacidad reductora y oxidante. El potencial redox afecta a aquellos elementos que pueden existir en el suelo en dos o más estados de oxidación (O, C, N, S, Fe, Mn, Cu). Las condiciones de oxidación-reducción resultan ser de vital importancia en los procesos de meteorización o alteración de los minerales del suelo y las rocas de las que proceden, repercutiendo directamente en la formación de los tipos de suelo, así como en la actividad biológica del mismo. El color de los suelos es un buen indicador de su potencial redox.
18 ¿Qué te hace decir eso? Discute, justificando tu respuesta, si el electrodo de Fe3+/Fe2+ en condiciones normales se oxidará o se reducirá espontáneamente frente al electrodo normal de hidrógeno.
Dato: Eº (Fe3+/Fe2+) = 0,77 V.
Una vez fijado este criterio, se puede determinar el potencial estándar (E°) de cualquier electrodo sin más que hallar la fuerza electromotriz de la celda formada por el electrodo en cuestión sumergido en una disolución 1 M de sus iones y el electrodo normal de hidrógeno, efectuando la medida a 25 ºC. El potencial normal de dicho electrodo es la diferencia de potencial entre dicho electrodo y el electrodo normal de hidrógeno. La expresión mediante la que obtenemos el potencial de la celda electroquímica viene dada por:
E° celda = E° red. cátodo + E° ox. ánodo
Si trabajamos con potenciales normales de reducción, se cumple que:
E° celda = E° red. cátodo − E° red. ánodo
Para que la celda electroquímica funcione, el potencial debe ser positivo:
E° celda = E° red. cátodo + E° ox. ánodo > 0
Se denomina serie electroquímica de potenciales estándar de reducción a la escala relativa de los potenciales de reducción estándar.
Utilizando esta serie electroquímica, se puede explicar la tendencia de una especie a reducirse u oxidarse y calcular la fuerza electromotriz de una celda formada por cualquier pareja de electrodos. A la hora de utilizar esta serie, debemos tener en cuenta:
• Los potenciales hacen referencia al proceso de reducción, por lo que si se invierte el proceso, habrá que cambiar el signo al potencial de reducción (obteniendo, así, el potencial de oxidación).
• Una sustancia es tanto más oxidante cuanto mayor es su tendencia a reducirse. Cuanto mayor sea el potencial de reducción de una semirreacción dada, mayor será el poder oxidante de la especie química escrita a la izquierda. El flúor es el oxidante más fuerte y el litio es el reductor más fuerte.
• Las semirreacciones descritas en la serie electroquímica son reversibles. Dependiendo de con qué especie química reaccione, cualquier electrodo puede actuar como ánodo (salvo el flúor) o como cátodo (salvo el litio).
• El cambio de los coeficientes estequiométricos en una semirreacción no afecta al valor del potencial.
La serie electroquímica sirve para calcular la f. e. m. estándar de una celda cualquiera, a partir de los potenciales conocidos de sus electrodos, teniendo en cuenta que el electrodo de menor potencial de reducción será el polo negativo (ánodo) en el que tiene lugar la oxidación, y el de mayor potencial el polo positivo (cátodo), donde tiene lugar la reducción.
La reacción global que tiene lugar en la celda será la suma de ambas semirreacciones y su f. e. m. se obtendrá sumando los correspondientes potenciales de electrodo.
Determinación del potencial estándar de electrodo del cinc.
H+ + 2 e → H2 0,00
Cu2+ + 2 e → Cu +0,34
MnO4 + e → MnO42− +0,56
Fe3+ + e → Fe2+ +0,77
Ag+ + e → Ag +0,80
Cr2O72− + 14 H+ + 6 e− → → 2 Cr3+ + 7 H2O +1,33

Cl2 + 2 e → 2 Cl +1,36
MnO4 + 8 H+ + 5 e → → Mn2+ + 4 H2O +1,51
Pb4+ + 2 e → Pb2+ +1,67
Desde el punto de vista cuantitativo, existe una relación matemática entre el potencial de una celda y la concentración de reactivos y productos de una reacción redox cuando esta se realiza en condiciones no estándar. Dicha ecuación fue propuesta por W.H. Nernst:
1 0, 059log (298, 15 K) EE n QT = = º
donde E° es el potencial de reducción estándar; E es el potencial en condiciones no estándar; Q, el cociente de reacción establecido en el sentido en el que es espontáneo el proceso, y n es la cantidad de sustancia o de electrones transferidos en la reacción. Hay dos casos posibles:
• Si [productos] >[reactivos] → Q > 1 → E < E°. La reacción de la celda se hace menos espontánea (la f. e. m. disminuye).
• Si [productos]<[reactivos] → Q < 1 → E > E°. La reacción de la celda se hace más espontánea (la f. e. m. aumenta).
Así en una pila de Daniell donde [Cu2+] = 5 M y [Zn2+] = 0,05 M, tenemos:
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s) E° = 1,1 V – 1, 1 2 0, 059 log 5 0, 05 1, 16 V E == > 1,1 V (E°)
La reacción se vuelve más espontánea.
Ejercicios resueltos
5 Considerando los siguientes metales: Zn, Mg, Pb y Fe, responde a las siguientes cuestiones y justifica las respuestas:
a) Ordénalos de mayor a menor facilidad de oxidación.
b) ¿Cuáles de estos metales pueden reducir Fe3+ a Fe2+ pero no Fe2+a Fe metálico?
Datos: E° (Zn2+/Zn) = −0,76V
E° (Mg2+/Mg) = −2,37V; E° (Pb2+/Pb) = −0,13 V
E° (Fe2+/Fe) = −0,44V; E° (Fe3+/Fe2+) = 0,77 V
Ejercicios
19 Deduce razonadamente por qué el hierro (II) puede ser oxidado en medio ácido a hierro (III) por el ion nitrato y, sin embargo, este mismo ion no puede oxidar el oro en su estado elemental a oro (III). Justifica la respuesta desde el punto de vista electroquímico y escribe las reacciones correspondientes.
Datos: E° (NO3 /NO) = 0,96 V, E° (Fe3+/Fe2+) = 0,77 V, E° (Au3+/Au) = 1,50 V.
20 Indica razonadamente lo que ocurrirá si a una disolución de FeSO4 le añadimos: a) trocitos de cinc,
Walter Hermann NernstW. H. Nernst (1864-1941). Físico y químico alemán, recibió el Premio Nobel de Química en 1920. Desarrolló el teorema del calor, que posteriormente fue considerado como la tercera ley de la termodinámica, según el cual: «Todos los cristales perfectos tienen la misma entropía en el cero absoluto».

Solución
1. a) Se oxida más fácilmente el que tiene el potencial de reducción más negativo, en este caso, el magnesio. El que menos fácilmente se oxida es el plomo, ya que tiene el potencial de reducción menos negativo, es decir, el mayor potencial de todos. Así, el orden de mayor a menor tendencia es el siguiente: Mg, Zn, Fe, Pb.
b) El plomo, ya que todos pueden reducir Fe3+ a Fe2+, pero solo él no puede reducir el Fe2+ a Fe metálico porque tiene un potencial de reducción mayor.
Pb + Fe2+ → Pb2+ + Fe
E° = E°red. + E° ox. = −0,44V + 0,13 V = −0, 31 V
b) limaduras de cobre. Datos: E° ( Fe2+/Fe) = −0,44V, E° (Zn2+/Zn) = −0,76 V, E° (Cu2+/Cu) = 0,34 V.
21 Una pila consta de una semicelda que contiene una barra de platino sumergida en una disolución 1 M de Fe2+ y 1 M de Fe3+. La otra semicelda consiste en un electrodo de talio sumergido en una disolución 1 M de ion talio (I): a) escribe las semirreacciones en el cátodo y en el ánodo, y la reacción global, b) calcula el potencial estándar de la pila.
Datos: E° (Fe3+/Fe2+) = 0,77 V, E° (Tl+/Tl)= −0,34 V.
Según la termoquímica, las reacciones químicas son espontáneas cuando ΔG < 0 y a medida que la reacción transcurre, su ΔG se va aproximando al valor 0, que se alcanza en el momento del equilibrio.
La termodinámica indica que para un proceso a presión y temperatura constante se cumple:
ΔG = −P · ΔV = −ΔW [1]
Como el trabajo eléctrico cumple que ΔW = n · F · Ecelda siendo n el número de electrones transferidos, y F, la constante de Faraday (1F = 96 500 C), sustituyendo nos queda:
ΔG = −n · F · Ecelda
Esta expresión nos permite determinar la espontaneidad de los procesos redox. Como n y F son cantidades positivas, un valor de Ecelda positivo origina un valor negativo de ΔG, lo que significa que la reacción es espontánea. Por el contrario, si el valor de Ecelda es negativo, la reacción no será espontánea. En
estándar, se cumple que: ΔG° = −n · F · E° celda
Q ΔG E° Situación
< K + Espontánea
= K 0 0 Equilibrio
>K + No espontánea
Tabla 5. Espontaneidad de la reacción según los valores de Q, E° y ΔG
6 Completa y ajusta, en medio ácido, las semirreacciones de oxidación y de reducción, así como la reacción global. Indica si son espontáneas las reacciones globales en función de los potenciales normales redox.
a) Cr2O72− + S2− + H+ → Cr3+ + …
b) KMnO4 + HCl + SnCl2 → SnCl4 + …
Datos: E° (Cr2O72−/Cr3+) = 1,33 V ; E° (S/S2−) = 0,14
V; E° (MnO4 /Mn2+) = 1,51 V; E° (Sn4+/Sn2+) = 0,15 V.
Solución
a) Semirreacción reducción:
Cr2O72− + 14 H+ + 6 e → 2 Cr3+ + 7 H2O; E° = 1,33 V
Semirreacción oxidación: S2− → S + 2 e E° = −0,14 V
Ejercicios
22 a) Ajusta la siguiente reacción según el método del ion-electrón en medio ácido: KIO3 + KI + H2SO4 → I2 + H2O + K2SO4
b) Deduce si la citada reacción será espontánea en condiciones estándar y cuál será la especie reductora.
Datos: E° (I2/I ) = 0,52 V, E° ( IO3 /I2) = 1,2 V.
La corrosión ordinaria es un proceso redox por el cual los metales se oxidan por medio del oxígeno, O2, en presencia de humedad. El oxígeno en estado gaseoso es un agente oxidante, y la mayoría de los metales tienen potenciales de reducción menores que él, por tanto, puede oxidarlos.

Reacción global: Cr2O72− + 14 H+ + 3 S2− → 2 Cr3+ + 3 S + 7 H2O; E° = 1,19 V Por tanto, como E° > 0 , entonces ΔG° < 0 y la reacción es espontánea.
b) Semirreacción reducción:
MnO4 + 8 H+ + 5 e → Mn2+ + 4 H2O; E° = 1,51 V Semirreacción oxidación: Sn2+ → Sn4+ + 2 e ; E° = −0,15 V Reacción global:
2 KMnO4 + 16 HCl + 5 SnCl2 → 2 MnCl2 + 5 SnCl4 + 8 H2O + + 2 KCl E° = 1,36 V Por tanto, como E° > 0, entonces ΔG° < 0 y la reacción es espontánea.
23 Indica, de forma razonada, si la reacción: Sn (s) + Pb2+ (aq) → Sn2+ (aq) + Pb (s) transcurrirá de manera espontánea en el sentido en que está escrita. Supón que reactivos y productos se encuentran en estados estándar.
Datos: E° (Sn2+/Sn) = −0,137 V.
E° (Pb2+/Pb) = −0,125 V.
La valoración redox es una técnica analítica muy similar a la valoración ácido-base, pero, en este caso, empleando agentes oxidantes y reductores.
En las valoraciones redox podemos determinar la concentración de un agente oxidante a partir de la concentración conocida de un agente reductor (valorante).
Para que una reacción redox pueda ser utilizada en análisis volumétrico, tiene que cumplir los siguientes requisitos:
• Debe ser una reacción simple, cuantitativa, libre de reacciones secundarias y que se pueda representar por una ecuación química en relación estequiométrica o de equivalencia química.
• El valorante debe ser lo bastante «fuerte» como para que la reacción sea completa.
• El valorante ha de reaccionar rápidamente con la sustancia de concentración desconocida, es decir, debe ser prácticamente instantánea.
• Las reacciones redox a veces son lentas, este inconveniente se resuelve mediante distintos procedimientos: temperatura elevada, adición de catalizadores o exceso de reactivos.
24 Se sabe que el ion MnO4 oxida el Fe (II) a Fe (III) en presencia de H2SO4 mientras se reduce a Mn (II). a) Escribe y ajusta por el método del ionelectrón la ecuación iónica global, indicando las semirreacciones correspondientes, b) ¿qué volumen de KMnO4 0,02 M se requiere para oxidar 40 mL de una disolución 0,1 M de FeSO4 en disolución de H2SO4?
25 El tetraoxomanganato (VII) de potasio, en medio ácido sulfúrico, transforma el yoduro de potasio en yodo molecular a la vez que el primero se transforma en sulfato de manganeso (II) y se forma sulfato de potasio y agua. Se pide: a) formular, ajustar por el método del ion-electrón y completar la reacción molecular citada, indicando el oxidante y reductor; b) calcular la concentración molar de yoduro de potasio presente en 50 mL de disolución si se consumen 25 mL de permanganato de potasio 0,5 M en la valoración en exceso de medio ácido.
En el matraz erlenmeyer se coloca, por ejemplo, una disolución de la sustancia oxidante cuya concentración desconocemos. En la bureta, colocamos una disolución de concentración conocida de la sustancia reductora.

Al ir vertiendo poco a poco la disolución de la bureta, la especie reductora irá reduciendo a la especie oxidante. Se alcanzará el punto de equivalencia cuando toda la sustancia oxidante haya pasado a su forma reducida (y a su vez, toda la sustancia reductora haya pasado a su forma oxidada).
A partir del punto de equivalencia, ya tendremos un exceso de sustancia reductora en la bureta, que no podrá oxidarse, pues ya no queda sustancia oxidante en el matraz erlenmeyer.
El punto de equivalencia de una reacción tal como:
a Oxidante1 + b Reductor2 → c Reductor1 + d Oxidante2
se alcanza, cuando el número de electrones ganados por el oxidante oxida completamente a la especie reductora problema.
Cuando hacemos una valoración redox, debemos tener muy en cuenta cuál es la reacción de valoración y ajustar su ecuación química para determinar la cantidad de sustancia de la especie oxidante y la cantidad de sustancia de la especie reductora que reaccionan entre sí.
En el punto de equivalencia de la valoración, se cumple que la cantidad de sustancia de electrones (en mol) que cede la sustancia reductora coincide con la que gana la sustancia oxidante.
Así, para una especie oxidante de concentración Mox., que acepta νox. electrones por cada molécula (o cantidad de sustancia de electrones (en mol) por cada mol de sustancia), y una especie reductora de concentración Mred. que pierde νred. electrones por cada molécula (o cantidad de sustancia de electrones (en mol) por cada mol de sustancia) se cumple que:
νred. ∙ Mred. ∙ Vred. = νox. ∙ Mox. ∙ Vox.
donde:
Vred. es el volumen de la disolución del reductor.
Mred. es la molaridad de la disolución del reductor.
Vox. es el volumen de la disolución del oxidante.
Mox. es la molaridad de la disolución del oxidante.

νox. es el número de electrones aceptados por cada molécula.
νred es el número de electrones perdidos por cada molécula.
En el caso de una disolución de Fe2+ que se oxida hasta Fe3+ tendremos:
Fe2+ → Fe3+ + 1 e– νred. = 1
En el caso de una disolución de Sn4+ que se reduce hasta Sn2+, tendremos: Sn4+ + 2 e– → Sn2+ νox.= 2
Las sustancias de concentraciones conocidas utilizadas como referencia en las valoraciones redox son muy pocas. Se trata siempre de oxidantes y reductores fuertes, estables en disolución y cuyas reacciones redox son estequiométricamente sencillas. Entre los oxidantes más usados están:
• Permanganato de potasio (KMnO4): es un excelente oxidante, que está disponible con facilidad, no es caro y no requiere indicador, a menos que se utilice en solución muy diluida.
El permanganato participa en varias reacciones químicas, ya que el manganeso puede existir en varios estados de oxidación (+2, +3, +4, +6 y +7). En general, se emplea para valoraciones en medios fuertemente ácidos.
• Dicromato de potasio (K2Cr2O7): es un agente oxidante menos fuerte que el KMnO4. Es muy soluble en agua, y las disoluciones resultantes son estables durante mucho tiempo si se protegen de la evaporación.

• Sales de cerio (IV): el cerio es un elemento que forma parte de las tierras raras, y puede existir solo en dos estados de oxidación, +4 y +3. En el estado tetravalente es un agente oxidante fuerte, que pasa por una sola reacción:
Ce4+ + 1 e → Ce3+
• Yodo (I2): el yodo es un agente oxidante más débil que el permanganato de potasio, los compuestos de cerio (IV) y el dicromato de potasio. En los procesos analíticos, el yodo se emplea como agente oxidante, y el ion yoduro, como agente reductor.
La determinación de la concentración de una sustancia mediante valoraciones redox suele denominarse con el nombre del compuesto que se utiliza como oxidante. Por ello, podemos hablar de yodometrías, permanganimetrías, etcétera.
Entre los reductores más usados, tenemos:
• Oxalato de sodio (Na2C2O4) y ácido oxálico (H2C2O4): ambas sustancias pueden obtenerse en estado puro y se usan en la valoración de permanganato y sulfato de cerio (IV).
Las soluciones de oxalato y ácido oxálico disminuyen su fuerza con el tiempo, especialmente cuando se exponen a la luz, por ello, deben guardarse en la oscuridad (preferiblemente, en botellas de vidrio oscuro).
• Tiosulfato de sodio (Na2S2O3): es la solución que se utiliza en la mayoría de los procesos yodométricos. Es excepcional por el hecho de que la mayoría de los demás oxidantes convierten ion tiosulfato (S2O32−) en sulfito (SO32−) o sulfato (SO42−), y no en tetrationato (S4O26−).
El punto final de la valoración se puede determinar mediante un indicador que presente distinto color en sus formas oxidada y reducida. Para su selección, un indicador debe cambiar de color cerca del potencial de la disolución, o potencial de equivalencia.
Un indicador redox general es un compuesto que cambia de color cuando pasa de su forma oxidada a reducida, o al contrario.
La semirreacción a la que se debe el cambio de color puede escribirse: Inox. + n e ⟶ Inred.
Para que el ojo humano pueda observar el cambio de color de la forma oxidada del indicador a la forma reducida se requiere que la proporción de concentraciones de ambas varíe unas cien veces.
Ce (III) con ferroína → Ce (IV) con ferroína + e (Azul) (Rojo)
Ce (IV) con ferroína → Ce (III) con ferroína + e (Rojo) (Azul)
Reacción de oxidación y reducción del cerio en presencia de la ferroína. En la siguiente tabla se muestran algunos de los indicadores redox más importantes:
El ácido oxálico (H2C2O4) se presenta en distintos alimentos de origen vegetal como las espinacas, la remolacha, la col, la acelga y los frutos secos. El consumo excesivo de alimentos ricos en oxalato puede favorecer la formación de cálculos renales.

26 Para valorar 75 cm3 de disolución acuosa de sulfato de hierro (II) —previamente acidificado con ácido sulfúrico—, se utilizan 38 cm3 de dicromato de potasio 0,40 M como valorante. ¿Qué concentración tiene el sulfato?
27 En una valoración, 31,25 mL de una disolución 0,1 M de Na2C2O4 (oxalato de sodio) en medio ácido se consumen 17,38 mL de una disolución de KMnO4 de concentración desconocida. Sabiendo que el oxalato pasa a CO2 y el permanganato a Mn2+: a) ajusta la ecuación iónica por el método del ion-electrón, b) calcula la concentración de la disolución de KMnO4
Datos: Masas atómicas: O = 16 u, K = 39 u, Mn = 55 u.
Tabla
Si se sumergen dos conductores químicamente inertes (por ejemplo, platino o grafito) en una solución de un electrolito o de un compuesto iónico fundido y se aplica una determinada diferencia de potencial eléctrico entre ellos, circulará una corriente eléctrica porque hay especies cargadas capaces de moverse: los iones (en el electrolito, o el compuesto iónico fundido) y los electrones (en los conductores).
Este tránsito de cargas origina una reacción química no espontánea en los electrodos entre los cuales se ha establecido la diferencia de potencial. Este proceso se denomina electrólisis, y el sistema al cual se le suministra la diferencia de potencial eléctrico es la cuba, o celda electrolítica.
Las celdas electrolíticas están constituidas por un recipiente que contiene el sistema químico reaccionante o medio conductor (disolución o electrolito fundido). En él, van sumergidos los dos electrodos conectados a una fuente de corriente continua que suministra los electrones necesarios al cátodo para que tenga lugar una reacción dada.
• Los electrolitos son las sustancias que conducen la corriente eléctrica. Suelen ser compuestos iónicos fundidos o disueltos, pero también puede ser un compuesto covalente que se ionice en disolución.
• El medio conductor, por lo general, es el mismo para ambos electrodos, por lo que no se requiere puente salino.
• Los dos electrodos son de un material conductor sólido (generalmente, un metal o grafito), uno se llama cátodo, en él tiene lugar la reducción; el otro se llama ánodo y en él tiene lugar la oxidación.

En las celdas electrolíticas se producen reacciones químicas termodinámicamente no espontáneas mediante un proceso denominado electrólisis. A diferencia de las celdas galvánicas, para que una celda electrolítica funcione, se requiere una fuente externa de energía eléctrica, por ejemplo, una batería, la cual fuerza a la reacción no espontánea a ocurrir.
Esquema de una celda electrolítica.
Para que se produzca la electrólisis, se debe aplicar una diferencia de potencial mayor que la diferencia de potencial de la reacción espontánea.
Así, por ejemplo, si el ΔE° de la reacción espontánea, con reactivos y productos en estado estándar es 0,76 V, se deberá aplicar una diferencia de potencial mayor que ese valor para invertir el sentido de la corriente.
Los iones positivos de la disolución (cationes) se moverán hacia el electrodo negativo o cátodo (donde se produce la reducción) y los iones negativos (aniones) hacia el electrodo positivo o ánodo (donde se produce la oxidación).
28 Por una celda electrolítica circulan 4,3 mol de electrones. Calcula la carga, expresada en culombios, a la que equivalen. Datos: carga electrón: 1,6022 · 10−19 C; NA = 6,022 · 1023
29 Se realiza la electrólisis de una disolución acuosa de cloruro de potasio. Indica las especies químicas que se producirán en el ánodo y en el cátodo.
30 En una celda electrolítica con electrodos inertes, se introduce cloruro de potasio fundido. Indica las especies químicas que se producirán en el ánodo y en el cátodo.
En el interior de la cuba existe un transporte de carga y de materia. Al llegar a los electrodos, los iones pueden ganar o perder electrones y transformarse en átomos neutros o moléculas.
Podemos interpretar la electrólisis como el proceso opuesto al que tiene lugar en una celda galvánica. Mientras que en una celda galvánica aprovechamos una reacción química «redox» espontánea para producir una diferencia de potencial eléctrico, en la electrólisis, por medio de la aplicación de una diferencia de potencial eléctrico externo se genera una reacción química «redox» no espontánea.
Pila o celda electroquímica Celda electrolítica
Reacción química espontánea. Reacción química no espontánea.
A partir de una reacción química se produce energía eléctrica. A partir de energía eléctrica se produce una reacción química.
Dos electrolitos separados en contacto por un puente salino. Un electrolito.
El ánodo es el polo negativo, y el cátodo, el positivo. El ánodo es el polo positivo, y el cátodo, el negativo.
Se produce la semirreacción de oxidación en el ánodo (–) y la de reducción en el cátodo (+).
Tabla
Se produce la semirreacción de oxidación en el ánodo (+) y la de reducción en el cátodo (–).
El cloruro de sodio sólido, NaCl, no conduce la corriente eléctrica debido a que sus iones no pueden moverse dentro de la red cristalina. En cambio, si se calienta el NaCl sólido por encima de su punto de fusión (808 ºC), sí puede conducir la corriente eléctrica debido a la presencia de iones Na+ y Cl , los cuales tienen libertad para desplazarse. En su estado fundido, el cloruro de sodio se puede electrolizar para formar sodio metálico (Na) y cloro gaseoso (Cl2).
En este caso, la celda electrolítica está constituida por dos electrodos inertes (generalmente de grafito) en un recipiente que contiene cloruro de sodio fundido, conectados a los respectivos polos de un generador de corriente continua. De esta manera, el electrodo que está conectado al polo negativo, se carga negativamente, provocando que los iones positivos Na+ se muevan hacia él y se reduzcan a sodio metálico. El electrodo conectado al polo positivo se carga positivamente, provocando que los iones negativos Cl se muevan hacia él y se oxiden a Cl2.
Las dos semirreacciones y la reacción global son:
Reducción (cátodo, −) : 2 Na+ (l) + 2 e → 2 Na (l) E1° = −2,71 V
Oxidación (ánodo, +): 2 Cl (l) → Cl2 (g) + 2 e E2° = −1,36 V
Reacción global: 2 Na+ (l) + 2 Cl (l) → 2 Na (l) + Cl2 (g) E° = −4,07 V
En este caso, para que se produzca la reacción en el sentido indicado, se debe aplicar una diferencia de potencial superior a 4,07 V. Cuanto más negativo es el valor de la fuerza electromotriz, más difícil será producir la reacción redox en el sentido deseado.
31 Para lograr el objetivo de desarrollo sostenible 6, es esencial apoyar y fortalecer la participación de las comunidades locales en la mejora de la gestión del agua y en el saneamiento. El proyecto iMETland es uno de los proyectos financiados por la Unión Europea para demostrar que las aguas residuales urbanas pueden limpiarse de manera sostenible y ser aptas para el riego, con un coste energético nulo, mediante la utilización de bacterias que producen corriente eléctrica a partir de los contaminantes. Haciendo uso de las herramientas TIC, investiga acerca de los objetivos y características del proyecto así como su contribución a las metas 6.3 y 6.4 de los ODS.
Ánodo Cátodo
Electrólisis del NaCl fundido. Este proceso es la fuente principal de sodio metálico y cloro gaseoso.
El agua pura no es conductora de la electricidad. Para hacerla conductora, se añade una pequeña cantidad de H2SO4 0,1 M que aporte los iones H+ necesarios para conducir la corriente eléctrica.
Las dos semirreacciones que tienen lugar y la reacción global son:
Reducción (cátodo, −): 4 H+ (aq) + 4 e → 2 H2 (g) E1° = 0 V
Oxidación (ánodo, +): 2 H2O (l) → O2 (g) + 4 H+ (aq) + 4 e E2° = −1,23 V
Reacción global: 2 H2O (l) → 2 H2 (g) + O2 (g) E° = −1,23 V
En el ánodo se pueden oxidar iones sulfato o agua, pero si observamos los valores de los potenciales de reducción, se deduce que lo hará el agua. En el cátodo se reducen los iones H+
Electrólisis del NaCl en disolución acuosa
Cuando se efectúa una electrólisis haciendo pasar una corriente eléctrica por una disolución, se debe tener presente qué especies pueden oxidarse o reducirse por efecto de la corriente.
En el caso que nos ocupa, además de iones Na+ e iones Cl , en el medio tenemos agua, la cual también puede oxidarse y reducirse. Sin embargo, al ser el potencial de reducción del agua, −0,83 V, mayor que el del Na+, −2,71 V, se producirá la reducción del agua, H2O.
Electrólisis del agua. En el proceso se obtiene el doble de hidrógeno que de oxígeno.
Electrólisis en agua de cloruro sódico. Este proceso electrolítico es de gran importancia industrial, pues en él se obtienen como productos principales Cl2 (g) e H2 (g) y, como subproducto, NaOH.
Las semirreacciones que tienen lugar son:
Reducción
Oxidación (ánodo, +): 2 Cl (aq) → Cl2 (g) + 2 e E2° = −1,36 V
El cloro y la sosa caústica son coproductos de fabricación conjunta por electrólisis. La producción de sosa por esta vía se ve limitada por un consumo de cloro que es cada vez menor por razones medioambientales.
Se producen a partir de una solución purificada de salmuera obteniéndose también hidrógeno:
2 NaCl (aq) + 2 H2O → Cl2 + H2 + 2 NaOH
En 1800, William Cruickshank, describió por primera vez la electrólisis de salmuera.
En este caso, la sal CuSO4, en disolución acuosa, está totalmente disociada en Cu2+ y SO42−. Al igual que en el caso anterior, tenemos dos especies que pueden reducirse, Cu2+ y H2O. Al ser el potencial de reducción del agua, −0,83 V, menor que el del Cu2+, +0,34 V, se producirá la reducción del cobre. Las semirreacciones que tienen lugar son:
Reducción (cátodo, −): 2 Cu2+ (aq) + 4 e → 2 Cu (s) E1° = +0,34 V
Oxidación (ánodo, +): 2 H2O (l) → O2 (g) + 4 H+ (aq) + 4 e E2° = −1,23 V
R. global: 2 Cu2+ (aq) + 2 H2O (l) → 2 Cu (s) + O2 (g) + 4 H+ (aq) E°= −0,89 V
Michael Faraday (1791-1867) descubrió en el siglo xix que existe una relación sencilla entre la cantidad de sustancia que se produce o consume en un electrodo durante la electrólisis y la carga eléctrica que circula por la celda. Estableció dos leyes:
Primera ley: la masa de un elemento depositada en un electrodo es proporcional a la cantidad de electricidad que pasa a través de la disolución.
Segunda ley: para una misma cantidad de electricidad que pasa por varias cubas conectadas en serie, las masas depositadas o liberadas en los electrodos son proporcionales a sus respectivos equivalentes químicos.
Dicho de otra forma, un faraday deposita o libera un equivalente de sustancia (1 F = 96 500 C).
Para realizar cálculos estequiométricos, necesitamos saber la cantidad de electricidad, Q, que ha pasado durante un cierto tiempo t:
donde I es la intensidad de corriente y se mide en amperios, A. Combinando las dos leyes, resulta que la masa, m, de material depositado o disuelto en cada electrodo vendrá dado por:
donde m = masa que se deposita en un electrodo (gramos), I = intensidad de corriente (amperios), t = tiempo de electrólisis (segundos), M = masa molar del elemento (expresada en gramos, pues realmente hace referencia a un mol de átomos o moléculas), n = número de electrones intercambiados y F = faraday (carga de un mol de electrones).
Teniendo en cuenta que un faraday es la cantidad de electricidad que corresponde a un mol de electrones y que equivale, aproximadamente, a 96 500 C, tenemos:
En las reacciones de oxidación-reducción, un equivalente químico es igual al cociente entre la masa de un mol de átomos o moléculas de una sustancia y el número de electrones puestos en juego para oxidarla o reducirla.
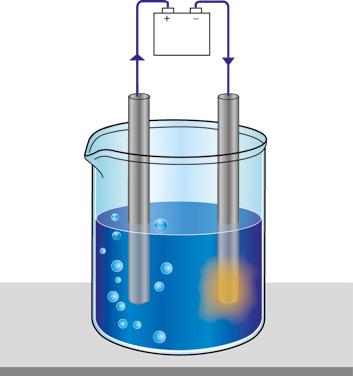
Matemáticamente:
Ejercicios
32 Rompecabezas. Sería fácil llenar un libro con los detalles de todos los descubrimientos de Faraday, tanto en química como en física. No es un accidente que Albert Einstein guardara fotos de tres científicos en su oficina: Isaac Newton, James Clerk Maxwell y Michael Faraday. Investiga sobre las aportaciones realizadas por M. Faraday a lo largo de su vida y luego trabaja en grupos utilizando la técnica cooperativa «Rompecabezas» recogiendo y sintetizando todo el contenido mediante una aplicación digital.
7 Se colocan en serie una celda electrolítica de AgNO3 y otra de CuSO4. Calcula:
a) ¿Cuántos gramos de Cu (s) se depositan en la segunda celda mientras se depositan 2 g de Ag (s) en la primera?
b) ¿Cuánto tiempo ha estado pasando corriente si la intensidad era de 10 A? Datos: masas atómicas Ag = 107,87 u y Cu = 63,54 u; 1 faraday = 96 500C · mol–1
Solución
a) Tenemos las siguientes semirreacciones: Ag+ + 1 e → Ag Cu2+ + 2 e → Cu
Calculamos la cantidad de sustancia de plata depositada:
107, 87gmol 2g 0, 0185 mol n –1 ==
Observamos que se deposita 1 mol de Cu por cada 2 mol de Ag, así:
molAg molCu 2 1 = , n molAg Cu 00185
(Cu) 2 0, 0185 mol 9, 25 10 mol n –3 ==
m (Cu) = 9,25 ∙ 10−3 mol ∙ 63,54 g · mol–1
Por tanto: m (Cu) = 0,59 g
b) El tiempo que ha estado pasando la corriente viene dado por: t l Q =
Así: · 10 A 0, 0185 mol96500C mol 178, 5s t –1 ==
33 Una pieza metálica de 4,11g que contiene cobre se introduce en ácido clorhídrico obteniéndose una disolución que contiene Cu2+ y un residuo sólido insoluble. Sobre la disolución resultante se realiza una electrólisis pasando una corriente de 5 A. Al cabo de 656 s se pesa el cátodo y se observa que se han depositado 1,08 g de cobre. Responde a las siguientes cuestiones:
a) ¿Cuál es la masa atómica del cobre?
b) ¿Qué volumen de cloro se desprendió durante el proceso electrolítico en el ánodo (medido a 20 ºC y 760 mmHg)?
c) ¿Cuál era el contenido real de Cu (en % en masa) en la pieza original, si al cabo de 25 minutos de paso de corriente se observó que la masa del cátodo no variaba?
Datos: 1F = 96 500 C · mol–1; R = 0,082 atm ∙ L · mol–1 ∙ K–1 .
34 ¿Qué volumen de cloro se obtiene medido a 27 ºC y 670 mmHg de presión, al realizar la electrólisis de una disolución de NaCl haciendo pasar una corriente de 200 A durante 12 h?
Datos: Masa atómica Cl = 35,5 u, 1F = 96 500 C · mol–1
35 La electrólisis de una disolución acuosa de BiCl3 en medio neutro origina Bi (s) y Cl2 (g). Resuelve las siguientes cuestiones:
a) Escribe las semirreacciones iónicas en el cátodo y en el ánodo y la reacción global del proceso.
b) Calcula el potencial estándar correspondiente a la reacción global.
c) Calcula la masa de bismuto metálico y el volumen de cloro gaseoso medido a 25 ºC y 1 atm, obtenidos al cabo de dos horas, cuando se aplica una corriente de 1,5 A.
Datos: masas atómicas: Cl = 35,5 u, Bi = 209 u; 1F = 96 485 C · mol–1, R = 0,082 atm · L · mol–1 ∙ K–1; E° (Bi3+/Bi) = 0,29 V, E° (Cl2/Cl ) = 1,36 V.
36 a) ¿Qué cantidad de electricidad es necesaria para que se deposite en el cátodo todo el oro contenido en 1 L de disolución 0,1 M de AuCl3?
b) ¿Qué volumen de Cl2, medido a la presión de 740 mmHg y 25 ºC, se desprenderá en el ánodo?
Datos: 1F = 96 500 C · mol–1, R = 0,082 atm · L · mol–1 ∙ K–1
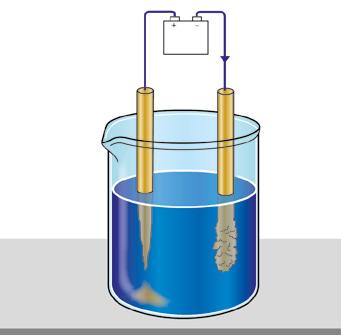
La industria moderna no podría funcionar como lo hace hoy en día sin las reacciones de electrólisis. Diversos metales y no metales como el Al, Mg, Cl2 y F2 que en la naturaleza se encuentran formando compuestos se pueden obtener por reducción aplicando el proceso de electrólisis. Entre los compuestos químicos producidos por electrólisis están el NaOH, K2Cr2O7, KMnO4 y un gran número de compuestos orgánicos. Algunos procesos importantes son el refinado electrolítico de metales, el depósito electrolítico, la electrosíntesis y la galvanotecnia.
10.1.
El refinado electrolítico de metales implica el depósito de metal puro en un cátodo, a partir de una disolución que contiene el ion metálico. Así, el cobre que se obtiene por tostación de sus minerales tiene bastante pureza para algunas aplicaciones, como tuberías, pero no las suficientes para aplicaciones que requieren una gran conductividad eléctrica. Se toma como ánodo un trozo de cobre impuro y como cátodo una lámina delgada de cobre metálico puro. Durante la electrólisis, el Cu2+ producido en el ánodo se desplaza a través de una disolución de ácido sulfúrico y sulfato de cobre hasta el cátodo, donde se reduce a Cu (s).


El cátodo de cobre puro aumenta su tamaño, mientras que el trozo de cobre impuro se consume.
En el depósito, o baño electrolítico, se deposita un baño de metal sobre otro por electrólisis. Este procedimiento se lleva a cabo por motivos decorativos o para proteger de la corrosión al segundo metal.
En un proceso de depósito electrolítico, el objeto a bañar constituye el cátodo de la celda electroquímica.
El cromado o baño de cromo es muy útil por su resistencia a la corrosión, así como por su belleza con fines decorativos. El acero puede cromarse mediante una disolución acuosa de CrO3 y H2SO4.
Charles M. Hall y Paul Herroult, en 1886, descubrieron casi de manera simultánea un proceso electrolítico práctico para la obtención de aluminio que hizo posible disponer de este material para diversas aplicaciones. Tras este descubrimiento se produjo un descenso drástico en el precio del aluminio. El efecto del proceso de electrólisis es transformar los iones Al3+ en átomos de Al neutros que forman aluminio metálico. El aluminio que se obtiene en el proceso electrolítico tiene un 99,5 % de pureza. Se almacena en grandes bobinas que constituyen la materia prima en la fabricación de multitud de piezas y objetos de este metal.
Cromado de las piezas de una motocicleta.

10.3. Electrosíntesis
Es un procedimiento para producir sustancias por medio de reacciones de electrólisis.
El dióxido de manganeso se presenta en la naturaleza en forma de pirolusita, pero el pequeño tamaño de los cristales y las imperfecciones de la red hacen que este material no sea adecuado para algunas aplicaciones.

La electrólisis de MnO2 se lleva a cabo en una disolución de MnSO4 en H2SO4 (aq) El MnO2 (s) puro se forma por oxidación del Mn2+ sobre un electrodo inerte, como el grafito.
Se trata de un proceso electroquímico mediante el cual se deposita una capa fina de metal sobre una base, generalmente, metálica.
Los objetos se galvanizan para evitar la corrosión, para obtener un acabado atractivo, para purificar metales, para reproducir moldes, etc.
Los metales que se utilizan, normalmente, en galvanotecnia son: cromo, cadmio, cobre, oro, níquel, plata y estaño.
Material Nombre
Cobre Cobreado
Cromo Cromado
Níquel Niquelado
Cadmio Cadmiado
Cinc Galvanizado

Estaño Estañado
Oro Dorado
Plata Plateado
Hierro Acerado
Tabla 8. Tipos de recubrimientos galvánicos.
Las pilas se utilizan para producir reacciones redox y para calcular potenciales de electrodo. Sin embargo, su mayor utilidad es para producir corrientes eléctricas de pequeña intensidad, destinadas principalmente, al funcionamiento de relojes, juguetes, aparatos portátiles de radio... y también como fuente de energía en los satélites artificiales.
Las pilas se asocian en baterías (serie) para conseguir una fuerza electromotriz mayor, y la intensidad de corriente generada puede variar desde algunos miliamperios hasta varios cientos de amperios.
Las pilas se clasifican, fundamentalmente, en dos tipos:
• Primarias: las pilas son dispositivos generadores de electrones, con una vida limitada por el agotamiento de las sustancias redox reaccionantes, ya que a medida que se genera corriente, se consumen productos químicos. Las pilas primarias no se pueden recargar, una vez que los productos químicos se han consumido, no es posible ninguna reacción química posterior (proceso irreversible).
• Secundarias: en ellas, el proceso de conversión de energía eléctrica es reversible, es decir, los reactivos originales se pueden regenerar. También se les denomina acumuladores, y la pila se puede recargar haciendo pasar una corriente continua a través de ella en el sentido opuesto a la corriente de descarga, proceso que se denomina carga, o recarga, de una batería.
Pilas primarias
Pila de Volta o pila voltaica
Es la pila más antigua y fue ideada por el físico italiano Alessandro Volta (1745-1827). El ánodo de la pila de Volta es una lámina de cinc y el cátodo es una lámina de cobre.
Las reacciones que tienen lugar en esta pila son:
Ánodo (−): Zn (s) → Zn2+ (aq) + 2 e
Cátodo (+): 2 H+ (aq) + 2 e (s) → H2 (g)
Reacción global: Zn + 2 H+ → Zn2+ + H2
Los electrones pasan a través del circuito externo desde el ánodo al cátodo, donde descargan los iones H+ del ácido, desprendiendo H2. El H2 es absorbido por la superficie de cobre haciendo que la intensidad de corriente disminuya. Este fenómeno recibe el nombre de polarización del electrodo y para evitarlo se introducen unas sustancias despolarizantes que reaccionan con el hidrógeno formando agua.
La presencia del cobre en esta pila es para conducir la corriente eléctrica, por lo que puede ser sustituido por otro metal.
La notación de la pila de Volta es: Zn | H2SO4 | Cu, y es una pila húmeda. Aunque fue empleada como generador de corriente durante mucho tiempo, se demostró que eran mucho más eficaces y prácticas las pilas sin disolución líquida en su interior.
Los acumuladores son dispositivos que pueden utilizarse indistintamente como generadores de corriente y también como receptores. De ahí que puedan cargarse de nuevo empleando la energía eléctrica de una fuente exterior. Son especialmente útiles en aplicaciones que precisan energía en un momento determinado, pero que producen energía en otras ocasiones, como es el caso del automóvil.
Es una pila seca, común en las linternas y aparatos de radio portátiles (pilas cilíndricas). El recipiente de esta pila, hecho de cinc, actúa como uno de los electrodos. El otro electrodo es una barra de carbono inerte en el centro de la celda. El recipiente de cinc está recubierto de papel poroso para separarlo de los demás materiales de la celda. El espacio entre los electrodos se llena con una mezcla de cloruro de amonio, dióxido de manganeso, cloruro de cinc y un filtro poroso e inerte. Las pilas secas se sellan para evitar pérdidas de humedad por evaporación.
Una vez conectados los electrodos externamente, el Zn metálico se oxida a Zn2+, y los electrones fluyen a lo largo del recipiente hasta el circuito exterior. Las reacciones que tienen lugar en esta pila son:
Oxidación (ánodo): Zn (s) → Zn2+ (aq) + 2 e
Reducción (cátodo): 2 NH4+ (aq) + 2 e → 2 NH3 (g) + H2 (g)
R. global: Zn (s) + 2 NH4+(aq) → Zn2+(aq) + 2 NH3 (g) + H2 (g) Ecelda = 1,6 V Como los productos de la reacción de reducción son gaseosos, hay que eliminarlos para evitar que se formen burbujas alrededor del electrodo de carbono, impidiendo el funcionamiento de la pila por polarización. Para impedirlo, se añaden despolarizantes como el dióxido de manganeso que al reaccionar con el hidrógeno, produce agua y mantiene la humedad necesaria en la pila:
2 MnO2 (s) + H2 (g) ⇄ Mn2O3 (s) + H2O (l)
El potencial que genera esta pila es de unos 1,5 V, pero debido a su resistencia interna, disminuye. Cuando se necesitan f. e. m. mayores, se conectan en serie. Así, las llamadas pilas de petaca son en realidad tres pilas de Leclanché conectadas en serie produciendo una f. e. m. de 4,5 V.



Pilas alcalinas
Las pilas alcalinas secas son parecidas a la pila seca de Leclanché, excepto que el electrolito es básico porque contiene KOH, la superficie interior del recipiente de Zn es rugosa, lo que proporciona mayor área superficial, y tiene una vida más larga que las pilas secas ordinarias, soportando mejor el uso continuado. Tienen como ánodo una barra de cinc; como cátodo, dióxido de manganeso, y como electrolito, hidróxido de potasio.
Se conocen con este nombre una serie de pilas que por sus dimensiones se asemejan a un botón. Están formadas por capas separadas de fibras plásticas y los agentes oxidantes más utilizados son el HgO y Ag2O. Una pasta de hidróxido de potasio y óxido de cinc forman el electrolito.
Todas las reacciones de combustión son reacciones redox y por ello las reacciones de combustión se utilizan para construir pilas, llamadas pilas de combustible, en las que se aprovecha el 80 % de la energía química de los combustibles utilizados y, además, no producen contaminación. Se utilizan para suministrar energía eléctrica en muchos satélites artificiales. Los electrodos son dos cilindros de carbono hueco impregnado de un catalizador que puede ser platino, plata o monóxido de cobalto. El electrolito utilizado es una disolución concentrada de KOH.

Acumulador de plomo
Consta de un grupo de placas de plomo que contenienen plomo esponjoso que se alterna con otro grupo de placas de plomo que contienen dióxido de plomo. Los electrodos están sumergidos en una disolución del 40 % en ácido sulfúrico (medio ácido) que aporta los iones H+ necesarios para la reacción, así como iones SO42− que reaccionan con Pb2+ para formar PbSO4 sólido. Las reacciones que tienen lugar son:


Ánodo: Pb (s) → Pb2+ (aq) + 2 e
Cátodo: PbO2 (s) + 4 H+ (aq) + 2 e → Pb2+ (aq) + 2 H2O

Reacción iónica global: Pb (s) + PbO2 (s) ⇄ 2 Pb2+ (aq)+ 2 H2O
Reacción molecular: Pb (s) + PbO2 (s) + 2 H2SO4 (aq) ⇄ 2 PbSO4 (s) + 2 H2O (l) A medida que transcurre la reacción, se produce sulfato de plomo y disminuye la concentración de ácido sulfúrico. Si se conecta el acumulador a una fuente exterior, se invierte el sentido de la corriente y se regeneran los componentes en ambas placas.
Los automóviles utilizan este tipo de batería; esta proporciona energía para la puesta en marcha del vehículo y, posteriormente, se carga gracias al alternador del coche.
37 Mesa redonda. Descubierto en 1817, el litio empezó a utilizarse a gran escala con la industria de las baterías cuando reemplazó al níquel como sustrato químico básico. Hoy en día se le conoce como el «oro blanco» del siglo xxi
Utilizando las TIC investiga cuáles son las razones de su importancia y, a continuación, en pequeños grupos utilizad la técnica cooperativa «Mesa redonda» para debatir y consensuar una única respuesta que se expondrá oralmente al resto de grupos mediante asamblea.
Acumulador de plomo utilizado en automóviles.
Baterías de níquel-cadmio (NICAD)
Tienen una vida útil mucho más larga que las pilas secas ordinarias, ya que se pueden recargar. Se usan en calculadoras y relojes electrónicos. El electrolito es una disolución de KOH (medio básico), el ánodo es cadmio y el cátodo es un óxido de níquel. Los hidróxidos que se forman se depositan sobre los electrodos y permiten la reversibilidad de las reacciones durante la recarga.
Tienen ánodos de grafito y cátodos de óxido de litio-cobalto. Dominan el mercado de cámaras fotográficas y ordenadores portátiles. Se utilizan en vehículos eléctricos e híbridos movidos por baterías.
Se conoce con el nombre de corrosión al proceso redox por el cual los metales se oxidan en presencia de oxígeno y humedad.
Además de la humedad y el oxígeno, hay otros factores como el pH de la disolución, la presencia de sales o el contacto con metales más difíciles de oxidar que el hierro, que pueden acelerar la oxidación.
El ejemplo típico de corrosión es la formación de una capa de óxido llamada orín, o herrumbre, que puede llegar a producir la destrucción del metal según los procesos. Si el agua tiene iones disueltos, es más conductora y la herrumbre se forma más rápidamente. Por esta razón, la sal en el aire de las ciudades costeras (y en las ciudades del interior si se ha echado sal en las carreteras con ocasión de las heladas) puede ser tan dañina.
F. Al-Kharafi (1946 - actualidad): Química kuwaití, recibió el Premio L´Oreal-UNESCO a Mujeres en Ciencia por sus trabajos sobre la corrosión, un problema de fundamental importancia para el tratamiento del agua y la industria del petróleo. Profesora de química de la Universidad de Kuwait y primera mujer en dirigirla (1993-2002). En 2005, la revista Forbes la nombró como una de las 100 mujeres más poderosas del mundo.
Sus investigaciones se centran en los comportamientos electroquímicos del aluminio, cobre, platino, niobio, vanadio, cadmio, latón, cobalto y acero con poco contenido de carbono.
Barco con la mayoría de la superficie del casco cubierta de herrumbre. Costa de Lanzarote.
El modo más simple de prevenir la corrosión es asegurar que la superficie del metal no esté expuesta al aire y al agua, y esto se puede conseguir mediante diferentes procedimientos:

• Utilizando pinturas anticorrosivas, como, por ejemplo, el cromato de cinc, que impiden el contacto del metal con el oxígeno y la humedad.
• Recubrimiento con otro metal, esto se consigue electrolíticamente. La galvanostegia (o galvanoplastia) consiste en recubrir los metales de una capa metálica resistente para darles un mejor aspecto o para aumentar su duración y resistencia a la corrosión. Entre las aplicaciones podemos usar el galvanizado, cromado, latonado, plateado, etc.
• Mediante la pasivación, consistente en formar sobre la superficie de un metal una película relativamente inerte que la protege. Así, el anodizado es el proceso al que se somete el aluminio para generar una capa de óxido de aluminio en su superficie, que lo protege contra la corrosión.
Desde hace mucho tiempo se conoce el papel que desempeñan las bacterias en los procesos de corrosión metálica. Los primeros trabajos en este campo se deben a Von WolzogenKuhr, que en 1923 puso en evidencia el mecanismo electroquímico del ataque del hierro por los microorganismos sulforreductores. La corrosión microbiana puede definirse como un proceso metabólico bacteriano que origina o acelera la destrucción de los metales.
El cuerpo humano mantiene un balance de óxido-reducción constante, preservando el equilibrio entre la producción de pro-oxidantes que se generan como resultado del metabolismo celular y los sistemas de defensa antioxidantes. La pérdida en este balance de óxido-reducción lleva a un estado de estrés oxidativo, que se caracteriza por un aumento en los niveles de radicales libres y especies reactivas, que no alcanza a ser compensado por los sistemas de defensa antioxidantes causando daño y muerte celular. Esto ocurre en patologías degenerativas, de tipo infeccioso, inflamatorio…
Los radicales libres son átomos o grupos de átomos que tienen un electrón desapareado, por lo que son muy reactivos, ya que tienden a captar un electrón de otros átomos con el fin de alcanzar su estabilidad electroquímica. Al ser sumamente reactivos, son capaces de dañar a otras moléculas transformándolas a su vez en moléculas muy reactivas; una reacción en cadena que causa daño oxidativo, desde células hasta tejidos.
Las especies reactivas incluyen a las de oxígeno (ROS), las de hierro (RIS), las de cobre (RCS) y las de nitrógeno (RNS). Todas ellas son moléculas oxidantes que se transforman fácilmente en radicales libres, lo que les confiere la característica de ser compuestos muy dañinos para las células.
Proteína alterada Lesión Enfermedad neurodegenerativa
β-amiloide Formación de placa Enfermedad de Alzheimer
Proteína TAU Maraña neurofibrilar Demencia frontotemporal
Huntingtina Inclusiones nucleares Enfermedad de Huntington
α-sinucleína Cuerpo de Lewy Enfermedad de Parkinson
Tabla 8. Relación entre la proteína alterada por estrés oxidativo, la lesión fisiopatológica y la enfermedad neurodegenerativa asociada.
Por ejemplo, en la enfermedad de Huntington se produce una alteración en el ADN del paciente, el cual tiene un número muy elevado de repeticiones del triplete de bases CAG, lo que codifica una proteína anormal, la huntingtina.
Gen correcto (menos de 35 repeticiones de nucleótidos CAG)
Gen mutado (más de 35 repeticiones de nucleótidos CAG)
Las especies reactivas dañan tanto al ADN como a las proteínas transformadoras. Un estado de estrés oxidativo induce en la célula efectos tóxicos por oxidación de lípidos, proteínas, carbohidratos y nucleótidos, lo cual produce acumulación de agregados intracelulares, disfunción mitocondrial, excitotoxicidad y apoptosis. Este daño oxidativo es común en las enfermedades neurodegenerativas.
Otra enfermedad muy común en nuestros días es la enfermedad de Alzheimer. En este caso, la proteína alterada es la β-amiloide.
En esta sección vamos a usar un simulador gratuito para el estudio de la electrólisis. La herramienta nos permitirá visualizar y explicar la primera ley de Faraday según la cual, la masa de un elemento depositada en un electrodo es proporcional a la cantidad de electricidad que pasa a través de la disolución. Para localizar esta aplicación, tienes que ir a la página: https://media.pearsoncmg.com/bc/bc_0media_chem/ chem_sim/html5/Electro/Electro.php
Observarás que está en inglés y que te permite trabajar con varios parámetros claves en el estudio de la electrólisis (corriente eléctrica, tiempo, electrodos…).
Igualmente podemos seleccionar mediante un cursor la intensidad de corriente y el tiempo que dura el proceso. De esta manera se podrá establecer una relación directa entre la masa depositada en un electrodo (m) y la cantidad de electricidad (Q) que pasa a través de la disolución.
Podemos establecer la relación entre la intensidad de corriente que circula y la carga eléctrica (Q = I · t) y la relación entre la cantidad de electrones que circulan y la masa de una sustancia sólida depositada en los electrodos. En el simulador es posible seleccionar el material conductor del ánodo y del cátodo, seleccionando en el desplegable cada uno de ellos. Esta aplicación nos permite trabajar con diferentes metales (Fe, Al, Cu, Ag,…).
El aspecto cuantitativo de la electrólisis es directo: con la ayuda de esta herramienta, es posible observar que la cantidad de una sustancia producida durante una electrólisis es directamente proporcional a la intensidad de corriente y al tiempo que circula por la misma; es decir, a la cantidad de electricidad (carga eléctrica) que circula por el electrolito o medio conductor.
Una vez seleccionado el material del polo positivo (ánodo) y del polo negativo (cátodo), hay que elegir también el medio conductor, pues también es susceptible de oxidarse o reducirse al pasar la corriente.
1 Utilizando el programa interactivo bajo las mismas condiciones de intensidad de corriente eléctrica y tiempo, estudia la masa depositada en uno de los electrodos en cada uno de los siguientes casos: a) Al (polo positivo), Ag (polo negativo) y Al(NO3)3 como disolución conductora, b) Al (polo positivo), Cu (polo negativo) y Al(NO3)3 como disolución conductora, c) Fe (polo positivo), Ag (polo negativo) y Fe (NO3)2 como disolución conductora, d) Fe (polo positivo), Cu (polo negativo) y Fe(NO3)2 como disolución conductora.

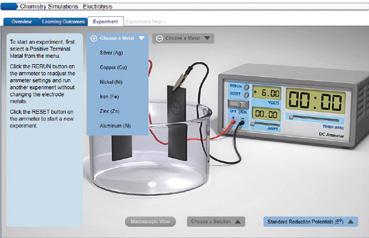

2 Utilizando la simulación estudiada para una electrólisis donde el ánodo está formado por Zn, el cátodo por Ni y el medio conductor se trata de una disolución de Zn(NO3)2 determina la masa depositada en uno de los electrodos para las siguientes condiciones de corriente eléctrica y tiempo: a) 9 amperios y 4 minutos, b) 9 amperios y 36 minutos, c) 3 amperios y 6 minutos, d) 3 amperios y 55 minutos.
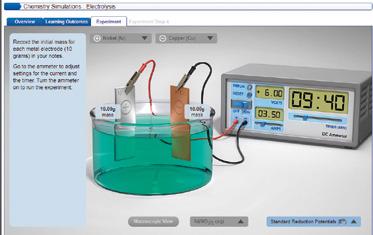

1 En la electrólisis de una disolución acuosa de cloruro de sodio se hace pasar una corriente de 3 000 A durante 2 horas. Mientras transcurre el proceso, se observa desprendimiento de hidrógeno y se obtiene cloro en medio básico.
a) Escribe y ajusta las semirreacciones que se producen en el ánodo y en el cátodo y la reacción molecular global. Utiliza el método de ajuste del ion-electrón.
b) A 25 ºC y 1 atm, ¿qué volumen de cloro se obtiene?
c) ¿Qué masa de hidróxido de sodio se habrá formado en la cuba electrolítica en ese tiempo?
Datos: Eº (V): Na+/Na = –2,71; Cl2/Cl– = 1,36 ; H2O/H2 = = –0,83; masas atómicas (u): H = 1, O = 16, Na = 23; 1 F = 96 500 C · mol–1; R = 0,082 atm· L · mol–1·K–1
Planteamiento y resolución
a) Analizamos los potenciales de reducción estándar para ver cuáles son las especies que se oxidan y cuáles se reducen: Al ser Eº (H2O/H2) > Eº (Na+/Na) se producirá la reducción del agua (H2O) y no del Na+. En la electrólisis de la disolución acuosa de NaCl se producen H2 y Cl2
Ahora a partir de los datos aportados por el enunciado, podemos empezar a escribir las semirreacciones que tienen lugar en el ánodo y en el cátodo:
– El cátodo es el polo negativo y en él se produce la semirreacción de reducción del H2O.
– El ánodo es el polo positivo y en él se produce la semirreacción de oxidación del Cl– . De acuerdo a ello, las semirreacciones que transcurren en los correspondientes electrodos en medio básico son:
Cátodo: 2 H2O + 2 e– → H2 + 2 OH– Eº1 = –0,83 V
Ánodo: 2 Cl– → Cl2 + 2 e– Eºc= –1,36 V
A continuación, sumamos las semirreacciones y obtenemos la reacción iónica ajustada.
Reacción iónica global:
2 H2O + 2 Cl– → H2 + Cl2 + 2 OH– Eº = -2,19 V
Para escribir la reacción molecular global ajustada, colocamos las moléculas de base necesarias para ajustar correctamente los OH– y añadimos y ajustamos los iones espectadores. Así, obtenemos:
Reacción molecular global:
2 H2O + 2 NaCl → H2 + Cl2 + 2 NaOH
b) Para calcular el volumen de cloro (Cl2) obtenido en el proceso electrolítico, debemos calcular previamente, de acuerdo a los datos del enunciado, la masa de hidrógeno que se desprende en el cátodo. Mediante la ecuación de Faraday, obtenemos:
g
A continuación, calculamos la cantidad de sustancia de H2 obtenida:
H2 = M m = , gmol g 2 14923 –1
mol H2
Según la estequiometria de la reacción, se obtiene la misma cantidad de sustancia de Cl2. Así pues:
nCl2 = 74,61 mol Cl2
A partir de la ecuación de estado de los gases ideales, a la presión y temperatura indicadas, el volumen de Cl2 que se obtiene es:
p · V = n · R · T → VCl2 = nCl2 · R · T / p =
= 74,61 mol · 0,082 atm · L· mol–1 ·K–1 · 298K / 1 atm
VCl2 = 1823,17 L
c) Para calcular la masa de hidróxido de sodio que se ha formado en la cuba electrolítica en 2 horas, atendemos a la estequiometria de la reacción. La cantidad de sustancia de de NaOH que se obtiene es el doble que de Cl2, por tanto:
m (NaOH) = 74,62 mol · 2 · 40 g · mol–1 = 5968,8 g
La electrólisis se puede interpretar como el proceso opuesto al que tiene lugar en una celda galvánica. Mientras que en una celda galvánica aprovechamos una reacción redox espontánea para producir una diferencia de potencial eléctrico, en la electrólisis, por medio de la aplicación de una diferencia de potencial eléctrico externo se genera una reacción química redox no espontánea.
En este caso, para que se produzca la reacción global en el sentido indicado, se debe aplicar una diferencia de potencial superior a 2,19 V. Cuanto más negativo sea el valor de la fuerza electromotriz, más difícil será producir la reacción redox en el sentido indicado.
Para comprobar que hemos ajustado de manera adecuada la reacción molecular global, podemos ajustarla también por el método algebraico. Es fundamental que la reacción global esté expresada y ajustada correctamente para que los resultados obtenidos sean los correctos.
En el desarrollo del problema es importante tener en cuenta también el número de cifras significativas para realizar los cálculos correctamente y que el resultado obtenido sea lo más aproximado posible.
2 En una valoración, 35 mL de una disolución 0,2 M de Na2C2O4 (oxalato de sodio) en medio ácido, se consumen 20 mL de una disolución de KMnO4 de concentración desconocida. Sabiendo que el oxalato pasa a CO2 y el permanganato a Mn2+, a) ajusta la ecuación iónica por el método del ion-electrón, b) calcula la concentración de la disolución de KMnO4
Datos: masas atómicas (u): O= 16, K= 39, Mn= 55
Planteamiento y resolución
a) A partir de los datos del enunciado, escribimos las semirreacciones que se producen en la valoración redox.
En el caso de la disolución de KMnO4, se produce un proceso de reducción:
MnO4– + 8 H+ + 5 e– → Mn2+ + 4 H2O
En el caso de la disolución de oxalato de sodio se produce un proceso de oxidación:
C2O42– → 2 CO2 + 2 e–
A continuación, procedemos a ajustar la ecuación iónica por el método del ion-electrón, teniendo en cuenta masa y carga. Así multiplicamos por 2 la primera ecuación, por 5 la segunda y sumamos: Cátodo (reducción):
2 MnO4– + 16 H+ + 10 e– → 2 Mn2+ + 8 H2O
Ánodo (oxidación): 5 C2O42– → 10 CO2 + 10 e–Ecuación iónica global:
2 MnO4– + 16 H+ + 5 C2O42– → 2 Mn2+ + 8 H2O + 10 CO2
b) En 35 mL de una disolución 0,2 M de Na2C2O4 , tenemos:
n (Na2C2O4) = ,mol LmL mL L 02 35 1000 1 –1 = = 7 ·10–3 mol de Na2C2O4
Por la estequiometria de la reacción, tenemos que 5 mol de Na2C2O4 reaccionan con 2 mol de KMnO4, lo que nos permite calcular la cantidad de sustancia de KMnO4 que tenemos:
n (KMnO4) = molNaC O molK nO molNaC O M 5 27 10 22 4
4 3 22 4 –;
La valoración redox es una técnica muy similar a la valoración ácido-base, pero, en este caso, empleando agentes oxidantes y reductores.
En las valoraciones redox podemos determinar la concentración de un agente oxidante a partir de la concentración conocida de un agente reductor (valorante). En nuestro caso, la valoración se produce entre el oxalato de sodio (Na2C2O4) y el permanganato de potasio (KMnO4).
Cuando se hace una valoración redox, se debe tener muy en cuenta cuál es la reacción de valoración y ajustar su ecuación química para determinar la cantidad de sustancia de la especie oxidante y la cantidad de sustancia de la especie reductora que reaccionan entre sí.
Es imprescindible que la ecuación iónica global esté bien ajustada para que el resultado obtenido para la concentración de la disolución de KMnO4 esté expresado correctamente.
En el desarrollo del problema es muy importante tener en cuenta tanto los factores de conversión como el número de cifras significativas en los diferentes cálculos para que el resultado no sea erróneo.
n (KMnO4) = 2,8·10–3 mol KMnO4
Calculamos ahora la concentración de la disolución de KMnO4:
c (KMnO4) =
Las capacidades oxidantes del permanganato de potasio (KMnO4) permiten su aprovechamiento en procesos de potabilización de agua, principalmente en grandes plantas potabilizadoras y en acuarios. Este compuesto ofrece las siguientes ventajas:
1. Elimina olores de materia orgánica en descomposición presente en el agua.
2. Oxida el hierro y el magnesio del agua turbia.
3. Reduce la herrumbre arrastrada por el agua en su paso por las cañerías.
1 Explica razonadamente si son ciertas o no cada una de las siguientes afirmaciones: a) el número de oxidación del cloro en ClO3 es −1, b) un elemento se reduce cuando su número de oxidación cambia de menos a más negativo, c) una especie se oxida cuando gana electrones.
2 Indica, justificando brevemente la respuesta, si los procesos sufridos por el cloro, el azufre y el hierro en las siguientes semirreacciones corresponden a una oxidación o a una reducción.
a) ClO2 → Cl , b) S → SO42−, c) Fe2+ → Fe3+
3 Indica el número de oxidación de todos los elementos en los compuestos siguientes: K2S2O7, Ni (NO3)2, Li2S, Na2 B4O7, NH4Cl, KHSO4, PbCl4.
4 Para la reacción: I2 + HNO3 → HIO3 + NO + H2O, determina la especie que se oxida y la que se reduce, determina los productos de la oxidación y la reducción y ajusta la ecuación por el método del ion-electrón.
5 Ajusta las siguientes reacciones por el método del ion-electrón:
a) K2Cr2O7 + HCl → CrCl3 + KCl + Cl2 + H2O
b) Na2S2O3 + HCl → SO2 + S + NaCl + H2O
c) MnO2 + As2O3 + HCl → MnCl2 + As2O5 + H2O
d) KClO3 + CrCl3 + KOH → K2CrO4 + KCl + H2O
6 En el laboratorio se puede preparar cloro gas haciendo reaccionar permanganato de potasio sólido con ácido clorhídrico concentrado.
a) En el transcurso de esta reacción redox se forma cloro, cloruro de manganeso (II), cloruro de potasio y agua. Escribe y ajusta la reacción molecular mediante el método del ion-electrón.
b) Calcula el volumen de cloro (gas), a 20 ºC y 1 atm, que se obtiene al hacer reaccionar 10 mL de ácido clorhídrico concentrado del 35,2 % en masa y densidad 1,175 g · mL–1 con un exceso de permanganato de potasio.
Datos: R = 0,082 atm · L · mol–1 · K–1.
7 El nitrato de potasio (KNO3) reacciona con dióxido de manganeso (MnO2) e hidróxido de potasio (KOH) para dar nitrito de potasio (KNO2), permanganato de potasio (KMnO4) y agua.
a) Ajusta la reacción en medio básico por el método del ion-electrón.
b) A continuación, calcula los gramos de nitrato de potasio necesarios para obtener 100 g de permanganato de potasio si el rendimiento de la reacción es del 75 %.
c) Uno de los objetivos de la Unión Europea es proteger la calidad del agua en toda Europa, evitando la contaminación por nitratos procedentes de fuentes agrícolas y promoviendo el uso de buenas prácticas agrícolas. Haciendo uso de las herramientas TIC, investiga y realiza un debate en grupo acerca de las directrices actuales de la UE sobre nitratos.
8 La reacción de permanganato de potasio con yoduro de potasio en presencia de ácido sulfúrico conduce a la formación de sulfato de manganeso (II), sulfato de potasio, yodo y agua.
a) Escribe la ecuación química molecular ajustada, indicando qué especie es la oxidante, y cuál, la reductora.
b) ¿Cuánto yodo se puede obtener cuando se añaden 80 g de yoduro de potasio del 84 % a 60 mL de una disolución de permanganato de potasio 1,2 M en presencia de H2SO4?
Datos: masas atómicas (u): O =16, S = 32, K = 39,1, Mn = 55, I = 127.
Celdas electroquímicas
9 Indica razonadamente qué sucederá cuando a una disolución de FeSO4 le añadimos Zn.
Datos: E° (Fe2+/Fe) = –0,44 V, E° ( Zn2+/Zn) = −0,76 V.
10 Suponiendo una pila galvánica formada por un electrodo de Ag (s) sumergido en una disolución de AgNO3 y un electrodo de Pb (s) sumergido en una disolución de Pb(NO3)2. Indica: a) la reacción que tendrá lugar en el ánodo, b) la reacción que tendrá lugar en el cátodo, c) la reacción global, d) el potencial de la pila.
Datos: E° (Ag+/Ag) = 0,8 V, E° (Pb2+/Pb) = −0,13 V.
11 Responde, razonando las respuestas, qué ocurrirá cuando: a) se agita con una cucharilla de cinc una disolución de FeSO4, b) se introducen limaduras de hierro en una disolución de sulfato de cobre (II), c) se añaden trozos de cinc sobre una disolución de cloruro de calcio.
Datos: E° (Zn2+/Zn) = −0,76 V, E° (Fe2+/Fe) = –0,44 V, E° (Cu2+/Cu) = 0,34 V, E° (Ca2+/Ca) = −2,87 V.
Recuerda seleccionar el material de trabajo de esta unidad para tu porfolio.12 A partir de los potenciales normales de electrodo que se indican, escoge razonadamente un agente reductor que pueda pasar el Fe3+ a Fe2+.
Datos: E° (Cl2/Cl ) = 1,36 V, E° (Sn2+/Sn) = −0,14 V, E° (Fe3+/Fe2+) = 0,77 V.
13 Dados los pares (Pb2+/Pb) y (Zn2+/ Zn), se quiere construir una pila galvánica: a) haz un esquema de ella, señalando cuál es el cátodo y cuál es el ánodo, b) escribe las reacciones que tienen lugar en cada uno de los electrodos y la reacción global, c) calcula el potencial estándar de la pila y escribe su notación, d) ¿en qué dirección circulan los electrones por el circuito?
Datos: E° (Pb2+/Pb) = −0,13 V, E° (Zn2+/Zn) = −0,76 V.
14 Dadas las siguientes semipilas: Hg2+/Hg (l), Ni2+/Ni (s) y Cu2+/Cu (s), busca la combinación cuya pila tendría una mayor fuerza electromotriz y calcula su valor. Escribe las semirreacciones de oxidación y reducción correspondientes a dicha pila.
Datos: E° (Hg2+/Hg (l)) = 0,80 V, E° (Ni2+/Ni (s)) = = −0,25 V, E° (Cu2+/Cu (s)) = 0,34 V.
15 Indica si las siguientes reacciones son espontáneas y, en caso afirmativo, calcula el potencial normal de la pila correspondiente.
a) H2SO4 + Zn → ZnSO4 + H2
b) AgNO3 + Cu → Ag + Cu(NO3)2
c) FeSO4 + Sn → SnSO4 + Fe
Datos: E° (H+/H2) = 0,00 V, E° (Zn+2/Zn) = −0,76 V, E° (Ag+/Ag) = 0,84 V, E° (Cu2+/Cu) = 0,34 V, E° (Fe2+/Fe) = = −0,44V, E° (Sn2+/Sn) = −0,14 V.
16 Utilizando los valores de los potenciales de reducción estándar, indica, justificando brevemente la respuesta, cuál o cuáles de las siguientes reacciones se producirán de forma espontánea:
a) Fe2+ + Cu → Fe + Cu2+
b) Fe2+ + Cu → Fe3+ + Cu2+
c) Fe3+ + Cd → Fe2+ + Cd2+
d) Fe2+ + Cd → Fe + Cd2+
Datos: E° (Cu2+/Cu) = 0,34 V, E° (Fe2+/Fe) = −0,44V, E° (Fe3+/Fe2+) = 0,77V, E° (Cd2+/ Cd) = –0,40 V.
17 Para los pares redox : Cl2/Cl , I2/I y Fe3+/Fe2+:
a) Indica los agentes oxidantes y reductores en cada caso, b) justifica si se producirá una reacción redox espontánea al mezclar Cl2 con una disolución de KI, c) justifica si se producirá una reacción redox espontánea al mezclar I2 con una disolución que contiene Fe2+, d) para la reacción redox espontánea de los apartados b) y c), ajusta las semirreacciones de oxidación y reducción y la reacción iónica global. Datos: E° (Cl2/Cl ) = 1,36 V, E° (I2/I ) = 0,53 V, E° (Fe3+/Fe2+) = 0,77 V.
Electrólisis
18 Se electroliza una disolución de cloruro de cobre (II) con una corriente de 10 A: a) escribe la ecuación química del proceso que ocurre en cada electrodo, b) ¿cuántos gramos de cobre metálico se depositan en 20 minutos?, c) tras ese tiempo, ¿cuántos litros de cloro (g) se liberan, medidos en condiciones normales?
19 Una cuba electrolítica contiene 750 mL de una disolución de CuSO4. El paso de una corriente de 1,5 A durante 10 horas consigue depositar todo el cobre de la disolución. Calcula: a) la cantidad de cobre depositado, expresándola en gramos, así como en número de átomos, b) la molaridad de la disolución inicial de CuSO4, c) la concentración molar de iones Cu2+ que queda en disolución si la corriente de 1,5 A se hubiese aplicado solamente durante 1 hora. Datos: masas atómicas (u): S = 32, O = 16, Zn = 65,4, Cu = 63,5, NA = 6,023 ∙ 1023, R = 0,082 atm · L · mol–1 · K–1 = 8,3 J · mol–1 · K–1
20 El aluminio se obtiene por electrólisis del óxido de aluminio fundido empleando como ánodo un electrodo de carbón, que se consume en la reacción. Las semirreacciones que se producen son:
Ánodo: C (s) + 2 O2− (aq) → CO2 (g) + 4 e
Cátodo: Al3+ (aq) + 3 e → Al (l)
a) Calcula la cantidad de carga necesaria para obtener 0,75 kg de Al; b) ¿cuántos gramos de C se consumen en el ánodo durante el proceso?
Datos: masas atómicas (u): Al = 27, C = 12; 1 F = 96 500 C · mol–1.
21 Calcula la masa de níquel depositada sobre el cátodo y el volumen de cloro (medido en condiciones normales) que se desprende en el ánodo en una electrólisis de NiCl2 cuando pasa una corriente de 0,1 A durante 20 horas. Datos: masas atómicas (u): Cl = 35,5 , Ni = 58,7; 1F = 96 500 C · mol–1.
© GRUPO ANAYA, S.A., 2023 - C/ Valentín Beato, 21 - 28037 Madrid.
Reservados todos los derechos. El contenido de esta obra está protegido por la Ley, que establece penas de prisión y/o multas, además de las correspondientes indemnizaciones por daños y perjuicios, para quienes reprodujeren, plagiaren, distribuyeren o comunicaren públicamente, en todo o en parte, una obra literaria, artística o científica, o su transformación, interpretación o ejecución artística fijada en cualquier tipo de soporte o comunicada a través de cualquier medio, sin la preceptiva autorización.