

SCIENZE m a teria

Educazione
Gruppo
Il piacere di apprendere
Fabio Calvino
Rita Poletti
Marinella Torri
Il viaggio di Darwin STORYTELLING
Science Reel di Marco Martinelli Metodo IBSE

Costruire il futuro insieme
Il Gruppo Editoriale ELi
offre proposte editoriali che coprono tutti i gradi e i rami scolastici, all’insegna della qualità, del rigore e dell’innovazione.
INTELLIGENZA
ARTIFICIALE
Percorsi didattici con attività pratiche che mirano ad approfondire i principali strumenti di IA generativa per favorirne un utilizzo critico e il tool VELIA a disposizione dei docenti per personalizzare l’attività didattica.
EQUILIBRI
Progetto di ricerca costante che mira a eliminare gli stereotipi di genere nei testi scolastici ponendo particolare attenzione alla scelta dei contenuti, a una valutazione iconografica ragionata e all’utilizzo di un linguaggio testuale inclusivo.
INCLUSIONE

Sviluppo di una cultura dell’inclusione attraverso contenuti accessibili e adeguati ai diversi stili di apprendimento.
ORIENTAMENTO
Approccio educativo e formativo volto a favorire la conoscenza di sé, delle proprie attitudini e delle proprie capacità, oltre a sviluppare le competenze non cognitive e trasversali necessarie per le scelte del futuro.
EDUCAZIONE
CIVICA secondo le NUOVE Linee guida
Aggiornamento e ampliamento dei nuclei tematici attorno ai quali si articolano le competenze e gli obiettivi di apprendimento: Costituzione, Sviluppo economico e sostenibilità, Cittadinanza digitale
STEM/STEAM, CLIL
Attivazione del pensiero scientifico e computazionale, approccio interdisciplinare e laboratoriale, sviluppo della competenza multilinguistica, attraverso attività STEM, STEAM e CLIL.
DIGITALE
Acquisizione delle competenze digitali e dell’alfabetizzazione informatica come aiuto all’inclusione sociale e alla cittadinanza attiva.
EDUCAZIONE ALLE RELAZIONI
Percorsi incentrati sullo sviluppo di competenze relazionali che arricchiscono la consapevolezza del vissuto personale in relazione con la realtà circostante.
Gruppo Editoriale
Gruppo Editoriale
ELi
ELi
SCIENZE
COME È FATTO IL TUO LIBRO?
IBRIDAZIONE TECNOLOGICA, METODO SCIENTIFICO E DIDATTICA LABORATORIALE
le caratteristiche dei suoni






1. Quali sono le caratteristiche dei suoni percettibili?
2. Che cosa sono gli infrasuoni?
3. Che cosa sono gli ultrasuoni?
4. In quali settori sono utilizzati gli infrasuoni e gli ultrasuoni?




CARTA, PENNA E COMPUTER è la rubrica che collega libro e risorse digitali, come previsto dalle Indicazioni Nazionali 2025. Attraverso video e attività guidate avrai la possibilità di osservare, riflettere e rispondere a domande, sviluppando un apprendimento attivo e multimediale, costruendo un ponte tra contenuti cartacei e strumenti digitali.
Soluzioni acide, basiche e neutre lezione 3


Per verificare l’acidità o la basicità di una sostanza o di
1 L’altezza dei suoni.
1 Altezza, intensità e timbro dei suoni
I suoni possono essere distinti tra loro in base a tre caratteristiche dell’onda sonora: altezza, intensità e timbro.

L’altezza distingue i suoni acuti (o alti) da quelli gravi (o bassi). Un esempio di suono acuto è quello emesso da un bicchiere vuoto percosso con un oggetto metallico, mentre il suono è grave se emesso dallo stesso bicchiere pieno d’acqua.
L’altezza di un suono dipende dalla frequenza dell’onda sonora: maggiore è la frequenza, più acuto è il suono; minore è la frequenza, più grave è il suono.
Lab STEM, STEAM e Lab Tinkering: esperimenti, costruzioni e sfide scientifiche che coinvolgono attivamente la classe. Con materiali comuni e procedure guidate, esplorerai i fenomeni in modo concreto, stimolando curiosità, collaborazione e spirito di osservazione. La manualità e la sperimentazione diventano il punto di partenza per comprendere la scienza.
Un corpo che vibra ad alta frequenza, come un fischietto, emette suoni alti 1 a
Un corpo che vibra a bassa frequenza, come un tamburo, emette suoni bassi 1 b
a
P.O.P. - PICCOLE OCCASIONI PER PENSARE

Curiosità sorprendenti e fatti incredibili, per far dire davvero “WOW!” a chi studia.

WOW CHE SCIENZA! presenta curiosità, aneddoti e scoperte sorprendenti che mostrano il lato più affascinante della scienza, stimolando meraviglia e spirito di scoperta. Si accompagna a contenuti multimediali ed esperimenti in collaborazione con Marco Martinelli, divulgatore apprezzato per il suo linguaggio chiaro e coinvolgente.


EDUCAZIONE CIVICA
Cittadinanza scientifica e sostenibilità attraversano l’intero corso, nelle lezioni e negli approfondimenti visual. Esempi reali e buone pratiche sviluppano comportamenti responsabili verso ambiente, comunità e salute, promuovendo consapevolezza e cittadinanza attiva. Clima, energia e salute diventano pilastri del curricolo, con attenzione al pensiero critico

• foglie di cavolo rosso
• mortaio e pestello
• alcol a 95°
• carta da filtro
• garze • una ciotola

degli strumenti appositi, ma in natura puoi trovare sostanze timamente come indicatori.

Per esempio, avrai notato che il tè schiarisce quando aggiungi comporta come un indicatore naturale di acidità. Prova ora indicatore a base di foglie di cavolo rosso.
■ REALIZZA L’ESPERIMENTO




• un barattolo con coperchio
• forbici
• un cucchiaino di limone, uno di acqua e uno di sapone liquido




PROCEDIMENTO
Perché molti frutti e verdure diventano neri dopo averli affettati?
1. Nel mortaio pesta le foglie di cavolo rosso.
Il colore scuro che appare sulla superficie tagliata di mele, banane, funghi e melanzane è provocato dagli enzimi che contengono. Gli enzimi sono sostanze organiche che cedono elettroni all’ossigeno presente nell’atmosfera, favorendo la formazione di ossidi scuri nella polpa esposta all’aria. Questo è il motivo per cui la superficie delle fette non esposta mantiene un colore più chiaro. Per evitare questo inconveniente si può spremere sulle fette del succo di limone che agisce come antiossidante e impedisce agli enzimi di legarsi con l’ossigeno.







2. Aggiungi un po’ di alcol e continua a pestare fino a ottenere
3. Filtra la poltiglia con la garza e raccogli il liquido nella ciotola.
4. Immergi la carta da filtro nella ciotola e fai assorbire il liquido.
5. Fai asciugare la carta su una superficie piana.
6. Tagliala a striscioline e inseriscile nel barattolo.
7. Prova a immergere tre striscioline rispettivamente nel succo qua e nel sapone liquido.
■ OSSERVA E RISPONDI
1. Che cosa osservi quando immergi le striscioline nei tre diversi
2. Fai un’ipotesi sul motivo di questo comportamento.
3. Scrivi la relazione dell’esperimento.

Soluzioni acide,
EDUCAZIONE CIVICA
Guarda il video e scrivi
risposte sul quaderno.
La puna








STORYTELLING
IL VIAGGIO DI DARWIN: per ogni tappa, il diario di un marinaio del Beagle e un estratto del diario originale di Darwin offrono una doppia prospettiva sul mondo naturale. Sarai poi tu protagonista, raccontando la tua esperienza, immaginando di essere anche tu a bordo della nave. Il percorso integra risorse digitali e il supporto dell’Intelligenza Artificiale per approfondire i temi trattati.












PODCAST RACCONTO GENIALE: scienziati e scienziate che hanno fatto la storia raccontano in prima persona episodi di vita, difficoltà, intuizioni e momenti inattesi, mostrando che ogni genio è prima di tutto una persona con passioni e curiosità




PERCORSI INTERDISCIPLINARI alla fine di ogni tema, in linea con le Indicazioni Nazionali 2025. Una mappa concettuale collega l’argomento centrale ad altre discipline (geografia, tecnologia, storia, educazione civica che sono approfondite con testi, esempi e domande. Favoriscono un apprendimento integrato, mostrando la scienza come parte di un sapere connesso.







PARLA LA SCIENZA: scienziati e scienziate di oggi raccontano il loro percorso di studi, le scelte professionali e il lavoro quotidiano, mostrando la varietà delle carriere scientifiche e offrendo spunti per l’orientamento
SKILL BOOK
Insieme ai volumi del corso trovi lo SKILL BOOK, una raccolta di schede con tantissime attività: laboratori compiti di realtà debate e di estetica della natura informatica e intelligenza artificiale


MATERIA


e il suo











Parla la scienza
La struttura della materia
1
materia e le sue caratteristiche
1. La materia forma tutto quello che ci circonda
2. La materia possiede proprietà fisiche e chimiche
3. La materia si presenta in diverse forme chiamate sostanze
lezione 2 La composizione della materia
1. La materia è formata da atomi
2. Dagli atomi alle molecole
3. Le sostanze possono essere semplici o composte
4. I miscugli

Separare i miscugli
3 Gli stati fisici della materia
1. Solidi, liquidi e aeriformi
2. Le proprietà dei solidi
3. Le proprietà dei liquidi e degli aeriformi
4. Lo stato di plasma
unità 3
La temperatura e il calore
temperatura
1. La temperatura e l’agitazione termica
Il calore è una forma di energia
3. Relazioni fra temperatura e calore
4. La misura della temperatura
5. Le scale termometriche

lezione 3 La propagazione del calore
1. Il calore si propaga
2. La propagazione del calore nei solidi 83
3. La propagazione del calore nei liquidi e negli aeriformi 83
4. La propagazione del calore nel vuoto 84
5. La dilatazione termica 84
lezione 4 I cambiamenti di stato della materia 86
1. Da uno stato all’altro 86 unità 2


LEZIONI IN POWERPOINT
Pic-nic nel parco

Separare i miscugli


Sale d’Italia I miscugli

Gli stati d’aggregazione dell’acqua


Lezioni in Podcast
Test interattivi

Listening

LEZIONI IN POWERPOINT
Science REEL

Le scale termometriche

Come funziona il calorimetro


Come si muovono le correnti convettive in una stanza? I passaggi di stato
2. Il passaggio da solido a liquido
3. Il passaggio da liquido a solido
4. Il passaggio da liquido ad aeriforme
5. Il passaggio da vapore a liquido 88
6. Il passaggio da gas a liquido 88
7. Il passaggio da solido ad aeriforme e viceversa 88




unità 4
TEMA 2
LA CHIMICA
La chimica della materia
lezione 1 L’atomo e la sua struttura
1. Le sostanze si possono trasformare
2. La struttura dell’atomo
3. Come si identificano gli atomi
4. Gli isotopi
MATERIA
Parla la scienza

LEZIONI IN POWERPOINT


5. Come si determina il peso di un atomo: la massa atomica
lezione 2 La tavola periodica degli elementi
1. Mettere in ordine gli elementi
2. Come è strutturata la tavola periodica
3. Gli elementi sono suddivisi in categorie

Esploriamo la tavola periodica
lezione 3 I legami chimici
1. La regola dell’ottetto
2. La formula chimica
3. Perché gli atomi si combinano tra loro
4. Il legame ionico
5. Il legame covalente
6. Il legame metallico

La teoria atomica Fenomeni chimici e fisici a confronto Il Sistema Periodico degli elementi

Racconto geniale: Dmitrij Mendeleev Due legami chimici

Composti ionici in vetrina

Composti covalenti in vetrina
lezione 4 La composizione della materia
1. Le trasformazioni chimiche
2. Le leggi che regolano le reazioni chimiche
3. I tipi di reazioni chimiche




I composti chimici
lezione 1 Ossidi, anidridi e basi
1. L’ossidazione
2. Gli ossidi basici o ossidi
3. Gli ossidi acidi o anidridi
4. Le basi
lezione 2 Acidi e sali
1. Gli acidi
2. I sali

1. Miscugli particolari: le soluzioni
2. La solubilità
3.

4. La carta
5.



Scopriamo il pH di alcune sostanze Il mondo dei composti organici Dove lo butto?

Lezioni in



TEMA 3
CORPI IN MOVIMENTO
unità 6
Il moto dei
lezione 1
elementi che descrivono il moto
La relatività galileiana
MATERIA


LEZIONI IN

Stato di quiete, stato di moto e sistema di riferimento
3. Le caratteristiche del moto
4. Applichiamo il metodo scientifico al moto

Tutto si muove! I sistemi di riferimento inerziali Il moto rettilineo
L’accelerazione
2. Il moto uniformemente accelerato
Il moto dei corpi in caduta libera
unità 7
Le forze
Le caratteristiche di una forza
Come si misurano
3. La composizione delle
Tanti tipi di forze
La dinamica
Il primo principio della dinamica
3. Il secondo principio della dinamica
4. Il terzo principio della dinamica
5. Forze e moti circolari
1. La statica


Lezioni in Podcast Test interattivi

Listening

LEZIONI IN POWERPOINT

Cronaca di una partita di calcio


La costruzione del poligono funicolare Il principio di inerzia Racconto geniale: Isaac Newton
Parla la scienza
2. Il baricentro
3. L’equilibrio di un corpo appoggiato e di un corpo sospeso
lezione 4 Macchine e leve
1. Le macchine semplici
2. La leva
3. I tre generi di leve
lezione 5 La pressione e le forze nei fluidi
1. La pressione
2. Il principio di Pascal
3. La pressione dei fluidi
4. La spinta idrostatica
5. La spinta aerostatica





TEMA 4
LA FISICA DELLE ONDE
MATERIA





Parla la scienza




L’elettricità e il magnetismo

2
Conduttori e isolanti
corrente elettrica
1. La differenza di potenziale
2. I generatori di corrente elettrica
3. I circuiti elettrici
4. La resistenza elettrica e le leggi di Ohm
Tecnologie per migliorare il Pianeta
2. Come è fatta l’etichetta energetica



corrente

1. La corrente elettrica genera un campo magnetico
3. L’induzione

Lezioni in


Il suono e la luce
lezione 1 Che cos’è il suono
1. Le sorgenti sonore
2. La propagazione del suono
3. Le onde sonore
4. Le caratteristiche di un’onda
lezione 2 Le caratteristiche dei suoni
1. Altezza, intensità e timbro dei suoni
2. La velocità del suono
3. La riflessione del suono
4. La risonanza
3 Che cos’è la luce
L’energia luminosa
2. La propagazione rettilinea della luce
3. Sorgenti luminose e corpi illuminati
4. Ombra e penombra
1. La riflessione della luce
2. Gli specchi
La rifrazione
5. Le lenti
5 I colori
La luce bianca
La dispersione della luce
3. I colori degli oggetti


Il campo di udibilità

L’ecolocalizzazione dei pipistrelli


Luce: onda o particella?

Lo spettro elettromagnetico Fenomeni ottici

L’esperimento di Newton

I colori complementari


Lezioni in Podcast
Test interattivi

Listening
MATERIA TEMA
1
Le teorie scientifiche e i fenomeni naturali
Viviamo in un mondo fatto di materia: sono materia tutti gli organismi viventi, l’aria che respiriamo, gli oggetti che usiamo ogni giorno, il nostro stesso corpo. Pertanto, è dalla materia che dobbiamo cominciare le nostre indagini per comprendere come funziona e come è fatta la realtà. Le discipline scientifiche che ci aiutano più di altre in questo compito sono le hard sciences, “scienze dure”, che comprendono la fisica, la chimica, la biologia. Ma perché le hanno chiamate così? Queste discipline scientifiche hanno in comune l’uso sistematico di un metodo di indagine della realtà, il metodo scientifico, e l’utilizzo del linguaggio della matematica per rielaborare i dati raccolti. L’applicazione del metodo scientifico ha permesso, nel corso degli anni, di raccogliere una grandissima quantità di dati sperimentali, grazie ai quali sono state elaborate le leggi e le teorie scientifiche con le quali spieghiamo i fenomeni naturali. L’applicazione delle scoperte della fisica e della chimica, in particolare, hanno dato uno straordinario contributo allo sviluppo umano, basti pensare ai livelli raggiunti dalle tecnologie digitali che usiamo ogni giorno, alla produzione di nuovi strumenti e farmaci usati per la cura delle malattie o per la soluzione dei problemi ambientali della Terra.


La scienza unità 1 della materia La struttura unità 2 e il calore La temperaturaunità 3
e il suo metodo


ANDREA CIOFFI, data scientist

Andrea ha studiato Ingegneria matematica e si è specializzato in Statistica. Da sempre affascinato dal funzionamento di computer e cellulari, ha trovato nella matematica la risposta a tutte le sue curiosità. Oggi lavora per una società dove si occupa di analizzare grandi quantità di dati e di metterli in relazione per ottenere informazioni utili in diversi ambiti, da quello medico a quello economico.
GIUSEPPE SCALIA, productionmanager



Dopo il diploma all’istituto tecnico con indirizzo in elettronica e telecomunicazioni, Giuseppe si è laureato in Fisica e ha svolto attività di ricerca presso l’Università della California di Los Angeles, occupandosi dell’applicazione di tecniche di microscopia a fluorescenza per lo studio delle strutture inorganiche e organiche. Oggi si occupa di quantum key distribution, una nuova tecnologia per la protezione dei dati informatici.
MARIA LUISA CHIARAMONTE, clinical research associate
Maria Luisa si è laureata in Biologia, ha conseguito il dottorato in Biologia Molecolare per poi diventare clinical research associate: il suo lavoro consiste nel gestire la conduzione degli studi clinici sugli effetti di nuovi farmaci e terapie all’interno degli ospedali. Tra i suoi compiti vi è il controllo delle fasi della sperimentazione perché sia condotta e documentata in modo appropriato e garantisca che i dati siano integri e attendibili.

PARLA LA SCIENZA
MATERIA
e il suo metodo La scienza unità

lezione 1
Il metodo sperimentale
lezione 2
Facciamo un esperimento
lezione 3
Misurare le grandezze: lunghezza, superficie e volume
Misurare le grandezze: massa, peso e tempo lezione 4
La rappresentazione grafica dei dati lezione 5


BUONE NOTIZIE PER IL FUTURO
Un modello virtuale della Terra
A partire dal XVII secolo, l’uso del metodo scientifico per indagare la natura ha permesso di ottenere grandi risultati in ogni ambito di ricerca. La complessità della realtà, però, presenta spesso situazioni in cui il metodo scientifico non è applicabile, per esempio perché il fenomeno non è “ancora” avvenuto e si vuole conoscere la sua evoluzione nel tempo: ciò è tipico della meteorologia, dell’astronomia, di una epidemia da virus. L’invenzione dei computer, capaci di elaborare rapidamente enormi quantità di dati, permette già da qualche anno di costruire modelli scientifici virtuali di moltissimi fenomeni naturali. Oggi i computer tradizionali vengono progressivamente sostituiti dai computer quantistici, in grado di elaborare dati ad una velocità sorprendente ed effettuare calcoli estremamente complessi, che permettono di costruire modelli virtuali ancora più precisi. È il caso del “gemello digitale” della Terra, un modello ad alta precisione del nostro Pianeta, grazie al quale gli scienziati possono studiare gli effetti del cambiamento climatico, lo stato degli oceani, la biodiversità e moltissimi altri fenomeni naturali. L’ambizioso progetto, che fa parte dell’iniziativa Destination Earth (DestinE), offrirà alla scienza la possibilità di eseguire veri e propri esperimenti a livello globale, simulando le interazioni tra fenomeni naturali e le attività umane, e contribuirà al raggiungimento degli obiettivi della transizione ambientale e digitale sostenuta dall’Unione Europea.
SCIENCE
REEL


Magia o scienza?
Il metodo sperimentale lezione 1
CARTA PENNA COMPUTER

Galilei e il metodo sperimentale
Guarda il video e scrivi le risposte sul quaderno.
1. Dove e quando Galilei approfondisce la conoscenza della matematica e della fisica?
2. Quali sono i più importanti strumenti costruiti o perfezionati da Galilei?
3. Che cosa ha scoperto con il telescopio?
4. Come è strutturato il metodo scientifico sperimentale?
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.


5. Che cosa significa per Galilei “sensata esperienza”?
6. Che cosa sostiene nelle pagine del Saggiatore a proposito del linguaggio della natura?
1 Dalla magia alla scienza
«Perché il Sole sorge e tramonta? Perché cadono i fulmini? Perché si forma l’arcobaleno?»
Queste sono alcune delle domande che bambini e bambine rivolgono agli adulti e in questo modo manifestano il bisogno di capire il mondo che li circonda. Probabilmente anche i nostri antenati si ponevano domande simili quando cercavano una spiegazione dei fenomeni naturali che avvenivano davanti ai loro occhi.
L’arcobaleno si vede sempre dopo un temporale?
No, dipende dall’altezza del Sole sull’orizzonte. L’arcobaleno, infatti, è un fenomeno ottico prodotto dalla dispersione della luce solare ad opera delle goccioline di pioggia sospese nell’aria dopo un temporale. Per poterlo vedere è tuttavia necessario che il Sole sia ad una altezza tale da formare con la linea dell’orizzonte un angolo inferiore ai 42°, condizione che si verifica solo al mattino o nel tardo pomeriggio.
I nostri antenati avevano trovato risposte magiche e mitologiche a queste domande: ad esempio il Sole è un carro infuocato che attraversa il cielo, i fulmini sono lanciati da un dio adirato che vive sulle nuvole.
Le risposte magiche non richiedevano nessuna prova e alimentavano la superstizione e il senso di paura nei confronti della natura.
I filosofi dell’antica Grecia sono stati i primi a spiegare i fenomeni naturali attraverso l’osservazione e il ragionamento. Il loro metodo non dava spiegazioni magiche, ma le risposte non prevedevano la realizzazione di esperimenti in grado di provarle. Il metodo dei filosofi greci fu utilizzato fino al Cinquecento, quando uno scienziato e artista italiano, Leonardo da Vinci, iniziò a metterlo in dubbio.
2 Galileo Galilei e il metodo sperimentale
Nei primi anni del XVII secolo comincia a diffondersi l’idea che lo studio di un fenomeno naturale deve essere effettuato seguendo un determinato “metodo di lavoro”. Lo scienziato pisano Galileo Galilei (1564-1642) è stato il primo a comprendere che, per spiegare i fenomeni naturali, è necessario compiere delle osservazioni, elaborare ipotesi ed effettuare prove per verificarle. Queste prove sono gli esperimenti e rappresentano la parte innovativa del “metodo di lavoro” di Galilei. Molto spesso Galilei eseguiva i suoi esperimenti in laboratorio così da seguirli passo passo; ha anche ideato e perfezionato vari strumenti per fare delle osservazioni approfondite e delle misurazioni più accurate. Analizzando i risultati dei suoi esperimenti, Galilei ricavava delle teorie che fornivano una spiegazione dei fenomeni osservati.
Il lavoro di indagine e sperimentazione ideato da Galilei è detto metodo sperimentale, o metodo scientifico
I criteri del metodo sperimentale enunciati da Galilei sono tuttora validi e sono applicati in diversi ambiti della scienza moderna.
3 Le fasi del metodo sperimentale
Quando compiamo una ricerca su un fenomeno naturale seguendo il metodo sperimentale, dobbiamo procedere come farebbe uno scienziato.
1. Partiamo dall’osservazione del fenomeno naturale che attira la nostra attenzione: ad esempio l’arcobaleno che si forma, a volte, dopo un temporale, un’ape che vola da un fiore all’altro, il salmone che risale il fiume, un pezzo di ghiaccio che si scioglie. Compiute le osservazioni, ci poniamo una domanda sull’aspetto che vogliamo indagare.
2. Il nostro interesse ci porta alla formulazione di un’ipotesi che possa spiegare in modo razionale il fenomeno osservato. Per esempio, un cubetto di ghiaccio si scioglie perché la temperatura dell’ambiente è maggiore di quella del freezer.
La prima spiegazione, che può essere soggettiva, quando diventa un’ipotesi ci spinge a considerare quegli aspetti della nostra osservazione che sono più utili allo scopo prefissato e che ci portano a fare una previsione sulle possibili conseguenze. Per esempio, se metto l’acqua al freddo si ghiaccia?
3. Per rispondere alla domanda, cioè per verificare le conseguenze dell’ipotesi, possiamo realizzare un esperimento. Mi procuro il materiale necessario: in questo caso alcuni contenitori, dell’acqua e un apparecchio come il frigorifero di casa che mi permette di avere un ambiente a temperatura inferiore a quella della stanza.
METODO SCIENTIFICO
OSSERVAZIONE Osservazione di un fenomeno.
IPOTESI Formulazione di un’ipotesi che possa rispondere alla do manda.
DOMANDA Formulazione di una domanda sull’aspetto che si vuole studiare.
ANALISI Raccolta dei dati e registrazione delle misurazioni.
ESPERIMENTO Realizzazione di un esperimento per verificare la conseguenza dell’ipotesi.
CONCLUSIONI Conferma o abbandono dell’ipotesi iniziale sulla base dei risultati sperimentali.
4. La fase successiva rende necessario raccogliere i dati e registrare le misurazioni. Per effettuare le misurazioni che ci servono dobbiamo utilizzare degli strumenti opportuni, nel nostro caso il termometro, che ci permette di rilevare la temperatura all’interno del frigorifero e del freezer.
Osserviamo il risultato dell’esperimento: l’acqua del contenitore riposta nel frigorifero, dove abbiamo rilevato una temperatura bassa, ma superiore a 0 °C, non si è ghiacciata, mentre quella nel freezer sì.
5. Dall’analisi dei risultati traiamo le conclusioni: l’ipotesi che possiamo confermare è che l’acqua si ghiaccia nel freezer, quella che dobbiamo abbandonare è che l’acqua si ghiaccia nel frigorifero 1 .
La caratteristica che devono avere gli esperimenti è la loro completa riproducibilità, cioè la possibilità di ripeterli e verificarne i risultati, grazie a una descrizione corretta e precisa del procedimento. Per questo è importante comunicare i risultati ottenuti e condividerli con il resto della comunità scientifica.
Dobbiamo ripetere più volte l’esperimento, per essere certi che il risultato ottenuto non sia frutto del caso; variamo anche la temperatura, per determinare esattamente quella di congelamento.
Quando i dati sperimentali presentano delle regolarità, ad esempio l’acqua si congela sempre alla stessa temperatura, possiamo confermare la nostra ipotesi e trasformarla in una legge scientifica . Una legge scientifica spiega come quel fenomeno naturale funziona e permette di prevedere come avverrà un fenomeno simile a quello osservato.
Le leggi e le teorie scientifiche non sono verità assolute e sono valide solo temporaneamente: possono essere ri-
Perché?
viste in qualunque momento, quando i risultati di un nuovo esperimento forniscono elementi che mettono in discussione il contenuto della teoria stessa. È proprio per questa ragione che la scienza è sempre in evoluzione.
L’incredibile evoluzione delle scienze, in particolare negli ultimi decenni, è dovuta anche alle nuove scoperte della tecnologia, che hanno messo a nostra disposizione strumenti sofisticatissimi su oggetti diventati di uso comune. Hai mai preso in considerazione l’incredibile dotazione del tuo smartphone?
Spesso chi è assorbito da un lavoro di ricerca arriva al punto di modificare o addirittura costruirsi gli strumenti più adatti al tipo di indagine che sta conducendo.
Sono proprio il metodo scientifico e questa capacità “imprenditoriale” che, applicati in qualunque ambito, permettono un costante progresso.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. Il metodo scientifico è il metodo di lavoro di chi studia i fenomeni.
2. Il primo a utilizzare il metodo sperimentale fu Leonardo da Vinci.
3. Una legge scientifica è una verità assoluta.
4. La fase iniziale del metodo scientifico è la realizzazione di un esperimento.
VERSO LE COMPETENZE
Abbina ogni azione con la corrispondente fase del metodo sperimentale. Stai pedalando e ti sembra che ci sia qualcosa che non va. Esamina la situazione come se fossi uno scienziato.
a La pedalata è faticosa anche con le gomme ben gonfie. Devi scartare la prima ipotesi.
1 Osservazione di un fenomeno
2 Formulazione di un’ipotesi
3 Previsione di conseguenze dell’ipotesi
4 Realizzazione di un esperimento
5 Conferma o smentita dell’ipotesi
6 Formulazione di un’altra ipotesi
7 Realizzazione di un altro esperimento
8 Conferma o smentita della seconda ipotesi
b Gonfi le gomme della bicicletta e riparti.
c Pensi che le gomme sgonfie rendono la pedalata più faticosa.
d Osservi che le gomme della bicicletta sono un poco sgonfie.
e Se le gomme sono gonfie, allora pedali più velocemente.
f Aggiungi qualche goccia di olio alla catena.
g Pensi a un’altra ipotesi: ad esempio la catena non è ben oliata.
h La catena gira fluida e la tua ipotesi è confermata.
1: 2: 3: 4: 5: 6:


Facciamo un esperimento lezione 2
CARTA PENNA COMPUTER

La ricerca di Hasler
Guarda il video e scrivi le risposte sul quaderno.
1. Qual era lo scopo dell’esperimento di Hasler?
2. Quale ipotesi ha formulato lo scienziato relativamente alla capacità di orientarsi dei salmoni?
3. Come è stato organizzato l’esperimento?
4. Quali conclusioni ha tratto Hasler dall’esame dei dati raccolti?
5. Perché è importante che i risultati di un esperimento siano pubblicati e fatti conoscere alla comunità scientifica?
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.
6. Dai un titolo alle immagini e scrivi sul quaderno una didascalia per ciascuna foto (max due righe).


1 Applichiamo il metodo sperimentale
1 Raggi di Sole che filtrano dalle nuvole.

Tutti coloro che indagano sui fenomeni naturali applicano il metodo sperimentale. Se anche tu vuoi agire in modo scientifico è importante che impari a seguire le tappe che caratterizzano questo metodo di indagine della realtà che ti circonda. Applichiamo il metodo allo studio di un fenomeno che sicuramente ti sarà capitato di osservare: la propagazione della luce. La domanda è: “I raggi luminosi hanno un andamento rettilineo?”
■ Fase 1 OSSERVAZIONE DI UN FENOMENO
Le osservazioni devono essere accurate e sistematiche e, se necessario, effettuate mediante appositi strumenti. Nella vita quotidiana è facile osservare i raggi del Sole che filtrano dalle nuvole o la traccia lasciata da un laser: in entrambi i casi i raggi luminosi sembrano mantenere una traiettoria rettilinea 1 .
■ Fase 2 FORMULAZIONE DI UNA DOMANDA SULL’ASPETTO CHE SI VUOLE STUDIARE E DI UNA IPOTESI CHE LO SPIEGHI IN MODO RAZIONALE
Questa è la parte più creativa del metodo sperimentale, servono un po’ di intuizione, immaginazione e… un pizzico di fortuna. Naturalmente non è possibile limitarsi a formulare un’ipotesi, ma occorre anche cercare di prevedere che cosa potrebbe accadere se l’ipotesi fosse confermata. La cosa migliore è fare più di una previsione, cercando di immaginare gli effetti delle possibili variazioni degli elementi in gioco.
Dalle osservazioni eseguite si può formulare l’ipotesi che la luce si propaghi in modo rettilineo indipendentemente dalla sorgente che la produce.
■ Fase 3 REALIZZAZIONE DI UN ESPERIMENTO PER VERIFICARE LE CONSEGUENZE
DELL’IPOTESI
Occorre progettare l’esperimento con cura, ma non è indispensabile avere a disposizione un laboratorio. Chi studia la foresta amazzonica, per esempio, deve ingegnarsi con quello che trova!
Procurati 4 cartoncini, pratica un foro in ognuno di essi dopo averli disposti su un piano in modo che i fori siano allineati. Per tenerli ben fermi puoi usare delle mollette da bucato fissate ai lati di ogni cartoncino o realizzare una base di plastilina per tenerli allineati. Utilizza un cartoncino nero per costruire uno schermo. Da un lato disponi una candela, dall’altro dei cartoncini forati. Sullo schermo vedrai formarsi l’immagine del punto del raggio di luce che passa attraverso i fori.
Sposta uno dei cartoncini in modo che i fori non siano più allineati: il punto luce sullo schermo non sarà più visibile.
■ Fase 4 LA RACCOLTA DEI DATI
Normalmente i dati di tipo numerico o visuale (per esempio immagini di fototrappole) sono riportati in tabelle, rielaborati e presentati sotto forma di grafico.
Documenta mediante fotografie i risultati del tuo esperimento dopo aver utilizzato altre fonti di luce, per esempio una torcia o una lampadina.
■ Fase 5 CONFERMA O ABBANDONO DELL’IPOTESI
In questa fase possiamo commentare i risultati ottenuti e confrontarli con quelli di esperimenti analoghi di altri scienziati; possiamo anche segnalare eventuali difficoltà che abbiamo incontrato.
Anche cambiando la sorgente di luce, il punto luminoso appare sullo schermo solo quando i fori dei cartoncini sono allineati. Questi risultati ti conducono a confermare l’ipotesi della propagazione rettilinea della luce.
2 Misure ed errori
Per effettuare un esperimento è quasi sempre necessario utilizzare degli strumenti di misura. Tuttavia, ogni volta che si misura una grandezza, cioè la si confronta con una opportuna unità di misura, sorgono dei problemi. Il primo è quello di avere sempre a disposizione dei dati comprensibili da tutti, ed è questo il motivo che ha portato la maggior parte dei paesi del mondo ad adottare il Sistema Internazionale Il secondo problema riguarda lo strumento di misura scelto: la misura di un banco, rilevata con la riga, si ottiene con uno o al massimo due appoggi, mentre con il righello è necessario un numero maggiore di rilevazioni.
SIAMO ALTI UGUALI?





Altri problemi dipendono dalla persona che effettua la misura oppure da un’errata lettura della scala o a imprecisioni nel procedimento.
Ogni misurazione, quindi, è inevitabilmente accompagnata da errori.
Come si fa, allora, a determinare il valore esatto di una grandezza?
Prima di tutto, quando affronti una misurazione, devi valutare preventivamente quale tipo di strumento ti permette la corretta rilevazione. Per esempio, la lunghezza della tua aula potrà essere circa 4-5 metri, e quindi per misurarla sarà meglio utilizzare un metro piuttosto che un righello. Inoltre, è bene ripetere più volte la misurazione e calcolare la media aritmetica (M) dei valori ottenuti. Il calcolo viene eseguito sommando i valori delle misurazioni e dividendo il risultato per il numero delle misurazioni stesse:
media aritmetica = somma dei valori numero delle misurazioni
In questo modo si cerca di limitare il più possibile il numero di errori, ma quello che ottieni è un valore approssimativo della misura cercata.
3 La relazione di laboratorio
Un esperimento non è ben realizzato se, una volta concluso, non contiene tutte le indicazioni necessarie affinché altri scienziati lo possano ripetere allo stesso modo. La relazione di laboratorio è lo strumento che ti permette la condivisione dei risultati. In questo corso, la sigla LAB STEM (Science, Technology, Engineering and Mathematics) indica che l’attività sperimentale proposta deve essere eseguita seguendo le fasi del metodo sperimentale e prevede una relazione di laboratorio finale. L’esempio che segue riguarda un esperimento sulla combustione effettuato applicando il metodo sperimentale. Ricorda! Prima di lavorare in laboratorio devi conoscere le norme di sicurezza e il comportamento da tenere perché non avvengano incidenti, non si provochino danni e l’ambiente non venga inquinato dalle sostanze che usi.
• il nome di chi esegue l’esperimento; la data di esecuzione permette di verificare a distanza di tempo se i risultati rimangono invariati oppure no;
• il titolo indica quale esperimento si esegue;
• l’osservazione del fenomeno e l’ipotesi che si vuole verificare;
La relazione di laboratorio
nome cognome
■ Titolo Esperimento sulla combustione
■ Osservazione del fenomeno
data / /
Un falò, la fiamma del gas, una candela accesa sono esempi di combustione, il fenomeno grazie al quale una sostanza brucia. Quali sono le condizioni necessarie perché possa avvenire una combustione? Devono esserci un materiale in grado di bruciare (il combustibile) e qualcosa che permette la combustione (il comburente), cioè l’ossigeno.
Ho ipotizzato che la combustione possa avvenire solo in presenza di ossigeno, quindi posso prevedere che in mancanza di esso la combustione non è possibile.
Leggi le norme di sicurezza in laboratorio
• il materiale occorrente: elenca tutto ciò che serve per realizzare l’esperimento (possono essere anche oggetti di uso comune);
• il procedimento, cioè i vari momenti dell’esperienza descritti in modo dettagliato e preciso;
■ Materiale occorrente
• una candela
• un portacandele
• un accendino
• due vasi di vetro di dimensioni diverse, ma abbastanza grandi da contenere la candela e il portacandele
• un cronometro
■ Procedimento
1. Sistemo la candela sul portacandele. Accendo la candela e osservo la combustione per qualche istante.
2. Prendo il vaso più piccolo e lo capovolgo sopra la candela.
3 Faccio partire il cronometro e leggo il tempo che passa prima che la fiamma si spenga.
4 Riaccendo la candela e lascio avviare la combustione.
5 Prendo il vaso più grande e lo capovolgo sopra la candela.
6 Cronometro il tempo che passa prima che la fiamma si spenga.
7. Raccolgo i dati in una tabella.
contenitore 1 2
tempo
• la riflessione sui risultati raggiunti;
• gli eventuali problemi riscontrati e gli interventi fatti per risolverli.
■ Commenti e conclusioni
L’esperimento ha dimostrato che la combustione avviene finché c’è ossigeno. Infatti, la fiamma dura di più quando si utilizza il vaso più grande, perché al suo interno rimane racchiusa una maggiore quantità di ossigeno.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. La relazione di laboratorio si realizza dopo aver effettuato un esperimento.
2. Gli errori di misurazione dipendono solo dalla persona che la effettua.
3. Quando si esegue un esperimento non è necessario seguire sempre il metodo scientifico.
4. Gli esperimenti confermano sempre le ipotesi fatte.
VERSO LE COMPETENZE STEM
Un esperimento di laboratorio ha richiesto di determinare la massa di un oggetto. I tre gruppi in cui è divisa la classe hanno effettuato cinque pesate ciascuno. I risultati, espressi in grammi, sono i seguenti: 600 600 610 610 590 590 600 600 610 610 610 590 590 580 600
a. Qual è il valore più corretto della massa dell’oggetto?
b. Come lo hai determinato?
Misurare le grandezze : lunghezza, superficie e volume lezione 3
LAB STEM
MISURA IL VOLUME DI UN OGGETTO
Per determinare la misura del volume di un oggetto di forma geometrica esistono delle specifiche regole matematiche, ma come si procede se si tratta di un oggetto di forma irregolare?
■ REALIZZA
L’ESPERIMENTO
MATERIALI
• contenitore rettangolare in vetro o in plastica trasparente
• un mattone e un sasso
• bottiglia
• acqua
• righello
• calcolatrice
• carta e penna

altezza

lunghezza larghezza
PROCEDIMENTO
1. Con il righello misura gli spigoli del mattone: poiché ha la forma di parallelepipedo, il suo volume si calcola moltiplicando le misure di lunghezza, larghezza e altezza.
2. Usa la bottiglia per riempire d’acqua il contenitore, in modo che il livello dell’acqua superi di qualche centimetro l’altezza del mattone.
3. Con il righello misura l’altezza dell’acqua nel contenitore.
4. Immergi il mattone e, una volta che la superficie è di nuovo piana, misura l’altezza raggiunta dell’acqua e calcola la differenza tra le due misure.
5. Poiché il contenitore è un parallelepipedo, l’acqua al suo interno ha la stessa forma. Il volume del mattone è uguale al volume dell’acqua spostata e risulta dal prodotto di lunghezza, larghezza e altezza del dislivello dell’acqua. (Attenzione! Se le pareti del contenitore sono molto spesse devi considerare le misure interne.)
6. Ora immergi il sasso e determina il suo volume.
■ OSSERVA E RISPONDI
1. Compila la tabella e confronta i risultati: i valori sono gli stessi?
acqua spostata
2. Puoi affermare che il metodo usato per determinare il volume di un oggetto di forma regolare può essere usato per valutare il volume di oggetti di qualsiasi forma?
3. Scrivi la relazione dell’esperimento.
1 Misurare vuol dire confrontare
Per esprimere i risultati di un esperimento o le caratteristiche di un oggetto in modo preciso e comprensibile a tutti, non possiamo fare affidamento sui nostri sensi: dobbiamo effettuare delle misurazioni. Tutti gli oggetti hanno delle caratteristiche che possono essere misurate e che possono essere espresse attraverso numeri: ad esempio la lunghezza e la temperatura.
Si definisce grandezza la caratteristica di un oggetto che si può misurare.
Per eseguire una misurazione è necessaria un’unità di misura, cioè una grandezza dello stesso tipo di quella che vogliamo misurare, che viene presa come riferimento e alla quale si dà il valore 1.
Misurare significa confrontare una grandezza con l’unità di misura scelta, per determinare quante volte l’unità di misura è contenuta in quella grandezza.
La misura della grandezza si esprime con un numero e con l’unità di misura scelta per misurarla.
2 Il Sistema Internazionale di unità di misura
L’aumento degli scambi e delle informazioni tra le nazioni del mondo ha reso necessario adottare un sistema di unità di misura uguale per tutti i Paesi.
Nel 1960 è entrato in vigore il Sistema Internazionale di unità di misura (abbreviato in SI). Esso definisce il nome, l’unità di misura e il simbolo di sette grandezze fondamentali indipendenti l’una dall’altra 1 Tab. :
• lunghezza
• massa
• tempo
• intensità di corrente elettrica
• temperatura
• intensità luminosa
• quantità di sostanza
Dalla combinazione delle sette unità fondamentali si ottengono le unità di misura delle grandezze derivate, come la velocità e il volume. Inoltre, tutte le unità di misura hanno multipli e sottomultipli. Se dobbiamo misurare grandezze “grandi” usiamo i multipli dell’unità di misura, se dobbiamo misurare grandezze “piccole” usiamo i sottomultipli. Multipli e sottomultipli sono espressi da un prefisso posto davanti al nome dell’unità di misura 2 Tab. .
nome

Grandezze e misure
simbolo della grandezza unità di misura
simbolo dell’unità di misura
lunghezza L metro m massa m kilogrammo kg
tempo t secondo s intensità di corrente elettrica I ampere A
temperatura T kelvin K intensità luminosa iL candela cd quantità di sostanza n mole mol
1 Tab. Le sette grandezze fondamentali del SI.
prefisso simbolo moltiplica l’unità di misura per
tera T 1 000 000 000 000 = 1012
giga G 1 000 000 000 = 109
mega M 1 000 000 = 106
kilo k 1000 = 103
etto h 100 = 102
deca da 10
deci d 0,1 = 10 –1
centi c 0,01 = 10 –2
milli m 0,001 = 10 –3
micro μ 0,000 001 = 10 –6
nano n 0,000 000 001 = 10 –9
pico p 0,000 000 000 001 = 10 –12
2 Tab. Multipli e sottomultipli.
1 Il righello (a) e una rotella metrica (b) permettono di misurare direttamente la lunghezza.

Per esprimere misure molto grandi o molto piccole è più semplice utilizzare la notazione scientifica ed esprimere il valore con le potenze di 10 anziché con lunghe sequenze di 0. Con la notazione scientifica:
• 10 si esprime come 101
• 1000 si esprime come 103
• 1 000 000 come 106
Anche i numeri decimali si esprimono in questo modo, ma utilizzando potenze negative:
• 0,1 si esprime come 10–1
• 0,001 si esprime come 10–3
• 0,000001 si esprime come 10–6.
3
Gli strumenti di misura
Per effettuare una misurazione occorre anche uno strumento di misura
Gli strumenti che usiamo devono essere adatti alla misura che vogliamo eseguire, cioè devono avere sensibilità e portata adeguati.

Ad esempio, per misurare le dimensioni di un libro, del banco o del cellulare sono adatti una squadra o un righello: questi strumenti hanno la scala divisa in centimetri e millimetri e permettono di compiere misurazioni dirette .
La sensibilità di uno strumento di misura corrisponde alla più piccola di uno strumento di misura corrisponde al valore minimo e al valore massimo che esso può misurare.

Ad esempio, per determinare la lunghezza della tua aula puoi usare una rotella metrica, che ha una portata di 20 m. Effettuare la stessa misura con il righello, la cui portata è di circa 20-30 cm, è un’operazione difficoltosa e puoi facilmente commettere errori 1
Misurare la lunghezza
L’unità di misura della lunghezza è il metro (simbolo m). In molti casi misurare direttamente una lunghezza non è possibile: come fa, ad esempio, un ingegnere a misurare la distanza tra le rive di un fiume per costruire un ponte? Gli strumenti per la misura di grandi distanze utilizzano la luce, che viaggia alla velocità di circa 300 000 km al secondo. Uno di questi strumenti è il teodolite. Il teodolite registra il tempo di andata e ritorno di un raggio di luce e lo trasforma in una misura di lunghezza. Sullo stesso funzionamento si basa il puntatore laser, uno strumento ormai molto diffuso, usato per misurare piccole lunghezze, come le dimensioni di una stanza. Il teodolite e il puntatore laser permettono una misurazione indiretta delle lunghezze 2
Una misura indiretta è ricavata con calcoli di altre grandezze di cui si ha la misura diretta.
5 Misurare la superficie
Se devi misurare l’area del tuo banco non è sufficiente una misura lineare, perché una superficie è caratterizzata da due dimensioni.
L’unità di misura della superficie è il metro quadrato (m2), che corrisponde all’estensione di un quadrato il cui lato è lungo un metro.
Il metro quadrato è un’ unità di misura derivata dal metro. Anche del metro quadrato esistono multipli e sottomultipli. Nelle misure di superficie si passa da una unità alla successiva moltiplicando per 100, mentre per passare alla precedente si divide per 100.
6 Misurare il volume
Gli oggetti occupano uno spazio: la misura associata allo spazio occupato è il volume Per misurare il volume occorre fare un confronto con una unità di misura che delimiti uno spazio, cioè che abbia tre dimensioni.
L’unità di misura del volume è il metro cubo (m3), che corrisponde allo spazio occupato da un cubo i cui spigoli sono lunghi un metro.
Anche il metro cubo è un’unità di misura derivata dal metro. Nelle misure di volume si passa all’unità successiva moltiplicando per 1000, e alla precedente dividendo per 1000. Il volume delle sostanze liquide, come acqua, olio e vino, corrisponde allo spazio che possono occupare in un contenitore. Questa grandezza si chiama capacità Esiste una relazione tra le misure di capacità e quelle di volume 3 . Per verificarlo puoi eseguire questa prova. Procurati un contenitore cubico con gli spigoli di 10 cm = 1 dm: delimita uno spazio di 1 dm3. Riempilo completamente di acqua e poi versa il liquido in un contenitore graduato in litri: osserverai che vi hai versato 1 litro di acqua. Infatti: 1 litro = 1 dm3
FISSA I CONTENUTI
ESSENZIALI
Abbina i termini con la definizione corretta.
1 Portata di uno strumento
2 Sistema Internazionale
3 Metro
1: 2: 3:

3 La corrispondenza tra litro e decimetro cubo.

Misurare lunghezza, superficie e volume 1 dm


a Unità fondamentale di misura delle lunghezze.
b Valore minimo e valore massimo che uno strumento può misurare.
c Sistema che definisce le grandezze fondamentali e le loro unità di misura.
VERSO LE COMPETENZE
Scrivi le seguenti misure di lunghezza utilizzando le potenze di 10 dell’unità fondamentale del SI.
- raggio di un atomo = 0,0000000000003 cm
- distanza di Plutone dal Sole = 5900 milioni di kilometri
- diametro di un globulo rosso = 7,7 millesimi di millimetro
- diametro della galassia di Andromeda = 220000 anni luce.
Misurare le grandezze : massa, peso e tempo lezione 4
LAB STEM
MASSA E PESO NON SONO LA STESSA COSA!
Lo sanno bene gli astronauti, che all’interno delle navicelle spaziali sembrano fluttuare come se non avessero più peso. Eppure il loro corpo è lo stesso di quando si trovano sulla Terra... Fai questo semplice esperimento per verificare la differenza tra la massa e il peso di un corpo.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• bilancia digitale
• dinamometro
• oggetti diversi (una bottiglietta di acqua, una mela, un libro, una bibita in lattina...)
• alcuni sacchetti in plastica riciclabile
• carta e penna
• calcolatrice







PROCEDIMENTO
1. Metti la bottiglietta di acqua in un sacchetto, ponilo sulla bilancia e registra la misurazione.
2. Appendi il sacchetto con dentro la bottiglietta al gancio del dinamometro e registra la misurazione.
3. Ripeti la procedura per ognuno degli oggetti che hai a disposizione.
4. Dividi la misura di ogni oggetto registrata con il dinamometro per quella registrata con la bilancia.
5. Registra i dati in una tabella come questa.
oggetto bilancia dinamometro dinamometro/bilancia bottiglietta
■ OSSERVA E RISPONDI
Dopo aver eseguito l’esperimento, rispondi alle domande.
1. I due strumenti danno misurazioni uguali?
2. Quale strumento registra valori più alti?
3. Il rapporto tra le due misurazioni rimane costante?
4. Sai ipotizzare che cosa rappresenta questo rapporto?
5. Scrivi la relazione dell’esperimento.
1 Misurare la massa
La massa è una delle grandezze del Sistema Internazionale e la sua unità di misura è il kilogrammo (kg).
La massa è definita come la quantità di materia che forma un corpo.
La massa di un corpo è costante, cioè resta invariata in qualsiasi punto della Terra la si misuri: infatti la quantità di materia che lo compone non cambia. Lo strumento per determinare la massa di un oggetto è la bilancia a bracci uguali, che misura la massa di un oggetto attraverso il confronto con masse campione 1 La bilancia a bracci uguali è formata da un’asta, libera di ruotare attorno a un punto, che alle estremità sostiene due piatti. Su un piatto si posa l’oggetto da pesare, sull’altro si mettono dei campioni di massa conosciuta. Quando le masse sui due piatti sono uguali, l’asta si dispone orizzontalmente e la bilancia è in equilibrio. Se la massa su un piatto è maggiore, il suo braccio è più in basso.
1 La bilancia a bracci uguali.

Come già visto per le lunghezze, anche nel caso della misura della massa sono di fondamentale importanza la portata e la sensibilità della bilancia. La scelta della bilancia dipende dalle caratteristiche dell’oggetto di cui si vuole determinare la massa: un orefice e un macellaio non usano strumenti con la stessa scala e anche la portata sarà certamente diversa.
Quanto più una bilancia è sensibile, tanto più la misura indicata sarà precisa, anche se non sempre è necessario tenerne conto: una differenza di un milligrammo in un oggetto d’oro, o in una preparazione farmaceutica, comporta delle conseguenze ben diverse rispetto alla differenza di un milligrammo in un taglio di carne!
2 Misurare il peso


Nel linguaggio comune spesso si fa confusione tra “massa” e “peso”. Per esempio usiamo il kilogrammo come se fosse l’unità di misura del peso. Così, quando acquistiamo 1 kg di mele non stiamo comprando una massa, una quantità di mele pari a 1 kg, ma il peso delle mele (perché la bilancia del fruttivendolo misura il peso, non la massa) anche se, per comodità, lo esprimiamo con l’unità di misura della massa. Che cos’è allora il peso?
Tutti i corpi, qualunque sia la loro massa, subiscono gli effetti della forza di gravità, che è la forza con cui la Terra attira i corpi verso il proprio centro.
Il peso di un corpo è la misura della forza di gravità che agisce sul corpo.
È
vero che sulla Luna pesiamo meno?
Ciò che determina il peso è la forza di gravità, cioè la forza di attrazione esercitata sul corpo dalla massa del pianeta. Sulla Luna, che ha una massa pari a 1/6 di quella terrestre, il peso di un corpo è 6 volte inferiore rispetto a quello sulla Terra. Per esempio una persona che pesa 75 kg sulla Terra, sulla Luna peserebbe solo 12,5 kg! Questo però non significa che si dimagrisca, perché cambia il peso ma non la massa che forma il nostro corpo.
















Mentre la massa di un corpo è costante, il peso cambia, anche se di poco, in base alla distanza del corpo dal centro della Terra: è maggiore ai Poli rispetto all’Equatore, ed è minore su una montagna rispetto al livello del mare.

Il peso si misura con uno strumento che si chiama dinamometro e la sua unità di misura è il newton (N) 2


Il dinamometro è formato da una molla posta all’interno di un cilindro graduato e dotata di un gancio per reggere il corpo di cui si vuole misurare il peso. Il peso del corpo determina un allungamento della molla; la scala graduata indica la misura del peso.
3
Densità e peso pecifico
Appoggiamo sui piatti di una bilancia una sfera di polistirolo e una sfera di legno delle stesse dimensioni. I due oggetti hanno lo stesso volume ma la posizione dei piatti della bilancia indica che le masse sono diverse: la sfera di legno ha una massa maggiore rispetto alla sfera di polistirolo. Possiamo dire che legno e polistirolo hanno diversa densità
La densità indica quanta massa è contenuta in un certo volume di una sostanza.
La densità è una misura indiretta e si ottiene dividendo la massa (m) di un corpo per il volume (V) che esso occupa:
1 Tab. Densità di alcune sostanze.
sostanza densità (g/cm3)
acqua 1
neve fresca 0,08-0,19
sughero 0,25
legno di abete 0,37
alcol etilico 0,79
olio d’oliva 0,9
burro 0,94
aria secca 0,0012
ossa 1,7-2,0
gesso 1,9
alluminio 2,7
ferro 7,86
argento 10,49
oro 19,25









L’unità di misura della densità è il kilogrammo per metro cubo (kg/m3), ma nell’uso quotidiano si preferisce usare il sottomultiplo grammi per centimetro cubo (g/cm3) o, in maniera equivalente, kilogrammi per decimetro cubo (kg/dm3).
La densità è una proprietà caratteristica di ciascuna sostanza 1 Tab. . I corpi con densità maggiore dell’acqua affondano, quelli con densità minore galleggiano 3 . Una grandezza simile alla densità è il peso specifico, che mette in relazione il peso e il volume di una sostanza.



Il peso specifico indica quanto pesa un certo volume di una sostanza.

Anche il peso specifico è una misura indiretta e si calcola dividendo il peso (P) di un corpo per il volume (V) che esso occupa:



3 Un corpo galleggia se la sua densità è inferiore a quella dell’acqua.





densità sughero 0,25 g/cm3


densità acqua 1 g/cm3
densità ferro 7,86 g/cm3






























4 Misurare il tempo
Il tempo è scandito dai movimenti della Terra e del suo satellite, la Luna. Per esempio chiamiamo anno il tempo che la Terra impiega per compiere un’orbita completa intorno al Sole: la sua durata è circa 365 giorni e il suo tra scorrere è segnato dall’alternarsi delle stagioni.
I mesi e le settimane invece sono determinati dai movimenti della Luna: la settimana è il tempo che intercorre fra due fasi lunari successive e il il tempo che passa prima che la Luna si presenti nella stessa fase. Il giorno è il tempo impiegato dal nostro pianeta per compiere un giro completo intorno al suo asse: è scandito dall’alternarsi di ore di luce e di buio ed è diviso in Queste suddivisioni, usate per realizzare i calendari, servono per organizzare la nostra esistenza ma non possono essere ritenute delle unità di misura.
L’unità di misura del tempo è il secondo (s).

Lo strumento per misurare il tempo è l’orologio, mentre il cronometro è usato per piccoli intervalli di tempo fino ai millesimi di secondo. 4
I sottomultipli del secondo seguono il sistema decimale: decimi di secondo, centesimi di secondo e millesimi di secondo. I suoi multipli, invece, seguono il sistema sessagesimale, cioè vanno di sessanta in sessanta: un minuto è formato da 60 secondi, un’ora è formata da 60 minuti.
L’ora è indicata dal simbolo h, iniziale del vocabolo latino hora
FISSA I CONTENUTI ESSENZIALI
Scegli la soluzione corretta.
1. La corretta misura del peso di un oggetto si ottiene utilizzando:
a il metro
b la bilancia
2. La densità di un corpo:
a è identica al peso specifico.
b è il rapporto tra la sua massa e il suo peso.
VERSO LE COMPETENZE STEM

c il dinamometro
d l’orologio
c è il rapporto tra la massa e il volume del corpo.
d è uguale per ogni corpo.
1. Su un piatto di una bilancia c’è una massa di 1 kg, sull’altro ci sono 5 cubi uguali di legno. La bilancia è in equilibrio. Qual è la conclusione corretta?
a Ogni cubo ha massa di 1 kg.
b Ogni cubo ha massa di 200 g.
c La massa dei cubi dipende dal materiale. d Non si può determinare la massa del cubo.
2. Appendi una sfera a un dinamometro e rileva l’allungamento della molla con un righello. Successivamente appendi una seconda sfera e rileva un allungamento doppio. Che cosa deduci?
a La seconda sfera ha peso uguale alla prima.
b Le due sfere hanno la stessa massa.
c La seconda sfera ha volume doppio di quello della prima.
d La seconda sfera ha peso doppio della prima. Giustifica la tua risposta.
Misurare massa e tempo
La rappresentazione grafica dei dati lezione 5
COMPUTER



Guarda il video e scrivi le risposte sul quaderno.

scientifici
1. Perché nella ricerca scientifica si utilizzano dei modelli?
2. In quali occasioni è indispensabile l’uso di modelli?
3. È sempre possibile rispettare i rapporti in scala in un modello?
Motiva la tua risposta con un esempio.
4. Quale definizione puoi dare di modello scientifico?
5. Quali caratteristiche a tuo parere deve avere un modello scientifico?
Tabelle e rappresentazioni grafiche
Nel corso degli esperimenti che gli scienziati svolgono, basati sull’osservazione di un fenomeno o sull’analisi di un modello scientifico, è raccolta una grande quantità di dati: questi devono essere accessibili ad altri, confrontabili e visualizzati in modo immediato. Per questo vengono organizzati in tabelle e rappresentati con grafici, che rendano chiaro il fenomeno studiato. Vediamo alcuni casi. L’insegnante ti propone di studiare il clima di una città e ti suggerisce di considerare la quantità di pioggia caduta nell’arco della settimana. Puoi organizzare i dati raccolti utilizzando una tabella a doppia entrata: la tabella 1 riporta i giorni e la quantità di pioggia, misurata in millimetri, caduta in una certa località.
1 Una tabella a doppia entrata.
La ricerca di Hasler CARTA PENNA
L’ideogramma, come si intuisce dal nome, è una rappresentazione grafica che utilizza un disegno stilizzato o un simbolo che fa capire immediatamente a quale tipo di fenomeno si riferiscono i dati considerati.
La lettura dei dati su un ideogramma però fornisce in genere valori approssimati. Nella tabella sono riportati i dati relativi ai milioni di ettari di copertura arborea che sono andati persi su tutta la Terra dal 2016 al 2021 2 . I dati permettono di costruire il relativo ideogramma. Il simbolo dell’albero corrisponde a due milioni di ettari di foreste distrutte dalla deforestazione.
2 La deforestazione, dalla tabella all’ideogramma.

I diagrammi a colonne, o ortogrammi, visualizzano i dati da rappresentare con una serie di rettangoli di uguale base e di altezza corrispondente al dato da visualizzare. Nella tabella sono riportati i dati di uno studio del 2000 del Ministero dell’Ambiente su alcune specie di vertebrati a rischio di estinzione in Italia 3
3 La biodiversità, dalla tabella all’ortogramma.


4 Uno studio meteorologico, dalla tabella all’istogramma.
L’istogramma è un diagramma formato da colonne costruite secondo i criteri dell’ortogramma. Le colonne però sono affiancate l’una all’altra perché rappresentano la variazione continua di una grandezza.
Nella tabella è riportata la quantità di pioggia, misurata in millimetri, caduta in una località italiana nel corso dell’anno 4

I grafici cartesiani, che utilizzano un sistema di assi cartesiani, si usano quando si vuole rappresentare la variazione di una grandezza (la variabile dipendente) rispetto a un’altra grandezza (la variabile indipendente). Si riportano sull’asse delle ordinate i valori della variabile dipendente e sull’asse delle ascisse quelli della variabile indipendente 5 .
5 Temperatura media stagionale, dalla tabella al grafico cartesiano.
Nella tabella sono riportati i dati relativi alla temperatura media stagionale registrata nel corso di un anno in una località della Campania.

Gli areogrammi, a torta o a quadretti, sono utilissimi per rappresentare dati in percentuale e, in tal caso, l’area del grafico (cerchio o quadrato) corrisponde al valore 100. In base agli avvistamenti degli ultimi anni di cetacei nell’area Pelagos, al largo di Genova, è stata costruita la tabella che riporta la distribuzione percentuale delle diverse specie rispetto al numero totale di cetacei. Dalla tabella è stato poi costruito l’areogramma 6 .
tursiope 21%
grampo 17%
globicefalo 28%
balenottera 15%
capodoglio 19%
FISSA I CONTENUTI ESSENZIALI
Il diagramma a colonne visualizza la quantità in grammi dei principi nutritivi (proteine, grassi e zuccheri) presenti in 100 g di alcuni alimenti.
6 Le rilevazioni dei cetacei al largo di Genova, dalla tabella all’areogramma. 28%
Per ogni alimento costruisci un areogramma che indichi le quantità percentuali dei principi nutritivi in esso contenuti.
CON LA SINTESI
lezione 1 IL METODO SPERIMENTALE
Gli scienziati applicano in tutte le loro ricerche il metodo sperimentale o metodo scientifico, ideato da Galileo Galilei. Le fasi del metodo scientifico sono: osservazione di un fenomeno: si osserva con attenzione il fenomeno o l’oggetto di studio in tutti i suoi particolari; formulazione di un’ipotesi: si elabora una spiegazione razionale del fenomeno; elaborazione di previsioni: si ipotizzano una o più conseguenze che dipendono dall’ipotesi; realizzazione di un esperimento: si eseguono una serie di procedure per verificare le conseguenze dell’ipotesi; raccolta dei dati: si misurano le grandezze e si raccolgono i dati; conferma o abbandono dell’ipotesi: si valutano i risultati dell’esperimento. Se i risultati degli esperimenti si ripetono con regolarità gli scienziati possono confermare le loro ipotesi e formulare una legge scientifica che in alcuni casi si può esprimere in linguaggio matematico.
lezione 2 FACCIAMO UN ESPERIMENTO
Per realizzare correttamente un esperimento occorre seguire le fasi del metodo sperimentale ed eseguire le misurazioni con gli strumenti di misura più adatti per ridurre il più possibile gli inevitabili errori
Per determinare il valore vero di una grandezza occorre calcolare la media matematica M, sommando i valori delle misurazioni e dividendo il risultato per il numero delle misurazioni stesse. Una volta concluso, ogni esperimento deve contenere tutte le indicazioni necessarie affinché possa essere replicato da altri scienziati. La relazione di laboratorio è lo strumento che permette la condivisione dei risultati.
lezione 3 MISURARE LE GRANDEZZE: LUNGHEZZA, SUPERFICIE E VOLUME

Una grandezza è una caratteristica che può essere espressa numericamente. Il Sistema Internazionale di unità di misura, SI, stabilisce le sette grandezze fondamentali, le loro unità di misura e il simbolo: lunghezza, massa, tempo, intensità di corrente elettrica, temperatura, intensità luminosa, quantità di sostanza.

Caratteristiche degli strumenti di misura sono la sensibilità, che corrisponde alla più piccola divisione della scala di misurazione, e la portata, che corrisponde al valore massimo e al valore minimo che lo strumento può misurare.
La lunghezza di un oggetto si ottiene confrontandola con l’unità di misura, il metro (m). L’unità di misura della superficie è il metro quadrato (m2), che corrisponde all’estensione di un quadrato il cui lato è lungo un metro. L’unità di misura del volume è il metro cubo (m3), che corrisponde allo spazio occupato da un cubo i cui spigoli sono lunghi un metro. Il volume delle sostanze liquide, detto capacità, corrisponde allo spazio che esse occupano in un contenitore. L’unità di misura della capacità è il litro (l).
lezione 4 MISURARE LE GRANDEZZE: MASSA, PESO E TEMPO
La massa è la quantità di materia che forma un corpo, è una delle grandezze del SI e la sua unità di misura è il kilogrammo (kg). Lo strumento che misura la massa di un corpo è la bilancia a bracci uguali. Il peso di un corpo è la misura della forza di gravità che agisce su di esso. Si rileva con il dinamometro e la sua unità di misura è il newton (N).
La densità è una grandezza derivata che indica quanta massa è contenuta in un certo volume di una sostanza. Il peso specifico è una grandezza derivata che indica quanto pesa un certo volume di sostanza. Il tempo si misura con l’orologio o il cronometro e la sua unità di misura è il secondo (s).
lezione 5 LA RAPPRESENTAZIONE GRAFICA DEI DATI

I dati raccolti negli esperimenti sono inseriti in tabelle e visualizzati mediante rappresentazioni grafiche: l’ideogramma utilizza un disegno stilizzato o un simbolo per rappresentare un fenomeno; il diagramma a colonne, o ortogramma, è formato da rettangoli che hanno base uguale e altezza corrispondente al valore da rappresentare; l’istogramma è formato da colonne affiancate l’una all’altra e si usa quando i dati da rappresentare indicano la variazione continua di una grandezza; i grafici cartesiani rappresentano due grandezze in relazione tra loro; l’areogramma è usato per rappresentare i dati espressi in percentuale.

CON LA MAPPA
si basa su una serie di fasi fu ideato da
3. del fenomeno
4. Formulazione di un’ipotesi
5. delle conseguenze
Adesso che hai ripassato i contenuti essenziali con la sintesi, prova a completare la mappa con le parole chiave suggerite e a trovare le definizioni corrispondenti. areogrammi - esperimento - Galileo Galilei - istogrammi - osservazione - previsione che sono organizzati in
6. Realizzazione di un ........................................................................
7. Raccolta e analisi dei dati
8. Verifica dell’ipotesi iniziale
9. tabelle 10. rappresentazioni grafiche
12. grafici cartesiani 13. ideogrammi 14.
a. Spiegazione razionale di un fenomeno osservato.
b. Metodo di indagine della realtà ideato da Galilei.
c. Rappresentazione di un fenomeno mediante simboli o disegni stilizzati.
d. Rappresentazione su assi cartesiani delle variazioni di una grandezza rispetto a un’altra.
11.
1. IL METODO SCIENTIFICO
2.

lezione 1 IL METODO SPERIMENTALE
1 Sottolinea i termini errati presenti nelle frasi seguenti.
a. Le fasi iniziali della ricerca scientifica sono la descrizione di un fenomeno e la formulazione di una teoria.
b. Durante un fenomeno si effettuano valutazioni per mezzo di strumenti.
2 Segna con una crocetta se vero (V) o falso (F).
a. L’osservazione di un fenomeno è la prima fase del metodo sperimentale.
b. Un’ipotesi è sempre confermata da un esperimento.
c. Il metodo sperimentale è stato ideato da Leonardo da Vinci.
d. Il metodo sperimentale si applica solo all’osservazione di fenomeni naturali.
3 Metti in ordine corretto le fasi del metodo sperimentale.
a. Formulazione dell’ipotesi.
b. Raccolta dei dati.
c. Conferma dell’ipotesi
d. Osservazione del fenomeno.
e. Previsione delle conseguenze.
f. Realizzazione di un esperimento.
1: 2: 3: 4: 5: 6:
5 Segna con una crocetta se vero (V) o falso (F).
a. Ogni misura è accompagnata da errori.
b. Gli errori in una misura non dipendono dallo strumento utilizzato.
c. Il valore più corretto di una misura è la media di più rilevazioni.
d. Per rilevare lo spessore di un foglio è più opportuno usare il righello per limitare gli errori di misurazione.
6 Scegli la soluzione corretta.
La tabella riporta la quantità di precipitazione (mm) annua in alcune località italiane.
4 Scegli la soluzione corretta.
Quale tra le seguenti azioni non è caratteristica di un esperimento?
1 Eseguire osservazioni accurate
2 Formulare un’unica previsione
3 Raccogliere i dati in modo accurato
4 Stendere una relazione
La media complessiva dei millimetri di pioggia caduti è:
1 915 2 710 3 MILANO 4 695
lezione 3 MISURARE LE GRANDEZZE: LUNGHEZZA, SUPERFICIE E VOLUME
7 Segna con una crocetta se vero (V) o falso (F).
a. Il Sistema Internazionale raggruppa le grandezze fondamentali.
b. Una grandezza è una caratteristica di un oggetto che si può misurare.
c. Il m3 e il litro sono unità di misura della lunghezza.
d. Il colore di un fiore è una grandezza.
8 Scegli la soluzione corretta.
a. Quale delle seguenti unità di misura non appartiene al SI?
1 Il metro 2 Il kilogrammo 3 La mole 4 Il litro
Firenze Venezia Roma Bari
b. Una corretta misura della lunghezza si ottiene utilizzando:
1 il cronometro. 2 la bilancia. 3 il metro. 4 la spanna.
9 Abbina la definizione con il termine corretto.
1. Sensibilità
2. Portata
3. Grandezza
4. Strumento di misura
a Oggetto utilizzato per misurare una grandezza.
b La più piccola divisione della scala di uno strumento.
c Valore massimo e valore minimo che si possono misurare con uno strumento.
d Caratteristica di un oggetto che può essere misurata.
1. 2. 3. 4.
lezione 4 MISURARE LE GRANDEZZE: MASSA, PESO E TEMPO
10 Sottolinea il termine corretto tra i due proposti.
a. L’unità di misura della massa è il newton/ kilogrammo.
b. La densità è il prodotto/rapporto di massa e volume.
c. L’unità di misura del tempo è l’ora/il secondo.
d. Il peso/La massa è la misura della forza di gravità che agisce su un corpo.
11 Segna con una crocetta se vero (V) o falso (F).
a. La quantità di materia che costituisce un corpo si chiama massa.
b. Il dinamometro è lo strumento che misura la massa di un corpo.
c. I multipli del secondo seguono il sistema decimale.
d. L’orologio e il cronometro sono due strumenti di misura del tempo.
12 Scegli la soluzione corretta.
Che cosa rappresenta questo disegno?
densità sughero
0,25 g/cm3
densità acqua
1 g/cm3
densità ferro
7,86 g/cm3





1 La differenza di massa tra il tappo di sughero e la sfera di ferro.
2 La differenza di peso tra i due oggetti.
3 La differenza di densità tra i due oggetti.
4 La differenza di peso specifico tra i due oggetti.
lezione 5 LA RAPPRESENTAZIONE GRAFICA DEI DATI
13 Scegli la soluzione corretta.
a. Devi visualizzare con un grafico i dati relativi alle temperature massime che hai registrato la scorsa settimana. Che cosa utilizzi?
1 Un istogramma.
2 Un ideogramma.
3 Un areogramma.
4 Un grafico cartesiano.
b. Il punto rosso del grafico cartesiano corrisponde al punto:
1 A = (4, 2)
2 B = (3, 1)
3 C = (2, 4)
4 D = (4, 3)
TRARRE INFORMAZIONI DA UN’IMMAGINE
1 Osserva le immagini.


a. Scrivi il nome di questi due strumenti.
b. Quale utilizzi per determinare la massa di un oggetto?

b. Rappresentazione grafica Fenomeno osservato
visitatori del museo d’ arte giovedì venerdì sabato domenica
c. Rappresentazione grafica Fenomeno osservato
2 Individua il tipo di rappresentazione grafica di ogni figura. Per ciascuna di esse indica a quale fenomeno osservato si riferisce.
produzione (milioni di tonnellate)
a. Rappresentazione grafica Fenomeno osservato
LEGGERE UN GRAFICO IN MODO CRITICO
3 Segna con una crocetta se vero (V) o falso (F).
a. La temperatura minima è stata registrata alle 4.
b. Alle 10 e alle 18 è stata registrata la stessa temperatura.
c. La temperatura registrata alle ore 10 è stata di 14°.
APPLICARE CONOSCENZE MATEMATICHE
4 Scegli la soluzione corretta.
a. L’attività sportiva è indispensabile per un corretto sviluppo corporeo. Dopo un’indagine, l’insegnante ha rappresentato con un areogramma a quadretti le percentuali relative agli sport praticati dai suoi 25 alunni.
I ragazzi che giocano a basket sono rappresentati da 12 quadretti: che cosa significa?
6 Leggi il brano.
APPRENDISTI STREGONI
1 12 ragazzi giocano a basket.
2 I ragazzi che giocano a basket sono 1/12 del totale.
3 I ragazzi che giocano sono basket sono il 12%.
4 La differenza tra 25 e 12 rappresenta i ragazzi che giocano a basket.
5 Completa le seguenti uguaglianze.
a. 4,715 km = m = dm = = dam
b. 15,824 m3 = cm3 = dm3
c. 123 dal = dl = ml
d. 1,96 hg = mg = kg
La mia generazione ha attraversato praticamente tutto questo secolo, drammatico per guerre e rivoluzioni, ma anche entusiasmante per gli enormi progressi della scienza e della tecnologia. Sono avvenute più scoperte in questi cent’anni che nei venti secoli precedenti, e le radici di questi profondi mutamenti le troviamo nel 1500 con Copernico, nel 1600 con Galileo, Keplero e poi con Newton. […] È stato il secolo della conquista dello spazio, dell’uomo sulla Luna, dell’avverarsi delle fantasie di Verne e di Wells. Siamo passati dalle carrozze a cavalli ai Concorde, dal giro del mondo in ottanta giorni a quello in venti ore. È stato il secolo dei progressi della medicina e della biologia, dei trapianti, delle madri ultrasessantenni, delle clonazioni. Siamo apprendisti stregoni che potranno fare un gran bene a tutti i viventi o addirittura distruggere il pianeta.
(M. Hack, L’amica delle stelle, BUR)
Rispondi alle domande. Svolgi l’attività proposta, da solo o insieme ai tuoi compagni.
a. Sulla base delle informazioni che ricavi dal testo, a quale secolo si riferisce l’autrice?
b. Quali sono gli eventi scientifici più importanti che si sono verificati?
c. Chi sono i personaggi famosi citati? Sulla base delle tue conoscenze, sono tutti scienziati?
d. Perché, secondo te, l’autrice definisce gli scienziati “apprendisti stregoni”?
Con l’aiuto del vostro insegnante chiedete a un chatbot di intelligenza artificiale di fornirvi delle informazioni sulla vita dell’astrofisica Margherita Hack. Dividete la classe in gruppi e assegnate a ciascuno uno dei seguenti compiti:
• realizzazione di una scheda biografica delle scienziata, corredata di immagini;
• registrazione di un mini-podcast in cui immaginate di intervistare Margherita Hack:
• costruzione di una presentazione creativa delle sue attività di ricerca, con inserimento di alcune delle sue affermazioni più famose. Al termine dei lavori ogni gruppo presenta alla classe il suo prodotto.


della Stazione Internazionale Spaziale (ISS).
THE ISS
INTERNATIONAL SPACE STATION
Among the teams of scientists who have carried out research on the ISS International Space Station, there are five Italians: Paolo Nespoli, Umberto Guidoni, Samantha Cristoforetti, Luca Parmitano and Roberto Vittori.
In the images and videos sent back to Earth we can see the astronauts floating inside the laboratories and in the other environments of the ISS. They appear to be weightless! Yet their bodies were the same as when they were on Earth In fact, when we move away from the Earth at the rotation altitude of the Space Station, that is about 400 km away from the Earth, it is not the mass of the bodies that changes, but it is their weight that changes. Their weight changes due to the effects of the force of attraction exerted by our planet. At this altitude, the ISS is still affected by the Earth’s gravity, but in relation to the distance, the gravity decreases by about 1/10. This causes a reduction in the weight of the vehicle and everything it contains.
COMPREHENSION EXERCISES
a. What is an active heat source?
b. What does the Sun provide?
c. Name two phenomena that demonstrate heat from the Earth.
d. What do we get from photovoltaic panels?



Interno
della materia La struttura unitàMATERIA
2
La materia e le sue caratteristiche lezione 1
La composizione della materia lezione 2
lezione 3
Gli stati fisici della materia



BUONE NOTIZIE PER IL FUTURO
Meno rifiuti, materie prime
Quando parliamo di materie prime indichiamo tutti quei materiali che ricaviamo dallo sfruttamento delle risorse naturali per la produzione di una grande varietà di beni. Le materie prime possono essere di origine agricola, come legno, fibre naturali, oli vegetali, e di origine mineraria, come ferro, rame, carbone e petrolio. Le lavorazioni e i processi industriali che trasformano le materie prime in prodotti lasciano dietro di sé grandi quantità di rifiuti di diverso tipo che rappresentano un grave problema per l’ambiente. Nell’ambito dell’economia circolare, tuttavia, i rifiuti possono diventare una preziosa fonte di materie prime seconde (mps): si tratta di scarti di produzione o di materiali derivanti da processi di riciclo che possono essere immessi sul mercato come nuove materie prime. È il caso delle bucce di arance, uno scarto prodotto in grandi quantità dall’industria agroalimentare. Dalla lavorazione delle bucce e dei resti degli agrumi si possono ottenere pannelli termoisolanti ecosostenibili, per realizzare oggetti per la casa del tutto riciclabili e persino tessuti pregiati, Orange fiber, entrata nella produzione anche dei capi di alta moda.
La materia e le sue caratteristiche lezione 1
CARTA PENNA COMPUTER

Pic-nic nel parco
1
Caratteristiche della materia.

Guarda il video e scrivi le risposte sul quaderno.
1. Di che cosa è fatto il nostro corpo e tutto ciò che ci circonda?
2. Come si può definire la materia?
3. Che differenza esiste tra la materia che forma il nostro corpo e quella che compone l’aria o l’acqua?
4. Da dove deriva la parola “materia”? Che cosa pensi del significato di questa parola?
1
La
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.
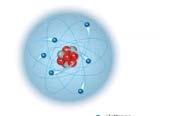

5. Spiega quale tipo di atomo è rappresentato e che cosa lo lega agli organismi illustrati.


materia forma tutto quello che ci circonda
Tutto ciò che esiste intorno a noi è fatto di materia: i pianeti e le stelle, l’acqua e le rocce, il nostro corpo e gli oggetti prodotti dall’uomo sono fatti di materia; anche l’aria è formata da materia, nonostante sia invisibile.
La materia è tutto ciò che occupa uno spazio e ha una massa. Una porzione limitata di materia è un corpo.
I corpi presentano alcune caratteristiche in comune 1 :
• hanno un’estensione: infatti occupano uno spazio e possiedono un determinato volume;
• sono impenetrabili: lo spazio occupato da un corpo non può essere contemporaneamente occupato da un altro;
• sono divisibili: un corpo, cioè, può essere suddiviso in parti più piccole.
Un cubetto di ghiaccio immerso in un bicchiere colmo fa traboccare l’acqua perché l’acqua è impenetrabile.
Una mela intera e la stessa mela tagliata a pezzetti hanno la stessa massa, come rileva la bilancia: è cambiata la forma ma non la quantità di materia.

2 La materia possiede proprietà fisiche e chimiche
La materia possiede delle proprietà fisiche che puoi facilmente osservare, per esempio il colore, la durezza, la densità e la viscosità, cioè la resistenza allo scorrimento 2 . Altre proprietà fisiche sono la conducibilità termica e la conducibilità elettrica: indicano rispettivamente la capacità dei materiali di condurre calore ed elettricità.
I gessi si rompono facilmente, si sbriciolano e sono di colori differenti.

La materia possiede anche delle proprietà chimiche, che caratterizzano il suo comportamento e le sue trasformazioni.
La reattività, per esempio, indica la tendenza di un materiale a combinarsi con altri tipi di materia. Il ferro è un materiale reattivo: in presenza di umidità reagisce facilmente con l’ossigeno atmosferico dando origine alla ruggine. L’infiammabilità è la tendenza a reagire con l’ossigeno dell’atmosfera: quando un oggetto brucia, reagisce con l’ossigeno, sviluppa calore e cambia la sua composizione. L’alcol è altamente infiammabile: per ragioni di sicurezza le bottiglie contenenti alcol riportano sull’etichetta i simboli di rischio che avvertono della sua pericolosità.
Il diamante è il minerale più duro che si conosca. Le macchine che scavano i tunnel, per esempio, hanno lame ricoperte di diamante.

È vero che il miele non scade mai?
2 Caratteristiche fisiche a confronto.
Il miele è denso e viscoso, scorre con difficoltà.

Il miele ha la straordinaria capacità di conservarsi e restare commestibile nel tempo, come è stato dimostrato dai ritrovamenti degli archeologi nelle tombe dell’antico Egitto e a Pompei. Il miele è composto prevalentemente da zuccheri con una piccolissima quantità di acqua, in quanto le api , dopo averlo depositato nei favi, lo sottopongono a ventilazione per mezzo delle ali, in modo da far evaporare tutta l’acqua che contiene. In questo modo il miele diventa un ambiente inospitale per muffe e batteri che hanno bisogno di umidità per riprodursi. Malgrado questo, sul vasetto del miele è obbligatorio indicare il “termine minimo di conservazione” (TMC), solitamente di circa 18-24 mesi.

4 Basicità e acidità.
Altre proprietà chimiche sono la basicità e l’acidità, che esprimono il comportamento di un certo tipo di materia quando viene disciolto in acqua 4
Lo yogurt ha un sapore aspro per la presenza di acido lattico.
5 Le sostanze sono tipi diversi di materia.
I detergenti hanno proprietà basiche grazie alle quali aggrediscono i grassi e li eliminano con il lavaggio.

3 La materia si presenta in diverse forme chiamate sostanze
Ogni “tipo di materia” è chiamato sostanza. Il legno del banco, la ceramica del piatto o l’acciaio delle forbici sono sostanze.
Sono sostanze naturali quelle che si trovano in natura, per esempio l’acqua, il legno e la roccia, mentre sono sostanze sintetiche ottenute attraverso reazioni chimiche, come le materie plastiche e i medicinali 5 .
Una è un tipo di materia con delle proprietà specifiche che la distinguono da tutte le altre.


6 Vasetti di yogurt biodegradabili e compostabili.

Negli ultimi anni si presta sempre più attenzione alle sostanze biodegradabili, che vengono degradate da organismi presenti nell’ambiente e non inquinano, e a quelle biocompostabili, che vengono raccolte insieme ai rifiuti e costituiscono la biomassa 6
Anche per i corpi possiamo fare delle distinzioni e suddividerli in due categorie: i corpi omogenei e i corpi eterogenei 7
• I corpi omogenei sono formati da una sola sostanza; una lattina, una scatola, un mattone sono corpi omogenei, formati rispettivamente da alluminio, cartone e argilla 7 a

FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. La materia occupa uno spazio.
2. I corpi sono porzioni limitate di materia.
a. Una bottiglia di vetro è un corpo omogeneo formato da una sola sostanza, il vetro.
b. Lo zaino da trekking è un corpo eterogeneo, costituito da sostanze diverse.
7 La bottiglia di vetro è un corpo omogeneo, lo zaino è un corpo eterogeneo.

• i corpi eterogenei sono formati da più sostanze; una valigia, un computer, il nostro stesso corpo sono eterogenei 7 b corpo omogeneo eterogeneo naturale sintetico biro
3. La viscosità è una proprietà chimica della materia.
4. La reattività è una proprietà chimica della materia.
Sottolinea il termine corretto tra i due proposti.
1. La reattività/l’infiammabilità è la capacità di una sostanza di combinarsi con altri materiali.
2. Una sostanza naturale/sintetica è prodotta in laboratorio.
3. Un corpo omogeneo/eterogeneo è formato da un’unica sostanza.
4. Il colore è una proprietà fisica/chimica della materia.
VERSO LE COMPETENZE
Fai un inventario degli oggetti che vedi nella tua aula. Per ognuno riconosci se è fatto da una o più sostanze e se è naturale o sintetico.
Riporta le tue considerazioni in una tabella come quella proposta. Segui l’esempio.
La composizione della materia lezione 2
CARTA PENNA COMPUTER

Separare i miscugli
1 Le barrette di ferro e la mina della matita sono costituite da due diversi tipi di atomi.

atomi di ferro

Guarda il video e scrivi le risposte sul quaderno.
1. Quale caratteristica fisica della materia è alla base del processo di decantazione?
2. Quale metodo si usa per separare i componenti dell’acqua salata?
3. Come funziona una centrifuga?
4. Come funziona la mascherina che dobbiamo indossare per proteggerci dalle infezioni?
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.
5. Descrivi sul quaderno il metodo di separazione rappresentato e fai degli esempi di applicazione.
1 La materia è formata da atomi
Già nel VII secolo a.C., i filosofi greci si erano posti delle domande sulla struttura della materia. Democrito (460-370 a.C.), per esempio, aveva ipotizzato che la materia fosse costituita da atomi, parti piccolissime e indivisibili, diverse per dimensione e forma e in continuo movimento. Questa ipotesi, dimenticata per molti secoli e riscoperta dagli scienziati nell’Ottocento, è alla base di un modello della materia basato sull’esistenza degli atomi, la teoria atomica.
I punti principali della teoria atomica sono:
• la materia è costituita da atomi;
• gli atomi di uno stesso tipo sono uguali e hanno la stessa massa;
• gli atomi sono diversamente disposti all’interno della materia.


atomi di carbonio
Frantumiamo una barretta di ferro in pezzi via via sempre più piccoli, fino a ottenere minuscole particelle di ferro, invisibili a occhio nudo: abbiamo ottenuto degli atomi di ferro. Se invece sbricioliamo in parti piccolissime la mina di una matita, le particelle che otteniamo sono atomi di carbonio, che presentano caratteristiche ben definite e diverse dagli atomi di ferro 1 .
Gli atomi sono particelle microscopiche di materia con caratteristiche ben definite.
In natura esistono 92 tipi di atomi differenti, ciascuno con caratteristiche specifiche, contraddistinto da un nome e da un simbolo: per esempio, il simbolo dell’atomo di cloro è Cl e il simbolo dell’atomo di sodio è Na; l’atomo di ferro ha simbolo Fe, l’atomo di carbonio ha simbolo C, l’atomo di idrogeno H e quello di ossigeno O.
Poiché la struttura microscopica della materia non è osservabile né misurabile direttamente, la teoria atomica è stata elaborata avvalendosi anche di prove sperimentali indirette.
2 Dagli atomi alle molecole
Due o più atomi possono legarsi tra loro e formare altre strutture chiamate molecole. Le molecole possono essere formate da uno o più atomi uguali oppure da atomi diversi: per esempio, la molecola di ossigeno è formata da due atomi di ossigeno, mentre la molecola dell’acqua è formata da due atomi di idrogeno e uno di ossigeno 2 .
La molecola è la più piccola parte di una sostanza che mantiene le proprietà della sostanza stessa.
Le molecole, legandosi tra loro, formano le sostanze di cui è composta la materia.
3 Le sostanze possono essere semplici o composte
Le sostanze possono essere formate da molecole o atomi dello stesso tipo, oppure da molecole costituite da atomi differenti.
Le sostanze semplici sono costituite da molecole o da atomi dello stesso tipo.
Le sostanze semplici non possono essere ulteriormente scomposte e sono chiamate elementi. A ogni elemento corrisponde un certo tipo di atomo. Riprendendo gli esempi precedenti, sono elementi il ferro che forma la barretta e il carbonio della mina della matita. Anche il rame è un elemento e non può essere scomposto in una sostanza più semplice 3
La scoperta di alcuni elementi è stata importantissima per la storia dell’umanità: il fer ro ha segnato la prima tappa evolutiva dei nostri antenati; per molto tempo il valore delle monete è stato legato all’oro o all’argento con il quale erano coniate. Le sostanze semplici rappresentano una piccola parte della grande varietà di sostanze esistenti.
La maggior parte delle sostanze, naturali o sintetiche, sono composte, cioè sono costituite da molecole formate da atomi di diverso tipo.
Le sostanze composte, o composti, sono costituite da molecole formate da atomi diversi.
Per indicare un composto si usa una formula chimica, in cui compaiono i simboli degli elementi che lo costituiscono. Esempi di composti sono l’acqua e l’anidride car bonica: l’acqua è indicata con la formula H2O, l’anidride carbonica con la formula CO
2 Una molecola di ossigeno (a) e una di acqua (b).
di ossigeno
3 Il rame è impiegato per fabbricare cavi elettrici per la sua ottima conducibilità elettrica. molecola biatomica


4 Il sale da cucina, chiamato cloruro di sodio, è una sostanza composta costituita da due elementi: il cloro (Cl) e il sodio (Na).
A differenza degli elementi, i composti possono essere suddivisi in sostanze più semplici 4 . Per esempio, usando energia elettrica è possibile scomporre la molecola di acqua e ottenere un atomo di idrogeno e due atomi di ossigeno.

Anche l’anidride carbonica, presente nell’aria, può essere scomposta in ossigeno e carbonio, ma occorre una grande quantità di energia. In natura la scomposizione dell’anidride carbonica è compiuta dai vegetali per svolgere la fotosintesi.
4 I miscugli
In natura, gli elementi e i composti si presentano raramente da soli. Nella maggior parte dei casi infatti si mescolano tra loro e formano dei miscugli Esistono due tipi di miscugli: i miscugli eterogenei e i miscugli omogenei.
5 Il latte è un esempio di miscuglio eterogeneo in cui le componenti sono visibili solo al microscopio.

In un miscuglio eterogeneo le sostanze che lo compongono sono distinguibili a occhio nudo (o mediante un microscopio) e separabili con procedimenti fisici.
Inoltre, la composizione di un miscuglio eterogeneo è diversa nelle varie parti del miscuglio.
Le sostanze che compongono un miscuglio eterogeneo mantengono inalterate le loro caratteristiche; per questo un miscuglio eterogeneo possiede le proprietà di tutte le sostanze che lo formano, anche se variano da un punto all’altro del miscuglio. Un esempio di miscuglio eterogeneo è una roccia come il granito: anche a occhio nudo si riconoscono i minerali che lo formano. Altre volte, invece, i vari componenti di un miscuglio eterogeneo non sono distinguibili a occhio nudo. È il caso della maionese, della nebbia e del latte 5
In un miscuglio omogeneo le sostanze che lo compongono non si possono distinguere in alcun modo tra loro.
Nei miscugli omogenei i singoli componenti sono così profondamente miscelati da non essere distinguibili neanche al microscopio. Inoltre, a differenza di un miscuglio eterogeneo, un miscuglio omogeneo ha la stessa composizione e le stesse proprietà in ogni suo punto.
Sale d’Italia
Cl Na
Sono miscugli omogenei il vino, il tè e l’acqua, sia quella del mare sia quella dolce. I miscugli omogenei sono chiamati anche soluzioni

In una soluzione, la sostanza presente in quantità maggiore è chiamata solvente; la sostanza presente in quantità minore è detta soluto. I miscugli
Puoi creare una soluzione versando dell’inchiostro in un bicchiere contenente acqua. Agita il bicchiere: acqua e inchiostro si mischiano e, anche se lasci riposare il miscuglio, i componenti non si separano. In natura esistono molti tipi di soluzioni, come l’acqua del mare: il solvente è l’acqua e i soluti sono i sali in essa disciolti. Anche l’aria è una soluzione: il solvente è l’azoto gassoso e i soluti sono gli altri gas, come ossigeno, anidride carbonica e vapore acqueo.
Le soluzioni artificiali sono utilizzate nella vita di tutti i giorni: un esempio sono le bevande in cui il solvente è l’acqua e i soluti sono lo zucchero, i coloranti, gli aromi; oppure i diversi tipi di detergenti usati per le pulizie domestiche.
Le soluzioni possono essere anche solide, come nel caso delle leghe metalliche. Ne sono esempi l’acciaio e l’ottone: l’acciaio si ottiene mescolando ferro e carbonio, l’ottone mescolando rame e zinco.
Acciaio e ottone hanno proprietà differenti da quelle delle sostanze di partenza.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. L’atomo è la parte più piccola della materia.
L’acqua in bottiglia è più pura dell’acqua del rubinetto?
Anche la migliore acqua in bottiglia contiene sempre una certa quantità di sostanze minerali disciolte e, pertanto, non è pura. Per ottenere acqua pura, cioè formata solo da molecole d’acqua, si ricorre a processi fisici che permettono di rimuovere sali minerali, gas e altre sostanze. L’acqua così ottenuta è chiamata “acqua distillata”. Ma, attenzione! L’acqua distillata non disseta, a differenza dell’acqua potabile che toglie la sete proprio grazie ai sali minerali che contiene.
SCIENZA

2. La molecola di una sostanza non ne conserva le caratteristiche.
3. In un miscuglio omogeneo è possibile distinguere i componenti.
4. Per indicare un composto si usa la formula chimica.
VERSO LE COMPETENZE STEM
Esegui l’esperimento.
Materiali
• uguali quantità delle seguenti sostanze: acqua, latte, sabbia, ghiaia, limatura di ferro e olio
• bicchieri di carta
Esecuzione
1. Mescola a due a due uguali quantità delle sostanze che hai a disposizione fino a esaurire le possibili coppie.
Osserva e rispondi.
1. In quali casi ottieni dei miscugli omogenei?
2. Quando ottieni dei miscugli eterogenei?
3. Che cosa osservi se, dopo aver mescolato le sostanze, le lasci riposare per 10 minuti?
VISUAL i Separaremiscugli

Per ottenere un miscuglio è sufficiente mescolare tra loro due o più sostanze. Ma è possibile fare il procedimento inverso, cioè separare i componenti di un miscuglio? Certo, basta sfruttare le diverse proprietà fisiche dei componenti stessi.

Il metodo sfrutta le differenze di densità dei componenti di un miscuglio. Puoi vederlo all’opera in una giornata di mare agitato, sulla spiaggia: le onde alzano la sabbia e l’acqua è torbida. Quando il mare si calma, la sabbia, più densa dell’acqua, si deposita sul fondo e l’acqua ritorna limpida. Lo stesso accade per l’acqua e l’olio. Versa qualche goccia di olio nell’acqua e lascia riposare il bicchiere: vedrai che l’olio, meno denso dell’acqua, si dispone in uno strato compatto al di sopra dell’acqua perché le due sostanze sono immiscibili, cioè non si mescolano tra loro.
FILTRAZIONE
È un metodo che si basa sulle diverse dimensioni delle particelle che formano il miscuglio e utilizza un filtro con pori abbastanza piccoli da trattenere le particelle che si vogliono separare. Anche il colino e lo scolapasta che usiamo in cucina sono strumenti che sfruttano il metodo della filtrazione. Le mascherine, per esempio, sono filtri che trattengono le polveri e altre minuscole particelle, così come il filtro della cappa aspirante. Nei laboratori chimici il filtro è una speciale carta con pori invisibili a occhio nudo. Quando viene versato un


DECANTAZIONE
liquido, questo filtro di carta trattiene le particelle solide contenute nel liquido e lascia passare solo il liquido che si raccoglie nel recipiente sottostante.
DISTILLAZIONE
Permette di separare i componenti di un miscuglio omogeneo, come i sali minerali contenuti nell’acqua salata. Si riscalda il miscuglio in un contenitore per fare evaporare l’acqua: il vapore acqueo è fatto passare in un tubo dove si trasforma nuovamente in acqua liquida, mentre sul fondo del contenitore resta il sale. I distillatori utilizzati per la produzione di whisky e grappa si basano su questo metodo di separazione.

CENTRIFUGAZIONE
La centrifugazione sfrutta la forza generata da una centrifuga per separare le componenti di un miscuglio quando sono molto piccole. Il latte è un miscuglio eterogeneo composto da globuli di grasso, la panna, immersi nel liquido. Per separarli si usa la scrematrice, una macchina per centrifugare che permette di ottenere dal latte la panna con cui si produce il burro. La lavatrice usa il metodo della centrifugazione per separare l’acqua dal bucato. Infatti quando termina il lavaggio, gran parte dell’acqua è stata già allontanata dal bucato. Anche nei laboratori chimici si usa questa tecnica. Le provette contenenti un miscuglio, vengono inserite in un macchinario che le fa ruotare rapidamente. Questo determina la separazione dei componenti del miscuglio in base alla loro densità. La lavatrice usa il metodo della centrifugazione per separare l’acqua dal bucato. Infatti quando termina il lavaggio, gran parte dell’acqua è stata già allontanata dal bucato. Anche nei laboratori chimici si usa questa tecnica. Le provette contenenti un miscuglio, vengono inserite in un macchinario che le fa ruotare rapidamente. Questo determina la separazione dei componenti del miscuglio in base alla loro densità.



Gli stati fisici della materia lezione 3
CARTA PENNA COMPUTER
1 Ghiaccio, acqua liquida e vapore acqueo sono costituiti dalle stesse molecole d’acqua. Ciò che cambia è il modo in cui le molecole sono aggregate.

Guarda il video e scrivi le risposte sul quaderno.

Gli stati d’aggregazione dell’acqua
1. In quali condizioni si trovano le particelle quando l’acqua è solida?
2. A quale temperatura l’acqua si trova allo stato solido?
3. Quali sono le caratteristiche fisiche dell’acqua allo stato liquido?
4. Come si muovono le particelle nell’acqua liquida? Che cosa cambia rispetto allo stato solido?
5. In quale stato di aggregazione le particelle si muovono più velocemente?
6. Secondo te esiste una relazione tra i movimenti delle particelle e la temperatura?
1 Solidi, liquidi e aeriformi
I tre aspetti che la materia può assumere sono chiamati stati fisici o stati di aggregazione: sono lo stato solido, lo stato liquido e lo stato aeriforme Le sostanze allo stato aeriforme possono essere gas o vapori. Si parla di gas quando le sostanze esistono normalmente solo allo stato aeriforme, come l’ossigeno, l’elio, l’anidride carbonica e il metano. I vapori invece derivano da sostanze solide o liquide, come ad esempio la naftalina e l’acqua. La stessa sostanza può presentarsi in stati fisici diversi. L’acqua, per esempio, si presenta sotto forma di ghiaccio (stato solido), di acqua liquida (stato liquido) e di vapore acqueo (stato aeriforme) 1


Dall’esperienza comune sappiamo che si tratta sempre della stessa sostanza. Infatti, se togliamo dal freezer un cubetto di ghiaccio e lo lasciamo a temperatura ambiente, dopo pochi minuti fonde e diventa liquido. Se poi versiamo l’acqua in un pentolino e la riscaldiamo sopra un fornello acceso, dopo un po’ di tempo vediamo che incomincia a muoversi, bolle e diventa vapore. Come l’acqua, tutte le sostanze possono mutare il loro stato fisico al variare della temperatura.
Perché la materia si può presentare in diversi stati fisici? Le molecole che formano le sostanze non sono ferme, ma si muovono in modo continuo e disordinato. Questo movimento invisibile è chiamato agitazione termica. Nello stesso tempo, però, le molecole, pur essendo in movimento, non si allontanano le une dalle altre perché sono tenute assieme dalle forze di coesione
La combinazione delle forze di coesione e dell’agitazione termica determina le caratteristiche e le proprietà dei tre stati fisici della materia 2
• Le elevate forze di coesione presenti nei solidi impediscono alle molecole di allontanarsi e le mantengono in posizioni fisse, consentendo loro di fare solo piccole oscillazioni intorno alla propria posizione. L’agitazione termica nei solidi è quindi minima.
• In un liquido le molecole sono molto vicine tra loro, ma possono muoversi perché le forze di coesione sono meno intense di quelle presenti nei solidi. Le molecole possono scorrere le une sulle altre e l’agitazione termica è maggiore che nei solidi.
• Tra le molecole degli aeriformi l’agitazione termica è elevata e le forze di coesione sono quasi inesistenti. Le molecole, distanti tra loro e libere di muoversi, occupano tutto lo spazio disponibile.
2 Le proprietà dei solidi


Una roccia, un bicchiere e una zolletta di zucchero sono sostanze solide ben diverse tra loro, ma hanno in comune alcune caratteristiche: hanno tutte una forma ben definita, occupano uno spazio ben preciso, cioè hanno volume proprio, e sono incomprimibili, cioè non possono spontaneamente ridurre il loro volume e deformarsi.
I solidi hanno forma e volume propri e non sono comprimibili.
Le molecole che formano un solido possono disporsi in modo ordinato oppure in modo disordinato: nel primo caso si parla di cristalli, nel secondo caso di solidi amorfi.
In un cristallo le molecole si dispongono nello spazio secondo una struttura regolare: la forma finale di un cristallo è un solido geometrico come un cubo, una piramide o un parallelepipedo 3
In un solido amorfo, invece, le molecole sono disposte in maniera molto disordinata e senza alcuna regolarità: sostanze solide che hanno questa struttura sono, per esempio, il vetro e la cera con cui si realizzano le candele 4
Solido: le molecole sono strettamente connesse tra loro.
Liquido: le molecole “scivolano“ le une sulle altre.
Aeriforme: le molecole sono libere di occupare tutto lo spazio a disposizione.

3 Cristalli cubici di fluorite.
5 Come si deformano i solidi.
I solidi sottoposti a una forza che tende a deformarli reagiscono in modi diversi 5 .
• I solidi rigidi, come un piatto di ceramica e un bicchiere di vetro, non cambiano la loro forma e si rompono.

• I solidi elastici, come la gomma per cancellare e gli elastici, possono essere deformati, ma poi tornano alla forma originaria.
• I solidi plastici possono essere deformati senza rompersi e mantengono la nuova forma: la creta e un blocco di plastilina sono esempi di corpi plastici.
• I solidi malleabili, come l’alluminio e l’oro, si lasciano ridurre in lamine sottili.
• I solidi duttili, come l’argento, possono essere ridotti in fili sottili.


L’alluminio è malleabile: quello che si usa in cucina ne è un esempio.
3 Le proprietà dei liquidi e degli aeriformi
Quando versi un liquido in un recipiente, per esempio l’acqua da una bottiglia in un bicchiere, ti accorgi che esso assume precisamente la forma del recipiente 6
I liquidi hanno un volume proprio e non hanno una forma propria: assumono quella del recipiente che li contiene.
6 I liquidi prendono la forma del loro recipiente.

Inoltre la superficie libera del liquido, cioè la superficie a contatto con l’aria, è sempre orizzontale. Una bottiglia piena d’acqua sino all’orlo non può essere chiusa inserendo un tappo: è necessario svuotarla un poco, in modo da creare un po’ di spazio per il tappo. Questo dimostra che i liquidi, come i solidi, sono incomprimibili Che cosa succede invece quando lasci aperta una boccetta di profumo? In breve tempo i “vapori odorosi” si diffondono nell’aria e riesci a percepirli anche a una certa distanza. Le molecole delle sostanze aeriformi, come quelle del profumo, si muovono incessantemente in ogni direzione fino a occupare tutto lo spazio a loro disposizione.
Gli aeriformi non hanno né forma né volume propri.
Le molecole delle sostanze aeriformi tendono ad allontanarsi le une dalle altre: se le comprimiamo possiamo avvicinarle tra loro e ridurre il volume. Quindi gli aeriformi, a differenza di solidi e liquidi, sono comprimibili.
Il piatto è un solido rigido.
La plastilina è plastica.
I liquidi e gli aeriformi sono raggruppati nella categoria dei fluidi: li accomuna la scarsa coesione tra le molecole che li costituiscono. Una proprietà comune dei fluidi è la capacità di scorrere. Lo vedi ad esempio quando versi dell’acqua da una bottiglia: le forze di coesione tra le molecole permettono il trasferimento dell’acqua dalla bottiglia al bicchiere, perché una molecola trascina l’altra come in una catena.
L’acqua scorre facilmente, ma i fluidi presentano sempre una viscosità più o meno accentuata, cioè una resistenza allo scorrimento che dipende dalle forze di coesione.
I liquidi hanno anche altre proprietà: per esempio la tensione superficiale, la forza di adesione, il potere solvente.
4 Lo stato di plasma
Esiste un quarto stato di aggregazione della materia, lo stato di plasma: uno stato gassoso nel quale le molecole sono dotate di carica elettrica, si muovono velocissime e sono contenute in uno spazio piccolissimo. Lo stato di plasma ci è poco familiare, in realtà rappresenta lo stato normale della materia nell’Universo: lo possiamo osservare nelle code delle comete, nelle aurore boreali e nell’aria intorno ai fulmini.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
Come funziona le sfera dei fulmini?
La sfera dei fulmini è un oggetto molto divertente e suggestivo! Si tratta di una lampada al plasma costituita da una sfera di vetro trasparente contenente gas allo stato di plasma con al centro un dispositivo che emette elettricità. All’accensione, l’elettricità stimola le particelle del gas, che si separano in particelle più piccole e dotate di carica elettrica, producendo filamenti di luce viola-blu. Basta toccare la sfera con un dito che i fulmini si concentrano nel punto di contatto: il nostro corpo, infatti, crea un percorso di minor resistenza per le scariche elettriche, dandoci l’impressione di catturare i fulmini.
SCIENZA CHE


1. Le molecole dei solidi hanno una debole agitazione termica.
2. I liquidi mantengono sempre la superficie libera orizzontale.
3. Le forze di coesione che tengono insieme le molecole degli aeriformi sono molto intense.
4. Un solido malleabile può essere ridotto in lamine sottili.
VERSO LE COMPETENZE STEM
Esegui l’esperimento.
Materiali • una siringa senza ago • un bicchiere pieno di acqua
Esecuzione
1. Riempi completamente d’acqua la siringa, aspirandola dal bicchiere. Tappa con un dito il foro di uscita e spingi lo stantuffo.
2. Svuota la siringa e aspira aria. Tappa il foro di uscita e spingi lo stantuffo.
Osserva e rispondi.
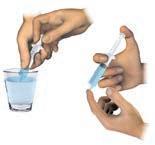
1. Che cosa succede quando comprimi l’acqua?
2. Che cosa succede quando comprimi l’aria?
3. Dopo aver compresso l’aria, lascia libero lo stantuffo. Che cosa osservi?
CON LA SINTESI
lezione 1 LA MATERIA E LE SUE CARATTERISTICHE
La materia è tutto ciò che occupa uno spazio e ha una massa. Una porzione limitata di materia è un corpo.
I corpi possiedono un volume; sono impenetrabili perché ogni corpo occupa uno spazio che non può essere occupato da un altro; sono divisibili in parti più piccole.
Sono proprietà fisiche della materia forma, colore, durezza, conducibilità elettrica e termica.
Sono proprietà chimiche della materia reattività, infiammabilità, basicità e acidità.
Esistono diversi tipi di materia, chiamati sostanze; una sostanza possiede specifiche proprietà che la distinguono da tutte le altre.
Sono sostanze naturali quelle che si trovano in natura; sono sostanze sintetiche quelle prodotte in laboratorio.
I corpi a loro volta si distinguono in omogenei, quando sono formati da un’unica sostanza, e in eterogenei, quando sono formati da più sostanze.
lezione 2 LA COMPOSIZIONE DELLA MATERIA
La materia è costituita da parti microscopiche dette atomi. Esistono 92 tipi differenti di atomi con caratteristiche specifiche. Due o più atomi possono legarsi tra loro e formare delle molecole. La molecola è la parte più piccola di sostanza che ne conserva le caratteristiche. Le sostanze semplici o elementi sono costituite da molecole formate da atomi uguali.
Le sostanze composte, o composti, sono costituite da molecole formate da atomi diversi. Per indicare i composti si usa una formula chimica. A differenza degli elementi, i composti possono essere suddivisi in sostanze più semplici. Elementi e composti si combinano tra loro a formare i miscugli che possono essere omogenei o eterogenei. Nei miscugli eterogenei i componenti sono distinguibili a occhio nudo o con un microscopio e sono separabili con procedimenti fisici. In un miscuglio omogeneo i componenti non sono distinguibili in alcun modo e le proprietà del miscuglio sono uguali in ogni suo punto.
Le soluzioni sono miscugli omogenei: la sostanza presente in misura maggiore si chiama solvente, quella presente in misura minore soluto Esempi di soluzioni sono l’acqua del mare, l’aria e le leghe metalliche.



lezione 3 GLI STATI FISICI DELLA MATERIA
La materia si presenta in tre stati fisici o stati di aggregazione: stato solido, stato liquido, stato aeriforme.
L’esistenza dei tre stati fisiciè una conseguenza delle forze di coesione che si esercitano tra le molecole e dell’agitazione termica, cioè il movimento delle molecole stesse. Nei solidi le forze di coesione sono elevate e le molecole possono vibrare attorno a posizioni fisse. I solidi hanno forma e volume propri e non sono comprimibili. Gli atomi o le molecole che li formano possono essere disposti in modo regolare (cristalli) o irregolare (solidi amorfi).
I solidi, quando sono sottoposti a una forza deformante, reagiscono in maniera differente: i solidi rigidi si rompono; i solidi elastici, cessata l’azione della forza, ritornano alla forma originale; i solidi plastici possono essere deformati senza rompersi e mantengono la nuova forma; i solidi malleabili possono essere ridotti in lamine sottili; i solidi duttili possono essere ridotti in fili sottili.
Nei liquidi le forze di coesione sono più deboli che nei solidi e le molecole possono scivolare le une sulle altre. I liquidi assumono la forma del recipiente che li contiene, hanno volume proprio e non sono comprimibili.
Negli aeriformi le forze di coesione sono minime, ma è forte l’agitazione termica, perciò tendono a occupare tutto lo spazio disponibile. Gli aeriformi non hanno né forma né volume propri, e sono comprimibili.
Esiste un quarto stato di aggregazione della materia, lo stato di plasma: è uno stato di gas in cui le molecole si muovono velocissime, hanno carica elettrica e sono contenute in uno spazio piccolissimo. È lo stato caratteristico della materia che forma l’Universo.


CON LA MAPPA
Adesso che hai ripassato i contenuti essenziali con la sintesi, prova a completare la mappa con le parole chiave suggerite e a trovare le definizioni corrispondenti. aeriforme - atomi - plasma - proprietà chimiche - solido - sostanze composte
è formata da che possono unirsi formando che compogono
3. molecole 3. molecole
4. le sostanze semplici 5. le
si presenta in diversi possiede
11. proprietà fisiche

liquido

Inserisci accanto a ogni definizione il numero che corrisponde alla parola chiave usata nella mappa.
a. Stato fisico della materia caratterizzato da elevata agitazione termica delle molecole.
b. Sono costituite da molecole formate da atomi diversi.
c. Sono la più piccola parte delle sostanze che ne conservano tutte le proprietà.
d. L’infiammabilità è una proprietà di questo tipo.
1. LA MATERIA
6. stati fisici
2.
10. stato di
FISSA I CONTENUTI ESSENZIALI
lezione 1 LA MATERIA
E LE SUE CARATTERISTICHE
1 Sottolinea il termine corretto tra i due proposti.
a. Un corpo è una porzione limitata/illimitata di materia.
b. Se dividi un corpo in parti più piccole la sua massa cambia/non cambia
c. La formazione della ruggine in presenza di umidità è una proprietà fisica/chimica del ferro.
d. Il miele è più/meno viscoso dell’acqua.
2 Scegli la soluzione corretta.
a. La materia:
1 non occupa spazio.
2 è penetrabile.
3 ha una sua massa.
4 non è divisibile.
b. La reattività è la capacità di un corpo di:
1 combinarsi con l’ossigeno dell’atmosfera.
2 scorrere su una superficie.
3 far passare il calore.
4 combinarsi con altri tipi di materia.
3 Completa la tabella inserendo una crocetta nella colonna corrispondente.
proprietà chimica fisica
Infiammabilità
Viscosità
Conducibilità termica
Colore
Conducibilità elettrica
Reattività
Durezza
Densità

lezione 2 LA COMPOSIZIONE DELLA MATERIA
4 Segna con una crocetta se vero (V) o falso (F).
a. La molecola è la parte più piccola della materia.
b. Gli atomi nella materia sono sempre disposti nello stesso modo.
c. Le sostanze semplici sono composte da atomi o molecole dello stesso tipo.
d. In un qualunque tipo di miscuglio le sostanze si possono sempre separare.
5 Sottolinea il termine corretto tra i due proposti.
a. In natura esistono 92 /102 atomi differenti.
b. In un miscuglio omogeneo /eterogeneo le sostanze che lo compongono sono distinguibili.
c. In una soluzione la sostanza che si scioglie si chiama solvente /soluto.
d. Il latte è un miscuglio omogeneo /eterogeneo.
6 Completa la tabella inserendo una crocetta nella colonna corrispondente.
sostanza semplice composta acqua
metano
azoto
lezione 3
GLI STATI FISICI
DELLA MATERIA
7 Segna con una crocetta se vero (V) o falso (F).
a. Nei liquidi le molecole scorrono le une sulle altre.
b. Nei solidi le molecole sono debolmente legate tra loro.
c. Negli aeriformi le molecole si muovono in modo disordinato in tutte le direzioni.
d. Le molecole di un liquido sono disposte ordinatamente.
8 Abbina i termini con la definizione corretta.
1. Malleabilità
2. Elasticità
3. Duttilità
4. Plasticità
a Proprietà di un solido di essere ridotto in fili sottili.
b Proprietà di un solido di deformarsi e mantenere la nuova forma.
c Proprietà di un solido di deformarsi e riprendere la forma originale.
d Proprietà di un solido di essere ridotto in lamine sottili.
1. 2. 3. 4.
9 Rispondi alla domanda.
Quale proprietà dei liquidi è rappresentata nell’immagine?

10 Completa le frasi con i termini corretti.
a. I solidi composti da molecole disposte secondo una struttura regolare si chiamano .
b. Le molecole dei gas possiedono agitazione termica.
c. La superficie libera di un liquido è sempre
d. Lo stato di plasma è uno stato della materia.
11 Il disegno rappresenta la disposizione delle molecole dell’acqua nei suoi tre stati di aggregazione. Scrivi il termine corretto sotto ogni immagine.
a b c


12 Completa il brano con i termini corretti. Un corpo allo stato liquido ha un volume , non ha propria, ma assume quella del recipiente in cui è contenuto e, come i solidi, non è . Le sue molecole possono scorrere le une sulle altre perché sono legate da deboli forze di L’agitazione termica delle molecole di un liquido è rispetto a quella di un aeriforme.
13 Scegli la soluzione corretta.
Osserva l’immagine: quale proprietà possiede il trampolino?

1 Plasticità.
2 Elasticità.
3 Duttilità.
4 Malleabilità.
TRARRE INFORMAZIONI DA UN’IMMAGINE
1 Osserva l’immagine e rispondi alle domande.



a. Quale stato fisico è rappresentato nella figura a?
b. Quali sono le caratteristiche delle molecole di un corpo allo stato liquido?
OSSERVARE E TRARRE CONCLUSIONI
3 Osserva i disegni. Completa la definizione e rispondi alle domande.
CLORO (formato da molecole costituite da
c. Perché è necessario tappare il contenitore della figura c?
INTERPRETARE FENOMENI
2 Osserva l’immagine e rispondi alle domande. Se provi a versare un po’ di olio in un bicchiere contenente acqua, ottieni un risultato simile a quello della foto.

a. Si forma un miscuglio omogeneo o eterogeneo?
b. Da che cosa lo capisci?
ACQUA (formato da molecole costituite da
a. Qual è la sostanza semplice?
b. Qual è la sostanza composta?
INDIVIDUARE CARATTERISTICHE E SPIEGARE
4 Rispondi alle domande.
a. Quali sono le caratteristiche di un miscuglio eterogeneo?
b. Quali sono le caratteristiche di un miscuglio omogeneo?
c. Completa la tabella.
miscugli omogeneo eterogeneo acqua e zucchero
benzina nuvole tè
maionese vino acciaio
ANALIZZARE UN MODELLO
5 Riconosci nei disegni i tre stati fisici della materia e scrivi il termine corretto di ognuno.
c. Che ruolo hanno le dislocazioni? V01U03L06 V01U03L03-4 V01U03L01-3
COMPRENDERE UN TESTO E RICERCARE INFORMAZIONI
6 Leggi il brano.
SCOPERTO IL MATERIALE PIÙ TENACE AL MONDO
In un articolo pubblicato su Science, Easo George, uno degli autori dello studio, ha annunciato la scoperta di una nuova lega metallica, il CrCoNi, formata da cromo, cobalto e nichel, estremamente duttile e tenace, specialmente a basse temperature. Al contrario delle altre leghe, ogni elemento è presente
in parti uguali e questo garantisce la sua robustezza. I metalli, come altri materiali solidi, hanno una struttura cristallina, formata dalla ripetizione di strutture semplici, chiamate celle unitarie, che formano il reticolo. I cristalli però non sono perfetti, le celle unitarie presentano dei difetti chiamati dislocazioni, punti dove un pezzo di reticolo deformato si incontra con un altro non deformato. Quando una dislocazione si muove con facilità nel reticolo, il materiale è più malleabile; quando invece il movimento è bloccato dalle irregolarità del reticolo il materiale è più robusto, ma incline alla rottura. Nel caso del CrCoNi le dislocazioni agiscono in un ordine particolare e provocano delle interazioni tra gli atomi che lo irrobustiscono. In futuro questo materiale potrebbe essere utilizzato per costruire razzi o satelliti, ma si stanno studiando altre leghe, ottenute con materiali meno cari rispetto a cobalto e nichel, da utilizzare per la fabbricazione degli aerei. (Rid. e adatt. da Focus)
Rispondi alle domande. Svolgi l’attività proposta da solo o insieme ai tuoi compagni.
a. I solidi hanno sempre una struttura cristallina?
b. Che cosa sono le celle unitarie?
Intelligenza Artificiale IA
Con l’aiuto dell’insegnante chiedi a un chatbot di intelligenza generativa di spiegarti in maniera semplice e con degli esempi il significato delle seguenti parole:
duttile ~ tenace ~ malleabile ~ celle unitarie ~ dislocazione ~ lega metallica ~ cristallo
• Ricerca nel testo le definizioni di cristallo e lega metallica e mettile a confronto con quelle fornite dal chatbot che hai utilizzato: hai migliorato la comprensione di questi termini?
• Con delle informazioni fornite dal testo, utilizza plastilina di diversi colori e stuzzicadenti per costruire delle celle unitarie della lega di CrCoNi. In che modo si può introdurre una dislocazione nel modellino che hai costruito?

HETEROGENEOUS AND HOMOGENEOUS MIXTURES

A heterogeneous mixture is a mixture where the components of the mixture are not uniform or have localized regions with different properties. Different samples from the mixture are not identical to each other.
There are always two or more phases in a heterogeneous mixture.
Usually, it’s possible to physically separate components of a heterogeneous mixture. For example, you can centrifuge solid blood cells to separate them from the plasma of blood. You can remove ice cubes from soda. You can separate candies according to color.

A homogeneous mixture is a mixture where the components that make up the mixture are uniformly distributed throughout the mixture.
The composition of the mixture is the same throughout.
Only one phase of matter is present in a homogeneous mixture. So, you wouldn’t observe both a liquid and a gas or a liquid and a solid in a homogeneous mixture.
COMPREHENSION EXERCISES
Complete.
degree ● heterogeneous ● homogeneous ● mixture
a. A can be homogeneous or heterogeneous.
b. The difference between heterogeneous and homogeneous mixtures is the to which the materials are mixed together.
c. In a mixture the components are uniformly distributed throughout the mixture.
d. There are always two or more phases in a mixture.



MATERIA
e il calore La temperaturaunità

lezione 1
La temperatura
Il calore lezione 2
La propagazione del calore lezione 3
I cambiamenti di stato della materia lezione 4

LEZIONI POWERPOINT in

BUONE NOTIZIE PER IL FUTURO
Riscaldiamoci col calore della Terra
La nostra stella, il Sole, è paragonabile a un’enorme centrale termica che ogni secondo produce calore e luce che si propagano nello spazio. Attraverso i pannelli fotovoltaici possiamo trasformare l’energia del Sole in energia elettrica: presto i pannelli tradizionali saranno sostituiti da quelli a celle tandem ottenuti accoppiando una cella tradizionale al silicio con una realizzata in perovskite, un minerale capace di assorbire una maggiore quantità di luce. Anche la Terra è una fonte di calore, come dimostrano le eruzioni vulcaniche e le acque bollenti delle sorgenti impianti geotermici possiamo sfruttare le acque calde del sottosuolo per riscaldare direttamente le nostre abitazioni o per produrre energia elettrica. Aria, acqua e suolo sono anch’essi fonti di energia termica rinnovabile.
pompe di calore permettono di prelevare l’energia termica presente all’esterno delle abitazioni e trasferirla all’interno a temperature più elevate sfruttando successivi cambiamenti di statoevaporazione, compressione, condensazionedi un fluido refrigerante. Per funzionare gli impianti richiedono una contenuta quantità di elettricità che può essere fornita dai pannelli fotovoltaici installati sul tetto delle abitazioni.


I liquidi non newtoniani
La temperatura lezione 1
LAB
STEM
UNO STRANO INCHIOSTRO
Immaginiamo di poter vedere le particelle che formano i corpi. Scopriremmo che esse non sono immobili ma in continuo movimento. Se poi potessimo guardare all’interno di due corpi formati dalla stessa sostanza, uno più caldo dell’altro, vedremmo che le particelle si muovono a velocità più elevata in quello più caldo. Scopriamo questo fenomeno con un semplice esperimento.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• due bicchieri trasparenti
• acqua
• ghiaccio
• inchiostro
• pentolino
• cucchiaino


PROCEDIMENTO





1. Versa un po’ d’acqua nel pentolino e chiedi a un adulto di metterlo a scaldare sul fornello. Poi versa l’acqua calda in uno dei bicchieri.
2. Nel frattempo metti dell’acqua nell’altro bicchiere e introduci due o tre cubetti di ghiaccio. Aspetta che il ghiaccio si sia sciolto.
3. Metti un cucchiaino di inchiostro in ciascuno dei due bicchieri.
■ OSSERVA E RISPONDI
1. Che cosa osservi?
2. La diversa temperatura dell’acqua ha qualche influenza sul fenomeno?
3. Sai giustificare quello che accade?
4. Scrivi la relazione dell’esperimento.
1 La temperatura e l’agitazione termica
Quando affermiamo che un corpo è caldo o freddo valutiamo il suo livello termico, cioè la sua temperatura
Grazie alle conoscenze sulla struttura della materia, sulle forze di coesione e sull’agitazione molecolare, è stato possibile collegare la temperatura al movimento continuo e disordinato delle molecole che compongono un corpo.
In fisica questo movimento è detto agitazione termica.
La temperatura è la grandezza che misura il grado di agitazione termica delle molecole di un corpo.
In un corpo caldo le molecole si muovono velocemente; se la temperatura diminuisce le molecole rallentano fino a immobilizzarsi 1


2 Il calore è una forma di energia

Per aumentare l’agitazione termica delle molecole, quindi innalzare la temperatura di un corpo, è necessario fornire a esso una certa quantità di energia. Il calore è una forma di energia, chiamata energia termica.
Il calore è responsabile dell’aumento dell’agitazione termica delle molecole di un corpo.
Il calore si trasferisce “spontaneamente” da un corpo a temperatura più alta a uno a temperatura più bassa. Quando i due corpi hanno raggiunto la stessa temperatura, si dice che sono in equilibrio termico
3 Relazioni fra temperatura e calore
Talvolta le parole temperatura e calore sono utilizzate come se avessero lo stesso significato. Temperatura e calore non sono la stessa cosa.
Per dimostrare questa affermazione basta fare questa prova. Metti su due fornelli identici due pentolini uguali, uno completamente pieno d’acqua e l’altro pieno solo per metà. Chiedi a un adulto di accendere i due fornelli. Dopo qualche minuto misura con un termometro per alimenti la temperatura dell’acqua nei due recipienti. Scoprirai che nel recipiente con minor quantità d’acqua la temperatura è maggiore 2 . Eppure la quantità di calore fornita è la stessa, quella della fiamma, e la sostanza che viene scaldata è identica!
Nel pentolino contenente meno acqua il calore fornito si è “distribuito” tra un minor numero di molecole, perciò queste hanno acquisito mediamente maggiore agitazione: di conseguenza la temperatura è salita di più rispetto al recipiente pieno.
Il fornello, il calorifero, il Sole sono sorgenti attive di calore: forniscono energia e non si raffreddano. Una bevanda calda e le acque bollenti termali sono sorgenti non attive di calore: forniscono energia termica ma si raffreddano pian piano.

1 Più la temperatura è elevata, più il grado di agitazione termica aumenta.
2 La quantità di calore fornita è la stessa, ma le temperature nei recipienti sono diverse.

3 Tipi di termometri.
Nel termometro clinico l’aumento della temperatura provoca la dilatazione del liquido contenuto nel bulbo. Sulla scala graduata si può leggere il valore.
4
La misura della temperatura
La temperatura è una delle sette grandezze fondamentali del SI, come la lunghezza, la massa e il tempo, e si indica con T; per misurarla si usa uno strumento, il termometro 3
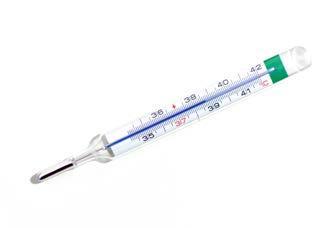
Nei termometri digitali la temperatura è rilevata da un sensore ed è riportata su un display.
Fino a qualche anno fa i termometri clinici più usati erano quelli ad alcol o a galistan, il cui funzionamento si basava sul fatto che queste sostanze, quando riscaldate, si dilatano e aumentano di volume. Oggi questo tipo di termometro clinico è stato sostituito dai termometri digitali e da quelli a infrarossi.

I termometri a infrarossi per bambini si utilizzano nella cavità auricolare o vicino alla fronte.

4 La scala centigrada.
5
Le scale termometriche
Le scale di riferimento che permettono di leggere il valore della temperatura di un corpo sono dette scale termometriche. Ne esistono diverse e generalmente prendono il nome dallo scienziato che le ha ideate.
ghiaccio fondente


acqua bollente
La scala che usiamo comunemente è detta scala centigrada o scala Celsius, dal nome dello scienziato svedese Anders Celsius (1701-1744).
Il valore 0 corrisponde alla posizione dell’alcol del capillare posto a contatto con il ghiaccio fondente; il valore 100 alla posizione dell’alcol a contatto con l’acqua in ebollizione 4
L’intervallo tra questi due valori è diviso in 100 parti uguali, ognuna delle quali corrisponde a grado Celsius o grado centigrado
Il grado centigrado (°C) è l’unità di misura della temperatura misurata con la scala centigrada.
Le scale termometriche
Nei paesi anglosassoni è in uso la scala Fahrenheit, ideata dal fisico Gabriel Fahrenheit (1686-1736).
L’unità di misura è il grado Fahrenheit (°F) e i valori di riferimento sono 32 °F (la temperatura del ghiaccio fondente) e 212 °F (la temperatura dell’acqua in ebollizione). L’intervallo tra le due temperature è suddiviso in 180 parti uguali, ognuna delle quali corrisponde a 1 °F.
Un’altra scala termometrica è la scala Kelvin, che si deve al fisico inglese William Thomson Kelvin (18241907); la sua unità di misura è il kelvin (K).
Il valore più basso (0 K) di questa scala si chiama zero assoluto e corrisponde a 273,15 °C, cioè a 273,15 °C sotto lo zero della scala centigrada 5 Gli scienziati sostengono che a questa temperatura, che è la più bassa possibile, le molecole di un corpo sono perfettamente immobili e prive di energia.
acqua bollente
ghiaccio fondente
zero assoluto

Il kelvin (K) è l’unità di misura della temperatura del Sistema Internazionale. I valori di riferimento della scala Kelvin sono 273,15 K (la temperatura del ghiaccio fondente) e 373,15 K (la temperatura dell’acqua in ebollizione).
FISSA I CONTENUTI ESSENZIALI
Sottolinea il termine corretto tra i due proposti.


5 Un confronto tra le tre principali scale termometriche.
1. La temperatura di un corpo è maggiore/minore quando le molecole si muovono lentamente.
2. Il calore/La temperatura di un corpo è una forma di energia.
3. La temperatura si misura con il termometro/barometro
4. Il grado kelvin/celsius è l’unità di misura della temperatura nel SI.
VERSO LE COMPETENZE
Le scale termometriche più usate sono la scala Celsius, la scala Kelvin e la scala Fahrenheit.
1. Riconosci quale tra le seguenti uguaglianze esprime correttamente la relazione tra la scala Celsius e la scala Kelvin.
a T (°C) = T (K) + 273,15 b T (°C) = T (K) 273,15 c T (°C) = T (K) · 273,15 d T (°C) = T (K) : 273,15
2. Completa le seguenti uguaglianze. a 30 °C = K b 315 K = °C c 0 °C = K
3. All’uscita di un aeroporto negli Stati Uniti leggi sul display le temperature massime e minime della giornata.
In quale scala termometrica sono espresse?



VISUAL della natura Il termometro


Temperatura sulla super cie del Sole
Il ferro fonde










bolle




5800 °C 6073 K























Temperatura corporea media dei mammiferi


Temperatura nel nucleo esterno della Terra


































Il legno prende fuoco
Temperatura più alta sulla Terra

L'acqua




Temperatura più bassa sulla Terra
Temperatura

































































L'acqua Temperatura sulla faccia in ombra della Luna


Lo zero assoluto è la temperatura più bassa che si possa raggiungere, sotto la quale non si può scendere. A questa temperatura le molecole sono immobili e prive di energia. Nella realtà non è mai possibile raggiungere lo zero assoluto ma si può arrivare molto vicino, come accade nell’immensità dello spazio!
Zero assoluto



Il calore lezione 2
LAB STEM
LE SOSTANZE SI SCALDANO ALLO STESSO MODO?
Perché l’acqua per il tè bolle prima del latte? Eppure hai versato le stesse quantità in due pentolini uguali e hai regolato i fornelli allo stesso modo… Trasforma questa esperienza in un vero esperimento utilizzando altre sostanze e strumenti di misura facili da trovare. Per esempio, se non hai un vero cronometro, puoi usare la funzione che hai nell’applicazione Orologio dello smartphone.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• 2 pentolini in acciaio delle stesse dimensioni
• misuratore graduato da cucina
• acqua
• olio
• cronometro
• termometro a immersione da cucina




PROCEDIMENTO



1. Usa il misuratore per prelevare 200 ml di acqua e 200 ml di olio.
2. Versa l’acqua in uno dei due pentolini e chiedi a un adulto di metterlo sul fornello acceso.
3. Fai partire il cronometro e riscalda l’acqua per 4 minuti.
4. Spegni il fornello e immergi il termometro per rilevare la temperatura.
5. Versa l’olio nell’altro pentolino e ripeti le operazioni, avendo cura che l’intensità della fiamma sia la stessa.
■
OSSERVA E RISPONDI
1. Che cosa noti mettendo a confronto le temperature che hai registrato?
2. Da che cosa può dipendere il diverso comportamento delle due sostanze?
3. Prova a ripetere l’esperimento cambiando le variabili in gioco: ad esempio raddoppiando la quantità delle due sostanze o modificando allo stesso modo l’intensità della fiamma. Riporta in una tabella i dati raccolti e mettili a confronto.
4. Scrivi la relazione dell’esperimento.
1 La misura del calore
Quando diciamo che la temperatura di un corpo è 30 °C abbiamo definito il suo livello termico, ma non sappiamo nulla sulla quantità di calore che l’oggetto ha ceduto o acquistato per arrivare a tale temperatura. Occorre quindi stabilire un’unità di misura anche per il calore. Nel SI il calore, come tutte le altre forme di energia, è misurato in joule (J). Nella pratica, però, si utilizza la caloria (cal) 1 .
La caloria è la quantità di calore necessaria per aumentare di un grado centigrado, più precisamente da 14,5 °C a 15,5 °C, la temperatura di un grammo di acqua distillata.
Un multiplo della caloria è la kilocaloria (kcal), equivalente a 1000 calorie 2
1 J = 0,24 cal
1 cal = 4,18 J

1 g di acqua
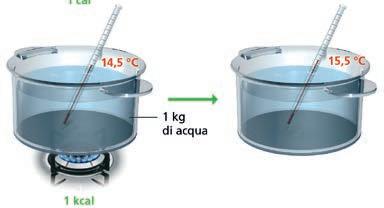
1 kg di acqua
2 La caloria e la kilocaloria a confronto.
2 Il calore specifico
Come hai potuto sperimentare nel laboratorio che apre questa lezione, le sostanze si scaldano in modo diverso. Se prima hai verificato questo comportamento con due liquidi, prova ora con acqua e sabbia.
1 Le calorie si consumano, non si bruciano. Infatti quando facciamo attività fisica, bruciamo gli zuccheri e i grassi e la caloria è la misura della quantutà di calore che si libera.
3 Fornendo la stessa quantità di calore a masse uguali di sostanze diverse, si osservano aumenti di temperatura diversi.
100 g di sabbia

100 g di acqua
sostanza calore specifico (cal/(g °C))
acqua 1
benzina 0,536
olio d’oliva 0,471
aria 0,24
granito (un tipo di roccia) 0,20
zolfo 0,175
ferro 0,107
rame 0,092
argento 0,057
1
Tab. Il calore specifico di alcune sostanze.

SCIENZA CHE
Scalda la stessa quantità di queste due sostanze su due fornelli che forniscono la stessa quantità di calore. Dopo qualche minuto misura le temperature con il termometro: osserverai che le due sostanze hanno raggiunto temperature diverse 3 . In effetti, la quantità di calore che un corpo assorbe dipende da una proprietà specifica di ciascuna sostanza, chiamata calore specifico.
Il calore specifico di una sostanza è la quantità di calore necessaria per aumentare di 1 °C la temperatura di un grammo di quella sostanza.
Il calore specifico si misura in cal/g per °C. Il calore specifico dell’acqua è 1 cal/(g °C), un valore molto elevato, più alto di tutte le altre sostanze liquide e solide 1 Tab. Questo significa che, rispetto alle altre sostanze, l’acqua si scalda lentamente e si raffredda altrettanto lentamente a parità di calore ricevuto.
3 La capacità termica
Se consideriamo un oggetto specifico, notiamo che la sua capacità di assorbire (o cedere) calore non dipende soltanto dalla sostanza di cui è composto ma anche dalla sua massa, cioè dalla quantità di materia di cui è costituito. Questa caratteristica dei corpi, che dipende sia dal tipo di sostanza sia dalla massa, è chiamata capacità termica.
La capacità termica è la quantità di calore necessaria per innalzare di 1 °C la temperatura di un corpo che ha una certa massa.
Per misurare la quantità di calore ceduta o assorbita da un corpo si usa il calorimetro. Lo strumento è formato da un contenitore metallico pieno d’acqua, nel quale sono inseriti un termometro e un contenitore più piccolo con la sostanza di cui si vuole determinare la capacità termica. Un agitatore rende uniforme la temperatura dell’acqua. Esistono diversi tipi di calorimetri, ma sostanzialmente funzionano nello stesso modo: rilevano il calore scambiato misurando la variazione di temperatura del liquido contenuto al loro interno.
Perché al mare si sta bene tutto l’anno?
È una delle conseguenze dell’elevato calore specifico dell’acqua. Durante l’estate l’acqua e il suolo assorbono il calore del Sole ma l’acqua si scalda più lentamente e rimane più fresca rispetto al suolo che, invece, si scalda più velocemente perché è costituito in prevalenza da rocce che hanno un calore specifico molto basso. Accade così che, durante l’inverno, il mare cede gradualmente il calore accumulato nei mesi estivi, innalzando la temperatura dell’aria; durante l’estate, invece, le acque più fresche rendono più sopportabili le temperature elevate della stagione.
Come funziona il calorimetro
Abbina i termini con la definizione corretta.
1 Calore
2 Caloria
3 Calore specifico
4 Capacità termica
a Quantità di calore necessaria per innalzare di un grado la temperatura di un grammo di una sostanza.
b Quantità di calore necessaria per innalzare di un grado la temperatura di un corpo che ha una certa massa.
c Forma di energia che causa la variazione dello stato di agitazione termica delle molecole di un corpo.
d Quantità di calore necessaria per innalzare di un grado la temperatura di un grammo di acqua distillata.
1: 2: 3: 4:
VERSO LE COMPETENZE
Leggi con attenzione i comportamenti da tenere per evitare gli incendi boschivi.
Non gettare mozziconi di sigaretta o fiammiferi ancora accesi
Possono incendiare l'erba secca.
Non accendere fuochi nel bosco

Usa solo le aree attrezzate. Non abbandonare mai il fuoco e prima di andare via accertati che sia completamente spento.
Se devi parcheggiare l’auto accertati che la marmitta non sia a contatto con l'erba secca
La marmitta calda potrebbe incendiare facilmente l’erba.
Non abbandonare i rifiuti nei boschi e nelle discariche abusive. Sono un pericoloso combustibile.
Non bruciare, senza le dovute misure di sicurezza, le stoppie, la paglia o altri residui agricoli. In pochi minuti potrebbe sfuggirti il controllo del fuoco.
Se avvisti delle fiamme o anche solo del fumo telefona al numero unico di emergenza 112
Non pensare che altri l'abbiano già fatto. Fornisci le indicazioni necessarie per localizzare l'incendio.
Condividi con i tuoi compagni le tue opinioni relativamente a queste indicazioni e, più in generale, al problema della difesa del patrimonio boschivo.
Dividetevi in gruppi: ciascuno scelga una delle norme elencate per analizzarla più nel dettaglio e ricerchi materiali diversi per illustrarla (fotografie, video in rete, articoli di giornale).
Mettete in comune i documenti raccolti e realizzate una presentazione sul tema della prevenzione degli incendi.
La propagazione del calore lezione 3
LAB STEM
CORRENTI
CONVETTIVE IN VISTA
Quando riscaldiamo un fluido, l’agitazione termica delle particelle aumenta e queste tendono ad allontanarsi le une dalle altre. Si determina una diminuzione di densità che è all’origine di un vero e proprio spostamento di materia: correnti di fluido caldo (meno denso) si spostano verso l’alto, mentre correnti di fluido freddo (più denso) scendono verso il basso. Puoi osservare anche tu questo fenomeno con un semplice esperimento.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• una pentola in pyrex
• acqua
• riso



PROCEDIMENTO
1. Versa dell’acqua nella pentola fino a riempirla per tre quarti.
2. Metti un cucchiaio di riso.
3. Chiedi a un adulto di mettere la pentola sul fuoco.
■ OSSERVA E RISPONDI
1. Che cosa osservi quando l’acqua diventa calda?
2. Quale fenomeno fa salire i chicchi di riso al centro del recipiente e ridiscendere ai bordi?
3. Fino a quando pensi che proseguiranno i movimenti dei chicchi di riso?
4. Pensi che questo fenomeno si verifichi solo nell’acqua?
5. Se salendo su una scala ti porti verso il soffitto in una stanza riscaldata senti più caldo. Questo fatto è dovuto alle correnti convettive?
6. Scrivi la relazione dell’esperimento.
1
Il calore si propaga
Come abbiamo già visto, il calore è una particolare forma di energia, l’energia termica Quando entrano in contatto due corpi con temperature diverse, il calore si trasferisce spontaneamente dal corpo più caldo a quello meno caldo. Il corpo più caldo cede calore e si raffredda, mentre quello meno caldo acquista calore e si riscalda.
Questo passaggio di calore continua finché i due corpi raggiungono la stessa temperatura, cioè fino a quando raggiungono l’equilibrio termico
La trasmissione del calore si chiama propagazione e avviene in modo diverso nei corpi solidi, nei liquidi e negli aeriformi; inoltre dipende dalle sostanze di cui sono costituiti. I modi in cui il calore si propaga sono tre: conduzione, convezione e irraggiamento.
2 La propagazione del calore nei solidi
Quando un solido viene posto a contatto con una sorgente di calore, le molecole che lo costituiscono intensificano il loro moto di agitazione termica e si muovono più velocemente. Esse cedono parte della loro energia alle molecole vicine, che sono a temperatura minore e, di conseguenza, si muovono più lentamente. Gli urti tra le molecole permettono il passaggio dell’energia: il calore passa dalle zone del corpo più calde a quelle vicine più fredde, con una trasmissione a catena attraverso la quale il calore si propaga in tutto il solido 1 . Questa modalità di propagazione del calore avviene per contatto diretto delle molecole e si chiama conduzione
Nei solidi, il calore si propaga per conduzione.

L’esempio appena visto descrive la conduzione quando parti diverse dello stesso corpo si trovano a temperature differenti, ma lo stesso fenomeno avviene anche quando sono a contatto un corpo più caldo e uno meno caldo.
La capacità di una sostanza di trasmettere calore si chiama conducibilità termica. Essa dipende sia dal tipo di molecole che costituiscono la sostanza sia dal modo in cui queste sono legate tra loro.
1 Le molecole della barretta di metallo vicine alla fiamma si muovono più velocemente di quelle all’estremità opposta.

Le sostanze con conducibilità termica elevata sono buoni conduttori, cioè sono sostanze in grado di trasmettere il calore rapidamente. Per esempio sono buoni conduttori tutti i metalli. Invece le sostanze che hanno una conducibilità termica bassa sono cattivi conduttori o isolanti; esse trasmettono poco calore e lo fanno lentamente. Sono cattivi conduttori il legno, la lana, il vetro, il sughero, la plastica, i liquidi e i gas in genere 2 .
3 La propagazione del calore nei liquidi e negli aeriformi
Quando un fluido (gas, vapore o liquido) si scalda, le sue molecole si allontanano le une dalle altre. Di conseguenza il fluido caldo diventa meno denso e più leggero e tende a salire verso l’alto. Al contrario, quando un fluido si raffredda, le sue molecole si avvicinano; il fluido diventa più denso e pesante e tende a scendere verso il basso. Si creano perciò spostamenti di materia che sono detti correnti convettive: più precisamente, si chiamano correnti convettive ascendenti quelle che salgono e correnti convettive discendenti quelle che scendono. Questa modalità di propagazione del calore mediante spostamento di materia, oltre che di energia, è detta convezione 3 .
Nei fluidi il calore si propaga per convezione.
2 Il metallo della pentola è un buon conduttore mentre il sughero del sottopentola è un isolante.
3 I chicchi di riso salgono e scendono trasportati dalle correnti convettive dell’acqua.

SCIENZA
COME FUNZIONA LA TERMOCAMERA DEL MIO SMARTPHONE?
Gli apparecchi per la visione notturna sono dotati di sensori infrarossi che trasformano la radiazione in arrivo in immagini. Le immagini possono essere monocromatiche (per esempio, gli oggetti più caldi appaiono più chiari), oppure riprodotte in falsi colori per rappresentare le diverse temperature. Le termografie sono mappe della temperatura di un oggetto o di un corpo: le parti che emettono più calore sono in rosso e in giallo, mentre quelle più fredde appaiono in verde e in blu.


Come si muovono le correnti convettive in una stanza?
Nel laboratorio all’inizio di questa lezione hai potuto osservare la convezione nei liquidi. La convezione negli aeriformi avviene con le stesse modalità.
L’aria contenuta in una stanza, riscaldata per esempio da un termosifone, sale verso l’alto fino ad arrivare al soffitto. Qui le molecole che costituiscono l’aria calda si scontrano con le molecole vicine più fredde e cedono a queste parte del loro calore, raffreddandosi. Di conseguenza l’aria diventa più densa e pesante e tende a ridiscendere, scorrendo lungo le pareti. Arrivata a livello del pavimento, la sorgente di calore riscalda nuovamente l’aria e il circolo ricomincia. Molecole con diversa energia termica si mescolano e si urtano in continuazione, sino a quando tutta l’aria della stanza non si è riscaldata.
4 La propagazione del calore nel vuoto
Il calore si trasmette anche senza che i corpi a diversa temperatura siano a contatto tra loro. Pensa al calore del Sole che giunge sulla Terra, sebbene lo spazio tra Sole e Terra sia praticamente vuoto, cioè privo di molecole: nel vuoto il calore non si può trasmettere né per conduzione né per convezione, perché entrambe queste modalità sono possibili solo in presenza di materia. In mancanza di materia, la trasmissione di calore avviene per mezzo di un particolare tipo di radiazione, la radiazione termica (detta anche radiazione infrarossa). Questa modalità di propagazione del calore, senza necessità di contatto o di spostamento di materia, si chiama irraggiamento
Nel vuoto il calore si propaga per irraggiamento.
La radiazione termica è invisibile all’occhio umano, ma è rilevabile sotto forma di calore.
Emettono radiazioni termiche tutti i corpi caldi: per esempio il Sole, una lampadina accesa, una stufa, un falò; anche l’uomo e in generale tutti i mammiferi.
5 La dilatazione termica
Tutte le modalità di propagazione causano un aumento dell’agitazione termica delle molecole, perciò un aumento della loro distanza e quindi del volume della sostanza. Questo fenomeno si chiama dilatazione termica e avviene nei solidi, nei liquidi e negli aeriformi.
La dilatazione termica nei solidi avviene in maniera diversa a seconda della forma del corpo e della sostanza che lo costituisce. Nei solidi in cui una dimensione prevale sulle altre due, per esempio nelle sbarre metalliche, la dilatazione avviene lungo la dimensione maggiore. Questo tipo di dilatazione è detta dilatazione lineare. L’entità
della dilatazione lineare dipende dall’aumento della temperatura, dal tipo di sostanza e dalla lunghezza del corpo. Essa è trascurabile negli oggetti che utilizziamo tutti i giorni, ma diventa importante quando la lunghezza del solido è notevole e bisogna tenerne conto quando si progettano ponti, edifici e linee ferroviarie. Tra i diversi tratti dei ponti, per esempio, sono posizionati speciali giunti metallici per lasciare piccoli spazi vuoti. Con il calore i giunti si dilatano e annullano la dilatazione lineare del ponte 4
Nei solidi nei quali nessuna dimensione prevale sulle altre, come ad esempio in un bullone, l’allungamento avviene allo stesso modo nelle tre dimensioni e il risultato è un complessivo aumento di volume. In questo caso si parla di dilatazione cubica. È possibile osservare la dilatazione termica dei solidi utilizzando l'apparecchio di Gravesande, formato da una sferetta di metallo collegata a una catenella e da un anello. A temperatura ambiente la sferetta riesce a a passare attraverso l'anello ma una volta riscaldata aumenta di volume e non riesce più ad attraversarlo fino a quando non si raffredda 5 .
4 Giunti di dilatazione di un ponte.

La dilatazione termica nei liquidi dipende dalla sostanza di cui è costituito il liquido. In genere i liquidi si dilatano più dei solidi, perché le loro molecole sono meno strettamente legate e quindi si possono allontanare con più facilità. La dilatazione, quindi, determina un aumento del volume e una diminuzione della densità del liquido. Anche gli aeriformi (gas e vapori) aumentano il loro volume quando sono scaldati: la loro dilatazione è molto più elevata rispetto ai solidi e liquidi, perché le molecole che li formano sono già libere di muoversi e di allontanarsi.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. Nei solidi il calore si propaga per contatto.
2. La conduzione avviene con spostamento di materia.
3. Il calore si può propagare nel vuoto.
4. La propagazione del calore negli aeriformi avviene per irraggiamento.
5 Esperimento sulla dilatazione cubica usando l'apparecchio di Gravesande.
I cambiamenti di stato della materia lezione 4
CONTENUTI DIGITALI
CARTA PENNA COMPUTER

I passaggi di stato
Guarda il video e scrivi le risposte sul quaderno.
1. Che cosa accade alle molecole che formano la materia quando si somministra calore e la temperatura aumenta?
2. Come si chiama il passaggio di stato da solido a liquido?
3. Che cosa accade a un solido quando sublima?
4. Che cosa provoca la solidificazione di un liquido?
5. Che cosa accade durante il processo di condensazione?
1
1 Andamento della temperatura durante la fusione e l’ebollizione dell’acqua.
temperatura (°C)
punto di ebollizione dell’acqua
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.

6. Spiega quali passaggi di stato sono rappresentati nelle due immagini.
Da uno stato all’altro
punto di fusione del ghiaccio
fusione 100 °C 0 °C ebollizione
Tutte le sostanze normalmente si trovano in uno dei tre stati fisici (solido, liquido, aeriforme), ma possono passare da uno all’altro se, mantenendo costante la pressione, la loro temperatura cambia. Come già sai, fornire o sottrarre calore a una sostanza cambia il moto di agitazione termica delle sue molecole; in questi casi la sostanza può subire una trasformazione, cioè cambiare il modo in cui si aggregano le molecole che la formano, senza che cambi la composizione chimica. Può subire, cioè, un cambiamento di stato fisico, detto anche passaggio di stato. Per esempio, l’acqua raffreddata a 0 °C da liquida diventa solida, mentre se la riscaldi fino a 100 °C da liquida diventa vapore. Durante un cambiamento di stato, la temperatura resta costante fino a che tutta la sostanza si è trasformata 1 . Il calore necessario affinché una sostanza completi un passaggio di stato è detto calore latente
la fusione inizia la fusione finisce
l’ebollizione inizia
l’ebollizione finisce
calore fornito (J)
Nei tratti orizzontali la temperatura rimane costante: il calore fornito non fa aumentare la temperatura, ma è utilizzato per allentare i legami tra le molecole e permettere i passaggi di stato.
2
Il passaggio da solido a liquido
Se lasci un cubetto di ghiaccio a temperatura ambiente ti accorgi che dopo qualche minuto comincia a fondere sino a diventare completamente liquido.
La fusione è il passaggio dallo stato solido a quello liquido.
Ogni sostanza possiede una temperatura specifica, chiamata temperatura di fusione, alla quale passa dallo stato solido a quello di liquido 1 Tab. . La temperatura di fusione è indipendente dalla quantità di sostanza.
Per passare dallo stato solido a quello liquido occorre fornire energia al corpo sotto forma di calore, che innalza la temperatura del corpo. Di conseguenza l’agitazione termica aumenta e i legami tra le molecole della sostanza si indeboliscono.
1 Tab. I punti di fusione di alcune sostanze.
3
Il passaggio da liquido a solido
Si chiama solidificazione il passaggio dallo stato liquido a quello solido.
La trasformazione dell’acqua in ghiaccio ne è un esempio. Ogni liquido possiede una sua temperatura di solidificazione che coincide con il punto di fusione. Passando allo stato solido le molecole si avvicinano sempre di più e perdono del tutto la capacità di scivolare le une sulle altre; invece le forze di coesione raggiungono il loro massimo valore. Per ottenere questo risultato è necessario abbassare la temperatura del corpo sottraendogli calore 2 Fusione e solidificazione sono passaggi di stato l’uno l’inverso dell’altro.
4 Il passaggio da liquido ad aeriforme
La vaporizzazione è il passaggio dallo stato liquido a quello aeriforme.
Si può verificare in due modi diversi: per ebollizione e per evaporazione. Se metti una pentola d’acqua sul fuoco, osservi che a mano a mano che la temperatura aumenta si formano grosse bolle che salgono in superficie e “scoppiano” liberando vapore 3 . L’ebollizione è una trasformazione rapida e tu multuosa che avviene in ogni punto del liquido. Ogni sostanza possiede una pro pria temperatura di ebollizione che non dipende dalla quantità di sostanza. Per esempio l’alcol etilico bolle a 78 °C, l’acqua a 100 °C e il mercurio a circa 357 °C. Se lasci su un ripiano un bicchiere d’acqua, dopo qualche giorno noterai una diminuzione del livello dell’acqua: parte dell’acqua è passata lentamente dallo stato liquido a quello aeriforme. L’evaporazione è una trasformazione lenta che interessa la superficie del liquido.
2 La cera liquida di una candela accesa, solidifica a temperatura ambiente una volta spenta la fiamma.

3 Le bolle che si staccano dal fondo di una pentola d’acqua in ebollizione si spostano verso l’alto grazie alle correnti convettive.

sostanza acqua alcol mercurio sodio alluminio sale da cucina rame carbonio
ACQUA CALDA
ACQUA FREDDA
4 Quando la temperatura si abbassa il vapore acqueo condensa in gocce di acqua liquida.

Le molecole di acqua che si trovano sulla superficie libera del recipiente, per effetto del calore dell’ambiente diventano vapore acqueo e si liberano nell’aria. Alcune sostanze, come l’alcol, l’etere e la benzina, evaporano rapidamente; altre invece, come gli oli e il mercurio, evaporano lentamente. L’evaporazione, inoltre, dipende dalla temperatura ambientale, dall’ampiezza della superficie libera e dalla presenza di vento. Affinché un corpo passi dallo stato liquido a quello aeriforme è necessario fornirgli calore: in questo modo aumenta l’agitazione termica delle molecole, che possono allontanarsi le une dalle altre.
5 Il passaggio da vapore a liquido
Si chiama condensazione il passaggio di una sostanza dallo stato di vapore a quello liquido.
Se metti un coperchio sopra una pentola di acqua in ebollizione, puoi notare che il vapore, a contatto con una superficie più fredda, ritorna allo stato liquido e ricopre il coperchio di goccioline 4
La temperatura di condensazione di una sostanza coincide con la sua temperatura di ebollizione.Per passare dallo stato di vapore a quello liquido è necessario abbassare la temperatura della sostanza, cioè raffreddarla. In questo modo si rallenta l’agitazione termica delle molecole e aumentano le forze di coesione tra le molecole.
6 Il passaggio da gas a liquido
Nel linguaggio di tutti i giorni spesso usiamo i termini gas e vapore come se fossero sinonimi; in realtà non sono la stessa cosa e la differenza sta proprio nella diversa modalità di passaggio allo stato liquido. Per far condensare il vapore è sufficiente ridurre la temperatura. Invece, per portare un gas allo stato liquido occorre comprimerlo, aumentando la pressione, e raffreddarlo a una certa temperatura.
La liquefazione è il passaggio di un gas allo stato liquido.
Anche l’aria può essere liquefatta: in questo modo si ricavano ossigeno e azoto liquidi, che sono molto pericolosi e devono essere conservati in robusti contenitori e maneggiati con opportune protezioni.
5 Il ghiaccio secco è utilizzato in molte preparazioni di prodotti alimentari.

7 Il passaggio da solido ad aeriforme e viceversa
Si chiama sublimazione il passaggio diretto dallo stato solido a quello di vapore.
La naftalina, la canfora, lo iodio e il cosiddetto “ghiaccio secco” usato per refrigerare i gelati (in realtà si tratta di anidride carbonica solida) sublimano a temperatura ambiente 5 .
Si chiama brinamento il passaggio diretto dallo stato di vapore a quello solido.
Durante le notti invernali può succedere che la temperatura si abbassi rapidamente sotto gli 0 °C.
Allora il vapore acqueo presente nell’aria si trasforma in minuti cristalli di ghiaccio, la brina 6
I passaggi di stato sono trasformazioni reversibili e si possono rappresentare in uno schema 7
7 I passaggi di stato della materia.
sublimazione




FISSA I CONTENUTI ESSENZIALI
6 Cristalli di brina sul margine delle foglie.

Segna con una crocetta se vero (V) o falso (F).
1. La temperatura di fusione dell’acqua è 0° C.
2. L’evaporazione è minore se la superficie libera è piccola.
3. La condensazione è il passaggio di una sostanza da liquido a solido.
4. Per liquefare un gas è necessario comprimerlo.
VERSO LE COMPETENZE STEM
Esegui l’esperimento.
Materiali
• un barattolo alto circa 20 cm con coperchio
• circa 20 cm di filo di nylon non troppo sottile
• due pesi uguali (puoi utilizzare due piombi da pesca)
• un cubetto di ghiaccio
Esecuzione
1. Lega i due pesi alle estremità del filo.
2. Metti il cubetto di ghiaccio sul coperchio del barattolo.
3. Metti il filo con i pesi sopra al cubetto facendo attenzione che sia ben centrato
Osserva e rispondi.
1. Che cosa osservi?
2. Che cosa è successo?
3. Questo fenomeno permette di praticare il pattinaggio su ghiaccio, sai spiegare perché?
CON LA SINTESI
lezione 1 LA TEMPERATURA
La temperatura è una grandezza fisica che esprime il grado di agitazione termica, cioè la velocità con cui si muovono le molecole di un corpo. Il calore è l’energia che fa muovere le molecole.
Lo strumento per misurare la temperatura è il termometro, che utilizza diverse scale termometriche
La scala Celsius (°C) o centigrada pone al valore 0 la temperatura di fusione del ghiaccio e a 100 quella di ebollizione dell’acqua.
Nella scala Fahrenheit (°F) i valori di riferimento sono 32 °F, corrispondenti alla temperatura del ghiaccio fondente, e 212 °F, corrispondenti alla temperatura dell’acqua in ebollizione.
La scala Kelvin pone lo 0 K (zero assoluto) alla temperatura di –273,15 °C.
Nel SI la temperatura si misura in kelvin (K).
lezione 2 IL CALORE
Le unità di misura del calore sono la caloria e il joule.
1 joule = 0,24 calorie
La caloria è la quantità di calore necessaria per portare da 14,5 a 15,5 °C la temperatura di 1 grammo di acqua distillata.
Le sostanze si scaldano in maniera differente. Il calore specifico di una sostanza è la quantità di calore necessaria per aumentare di 1 grado la temperatura di un grammo di quella sostanza. La capacità di un corpo di assorbire o di cedere calore non dipende solo dalla sostanza di cui è composto, ma anche dalla sua massa.
La capacità termica è la quantità di calore necessaria per aumentare di 1 °C la temperatura di un corpo che ha una certa massa.
lezione 3 LA PROPAGAZIONE DEL CALORE

Il calore si trasferisce spontaneamente da un corpo più caldo a uno meno caldo. Il passaggio di calore prosegue fino all’equilibrio termico,

cioè fino a quando i corpi non raggiungono la stessa temperatura. Nei solidi il calore si propaga per conduzione, mediante urti tra le molecole.
I metalli sono buoni conduttori di calore, mentre sostanze come il vetro, la lana, il legno e i gas in generale sono cattivi conduttori.
Nei fluidi il calore si propaga per convezione. Si formano correnti convettive calde ascendenti e correnti convettive fredde discendenti. Il calore può propagarsi anche senza che i corpi a diversa temperatura entrino in contatto. Nel vuoto, in mancanza di materia, il calore si propaga per irraggiamento, per mezzo della radiazione termica, detta anche radiazione infrarossa. Fornire calore a un corpo fa aumentare l’agitazione termica delle sue molecole, determinando una dilatazione termica, cioè un aumento del volume del corpo.
Nei solidi la dilatazione è determinata dalla forma e dalla sostanza che li costituisce: è lineare, se avviene lungo la dimensione maggiore, oppure cubica se avviene nelle tre dimensioni. La dilatazione dei fluidi è maggiore che nei solidi e dipende anche dalla sostanza di cui sono composti.
lezione 4 I CAMBIAMENTI DI STATO DELLA MATERIA
I corpi possono cambiare stato di aggregazione se viene loro fornito o sottratto calore.
Il passaggio da solido a liquido si chiama fusione
Il passaggio inverso, da liquido a solido, prende il nome di solidificazione.
Il passaggio da liquido ad aeriforme si chiama vaporizzazione. Si definisce ebollizione il passaggio dallo stato liquido allo stato di vapore che avviene in modo rapido e interessa tutta la massa del liquido; si definisce evaporazione se lo stesso passaggio di stato avviene lentamente, interessando solo la superficie del liquido. Il passaggio di stato da vapore a liquido si chiama condensazione. Un gas passa allo stato liquido mediante liquefazione. Il passaggio di stato richiede che, oltre ad abbassare la temperatura, sia aumentata anche la pressione nel recipiente che contiene il gas. Il passaggio diretto da solido ad aeriforme si chiama sublimazione, quello inverso si chiama brinamento.


CON LA MAPPA
Adesso che hai ripassato i contenuti essenziali con la sintesi, prova a completare la mappa con le parole chiave suggerite e a trovare le definizioni corrispondenti. brinamento - condensazione - conduzione - convezione - energia - fusione - temperatura
se viene sottratto o fornito a un
determina i
si trasmette per è una forma di mentre la

6. passaggi di stato
che sono, per esempio
che è il passaggio da solido a liquido


è la grandezza che misura l’agitazione termica delle molecole
10. vaporizzazione
che è il passaggio da liquido a vapore
Inserisci accanto a ogni definizione il numero che corrisponde alla parola chiave usata nella mappa.
a. Cambiamenti di stato fisico della materia.
b. Modalità di propagazione del calore nel vuoto.
c. Passaggio di stato che avviene quando il ghiaccio diventa acqua liquida.
d. Il kelvin è la sua unità di misura nel Sistema Internazionale.
1. IL CALORE
3. irraggiamento 11.
5. corpo

Test interattivi
lezione 1 LA TEMPERATURA
1 Segna con una crocetta se vero (V) o falso (F).
a. La temperatura si misura con il dinamometro.
b. La scala Celsius è una scala termometrica.
c. Due corpi in equilibrio termico hanno la stessa temperatura.
d. Il calore è una forma di energia.
2 Sottolinea il termine corretto tra i due proposti.
a. La temperatura/Il calore indica il livello termico di un corpo.
b. Lo zero della scala centigrada coincide/ non coincide con quello della scala Fahrenheit.
c. Il Sole è una sorgente attiva/non attiva di calore.
d. Il valore 100 della scala centigrada corrisponde alla temperatura di fusione del ghiaccio/di ebollizione dell’acqua.
3 Osserva il disegno delle scale termometriche e inserisci nelle caselle il numero corrispondente alle temperature.
lezione 2 IL CALORE
4 Scegli la soluzione corretta.
a. Il calore specifico di una sostanza è:
1 la quantità di calore posseduta dalla sostanza.
2 la quantità di calore necessaria per riscaldare 1 g di quella sostanza.
3 la quantità di calore necessaria per innalzare di 1 °C la temperatura di 1 g di quella sostanza.
4 la quantità di calore necessaria per innalzare di 1 °C la temperatura del corpo.
b. La capacità termica di un corpo:
1 dipende dalla sua temperatura.
2 dipende dalla fonte di calore.
3 è una proprietà specifica della sostanza che lo forma.
4 dipende sia dalla sostanza sia dalla sua massa.
5 Se fornisci la stessa quantità di calore a 1 kg delle sostanze indicate esse raggiungono temperature diverse.
a. Da che cosa dipende questo comportamento?
K
K
K zero assoluto ghiaccio fondente acqua in ebollizione
K zero assoluto ghiaccio fondente acqua in ebollizione
K zero assoluto ghiaccio fondente acqua in ebollizione
K zero assoluto ghiaccio fondente acqua in ebollizione
b. Metti in ordine crescente le sostanze secondo le temperature che raggiungono.
1 Aria
2 Acqua
3 Granito
4 Rame
6 Completa il brano con i termini corretti. Le regioni affacciate sul mare o su un grande lago godono di un clima mite poiché l’acqua ha un calore specifico. Le rocce che formano il suolo hanno, invece, un calore specifico e per questo si riscaldano e si raffreddano più delle acque.
lezione 3 LA PROPAGAZIONE DEL CALORE
7 Segna con una crocetta se vero (V) o falso (F).
a. Nei liquidi il calore si propaga per conduzione.
b. La lana è un isolante.
c. Un corpo che si raffredda cede calore.
d. Le correnti convettive ascendenti sono fredde.
8 Scegli la soluzione corretta.
a. La propagazione del calore negli aeriformi avviene soprattutto per:
1 conduzione.
2 convezione.
3 irraggiamento.
4 diffusione.
b. Durante l’estate i binari del treno si allungano per:
1 conduzione.
2 dilatazione.
3 irraggiamento.
4 convezione.
c. Una sfera di rame alla temperatura di 70 °C è messa in contatto con una barra di ferro che ha una temperatura di 40 °C. Il calore:
1 passa dalla sfera alla barra.
2 passa dalla sfera alla barra e viceversa.
3 passa dalla barra alla sfera.
4 non passa e non viene ceduto.
9 Completa il brano con i termini corretti.
Quando una sostanza passa dallo stato a quello solido si verifica un aumento di densità e una diminuzione del . La sostanza che fa eccezione è che riduce la sua quando diventa ghiaccio. Questo spiega perché gli iceberg galleggiano. Il motivo di questo comportamento è legato alla disposizione a “nido d’ape” delle molecole che intrappolano negli spazi vuoti molecole di rendendo la struttura dell’ solida meno densa.
lezione 4 I PASSAGGI DI STATO DELLA MATERIA
10 Abbina i termini con la definizione corretta.
1. Fusione
2. Brinamento
3. Condensazione
4. Vaporizzazione
a Passaggio di stato da liquido ad aeriforme.
b Passaggio di stato da aeriforme a liquido.
c Passaggio di stato da aeriforme a solido.
d Passaggio di stato da solido a liquido.
1. 2. 3. 4.
11 Osserva le fotografie e inserisci il numero corrispondente al passaggio di stato avvenuto.
1. Brinamento
2. Vaporizzazione


3. Solidificazione
4. Fusione


12 Osserva i grafici e rispondi alla domanda.
Se togli dal freezer un ghiacciolo e lo metti al Sole, quale dei seguenti grafici mette in relazione correttamente la variazione della temperatura del ghiacciolo al passare del tempo?
APPLICARE CONOSCENZE
1 Completa le seguenti uguaglianze.
a. 30 °C = K
b. 315 K = °C
c. 0 °C = K
RISOLVERE PROBLEMI
2 Un filo di ferro lungo 150 m si trova alla temperatura di 59 ˚C.
a. Sapendo che la sua massa è circa 3,6 kg e che il calore specifico del ferro è 0,11 cal/g, calcola quante calorie sono necessarie per innalzare la sua temperatura di 2,5 °C.
b. A causa della dilatazione termica il filo di ferro si allunga di 0,012 mm per ogni grado centigrado di aumento della temperatura. Quanto misura una volta raggiunta la temperatura finale?
3 Osserva l’immagine e rispondi alle domande.

a. Perché l’acqua e la sabbia raggiungono temperature differenti?
b. Che cosa succede se sostituisco la sabbia con l’acqua?
c. Che cosa cambia se metto nei contenitori quantità doppie di sabbia e acqua?
RIFLETTERE E TRARRE CONCLUSIONI
4 Quando una sostanza passa dallo stato liquido a quello aeriforme:
a cede calore, quindi la sua massa diminuisce.
b diminuiscono in modo evidente il suo volume e il suo contenuto energetico.
c assorbe calore, quindi aumenta la sua massa.
d aumenta notevolmente il suo volume e il suo contenuto energetico.
INTERPRETARE FENOMENI
5 Osserva la sequenza di disegni che mostra l’esperimento con l’anello di Gravesande e rispondi alle domande.
2 3 1
a. Che cosa succede alla sfera quando viene riscaldata?
b. Dopo che si è riscaldata la sfera passa ancora attraverso l’anello?
c. Quale tipo di processo è avvenuto?
d. Che cosa succede se lasciamo raffreddare la sfera?

Syms Covington IL BLOG di STORYTELLING RIFLETTI RACCONTA PENSA
La partenza di Darwin
27 dicembre 1831, Devonport, Plymounth
Mi chiamo Simon Covington, ma tutti mi chiamano Syms. Sono il nuovo mozzo a bordo della nave di sua maestà Beagle, un bellissimo brigantino ancorato a Devonport, una sezione del porto di Plymouth. Oggi salpiamo per un lungo viaggio nei mari del Sud. Io sono entusiasta perché è la prima volta che faccio un viaggio così lungo. A bordo c'è anche un giovane scienziato, il signor Charles Darwin. Durante il viaggio avrà il compito di osservare gli animali, le piante, le rocce e la natura intorno a noi. Lui scriverà un diario e io scriverò il mio blog. Non è interessante? Il Capitano FitzRoy mi ha promosso assistente del signor Darwin! Quando non lo devo aiutare, però, posso suonare il mio violino: io amo la musica!
Diario di viaggio
Darwin Darwin di

Mi chiamo Charles Darwin, ho 22 anni e sono nato a Shrewsbury, nel cuore dell'Inghilterra, il 12 febbraio 1809. Mio padre, Robert Waring Darwin, è un medico molto famoso, mia madre, Susannah Wedgwood, nata in una famiglia di vasai, purtroppo è morta nel 1817, quando avevo solo 8 anni. Ho iniziato a studiare Medicina all'Università, ma ben presto ho smesso per passare allo studio della Teologia. La mia vera passione, però, è la Storia Naturale! Amo la geologia, la botanica e la zoologia e colleziono rocce, minerali, piante e insetti, soprattutto coleotteri. Per questo sono stato nominato esperto scientifico a bordo di un'importante nave su sua Maestà, il Beagle, un brigantino da 10 cannoni al comando del Capitano FitzRoy. Fino ad oggi la nostra nave non è riuscita a salpare a causa di un forte vento da sud-ovest. L'obiettivo della nostra spedizione è studiare vaste aree del Sud America e disegnare mappe della Patagonia e della Terra del Fuoco, ma anche delle coste del Cile, del Perù e di alcune isole del Pacifico. Inoltre dovrò effettuare osservazioni, raccogliere dati ed effettuare esperimenti su processi che avvengono in natura.
ORA RACCONTA TU!
a. Immagina di essere nei panni di Syms: come ti sentiresti? Prova a descrivere le tue emozioni prima della partenza.
b. Confronta lo stato d’animo e il carattere di Syms e di Darwin: noti delle differenze?
c. Darwin è un appassionato di geologia, botanica e zoologia: sai che cosa studiano queste discipline scientifiche? Se non lo sai puoi eseguire una ricerca in rete.
d. Quale metodo utilizzò Darwin per studiare i fenomeni naturali?
e. Ricerca in rete informazioni ed immagini relative al brigantino Beagle. Perché si chiamava così?
DIGITAL SKILLS
Utilizza l’app di Google Earth per localizzare tutti i luoghi citati nel blog e nel diario di Darwin: il porto di partenza della nave Beagle, il luogo di nascita di Darwin, i paesi che saranno raggiunti durante il viaggio.
Intelligenza Artificiale IA
Con l'aiuto del tuo insegnante utilizza un chatbot di intelligenza artificiale per trovare in rete film e documentari dedicati al viaggio di Darwin. Insieme ai tuoi compagni, e con l’aiuto del tuo insegnante, sceglietene uno e, dopo averlo visto insieme, realizzate una scheda film, seguendo le indicazioni fornitedal chatbot.
La Terra si riscalda

Immagina la Terra come una grande casa e l’atmosfe ra come una coperta che la avvolge. Questa coperta è molto importante perché mantiene la temperatura del pianeta adatta alla vita, in un equilibrio perfetto che rende la Terra confortevole per tutti noi. Il Global Warming, o Riscaldamento Globale, è un fenomeno iniziato alla fine del XIX secolo, quando lo sviluppo delle attività industriali ha determinato la combustione di grandi quantità di combustibili fossili (carbone, petrolio e gas) e il rilascio di enormi quantitativi di anidride carbonica, vapore acqueo, metano e altri gas. Sono proprio questi gas, detti ”gas serra”, i responsabili del progressivo riscaldamento dell’atmosfera terrestre che provoca effetti sul clima terrestre. Il percorso qui proposto esamina alcune conseguenze dell’aumento della temperatura, in particolare l’innalzamento del livello del mare in una città italiana di enorme importanza sotto molteplici aspetti, Venezia.
PREREQUISITI

RACCORDI interdisciplinari
Proponiamo alcuni approfondimenti che possono essere affrontati nel percorso interdisciplinare, ma la mappa suggerisce molti altri argomenti che possono essere sviluppati per integrare lo stesso percorso.
SCIENZE: calore e temperatura, effetti dell’aumento della temperatura terrestre.
GEOGRAFIA: le zone umide (classificazione, localizzazione geografica), la laguna di Venezia.
TECNOLOGIA: come difendere le zone umide dall’innalzamento dei mari, il MOSE e il suo funzionamento.
STORIA: le Repubbliche marinare: Venezia, Genova, Pisa, Amalfi.
ITALIANO: Il Milione di Marco Polo, come un veneziano ha fatto conoscere l’Oriente in Europa.
LO SBILANCOENERGETICO
DEL SISTEMA TERRA
LE ZONE UMIDE E LA LORO IMPORTANZA ECOLOGICA
VENEZIA E LA SUA LAGUNA
Conoscere la differenza tra calore e temperatura. Saper definire e distinguere calore specifico e capacità termica, con riferimento all’acqua. Conoscere i cambiamenti di stato della materia.
RISULTATI ATTESI
Comprensione del legame esistente tra variazioni della temperatura e l’innalzamento dei mari.
Capacità di riconoscere cause e conseguenze del cambiamento climatico
Conoscenza di alcuni interventi messi in atto per ridurre gli effetti del cambiamento climatico.
L'OLANDA COLTIVA
TERRE STRAPPATE
DAL MARE
IL MOSE
LE REPUBBLICHE MARINARE
SCIENZE
Lo sbilancio energetico del sistema Terra
Sandro Carniel è un oceanografo, climatologo e divulgatore scientifico italiano; dal 2024 è stato ammesso come International Fellow nel The Explorers Club.
TECNOLOGIA
Il MOSE
Mettendo in fila e ricombinando tutti i dati relativi alla temperatura oggi disponibili, raccolti in mare da scienziati di tutto il mondo, il risultato è sempre e comunque lo stesso: gli oceani si stanno scaldando, e in modo sempre più veloce. Il 90% dello sbilancio energetico della Terra nel sistema climatico (cioè la differenza tra quanta energia entra e quanta esce) viene trattenuto dagli oceani, e solo il rimanente 10% se ne va per riscaldare terra, atmosfera e fondere i ghiacci. Quindi il contenuto di calore degli oceani è, di fatto, il migliore indicatore di cambiamento climatico che abbiamo a disposizione, e la sua misura è il miglior modo per poter dire qualche cosa su come e quanto la Terra si stia riscaldando. Sono serviti molti anni per poter dire oggi con certezza che il riscaldamento del pianeta è collegato alle emissioni di gas serra derivanti dalle attività umane. Ora sappiamo che l'aumento di temperatura sta producendo una serie di effetti quali aumento di tempeste ed eventi meteorologici particolarmente intensi, innalzamento del livello del mare, diminuzione della capacità di assorbire CO2, tropicalizzazione di alcuni mari.

Tratto da “Oceani - il futuro scritto nell’acqua” di Sandro Carniel
DOMANDE GUIDA
a. A quale conclusione sono arrivati gli scienziati raccogliendo dati sulle temperature degli oceani?
b. Perché anidride carbonica, metano e vapore acqueo sono chiamati “gas serra”? Formula una tua ipotesi.
c. Quale caratteristica fisica permette agli oceani di assorbire il calore in eccesso all’interno del sistema Terra?
Intelligenza Artificiale IA
Chiedi a un chatbot di intelligenza artificiale di fornirti una spiegazione con parole semplici del fenomeno dello “sbilancio energetico” riferita al clima terrestre.
Uno degli effetti più evidenti del riscaldamento globale è la fu sione delle calotte polari, che ha come conseguenza l’innalzamento del livello dei mari. La laguna di Ve nezia, con la sua particolare conformazione, risente di picchi di alta marea che, in seguito alle recenti diverse situazioni climatiche, sono diventati sempre più alti. Per cercare di evitare che la città sprofondi sommersa dalle acque è stato progettato e costruito il MOSE, un sistema di barriere mobili che blocca le aperture della laguna verso il mare aperto, impedendo all’acqua di sommergere interi quartieri e in particolare piazza San Marco. Si tratta complessivamente di 78 paratoie indipendenti, incernierate su un lato al fondale e movimentate mediante immissione ed espulsione di aria o acqua. Immettendo aria, la paratia diventa leggera e si alza al di sopra del livello dell’acqua; passato il pericolo si introduce acqua in modo che la struttura affondi. La lunghezza complessiva delle paratoie è di 1,56 km (pari alla lunghezza di ben 15 campi da calcio) in grado di separare temporaneamente la laguna dal mare e difendere Venezia sia dagli eventi di marea eccezionali che da quelli più frequenti. Le barriere sono collocate alle bocche di porto di Lido (divisa in due barriere di 21 e 20 paratoie), Malamocco (19 paratoie) e Chioggia (18 paratoie). Il Mose può proteggere Venezia e la laguna da maree alte fino a 3 metri e da un innalzamento del livello del mare fino a 60 centimetri nei prossimi 100 anni.
Tratto da https://mosevenezia.eu › progetto
DIGITAL SKILLS PER APPROFONDIRE
Esistono alcune ipotesi realistiche sull’innalzamento del livello dei mari in un futuro ormai prossimo. Ricerca in rete notizie riguardo a questi studi ed esprimi le tue considerazioni sulla situazione prevista per l’Italia.
DOMANDE GUIDA
a. Osserva l’immagine che mostra il funzionamento delle paratoie del MOSE e descrivi con le tue parole il cambio di situazione quando si alzano le paratoie.
b. Sai spiegare perché negli ultimi decenni i picchi di alta marea sono diventati sempre più alti? Che relazione c’è tra questo fenomeno e il Global warming?
MATERIA TEMA
La chimica intorno a noi
“Non bere quella bibita, contiene additivi chimici che fanno male!” “Questa crema fa bene alla pelle, non contiene sostanze chimiche ma solo sostanze naturali!”
A che cosa pensi quando si dice che qualcosa è “chimico”?
La maggior parte delle persone dà a questo termine un significato negativo, attribuendolo a qualcosa che è dannoso per la nostra salute e per l’ambiente. È stato addirittura coniato un nuovo termine, chemofobia, per definire l’avversione irrazionale o il pregiudizio nei confronti della chimica e di tutto ciò che si definisce chimico.
2

In realtà, tutto quello che ci circonda è chimico, tutto quello che fa la natura è chimico, ma è anche vero che la produzione e l’uso improprio o incontrollato di certe sostanze artificiali – pensiamo per esempio agli insetticidi che sono cancerogeni o a diserbanti e antiparassitari che danneggiano interi ecosistemi –hanno creato gravi danni ambientali e alcune volte causato vere e proprie tragedie. Ma anche nella soluzione di questi problemi la chimica ha un ruolo di primaria importanza: mettendo in campo e integrando tra loro tutte le conoscenze che i diversi settori della disciplina hanno accumulato nei secoli, la chimica inorganica, la chimica analitica, la chimica fisica, la chimica organica oggi stanno contribuendo allo sviluppo di una chimica sostenibile al servizio degli esseri umani e dell’ambiente.


della materia La chimica unità 4 chimici I composti unità 5


SIMONE SALGAROLLO, cleaningvalidationspecialist
Simone si è diplomato in chimica e, dopo anni di lavoro in laboratorio per il controllo della qualità dei farmaci, da qualche tempo lavora in un’azienda farmaceutica come cleaning validation specialist, cioè si occupa del controllo dei processi di produzione dei farmaci per garantire che i medicinali siano privi di contaminazioni e quindi sicuri per chi li assume.


STEFANIA TOSTO, insegnantediScienze


Sin da piccola, Stefania è stata affascinata dalla bellezza della natura. Dopo la laurea in Scienze geologiche, ha fatto la guida presso il Parco Naturalistico Monte Serra di Viagrande, ha conseguito un master sulla salvaguardia dei beni culturali e ambientali e oggi lavora come docente di Scienze in un istituto superiore. Stefania crede che la chimica abbia un ruolo importante nell’insegnamento delle discipline scientifiche, perché aiuta a comprendere fenomeni che interessano l’intero sistema Terra.
MARCO PIACENTINI, strategy manager
Dopo il liceo scientifico Marco si è laureato in Ingegneria Nucleare e ha lavorato a lungo nel settore dell’energia. Oggi è strategy manager semiconductor service nel mercato dei semiconduttori, dove sviluppa la produzione dei chip, i circuiti integrati miniaturizzati, costituiti in gran parte da semiconduttori. I chip hanno un impiego vastissimo, dal settore automobilistico, alla medicina, alle comunicazioni, allo sviluppo dell’Intelligenza Artificiale, cercando di conciliare l’innovazione tecnologica con la sostenibilità.

Dmitrij Mendeleev
PARLA LA SCIENZA
della materia La chimica unità
lezione 1
L’atomo e la sua struttura
lezione 2
la tavola periodica degli elementi

lezione 3
I legami chimici
lezione 4
Le reazioni chimiche

dei prodotti di rifiuto 1
I 12 PRINCIPI DELLA GREEN CHEMISTRY
2
tossicità dei materiali usati 3
Minima
BUONE NOTIZIE PER IL FUTURO
Green chemistry, la chimica che ha cura della salute dell ’ambiente
La chimica ha un enorme potere di trasformazione della natura. I prodotti delle reazioni chimiche possono migliorare di molto le nostre condizioni di vita, come i farmaci che curano molte malattie, ma possono anche causare gravi danni all’ambiente se pensiamo, per esempio, alle sostanze di scarto delle lavorazioni industriali che, se vengono liberate nell’ambiente, sono tossiche per tutti gli esseri viventi. Negli anni Novanta del secolo scorso, due chimici americani, John C. Warner e Paul Anastas, hanno proposto un nuovo modo di concepire la chimica, basandola su criteri di ecosostenibilità: è nata così la Green chemistry Non si tratta di un nuovo settore della chimica che si occupa di ambiente (di questo si occupa la chimica ambientale), ma di una lista di 12 principi, a cui ogni chimico dovrebbe far riferimento nel suo lavoro quotidiano, tra i quali la prevenzione, l’efficienza energetica e l’utilizzo di materie prime rinnovabili. Sono principi scritti da scienziati convinti del ruolo irrinunciabile della chimica nella nostra civiltà, ma nello stesso tempo consapevoli degli effetti dannosi che le sue applicazioni avventate, superficiali o scorrette possono provocare sull’ambiente, sulla salute dell’uomo e di tutti gli organismi.


L’atomo e la sua struttura lezione 1
CARTA PENNA COMPUTER

La teoria atomica
Guarda il video e scrivi le risposte sul quaderno.
1. Quali sono stati i filosofi greci che per primi hanno introdotto il termine “atomo”?
2. Come immaginava che fosse composta la materia il filosofo Aristotele?
3. Quali sono i punti più importanti della teoria atomica di John Dalton?
4. Qual è stato il contributo di Albert Einstein alla teoria atomica della materia?
5. Quali erano le caratteristiche del modello atomico proposto da Niels Bohr?

1 Un esempio di trasformazione fisica.
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.

6. Commenta l’immagine e spiega con le tue parole che cosa pensano oggi i fisici della struttura della materia.
Le sostanze si possono trasformare
Durante i cambiamenti di stato la sostanza coinvolta subisce una trasformazione fisima non cambia la sua composizione chimica. Il ghiaccio che fonde quando viene tolto dal congelatore oppure l’acqua che, messa nel freezer, diventa ghiaccio sono costituiti della stessa sostanza: l’acqua.
trasformazioni fisiche sono reversibili ed è sempre possibile passare da uno stato all’altro della materia senza che cambi la sua struttura interna 1 .
Che cosa hai pensato, invece, guardando la legna che brucia nel camino? Forse che la materia coinvolta nella combustione sparisca: del resto rimane solo cenere! Quello che hai ottenuto alla fine di un processo di questo tipo è completamente diverso da ciò che avevi in partenza. I fumi che si liberano e le ceneri che ritrovi alla fine della combustione hanno composizione differente da quella della legna. Hai assistito a una trasformazione chimica
trasformazioni chimiche sono processi irreversibili e comportano dei cambiamenti della struttura interna della materia.
La chimica è la scienza che studia la composizione, la struttura e le trasformazioni delle sostanze. I chimici distinguono le sostanze in due categorie: gli elementi e i composti.
Un elemento, o sostanza semplice, è una sostanza che non può essere scomposta in altre sostanze più semplici.
Un composto è una sostanza che si può scomporre in elementi, cioè in sostanze semplici.
2 La struttura dell’atomo
L’atomo è la particella più piccola che compone la materia e per molti secoli gli scienziati hanno ritenuto che fosse indivisibile. Le scoperte della fisica e della chimica dai primi anni del Novecento fino ai giorni nostri hanno stabilito che in realtà l’atomo è costituito da particelle ancora più piccole, le particelle subatomiche: protoni, neutroni ed elettroni.
• I protoni sono particelle dotate di carica elettrica positiva (+);
• i neutroni sono particelle prive di carica elettrica;
• gli elettroni sono particelle dotate di carica elettrica negativa (–).
I protoni e i neutroni hanno massa quasi identica e sono posizionati nel nucleo dell’atomo, che è la parte centrale. Intorno al nucleo si muovono velocemente gli elettroni, particelle di massa molto più piccola dei protoni e dei neutroni 2 . Dal punto di vista elettrico, il nucleo è carico positivamente per la presenza dei protoni.
In condizioni normali il numero degli elettroni coincide con quello dei protoni: le cariche elettriche (positive e negative) si compensano tra loro e l’atomo è elettricamente neutro.
Gli elettroni di un atomo non ruotano tutti alla stessa distanza dal nucleo ma si muovono all’interno di strati via via più grandi, i gusci elettronici. Ogni guscio è caratterizzato da un valore energetico ben preciso che ne definisce il livello energetico. Gli elettroni che occupano un certo guscio elettronico hanno tutti lo stesso contenuto energetico. Nei diversi atomi gli elettroni occupano di preferenza i gusci elettronici più vicini al nucleo e solo quando un guscio è completo iniziano a occupare il guscio successivo. I gusci sono in tutto 7: il primo guscio contiene al massimo 2 elettroni, tutti gli altri al massimo 8 3


2 Le particelle subatomiche di un atomo.


elettrone neutrone protone

3 La disposizione degli elettroni nei primi tre gusci elettronici.



Recentemente si è scoperto che protoni e neutroni si possono suddividere in particelle ancora più piccole, chiamate particelle elementari
Una particella elementare è una particella subatomica indivisibile che non è formata da particelle più semplici. Un tipo di particelle elementari sono i quark: in natura i quark si originano da collisioni ad alta energia, come quelle che si verificano nei raggi cosmici.
Si ritiene che i quark fossero presenti immediatamente dopo il Big Bang, l’esplosione primordiale dalla quale si sarebbe formato l’Universo.


















1° guscio (2 elettroni)
2° guscio (8 elettroni)
nucleo
3° guscio (8 elettroni)
Gli isotopi dell’idrogeno si differenziano per il numero di neutroni contenuti nel nucleo.



3 Come si identificano gli atomi
Qualunque sia l’atomo, le particelle che lo compongono sono sempre le stesse: protoni, neutroni ed elettroni. Che cosa distingue allora un atomo da tutti gli altri?
Ciò che caratterizza un atomo e determina le sue proprietà chimiche è il numero dei protoni contenuti nel nucleo. Ogni atomo infatti ha un numero particolare di protoni che lo identifica: il numero atomico, che si indica con la lettera Z.

+ n elettrone neutrone protone H 1 1 –
prozio
+ n elettrone neutrone protone
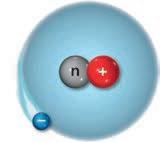


Il numero atomico è il numero dei protoni presenti in un atomo.
In un atomo neutro, in cui il numero di protoni coincide con il numero di elettroni, il numero atomico indica anche il numero di elettroni. Ad esempio, il ferro ha numero atomico 26: questo significa che l’atomo di ferro contiene 26 protoni (e 26 elettroni); il cobalto, che ha numero atomico 27, contiene un protone (e un elettrone) in più del ferro. Per identificare in modo completo un atomo occorre conoscere anche il numero di neutroni (indicato con la lettera N).
Il numero di massa è la somma del numero di protoni e neutroni di un atomo.


Il numero di massa si indica con la lettera A. Quindi A = N + Z. Il cloro, ad esempio, ha numero di massa uguale a 35 perché nel suo nucleo si trovano 17 protoni e 18 neutroni. Il carbonio ha numero di massa uguale a 12 poiché il suo nucleo contiene 6 neutroni e 6 protoni. Questi due numeri si scrivono a sinistra del simbolo dell’elemento: il numero atomico in basso e il numero di massa in alto.
+ n elettrone neutrone protone
2H 1 –deuterio


+ n elettrone neutrone protone
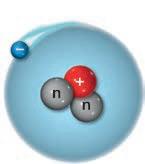



4
numero di massa numero atomico
Gli isotopi
simbolo chimico dell’elemento A
ìMentre il numero di protoni nell’atomo di uno stesso elemento è sempre uguale, il numero di neutroni può variare.
Atomi di uno stesso elemento con lo stesso numero di protoni e diverso numero di neutroni sono detti isotopi


Gli isotopi hanno lo stesso comportamento chimico dell’elemento, ma proprietà fisiche diverse. Per esempio l’idrogeno, elemento con numero atomico Z = 1, è presente in natura con tre isotopi 4 :
• il prozio, che non ha neutroni e costituisce quasi tutto l’idrogeno esistente, ha numero di massa A = 1;
+ n elettrone neutrone protone
3H 1 –trizio
+ n elettrone neutrone protone
• il deuterio, che ha un neutrone ed è un potenziale carburante per i reattori nucleari, ha numero di massa A = 2;
• il trizio, con due neutroni, utilizzato nel campo della diagnostica medica, ha numero di massa A = 3.
Anche il carbonio (elemento con Z = 6) ha tre isotopi, con numeri di massa rispettivamente 12, 13 e 14. Quest’ultimo è prodotto naturalmente negli strati alti dell’atmosfera e
ricade sul terreno, penetrando nei tessuti animali e vegetali. Si trasforma in azoto secondo uno schema preciso e per questo motivo viene usato per datare reperti antichi. Per indicare l’isotopo di un elemento ci sono due modalità:
• si scrive il simbolo dell’elemento con il numero di massa a sinistra in alto e il numero atomico a sinistra in basso; per esempio, il carbonio con A = 12 si indica scrivendo 126C;
• si scrive il simbolo dell’elemento seguito dal numero di massa, separato da un trattino; quindi l’esempio di prima diventa C-12.
5 Come si determina il peso di un atomo: la massa atomica
I protoni, i neutroni e gli elettroni possiedono tutti una massa, anche se molto piccola. La massa degli elettroni è 1840 volte più piccola rispetto a quella di un protone, di conseguenza gli elettroni sono trascurabili nel calcolo della massa atomica. Essa è perciò concentrata quasi esclusivamente nel nucleo, dove sono presenti protoni e neutroni. Poiché i valori sono molto bassi, l’espressione in kilogrammi delle masse atomiche è poco pratica. I chimici preferiscono confrontare la massa di un atomo con la massa atomica di un altro atomo assunto come riferimento. L’atomo che è stato scelto come campione è il carbonio-12, con 6 protoni e 6 neutroni, e ha per definizione massa atomica 12.
L’unità di massa atomica, u.m.a., è definita come la dodicesima parte della massa di un atomo di carbonio.
VERSO LE COMPETENZE
Come si fa a sapere quanti anni ha una mummia?
Per determinare l’età di una mummia, gli archeologi e gli scienziati utilizzano principalmente il metodo della datazione al radiocarbonio (Carbonio-14). Il carbonio 14, un isotopo del carbonio, entra a far parte degli organismi con la respirazione e l’alimentazione e rimane pressoché stabile finché l’organismo è in vita. Quando un essere vivente muore la quantità dell’isotopo diminuisce in modo regolare, fino a diventare la metà dopo 5730 anni. Confrontando la quantità di carbonio 14 contenuta nel reperto con quella di un vivente al momento del rilevamento si può stabilire quanti dimezzamenti si sono verificati e calcolare la data in cui il l’essere umano era in vita.

Esegui questo esperimento per confrontare una trasformazione fisica e una trasformazione chimica. Materiali
• zucchero • acqua • bicchiere • pentolino • cucchiaino
Esecuzione





1. Versa l’acqua nel bicchiere, aggiungi due cucchiaini di zucchero e mescola.
2. Metti due cucchiaini di zucchero nel pentolino, chiedi a un adulto di appoggiarlo sul fornello acceso e mescola per un po’, finché lo zucchero si scurisce.
Rispondi alle domande.
1. Sciogliere lo zucchero nell’acqua è una trasformazione fisica o chimica?
2. Sciogliere lo zucchero con il calore è una trasformazione fisica o chimica?
3. Lo zucchero si è caramellato: ha lo stesso sapore e lo stesso odore dello zucchero normale? Perché?
4. Quale delle due trasformazioni è reversibile?
lezione 2
la tavola periodica degli elementi
CONTENUTI DIGITALI
CARTA PENNA COMPUTER

Il Sistema Periodico degli elementi
Guarda il video e scrivi le risposte sul quaderno.
1. Quale scienziato ha sistemato in modo organico gli elementi?
2. Perché alcune caselle della tavola periodica sono rimaste inizialmente vuote?
3. Nella tavola periodica quali caratteristiche hanno gli elementi che appartengono allo stesso gruppo?
4. Che cosa indica il numero che contraddistingue ciascun periodo?
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.

5. A quali famiglie appartengono gli elementi di questi due gruppi? Illustra le loro caratteristiche.
1 Mettere in ordine gli elementi
Alla metà del XIX secolo si conoscevano 63 tipi di atomi diversi, ciascuno dei quali rappresentava un elemento. I chimici si erano accorti che molti elementi presentavano caratteristiche abbastanza simili tra loro, grazie alle quali potevano riunirli in gruppi. Fecero allora numerosi tentativi per organizzare gli elementi in modo logico, finché il 1° marzo 1869 il chimico russo Dmitrij Ivanovich Mendeleev (1834-1907) pubblica la prima edizione di una tavola di classificazione degli elementi. Come è riuscito a realizzarla? Mendeleev prova a disporre gli elementi su righe orizzontali dal più leggero al più pesante; ricomincia una nuova riga tutte le volte che un elemento presenta caratteristiche chimiche simili a quelle dell’elemento che occupa la casella immediatamente sopra. Realizza così il Sistema Periodico degli elementi, chiamato anche tavola periodica. Nell’ordinare in righe gli elementi secondo la massa atomica crescente, lo scienziato non riesce a riempire tutte le caselle, perciò ne lascia alcune vuote, convinto che esse saranno successivamente occupate da altri elementi non ancora scoperti. In effetti, circa quindici anni dopo, tra il 1875 e il 1886, vengono scoperti gli elementi germanio, scandio e gallio che trovano il loro posto nelle caselle lasciate vuote. Nel corso degli anni la tavola di Mendeleev è stata più volte aggiornata. Inoltre, si è compreso che le caratteristiche chimiche e fisiche di un elemento e la regolarità con cui essi si succedono nella tavola periodica dipendono non tanto dalla massa atomica quanto dal numero atomico.
L’attuale tavola periodica dispone gli elementi secondo il numero atomico crescente.
RACCONTO GENIALE
2 Come è strutturata la tavola Periodica
La tavola periodica è composta da 118 elementi: 90 sono elementi naturali, cioè si trovano in natura; i rimanenti 28 sono elementi artificiali, ottenuti in laboratorio mediante reazioni nucleari.
A ciascun elemento è stato attribuito un nome e, per comodità di scrittura, è stato assegnato un simbolo. Questo simbolo di solito è formato da una o due lettere iniziali del nome latino dell’elemento, ed è sempre scritto con l’iniziale maiuscola. Per esempio: l’idrogeno ha simbolo H dal latino hidrogenum, l’ossigeno O da ossigenum, il rame Cu da cuprum. L’uso della lingua latina deriva dal fatto che è stata la lingua universale in campo scientifico.
Ogni elemento è inserito in una casella che riporta il suo nome, il suo simbolo chimico, il numero atomico e la massa atomica 1
Gli elementi sono ordinati in 7 righe orizzontali, chiamate periodi, e 18 colonne verticali, chiamate gruppi, secondo la più recente (1990) convenzione di numerazione stabilita dalla IUPAC, l’Unione internazionale di chimica pura e applicata.
In ciascun periodo, il numero atomico aumenta progressivamente di una unità spostandosi da sinistra a destra.
Sia i gruppi sia i periodi sono indicati con un numero progressivo.
Il numero del periodo rappresenta il numero di gusci elettronici posseduti dagli atomi che in esso compaiono. Gli elementi che appartengono allo stesso periodo:
• hanno lo stesso numero di gusci, ma l’ultimo guscio contiene un numero diverso di elettroni 2 ;
• possiedono proprietà fisiche simili e proprietà chimiche che variano in modo graduale.


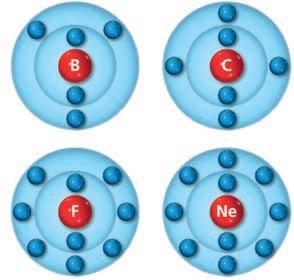

Litio (Li), berillio (Be), boro (B), carbonio (C), azoto (N), ossigeno (O), fluoro (F) e neon (Ne) possiedono due gusci elettronici: il primo è completo con due elettroni, il secondo si riempie progressivamente di elettroni andando dal litio al neon.
1 La casella dell’elemento idrogeno.

numero aromico
nome massa atomica simbolo
litio
azoto
berillio
ossigeno
boro
fluoro
carbonio neon
3 La struttura della tavola periodica.
Il numero del gruppo indica il numero di elettroni presenti nel guscio elettronico più esterno. Gli elementi che appartengono allo stesso gruppo:
• hanno diverso numero di gusci elettronici, ma lo stesso numero di elettroni in quello più esterno;
• possiedono un comportamento chimico simile.
Per esempio, il primo gruppo include 7 elementi: idrogeno (H), litio (Li), sodio (Na), potassio (K), rubidio (Rb), cesio (Cs) e francio (Fr). L’idrogeno ha un solo guscio, il litio due, il sodio tre e così via sino al francio, che ha sette gusci. L’ultimo guscio elettronico di tutti questi elementi contiene un solo elettrone 3 .
3
4 Il platino non si ossida a contatto con l’aria e resta sempre lucente.
Gli elementi sono suddivisi in categorie

La tavola periodica permette di distinguere alcuni tipi fondamentali di elementi.
• I metalli costituiscono la maggior parte degli elementi esistenti in natura. Sono metalli tutti gli elementi compresi fra il gruppo 1 e la diagonale che va dall’alluminio (Al) al polonio (Po), compresi gli elementi di transizione, i lantanidi e gli attinidi. I metalli sono tutti solidi, ad eccezione del mercurio (Hg) che è liquido. Sono buoni conduttori di elettricità e calore, sono lucenti e riflettenti, sono duttili, cioè possono essere ridotti in fili sottil, e malleabili, cioè possono essere ridotti in lamine sottili. Gli atomi dei metalli perdono facilmente gli elettroni più esterni 4 metalli
lantanidi
• I non metalli occupano la parte destra della tavola periodica, fra la diagonale allumi nio-polonio e il gruppo 17 compreso. Alcuni non metalli – azoto (N), ossigeno (O), fluoro (F), cloro (Cl) – sono gassosi in condizioni ambiente, il bromo (Br) è liquido, mentre gli altri sono solidi. In generale, i non metalli possiedono caratteristiche opposte a quelle dei metalli: non riflettono la luce, allo stato solido sono quasi sempre cattivi conduttori di corrente elettrica e di calore, non sono lavorabili come i metalli 5
• I semimetalli sono posti a cavallo della linea a gradini che attraversa la tavola periodica e hanno un comportamento chimico intermedio tra metalli e non metalli. Alcuni di essi, come il germanio (Ge) e il silicio (Si), sono semiconduttori e la loro capacità di far passare la corrente elettrica aumenta al crescere del la temperatura 6
• I gas nobili , posti nell’ultimo gruppo a destra, sono così chiamati perché non si combinano con nessun altro elemento (non formano quindi alcun composto). I gas nobili hanno l’ultimo guscio elettronico saturo, cioè completo di tutti gli elettroni: 2 elettroni nell’elio (He), 8 in tutti gli altri.





















FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).

• Gli elementi artificiali , chiamati anche elementi transuranici perché hanno nume ro atomico maggiore di 92, che è quello dell’uranio, non si trovano in natura, ma vengono ottenuti in laboratorio.
5 Lo zolfo è opaco. non metalli
6 Il silicio è utilizzato nei circuiti elettronici.

1. Nella tavola periodica metalli e non metalli occupano posizioni diverse.
2. I gas nobili si combinano facilmente con altri elementi.
semimetalli
3. Gli elementi che appartengono allo stesso periodo hanno lo stesso numero di elettroni.
4. I gusci elettronici contengono tutti lo stesso numero di elettroni.
VERSO LE COMPETENZE
Utilizza la tavola periodica per completare la tabella. Ricerca in rete informazioni sugli impieghi di questi elementi chimici.
P - fosforo
Pt - platino
Ba - bario
I - iodio
Hg - mercurio
Cl - cloro
elemento metallo non metallo numero atomico
VISUAL la tavola periodica Esploriamo

La tavola periodica non serve solo a “mettere in ordine” gli elementi. Se la osservi puoi capire, anche con una semplice occhiata, quali solo le principali proprietà dell’elemento che stai considerando semplicemente conoscendo le caratteristiche di atomi dello stesso gruppo o periodo che ti sono noti.
Li = litio
Metallo, numero atomico 3. Dal greco lithos, pietra.
È il più leggero dei metalli e, per la sua elevata reattività, non si trova allo stato naturale.
È usato principalmente nelle leghe conduttrici di calore, nelle batterie, oltre a numerosissimi altri impieghi.
Dal 2007 la domanda di litio è enormemente aumentata perché il metallo è alla base della produzione delle batterie per auto elettriche.

C = carbonio
Non metallo, numero atomico 6. Da carbo, carbone. Puro, si presenta come diamante o come grafite. Combinato con l’ossigeno forma il biossido di carbonio, comunemente noto come anidride carbonica, un gas indispensabile per le piante. La fibra di carbonio è un materiale molto leggero e contemporaneamente molto resistente, utilizzato, per esempio, nella produzione del telaio delle biciclette da corsa ma anche in ambito medico per la realizzazione di protesi.
O = ossigeno
Non metallo, numero atomico 8. Il suo nome deriva dal greco oxys, acido, e ghen, generare, e quindi significa “generatore di acidi”. Altamente reattivo, l’ossigeno forma facilmente ossidi e altri composti. È essenziale per tutti i viventi in quanto indispensabile per la respirazione ed è il componente fondamentale di tutte le biomolecole. Permette di respirare in aerei, sottomarini ed è necessario per le attività subacquee. È usato come propellente nei razzi ed entra nei processi produttivi di acciaio e plastica.
He = elio
Gas nobile, numero atomico 2. Il simbolo deriva dal greco helios, Sole: infatti è prodotto dalla fusione nucleare dell’idrogeno che avviene all’interno delle stelle. Insieme all’ossigeno è usato nei respiratori di alta profondità e nei sommergibili. Viene utilizzato per gonfiare i palloncini.
Ne = neon
Gas nobile, numero atomico 10. Dal greco neos, nuovo. Produce una luce rosso-arancio ed è usato per insegne pubblicitarie e per laser a gas.
Per la sua altissima capacità di refrigerazione il neon è impiegato nelle tecnologie del freddo.
Fe = ferro
Metallo, numero atomico 26. Dal latino ferrum. È il metallo più abbondante nella Terra (raggiunge la sua massima concentrazione nel nucleo terrestre) ed è così importante da aver dato il nome a un periodo preistorico, l’Età del ferro. Fondamentale nell’industria metallurgica; nel nostro organismo permette la sintesi dell’emoglobina.
K = potassio
Metallo, numero atomico 19. Il simbolo K deriva dal nome latino kalium Si trova in natura combinato con altri elementi e nell’acqua di mare. Si ossida rapidamente, è corrosivo e infiammabile. È indispensabile per la crescita delle piante ed è presente in tutti i tipi di suolo. La frutta è ricca di potassio indispensabile per il metabolismo delle cellule animali.
Molti composti del potassio sono presenti nei fertilizzanti, nella polvere da sparo e nel vetro.






I legami chimici lezione 3
Guarda il video e scrivi le risposte sul quaderno.
CARTA PENNA COMPUTER
1. Quali sono le forze che entrano in gioco tra il nucleo di un atomo e i suoi elettroni?
2. Quando due atomi possono legarsi?
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.
3. Come si forma un legame covalente?
4. Come si forma un legame ionico?
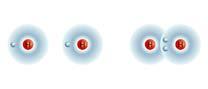
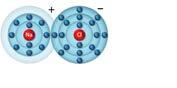
1 Rappresentazione di un atomo (neon, Ne), di una molecola biatomica (azoto, N e di un composto (acqua, H
Facciamo due altri esempi. Nella fotosintesi, le piante producono glucosio che ha per formula C6H12O6: significa che una molecola di glucosio è costituita da 6 atomi di carbonio, 12 di idrogeno e 6 di ossigeno.
Il metano, un gas infiammabile usato come combustibile per autovetture, per la produzione di energia elettrica, il riscaldamento e la cottura dei cibi, ha formula chimica CH4: indica che una molecola di metano è formata da un atomo di carbonio e 4 di idrogeno 2 .
3 Perché gli atomi si combinano tra loro
In natura gli atomi tendono ad aggregarsi per formare dei composti anziché restare isolati. La spiegazione di questo comportamento risiede nella loro struttura, in particolare nella disposizione degli elettroni nei gusci elettronici: 2 elettroni nel guscio più vicino al nucleo, 8 nei gusci successivi.
Gli atomi, tuttavia, hanno spesso meno di 8 elettroni nel guscio più esterno (o 2 se hanno un solo guscio) e questo li rende chimicamente instabili. Per raggiungere una struttura stabile, un atomo cerca di riempire il guscio più esterno con 8 elettroni e completare l’ottetto.
Per fare ciò gli atomi instabili si combinano ad altri atomi mediante i legami chimici.
Un legame chimico è una forza attrattiva di natura elettrica che unisce due o più atomi; alla sua formazione partecipano solo gli elettroni del guscio più esterno.
Esistono tre tipi di legami chimici: il legame ionico, il legame covalente e il legame metallico. Alcuni elementi, tuttavia, sono chimicamente inerti, cioè hanno una scarsa tendenza a legarsi ad altri elementi: sono i gas nobili che, come sai, appartengono al gruppo 18 della tavola periodica. Poiché il loro guscio elettronico più esterno è già completo, sono stabili dal punto di vista chimico e non si legano ad altri elementi 3
4
Il legame ionico
In alcuni casi gli atomi raggiungono la stabilità cedendo o acquistando elettroni. In questo modo essi non sono più elettricamente neutri e sono diventati degli ioni.
Uno ione è un atomo che ha una o più cariche elettriche, positive o negative.
2 Rappresentazione della molecola del metano.
=
3 La disposizione degli elettroni negli atomi di elio, neon e argon.

• primo guscio completo

Se un atomo cede uno o più elettroni, diventa elettricamente positivo, perché il numero dei protoni del nucleo diventa maggiore di quello degli elettroni; viene indicato con il nome di ione positivo o catione e si indica con un più (+). Al contrario, se un atomo acquista uno o più elettroni, diventa elettricamente negativo, perché il numero di elettroni diventa maggiore di quello dei protoni del nucleo. Questo atomo è detto ione negativo o anione e si indica con un meno (–).

Il legame ionico si forma tra uno ione positivo e uno ione negativo; è una conseguenza della forza di attrazione che si esercita tra ioni di carica opposta.

Ioni positivi e negativi esistono anche in natura: gli ioni positivi possono essere prodotti dal vento in un deserto torrido, dai telefoni cellulari, dai trasmettitori radio e TV. Gli ioni negativi sono nell’aria in prevalenza al mare in prossimità degli scogli, vicino a una cascata che si getta nelle acque di un lago e durante i temporali estivi.

• primo guscio completo
• secondo guscio completo



• primo guscio completo
• secondo guscio completo
• terzo guscio completo
4 Come si forma il cloruro di sodio.


1. Il sodio (Z = 11) ha solo un elettrone nel guscio più esterno perciò, per raggiungere l’ottetto stabile, tende a cederlo e a diventare ione Na+.
5 Formazione del legame di idrogeno H




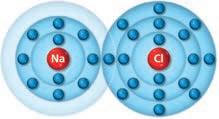











legame singolo
SCIENZA
Il cloruro di sodio (formula NaCl) è un esempio di sostanza con legame ionico 4


2. Il cloro (Z = 17) ha 7 elettroni nel guscio esterno, per cui tende ad acquistare un altro elettrone e diventa ione Cl–.

5 Il legame covalente


3. I due ioni con carica elettrica opposta si attraggono, creano un legame ionico e formano il composto NaCl.

Nella molecola dell’acqua, come in tanti altri casi, gli atomi non cedono né acquistano elettroni ma li mettono in comune o, come dicono i chimici, in “compartecipazione”, così ciascuno di essi può saturare l’ultimo guscio e raggiungere una situazione di stabilità. legame covalente si forma quando gli atomi condividono una o più coppie di elettroni del guscio esterno di ognuno di essi.






Elementi come il cloro, il bromo, lo iodio e l’idrogeno esistono in natura sotto forma di molecole biatomiche, cioè formate da due atomi uniti da un legame covalente. L’idrogeno, per esempio, ha un solo guscio elettronico, con un elettrone. Quando due atomi di idrogeno si avvicinano, condividono ciascuno il proprio elettrone. Si forma così la molecola biatomica H2 5 . Il legame covalente si può formare anche tra atomi di elementi diversi, come avviene nell’acido cloridrico (HCl) e nell’acqua.
QUAL è IL MIGLIORE CONDUTTORE DI CALORE?
La conducibilità termica misura la quantità di calore che, nell’unità di tempo, attraversa un determinato materiale con spessore pari a 1 metro e una superficie di 1 mq, quando la differenza di temperatura tra le due facce del materiale considerato è pari a 1 K. Tutti sanno che i materiali che meglio conducono il calore sono i metalli, a causa delle particolari caratteristiche del loro legame; eppure il miglior conduttore di calore non è un metallo, bensì un semimetallo cristallino molto speciale, il diamante, composto da atomi di carbonio. La sua conducibilità termica è 5 volte maggiore di quella del rame, e questo lo rende estremamente freddo al tocco.

Composti ionici in vetrina
Il legame formato da una sola coppia di elettroni, come nel caso della molecola di H2, è chiamato legame covalente singolo.
Il legame formato da due coppie di elettroni condivise da ciascun atomo è chiamato legame covalente doppio. Ne è un esempio la molecola biatomica dell’ossigeno (O2) 6 Esiste anche il legame covalente triplo, in cui sono condivise tre coppie di elettroni. Un legame di questo tipo si trova, per esempio, nella molecola biatomica dell’azoto (N2) 7 .
6 Il legame metallico
La presenza del legame metallico rende i metalli facilmente lavorabili ma soprattutto ottimi conduttori di calore ed elettricità. Nei metalli, gli elettroni del guscio più esterno tendono ad allontanarsi dagli atomi e a muoversi liberamente attorno ad essi formando una specie di nuvola elettronica: gli atomi diventano quindi ioni positivi. Si forma così una struttura ordinata costituita dai nuclei con i gusci elettronici più interni, circondati da elettroni in continuo movimento tra un atomo e l’altro 8
Il legame metallico è la forza, di tipo elettrostatico, che tiene uniti gli ioni positivi di un metallo e la nuvola di elettroni che li circonda.
6 Il legame covalente doppio nella molecola di ossigeno O2.



7 Il legame covalente triplo nella molecola di azoto N2.

































Abbina i termini con la definizione corretta.
1 Catione
2 Molecola biatomica
3 Legame chimico
4 Legame covalente triplo
1: 2: 3: 4:
a Forza elettrica attrattiva che unisce due o più atomi.
b Legame in cui sono condivise tre coppie di elettroni.
c Atomo che ha ceduto uno o più elettroni.
d Molecola formata da due atomi uguali.
Il biossido di carbonio, meglio conosciuto come anidride carbonica, è una tra le sostanze più importanti in natura (pensa per esempio al suo ruolo nella fotosintesi). La sua formula chimica è CO2. Rappresenta la struttura dei due atomi e la molecola del composto. Rispondi alla domanda. Quale tipo di legame unisce il carbonio e l’ossigeno?
Il legame metallico.
4
LE REAZIONI CHIMICHE
LAB STEM
C’È ARIA E ARIA
La combustione è una reazione chimica in cui le sostanze coinvolte – il legno di un ceppo o la cera di una candela – si combinano con l’ossigeno dell’aria dando origine al diossido di carbonio gassoso e ad altre sostanze. Perché avvenga una combustione è sempre necessaria la presenza di ossigeno, mentre altri gas, come l’anidride carbonica, possono fermare questa reazione.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• due vasetti di vetro o due beker
• mezzo bicchiere di aceto
• bicarbonato
• un lumino
• cartoncino




• accendino
• cucchiaino




PROCEDIMENTO
1. Metti il lumino in uno dei vasetti e accendilo.
2. Nell’altro vasetto metti tre cucchiaini di bicarbonato e versa l’aceto, quindi copri con il cartoncino. Osserva che cosa accade.
3. Aspetta qualche minuto, poi togli il cartoncino e versa sopra il lumino acceso il gas che si è accumulato nel vasetto, avendo cura di non versare il liquido.
■ OSSERVA E RISPONDI
1. Che tipo di trasformazione chimica avviene quando accendi il lumino?
2. Quale fenomeno indica che, unendo l’aceto al bicarbonato, avviene una reazione chimica?
3. Che tipo di gas si è formato come prodotto della combustione?
4. Che cosa succede quando versi l’anidride carbonica sopra il lumino acceso?
5. Scrivi la relazione dell’esperimento.
1
Le trasformazioni chimiche
Ad eccezione dei gas nobili, che come sai hanno l’ultimo guscio elettronico completo, tutti gli altri elementi tendono a combinarsi tra loro fino a raggiungere la stabilità tipica di questi gas.
Queste combinazioni sono tutte trasformazioni chimiche, perché comportano cambiamenti sostanziali nella struttura interna della materia: al termine dei processi si ottengono sostanze diverse da quelle di partenza.
Una trasformazione chimica si chiama reazione chimica.
Le sostanze di partenza sono chiamate reagenti, quelle finali sono i prodotti. In una reazione chimica i legami esistenti tra gli atomi delle molecole dei reagenti si rompono e se ne formano di nuovi, che creano le molecole dei prodotti 1
Una reazione viene descritta mediante una equazione chimica che utilizza le formule delle sostanze reagenti e quelle dei prodotti ottenuti. In una equazione chimica le formule dei reagenti sono scritte a sinistra, quelle dei prodotti a destra di una freccia; il verso della freccia indica il verso della reazione. Per esempio, il ferro e lo zolfo reagiscono se vengono riscaldati e si trasformano in un composto, il solfuro di ferro. L’equazione chimica che esprime questa reazione è la seguente:
Fe + S reagenti
FeS prodotto
2 Le leggi che regolano le reazioni chimiche
Esistono diverse leggi che governano le reazioni chimiche. Una delle più importanti è la legge di conservazione della massa, detta anche legge di Lavoisier, dal nome del chimico francese Antoine Lavoisier (17431794) che l’ha ideata 2 . Ecco che cosa afferma.

1 I fuochi artificiali sono a base di sostanze che, reagendo violentemente, liberano l’energia.



In qualsiasi reazione chimica, la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti.


2 Un esempio della legge di Lavoisier. Se si scaldano 21 g di ferro con 12 g di zolfo, si ottengono 33 g di solfuro di ferro.

La legge di conservazione della massa permette di bilanciare le equazioni chimiche, cioè di verificare che nell’equazione chimica il numero di atomi di ciascun elemento sia lo stesso nei reagenti e nei prodotti della reazione. Infatti il numero complessivo di atomi di ciascun elemento dei reagenti rimane uguale al numero complessivo di atomi dei prodotti. Facciamo un esempio con la reazione di formazione dell’acqua:
H2 + O2 H2O
Controlliamo se la legge di Lavoisier è rispettata, ricordando che le molecole di ossigeno e idrogeno sono biatomiche:
• 2 atomi di idrogeno nei reagenti 2 atomi di idrogeno nei prodotti;
• 2 atomi di ossigeno nei reagenti 1 atomo di ossigeno nei prodotti. L’equazione è sbagliata: manca un atomo di ossigeno. Per correggerla si devono far reagire due molecole di idrogeno e una di ossigeno con la formazione di due molecole di acqua.
2H2 + O2 2H2O
In questo modo la legge di Lavoisier è rispettata:
• 4 atomi di idrogeno nei reagenti 4 atomi di idrogeno nei prodotti;
• 2 atomi di ossigeno nei reagenti 2 atomi di ossigeno nei prodotti.
o zolfo
solfuro di ferro
SKILL BOOK
GIOCHIAMO CON GLI ATOMI LAB TINKERING

SCIENZA
Successivamente un altro chimico francese, Joseph Louis Proust (1754-1826), ha formulato la legge delle proporzioni definite, o legge di Proust
Le masse degli elementi chimici che si combinano per formare un composto stanno sempre tra loro in un rapporto definito e costante.
Se per esempio facciamo reagire tre molecole di ossigeno e quattro di idrogeno, solo due molecole di ossigeno entrano nella reazione e vanno a formare con l’idrogeno quattro molecole di acqua; la restante molecola di ossigeno rimane inalterata perché il rapporto tra ossigeno e idrogeno è sempre 1 : 2.
3 I tipi di reazioni chimiche
Esistono cinque tipi fondamentali di reazioni chimiche: di sintesi, di ossidazione, di decomposizione, di sostituzione e di doppio scambio.
• Le reazioni di sintesi, o reazioni di combinazione, avvengono tra due elementi che si combinano per dare origine a un composto. Un esempio è la formazione del sale da cucina, o cloruro di sodio (NaCl), a partire da cloro e sodio:
2Na + Cl2 2NaCl sodio cloro cloruro di sodio
Le reazioni di sintesi possono avvenire anche tra composti. Un esempio è la formazione del cloruro di ammonio a partire da ammoniaca e acido cloridrico:
NH3 + HCl NH4Cl ammoniaca acido cloridrico cloruro di ammonio
• Le reazioni di ossidazione sono un caso particolare di reazioni di sintesi, in cui l’ossigeno reagisce con un elemento. Sono reazioni di ossidazione per esempio la formazione della ruggine, la patina di colore verde che ricopre il rame o quella scura che si forma sugli oggetti di argento e ottone.
2Mg + O2 2MgO magnesio ossigeno ossido di magnesio
Perché molti frutti e verdure diventano neri dopo averli affettati?
Il colore scuro che appare sulla superficie tagliata di mele, banane, funghi e melanzane è provocato dagli enzimi che contengono. Gli enzimi sono sostanze organiche che cedono elettroni all’ossigeno presente nell’atmosfera, favorendo la formazione di ossidi scuri nella polpa esposta all’aria. Questo è il motivo per cui la superficie delle fette non esposta mantiene un colore più chiaro. Per evitare questo inconveniente si può spremere sulle fette del succo di limone che agisce come antiossidante e impedisce agli enzimi di legarsi con l’ossigeno.

Reazione di sintesi
• Nelle reazioni di decomposizione un unico reagente si scompone nei prodotti. Questa reazione avviene, per esempio, nelle bottiglie di bibite gassate lasciate aperte: l’acido carbonico contenuto si scompone in acqua e anidride carbonica, e la bibita perde il frizzante.
H2CO3 H2O + CO2 acido carbonico acqua anidride carbonica
• Nelle reazioni di sostituzione un elemento di un composto si sostituisce a un altro. Ad esempio, quando una lamina ricoperta di rame viene immersa in una soluzione acquosa di nitrato d’argento (un liquido incolore), il rame si trasferisce nella soluzione e forma il nitrato di rame. La soluzione acquista una colorazione blu, mentre l’argento si deposita sulla lamina come argento metallico 3
AgNO3 + Cu Ag + Cu(NO3)2 nitrato di argento rame argento nitrato di rame
• Nelle reazioni di doppio scambio due elementi contenuti nei reagenti si scambiano il posto e danno origine a due diversi composti nei prodotti. Per esempio, se si versano alcune gocce di acido cloridrico in una provetta contenente solfuro di ferro, il cloro prende il posto dello zolfo e viceversa. Si formano cloruro di ferro (FeCl2) e acido solfidrico (H2S).
2HCl + FeS FeCl2 + H2S acido cloridrico solfuro di rame clururo di ferro acido solfidrico
Quest’ultimo composto è responsabile dell’odore sgradevole di uova marce che si sente nelle regioni termali o vulcaniche dove fuoriescono vapori surriscaldati di acido solfidrico.
FISSA I CONTENUTI ESSENZIALI
Sottolinea il termine corretto tra i due proposti.
1. La legge di Lavoisier/Proust afferma che le masse degli elementi si combinano per formare un composto in proporzioni definite e costanti.
2. Secondo la legge di Lavoisier la somma delle masse dei reagenti è uguale/proporzionale alla somma delle masse dei prodotti.
3. In una reazione di ossidazione uno dei reagenti è sempre l’idrogeno/ossigeno.
4. In una reazione di sostituzione/ decomposizione un elemento di un composto si sostituisce a un altro.
VERSO LE COMPETENZE STEM
Esegui l’esperimento e osserva una reazione di ossidazione particolare: la combustione.

Reazione di decomposizione dell'acqua
lamina di Cu patina di Ag metallico 3 Una reazione di sostituzione.
soluzione di Cu(NO3 )2 soluzione di AgNO3
Materiali
• una candela o un cero
• un piattino di ceramica
• un vetrino da microscopio
• una presina o un guanto
• un accendino da forno
Esecuzione
1. Posiziona la candela sul portacandele in modo che sia stabile. Chiedi a un adulto di accenderla.
2. Sostieni il piattino sopra la fiamma per 15 secondi, tenendolo con il guanto per non scottarti.
3. Allontanalo e appoggialo su un pezzo di carta a raffreddare.
4. Controlla che il vetrino sia perfettamente pulito e ripeti la procedura.
Rispondi alle domande.
1. Che cosa osservi sul retro del piattino?
2. Che cosa osservi sul vetrino?
CON LA SINTESI
lezione 1 L’ATOMO E LA SUA STRUTTURA
La chimica studia la composizione, la struttura e le trasformazioni delle sostanze. Una sostanza semplice, o elemento, non può essere scomposta in altre sostanze semplici, mentre un composto è una sostanza che si può scomporre in elementi.
Le sostanze possono subire due tipi di trasformazioni: trasformazioni fisiche, reversibili, che non cambiano la struttura della materia; trasformazioni chimiche, che comportano cambiamenti della struttura della materia, cioè delle molecole che la compongono.
La parte più piccola di materia è l’atomo. Esso è costituito da un nucleo, formato da protoni, dotati di carica elettrica positiva, e da neutroni, elettricamente neutri. Intorno al nucleo, in strati di diverso livello energetico detti gusci elettronici, ruotano gli elettroni, con carica elettrica negativa. Normalmente il numero dei protoni è uguale a quello degli elettroni e, in queste condizioni, l’atomo è elettricamente neutro.
Gli atomi si identificano con: il simbolo chimico, iniziale del nome latino dell’elemento; il numero atomico Z, che corrisponde al numero dei protoni; il numero di massa A, che è uguale alla somma del numero di protoni e neutroni.
Gli atomi di uno stesso elemento ma con diverso numero di neutroni sono detti isotopi. Per indicare il peso di un atomo si usa come unità di misura l’unità di massa atomica, u.m.a., che è la dodicesima parte della massa di un atomo di carbonio.
lezione 2 LA TAVOLA PERIODICA DEGLI ELEMENTI
La tavola periodica è una tavola di classificazione degli elementi realizzata dal chimico russo
Dmitrij Ivanovich Mendeleev nel 1869.
Nella tavola periodica attualmente in uso, gli elementi sono ordinati secondo il numero atomico crescente: contiene 118 elementi di cui 90 elementi naturali e 28 artificiali. Le sette righe orizzontali sono i periodi; le otto colonne, sono i gruppi. Nella tavola periodica si distinguono i metalli, i non metalli, i semimetalli, gli elementi di transizione, i gas nobili e gli elementi artificiali.



lezione 3 I LEGAMI CHIMICI
Gli atomi sono stabili quando contengono otto elettroni nel guscio più esterno. Per ottenere questa stabilità, gli atomi tendono a legarsi tra loro, ad eccezione dei gas nobili che già contengono 8 elettroni nel guscio esterno. La tendenza degli atomi a riempire il guscio più esterno è chiamata dai chimici regola dell’ottetto. Gli atomi che cedono uno o più elettroni si trasformano in ioni positivi o cationi, mentre gli atomi che acquistano uno o più elettroni si trasformano in ioni negativi o anioni. Ioni di carica opposta si attraggono e formano delle sostanze caratterizzate dalla presenza di un legame ionico. Quando gli atomi mettono in comune due o più coppie di elettroni del loro guscio esterno si formano delle sostanze caratterizzate dalla presenza di un legame covalente. Il legame metallico si origina perché forze di tipo elettrostatico uniscono i nuclei degli atomi, che hanno le caratteristiche di ioni positivi, alla nuvola di elettroni che circonda i nuclei e che si sposta liberamente da un atomo all’altro. Le caratteristiche tipiche dei metalli, come la conduzione di calore ed elettricità e la facilità con cui possono essere lavorati, dipendono direttamente da questo tipo di legame.
lezione 4 LE REAZIONI CHIMICHE




















Quando gli atomi si combinano tra loro avvengono delle reazioni chimiche. Le sostanze di partenza si chiamano reagenti, quelle ottenute sono i prodotti. Le reazioni chimiche sono regolate da due leggi fondamentali: la legge di conservazione della massa o legge di Lavoisier: la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti; la legge delle proporzioni definite o legge di Proust: le masse degli elementi che si combinano in un composto stanno tra loro in un rapporto definito e costante.
Le principali reazioni chimiche sono: sintesi: due elementi si combinano e formano un composto; ossidazione: combinazione di un elemento con l’ossigeno; decomposizione: divisione di un composto nei componenti; sostituzione: un elemento di un reagente si sostituisce a un altro; doppio scambio: due elementi dei reagenti si scambiano, producendo composti diversi.

CON LA MAPPA
Adesso che hai ripassato i contenuti essenziali con la sintesi, prova a completare la mappa con le parole chiave suggerite e a trovare le definizioni corrispondenti. gusci elettronici - legami covalenti - legami ionici - neutroniregola dell’ottetto - tavola periodica
particelle con carica elettrica +
particelle con carica elettrica

riempiendo con 8 elettroni il più esterno dei


reagendo tra loro e formando
particelle prive di carica elettrica
secondo la


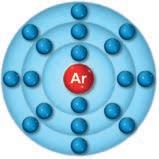

a. Sono i costituenti fondamentali della materia.
b. Particelle subatomiche con carica elettrica negativa.
d. Lo sono elementi che hanno raggiunto l’ottetto.






c. È il tipo di legame che si forma tra uno ione positivo e uno ione negativo.


6.
sono formati da
tendono a diventare sono ordinati nella
5. stabili
3. elettroni
1. GLI ATOMI
7.
legami metallici
4.
2. protoni

lezione 1 L’ATOMO E LA SUA STRUTTURA
1 Segna con una crocetta se vero (V) o falso (F).
a. I protoni si trovano nel nucleo dell’atomo.
b. La massa di un atomo è espressa dal numero di massa.
c. I neutroni sono particelle subatomiche.
d. Il numero di elettroni di un atomo è uguale al numero dei neutroni.
2 Scegli la soluzione corretta.
a. Gli isotopi di un elemento sono:
1 atomi dell’elemento che hanno un diverso numero di protoni.
2 atomi dell’elemento che hanno un diverso numero di neutroni.
3 atomi dell’elemento che hanno un diverso numero di elettroni.
4 atomi con diverso numero sia di protoni sia di elettroni.
b. L’unità di massa atomica è:
1 la somma del numero di protoni e neutroni.
2 la dodicesima parte della massa di un atomo di carbonio.
3 il numero dei neutroni di un atomo.
4 il numero dei protoni di un atomo.
c. Che cosa rappresenta il disegno?




1 Il nucleo di un atomo.
2 La distribuzione dei protoni nei gusci di un atomo.
3 La distribuzione degli elettroni nei gusci di un atomo.
4 La distribuzione dei neutroni nell’atomo.
lezione 2 LA TAVOLA PERIODICA
ELEMENTI
3 Scegli la soluzione corretta.
Nella tavola periodica il numero del gruppo indica:
1 il numero di elettroni di ciascun elemento del gruppo.
2 il numero di elettroni del primo elemento del gruppo.
3 il numero di elettroni contenuti nel guscio più interno di ciascun elemento del gruppo.
4 il numero di elettroni contenuti nel guscio più esterno di ciascun elemento del gruppo.
4 Completa la tabella indicando le caratteristiche di metalli e non metalli.
Proprietà Metallo Non metallo
Buon conduttore di elettricità
Collocato nella parte destra della tavola periodica Opaco
Duttile e malleabile
Solidi a temperatura ambiente tranne uno
Diventano facilmente ioni
5 Abbina i termini con la definizione corretta.
1. Non metalli
2. Simbolo chimico
3. Gas nobili
4. Elementi di transizione
a Iniziale del nome latino di un elemento.
b Elementi che non si combinano con altri.
c Elementi che non fanno parte di nessun gruppo.
d Elementi chimici cattivi conduttori termici ed elettrici.
1. 2. 3. 4.
6 Sottolinea le parole sbagliate presenti nel brano e sostituiscile con i termini corretti.
a. In natura esistono 92 tipi diversi di atomi che sono ordinati nella tavola periodica in base al numero di massa crescente.
b. Le righe orizzontali della tavola periodica si chiamano simboli chimici, le colonne si chiamano periodi.
lezione 3 I LEGAMI CHIMICI
7 Scegli la soluzione corretta.
a. Un catione con 4 protoni e 2 neutroni possiede:
1 6 elettroni.
2 4 elettroni.
3 2 elettroni.
4 nessun elettrone.
b. Un atomo è in condizioni di stabilità quando possiede:
1 8 elettroni nel guscio esterno.
2 lo stesso numero di protoni ed elettroni.
3 carica positiva.
4 pochi elettroni nel nucleo.
9 Sottolinea il termine corretto tra i due proposti.
a. Se un atomo acquista o cede un elettrone diventa un isotopo/uno ione.
b. Nel legame ionico/covalente due atomi mettono in comune uno o più elettroni.
c. La regola dell’ottetto riguarda i protoni/ gli elettroni di un atomo.
d. Nei metalli i neutroni/gli elettroni si muovono liberamente attorno ai nuclei.
lezione 4 LE REAZIONI CHIMICHE
10 Scegli la soluzione corretta.
La legge di Lavoisier afferma che:
1 l’energia delle sostanze reagenti è uguale all’energia dei prodotti.
2 il numero di molecole delle sostanze reagenti è uguale al numero di molecole dei prodotti.
3 il volume dei prodotti è uguale al volume dei reagenti.
4 la massa delle sostanze misurate prima della reazione è uguale alla massa delle sostanze misurata dopo la reazione.
8 Osserva i disegni e mettili nell’ordine corretto di formazione del legame. Di quale legame si tratta?


11 Sottolinea le parole sbagliate presenti nel brano e sostituiscile con i termini corretti.


Una reazione di ossidazione è un caso particolare di reazione di sostituzione nella quale uno dei reagenti è sempre l’idrogeno
12 Osserva la seguente reazione chimica e rispondi alle domande.
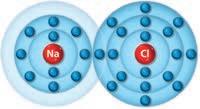




C + O2 → CO2
a. Quali sostanze reagiscono?
b. Qual è il prodotto?
c. La reazione è bilanciata?
d. È rispettata la legge di conservazione della massa?
13 Scegli la soluzione corretta.
La reazione: 2HCl + FeS → FeCl2 + H2S è una reazione di:
1 sostituzione.
2 doppio scambio. 3 sintesi. 4 decomposizione.
INTERPRETARE E COMMENTARE UN MODELLO
1 Osserva l’immagine e rispondi alle domande.

INTERPRETARE SCHEMI






3 Nella reazione chimica: 2C2H6 + 7O2 → 4CO2 + 6 H2O l’acqua è:


a. Che cosa è rappresentato in questa immagine?
b. Quella rappresentata è l’unica tipologia di legame di questo tipo?
c. Sai fare qualche esempio di composti ottenuti con questo legame?
INDIVIDUARE CARATTERISTICHE E SPIEGARE
2 Osserva l’immagine e rispondi alle domande.




















a. Quale tipo di legame è rappresentato?
b. Quali sostanze presentano un legame di questo tipo?
c. Quali sono le loro caratteristiche?
1 un reagente. 3 un termine di bilanciamento. 2 un prodotto. 4 un elemento chimico.
4 Riconosci il tipo di reazione chimica e scrivi il nome dei reagenti e dei prodotti.
a. 2Na + Cl2 → 2NaCl
Reazione di
Reagenti
Prodotto
b. 2Mg + O2 → 2MgO
Reazione di Reagenti
Prodotto
c. H2CO3 → H2O + CO2
Reazione di Reagenti
Prodotto
d. AgNO3 + Cu → Ag + CuNO3
Reazione di Reagenti
Prodotto
e. 2HCl + FeS → FeCl + H2S
Reazione di Reagenti
Prodotto
RISOLVERE PROBLEMI
5 Bilancia le seguenti reazioni chimiche.
a. Al + O2 → Al2O3
b. Cu2O + O2 → CuO
c. Fe + O2 → Fe2O3
d. Na + H2O → NaOH + H2
e. NH3 + O2 → NO2 + H2O
6
Riconosci sulla tavola periodica degli elementi l’elemento che corrisponde alla descrizione. È un metallo.
Si trova nel quinto periodo. È un elemento artificiale.
Si trova tra molibdeno e rutenio. È l’elemento
7 Cerca sulla tavola periodica il nome e il simbolo degli elementi che hanno la seguente massa atomica.
a. 69,72:
b. 137,3:
c. 79,9:
d. 209,0:
RIFLETTERE E SPIEGARE
8 Osserva il disegno e rispondi.
a. Che cosa rappresenta l’immagine?
b. Che cosa sono gli elementi in giallo?
c. Quali elementi sono raggruppati nelle caselle verdi?
d. Quali sono le loro caratteristiche?
e. Che cosa rappresenta la linea a gradini?
f. Come si chiamano gli elementi a cavallo di questa linea?
TRARRE INFORMAZIONI DA UN TESTO E FORMULARE IPOTESI
9 Leggi il brano.
I 10 ANNI DEL BOSONE DI HIGGS
Il 4 luglio 2012 Fabiola Gianotti, direttore generale del Cern di Ginevra e capo progetto dell’esperimento ATLAS in collaborazione con l’acceleratore più grande del mondo, il Large Hadron Collider (LHC), dava la notizia di una delle più grandi scoperte della scienza: il bosone di Higgs. Che cos’è? È una delle 17 particelle elementari dell’Universo che compongono il Modello Standard della fisica delle particelle. Questo modello divide le particelle fondamentali in due tipi: i campi di materia, leptoni e quark, e i bosoni mediatori delle forze. Senza il bosone di Higgs non esisterebbero gli atomi che compongono tutta la materia esistente, noi compresi. La sua scoperta ha rappresentato per i fisici quello che la teoria dell’evoluzione ha rappresentato per i biologi. La ricerca del bosone di Higgs è durata 50 anni: era talmente sfuggente da essere chiamata “particella di Dio” dal titolo di un libro del premio Nobel per la fisica Leon Lederman The God Particle: if the Universe is the answer. What in the question? Ci sono ancora molte domande che gli scienziati si pongono sul bosone di Higgs e trovare le risposte non solo migliorerà la nostra comprensione dell’Universo, ma potrebbe anche aiutarci a capire qual è stata la sua evoluzione e quale potrebbe essere la sua fine. (Rid. e adatt. da Focus)
Rispondi alle domande e svolgi le attività proposte, da solo o in gruppo con i tuoi compagni.
a. Quando è stato scoperto il bosone di Higgs?
b. Quale strumentazione ha permesso di scoprire questa particella?
c. Che cos’è?
d. Perché è importante questa scoperta?
Con l’aiuto del tuo insegnante realizza un prompt, cioè una domanda da sottoporre a un chatbot di intelligenza artificiale, per proporti un test divertente sul brano che hai appena letto oppure un gioco a squadre da fare in classe con i tuoi compagni.

ELEMENTS IN THE HUMAN BODY
The human body is composed of many atoms: in a 70 kg man there are 7 × 1027. The majority of the atoms that make up the human body are represented by only three elements: oxygen, carbon, and hydrogen In all there are 41 elements including nitrogen, calcium, phosphorus, sulphur, and sodium.
lossario
Oxygen is present in water and other compounds. Oxygen is necessary for respiration. You will find this element in the since about 20% of the air you breathe is oxygen. Oxygen accounts for about 65% of the mass of the human body.
Hydrogen is a component of the water molecules in the body. It accounts for about 9.5% of the mass of the human body.
Calcium is a major component of the skeletal system. It is found in bones and teeth, in the nervous system, and muscles. Calcium accounts for 1.5% of the body's mass.

18.6% of body mass is carbon. Carbon is found in every organic molecule in the body. The reason it forms the basis for organic life is that each carbon atom offers four sites for chemical bonding and allows new bonds to be formed or broken without expending too much energy. This makes carbon a good building block. We even expel carbon as a waste product when we exhale in the form of carbon dioxide.
COMPREHENSION EXERCISES
Answer the following questions.
How many atoms can we find in a 70 kg man?
What are the main elements?
Why is carbon a good building
Where is calcium located?



LUNGS polmoni
chimici I composti unità 5
lezione 1
Ossidi, ANIDRIDI e BASI
lezione 2
ACIDI E SALI
VISUAL

lezione 3
Architetture di sale
Soluzioni acide, basiche e neutre
lezione 4
I composti organici e le biomolecole
lezione EDUCAZIONE CIVICA 5
La chimica quotidiana

in


BUONE NOTIZIE PER IL FUTURO
Plastica si ` , ma buona ambiente
Immagina che cosa succederebbe se, all’improvviso, sparissero i materiali plastici. Molti oggetti scomparirebbero del tutto, di alcuni resterebbero le parti metalliche o in vetro, rimarrebbero le stoffe in fibre naturali, libri e giornali, e poco altro.
La plastica si è conquistata un ruolo importante nella vita quotidiana e in tutti i settori produttivi, eppure oggi costituisce un grave problema per l’ambiente. Le plastiche sono prodotti di sintesi ottenuti dal petrolio, composti chimici molto stabili, che si decompongono lentamente e con difficoltà una volta immessi nell’ambiente: è possibile sostituirle con materiali con le stesse qualità, ma sostenibili? Sì, per esempio con le bioplastiche, prodotte a partire da cellulosa, amido di mais, grano, tapioca, scarti vegetali, come bucce di patate, che sono completamente biodegradabili e compostabili.
Presto anche nella produzione delle plastiche termoindurenti, come quelle degli pneumatici, che non sono riciclabili, entreranno molecole d’origine organica che ne ridurranno l’impatto ambientale.
La raccolta differenziata e il riciclo degli oggetti di plastica continuano ad essere le migliori strategie per ridurre i danni all’ambiente. Dal 2025 una direttiva dell’Unione Europea ha imposto a tutte le aziende produttrici di bottiglie di plastica di utilizzare almeno il 25% di plastica riciclata nella produzione di contenitori con una capacità fino a 3 litri.
SCIENCE


Capelli di Ade in Hercules?
Tutta colpa dell’alluminio
Ossidi, ANIDRIDI E basi lezione 1
LAB STEM
LA FORMAZIONE DELLA RUGGINE
MATERIALI
• una paglietta di ferro, come quelle per lavare le pentole
• una provetta di vetro o di plastica (sono vendute in farmacia per le analisi)
• un piatto fondo
• acqua




Lo sanno tutti che un oggetto di ferro, lasciato esposto all’aria o a contatto con l’acqua, cambia colore e si arrugginisce. Il contatto con oggetti arrugginiti ha sempre suscitato un certo timore perché si teme di contrarre il tetano se ci si ferisce con materiali arrugginiti. Questa è una falsità perché ciò può succedere solo se l’oggetto è venuto a contatto con il batterio portatore dell’infezione. Ma quale sostanza è responsabile di questa trasformazione?
■ REALIZZA L’ESPERIMENTO
PROCEDIMENTO
1. Riempi d’acqua la provetta e poi svuotala in modo che resti umida.
2. Sistema sul fondo della provetta un po’ di paglietta.
3. Versa circa un centimetro di acqua nel piatto.
4. Capovolgi la provetta sul piatto e lascia riposare per 24-48 ore.
5. Al termine, osserva quanto è successo.
■ OSSERVA E RISPONDI
1. Come è diventata la paglietta?
2. È cambiato il livello di acqua nel piatto?
3. Quale reazione chimica può essere avvenuta?
4. Quale sostanza ha reagito con il metallo della paglietta?
5. Scrivi la relazione dell’esperimento.
1 L’ossidazione
L’ossigeno ha un ruolo di primo piano nel nostro pianeta: è uno dei gas che formano l’atmosfera ed è indispensabile per la respirazione degli organismi viventi; è anche uno dei componenti dell’acqua ed è molto reattivo, combinandosi facilmente sia con gli altri elementi sia con i composti.
Le reazioni nelle quali uno dei reagenti è l’ossigeno si chiamano ossidazioni
Un particolare tipo di reazione di ossidazione è la combustione: in essa l’ossigeno si lega al carbonio o a un suo composto e si liberano energia (sotto forma di luce) e calore.
CONTENUTI DIGITALI
Per esempio, quando un pezzo di legno brucia, il carbonio contenuto nel legno si combina con l’ossigeno dell’aria formando un gas, l’anidride carbonica, e liberando energia sotto forma di luce e calore 1 .
O2 ossigeno C carbonio +
CO2 anidride carbonica
anidridecarbonica CO2
1 Rappresentazione grafica della reazione di combustione.
+ energia
Tutte le sostanze che contengono carbonio come la carta, la benzina, il petrolio, il legno, il carbone, il metano sono chiamate combustibili perché, quando bruciano, reagiscono con l’ossigeno, il comburente, generando energia. Come abbiamo visto, la materia è formata da atomi che si legano tra loro, grazie agli elettroni posti sul guscio elettronico più esterno, formando dei legami chimici. Le molecole, a loro volta, forniscono una particolare struttura alla materia a causa dei diversi tipi di forze, di natura elettrica, che agiscono tra le stesse molecole.
U04F??2
L’energia legata alla posizione dei nuclei, degli elettroni, degli atomi e delle molecole si chiama energia potenziale chimica.
Le reazioni chimiche modificano questa situazione energetica: la differenza tra l’energia necessaria per rompere i legami dei reagenti e quella necessaria per creare i legami nei prodotti è liberata all’esterno del sistema.
Per esempio, nel caso della combustione di carbone e petrolio, l’energia solare accumulata negli organismi morti che, in milioni di anni, si sono trasformati in combustibili fossili, è in eccesso rispetto a quella che serve per innescare la reazione chimica tra il carbonio e l’ossigeno; pertanto, si libera nell’ambiente.
La reazione tra un metallo o un non metallo con l’ossigeno porta alla formazione di composti chiamati genericamente ossidi. I chimici li distinguono in ossidi basici e ossidi acidi.
2 Gli ossidi basici o ossidi
Il carbonio è un non metallo, ma anche i metalli reagiscono con l’ossigeno: per esempio un oggetto di ferro (che è un metallo) esposto all’aria per un certo tempo arrugginisce, cioè cambia colore diventando rossastro 2
Quando un metallo reagisce con l’ossigeno si forma un composto chiamato ossido basico o più comunemente ossido. metallo + ossigeno ossido basico o ossido
L’equazione che descrive la reazione tra il ferro e l’ossigeno è:
4Fe + 3O2
2Fe2O3 ferro ossigeno ossido di ferro
Al termine della reazione si forma un ossido di ferro, il principale componente della ruggine.
2 La ruggine è un composto che si forma grazie alla reazione tra il ferro e l’ossigeno.

SKILL BOOK
COMPITO DI REALTÀ ANDIAMO IN LABORATORIO!
3 La molecola di
3 Gli ossidi acidi o anidridi
Abbiamo visto che il carbonio contenuto nei combustibili si combina con l’ossigeno e produce anidride carbonica: questo comportamento non è esclusivo del carbonio, ma avviene con tutti i non metalli.
Quando un non metallo reagisce con l’ossigeno si forma un composto chiamato ossido acido o anidride
non metallo + ossigeno ossido acido o anidride
Fino a non molto tempo fa era comune usare il termine anidride, ma attualmente è preferibile usare la dicitura ossido. Per esempio, il composto CO2 nel linguaggio corrente è chiamato anidride carbonica o biossido di carbonio, ma il nome corretto è diossido di carbonio 3
Il diossido di carbonio che si libera da tutte le combustioni non è di per sé un gas dannoso per gli animali o per gli esseri umani che lo respirano, mentre è fondamentale per la fotosintesi compiuta dalle piante.
Il vero pericolo per l’ambiente è rappresentato, invece, dall’imponente aumento delle emissioni di CO2 degli impianti industriali, dei motori degli autoveicoli e degli aerei e degli impianti di riscaldamento delle abitazioni.
4 La formazione degli ossidi acidi.

A peggiorare la situazione si aggiunge la massiccia deforestazione compiuta su vaste aree del pianeta, che ha ridotto il numero delle specie vegetali in grado di regolare le quantità di diossido di carbonio presente in atmosfera.
no n n m metallo os ossigeno eno

La figura 4 riassume la formazione degli ossidi acidi o anidridi. U04F??2
o oss do bas co o ossiddo aciido (a ( nidr d idde) an e)


Un pericoloso gas prodotto dalla combustione è, invece, il monossido di carbonio, CO, un gas che si origina quando il carbonio reagisce con una quantità insufficiente di ossigeno. A causa delle sue caratteristiche, è un gas incolore, inodore e insapore, può raggiungere elevate concentrazioni negli ambienti chiusi senza che se ne percepisca la presenza, e risultare mortale una volta inalato. Per queste ragioni si consiglia di controllare periodicamente gli impianti di riscaldamento, di installare caldaie di ultima generazione e di evitare di riscaldare gli ambienti con camini a combustibili vegetali, a meno che rispettino norme molto precise.
Ma la calce che si usa per i muri è pericolosa?
Se ci metto le mani sopra, mi brucio?
SCIENZA
No, la calce che serve per intonacare i muri non è pericolosa perché è già stata trattata per trasformarla da “calce viva” in “calce spenta”. È l’ossido di calcio CaO, la “calce viva”, a essere molto pericoloso perché può provocare ustioni e profonde ulcerazioni; per questa ragione deve essere maneggiata con molta cautela, usando tutti i dispositivi di protezione individuale. Per essere utilizzato CaO deve essere trasformato in idrossido di calcio Ca(OH)2 o “calce spenta” facendolo reagire con l’acqua, operazione che provoca un violento rilascio di calore. La calce è una sostanza che ha molti impieghi: in edilizia come legante delle malte, nel restauro di edifici storici, in agricoltura come correttore dell’acidità dei terreni e disinfezione dei tronchi degli alberi, nell’industria per la produzione di vetro e acciaio.

diossido di carbonio.
4 Le basi
Quando un ossido basico reagisce con l’acqua si forma un composto chiamato base o idrossido
ossido + acqua
base o idrossido
Gli idrossidi sono composti formati da tre elementi: un metallo, ossigeno e idrogeno. L’ossido di magnesio, per esempio, reagisce con l’acqua e forma l’idrossido di magnesio:
MgO + H2O Mg(OH)2 ossido idrossido di magnesio acqua di magnesio
La caratteristica fondamentale di quasi tutte le basi è quella di possedere il gruppo OH–(gruppo ossidrile) che si comporta come uno ione negativo con carica –1. Quando vengono sciolte in acqua, le basi liberano il gruppo OH– e uno ione metallico positivo. Alcune sostanze si comportano come delle basi, anche se non possiedono gruppi OH–. Per esempio, l’ammoniaca (NH3) reagisce con l’acqua e produce un gruppo ossidrile secondo questa reazione:
NH3 + H2O NH4 + OH–
Tutte le basi hanno un sapore amaro (non assaggiarle mai, sono tossiche!), sono viscide al tatto, a contatto con l’acqua si dissociano in ioni OH– (cioè liberano ioni).
Le basi deboli evidenziano queste proprietà in modo blando, le basi forti invece in modo marcato.
La figura 5 riassume la formazione degli ossidi basici e degli idrossidi.
FISSA I CONTENUTI
ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).

5 La formazione degli ossidi basici e delle basi.




1. L’ossidazione è una reazione che avviene solo tra i non metalli e l’ossigeno.
2. Nel corso di una combustione si libera anidride carbonica.
3. Le basi si chiamano anche idrossidi.
4. Una base sciolta in acqua libera uno ione metallico positivo.
VERSO LE COMPETENZE
Osserva le immagini e scrivi le reazioni chimiche rappresentate. a. b.


ACIDI E SALI lezione 2
LAB STEM
UNA BELLA BIBITA FRIZZANTE
Siamo ormai abituati a scegliere bibite sempre diverse sugli scaffali del supermercato e preferiamo quelle frizzanti, anche se non sono proprio salutari. Con pochi ingredienti si possono “fabbricare” bibite gustose e stupire gli amici con una varietà di colori e tante bollicine.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• una brocca
• acqua
• colorante alimentare (facoltativo)

• zucchero a velo
• bicarbonato di sodio NaHCO3
• succo di limone
• cucchiaio e cucchiaino




1 La formazione degli ossiacidi.

PROCEDIMENTO
1. Metti nella brocca l’acqua, un paio di cucchiai di zucchero a velo, qualche goccia di colorante alimentare e mescola bene.
2. Aggiungi ora due cucchiai di bicarbonato di sodio e fallo sciogliere.
3. Aggiungi 6 cucchiaini di succo di limone fresco.
■ OSSERVA E RISPONDI
1. Osservi qualcosa nell’acqua quando aggiungi il sale bicarbonato di sodio?
2. Assaggia la bibita: che sapore ha?
3. Osservi qualcosa nell’acqua quando aggiungi il succo di limone?
4. Come è cambiata la bibita quando l’assaggi?
5. Quale potrebbe essere la composizione del gas che vedi sotto forma di bollicine?
6. Scrivi la relazione dell’esperimento.
1
Gli acidi
L’acqua è un composto molto abbondante sul nostro pianeta, presente in tutti gli stati fisici. Questa è la ragione per cui l’acqua, H2O, partecipa attivamente come reagente in moltissime reazioni chimiche che avvengono sia nell’ambiente non vivente – acqua, rocce, suolo, atmosfera – sia nei viventi.
o oss do bas co o ossiddo aciido (a ( nidr d idde) an e) a acqua q

+ oss d do basicoosssiacido s (oss o)(acidoo)

Un ossiacido, o acido, è un composto ottenuto dalla reazione di un ossido acido con l’acqua.
ossido acido + acqua ossiacido
Gli ossiacidi sono una classe di acidi formati da tre elementi: idrogeno, un non metallo e ossigeno 1
Per esempio, il diossido di carbonio reagisce con l’acqua e forma l’acido carbonico, presente in tutte le bibite gasate.
CO2 + H2O H2CO3 diossido di carbonio acqua acido carbonico
Alcuni non metalli, come zolfo (S), cloro (Cl), bromo (Br), iodio (I) e fluoro (F), reagiscono solo con l’idrogeno formando gli idracidi 2 . Gli idracidi sono un’altra classe di acidi, che non contengono ossigeno.

n non m metaallo n ossiggeno en o i
2 La formazione degli idracidi.

non metallo idrogeno idracido

n non m metaallo n

L’acido cloridrico si forma quando l’idrogeno reagisce con il cloro.
o ossido basico o ossiddo aciido (a ( nidr d idde) an e)

a acqua qu
Cl2 2HCl idrogeno cloro acido cloridrico

La caratteristica comune a tutti gli acidi è quella di possedere il gruppo H+, chiamato ione idrogeno, uno ione positivo con carica +1. Quando vengono sciolti in acqua, gli acidi liberano lo ione H
Per esempio, l’acido cloridrico posto in acqua si dissocia secondo la reazione:
HCl + H2O H+ + Cl–
Tutti gli acidi hanno un sapore aspro (simile a quello del limone), sono corrosivi, attaccano i metalli; sono pericolosi o irritanti se vengono a contatto con pelle

ba b se idroogeno ogen i
a acido

Si definiscono acidi forti quelli che evidenziano in modo marcato le caratteri stiche degli acidi, come per esempio l’acido muriatico, un prodotto per la casa utilizzato per eliminare le incrostazioni di calcare dai sanitari 3

a acqua qu s sale

Il prodotto in vendita è, in realtà, una soluzione di acqua e HCl al 10%: si trat ta, tuttavia, di un acido corrosivo per la pelle, gli occhi e le mucose respira torie, da maneggiare solo con la protezione di guanti, evitando di inalarne i vapori.
Molti dei prodotti per la pulizia, che usiamo quotidianamente, sono sostan ze acide. Ricorda di leggere sempre con attenzione quanto riportato sulle etichette, soprattutto come usare correttamente il prodotto, per esempio proteggendo le mani con guanti di gomma, e come intervenire in caso di ingestione o contatto con gli occhi.
Si definiscono acidi deboli quelli che, al contrario, manifestano in maniera blanda le caratteristiche degli acidi, come per esempio l’acido citrico contenuto nel limone e in tutti gli agrumi 4
Da non sottovalutare, tuttavia, è la concentrazione di ioni H+ che può essere presente in una soluzione, anche nel caso di un acido debole. Per esempio, un acido debole usato in cucina è l’acido acetico contenuto nell’aceto: è gradevole quando usato per condire l’insalata, ma, quando è molto concentrato, emana vapori corrosivi dall’odore molto pungente. + + + + + oss d do basicoosssiacido s id (oss o)(acidoo)


iddra r cido (acidoo)

3 L’acido muriatico è un acido forte.

4 L’acido citrico è un acido debole.
Cucchiaini.ai
LAB STEAM
FABBRICHIAMO I CRISTALLI
SKILL BOOK
5 Foglie danneggiate dalle pioggie acide.
Tra le sostanze contenute nelle emissioni dei processi industriali, degli impianti di riscaldamento e dei motori dei veicoli, alcune, come l’anidride solforosa (SO2), gli ossidi di azoto e gli ossidi di carbonio, si combinano con l’acqua contenuta nell’atmosfera trasformandosi in acido solforico, H2SO4, acido nitrico, HNO3,e acido carbonico, H2CO3 Queste sostanze, mescolandosi alle precipitazioni, le rendono acide e causano gravi danni all’ambiente, agli edifici e alla salute. Per esempio, danneggiano la vegetazione perché corrodono le foglie, impedendo la fotosintesi; modificano l’acidità delle acque superficiali e di quelle sotterranee; corrodono le rocce di cui sono fatti i monumenti, in particolare il marmo, e i manufatti in ferro; possono danneggiare l’apparato respiratorio. Il fenomeno delle ”piogge acide” è stato particolarmente avvertito nelle regioni industriali del nord Europa, dove le foreste di conifere sono state profondamente danneggiate 5 .

2 I sali
I sali sono costituenti importanti del sistema Terra: molte rocce della litosfera sono formate da minerali composti da sali, come per esempio la calcite e il salgemma.
Un sale è un composto ottenuto dalla reazione di un acido con una base, con formazione di acqua.
6 La formazione di un sale.



acido + base sale + acqua

I sali sono composti ionici e, sciolti in acqua, si dissociano completamente in ioni positivi e ioni negativi: facendo reagire un acido e una base avviene una reazione tra gli ioni H+ liberati dell’acido e quelli OH- della base. Questa reazione è chiamata reazione di neutralizzazione, in quanto l’acido e la base si neutralizzano a vicenda perdendo ciascuno le proprie caratteristiche 6
Se si neutralizza un acido debole si ottiene un sale basico, se si neutralizza un acido forte si ottiene un sale acido. I sali sono composti molto diffusi in natura, sia nelle composizioni delle rocce sia in quella delle parti dure degli organismi, come ossa, gusci e corazze.
L’idrogenocarbonato di sodio, più noto come bicarbonato di sodio, NaHCO3, è il prodotto della salificazione di un solo ione H+ dell’acido carbonico, H2CO3, sostituito da uno ione Na+. Si tratta di un prodotto che ha moltissimi utilizzi in cucina, sia per la cottura e la preparazione di alcuni cibi, sia per la pulizia e l’igiene di ambienti e strumenti.

Un sale acido molto diffuso in natura è l’idrogenocarbonato di calcio, comunemente denominato bicarbonato di calcio, Ca(HCO3)2, prodotto della dissoluzione del carbonato di calcio, CaCO3, il principale componente delle rocce calcaree.

FISSA I CONTENUTI ESSENZIALI
Sottolinea il termine corretto tra i due proposti.
1. Idrogeno, non metallo e ossigeno formano un idracido/ossiacido
2. Gli acidi possiedono uno ione idrogeno/metallico.
I coralli e i gusci di conchiglie e ricci di mare sono costituiti da carbonato di calcio, CaCO3 e solfato di calcio, CaSO4

3. I sali si ottengono mediante una reazione di sostituzione/neutralizzazione.
4. L’acido citrico è un acido debole/forte.
VERSO LE COMPETENZE STEM
Esegui l’esperimento.

ATTENZIONE! Questo esperimento va realizzato in laboratorio seguendo le norme di sicurezza in quanto si impiegano sostanze potenzialmente pericolose.
Materiali
• idrossido di sodio al 4% • contenitore
• acido cloridrico al 10% • due provette uguali
Esecuzione
1. Metti nel contenitore uguali quantità di idrossido di sodio e acido cloridrico.
2. Lascia riposare per 10 minuti il liquido ottenuto.
Osserva e rispondi.
1. Che cosa osservi all’interno del contenitore?
2. Quale reazione è avvenuta?
VISUAL

di Architetturesale
Molte rocce della litosfera sono formate da minerali composti da sali, come il carbonato di calcio e il salgemma. Anche negli organismi i sali, presenti in diverse quantità, svolgono importanti funzioni.
SALI NELLE ROCCE
Il minerale calcite, che forma le rocce calcaree, è composto da carbonato di calcio, CaCO3 Di calcite sono fatte le stalattiti e le stalagmiti che si formano all’interno delle grotte, ma anche le spettacolari scogliere di Dover, in Inghilterra.
Il minerale dolomite che forma la roccia dolomia, è composto da un sale doppio, il carbonato di calcio e magnesio, MgCa(CO3)2. Le straordinarie forme delle Dolomiti, dovute proprio alla composizione delle loro rocce, creano paesaggi insoliti e spettacoli indimenticabili.


Grotta del Miracolo, Baunei (Sardegna).
Tre Cime di Lavaredo, Dolomiti.

SALI NELL’ACQUA
Il salgemma è un minerale composto da cloruro di sodio, NaCl. Le miniere di salgemma sono sfruttate per l’estrazione del sale, ma anche come luoghi di cura per molte malattie, specialmente dell’apparato respiratorio. Quando l’acqua marina evapora, i sali che sono in soluzione cominciano a precipitare: i primi a cristallizzare sono il carbonato di calcio, CaCO3 e il solfato di calcio, CaSO4. In seguito, quando la quantità di acqua si è ridotta, si deposita NaCl sotto forma di piccoli cristalli bianchi. Questo processo avviene nelle saline ed è alla base della produzione del sale da cucina.
SALI NEGLI ORGANISMI
Gusci e conchiglie sono formati per lo più da carbonato di calcio; le ossa dello scheletro e lo smalto dei denti, invece, sono formati da fosfato di calcio e da idrossiapatite, Ca5(PO4)3OH, un minerale molto duro e resistente. Quello che viene comunemente chiamato “corallo” è l’impalcatura scheletrica prodotta da molte specie di coralli, composta da carbonato di calcio, idrossiapatite e solfato di calcio. Il colore rosso che rende prezioso il corallo è dovuto alla presenza di ossido di ferro.



Saline di Mozia (Sicilia).
Soluzioni acide, basiche e neutre lezione 3
LAB STEM
REALIZZIAMO UN INDICATORE DI ACIDITÀ E BASICITÀ
Per verificare l’acidità o la basicità di una sostanza o di una soluzione, esistono degli strumenti appositi, ma in natura puoi trovare sostanze che funzionano ottimamente come indicatori.
Per esempio, avrai notato che il tè schiarisce quando aggiungi il limone, quindi si comporta come un indicatore naturale di acidità. Prova ora a realizzare un altro indicatore a base di foglie di cavolo rosso.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• foglie di cavolo rosso
• mortaio e pestello
• alcol a 95°
• carta da filtro
• garze
• una ciotola

• un barattolo con coperchio
• forbici


• un cucchiaino di limone, uno di acqua e uno di sapone liquido
PROCEDIMENTO





1. Nel mortaio pesta le foglie di cavolo rosso.
2. Aggiungi un po’ di alcol e continua a pestare fino a ottenere una poltiglia.
3. Filtra la poltiglia con la garza e raccogli il liquido nella ciotola.
4. Immergi la carta da filtro nella ciotola e fai assorbire il liquido.
5. Fai asciugare la carta su una superficie piana.
6. Tagliala a striscioline e inseriscile nel barattolo.
7. Prova a immergere tre striscioline rispettivamente nel succo di limone, nell’acqua e nel sapone liquido.
■ OSSERVA E RISPONDI
1. Che cosa osservi quando immergi le striscioline nei tre diversi liquidi?
2. Fai un’ipotesi sul motivo di questo comportamento.
3. Scrivi la relazione dell’esperimento.
1 Miscugli particolari: le soluzioni
Nei miscugli, uno dei componenti può essere l’acqua. Quando versi della sabbia in un recipiente con dell’acqua, il liquido diventa torbido; dopo poco tempo la sabbia si deposita sul fondo e l’acqua ritorna limpida. Invece, se mescoli dello zucchero con l’acqua, osservi che i cristalli si sciolgono e non è più possibile distinguere i due componenti: semplicemente l’acqua è diventata dolce. Anche quando versi del vino nell’acqua, i due liquidi si mescolano e non è più possibile vedere i due componenti: hai ottenuto un li quido uniforme e omogeneo in tutte le sue parti.
Una soluzione è un miscuglio omogeneo formato da due o più sostanze: il componente presente in quantità maggiore si chiama solvente, mentre l’altro (o gli altri) si chiama soluto
Nell’acqua zuccherata, per esempio, l’acqua è il solvente e lo zucchero è il so luto. Le soluzioni in cui il solvente è l’acqua sono chiamate soluzioni acquose
1 L’acciaio è una lega metallica costituita da ferro e carbonio.

A seconda dello stato di aggregazione del solvente, le soluzioni possono essere liquide, come per esempio l’acqua del mare; gassose, come l’aria che respiriamo; solide, come una lega metallica, per esempio l’acciaio 1 . Un soluto può essere a sua volta solido, come lo zucchero e il sale; liquido, come l’alcol nelle bevande alcoliche; gassoso, come l’anidride carbonica contenuta in una bevanda gassata.
2 La solubilità
Quando una soluzione contiene poco soluto rispetto al solvente si dice che è diluita; invece, se la quantità di soluto disciolto è abbondante, la soluzione è concentrata
La quantità di soluto che si può sciogliere in un certo volume di solvente non è infinita: se in una soluzione di acqua e zucchero continui ad aggiungere zucchero, a un certo punto l’acqua non sarà più in grado di scioglierlo ed esso si depositerà sul fondo. Quando si verifica questa situazione si dice che la soluzione è satura e il soluto (in questo caso lo zucchero), che non si è sciolto, costituisce il corpo di fondo 2
In una soluzione esiste un indicatore, la concentrazione, che fornisce informazioni sulla quantità di soluto presente. La concentrazione può essere espressa:
• in grammi di soluto sciolti in un litro di soluzione:
concentrazione = grammi di soluto litro di soluzione
• in percentuale, facendo riferimento ai grammi di soluto sciolti in 100 g di soluzione:
concentrazione % = grammi di soluto × 100 grammi di soluzione
Per esempio, in 2 litri di acqua si sciolgono 70 g di sale da cucina. Se consideri che 1 litro d’acqua ha massa 1 kg e che 1 kg = 1000 g, la massa totale della soluzione è:
70 g (sale) + 2000 g (acqua) = 2070 g (soluzione)
La concentrazione della soluzione è: 70 × 100 = 3,38% 2070
2 Il corpo di fondo di una soluzione satura.

SKILL BOOK
LAB STEM
SOLUZIONE O SOSTANZA PURA?
3 Depositi salini lungo le coste del Mar Morto.

Non tutte le sostanze si sciolgono allo stesso modo in un certo solvente. Per esempio, in 100 g di acqua si possono sciogliere ben 204 g di zucchero, ma solo 36 g di sale: quindi lo zucchero si scioglie più del sale.
Si chiama solubilità la capacità di una certa sostanza di sciogliersi in un dato solvente.
La solubilità si esprime in grammi di soluto che possono essere sciolti in 100 g di solvente oppure in grammi di soluto per litro di soluzione.
solubilità = grammi di soluto / 100 grammi di solvente
La solubilità è legata anche alla temperatura: in una soluzione in cui il solvente è liquido e il soluto è solido, come acqua e zucchero o acqua e sale, la solubilità aumenta con la temperatura. Un esempio sono le acque del Mar Morto, che occupa una depressione in una regione molto calda del Vicino Oriente. Le sue acque hanno una salinità molto elevata, tanto che verso i 100 metri di profondità i sali non si sciolgono più nell’acqua e formano dei depositi sulla costa 3 . Nelle soluzioni di gas in liquidi, invece, la solubilità diminuisce con l’aumentare della temperatura.
3 L’acidità e la basicità delle soluzioni

4 I valori più bassi di pH corrispondono agli acidi più forti. I valori più alti di pH corrispondono alle basi più forti.
Quando un acido o una base vengono messi in acqua, liberano ioni H+ o ioni OH–. La quantità di ioni H+ e ioni OH– che la sostanza libera in acqua determina l’acidità o la basicità della sostanza o della soluzione:
• una soluzione acida contiene una concentrazione maggiore di ioni H+ e minore di ioni OH–;
• una soluzione basica contiene una concentrazione maggiore di ioni OH– e minore di ioni H+;
• una soluzione neutra contiene una uguale concentrazione di ioni H+ e ioni OH–
La grandezza che misura l’acidità di una soluzione si chiama pH (si legge “pi-acca”). Essa si basa sulla concentrazione di ioni H+ presenti nella soluzione.
La scala di valori del pH va da 0 a 14. I valori inferiori a 7 corrispondono a soluzioni acide, quelli superiori a soluzioni basiche; quando il valore di pH è 7 significa che la sostanza è neutra, cioè non è né acida né basica (per esempio l’acqua distillata) 4
Scopriamo il pH di alcune sostanze
4
Gli indicatori
Per stabilire se una soluzione è acida, basica o neutra, i chimici utilizzano particolari sostanze, gli indicatori di pH
Gli indicatori di pH sono sostanze che hanno la proprietà di cambiare colore secondo il pH della soluzione con cui vengono a contatto.
Gli indicatori sono spesso di origine naturale, come le foglie di cavolo rosso, il succo delle rape rosse e i petali di rose, iris, petunie, gerani. L’indicatore più usato dai chimici è il tornasole, una sostanza che si ricava da un lichene e con cui si impregnano particolari cartine, le cartine al tornasole
5 : tendono ai toni del rosso in presenza di un acido, blu in presenza di una base. Inoltre, l’intensità del colore indica la forza dell’acido o della base: più intensi sono il rosso o il blu più forti sono l’acido o la base.
Per misurare il pH in modo preciso e immediato oggi si usa il piaccametro elettronico che è costituito da una sonda che viene immersa nella soluzione e da un display che riporta il valore di pH rilevato.
FISSA I CONTENUTI
ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. Lo zucchero sciolto in acqua è il soluto.
2. Una soluzione può essere anche solida.
5 La cartina tornasole si colora di rosso se è appoggiata al succo acido di un limone.

3. Il corpo di fondo è il solvente in eccesso in una soluzione satura.
4. La solubilità di una sostanza non dipende dalla temperatura.
5. Una soluzione con pH = 7 è neutra.
VERSO LE COMPETENZE STEM
Esegui l’esperimento.
Materiali
• un foglio di carta da cucina piuttosto spessa
• piccole quantità di vino rosso, aceto e acqua saponata
Esecuzione
1. Versa una goccia di vino sulla carta da cucina e fai cadere alcune gocce di aceto su un angolo della macchia.
2. Versa qualche goccia di acqua e sapone in un altro punto del foglio di carta e fai cadere sulla macchia qualche goccia di aceto.
Osserva e rispondi alle domande.
1. Che colore assume il vino quando reagisce con l’aceto?
2. Che colore assume la soluzione di acqua e sapone?
3. Che tipo di considerazioni puoi fare sull’acidità di aceto e sapone?
I composti organici e le biomolecole lezione 4
CARTA PENNA COMPUTER
Guarda il video e scrivi le risposte sul quaderno.
1. Che cosa sono i gruppi funzionali?
2. Perché sono importanti in chimica organica?
3. Qual è il gruppo funzionale che caratterizza gli alcoli?

Il mondo dei composti organici
1 Disposizione degli elettroni nel carbonio.

4. Quale atomo è presente nelle ammine e nelle ammidi?
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.

5. Indica i gruppi funzionali contenuti nelle molecole organiche presenti in ciascun cibo.


1 I composti del carbonio
L’olio per cucinare, gli alimenti, la lana del maglione, la carta, le cellule che formano il nostro corpo e quello di tutti gli organismi sono costituiti da una straordinaria varietà di sostanze organiche. Tutte queste sostanze hanno in comune il fatto che contengono atomi di carbonio (C).
Il settore della chimica che studia i composti contenenti carbonio è la chimica organica. La chimica inorganica invece si occupa di tutti gli altri elementi della tavola periodica.
Come possono esistere tante sostanze organiche così diverse? Tutto dipende dalle particolari caratteristiche dell’atomo di carbonio:
• l’atomo di carbonio appartiene al gruppo 14 e al periodo 2 della tavola periodica;
• il carbonio ha numero atomico Z = 6: possiede 6 elettroni, dei quali 4 sono posti nel guscio elettronico più esterno 1 ;
• per raggiungere la configurazione stabile di 8 elettroni nel guscio esterno, il carbonio può legarsi fino ad altri 4 atomi.
Un atomo di carbonio può legarsi ad altri atomi di carbonio mediante legami covalenti semplici, doppi o tripli. Si formano così strutture a catena, strutture ramificate o strutture chiuse ad anello, anche molto complesse.
I composti organici sono costituiti da atomi di carbonio ai quali si uniscono pochi altri elementi chimici: ossigeno, idrogeno, azoto, zolfo, fosforo, cloro, ferro e magnesio. In natura già esiste una varietà quasi infinita di composti organici; altri possono essere sintetizzati in laboratorio o nelle industrie chimiche per fabbricare materie plastiche, detersivi, coloranti, farmaci e altro. Questi composti possono essere divisi in due grandi gruppi:
• gli idrocarburi, nei quali il carbonio si lega solo ad atomi di idrogeno;
• le biomolecole, cioè i composti organici presenti nella struttura della materia vivente, che partecipano ai processi vitali degli organismi e che formano il nostro corpo.
2 Gli idrocarburi
Gli idrocarburi sono i composti organici più semplici, poiché contengono solo atomi di carbonio e idrogeno. Lo “scheletro” degli idrocarburi è costituito da una catena di atomi di carbonio che può essere aperta o chiusa ad anello.
Il più semplice è il metano, un idrocarburo che si forma dalla lenta decomposizione di resti di organismi e che ha formula CH4. La molecola del metano è costituita da un atomo di carbonio posto al centro di un tetraedro ai cui vertici si legano 4 atomi di idrogeno 2
Gli idrocarburi sono classificati in tre famiglie principali: alcani, alcheni e alchini.
• Gli alcani contengono solo legami covalenti singoli C C, come l’etano 3 e il metano. Gli alcani sono anche chiamati idrocarburi saturi perché gli atomi di carbonio sono sempre legati ad altri quattro atomi.
• Gli alcheni contengono almeno un legame covalente doppio C = C. Un esempio di alchene è l’etilene 4
• Gli alchini contengono un triplo legame covalente C ≡ C. Un esempio di alchino è l’acetilene 5
Alcheni e alchini sono chiamati idrocarburi insaturi.
Gli idrocarburi aromatici sono caratterizzati dalla catena di atomi di carbonio chiusa ad anello. L’idrocarburo aromatico più semplice è il benzene: è una sostanza molto volatile che ha odore simile a quello della vernice fresca 6 .
Gli idrocarburi aromatici sono molto pericolosi per la salute umana: oltre a essere estremamente infiammabili, è stata da tempo accertata l’azione cancerogena di molti di essi. Tra gli idrocarburi aromatici più pericolosi c’è il benzopirene, contenuto nei gas di scarico delle auto e nel fumo delle sigarette.
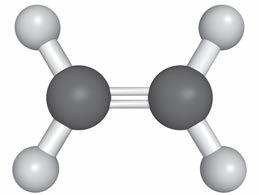
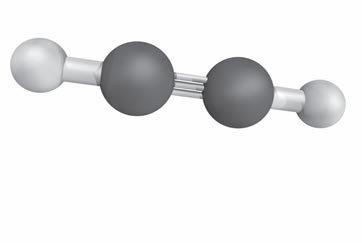
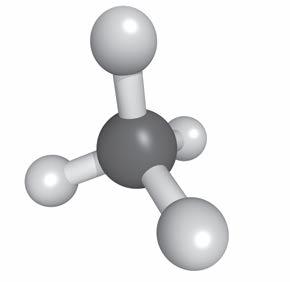
3 Etano.
4 Etilene.
Acetilene.
7 La frutta è ricca di carboidrati.

Tutti gli idrocarburi aromatici si ottengono dal petrolio. Il petrolio è un liquido oleoso, infiammabile e di colore generalmente scuro, composto da una miscela di idrocarburi che si sono formati per decomposizione di microrganismi marini.
Il petrolio è un’importante materia prima alla base della produzione della maggior parte delle sostanze sintetiche che usiamo ogni giorno; è una risorsa naturale così importante da essere chiamato “oro nero”. È anche una fonte energetica non rinnovabile a causa del lunghissimo tempo richiesto per la sua formazione.
3 Le biomolecole
Le biomolecole costituiscono un gruppo molto ampio di composti organici che svolgono un ruolo fondamentale negli organismi; sono i costituenti delle cellule e partecipano alle reazioni chimiche del loro metabolismo. Sono biomolecole composti come i carboidrati, i lipidi, le proteine e gli acidi nucleici.
8 L’olio di oliva è un lipide.

• I carboidrati, chiamati anche zuccheri o glucidi, sono formati da tre tipi di atomi: carbonio, idrogeno e ossigeno, e per questo vengono detti composti ternari.
I carboidrati si trovano negli alimenti, per esempio nella frutta 7 , nel latte e nella farina, e in numerose altre sostanze sotto forma di cellulosa, il composto che forma il legno, la carta e il cartone.
• I lipidi, o grassi, sono formati soltanto da atomi di carbonio, idrogeno e ossigeno, quindi sono composti ternari come i carboidrati. I lipidi più diffusi in natura sono i trigliceridi, così chiamati perché formati da 3 molecole di acidi grassi legate a 1 molecola di glicerina. Possono essere liquidi, come gli oli 8 , oppure solidi in relazione alla presenza di doppi legami nelle molecole di acidi grassi. I lipidi costituiscono un’importante riserva energetica per tutti gli organismi.
9 Il pesce fornisce molti amminoacidi essenziali.

• Le proteine sono composti quaternari, perché contengono atomi di carbonio, idrogeno, ossigeno e azoto, ma a volte anche atomi di zolfo, fosforo e magnesio. Sono formate dall’unione di composti più semplici, gli amminoacidi. Venti di questi amminoacidi sono detti essenziali, perché non possono essere sintetizzati dall’organismo, ma devono essere introdotti con l’alimentazione. La maggior parte delle proteine ha funzione plastica e di sostegno e costituisce i tessuti degli organismi 9 .
• Gli acidi nucleici devono il loro nome al fatto di contenere un acido (acido fosforico) e di essere presenti nel nucleo delle cellule. Comprendono l’acido desossiribonucleico (DNA) e l’acido ribonucleico (RNA).
4 Le classi dei composti organici
La famiglia dei composti organici è davvero numerosa! Come è possibile classificarli tutti? Il miglior modo per identificare un composto organico è riconoscere il suo gruppo funzionale, cioè un atomo o un gruppo di atomi che caratterizza le sue molecole. Sulla base dei gruppi
funzionali, i composti organici sono raggruppati in classi. Le classi principali sono alcoli, aldeidi, chetoni, acidi carbossilici, ammine, ammidi ed esteri.
• Il gruppo funzionale ossidrile, –OH, è caratteristico degli alcoli.
• Il gruppo funzionale carbonile, C=O, è caratteristico delle aldeidi e dei chetoni 10
• Il gruppo funzionale carbossilico, –COOH, è caratteristico degli acidi carbossilici
• I composti organici azotati sono caratterizzati da gruppi funzionali che contengono azoto. Sono composti azotati le ammine e le ammidi.
10 La cannella è un aldeide.

Esistono dei composti organici che si ottengono per reazione tra gruppi funzionali di sostanze diverse.
Questa reazione è chiamata condensazione e comporta sempre l’eliminazione di una molecola d’acqua.
L’esterificazione è un esempio di reazione di condensazione che avviene tra un acido carbossilico e un alcol e che ha come prodotto un estere 11 . Il gruppo funzionale degli esteri è –CO–O.
La reazione inversa della condensazione è l’idrolisi, cioè la rottura di una molecola per mezzo dell’acqua.
FISSA I CONTENUTI ESSENZIALI
Sottolinea il termine corretto tra i due proposti.
1. Il legame tipico del carbonio è il legame ionico/covalente.
2. Gli atomi di carbonio possono/non possono legarsi tra loro.
3. Gli alcheni/alcani sono idrocarburi saturi.
4. DNA e RNA contengono acido fosforico/acido carbonico
11 Il profumo intenso del fiore di gelsomino è prodotto da un estere.

5. Il gruppo funzionale carbonile/ossidrile è caratteristico degli alcoli.
6. Gli esteri/Le aldeidi danno il caratteristico odore di mele mature.
VERSO LE COMPETENZE
La saponificazione è una reazione di idrolisi che provoca la rottura di molecole di trigliceridi e la formazione di sali degli acidi grassi, chiamati comunemente saponi. Quando il sapone si unisce all’acqua si formano delle micelle, aggregati di molecole formati da una testa, che si lega all’acqua, e dalle code, che avvolgono le particelle di sporco. Di qui il potere pulente di acqua e sapone.
Osserva le immagini e scrivi le tre didascalie di commento.






EDUCAZIONE CIVICA
LA CHIMICA QUOTIDIANA
CARTA PENNA COMPUTER

Dove lo butto?
1 Molti degli oggetti con cui veniamo a contatto nella vita quotidiana sono costituiti da materiali prodotti con reazioni chimiche.
Guarda il video e scrivi le risposte sul quaderno.
1. Quali funzioni svolgono gli imballaggi?
2. Perché sono generalmente colorati e decorati?
3. Che cosa sono gli imballaggi poliaccoppiati?
4. Che cos’è il Tetra Pak?
5. Come vanno smaltiti gli imballaggi poliaccoppiati?
Metti in pausa il video nei seguenti punti.



6. Scrivi per ciascun simbolo una didascalia che indichi a quale materiale si riferisce e qual è la sua composizione.
1 C’è chimica intorno a noi!
Ogni oggetto che ci circonda è costituito da elementi chimici che, unendosi e reagendo tra loro, creano i materiali con cui veniamo a contatto tutti i giorni.
La chimica è parte della nostra vita quotidiana, al punto che spesso finiamo per dimenticarcene 1






ORA FERMA L’IMMAGINE!
2
Il vetro
Il vetro è un materiale con caratteristiche particolari: è trasparente e impermeabile, è duro e allo stesso tempo fragile, trasmette il calore ma è anche un ottimo isolante elettrico, ed è inerte, cioè non reagisce con la maggior parte delle sostanze chimiche. Queste caratteristiche lo rendono perfetto come materiale da costruzione (in particolare per le finestre), per fabbricare contenitori per alimenti (come ciotole, bottiglie e bic chieri) e per realizzare oggetti decorativi.
Il vetro si ottiene dalla solidificazione della silice, un ossido del silicio, la sostanza che compone la sabbia: una volta fuso, il miscuglio di silice diventa un liquido piuttosto denso, che può essere lavorato con facilità. Il colore del vetro è bian co trasparente, ma può assumere anche altri colori aggiungendo al miscuglio iniziale particolari sostanze 2
Da un punto di vista ecologico il vetro è un materiale che può essere riutilizzato infinite volte. Tramite la raccolta differenziata il vetro è portato in vetreria, dove viene fuso a temperature intorno ai 1500 °C e trasformato in un nuovo prodotto. Dal vetro misto, raccolto senza separarlo in base al colore, non è possibile ottenere vetro riciclato incolore, ma solo vetro verde e marrone.
3 L’alluminio
2 Vetro riciclato di colore verde.

L’alluminio è un metallo leggero ma resistente, che non reagisce facilmente a contatto con altre sostanze, non fa passare la luce e può essere riciclato all’infinito. Per queste sue caratteristiche è un materiale particolarmente adatto per realizzare contenitori per cibi e bevande.
L’alluminio proviene dalla bauxite, un minerale di colore rosso.
Gli oggetti in alluminio provenienti dalla raccolta differenziata, una volta arrivati all’impianto, vengono puliti e inviati alla fonderia. Dopo la fusione si ottiene nuovo alluminio sotto forma di blocchi o di lamine, che sarà utilizzato per nuovi prodotti.
A cosa serve la raccolta differenzata dell’alluminio?
Con l’alluminio di 800 lattine si fabbrica una bicicletta, con 37 una caffettiera e con 3 una montatura per occhiali. Servono 13 barattoli di pomodori pelati per costruire una pentola nuova e con 18 scatolette di tonno si può fare un vassoio.



3 Con la carta da riciclo si produce altra carta per imballaggi, piatti, bicchieri e altro ancora.
4
La carta
La carta si ottiene dalla lavorazione della cellulosa, un polimero naturale che viene estratto dalla polpa del legno. La trasformazione della cellulosa pura in rotoli di carta ha un notevole impatto ambientale, perché l’intero processo produttivo richiede grandi quantità di acqua e di energia e il costante taglio di alberi. Inoltre, il colore originario dei fogli di carta che si ottengono è giallo chiaro e per sbiancarlo vengono usati prodotti chimici che sono molto dannosi per l’ambiente.

È possibile, però, limitare l’impatto ambientale della produzione di nuova carta riciclando la carta già usata 3 . Nelle cartiere un giornale, un quaderno o un cartone vengono ridotti in pezzi, frullati, macerati e trasformati in una pasta da cui poi è ottenuta nuova materia prima. Le tecnologie a nostra disposizione producono carta riciclata di buona qualità, ma a ogni processo di riciclo le fibre di cellulosa progressivamente si accorciano: per questa ragione la carta riciclata è più adatta per usi che non richiedono un’alta qualità, come i cartoni per gli imballaggi.
5 La plastica
Verso la fine dell’Ottocento, i materiali tradizionali come vetro, carta e alluminio sono stati affiancati da nuovi materiali creati in laboratorio. Tra questi è stata realizzata per prima la celluloide, a partire dalla cellulosa, la materia prima dalla quale si ricava la carta. Dopo la celluloide sono state prodotte migliaia di molecole complesse, i polimeri, che sono alla base delle moderne materie plastiche. I polimeri, grazie alla proprietà di essere lavorati facilmente, hanno trovato applicazioni in vari settori per la produzione di imballaggi, fibre tessili, giocattoli e un’infinità di altri oggetti di uso quotidiano. I polimeri sono macromolecole costituite da lunghe catene, nelle quali si ripetono regolarmente unità più piccole, legate fra loro, chiamate monomeri. L’industria chimica produce migliaia di polimeri sintetici che entrano nella composizione delle plastiche. I polimeri di poliaddizione si ottengono per successiva addizione di un monomero a un altro; la reazione è favorita da particolari sostanze che hanno la funzione di attivare il processo.
I polimeri di policondensazione si ottengono attraverso l’unione di monomeri e l’eliminazione di piccole molecole, come acqua, ammoniaca, alcol.
SCIENZA CHE
È vero che lavare troppo spesso in lavatrice vestiti come i pile o i costumi da bagno fa aumentare le microplastiche nel mare?
Quasi tutti i tessuti dei nostri vestiti contengono fibre sintetiche, cioè realizzate con materiali derivati dal petrolio. Numerose ricerche hanno dimostrato che i lavaggi di capi sintetici sono la fonte primaria di inquinamento da microplastiche, in quanto contribuiscono per il 35% al rilascio mondiale di queste particelle. Un carico di lavatrice di 6 kg può rilasciare oltre 700 000 microplastiche! La maggior parte di esse non è catturata dai filtri delle lavatrici, e neppure dagli impianti di trattamento delle acque reflue; di conseguenza, gran parte delle microplastiche rilasciate dai tessuti finisce nei mari e negli oceani e può entrare nella catena alimentare.

La plastica è un polimero sintetico che si ottiene dalla lavorazione del petrolio. È stata studiata fin dai primi anni del Novecento ma si è affermata intorno al 1960 quando ha iniziato a rivoluzionare le nostre abitudini di vita.
Esistono tipi di plastica diversi per resistenza al calore, peso specifico ed elasticità, che permettono di adattarla a scopi diversi.
Le plastiche che utilizziamo ogni giorno sono: il polietilene tereftalato (PET), un polimero di addizione di molecole di etilene, con cui vengono realizzate le bottiglie di plastica; il cloruro di polivinile (PVC), un polimero di policondensazione, impiegato per fabbricare tubi, cavi elettrici e infissi, e il polistirene (PS), un polimero di addizione di molecole di stirene, utilizzato per imballaggi e vaschette per alimenti 4
Tutte le plastiche sono poco biodegradabili: una volta immesse nell’ambiente, sono necessari tempi molto lunghi perché siano trasformate in molecole riutilizzabili dagli organismi viventi. Per esempio, i contenitori in PVC impiegano dai 100 ai 1000 anni per essere degradati, mentre una bottiglia di plastica in PET impiega circa 400 anni. Il paradosso di questa situazione è che viene usata una materia praticamente indistruttibile per oggetti di cui vogliamo liberarci rapidamente.
FISSA
4 Il logo e la sigla presenti sugli oggetti in plastica permettono di riciclarli correttamente.



I CONTENUTI ESSENZIALI
Completa le frasi con i termini corretti. polimeri • inerte • bauxite • cellulosa

1. Il vetro è un materiale perché non reagisce con gran parte delle sostanze chimiche.
2. La è la materia prima per la fabbricazione di carta e cartone.
3. Dal minerale si estrae il metallo alluminio.
VERSO LE COMPETENZE
Ricerca in rete informazioni sulla plastica HDPE, LDPE e PP. Rispondi alle domande. Che cosa indicano le sigle?
1. HDPE:
2. LDPE:
3. PP:
4. Quale di queste tre plastiche è usata per realizzare flaconi, taniche e annaffiatoi?
CON LA SINTESI
lezione 1 OSSIDI, ANIDRIDI E BASI
L’ossidazione è un tipo di reazione chimica tra l’ossigeno e un altro elemento chimico. Un tipo particolare di ossidazione è la combustione che avviene quando si combina l’ossigeno, il comburente, con il carbonio o un suo composto, il combustibile: la combustione libera energia sotto forma di luce e calore. Quando l’ossigeno reagisce con un metallo si forma un ossido basico o ossido. Quando l’ossigeno reagisce con un non metallo si forma un ossido acido o anidride. Quando un ossido basico reagisce con l’acqua si ottiene una base o idrossido
La caratteristica di tutte le basi è di possedere il gruppo ossidrile OH. Le basi hanno un sapore amaro, sono viscide al tatto e sono tossiche.
lezione 2 ACIDI E SALI
Quando un ossido acido reagisce con l’acqua si forma un ossiacido, cioè un tipo di acido formato da idrogeno, ossigeno e un non metallo. Quando un non metallo reagisce con l’idrogeno si forma un idracido, cioè un acido che non contiene ossigeno. Caratteristica di tutti gli acidi è quella di possedere il gruppo H+, chiamato ione idrogeno. Gli acidi hanno un sapore aspro, sono corrosivi, sono pericolosi se vengono a contatto con pelle o mucose. Quando un acido reagisce con una base avviene una reazione di neutralizzazione: i prodotti che si ottengono sono sali e acqua.
lezione 3 SOLUZIONI ACIDE, BASICHE E NEUTRE


Una soluzione è un miscuglio omogeneo di due o più sostanze. Quella che è presente in quantità maggiore si chiama solvente, l’altra si chiama soluto Una soluzione può essere liquida (per esempio l’acqua di mare), solida (per esempio una lega metallica), aeriforme (per esempio l’aria). La concentrazione di una soluzione fornisce informazioni sulla quantità di soluto presente: si può esprimere come rapporto tra la quantità (la massa) di soluto in 1 litro di soluzione oppure in percentuale, facendo riferimento ai grammi di soluto sciolti in 100 g di soluzione. Una soluzione con poco soluto si dice diluita; con abbondante soluto si dice concentrata. Una soluzione è satura quando non è più in grado di sciogliere il soluto, che si deposita come corpo di fondo. La solubilità è la capacità di una sostanza


di sciogliersi in un solvente e aumenta con il crescere della temperatura. Una soluzione si dice acida se la concentrazione di ioni H+ supera quella degli ioni OH-; si dice basica se la concentrazione di ioni OH- supera quella degli ioni H+ La grandezza che misura l’acidità di una soluzione è il pH, che esprime la concentrazione di ioni H+ Nella scala del pH i valori vanno da 0 a 14: il valore 7 corrisponde a una soluzione neutra, valori inferiori a 7 corrispondono a soluzioni acide, valori superiori a 7 a soluzioni basiche.
lezione 4 I COMPOSTI ORGANICI E LE BIOMOLECOLE
La chimica organica studia i composti del carbonio. I composti organici sono formati da carbonio e pochi altri elementi, come idrogeno, ossigeno, azoto e zolfo. Gli idrocarburi sono composti organici che contengono acarbonio e idrogeno. Si suddividono in: alcani che contengono solo legami covalenti singoli tra gli atomi di carbonio; alcheni, che contengono almeno un legame covalente doppio; alchini, che contengono un legame covalente triplo. Gli idrocarburi aromatici sono caratterizzati dalla catena di atomi di carbonio chiusa ad anello. Il benzene è un idrocarburo aromatico contenuto nel petrolio. Le biomolecole formano un gruppo molto ampio di composti organici che svolgono un ruolo fondamentale negli organismi. Esse comprendono: carboidrati, chiamati anche zuccheri o glucidi, lipidi o grassi, proteine, che contengono anche azoto, acidi nucleici, che contengono acido fosforico. I composti organici sono classificati in base al gruppo funzionale che contengono: si distinguono in alcoli, aldeidi, chetoni, acidi carbossilici, ammine, ammidi
lezione 5 EDUCAZIONE CIVICA LA CHIMICA QUOTIDIANA
Nella vita di tutti i giorni utilizziamo oggetti realizzati a partire da diverse materie prime. Il vetro si ottiene dalla silice, la carta si ottiene dalla cellulosa, l’alluminio è un metallo estratto dalla bauxite. Alla fine dell’Ottocento sono stati creati in laboratorio i polimeri, macromolecole costituite da lunghe catene, di unità più piccole, legate fra loro, chiamate monomeri. I polimeri sintetici si ottengono dalla lavorazione del petrolio e sono alla base dei diversi tipi di plastiche impiegate nella fabbricazione di moltissimi oggetti di uso quotidiano.


CON LA MAPPA
Adesso che hai ripassato i contenuti essenziali con la sintesi, prova a completare la mappa con le parole chiave suggerite e a trovare le definizioni corrispondenti.
acqua - carbonio - organici - ossidi acidi - ossidi basici - ossigeno - soluzioni
che possono essere il risultato di reazioni con l’elemento
che sono composti del
6. non metallo + ossigeno 7. metallo + ossigeno
che porta alla formazione di
come accade nella reazioni di che disciolti in 4.
che porta alla formazione di

11. danno origine alle
a. È il prodotto della reazione di ossidazione dell’idrogeno.
b. Lo è la reazione di combustione del carbonio.
c. Sono composti che contengono carbonio e pochi altri elementi, come ossigeno, azoto e idrogeno.
d. Sono composte dal solvente e dal soluto.
5.
si suddividono in
1. I COMPOSTI CHIMICI
3. 2. inorganici
8. 9.
FISSA I CONTENUTI ESSENZIALI
lezione 1 OSSIDI, ANIDRIDI E BASI
1 Scegli la soluzione corretta.
Le reazioni di ossidazione:
1 sviluppano sempre anidride carbonica.
2 comprendono le combustioni.
3 avvengono in assenza di ossigeno.
4 hanno l’ossigeno tra i prodotti della reazione.
2 Scegli la soluzione errata.
Le basi:
1 sono amare e viscide.
2 in acqua liberano uno ione OH-.
3 sono anche chiamate idrossidi.
4 presentano un’anidride come reagente.
3 Segna con una crocetta se vero (V) o falso (F).
a. Una base è formata da ossido e acqua.
b. L’ossidrile contiene due atomi di ossigeno.
c. Un idrossido contiene almeno un ossidrile.
d. Sciolte in acqua le basi liberano uno ione metallico positivo.
4 Sottolinea il termine corretto tra i due proposti.
a. In una reazione di ossidazione uno dei reagenti è l’idrogeno/ossigeno.
b. L’anidride è il prodotto della reazione tra metallo/non metallo e ossigeno.
c. L’ossido è il prodotto della reazione tra metallo/non metallo e ossigeno.
d. In una combustione l’ossigeno è il combustibile/comburente
2 ACIDI E SALI
5 Segna con una crocetta se vero (V) o falso (F).
a. Un idracido contiene almeno un atomo di ossigeno.
b. L’acido carbonico contiene due atomi di ossigeno.

c. Gli acidi sono corrosivi.
d. Quando acido e base reagiscono si forma un sale.
6 Scegli la soluzione corretta.
È più pericoloso maneggiare:
1 una piccola quantità di acido cloridrico.
2 una goccia di aceto.
3 una goccia di succo di limone.
4 una piccola quantità di succo di un’arancia.
7 Scegli la soluzione errata.
Quando si mescolano tra loro un acido e una base si ha:
1 una reazione diversa in relazione al tipo di reagenti.
2 una reazione di neutralizzazione.
3 la formazione di un sale.
4 la formazione di acqua.
8 Completa le frasi con i termini corretti.
Gli acidi sono formati da tre elementi: idrogeno, ossigeno e . Tutti gli acidi possiedono il gruppo H+ che si chiama che ha carica .
lezione 3 SOLUZIONI ACIDE, BASICHE E NEUTRE
9 Abbina i termini con la definizione corretta.
1. Lega
2. Corpo di fondo
3. Concentrazione
4. Solubilità
a Rapporto tra grammi di soluto e litro di soluzione.
b Rapporto tra grammi di soluto e 100 grammi di solvente.
c Soluzione solida tra due metalli.
d Soluto non disciolto in una soluzione satura.
1. 2. 3. 4.
lezione
10 Scegli la soluzione corretta.
a. Se, a una certa temperatura, parte del soluto rimane indisciolto, significa che la soluzione è:
1 concentrata.
2 satura.
3 impura.
4 diluita.
b. Quando sciogli lo zucchero nell’acqua, lo zucchero è:
1 il solvente.
2 la soluzione.
3 il soluto.
4 il miscuglio.
11 Osserva il disegno e inserisci accanto a ogni termine il numero corrispondente.
13 Segna con una crocetta se vero (V) o falso (F).
a. Il legame tipico del carbonio è il legame covalente.
b. Solo i composti organici contengono carbonio.
c. Gli acidi nucleici contengono acido carbonico.
d. Il gruppo funzionale carbonile è caratteristico degli alcoli.
lezione 5 LA CHIMICA QUOTIDIANA
14 Scegli la soluzione corretta.
Il vetro si ottiene:
1 dalla solidificazione della silice.
2 da derivati del petrolio.
3 da derivati della bauxite.
4 dalla cellulosa.
15 Scegli la soluzione errata.
I polimeri plastici sono:
1 macromolecole sintetiche che contengono carbonio.
2 catene di monomeri.
1 2 3
a. Soluzione basica
b. Soluzione acida
c. Soluzione neutra
lezione
4 I COMPOSTI ORGANICI
E LE BIOMOLECOLE
12 Scegli il termine corretto tra i due proposti.
a. Il settore della chimica che studia i composti del carbonio è la chimica organica/inorganica.
b. Il benzene è un alcano/idrocarburo aromatico.
c. Le proteine sono biomolecole ternarie/ quaternarie.
d. I composti organici si classificano in base al gruppo ossidrile/funzionale che contengono.
3 prodotti ottenuti dalla lavorazione del petrolio.
4 macromolecole naturali che contengono carbonio.
16 Segna con una crocetta se vero (V) o falso (F).
a. L’alluminio è un metallo che reagisce facilmente con altre sostanze.
b. Il vetro è un conduttore di calore e un isolante elettrico.
c. Il processo di produzione delle carte richiede poca energia.
d. La celluloide è stata il primo polimero sintetizzato in laboratorio.
e. Il vetro è un materiale riciclabile infinite volte.
f. Il polistirene è utilizzato per realizzare bottiglie di plastica.
TRARRE INFORMAZIONI DA UNA IMMAGINE
1 Osserva i disegni e rispondi alle domande.
a. Quale sostanza è contenuta nel becker A?
b. Quale sostanza è contenuta nel becker B?
c. Che tipo di reazione avviene tra queste due sostanze?
d. Che cosa si ottiene come prodotto nel becker C?
2 A quale famiglia appartiene ciascuna delle tre molecole rappresentate e quale tipo di legame ha il carbonio in ciascuna di esse?
APPLICARE CONOSCENZE
3 Risolvi i problemi.
a. Una soluzione è costituita da 180 g di solvente e 15 g di soluto. Qual è la sua concentrazione?
b. In una soluzione al 25% di acqua e sale sono contenuti 600 g di sale. Quanti litri di acqua sono presenti ?
c. Considera le seguenti soluzioni:
1 10 g di soluto in 100 ml di solvente;
2 30 g di soluto in 200 ml di solvente;
3 40 g di soluto in 250 ml di solvente. Calcola la concentrazione di ciascuna di esse e determina quale è più concentrata.
TRARRE INFORMAZIONI DA UNA IMMAGINE E FORMULARE IPOTESI
4 Osserva l’immagine.

Per ognuno dei materiali considerati indica per quali oggetti vengono usati.
Polistirene:
Polietilene tereftalato:
Cloruro di polivinile: Polipropilene:: 1 2 3

Il paese salato
13 LUGLIO 1835, le miniere di Guantajaya
Dopo aver lasciato Iquique a cavallo abbiamo attraversato un’area desertica. Il paesaggio qui è bianco, bianco dovunque! È come quando nevica nella campagna intorno a Bedford, la mia città natale, nel centro dell’Inghilterra, dove vive la mia famiglia. Lungo la strada ci sono molti teschi e ossa di animali morti, perfettamente lucidati. Penso che sia opera dei condor. Siamo arrivati nei pressi di una miniera di salnitro. Il signor Darwin dice che questo luogo, in tempi molto antichi, era un lago di acqua salata o uno stretto di mare. Nel corso dei secoli l’acqua è lentamente scomparsa, lasciando questo strato di sale. È davvero affascinante! E qui devono esserci molti resti fossili – pesci, conchiglie, foglie e animali. Ma è ora di tornare alla casa del proprietario della miniera, dormiremo lì stasera. L’unico problema è che dobbiamo tornare indietro a cavallo, e io non sono abituato a cavalcare. La mia schiena mi fa davvero male!
DDarwin
al porto di Iquique, nel nord del Cile , viaggiamo a cavallo verso le miniere di salnitro, a 68 chilometri di distanza. Saliamo una ripida montagna fino a raggiungere due piccoli villaggi vicino alla miniera, GuantaJaya e Santa Rosa . L’area che abbiamo appena attraversato è desertica. La strada è coperta di ossa e pelli di animali da soma che muoiono di sfinimento durante il viaggio. È un paesaggio impressionante! La regione è coperta da uno spesso strato di sale comune e di altri sali: è bianco, duro e compatto e forma dei noduli che sporgono dalla sabbia. C’è anche molto gesso mescolato al sale, tanto che il paesaggio assomiglia a quello della campagna quando è coperta di neve. Ma il clima qui deve essere molto secco, altrimenti la pioggia scioglierebbe tutti i noduli di sale.
ORA RACCONTA TU!
Le miniere di salnitro (nitrato di sodio) sono fatte di uno strato duro di salnitro mescolato con un po’ di solfato di sodio e molto sale comune. Questo strato è talvolta molto spesso, da 60 a 90 centimetri: si estende per 240 Km, molto vicino alla superficie del terreno, a 1000 metri di altezza sul livello del mare. In passato, probabilmente, qui c’era un lago o un tratto di mare che poi si è ritirato perché il territorio si è innalzato. Questo spiega perché si sono formati questi ricchi depositi che sono sfruttati per raccogliere il salnitro e venderlo come fertilizzante.
a. Prova a descrivere le emozioni che prova Sims passando a cavallo attraverso il deserto: come ti sentiresti al suo posto?
b. Che cosa suscita in Sims il ricordo del suo paese natale e della sua famiglia?
c. Descrivi con le tue parole il processo di formazione dei depositi di salnitro che Darwin descrive a Sims.
d. Sims ha imparato nuovi contenuti scientifici viaggiando con Darwin: da che cosa lo puoi capire?

DIGITAL SKILLS
Utilizza Google Map per localizzare le città e i paesi citati nel da Sims nel suo Blog e da Darwin nel suo diario.
Intelligenza
Con l’aiuto del tuo insegnante chiedi a un chatbot di intelligenza artificiale di mettere a confronto le caratteristiche climatiche di Bedford, nel Regno Unito, e di Iquique, nel nord del Cile. Ora che possiedi queste informazioni, prova a descrivere con le tue parole la relazione che lega il processo di formazione dei depositi di sale con il clima del deserto del Cile.
C’ E ` metallo e C
’ E ` colore!


La scoperta del rame, seguita da quella di altri metalli, ha rappresentato una svolta decisiva nella storia dell’umanità, influenzando profondamente la nostra evoluzione dalla preistoria fino ai nostri giorni. Ancora oggi i metalli continuano a giocare un ruolo fondamentale: alcuni di essi sono diventati risorse strategiche che incidono direttamente sull’economia del mondo. La loro estrazione e il controllo dei giacimenti possono generare tensioni geopolitiche, fino a provocare veri e propri conflitti. I metalli, fin dai tempi antichi, sono stati impiegati anche come materia prima per i colori utilizzati nell’arte pittorica. I capolavori dei secoli scorsi non sarebbero mai esistiti senza di essi! L’ematite, ad esempio, contiene ferro e anticamente era chiamata “pietra di sangue” per il suo colore rosso, e nella preistoria era usata per realizzare le pitture rupestri.
PREREQUISITI
Conoscere le caratteristiche degli elementi e in particolare quelle dei metalli. Riconoscere la presenza di pigmenti nei vegetali e in altri materiali.
RISULTATI ATTESI
Comprensione del ruolo giocato dai metalli nell’evoluzione tecnologica umana.
Capacità di riconoscere l’uso dei metalli, in particolare dell’oro, in ambiti diversi.
Capacità di riconoscere gli effetti dell’estrazione e dell’uso dei metalli sulla salute umana e sull’ambiente.
RACCORDI interdisciplinari
Proponiamo alcuni approfondimenti che possono essere affrontati nel percorso interdisciplinare, ma la mappa suggerisce altri argomenti che possono essere sviluppati per integrare lo stesso percorso.
SCIENZE: realizzazione di un esperimento che permette di ricavare pigmenti colorati. Comprensione di un testo riguardante il riciclo di metalli da rifiuti tecnologici.
STORIA: la scoperta dei diversi metalli nella preistoria e i cambiamenti delle dinamiche all’interno e all’esterno dei vari gruppi.
EDUCAZIONE CIVICA: il ruolo dell’oro nell’economia internazionale; estrazione e uso dei metalli, rischi sanitari e ambientali a breve e lungo termine.
ARTE: i codici miniati rappresentano una testimonianza dell’uso dei pigmenti naturali nella pittura medioevale.
UN
LA SCOPERTA DEI METALLI NELLA PREISTORIA
L’ORO NELL’ECONOMIA INTERNAZIONALE
I RISCHI CONNESSI ALL’ESTRAZIONE DEI METALLI
INQUINAMENTO DA METALLI
I CODICI MINIATI
LAB STEM
ROSSO VEGETALE
UNA MINIERA NEGLI OGGETTI HI-TEC
ARTE
I codici miniati
I codici miniati sono manoscritti realizzati principalmente durante il Medioevo, scritti a mano dagli amanuensi e impreziositi dai miniatori che decoravano i capolettera (le lettere iniziali della prima parola della prima riga di un testo) conferendo rilievo e bellezza all’opera. Le pagine erano realizzate in pergamena, una membrana ricavata dalla pelle di animali, soprattutto agnelli e vitelli, particolarmente apprezzata per la sua resistenza e la capacità di assorbire i colori. Dopo la preparazione, sulla superficie della pergamena veniva steso uno strato di argilla, gesso e gomma arabica, utile a preparare il fondo per la decorazione. I pigmenti utilizzati per le miniature avevano origine animale, vegetale o minerale, ed erano mescolati con leganti naturali come l’albume o il tuorlo d’uovo. Il rosso porpora, ad esempio, si otteneva dalla secrezione di alcuni molluschi, il blu dai lapislazzuli, una pietra preziosa, il verde dal rame. L’oro, invece, veniva applicato in sottilissimi fogli, la cosiddetta “foglia d’oro”, per arricchire e illuminare le immagini.
Testo ripreso e adattato da https://museodiocesano.brescia.it

DOMANDE GUIDA
a. Che cosa sono i codici miniati?
b. Qual era il procedimento per la produzione dei fogli dei codici?
c. Come venivano realizzati i colori usati dai miniatori?
Intelligenza Artificiale IA
Con l’aiuto del tuo insegnante chiedi a un chatbot di intelligenza artificiale di spiegarti in maniera semplice come facevano i pittori a ottenere i colori nei tempi antichi e come si ottengono oggi.
SCIENZE
Una miniera negli oggetti Hi-Tech
L’oro e i metalli del gruppo del platino, come il palladio, il platino e l’iridio, sono molto richiesti per produrre oggetti elettronici.
Tuttavia, l’approvvigionamento di questi metalli, dalle miniere e attraverso le attuali tecniche di riciclo dei rifiuti elettronici, non è sostenibile dal punto di vista energetico e comporta un’elevata produzione di CO2.
Recentemente un gruppo di ricerca, utilizzando un solvente organico, è riuscito a disciogliere diversi tipi di oggetti dismessi come convertitori catalitici delle auto, rifiuti elettronici, vecchie schede di circuiti, estraendone oro e metalli del gruppo del platino.
Uno dei vantaggi di questo nuovo processo di riciclo è che può funzionare ininterrottamente in modo ecologico e permette la separazione dei metalli pregiati da altri metalli, come l’argento, il nichel, il rame.
Testo ripreso e adattato dall’articolo “Redox-mediated electrochemical liquidliquid Extraction (e-LLE) for selective metal recovery” pubblicato nella rivista Nature Chemical Engineering)

DIGITAL SKILLS PER APPROFONDIRE
a. Ricerca in rete informazioni sulla raccolta differenziata dei rifiuti elettronici in Italia. Che cosa succede nel tuo comune?
b. Hai sentito parlare di apparecchi ricondizionati? Quali vantaggi offrono?
MATERIA TEMA
Corpi in movimento
3
Burj Khalifa è il nome di un grattacielo che sorge a Dubai, negli Emirati Arabi. Sembra un gigantesco razzo pronto al decollo, ma non è la sua forma che lo rende speciale: con i suoi 828 m, questo grattacielo è l’edificio più elevato del mondo, con un significativo margine di vantaggio rispetto a qualsiasi altra costruzione umana. L’architettura moderna ha potuto raggiungere straordinari risultati grazie alla continua evoluzione della ricerca fisica, in particolare della fisica meccanica. Le origini della meccanica risalgono a quando gli esseri umani cominciarono a interessarsi ai fenomeni naturali e al movimento dei corpi. Anche se la semplice osservazione dei fenomeni non può essere considerata uno studio scientifico, fu proprio grazie all’osservazione del cielo che i nostri antenati divennero capaci di riferirsi al moto degli astri per orientarsi e spostarsi. Oggi la fisica meccanica è divisa in due grandi categorie: la meccanica classica, che si occupa dello studio del movimento dei corpi macroscopici, quelli che possiamo vedere e toccare, e la meccanica quantistica, che studia il comportamento della materia a livello degli atomi e delle particelle che li formano. La meccanica classica si divide a sua volta in cinematica, dinamica e statica. La fisica meccanica non ha applicazioni solo in ingegneria e architettura, ma in molti altri campi, dalla biomeccanica, alla geofisica, all’astronomia.






dei corpi Il moto unità 6 Le forze unità 7
MARTA MAURI, researchmanager
La passione di Marta per la matematica e per la fisica è nata al liceo classico. Si è laureata in Fisica a Milano e ha lavorato per qualche anno a Toronto, in Canada, come research manager, collaborando con team di specialisti che si occupa di ricerca nell’ambito dei computer quantistici. L’ambiente giovane e dinamico della sua azienda le ha permesso di crescere sul piano umano e professionale.



PIETRO CARRARA, dottorando in Fisica della materia


Dopo la laurea in Fisica della materia, ha vissuto a Trieste dove ha studiato le proprietà microscopiche della materia e sviluppato nuove tecnologie da applicare a computer, smartphone e tablet. Per “guardare” dentro la materia Pietro utilizza sia la luce visibile sia i raggi X, ma anche raggi laser ultraveloci che consentono di “mettere in movimento” gli atomi e osservare la loro evoluzione nel tempo.
PAOLO MOGGIO, assistente alle vendite di strumentazione da laboratorio
Fin da bambino sognava di diventare uno scienziato che si circonda di ampolle e liquidi colorati nel suo laboratorio. Dopo il diploma al liceo scientifico con indirizzo biotecnologico, si è laureato in Scienze chimiche e ha subito trovato lavoro nel settore che si occupa di strumenti di laboratorio per le analisi chimiche in ambito industriale e ambientale. Paolo pensa che il suo lavoro sia molto stimolante perché può approfondire le sue conoscenze grazie alla continua evoluzione delle tecnologie.

PARLA LA SCIENZA
Isaac Newton
dei corpi Il moto unità
Gli elementi che descrivono il moto lezione 1
La veloci tA ` e il moto rettilineo lezione 2
L ’accelerazione e il moto accelerato lezione 3

LEZIONI POWERPOINT in


BUONE NOTIZIE PER IL FUTURO
MobilitA ` sostenibile e strade“intelligenti”
Esistono alternative ecologiche all’uso delle automobili per muoversi in città? Usare la bicicletta o il monopattino, servirsi dei mezzi pubblici, ma anche camminare, sono esempi di mobilità sostenibile, cioè l’insieme di tutti quei comportamenti che conciliano il bisogno di muoversi con la riduzione dell’inquinamento. La mobilità sostenibile nelle città ha molteplici scopi: ridurre il traffico, migliorare la qualità dell’aria, salvaguardare la salute dei cittadini, diminuire le emissioni di CO2 abbandonando progressivamente l’uso dei carburanti derivati combustibili fossili. Per raggiungere questi obiettivi è fondamentale integrare i diversi mezzi di trasporto pubblico, potenziare la rete delle piste ciclabili car sharing, che sta facendo gradualmente il suo ingresso nelle nostre città.
Ma perché la mobilità sostenibile sia efficiente occorre che sia anche integrata a una rete di strade e autostrade sempre più connessa. In Italia l’ANAS (Azienda Nazionale Autonoma delle strade Statali) ha avviato il progetto Smart road, che prevede la creazione di una piattaforma digitale che utilizzerà le tecnologie più avanzate per favorire la mobilità sostenibile, migliorare la sicurezza sulle strade e rendere più fluido il traffico.
Gli elementi che descrivono il moto lezione 1
CARTA PENNA COMPUTER

Tutto si muove!
Guarda il video e scrivi le risposte sul quaderno.
1. Quando puoi dire che un corpo è in quiete? E quando è in movimento?
2. Da quale punto di osservazione puoi affermare che la Terra è in movimento?
3. Da che cosa dipende il movimento della nostra e delle altre galassie dell’Universo?
4. È possibile affermare che nulla di tutto ciò che riusciamo a osservare è fermo?
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.

5. Qual è la velocità di rotazione della Terra attorno al proprio asse?
6. Qual è la velocità di rotazione della Terra attorno al Sole?
1 La relatività galileiana
Lo scienziato Galileo Galilei, oltre ad averci insegnato che il metodo scientifico è l’unico che può essere applicato nello studio di un fenomeno dal punto di vista scientifico, dedicò gran parte delle sue ricerche al movimento dei corpi. È stato, infatti, uno dei primi a intuire che un corpo è fermo o in movimento in relazione alla posizione di chi osserva il corpo stesso. Per dimostrare ciò, Galileo descrisse il seguente esperimento nel trattato Dialogo sopra i due massimi sistemi del mondo Nella cabina di una nave si trovano una vasca d’acqua con dei pesci, degli insetti che volano e un catino che raccoglie l’acqua che gocciola da un recipiente bucato. La nave è ferma in porto e un uomo presente in cabina osserva quello che succede. Quando la nave si mette in movimento, l’uomo non osserva alcun cambiamento: i pesci continuano a nuotare nella vasca, gli insetti volano, l’acqua continua a gocciolare nel catino. Se la nave si muove senza scossoni e sempre alla stessa velocità l’uomo, stando in cabina, non è in grado di distinguere se la nave si sta muovendo o è ferma. Tutto quello che sta dentro la cabina, anzi, dentro la nave, si muove alla stessa velocità della nave ed è soggetto alle stesse leggi fisiche di un sistema fermo: la nave è un sistema di riferimento inerziale. Il principio della relatività galileiana afferma infatti che le leggi della meccanica sono le stesse nei sistemi inerziali, cioè nei sistemi fermi o nei sistemi in movimento con velocità costante.
2 Stato di quiete, stato di moto e sistema di riferimento
Siamo soliti stabilire se un corpo è fermo o in movimento prendendo come riferimento la nostra casa, la strada, la Terra o il Sole, eppure nessuno di essi è fermo. Tuttavia questo non è un problema: basta che sia chiaro qual è il punto di vista, cioè quale sistema di riferimento stiamo utilizzando per descrivere il moto del corpo che stiamo osservando.
Un corpo è in stato di quiete se non cambia la sua posizione rispetto al sistema di riferimento scelto.
Un corpo è in stato di moto se cambia la sua posizione rispetto al sistema di riferimento scelto.
Per esempio, quando viaggi in auto sei in quiete rispetto all’automobile, ma in movimento rispetto al paesaggio esterno. Se sei seduto al banco sei in quiete rispetto al paesaggio esterno, ma in movimento, insieme alla Terra, rispetto al Sole.
Da questi esempi possiamo capire che la descrizione di un moto può cambiare a seconda del punto di vista, cioè a seconda del sistema di riferimento scelto 1 .
La bambina che è a bordo del treno è ferma rispetto al convoglio, ma è in movimento insieme al treno rispetto al paesaggio.


I sistemi di riferimento inerziali
1 Questione di punti di vista.
La ragazza è ferma rispetto alla banchina della stazione, mentre il treno è in movimento.

Nel linguaggio scientifico si dice che gli stati di quiete e di moto sono relativi, perché in relazione al sistema di riferimento. Di solito, quando descriviamo il moto di un corpo consideriamo come sistema di riferimento un sistema di riferimento inerziale, in particolare la Terra o un oggetto fissato sulla sua superficie.
Due treni che viaggiano su binari paralleli alla stessa velocità sono in moto rispetto all’esterno, ma i passeggeri a bordo hanno l’impressione di essere fermi.
2
Le traiettorie percorse dalle atlete in una gara di 100 metri sono rettilinee.

3 Le caratteristiche del moto
Il settore della fisica che studia le caratteristiche del moto di un corpo è la cinematica
Per descrivere un moto, una volta scelto il sistema di riferimento, sono indispensabili altri tre elementi: la traiettoria, lo spazio percorso e il tempo impiegato a percorrerlo.
La traiettoria di un corpo in moto è la linea costituita dalla successione delle posizioni che il corpo occupa nel suo moto. Essa rappresenta il percorso compiuto dal corpo.
Una traiettoria è rettilinea o curvilinea a seconda che il corpo si sposti lungo una linea retta o curva. Possiamo perciò distinguere diversi tipi di moto:
• il moto rettilineo, che avviene lungo una traiettoria costituita da una linea retta 2 ;
• il moto curvilineo, che può avvenire lungo una linea curva, per esempio lungo una circonferenza o una parabola: il moto circolare 3 a avviene lungo una traiettoria rappresentata da una circonferenza; il moto parabolico avviene lungo una traiettoria rappresentata da una parabola 3 b



Il secondo elemento che occorre conoscere per descrivere il moto è lo spazio percorso dal corpo, cioè la lunghezza dello spostamento.
L’unità di misura della lunghezza è il metro (m).
Per misurare piccoli spostamenti si usano i sottomultipli del metro, come i centimetri (cm), mentre per le grandi distanze si utilizzano i multipli, di solito i kilometri (km).
Per completare la descrizione del moto di un corpo bisogna conoscere il tempo impiegato per compiere lo spostamento.
L’unità di misura del tempo è il secondo (s).
Anche la durata dello spostamento può essere misurata in multipli o sottomultipli del secondo. Per esempio, il tempo impiegato da un’auto per compiere un viaggio si misura in ore (h), la durata di un segnale elettrico si misura in microsecondi (µs).
3 Due esempi di moto curvilineo. a b
4 Applichiamo il metodo scientifico al moto
La descrizione del moto di un corpo è completa quando si conoscono le posizioni occupate dal corpo al variare del tempo.
Quando analizziamo un fenomeno con il metodo scientifico, dobbiamo raccogliere i dati delle nostre osservazioni. Nel caso del moto, i dati sono raccolti in tabelle orarie, quali per esempio gli orari dei treni e degli autobus 4 . Nelle tabelle orarie vengono riportate le posizioni occupate dal treno o dal bus nei diversi istanti di tempo. Per visualizzare il moto si riportano i dati della tabella oraria in un grafico orario, un diagramma cartesiano che ha il tempo sull’asse delle ordinate e lo spazio percorso sull’asse delle ascisse 4
4 Nelle colonne sono riportati gli orari di alcuni treni che partono dalla Stazione Centrale di Milano.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. Gli stati di quiete o moto sono relativi.
2. Una nave in navigazione è un sistema inerziale per le persone a bordo.
3. Un moto rettilineo può avere un solo verso.
4. L’unità di misura per lo spazio percorso è il kilometro.
VERSO LE COMPETENZE
Osserva l’immagine e completa le frasi inserendo i termini “quiete” e “movimento”.
1. Il treno rispetto all’auto è in
2. I passeggeri dell’auto rispetto all’auto sono in
3. Un passeggero seduto sul treno è in rispetto al passaggio a livello.
4. Un passeggero che cammina lungo il corridoio del treno è in rispetto all’auto.

5 Dalla tabella al grafico.
La veloci tA ` e il moto rettilineo lezione 2
CARTA PENNA COMPUTER

Il moto rettilineo
Guarda il video e scrivi le risposte sul quaderno.
1. Come è definito in fisica il moto “regolare” di un corpo?
2. Quale grandezza rappresenta il rapporto tra lo spazio percorso e il tempo impiegato a percorrerlo?
3. Che tipo di proporzionalità lega le grandezze spazio e tempo?
1
La velocità
Metti in pausa il video nei seguenti punti.

4. Descrivi con le tue parole le caratteristiche del moto rettilineo uniforme utilizzando tutte le informazioni contenute nell’immagine.
Sistema di riferimento, traiettoria, spazio percorso e tempo impiegato sono le informazioni necessarie per descrivere il moto di un corpo. Esiste una grandezza che visualizza in modo immediato quanto è lento o rapido il moto del corpo: è la velocità.
La velocità v è il rapporto tra lo spazio s percorso e il tempo t impiegato a percorrerlo.

che, partito da una località alle 8 del mattino, ha

ORA FERMA L’IMMAGINE!
Per saperlo dobbiamo calcolare il rapporto tra lo spazio percorso e il tempo impiegato:
v = 240 km = 80 km/h 3 h
La velocità dell’autobus che ha impiegato 3 h a percorrere 240 km è stata pari a 80 km/h. Se lo spazio è misurato in kilometri (km) e il tempo in ore (h) la velocità si esprime in km/h. Se le unità di misura delle grandezze considerate sono rispettivamente metri (m) e secondi (s) la velocità si misura in m/s.
Per passare da km/h a m/s, o viceversa, basta eseguire un semplice calcolo. È sufficiente ricordare che 1 km = 1000 m e che 1 h = 3600 s. Perciò:
1 km/h = 1000 m = 1 m/s
3600 s 3,6
Ciò significa che:
• per passare da m/s a km/h si deve moltiplicare il valore della velocità per 3,6;
• per passare da km/h a m/s si deve dividere il valore della velocità per 3,6 1
2 Il moto rettilineo uniforme
1 Conversione di metri al secondo in kilometri all'ora e viceversa.


moltiplicare per 3,6 dividere per 3,6


Durante il suo allenamento quotidiano, un ragazzo percorre una strada rettilinea mantenendo una velocità costante di 5 m/s. Possiamo dire che, in ogni secondo, il ragazzo percorre spazi uguali pari a 5 m e si muove di moto rettilineo uniforme 2
Un corpo si muove di moto rettilineo uniforme quando percorre una traiettoria rettilinea con velocità costante, cioè percorre spazi uguali in intervalli di tempo uguali.
2 Un esempio di moto rettilineo uniforme.
Immagina un’automobile che si muove con moto rettilineo uniforme alla velocità di 100 km/h: in 1 ora percorrerà 100 km, in 2 ore 200 km, in 3 ore 300 km e così via. Per trovare lo spazio percorso, abbiamo moltiplicato la velocità per il tempo:
100 km/h 1 h = 100 km
100 km/h ⋅ 2 h = 200 km
100 km/h 3 h = 300 km
Più in generale:
3 Grafico orario del moto rettilineo uniforme.
La relazione che lega spazio, tempo e velocità è detta legge oraria del moto rettilineo uniforme. Nel moto rettilineo uniforme, poiché la velocità è costante, esiste una relazione di proporzionalità diretta tra spazio percorso e tempo impiegato a percorrerlo. Le misure dello spazio e del tempo impiegato per percorrerlo ci forniscono informazioni sul moto di un corpo, ma se vogliamo conoscere più in dettaglio di che tipo di moto si tratta, possiamo ricorrere a un grafico tracciato sul piano cartesiano. La linea che otteniamo sulla carta ci dà immediatamente l’indicazione del tipo di moto.
Realizziamo il grafico orario del moto rettilineo uniforme
Costruiamo una tabella con i valori relativi al moto rettilineo uniforme di un maratoneta che procede alla velocità di 1,4 m/s. Riportiamo i dati in un sistema di assi cartesiani: scriviamo sull’asse x i valori del tempo t e sull’asse y i valori dello spazio percorso s. Otteniamo il grafico orario del moto rettilineo uniforme: una semiretta che passa per l’origine degli assi. In termini matematici, ciò significa che nel moto rettilineo uniforme spazio e tempo sono due grandezze direttamente proporzionali 3
Utilizzando il grafico possiamo rispondere ad alcune domande sul moto del maratoneta senza eseguire calcoli. Quale distanza ha percorso dopo 3 secondi e mezzo? Per rispondere basta individuare il punto sull’asse x che corrisponde alla metà dello spazio tra i secondi 3 e 4 e leggere il valore corrispondente sull’asse y. La risposta è 4,9 m.
3 Il moto vario
Il moto rettilineo uniforme avviene solo per brevi intervalli di tempo, perché difficilmente un corpo in movimento può mantenere a lungo la stessa velocità. Succede anche a te, quando ti sposti in bicicletta: la velocità con cui procedi dipende dall’andamento della strada (se è rettilinea oppure con molte curve), dalla presenza di ostacoli, dai rallentamenti provocati da altri veicoli o dalle soste ai semafori.
Il moto di un corpo che non mantiene una velocità costante è detto moto vario





4 Il tachimetro montato sul cruscotto delle auto permette di misurare la velocità istantanea.


















Per descrivere un moto vario si può considerare la velocità registrata in ogni singolo istante, cioè la velocità istantanea, indicata con vi . La velocità istantanea cambia continuamente, è variabile 4 . Tuttavia nel moto vario è utile individuare la velocità media, indicata con vm , che si ottiene dividendo lo spazio totale percorso per il tempo totale impiegato a percorrerlo:





vm = spazio totale = s tempo totale t
La formula per determinare la velocità media è la stessa che hai visto nel moto rettilineo, ma il significato è diverso. Infatti, immagina un’automobile che ha percorso 400 km alla velocità media di 100 km/h: impiega 4 ore per coprire il tragitto ma questo non significa che ha mantenuto la velocità costante di 100 km/h, perché può aver rallentato o accelerato in ogni istante. Durante i Mondiali di atletica leggera di Berlino nel 2009, l’ex velocista giamaicano Usain Bolt stabilì il record mondiale sui 100 m piani correndoli in 9,58 s. Nella gara ha raggiunto una velocità massima di 44 km/h, ma ha vinto perché è riuscito a mantenere una velocità media di 41 km/h nei 50 m finali.

L’indicazione della velocità media, pertanto, non considera i cambiamenti di velocità lungo il percorso e non fornisce informazioni sulla velocità istantanea.
Realizziamo il grafico orario del moto vario.
La lunghezza dell’autostrada che collega Torino a Venezia è di circa 400 km. Mantenendo la velocità media di 100 km/h, un’auto impiega 4 ore per percorrere il tragitto, ma nella realtà la sua velocità può cambiare in ogni istante.
L’auto, per esempio, può percorrere 120 km nella prima ora, 100 km nella seconda, 80 km nella terza e altri 100 km nell’ultima ora; oppure 50 km nella prima ora, 100 km nella seconda, 200 km nella terza e 50 km nell’ultima ora.
Rappresentiamo mediante un grafico il movimento dell’auto, considerando le due possibilità che sono schematizzate nella tabella.
Possiamo osservare che l’inclinazione dei tratti di retta dipende dalla velocità in ciascun tratto 5 .
FISSA I CONTENUTI ESSENZIALI
Abbina i termini con la definizione corretta.
1 Tachimetro
2 Velocità
3 Moto vario
4 Moto uniforme
1: 2: 3: 4:
1 ipotesi 2
5 Grafico orario del moto vario.
a Moto di un corpo con velocità variabile.
b Moto di un corpo con velocità costante.
c Rapporto tra spazio percorso e tempo impiegato a percorrerlo. d Strumento che misura la velocità istantanea.
VERSO LE COMPETENZE
Manuela è uscita di casa per fare una passeggiata. Il grafico rappresenta la sua posizione in funzione del tempo.
Segna con una crocetta se vero (V) o falso (F).
1. Il grafico mostra che Manuela nel tratto 3 ha camminato più velocemente che nel tratto 1.
2. Il grafico mostra che Manuela nel tratto 5 è tornata indietro.
3. Il grafico mostra che Manuela nel tratto 1 e nel tratto 5 ha camminato alla stessa velocità.
4. In 70 minuti, comprese le soste, Manuela ha percorso 1400 metri.
L’accelerazione e il moto accelerato lezione 3
LAB STEM
PROVE DI CADUTA LIBERA
Cade a terra più rapidamente un foglio di cartoncino o un evidenziatore? La risposta sembra scontata, ma se esegui, a casa o in classe, questo semplice esperimento nei tre diversi modi che ti proponiamo, scoprirai delle cose interessanti.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• un foglio di cartoncino leggero
• un evidenziatore
• una bilancia da cucina



PROCEDIMENTO
Determina con la bilancia da cucina i pesi del foglio di cartoncino e dell’evidenziatore.
Prova 1
Tieni in una mano l’evidenziatore e nell’altra il foglio di cartoncino in posizione orizzontale. Lasciali cadere nello stesso istante da un’altezza di circa un metro. Osserva e annota quale dei due oggetti arriva per primo sul pavimento.
Prova 2
Tieni in una mano l’evidenziatore e nell’altra il foglio di cartoncino, ma questa volta in posizione verticale. Lasciali cadere nello stesso istante da un’altezza di circa un metro. Osserva e annota l’ordine di arrivo dei due oggetti sul pavimento.
Prova 3
Ripiega più volte il cartoncino, in modo da cambiarne la forma iniziale. Tieni in una mano l’evidenziatore e nell’altra il cartoncino ripiegato. Lasciali cadere nello stesso istante da un’altezza di circa un metro. Osserva e annota l’ordine di arrivo dei due oggetti sul pavimento.
■ OSSERVA E RISPONDI
1. In che ordine gli oggetti raggiungono il pavimento nella prova 1? E nelle due prove successive?
2. Puoi affermare che gli oggetti cadono tutti alla stessa velocità?
3. Scrivi la relazione dell’esperimento.
1
L’accelerazione
Quando lasci cadere un oggetto da una certa altezza, come hai fatto nell’esperimento appena proposto, ti accorgi che si muove lungo una traiettoria rettilinea diretta verso il basso aumentando progressivamente la sua velocità. In questo tipo di moto, chiamato moto di caduta libera, il valore iniziale della velocità è uguale a zero (perché l’oggetto è fermo) e raggiunge il suo massimo valore quando l’oggetto arriva al suolo.
La grandezza fisica che misura la rapidità con cui varia la velocità di un corpo nel tempo è l’accelerazione.
L’accelerazione, a, misura la variazione della velocità in un certo intervallo di tempo.
accelerazione = variazione della velocità intervallo di tempo
Il moto è accelerato quando la velocità aumenta e l’accelerazione assume valori positivi. Il moto è decelerato quando la velocità diminuisce e l’accelerazione assume valori negativi 1 .
Se indichiamo con v1 la velocità iniziale, con v2 la velocità finale, con t1 il tempo iniziale e con t2 il tempo finale, l’accelerazione si esprime con il rapporto:
Più in generale, se indichiamo con v la differenza tra le due velocità e con t la differenza tra i valori dei tempi, otteniamo:
a = v t
Facciamo l’esempio di un ciclista che, durante una gara, aumenta la sua velocità da 10 m/s a 14 m/s in 2 secondi. La velocità iniziale del ciclista (v1) è 10 m/s, mentre la velocità finale (v2) è 14 m/s; la variazione di velocità che avviene nell’intervallo di tempo (2 s) è pari a:
(14 – 10) m/s = 4 m/s
L’accelerazione a del ciclista risulta:
a = 4 m/s = 4 m 1 = 2 m/s2
2 s s 2 s
In altre parole, il ciclista aumenta ogni secondo la sua velocità di 2 m/s.
L’unità di misura dell’accelerazione è il m/s2 (si legge “metro al secondo quadrato”).
Accelerazione con valori positivi
Velocità 1 Accelerazione e decelerazione.
Accelerazione con valori negativi
Velocità
Un moto con accelerazione costante.
2 Il moto uniformemente accelerato
Osserviamo il moto di un’automobile dal momento della sua partenza 2 .
Da ferma, cioè con velocità iniziale v1 = 0, l’automobile raggiunge dopo 1 secondo la velocità v2 = 2 m/s, dopo 2 secondi la velocità v3 = 4 m/s, dopo 3 secondi la velocità v4 = 6 m/s, dopo 4 secondi la velocità v5 = 8 m/s, e così via.
t (s) v (m/s) a (m/s2)
1 2 2
2 4 2
3 6 2
4 8 2 t
Tab. 1 a
(s) v (m/s) s (m) 1 2 2 2 4 8 3 6 18 4 8 32
1 b

L’automobile si muove con accelerazione costante, nell’intervallo di tempo considerato. Nell’intervallo tra 0 e 1 secondo, l’accelerazione è:
a = v2 – v1 = (2 – 0) m/s = 2 m/s2
t2 – t1 1 s
Nell’intervallo tra 1 e 2 secondi, l’accelerazione è:
a = v3 – v2 = (4 – 2) m/s = 2 m/s2
t2 – t1 1 s
e così per gli altri due successivi intervalli di tempo Tab. 1 a
Un moto accelerato in cui l’accelerazione è costante in ogni istante si dice uniformemente accelerato.
Calcoliamo gli spazi percorsi dall’automobile Tab. 1 b
Osserviamo che, quando il tempo raddoppia, lo spazio aumenta di quattro volte, quando triplica si incrementa di 9 volte e così via. Esiste quindi una relazione di proporzionalità tra lo spazio percorso e il quadrato del tempo impiegato.
3
Il moto dei corpi in caduta libera
Ora che sai che cos’è l’accelerazione, quali sono le formule che la descrivono e conosci le caratteristiche del moto uniformemente accelerato, puoi comprendere meglio il moto dei corpi in caduta libera. Osservare nel dettaglio, a occhio nudo, il moto di un corpo che cade è un’impresa impossibile: la velocità di caduta impedisce al nostro occhio di osservare le diverse posizioni assunte dal corpo lungo la sua traiettoria. Esiste però una particolare tecnica fotografica, detta stroboscopica, che scatta immagini ripetute di un oggetto o di un fenomeno a intervalli di tempo costanti. Grazie a questa tecnica è stato possibile scattare la fotografia di una pallina in caduta libera. Come puoi osservare, lo spazio percorso dalla pallina tra uno scatto e l’altro aumenta secondo dopo secondo: la velocità di caduta cresce di un valore costante di circa 9,8 m/s2
Questa accelerazione è chiamata accelerazione di gravità g ≈ 9,8 m/s2.
Il moto di un corpo in caduta libera è un moto uniformemente accelerato.
Tab.
Per calcolare lo spazio percorso da un corpo in caduta libera si utilizza la formula:
s = 1 g t2 2
La legge oraria per qualsiasi moto uniformemente accelerato è:
s = 1 a t 2 2
Studiamo la relazione tra spazio e tempo per i corpi in caduta libera riferendoci, come esempio, all’immagine stroboscopica della pallina 3 . Utilizzando la formula sopra, calcoliamo lo spazio percorso a ogni intervallo di un decimo di secondo (0,1 s è il tempo tra uno scatto e l’altro della macchina fotografica) e riportiamo i dati ottenuti in una tabella.
3 Fotografia stroboscopica e grafico orario del moto di una pallina in caduta libera.
Calcoliamo l’accelerazione per ogni intervallo di tempo.
Come possiamo vedere l’accelerazione è costante e vale 980 cm/s2 (cioè 9,8 m/s2). Il moto, quindi, è uniformemente accelerato e il suo grafico orario è una parabola, come puoi verificare riportando nel piano cartesiano i valori della relazione spazio-tempo della prima tabella.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. Se in un moto l’accelerazione è costante la velocità varia continuamente.
2. Se al kilometro 2 e al kilometro 3 di un percorso la velocità è la stessa possiamo dire che in quel tratto il moto è avvenuto senza accelerazione.
3. Se in due istanti differenti la velocità di un corpo è la stessa in quell’intervallo di tempo l’accelerazione è nulla.
4. Se la velocità di un corpo diminuisce in modo costante a ogni secondo il moto è uniformemente decelerato.

CON LA SINTESI
lezione 1 GLI ELEMENTI
CHE DESCRIVONO IL MOTO
Per stabilire se un corpo è fermo o in movimento occorre scegliere un sistema di riferimento. Per il principio della relatività galileiana i sistemi di riferimento da considerare sono i sistemi inerziali, cioè fermi o in movimento con velocità costante. Un corpo è in quiete se non cambia posizione rispetto al sistema di riferimento fissato; in moto se la sua posizione cambia. Gli elementi che descrivono il moto sono: la traiettoria, cioè la linea formata dalle successive posizioni occupate dal corpo durante il suo movimento. Può essere rettilinea, circolare, parabolica; lo spazio percorso, cioè la distanza dal punto di partenza a quello di arrivo; si misura con il metro o con i suoi multipli e sottomultipli; il tempo impiegato dalla partenza all’arrivo, che si misura in multipli o sottomultipli del secondo.
lezione 2 LA VELOCITÀ E IL MOTO RETTILINEO
La velocità è il rapporto tra lo spazio percorso e il tempo impiegato a percorrerlo. Si misura in metri al secondo (m/s) o kilometri orari (km/h). Per trasformare i m/s in km/h si moltiplica per 3,6; per passare da km/h a m/s si divide per 3,6.

Un corpo si muove di moto rettilineo uniforme quando percorre una traiettoria rettilinea con velocità costante, cioè percorre spazi uguali in tempi uguali. La legge oraria di questo moto è: s = v ⋅ t























Nel moto rettilineo uniforme esiste una proporzionalità diretta tra spazio percorso e tempo che è rappresentata da una retta in un grafico cartesiano.


Se un corpo non mantiene una velocità costante si parla di moto vario. Per descriverne le caratteristiche si considera la velocità istantanea vi
















La velocità istantanea cambia continuamente, quindi è utile riferirsi alla velocità media, vm. In un grafico cartesiano l’inclinazione della retta dipende dalla velocità di ciascun tratto. È possibile rilevare la velocità istantanea con un apposito strumento, il tachimetro.

lezione 3 L’ACCELERAZIONE E IL MOTO ACCELERATO
L’accelerazione misura la variazione di velocità in un intervallo di tempo. Se la velocità aumenta l’accelerazione assume valori positivi e si parla di moto accelerato; se la velocità diminuisce l’accelerazione assume valori negativi e si parla di moto decelerato
L’accelerazione si misura in m/s2
Un moto uniformemente accelerato è un moto con accelerazione costante.
La legge oraria di un moto uniformemente accelerato è:
s = 1 — 2 at2
Tra i moti uniformemente accelerati particolarmente importante è il moto in caduta libera, cioè il movimento degli oggetti che cadono a terra per effetto della forza di gravità.
La legge oraria del moto di caduta libera è:
s = 1 2 gt2
dove g indica il valore dell’accelerazione di gravità che vale circa 9,8 m/s2
Il grafico spazio-tempo di un moto in caduta libera è una parabola.

CON LA MAPPA
Adesso che hai ripassato i contenuti essenziali con la sintesi, prova a completare la mappa con le parole chiave suggerite e a trovare le definizioni corrispondenti.
caduta libera - rettilineo uniforme - riferimento inerziale - tempo impiegato - traiettoria - vario
è caratterizzato da

può essere
accelerato o decelerato
uniformemente accelerato
si può definire come un
9. cambiamento di posizione
quando la velocità non è costante

come è il moto di un corpo in
rispetto a un
a. Linea costituita dalle successive posizioni occupate dal corpo nel suo moto.
b. Distanza tra il punto di partenza e il punto di arrivo.
c. Moto caratterizzato da accelerazione costante.
d. Moto caratterizzato da traiettoria rettilinea e velocità costante.
1. IL MOTO DI UN CORPO
4. spazio percorso
7.
8.
11. 5. 6.
10.
2.

lezione 1 GLI ELEMENTI
CHE
DESCRIVONO IL MOTO
1 Scegli la soluzione corretta.
a. Un corpo è in stato di quiete quando:
1 ha accelerazione nulla.
2 ha velocità costante.
3 mantiene una traiettoria rettilinea.
4 non cambia posizione rispetto a un opportuno sistema di riferimento.
b. La traiettoria è:
1 la linea del movimento.
2 il grafico del movimento.
3 l’insieme delle posizioni occupate dal corpo in movimento.
4 la direzione del movimento.
c. Una traiettoria curvilinea:
1 è sempre circolare.
2 e sempre aperta.
3 è sempre chiusa.
4 può essere aperta o chiusa.
2 Segna con una crocetta se vero (V) o falso (F).
a. Un sistema di riferimento inerziale è fermo o in moto con velocità costante.
b. Nello studio di un movimento il tempo si misura solo in ore.
c. Quando vai in bicicletta sei in quiete rispetto alla bicicletta.
d. Lo spazio percorso da un’auto su un circuito si misura in metri.
3 Completa le frasi con i termini corretti.
a. La studia i corpi in movimento.
b. Un corpo in quiete rispetto a un sistema di riferimento può essere in rispetto a un altro sistema.
c. Un segnale stradale è un punto di riferimento .
d. Una tabella riporta le posizioni del corpo in movimento nei vari istanti.
e. 4 Osserva il disegno e inserisci accanto a ogni termine il numero corrispondente.
a. Traiettoria rettilinea
b. Traiettoria curvilinea
c. Traiettoria circolare
d. Traiettoria parabolica
lezione 2 LA VELOCITÀ E IL MOTO
RETTILINEO
5 Scegli la soluzione corretta.
a. Un corpo si muove di moto rettilineo uniforme quando:
1 percorre una traiettoria rettilinea con accelerazione costante.
2 si muove con velocità costante lungo una qualunque traiettoria.
3 percorre una traiettoria rettilinea con velocità che aumenta in modo costante.
4 percorre una traiettoria rettilinea mantenendo in ogni punto la stessa velocità.
b. La formulazione corretta della legge oraria del moto rettilineo uniforme è:
1 v = t/s
2 s = vt
3 t = sv
4 v = st
6 Segna con una crocetta se vero (V) o falso (F).
a. 10 m/s = 36 km/h
b. 60 km/h = 6 km/s
c. 72 km/h = 20 m/s
d. 50 km/h = 5 m/s
7 Scegli la soluzione errata.
Un corpo si muove di moto rettilineo uniforme alla velocità di 108 km/h.
1 Ha una velocità di 30 m/s.
2 Dopo mezz’ora ha percorso 54 km.
3 Dopo 5 secondi ha percorso 1,5 km.
4 Impiega un’ora e mezza per percorrere 162 km.
8 Osserva il disegno e completalo con i valori di tempo e spazio mancanti.
lezione 3 L’ACCELERAZIONE E IL MOTO ACCELERATO
9 Completa le frasi con i termini corretti.
a. Un moto si dice uniformemente quando la sua aumenta della stessa quantità in uno stesso intervallo di .
b. Se un corpo ha accelerazione si muove di moto uniforme oppure è in stato di .
10 Segna con una crocetta se vero (V) o falso (F).
a. La velocità media di un corpo in caduta libera è la metà della velocità finale.
b. Se un vaso di fiori arriva a terra in 1 secondo significa che è caduto da 4,9 m.
c. Il valore dell’accelerazione di gravità sulla Terra dipende dal peso del corpo che si considera.
d. Lo spazio percorso da un corpo in caduta libera si ottiene moltiplicando gravità per tempo.
11 Scegli la soluzione corretta.
Quale tra i seguenti è il grafico del moto di caduta libera?
12 Segna con una crocetta se vero (V) o falso (F).






a. Tutti i pedoni sono in movimento.
b. Il pedone 1 è fermo, il pedone 4 in movimento.
c. L’auto 3 si muove di moto accelerato. d. L’auto 2 è ferma.
APPLICARE CONOSCENZE
1 Risolvi i problemi.
a. Un’auto percorre 441 km in 4 h 22 min 30 s. Qual è la sua velocità media?
b. La luce viaggia alla velocità di 300 000 km/s. Sapendo che un raggio solare raggiunge la Terra in 8 minuti e 20 secondi, qual è la distanza Sole-Terra?
c. La velocità del suono nell’aria è di 340 m/s. Durante un temporale Lucia vede un fulmine scaricarsi a terra e sente il tuono dopo 4 secondi. A quale distanza si trova dal punto di impatto del fulmine?
d. Due treni sono partiti contemporaneamente da due stazioni distanti tra loro 480 km e viaggiano uno verso l’altro a 120 km/h il primo e 80 km/h il secondo. Dopo un’ora quale distanza li separa?
e. Una bicicletta raggiunge i 54 km/h in 5 secondi con un’accelerazione di 1 m/s2. Calcola la velocità iniziale.
f. Un oggetto cade da un’altezza di 236 m. Dopo quanto tempo arriva al suolo? A quale velocità?
g. Alessandro, Bianca, Carlo e Daniela abitano in diversi punti della città e devono raggiungere tutti la stazione per prendere il treno delle 17:05 per Torino.
Alessandro esce di casa alle 16:20 e impiega 41 minuti; Bianca esce alle 16:29 e arriva alla stazione in 29 minuti; a Carlo occorrono 32 minuti ed esce alle 16:36; Daniela lascia la sua casa alle 16:12 e impiega 51 minuti. Chi di loro non riuscirà a prendere il treno?
1 Alessandro.
2 Carlo. 3 Bianca. 4 Daniela.
TRARRE INFORMAZIONI
DA UN GRAFICO E FORMULARE IPOTESI
2 Osserva il grafico e rispondi.
Il grafico rappresenta il moto di due corpi. Il tempo è misurato in secondi, lo spazio in metri.
a. Osservando il grafico che tipo di moto è quello di ciascun corpo?
b. Quali sono le velocità dei due corpi nel momento in cui si incontrano?
c. Quale distanza li separava alla partenza?
d. In quale istante si incontrano i due corpi?
e. Come si ricava questa informazione dal grafico?
f. Qual è lo spazio percorso rispettivamente dai due corpi prima di incontrarsi?
INTERPRETARE TABELLE E COSTRUIRE GRAFICI
3 Un corridore, un ciclista e un automobilista partono contemporaneamente e percorrono una strada rettilinea con velocità costante. Le tabelle orarie del loro moto sono le seguenti:
TRARRE INFORMAZIONI DA UN TESTO E FORMULARE IPOTESI
5 Leggi il brano.
DUE O QUATTRO?
a. Rappresenta su uno stesso grafico i tre moti.
b. Che cosa rappresenta l’inclinazione della retta?
SPIEGARE I FENOMENI
4 Osserva l’immagine e rispondi alle domande.

a. Quale fenomeno è illustrato?
b. Di quale tipo di moto si muovono gli oggetti?
Un ghepardo che corre al massimo della sua velocità può raggiungere, e superare con facilità, i 100 km/h. Un uomo non riuscirà mai a superare i 45 km/h, nonostante tutti i suoi sforzi. Come mai questa differenza? Uno studio dell’università di Stoccarda ha rilevato che gli animali quadrupedi sono più veloci di quelli bipedi. La disciplina di cui si occupa Michael Günther, il primo autore dello studio, si chiama allometria, e studia il rapporto tra le dimensioni del corpo di un animale e la sua forma. Per esempio un topo grosso come un elefante non potrebbe esistere, perché avrebbe ossa troppo sottili e collasserebbe sotto il suo stesso peso. Lo scienziato, insieme a un team di ricercatori, ha quindi provato a mettere in relazione le dimensioni del corpo di diversi animali di terra che corrono con la loro forma e soprattutto con la loro velocità, e a capire quali caratteristiche ne limitano la rapidità, e quali strutture al contrario sono necessarie per correre più rapidamente. Incrociando tutti i dati relativi alle specie analizzate, i ricercatori hanno creato un modello teorico che descrive il modo in cui il corpo di un animale deve cambiare forma man mano che cresce per continuare a mantenere alta la velocità della sua corsa.
(Tratto da focus.it)
Rispondi alle domande e svolgi le attività proposte, da solo o in gruppo con i tuoi compagni.
a. Quali sono le velocità massime raggiunte rispettivamente dall’uomo e da un ghepardo?
b. A quali conclusioni sono giunti i ricercatori dell’università di Stoccarda?
c. Come si chiama la disciplina di cui si occupa il dottor Günther? Che cosa studia?
d. Formula un’ipotesi che spieghi la ragione per cui i quadrupedi sono più veloci dei bipedi.
DIGITAL SKILLS
Ricerca in rete quali sono gli animali terrestri più veloci e stila una classifica.


SUSTAINABLE
One of the most relevant impacts associated with transportation in tourist destinations is related to greenhouse gas emissions. It is estimated that the tourism industry is directly responsible for approximately 8% of the total volume of CO2 emissions. Although all means of transportation require energy, some are more efficient and cleaner than others. Sustainable transportation consists of green and eco-friendly forms of vehicular travel to minimise damage to the environment. In general, planes and cars tend to be the most used means of transport, but they are also the least efficient means of transportation. When going on holiday to destinations that are close to home, travelling by train or bus is the best way to cut emissions. Once at the destination, taking the bus, travelling by rail, or cycling around town is better than renting a car.
How can you reduce your environmental impact during air-travel?
1. Avoid flying to nearby destinations
2. Book non-stop flights: they require less fuel than itineraries with multiple stops
3. Fly economy
COMPREHENSION EXERCISES
1. Read the text and answer the questions.
a. What are the most used means of transportation?
b. What are the best ways to get around the holiday destination?
c. How can air-travel’s environmental impact be reduced?
2. Think
To travel from Milan to Rome, the highspeed train takes 3 hours and 8 minutes and arrives in the city centre. The flight lasts 1 hour and 20 minutes, but you must also consider time for check-in, boarding, and transfers to and from the airports.
a. Compare the two travel possibilities. Which is faster?
b. Which is more environmentally friendly?



Trenino del Bernina.
Le forze unità
lezione 1
Che cos ’ E ` una forza
lezione 2
I principi della dinamica
lezione 3
L ’ equilibrio dei corpi
lezione 4
Macchine e leve
lezione 5
La pressione e le forze nei fluidi

LEZIONI POWERPOINT in




BUONE NOTIZIE PER IL FUTURO
Aerei che cambiano forma
Circa il 2,5% delle emissioni globali di CO2 è prodotto dal trasporto aereo. Per trasformare il volo e renderlo più sostenibile è necessario intervenire sui carburanti decarbonizzazione del trasporto aereo.
Già oggi il cherosene è integrato con il SAF (Sustainable Aviation Fuel), un combustibile liquido che riduce le emissioni di CO2 fino all’80%. Le materie prime per produrre il SAF sono scarti di varia provenienza, come oli da cucina usati, grassi animali, rifiuti urbani e residui della produzione agricola, ma può anche essere prodotto sinteticamente catturando carbonio direttamente dall’aria. Ma sarà idrogeno, più economico e sostenibile, a diventare il carburante degli aerei del futuro. Già sono stati effettuati voli sperimentali che utilizzano idrogeno liquido, immagazzinato in serbatoi a bassissima temperatura, per ottenere l’energia necessaria per voli di migliaia di kilometri, emettendo solo vapore acqueo.
Anche la progettazione e l’aerodinamica degli aerei è determinante per la riduzione del consumo di carburanti. È il caso di Flying-V, un prototipo di aereo dalla particolare forma a V che ricorda quella degli aeroplanini di carta, che permette di sfruttare al meglio le caratteristiche della fusoliera e delle ali: la fusoliera contribuisce al sollevamento dell’aereo e crea meno resistenza aerodinamica mentre le ali migliorano la portanza. Si ritiene che la forma aerodinamica di Flying-V ridurrà il consumo di carburante del 20% rispetto agli aerei di oggi.
che cos ’ E ` una forza lezione 1
CARTA PENNA COMPUTER

1
Una forza può far cadere un corpo (i birilli) oppure lo può deformare (il sacco da pugile).
Guarda il video e scrivi le risposte sul quaderno.
1. Quali forze entrano in gioco in un’azione di una partita di calcio?
2. Che cosa succede alle forze durante una parata?
3. Che cos’è l’effetto Magnus? Quali sono le sue conseguenze?
Metti in pausa il video nei seguenti punti.
4. Descrivi con le tue parole che cosa accade nei diversi momenti indicati dai numeri.
1 Le caratteristiche di una forza
Tutto quello che ci circonda ha due caratteristiche fondamentali: è fermo o si muove. Nessun corpo però si muove spontaneamente, ma solo perché ha subito l’effetto di una forza. Anche il cambiamento di forma di un corpo (deformazione) è provocato da una o più forze 1 . È proprio basandosi sugli effetti provocati dalla sua azione che si è potuto dare una definizione di forza.
Una forza è tutto ciò che produce variazioni allo stato di quiete o di moto di un corpo, oppure modifica la forma del corpo stesso.

Per descrivere con precisione una forza, dobbiamo conoscere le sue caratteristiche. Per esempio, se sposti un libro sul tavolo con la mano puoi:
• spingere con più o meno forza;
• appoggiare la mano in punti diversi del libro per esercitare la spinta;
• spostare il libro in varie direzioni: orizzontale, verticale e obliqua;

• avvicinare o allontanare il libro lungo queste direzioni. In ognuna delle azioni che hai compiuto è stata applicata una forza.
Cronaca di una partita di calcio
ORA FERMA L’IMMAGINE!
Per descrivere una forza occorre conoscere i seguenti elementi:
• il punto di applicazione, cioè il punto in cui è applicata la forza; per esempio, il punto in cui appoggi la mano per spostare il libro;
• la direzione della forza, cioè la retta lungo la quale la forza agisce: può essere orizzontale, verticale, obliqua;

• il verso della forza, cioè il senso in cui agisce la forza lungo la direzione: per esempio, in una direzione verticale il verso può essere in alto o in basso;
• l’intensità, cioè il valore della forza.
Questi elementi caratterizzano una forza e permettono di affermare che essa è una grandezza vettoriale e può essere rappresentata mediante un vettore 2 .
2 Rappresentazione grafica del vettore forza.







Un vettore è un segmento orientato: la freccia a un’estremità indica il verso; la retta a cui appartiene il segmento indica la direzione; la lunghezza del segmento rappresenta l’intensità della forza.
Il simbolo utilizzato per indicare una forza è la lettera effe maiuscola sormontata da una freccia (F ). Il solo simbolo F senza la freccia sta a significare l’intensità della forza che, come altre grandezze fisiche, per esempio la temperatura, è una grandezza scalare. Una grandezza scalare è sempre rappresentata da un numero con una unità di misura.
2 Come si misurano le forze



L’intensità di una forza è misurata con il dinamometro, lo stesso strumento che viene impiegato per valutare il peso (come sai, il peso è l’espressione della forza di attrazione esercitata dalla massa della Terra su un corpo). Il dinamometro è costituito da una molla di acciaio contenuta in un tubo. L’estremità superiore è dotata di un gancio o di un anello che serve per appendere lo strumento; l’estremità inferiore della molla termina con un gancio a cui si applica la forza da misurare. La molla si allunga ogni volta che vi si aggancia un peso e un indice scorrevole segna, su una scala graduata, il valore della forza 3 .


Nel Sistema Internazionale l’unità di misura della forza è il newton (N), dal nome dello scienziato inglese Isaac Newton.
3 La composizione delle forze


Raramente su un corpo agisce una sola forza: nella maggior parte dei casi sono molte le sollecitazioni a cui è sottoposto. L’effetto complessivo di tutte le forze applicate è determinato dalla risultante.
Si chiama risultante (R) la forza che da sola produce l’effetto delle singole forze applicate al corpo.
Poiché le forze sono grandezze vettoriali, per determinare la risultante non si possono considerare solo le loro intensità: occorre conoscere anche punto di applicazione, direzione e verso. In alcuni casi, è possibile determinare facilmente l’effetto finale di più forze applicate a un corpo. Vediamo alcuni esempi.
3 Un dinamometro.




■ FORZE CONCORDI
Due forze si dicono concordi quando hanno lo stesso punto di applicazione, la stessa direzione e lo stesso verso. La risultante di due forze concordi ha la stessa direzione e lo stesso verso delle forze considerate e intensità uguale alla somma delle due intensità 4
= F1 + F2
4 Somma di forze concordi.

■ FORZE DISCORDI
Due forze si dicono discordi quando hanno lo stesso punto di applicazione, la stessa direzione ma versi opposti. La risultante di due forze discordi ha la stessa direzione delle forze considerate, verso concorde con quello della forza maggiore e intensità pari alla differenza delle singole intensità (F1 e F2) 5 .

= F1 – F2 con F1 > F2


Due forze discordi che hanno anche la stessa intensità si dicono opposte: la risultante è nulla e le due forze sono in equilibrio. In questo caso è come se nessuna forza agisse sul corpo.
■ FORZE OBLIQUE



Due forze si dicono oblique quando hanno lo stesso punto di applicazione, ma direzione e verso sono diversi. La loro risultante si determina graficamente in modo geometrico, con la regola del parallelogramma 6 . Le fasi sono le seguenti:
5 Somma di forze discordi.















1. si disegnano i due vettori che rappresentano le forze da sommare, con lo stesso punto di applicazione;
2. dalla punta di ogni vettore si traccia la parallela all’altro vettore. Si ottiene così un parallelogramma; 3. partendo dal punto di applicazione delle forze si traccia la diagonale fino al vertice opposto: la diagonale è la forza risultante.




Quando le forze applicate a un corpo sono più di due, la risultante del sistema si ottiene con il metodo del poligono funicolare














R
R
6 Somma di forze oblique.
La costruzione del poligono funicolare
4 Tanti tipi di forze
Negli esempi considerati finora abbiamo parlato della forza esercitata dai muscoli del nostro corpo. In natura ci sono tipi diversi di forze.
• Forza peso: è la forza esercitata dalla massa della Terra che attrae tutto quello che si trova nei pressi della sua superficie, anche il corpo di un tuffatore che si lancia da una scogliera.
• Forza di attrito: è la forza che si genera quando due corpi sono a contatto tra di loro. Per esempio, il contatto tra i copertoni delle ruote di una mountain bike e la superficie della strada è all’origine della forza di attrito, che permette alla bicicletta di avanzare anche sulle strade più ripide e impervie. La forza di attrito si genera anche dal contatto tra un corpo e un fluido, come accade quando nuotiamo nell’acqua.
• Forza elastica: è la forza che riporta un corpo deformabile alla forma e alle dimensioni originarie. Il materiale di cui è fatto il robusto cavo usato per il bungee jumping, per esempio, è estremamente elastico, cioè si deforma per poi tornare alle dimensioni iniziali.
• Forza elettrica: è la forza prodotta dalle cariche elettriche contenute negli atomi, ma si può ottenere da fonti di energia diverse utilizzando appositi generatori. Per esempio, la forza muscolare impiegata per praticare lo spinning può essere convertita, grazie a un generatore, in energia elettrica. Anche la forza che attrae i capelli alla spazzola quando ci pettiniamo è una forza elettrica.
• Forza magnetica: è la forza generata dal nucleo della Terra e da particolari materiali in grado di attrarre oggetti di ferro, come, per esempio, la calamita. Per praticare l’orienteering è necessario usare la bussola; l’ago magnetico dello strumento si muove sul quadrante indicando sempre la direzione del nord. Ciò è dovuto all’azione del campo magnetico terrestre perché il nostro pianeta si comporta come una enorme calamita.
• Forza nucleare: è la forza che tiene uniti i protoni e i neutroni all’interno dei nuclei degli atomi. È la forza all’origine della formazione e della vita delle stelle. Si può sfruttare per produrre energia elettrica grazie a processi di fissione nucleare, come avviene nelle centrali nucleari.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. La forza è una grandezza vettoriale.
2. L’unità di misura di una forza è il kilogrammo.
3. La direzione indica il punto verso cui agisce la forza.
Qual è l’animale più forte della terra?
In termini di forza assoluta sulla terraferma, l’elefante africano è l’animale più forte. Tuttavia, se commisuriamo i valori di forza alle proporzioni dell’animale, il più forte al mondo è l’Onthophagus taurus, lo scarabeo stercorario cornuto, un insetto lungo 1 cm che è in grado di trascinare un carico equivalente a 1141 volte la propria massa. Pensando

4. Due forze concordi hanno lo stesso verso. F V
VERSO LE COMPETENZE
A un dinamometro, costituito da una molla lunga 7 cm, vengono appesi degli oggetti di massa uguale. La tabella riporta l’allungamento in centimetri della molla in relazione al numero degli oggetti appesi.
1. Rappresenta i dati con un grafico cartesiano.
2. Quali considerazioni ricavi dall’osservazione del grafico?
I principi della dinamica lezione 2
LAB TINKERING
IL MOTO DI UN CARRELLINO
Quando si applica una forza a un oggetto in stato di quiete il risultato che si ottiene è quello di metterlo in movimento. È possibile stabilire una relazione tra la forza applicata e il movimento dell’oggetto? Verifichiamolo con questo esperimento.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• mattoncini da costruzione, inclusi ruote e perni
• elastici di misure diverse
• una biglia di ferro
• un chiodino
• martello
• tavola di legno
• matita
• metro









PROCEDIMENTO
1. Costruisci un carrellino utilizzando i mattoncini in modo che abbia la sponda anteriore più alta.
2. Chiedi a un adulto di fissare con il martello il chiodino sulla tavola posizionandolo vicino al bordo, ma centralmente.
3. Passa l’elastico più corto intorno alla sponda più alta del carrellino e intorno al chiodino. Fai attenzione che il chiodino si trovi allineato con il centro del carrello.
4. Tendi l’elastico spostando indietro il carrello e lascialo andare.
5. Con la matita segna sul legno il punto di arresto del carrellino.
6. Ripeti l’esperimento mettendo la biglia di ferro sul carrellino.
7. Prendi ora un elastico più lungo e ripeti le operazioni 3 e 4 segnando il punto di arrivo.
8. Ripeti con gli altri elastici che hai a disposizione.
9. Misura le distanze percorse dal carrellino in ogni prova.
■ OSSERVA E RISPONDI
1. Quando aggiungi la biglia, il carrellino si sposta della stessa distanza?
2. Come varia la distanza percorsa dal carrellino quando usi elastici più lunghi?
1 La dinamica
Gli effetti prodotti dalle forze sono numerosi, ma quelli più visibili sono i cambiamenti del movimento dei corpi.
Pensa a queste situazioni: quando un portiere respinge un tiro diretto in porta, cambia la traiettoria del pallone; quando soffia il vento, la sua forza mette in movimento le foglie degli alberi o le pale di un generatore eolico.
Il settore della fisica che studia la variazione del moto dei corpi in seguito all’applicazione di forze è la dinamica. La dinamica si fonda su tre importanti leggi fisiche, i tre principi della dinamica enunciati dal fisico inglese Isaac Newton.
2
Il primo principio della dinamica
Prendi una pallina e appoggiala sul banco: essa rimane ferma (conserva il suo stato di quiete) finché una forza, come una spinta, un soffio o anche la semplice inclinazione del banco, non la mette in moto. A questo punto la pallina tenderà a muoversi in linea retta con velocità costante, quindi di moto rettilineo uniforme. Questa osservazione permette di formulare il primo principio della dinamica o prima legge di Newton
Il primo principio della dinamica afferma che un corpo mantiene il suo stato di quiete o di moto rettilineo uniforme finché non interviene una forza a modificare tale stato.
La tendenza di un corpo a mantenere il suo stato di quiete o di moto è chiamata inerzia, perciò il primo principio della dinamica è noto anche come principio di inerzia. Perché inerzia? Perché i corpi possiedono una certa ”pigrizia” e, se non sono soggetti a forze, rimangono nel loro stato: fermi se erano fermi, in movimento se già si stavano spostando. Dobbiamo a Galileo Galilei l’intuizione della presenza dell’inerzia, con cui dobbiamo fare i conti nella vita di tutti i giorni.
Nella realtà, tutti i corpi in movimento prima o poi si fermano: un pattinatore sul ghiaccio deve continuare a spingere, altrimenti gradualmente si ferma, anche se apparentemente il ghiaccio non presenta ostacoli 1 . Allo stesso modo, quando percorri in bicicletta una strada pianeggiante devi pedalare in continuazione, altrimenti ti arresti. Queste osservazioni sembrano contraddire il primo principio della dinamica, ma in realtà tutto ciò è il risultato dell’azione di un’altra forza: l’attrito
L’attrito è una forza che si oppone al movimento dei corpi.
L’attrito dipende dalle irregolarità e dalle dimensioni delle due superfici a contatto: quanto più una superficie è ruvida e maggiore è l’area di contatto, tanto più l’attrito è forte.
Non esistono superfici perfettamente lisce, ma è possibile attenuare gli effetti dell’attrito in vari modi, per esempio riducendo la superficie di contatto: per spostare una cassa possiamo trascinarla sul pavimento oppure servirci di un carrellino. Un altro valido sistema per ridurre l’attrito è attenuare la rugosità delle superfici utilizzando delle apposite sostanze: per questo motivo tutti i pezzi meccanici in movimento sono costantemente lubrificati. Succede la stessa cosa anche nel nostro corpo: il liquido sinoviale infatti riduce l’attrito tra le ossa in corrispondenza delle articolazioni.
3 Il secondo principio della dinamica
Una forza modifica lo stato di quiete o di moto di un corpo: lo mette in movimento se era fermo, oppure modifica la sua velocità, oppure lo deforma.
Prova a imprimere una spinta di uguale intensità su due corpi di massa diversa, per esempio una pallina da tennis e una pallina da ping-pong. Gli effetti che osservi sono molto diversi: la pallina da tennis, essendo di massa maggiore, subisce una minore accelerazione rispetto alla pallina da ping-pong.


1 Anche su una superficie molto levigata, un corpo in movimento, prima o poi, si ferma.

Il principio di inerzia
RACCONTO GENIALE
2 Relazioni tra accelerazione,
e forza applicatala.












Ora prova a spingere un carrello del supermercato con dentro una confezione di acqua minerale e un altro con due confezioni d’acqua: dovrai sicuramente usare una forza maggiore per mettere in movimento il secondo carrello 2 a
Considerando la massa di un corpo come la misura della resistenza che esso offre all’azione di una forza o anche come la misura della sua inerzia, le due esperienze permettono di affermare che, quanto maggiore è la massa di un corpo in stato di quiete, tanto più grande è la forza necessaria per metterlo in moto. Analogamente, se un corpo è in moto, la forza necessaria per fermarlo è tanto più grande quanto maggiore è la sua massa. Immaginiamo ora di esercitare forze diverse sullo stesso corpo: notiamo che a forza maggiore corrisponde un maggiore spostamento e, quindi, una maggiore accelerazione. Per esempio, se siamo in due persone a spingere con la stessa forza, il carrello acquista un’accelerazione doppia 2 b
Queste considerazioni ci permettono di affermare che esiste una relazione di proporzionalità diretta tra la forza applicata e l’accelerazione acquisita dal corpo. Questa relazione costituisce il secondo principio della dinamica
forza = massa accelerazione
F = m a
Il secondo principio della dinamica afferma che la forza F applicata a un corpo corrisponde al prodotto della massa del corpo (m) per la sua accelerazione (a).
Per esempio, se un corpo con massa di 4 kg subisce un’accelerazione di 5 m/s2, la forza avrà intensità pari a F = 4 kg ⋅ 5 m/s2 = 20 kg ⋅ m/s2.
Poiché l’unità di misura della forza è il newton, possiamo affermare quanto segue.
3 Le forze di azione P e reazione R R
La forza di 1 newton è quella che, agendo su un corpo di 1 kg, ne determina un’accelerazione di 1 m/s2
1 N = 1 kg 1 m/s2

Quindi la forza applicata nell’esempio precedente equivale a 20 N.
4
Il terzo principio della dinamica
Quando prendi lo slancio per tuffarti da una barca devi esercitare una forza che ha come effetto lo spostamento all’indietro dell’imbarcazione. Essa infatti reagisce ed esercita a sua volta una forza su di te, spingendoti in avanti. E ancora, quando sei seduto sul divano il tuo corpo esercita una forza P, la forza peso; il divano a sua volta esercita su di te una forza R uguale e opposta, che ti sostiene. Le due forze in gioco sono chiamate azione e reazione 3 .
Le situazioni di questo tipo sono descritte dal terzo principio della dinamica, noto anche come principio di azione e reazione. Grazie al principio di azione e reazione è possibile descrivere il movimento di un motoscafo, il volo di un elicottero, il meccanismo di propulsione dei razzi.
Secondo il terzo principio della dinamica, quando un corpo esercita una forza su un altro corpo, questo reagisce con una forza di verso opposto, ma uguale alla prima per intensità e direzione.
Ora che conosci le leggi che governano il moto, puoi provare a ritrovarle in situazioni quotidiane. Forse non ci hai mai pensato, ma è l’azione combinata di diversi tipi di forze che permette, per esempio, di andare sullo skateboard 4 .
5
Forze e moti circolari
I pianeti percorrono intorno al Sole orbite a forma di ellisse, che si può considerare come una circonferenza leggermente schiacciata. Il principio d’inerzia afferma che un corpo non soggetto a forze si muove di moto rettilineo uniforme: che cosa interviene per far sì che un pianeta rimanga nella sua orbita, costringendolo a modificare continuamente la sua direzione “spontanea”, cioè quella rettilinea? Il mantenimento di una traiettoria circolare da parte di un corpo in moto è reso possibile dall’esistenza di una forza centripeta diretta verso il centro della traiettoria. I pianeti infatti percorrono una traiettoria quasi circolare perché il Sole li attrae verso di sé; allo stesso modo, la Luna ruota attorno alla Terra perché essa la attrae. Consideriamo questa situazione: la disciplina del lancio del martello. In questa disciplina di atletica leggera l’atleta fa ruotare una sfera di metallo legata a un filo su sé stesso più volte, fino a lanciarlo il più lontano possibile.
Durante le rotazioni, l’atleta sfrutta la forza centripeta, cioè quella forza che tiene il martello in traiettoria circolare, diretta verso il centro cioè dove c’è l’atleta 5 . Più velocemente ruota il martello, più energia accumula, e maggiore sarà la distanza del lancio quando viene lasciato andare.
FISSA I CONTENUTI ESSENZIALI

Quali forze agiscono quando si va sullo skateboard?

5 La forza centripeta è responsabile del moto circolare del martello.
Completa le seguenti frasi inserendo i termini corretti.
1. Il principio di afferma che un corpo mantiene il suo stato di o di moto rettilineo uniforme finchè non interviene una a modificare tale stato.
2. Se ti tuffi da una barca la barca si sposta nella direzione al tuffo, per il principio della dinamica chiamato anche principio di e reazione.
L ’ equilibrio dei corpi lezione 3
LAB TINKERING
L’EQUILIBRISTA
Quali sono le condizioni che permettono a un oggetto sospeso di stare in equilibrio? Cerchiamo di capirlo con questo esperimento.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• cartoncino pesante
• cannuccia
• perno e rotellina
• spago sottile
• forbici e colla
• due monete


PROCEDIMENTO




1. Misura il diametro delle monete che hai scelto e in base a esso ritaglia l’omino nel cartoncino pesante rispettando le proporzioni. Segui il modello che vedi qui a fianco.
2. Incolla le monete al posto dei piedi.
3. Ritaglia due pezzetti di cannuccia e incollali sulle gambe nella posizione indicata dai segni orizzontali.

4. Fai passare il perno nella cannuccia, poi nella rotellina. La rotellina deve stare in mezzo alle gambe e infilata anche nell’altra cannuccia.
5. Tendi bene lo spago, ad esempio tra due sedie, e posiziona l’equilibrista appoggiando la rotellina sullo spago.
■ OSSERVA E RISPONDI
1. L’equilibrista resta in equilibrio?
2. La condizione di equilibrio rimane se lo sposti lungo il filo?
3. Sai fornire una spiegazione di quello che osservi?
1 La statica
Il primo principio della dinamica afferma che un corpo rimane nel suo stato di quiete o di moto rettilineo uniforme finché una forza non interviene a modificarne lo stato. In realtà, anche due forze opposte, cioè di uguale intensità e direzione ma con verso opposto, ap-
CONTENUTI DIGITALI
plicate a un corpo non ne causano alcuno spostamento, perché la loro risultante è nulla Per rendercene conto, consideriamo il gioco del tiro alla fune. Se le due squadre tirano la fune con la stessa intensità, la fune non si muove. L’effetto combinato delle due forze è nullo e il corpo (la fune) rimane fermo o, meglio, si trova in uno stato di equilibrio
Un corpo si trova in uno stato di equilibrio quando la risultante di tutte le forze agenti su di esso è nulla.
La statica è il settore della fisica che studia l’equilibrio dei corpi, cioè le condizioni in base alle quali i corpi rimangono fermi.
Le condizioni di equilibrio si verificano quando la forza di gravità (il peso degli oggetti) è equilibrata dalle forze vincolari Fr, dette anche vincoli Il lampadario non cade perché il soffitto lo “tira” verso l’alto con una forza (Fr) uguale al suo peso (FP), ma in verso opposto 1
2 Il baricentro
Ogni corpo è formato da un grande numero di molecole, ognuna delle quali è sottoposta all’azione della forza di gravità. In base al secondo principio della dinamica, quindi, la forza che agisce su ognuna di esse è uguale alla massa per l’accelerazione di gravità g
Tutte queste piccolissime forze sono parallele tra loro e dirette verticalmente verso il basso; la loro somma costituisce la forza peso FP di tutto il corpo e il suo punto di applicazione è chiamato baricentro G o centro di gravità 2
Il baricentro, o centro di gravità, è il punto in cui è applicata la forza peso del corpo.

forza vincolare Fr Fp forza peso del lampadario
2 Baricentro o centro di gravità.

Nella maggior parte delle situazioni possiamo ritenere che tutto il peso del corpo sia concentrato nel suo baricentro.
Il baricentro di un corpo di forma geometrica regolare e omogeneo, cioè con la stessa densità in tutte le sue zone, coincide con il centro geometrico 3 a Per determinare il baricentro di un oggetto di forma irregolare, sospendilo con un filo a un qualsiasi punto. Quando smette di oscillare traccia il prolungamento del filo di sospensione.
Ripeti l’operazione appendendo l’oggetto in un altro punto: l’intersezione delle due semirette che hai tracciato rappresenta la posizione del baricentro 3 b . a b







1 Equilibri nella tua stanza. baricentro G forza peso



3 Come si determina la posizione del baricentro.




3 L’equilibrio di un corpo appoggiato e di un corpo sospeso
Le condizioni di equilibrio cambiano in relazione alla condizione in cui si trova il corpo. Un corpo è in equilibrio stabile se, dopo un piccolo spostamento dalla sua posizione di equilibrio tende a ritornarvi.
Un corpo è in equilibrio instabile quando, spostato di poco dalla condizione di equilibrio si allontana ancora di più da essa.
Un corpo è in equilibrio indifferente, quando spostato di poco dalla condizione di equilibrio rimane stabilmente nella nuova posizione.
Consideriamo due casi che si possono presentare: il corpo appoggiato e il corpo sospeso.
Un corpo appoggiato tocca il piano di appoggio in più punti, i punti di appoggio
Questi individuano un poligono, detto base di appoggio
In generale, l’equilibrio di un corpo appoggiato è tanto più stabile quanto più è larga la sua base di appoggio e più basso il suo baricentro.
• Quando sei dritto in piedi, il baricentro del tuo corpo si trova in corrispondenza della pancia e la verticale cade nella base d’appoggio, la zona di pavimento delimitata dai tuoi piedi 4 a
• Se ti pieghi all’indietro, il baricentro si sposta e così pure la verticale; oltre un certo limite questa non cade più nella base d’appoggio e rischi di cadere 4 b .
Un corpo sospeso è rappresentato in modo semplice da un quadro appeso a una parete. Esso si trova in una condizione di equilibrio perché la forza peso è equilibrata dalla forza vincolare, uguale e contraria, del chiodo. Poiché il quadro ha una forma geometrica regolare, il suo baricentro è il punto di incontro delle due diagonali; il punto di sospensione invece è sulla sua verticale. In queste condizioni si possono avere tre tipi di equilibrio, a seconda che il punto di sospensione sia sopra il baricentro, sotto il baricentro o coincida con esso.
Baricentro, base di appoggio ed equilibrio.


base di appoggio
base di appoggio
baricentro
baricentro
• Quando il punto di sospensione (S) si trova al di sopra del baricentro (G), il quadro è in equilibrio stabile 5 a : se spostato leggermente oscilla e ritorna nella posizione iniziale.
• Quando il punto di sospensione si trova al di sotto del baricentro, il quadro è in equilibrio instabile 5 b : se spostato anche di pochissimo, ruota e si dispone nella posizione di equilibrio stabile.
• Quando il punto di sospensione coincide con il baricentro, il quadro è in equilibrio indifferente 5 c : se spostato mantiene la nuova posizione che gli è stata data.
5 I punti di equilibrio di un quadro.
equilibrio stabile a equilibrio instabile b equilibrio indifferente c






FISSA I CONTENUTI
ESSENZIALI






equilibrio stabile equilibrio indifferente
equilibrio stabile
equilibrio stabile
Segna con una crocetta se vero (V) o falso (F).
equilibrio instabile equilibrio indifferente
equilibrio instabile equilibrio indifferente
1. Un corpo è in equilibrio se la risultante delle forze applicate è nulla.
2. Un corpo appoggiato su una superficie è sempre in equilibrio stabile.
3. Il baricentro è il punto in cui è applicata la forza peso.
4. La statica studia il movimento dei corpi.
VERSO LE COMPETENZE
Il disegno mostra alcune palline che percorrono una pista mistilinea, cioè con un’alternanza di tratti rettilinei e curvilinei.



Riconosci nel disegno le posizioni di equilibrio stabile ed equilibrio instabile. Rispondi alle domande.
1. Quale tipo di equilibrio possiede la pallina rossa che si trova nella posizione A?
2. Nella posizione C la pallina verde è in equilibrio? Giustifica la tua risposta.
3. Come è l’equilibrio della pallina B?
4. E quello della pallina D?

Macchine e leve lezione 4
LAB TINKERING
COSTRUIAMO UNA
BILANCIA
Il principio di funzionamento della bilancia è quello della leva a due bracci. Costruiamone una e verifichiamo il suo funzionamento.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• una lista di legno lunga 40 cm
• un triangolino metallico (di quelli usati per appendere i quadri)



• chiodini o puntine
• due bicchieri di carta
• spago o filo di nylon
• colla


PROCEDIMENTO

• martello
• forbici
• righello


1. Con il righello determina il centro della lista di legno e posiziona il triangolino metallico allineato con la parte superiore, fissandolo con il martello.
2. Posiziona i chiodini o le puntine alle estremità del legno, fissandoli nello spessore alla stessa altezza.
3. Incolla o fissa lo spago in modo da fare il manico a un bicchiere (simile al manico dei secchielli); poi prepara l’altro bicchiere in modo identico.
4. Taglia un altro pezzo di spago, passalo nel triangolino, chiudilo con un nodo e appendi l’asta a un supporto in modo che sia libera di muoversi. Appendi i bicchierini ai chiodini.
■ OSSERVA E RISPONDI
1. Che cosa succede se metti lo stesso oggetto in entrambi i bicchierini?
2. Se utilizzi dei pesi noti (li puoi trovare tra gli articoli da pesca) puoi “pesare” gli oggetti?
3. Se confronti le tue pesate con quelle fatte con una bilancia elettronica i valori sono uguali o diversi?
4. Quali sono i problemi che possono sorgere usando una bilancia come quella che hai costruito?
1 Le macchine semplici
Monoliti, piramidi, obelischi: quante volte, davanti a imponenti monumenti dell’antichità, ti sei chiesto “Come hanno fatto a costruirli? Quali forze ci sono volute per trasportare e innalzare blocchi di pietra che pesano tonnellate?”. I popoli antichi non possedevano le tecnologie odierne, ma avevano già messo a punto alcuni sistemi che permettevano di risparmiare forza muscolare per compiere lavori gravosi: erano le prime macchine
Una macchina è uno strumento che ha la funzione di vincere una forza, la resistenza, applicando un’altra forza con caratteristiche diverse, chiamata potenza o forza motrice
I popoli delle antiche civiltà costruivano strumenti per sollevare blocchi di roccia utilizzando legno e funi. Piani inclinati e leve, chiamati macchine semplici , servivano sia nella vita quotidiana sia durante le guerre.
Il piano inclinato è una superficie piana che forma un angolo più o meno ampio con l’orizzontale.
La leva è un’asta rigida, rettilinea omogenea di sezione costante che ruota attorno a un punto fisso detto fulcro.
Da queste macchine hanno avuto origine altri oggetti che ancora oggi trovano largo impiego. Dalla leva derivano:
• la carrucola, costituita da una o più ruote in cui scorrono delle funi, che è utilizzata per sollevare carichi 1 a ;
• il verricello, costituito da un cilindro che avvolge una fune che traina dei carichi in orizzontale, per esempio le vele delle barche, manovrato da un ingranaggio che moltiplica la forza impiegata 1 b ;
• l’argano, simile al verricello ma utilizzato per sollevare carichi in verticale 1 c
Dal piano inclinato derivano:
• il cuneo che serve per bloccare gli oggetti nella posizione voluta o per intaccare materiali solidi. È la base di tutti gli utensili che servono per tagliare e perforare come coltelli, asce, scalpelli, chiodi, aghi e spilli;
1 Esempi di macchine semplici.



• la vite , un cilindro con una incisione elicoidale che trasforma il moto circolare in moto rettilineo 2 . Oltre a fissare tra loro gli oggetti è alla base di strumenti come le trivelle o le pompe a vite.
In generale, per vantaggio di una macchina semplice si intende la possibilità di compiere un’azione impiegando una forza minore di quella che deve essere contrastata. Il vantaggio si esprime con il rapporto tra il valore della resistenza e quello della potenza.
2 La vite è uno strumento che deriva dal piano inclinato.

COMPITO DI REALTÀ
CACCIA ALLE BARRIERE ARCHITETTONICHE
SKILL BOOK
3 Nell’altalena la potenza è la spinta data dalla bambina che tocca terra; la
Una macchina è:
• vantaggiosa quando la potenza impiegata è minore della resistenza, quindi V > 1;
• svantaggiosa quando la potenza impiegata è maggiore della resistenza, V < 1.
• indifferente quando la potenza impiegata è uguale alla resistenza, V = 1.
2 La leva
La leva è una delle macchine più antiche create dall’uomo; per molto tempo il suo impiego è stato limitato al sollevamento di grossi massi per mezzo di un bastone appoggiato a un corpo solido.
La leva è costituita da un’asta rigida rettilinea e omogenea che ruota attorno a un punto fisso, il fulcro, indicato con F, sotto l’azione di due forze: la forza motrice, o potenza, indicata con P, e la forza resistente, o resistenza, indicata con R . Le distanze tra il fulcro e i punti di applicazione delle due forze sono chiamate rispettivamente braccio di potenza (bP) e braccio di resistenza (bR) 3

F
SCIENZE & MAT LE LEVE
Il prodotto di ogni forza per la distanza tra fulcro e punto di applicazione della forza è detto momento della forza considerata.
P bP = momento della potenza
R bR = momento della resistenza
Possiamo quindi formulare la legge della leva.
In una leva si raggiunge l’equilibrio quando il momento della potenza, cioè il prodotto della potenza (P) per il suo braccio (bP), è uguale al momento della resistenza, cioè il prodotto della resistenza (R) per il suo braccio (bR).
bP = R bR
La relazione, in base alle proprietà delle proporzioni, può essere scritta come:
: R = bR : bP
3 I tre generi di leve
In base alla posizione del fulcro rispetto a quella della potenza e della resistenza, le leve si distinguono anche in leve di primo genere, leve di secondo genere e leve di terzo genere.
Nelle leve di primo genere il fulcro si trova tra la potenza e la resistenza. Sono leve di questo tipo l’altalena, le tenaglie, la bilancia a bracci uguali e le forbici. Esse possono essere vantaggiose, se il braccio di potenza è maggiore di quello di resistenza; svantaggiose, se il braccio di potenza è minore di quello di resistenza; indifferenti, se i due bracci sono uguali, come nel caso della bilancia 4 a
fulcro
P
P
Nelle leve di secondo genere la resistenza si trova tra il fulcro e la potenza. Sono leve di questo tipo lo schiaccianoci 4 b , la carriola e il levacapsule.
Poiché in questo tipo di leva il braccio di potenza è sempre maggiore di quello di resistenza, queste leve sono sempre vantaggiose.
Nelle leve di terzo genere la potenza si trova tra il fulcro e la resistenza. Sono leve di questo tipo la canna da pesca 4 c , le pinze del camino, le pinzette per le ciglia e la pinza per il ghiaccio.
Poiché in questo tipo di leva il braccio di potenza è sempre minore di quello di resistenza, queste leve sono sempre svantaggiose, quindi occorre una potenza maggiore della resistenza. Tuttavia non potremmo usare le mani per spostare la legna nel camino o per togliere un ciglio e, per questioni di igiene, i negozianti utilizzano le pinze per servirci dei dolci, il pane o degli affettati.


FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. Il piano inclinato è una macchina semplice.
2. Il punto fisso di una leva si chiama perno.
3. Usiamo le macchine perché sono sempre vantaggiose.
4. Una leva di primo genere può essere svantaggiosa.
VERSO LE COMPETENZE
CODING
I TRE GENERI DI LEVA
SKILL BOOK




Osserva queste immagini che raffigurano delle leve. Individua per ognuna il tipo di leva.

Le leve 4 Generi di leve.
braccio della resistenza bR
braccio della potenza bP
braccio della potenza bP
braccio della resistenza bR
a Leva di primo genere.
b Leva di secondo genere.
c Leva di terzo genere.
braccio della resistenza bR
braccio della potenza bP
La pressione e le forze Nei fluidi lezione 5
CONTENUTI DIGITALI
MATERIALI
• una bottiglia di plastica
• un ago da calza
• nastro adesivo



SCIENZE & MAT
DENSITÀ, PRESSIONE E PRESSIONE IDROSTATICA
SKILL BOOK
LAB STEM
LA PRESSIONE DELL’ACQUA
Come tutti i corpi, l’acqua ha un peso e quindi esercita una forza, più precisamente una pressione, sul fondo e sulle pareti del recipiente che la contiene. Osserviamo come varia la pressione dell’acqua contenuta in un recipiente con un semplice esperimento.
■ REALIZZA L’ESPERIMENTO
PROCEDIMENTO
1. Pratica quattro fori sulla parete della bottiglia con l’ago da calza, in modo che siano ad altezze diverse.
2. Chiudi i fori con un’unica striscia di nastro adesivo.
3. Riempi la bottiglia di acqua.
4. Togli il nastro adesivo e osserva che cosa accade.
■ OSSERVA E RISPONDI
1. Come ti sembrano i quattro zampilli d’acqua?
2. Quale relazione lega l’altezza dei fori e la lunghezza degli zampilli?
3. Da quale foro l’acqua esce con maggiore velocità?
4. Che cosa succede all’acqua che esce dal terzo e quarto foro man mano che si abbassa il livello dell’acqua nella bottiglia?
5. Scrivi la relazione dell’esperimento.
1 La pressione
Quando una qualunque forza agisce su una superficie, essa esercita una pressione sull’area considerata. Il termine pressione è molto usato nella vita quotidiana, per esempio quando si parla di pressione delle gomme di una bicicletta, di pressione atmosferica, di pressione del sangue. In fisica la pressione ha un significato ben preciso.
La pressione (p) è una grandezza che esprime il rapporto tra la forza (F ) che agisce perpendicolarmente a una superficie (S) (superficie di appoggio) e la superficie stessa.
pressione = forza p = F superficie S
Nel Sistema Internazionale l’unità di misura della pressione è il pascal (Pa): 1 pascal corrisponde alla pressione esercitata dalla forza di 1 newton su una superficie di 1 metro quadrato.
1 Pa = 1 N 1 m2
Dalla relazione che lega pressione e superficie di appoggio si capisce che esse sono grandezze inversamente proporzionali: minore è la superficie di appoggio, maggiore è la pressione esercitata; maggiore è la superficie di appoggio, minore è la pressione esercitata. Per esempio per camminare sulla neve senza affondare sono utilissime le ciaspole. Sono molto simili a racchette da tennis: fissate ai piedi aumentano la superficie d’appoggio e distribuiscono il peso corporeo impedendo di affondare nella neve 1
2 Il principio di Pascal
1 Camminare senza affondare.

Le sostanze allo stato liquido, come l’acqua, o aeriforme, come l’aria, sono dei fluidi: non hanno forma propria e assumono quella del recipiente che le contiene. I fluidi possiedono una massa, quindi per azione della gravità sono dotati di forza peso ed esercitano una pressione.
Lo scienziato francese Blaise Pascal (1623-1662) fu il primo a descrivere il comportamento della pressione all’interno di un liquido. Per realizzare il suo esperimento, lo scienziato si servì di un recipiente rigido e resistente formato da una parte sferica, costellata di piccoli fori, e da un piccolo collo, nel quale scorreva un pistone.
Riempiendo quasi completamente d’acqua il recipiente e premendo il pistone, il liquido usciva dai fori in zampilli uguali tra loro e con direzione perpendicolare alla superficie della sfera 2 . Sulla base delle sue osservazioni sperimentali fu formulato un principio che oggi chiamiamo principio di Pascal
La pressione esercitata su un fluido si trasmette in tutte le direzioni con uguale intensità e perpendicolarmente alle pareti del recipiente che lo contiene.
3 La pressione dei fluidi
La pressione esercitata dall’acqua si chiama pressione idrostatica. Essa, e più in generale la pressione esercitata da un fluido, dipende dalla profondità: man mano che la profondità aumenta, aumenta lo strato di acqua soprastante e, di conseguenza, aumentano il peso dell’acqua e la pressione idrostatica 3 .
A parità di altezza della colonna di liquido, la pressione idrostatica dipende anche dal peso specifico del liquido considerato: maggiore è il peso specifico, maggiore è la pressione esercitata. Questa relazione si esprime con la seguente formula:
Anche l’aria, essendo un fluido, esercita una pressione: è la pressione atmosferica e dipende dall’altezza della colonna d’aria che si considera. Per esempio, è minore in montagna, perché la colonna d’aria soprastante è più bassa che a livello del mare.
2 L’esperimento di Pascal.





3 Lo strato più profondo è soggetto alla somma delle pressioni esercitate da tutti gli strati soprastanti.


La misura della spinta idrostatica.

4 La spinta idrostatica

I corpi immersi in acqua hanno comportamenti diversi: una tavoletta di legno o una forchetta di plastica galleggiano con facilità, mentre un bullone o una moneta da 1 euro affondano immediatamente. Da che cosa dipende?
Archimede di Siracusa, già nel III secolo a.C., osservando il diverso comportamento di alcuni corpi solidi in acqua è arrivato a un importante risultato, noto come principio di Archimede













Un corpo immerso in acqua riceve una spinta verticale, dal basso verso l’alto, pari al peso del volume dell’acqua spostata.
Questa forza, detta spinta idrostatica, non si manifesta solo nell’acqua, ma in tutti i fluidi, compresa l’aria.



Puoi provare a misurare il valore della spinta idrostatica utilizzando un dinamometro e un oggetto, per esempio un sasso 4 . Appendi il sasso al dinamometro e rileva il suo peso. Poi immergilo in un recipiente graduato pieno d’acqua e rileva nuovamente il suo peso. Osservi che, in queste condizioni, il valore indicato dal dinamometro risulta minore. Il livello dell’acqua nel recipiente è aumentato di una quantità corrispondente al volume dell’acqua spostata, che è anche il volume del sasso. Se calcoli il peso dell’acqua spostata, ricordando che il suo peso specifico è pari a 1 g/cm3, ottieni un valore che corrisponde esattamente alla differenza tra le due misurazioni.
In termini matematici il principio di Archimede è espresso con la seguente formula:
F = psl Vl
in cui psℓ è il peso specifico del liquido, Vℓ il volume del liquido spostato e F la spinta idrostatica. Un corpo immerso in un liquido è perciò sottoposto a due forze: la forza peso (P), che lo spinge verso il basso e tende a farlo affondare, e la spinta idrostatica (F), che lo spinge verso l’alto. La forza peso e la spinta idrostatica hanno uguale direzione ma verso opposto e, a seconda che prevalga l’una o l’altra, il corpo galleggia, va a fondo o resta sospeso nel liquido 5

F > P: il corpo galleggia
5 Forza peso e spinta idrostatica.


P > F: il corpo affonda



F = P: il corpo è in equilibrio e quindi non galleggia né affonda
Una nave, anche se pesa parecchie tonnellate e trasporta carichi pesanti, può galleggiare purché il suo peso specifico complessivo sia minore di quello dell’acqua, cioè 1. È per questo che lo scafo delle navi è cavo. Il funzionamento del sommergibile è basato sull’equilibrio tra la forza peso, che spinge
SKILL BOOK
IL DIAVOLETTO DI CARTESIO
LAB TINKERING
il sottomarino verso il basso, e la spinta idrostatica, che lo spinge verso la superficie. Un sommergibile presenta dei compartimenti a tenuta stagna che possono essere riempiti d’acqua, aumentando il peso del veicolo e consentendo l’immersione. Quando invece nei compartimenti viene immessa l’aria, il peso diminuisce e il sommergibile può emergere.
5 La spinta aerostatica
Il principio di Archimede vale anche per i corpi immersi nei fluidi gassosi, come per esempio l’aria. In questo caso si parla di spinta aerostatica, che è pari al peso del volume del gas spostato. Sfruttando questo principio è stato possibile costruire le mongolfiere e i dirigibili. Essi sono costituiti da grandi involucri riempiti di gas più leggeri dell’aria circostante, come l’elio o l’aria stessa, ma riscaldata. Poiché spostano grandi masse di gas, ricevono una forte spinta verso l’alto e possono salire in quota.
Nel XVIII secolo, il fisico svizzero Daniel Bernoulli (1700-1782) formulò un importante principio che è alla base della dinamica dei fluidi.
Maggiore è la velocità di un flusso d’aria, minore è la pressione che esso esercita.

Su questo principio si basa il volo degli uccelli e degli aerei. Sia le ali degli uccelli sia quelle degli aerei sono sagomate in modo che la parte superiore abbia una curvatura maggiore di quella inferiore. Quando l’ala fende l’aria, si formano due flussi: quello superiore è più veloce. La differenza di velocità dei due flussi determina una riduzione della pressione sulla parte superiore dell’ala e la formazione di una spinta verso l’alto, la spinta ascensionale, o portanza
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. La pressione è il prodotto tra la forza e la superficie interessata.
2. La pressione nell’acqua aumenta con la profondità.
3. La spinta idrostatica è diretta verso il basso.
4. Le mongolfiere sfruttano la spinta aerostatica.
VERSO LE COMPETENZE
Osserva l’immagine e attribuisci a ciascun vettore la forza corrispondente:
• forza motrice del motore
• forza peso
• portanza
• forza d’attrito dell’aria

Come deve essere la risultante di queste forze perché l’aereo possa volare in orizzontale e a velocità costante?
lezione 1 CHE COS’È UNA FORZA
CON LA SINTESI

Una forza è tutto ciò che modifica lo stato di quiete o di moto di un corpo o che ne cambia la forma. La forza è una grandezza vettoriale e si rappresenta mediante un vettore orientato che ne specifica le caratteristiche: punto di applicazione, il punto in cui è applicata la forza; direzione, la retta lungo cui agisce la forza; verso, il senso in cui agisce la forza (alto, basso, destra, sinistra...); intensità, il valore della forza. Lo strumento che misura l’intensità di una forza è il che è tarato in newton (N). Si chiama risultante esprime tutte le forze che agiscono contemporaneamente su un corpo.
lezione 2 I PRINCIPI DELLA DINAMICA
La dinamica studia la variazione del moto dei corpi in seguito all’applicazione di una forza. È governata da tre leggi note come principi della dinamica. Il primo principio, o principio di inerzia, afferma che un corpo mantiene il suo stato di quiete o di moto rettilineo uniforme fino all’intervento di una forza che ne modifica lo stato. L’inerzia è la tendenza di un corpo a mantenere il suo stato. La forza che si genera dal contatto tra un corpo e la superficie su cui scorre e che si oppone al movimento è l’attrito. Il secondo principio afferma che la forza applicata a un corpo è uguale al prodotto della massa del corpo per l’accelerazione che acquisisce. Il terzo principio, o principio di azione e reazione, afferma che a ogni forza che agisce su un corpo, ne corrisponde un’altra di uguale direzione e intensità ma di verso contrario.
lezione 3 L’EQUILIBRIO DEI CORPI












La statica è il settore della fisica che studia l’equilibrio dei corpi, cioè le condizioni in cui i corpi rimangono fermi. Un corpo è in equilibrio quando la risultante delle forze che agiscono su di esso è nulla. La somma di tutte le minuscole forze di gravità che agiscono sulle molecole di un corpo costituisce la forza peso che è applicata nel baricentro del corpo. Un corpo è in equilibrio


stabile se spostato di poco ritorna nella posizione precedente; è in equilibrio instabile se spostato si allontana ancora di più dalla posizione precedente; è in equilibrio indifferente se spostato mantiene la nuova posizione. Un corpo appoggiato è in equilibrio se la verticale passante per il baricentro cade all’interno della base di appoggio. Un corpo sospeso è in equilibrio stabile se il punto di sospensione si trova sopra al baricentro; instabile se il punto di sospensione è sotto al baricentro; indifferente se il punto di sospensione è il baricentro.
lezione 4 MACCHINE E LEVE
Una macchina è uno strumento che vince una forza, la resistenza, mediante l’applicazione di un’altra forza, la potenza o forza motrice. Il piano inclinato e la leva sono macchine semplici. Il piano inclinato è una superficie piana che forma un angolo più o meno ampio con l’orizzontale; la leva è formata da un’asta rettilinea omogenea cheruota attorno a un punto fisso detto fulcro sotto l’azione della potenza e della resistenza. Una macchina semplice è vantaggiosa quando la potenza impiegata è minore della resistenza; svantaggiosa quando la potenza è maggiore; indifferente quando la potenza impiegata è uguale alla resistenza. La condizione di equilibrio di una leva è espressa dalla legge: P bP = R bR
dove bP e bR, i bracci di potenza e resistenza, rappresentano la distanza dal fulcro del punto di applicazione delle forze.
lezione 5 LA PRESSIONE E LE FORZE NEI FLUIDI

La pressione P esprime il rapporto tra la forza che agisce perpendicolarmente a una superficie è la superficie stessa e si misura in pascal (Pa). Il principio di Pascal afferma che in un fluido la pressione si trasmette in tutte le direzioni con uguale intensità e perpendicolarmente alle superfici del recipiente che lo contiene. La pressione esercitata dall’acqua si chiama pressione idrostatica ed è uguale al prodotto del peso specifico del liquido per la profondità. Il principio di Archimede afferma che un corpo immerso in un liquido riceve una spinta verticale verso l’alto (spinta idrostatica) pari al peso del liquido spostato. Tale principio vale anche per i corpi immersi nei fluidi gassosi come l’aria. In questo caso si parla di spinta aerostatica. Quando un corpo si muove nell’aria si forma un flusso d’aria: secondo il principio di Bernoulli, maggiore è la sua velocità, minore è la pressione che esso esercita.

CON LA MAPPA
Adesso che hai ripassato i contenuti essenziali con la sintesi, prova a completare la mappa con le parole chiave suggerite e a trovare le definizioni corrispondenti.
fluido - leva - risultante - spinta aerostatica - stato di quiete - vettori







che si possono rappresentare



quando agiscono su un corpo ne modificano lo
quando agiscono su un






applicazione



vinte dalle
macchine


provocano una
8. stato di moto





11. spinta idrostatica
come avviene nell’acqua
9. dinamica
13. F = m ⋅ a secondo i tre principi della di cui il secondo è espresso dalla relazione
come avviene nell’aria
a. Determinano lo stato di equilibrio di un corpo.
b. Settore della fisica che studia le variazioni del moto dei corpi per effetto di forze.
c. È stata osservata e studiata dallo scienziato Archimede.
d. È una macchina semplice.
LE FORZE

lezione 1 CHE COS’È UNA FORZA
1 Scegli la soluzione corretta.
a. Nel SI l’unità di misura della forza è:
1 il dinamometro.
2 il kilogrammo.
3 la bilancia.
4 il newton.
b. Due forze concordi hanno:
1 stessa direzione, verso e intensità.
2 stessa direzione e verso opposto.
3 stessa direzione e verso.
4 stesso verso e direzione diversa.
2 Abbina i termini con la definizione corretta.
1. Punto di applicazione
2. Direzione
3. Intensità
4. Verso
a Senso in cui agisce la forza.
c Punto in cui è applicata la forza.
e Retta lungo la quale agisce la forza.
f Valore della forza.
1. 2. 3. 4.
lezione 2 I PRINCIPI DELLA DINAMICA
3 Sottolinea il termine corretto tra i due proposti.
a. La dinamica studia il moto/l’equilibrio dei corpi.
b. Il primo principio della dinamica è detto anche principio di inerzia/attrito.
c. La forza contraria all’azione si chiama opposta/reazione
d. Se a uno stesso corpo si applica una forza doppia la sua accelerazione raddoppia/rimane la stessa.
4 Scegli la soluzione corretta.
a. Un corpo di massa 7 kg è sottoposto a una forza di 21 N. La sua accelerazione è:
1 147 m/s2.
2 14 m/s2
3 28 m/s2.
4 3 m/s2
b. Se facciamo ruotare un sasso legato a una corda esso mantiene la stessa distanza perché:
1 la mano esercita una forza centripeta.
2 la forza centrifuga lo fa allontanare.
3 si muove in modo circolare.
4 la corda oppone resistenza.
5 Scegli la soluzione errata.
a. Quando un corpo appoggiato è in equilibrio:
1 essendo appoggiato, determina una reazione vincolare.
2 il poligono individuato dai punti di appoggio è la sua base di appoggio.
3 la verticale del suo baricentro cade fuori dalla base di appoggio.
4 la sua stabilità dipende dalla larghezza del piano di appoggio.
b. Il baricentro:
1 in un triangolo è il punto di incontro delle bisettrici.
2 in un rettangolo è il punto di incontro delle diagonali.
3 in un cerchio è il centro.
4 in un corpo sospeso è sulla verticale passante per il punto di sospensione.
lezione 3 L’EQUILIBRIO DEI CORPI
6 Segna con una crocetta se vero (V) o falso (F).
a. Il baricentro di un corpo è il punto di applicazione della forza di gravità.
b. Il baricentro di un triangolo è il punto di incontro delle bisettrici.
c. Il baricentro di un rettangolo è il punto di incontro delle diagonali.
d. La verticale tracciata dal punto di sospensione di un oggetto passa per il baricentro.
7 Completa le frasi con i termini corretti.
a. Un corpo è in equilibrio se spostato di poco ritorna nella posizione iniziale.
b. Un corpo è in equilibrio se spostato mantiene la nuova posizione.
c. Un corpo è in equilibrio se spostato si allontana dalla posizione.
d. Un corpo è in equilibrio se la risultante delle forze non è nulla.
lezione 4 MACCHINE E LEVE
8 Sottolinea il termine corretto tra i due proposti.
a. Una macchina vince una forza resistente mediante una forza motrice/di azione.
b. Il piano inclinato è una macchina semplice/composta
c. Una leva di terzo genere è sempre vantaggiosa/svantaggiosa.
d. La bilancia è una leva di primo/secondo genere.
9 Segna con una crocetta se vero (V) o falso(F).
a. Il vantaggio di una macchina è il rapporto tra potenza e resistenza.
b. La distanza tra il punto di applicazione della potenza e il fulcro è il braccio della resistenza.
c. Il momento è il prodotto di una forza per il rispettivo braccio.
d. La legge della leva afferma che i momenti di potenza e resistenza sono uguali quando raggiunge l’equilibrio.
10 Scegli la soluzione errata.
a. La bilancia:
1 è una leva di primo genere.
2 è una leva indifferente.
3 è una leva svantaggiosa.
4 in equilibrio ubbidisce alla legge della leva.
b. La carriola:
1 è una leva svantaggiosa.
2 è una leva di secondo genere.
3 permette di vincere la resistenza con una forza minore.
4 in equilibrio ubbidisce alla legge della leva.
lezione 5 LA PRESSIONE E LE FORZE NEI FLUIDI
11 Scegli la soluzione corretta.
a. Il principio di Archimede afferma che:
1 a ogni azione corrisponde una reazione uguale e contraria.
2 un corpo immerso in un liquido riceve una spinta verticale verso l’alto pari al peso del liquido spostato.
3 una forza modifica lo stato di quiete o di moto di un corpo.
4 tutte le molecole di un corpo sono sottoposte alla forza di gravità.
b. Il principio di Pascal afferma che:
1 la pressione in un fluido si trasmette verticalmente.
2 la pressione in un fluido non si trasmette sulle pareti del recipiente.
3 la pressione in un fluido si trasmette in tutte le direzioni con uguale intensità e perpendicolarmente alle pareti del recipiente.
4 la pressione in un fluido rimane costante.
12 Osserva il disegno e rispondi. F P

a. Che cosa indicano i vettori?

b. Perché il corpo galleggia?
TRARRE
1 Osserva i disegni e per ognuno di essi specifica direzione e verso delle forze rappresentate.



b c
2 Osserva il disegno e spiega la differenza tra i due dinamometri.
3 Osserva i disegni e specifica quando la leva rappresentata è in equilibrio e quando non lo è. Giustifica le risposte.
4 Per ognuno dei disegni stabilisci la condizione di equilibrio del quadro.


ANALIZZARE UN MODELLO E SPIEGARE
5 Andrea tiene sospesa una cassa di 20 kg, mantenendo la fune in modo che formi un angolo di 60˚ con la verticale.




60°


a. Scegli la soluzione corretta.



1 La forza applicata è maggiore del peso della cassa.
2 La forza applicata è minore del peso della cassa.

3 La forza applicata è uguale al peso della cassa.

b. Come cambia la forza applicata se l’angolo con la verticale diminuisce? Giustifica la risposta.


RISOLVERE PROBLEMI
6 Due forze concordi di 7 N e 5 N sono applicate a uno stesso corpo. Calcola la risultante e disegna il sistema di forze e la risultante.
7 Un corpo con massa di 3 kg si muove con un’accelerazione di 6 m/s2. Qual è l’intensità della forza a cui è sottoposto?
8 Due ragazzi esercitano, in direzione opposta, due forze rispettivamente di 12 N e 16 N su un corpo avente massa di 5 kg.
a. In quale direzione si sposta l’oggetto?
b. Qual è la sua accelerazione?
9 A una estremità di una leva di primo genere lunga 100 cm è appeso un corpo con una massa di 15 kg. Se la leva è fissata in un punto distante 75 cm dall’estremità opposta, qual è il valore della massa di un corpo che realizza l’equilibrio?
10 Un corpo con il volume di 100 cm3 e massa di 500 g viene immerso in acqua. Galleggia o affonda? Calcola il valore della spinta di Archimede e giustifica la risposta.
INTERPRETARE E TRARRE INFORMAZIONI
DA UN TESTO
12 Leggi il brano.
LE “MACCHINE” DI LEONARDO
La macchina volante, conosciuta anche come ornitottero, è generalmente considerata l’invenzione più rappresentativa di Leonardo da Vinci. Partendo dallo studio del volo degli uccelli, lo scienziato realizzò dei disegni che rappresentavano un mezzo composto da una tavola e da due grandi ali che erano manovrate tramite un apposito sistema di pedane e leve. È la curiosità che spinse Leonardo a considerare anche l’idea di progettare uno strumento che permettesse all’uomo di respirare e muoversi liberamente sotto la superficie dei mari: si trattava di un vero e proprio scafandro da palombaro, il cui pezzo forte consisteva in canne e tubi di cuoio attaccati a una maschera facciale e dotati di anelli di metallo per resistere alla pressione dell’acqua. La vite aerea è, di fatto, considerata l’antenato del moderno elicottero. Il progetto di Leonardo consisteva in una vite aerea elicoidale in grado di comprimere l’aria, favorendo così il volo: è conosciuta ancora oggi come macchina del volo verticale. Il ponte girevole fu ideato dal grande scienziato con il proposito di rivoluzionare l’ambito urbanistico e militare.
Tra le centinaia di bozze di Leonardo è stato ritrovato anche il prototipo di quello che sarebbe diventato l’attuale sottomarino.
Rispondi alle domande e svolgi le attività proposte da solo o in gruppo con i tuoi compagni.
a. Qual è l’invenzione considerata più rappresentativa tra quelle di Leonardo da Vinci?
11 Tre cubi uguali di sughero (ps = 0,25) legno (ps = 0,7) e rame (ps = 8,9) sono immersi in un recipiente contenente alcol (ps = 0,8). In base a quali considerazioni puoi stabilire quali galleggiano e quali affondano?
b. Quali prodotti tecnologici attuali derivano dai prototipi di Leonardo?
DIGITAL SKILLS
Visita il sito https://www.leonardo3.net/it/ museo-di-milano/ per vedere le ricostruzioni di alcune macchine di Leonardo e raccogliere informazioni su molte altre sue invenzioni.

















WHEN DOES INERTIA BECOME















DANGEROUS ?
Bodies tend to remain stationary or maintain a uniform rectilinear motion due to a kind of natural ‘laziness’. In physics this laziness is called the law of inertia. Inertia must be taken into account when building cars: airbags and seat belts, for example, are safety devices that protect passengers from the consequences of inertia, in the event of sudden braking or accidents. In fact, when a car suddenly stops, the passengers tend to maintain the movement and continue to move forward. This is due to inertia. At this point, the seat belts intervene, stretching to a certain limit and then locking, preventing passengers from bumping into the windscreen or seats. In the event that the car hits an obstacle, the airbags inflate and lessen the blow against the side parts of the car and the steering wheel These safety systems, in order to be effective, must always be efficient, therefore controlled and used by passengers. Therefore, for your safety you must always fasten your seat belt and travel in the back seats, because front airbags, calibrated for an adult, can be dangerous for a child or a young person.
LAZINESS pigrizia.
COMPREHENSION EXERCISES
Read the text and answer the questions.
a. What are the car safety devices that protect us from the consequences of inertia?
b. Why should you always wear a seat belt?
c. Why do children and young people have to travel in the back seats?



Dalla leva di Archimede a LEVA


Le applicazioni della leva sono molteplici. Partendo dal suo inventore Archimede, fino ad arrivare a LEVA, un robot cargo in grado di sollevare in autonomia carichi fino a 85 kg, le applicazioni di questa macchina semplice sono tantissime e spesso le utilizziamo senza neanche rendercene conto, risolvendoci in modo efficace molti problemi della vita di tutti i giorni.
PREREQUISITI
Conoscere il funzionamento delle macchine semplici, in particolare della leva.
Saper descrivere i tre generi di leva e le loro applicazioni.
Conoscere la legge della leva e saperla applicare.
RISULTATI ATTESI
Comprensione del ruolo del principio della leva nell’evoluzione tecnologica.
Conoscenza dell’applicazione dei tre generi di leva nella costruzione di strumenti di uso quotidiano.
Comprensione dell’importanza di superare le barriere architettoniche per rendere le città più vivibili.
Capacità di riconoscere gli effetti della robotica in campo industriale, medico e nelle attività quotidiane.
Proponiamo alcuni approfondimenti che possono essere affrontati nel percorso interdisciplinare, ma la mappa suggerisce altri argomenti che possono essere sviluppati per integrare lo stesso percorso.
STORIA: le invenzioni di Archimede e le sue scoperte hanno gettato le basi della ricerca scientifica.
EDUCAZIONE CIVICA: le leve del corpo umano, formate da ossa, muscoli e articolazioni, sono alla base del movimento dell’organismo.
TECNOLOGIA: dai robot ai cobot, lo sviluppo della robotica mette a disposizione strumenti intelligenti capaci di collaborare con gli esseri umani.
EDUCAZIONE CIVICA: il superamento delle barriere architettoniche attraverso interventi urbani di diverso tipo migliora la qualità della vita dei cittadini.
ARCHIMEDE, GENIO DELL’ANTICHITÀ
MACCHINE E LEVE
FORZE MOTRICI E FORZE RESISTENTI
RELAZIONI DI PROPORZIONALITÀ DIRETTA E INVERSA TRA GLI ELEMENTI CHE CARATTERIZZANO UNA LEVA
LEVA, UN COBOT CHE MIGLIORA IL LAVORO
BARRIERE ARCHITETTONICHE LE LEVE DEL CORPO UMANO
STORIA
STORIA
Archimede, genio dell’antichità
Archimede, uno dei più grandi scienziati dell’antichità, nacque nel 287 a.C. a Siracusa, dove visse durante il regno di Gerone II. In seguito si trasferì ad Alessandria d’Egitto dove incontrò altri studiosi famosi, come Eratostene. Tornato a Siracusa, contribuì al benessere della città con invenzioni utili, come la vite idraulica, o vite di Archimede, usata per portare l’acqua nei campi. A lui si deve la scoperta del famoso “principio della leva” col quale dimostrò che, con una leva composta, era possibile sollevare con la sola forza delle braccia oggetti molto pesanti, addirittura una nave con tutto il suo carico. Quando i Romani assediarono Siracusa, Archimede costruì armi per difendere la città, come gli specchi ustori realizzati con lamiere concave che concentravano i raggi del sole sulle navi nemiche per bruciarle. La sua frase “Datemi un punto d’appoggio e solleverò il mondo” è passata alla storia, ma la sua scoperta più nota è il “pi greco”, che si ricorda ogni anno il 14 marzo, Giornata Internazionale della Matematica

DOMANDE GUIDA
a. Dove visse Archimede?
b. Descrivi con le tue parole le scoperte e le invenzioni di Archimede citate nel testo.
c. Perché il pi greco è un’importante costante matematica? In quale tipo di calcolo hai imparato a usarla?
d. Perché il 14 marzo è stato dichiarato “Giornata Internazionale della Matematica?
DIGITAL SKILLS
PER APPROFONDIRE
a. Ricerca in rete notizie sugli studi compiuti da Archimede e sulle sue scoperte scientifiche e matematiche.
b. Completa la ricerca con qualche aneddoto attribuito ad Archimede.
TECNOLOGIA
LEVA, un COBOT che migliora il lavoro

Immagina un cane robotico che invece delle zampe ha delle ruote, ma può comunque arrampicarsi su per le scale quando serve. Ora aggiungi la capacità di individuare una scatola, posizionarsi sopra di essa, abbassarsi, agganciarla con ganci motorizzati interni e portarsela via.
Questo è LEVA, il robot cargo creato da un team di ingegneri e designer dell’Università di Zurigo. A differenza degli attuali robot per le consegne, che devono essere caricati e scaricati da esseri umani, LEVA fa tutto da solo.
Grazie alle sue telecamere e alle ruote a sterzata indipendente, questo robot cargo può attraversare autonomamente le strade cittadine, evitare ostacoli e trasportare scatole pesanti fino a 85 kg. LEVA è un cobot, un “robot collaborativo” creato per collaborare con gli umani: non sappiamo ancora quando vedremo LEVA in azione nelle nostre strade, ma è chiaro che rivoluzionerà il futuro della logistica urbana, eliminando la necessità di intervento umano nelle operazioni di carico e scarico.
Intelligenza Artificiale IA
Con l’aiuto del tuo insegnante chiedi a un chatbot di intelligenza artificiale di spiegarti in maniera semplice la differenza tra robot e cobot e di suggerirti qualche video in rete per conoscere le loro applicazioni. Condividi con i tuoi compagni di classe le tue personali considerazioni su come i robot siano destinati a cambiare il nostro modo di vivere.
MATERIA TEMA
La fisica delle onde
4
Molti di noi hanno indossato almeno una volta un visore VR per vivere l’esperienza della realtà virtuale: può trattarsi di un videogioco di ultima generazione, oppure della visita a un museo, dell’esplorazione di un ambiente naturale o della ricostruzione di una città del passato. La realtà virtuale è il risultato della combinazione di dispositivi hardware e software in grado di creare per i nostri sensi un ambiente simulato tridimensionale all’interno del quale ci muoviamo come se fossimo nel mondo reale. L’avvento degli ologrammi ha abbattuto un’altra barriera tra virtuale e reale: grazie ai raggi laser è possibile realizzare un ologramma, un’immagine tridimensionale di un oggetto reale o di una persona, che può inserirsi accanto a noi all’interno del mondo virtuale. Ancora una volta, è stato grazie allo straordinario sviluppo della ricerca nel campo della fisica che la tecnologia informatica ha potuto raggiungere questi risultati: senza gli studi nel campo dell’ elettromagnetismo non sarebbe stato possibile costruire i microchip alla base di tutti gli apparecchi elettronici, senza gli sviluppi dell’ acustica non sarebbe stato possibile realizzare gli effetti sonori dei nostri videogiochi, e senza l’ ottica che studia la natura e i comportamenti delle onde luminose non sarebbe neppure stato possibile creare il raggio laser.






e il magnetismo e la luce Il suono unità 10
optometristaedocente

Stefano si è laureato in Ingegneria fisica con specializzazione in Nano ottica e Fotonica, e in seguito ha conseguito anche una laurea in Ottica e Optometria. Crea nuovi design di lenti a contatto su misura, che costruisce e applica personalmente ai clienti. Dal 2016 è docente presso l’Università Bicocca di Milano dove insegna Laboratorio di Contattologia alla facoltà di Ottica e Optometria.

dottoranda in Fisica nucleare
Si è laureata in fisica e oggi svolge il dottorato di ricerca in fisica nucleare sperimentale. Giulia studia le proprietà e la struttura degli atomi attraverso le radiazioni emesse dal decadimento dei nuclei, collaborando con i più importanti laboratori di ricerca del mondo.

La fisica nucleare, infatti, trova applicazione in ambito medico, ma anche in astrofisica, per comprendere come è fatto l’Universo e come si sono formati gli elementi.
LUCA ANTONELLI, senior scientist
Dopo il diploma al liceo scientifico, Luca si è iscritto alla facoltà di Fisica e in seguito ha conseguito un dottorato sulla fusione nucleare partecipando a decine di esperimenti internazionali in Europa e negli Stati Uniti. Oggi lavora come senior scientist in una società del Regno Unito: studia le condizioni nelle quali le reazioni di fusione nucleare possono avvenire e autosostenersi producendo, per un certo periodo di tempo, più energia di quella necessaria per attivarle.

Albert
Einstein
PARLA LA SCIENZA
L’energia unità

lezione 1
IL LAVORO E L ’ ENERGIA
lezione 2
LE TRASFORMAZIONI DELL ’ ENERGIA
lezione EDUCAZIONE CIVICA 3
LE FONTI DI ENERGIA
EDUCAZIONE CIVICA
L ’ ENERGIA NUCLEARE

LEZIONI POWERPOINT in

BUONE NOTIZIE PER IL FUTURO
idrogeno
L’idrogeno è un gas incolore e inodore: quando è bruciato, l’unico sottoprodotto della combustione è l’acqua, il che lo rende una fonte di energia molto pulita.
Tradizionalmente si ottiene dalla raffinazione del petrolio e del gas, e per questa ragione
è considerato un combustibile fossile non sostenibile. L’idrogeno verde, invece, si produce per elettrolisi , un processo che scompone la molecola dell’acqua negli atomi componenti, ma che richiede molta energia per poter avvenire. Se, tuttavia, l’energia proviene da fonti rinnovabili, come l’energia solare, eolica o idroelettrica, il processo di elettrolisi diventa sostenibile e rende l’idrogeno una fonte di energia pulita, il combustibile ideale per affrontare transizione energetica e ridurre le concentrazioni di gas inquinanti in atmosfera. Una volta prodotto, l’idrogeno verde può essere utilizzato per i trasporti, nell’industria, per il riscaldamento e per produrre elettricità.
Attualmente molte aziende siderurgiche utilizzano l’idrogeno verde al posto del carbone nella produzione di acciaio, riducendo così le emissioni di anidride carbonica nel processo di produzione.
il lavoro e L’ Energia lezione 1
CARTA PENNA COMPUTER

Esplora l’oggetto interattivo e scrivi le risposte sul quaderno.

Energie nell’Universo

1 Il lavoro
1. L’energia attualmente presente nell’Universo è uguale o diversa rispetto a quella iniziale?
2. Quant’è l’energia consumata giornalmente dal nostro corpo?
3. A quanto ammonta l’energia emessa dal Sole in un anno?
4. Eventi naturali come uragani, terremoti e tsunami sviluppano una grande quantità di energia: sai fare qualche altro esempio?
5. Quanta energia viene liberata quando esplode una stella?

Che cosa significa compiere un lavoro? La domanda può sembrare inutile perché tutti noi, dopo esserci impegnati in attività che richiedono uno sforzo intellettuale o muscolare, come studiare o sollevare dei pesi, sappiamo di aver lavorato perché avvertiamo fatica mentale e fisica.
Secondo la fisica, invece, compiamo un lavoro solo quando con la nostra forza muscolare determiniamo lo spostamento di un corpo.
In fisica si dice che una forza compie un lavoro se causa lo spostamento del corpo al quale è applicata.
Il lavoro compiuto da una forza è una grandezza scalare, legata alla forza e allo spostamento.
Il lavoro è il prodotto della forza per lo spostamento.
lavoro = forza ⋅ spostamento L = F ⋅ s
Da questa relazione si comprende che il lavoro è direttamente proporzionale alla forza applicata e allo spostamento.
Ciò significa che, a parità di forza applicata, il lavoro aumenta man mano che cresce lo spostamento; oppure, a parità di spostamento, il lavoro aumenta al crescere della forza applicata per compierlo. Per esempio, un elevatore che solleva da terra una cassa di 100 N e la porta a 3 m di altezza compie un lavoro di:
100 N ⋅ 3 m = 300 J
La ricerca di Hasler
Se solleva la stessa cassa e la porta all’altezza di 6 m compie un lavoro doppio:
100 N 6 m = 600 J
Se l’elevatore solleva due casse, ciascuna di 100 N, all’altezza di 3 m, avrà compiuto un lavoro doppio rispetto al primo caso:
2 (100 N) 3 m = 600 J
Per calcolare in modo semplice il lavoro compiuto da una forza, utilizzando la formula precedente, è necessario che lo spostamento e la forza abbiano la stessa direzione come nel caso dell'elevatore e nella figura 1 a Se invece la forza è obliqua rispetto alla direzione dello spostamento, compie lavoro solo la componente della forza che agisce nella stessa direzione dello spostamento 1 b
spostamento forza a



1 Solo la componente della forza nella stessa direzione dello spostamento genera un lavoro.



Se poi lo spostamento e la forza sono perpendicolari, il lavoro è nullo. Per esempio, quando cammini in piano portando le borse della spesa fai fatica, perché le borse sono pesanti, ma non compi lavoro dal punto di vista fisico rispetto alla forza peso. Infatti, la direzione della forza peso (che è verticale) e lo spostamento (che è orizzontale) sono perpendicolari.
Anche l’atleta che tiene sollevato il bilanciere compie uno sforzo grandissimo ma lavoro nullo, perché la forza peso del sistema “uomo + bilanciere” posta nel baricentro, non compie alcuno spostamento 2 .
Nel Sistema Internazionale l’unità di misura del lavoro è il joule (J), dal nome dello scienziato inglese James Prescott Joule (1818-1889).
Un joule equivale al lavoro compiuto dalla forza di un newton che produce uno spostamento di un metro nella stessa direzione della forza applicata.
1 joule = 1 newton ⋅ 1 metro
1 J = 1 N ⋅ 1 m


spostamento
componente orizzontale

2 Senza spostamento non c’è lavoro!
SCIENZA
Che cosa significa la famosa formula di Albert Einstein?
E = mc2 è probabilmente una delle formule matematiche più conosciute.
Il suo significato è apparentemente molto semplice: la massa e l’energia sono grandezze legate tra loro e si trasformano l’una nell’altra.
Ma… attenzione al moltiplicatore c2!
c rappresenta la velocità della luce, circa 300 000 km/s, valore che elevato al quadrato diventa un numero gigantesco. Questo vuol dire che anche una piccolissima massa, moltiplicata per questo numero enorme, può trasformarsi in una stratosferica quantità di energia!
2
Lavoro ed energia
RACCONTO GENIALE

Il lavoro è strettamente collegato all’energia: infatti, per compiere un determinato lavoro occorre impiegare una corrispondente quantità di energia. Il motore di un elevatore deve fornire una quantità di energia sufficiente per sollevare un oggetto; i nostri muscoli devono fornire l’energia necessaria per lanciare un pallone, il vento deve avere energia sufficiente per azionare le pale eoliche.
L’energia è la capacità di compiere lavoro.
L’unità di misura dell’energia è la stessa del lavoro, cioè il joule. Esistono varie forme di energia: particolarmente importanti sono l’energia potenziale e l’energia cinetica
L’energia potenziale è l’energia che possiede un corpo in relazione alla sua posizione all’interno dello spazio in cui agiscono delle forze.



Se ad agire è la forza peso, un corpo di massa m posto a una certa altezza h possiede energia potenziale gravitazionale.
Consideriamo una pallina, posta su un dosso a una certa altezza: è ferma perché è in equilibrio e apparentemente sembra non possedere alcuna energia 3 a
Se però cambiamo la posizione della pallina anche di poco, per effetto della forza di gravità essa si mette in moto e rotola verso il basso 3 b . Nella caduta la forza peso ha compiuto un lavoro. Per esprimerlo in termini numerici dobbiamo considerare che:
la forza peso è F = m ⋅ g, dove g è l’accelerazione di gravità; lo spostamento s corrisponde alla differenza tra la quota iniziale e la quota finale della pallina che indichiamo con h. Allora, possiamo scrivere:



Ep = m ⋅ g ⋅ h h
L = F ⋅ s = m ⋅ g ⋅ h



L’energia potenziale gravitazionale, Ep, è la capacità di un corpo di compiere lavoro quando cambia quota rispetto alla posizione iniziale.


Riprendiamo l’esempio della caduta della pallina dal dosso e supponiamo di mettere alla base del dosso un’altra pallina 4 . La pallina A rotola a terra e colpisce la pallina B di massa m, che si mette in movimento con una certa velocità v.
La pallina A ha ceduto la sua energia alla pallina B, che ha acquistato energia nella for ma di energia cinetica (Ec).
L’energia cinetica posseduta da un corpo di massa m e velocità v si esprime come
Ec = 1 m ⋅
e si misura anch’essa in joule

AB 4 L’energia cinetica.





L’energia cinetica è l’energia associata al movimento di un corpo.
Una particolare espressione dell’energia è rappresentata dall’energia meccanica.
L’energia meccanica di un corpo è la somma della sua energia cinetica e della sua energia potenziale.
Em = Ec + Ep
Immagina di essere sulla cima di una rampa con il tuo skateboard. L’energia potenziale è massima (perché è massima la distanza h dal suolo), mentre l’energia cinetica è zero (perché sei fermo). Man mano che scendi, l’energia potenziale diminuisce, poiché diminuisce l’altezza h; contemporaneamente aumenta l’energia cinetica, poiché lo skate acquista velocità: l’energia potenziale diminuisce della stessa quantità di cui aumenta l’energia cinetica. Alla fine della rampa, lo skate avrà energia cinetica massima ed energia potenziale zero.
Se esaminiamo la variazione dell’energia dello skate in movimento osserviamo che la somma dell’energia potenziale e dell’energia cinetica si mantiene costante. Da questa osservazione deriva uno dei principi più importanti della fisica: il principio di conservazione dell’energia meccanica, che afferma quanto segue.
In assenza di attriti, l’energia meccanica di un corpo rimane costante. L’energia potenziale e l’energia cinetica si trasformano continuamente l’una nell’altra ma la loro somma, cioè l’energia meccanica, non cambia.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. L’unità di misura del lavoro è il joule.
2. Il lavoro è una grandezza vettoriale.
3. L’energia cinetica è legata al movimento di un corpo.
4. L’energia potenziale aumenta con l’altezza.
5. Se non c'è spostamento il lavoro è nullo.


6. La differenza tra energia cinetica ed energia potenziale è l'energia meccanica.

Le trasformazioni delL’ Energia lezione 2
CARTA PENNA COMPUTER

1 Una molla possiede energia elastica.

2 Energia luminosa emessa da una farfalla illuminata dai raggi X. La ricerca di Hasler

Guarda il video e scrivi le risposte sul quaderno.

L’energia del vento
1. Che cos’è un aerogeneratore?
2. Da che cosa è generata l’energia cinetica?
3. Come avviene la trasformazione dell’energia cinetica in energia elettrica?
4. In quali luoghi vengono costruiti gli impianti eolici? Perché?
1 Altre forme di energia
Oltre all’energia cinetica e potenziale la cui somma determina l’energia meccanica di un corpo, in natura esistono altre forme di energia.
• Energia chimica: è sviluppata o assorbita durante una reazione chimica, in quanto è l’energia necessaria per rompere i legami delle molecole dei reagenti e per costituire le nuove molecole dei composti. L’energia chimica sviluppa generalmente energia termica, talvolta energia elettrica e meccanica.
• Energia elastica: è immagazzinata nei corpi elastici, cioè quei corpi che sono capaci di riprendere la loro forma dopo essere stati deformati da una forza, come una molla 1 . La restituzione dell’energia non è totale perché in natura non esistono corpi perfettamente elastici e una parte dell’energia si trasforma in energia cinetica.
• Energia nucleare: tiene uniti protoni e neutroni all’interno del nucleo di un atomo. Può trasformarsi in grandi quantità di energia termica e luminosa attraverso processi di fusione nucleare (come accade nel Sole e in tutte le stelle) e di fissione nucleare (come avviene nelle centrali nucleari).
• Energia termica: è il calore, l’energia responsabile dell’agitazione termica delle molecole di un corpo, di cui abbiamo già studiato i molteplici effetti.
• Energia elettrica: si può manifestare come energia elettrostatica quando su un corpo si accumulano cariche positive o negative in eccesso, o come corrente elettrica quando le cariche si spostano in un conduttore. È l’energia che utilizziamo per molteplici apparecchi, dagli elettrodomestici ai computer, dalle lampadine alle automobili.
• Energia sonora: prodotta dalle vibrazioni meccaniche di un corpo, si trasmette sotto forma di onde nei mezzi materiali e, entro particolari limiti, viene percepita dall’orecchio umano come suono.
• Energia luminosa: comprende le radiazioni luminose visibili e invisibili, le onde radio, i raggi X e gamma, che si propagano sotto forma di onde 2 .
2 Il principio di conservazione dell’energia
Le forme in cui si manifesta l’energia sono tante, ma per tutte vale il principio di conservazione dell’energia
L’energia non si crea e non si distrugge, ma passa da una forma all’altra.
L’energia passa da una forma all’altra oppure da un corpo a un altro, senza che il suo valore complessivo cambi.



Per capire come questo avvenga, considera questo semplice esempio
Immagina un ciclista prima su un tratto di strada pianeggiante, poi in salita e infine lungo una discesa: durante il percorso utilizza l’energia chimica contenuta nelle mole cole che formano i cibi che ha mangiato e produce energia muscolare; a sua volta, l’e nergia muscolare si trasforma in energia cinetica e potenziale. In salita, l’energia spesa aumenta per contrastare la forza di gravità; oltre all’energia cinetica, quindi, il ciclista acquista anche energia potenziale. In discesa può anche non pedalare, poiché sfrutta l’energia potenziale dovuta alla forza peso per produrre energia cinetica.

energia chimica degli alimenti
energia chimica muscolare
energia cinetica della bicicletta






energia chimica degli alimenti
energia chimica muscolare
energia cinetica della bicicletta
energia potenziale





energia potenziale
energia cinetica




Le macchine termiche
Gli esseri umani hanno costruito numerose macchine per ottenere le forme di energia desiderate, proprio sfruttando la proprietà dell’energia di passare da un corpo all’altro e da una forma all’altra.
Tra queste, le più vantaggiose sono le macchine termiche, ossia macchine che trasformano l’energia termica, cioè quella posseduta dal calore, in energia meccanica. Un esempio di macchina termica è la macchina a vapore, che ha aperto la strada all’invenzione di macchine termiche sempre più potenti. La prima macchina a vapore è stata ideata nel 1769 dallo scienziato scozzese James Watt (1736-1819)
4 . In questo tipo di macchina la combustione di legno o carbone produce l’ebollizione dell’acqua; il vapore viene convogliato a un pistone che, salendo e scendendo, trasmette il movimento a un braccio collegato a una ruota. La macchina a vapore ebbe grande successo e fu usata per realizzare macchine industriali, far viaggiare navi e locomotive.
L’invenzione del motore a scoppio, in grado di far muovere un veicolo grazie alla spinta dei gas prodotti dalla combustione di benzina o gasolio, ha permesso di costruire le automobili che oggi conosciamo.
4 Potenza e rendimento di una macchina

L’invenzione delle macchine ha sicuramente migliorato le nostre vite, perché ha consentito di compiere lavoro con un notevole risparmio di energia muscolare. L’efficienza di una macchina, tuttavia, dipende anche da quanto lavoro compie (cioè da quanta energia trasferisce) nel minor tempo possibile.
Il mio drinking bird funziona sempre, senza bisogno di energia: è una macchina per il moto perpetuo?
SCIENZA
Una macchina a moto perpetuo sarebbe in grado di compiere lavoro producendo una quantità di energia maggiore di quella che consuma o anche di convertire interamente in lavoro il calore estratto da una sorgente a temperatura costante senza alcuna dispersione. In realtà una macchina simile non esiste e la sua realizzazione è considerata impossibile dalle leggi fondamentali della fisica, in particolare dai principi della termodinamica. Anche il tuo Drinking Bird non lo è. Il suo funzionamento si basa su una differenza di temperatura e pressione tra la testa e la base del corpo. Quando il becco tocca l’acqua il liquido contenuto nella testa dell’uccellino si raffredda. La piccola differenza di temperatura tra la parte più alta dell’oggetto e la parte bassa, spinge il liquido verso la testa del drinking bird che diventa pesante e cade nel bicchiere. La temperatura esterna riscalda nuovamente il giocattolo e fa ricominciare il ciclo.

La macchina di Watt
4 La macchina a vapore di Watt.
La rapidità con cui una macchina compie lavoro è la sua potenza
La potenza si esprime come il rapporto tra il lavoro compiuto da una forza e il tempo impiegato per compierlo.
potenza = lavoro P = L tempo t
La potenza è una grandezza scalare (come il lavoro) e nel Sistema Internazionale è misurata in watt (W). Una macchina sviluppa la potenza di 1 watt quando compie il lavoro di 1 joule in 1 secondo. 1 watt = 1 joule 1 W = 1 J 1 secondo
Il watt è un’unità molto piccola e per questo spesso si usano i suoi multipli: il kilowatt (kW), equivalente a 1000 W, e il megawatt (MW), che corrisponde a 1 000 000 W. Per esempio, la potenza dell’energia elettrica normalmente utilizzata nelle nostre case è di 3 kW, mentre la potenza delle centrali elettriche si misura in megawatt 5 Malgrado i progressi della scienza e della tecnologia, non esistono macchine che compiano lavoro senza disperdere energia. Infatti ogni macchina, per compiere un lavoro, ha bisogno di energia (muscolare, chimica, elettrica ecc.), la quale si trasforma: a ogni passaggio da una forma all’altra, si sviluppa calore, o meglio, si “dissipa” energia sotto forma di calore. Per valutare l’efficienza di una macchina, cioè per calcolare quanta energia è stata impiegata per il suo funzionamento e quanta è stata dispersa, si usa una grandezza chiamata rendimento
Il rendimento di una macchina è il rapporto tra il lavoro compiuto dalla macchina e l’energia assorbita per compierlo.
VERSO LE COMPETENZE
5 Motori a confronto.






Confronta i motori a benzina, diesel ed elettrico e immagina di fornire a ciascuno 100 J di energia. Calcola quanto lavoro producono.
1. Un’auto a benzina ha un rendimento del 25%: compie un lavoro di L’energia rimanente viene dispersa sotto forma di calore: il 35% con i gas di scarico, il 20% attraverso il sistema di raffreddamento e il 20% per irraggiamento.
2. Un’auto elettrica ha un rendimento del 90%: compie un lavoro di
CARTA PENNA COMPUTER DI

Energie del futuro
EDUCAZIONE CIVICA
LE FONTI DI ENERGIA
Guarda il video e scrivi le risposte sul quaderno.
1. Quali sono le conseguenze dell’impiego massiccio dei combustibili fossili?
2. A che cosa assomigliano i generatori eolici?
3. Perché le biomasse sono una delle più promettenti risorse energetiche del futuro?
Metti in pausa il video nei seguenti punti.

4. Descrivi che cosa avviene in un impianto di cogenerazione.
1 Energia, un problema da affrontare

Le società umane hanno continuamente bisogno di energia: energia per le diverse produzioni, carburanti per i mezzi di trasporto, combustibili per riscaldare le abitazioni e per cucinare. Il fabbisogno di energia è in continua crescita ed è destinato ad aumentare ancora, a causa dell’incremento della popolazione umana (ha già raggiunto i 7 miliardi ma è destinata a superare i 9 miliardi entro il 2050).
L’approvvigionamento di energia per soddisfare il fabbisogno umano è uno dei problemi più urgenti da affrontare ed è per questo che è argomento di molti obiettivi dell’Agenda 2030.
Le fonti di energia che il nostro pianeta ci mette a disposizione sono diverse, per quanto riguarda la loro origine e la durata dei processi necessari alla loro formazione, e vengono classificate in due gruppi: fonti di energie non rinnovabili e fonti di energie rinnovabili Fino a qualche decennio fa, le energie non rinnovabili, in particolare carbone e idrocarburi, sono state le principali fonti di energia per tutte le attività umane, e questo ha contribuito in maniera decisiva all’aumento dell’effetto serra, con tutte le sue conseguenze.
L’uso delle energie rinnovabili, come l’energia solare e quella eolica, è più recente, ma nei prossimi anni tali energie affiancheranno sempre di più i combustibili fossili.
2 Le fonti di energia non rinnovabili
Le fonti di energie non rinnovabili hanno tempi di rigenerazione molto lunghi e, una volta esaurite, non sono più disponibili.
In questo gruppo rientrano i combustibili fossili e gli elementi radioattivi uranio e plutonio.
ORA FERMA L’IMMAGINE!
■ I combustibili fossili
Con il termine combustibili fossili si indicano tre fonti energetiche: il petrolio e il gas naturale, che sono idrocarburi, e il carbone. I combustibili fossili rappresentano una riserva di energia chimica che viene trasformata nelle centrali termoelettriche per produrre energia termica, che a sua volta viene trasformata in energia elettrica. Gli idrocarburi e il carbone si sono originati dalla lenta trasformazione di resti organici, animali e vegetali, che si sono depositati sui fondali di mari, laghi e paludi, e successivamente sono stati ricoperti dai sedimenti. Il processo ha richiesto milioni di anni per avvenire ed è questa la ragione per cui tali fonti energetiche sono considerate non rinnovabili. I giacimenti di idrocarburi hanno iniziato a formarsi circa 500 milioni di anni fa, durante l’era geologica chiamata Paleozoico. Oggi il petrolio è la fonte di energia più usata al mondo: per la sua importanza è soprannominato oro nero. Il carbone è di poco più “recente”, perché ha iniziato a formarsi circa 400 milioni di anni fa, alla fine del Paleozoico. È il risultato della decomposizione dei resti vegetali di grandi foreste che nel periodo Carbonifero coprivano una parte delle terre emerse 1 Il metano è un idrocarburo gassoso che si accumula nei giacimenti associato a petrolio o carbone, oppure si trova da solo nei giacimenti di gas naturale. Riveste una grande importanza economica in quanto è ampiamente utilizzato per il riscaldamento delle abitazioni.
■ Uranio e plutonio
I nuclei atomici sono formati da protoni e neutroni, tenuti insieme da una forza molto intensa: questa energia può liberarsi attraverso il processo del decadimento radioattivo con emissione di energia sotto forma di radiazioni alfa, beta e gamma. In natura esistono elementi che decadono spontaneamente, come l’uranio e il plutonio Nelle centrali nucleari a fissione 2 la radioattività di questi elementi è innescata artificialmente per liberare energie molto elevate: la fissione di un grammo di uranio-235 libera una quantità di energia pari a quella liberata dalla combustione di 2,7 tonnellate di carbone o di 13,7 barili di petrolio. La sicurezza delle centrali a fissione richiede costi di manutenzione elevatissimi e l’uranio consumato lascia pericolose scorie radioattive, che richiedono complessi processi per lo stoccaggio e lo smaltimento.
Da anni nei laboratori di fisica di tutto il mondo si studia il modo di ottenere energia sfruttando la fusione nucleare, lo stesso processo che avviene nel Sole e nelle stelle. Il processo consiste nell’unione di due nuclei di atomi “leggeri”, per esempio il deuterio e il trizio, due isotopi dell’idrogeno: fondendosi insieme danno origine al nucleo di un atomo “pesante”, l’elio, a un neutrone e a una grande quantità di energia. Il processo, oltre che produrre molta più energia rispetto alla fissione, produce scorie che non sono né radioattive né pericolose.
Anche l’energia nucleare è considerata una fonte energetica non rinnovabile perché sia l’uranio sia il plutonio, gli elementi chimici utilizzati nelle centrali nucleari, sono estratti da minerali che si sono formati centinaia di milioni di anni fa, durante le prime fasi di formazione della crosta terrestre. A oggi non esistono metodi efficaci per la rigenerazione dei combustibili a base di uranio, dopo che sono stati usati nelle centrali a fissione nucleare.
1 Una miniera di carbone a cielo aperto.

2 Centrale nucleare francese.


L’energia in casa
3
Le fonti di energia rinnovabili
Le fonti di energie rinnovabili sono inesauribili o hanno tempi di rigenerazione molto brevi e, per questi motivi, sono sempre disponibili. Tali fonti sono definite anche sostenibili perché il loro impiego per la produzione di energia ha un basso impatto ambientale. Perché possano essere veramente sostenibili, tuttavia, le energie non solo devono essere rinnovabili, ma devono anche essere impiegate in modo efficiente ed essere disponibili per le future generazioni.
■ Energia dall’acqua
3 Pannelli fotovoltaici per la produzione di energia elettrica.
L’energia idroelettrica è prodotta dal movimento dell’acqua. Oggi esistono due tipi di centrali idroelettriche. Le centrali idroelettriche a salto sfruttano l’energia cinetica acquisita dall’acqua che scende in una condotta. Arrivata alla centrale, mette in movimento delle grandi ruote chiamate turbine, capaci di trasformare l’energia cinetica dell’acqua in energia elettrica. Le centrali idroelettriche ad acqua fluente, invece, producono energia elettrica sfruttando l’energia di scorrimento dell’acqua di un fiume in pianura. Un altro utilizzo dell’energia dell’acqua è l’energia mareomotrice, cioè l’energia meccanica prodotta dal periodico innalzamento e abbassamento delle maree, che viene convertita in energia elettrica.
■ Energia dal Sole
4 Schema del principio di funzionamento di una turbina eolica.
L’energia solare arriva sulla Terra tramite le radiazioni prodotte dall’attività del Sole. I pannelli solari termici trasformano questa energia in calore che poi è utilizzato per avere acqua calda e riscaldare le abitazioni. I pannelli fotovoltaici, invece, sono formati da celle fotovoltaiche che trasformano l’energia solare direttamente in energia elettrica. Le centrali solari, presenti anche in molte aree del territorio italiano sono formate da un gran numero di pannelli fotovoltaici collegati tra loro che producono corrente elettrica continua, poi convertita in corrente alternata 3
■ Energia dal vento
L’energia eolica è prodotta dal movimento del vento. Gli aerogeneratori, impianti formati da grandi eliche collegate a un generatore, trasformano l’energia cinetica del vento in energia elettrica 4 . Un impianto eolico, chiamato anche parco eolico, è formato da centinaia di aerogeneratori che vengono posizionati in luoghi dove le condizioni del vento sono favorevoli. Alcuni parchi eolici, chiamati off-shore, sono posizionati in mare, lontano dalla costa, per sfruttare al meglio le correnti e ridurre l’inquinamento acustico prodotto dalle pale e l’impatto degli aerogeneratori sul paesaggio.
■
Energia dalle biomasse
Le biomasse vegetali sono in gran parte costituite dal legno e dai suoi derivati, mentre le biomasse animali sono formate in prevalenza dai residui delle aziende di allevamento del bestiame e di lavorazione del latte. Sottoposte a processi di fermentazione controllata in speciali caldaie, è possibile sfruttare i gas prodotti dalle biomasse per ottenere elettricità e calore. Le biomasse vegetali possono essere impiegate per la produzione di biocarburanti, in alternativa ai carburanti tradizionali; il bioetanolo, per esempio, si ottiene dalla canna da zucchero, dalla barbabietola e da cereali ricchi di zucchero come il mais; il biodiesel, invece, è ottenuto da materia organica ricca di oli o grassi, come la colza, la soia e la palma.
■ Energia dalla Terra

L’energia interna della Terra arriva dalle profondità del pianeta e si manifesta in superficie attraverso le eruzioni vulcaniche e sotto forma di potenti getti di gas e vapore acqueo emessi da geyser, soffioni e sorgenti termali. Tutti questi fenomeni geologici sono accompagnati dall’emissione di energia termica, l’energia geotermica utilizzata direttamente per riscaldare le abitazioni o trasformata in energia elettrica nelle centrali geotermiche.


FISSA I CONTENUTI ESSENZIALI
Scegli il termine corretto tra i due proposti.

1. Le centrali idroelettriche trasformano l’energia cinetica dell’aria/acqua in energia elettrica.
2. I biocarburanti sono carburanti ottenuti dalla fermentazione/combustione delle biomasse.
3. Il carbone/vento è una fonte di energia rinnovabile.
4. I pannelli solari termici/fotovoltaici trasformano direttamente l’energia solare in elettricità.
EDUCAZIONE CIVICA
L’energia nucleare
L’energia “racchiusa” nel nucleo degli atomi può essere liberata attraverso il processo del decadimento radioattivo.
Nelle centrali nucleari questi stessi processi sono riprodotti e intensificati.

1 Radiazioni alfa, beta e gamma.
1 Il decadimento radioattivo

I nuclei atomici sono formati da protoni e neutroni, tenuti insieme da una forza molto intensa. Gli atomi di alcuni elementi, tuttavia, sono instabili perché nel loro nucleo è contenuto un numero di neutroni superiore a quello dei protoni. Questa instabilità fa sì che il nucleo spontaneamente si trasformi (decada) in un nucleo con un minor numero di neutroni, più stabile. Questo processo è chiamato decadimento radioattivo e gli elementi che lo subiscono sono detti elementi radioattivi
Il decadimento radioattivo è accompagnato dall’emissione di energia sotto forma di radiazioni alfa, beta e gamma. Si tratta di raggi altamente energetici che possono penetrare negli organismi viventi e danneggiarne le cellule 1
Le radiazioni alfa sono nuclei di elio, costituiti da due protoni e due neutroni. Sono poco penetranti e possono essere trattenute da un semplice foglio di carta.
Le radiazioni beta sono costituite da elettroni. Possono essere bloccate da uno schermo di alluminio. Le radiazioni gamma sono onde elettromagnetiche e sono prive di massa. Sono molto penetranti e sono assorbite da uno spesso schermo di piombo o un blocco di cemento.
raggi alfa
raggi beta
raggi gamma neutrone carta alluminio piombo calcestruzzo
nucleo di uranio 235 neutrone rottura del nucleo nuclei più piccoli neutroni rilasciati dalla reazione energia





2 Schema della fissione nucleare di un nucleo di uranio-235.
2 L’uranio
L’uranio naturale è un elemento debolmente radioattivo. Nelle centrali nucleari, invece, attraverso il processo di fissione nucleare, la radioattività dell’uranio viene innescata artificialmente per liberare energie molto elevate 2
Si sottopongono i nuclei di uranio, in particolare dell’uranio-235, a un bombardamento di neutroni. Il nucleo si frantuma in due atomi più leggeri e sono emessi due o tre neutroni. Questi nuovi neutroni possono colpire altri atomi di uranio-235 provocando altre fissioni: innescano cioè una reazione a catena
La fissione di un grammo di uranio-235 libera una quantità di energia pari a quella liberata dalla combustione di 2,7 tonnellate di carbone o di 13,7 barili di petrolio.
3 Le centrali a fissione nucleare
Processi di fissione nucleare controllata sono alla base del funzionamento dei reattori delle centrali nucleari a fissione 3 . Nel “cuore” del reattore, il nocciolo, sono sistemati fasci di barre di uranio-235; un fluido circola nel nocciolo e raccoglie il calore prodotto dalla fissione. Il fluido riscaldato produce vapore che fa ruotare una turbina collegata con generatori elettrici. L’energia elettrica è trasmessa agli utilizzatori lungo una rete di linee elettriche.
La produzione di energia nucleare da fissione presenta moltissimi rischi e inconvenienti. La sicurezza delle centrali richiede costi di manutenzione elevatissimi, mentre l’uranio consumato lascia pericolose scorie radioattive, che richiedono complessi processi per lo stoccaggio e lo smaltimento.
In Italia la produzione di energia nucleare è stata interrotta da un referendum popolare del 1986, che ha espresso parere sfavorevole alla costruzione di nuove centrali a fissione nucleare.
4
Le centrali a fusione nucleare
L’evoluzione delle centrali nucleari a fissione sono le centrali nucleari a fusione 4 , nelle quali si vorrebbe poter sfruttare lo stesso processo che avviene nel Sole e nelle stelle per generare energia.

3 Schema di una centrale nucleare.
fusione termonucleare


Il processo consiste nell’unione di due nuclei di atomi “leggeri”, ad esempio il deuterio e il trizio, due isotopi dell’idrogeno. Fondendosi insieme, questi isotopi danno origine al nucleo di un atomo “pesante”, l’elio, a un neutrone e a una grande quantità di energia. Il nucleo di nuova formazione, infatti, non possiede una massa pari alla somma dei due nuclei di partenza, in quanto la materia mancante è stata convertita in energia.
Il processo, oltre che essere molto più produttivo della fissione in termini di energia, produce scorie inerti, cioè che non sono né radioattive né pericolose. Il motivo per cui non è ancora possibile costruire centrali a fusione nucleare consiste nel fatto che, per ottenere l’avvicinamento dei nuclei e la loro fusione, occorrono temperature elevatissime, dell’ordine delle centinaia di milioni di gradi.
A tali temperature non esistono materiali in grado di resistere: nei prototipi di centrali a fusione nucleare, dette a “confinamento magnetico”, vengono impiegati forti campi magnetici per impedire al plasma, fatto da nuclei di idrogeno, di venire a contatto con le pareti del reattore.

4 Schema della fusione nucleare di un nucleo di deuterio e un nucleo di trizio.
nucleo di deuterio
neutrone
nucleo di elio
nucleo di trizio
turbina trasformatore generatore elettrico
linee di trasmissione
barra di controllo refrigerante
combustibile nucleare
acqua di reintegro del circuito di raffreddamento lago/fiume
meccanismo
motore a ingranaggi
acqua calda
acqua fredda
condensatore
pompa dell’acqua
reattore nucleare
pompa dell’acqua
generatore di vapore
torre di raffreddamento
CON LA SINTESI
lezione 1 IL LAVORO E L’ENERGIA
Una forza compie lavoro se causa lo spostamento del corpo al quale è applicata. Il lavoro è il prodotto della forza per lo spostamento; è una grandezza scalare e si misura in joule (J).
L’energia è la capacità di compiere lavoro e si misura anch’essa in joule. Esistono diversi tipi di energia; i più importanti sono l’energia potenziale e l’energia cinetica. L’energia potenziale è l’energia che possiede un corpo in relazione alla posizione che occupa nello spazio in cui agiscono le forze. In particolare, un corpo posto a una certa altezza possiede energia potenziale gravitazionale, che si esprime come prodotto della massa per l’accelerazione di gravità e per l’altezza.
Ep = m ⋅ g ⋅ h
L’energia cinetica è legata al movimento dei corpi.
Si esprime come

E = 1 m v2 2
Si definisce energia meccanica la somma dell’energia cinetica e dell’energia potenziale di un corpo. Secondo il principio di conservazione dell’energia meccanica, in assenza di attriti l’energia meccanica di un corpo rimane costante.
lezione 2 LE TRASFORMAZIONI DELL’ENERGIA
Oltre all’energia meccanica esistono molti altri tipi di energia, come l’energia termica, chimica, elettrica, luminosa, nucleare, elastica e altre ancora. Per tutte le forme di energia vale il principio di conservazione dell’energia: l’energia non si crea e non si distrugge, ma passa da una forma all’altra. Sulla base di questo principio sono state inventate le macchine, che permettono di ottenere le forme di energia desiderate sfruttando la proprietà dell’energia di passare da una forma all’altra. Le macchine termiche sono quelle più vantaggiose nella trasformazione di energia termica in energia meccanica. La prima a essere inventata fu la macchina a vapore, seguita poi dal motorea scoppio


La potenza di una macchina dipende dalla rapidità con cui compie lavoro e si esprime come il rapporto tra il lavoro compiuto e il tempo in cui si compie. La potenza è una grandezza scalare e si misura in watt (W). Il rendimento di una macchina è il rapporto tra il lavoro compiuto e l’energia assorbita per compierlo. In tutte le macchine la trasformazione di energia da una forma all’altra avviene con la dispersione di una certa quantità di calore: cioè, non tutta l’energia a disposizione viene trasformata, una parte si disperde nell’ambiente sotto forma di calore.
lezione 3 EDUCAZIONE CIVICA LE FONTI DI ENERGIA
Le diverse fonti di energia si classificano in non rinnovabili e rinnovabili.
Le fonti di energia non rinnovabili hanno tempi di rigenerazione molto lunghi e, una volta consumate, non sono più disponibili. Comprendono i combustibili fossili (petrolio, carbone, gas naturale), uranio e plutonio, minerali radioattivi usati nelle centrali nucleari a fissione per la produzione di energia.
Le fonti di energia rinnovabili hanno tempi di rigenerazione brevi e sono disponibili anche per le generazioni future.
L’energia idroelettrica, l’energia delle masse d’acqua in movimento, è trasformata in elettricità nelle centrali idroelettriche.
L’energia eolica, l’energia delle masse d’aria in movimento, è trasformata in elettricità dagli aerogeneratori.
L’energia solare, l’energia luminosa prodotta dal Sole, è trasformata direttamente in elettricità all’interno dei pannelli fotovoltaici e in calore dai pannelli solari termici.

L’energia da biomassa si libera come calore attraverso la combustione dei residui animali e vegetali, mentre dalla fermentazione delle biomasse si ottengono gas e biocombustibili.
L’energia geotermica ha origine dal calore interno della Terra e può essere usata direttamente come energia termica oppure trasformata in energia elettrica.
CON LA MAPPA
Adesso che hai ripassato i contenuti essenziali con la sintesi, prova a completare la mappa con le parole chiave suggerite e a trovare le definizioni corrispondenti.
combustibili fossili - energia chimica - fonti rinnovabili - lavoro - macchine termiche - spostamento - vento
si presenta in diverse forme per esempio può provenire da che è usata nelle 6. termica
che si esprime come prodotto di
che è la somma di 3. meccanica
4. energia cinetica 5. energia potenziale

a. La sua unità di misura è il joule.
b. Energia associata al movimento di un corpo.
c. Fonte di energia formata da scarti di materiali organici.
d. Hanno tempi di rigenerazione molto lunghi.
e. Causa lo spostamento di un corpo.
come l’energia ottenuta dai 11. fonti non rinnovabili
14. biomassa 16. Sole come l’energia ottenuta da
è la capacità di compiere
forza 8.
1. L’ENERGIA 2.

lezione 1 IL LAVORO E L’ENERGIA
1 Sottolinea il termine corretto tra i due proposti.
a. Il lavoro è il rapporto/prodotto di forza e spostamento.
b. L’energia è la capacità di compiere lavoro/ movimento.
c. Il lavoro si misura in joule/watt
d. Il lavoro è una grandezza scalare/vettoriale.
2 Scegli la soluzione errata.
a. Dal punto di vista fisico il lavoro è nullo quando:
1 la forza è nulla.
2 lo spostamento è nullo.
3 la direzione della forza è perpendicolare a quella dello spostamento.
4 il verso della forza è contrario a quello dello spostamento.
b. L’energia cinetica:
1 è l’energia posseduta da un corpo in movimento.
2 è l’energia legata alla posizione del corpo.
3 dipende dalla massa del corpo.
4 è proporzionale al quadrato della velocità.
c. L’energia potenziale:
1 deriva dalla posizione del corpo.
2 è legata al peso del corpo.
3 è l’energia muscolare.
4 è l’energia di una biglia ferma su un banco.
3 Completa il brano con i termini corretti. Un corpo che cade a terra da un’altezza di 3 metri ha energia massima a 3 m e minima a terra. L’energia cinetica è a terra e a 3 m dal suolo. Si definisce energia la somma di energia cinetica ed energia potenziale e, in assenza di attriti, essa si
4 Osserva il disegno e inserisci i numeri corrispondenti alle situazioni indicate.



a. Individua gli argani che compiono lo stesso lavoro.
b. Individua l’argano che compie un lavoro di 300 J.
c. Individua un argano che compie un lavoro doppio rispetto all’argano 1.
lezione 2 LE TRASFORMAZIONI DELL’ENERGIA
5 Segna con una crocetta se vero (V) o falso (F).
a. Lavoro, energia e potenza sono espresse con la stessa unità di misura.
b. L’energia termica non può essere trasformata in energia meccanica.
c. Tutta l’energia fornita a una macchina si trasforma in lavoro.
6 Abbina i termini con la definizione corretta.
1. Energia chimica
2. Energia elastica
3. Energia termica
4. Energia nucleare
a Energia prodotta dai corpi elastici.
b Energia che lega protoni e neutroni del nucleo di un atomo.
c Energia prodotta nelle reazioni chimiche.
d Energia prodotta dai combustibili.
7 Scegli la soluzione corretta.
a. Il principio di conservazione dell’energia afferma che:
1 l’energia non si crea e non si distrugge, ma si trasforma.
2 l’energia fornita a una macchina è uguale a quella consumata.
3 l’energia è sempre minore di 1.
4 l’energia si trasforma solo in calore.
b. La potenza è:
1 il lavoro compiuto in un determinato tempo.
2 la capacità di compiere lavoro.
3 il rapporto tra energia fornita e energia consumata da una macchina.
4 l’energia necessaria per sollevare un oggetto.
c. In una trasformazione parte dell’energia si trasforma in:
1 energia cinetica.
2 calore.
3 energia potenziale.
4 energia elettrica.
8 Osserva le immagini e inserisci accanto a ogni foto il numero corrispondente.


1. Energia eolica
2. Energia geotermica
3. Energia solare


4. Energia da combustibili fossili
9 Scegli la soluzione errata.
a. Le centrali idroelettriche:
1 trasformano l’energia cinetica dell’aria in energia elettrica.
3 trasformano l’energia cinetica dell’acqua in energia elettrica.
4 sono “a salto” quando sfruttano l’energia cinetica dell’acqua in una condotta.
5 sono “ad acqua fluente” quando sfruttano l’energia cinetica dell’acqua che scorre.
b. Il petrolio:
1 è una fonte di energia rinnovabile.
2 è un idrocarburo.
3 è il prodotto di una lunghissima trasformazione di resti organici.
4 è una fonte di energia non rinnovabile.
c. Un parco eolico:
1 è formato da centinaia di aerogeneratori.
2 è formato da centinaia di pannelli solari.
3 può essere posizionato in mare.
4 è installato dove le condizioni del vento sono favorevoli.
10 Segna con una crocetta se vero (V) o falso (F).
a. Petrolio, uranio e gas metano sono combustibili fossili.
b. L’energia geotermica è l’energia che proviene dal Sole.
c. L’energia eolica si ottiene per trasformazione dell’energia cinetica del mare.
d. Dalla fermentazione delle biomasse si ottiene gas.
11 Sottolinea il termine corretto tra i due proposti.
Le masse d’acqua/biomasse sottoposte a fermentazione/combustione possono liberare gas che vengono utilizzati per produrre energia elettrica/potenziale oppure possono essere utilizzate come biocarburanti: il bioetanolo/biodisel prodotto a partire da residui vegetali ricchi di zucchero, il bioetanolo/biodisel prodotto da materia organica/inorganica ricca di grassi e oli.
lezione 3 LE FONTI DI ENERGIA
RICONOSCERE
1 Osserva l’immagine e rispondi.

a. In questa immagine è visualizzata la variazione di un tipo di energia: quale?
b. Quale tipo di energia possiede il ragazzo
• nel punto 1?
• nel punto 2?
• nel punto 3?
c. Che cosa è rappresentato dalla lunghezza uguale delle tre frecce?
TRARRE INFORMAZIONI DA UN’IMMAGINE
2 Osserva l’immagine e rispondi.
a b
VERSO L’ESAME: RISOLVERE PROBLEMI
3 Osserva il disegno, rispondi alle domande ed esegui i calcoli richiesti.
B
a. Sulle montagne russe, l’energia del vagone continuamente si trasforma da energia potenziale a energia cinetica e viceversa. Quale principio fisico regola questa trasformazione?
Quale delle due persone compie lavoro? Motiva la tua risposta.
b. Sapendo che il punto A, il punto più alto, si trova a 20 m di altezza, il punto C a 10 m e il punto D a 5 m e che la massa totale del vagone è 550 kg, calcola:
1. l’energia potenziale del vagone nei punti A, C, D;
2. l’energia cinetica del carrello in B, che si trova a una quota intermedia tra A e C;
3. la velocità del vagone nel punto C.
4 Un rimorchiatore con una potenza di 650 W trascina una nave con una velocità di 4 m/s per 5 minuti.
a. Qual è il lavoro compiuto dal rimorchiatore?
b. Di quanto viene spostata la nave?
c. Quale forza esercita?
SPIEGARE UN FENOMENO
5 Rispondi alle domande.
a. Perché le fonti energetiche rinnovabili spesso sono definite sostenibili?
ELABORARE INFORMAZIONI DA UN TESTO
7 Leggi il brano.
RINNOVABILI, FACCIAMO IL PUNTO
b. Come funziona una centrale idroelettrica a salto e una ad acqua fluente?
c. Di che tipo possono essere i pannelli che sfruttano l’energia solare?
VERSO L’ESAME: INTERPRETARE GRAFICI
6 Il grafico riporta la quota di ciascuna fonte energetica sul totale delle fonti rinnovabili nel 2022 in Italia.
a. Qual è la principale fonte di energia rinnovabile in Italia?
b. Quali condizioni geologiche rendono possibile l’utilizzo della geotermia?
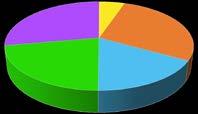
Il pianeta ha sempre più bisogno di energia, ma soprattutto ha bisogno di energia pulita e rinnovabile. Ancora oggi la maggior parte delle fonti energetiche è costituita da combustibili fossili molto inquinanti. I progetti di ricerca sulle fonti energetiche rinnovabili hanno permesso di capire la necessità di conciliare il bisogno crescente di energia con la preoccupazione sullo stato del pianeta. Nel complesso l’energia pulita utilizzata copre il 34% del totale, contro una media europea che non supera il 29%. L’impegno del nostro Paese è quello di raggiungere quota 10% di consumi green nel settore dei trasporti. I prossimi obiettivi per la crescita delle rinnovabili aprono, una sfida decennale. L’Italia deve installare 40 gigawatt (GW) di nuovi impianti a fonti rinnovabili entro il 2030, secondo quanto prevede il Piano nazionale integrato energia e clima (PNIEC). Il nuovo PNIEC mette nero su bianco i nuovi obiettivi italiani sul tema decarbonizzazione, efficienza energetica, autoconsumo e generazione distribuita, sicurezza energetica ed elettrificazione dei consumi. Dal 2025 al 2030 il piano punta molto sulle nuove installazioni di eolico e soprattutto fotovoltaico (2,5 volte l’installato attuale). Da questo deriverebbe un aumento complessivo della potenza da fonti rinnovabili installate del 75%.
Rispondi alle domande. Svolgi l’attività proposta da solo o insieme ai tuoi compagni.
a. Che cosa si intende per “energia pulita”?
b. Perché è auspicabile passare a fonti energetiche rinnovabili?
c. Quali sono gli obiettivi del PNIEC?
d. Quali cambiamenti si possono attuare nelle nostre abitazioni per raggiungere gli obiettivi del PNIEC?
DIGITAL SKILLS
Ricerca in rete esempi di autoconsumo e generazione distribuita di energia realizzati in Italia.


CLIMATE CHANGE
A hard reality is facing future generations: the weather will get worse and worse. The changing climate of the planet derives from the combustion of billions of tons of fossil fuel to produce industrial power, electricity, transport, heating and, more recently, digital technology. This will lead to dramatic consequences: seas will be higher, glaciers melt, storms became more intense. Tens of millions of people will be displaced, rivers will be dried up, low lying areas flooded. Because the processes that cause climate change are global, measures have to be similarly all over the world. The first step to be taken immediately is decarbonization. But to decarbonize an economy is not simple; it requires an enormous change both in the economy and in everyday life. Reducing greenhouse gas emissions will raise the cost of doing business in some sectors but will mean savings in others. In Europe, for instance, reaching net-zero emissions would create 11 million jobs and eliminate six million jobs by 2050. This is a global challenge which implies a change in geopolitics, too. In order to accelerate the transition world governments should come together and agree on a global action to save the planet allocating financial support to address emissions in at least big cities which produce most CO2.
Answer the following questions.
a. Why should global measures be taken?
b. What immediate measure is necessary?
c. How will it be to take it?





e il L’elettricitàmagnetismo unità
lezione 1
I FENOMENI ELETTRICI
lezione 2

LA CORRENTE ELETTRICA
lezione 3
UNA CASA ECOSOSTENIBILE
EDUCAZIONE CIVICA
Le miniere urbane
lezione 4

I FENOMENI MAGNETICI
lezione 5
L’ELETTROMAGNETISMO

LEZIONI POWERPOINT













BUONE NOTIZIE PER IL FUTURO
Trasporto elettrico in evoluzione
Grazie ai veicoli con motori ibridi o con motori completamente elettrici, la riduzione dell’inquinamento dell’aria nelle città sta diventando una realtà destinata a crescere nei prossimi anni. Rimangono, tuttavia, i problemi legati alla produzione e allo smaltimento delle batterie che alimentano i motori elettrici. Il loro componente principale è il litio, un metallo leggero con una forte capacità di accumulare e conservare energia elettrica. In natura, il litio è legato ad altri composti, dai quali viene separato grazie a un processo complesso e costoso, che richiede energia e acqua, e che produce sostanze chimiche inquinanti. L’Unione Europea ha emanato una direttiva che impone ai produttori di auto e agli importatori di batterie l’obbligo di provvedere al loro riciclo, così da ridurre il fabbisogno di litio e di altre materie prime come nichel, manganese, cobalto, grafite, e di conseguenza ridurre il dannoso impatto ambientale prodotto dall’estrazione in miniera. Questi minerali, dopo un processo di purificazione, possono essere riciclati per produrre nuove batterie per finalità differenti, per esempio per la fornitura di energia per apparecchiature elettriche in ospedali e aziende in caso di blackout.





I fenomeni elettrici lezione 1
LAB STEM
STROFINA E ATTIRA
Se si strofina con un panno di lana un pezzo di ambra, una resina fossilizzata, questa acquista la proprietà di attirare pagliuzze e piume. Questo fenomeno è chiamato elettricità. Prova a riprodurlo usando materiali diversi, come la plastica e il vetro.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• 2 bacchette di plastica (vanno bene anche le cannucce di 2 penne biro)
• una bacchetta di vetro
• un panno di lana
• un sostegno per le bacchette (per esempio un chiodo)
• un rotolo di filo di nylon

carta e penna




PROCEDIMENTO
1. Strofina con il panno di lana le due bacchette di plastica.
2. Lega una delle due bacchette a un pezzo di filo di nylon, poi appendilo al sostegno facendo in modo che la bacchetta sia ferma.
3. Avvicina l’altra bacchetta di plastica alla bacchetta sospesa.
4. Osserva e annota su un foglio che cosa accade.
5. Strofina con il panno di lana la bacchetta di vetro.




6. Avvicina la bacchetta di vetro alla bacchetta di plastica sospesa al filo di nylon.
7. Osserva e annota su un foglio che cosa accade.
■ OSSERVA E RISPONDI
1. Che cosa accade quando avvicini le due bacchette di plastica?
2. Che cosa accade quando avvicini la bacchetta di vetro a quella di plastica?
3. Avvengono gli stessi fenomeni se non strofini le bacchette con il panno di lana?
4. Scrivi la relazione dell’esperimento.

1
L’elettrizzazione per strofinio
Da che cosa dipende l’elettricità di un corpo? Perché lo strofinio fornisce a un oggetto la capacità di attrarne o respingerne un altro? La risposta a queste domande è da ricercare nella struttura stessa della materia, più precisamente nella struttura degli atomi che la compongono. Ogni atomo è composto da:
• protoni, particelle dotate di carica elettrica positiva (indicata con +) che si trovano nel nucleo;
• neutroni, particelle prive di carica elettrica, anch’esse localizzate nel nucleo;
• elettroni, particelle dotate di carica elettrica negativa ( ), che si muovono intorno al nucleo dell’atomo.
Gli atomi che contengono un uguale numero di protoni e di elettroni sono elettricamente neutri. In condizioni normali, anche i corpi sono elettricamente neutri, poiché contengono un’uguale quantità di carica elettrica positiva e negativa. Infatti, se avvicini tra loro due bacchette di plastica e una di vetro senza averle prima strofinate con un panno di lana, non avviene alcun fenomeno di attrazione né di repulsione, perché gli atomi che le compongono sono elettricamente neutri. Tuttavia, i corpi possono cambiare il proprio stato elettrico ed elettrizzarsi.
Un corpo si dice elettrizzato se contiene un numero di cariche elettriche positive diverso da quello delle cariche elettriche negative.
Riprendiamo l’esperimento in apertura di questa lezione. Quando si strofinano tra loro il panno di lana e la bacchetta di vetro, si produce uno squilibrio nella distribuzione delle cariche elettriche: gli elettroni più esterni degli atomi che compongono il vetro, che sono più liberi di muoversi, passano agli atomi del panno di lana utilizzando l’energia meccanica dovuta allo strofinio. Gli atomi del vetro si ritrovano quindi con un numero di protoni maggiore del numero di elettroni: la bacchetta di vetro risulta carica positivamente. Al contrario, il panno di lana, avendo acquistato elettroni, risulta carico negativamente 1
1 L’elettrizzazione per strofinio.
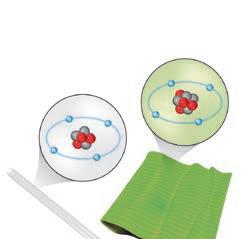
bacchetta di vetro panno di lana


PRIMA DELLO STROFINIO DURANTE PRIMA DELLO STROFINIO
Se invece usiamo una bacchetta di plastica, il movimento di elettroni durante lo strofinio avviene dalla lana alla plastica: alla fine la plastica è carica negativamente, mentre il panno di lana risulta carico positivamente.
Questo tipo di elettrizzazione dei corpi è definito per strofinio.
Un corpo si elettrizza per strofinio quando viene strofinato contro un altro corpo.


bacchetta di vetro
Perché nei giorni di vento mi capita di prendere la scossa quando tocco lo sportello dell’auto?
panno di lana PRIMA DELLO STROFINIO
bacchetta di vetro


panno di lana

Toccando lo sportello dell’auto, ma anche i vestiti in materiali sintetici, possiamo percepire una scossa elettrica, un passaggio di energia tra il nostro corpo e l’altro oggetto. Questo succede perché tra i due corpi si crea una differenza di carica elettrica: il corpo umano è dotato di elettricità statica, l’altro è stato elettrizzato sulla sua superficie per l’azione del vento.









DOPO LO STROFINIO
2 L’elettrizzazione per contatto.






3 L’elettrizzazione per induzione.

2 L’elettricità statica
È bene notare che lo strofinio causa solo uno spostamento di cariche elettriche: esse, infatti, non possono essere né create né distrutte.
L’elettrizzazione produce un accumulo di particelle elettrizzate sulla superficie dei corpi, che acquistano elettricità statica
Esistono due tipi di elettricità statica:
• un’elettricità positiva (quella delle sostanze che si comportano come il vetro);
• un’elettricità negativa (quella delle sostanze che si comportano come la plastica).
Se avviciniamo tra loro due corpi carichi di elettricità dello stesso tipo, osserviamo che si respingono, mentre se avviciniamo due corpi carichi di elettricità di tipo opposto, essi si attraggono
L’unità di misura della quantità di carica elettrica è il coulomb (C), dal nome dello scienziato francese Charles Augustin de Coulomb (1736-1806).
La carica di 1 C corrisponde a quella di 6,25 · 1018 elettroni.
L’elettrizzazione può avvenire anche per contatto e per induzione. Procurati una pallina di polistirolo o di sughero e sospendila a un filo di cotone. Carica per strofinio una bacchetta di plastica con un panno di lana (la bacchetta accumula cariche negative) e poi mettila a contatto con la pallina. Osserverai che, subito dopo il contatto, la pallina si allontana dalla bacchetta. Tra pallina e bacchetta c’è infatti repulsione: sono entrambe caricate negativamente 2 Quando si appoggia su un corpo neutro una bacchetta elettrizzata, di plastica o di vetro, una parte di carica si trasferisce attraverso la zona di contatto: il corpo neutro acquisisce cariche elettriche dello stesso segno di quelle del corpo elettrizzato.
Un corpo neutro si elettrizza per contatto quando tocca un corpo elettricamente carico (positivamente o negativamente).





bacchetta di vetro

























Prova ora ad avvicinare una bacchetta di vetro, caricata positivamente per strofinio con un panno di lana, a dei pezzetti di carta. Puoi osservare che essi vengono attratti: la bacchetta e i pezzetti di carta presentano quindi cariche di segno opposto 3 a . La vicinanza con la bacchetta elettrizzata provoca una separazione di cariche sul corpo neutro, cioè la carta. Gli elettroni liberi della carta si spostano verso la bacchetta; di conseguenza questa parte di carta si carica negativamente, mentre la parte più lontana della carta si carica positivamente 3 b









Un corpo neutro si elettrizza per induzione quando viene avvicinato a un corpo carico.


Il corpo carico (la bacchetta) è detto anche corpo inducente o induttore, mentre il corpo che viene elettrizzato (la carta) è detto corpo indotto. L’elettrizzazione per induzione è temporanea e cessa quando il corpo inducente si allontana.
3 Conduttori e isolanti
Prova a realizzare questi due semplici esperimenti: strofina con un panno di lana due oggetti di metallo, per esempio una forchetta e un cacciavite. Avvicina la forchetta a una pallina di sughero o di plastica sospesa a un filo di nylon: la pallina non è attratta né re-
spinta dalla forchetta. Questo significa che la forchetta non si è elettrizzata mediante strofinio 4 a . Ora avvicina alla pallina il cacciavite precedentemente strofinato e vedrai che la pallina è attratta dal cacciavite: significa che il cac ciavite si è elettrizzato mediante strofinio

Per spiegare i diversi risultati dei due esperimenti, consi dera la diversa composizione dei due oggetti. Nella for chetta, tutta di metallo, le cariche trasferite per strofinio si muovono rapidamente, attraversano la tua mano e il tuo corpo e si disperdono nel terreno. Nel cacciavite, che è di metallo ma ha un’impugnatura di plastica, gli elettroni tra sferiti per strofinio restano localizzati nella punta, perché la plastica li blocca. Il cacciavite, quindi, resta elettrizzato e può attrarre la pallina. L’effetto scompare se tocchi la punta del cacciavite con un dito, perché le cariche attra versano il tuo corpo e si scaricano nel terreno.
I metalli, ma anche sostanze liquide come soluzioni di aci di, basi o sali, si comportano da conduttori elettriche.





I conduttori sono sostanze in cui gli elettroni più esterni sono liberi di spostarsi da un atomo all’altro.
Nei conduttori liquidi o gassosi i portatori di carica sono ioni, cioè atomi che non sono più neutri perché hanno acquistato o ceduto elettroni. La plastica, ma anche altre sostanze come l’ambra, il legno, la seta, i grassi e molti oli minerali, si comportano da isolanti perché impediscono il passaggio di cariche elettriche.
Gli isolanti sono sostanze in cui gli elettroni più esterni non possono allontanarsi dall’atomo di cui fanno parte.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. Un atomo è elettricamente neutro se il suo nucleo contiene solo neutroni.
2. Se un corpo cede elettroni risulta carico positivamente.

Elettrizzazione per contatto

3. Un corpo si elettrizza per induzione se viene a contatto con un corpo elettricamente carico.
4. Due corpi elettrizzati con materiali diversi si attraggono.
VERSO LE COMPETENZE
Osserva gli oggetti e specifica se sono conduttori o isolanti elettrici.



la corrente elettrica lezione 2
LAB STEM
UNA PILA CON L’ACETO
Tutti conosciamo le pile: le usiamo negli orologi, nel telecomando della TV, nel mouse wireless… In questo esperimento realizziamo delle pile “fai da te”.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• aceto
• 8 bicchierini da caffè di plastica

• 4 chiodi di rame e 4 chiodi di zinco (si acquistano dal ferramenta)
• filo di rame
• cartone
• lampadina a LED
• forbici

• pinza isolante







PROCEDIMENTO
1. Ritaglia dal cartone dei quadrati, che saranno i supporti da appoggiare sui bicchierini. Infila in ogni quadrato un chiodo di rame o di zinco.
2. Riempi i bicchierini con l’aceto, copri ciascuno con un quadrato di cartone e posiziona i bicchierini in sequenza, alternandone uno coperto dal supporto con il chiodo di rame e uno coperto dal supporto con il chiodo di zinco.
3. Collega con il filo di rame il chiodo di rame del primo bicchiere con quello di zinco del secondo, e così via. Collega un pezzo del filo di rame al chiodo di rame del primo bicchiere e un altro al chiodo di zinco dell’ultimo bicchiere.
4. Collega un’estremità dei due fili liberi al polo positivo del led, quindi, utilizzando la pinza isolante, appoggia l’estremità dell’altro filo libero al polo negativo.
■ OSSERVA E RISPONDI
1. Come si comporta il led quando lo colleghi ai fili?
2. L’aceto è una sostanza acida: che cosa potresti usare al suo posto?
3. Sai se esistono strumenti che ti permettono di valutare l’intensità di corrente che circola nel sistema?
4. Scrivi la relazione dell’esperimento.
1

La differenza di potenziale
Le cariche elettriche possono rimanere ferme sulla superficie di un corpo, oppure possono muoversi al suo interno e dare origine a una corrente elettrica
La corrente elettrica è un flusso di cariche elettriche, dello stesso segno, che si muovono nello stesso verso all’interno di un conduttore.
A seconda della struttura delle sostanze che formano i corpi conduttori, le correnti elettriche possono essere costituite da elettroni (come avviene nei metalli) o da ioni (come accade nei liquidi e nei gas).
La
Per capire come si origina una corrente elettrica facciamo un semplice paragone. Se colleghiamo tra loro due recipienti contenenti diversi livelli di acqua, secondo il principio dei vasi comunicanti si genera un flusso d’acqua dal recipiente con livello maggiore a quello con livello minore. Questo movimento termina quando l’acqua raggiunge lo stesso livello nei due recipienti 1 a . Allo stesso modo, perché si generi un flusso di elettroni in un corpo conduttore deve esistere un “dislivello” di cariche elettriche agli estremi del conduttore stesso, cioè una zona con un eccesso di cariche positive, il polo positivo, e una con un eccesso di cariche negative, il polo negativo 1 b . Nel linguaggio scientifico si dice che i due poli hanno un potenziale elettrico diverso. Il flusso continua finché il sistema diventa elettricamente neutro.
La differenza di potenziale elettrico, o tensione (V), si stabilisce tra le due estremità di un conduttore che si trovano ad avere un eccesso di cariche positive e negative.
L’unità di misura della differenza di potenziale è il volt (V), dal nome del fisico italiano Alessandro Volta (1745-1827). Lo strumento che misura la differenza di potenziale elettrico è il voltmetro. Nei metalli le cariche elettriche in movimento sono elettroni, che si muovono spontaneamente dal polo negativo al polo positivo. Quanto maggiore è la differenza di potenziale, tanto più grande è la forza che spinge gli elettroni all’interno del conduttore, creando una corrente di maggiore intensità.
L’intensità di corrente elettrica (i ) è la quantità di carica che attraversa il conduttore in un secondo.
L’unità di misura dell’intensità di corrente è l’ampere (A), in onore del fisico francese André-Marie Ampère (1775-1836). Una corrente ha intensità di 1 ampere (1 A) quando in un secondo passa, attraverso una sezione del conduttore, una quantità di carica uguale a 1 coulomb (1 C). Lo strumento che misura l’intensità di corrente elettrica è l’amperometro
2 I generatori
di corrente elettrica
1 Come si genera una corrente elettrica.












flusso di elettroni

conduttore metallico

Affinché la corrente elettrica continui a fluire all’interno di un conduttore, occorre mantenere costante la differenza di potenziale tra il polo positivo e il polo negativo. I dispositivi in grado di svolgere questa funzione, quando i loro estremi sono collegati con un filo conduttore, sono i generatori di corrente elettrica.
Un generatore di corrente elettrica è la pila, o batteria, inventata all’inizio dell’Ottocento da Alessandro Volta. Il polo negativo della pila è detto anodo, il polo positivo è detto catodo. Le pile di uso comune erogano tensioni di 1,5 V, 4,5 V o 9 V, valori decisamente bassi rispetto ai 220 V presenti nella rete elettrica di un’abitazione.



SKILL BOOK
UN CIELO STELLATO
LAB TINKERING

Il circuito elettrico
3 I circuiti elettrici
Il passaggio di corrente può avvenire solo all’interno di un circuito elettrico, un percorso chiuso che presenta al suo interno un generatore di differenza di potenziale. Il circuito elettrico più semplice è costituito da quattro elementi:
• un generatore di corrente, cioè una pila;
• un filo conduttore che unisce i due poli del generatore a differente potenziale;
• un utilizzatore, per esempio una lampadina che trasforma l’energia elettrica in energia luminosa;
• un interruttore che serve ad aprire e chiudere il circuito.
Un circuito elettrico può essere aperto o chiuso.
Quando l’interruttore è aperto, nel circuito non passa corrente e la lampadina non si accende: il circuito è aperto.
Quando l’interruttore è chiuso, nel circuito passa corrente e la lampadina si accende: il circuito è chiuso.
4 La resistenza elettrica e le leggi di Ohm
2 La prima legge di Ohm.
brilla di più
rame













ferro
brilla di più






























Il filo di rame del primo circuito offre una minore resistenza rispetto al filo di ferro del secondo circuito e la lampadina brilla di più.
Nei materiali isolanti, come la gomma e la plastica, gli elettroni si muovono con molta difficoltà, mentre nei materiali conduttori, come i metalli, il loro movimento è molto rapido. Tuttavia, anche in un buon conduttore gli atomi costituiscono sempre un ostacolo al passaggio di elettroni e quindi fanno diminuire la corrente elettrica circolante.
La resistenza elettrica (R) è la tendenza di un corpo a opporsi al passaggio di corrente elettrica.
rame rame
















Se il filo conduttore è lo stesso nei due circuiti, ma in uno dei due aumenta la differenza di potenziale, allora aumenta anche l’intensità di corrente.
L’unità di misura della resistenza è l’ohm (Ω), dal nome del fisico tedesco Georg Simon Ohm (1789-1854). La resistenza di 1 ohm equivale a quella incontrata dalla corrente di 1 ampere quando attraversa un conduttore ai cui estremi è applicata una tensione di 1 volt. Ohm ha formulato anche le due leggi che esprimono la relazione che intercorre fra le tre grandezze elettriche fondamentali: l’intensità di corrente i, la differenza di potenziale V e la resistenza R. La prima legge di Ohm afferma che, in un filo conduttore, l’intensità di corrente i è direttamente proporzionale alla differenza di potenziale V e inversamente proporzionale alla resistenza R 2 :
V resistenza R
Le formule inverse sono: R = i V V = i ⋅ R
La seconda legge di Ohm afferma che la resistenza R di un filo conduttore è direttamente proporzionale alla lunghezza l del filo e inversamente proporzionale alla sua sezione S, e dipende anche dal materiale di cui è fatto 3 :
resistenza = ρ
lunghezza del conduttore R = ρ
l sezione del conduttore S
Nella formula, ρ (lettera dell’alfabeto greco che si legge “ro”) è una costante detta resistività e dipende dal tipo di materiale di cui è fatto il conduttore.

3
PILE A SECCO
La seconda legge di Ohm.





















A parità di differenza di potenziale, l’intensità di corrente è maggiore nel circuito con il filo più corto perché la resistenza aumenta quando aumenta la lunghezza del filo.
Ho sentito dire che i fulmini sono la messa a terra dei temporali: cosa vuol dire?
La messa a terra è un insieme di dispositivi che scaricano sul terreno -la Terra ha potenziale nullo- gli eccessi di potenziale di tutti gli elementi metallici a contatto con un dispositivo elettrico. Si evitano così rischi di folgorazione e danni agli elettrodomestici. I fulmini sono la manifestazione visibile della messa a terra dell’enorme differenza di potenziale che si crea tra la parte alta e la parte più bassa delle nubi temporalesche.
VERSO LE COMPETENZE











Anche se circola in un buon conduttore, la corrente elettrica provoca sempre un riscaldamento del corpo. Questo fenomeno, detto effetto Joule, costituisce un problema perché, per esempio, può danneggiare il motore di un elettrodomestico; ma può diventare anche un vantaggio se sfruttato negli apparecchi progettati per produrre calore come phon, tostapane, griglie elettriche.











A parità di differenza di potenziale, l’intensità di corrente è maggiore nel circuito con il filo con sezione maggiore perché la resistenza diminuisce.

1. In un circuito elettrico alimentato da una tensione di 220 V sono inseriti degli apparecchi elettrici con una resistenza complessiva di 20 Ω. Qual è l’intensità della corrente che circola?
2. Un filo conduttore di rame (resistività 0,017 Ω ⋅ mm2/m) lungo 12 m e di sezione 2 mm2 costituisce un circuito. Qual è il valore della resistenza del filo?
CHE
brilla di più
brilla di più

UNA CASA ECOSOSTENIBILE EDUCAZIONE CIVICA
Esplora l’oggetto interattivo e scrivi le risposte sul quaderno.

Chi consuma di più?
1. Tra lo stereo e la macchinetta del caffè, quale ha consumi energetici maggiori in un’ora di utilizzo?
2. Quale dispositivo elettrico consuma la stessa quantità di energia sia in modalità stand-by sia quando è in funzione?
3. Metti a confronto il consumo in modalità stand-by di un televisore, di una stampante e di una consolle di videogiochi. Quale apparecchio consuma di più? Quale consuma di meno?
1 Tecnologie per migliorare il Pianeta
Per affrontare concretamente problemi come inquinamento, effetto serra e riscaldamento globale è necessario scegliere delle soluzioni efficaci per limitare i consumi di energia ed evitare gli sprechi: in questo ci aiuta l’innovazione tecnologica, che mette a nostra disposizione sistemi energetici sempre più efficienti. Dal 2010 l’Unione Europea ha stabilito che gli elettrodomestici in vendita in tutti i paesi membri debbano avere un’etichetta che indichi in quale classe di consumo energetico sono inseriti.
La classe di consumo energetico misura quanta energia consuma un elettrodomestico quando è in funzione.
1 Ogni elettrodomestico
è contrassegnato da una classe di consumo energetico.

L’etichetta energetica fa parte delle misure adottate per una maggiore tutela dell’ambiente e per la riduzione degli sprechi energetici e il raggiungimento degli obiettivi n. 7 e n. 11 dell’Agenda 2030. Inizialmente l’etichetta energetica era obbligatoria solo per i grandi elettrodomestici come frigoriferi, lavastoviglie e lavatrici, ma dal 2010 è diventata obbligatoria per tutti gli apparecchi che “consumano effettivamente energia nella fase d’uso”, compresi quelli di piccole dimensioni 1 .
Lo scopo dell’etichetta energetica è dare informazioni sulla quantità di energia e di altre risorse, per esempio l’acqua, necessarie per far funzionare quel particolare elettrodomestico, in modo da fornire più informazioni possibili e permettere di fare scelte consapevoli.
Un consumatore attento non può che preferire un elettrodomestico che ha un basso consumo energetico ed è poco inquinante. I dati confermano questa tendenza: da quando è stata introdotta l’etichetta energetica sono aumentate le vendite di elettrodo-
La ricerca di Hasler
mestici con consumi ridotti. Le preferenze di acquisto espresse sul mercato innescano un circolo virtuoso, perché i produttori sono spinti a migliorare sempre di più la tecnologia dei loro prodotti, per ridurre il consumo di energia e accontentare i clienti.
2 Come è fatta l’etichetta energetica
L’etichetta energetica deve essere collocata in una posizione ben visibile, davanti o sopra all’apparecchio esposto per la vendita. Il consumo energetico riportato sull’etichetta è rappresentato da una scala a sette livelli indicati con delle lettere: si va dalla classe energetica A fino alla G
La classe A è la più efficiente, ossia quella con i consumi più bassi; la classe G è, invece, quella con i consumi più alti. Tutte le etichette, anche se di prodotti molto diversi tra loro come un televisore e un frigorifero, hanno gli stessi elementi grafici, in modo da poter essere facilmente riconosciute e confrontate.
Le informazioni che devono essere sempre presenti sono: il nome del produttore e il modello del prodotto, la classe energetica, il consumo energetico scritto in numero e le caratteristiche del prodotto illustrate con simboli grafici comprensibili a tutti 2 .
Consumo annuale di energia (kWh)
Somma dei volumi per i prodotti congelati (litri).
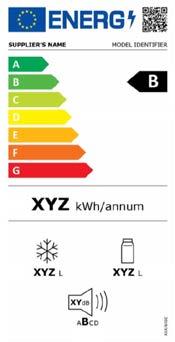
3 L’evoluzione della lampadina
2 Etichetta energetica di un frigorifero.
QR Code da inquadrare per accedere alla banca dati europea dei prodotti per l’etichettatura energetica per conoscere ogni aspetto dell’elettrodomestico.
Classe di efficienza energetica da A a G.
Somma dei volumi degli scomparti di raffrescamento e degli scomparti per prodotti non congelati (litri).
Emissioni di rumore aereo (dB) e classe di emissione del rumore (A).
L’etichetta energetica è applicata anche sulle confezioni delle lampadine usate per l’illuminazione domestica.
Molto è cambiato in termini di consumi di energia elettrica da quando Thomas Edison nel 1879 inventò la lampadina. Oggi questo tipo di lampadina, definito lampadina a incandescenza, rientra nella classe energetica G, perché solo il 5% dell’energia elettrica che riceve si trasforma in luce: tutto il resto è disperso sotto forma di calore.
A causa di questo enorme spreco di energia, le lampadine a incandescenza sono state definitivamente abbandonate dal 2009 per decisione dell’Unione Europea, per essere sostituite dalle lampadine a fluorescenza, che permettono di trasformare fino al 25% di energia elettrica in luce.
3 Lampadine a incandescenza, a fluorescenza e a LED.
La vera rivoluzione energetica è stata rappresentata dai LED (Light Emitting Diode): si tratta di lampadine che si accendono immediatamente, producono pochissimo calore, sono resistenti nel tempo e hanno un’efficienza di circa l’80%, molto superiore a qualsiasi altra lampadina usata in precedenza 3 . Per molto tempo i LED sono stati utilizzati per illuminare gli schermi dei televisori e dei computer (che, infatti, sono molto luminosi) e nelle spie che indicano l’accensione di un elettrodomestico. Oggi i LED sono ampiamente impiegati nell’illuminazione stradale e domestica.
LAMPADINA A FLUORESCENZA
A INCANDESCENZA

si trasforma in luce.
Ingresso energia elettrica.
Il vetro del bulbo non è trasparente, ma bianco: il suo interno è ricoperto da una polvere di materiale fluorescente.
Il bulbo può essere sferico, cilindrico o a spirale.
Ingresso energia elettrica.
LAMPADINA A LED

Il passaggio di corrente elettrica eccita gli elettroni che emettono luce.
Semiconduttore di gallio.
Nel bulbo sono presenti vapori di mercurio che, scaldandosi al passaggio della corrente elettrica, emettono radiazioni ultraviolette. Le radiazioni ultraviolette, invisibili ai nostri occhi, colpiscono il rivestimento fluorescente che, a sua volta, emette le radiazioni che formano la luce visibile.

Ingresso energia elettrica.
Le luci LED sono utilizzate anche per le no accese qua e là nelle nostre case. Sono presenti in quasi tutti gli elettrodomestici e dispositivi elettronici che non hanno un vero interruttore acceso/spento: segnalano che il dispositivo è collegato alla corrente elettrica, ma non è in funzione.
Un dispositivo collegato alla rete elettrica con una spina continua a consumare energia anche quando non è in funzione, per mantenere attivi tutti i circuiti elettrici ed essere pronto all’accensione.
È giusto consumare energia quando non serve? Utilizzare la modalità stand-by degli elettrodomestici conviene? Di notte, mentre dormiamo, non ci servono né televisore, né stereo, né computer e quindi non ha senso metterli in modalità stand-by: è sufficiente spegnere correttamente i dispositivi elettrici per ottenere un notevole risparmio di energia.
LAMPADINA
4
Il risparmio energetico
In Italia circa il 50% dell’energia elettrica è ancora prodotta nelle centrali termoelettriche che bruciano combustibili fossili, cioè carbone, petrolio e soprattutto gas metano, per generare energia elettrica. Per salvaguardare il futuro energetico del pianeta oc corre che anche noi cittadine e cittadini ci impegniamo in piccole azioni quotidiane per risparmiare energia, specialmente nelle nostre case. Il risparmio energetico passivo comprende tutte quelle azioni che possiamo intraprendere per ridurre i consumi di energia elettrica: per esempio, possiamo decidere di sostituire tutte le lampadine della nostra casa con modelli a LED, scegliere elettrodomestici a basso consumo e usare la lavatrice solo a pieno carico. Per risparmio energetico attivo si intendono, invece, tutte le azioni volte alla produzione di energia elettrica o alla generazione di riscaldamento attraverso fonti di energia rinnovabili, per esempio installando pannel li fotovoltaici sul tetto della propria abitazione, per produrre autonoma mente elettricità e acqua calda.
VERSO LE COMPETENZE
Leggi con attenzione l’elenco dei consigli per migliorare il risparmio energetico nelle nostre case.
1. Spegnere i dispositivi invece di lasciarli in stand-by.
2. Acquistare elettrodomestici a basso consumo.

3. Utilizzare apparecchi per smart home, per accendere gli elettrodomestici e spegnerli negli orari in cui non se ne ha bisogno.
4. Utilizzare lampadine a LED.
5. Scollegare gli elettrodomestici dalle prese di corrente.
6. Sfruttare il più possibile la luce solare.
7. Utilizzare gli elettrodomestici la sera.
8. Usare il microonde e non il forno per scongelare e riscaldare i cibi.
9. Spegnere il condizionatore una volta che la casa ha raggiunto una temperatura adeguata.
10. Tenere controllato in bolletta il dettaglio dei consumi di energia elettrica nelle fasce orarie del giorno.
11. Migliorare il certificato energetico della casa, installando una pompa di calore e dei pannelli fotovoltaici, o aggiungendo un cappotto termico all’edificio.
12. Utilizzare dispositivi che misurano in maniera esatta corrente e tensione di tutti gli elettrodomestici, circuiti elettrici e apparecchiature che si hanno in casa.
1. Individua quali comportamenti rientrano nel risparmio energetico passivo e quali nel risparmio energetico attivo.
2. Confrontati con i tuoi genitori per stabilire con loro quali comportamenti adottare per ridurre il consumo di energia elettrica.
EDUCAZIONE CIVICA
Le miniere urbane
Oggi più che mai è necessario creare un nuovo modello di sviluppo per migliorare il nostro benessere e quello dell’ambiente, e dare un futuro al Pianeta.
Anche tu puoi diventare parte attiva del cambiamento globale delle abitudini per ridurre lo spreco di energia.


Puoi cominciare proprio da casa tua, usando un po’ di attenzione, di programmazione e di buona volontà, ma senza rinunciare alle tue comodità!
1
Batterie primarie e secondarie
Sono moltissimi gli oggetti che usiamo quotidianamente e che hanno bisogno di energia per funzionare. Pensiamo alla sveglia, al telecomando o al mouse wireless: tutti questi oggetti funzionano con le pile. La pila contiene dei metalli che, reagendo tra loro, trasformano l’energia chimica in energia elettrica. Con il tempo la reazione tra i metalli si esaurisce, la pila si scarica e deve essere sostituita. Le pile di questo tipo sono chiamate batterie primarie 1 a .
Per affrontare il problema e creare abitudini diverse rispetto al modello di consumo “usa e getta”, sono state create le batterie ricaricabili, chiamate anche batterie secondarie 1 b . Si tratta di accumulatori di energia: l’energia è fornita dall’esterno e viene immagazzinata nelle batterie ricaricabili, che sono di nuovo pronte per essere utilizzate negli apparecchi elettrici. Anche le batterie del cellulare e del computer sono degli accumulatori di energia: infatti puoi usarli per molto tempo senza collegarli alla corrente elettrica.

Sono molti i vantaggi delle batterie ricaricabili. Prima di tutto sono molto più ecologiche, perché i metalli inquinanti come cadmio e mercurio, presenti nelle batterie primarie, sono stati sostituiti da nichel e leghe metalliche meno tossiche; inoltre, possono essere riutilizzate per circa 200 cicli di carica-scarica.

1 Tipi di batteria. a b
2
Smaltimento e riciclo delle pile
I metalli e le soluzioni di acidi corrosivi contenuti in qualsiasi tipo di batteria e di accumulatore sono molto inquinanti. Per questo motivo tutti i tipi di pile sono considerati rifiuti speciali tra i più velenosi in assoluto, per l’ambiente e per noi.
Una pila sopravvive per oltre 100 anni ed è sufficiente un grammo del mercurio che disperde in discarica per inquinare 1000 litri di acqua. Se i metalli delle batterie non sono raccolti e smaltiti correttamente possono arrivare a contaminare gravemente le falde sotterranee da cui attingiamo l’acqua potabile.
Il primo passo da compiere è raccogliere separatamente le pile esauste: le pile non vanno buttate nei rifiuti urbani, ma nei punti di raccolta presenti nei centri abitati, nei centri commerciali o nelle isole ecologiche.
Una volta portati negli impianti per il riciclo, pile e accumulatori sono sud divisi per dimensione e per componenti chimiche, in modo da trattarli con i processi adeguati. Le pile, quindi, sono sottoposte a trattamenti meccanici per separare la black mass, o “pasta di pile”, dall’involucro esterno di plastica e metallo che, successivamente, subisce un trattamento chimico per estrarre carbonio, zinco e manganese. Questi metalli, diventati materie prime seconde, possono essere riutilizzati, per esempio per ottenere lamine di zinco puro e leghe metalliche da rivendere alle industrie. Un impianto di riciclaggio delle pile di questo tipo consente di reimmettere sul mercato, ogni anno, circa 8000 tonnellate di materie prime seconde.
3
Il riciclo dei RAEE

La possibilità di estrarre dai rifiuti materie prime seconde, in particolare metalli pesanti e metalli rari, prende il nome di urban mining, cioè miniere urbane 2 . Le discariche delle grandi città sono vere e proprie “miniere a cielo aperto”: computer, smartphone e oggetti elettronici di ogni tipo contengono metalli rari e preziosi che possono essere separati, raccolti e reimmessi sul mercato. L’Unione Europea ha finanziato il progetto QUMEC (Quantifying urban mines in Europe and related implications for the metal-energy-climate change nexus) per indagare sulle possibilità di recuperare e riciclare i metalli rari presenti nei RAEE (Rifiuti di Apparecchiature Elettriche ed Elettroniche), che costituiscono le “miniere urbane” distribuite nel territorio europeo. L’iniziativa ha lo scopo di valutare la quantità di risorse minerarie disponibili, il livello degli interventi necessari per recuperarle e le strategie per utilizzare queste materie prime seconde in modo efficiente. La raccolta differenziata di RAEE riguarda solo una parte dei rifiuti elettronici che vengono scartati perché dotati di tecnologie superate o perché non più funzionanti. Per evitare le spese di smaltimento, recupero e riciclo di metalli rari la maggior parte dei rifiuti hi-tech dei paesi sviluppati finisce nelle discariche di paesi come Cina, Niger e Ghana. È qui che migliaia di persone, tra cui bambini, lavorano ogni giorno a contatto con sostanze altamente velenose e inquinanti per estrarre metalli che poi alimentano un mercato illegale che interessa l’intero pianeta.

2 Oggetti elettronici di scarto da cui estrarre materie prime seconde.
i fenomeni magnetici lezione 4
LAB TINKERING
MAGIE MAGNETICHE
L’uso delle calamite può essere divertente oltre che istruttivo. Hai mai pensato di usare le calamite per giocare? Prova a realizzare questi semplici esperimenti: potrai osservare gli effetti della forza magnetica divertendoti!
■ REALIZZA L’ESPERIMENTO
MATERIALI
ESPERIMENTO 1
• un fazzoletto di carta
• una moneta
• una calamita
• nastro adesivo




ESPERIMENTO 2
• una bottiglia di plastica trasparente con tappo
• una calamita
• un pennarello
• una biglia di ferro



1 Calamite impiegate nei giocattoli.

PROCEDIMENTO
ESPERIMENTO 1
1. Taglia un pezzo di nastro adesivo e fissa la moneta su un lato del fazzoletto.
2. Posa il fazzoletto sul tavolo in modo che la moneta non si veda.
3. Nascondi la calamita nella manica del maglione e avvicina il braccio al fazzoletto.
■ OSSERVA E RISPONDI
ESPERIMENTO 1
1. Per far sollevare “magicamente” il fazzoletto devi portare il braccio abbastanza vicino. Perché?
2. Che cosa succede se nascondi una calamita più potente?
ESPERIMENTO 2
1. Disegna sulla bottiglia un percorso a labirinto che termina con il tappo.
2. Inserisci la biglia di ferro e sfida i tuoi amici a farla uscire dalla bottiglia percorrendo il labirinto.
ESPERIMENTO 2
1. Per seguire correttamente il percorso devi spostare la calamita lentamente. Perché?
2. In questo gioco è più conveniente usare una calamita a barra o una a ferro di cavallo? Perché?
1
Magneti naturali e magneti artificiali
La calamita che hai usato per gli esperimenti è un magnete
Un magnete è un corpo in grado di attirare oggetti contenenti ferro. Questa proprietà si chiama magnetismo
In natura esistono sostanze che possiedono questa proprietà, per esempio la magnetite, un minerale molto usato per la fabbricazione di piccole calamite 1 . Alcune sostanze, chiamate ferromagnetiche, come il ferro, il nichel, il cobalto e tutte le loro leghe, possono acquistare proprietà magnetiche se vengono magnetizzate.
La magnetizzazione, come l’elettrizzazione, può avvenire per strofinio, per contatto e per induzione

2 Tre modi di magnetizzare.



STROFINIO




















































prima dopo






















CONTATTO INDUZIONE


















La lama delle forbici, strofinata su una calamita, acquisisce la capacità di attirare piccoli oggetti di ferro.










prima dopo prima dopo

prima dopo







prima dopo prima dopo prima dopo prima dopo dopo
Un oggetto di ferro, messo a contatto con una calamita, acquista proprietà magnetiche.
Dopo la magnetizzazione, queste sostanze diventano dei magneti artificiali I magneti artificiali possono essere:
• magneti permanenti, se mantengono nel tempo la proprietà magnetica acquistata, come accade per l’acciaio (una lega di ferro e carbonio);
• magneti temporanei, se mantengono solo per breve tempo la proprietà magnetica e solo in vicinanza della fonte magnetizzante; è quello che avviene per il ferro dolce (acciaio a bassa percentuale di carbonio).
Le proprietà magnetiche della materia sono alla base di molti dispositivi di memorizzazione delle informazioni, come gli hard disk dei computer, le bande magnetiche delle carte di credito o della carta di identità elettronica. Le bande magnetiche sono formate da uno strato di PVC in cui sono immersi granelli di sostanze magnetizzate che recano le informazioni necessarie.
Perché i magneti si chiamano così?





prima dopo









Un oggetto di ferro, per esempio un chiodo, può magnetizzarsi anche solo avvicinandolo a una calamita.
L’origine della parola “magnete” ci riporta indietro nel tempo, nell’antica Grecia, più di 2000 anni fa. In una regione chiamata Magnesia (che oggi si trova in Turchia, nell’Asia Minore), gli abitanti scoprirono delle pietre molto particolari che attiravano il ferro. I Greci diedero a queste pietre dalle proprietà straordinarie il nome di “magnétes líthos”, che significa proprio “pietra di Magnesia”, che col tempo divenne “magnétes”, parola che è arrivato a noi come “magnete”. Esiste anche una leggenda che racconta di un pastore di nome Magnes che, pascolando le sue pecore sul monte Ida, vicino alla regione di Magnesia, sentì la punta in ferro del suo bastone e i chiodi delle sue scarpe attaccarsi a una roccia che da lui prese il nome.

2 I poli magnetici
In una calamita, che sia a forma di barretta o a ferro di cavallo, la forza di attrazione esercitata sugli oggetti ferrosi è più intensa alle due estremità e minore nella parte centrale. Le due estremità sono i poli del magnete, chiamati polo nord e polo sud 3
Se spezziamo una calamita in due parti, ciascuna di esse presenta ancora due poli distinti. Continuando a spezzare le due parti otteniamo tante calamite più piccole, ognuna con un polo nord e un polo sud: i due poli di una calamita non si possono mai separare 4
Tra magneti si esercita una forza che può essere di attrazione o di repulsione: i poli opposti (N e S) di due magneti si attraggono, mentre i poli uguali (NN ed SS) si respingono 5 .
Polo nord e polo sud.











3 Il campo magnetico


Un magnete attira i materiali magnetizzabili che si trovano a una certa distanza, ma il raggio di azione della forza magnetica è limitato
Per osservare il comportamento di questa forza eseguiamo un semplice esperimento. Appoggiamo un cartoncino sopra una calamita e facciamo cadere “a pioggia”, lenta-


6 a. Spettro magnetico generato da un magnete lineare. b. Spettro magnetico generato da un magnete a ferro di cavallo.
3 La calamita attira oggetti ferrosi.
mente, della limatura di ferro: la polvere si disporrà formando delle linee che compongono due diversi disegni, chiamati spettri magnetici 6
Una parte della limatura di ferro si addensa intorno ai poli, una parte si orienta secondo delle linee precise e un’altra si dispone a caso, come se non avvertisse l’influsso del magnete. Si può concludere che la disposizione della limatura di ferro dipende dall’azione della forza magnetica, che è massima in prossimità dei due poli e minima al centro.
La regione di spazio in cui un magnete esercita la propria forza è chiamata campo magnetico.
Le linee curve lungo cui si dispone la limatura di ferro sono dette linee di forza del campo magnetico. Dalla loro osservazione possiamo dedurre che il campo magnetico non è uniforme; esse inoltre permettono una descrizione delle caratteristiche del campo magnetico stesso.
La Terra si comporta come un’enorme calamita, in grado di generare un gigantesco campo magnetico nello spazio che la circonda. Come tutti i magneti ha un polo nord e un polo sud, che però non coincidono con i poli geografici.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. Un magnete permanente perde progressivamente la sua magnetizzazione.
2. I poli di una calamita non si possono separare.
3. Il campo magnetico è lo spazio in cui un magnete esercita la propria forza.
4. In un magnete rettilineo le linee di forza escono dalla parte centrale.
VERSO LE COMPETENZE STEM
Rileviamo il magnetismo terrestre.
Materiali
• una bacinella • un po’ d’acqua
• un ago da cucito • un magnete

• nastro adesivo • una fettina di tappo di sughero
Esecuzione





1. Magnetizza l’ago strofinandolo più volte sulla superficie del magnete (almeno una cinquantina).
2. Con il nastro adesivo fissa l’ago alla fettina di sughero, in modo che sporga da una parte e dall’altra dei bordi.
3. Versa un po’ d’acqua nella bacinella e posa sulla superficie la fettina di sughero con l’ago.
Osserva e rispondi.

1. Che cosa succede quando appoggi sull’acqua il sughero con l’ago magnetizzato?
2. Qual è la forza che fa muovere l’ago e lo dispone in una certa posizione?
3. Conosci uno strumento che si comporta come l’ago che hai magnetizzato? Per quale scopo viene utilizzato?
La calamita terrestre
L’ Elettromagnetismo lezione 5
LAB TINKERING
UN TRENINO INESAURIBILE
Batterie e magneti possono dare vita a giochi sorprendenti! Prova a realizzare un trenino dal moto inesauribile.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• un filo di rame lungo 3 m
• una pila stilo
• 2 calamite tonde con diametro uguale a quello della pila
• un bastoncino con diametro poco superiore a quello della pila


PROCEDIMENTO
COME SI COMPORTANO

1. Avvolgi il filo a spirale intorno al bastoncino in modo da formare una lunga molla, cioè un solenoide.
2. Sfila il bastoncino.
3. Applica le calamite alle due estremità della pila.
4. Inserisci la pila nel solenoide.
■ OSSERVA E RISPONDI
1. Perché il sistema pila-calamite si muove?
2. Quali forze agiscono sul sistema?
3. Unisci le due estremità della molla di rame. Che cosa osservi?
4. Che cosa succede se inserisci due pile con le rispettive calamite?
La corrente elettrica genera un campo magnetico
Il 1820 è una data importante per gli studi sui fenomeni elettrici: il fisico danese Hans Christian Oersted (1777-1851) pubblica i risultati di un esperimento in cui dimostra l’esistenza di una relazione tra i fenomeni elettrici e quelli magnetici. Nasce così l’elettromagnetismo
Puoi realizzare anche tu lo stesso esperimento di Oersted 1 . Procurati del filo elettrico, una pila e una bussola e costruisci un piccolo circuito elettrico. Collega il filo elettrico a un polo della pila, in modo che il circuito rimanga aperto: se avvicini la bussola
osservi che l’ago si comporta normalmente, orientandosi secondo il campo magnetico terrestre.
Collega i poli della pila con il filo elettrico in modo da chiudere il circuito e permettere il passaggio della corrente; ora avvicina la bussola. Osservi che l’ago devia la sua direzione e si dispone perpendicolarmente rispetto al filo.
Oersted arriva alla conclusione che la corrente che passa nel filo elettrico genera nello spazio circostante un campo magnetico che si sovrappone al campo magnetico terrestre.
Correnti elettriche, cioè cariche in movimento, producono un campo magnetico.
2 L’elettrocalamita
Se la corrente elettrica è in grado di generare un campo magnetico, è possibile usare la corrente anche per magnetizzare un oggetto di ferro? Per rispondere a questa domanda, puoi eseguire un altro esperiemento.
Procurati del filo elettrico avvolto da materiale isolante, un chiodo di ferro, una pila e alcuni spilli 2
1 L’ago della bussola ruota se nel circuito passa la corrente.
ago della bussola




assenza di corrente





passaggio di corrente

Avvolgi attorno al chiodo il filo elettrico e collega le estremità ai poli della pila, in modo da chiudere il circuito. Avvicina al chiodo gli spilli. Il chiodo attira gli oggetti in ferro perché il passaggio della corrente elettrica lo ha magnetizzato. Se interrompi la corrente l’effetto cessa, perché il chiodo si smagnetizza.
Un filo conduttore avvolto a spirale è detto solenoide 3 .
Un solenoide avvolto attorno a una barra di ferro costituisce un’elettrocalamita.
L’intensità del campo magnetico che si genera è direttamente proporzionale al numero di spire e inversamente proporzionale alla lunghezza del solenoide.
L’elettrocalamita trova numerosi impieghi, dagli oggetti di uso quotidiano come il campanello elettrico, le serrature elettriche o le testine degli hard disk, alle apparecchiature diagnostiche usate negli ospedali.
2 Se avvolgiamo un chiodo con un filo elettrico percorso da corrente otteniamo un’elettrocalamita.

3 Esempio di solenoide.
Impieghi tecnologicamente più avanzati dell’elettrocalamita si devono alla scoperta dei superconduttori, materiali nei quali, una volta raffreddati fino a temperature molto basse, si annulla la resistenza e, di conseguenza, anche l’effetto Joule, cioè il riscaldamento dovuto al passaggio di corrente. Un cavo realizzato con un materiale superconduttore potrebbe trasportare corrente elettrica anche a grandi distanze senza dispersione di energia. Questi materiali permettono, inoltre, la realizzazione di magneti superconduttori capaci di generare campi magnetici molto intensi, come quelli necessari per il funzionamento dei più avanzati apparecchi per la risonanza magnetica nucleare usati negli ospedali.
3
L’induzione elettromagnetica
Abbiamo visto che il passaggio di corrente elettrica crea un campo magnetico, ma accade anche il fenomeno contrario.
Un magnete in movimento può dare origine a una corrente elettrica.
Il primo a dimostrare questa importantissima proprietà è stato nel 1831 il fisico inglese Michael Faraday (1791-1867).
Nell’esperimento di Faraday, il movimento del magnete genera nel solenoide una corrente, detta corrente indotta, che cambia verso ogni volta che il magnete viene spostato 4 . Questo fenomeno si chiama induzione elettromagnetica
Le correnti indotte sono correnti alternate poiché cambiano continuamente intensità e verso a seconda del movimento del magnete. L’insieme del magnete e del solenoide forma un dispositivo detto alternatore. Esso trasforma l’energia meccanica di rotazione del magnete in energia elettrica nella forma di corrente elettrica.

4 L’esperimento di Faraday.



a. Realizza un solenoide avvolgendo del cavo elettrico attorno a un cilindro in materiale isolante e collegalo a un amperometro. Poiché in questo circuito non è inserito alcun generatore di corrente, in esso non passa corrente e l’indice dell’amperometro segna “zero”.



b. Muovi il magnete in un verso: l’indice dell’amperometro devia, dimostrando che nel circuito passa una corrente. Se fermi il magnete, l’indice torna a zero e rimane in tale posizione finché non si muove nuovamente il magnete.

c. Se sposti il magnete nel verso opposto, la lancetta dell’amperometro si muove in direzione opposta, indicando il passaggio di una corrente di verso contrario a quella precedente.
Nelle centrali idroelettriche gli alternatori sono formati da un enorme magnete che non si muove (lo statore) e da avvolgimenti di conduttore che ruotano (i rotori). Il movimento di un flusso d’acqua fa girare le pale di una turbina che, a sua volta, mantiene in movimento il rotore, permettendo la produzione di corrente alternata nello statore. I motori elettrici che alimentano i mezzi di trasporto (automobili, biciclette, scooter) sfruttano l’azione di un magnete su una bobina percorsa da corrente: l’effetto è quello di una rotazione continua della bobina, che viene sfruttata per azionare le ruote del veicolo. In questo caso l’energia elettrica è trasformata in energia meccanica.
I vantaggi dei motori elettrici nei mezzi di trasporto sono molteplici:
• non emettono anidride carbonica (si dicono “a emissione zero”);
• sono molto silenziosi e non generano vibrazioni;
• non necessitano di sistemi di raffreddamento e di lubrificazione.
Il rifornimento delle auto con motore elettrico può essere effettuato alle colonnine elettriche. Il procedimento è piuttosto semplice: basta collegare la spina dell’auto alla presa della colonnina 5 . Nelle auto più recenti un particolare sistema di ricarica sfrutta sia la corrente alternata sia la corrente continua, in modo da ridurre i tempi di ricarica.
FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).

1. Nell’elettrocalamita il movimento di un magnete induce la corrente elettrica nel solenoide.
2. È possibile generare elettricità sia facendo variare il campo magnetico intorno a un solenoide, sia facendo ruotare un solenoide in un campo magnetico.
3. Un motore elettrico trasforma energia meccanica in energia elettrica.
4. La corrente elettrica genera un campo magnetico.
VERSO LE COMPETENZE
La levitazione magnetica è una tecnologia che utilizza i campi magnetici per mantenere gli oggetti sospesi, in modo che possano scorrere uno sopra l’altro.
La levitazione magnetica trova applicazione nei treni MagLev che viaggiano raggiungendo velocità elevatissime.
Rispondi alle domande.

1. Dove pensi che si debbano collocare i magneti perché si possano generare campi magnetici con polarità opposta?
2. Quale forza è annullata nei treni MagLev?
3. Qual è l’unica forza che contrasta il moto di questo tipo di treni? Ricerca in rete dove sono impiegati i treni MagLev e quali sono le velocità massime che raggiungono.
5 La mobilità elettrica.
CON LA SINTESI
lezione 1 I FENOMENI ELETTRICI
Un corpo in condizioni normali è elettricamente neutro perché gli atomi che lo formano contengono un numero uguale di protoni e di elettroni. I corpi tuttavia possono essere elettrizzati, cioè possedere un diverso numero di cariche elettriche positive e negative. L’elettrizzazione può avvenire per: strofinio, quando un corpo viene strofinato contro un altro corpo; contatto, quando un corpo neutro viene a contatto con un corpo elettrizzato; induzione, quando un corpo neutro viene avvicinato a un corpo elettrizzato.
Con l’elettrizzazione i corpi acquistano elettricità statica, che può essere positiva o negativa. Corpi con elettricità dello stesso tipo si respingono, con elettricità di tipo diverso si attraggono. L’unità di misura della quantità di carica elettrica è il coulomb (C). Sono conduttori le sostanze che permettono lo spostamento degli elettroni più esterni da un atomo all’altro; sono isolanti quelli che ne impediscono l’allontanamento.
lezione 2 LA CORRENTE ELETTRICA
La corrente elettrica è un flusso di cariche elettriche dello stesso segno, che si muovono nello stesso verso all’interno di un conduttore. Il movimento delle cariche elettriche è generato da una differenza di potenziale elettrico, o tensione (V ), tra le due estremità del conduttore tra le quali vi è un dislivello di cariche: nel polo positivo vi è un eccesso di cariche elettriche positive, nel polo negativo un eccesso di cariche negative. La tensione si misura in volt (V). L’intensità di corrente elettrica (i), cioè la quantità di carica che attraversa il conduttore in un secondo, si misura in ampere (A). I generatori di corrente sono dispositivi in grado di mantenere costante la differenza di potenziale. Sono un esempio le pile, che presentano un polo negativo (anodo) e un polo positivo (catodo). Le parti di un circuito elettrico sono: generatore, filo conduttore, utilizzatore, interruttore. La resistenza elettrica (R), cioè la tendenza di un corpo di opporsi al passaggio di corrente elettrica, si misura in ohm (Ω). Per un circuito elettrico valgono le due leggi di Ohm. La prima legge di Ohm afferma che l’intensità di corrente in un filo conduttore è direttamente proporzionale alla differenza di potenziale V e inversamente proporzionale alla resistenza R. La seconda legge di Ohm afferma che la resistenza di un filo conduttore è direttamente proporzionale alla lunghezza del filo e inversamente proporzionale alla sua sezione ma dipenda anche dalla resisistività, cioè dal materiale di cui è fatto.



lezione 3 EDUCAZIONE CIVICA UNA CASA ECOSOSTENIBILE
Tutti gli apparecchi elettrici sono dotati di un’etichetta energetica che informa l’acquirente sul consumo di energia elettrica del prodotto. L’etichetta energetica fa parte delle misure adottate dall’Unione Europea per spingere i consumatori a fare scelte a tutela dell’ambiente e limitare gli sprechi energetici. Sull’etichetta il consumo energetico è rappresentato da una scala a sette livelli contrassegnati da una lettera che va da A a G. Dal 2009 le lampadine a incandescenza in commercio sono state sostituite dalle lampadine a fluorescenza e da quelle a LED, nell’ambito dei comportamenti di risparmio energetico passivo che si possono mettere in atto per ridurre i consumi. Sono invece azioni di risparmio energetico attivo la produzione di energia elettrica o la generazione di riscaldamento da fonti di energia rinnovabili.
lezione 4 I FENOMENI MAGNETICI
Il magnetismo è la proprietà di un corpo di attirare materiali ferrosi. I magneti naturali sono naturalmente dotati di questa proprietà, ma altri materiali si possono magnetizzare per strofinio, contatto o induzione. Sono magneti permanenti se mantengono nel tempo le proprietà magnetiche; magneti temporanei se le perdono in breve tempo. Un magnete possiede un polo nord e un polo sud: poli dello stesso tipo si respingono, poli opposti si attraggono. La polarità si mantiene anche se il magnete viene diviso in più parti. Lo spazio entro il quale un magnete esercita la sua forza attrattiva si chiama campo magnetico. Le linee di forza di un campo magnetico, evidenziate utilizzando della limatura di ferro su un foglio bianco posto in prossimità del magnete, formano lo spettro magnetico e mostrano che l’intensità del campo è massima in prossimità dei poli.
lezione 5 L’ELETTROMAGNETISMO
L’elettromagnetismo è il risultato della relazione tra fenomeni elettrici e magnetici. Il passaggio di corrente elettrica in un conduttore genera un campo magnetico nello spazio circostante. Un filo conduttore avvolto a spirale (solenoide) attorno a una barra di ferro costituisce una elettrocalamita. Al passaggio della corrente il sistema diventa un magnete. Viceversa, un magnete che si muove all’interno di un solenoide genera una corrente, detta corrente indotta. L’induzione elettromagnetica è alla base del funzionamento degli alternatori, apparecchi che trasformano energia meccanica di movimento in corrente alternata.



CON LA MAPPA
Adesso che hai ripassato i contenuti essenziali con la sintesi, prova a completare la mappa con le parole chiave suggerite e a trovare le definizioni corrispondenti. campi magnetici - circuiti elettrici - contatto - corrente elettrica - elettrizzazione - magnete
1. LE CARICHE ELETTRICHE
possono accumularsi sui corpi mediante
si spostano attraverso i materiali
con i quali si realizzano i
che può avvenire per
3. strofinio

4.

5. induzione

che generano










b. Spazio soggetto all’azione di un magnete.
c. Materiale in cui si spostano le cariche elettriche.
a. Corpo capace di attrarre oggetti che contengono ferro.











governati dalle
cioè spazi che risentono dell’azione della forza di un
10. generando una

d. Metodo di elettrizzazione ottenuto avvicinando un corpo carico a uno neutro.
e. Esprimono la relazione tra intensità della corrente elettrica, differenza di potenziale e resistenza.
2. 7.
9.
8.
brilla di più
11. leggi di Ohm
6. conduttori
FISSA I CONTENUTI ESSENZIALI
lezione 1 I FENOMENI ELETTRICI
1 Segna con una crocetta se vero (V) o falso (F).
a. Un corpo possiede carica elettrica negativa se ha un eccesso di elettroni.
b. Un corpo è elettrizzato quando accumula elettricità statica.
c. L’unità di misura della carica elettrica è il coulomb.
d. Cariche di segno opposto si respingono.
2 Scegli la soluzione corretta.
a. I conduttori si lasciano attraversare dalla corrente elettrica perché sono liberi di muoversi:
1 i loro protoni.
2 i loro atomi.
3 i loro neutroni.
4 i loro elettroni.
b. I materiali isolanti:
1 impediscono il passaggio della corrente elettrica.
2 impediscono solo il passaggio delle cariche positive.
3 permettono solo il passaggio delle cariche negative.
4 permettono il passaggio della corrente.
3 Osserva il disegno e inserisci accanto a ogni descrizione il numero corrispondente.
a. Corpo elettricamente neutro
b. Corpo carico positivamente
c. Corpo carico negativamente

lezione 2 LA CORRENTE ELETTRICA
4 Scegli la soluzione corretta.
a. Quale delle seguenti formule esprime correttamente la prima legge di Ohm?
1 i
b. In un circuito elettrico, quale grandezza elettrica viene misurata con il voltmetro?
1 L’intensità di corrente
2 La resistenza del circuito
3 La differenza di potenziale
4 L’energia consumata
5 Sottolinea il termine corretto tra i due proposti.
a. L’intensità di corrente si misura in volt/ampere.
b. Tra gli estremi di un conduttore che presentano un eccesso di cariche opposte si stabilisce una tensione/corrente.
c. In un circuito elettrico la pila è un generatore/utilizzatore.
d. La resistenza elettrica è il prodotto/rapporto tra differenza di potenziale e intensità di corrente.
6 Osserva il disegno e inserisci accanto a ogni termine il numero corrispondente.



+ 1 3 4 2



Generatore Filo conduttore Interruttore Utilizzatore
lezione 3 UNA CASA ECOSOSTENIBILE
7 Segna con una crocetta se vero (V) o falso (F).
a. La classe di consumo energetico misura il consumo di energia di un elettrodomestico in funzione.
b. I piccoli elettrodomestici sono venduti senza etichetta energetica.
c. Le lampadine al LED hanno un’efficienza minore di quelle a incandescenza.
d. Non usare la modalità stand-by del televisore rientra nelle azioni di risparmio passivo.
8 Scegli la soluzione errata.
a. La classe energetica A:
1 è quella a minor consumo energetico.
2 è quella a maggior consumo energetico.
3 è la più efficiente.
4 è da preferire al momento dell’acquisto di un elettrodomestico.
b. Installare pannelli fotovoltaici sul tetto della propria casa:
1 è un intervento di risparmio energetico attivo.
2 permette la produzione autonoma dell’energia elettrica.
3 migliora l’isolamento termico dell’abitazione.
4 riduce i costi in bolletta.
lezione
4 I FENOMENI MAGNETICI
9 Scegli la soluzione corretta.
a. Il magnetismo è la proprietà che alcuni materiali hanno di:
1 acquisire o perdere elettroni.
2 acquisire o perdere atomi.
3 attirare oggetti di natura ferrosa.
4 attirare oggetti di qualsiasi natura.
b. Sono magneti naturali i materiali che:
1 acquistano proprietà magnetiche se sottoposti a particolari procedure.
2 danno origine spontaneamente a fenomeni magnetici.
3 perdono le proprietà magnetiche se sono allontanati dalla calamita.
4 danno origine spontaneamente a fenomeni elettrostatici.
c. Le linee di forza del campo magnetico mostrano che la forza magnetica:
1 agisce in prossimità del centro della calamita.
2 è la stessa in tutto lo spazio circostante.
3 presenta la massima intensità in uno dei poli.
4 presenta la massima intensità ai poli.
10
Completa le frasi con i termini corretti.
a. Se spezziamo una calamita in o più parti, ciascuna di esse presenta ancora due distinti.
b. Si chiama magnetico la regione di spazio in cui un magnete esercita la propria
lezione 5 L’ELETTROMAGNETISMO
11 Sottolinea il termine corretto tra i due proposti.
a. La scoperta dell’elettromagnetismo si deve a Faraday/Oersted.
b. In un solenoide si genera una corrente elettrica quando c’è un magnete che si muove al suo interno/esterno.
c. Le correnti alternate sono generate dallo statore/alternatore.
d. I motori elettrici producono/non producono anidride carbonica.
12 Segna con una crocetta se vero (V) o falso (F).
a. Un campo magnetico in movimento può generare una corrente elettrica.
b. Quando un magnete viene mosso all’interno di un solenoide, l’indice dell’amperometro segna il valore 0.
c. Il campanello elettrico funziona con il principio dell’elettrocalamita.
d. I rotori sono i magneti dell’alternatore.
METTI ALLA PROVA LE TUE COMPETENZE
INTERPRETARE UN MODELLO E SPIEGARE
1 I grafici che seguono mostrano il consumo energetico di due elettrodomestici: la lavastoviglie e il televisore. La lavastoviglie è dotata di un pulsante meccanico per l’accensione e lo spegnimento, mentre il televisore ha la modalità stand-by.
2 Osserva le differenze tra i due disegni nella figura a e nella figura b, spiegale e specifica a quale legge si riconducono i fenomeni rappresentati.
Rispondi alle domande.
a. Esistono dei momenti della giornata in cui il consumo energetico dei due elettrodomestici è simile?
b. In quale fascia oraria il consumo energetico dei due elettrodomestici è massimo?
c. Che cosa cambia nel consumo energetico dei due elettrodomestici nella fascia oraria 2:00-6:00?












3 Quale corpo ha generato questo spettro magnetico?

brilla di più
brilla di più
4 In un circuito è inserita una resistenza di 8 Ω e la variazione della differenza di potenziale in relazione alla variazione dell’intensità di corrente è rappresentata dal grafico qui sotto.
Ricava dal grafico:
a. l’intensità di corrente, se la differenza di potenziale è rispettivamente 12 V, 220 V, 40 V.
ELABORARE INFORMAZIONI DA UN TESTO
5 Leggi il brano.
UN NUOVO MAGNETISMO
b. la differenza di potenziale, se l’intensità di corrente è rispettivamente 3 A, 5 A, 20 A.
Ricercatori tedeschi e cechi hanno dimostrato che esiste una nuova classe di magnetismo chiamata altermagnetismo. È una nuova forma di magnetismo dove piccoli blocchi magnetici si allineano in modo parallelo rispetto ai loro vicini. Gli scienziati sono riusciti a unire le due proprietà apparentemente incompatibili, dei materiali ferrosi che sono magnetici con quelli di materiali che non lo sono utilizzando il modo in cui gli elettroni “girano” su se stessi: un po’ come unire ghiaccio e fuoco. La particolare forma di magnetismo appena scoperta permette di distribuire le unità magnetiche molto vicine tra loro senza che si disturbino a vicenda. Questo apre prospettive potenzialmente rivoluzionarie per l’elettronica, ad esempio per realizzare memorie in grado di archiviare più informazioni usando lo stesso spazio oppure dispositivi in cui chip e memorie possono trovarsi molto più vicini con un grande risparmio di energia. Le applicazioni sono, potenzialmente, da capogiro: dispositivi elettronici super efficienti, computer quantistici potenziati, superconduttori e materiali particolari che si comportano da isolanti all’interno e conduttori all’esterno.
Rispondi alle domande. Svolgi l’attività proposta da solo o insieme ai tuoi compagni.
a. In che modo il nuovo altermagnetismo è diverso dal magnetismo tradizionale?
b. Perché gli scienziati hanno paragonato l’unione di materiali ferrosi e non ferrosi a quella tra ghiaccio e fuoco?
c. Quali sono le applicazioni più sorprendenti o interessanti di questa scoperta?
d. In che modo questa nuova forma di magnetismo potrebbe contribuire a risparmiare energia nei dispositivi elettronici?
Con l’aiuto del tuo insegnante chiedi a un chatbot di intelligenza artificiale di darti delle idee per realizzare la sceneggiatura di una rappresentazione teatrale sui principi del magnetismo, da realizzare in classe con i tuoi compagni.


MOTORWAYS
OF THE FUTURE
The first project to transform existing motorways into levitation roads for super-fast travel is ready: it involves the installation of superconducting materials under the road surface, cooled by liquid hydrogen, which can also act as a system for storing and transporting electricity with zero dispersion. The plan is published in the APL Energy journal by experts from the University of Houston in collaboration with the German Leibniz Institute for Solid State and Materials Research in Dresden and Adelwitz Technologiezentrum GmbH. According to their estimates, this innovative transport system would allow people and goods to travel at over 600 kilometres per hour and, at the same time, it would allow large amounts of electricity to be stored and distributed in an ultra-efficient way. The novelty of this project lies in the reversal of the traditional architecture of magnetic levitation systems, which usually use a magnetic track on which vehicles with installed superconductors can move. This old concept has an important problem: the high cost of cooling the superconductors (operating at over 100 degrees below zero) makes its construction particularly expensive. On the contrary, in the new design, the vehicles are equipped with magnets while the superconductors are installed under the road surface, so that the system can have multiple uses and therefore be more cost-effective.
COMPREHENSION EXERCISES
a. At what speed can vehicles travel with this project?
b. What is the problem with today’s magnetic levitation systems?
c. Why is the new system more convenient and cost-effective?



(from Transforming highways for high-speed travel and energy transport ScienceDaily)
SYSTEM FOR STORING sistema di accumulo
TRACK tracciato lossario
e la luce Il suono unità
lezione 1
Che cos ’ E ` IL SUONO
lezione 2
LE CARATTERISTICHE DEI SUONI
EDUCAZIONE CIVICA
L ’ inquinamento acustico
lezione 3
Che cos ’ E ` LA LUCE
lezione 4
lezione 5 RIFLESSIONE, DIFFUSIONE E RIFRAZIONE DELLA LUCE
I COLORI





BUONE NOTIZIE PER IL FUTURO
Internet si ` , ma sostenibile
Non è più possibile rinunciare alla rete Internet. Eppure, anche la rete ha un impatto sull’ambiente, non solo a causa dell’energia necessaria per il suo funzionamento, ma anche per quel che riguarda i materiali di cui sono fatti i cavi, come per esempio il rame, che fino a ieri era il componente delle reti DSL e ADSL. Una volta estratto dalle miniere, il rame deve essere lavorato con grande dispendio di acqua ed energia per separare il metallo dalla roccia che lo contiene; questa fase di lavorazione produce notevoli quantità di sostanze inquinanti e di polveri ancora prima di essere trasformato in fili. l cavi in rame disperdono energia sotto forma di calore mentre trasportano i dati e questo comporta l’uso continuo di condizionatori per evitare il surriscaldamento degli apparecchi collegati alla rete; inoltre, la rete richiede una manutenzione continua.
L’alternativa è l’utilizzo dei cavi in fibra ottica: sono formati da un insieme di sottilissimi filamenti trasparenti di fibra di vetro o di polimeri plastici, tenuti insieme da una guaina protettiva in gomma. Sono flessibili e resistenti, richiedono minori quantità di energia per la loro produzione e trasportano enormi quantità di dati ad altissima velocità sotto forma di impulsi di luce. Grazie alla diffusione della rete FTTH sarà possibile comunicare in modo sempre più efficiente e sostenibile per l’ambiente.
che cos ’ E ` il suono lezione 1
LAB STEM
ALL’ORIGINE DEI SUONI
Suoni e rumori sono sempre intorno a noi, fanno parte della nostra vita. Ma come si originano? Quale fenomeno causa il rumore assordante di un martello pneumatico o il cinguettio di un uccellino? Per cominciare a rispondere puoi realizzare questa semplice esperienza.
■
REALIZZA L’ESPERIMENTO
MATERIALI
• un righello di plastica
• nastro adesivo
• il tavolo da cucina o il banco, se esegui l’esperimento a scuola



PROCEDIMENTO
1. Appoggia un’estremità del righello al bordo del tavolo o del banco, fissandola bene con il nastro adesivo.
2. Premi sull’estremità del righello che sporge dal banco e falla vibrare.
3. Ripeti l’esperimento facendo vibrare parti sporgenti più o meno lunghe.
■
OSSERVA E RISPONDI
1. Che cosa avverti quando il righello vibra?
2. Che cosa succede quando fai vibrare parti più lunghe del righello? E più corte?
3. Come puoi descrivere le caratteristiche dei diversi suoni prodotti?
4. Se utilizzi righelli di materiali diversi e li fai vibrare, ottieni sempre gli stessi suoni? Prova a descriverli.
5. Scrivi la relazione dell’esperimento.
1
Le sorgenti sonore
Come hai potuto osservare eseguendo l’esperimento, i corpi in vibrazione emettono dei suoni.
Un suono è generato dalle vibrazioni di un corpo, cioè rapidi movimenti oscillatori intorno a una posizione di equilibrio.
La capacità di produrre vibrazioni è una proprietà dei corpi elastici, cioè di quei corpi che possono subire una deformazione e ritornare successivamente alla loro condizione iniziale.
I corpi che, messi in vibrazione, producono un suono sono definiti sorgenti sonore
Gli strumenti musicali sono sorgenti sonore. I suoni possono essere generati da vibrazioni di corde, come quelle del pianoforte 1 a , del violino 1 b o come le nostre stesse corde vocali, da vibrazioni di colonne d’aria, come nell’organo, o da vibrazioni di mem brane, come nel tamburo 1 c e negli strumenti a percussione.
2 La propagazione del suono
Per essere percepite come suoni, le vibrazioni delle sorgenti sonore devono arrivare sino all’orecchio umano e per questo hanno bisogno di un “mezzo” che le trasporti: questo mezzo è rappresentato in genere dall’aria, ma il suono si propaga anche nell’acqua e nei corpi solidi, come il legno e il ferro. Il meccanismo di trasmissione del suono consiste in una successione di compressioni e di espansioni delle molecole del mezzo in cui si propaga. I movimenti delle molecole si trasmettono fino ad arrivare al timpano del nostro orecchio, dove vengono percepiti e rielaborati dal cervello come suoni. Nel vuoto, cioè in assenza di aria o di un altro mezzo, le vibrazioni della sorgente sonora non possono propagarsi e il suono non è udibile.
3 Le onde sonore


Immaginiamo di lanciare un sassolino sulla superficie piatta di uno stagno o dell’acqua contenuta in un recipiente. Vediamo che sulla superficie dell’acqua si forma un’increspatura che, con il passare del tempo, si allarga sino a giungere ai bordi dello stagno o del recipiente. Quella che si è formata è un’onda che si propaga sulla superficie dell’acqua. Un suono si propaga nell’aria (o in un altro mezzo) proprio come l’onda si propaga nell’acqua: nel caso specifico si parla quindi di onda sonora. Torniamo a osservare le onde che abbiamo generato nell’acqua: se è presente un corpo che galleggia, per esempio una boa, osserviamo che questa compie solo dei movimenti verticali, oscillando in basso e in alto, senza essere trascinata dall’onda nella direzione in cui questa si muove 2 . Ciò che si propaga non è materia (né la boa né l’acqua), ma l’energia associata all’onda.
Le onde che si propagano nell’acqua e le onde sonore che si propagano nell’aria sono onde meccaniche. Esse non trasportano materia, ma trasferiscono l’energia prodotta dall’oscillazione delle molecole.
Un’onda sonora è un’oscillazione che si propaga in un mezzo materiale e trasporta energia senza spostare materia.




2 Le onde meccaniche non trasportano materia.





oscillazione
oscillazione

propagazione


Oscillazione e propagazione in un’onda trasversale e in un’onda longitudinale.

b 4 Rappresentazione di un’onda.
propagazione propagazione oscillazione




oscillazione completa lunghezza d’onda λ
direzione di propagazione dell’onda ampiezza
ventre
4
Le caratteristiche di un’onda
Un’onda è caratterizzata da una direzione lungo la quale oscilla e da una direzione lungo la quale si propaga: queste direzioni possono essere tra loro perpendicolari oppure coincidere. Immagina di fissare l’estremo di una corda a un supporto, e di scuotere l’altro estremo verso l’alto e verso il basso per far oscillare la corda con continuità: quelle che ottieni sono onde trasversali 3 a .
In un’onda trasversale la direzione di oscillazione è perpendicolare alla direzione di propagazione.
Ora procurati una molla e appoggiala su un tavolo. Afferra un estremo della molla e muovilo avanti e indietro in modo da provocare successive compressioni e dilatazioni: ottieni delle onde longitudinali 3 b
In un’onda longitudinale la direzione di oscillazione è parallela alla direzione di propagazione.
Per rappresentare graficamente un’onda si usa una curva chiamata sinusoide, in cui le parti più alte sono dette
una cresta e di un ventre costituisce un’ completa
SCIENZA CHE
Perchè le onde d’urto sono diverse dalle normali onde sonore?
Un’onda d’urto è un’onda sonora ad alta energia, super-potente e super-veloce, che si forma quando qualcosa sposta l’aria (o l’acqua, o un altro materiale) con una forza e una velocità incredibili. Nell’atmosfera le onde d’urto possono essere conseguenza dell’esplosione di una bomba, che le espande in tutte le direzioni, oppure prodotte da un aereo supersonico che “rompe” la barriera del suono generando il caratteristico boato. Anche i fulmini provocano un rapidissimo aumento di pressione in grado di far muovere l’energia fino a luoghi lontani e brevissimo tempo e, a volte, far scoppiare i vetri delle finestre. In campo medico sono utilizzate per frantumare calcoli renali o biliari e per curare patologie legate a ossa, muscoli e tendini.

cresta cresta
La lunghezza d’onda è la distanza orizzontale tra due creste o due ventri consecutivi. Si indica con la lettera greca (lambda).
L’ampiezza dell’onda è la distanza verticale tra una cresta e l’asse di propagazione dell’onda.
La frequenza (f) è il numero di oscillazioni complete compiute in un secondo.
Esiste una precisa relazione tra frequenza e periodo. Per comprenderla, osserva i grafici 5 . Un’oscillazione completa è compiuta in un secondo: il periodo è uguale a 1 secondo e la frequenza è 1 5 a
Due oscillazioni complete sono compiute in un secondo: il periodo è uguale a mezzo secondo (1/2 di secondo) e la frequenza è 2 5 b
Quattro oscillazioni complete sono compiute in un secondo: il periodo è uguale a un quarto di secondo (1/4 di secondo) e la frequenza è 4 5 c .

Le caratteristiche delle onde
Come puoi osservare, frequenza e periodo sono l’una il reciproco dell’altro.
4. Per rappresentare graficamente un’onda si usa una sinusoide/retta. a b c
5 Relazione tra frequenza e periodo di un’onda.
L’unità di misura della frequenza è l’hertz (Hz), dal nome del fisico tedesco Heinrich Hertz (1857-1894), che per primo scoprì l’esistenza delle onde elettromagnetiche. In molte situazioni si usano i multipli dell’hertz: il kilohertz (1 kHz = 1000 Hz), il megahertz (1 MHz = 1 000 000 Hz), il gigahertz (1 GHz = 1 000 000 000 Hz).
FISSA I CONTENUTI ESSENZIALI
Sottolinea il termine corretto tra i due proposti.
1. I suoni sono onde che si propagano in un mezzo/nel vuoto
2. Una molla produce un’oscillazione trasversale/longitudinale.
3. La frequenza e il periodo sono uguali/reciproci
le caratteristiche dei suoni lezione 2
CARTA PENNA COMPUTER

Il campo di udibilità
LAB STEAM
COME SI PROPAGA
IL SUONO
SKILL BOOK
1 L’altezza dei suoni.
Guarda il video e scrivi le risposte sul quaderno.
1. Quali sono le caratteristiche dei suoni percettibili?
2. Che cosa sono gli infrasuoni?
3. Che cosa sono gli ultrasuoni?
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.


5. Rivedi il video, trova le immagini e indica per ciascun animale i tipi di suoni che è in grado di percepire.

1 Altezza, intensità e timbro dei suoni
I suoni possono essere distinti tra loro in base a tre caratteristiche dell’onda sonora: altezza, intensità e timbro.
L’altezza distingue i suoni acuti (o alti) da quelli gravi (o bassi). Un esempio di suono acuto è quello emesso da un bicchiere vuoto percosso con un oggetto metallico, mentre il suono è grave se emesso dallo stesso bicchiere pieno d’acqua.
L’altezza di un suono dipende dalla frequenza dell’onda sonora: maggiore è la frequenza, più acuto è il suono; minore è la frequenza, più grave è il suono.
Un corpo che vibra ad alta frequenza, come un fischietto, emette suoni alti 1 a .
Un corpo che vibra a bassa frequenza, come un tamburo, emette suoni bassi 1 b
4. In quali settori sono utilizzati gli infrasuoni e gli ultrasuoni? a b suono acuto (alto) suono grave (basso)
frequenza maggiore frequenza minore
tempo (s)
tempo (s)
tempo (s)
tempo (s) suono acuto (alto) suono grave (basso)


L’intensità di un suono dipende dall’ampiezza dell’onda sonora: maggiore è la sua ampiezza, più intenso è il suono.
L’intensità distingue i suoni deboli, come quello di un sussurro 2 a , dai suoni forti, come il suono di una sirena 2 b .
suono
b
debole suono forte
suono
debole suono forte
tempo (s)
tempo (s)
tempo (s) a
tempo (s)


L’ampiezza di un’onda sonora è legata all’energia trasportata, quindi al tipo di vibrazione prodotta dalla sorgente sonora. L’intensità del suono dipende anche dalla distanza tra sorgente sonora e orecchio: più la sorgente è lontana, più il suono è debole.
L’unità di misura dell’intensità del suono è il decibel (dB). Un suono di intensità 0 dB corrisponde alla soglia di udibilità, mentre un suono di 120 dB, come quello prodotto da un martello pneumatico, necessità l’uso delle cuffie protettive; 130 dB corrispondono alla soglia di dolore Suoni che hanno la stessa altezza e la stessa intensità possono essere percepiti in modo diverso. Per esempio, la nota musicale “sol” emessa da un clarinetto è udita in modo differente dal “sol” prodotto da un flauto: i due suoni sono uguali per intensità e altezza, ma li avvertiamo diversi a causa del timbro differente 3
Il timbro di un suono dipende dalla natura della sorgente sonora e dal modo in cui essa vibra.
tempo (s)
tempo (s)

2 L’intensità dei suoni.

tempo (s)
tempo (s)

Il timbro è dovuto alla diversa forma che hanno le onde sonore emesse: clarinetto e flauto, emettono una vibrazione fondamentale insieme ad alcune vibrazioni secondarie, dette armoniche, che si sovrappongono alla curva principale e ne modificano la forma. Un suono è tanto più puro quanto minore è il numero di armoniche prodotte. Mentre i suoni sono percepiti come gradevoli, armonici e musicali, i rumori sono percepiti come fastidiosi e, a volte, persino dolorosi. La spiegazione risiede nella irregolarità della vibrazione: un rumore, infatti, è un suono prodotto da vibrazioni meccaniche nelle quali altezza, intensità e timbro cambiano in maniera disordinata.
3 Il timbro dei suoni.
flauto
clarinetto
SKILL BOOK
ESTETICA DELLA NATURA IL SUONO E LA MATEMATICA
aria
sughero
acqua
PVC duro
mattone
legno di pino
ghiaccio
ottone
tessuto osseo
vetro
acciaio
ferro

340 m/s
500 m/s
1484 m/s
1700 m/s
3000-3600 m/s
3300 m/s
3200-4000 m/s
4000 m/s
4000 m/s
4000-5700 m/s
5900 m/s
5000-6000 m/s
alluminio

6300 m/s

2
La velocità del suono
Il suono arriva al nostro orecchio dopo un certo tempo dal momento della sua emissione, che dipende dalla nostra distanza rispetto alla sorgente ma anche dalla disposizione e dalle caratteristiche delle molecole del mezzo attraversato dall’onda. Infatti, quanto più la struttura molecolare è ordinata, come per esempio nei solidi, più velocemente e lontano il suono si propaga. Al contrario, nei liquidi e nei gas, che hanno una struttura molecolare più disordinata, la velocità di propagazione del suono si riduce. Nell’aria la velocità del suono è di 340 m/s, mentre nel ferro, che è un solido con una struttura molecolare ordinata, la velocità raggiunge i 6000 m/s 4 . I solidi che hanno una consistenza spugnosa, soffice o polverosa conducono male i suoni e sono per questo chiamati materiali fonoassorbenti. Materiali di questo tipo, come la gomma, l’ovatta e il polistirolo espanso, sono utilizzati come isolanti acustici per ambienti.
3 La riflessione del suono
Quando un’onda sonora incontra un ostacolo, per esempio un muro o la parete di una montagna, subisce una riflessione, cioè “rimbalza” e torna indietro. La riflessione produce i fenomeni dell’eco e del rimbombo. Quali sono le differenze? Sappiamo che la velocità del suono nell’aria è di 340 m/s; il nostro orecchio riesce a percepire due suoni distinti solo se arrivano a intervalli di un decimo di secondo l’uno dall’altro; in questo intervallo di tempo un’onda sonora percorre 34 m. Se la distanza dell’ostacolo dalla sorgente sonora è maggiore o uguale a 17 m, la riflessione riproduce il suono originario e si ha l’eco; se invece è minore di 17 m, l’onda riflessa si sovrappone a quella originaria dando luogo a un suono confuso, il rimbombo.
Come fanno i pipistrelli a non sbattere contro gli ostacoli?
SCIENZA
I pipistrelli sono mammiferi notturni che non possono sfruttare la vista per cacciare, orientarsi e anche per schivare gli oggetti. Per volare utilizzano l’udito grazie all’ecolocalizzazione, o biosonar: gli animali producono ultrasuoni attraverso la bocca o il naso e sono in grado di stabilire la distanza di un oggetto valutando la differenza di tempo tra l’emissione delle onde e la ricezione delle onde riflesse. Il metodo è usato anche da altri animali: i delfini e molti mammiferi marini utilizzano il biosonar poiché la visibilità nell’acqua è scarsa ma il suono vi si propaga molto bene.


L’ecolocalizzazione dei pipistrelli
4 La risonanza













Il diapason è costituito da una sbarretta di acciaio a forma di U, i cui rami sono detti rebbi. Il diapason è una sorgente sonora capace di emettere il suono di una sola e de terminata frequenza quando si percuote uno dei suoi rebbi. Utilizziamo il diapason per comprendere un altro fenomeno che si verifica con le onde sonore: la risonanza. Appoggiamo su un tavolo due diapason che vibrano alla stessa frequenza e percuotiamo i rebbi di uno dei due: osserviamo che anche l’altro entra in vibrazione, producendo un suono più intenso 5 a , che continua anche quando il primo diapason cessa di vibrare 5 b . Il fenomeno non si verifica se i due diapason vibrano con frequenze diverse.






5 La risonanza nei diapason.




































Segna con una crocetta se vero (V) o falso (F).


La trasmissione delle vibrazioni da una sorgente sonora a un corpo vicino è chiamata risonanza.
La risonanza aumenta l’ampiezza della vibrazione ed è caratteristica non solo delle onde sonore, ma di tutti i sistemi elastici oscillanti. I ponti sospesi sono un esempio di sistemi oscillanti: su di essi la risonanza può avere effetti anche molto negativi, che devono essere studiati nella fase di progettazione di queste opere. La risonanza può essere ulteriormente amplificata mediante la cassa di risonanza o cassa armonica, che ne aumenta l’intensità. Strumenti a corda come la chitarra, il violino e il pianoforte sono dotati di casse armoniche che sfruttano il fenomeno della risonanza per produrre suoni che altrimenti sarebbero troppo deboli 6 . Anche la cassetta di legno su cui poggia il diapason si comporta da cassa di risonanza.



1. I decibel misurano la frequenza di un suono.
2. Un suono acuto ha frequenza maggiore di un suono grave.
3. L’eco è dovuta alla riflessione del suono.
4. I materiali fonoassorbenti sono isolanti acustici.
FISSA I CONTENUTI ESSENZIALI VERSO
Risolvi i problemi.
1. Durante un temporale osservi la scarica del fulmine e senti il rumore del tuono dopo 12 secondi. A quale distanza ti trovi dalla nube?
2. Se ti trovi a 6,8 km da un parafulmine e osservi la scarica elettrica, dopo quanto tempo sentirai il tuono?
cassa di risonanza
6 La cassa di risonanza della chitarra.
cassa di risonanza b
cassa di risonanza a cassa di risonanza
EDUCAZIONE CIVICA
L’inquinamento acustico
Aerei che decollano, sirene di ambulanze in corsa, clacson nel traffico cittadino, moto, treni e auto che sfrecciano a tutta velocità. Per le persone che abitano in città, spesso le ore della giornata trascorrono in mezzo a suoni assordanti. Oggi, però, è possibile ridurre l’inquinamento acustico grazie all’utilizzo di materiali fonoassorbenti sintetici e naturali.
decibel sorgente sonora




140 aereo che decolla, botti e fuochi d’artificio
110-130 concerto rock, trapano, martello pneumatico, clacson, discoteca
90-100 camion, macchinari industriali, treno merci, cantiere edile
80 traffico nelle ore di punta, sveglia
70 automobile, televisore e radio ad alto volume
55-60 voce alta, attività in ufficio, aspirapolvere
50 conversazione a voce normale
35-40 conversazione in biblioteca
25 bisbiglio
20 ticchettio dell’orologio, cinguettio
15 fruscio delle foglie
10 respiro
0 soglia di udibilità umana


1 La scala decibel
L’orecchio umano percepisce suoni compresi tra la soglia di udibilità, che corrisponde al livello sonoro minimo rilevabile, e la soglia del dolore, oltre i 120 decibel.



La sensibilità ai rumori varia da persona a persona, ma esiste una soglia di tolleranza che è valida per tutti. I fonometri sono gli strumenti che rilevano i rumori e misurano la loro intensità in decibel: grazie ad essi è stato possibile costruire la scala dei decibel, che esprime i livelli di suono specifici e il rapporto di intensità fra il silenzio e i vari rumori in maniera semplificata.

La scala decibel è una scala logaritmica, di base 10. Questo significa che, in termini di decibel, un raddoppio del volume corrisponde all’incirca a un aumento di 10 dB. Sulla scala dei decibel, il suono udibile più basso (percepito quasi in silenzio totale) è 0 dB; un suono 10 volte più potente è 10 dB; un suono 100 volte più potente del silenzio quasi totale è di 20 dB; un suono 1000 volte più potente del silenzio quasi totale è di 30 dB; 40 dB e così via.
I rumori fino a 60 dB non provocano danni, ma oltre la soglia di rischio, individuata intorno agli 80 dB, diventano sgradevoli. Quando il rumore supera costantemente la soglia di 80 dB si può parlare di inquinamento acustico
2
Male da rumore
L’Organizzazione Mondiale della Sanità raccomanda di stare durante il giorno in ambienti al di sotto dei 65 dB e di non superare i 55 dB di notte. In Italia, tuttavia, l’inquinamento acustico medio si attesta sui 70 dB di giorno e sui 65 dB di notte, e un italiano su dieci accusa problemi all’udito provocati dal rumore eccessivo L’ascolto prolungato di suoni e rumori intensi, per esempio attraverso gli auricolari, oppure in discoteca o durante un concerto rock, può provocare danni irreversibili all’orecchio interno e ridurre la capacità uditiva. Il nostro comportamento è quindi importante per salvaguardare l’udito: l’ascolto della musica a un volume adeguato, oppure l’uso più frequente della bicicletta invece che degli altri mezzi di trasporto sono solo alcuni esempi di quello che ciascuno di noi può fare per ridurre gli effetti dell’inquinamento acustico.
3 Barriere verdi

L’ inquinamento acustico nell’ambiente urbano genera nelle persone sensazioni di malessere e influenza negativamente l’umore. Oggi disponiamo di materiali fonoassorbenti e di tecnologie che possono proteggerci, almeno in parte, dall’aggressione dei rumori e migliorare la qualità della nostra vita. Le barriere verdi, per esempio, sono sempre più utilizzate per proteggere le aree residenziali dai rumori prodotti da strade, autostrade, ferrovie e impianti industriali. Una fascia di vegetazione costituita da alberi, cespugli ed erba alta, costringe le onde sonore a compiere un percorso tortuoso che favorisce la loro trasformazione in calore. L’attenuazione prodotta dalle barriere verdi dipende sia dalle foglie, che assorbono e trasformano l’energia sonora in energia termica, oppure deviano i suoni, specialmente quelli con frequenze più alte, sia dal terreno che ospita la barriera, che agisce assorbendo o riflettendo le onde sonore, in particolare quelle con frequenze più basse. Secondo studi recenti, le piante in grado di assorbire meglio i rumori sono le co nifere, soprattutto il larice, grazie alla particolare rugosità della sua corteccia.


che cos ’ E ` la luce lezione 3
CARTA PENNA COMPUTER


Lo spettro elettromagnetico
1 Spettro elettromagnetico.
Esplora l’oggetto interattivo e scrivi le risposte sul quaderno.

Luce: onda o particelle?
1. Come era fatta la luce secondo Newton?
2. In quale prospettiva era vista da Huygens?
3. Quale scienziato ha dimostrato che la luce è un’onda elettromagnetica?
4. Che cosa sono i fotoni?
1 L’energia luminosa
Comprendere la natura della luce è difficile, ma possiamo facilmente osservare gli effetti che essa produce sui corpi. La luce emessa dal Sole si propaga nello spazio per irraggiamento e giunge fino a noi sotto forma di radiazioni che sono in grado di scaldare gli oggetti, di generare una corrente elettrica in un pannello solare o di azionare l’apertura di porte con le cellule fotoelettriche. In tutti questi casi la luce compie un lavoro, quindi è una forma di energia
La luce è una forma di energia chiamata energia luminosa.
Se la luce trasporta energia, ha tutte le caratteristiche di un’onda e si può rappresentare con una sinusoide. Tuttavia, diversamente dai suoni che sono onde meccaniche, le onde luminose sono onde elettromagnetiche che non hanno bisogno di un mezzo per propagarsi, perciò possono viaggiare anche nel vuoto. Le onde elettromagnetiche che noi percepiamo sotto forma di luce visibile hanno lunghezze d’onda comprese tra 400 nm (1 nm = 0,000000001 m) e 700 nm.
L’insieme di tutte le lunghezze d’onda e di tutte le frequenze delle radiazioni elettromagnetiche costituiscono lo spettro elettromagnetico 1
La ricerca di Hasler
2 La propagazione rettilinea della luce
Le onde luminose, come quelle sonore, si propagano in tutte le direzioni allargandosi secondo sfere concentriche. Tuttavia, se osservi la luce del Sole che filtra attraverso una persiana o una nuvola, essa appare sotto forma di raggi, come se la propagazione avvenisse in linea retta.
Per semplificare lo studio della luce quindi consideriamo i raggi di luce e immaginiamo ognuno di essi si irradi lungo una traiettoria rettilinea.
La velocità della luce dipende dalla densità del mezzo che attraversa: all’aumentare della densità dei corpi, la velocità diminuisce. Nel vuoto, dove la densità è uguale a zero, la velocità della luce è di circa 300 000 km/s. La luce emessa dal Sole impiega circa 8 minuti ad arrivare sulla Terra, la luce di Proxima Centauri, la seconda stella più vicina a noi dopo il Sole, impiega 4,2 anni luce ad arrivare sulla Terra. Nell’acqua la velocità scende a 250 000 km/s; nel vetro, che è più denso, è di 200 000 km/s.
3 Sorgenti luminose e corpi illuminati
Una lampadina, il Sole, una fiamma, la Luna sono corpi visibili, ma non tutti emettono luce. Dobbiamo quindi fare una distinzione tra sorgenti luminose e corpi illuminati.
Le sorgenti luminose producono ed emettono luce propria. I corpi illuminati non producono luce propria, ma riflettono la luce che li colpisce.
Le sorgenti luminose possono essere naturali, come il Sole e le stelle, o artificiali, come una lampadina o una candela. In una camera buia, la lampadina è la sorgente luminosa, mentre il libro è un corpo illuminato perché riflette la luce che lo colpisce 2 . La Luna può sembrare una sorgente luminosa ma in realtà non lo è, perché non emette luce propria ma riflette la luce che riceve dal Sole.
Perché devo spalmarmi di crema solare per evitare i danni prodotti dai raggi UV?
2 Un esempio di sorgente luminosa e corpo illuminato.

Proteggere la pelle per esporsi al sole è un’ottima abitudine, ma i raggi UV non sono tutti uguali, dipende dalla loro diversa lunghezza d’onda. Gli UVA (ultravioletti A) rappresentano la maggior parte della radiazione UV che raggiungono la superficie terrestre: penetrano profondamente nella pelle e sono responsabili della nostra abbronzatura. Gli UVB (ultravioletti B) causano le scottature solari e possono provocare danni al DNA delle cellule, ma sono essenziali per la produzione della vitamina D, preziosa per la salute delle ossa. Infine Gli UVC (ultravioletti C) i raggi UV con la lunghezza d’onda più corta e l’energia più elevata, quindi molto dannosi e potenzialmente cancerogeni, sono per la maggior parte assorbiti dallo strato di ozono.

Corpi trasparenti, opachi e traslucidi.
I corpi trasparenti si lasciano attraversare completamente dalla luce e permettono una visione nitida degli oggetti posti dietro di loro. Sono corpi trasparenti l’acqua, quelli costituiti da vetro e da alcune materie plastiche come il polietilene e il nylon.

I corpi illuminati possono farsi attraversare dalla luce o possono fermarla. Pensa a queste situazioni: la luce del Sole attraversa il vetro della finestra ed entra nella stanza; se però chiudi le imposte, la luce non entra più. Se il vetro è colorato o smerigliato, la luce lo attraversa ma in minore quantità, tanto che non riesci più a distinguere i dettagli degli oggetti posti dall’altra parte del vetro. In base alla loro capacità di farsi attraversare dalla luce, i corpi illuminati si suddividono in corpi trasparenti, opachi e traslucidi 3 . La trasparenza e l’opacità di una sostanza possono variare in base ad alcuni parametri. Per esempio, il vetro è trasparente quando ha uno spessore di pochi millimetri, ma diventa opaco se lo spessore è di qualche centimetro; viceversa una lamina d’oro, che è in genere opaca, diventa trasparente quando è ridotta in fogli molto sottili. Anche l’acqua è trasparente, ma solo fino a circa 200 m di profondità, a seconda della latitudine e
I corpi opachi non si lasciano attraversare dalla luce ma la assorbono, per cui gli oggetti posti dietro di loro non sono visibili. Sono corpi opachi quelli costituiti da ceramica, legno, metalli e cartone.

4
Ombra e penombra

I corpi traslucidi si lasciano attraversare parzialmente dalla luce, per cui impediscono di distinguere nitidamente gli oggetti posti dietro di loro. Sono corpi traslucidi quelli di vetro smerigliato, carta oleata, alabastro e alcune materie plastiche come i sacchetti in PVC.
Una conseguenza della propagazione della luce in linea retta è che, quando i raggi luminosi incontrano un corpo opaco, non riescono ad attraversarlo e il loro cammino viene fermato; invece, i raggi che non vengono ostacolati proseguono indisturbati. In questo modo, la parte del corpo che è rivolta verso la sorgente è illuminata, mentre dietro l’ostacolo si produce una zona non illuminata con lo stesso contorno del corpo opaco. Se il corpo opaco è posto davanti a una sorgente luminosa puntiforme (cioè piccolissima), ponendo uno schermo oltre il corpo osserviamo che su di esso si proietta un’ombra con il contorno definito e di dimensioni maggiori di quelle del corpo 4 a
Se invece la sorgente luminosa è più estesa, come una candela, i raggi si originano da punti diversi: alcuni sul loro cammino rettilineo incontrano l’ostacolo, altri proseguono. I contorni dell’ombra che si genera oltre il corpo non sono ben definiti e tra la zona com pletamente in ombra e quella completamente in luce c’è un’area d’illuminazione interme dia detta penombra 4 b sorgente luminosa puntiforme corpo illuminato
ombra a b

Rappresentazione di ombra e penombra.
sorgente luminosa puntiforme corpo illuminato

FISSA I CONTENUTI
ESSENZIALI

Scegli il termine corretto tra i due proposti.
1. La luce è un’onda meccanica/elettromagnetica.

sorgente luminosa estesa corpo illuminato

ombra penombra
2. Se la sorgente luminosa è puntiforme/estesa si forma sullo schermo una zona di penombra.
3. La luce attraversa un corpo opaco/trasparente
4. Un corpo illuminato emette/riflette la luce.
VERSO LE COMPETENZE
sorgente luminosa estesa corpo illuminato ombra

Quando si verifica un’eclissi di Sole ci sembra che il Sole venga eclissato, cioè coperto, tutto o in parte, da un oggetto nero; possiamo osservare lo stesso fenomeno quando a essere eclissata è la Luna. Ma sono davvero i due corpi celesti a essere coperti da un altro corpo, oppure è una sensazione di noi osservatori dalla Terra?
Le eclissi si verificano quando la Terra, il Sole e la Luna sono allineati.
Osserva il disegno che mostra le posizioni dei tre corpi celesti quando si verifica un’eclissi di Sole e rispondi alle domande.
1. Quale corpo è la sorgente luminosa e qual è l’oggetto illuminato?
2. Che cosa succede quando i raggi del Sole incontrano l’ostacolo, cioè la Luna?
3. Come chiameresti l’area indicata con la lettera A? E quella con la lettera B?
4. Un osservatore che si trova nell’area coperta dall’ombra della Luna, come vede il Sole?
Sole
Luna A B
Terra
CARTA PENNA COMPUTER lezione 4

LAB STEM
MISURIAMO L’ANGOLO DI RIFLESSIONE
SKILL BOOK
RIFLESSIONE,
DIFFUSIONE
E RIFRAZIONE DELLA LUCE
Guarda il video e scrivi le risposte sul quaderno.
1. Grazie a quale fenomeno possiamo vedere la nostra immagine allo specchio?
2. Che cosa accade quando un raggio di luce attraversa due mezzi di densità diversa?
3. Quale fenomeno ottico osserviamo quando un raggio di luce attraversa un prisma?
4. Perché durante il giorno il cielo appare azzurro e al tramonto rosso-arancio?
ORA FERMA L’IMMAGINE!
Metti in pausa il video nei seguenti punti.

5. Rivedi il video, trova le immagini e descrivi i fenomeni che rappresentano.


1 La riflessione della luce
Guardati allo specchio: l’immagine che ti restituisce riproduce in modo preciso tutti i particolari del tuo viso e del tuo corpo. Se però provi a specchiarti su una superficie metallica non perfettamente lucida, l’immagine prodotta risulta confusa o addirittura con i contorni indistinguibili. Ciò accade perché quando un raggio di luce colpisce una superficie perfettamente liscia e levigata viene riflesso e torna indietro. Il fenomeno della riflessione della luce è regolato da leggi di natura geometrica 1 .


perpendicolare

La prima legge della riflessione afferma che il raggio incidente il raggio riflesso e la perpendicolare alla superficie nel punto di incidenza stanno tutti sullo stesso piano, sono cioè complanari
raggio incidente raggio riflesso super ficie riflettente


1 Prima legge della riflessione (a). Seconda legge della riflessione (b).
perpendicolare
raggio incidente raggio riflesso

super ficie riflettente

perpendicolare angolo di incidenza angolo di riflessione

perpendicolare
angolo di incidenza
ir raggio incidente raggio riflesso angolo di riflessione
super ficie riflettente
Fenomeni ottici
Gli angoli formati dal raggio incidente e dal raggio riflesso con la perpendicolare allo specchio sono rispettivamente l’angolo di incidenza i e l’angolo di riflessione
La seconda legge della riflessione afferma che l’angolo di incidenza l’angolo di riflessione r sono uguali.
2
Gli specchi
I comuni specchi sono costituiti da una lastra di vetro trasparente levigato, accoppiata da un lato a uno strato di metallo (di solito argento) ricoperto a sua volta da uno strato di vernice.
Gli specchi hanno la proprietà di riflettere la luce fornendo immagini precise e definite degli oggetti posti di fronte a essi. In base alla loro forma, gli specchi si distinguono in piani e curvi Gli specchi piani hanno una superficie riflettente piana: producono un’immagine riflessa, detta immagine virtuale , che non è uguale a quella reale, ma è diritta e simmetrica rispetto al piano dello specchio L’immagine restituita da uno specchio piano è virtuale, cioè prodotta dal prolungamento dei raggi riflessi. All’osservatore sembra che essi provengano da una sorgente luminosa dietro lo specchio, che in realtà non esiste 2 .
sorgente luminosa

Come si formano le immagini virtuali con uno specchio piano.

immagine virtuale
Gli specchi curvi , sferici e parabolici , hanno la superficie riflettente curva: forniscono un’immagine riflessa e deformata secondo la curvatura.

Uno specchio curvo concavo ha la superficie riflettente all’interno della curvatura (come la parte incavata di un cucchiaio). Esso dà immagini reali, capovolte e rimpicciolite di oggetti lontani, poiché i raggi giungono paralleli alla superficie e convergono tutti in uno stesso punto, detto fuoco . Fornisce invece immagini virtuali, diritte e ingrandite di oggetti vicini posti tra fuoco e specchio. Gli specchi concavi sono impiegati nei telescopi e nei fanali delle automobili, ma anche negli specchi per la concentrazione dell’energia solare. Uno specchio curvo convesso ha la superficie riflettente con la curvatura verso l’esterno (come il dorso di un cucchiaio). Esso fornisce sempre immagini virtuali, diritte e rimpicciolite. Gli specchi convessi consentono una visione più ampia rispetto agli specchi piani. Sono utilizzati, per esempio, negli specchietti retrovisori delle automobili o in prossimità di incroci stradali con visuale limitata.
3
La diffusione della luce
Se la superficie riflettente è ruvida oppure ossidata, ogni singolo raggio luminoso viene riflesso in una di rezione diversa, secondo angoli di incidenza e di rifles sione che variano da punto a punto: è come se la superfi cie del corpo fosse costituita da tanti specchietti orientati in modo indipendente l’uno dall’altro 3 . I raggi riflessi si propa gano in tutte le direzioni, si mescolano tra loro e l’immagine pro dotta è confusa: il fenomeno che osserviamo è chiamato ne della luce . La diffusione della luce è molto importante perché è grazie a essa che possiamo vedere gli oggetti illuminati e i loro colori.

3 La diffusione della luce. a b b a specchio



osser vatore
4 Gli effetti della rifrazione della luce.
4
La rifrazione della luce

Immergi una matita in un bicchiere d’acqua: nella zona di separazione aria-acqua, la matita appare spezzata 4 . È solo un effetto ottico perché, se la estrai, essa risulta perfettamente integra. Ma che cosa lo ha provocato?
La velocità della luce, come sappiamo, dipende dalla densità del mezzo attraversato dal raggio luminoso: più è denso, più la velocità diminuisce. In questo caso, la luce che passa da un mezzo meno denso (l’aria) a un mezzo più denso (l’acqua) cambia velocità e anche direzione: la parte di matita immersa nell’acqua ha un’angolazione diversa e sembra staccata da quella non immersa. Questo fenomeno prende il nome di rifrazione della luce
La rifrazione consiste nella deviazione dei raggi luminosi che passano da un mezzo trasparente a un altro di diversa densità.
Il raggio incidente è quello che arriva sulla superficie di separazione dei due mezzi. Il raggio rifratto è quello che si propaga nel secondo mezzo.
L’ angolo di incidenza i è quello che il raggio incidente forma con la perpendicolare alla superficie di separazione.
La prima legge della rifrazione afferma che il raggio incidente, il raggio rifratto e la perpendicolare alla superficie di separazione dei due mezzi si trovano sullo stesso piano.
L’angolo di incidenza i e quello di rifrazione r non sono uguali, perché i raggi luminosi sono deviati nel passaggio da un mezzo all’altro.
La direzione del raggio rifratto dipende dalla densità dei corpi attraversati e segue la seconda legge della rifrazione 5 .
LAB STEAM
UN CALEIDOSCOPIO
“FAI DA TE”
SKILL BOOK
La seconda legge della rifrazione afferma che se il raggio luminoso passa da un mezzo meno denso a uno più denso, l’angolo di rifrazione è

raggio incidente

perpendicolare alla super ficie
super ficie di separazione dei due mezzi

5 Passaggio del raggio da un mezzo meno denso, l’aria, a uno più denso, l’acqua (a). Passaggio del raggio da un mezzo più denso, l’acqua, a uno meno denso, l’aria (b).
raggio incidente





raggio rifratto




rifratto


5 Le lenti
Le lenti sfruttano il fenomeno della rifrazione per ingrandire o ridurre le immagini modificando il percorso dei raggi luminosi. Le lenti sono costituite da materiale trasparente (plastica o vetro) delimitato da due superfici di cui almeno una è curva. I raggi luminosi che attraversano una lente subiscono due volte la rifrazione: la prima al passaggio aria-vetro, la seconda al passaggio vetro-aria. I raggi luminosi sono deviati in modo diverso a seconda del tipo di curvatura che le lenti presentano. Esistono, infatti, due tipi di lenti: le lenti convesse o convergenti, e le lenti concave o divergenti 6 . In entrambi i tipi, il raggio luminoso allineato con l’asse ottico non viene deviato.

raggi incidenti

raggi rifratti
asse ottico
i raggi rifratti
dalla lente convergono F
Le lenti convesse, più spesse al centro che ai bordi, sono lenti convergenti perché fanno convergere in un unico punto, il fuoco, i raggi paralleli che le colpiscono. Producono immagini diritte o capovolte, ingrandite o rimpicciolite, reali o virtuali a seconda della distanza dell’oggetto dalla lente.
La lente d’ingrandimento è un esempio di lente convergente.
6 Tipi di lenti.

raggi incidenti

asse ottico

fuoco virtuale
fuoco virtuale
i raggi rifratti
i raggi rifratti
dalla lente divergono
Le lenti concave, più sottili al centro che ai bordi, sono lenti divergenti perché fanno divergere i raggi paralleli che le colpiscono, allontanandoli tra loro. In questo caso non esiste il fuoco reale della lente, ma quello virtuale, dove si incontrano i prolungamenti dei raggi rifratti. Le lenti divergenti danno sempre immagini virtuali, diritte e rimpicciolite. Le lenti per la correzione della miopia sono un esempio di lenti divergenti. f atti
dalla lente divergono

Segna con una crocetta se vero (V) o falso (F).
1. L’angolo di incidenza è uguale all’angolo di riflessione.
2. Un raggio di luce che attraversa due mezzi diversi subisce una riflessione.
3. Una lente d’ingrandimento è una lente divergente.
4. Uno specchio piano produce un’immagine virtuale.
i colori lezione 5
LAB STEAM
UN COLORE? NO, SETTE!
Se ti è capitato di vedere un arcobaleno dopo un temporale, ti sarai accorto che la luce solare si suddivide in sette colori, i colori dell’arcobaleno. Ma perché, allora, vediamo la luce bianca? Un esperimento può aiutarti a capirlo.
■ REALIZZA L’ESPERIMENTO
MATERIALI
• un disco sottotorta bianco
• un chiodo
• tempere o pennarelli a punta grossa
• compasso, righello, goniometro e matita






PROCEDIMENTO
1. Con gli strumenti geometrici, suddividi il sottotorta in sette spicchi uguali.
2. Colora ogni settore con un colore dell’arcobaleno: rosso, arancione, giallo, verde, blu, indaco, violetto.
3. Pratica un foro al centro del sottotorta e infila il chiodo.
4. Fai ruotare velocemente il sottotorta.
■ OSSERVA E RISPONDI
1. I colori dell’arcobaleno sono distinguibili quando il disco ruota velocemente?
2. Come puoi spiegare il fenomeno?
3. Prova a riportare su un altro disco colori diversi da quelli dell’arcobaleno oppure gli stessi ma in diversa successione: ottieni lo stesso risultato?
4. Scrivi la relazione dell’esperimento.




L’esperimento di Newton
1
La luce bianca
Perché luce che proviene dal Sole appare bianca, eppure gli oggetti che ci circondano sono in gran parte colorati. Lo scienziato inglese Isaac Newton nel 1672 fornì una prima risposta a questa domanda. Newton utilizzò un prisma ottico, un prisma triangolare di vetro, e osservò che un sottile raggio di luce, dopo aver attraversato il prisma, formava una striscia luminosa nella quale si susseguivano con continuità diversi colori: rosso, arancione, giallo, verde, blu, indaco e violetto.
Si tratta dei colori dell’iride, gli stessi che formano l’arcobaleno 1 . Newton allora ipotizzò che il colore bianco della luce fosse generato dalla sovrapposizione dei sette colori dell’iride.
1 La scomposizione di un raggio di luce che attraversa un prisma ottico.
rosso arancione giallo verde blu indaco violetto
raggio di luce visibile
2
La dispersione della luce
Il fenomeno della scomposizione della luce bianca nei colori componenti è chiamato dispersione della luce e l’immagine colorata che si forma oltre il prisma rappresenta lo spettro della luce visibile
Le diverse componenti colorate dello spettro della luce visibile corrispondono a onde elettromagnetiche con lunghezze d’onda che vanno da 400 nm (il violetto) a circa 700 nm (il rosso): all’esterno di questo intervallo ci sono le regioni dell’ultravioletto e dell’infrarosso, invisibili all’occhio umano 2 . Lo spettro visibile comprende i colori percepibili dall’occhio umano: l’angolo di rifrazione delle radiazioni con lunghezza d’onda minore (violetto) è maggiore rispetto a quello delle radiazioni con lunghezza d’onda maggiore (rosso).
Finché la luce non subisce dispersione, la percepiamo bianca. Inoltre, se facciamo passare lo spettro di luce colorata attraverso un secondo prisma o una lente convergente, osserviamo che la luce bianca si ricompone 3 . L’arcobaleno il risultato della rifrazione e della riflessione dei raggi solari sulle goccioline d’acqua sospese nell’aria durante e dopo un temporale.
2 Lo spettro della luce visibile. infrarosso ultravioletto
3 Scomposizione e ricomposizione di un fascio di luce bianca.

















































































3
I colori degli oggetti
Quando la luce bianca colpisce un corpo può essere assorbita, riflessa o diffusa 4 . In particolare, un corpo opaco può assorbire completamente il fascio di luce, ossia tutte le radiazioni elettromagnetiche che lo compongono. Il corpo opaco, di conseguenza, appare nero, privo di colore, perché i nostri occhi non vengono raggiunti da alcuna radiazione riflessa. Oppure, il corpo opaco può riflettere tutto il fascio di luce, perciò tutto lo spettro ricomposto colpisce l’occhio e l’oggetto ci appare bianco Infine, un corpo può assorbire una parte del fascio di luce e diffondere solo qualche particolare radiazione, corrispondente a un determinato colore: l’occhio è colpito solo da queste onde e l’oggetto ci appare colorato. Per esempio, la matita ci appare rossa perché essa assorbe tutti i raggi luminosi tranne quelli di lunghezza d’onda corrispondente al colore rosso, che giungono ai nostri occhi.



I corpi quindi non “possiedono” un colore, ma restituiscono il colore della radiazione luminosa che diffondono. Inoltre, in assenza di radiazione luminosa, cioè al buio, non si vede alcun colore.













I corpi trasparenti, come l’aria o l’acqua, appaiono incolori quando lasciano passare tutti i raggi luminosi, come nel caso dei vetri delle finestre. Se appaiono colorati, come i vetri delle cattedrali, è perché contengono dei composti di elementi chimici (pigmenti) che diffondono quel determinato colore e assorbono tutti gli altri.



Il colore azzurro del cielo, invece, è dovuto alla composizione chimica dell’atmosfera. Sappiamo infatti che l’atmosfera terrestre è una miscela di gas diversi, in particolare azoto (78%) e ossigeno (circa 21%). Quando la luce solare raggiunge gli strati più alti dell’atmosfera, le molecole dei due gas intercettano e riflettono in maggior misura, rispetto agli altri colori, le radiazioni corrispondenti al blu e al violetto, diffondendole in tutte le direzioni. Il fatto che il cielo appaia blu e non violetto è dovuto inoltre alla maggior percentuale di luce blu nei raggi solari e alla maggior sensibilità dell’occhio umano al colore blu.
Ma le ombre sono tutte grigie e nere?
SCIENZA
Assolutamente no, le ombre hanno un colore proprio legato alla luce che l’oggetto riceve e alle caratteristiche della superficie del corpo su cui è proiettata. Furono gli impressionisti, che alla fine del XIX secolo realizzavano i loro dipinti all’aperto, i primi a notare che all’interno delle ombre sono presenti sia i colori riflessi sia i colori complementari. Per riprodurre ombre scure e allo stesso tempo brillanti, come quelle che osserviamo in natura, si utilizza il nero pittorico, un colore che si ottiene dalla mescolanza di tre colori primari: giallo, rosso e blu.

4 Nero, bianco e colorato.
4
La composizione dei colori
La gamma dei colori è molto più varia di quella dello spettro visibile, perché i corpi possono assorbire o riflettere più di una radiazione. Questo fatto produce sfumature e colori dovuti alla sovrapposizione delle radiazioni.
Il colore bianco, oltre che dalla sovrapposizione di tutti i sette colori dello spettro visibile, si può ottenere anche dalla sovrapposizione di tre soli colori, chiamati colori primari: il rosso, il verde e il blu.
Dalla sovrapposizione dei colori primari, variandone le quantità, si ottengono tutti i colori e le sfumature 5 . Per esempio, dal verde e dal rosso si ottiene il giallo, dal verde e dal blu si ottiene il ciano, dal rosso e dal blu il magenta. Questo modello di colori si chiama RGB, dalle iniziali dei nomi in inglese dei tre colori primari (Red, Green, Blue).
Un secondo modello per ottenere tutti i colori si chiama CMYK e si basa sulla composizione dei colori ciano (Cyan), magenta (Magenta), giallo (Yellow) e nero (blacK; si indica con la K per non confonderlo con il blu).
Con il modello RGB, dalla sovrapposizione dei colori rosso, verde e blu si ottiene il bianco; con il modello CMYK si ottiene il nero. Inoltre, siamo soliti classificare i colori in colori caldi (rosso, arancione, giallo) e in colori freddi (verde, blu, azzurro), mentre nero, bianco e grigio sono considerati colori neutri.

FISSA I CONTENUTI ESSENZIALI
Segna con una crocetta se vero (V) o falso (F).
1. La sovrapposizione dei colori primari dà il bianco.
2. I raggi infrarossi hanno lunghezza d’onda minore dei raggi ultravioletti.
3. Il verde è un colore primario.
4. Un corpo ci appare bianco perché assorbe tutti i colori che compongono la luce.
VERSO LE COMPETENZE
Tra la fine dell’Ottocento e l’inizio del Novecento sono state sviluppate in Italia e Francia due tecniche pittoriche molto particolari: il divisionismo e il puntinismo.
Osserva qui a fianco il quadro di Giovanni Segantini, uno dei maggiori esponenti italiani del divisionismo, e rispondi alle domande.
1. Quali sono le caratteristiche della tecnica utilizzata da Segantini?
2. Come percepisci i colori guardando il quadro da distanze diverse?
3. A quale fenomeno relativo alla luce bianca fa riferimento la tecnica del divisionismo?

Ricerca in rete informazioni su altri pittori che hanno seguito questi due movimenti e seleziona i quadri che meglio rappresentano le due tecniche pittoriche.
I colori complementari 5 Il modello RGB e il modello CMYK.
CON LA SINTESI
lezione 1 CHE COS’È IL SUONO
Il suono è prodotto dalle vibrazioni di un corpo elastico, chiamato sorgente sonora.
Le vibrazioni producono una serie di compressioni ed espansioni delle molecole del mezzo in cui si trova la sorgente sonora. Nel vuoto le vibrazioni non possono propagarsi e i suoni non sono udibili. Le vibrazioni propagano l’energia ad esse associata sotto forma di onde sonore. Le onde sono trasversali se la direzione di oscillazione è perpendicolare alla direzione di propagazione; longitudinali se le due direzioni sono parallele. Un’onda è rappresentata da una curva detta sinusoide: le parti più alte sono le creste, quelle più basse i ventri. L’insieme di una cresta e di un ventre costituisce un’oscillazione completa e il tempo in cui avviene è il periodo T. La lunghezza d’onda è la distanza tra due creste o due ventri successivi; l’ampiezza è la distanza verticale tra una cresta e l’asse di propagazione dell’onda; la frequenza è il numero di oscillazioni complete compiute in un secondo, si misura in hertz (Hz) ed è il reciproco del periodo.

lezione 2 LE CARATTERISTICHE DEI SUONI
Le caratteristiche di un suono sono: l’altezza, che dipende dalla frequenza dell’onda sonora e distingue i suoni in gravi e acuti; l’intensità, che dipende dall’ampiezza dell’onda, distingue i suoni deboli da quelli forti e si misura in decibel (dB); il timbro, che dipende dalla sorgente sonora e dal modo in cui essa vibra.
I suoni udibili sono compresi tra la soglia di udibilità (0 dB) e la soglia del dolore (130 dB). Le vibrazioni che producono i suoni sono gradevoli e armoniche; quelle che producono i rumori sono irregolari e le caratteristiche dell’onda sonora cambiano in maniera disordinata. La velocità del suono è diversa a seconda dei mezzi in cui si propaga l’onda: nell’aria è pari a 340 m/s mentre nel ferro, che è un solido con struttura molecolare ordinata, raggiunge i 6000 m/s. Quando un suono incontra un ostacolo viene riflesso causando la eco o il rimbombo, a seconda della distanza dell’ostacolo dalla sorgente. Una sorgente può trasmettere vibrazioni a un altro corpo attraverso il fenomeno della risonanza, che aumenta l’intensità della vibrazione.


lezione 3 CHE COS’È LA LUCE
La luce è una forma di energia che si propaga sotto forma di onda elettromagnetica: la luce visibile rappresenta un piccolo intervallo di lunghezze d’onda, ma sono radiazioni elettromagnetiche anche le onde radio e i raggi infrarossi. La luce si propaga nel vuoto alla velocità di 300 000 km/s. Sono sorgenti luminose i corpi capaci di produrre luce, come per esempio il Sole o una lampadina. Sono corpi illuminati quelli che riflettono la luce prodotta da una sorgente. I corpi illuminati possono essere trasparenti se si lasciano attraversare completamente dalla luce e permettono di vedere distintamente gli oggetti posti dietro di loro; opachi se assorbono la luce impedendo di vedere i corpi dietro di loro; traslucidi se si lasciano attraversare parzialmente dalla luce per cui i corpi dietro di loro appaiono con contorni indistinti. Quando la luce incontra un ostacolo forma l’ombra, se la sorgente è puntiforme, ombra e penombra se la sorgente è estesa.
lezione 4 RIFLESSIONE, DIFFUSIONE E RIFRAZIONE DELLA LUCE
Quando un raggio di luce incontra una superficie liscia e levigata viene riflesso e gli angoli formati da raggio incidente e raggio riflesso sono uguali. La riflessione è sfruttata dagli specchi che possono essere piani o curvi (sferici o parabolici). L’immagine riflessa da uno specchio piano si dice virtuale ed è simmetrica a quella reale. Quando i raggi sono riflessi in direzioni diverse si ha il fenomeno della diffusione. Quando un raggio luminoso attraversa mezzi differenti viene deviato, producendo il fenomeno della rifrazione L’ampiezza dell’angolo di rifrazione cambia in relazione alla densità dei mezzi attraversati. Le lenti convergenti e quelle divergenti ingrandiscono o riducono le immagini e per questo hanno differenti usi.
lezione 5 I COLORI
La dispersione della luce consiste nella scomposizione della luce bianca nei sette colori dell’iride che costituiscono lo spettro visibile della luce: ogni colore dello spettro ha una sua lunghezza d’onda. Un corpo appare nero quando assorbe tutta la radiazione visibile, appare bianco quando la riflette completamente. Il colore di un oggetto è dovuto alla riflessione della radiazione della lunghezza d’onda corrispondente. Il colore bianco può essere ottenuto dalla sovrapposizione dei colori primari rosso, verde e blu, secondo il modello RGB. I colori si possono ottenere anche con il modello CMYK dei colori ciano, magenta, giallo e nero.



CON LA MAPPA
Adesso che hai ripassato i contenuti essenziali con la sintesi, prova a completare la mappa con le parole chiave suggerite e a trovare le definizioni corrispondenti. diffusione - frequenza - luce - rifrazione - sinusoide - suono - timbro
1. UN’ONDA
è rappresentata da una può essere come come
meccanica
il
caratterizzato da
altezza
caratterizzata da
3. ampiezza
11. elettromagnetica 12. la
che subisce fenomeni di 2. 13.
10. intensità

4. lunghezza d’onda
5.
a. È la distanza tra due creste di un’onda.
b. Tipo di onda che si propaga anche nel vuoto.
c. Determina suoni acuti e gravi.
d. Proprietà sfruttata negli specchi.
e. Dipende dalla sorgente sonora e da come vibra.
14. riflessione




lezione 1 CHE COS’È IL SUONO
1 Scegli la soluzione corretta.
a. La frequenza di un’onda sonora è:
1 il tempo che passa tra due oscillazioni della sorgente.
2 il numero delle oscillazioni in un secondo.
3 la velocità di propagazione dell’onda.
4 la direzione dell’onda.
b. Quando una corda vibra percepiamo il suono perché:
1 la corda rilascia piccole molecole che arrivano al nostro orecchio sotto forma di suoni.
2 le molecole d’aria che oscillano si spostano dalla corda all’orecchio.
3 la corda provoca onde di compressione ed espansione nell’aria che si propagano dalla sorgente allo spazio circostante.
4 siamo lontani dalla corda.
2 Osserva il disegno e inserisci accanto a ogni termine il numero corrispondente.
a. Lunghezza d’onda
b. Cresta
c. Ventre
d. Ampiezza
e. Oscillazione completa

lezione 2 LE CARATTERISTICHE DEI SUONI
3 Abbina i termini con la definizione corretta.
1. Intensità
2. Altezza
3. Timbro
4. Risonanza
a Trasmissione della vibrazione sonora a un corpo vicino.
b Caratteristica del suono che dipende dalla natura della sorgente.
c Caratteristica di un suono che dipende dall’ampiezza dell’onda sonora.
d Caratteristica di un suono che dipende dalla frequenza dell’onda.
1. 2. 3. 4.
4 Completa le frasi con i termini corretti.
a. La del suono dipende dal mezzo attraverso il quale si propaga.
b. Nei solidi che hanno una struttura molecolare più ordinata la velocità del suono è che nei liquidi e nei gas.
c. I solidi che hanno una struttura soffice e spugnosa sono chiamati perché ostacolano la propagazione del suono.
d. Quando un’onda sonora incontra un ostacolo viene riflessa e si ha la quando la distanza dell’ostacolo è almeno di 17 m.
5 Osserva il disegno e inserisci accanto a ogni termine il numero corrispondente.
a. Suono debole
b. Suono acuto
c. Suono forte
lezione 3 CHE COS’È LA LUCE
6 Scegli la soluzione errata.
a. La luce:
1 è un’onda elettromagnetica.
2 ha una velocità nel vuoto di 300 000 km/s.
3 ha una velocità che aumenta con l’aumentare della densità del mezzo attraversato.
4 forma un’ombra quando colpisce un corpo.
b. Un corpo trasparente:
1 si lascia attraversare completamente dalla luce.
2 permette di vedere distintamente un oggetto posto dietro di esso.
3 rimane trasparente indipendentemente dal suo spessore.
4 è il vetro della finestra.
7 Completa le frasi con i termini corretti.
a. Le sono corpi che emettono luce propria come, per esempio, il .
b. I riflettono la che li colpisce come, per esempio, la Luna.
lezione 4 RIFLESSIONE, DIFFUSIONE E RIFRAZIONE DELLA LUCE
8 Sottolinea il termine corretto tra i due proposti.
a. Gli specchi sfruttano il fenomeno della riflessione/rifrazione della luce.
b. Uno specchio concavo dà immagini ingrandite/rimpicciolite di un oggetto.
c. Quando la luce passa da un mezzo più denso a uno meno denso l’angolo di rifrazione aumenta/diminuisce
d. La lente d’ingrandimento è una lente convessa/concava
e. Angolo incidente e angolo di riflessione sono uguali/diversi
9 Abbina i termini con la definizione corrispondente.
1. Raggio incidente
2. Fuoco
3. Immagine virtuale
4. Rifrazione
a Immagine formata da uno specchio.
b Deviazione di un raggio luminoso che passa in mezzi con differente densità.
c Raggio che colpisce una superficie.
d Punto di uno specchio concavo in cui convergono i raggi incidenti.
1. 2. 3. 4.
lezione 5 I COLORI
10 Scegli la soluzione corretta.
a. La luce solare forma lo spettro visibile per:
1 riflessione.
2 rifrazione.
3 diffusione.
4 dispersione.
b. Un oggetto appare colorato perché:
1 assorbe tutta la luce.
2 riflette tutta la luce.
3 assorbe solo la radiazione di quel colore.
4 riflette la radiazione corrispondente a quel colore.
11 Segna con una crocetta se vero (V) o falso (F).
a. Il prisma ottico è un cubo di vetro.
b. Il bianco e il nero sono colori primari.
c. Nel modello CMYK è presente il nero.
d. Il cielo è blu perché l’atmosfera riflette le radiazioni di questo colore.
e. Il nero è un componente della luce bianca.
INTERPRETARE UN MODELLO E SPIEGARE UN FENOMENO
1 Osserva i disegni, spiega il fenomeno rappresentato e individua gli errori.
RISOLVERE PROBLEMI
3 Risolvi i seguenti problemi.
a. La luce viaggia alla velocità di 300 000 km/s. Sapendo che un raggio solare raggiunge la Terra in 8 minuti e 20 secondi, calcola la distanza Sole-Terra.
b. Un sonar invia un segnale verso il fondo marino e questo ritorna indietro dopo 3 secondi. Sapendo che la velocità del suono nell’acqua è 1500 m/s, quanto è profonda l’acqua in quel punto?
INTERPRETARE GRAFICI
4 Ricava dai grafici le informazioni richieste.
T = 1 s
f = 1 Hz
t (s)
T = 1/2 s f = 2 Hz
t (s)
SPIEGARE UN FENOMENO
2 Spiega perché i seguenti oggetti appaiono di colori diversi.



a. Quale caratteristica del suono mostrano i disegni?
b. Quale onda mostra un suono grave?
c. Quale onda mostra un suono acuto ?
d. Che cosa indica il segmento rosso?
ANALIZZARE UN FENOMENO E
SPIEGARE
5 Osserva le immagini e spiega i fenomeni rappresentati.
luminosa
puntiforme
ombra sorgente luminosa puntiforme corpo illuminato



sorgente luminosa estesa corpo illuminato
penombra
ombra b a
penombra



ombra
ELABORARE INFORMAZIONI DA UN TESTO
6 Leggi il brano.
L’EFFETTO DOPPLER
Un effetto acustico particolare è l’effetto Doppler che si verifica quando la sorgente sonora si avvicina o si allontana dall’ascoltatore. Quando avverti la sirena di un antifurto percepisci il suono con una determinata frequenza, cosa che accade anche quando senti
la sirena di un’ambulanza e siete entrambi fermi. Ma se l’ambulanza si muove, percepisci un suono più acuto quando si avvicina a te, più basso quando si allontana. Ciò è dovuto al fatto che si percepisce il suono con frequenza maggiore se la sorgente in movimento si avvicina, con frequenza minore se la sorgente si allontana.
Lo stesso fenomeno si verifica se è l’osservatore a muoversi, oppure se entrambi si muovono. Un fenomeno particolare avviene con gli aerei: il nostro orecchio percepisce il rumore dei motori nei primi momenti del volo, poi, man mano che la velocità aumenta, le onde prodotte dal motore diventano sempre più compresse. Quando l’aereo raggiunge la velocità del suono, cioè 340 m/s, si forma un’unica onda d’urto che si comporta come una specie di barriera, nota con il nome di “muro del suono”: quando l’aero supera il muro del suono si sviluppa un forte rumore chiamato “bang supersonico”. Il primo uomo a superare il muro del suono fu l’americano Chuck Yeager che pilotava un X-1, il 14 ottobre 1947, mentre nel 2016 Leonard Weinster fotografò l’onda d’urto di un aereo contro il muro del suono.
Rispondi alle domande. Svolgi l’attività proposta da solo o insieme ai tuoi compagni.
a. Quando si verifica l’effetto Doppler?
b. Spiega con parole tue in che cosa consiste.
c. Che cos’è il “muro del suono”?
d. Chi lo ha superato per primo?
DIGITAL SKILLS
Ricerca in rete le informazioni per rispondere alle seguenti domande.
1. A quale velocità viaggiano normalmente gli aerei civili?
2. Quale velocità raggiungono gli aerei militari supersonici?
3. Nel 1976 è stato eseguito il volo inaugurale del Concorde: di che tipo di aereo si trattava? Esistono dei nuovi progetti di aerei di questo tipo?






EFFECTS OF
RESONANCE
Elastic bodies are capable of producing vibrations that can be reinforced by resonance. Suspension bridges are also elastic bodies, and the effects of resonance on them can be disastrous. The Tacoma Bridge was a suspension bridge in the US state of Washington. On 7th November 1940, strong winds caused the bridge to sway at its natural frequency. This triggered a resonance that twisted the central part, broke the support cables, and led to its collapse. The Millennium Bridge in London opened on 10th June 2000. It is a pedestrian suspension bridge with side support cables. Five days after the opening, it was closed because the large number of pedestrians caused lateral swaying movements that forced people to walk in sync with the movement. This triggered a very dangerous resonance, continuing even with few people on the bridge. To solve the problem, inertial dampers were added to counteract vertical oscillations and dissipating dampers for horizontal movement. The bridge was reopened on 22nd February, 2002.
COMPREHENSION EXERCISES
Read the text and answer the questions.
a. Why can bridges be affected by the phenomenon of resonance?
b. What caused the collapse of the Tacoma Bridge?
c. What is the Millennium Bridge?
d. Why was it immediately closed?
e. How was this resolved?



Il Millenium Bridge.
Dal motore a scoppio alle auto volanti


L’invenzione del motore a vapore, applicato soprattutto alle macchine industriali e alle locomotive, e quella del motore a scoppio e del motore diesel, impiegati nella produzione delle automobili, hanno cambiato radicalmente non solo il nostro modo di muoverci e viaggiare, ma di vivere lo spazio e il tempo. Contemporaneamente, il miglioramento del lavoro e l’aumento della ricchezza, conseguenze della rivoluzione industriale, hanno dato la possibilità a un numero sempre più grande di persone di acquistare un’auto, migliorando la qualità della vita, ma provocando nello stesso tempo un impatto molto significativo sul pianeta, soprattutto per quanto riguarda l’inquinamento atmosferico.
PREREQUISITI
Conoscere la differenza tra lavoro ed energia in fisica.
Conoscere il principio di trasformazione dell’energia. Sapere come funzionano i diversi tipi di macchine termiche.
RISULTATI ATTESI
Comprensione del ruolo giocato dall’evoluzione dei mezzi di trasporto sulla società e sulla vita quotidiana.
Capacità di riconoscere gli effetti della mobilità sull’ambiente e la necessità di promuovere una mobilità più sostenibile.
Comprendere la necessità di utilizzare motori meno inquinanti per diminuire l’inquinamento nelle città.
RACCORDI interdisciplinari
Proponiamo alcuni approfondimenti che possono essere affrontati nel percorso interdisciplinare, ma la mappa suggerisce altri argomenti che possono essere sviluppati per integrare lo stesso percorso.
STORIA: l’evoluzione dei mezzi di trasporto; la Napoli-Portici, la prima ferrovia italiana.
SCIENZE: le macchine termiche e l’inquinamento dell’atmosfera.
TECNOLOGIA: auto volanti, una nuova frontiera del trasporto urbano.
EDUCAZIONE CIVICA: la mobilità nelle città: aree ZTL e trasporto pubblico.
ARTE: primi passi del cinema: il cortometraggio dei fratelli Lumière sull’arrivo in stazione di una locomotiva.
EVOLUZIONE DEI MEZZI DI TRASPORTO LA PRIMA LINEA FERROVIARIA IN ITALIA, LA NAPOLI- PORTICI
MACCHINE TERMICHE INQUINAMENTO DA POLVERI SOTTILI
ALEF MODEL A: L’AUTO CHE VOLA DAVVERO!
EDUCAZIONE CIVICA
MOBILITÀ IN CITTÀ: ZTL E TRASPORTO PUBBLICO
CINEMA: L’ARRIVO DI UN TRENO ALLA STAZIONE DI LA CIOTAT
STORIA
ARTE
L’arrivo di un treno alla stazione di La Ciotat
Il racconto, elaborato con un chatbot di intelligenza artificiale, si ispira alla prima proiezione del film L’Arrivée d’un train en gare de La Ciotat
Parigi, 28 dicembre 1895

Salon Indien du Grand Café, Boulevard des Capucines Il salotto era gremito. Marie si accomodò in una delle sedie di legno, accanto al marito, incuriosita ma un po’ scettica. “Cosa sarà mai questo… cinematografo?”, chiese piano. “Un nuovo giocattolo dei Lumière. Pare che le immagini si muovano come nella vita vera,” rispose lui, controllando l’orologio da taschino. Le luci si abbassarono. Un uomo in giacca elegante spiegò qualcosa, ma Marie non ascoltava. Il fruscio di qualcosa dietro lo schermo attirò la sua attenzione. Un meccanismo iniziò a girare. Poi, la magia: lo schermo si accese. In bianco e nero, tremolante ma chiaro, un treno apparve in lontananza. La locomotiva sbuffava fumo, avanzando lentamente… poi più veloce… sempre più vicino… finché non sembrò uscire dallo schermo, dritto verso di loro. Un sussulto attraversò la sala. Una donna dietro Marie gridò. Qualcuno si alzò di scatto, facendo cadere la sedia. Il cuore di Marie prese a battere forte. Anche lei si sporse all’indietro d’istinto, tirando il braccio del marito. “È solo un’immagine! Guarda… è una proiezione!” disse lui, rassicurandola, ma con voce rotta dall’emozione. La locomotiva si fermò. Dalle carrozze scesero donne con ombrellini, uomini con valigie, bambini che correvano. Era così reale. Non un dipinto, non una fotografia, era come spiare la vita stessa.
DOMANDE GUIDA
a. Che cos’è il “cinematografo”, secondo il marito di Marie?
b. Qual è la reazione di Marie quando inizia la proiezione del treno?
c. Che effetto ha avuto il film sulle persone presenti nella sala?
d. In che modo il cinematografo è diverso da un dipinto o da una fotografia, secondo Marie?
DIGITAL SKILLS
PER APPROFONDIRE
Ricerca in rete informazioni sui fratelli Lumière e su come giunsero all’invenzione del cinematografo.
TECNOLOGIA
Alef
Model A: l’auto che vola davvero!
Immagina un’auto da guidare su strada ma che può anche volare! Si chiama Alef Model A, è completamente elettrica e decolla in verticale come un elicottero. Quando prende il volo, si inclina di lato e i suoi lati diventano ali, ma l’abitacolo resta sempre dritto, così nessuno finisce a testa in giù! Alef Model A può percorrere circa 320 km su strada e 180 km in volo: è dotata di 8 motori elettrici, sensori per evitare gli ostacoli, sistemi di sicurezza e persino un paracadute di emergenza. Inoltre, è stata progettata per muoversi nel traffico come una normale auto a bassa velocità e può stare in un garage di dimensioni standard. È la prima auto volante ad aver ottenuto il permesso di volo negli Stati Uniti: le prime consegne sono previste per il 2026 e ci sono già quasi 3000 prenotazioni!

DOMANDE GUIDA
a. Che tipo di energia sfruttano i motori di Alef Model A?
b. A quali apparecchi volanti si ispira Alef Model A?
c. Quali vantaggi offre questo veicolo?
d. Ritieni che siano necessarie delle regole per muoversi in volo, così come accade su strada?
Con l’aiuto del tuo insegnante chiedi a un chatbot di intelligenza artificiale di spiegarti con parole semplici il funzionamento di un motore elettrico. Per migliorare la comprensione, confronta le informazioni fornite, relative a magnetismo, campo magnetico e elettromagnetismo, con quelle del tuo libro di testo.
Intelligenza Artificiale IA
Coordinamento redazionale: Marco Mauri
Responsabile editoriale: Martina Mirabella
Redazione e revisione scientifica: Martina Mirabella, G.E.M.
Art director: Enrica Bologni
Revisione linguistica: Lisa Suett
Progetto grafico e impaginazione: G.E.M.
Copertina: G.E.M.
Ricerca iconografica: Martina Mirabella, Paola Bollani
Disegni: Daniele Gianni
Immagini di copertina: Shutterstock
Si ringrazia Federico Zanni per la collaborazione redazionale.
Referenze iconografiche: Shutterstock
Tutte le altre immagini provengono dall’Archivio Principato-Gruppo Editoriale ELi.
Per le riproduzioni di testi e immagini appartenenti a terzi, inserite in quest’opera, l’editore è a disposizione degli aventi diritto non potuti reperire, nonché per eventuali non volute omissioni e/o errori di attribuzione nei riferimenti.
Font: leggimi©Sinnos - www.sinnos.org
Contenuti digitali: bSmart labs
Prima edizione: gennaio 2026
Printed in Italy
RINGRAZIAMENTI
Per la collaborazione alla realizzazione della rubrica Le professioni del tuo futuro si ringraziano: Luca Antonelli, Pietro Carrara, Maria Luisa Chiaramonte, Giulia Ciconali, Andrea Cioffi, Stefano Giovanzana, Marta Mauri, Paolo Moggio, Marco Piacentini, Simone Salgarollo, Giuseppe Scalia, Stefania Tosto.
© 2026 - Proprietà letteraria riservata. È vietata la riproduzione, anche parziale, con qualsiasi mezzo effettuata, compresa la fotocopia, anche ad uso interno o didattico, non autorizzata. Le fotocopie per uso personale del lettore possono essere effettuate nei limiti del 15% di ciascun volume dietro pagamento alla SIAE del compenso previsto dall’art. 68, commi 4 e 5, della legge 22 aprile 1941 n. 633. Le riproduzioni per finalità di carattere professionale, economico o commerciale o comunque per uso diverso da quello personale, possono essere effettuate a seguito di specifica autorizzazione rilasciata da CLEARedi (Centro licenze e autorizzazioni per le riproduzioni editoriali), corso di Porta Romana 108, 20122 Milano, e-mail autorizzazioni@clearedi.org e sito web www.clearedi.org. L’editore fornisce – per il tramite dei testi scolastici da esso pubblicati e attraverso i relativi supporti nel sito www.gruppoeli.it materiali e link a siti di terze parti esclusivamente per fini didattici o perché indicati e consigliati da altri siti istituzionali. Pertanto l’editore non è responsabile, neppure indirettamente, del contenuto e delle immagini riprodotte su tali siti in data successiva a quella della pubblicazione, dopo aver controllato la correttezza degli indirizzi web ai quali si rimanda.
Principato, Gruppo Editoriale ELi www.gruppoeli.it Viale E. Jenner 17 - 20159 Milano e-mail: info@gruppoeli.it
La casa editrice attua procedure idonee ad assicurare la qualità nel processo di progettazione, realizzazione e distribuzione dei prodotti editoriali. La realizzazione di un libro scolastico è infatti un’attività complessa che comporta controlli di varia natura. È pertanto possibile che, dopo la pubblicazione, siano riscontrabili errori e imprecisioni. La casa editrice ringrazia fin da ora chi vorrà segnalarli a: Servizio clienti Principato-Gruppo Editoriale ELi e-mail: info@gruppoeli.it
Stampa: Tecnostampa - Pigini Group Printing Division - Loreto - Trevi 26.85.007.0
