





Noviembre / Diciembre 2025 - AÑO VI / CDMX / Periódico para profesionales veterinarios / Prohibida su venta al público ECV CAMPESTRE Nº 39 - MÉXICO







Noviembre / Diciembre 2025 - AÑO VI / CDMX / Periódico para profesionales veterinarios / Prohibida su venta al público ECV CAMPESTRE Nº 39 - MÉXICO
Errores comunes en la administración de antibióticos
[PG 12]
Síndromes tóxicos: cómo detectarlos a tiempo
[PG 14]
Presión arterial en perros y gatos: medición correcta paso a paso
[PG 16]
Manejo de la giardiasis felina: recomendaciones prácticas
[PG 20]

La Organización Mundial de la Salud Animal reporta que en 2024 enfermedades zoonóticas se registraron en zonas y especies previamente libres y en especies que antes no las padecían. [PG 3]

La Dra. Natalia Ignatenko, de Ucrania, con artistas de samba.
Comité Editorial: Gerardo Delgado, Arturo Delgado, Pablo Novillo y Martín Soberano
Dirección de Mercadotecnia & Contenidos: Alfredo Calderón Barrera
WEB: https://discampestre.com / https://es-la.facebook.com/distribuidora.campestre www.issuu.com/elcronista / Diseño: Magdalena Morard diseños



El primer informe sobre el estado de la sanidad animal en el mundo, presentado en mayo por la Organización Mundial de Sanidad a ni M al (OMSa), revela que las enfermedades infecciosas animales están afectando a nuevas regiones y especies, lo que pone en riesgo la seguridad alimentaria global, la salud humana y la biodiversidad. De acuerdo con los registros del organismo internacional, casi la mitad (47%) de las enfermedades en expansión incluidas en la lista de la OMSA y notificadas entre 2005 y 2023 tienen potencial zoonótico.
El informe de la OMSA establece las bases para un diálogo de alto nivel sobre cómo las estrategias de vacunación basadas en evidencia científica y las tecnologías emergentes pueden contribuir a enfrentar las amenazas actuales y futuras mediante el enfoque de “Una sola salud”.

La directora general del organismo, Emmanuelle Soubeyran, visitó la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de Buenos Aires, Argentina. Durante su visita, señaló: “Con este nuevo informe anual sobre el estado de la sanidad animal mundial, la OMSA arroja luz sobre los problemas de salud interconectados y las soluciones que pueden mejorar la salud animal y, en consecuencia, la salud global”. El concepto de One
Health o Una sola salud propone un abordaje interdisciplinario de los problemas sanitarios que integra la salud humana, animal y ambiental, para generar respuestas coordinadas desde distintas áreas de la ciencia y la investigación, con el fin de implementar políticas públicas efectivas de prevención, control y tratamiento de enfermedades.
La presencia de la titular de la OMSA en la UBA fue, justamente, la antesala de las Segundas Jornadas Interdisciplinarias “Una Salud”, realizadas a finales de octubre en la Facultad de Ciencias Veterinarias. Durante tres días (29, 30 y 31 de octubre), investigadores y profesionales de todo el país, junto con colegas de la región y de otros lugares del mundo, participaron en mesas redondas, conferencias y exposiciones sobre temas como zoonosis, inocuidad alimentaria, resistencia antimicrobiana, enfermedades emergentes y reemergentes, salud de la fauna silvestre y los efectos del cambio climático, entre otros ejes.



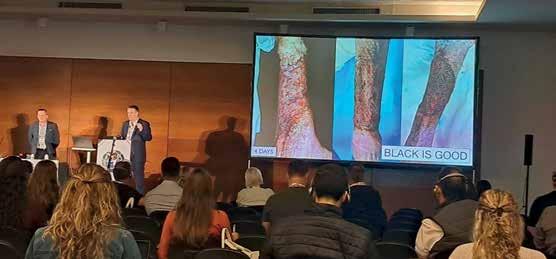
En el marco del c Ongre SO Mundial de la a SOciación Mundial de VeterinariOS de P equeñOS a ni M ale S (WS aVa), realizado del 25 al 27 de septiembre en Río de Janeiro, se llevó a cabo el encuentro anual del Comité de Oncología de la institución.
Durante la reunión, los
integrantes del comité debatieron las próximas acciones destinadas a ampliar la formación y el conocimiento sobre oncología veterinaria a nivel global. Bajo la presidencia del Dr. Martín Soberano, —también director de e l c r Oni S ta VeterinariO —, se presentaron y analizaron diversos
proyectos orientados al desarrollo profesional en esta especialidad. La participación del comité en el programa científico del congreso se centró en la exposición de los últimos avances en diagnóstico y tratamiento del cáncer en pequeños animales, así como en la discusión de casos clínicos
complejos que reflejan los desafíos actuales de la disciplina. El Comité de Oncología fue creado en 2021 por el Dr. Martín Soberano y el Dr. Jolle Kirpenjstein. En el sitio web de WSAVA puede encontrarse información técnica actualizada sobre oncología veterinaria, dirigida a profesionales de todo el mundo.



























Abordaje de los movimientos involuntarios
¿Afecta a todo el cuerpo/ ambos lados
Estado de consciencia
Alerta/ Asustado Inconsciente
(otro movimiento involuntario)
generalizada
Tratamiento de las convulsiones
x3
Discinesia (otro movimiento involuntario)
Si sigue convulsionando
X3
0,5 mg/kg en 15’ (15 mg/kg totales en 24h)
mantenimiento a 2-2,5 mg/kg BID
Si sigue convulsionando Discinesia Pautar mantenimiento a 20 mg/kg TID
Si sigue convulsionando
INHALATORIA Intentar evitar CRI propofol

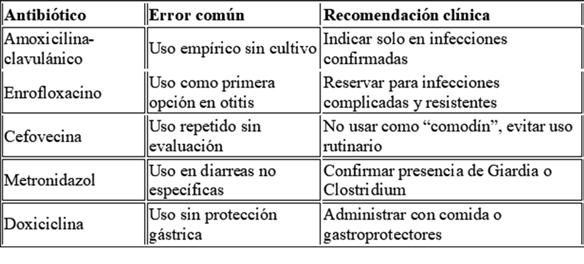
Laprescripción de antibióticos es una herramienta indispensable en medicina veterinaria, pero también una de las más frecuentemente mal utilizadas. La presión asistencial, la falta de pruebas complementarias inmediatas y los hábitos clínicos arraigados pueden generar errores en la antibioticoterapia, afectando tanto al paciente como a la salud pública al favorecer la aparición de resistencias antimicrobianas.
Evitar estos errores requiere una revisión crítica de la práctica diaria, el seguimiento de guías clínicas actualizadas y una sólida base en farmacología.
Principales errores
1. Uso empírico sin confirmación diagnóstica
Aunque el inicio empírico a veces es necesario, con frecuencia se inicia un antibiótico sin pruebas mínimas:
• Cultivo bacteriano y antibiograma: esencial en infecciones urinarias, dermatológicas recurrentes y otitis crónicas.
• Citologías o pruebas rápidas: orientan sobre la etiología.
Ejemplo: iniciar amoxicilina-clavulánico en una dermatitis sin citología → tratamiento ineficaz si la causa es Malassezia o no bacteriana.
2. Elección inadecuada del principio activo
Se utilizan antibióticos de amplio espectro para infecciones localizadas o de bajo riesgo sistémico, promoviendo resistencias innecesarias:
• Uso indiscriminado de fluoroquinolonas en otitis leves o diarreas.
• Elección de cefovecina por comodidad, cuando la adherencia oral sería suficiente.
Recomendación: priorizar antibióticos de primer escalón (aminopenicilinas, cefalexina, doxiciclina) antes de escalar.
3. Duración del tratamiento insuficiente o excesiva
No existe una duración única válida para todas las infecciones, pero es común:
• Interrumpir tratamiento a los 3–4 días “porque ya no hay fiebre”.
• Mantener tratamiento prolongado sin revaluación clínica. Guías recomendadas (ISCAID, PROVET):
• Piel: 7–14 días, reevaluar a los 7
• Infecciones urinarias: 3–5 días en cistitis no complicada
• Respiratorias: 7–10 días, con revisión clínica
4. Mala elección de la vía de administración
Uso innecesario de antibióticos parenterales, especialmente en pacientes ambulatorios:
• Cuando el antibiótico oral tiene igual biodisponibilidad
• Inyecciones prolongadas usadas por comodidad, no por indicación médica
Ejemplo: cefovecina para cistitis recurrente sin cultivo previo, cuando doxiciclina oral sería más efectiva.
5. Errores de dosificación
• Subdosificación: dosis más bajas por temor a efectos adversos, frecuente en geriátricos.


• Sobredosificación: errores de cálculo sin ajustar al estado corporal real.
• Intervalos incorrectos: administrar cada 12 h vs cada 8 h.
Ejemplo: enrofloxacino 5 mg/kg SID sin ajustar → fracaso terapéutico.
Otras prácticas incorrectas comunes
• No informar al tutor sobre la importancia de completar el tratamiento → recaídas y resistencias.
• Uso conjunto de antibióticos antagonistas (ej. betalactámicos con tetraciclinas).
• No ajustar dosis en enfermedad renal o hepática.
• Administración intramuscular de antibióticos que provocan necrosis si no se diluyen correctamente.
Cómo evitar estos errores
1. Seguir protocolos de uso racional de antibióticos
o Consultar guías clínicas (ISCAID, PROVET, WSAVA)
o Listado de antibióticos de elección por tipo de infección
o Establecer criterios de cultivo: infecciones recurrentes, falta de respuesta, inmunosupresión
2. Formular siempre con diagnóstico cuando sea posible
o Citología básica (otitis, dermatitis, secreciones)
o Urianálisis + sedimento antes de tratar cistitis
o PCR o serologías en infecciones sistémicas
3. Registrar con precisión dosis, duración y vía
o Historia clínica digital con ficha terapéutica obligatoria
o Seguimiento activo a los 3–5 días del inicio
4. Educar al tutor sobre el uso correcto
o Explicar por qué se indica el antibiótico, posibles efectos adversos y riesgos de mal uso
o Entregar pauta escrita, no solo verbal
5. Fomentar reevaluación antes de renovar tratamiento
o Nunca renovar antibiótico sin examen clínico
o Evitar dejar “el antibiótico de siempre” en la ficha sin revisión periódica
1. Amoxicilina
Indicaciones: Infecciones bacterianas de piel, tracto respiratorio, urinario y abscesos.
Mecanismo de acción: Antibiótico de amplio espectro que inhibe la síntesis de la pared celular bacteriana.
Dosis:
Perros: 10–20 mg/kg cada 8–12 h
Gatos: 10 mg/kg cada 12 h
Consideraciones: Precaución en animales con antecedentes de reacciones alérgicas a penicilinas.
2. Diazepam
Indicaciones: Convulsiones, ansiedad y relajante muscular.
Mecanismo de acción: Benzodiazepina que potencia los efectos del GABA, reduciendo la excitabilidad neuronal.
Dosis:
Perros: 0.5–2 mg/kg cada 6–8 h
Gatos: 0.5 mg/kg cada 8 h
Consideraciones: Monitorizar en animales con enfermedades hepáticas.
3. Ibuprofeno
Indicaciones: Alivio del dolor leve y la inflamación.
Mecanismo de acción: Inhibidor de COX-1 y COX2, disminuye la producción de prostaglandinas inflamatorias.
Dosis:
Perros: 5–10 mg/kg una vez al día (solo periodos cortos)
Gatos: No recomendado (alta toxicidad)
Consideraciones: Puede causar insuficiencia renal grave en gatos; evitar su uso en felinos.
4. Loratadina
Indicaciones: Alergias y urticaria.
Mecanismo de acción: Antihistamínico H1 que alivia síntomas alérgicos.
Dosis:
Perros: 0.5–1 mg/kg una vez al día
Gatos: 0.5 mg/kg una vez al día Consideraciones: Baja sedación, adecuada para tratamientos prolongados.
5. Prednisona
Indicaciones: Enfermedades autoinmunes, alergias y artritis.
Mecanismo de acción: Glucocorticoide que suprime inflamación e inhibe la respuesta inmune.
Dosis:
Perros y gatos: 0.5–1 mg/kg/día durante 1–2 semanas, luego disminuir gradualmente
Consideraciones: Uso prolongado puede causar hiperglucemia y supresión inmunitaria.

6. Metronidazol
Indicaciones: Infecciones gastrointestinales, giardiasis y colitis bacteriana.
Mecanismo de acción: Antibiótico y antiparasitario que inhibe la síntesis de ADN de bacterias y protozoos.
Dosis:
Perros: 10 mg/kg cada 12 h
Gatos: 5–10 mg/kg cada 12 h
Consideraciones: Evitar en pacientes con insuficiencia hepática grave.
7. Fentanilo
Indicaciones: Control del dolor agudo o crónico, postoperatorio.
Mecanismo de acción: Opioide que actúa sobre receptores mu-opioides del SNC.
Dosis (transdérmica):
Perros: 1–2 μg/kg/h
Gatos: 0.5 μg/kg/h
Consideraciones: Uso exclusivo en hospitalización bajo supervisión estricta.
8. Omeprazol (Prilosec®, Losec®)
Indicaciones: Úlceras gástricas y reflujo gastroesofágico.
Mecanismo de acción: Inhibidor de la bomba de protones, disminuye producción de ácido gástrico.
Dosis:
Perros y gatos: 0.5–1 mg/kg/día
Consideraciones: Útil en gastritis crónica y reflujo gastroesofágico en perros.
9. Clonazepam
Indicaciones: Convulsiones y ansiedad.
Mecanismo de acción: Benzodiazepina que aumenta la actividad de GABA, reduciendo la excitabilidad neuronal.
Dosis:
Perros: 0.05–0.1 mg/kg cada 12 h
Gatos: 0.05 mg/kg cada 12 h
Consideraciones: Uso prolongado requiere monitoreo por sedación o dependencia.
10. Amitriptilina
Indicaciones: Trastornos del comportamiento (ansiedad, agresión, depresión).
Mecanismo de acción: Antidepresivo tricíclico que aumenta neurotransmisores como serotonina.
Dosis:
Perros: 0.5–2 mg/kg/día
Gatos: 0.5 mg/kg/día
Consideraciones: Puede causar sedación o sequedad bucal.



Juan Gonzalo Restrepo Salazar (CIB Fondo Editorial)
Entoxicología veterinaria, los síndromes tóxicos son agrupaciones de signos y síntomas que pueden afectar uno o varios sistemas orgánicos y que son ocasionados por diversas sustancias. Durante su práctica profesional, el médico veterinario debe conocer estos síndromes para poder realizar un diagnóstico adecuado y aplicar un tratamiento terapéutico acorde con la intoxicación. El conocimiento de los toxidromes es de gran utilidad, ya que permite asociar los signos y síntomas presentados por el paciente con un grupo de agentes tóxicos que comparten mecanismos de acción similares. Esto facilita al médico veterinario orientar el diagnóstico, planificar el tratamiento y establecer la terapia de soporte Para ello, se evalúan los signos vitales y otros parámetros clínicos, como el tamaño pupilar, las características de la piel (temperatura y humedad), el peristaltismo y el estado de conciencia del paciente.
Toxidromes gastrointestinales
• Anorexia: Trastorno alimentario caracterizado por la falta anormal de apetito. Es un signo inespecífico, frecuente en muchas intoxicaciones, principalmente por vía oral.
• Diarrea: Alteración de las heces en volumen, consistencia o frecuencia. Puede ser de tipo hipersecretora, por malabsorción, hiperperistáltico o por destrucción de la mucosa.
Sustancias que pueden provocarla incluyen: arsénico, talio, urea, derivados fenoxiacéticos, mercurio, fósforo inorgánico, molibdeno, plomo,
cobre, fluoracetato de sodio, paraquat, nitritos, nitratos, detergentes, inhibidores de colinesterasas y enterotoxinas.
El uso inadecuado de catárticos y laxantes también puede inducir diarrea, cólico o dolor abdominal.
• Estreñimiento: Disminución de la evacuación intestinal. Los tóxicos que lo causan incluyen opioides, antihistamínicos y fármacos anticolinérgicos como atropina, escopolamina, burundanga o cacao sabanero.
• Cólico: Dolor abdominal de tipo espasmódico que puede ser causado por sustancias que aumentan (diarrea) o disminuyen (estreñimiento) el peristaltismo.
• Vómito: Expulsión violenta y espasmódica del contenido gástrico a través de la boca. Es un reflejo difícil de valorar clínicamente. Sustancias que pueden inducirlo incluyen paraquat, talio, etilenglicol, fenoxiacéticos, fósforo inorgánico, opioides, estimulantes del SNC, hidrocarburos, rodenticidas y enterotoxinas.
• Disnea: Dificultad respiratoria inducida por azufre, paraquat, cianuro, talio, nitritos y nitratos, monóxido de carbono, aflatoxinas, inhibidores de colinesterasas y depresores del SNC.
• Broncoespasmo: Contracción del músculo liso bronquial causada por inhibidores de colinesterasas o depresores del SNC.
• Bradipnea o hipopnea: Disminución de la frecuencia o profundidad respiratoria, inducida por depresores del SNC o sustancias que provocan acidosis respiratoria.
• Taquipnea e hiperpnea: Aumento de la frecuencia o profundidad respiratoria, inducido por estimulantes como cocaína, anfetaminas o sustancias que causan alcalosis respiratoria.
• Cianosis: Disminución de oxígeno en los tejidos, causada por organofosforados, carbamatos, paraquat, cianuro, monóxido de carbono, nitritos y nitratos. Depresores del SNC pueden causar cianosis por hipopnea o bradipnea
• Taquicardia e hipertensión: Pueden ser inducidas por estimulantes adrenérgicos, anfetaminas, amitraz, efecto nicotínico de inhibidores de colinesterasas, veneno de sapos o ranas, anticolinérgicos o derivados del ergot.
• Bradicardia: Asociada a digitálicos, inhibidores de colinesterasas, colinérgicos de acción directa (muscarina, pilocarpina), betabloqueantes, opioides o amitraz.
• Hipotensión: Común en intoxicación por depresores del SNC, antagonistas de canales de calcio, nitritos y nitratos, betabloqueantes, ofidiotoxicosis, amitraz, inhibidores de la ECA, diuréticos de asa o tiazidas, y sales de magnesio.
Los toxidromes neurológicos afectan el SNC y el SNP, pudiendo inhibir o estimular la función neuronal:
• Depresión del SNC: Somnolencia, sedación, estupor, hiperreflexia, arreflexia o coma. Asociada a tranquilizantes mayores (acepromazina, clorpromazina, haloperidol), hipnosedantes (barbitúricos, benzodiacepinas, alcoholes), anestésicos IV (tiopental, ketamina, propofol, etomidina), analgésicos (opioides, AINE), anticolinérgicos y estimulantes del SNC (estricnina, cocaína, anfetaminas).
• También considerar intoxicaciones por organoclorados, piretrinas/piretroides, organofosforados, carbamatos, tiocarbamatos, hidrocarburos, sales de cobre, amitraz, clorofenoxiacéticos, dicamba, nitrógeno, urea, fósforo inorgánico, nitritos/nitratos, metales como mercurio, plomo, hierro, litio, magnesio, cloro y yodo.
• Excitación del SNC: Alteraciones conductuales, hiperreflexia, excitación psicomotora y convulsiones. Asociada a cocaína, alucinógenos, síndrome de abstinencia, estricnina, anfetaminas, ácido benzoico (susceptible en gatos), metilxantinas, marihuana,

• fluoracetato, inhibidores de colinesterasas, opioides, plomo, nicotina, anticolinérgicos, gosipol, helechos (equinos), cicuta, semillas de ricino, clorados, clorofenoxiacéticos, antihistamínicos o fenotiazinas.
• Rigidez, temblores, coreoatetosis: Sospechar de plomo, mercurio, piretroides, helechos (equinos), fenol, metaldehido, cicuta, alucinógenos, fenotiazinas, metoclopramida o inhibidores de colinesterasas (fasciculaciones).
• Parálisis y neuropatías motoras: Asociadas a plomo, talio, mercurio, organofosforados, veneno de sapos, terapéutica con quelantes, selenio, cloruro de sodio (cerdos), cobre, botulismo, tétanos u ofidiotoxicosis.
Nota: Una misma sustancia puede producir varios toxidromes simultáneamente. Por ejemplo, los organofosforados pueden causar síndromes neurológicos, cardiovasculares, oculares, mucocutáneos y gastrointestinales.
Otros toxidromes importantes
• Hematológicos: Anemia, hematuria (ej. intoxicación por helechos en ganado bovino).
• Mucocutáneos: Dermatitis, alopecia, atrofia pilosa (ej. talio en mascotas).
• Genitourinarios: Coluria, disuria, oliguria, anuria, hemoglobinuria, insuficiencia renal.
• Abortos: Contaminación con plaguicidas.
Toxidromes específicos:
• Anticolinérgico: Taquicardia, hipertensión, midriasis, visión borrosa, peristaltismo disminuido, retención urinaria, psicosis, convulsiones. Asociado a antihistamínicos, fenotiazinas, antidepresivos tricíclicos, atropina, escopolamina.
• Colinérgico: Bradicardia, broncorrea, sibilancias, miosis, lagrimeo, diaforesis, sialorrea, diarrea, vómito, depresión de conciencia, convulsiones. Relacionado con carbamatos, organofosforados, fisostigmina, pilocarpina.
• Adrenérgico: Taquicardia, hipertensión, midriasis, diaforesis, agitación, psicosis, convulsiones. Sospechar de anfetaminas, cafeína, efedrina, cocaína, fenciclidina, terbutalina.
• Hipnosedante: Hipotensión, apnea, hipotermia, piel fría, confusión, estupor, coma. Asociado a anticonvulsivantes, etanol, antipsicóticos, barbitúricos, benzodiacepinas.
• Narcótico: Bradicardia, hipotensión, depresión respiratoria, miosis, hipotermia, peristaltismo disminuido. Relacionado con opioides.
• Desacople de fosforilación oxidativa: Hipertermia, taquicardia, acidosis metabólica. Sospechar de salicilatos, 2,4-diclorofenoxiacético, dinitrofenol, glifosato, fósforo, zinc.


Por el equipo del Hospital Veterinario de la Facultad de Veterinaria y Zootecnia de la Universidad Autónoma del Estado de México: doctores Alicia Pamela Pérez-Sánchez, Javier Del-AngelCaraza, Claudia Iveth MendozaLópez, Sofía Perini-Perera, Israel Alejandro Quijano-Hernández, Marco Antonio Barbosa-Mireles.
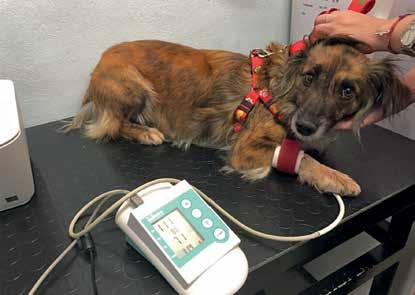
¿Cuál es la presión arterial normal en perros y gatos?
La definición de presión arterial (PA) normal en perros y gatos es compleja, ya que existen variaciones importantes según la especie, el sexo, la edad y la raza. Por ello, los valores deben interpretarse en función de las características del paciente y de su estado fisiológico o patológico.
En la literatura se reportan rangos normales de presión arterial sistólica (PAS) entre 110 y 160 mmHg, y presión arterial diastólica (PAD) entre 55 y 110 mmHg en perros. En gatos, la PAS varía entre 120 y 160 mmHg, y la PAD entre 70 y 120 mmHg.
En animales conscientes, la PAS es el parámetro de referencia, ya que el sistema Doppler —una técnica no invasiva— permite medir principalmente la presión sistólica. Además, es poco común que se presenten alteraciones aisladas de la PAD. Durante el monitoreo transanestésico, la presión arterial media (PAM) es el indicador más importante.
¿Hipotensión o hipertensión arterial?
En términos generales, una PAS menor a 110 mmHg se considera hipotensión, mientras que una PAS mayor a 150 mmHg indica hipertensión arterial sistémica (HAS).
La hipotensión implica una reducción del flujo sanguíneo hacia los órganos y puede presentarse en animales anestesiados o con enfermedades cardiovasculares, como insuficiencia cardíaca, arritmias graves, choque, hemorragia severa o estados críticos.
La HAS se define como una elevación sostenida de la presión arterial. En perros y gatos se asocia comúnmente con enfermedades sistémicas como enfermedad renal crónica, lesión renal aguda,
hiperadrenocorticismo (en perros) e hipertiroidismo (en gatos).
El “efecto de la bata blanca”, producto del estrés en clínicas u hospitales, puede causar un aumento transitorio de la presión arterial, que se normaliza en casa y no se considera HAS. Ciertos fármacos –como glucocorticoides, mineralocorticoides, fenilpropanolamina, eritropoyetina y antiinflamatorios no esteroides–, también pueden provocar hipertensión.
Un incremento sostenido y crónico de la presión arterial puede dañar órganos como los ojos, cerebro, corazón y riñones. Por ello, el tratamiento de la HAS busca principalmente prevenir el daño a órganos diana.
Entre los signos clínicos de daño se incluyen hemorragias o tortuosidad de los vasos retinianos, hipertrofia del ventrículo izquierdo, alteraciones en la filtración glomerular y proteinuria. Aunque no existen signos neurológicos específicos, se han descrito lesiones cerebrales mediante resonancia magnética o necropsia.
La HAS idiopática (también llamada esencial o primaria) no se asocia a ninguna enfermedad sistémica y se considera solo después de descartar causas secundarias (Brown et al., 2007). Siempre que sea posible, se recomienda medir la PA en el hogar para minimizar el efecto de la bata blanca.
¿En qué pacientes medir la presión arterial?
La PA puede medirse en
monitores oscilométricos.
Protocolo de medición
a) Equipos:
Usar un monitor de PA no invasiva calibrado periódicamente.
b) Operador:
Idealmente, uno o dos miembros del personal médico deben encargarse de las mediciones. Es recomendable que cuenten con experiencia, paciencia y conocimiento del equipo Doppler u oscilométrico utilizado.
c) Acondicionamiento del paciente:

cualquier paciente, pero debido al protocolo requerido, las guías actuales recomiendan realizarlo especialmente en:
—Pacientes críticos con sospecha de hipotensión.
— Animales con enfermedades sistémicas asociadas a HAS o signos de daño a órganos diana.
— Perros y gatos geriátricos, por la alta incidencia de enfermedades crónicas.
Indicaciones clínicas comunes:
— Enfermedad renal crónica
— Lesión renal aguda
— Hiperadrenocorticismo
— Hipertiroidismo
— Diabetes mellitus
— Hiperaldosteronismo
— Feocromocitoma
— Pacientes en estado crítico
— Revisiones rutinarias en pacientes geriátricos
Signos o hallazgos sugestivos de HAS:
— Tortuosidad vascular, hemorragia o desprendimiento de retina; hipema o ceguera súbita
— Convulsiones, ataxia, colapso súbito
— Disnea, ritmo de galope, hipertrofia del ventrículo izquierdo
— Proteinuria
Indicaciones para medir la PA en pacientes conscientes
Sitios de medición:
En perros y gatos, la PA no invasiva puede medirse en la arteria radial (miembros torácicos), arteria safena (miembros pélvicos) o arteria coccígea media (base de la cola). En gatos, también puede utilizarse la arteria braquial con
La medición debe realizarse antes de cualquier procedimiento estresante (tomas de muestra, radiografías, etc.). El animal debe permanecer de 5 a 10 minutos en una habitación tranquila, sin ruidos ni otros animales. El propietario puede estar presente si ayuda a mantener al paciente calmado. En mediciones con Doppler, se recomienda que el operador use audífonos para reducir el estrés del animal.
d) Posición del paciente:
Colocar al paciente en una posición cómoda (decúbito lateral o esternal). Las extremidades deben mantenerse a la altura de la base del corazón. Se aconseja estandarizar la posición —por ejemplo, decúbito lateral con medición en el miembro torácico—, para mejorar la consistencia de los resultados.
e) Mediciones:
Realizar entre 5 y 7 mediciones consecutivas, descartando la primera. Las lecturas de PAS no deben variar más del 10% entre sí. Promediar las restantes para determinar la presión final. Si se observa alta variabilidad, repetir la medición más tarde.
f) Registros:
Anotar los datos del paciente, el tipo de monitor, el tamaño y sitio del brazalete, la posición del cuerpo y las lecturas obtenidas.
Conclusión:
La evaluación sistemática de la presión arterial en perros y gatos es una herramienta fundamental en la medicina veterinaria preventiva y clínica. Su correcta medición permite detectar precozmente trastornos hemodinámicos, mejorar el pronóstico y evitar el daño irreversible a órganos vitales.




Por el Dr. Rodrigo Esteban Tello
Asesores:
Dr. Jorge Arredondo Ramos, Dr. Sergio Recillas Morales
os reflejos espinales involucran la participación de los nervios periféricos y los segmentos de la médula espinal. Cuando un reflejo espinal se encuentra disminuido o ausente, la lesión puede localizarse en el nervio específico o en el segmento medular correspondiente.
El martillo de percusión se utiliza para evaluar la elasticidad de los músculos y tendones, verificando la respuesta refleja apropiada. Si el animal mantiene el miembro en tensión o el tendón está contraído, el reflejo no puede ser evaluado con precisión. Es fundamental determinar si el reflejo espinal está disminuido o ausente, aunque en ocasiones la hiperreflexia puede estar asociada a una lesión de la neurona motora superior (NMS). Cuando se produce una lesión dentro del arco reflejo, puede observarse la pérdida del reflejo, lo que permite precisar la localización de la lesión dentro del sistema nervioso. Este tipo de alteración, al involucrar una lesión en la neurona motora inferior (NMI), se conoce como signo de NMI o cambio del reflejo propio de la NMI.
La mayoría de los nervios espinales son mixtos, pues contienen fibras sensitivas (ascendentes) y motoras (descendentes). Emergen de la médula espinal a través de dos raíces: una dorsal y una ventral. La raíz dorsal está formada por fibras sensitivas y presenta un ganglio espinal antes de unirse para formar el nervio periférico. Estos nervios periféricos son responsables de las funciones sensitivas y motoras del cuello, el tronco y las extremidades. Si la lesión se localiza cranealmente al arco reflejo, el reflejo queda desconectado de su regulación superior (cerebral). Dicha regulación suele ser de carácter inhibidor, por lo que su pérdida genera una exageración de los reflejos. Esta hiperreflexia indica una lesión del sistema nervioso central (SNC), particularmente en las vías de la neurona motora superior. Estos cambios se denominan signos o reflejos de la NMS. Los reflejos modulares se clasifican en tres grupos:
—Reflejos propioceptivos
— Reflejos nociceptivos
— Reflejos especiales
Esta división se basa en el tipo de estimulación sensitiva que se requiere para producir los dos primeros reflejos y en las condiciones especiales que se necesitan para producir el tercer reflejo.
Reflejos propioceptivos
El dolor es un factor clave en el sistema nervioso central o periférico, ya que el aumento o disminución de este (hiperalgesia e hipoalgesia) ayudan a detectar lesiones en el sistema nervioso incluso puede proporcionar la región exacta donde existe el daño o lesión.
La sensibilización que se produce en el dolor neuropático se debe a varios procesos complejos, el dolor neuropático se debe a la formación de neuromas, que son áreas de regeneración nerviosa intensa que se producen tras una lesión nerviosa.
Algunos de estos neuromas producen descargas ectópicas, espontaneas y que, además, responden a estímulos muy poco intensos. Además, estos neuromas (y otras fibras dañadas) desarrollan unos nuevos receptores llamados adrenorreceptores que generarán impulsos dolorosos cuando sean activados por la adrenalina, liberada por los nervios simpáticos adyacentes. A este proceso se le conoce con el nombre de mantenimiento simpático del dolor, y contribuirá en gran medida al dolor crónico neuropático. Expresiones de los reflejos propioceptivos
• Areflexia: Ausencia total de reflejos.
• Hiporreflexia: Disminución de la actividad de los reflejos corporales.
• Hiperreflexia: Aumento de la actividad fisiológica de los reflejos.


Su ausencia unilateral o bilateral puede indicar lesiones en los segmentos C8–T1, raíces espinales (por ejemplo, avulsión del plexo braquial) o tumores de la vaina nerviosa que afecten al nervio torácico lateral (eferente del reflejo).
La evaluación debe realizarse de caudal a craneal, estimulando con una aguja de punta roma en cada segmento desde el nivel de las alas del ilion. La contracción bilateral indica respuesta normal; su ausencia sugiere lesión medular, mientras que una respuesta exagerada puede reflejar dolor anormal en ese segmento. Reflejos medulares nociceptivos
Los reflejos nociceptivos se desencadenan por estímulos dolorosos (pellizco, presión o punción), provocando que el animal retire el miembro o genere otra respuesta refleja. Estos reflejos solo evalúan la integridad del arco reflejo medular.
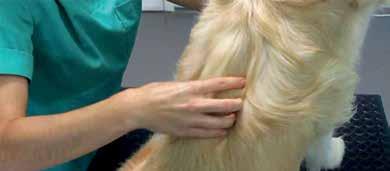
Reflejos de los miembros torácicos
Reflejo flexor del miembro torácico:
Se estimulan las almohadillas plantares o las falanges del paciente mediante pellizco. En algunos casos basta con una leve presión; sin embargo, suele requerirse una estimulación más intensa en zonas inervadas, como la raíz de las uñas o estructuras articulares. Puede emplearse una pinza hemostática.
La estimulación viaja por fibras ascendentes de distintos nervios sensitivos, según el punto de aplicación. Todas las articulaciones deben flexionarse ante el estímulo; una flexión disminuida sugiere patología del nervio periférico o de los segmentos medulares implicados.
Reflejo del tendón del tríceps:
Involucra los segmentos C7–T2 y el nervio radial. Se coloca el dedo índice sobre el tendón del tríceps y se percute suavemente con el martillo de reflejos, observando la contracción del músculo y la extensión del codo.
Reflejo del extensor radial del carpo:
Evalúa igualmente el nervio radial y los segmentos C7–T2. Se estimula percutiendo el cuerpo muscular del extensor radial del carpo, provocando la extensión del carpo. Es un reflejo más fácil de evocar que el del tríceps.
Reflejo del bíceps:
Evalúa el nervio musculocutáneo, originado en los segmentos C6 y C7. Se percute el tendón de inserción del bíceps, observando una ligera flexión del codo. Es un reflejo difícil de obtener e interpretar.
Reflejos propioceptivos de los miembros pélvicos
Reflejo patelar o rotuliano:
Involucra las vías sensitiva y motora del nervio femoral (segmentos L4–L6). Se evalúa percutiendo el tendón rotuliano entre la rótula y la tibia; la respuesta normal es la extensión de la rodilla. Es fácil de evocar, salvo en pacientes con luxación de rótula o geriátricos, donde puede observarse pseudohiperreflexia.
Reflejo tibial craneal:
Evalúa la rama peronea del nervio ciático (segmentos L2–S2). Se percute el cuerpo del músculo tibial craneal; la respuesta normal es la flexión del tarso (Birchard & Sherding, 2002).
Reflejo del gastrocnemio:
Evalúa los segmentos L6–S2 y el nervio tibial. Se sostiene el músculo entre el pulgar y el índice, y se golpea el pulgar con el martillo percutor para provocar la extensión del corvejón.
Reflejo panicular o dorsal cutáneo:
Puede evaluarse con el animal en estación o en posición vertical. Es útil para localizar lesiones toracolumbares, ya que cada nervio sensorial cutáneo (uno por segmento) aporta información sobre la integridad de la médula espinal en esa región.
Normalmente, este reflejo es bilateral: la estimulación de un lado provoca contracción de ambos músculos cutáneos de la espalda.
La presencia de un reflejo de retirada no implica integridad de las vías nociceptivas que ascienden al cerebro. La pérdida del reflejo nociceptivo indica lesión en la neurona motora inferior. Dado que estos reflejos tienen poca influencia de la neurona motora superior, no suelen exacerbarse cuando esta se lesiona.
Reflejo flexor de los miembros torácicos:
Evalúa los segmentos C6–T2 y todos los nervios periféricos del miembro torácico.
Se aplica compresión digital y la respuesta normal es la retirada del miembro. Su ausencia indica lesión en el arco reflejo.
Reflejo flexor de los miembros pélvicos:
Evalúa el nervio ciático y sus raíces (L6–S2). Se estimula mediante compresión digital, observando la retirada del miembro como respuesta normal. La pérdida del reflejo sugiere lesión del arco reflejo.
Reflejo perineal:
Se estimula la piel alrededor del esfínter anal o la mucosa anal con una pinza hemostática.
• Nervio aferente: pudendo.
• Respuesta normal: contracción del esfínter anal (nervios pudendos) y flexión de la cola (nervios caudales).
La estimulación debe ser gradual para evitar dolor excesivo que interfiera con la interpretación de la respuesta.
Reflejos especiales
En animales normales, estos reflejos están suprimidos por la acción de la neurona motora superior. Cuando se interrumpe la conexión entre el arco reflejo y la NMS, dichos reflejos se liberan o desinhiben. Su presencia, por tanto, indica pérdida de la inhibición de la NMS sobre el arco reflejo.
Reflejo de Babinski:
Con el paciente en decúbito lateral, se sostiene la extremidad pélvica desde la articulación tibio-tarsal, ligeramente flexionada. Se estimula con el mango del martillo o una pinza hemostática la parte caudolateral de los metatarsos.
La respuesta normal puede ser nula o mostrar una ligera flexión de los dígitos; la respuesta anormal es la extensión de los mismos.
Para la extremidad torácica, el procedimiento es similar: se sujeta en la articulación radio-carpal y se estimula la parte caudolateral de los metacarpos, observando las mismas posibles respuestas.
La Voz de la Industria:


