S3
• Características y representaciones de las reacciones redox Experimenta Experimenta con las reacciones de oxidación. 1. Reúnete con un compañero y consigan el
siguiente material: • Un limón • Un palito de madera o un pincel • 2 hojas de papel blanco • Una vela • Un vaso o recipiente para el jugo de
limón 2. Realicen el siguiente procedimiento: a. Expriman el limón y colecten el jugo
en un recipiente. b. Mojen el palito o el pincel con el jugo
de limón y escriban un mensaje en el papel. c. Dejen secar el papel. ¿Pueden ver lo que
escribieron? s é cprecaución uidadoso Maneja con el fuego. Maneja con precaución el fuego.
d. Con cuidado, acerquen el papel en posi-
ción horizontal a la parte superior de la vela encendida y esperen a que se revele el mensaje. No acerquen demasiado el papel porque se puede quemar. e. Anoten sus observaciones.
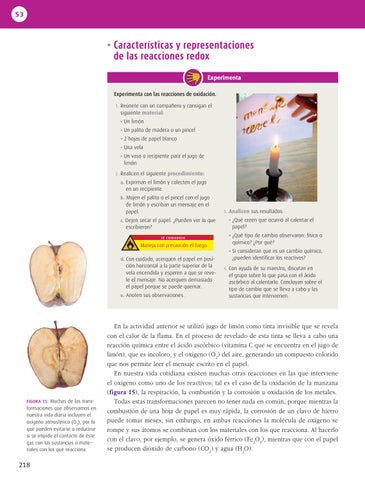
FIGURA 15. Muchas de las transformaciones que observamos en nuestra vida diaria incluyen el oxígeno atmosférico (O2), por lo que pueden evitarse o reducirse si se impide el contacto de este gas con las sustancias o materiales con los que reacciona.
3. Analicen sus resultados: • ¿Qué creen que ocurrió al calentar el
papel? • ¿Qué tipo de cambio observaron: físico o
químico? ¿Por qué? • Si consideran que es un cambio químico,
¿pueden identificar los reactivos? 4. Con ayuda de su maestro, discutan en
el grupo sobre lo que pasa con el ácido ascórbico al calentarlo. Concluyan sobre el tipo de cambio que se lleva a cabo y las sustancias que intervienen.
En la actividad anterior se utilizó jugo de limón como tinta invisible que se revela con el calor de la flama. En el proceso de revelado de esta tinta se lleva a cabo una reacción química entre el ácido ascórbico (vitamina C que se encuentra en el jugo de limón), que es incoloro, y el oxígeno (O 2) del aire, generando un compuesto colorido que nos permite leer el mensaje escrito en el papel. En nuestra vida cotidiana existen muchas otras reacciones en las que interviene el oxígeno como uno de los reactivos; tal es el caso de la oxidación de la manzana (figura 15), la respiración, la combustión y la corrosión u oxidación de los metales. Todas estas transformaciones parecen no tener nada en común, porque mientras la combustión de una hoja de papel es muy rápida, la corrosión de un clavo de hierro puede tomar meses; sin embargo, en ambas reacciones la molécula de oxígeno se rompe y sus átomos se combinan con los materiales con los que reacciona. Al hacerlo con el clavo, por ejemplo, se genera óxido férrico (Fe2O3), mientras que con el papel se producen dióxido de carbono (CO2) y agua (H2O).
218
QUIMICA book 2020.indb 218
28/04/20 1:33