

Síntesis
de noticias veterinarias
Órgano de difusión del Consejo Profesional de Médicos Veterinarios | Edición Nº 65 - Abril 2024
SUMARIO
Autor: Vet. Esp. Pablo Regner
Autor: Dr. Eduardo Jorge Boeri
Vet. Esp. Pablo Regner
Autor: Dr. Federico Bondone
Autores: Vet. Jimena Vidal, María Inés Ardiles, Vet. Christian Javier Durán
CENTROS DE RESCATE DE FAUNA SILVESTRE COMO SITIOS CLAVE EN LA ALERTA TEMPRANA PARA LA SALUD GLOBAL DEL ECOSISTEMA
Autor: M.V. Juan Carlos Sassaroli
EL BIENESTAR ANIMAL JUSTIFICA LA PROHIBICIÓN DEL SACRIFICIO RELIGIOSO
Autor: Página 12
LOS GUANACOS SON UNA PLAGA EL QUE LO DICE LO ES...
Autor: Sorex de Scripto.
VIAJE SEGURO EN AUTO, EL APRENDIZAJE Y LA SUJECIÓN HACEN LA DIFERENCIA
Autor: Dra. Silvia I. N. Vai
CONTROL DE ZOONOSIS, “PROHIBIR EL COMERCIO DE VIDA SALVAJE SOLO LO LLEVARÍA A LA CLANDESTINIDAD”
Autor: Diario Veterinario ...
NOTICIAS INSTITUCIONALES
Autor: C.P.M.V...
LEYNACIONAL14.072
CONSEJO DIRECTIVO
Presidente
Dra. Viviana L. Azas
Vicepresidente 1º
Dr. Ignacio A. Ojeda Bonillo
Vicepresidente 2º
Dra. Silvia Irene N. Vai
Secretaria
Dra. Andrea Viviana Zacuto
Prosecretaria
Dra. Adriana M. Betti
Tesorero
Dr. Enrique Héctor Bernard
Protesorero
Dr. Horacio A. Repetto
Vocales Titulares
Dr. Fernando A. Ruiz
Dr. Gabriel L. Cicuttin
Dra. María Inés Diez
Dr. Oscar De Gregorio
Dr. Alejandro D. Monteverde

Queridos Colegas:
ES UN ORGULLO Y UNA ENORME RESPONSABILIDAD PARA MÍ, ASUMIR LA PRESIDENCIA DE ESTE HONORABLE CONSEJO PROFESIONAL EN UNA NUEVA GESTIÓN.
AGRADEZCO A LA DRA. A. TORTOSA Y A SU EQUIPO, TODO LO REALIZADO CON TANTO ESMERO Y PROFESIONALISMO
HASTA ACÁ EN POST DE MEJORAR DÍA A DÍA LA PROFESIÓN
VETERINARIA Y TODOS LOS LOGROS QUE CON MUCHO ESFUERZO SEGURAMENTE FUERON CONSIGUIENDO.
Vamos a continuar en ese camino de progreso, de fortalecimiento de los lazos interinstitucionales ya conseguidos y vamos por muchos más.
Trabajar dentro de una comunidad integrada en todos sus aspectos es la manera de avanzar, y mejorar nuestra tarea. Vamos por mas BIENESTAR ANIMAL en todos los aspectos, por una mayor participación como profesionales de la salud en todo lo que tengamos incumbencias para desenvolvernos, en el seguimiento estricto en todo lo que son las enfermedades zoonóticas que tantos problemas actualmente están provocando en la sociedad, sabemos que estas son aproximadamente el 60% de las enfermedades hoy, de los humanos, en donde nuestra labor es más que necesaria, porque atendiendo la salud de nuestros pacientes, estamos mejorando y cuidando la salud humana en muchos aspectos. Vamos por mas charlas, encuentros, cursos y demás actividades para los matriculados.
En el nuevo contexto en donde estamos actualmente inmersos, con los avances científicos y tecnológicos, no nos podemos quedar atrás, hay que incentivar la actualización y el perfeccionamiento permanentemente, en un mundo que no para de crear nuevos horizontes, donde es nuestro deber también proponer la actualización de la currícula de nuestros egresados de las distintas universidades del país, promover la actualización del plan de estudio ayornarse al nivel más alto, superador , en post que los futuros egresados universitarios estén a la altura de los avances científicos y tecnológicos de esta era que vivimos.
Es la nuestra, una profesión que abarca múltiples campos de
actividades, desde la camilla, la salud pública, la alimentación humana y la alimentación animal, la investigación, laboratorios, docencia, medio ambiente, fauna, etc., un sinfín de campos de acción en donde debemos estar presentes y prepararnos cada vez más para este enorme desafío.
En otro orden de cosas, vamos a tener la satisfacción en nuestra gestión, de inaugurar la sede que actualmente se encuentra aún en obras por poco tiempo más y que después de tantos años de mucho esfuerzo entre todos, estamos terminando para brindarles a los matriculados un lugar como se merecen, que puedan disfrutar de ella y llevar a cabo allí distintas actividades que sin dudas vamos a ir incorporando para que todos puedan disfrutarlo y encuentren un espacio para las distintas actividades y propuestas que quieran acercar.
El esfuerzo fue de todos,……. los logros serán entonces para todos.
En este momento socioeconómico por el que estamos atravesando como país, debemos aunar nuestros deseos, esfuerzo, trabajo y las mejores propuestas para poder hacer que nuestra actividad diaria desde lo profesional y lo humano, se destaque y sea más que útil, no solo para nuestros pacientes sino también para los colegas y para la sociedad toda.
Sigamos trabajando codo a codo todos los días, poniendo siempre lo mejor de nosotros con profesionalismo, respeto, solidaridad y siempre con ética.
Me comprometo a darlo todo en esta etapa. Gracias por el apoyo y acá estoy para recibir los cada vez que necesiten acercarse para lo que sea. Las puertas de este Consejo están siempre abiertas para toda la comunidad veterinaria, no duden en participar o acercarse.
A seguir trabajando y creciendo, colegas.
La única batalla que se pierde irremediablemente, es la que se abandona. ¡Sigamos juntos para adelante y vayamos por más!!
Mi más afectuoso saludo, a TODOS.
Dra. Viviana L. Azas
Presidente - CPMV
Vocales suplentes
Dra. María I. Buffoni Almeida
Dr. Jorge O. Casim Abdala
Dr. Ricardo A. Di Lisio
Dr. Marcelo G. Giangreco
Dr. Juan M. Catoyra
Dra. Mariel Mirta Guy
Dr. Joaquín Mestre
Dra. Adriana I. Moirón
Dr. Juan C. Sassaroli
Dr. Alberto J. Vasalo
Dr. Federico Bondone.
COMISIONES AUXILIARES
Alimentos
Presidente:
Dra. Mariana Buffoni Almeida Salud Pública
Presidente:
Dr. Gabriel Cicuttin
Secretario:
Dr. Juan Carlos Sassaroli
Veterinarios especialistas en Pequeños Animales
Presidente:
Dra. Andrea V. Zacuto
Bienestar Animal
Presidente:
Dra. Silvia Irene Vai
Secretaria:
Dra. Marcela Haydee Valiña
Animales de Compañía no convencionales y Fauna Silvestre
Presidente: M.V Ricardo Di Lisio
Secretario: M.V. Juan C. Sassaroli
COMISIONES ITINERANTES
Animales de Laboratorio
Presidente:
Dra. Snitcofsky Marina
Secretario:
Dr. José M. Lucero Schmidt.
Especialidades Veterinarias
Presidente:
Dra. Florencia Sierra
Secretaria:
Dra. Andrea Zacuto
Género y Discapacidad
Presidente: Dra. Mariana Buffoni
Secretaria: Dra. Marcela Valiña
Equinos
Presidente: Dr. Fernando A. Ruiz
Secretaria: Dra. María V. Cortabarria Anguera
Petauro del azúcar
Petaurus breviceps

NOMBRE CIENTÍFICO:
Petaurus breviceps (Waterhouse, 1839). Esta especie se encuentra hace unos años en revisión taxonómica, ya que varias de sus subespecies conocidas ( P. b. breviceps, P. b. longicaudatus, P. b. ariel, P. b. flavidus, P. b. papuanus, P. b. tafa y P. b. biacensis ) se propusieron para pasar a ser especies, lo que cambiaría su estatus biológico y, muy posiblemente, su listado en CITES. Para facilitar su descripción y considerando que bajo condiciones controladas se encuentran híbridos de las diferentes subespecies, los datos que veremos a continuación son generalidades referidas a la especie.
NOMBRE COMÚN:
Petauro, Petauro del azúcar, Sugar glider, Lesser gliding opossum, Short-headed glider.
ESTATUS BIOLÓGICO:
IUCN: Preocupación Menor (LC)
CITES: No listado
Hábitat natural
Esta especie se distribuye por Indonesia desde las Islas Molucas (como límite oeste) hasta la Isla de Nueva Guinea (Indonesia/Papúa Nueva Guinea) e islas adyacentes (Papúa Nueva Guinea). A su vez, la encontramos en todo el norte y este de Australia, así como en Tasmania, donde ha sido introducida y ya existen poblaciones establecidas.
Habitan principalmente bosques primarios y secundarios de climas templados, subtropicales o tropicales. También se pueden encontrar en zonas de sabana seca. Tienen la capacidad de adaptarse a zonas más antropizadas, como plantaciones artificiales o bosques urbanos de zonas rurales.
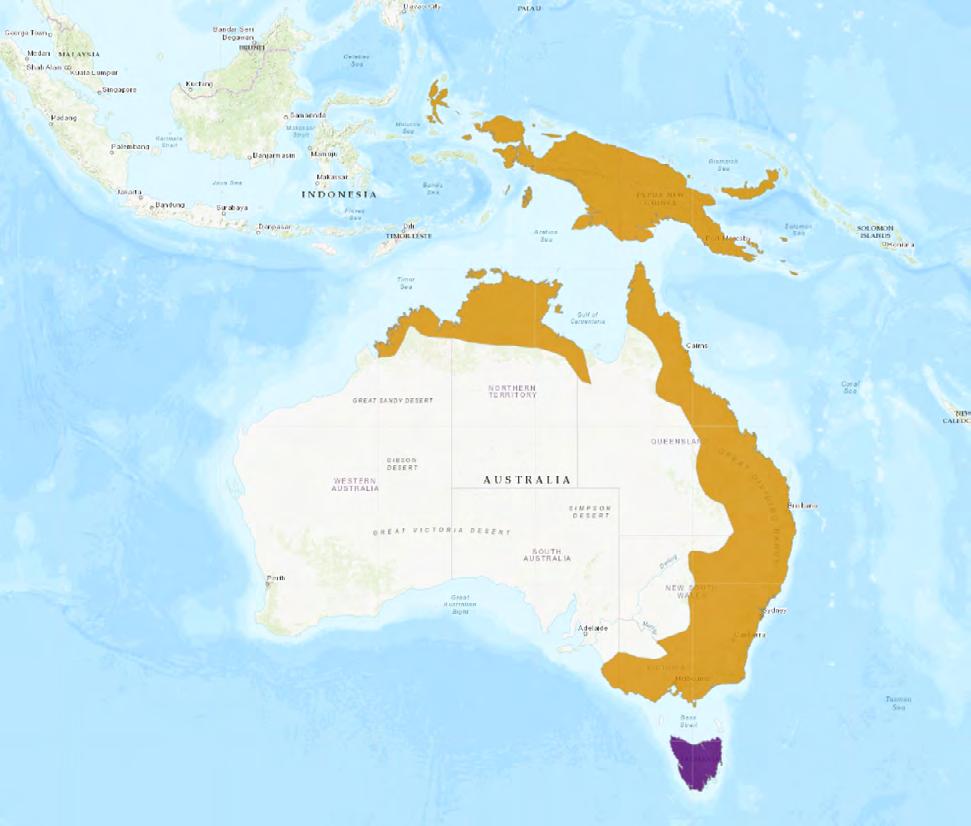
EXANT (RESIDENT) PRESENCE UNCERTAIN
Gráfico: IUCN (International Union for Conservation of Nature) 2008. Petaurus breviceps. The IUCN Red List of Thretened Species. Version 2023-1
Hábitos
Los petauros son arborícolas, utilizando madrigueras y agujeros en los árboles como refugio. Son de hábitos nocturnos, encontrándose la mayor parte del día dormidos. Son animales que naturalmente viven en comunidades o clanes con estratos sociales y son muy territoriales. Características anatómicas y fisiológicas
Poseen una longitud total de 30-40 cm en promedio, siendo la cola la mitad de su longitud. Su peso varía entre 80-170 gr, siendo el macho de mayor tamaño que la hembra (80-140 gr la hembra, 100-170 gr el macho). El cuerpo esta recubierto por un manto piloso abundante, con una coloración nominal grisácea en dorso y cola, mientras que su zona ventral es de color crema claro. Desde la frente hasta la base de la cola, se extiende una franja gris oscura característica. Más allá de esta coloración nominal, hay que saber que existen razas o fases, las cuales son mutaciones, que se buscan por selección artificial, generando cambios en las coloraciones y patrones del manto (ej: leucístico, albino, cara negra, cara blanca, etc.). A cada lado del cuerpo poseen una membrana, denominada patagio, que se extiende desde el quinto dedo de la mano hasta el pulgar del pie, y que tiene la función de aumentar su superficie al momento de saltar de un árbol a otro. De esta manera, y junto con la cola que actúa como timón estabilizador, puede llegar a realizar vuelos de hasta 55 m hacia un punto definido. Dado que son marsupiales, en la hembra vamos a encontrar en su zona ventral el marsupio correspondiente el cual posee en su interior cuatro mamas. A su vez, también poseen dos vaginas y dos cuellos de útero separados, que están directamente relacionados con el aparato reproductor del macho el cual posee un pene bifurcado y un escroto péndulo que se encuentra en craneal del pene. Ambos sexos poseen una cloaca en la que confluyen los conductos finales de los aparatos urinario, digestivo y reproductor. Los machos tienen tres glándulas marcatorias, una en la parte superior de la cabeza, la cual forma una zona alopécica cuando llega a su madurez, otra en el pecho, que suele generar una decoloración en el área (anaranjado/ocre) y la última, en el área anal (paracloacal). Mientras que la hembra posee pequeñas glándulas relacionadas con el marsupio y otra paracloacal. Sus incisivos están claramente adaptados a su dieta, ya que tienen forma de gubia, con el fin de rasgar y perforar ramas, siendo su fórmula dentaria I 3/2, C 1/0, PM 3/3, M 4/4. Poseen ojos muy grandes y separados, con retina avascular, los cuales están adaptados a la visión nocturna. La esperanza de vida promedio es de 12-14 años.
Alimentación
Los petauros son omnívoros especializados, en naturaleza su alimentación se basa en sabia, néctar, polen, melaza (árbol e insectos), invertebrados y pequeños vertebrados. Bajo condiciones controladas debemos ofrecerles balanceado para petauro o “insectívoro” (chequear origen, composición y aprobación oficial del mismo) o una variedad seleccionada de insectos de criadero, a estos le debemos sumar otros ingredientes como néctar, frutas, verduras y polen. No existe una dieta comercial completa para los mismos. La dieta debe ser lo más variada posible ya que al ser consumidores “selectivos” suelen dejar de comer si el alimento los aburre y al ofrecer variedad es menos probable que esto suceda. A su vez, la dieta debe poseer menos calorías de las que consume un animal en vida libre, ya que no van a tener el desgate calórico generado por la continua búsqueda de la comida. Consumen alrededor del 17-25% de su peso vivo diariamente, y se aconseja que la composición centesimal de la dieta este conformada por un 16-20% de proteínas, 2,5-4,5% de grasas, un 10% de fibra y 55-65% de carbohidratos. Deben tener agua filtrada ad libitum .
Reproducción
Es una especie poliéstrica estacional con un ciclo estral de 29 días. La madurez sexual es ligeramente diferente entre machos y hembras. Los machos alcanzan la madurez entre los 10 y 15 meses, mientras que las hembras necesitan entre 8 y 12 meses. Luego de la cópula la gestación se extiende por 16 días, momento en el cual se produce la parición y la cría se desplaza hasta la bolsa marsupial para su posterior desarrollo. Este recorrido lo realiza mediante la ayuda de la madre que va lamiendo el camino a realizar y por la presencia de un arco cartilaginoso, que poseen las crías en su cintura escapular y que le proporciona apoyo. Una vez en el marsupio, la cría se adhiere al pezón de la madre y se mantiene en esa posición durante 65-75 dias aproximadamente. Una vez cumplido este tiempo, la cría comenzará a realizar salidas intermitentes del marsupio durante 50-60 días, momento en que se destetará, pero seguirá con la madre y bajo sus cuidados hasta cumplir otros dos meses aproximadamente. En general tienen una o dos crías, pero puede llegar a tener cuatro. Una característica de esta especie es que realiza ciclos estrales post parición, pudiendo tener una preñez mientras tiene otra/s cría/s en el marsupio, pero de suceder esto, esta nueva preñez se pausa hasta que el marsupio queda disponible.
Manejo bajo condiciones controladas

Hay que recordar dos características particulares de los petauros para su manejo bajo condiciones controladas, una es que son arborícolas, por lo que se movilizan trepando y saltando y la otra, es que conviven en clanes, por lo que el tamaño y la disposición del terrario es crucial. Los mismos debe ser más altos que anchos y largos, para permitir el deambular en forma vertical. A modo de ejemplo, un recinto de 50 cm x 50 cm x 75 cm de altura es el mínimo para albergar una pareja, mientras que si requerimos un espacio para un pequeño grupo de entre 6-7 individuos, deberíamos estar pensando en un recinto o habitación de 2 m de lado x 2 m de altura. Debe poseer suficientes espacios y refugios para que todos los miembros del clan puedan tener su territorio y, de esta manera, evitar agresiones interespecíficas o estrés crónico. Como son animales muy activos se les debe ofrecer una gran variedad de juguetes, de preferencia colgantes al igual que los refugios. Siempre que se les coloque túneles, ruedas, aros, ramas, plataformas, perchas, cuerdas, etc. además de ser hechas con materiales no tóxicos e irrompibles, se debe tener la precaución de que los mismos no puedan generar el atrapamiento de un individuo o de alguno de sus miembros o cola, generando traumatismos severos. La temperatura óptima se encuentra entre 23-27°C, los petauros tienen gran dificultad en soportar las temperaturas bajas y muchas probabilidades de tener un golpe de calor por temperaturas altas, motivo por lo cual, es recomendable que se encuentre en un ambiente con temperatura controlada para mantener la misma estable a lo largo del año. También son grandes escapistas por lo que los recintos deben poseer un cierre doble o de seguridad para evitar escapes y se recomienda que la malla sea menor a ½ pulgada si se alojan adultos o menor a ¼ pulgada si se alojaran crías. Con esto se busca que no exista riesgo de que pasen la cabeza y queden atrapados entre los barrotes. El recinto debe tener varios accesos, de tal manera que, al abrirlos, se pueda llegar a todos los rincones del mismo para facilitar tanto la limpieza como si fuera necesario, la captura de uno de los individuos. Debe asegurarse la higiene y desinfección regular de la jaula, así como de todos los complementos. Se debe proporcionar iluminación adecuada, replicando el ciclo día-noche con una amplitud acorde al ciclo lumínico natural, la iluminación natural puede ser beneficiosa para regular su ciclo biológico.
Se debe ofrecer una dieta variada y equilibrada (ver alimentación). A su vez, y dada su territorialidad, es recomendable que existan varios comederos y bebederos a diferentes alturas y en diferentes espacios para evitar las peleas y la aparición de anorexia por agresión.
Se debe realizar un manejo y socialización de los individuos. A los petauros no les gusta que los agarren, si no se realiza un manejo previo, seguramente, al contacto morderán. Esto se realiza de manera regular y con movimientos suaves para acostumbrar a cada individuo a la presencia y manejo humano. Esto ayuda a reducir el estrés y facilita procedimientos veterinarios. Más allá de esto, cada individuo tiene sus límites individuales y algunos pueden tolerar el manejo más que otros, por lo que es importante respetar sus señales de incomodidad. Por otro lado, se debe prestar atención a un individuo que viva en soledad (cosa que no es recomendable), ya que al ser sociales suelen presentar signos de estrés crónico como automutilaciones por aburrimiento.
Parámetros clínicos:
frecuencia cardiaca: 200-300/min; frecuencia respiratoria: 16-40/min; temperatura: 36,5°C.
Patologías comunes:
Enfermedad Metabólica Ósea por hiperparatiroidismo secundario nutricional, la principal causa son dietas deficitarias en calcio o con mala relación Ca/P. Enfermedad odontológicas como odontolitiasis, caries o abscesos apicales, generadas por dietas blandas, con excesos de azúcares o por traumatismo con el alimento. Automutilación por alojamiento individual, estrés crónico o postquirúrgico. Laceraciones, fracturas o quemaduras por intentos de escape o por agresión interespecífica. Pasteurelosis. Giardiasis. Obesidad.

Control veterinario y vacunación:
Debido a sus características etológicas, es muy posible que para hacer un examen clínico completo se debe sedar al paciente. Para esto se puede utilizar una cámara con anestesia inhalatoria. Esta especie no posee ningún plan de vacunación. Se recomienda realizar un control clínico anual hasta los 8 años y luego cada 6 meses (incluir control odontológico). Se recomienda control coproparasitológico al ingreso al plantel y control ecográfico bianual a partir de los 6 años.
Zoonosis:
Los petauros son potenciales transmisores de Salmonella spp ., Citrobacter spp., Enterobacter spp., Klebsiella pneumoniae , Pseudomonas aeruginosa , Giardia spp., Leptospira spp . y Toxoplasma spp . Cuando nos referimos a su potencialidad es porque a pesar de padecer estas enfermedades o ser portadores de estos patógenos, los trabajos publicados de casos que confirman la transmisión a humanos es rara o inexistente.

Autor: Vet. Esp. Pablo Regner
Especialista en Medicina de Animales de Compañía No Convencionales y Fauna Silvestre. Miembro de la Comisión de Animales de Compañía No Convencionales y Fauna Silvestre (CENT-CPMV). Docente de la Cátedra de Producción, Manejo y Conservación de Fauna Silvestre (FCV-UBA) y de Recursos Faunísticos (FCVyA-USAL).
1. Allen M, Webb MH, Alves F, Heinsohn R, Stojanovic D. 2018. Occupancy patterns of the introduced, predatory sugar glider in Tasmanian forests. Austral Ecol. 43(4):470–475. doi: 10.1111/aec.12583
2. Campbell CD, Sarre SD, Stojanovic D, Gruber B, Medlock K, Harris S, MacDonald AJ, Holleley CE. 2018. When is a native species invasive? Incursion of a novel predatory marsupial detected using molecular and historical data. Diversity and Distributions24: 831–840.
3. Carboni D, Tully TN. 2009. Chapter 11 - Marsupials. In Manual of Exotic Pet Practice, Mitchell M and Tully T editors. W.B. Saunders. pages 299-325. https://doi.org/10.1016/B978-1416001195.50014-7.
4. Cremona T, Baker AM, Cooper SJB, Montague-Drake R, Stobo-Wilson AM, Carthew SM. 2021. Integrative taxonomic investigation of Petaurus breviceps (Marsupialia: Petauridae) reveals three distinct species, Zoological Journal of the Linnean Society , Volume 191, Issue 2, February, Pages 503–527, https://doi.org/10.1093/zoolinnean/zlaa060
5. Davey SM. 1984. Habitat preferences of arboreal marsupials within a coastal forest in southern New South Wales. In: Smith AP, Hume ID, editors. Possums and gliders. Sydney: Australian Mammal Society. p. 509–516.
6. Department of the Environment and Energy. 2022. Australian native plants and animals [Internet]. Canberra: Department of the Environment (Australian Government); [accessed 2023 Feb 16]. http:// www.environment.gov.au/biodiversity/wildlife-trade/natives .
7. Dierenfeld ES. 2009. Feeding behavior and nutrition of the sugar glider ( Petaurus breviceps ). Veterinary Clin North Am Exot Anim Pract. 12(2):209–215. doi: 10.1016/j.cvex.2009.01.014
8. Dierenfeld ES, Whitehouse-Tedd KM. 2018. Evaluation of three popular diets fed to pet sugar gliders ( Petaurus breviceps ): intake, digestion and nutrient balance. J Anim Physiol Anim Nutr. 102(1):e193–e208. doi: 10.1111/jpn.12727.
9. Geiser F, Holloway JC, Körtner G. 2007. Thermal biology, torpor and behaviour in sugar gliders: a laboratory-field comparison. J Comp Physiol B. 177(5):495–501. doi: 10.1007/s00360-007-0147-6
10. Holloway JC, Geiser F. 2000. Development of thermoregulation in the sugar glider Petaurus breviceps (Marsupialia: Petauridae). J Zool. 252(3):389–397. doi: 10.1111/j.1469-7998.2000.tb00634.x
11. Johnson DH. 2011. Hedgehogs and sugar gliders: respiratory anatomy, physiology, and disease. Veterinary Clin North Am Exot Anim Pract. 14(2):267–285. doi: 10.1016/j.cvex.2011.03.006
12. Pignon C, Mayer J. Zoonoses of ferrets, hedgehogs, and sugar gliders. Vet Clin North Am Exot Anim Pract. 2011 Sep;14(3):533-49, vii. doi: 10.1016/j.cvex.2011.05.004
13. Salas, L., Dickman, C., Helgen, K., Winter, J., Ellis, M., Denny, M., Woinarski, J., Lunney, D., Oakwood, M., Menkhorst, P. & Strahan, R. 2016. Petaurus breviceps . The IUCN Red List of Threatened Species 2016: e.T16731A21959798. https://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T16731A21959798. en . Accessed on 02 March 2024.
14. Smith AP. 1982. Diet and feeding strategies of the marsupial sugar glider in temperate Australia. J Anim Ecol. 51(1):149–166. doi: 10.2307/4316
15. Tully TN, Mitchell MA. 2012. Chapter 7 – Sugar glider. In A Technician’s Guide to Exotic Animal Care. American Animal Hospital Association, Denver. Pages 179-205.
Diversidad de Brucella canis en Argentina según análisis MLVA 13Bc. Parte 2
Introducción:
El único antecedente de tipificación molecular de B. canis en Argentina es un trabajo reciente donde se utilizaron solo cuatro marcadores del panel 2B MLVA_16 para el estudio preliminar de 15 aislamientos de B. canis (Boeri et al., 2020). Por lo tanto, en el presente estudio se plantea caracterizar mediante MVLA_13Bc la diversidad genética de cepas de B. canis circulantes en Argentina en el contexto de la información global de variabilidad de este patógeno de acuerdo al
mismo esquema de tipificación molecular.
El objetivo del trabajo fue caracterizar mediante MVLA_13Bc la diversidad genética de cepas de B. canis circulantes en Argentina en el contexto de la información global de variabilidad de este patógeno de acuerdo al mismo esquema de tipificación molecular. La segunda parte sigue a partir de los resultados de cepas argentinas.
3.3) Genotyping of 97 Argentinan Brucella canis strains
En el presente estudio se analizaron de novo 97 aislamientos de B. canis de diferentes regiones de Argentina. La Fig. 3 muestra la distribución de las cepas Argentinas de acuerdo al origen geográfico del caso clínico.

Fig. 3 Mapa de Argentina indicando el origen de las cepas estudiadas. Los colores indican la región geográfica de las cepas analizadas: violeta: CABA, azul: Provincia de Buenos Aires, gris: Provincia de Tierra del Fuego, rojo: Provincia de Tucumán, marrón: Provincia de Córdoba, negro: Provincia de Santa Fe, naranja: Provincia de Buenos Aires localidad de Verónica, violeta oscuro: Provincia de Corrientes, amarillo: Provincia de Entre Ríos y naranja: Provincia de La Pampa.
Los esquemas de 13 y seis loci también fueron analizados en esta subpoblación de manera de estudiar posibles asociaciones geográficas de los aislados (Supplementary data Fig S1, Fig S2 MST 13 loci and MST 6 loci respectively). Como se muestra en la Figura 4A, en el análisis del esquema de seis loci con el criterio TLV se obtuvieron 11 CCs. Por otro lado, de manera de ahondar asociaciones más estrechas, la Figura 4B muestra la asociación de genotipos de acuerdo al criterio de DLV donde se obtuvieron 6 CCs. En este análisis se obtuvieron 84 singletons.


Fig. 4. Análisis de complejos clonales de cepas argentinas con el esquema de 6 loci . (A) CCs de acuerdo a TLVs. (B) CCs de acuerdo a DLVs. Los colores indican la procedencia de los casos clínicos que dieron origen a las cepas aisladas: azul: AMBA (Buenos. Aires.), violeta: CABA, negro: Santa Fe, marrón: Córdoba, naranja: Verónica (Buenos Aires), gris: Tierra del Fuego.
Se observan 11 CCs formados por cepas de CABA y Buenos Aires (provincia); uno de Córdoba, CABA y Tierra del Fuego; uno de CABA; uno de CABA y Santa Fe, uno de Bs. As., Córdoba y Verónica (Fig. 4A). Se obsevan 6 CCs formados por CABA, AMBA y Verónica (Fig 4B).
4) Discusión
El ensayo de Multiple Locus Variable-Number Tandem Repeats (VNTR) Analysis (MLVA) es bien conocido por su utilidad para el análisis de la epidemiología molecular y la asociación geográfica de aislamientos bacterianos. Los antecedentes más recientes de uso del esquema MLVA para B. canis incluyen los trabajos de Kang et al. (2011) y Di D et al. (2014), quienes utilizaron el esquema MLVA_16 desarrollado por Le Fleche et al. (2006), y Al Dahouk et al. (2007). En nuestro estudio se evaluaron mediante el esquema MLVA_13 Bc (específico para B. canis ) 101 cepas latinoamericanas, 213 norteamericanas (Yang et al., 2017) y 22 cepas de referencia depositadas en el Genbank por medio del análisis in sílico las que sumaron un total de 336 especímenes analizados. El protocolo original de MLVA_13 Bc desarrollado por Yang et al. (2017) involucra siete grupos de reacciones de PCR. Sin embargo, nosotros al utilizar la visualización de las bandas de PCR en geles de agarosa observamos la presencia de numerosas bandas inespecíficas, inconveniente que fue resuelto al reemplazar las dúplex PCR por las correspondientes para cada marcador (ver métodos). Los autores americanos utilizaron electroforesis capilar y tal vez esa sea la razón por la cual nosotros, al no tener acceso a esa tecnología, tuvimos el inconveniente nombrado anteriormente. A partir del análisis del esquema MLVA_13 Bc de la población total de cepas (n= 336) se obtuvo un valor de HDGI igual a 1 (IC95% 1-1), evidenciando la elevada variabilidad del esquema de tipificación en una escala global. Se realizó un enfoque de árbol de expansión mínimo para el análisis de relaciones filogenéticas de perfiles alélicos. Además, también se utilizó el algoritmo goeBURST, que utiliza las mismas reglas de agrupamiento que eBURST, para determinar las relaciones entre los perfiles (Francisco et al., 2012). Ambos enfoques de análisis mostraron que las cepas latinoamericanas eran mucho más diversas que las norteamericanas. En base a esta alta diversidad, seleccionamos seis de los 13 marcadores para analizar más a fondo las relaciones genotípicas tanto a escala global como regional. Para ello, seleccionamos seis de los loci más variantes según los valores de HDGI. Este nuevo esquema describió 328 genotipos entre 336 cepas con un índice HDGI de 0,97 (IC 95%: 95,84-99,39). Cabe señalar que estos seis marcadores con el HDGI principal en nuestro estudio fueron los mismos que Yang et al. (2017).
El estudio del MST de seis loci permitió observar que las cepas Latinoamericanas se mantienen en general terminales aunque se dispersan más (Fig. 2A). A diferencia del MST de 13 loci (Fig 1A),
se forman grupos de genotipos más diversos, es decir grupos de cepas Norteamericanas y Latinoamericanas. Al analizar ambos MST de 13 y seis loci se puede observar la similitud de ambos lo que haría especular respecto a que la reducción de 13 a seis loci es muy útil para el análisis de variabilidad de la especie, . De hecho, un trabajo reciente sugiere que analizar menos genes puede ser más útil a la hora de sacar conclusiones (Yapur et al., 2021).
Con el análisis de seis loci se pudo profundizar la relación entre los genotipos, siendo que este conjunto de marcadores presentaron el mayor poder discriminatorio del esquema MLVA_13 Bc. Por ejemplo, el MST de seis loci permite observar que el genotipo 134 de Japón se encuentra asociado el 31 de Chile. Esta unión se mantiene en el esquema de 13 loci, lo que demuestra una relación estrecha entre ambos (Fig 1A, Fig. 2A).
El análisis goeBURST basado en este esquema de seis loci reunió una colección más amplia de genotipos en un menor número de CC, lo que permitió profundizar el estudio de la relación de las cepas (Fig. 2B). En el caso de las cepas europeas, mantuvieron la dispersión con 13 y seis loci. Cabe mencionar que los genotipos 117 de Norteamérica y 334 de UK (europea) están muy relacionados dado que formaron un CC con el esquema de 13 loci (Burst) (Fig1B) y de seis loci (Burst) (Fig 2B). Estas dos cepas son muy diversas respecto al total pero conservan una relación muy cercana entre ambas e independiente del resto. Desafortunadamente, no se tienen datos epidemiológicos de estos especímenes que permitan ahondar respecto al origen de esta asociación de genotipos.
Si comparamos la distribución geográfica que presentaron Yang et al. (2017) en su publicación, es muy similar a la que tuvimos en nuestro estudio: las cepas estudiadas se conglomeraron en un área y luego se dispersaron a lo largo del país con pocos especímenes por lo cual, esta no sería la posible causa de la diversidad hallada en latinoamérica respecto a norte américa. Esta diferencia respecto a la mayor diversidad de cepas de latinoamérica, podría deberse a distintas políticas sanitarias en el manejo de animales positivos y los métodos de aislamiento bacteriológico. Por ejemplo, en nuestro estudio se obtuvieron cepas a partir de hemcoultivos y urocultivos a diferencia de Yang et al. (2017) donde lo hicieron solo a partir de hemocultivos. De este modo se podría estar limitando la chance de aislar el microorganismo. Por otro lado, quizá el
monitoreo sanitario más estricto en nortemaérica podría ser otra causa de esa menor diversidad. Además, al haber menor diversidad, la formación de CCs presenta genotipos más relacionados y estables respecto a las cepas más diversas de norteamérica.
Este trabajo representa la primera caracterización molecular descripta en Argentina de B. canis por medio del ensayo de MLVA. Para analizar la relación entre cepas argentinas, se evaluó el esquema de seis loci por ser los más variables. Se realizó el algoritmo geoBURST por medio del TLV (Fig.4A) y DLV (Fig.4B).
Con el esquema de seis loci, el CC formado por los genotipos 116, 150 y 108 (CABA, Córdoba y Tierra del fuego respectivamente) presenta un análisis interesante: se podría considerar que estos tres genotipos poseen una mejor capacidad para adaptarse a diferentes entornos (conocido como fitness) ya que estas tres localidades se encuentran a largas distancias y además las condiciones climáticas de esas regiones son considerablemente diferentes (Fig. 4A). Esto podría deberse al movimiento de perros a través del país sin legislación que obligue a tener
testeos para esta enfermedad. El análisis de DLV permite observar que los seis CCs permanecen unidos al restringir un loci más lo que significa una fuerte unión entre esos genotipos/cepas (Fig. 4B).
El análisis de nuestro estudio permite concluir lo siguiente:
Existe diversidad genética en las cepas circulantes de Argentina y no se observó asociación geográfica. Además, al no haber estudios anteriores en Argentina y la región (solo Boeri et al., 2020 analizando 15 cepas con 4 marcadores y Vicente et al., 2018 por medio de WGS no MLVA), no fue posible comparar resultados. Los marcadores utilizados en el MLVA_13 Bc son muy variables y no aportan mucha información poblacional. Frente a tanta diversidad observada en Argentina, sería importante a futuro, realizar un ensayo de MLST.
Por último, nuestro estudio permite proponer además la genotipificación de B. canis mediante el empleo de un panel reducido denominado MVLA_6 Bc.
Autor: Dr. Eduardo Jorge Boeri Matricula 6907
Médico Veterinario
Magister en Microbiología Molecular
Instituto de Zoonosis Luis Pasteur C.A.B.A
Departamento Biológico
División Inmunología y Diagnóstico
Diagnóstico molecular de Brucelosis canina
INVESTIGACIÓN Y DESARROLLO FARMACÉUTICO:
LA FACETA MENOS CONOCIDA DE LA FAUNA SILVESTRE
Vet. Esp. Pablo
Regner
Introducción:
Generalmente, cuando pensamos en fauna silvestre desde un punto de vista veterinario, nuestra mente se dirige hacia diferentes lugares comunes como la medicina de la conservación, las enfermedades emergentes y remergentes o hasta producciones alternativas pero pocas veces, por no decir nunca, pensamos en la importancia que tiene la fauna silvestre para la medicina humana. Este hecho, tal vez tenga que ver con que, en el colectivo imaginario, la idea del uso de estas especies animales nos remonta a la medicina tradicional de países orientales y africanos, a la medicina ayurvédica o directamente a la brujería, todas situaciones que con poco o nada de sustento, generaron, y generan, la captura indiscriminada de individuos de diferentes especies llevando a algunas hasta su extinción. Pero en este ámbito no todo es superchería, sino que existe una gran cantidad de líneas de investigación, con sólidos fundamentos científicos, que llevaron (y llevarán) al desarrollo de productos farmacéuticos innovadores y necesarios por mejorar la calidad de vida de los humanos y animales y que originalmente partieron de una molécula perteneciente a una especie silvestre. A continuación, veremos algunos ejemplos de esto.
Inhibidores de la enzima convertidora de angiotensina (IECA’s)
Posiblemente, el puntapié en la historia de esta relación entre la fauna silvestre y los fármacos comenzó hace poco más de 50 años cuando el equipo liderado por Sergio H. Ferreira descubr ió un factor potenciador de bradiquinina (BPF) proveniente del veneno de la serpiente Bothrops jararaca y posteriormente, lo sintetiz ó creando el BPP5a (Ferreira y col., 1965; Green y col., 1970; Stewart y col., 1971). Este péptido tenía la función dual de ser inhibidor de la degradación de bradicinina (un potente vasodilatador) e inhibidor de la biosíntesis de angiotensina (un potente vasoconstrictor), pero tenía la complejidad de no ser estable en su administración oral. Esto llevó a nuevos estudios por parte del equipo de Ondetti y Cushman (Instituto Squibb), buscando un producto más potente y estable para administrar por vía oral, dando como resultado la obtención del Captopril (Cushman y col., 1973; Ondetti y col., 1977), el cual fue liberado al mercado en 1981, siendo el primer fármaco derivado de animales de fauna silvestre aprobado por la U.S. Food and Drug Administration (FDA) de la historia. El Captopril es, posiblemente, una de las drogas más utilizada a nivel mundial y la que abrió la puerta a otros inhibidores de la ECA, como el
Enalapril (1984), el Quinapril (1991) y el Fosinopril (1991) entre otros.
Peptidos antimicrobianos (PAM’s)
Cursaba el año 1945 y Sir Alexander Fleming recibía el premio Nobel en Medicina por el descubrimiento de la penicilina. En su discurso, se explay ó sobre sus hallazgos y sus beneficios, pero llegando al final, nos dejó una importante advertencia:
“Puede llegar el momento en que cualquiera pueda comprar penicilina en las tiendas. Luego está el peligro de que un hombre ignorante pueda fácilmente subdosificarse y exponer sus microbios a cantidades subletales de la droga haciéndolos resistentes a la misma” (Fleming, 1945).
Este vaticinio del padre de los antibióticos comenzó a ser realidad en la década del 80, creci ó en forma exponencial desde ese momento hasta el día de la fecha y se transform ó en una de las mayores problemáticas sanitarias de estos tiempos (OMS, 2016). En respuesta a esta situación, comenzó la carrera por el desarrollo de nuevos antibióticos y acá es donde nos encontramos con los péptidos antimicrobianos (PAM ´s ). Los PAM´s son moléculas formadas generalmente por menos de 50 residuos aminoacídicos, las cuales son producidas por
diversos organismos como parte de su sistema inmune para prevenir la infección por bacterias y otros microorganismos patógenos (Yan y col., 2021). Se caracterizan por poseer amplio espectro de actividad contra diversos microorganismos como hongos, virus y bacterias, rápida actividad, menor toxicidad y selectividad celular (Datta y Roy, 2021). En la actualidad existen más de
3000 PAM´s en diferentes fases de prueba o ya en comercialización. La mayor parte los mismos provienen de plantas, bacterias y animales domésticos, pero existe una gran cantidad que se aislaron a partir de diferentes especies de la fauna silvestre. En la Tabla 1 vemos algunos ejemplos de estos, indicando cuál es su especie de origen y sobre quienes actúan.
Tabla 1: PAM´s derivados de diferentes especies animales
Fuente animal Nombre del péptido Actividad farmacológica contra
Phormia terranovae
Hylophora cecropia
Hyalophora cecropia
Pandinus imperator
Pandinus imperator
Hadrurus aztectus
Opistophtalus carinatus
Defensina
Attacina
Cecropina
Scorpina
Pandinin 1
Pandinin 2
Hadrurina
Opistoporin 1 y 2
Parabuidetus schlechteri Parabutoporin
Bactridina-1
Tityus discrepans
Bombina orientalis
Xenopus laevis
Phyllomedusa sauvagii y otras especies de los géneros Phyllommedusa y Agalychnis
Naja atra
Bungarus fasciatus
Ophiophagus hannah
B. fasciatus
Bactridina-2
Péptidos Bombesina simil
Magainina
Dermaseptina y péptidos dermaseptina simil (Grupo dermaseptina)
NA-CATH
BF-CATH
OH-CATH
Cathelicidina-BF
Bacterias grampositivas
E. coli
E. coli
K. pneumonia
E. faecalis, B. subtilis, S. epidermidis and S.aureus
S. aureus, B. subtilis,E. faecalis y S. epidermidi
K. pneumoniae, E. coli, S. typhimurium, S. marcescens y P. aeruginosa
Bacterias grampositivas, gramnegativas y hongos
Bacterias gramnegativas y hongos
M. luteus, B. subtilis, Y. enterocolitica, E. faecalis, A. calcoaceticus y P. aeruginos
E. faecalis, A. calcoaceticus, B.subtilis, M.luteus, P. aeruginosa y Y. enterocolitica
Bacterias grampositivas, gramnegativas y hongos
Bacterias grampositivas, gramnegativas, hongos y protozoarios
Bacterias grampositivas, gramnegativas, hongos filamentosos, levaduras, protozoarios y virus
Bacterias grampositivas, gramnegativas y Biofilms
Bacterias grampositivas y gramnegativas
Bacterias grampositivas y gramnegativas
Bacterias grampositivas, gramnegativas, hongos y antitumoral
Pseudonaja textilis
Crotalus durissus terrificus
Bothrops atrox
Bothrops lutzi
Lachesis muta rhombeata
Hydrophis cyanocinctus
Python bivittatus
Sinonatrix annularis
Oxyuranus microlepidotus
Emys orbicularis
Pelodiscus sinensis
Pt_CRAMP1
Pt_CRAMP2
Crotalicidina
Crotamina
Batroxicidina
Lutzicidina
Lachesicidina
Hc-CATH
CATHPb1
SA-CATH
Omwaprin
TBD-1
Pelovaterina
Struthio camelus Ostricacina (OSP-1, 2, 3 y 4)
Bacterias grampositivas y gramnegativas
Bacterias grampositivas y gramnegativas
Bacterias grampositivas, gramnegativas, hongos y antitumoral
Bacterias grampositivas, gramnegativas, hongos y antitumoral
Bacterias grampositivas, gramnegativas y parásitos
Bacterias grampositivas y gramnegativas
Bacterias grampositivas y gramnegativas
Bacterias grampositivas, gramnegativas y hongos
Bacterias grampositivas, gramnegativas, S. aureos resistente a Meticilina (SARM) y a Vancomicina (SARV), hongos y Biofilms.
Bacterias grampositivas, gramnegativas, hongos y Biofilms.
Bacterias grampositivas
Bacterias grampositivas, gramnegativas y hongos
Bacterias gramnegativas
E. coli O157:H7, S. aureus SARM y C. albicans
(Fuente: van Hoek, 2014; Bartels y col., 2019; de Barros y col., 2019; Bin Hafeez y col., 2021; Datta y Roy, 2021)


Pandinus imperator
Bombina orientalis
Antineoplásicos
El cáncer es una de las principales causas de muerte en los humanos y un obstáculo importante para aumentar la esperanza de vida en todos los países del mundo (Sung y col., 2021). Es generalmente más prevalente en adultos mayores de 50 años, pero la incidencia del cáncer de aparición temprana (<50 años) ha aumentado en las últimas décadas en todo el mundo (Ugai y col., 2022). Las principales causales de esto, se atribuyen a los cambios en la dieta, el estilo de vida y el medio ambiente generados desde mediados del siglo XX, que dieron lugar a mayores tasas de obesidad, inactividad física, dietas occidentalizadas y contaminación ambiental, a esto podríamos sumar el aumento del consumo de alcohol, el tabaquismo y las exposiciones perjudiciales durante el embarazo (Zhao y col., 2023). Al igual que observamos con el aumento de la resistencia bacteriana, ante el surgimiento de una problemática sanitaria existe una respuesta directamente proporcional por intentar resolverla y en este caso, la industria farmac éu tica, no se ha quedado atrás. Hacía finales de siglo XX y luego de décadas de investigación y desarrollo, se contaba con alrededor de 70 drogas aprobadas
para el tratamiento de diferentes neoplasias. Pero este proceso se aceleró de manera exponencial desde los primeros años del siglo XXI, llegando a desarrollarse, tan solo entre 2000-2014, 63 nuevos fármacos con esta finalidad (Savage y Mahmoud, 2015). Actualmente, los compuestos químicos sintéticos que se utilizan para el tratamiento del cáncer van acompañados de efectos secundarios graves, como vómitos, pérdida de cabello, disminución de peso y deterioro funcional de los órganos. Por lo que se está realizando un cambio de dirección en la terapéutica tradicional, buscando desarrollar terapias moleculares, las cuales no poseen citotoxicidad contra los órganos no afectados y muy pocos efectos colaterales en general (Park y col, 2002). Volviendo a nuestro sitio de interés, varios de estos productos derivan de especies de fauna silvestre. En la tabla 2 podemos observar que algunos de estos se encuentran en las etapas iniciales de su investigación, donde se están evaluando como extractos, lisados de órganos, plasma entero o fracción de veneno, pero en otros casos, contamos con la producción sintética del péptido aislado originalmente y ya se encuentran en diferentes fases de los ensayos clínicos.
Tabla 2: Antineoplásicos derivados de diferentes especies animales
Fuente Animal Nombre del péptido
Dolabella auricularia
TZT-1027 (Soblidotina)
Dolastatin 10
Aplidium albicans Plitidepsina
Halichondria okadai Halichondrina B (Eribulina)
Hyalophora cecropia Cecropina
Cryptotheca crypta C-nucleoside (Cytarabina)
Jorunna funebris Jorumycina (Zalypsis)
Mecanismo de acción Tipo de cáncer
Anti-angiogenesis / Inducción de la apoptosis, durante la división celular, mediante interferencia de microtúbulos
Inducción de la apoptosis, durante la división celular, mediante interferencia de microtúbulos
Inhibición de CXCL12 liberada por NLC´s
Inducción de la apoptosis, durante la división celular, mediante interferencia de microtúbulos
Permeabilización de la membrana / Apoptosis
Cáncer de cólon / Cáncer de pulmón
Cáncer de cólon / Cáncer de pulmón / Cáncer de próstata
Leucemia linfocítica crónica
Cáncer de mama / Liposarcoma
Leucemia / Linfoma / Cáncer de vejiga /
Inhibición de la sintesis de ADN Leucemia
Inducción de la apoptosis via detención del ciclo celular en fase G1
Cáncer de cólon / Cáncer de pulmón / Leucemia
Xenopus laevis Magainina
Phyllomedusa spp.
Dermoseptina B2, B3, PH
Polisacáridos sulfatados
Gekko swinhonis
Extracto acuoso
Polvo
Gekko japonicus
Cyrtopodion scabrum
Extracción alcohólica de péptidos
Permeabilización de la membrana Cáncer hematológico
Permeabilización de la membrana Cáncer de prostata
Inhibición de la proliferación y diferenciación
Inhibición de crecimiento / Reducción en la Alfafetoproteina
Inducción de la apoptosis vía reducción de la expresión de VEGF y bFGF
Inducción de la apoptosis mediante regulación de la vía Bcl-2-Bax / Reducción en la expresión de VEGF.
Cáncer de hígado
Cáncer de hígado
Carcinoma de esófago / Sarcoma
Cáncer de hígado
Mezcla de polipéptidos
Extracción alcohólica (Etanol)
Eublepharis macularius
Extracto acuoso
Inducción de la apoptosis / Promoción de los procesos relacionados con EROs y UPR
Inhibición del crecimiento y migración
Inducción de la apoptosis via inhibición de la señalización de PI3K/ Akt / Inducción de la apoptois dependiente de caspasas por arresto celular en la fase G2/M.
Cáncer de hígado
Cáncer de colon / Cáncer de mama
Cáncer de vejiga / Cáncer de cuello uterino / Cáncer de pulmón
Colina de cocodrilo
Inducción de la apoptois por arresto celular en la fase G2/M.
Cáncer de estómago
Crocodylus siamensis
Extracto acuoso de leucocitos
Inducción a la apoptosis mediada por caspasas / Inhibición de la proliferación, migración e invasión.
Inducción de la apoptosis por arresto celular en la fase G2/M.
Cáncer de cuello uterino
Cáncer de pulmón / Cáncer de prostata / Cáncer de mama / Cáncer colorectal
Bilis
Crocodylus palustris
Varanus salvator
Malayopython reticulatus
Cuora amboinensis karamoja
Extracción alcohólica (Metanol)
Plasma
Plasma
Plasma
Inducción a la apoptosis mediada por caspasas Cáncer de pulmón
Inducción a la muerte celular Cáncer de próstata
Inducción a la muerte celular
Inducción a la muerte celular
Inducción a la muerte celular
Cáncer de cuello uterino / Cáncer de prostata / Cáncer de mama
Cáncer de cuello uterino / Cáncer de prostata / Cáncer de mama
Cáncer de cuello uterino / Cáncer de prostata / Cáncer de mama
Macrovipera lebetina Lectinas
Bothrops pauloensis BnSP-6 / Lys-49 PLA2
Naja naja oxiana NN-3
Leiurus quinquestriatus Chlorotoxina
Macrovipera lebetina Macrovipecetina
Crotalus durissus terrificus Crotoxina
Naja naja oxiana Cytotoxina 2
Daboia russelii Daboialectin
Naja atra Cytotoxin 1
Echis multisquamatus
Naja hage
Vipera latifii
Walterinnesia aegyptia
Naja naja oxiana
Disintegrin
Fracción de veneno
Fracción de veneno
Fracción de veneno
Proteína recombinante cytotoxin 2
Bothrops jararaca Jararhagina
Cerastes vipera L-Amino acid oxidase
Inhibición de la adhesión y migración de las integrinas
Inducción a la apoptosis / Inhibición de la adhesion, migración y angiogenesis
Inhibición de la proliferación
Inhibición de la proliferación, migración e invasión
Cáncer de mama
Cáncer de mama
Cáncer de mama
Cáncer de mama
Inhibición de la proliferación, migración e invasión Melanoma
Inducción de la apoptosis por arresto celular en la fase G2/M. / Inhibición de la señalización de ERK.
Inducción de la apoptosis por arresto celular en la fase G1
Activación de la caspasa-3 y señalización p38
Inducción a la apoptosis / Inhibición de la migración
Inducción a la necroptosis
Inhibición de la proliferación
Inducción a la muerte celular
Inducción a la muerte celular
Inducción a la apoptosis / Activación de la vía de la caspasa-3.
Cáncer de mama
Cerastes cerastes Veneno entero irradiado
Cáncer de mama
Cáncer de pulmón
Cáncer de pulmón
Leucemia
Cáncer de cuello uterino
Cáncer de hígado
Cáncer de hígado
Cáncer de mama
Inducción a la apoptosis mediada por la vía TGF-β/ SMAD Melanoma
Activación de la vía de la caspasa-3 / Supresión del crecimiento tumoral y metastasis Melanoma
Inducción a la muerte celular
Inducción de la apoptosis por arresto celular en la fase G2/M.
Cáncer de mama / Cáncer de hígado / Cáncer de pulmón / Cáncer de prostata / Cáncer de colon
Cáncer de pulmón / Cáncer de próstata
(Fuente: Conlon y col., 2014; Deslouche y Di, 2017; Li y col., 2018; Datta y Roy, 2021; Park y col., 2022)
Las incretinas son una serie de hormonas que se producen en el intestino en respuesta a la ingesta de alimentos con el fin de disminuir los niveles de glucosa en sangre. Uno de sus efectos más importantes es la secreción de insulina por el páncreas. El GLP-1, la principal incretina, actúa además suprimiendo la secreción de glucagón, retrasa el vaciamiento gástrico, reduce el apetito, estimula la proliferación de las células pancreáticas y reduce su apoptosis (Furman, 2012). Por tal motivo, se desarrollaron varias líneas de investigación con el fin de utilizarla como tratamiento de la diabetes tipo 2. La problemática con la que se encontraron fue que, debido a su corta vida media, solo se podría administrar por infusión continua para que sea útil clínicamente (Larsen y col., 2001). Durante la década del 80´s, en medio del auge del estudio de la actividad biológica de las toxinas de diferentes venenos, se puso interés en dos péptidos provenientes del veneno de Heloderma horridum (exendin-3) y H. suspectum (exendin-4), los dos únicos saurios venenosos del mundo. Los mismos poseían la capacidad de incrementar el AMPc en los acinos pancreáticos. Esto llevó a la búsqueda de análogos mamíferos del exendin-4, momento en que se descubre que el exedin-4 tiene la capacidad de unirse al receptor de GLP-1 estimulando la secreción de insulina (Göke et al., 1993). En el 2005 y luego de pasar por todas las fases de prueba, la Exenatida (análogo sintético del exedin-4) fue aprobado para su comercialización como tratamiento para diabetes de tipo II en Estados Unidos y en el 2012 en Europa. La misma es una símil GLP1 por lo que posee su misma actividad, pero con una vida media de 2.4 h y un efecto clínico de hasta 8 h (Kim y col., 2007). En el 2013 se aprobó en Europa y luego en Estados Unidos (2016) la Lixixenatida, otro derivado sintético del exedin-4 con las mismas funciones.
Quitosano
La quitina es el segundo biopolímero más abundante en la naturaleza luego de la celulosa. El quitosano es un derivado desacetilado de la quitina. La principal fuente para la fabricación de productos comerciales proviene de los desechos obtenidos del procesamiento de cangrejos y camarones en la industria alimentaria. Es biorenovable, biocompatible, biodegradable, no tóxico, no irritante y además mantiene las mismas
estructuras cristalinas α, β y γ . Debido a su versatilidad, es un producto utilizado en diferentes industrias con una gran cantidad de finalidades que van desde aditivos en la fabricación del papel, hasta recubrimiento de semillas o agentes floculantes. En la industria farmacéutica posee diversos usos. Debido a su sensibilidad al pH, biocompatibilidad y baja toxicidad, sumado a que es metabolizado por determinadas enzimas, como la lisozima, y que es biodegradable es un excelente medio para ser utilizado en el transporte de material genético y medicamentos a través de membranas, excipiente en formulaciones de medicamentos, preparación de nano-biodispositivos, microcápsulas y microesferas. Otro de sus principales usos es en la cicatrización de heridas, ya que inicia la proliferación de fibroblastos y la producción de colágeno, activa los macrófagos favoreciendo la fagocitosis y la liberación de mediadores como el TGF-β1 y factor de crecimiento derivado de plaquetas (PDGF), los cuales aceleran el proceso de síntesis de matriz extracelular. También se han descripto sus efectos antimicrobianos de amplio espectro ( Escherichia coli , Pseudomonas aeruginosa , Staphylococcus aureus resitente a la meticilina (SARM), Candida albicans , Trichophyton rubrum , y T. violaceum ), analgésicos y hemostáticos (Alves y Mano, 2008; Napavichayanun y Aramwit, 2017). Por último, debido a la alta carga positiva que posee, el quitosano se une fuertemente a sustratos con carga negativa, como los lípidos. Esta característica es utilizada para la formulación de productos farmacéuticos, de administración oral, para el tratamiento de las dislipemias y obesidad (Ormord, 1998).
Otros productos
Hasta acá vimos los grupos farmacológicos donde existe un mayor interés para generar nuevos productos y, por lo tanto, donde se produjo una mayor inversión en su investigación y posterior desarrollo. Más allá de esto, la lista de fármacos derivados de la fauna silvestre es mucho más amplia y se encuentra en continuo crecimiento. En la tabla 3 vemos algunos ejemplos de fármacos comerciales pertenecientes a otros grupos farmacológicos.
Fuente animal
Conus magus
Péptido sintético (Nombre comercial) / Péptido natural
Ziconotide (Prialt) / Conotoxina
Sistrurus miliarius barbouri
Eptifibatide (Integrilin) / Barbourina
Mecanismo de acción Uso Terapéutico
Bloquea los canales de calcio tipo N en los nervios nociceptivos primarios en la médula espinal.
Inhibidor selectivo y reversible del recepetor de glicoproteina IIa/IIIb de las plaquetas
Analgésico - tratamiento del dolor crónico severo en pacientes refractarios a la morfina
Antiplaquetario - Prevención del infarto de miocardio precoz en pacientes con síndromes coronarios agudos / Reducción de eventos cardiovasculares mayores en pacientes con infarto agudo de miocardio
Echis carinatus
Bothrops moojeni
Tirofibano (Aggrastat) / Echistatina
Inhibidor selectivo y reversible del recepetor de glicoproteina IIa/IIIb de las plaquetas
Hirudo medicinalis
(Defibrase; Botropase; Botroclot) / Batroxobin
Bivaluridina (Angiomax) / Hirudina
Desirudina (Iprivask) / Hirudina
Fibrinolisis y promueve la trombolisis
Unión reversible a la Trombina
Unión irreversible a la Trombina
Antiplaquetario - Prevención del infarto de miocardio precoz en pacientes con síndromes coronarios agudos / Reducción de eventos cardiovasculares mayores en pacientes con infarto agudo de miocardio
Fibrinolítico - Favorece la recanalización luego de un ACV isquémico o en la trombosis de senos venosos (TSV)
Anticoagulante - Pacientes con angina inestable sometidos a angioplastia coronaria
Anticoagulante - Profilaxis de la trombosis venosa profunda después de una cirugía de reemplazo de cadera.
( Fuente: McIntosh y col., 1982; McClellan y Goa, 1998; Lan y col. 2021; Oliveira y col., 2022; Bansal y col., 2024)



Heloderma suspectum
Hirudo medicinalis
Sistrurus miliaris
Conclusiones
La función de este trabajo es poder ampliar el concepto que poseemos sobre la “importancia de la conservación de la biodiversidad”. Actualmente solo poseemos una pequeña visión de todo lo que la fauna silvestre nos puede ofrecer. Y esto, sin tomar en cuenta que distan por ser descriptas millones de nuevas especies. Cada uno de los integrantes de la fauna silvestre ha generado adaptaciones que llevaron miles de años y que son las que les permitieron sobrevivir a diversas enfermedades, defenderse de predadores, ingerir todo tipo de alimentos, estar en contacto con productos que podrían ser tóxicos para otras especies y diseminarse por todo el mundo. Posiblemente, poder desentrañar que aspectos de esas adaptaciones pueden ser útiles para el ser humano y ver como transformar esos productos naturales en derivados sintéticos, puede ser la llave para el futuro de la humanidad. Actualmente, a través de la genómica y la proteogenómica, podemos acceder a nueva información sobre los genomas de diferentes especies y a las proteínas codificadas en ellos, siendo este el primer paso para luego obtener nuevas moléculas de utilidad terapéutica. Como vimos, gran parte de estos productos se encuentran en diferentes etapas de investigación y desarrollo y requerirán de muchos años para llegar al mercado, pero gracias a la incorporación de estas nuevas tecnologías, al interés científico y el apoyo farmacéutico y gubernamental, esos tiempos son cada vez más cortos. Mucho queda por investigar y aún más por experimentar, pero es el camino de los productos naturales el que ofrece la mayor potencialidad para descubrir moléculas novedosas que puedan conducir a la producción de fármacos eficaces contra una amplia variedad de enfermedades humanas.
Autor: Vet. Esp. Pablo Regner
Especialista en Medicina de Animales de Compañía No Convencionales y Fauna Silvestre. Miembro de la Comisión de Animales de Compañía No Convencionales y Fauna Silvestre (CENT-CPMV).
Docente de la Cátedra de Producción, Manejo y Conservación de Fauna Silvestre (FCV-UBA) y de Recursos Faunísticos (FCVyA-USAL).
Phyllomedusa sauvagii
Imágenes | Wikimedia.com



Echis carinatus
Jorunna funebris
Bibliografía
1. Alves NM, Mano JF. (2008). Chitosan derivatives obtained by chemical modifications for biomedical and environmental applications. 43(5),0–414. doi:10.1016/j.ijbiomac.2008.09.007
2. Bansal AB, Sattar Y, Jamil RT. (2024). Eptifibatide. 2023 Apr 3. In: Stat Pearls [Internet]. Treasure Island (FL): Stat Pearls Publishing; 2024 Jan–. PMID: 31082110
3. Bartels EJH, Dekker D, Amiche M. (2019) Dermaseptins, Multifunctional Antimicrobial Peptides: A Review of Their Pharmacology, Effectivity, Mechanism of Action, and Possible Future Directions. Front Pharmacol. Nov 26;10:1421. doi: 10.3389/fphar.2019.01421
4. Bin Hafeez A, Jiang X, Bergen PJ, Zhu Y. (2021) Antimicrobial Peptides: An Update on Classifications and Databases. Int. J. Mol. Sci. 22 , 11691. https://doi.org/10.3390/ijms222111691
5. Bordon K de CF, Cologna CT, Fornari-Baldo EC, Pinheiro-Júnior EL, Cerni FA, Amorim FG, Anjolette FAP, Cordeiro FA, Wiezel GA, Cardoso IA, Ferreira IG, Oliveira IS, Boldrini-França J, Pucca MB, Baldo MA, Arantes EC. (2020). From Animal Poisons and Venoms to Medicines: Achievements, Challenges and Perspectives in Drug Discovery. Frontiers in Pharmacology. https://doi.org/10.3389/fphar.2020.01132
6. Conlon JM, Mechkarska M, Lukic ML, Flatt PR. (2014). Potential therapeutic applications of multifunctional host-defense peptides from frog skin as anti-cancer, anti-viral, immunomodulatory, and anti-diabetic agents. Peptides. Jul; 57:67-77. doi:10.1016/j.peptides.2014.04.019.
7. Cushman DW, Pluscec J, Williams NJ, Weaver ER, Sabo EF, Kocy O, Cheung HS, Ondetti MA. (1973). Inhibition of angiotensin-converting enzyme by analogs of peptides from Bothrops jararaca venom. Experientia. vol.29, 1031.
8. Datta S, Roy A. (2021). Antimicrobial Peptides as Potential Therapeutic Agents: A Review. Int J Pept Res Ther 27, 555–577. https://doi.org/10.1007/s10989-020-10110-x
9. de Barros E, Gonçalves RM, Cardoso MH, Santos NC, Franco OL and Cândido ES (2019). Snake Venom Cathelicidins as Natural Antimicrobial Peptides. Front. Pharmacol. 10:1415. doi: 10.3389/fphar.2019.01415
10. Deslouches B, Di YP. (2017). Antimicrobial peptides with selective antitumor mechanisms: prospect for anticancer applications. Oncotarget. Jul 11;8(28):46635-46651. doi: 10.18632/oncotarget.16743. PMID: 28422728; PMCID: PMC5542299
11. Ferreira SH. (1965). A bradykinin-potentiating factor (BPF) present in the venom of Bothrops jararaca Br J Pharmacol Chemother. Feb;24(1):163-9. doi: 10.1111/j.1476-5381.1965.tb02091.x. PMID: 14302350; PMCID: PMC1704050.
12. Fleming A. (1945). Nobel Lecture. NobelPrize.org. Nobel Prize Outreach AB 2024. Fri. 8 Mar 2024. https:// www.nobelprize.org/prizes/medicine/1945/fleming/lecture/
13. Furman BL. (2012). The development of Byetta (exenatide) from the venom of the Gila monster as an anti-diabetic agent. Toxicon. Mar 15;59(4):464-71. doi:10.1016/j.toxicon.2010.12.016.
14. Göke R, Fehmann HC, Linn T, Schmidt H, Krause M, Eng J, Göke B. (1993). Exendin-4 is a high potency agonist and truncated exendin(9-39)-amide an antagonist at the glucagon-like peptide 1-(7-36)amide receptor of insulin-secreting beta-cells. J. Biol. Chem. 268, 19650–19655.
15. Greene LJ, Stewart JM, Ferreira SH. (1970). Bradykinin-Potentiating Peptides from the Venom of Bothrops jararaca . In: Sicuteri F, Silva, MR, Back, N. (eds) Bradykinin and Related Kinins. Advances in Experimental Medicine and Biology, vol 8. Springer, Boston, MA. https://doi.org/10.1007/978-1-46843198-8_11
16. Kim D, MacConell L, Zhuang D, Kothare PA, Trautmann M, Fineman M,Taylor K. (2007). Effects of onceweekly dosing of a long-acting release formulation of exenatide on glucose control and body weight in subjects with type 2 diabetes. Diabetes Care 30 (6), 1487–1493.
17. Lan D, Song S, Liu Y, Jiao B, Meng R. (2021). Use of Batroxobin in Central and Peripheral Ischemic Vascular Diseases: A Systematic Review. Front Neurol. Dec 2;12:716778. doi: 10.3389/fneur.2021.716778. PMID: 34925203; PMCID: PMC8675357.
18. Larsen J, Hylleberg B, Ng K, Damsbo P. (2001). Glucagon-like peptide-1 infusion must be maintained for 24 h/day to obtain acceptable glycemia in type 2 diabetic patients who are poorly controlled on
sulphonylurea treatment. Diabetes Care 24, 1416–1421.
19. Li L, Huang J, Lin Y. (2018). Snake Venoms in Cancer Therapy: Past, Present and Future. Toxins (Basel). Aug 29;10(9):346. doi: 10.3390/toxins10090346. PMID: 30158426; PMCID: PMC6162746.
20. McClellan KJ, Goa KL. (1998). Tirofiban. A review of its use in acute coronary syndromes. Drugs. Dec;56(6):1067-80. doi: 10.2165/00003495-199856060-00017. PMID: 9878994.
21. McIntosh M, Cruz LJ, Hunkapiller MW, Gray WR, Olivera BM. (1982). Isolation and structure of a peptide toxin from the marine snail Conus magus . Arch Biochem Biophys. Oct 1;218(1):329-34. doi: 10.1016/00039861(82)90351-4. PMID: 7149738.
22. Napavichayanun S, Aramwit P. (2017) Effect of animal products and extracts on wound healing promotion in topical applications: a review, Journal of Biomaterials Science, Polymer Edition, 28:8, 703-729, DOI: 10.1080/09205063.2017.1301772
23. Oliveira AL, Viegas MF, da Silva SL, Soares AM, Ramos MJ, Fernandes PA. (2022). The chemistry of snake venom and its medicinal potential. Nat Rev Chem. 6(7):451-469. doi: 10.1038/s41570-022-003937. Epub 2022 Jun 10. PMID: 35702592; PMCID: PMC9185726.
24. Ondetti MA, Rubin B, Cushman DW. (1977). Design of specific inhibitors of angiotensin-converting enzyme: new class of orally active antihypertensive agents. Science 196, 441.
25. Organización Mundial de la Salud. ( 2016) . Plan de acción mundial sobre la resistencia a los antimicrobianos. Organización Mundial de la Salud. https://iris.who.int/handle/10665/255204
26. Ormrod DJ, Holmes CC, Miller TE. (1998). Dietary chitosan inhibits hypercholesterolaemia and atherogenesis in the apolipoprotein E-deficient mouse model of atherosclerosis. Atherosclerosis. Jun;138(2):329-34. doi: 10.1016/s0021-9150(98)00045-8. PMID: 9690916.
27. Park SY, Choi H, Chung JW. (2022). Reptiles as Promising Sources of Medicinal Natural Products for Cancer Therapeutic Drugs. Pharmaceutics. Apr 16;14(4):874. doi:10.3390/pharmaceutics14040874.
28. Savage P, Mahmoud S. (2015). Development and economic trends in cancer therapeutic drugs: a 5-year update 2010-2014. Br J Cancer. Mar 17;112(6):1037-41. doi: 10.1038/bjc.2015.56. PMID: 25668005; PMCID: PMC4366897.
29. Stewart JM, Ferreira SH, Greene LJ. (1971). Bradykinin potentiating peptide PCA-Lys-Trp-Ala-Pro: An inhibitor of the pulmonary inactivation of Bradykinin and conversion of angiotensin I to II, Biochemical Pharmacology, Volume 20, Issue 7, pages 1557-1567, ISSN 0006-2952, https://doi.org/10.1016/00062952(71)90284-X.
30. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. (2021). Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 71: 209-249. https://doi.org/10.3322/caac.21660
31. Ugai T, Sasamoto N, Lee H-Y, et al. (2022). Is early-onset cancer an emerging global epidemic? Current evidence and future implications. Nat Rev Clin Oncol; 19:656–73. doi:10.1038/s41571-022-00672-8
32. van Hoek ML. (2014). Antimicrobial peptides in reptiles. Pharmaceuticals (Basel). Jun 10;7(6):723-53. doi: 10.3390/ph7060723. PMID: 24918867; PMCID: PMC4078517.
33. Yan Y, Li Y, Zhang Z, Wang X, Niu Y, Zhang S, . . . Ren, C. (2021). Advances of peptides for antibacterial applications. Colloids Surf B Biointerfaces, 202, 111682. https://doi.org/10.1016/j.colsurfb.2021.111682
34. Zhao J, Xu L, Sun J, et al. (2023). Global trends in incidence, death, burden and risk factors of earlyonset cancer from 1990 to 2019BMJ Oncology 2:e000049. doi: 10.1136/bmjonc-2023-000049
Ñanco
Geranoaetus polyosoma (Qouy & Gaimard, 1824)

Clase: Aves Orden: Accipitriformes
Familia: Accipitridae
HÁBITAT Y DISTRIBUCIÓN
• Presente en relación a la Cordillera de los Andes desde el centro de Colombia, Ecuador, Perú, Bolivia, Chile y Argentina (donde la distribución se dilata hacia el Este), siendo menos frecuente en Uruguay y accidental en el sur de Brasil y Paraguay.
• Argentina: Se distribuyen en todas las provincias, exceptuando Misiones y estando ausente en el este de Formosa. Es rara su presencia en Corrientes.
ESTATUS DE CONSERVACIÓN
• Internacional: UICN y BirdLife de Preocupación menor (LC).
• CITES: II
• Nacional: Aves Argentinas y Secretaría de Ambiente y Desarrollo Sustentable No Amenazada (NA)
Ejemplar juvenil en vuelo


EXANT (RESIDENT) EXTANT (NON-BREEDING)
Gráfico: BirdLife International and Handbook of the Birds of the World (2016) 2008
CLAVES PARA SU IDENTIFICACIÓN
• Presenta dimorfismo sexual, siendo los machos más pequeños (alrededor de 800 gr y unos 45 a 50 cm en estación) y las hembras mayores (1300 gr y cerca de 55 cm en estación). Los ejemplares insulares (Tierra del Fuego, Juan Fernández, Malvinas) tienden a ser de mayor tamaño.
• A lo largo de su vida su color varía con el transcurso de las sucesivas mudas. Los ejemplares juveniles son predominantemente acanelados u ocráceos, ventralmente con predominio de blanquecino y una mancha oscura en la región malar; recuerda a otros juveniles de la familia. En los ejemplares adultos predomina un color grisáceo en cabeza y alas, con el dorso y lomo del mismo color en los machos y rojizo en las hembras, y predominantemente blancos en mejillas, pecho, abdomen y muslos. Al vuelo es característica la cola blanca con una franja subterminal negra, la cual puede apreciarse desde los dos años de edad.
• Cabe destacar que para esta especie, al igual que para otros miembros del género y géneros afines, existen diversos morfos (es decir, patrones de coloración) que en ocasiones puede complicar su correcta identificación a campo; de ahí uno de los nombres que recibe en inglés: variable buzzard
• Frecuente, no es raro observarlo al costado de las rutas, tanto en vuelo como posado en postes.

Hembra adulta. Nótese el dorso rojizo característica de las hembras

Ejemplar adulto en vuelo. Nótese la característica franja negra subterminal en las timoneras, es una de las claves para su identificación
RASGOS ETOECOLÓGICOS
Adaptaciones
• Al igual que otros accipitriformes, posee fuertes garras que utiliza para capturar y ultimar sus presas.
• Por su conducta generalista y oportunista, puede ocupar diversos ambientes, y se lo puede encontrar desde el nivel del mar hasta los casi 5000 metros, prefiriendo ambientes más bien despejados (pastizales, sabanas, arbustales y bosques poco densos).
• Si bien existen poblaciones residentes, otras en otoño migran hacia el norte o el este. Alimentación
• Como todas las aves rapaces, se trata de carnívoros estrictos. En su amplio rango de distribución la predominancia de una u otra presa puede variar de acuerdo con la oferta de cada ambiente. Por este motivo, el listado de ítems alimentarios incluye una amplia variedad de vertebrados pequeños, algunos invertebrados y ocasionalmente carroña (carcasas de animales domésticos, placentas de lobos marinos en regiones costeras).
• En regiones áridas (como el desierto de Atacama) consume mayor proporción de lagartijas e invertebrados (principalmente arácnidos).
• En el extremo norte de su distribución predomina la ingesta de aves.
• En zonas de pastizales la dieta suele estar conformada mayormente por roedores.
• Es consumidor de especies exóticas invasoras, incluyendo ejemplares juveniles de la liebre europea ( Lepus europaeus ) y el conejo ( Oryctolagus cuniculus ).
• Patrulla su territorio con vuelos circulares de reconocimiento, pero también puede realizar planeos, y al detectar presas se lanza sobre ellas en una picada diagonal, abatiéndolas con las garras. Las lagartijas e invertebrados suelen ser capturados a la carrera.
Vida Social
• Existen registros de actividades que involucran tres a cinco individuos que parecieran indicar casos de búsqueda o caza cooperativa.
• Existen dos reportes donde un nido era vigilado y defendido por tres ejemplares.
Reproducción
• Existen pocos registros formales sobre la conducta de anidación del ñanco, pese a su extensa distribución y relativa abundancia, y la mayoría de ellos corresponden a diversas localidades de Chile.
• Se trataría de una especie monógama.
• El macho suele aportar el material para el nido (ramas y palos para la estructura principal, y hierbas y bosta seca para el recubrimiento interno), y la hembra se ocupa de su confección. Es una plataforma plana y voluminosa.
• En áreas serranas y montañosas los nidos suelen ubicarse en riscos, y en espacios abiertos eligen árboles (tanto autóctonos como exóticos), ubicando el nido habitualmente por encima de los 8 metros; sin embargo en zonas sin árboles como las Islas Malvinas, pueden anidar en el suelo entre matas de pasto, o en arbustos bajos en los ambientes esteparios. En ambientes antropizados pueden hacer uso de postes de cableado y antenas.
Pareja. Diferencia de colores y tamaños entre el macho (el de más arriba) y la hembra.

Nido sobre estructura artificial

• El nido puede ser reutilizado y reacondicionado durante varios años por la misma pareja.
• La puesta suele ser de uno a cuatro (siendo lo más habitual dos a tres) huevos, los cuales poseen una coloración blanquecina con sutiles manchas grises y en el polo mayor manchas rojizas, con un ancho de entre 42 a 51 mm y un largo de 52 a 55 mm. El período de incubación ronda los 35-36 días.
• Hubo nidos en los que el macho se ocupó activamente de proveer alimento a la hembra y los pichones, mientras que en otras ocasiones fue la hembra la principal responsable del cuidado de las crías, alimentándolas, defendiendo el nido y brindándoles sombra en las horas de mayor temperatura.
Crías
• Los pichones son altriciales (nacen inmaduros, con los ojos cerrados y recubiertos de plumón).
• La permanencia en el nido es de alrededor de 40-50 días.
• Como en otras aves rapaces, se han documentado posibles casos de cainismo.
SITUACIÓN ACTUAL
• En la región de la costa bonaerense, donde algunas poblaciones realizan su invernada, su abundancia parece haber disminuido en relación a la proliferación de desarrollos inmobiliarios.
• En forma opuesta, las zonas de pastizales protegidos parecen haber visto un aumento en la cantidad de ejemplares presentes.
• En líneas generales, sus poblaciones parecieran estar incrementándose.
Autor: Dr. Federico Bondone
BIBLIOGRAFÍA
1. Alvarado Orellana, S., & Figueroa Rojas, R. (2005). Possible social foraging behavior in the Red-backed Hawk (Buteo polyosoma). Ornitología Neotropical, 16: 271-275
2. Alvarado, S. (2006). Unusual observation of three Red-backed hawks (Buteo polyosoma) defending a nest. Journal of Raptor Research , 40 (3), 248-249.
3. Baladrón, A. V., Bó, M. S., & Malizia, A. I. (2006). Winter diet and time-activity budgets of the Red-Backed Hawk (Buteo polyosoma) in the coastal grasslands of Buenos Aires province, Argentina. Journal of Raptor Research , 40 (1), 65-70.
4. Baladron Felix, A. V., Cavalli, M., & Martínez, G. (2014). Dieta del Aguilucho Común (Geranoaetus polyosoma) en pastizales costeros y zonas periurbanas de la Región Pampeana. Nótulas Faunísticas - Segunda Serie , 143 (2014): 1-5
5. BirdLife International. 2016. Geranoaetus polyosoma . The IUCN Red List of Threatened Species 2016: e.T22735520A95113871. https://dx.doi.org/10.2305/IUCN.UK.2016-3.RLTS. T22735520A95113871.en. Accessed on 13 March 2024.
6. Cabot Nieves, J., de Vries, T., Alonso, C. U., & de los Reyes, M. P. O. (2013). Primeros datos sobre el periodo de incubación y crecimiento de los pichones del aguilucho común ( Geranoaetus polyosoma ) Quoy y Gaimard en cautiverio. Acta zoológica lilloana , 57 , 187-200.
7. De la Peña, M. R. (1992) Guía de aves argentinas. Tomo 2. Editorial LOLA.
8. De Lucca, E. R., Bertoni, M., & Quaglia, A. I. E. (2012). Nidificación del Aguila mora (Geranoaetus melanoleucus) y del Agilucho común (Buteo polyosoma) en el litoral marítimo del Noreste patagónico, Argentina. Nótulas Faunisticas - Segunda Serie; 103; 9-2012; 1-10
9. Jiménez, J. E. 1995. «Historia Natural Del Aguilucho Buteo Polyosoma: Una revisión». El Hornero 14 (1-2). Argentina, ARG:1-9.
10. MAyDS y AA (Ministerio de Ambiente y Desarrollo Sustentable y Aves Argentina) (2017). Categorización de las Aves de la Argentina (2015). Informe del Ministerio de Ambiente y Desarrollo Sustentable de la Nación y de Aves Argentinas, edición electrónica. C. A. Buenos Aires, Argentina. XX pp.
11. Morici, A & Veiga, J.A. (2015). Aportes al conocimiento de la dieta del ñanco ( Geranoaetus polysoma ) en las provincias de Buenos Aires y Neuquén, Argentina. Nótulas FaunísticasSegunda Serie , 184: 1-6
12. Narosky, T., & Yzurieta, D. (2003). Guía para la identificación de las aves de Argentina y Uruguay. Vázquez-Mazzini Editores. Buenos Aires, Argentina.
13. Saggese, M. D., Quaglia, A. I., Ellis, D. H., Ellis, C. H., Imberti, S., Nelson, R. W. & Trejo, A. (2020). Variable Hawk (Geranoaetus polyosoma) is a Rare Nesting Species in Santa Cruz Province, Southern Continental Patagonia, Argentina. Journal of raptor research , 54 (4), 447-454.
14. Travaini, A., Santillán, M. A., & Zapata, S. C. (2012). Diet of the Red-backed Hawk (Buteo polyosoma) in two environmentally contrasting areas of Patagonia. Studies on Neotropical Fauna and Environment , 47 (1), 25-32.
15. Valladares Faúndez, P., Álvarez Henríquez, N., Urrutia Osorio, N., Olivares Zuleta, F., & Alvarado Orellana, S. (2015). Dieta del aguilucho común Geranoaetus polyosoma (Quoy & Gaimard 1824) en la Región de Atacama, Chile. Gayana (Concepción) , 79 (2), 121-127.
16. Vaurie, C. (1962). A systematic study of the Red-backed Hawks of South America. The Condor , 64 (4), 277-290.
RABIA. SITUACIÓN EPIDEMIOLÓGICA Y MEDIDAS DE PREVENCIÓN EN LA CIUDAD AUTÓNOMA DE BUENOS AIRES.
PROTOCOLO DE SEGUIMIENTO DE CANINOS Y FELINOS EXPUESTOS A MURCIÉLAGOS. CIUDAD AUTÓNOMA DE BUENOS AIRES .
La rabia es una enfermedad zoonótica de origen viral que afecta el sistema nervioso central de todos los mamíferos, sean domésticos o silvestres, incluido el hombre. Se transmite a través del contacto con la saliva infectada por medio de mordeduras o arañazos.
Su distribución es mundial y causa la muerte de más de 60.000 personas al año, registrándose la mayoría de los casos en Asia y África, donde el perro es la principal fuente de transmisión.
En las Américas se ha logrado reducir fuertemente la incidencia de la rabia humana transmitida por caninos. Sin embargo, en los últimos años, los animales silvestres adquirieron mayor importancia como transmisores de la enfermedad.
En la Ciudad Autónoma de Buenos Aires (CABA), actualmente la situación epidemiológica de la rabia se caracteriza por la ausencia de circulación viral en perros y gatos (ciclo terrestre), manteniéndose un ciclo enzoótico en los murciélagos, principalmente Tadarida brasiliensis (ciclo aéreo), con el riesgo potencial del pasaje del ciclo aéreo al terrestre (spill over).
Actualmente, en el Instituto de Zoonosis Luis Pasteur (IZLP), alrededor del 5% de los murciélagos remitidos para su diagnóstico resultan positivos a rabia.
Por lo tanto, y teniendo en cuenta la tasa de letalidad de la enfermedad cercana al 100 % y su implicancia en salud pública, es imprescindible que, ante la posibilidad de un contacto de perro o gato con un quiróptero, se implemente un protocolo de seguimiento.
El contacto de los animales de compañía con los murciélagos puede ser directo, por mordida, juego o rozamiento. Sin embargo, también ante el hallazgo de murciélagos caídos en los domicilios donde habiten perros o gatos, debe considerarse realizar el seguimiento a pesar de que se desconozca fehacientemente el grado de exposición.
Las acciones de control en caninos y felinos expuestos a murciélagos se basan en protocolos adaptados de la Guía Nacional para la Prevención, Vigilancia y Control de la Rabia del Ministerio de Salud de Nación del año 2018. A su vez, la posibilidad de diagnosticar rabia en murciélagos y de realizar la medición de anticuerpos antirrábicos en el IZLP facilita la aplicación de este protocolo en CABA.
Los animales deben ser controlados en los siguientes casos:
• Perros y gatos expuestos a murciélagos con diagnóstico confirmado de rabia.
• Perros y gatos expuestos a murciélagos que no puedan ser analizados, ya sea porque son descartados o la muestra no es adecuada para realizar el diagnóstico (falta del encéfalo, por ejemplo).
El protocolo descripto a continuación no es aplicable en áreas con transmisión de ciclo terrestre (variantes 1 y 2). Las acciones son llevadas a cabo sobre caninos y felinos de CABA por el IZLP. Pasos a seguir ante una consulta de un canino o felino que contactó con un murciélago (CABA):
• Informar al tutor que siempre se remita el murciélago caído al IZLP para el diagnóstico de rabia.
• En caso de exposición del perro y/o gato al murciélago, el tenedor debe concurrir al IZLP (sin turno) con el animal en ayunas.
• Además, en caso de contacto de una persona con el murciélago debe concurrir al IZLP y luego al Servicio de Profilaxis Antirrábica del Hospital de Agudos Dr. Carlos Durand.
El seguimiento de los perros y gatos depende de su estado vacunal al momento del contacto. Las acciones de control se deben realizar en forma oportuna, idealmente dentro de los cuatro días de ocurrido el contacto.
Caninos/Felinos expuestos a murciélagos positivos a rabia o a murciélagos no analizados.
Vacuna vigente (más de 1 mes y menos de 1 año de aplicada).
Extracción de sangre para titulación de anticuerpos antirrábicos.
Revacunación inmediata (< de 4 días post-exposición)
Vacuna vencida (más de 1 año de aplicada)
Extracción de sangre para titulacion de anticuerpos antirrábicos.
Revacunación inmediata (< de 4 días post-exposición).
Nunca vaunado
Revacunación inmediata (< de 4 días post-exposición).
Aislamiento en el IZLP durante 4 meses.
Extracción de sangre para titulación de anticuerpos antirrábicos:
1° muestra (Día 0).
· Título igual o mayor a 0,5 UI/ml: Aislamiento domiciliario durante 45 días.
· Título menor a 0,5 UI/ml
2° muestra (Día 7)
· Título igual o mayor a 0,5 UI/m: Aislamiento domiciliario durante 45 días.
· Título menor a 0,5 UI/ml: Aislamiento 4 meses en IZLP
La vacuna que se aplica luego de la exposición a murciélagos debe ser de cultivo celular. En caso que la vacunación se demore más de 4 días, se debe evaluar la posibilidad de extender el periodo de aislamiento.
El seguimiento domiciliario para evaluar el estado de cada animal es llevado a cabo por profesionales del IZLP, quienes deben controlar la aparición de síntomas de rabia durante el lapso determinado según convención. Asimismo, los tenedores responsables deben firmar un acta de compromiso de aislamiento del perro o gato por este periodo.
La determinación de los tiempos de aislamiento y seguimiento del protocolo se basa en el periodo promedio de incubación de la rabia, que es de 30 a 60 días. En el caso de presencia de anticuerpos protectores en el animal (título igual o mayor a 0,5 UI/ml), el plazo coincide con este promedio (45 días), sin embargo, ante un resultado de anticuerpos antirrábicos menores a 0,5 UI/ml, el plazo debe ser duplicado (4 meses).
El mantenimiento del ciclo aéreo de la rabia en murciélagos y el posible pasaje (spill over) de manera esporádica a animales de compañía, sumado a un bajo nivel de percepción del riesgo en la comunidad, hace necesario reforzar las medidas de prevención y control de esta enfermedad:
• Vacunación antirrábica anual y obligatoria en caninos y felinos a partir de los tres meses de edad.
• Notificación de las lesiones producidas por caninos y felinos y realización de las observaciones antirrábicas de los animales agresores. No subestimar las mordeduras.
• Seguimiento de caninos y felinos expuestos a murciélagos.
• Remisión de murciélagos caídos y/o que hayan contactado con animales de compañía para diagnóstico de rabia.
• Remisión de cadáveres de animales que hayan lesionado dentro de los 10 días de su fallecimiento o que hayan padecido signos neurológicos inespecíficos para realizar el diagnóstico diferencial de rabia.
• Educación para la promoción de la salud, en relación a la tenencia responsable de caninos y felinos, y de la enfermedad.
Es muy importante, diferenciar los periodos de tiempo definidos para el seguimiento de animales en contacto con murciélagos (o sea, sobre animales agredidos) con los determinados para las observaciones antirrábicas, que deben realizarse ante un accidente potencialmente rábico producido por un canino o felino (o sea, sobre animales agresores). En este último caso, se considera el control del animal por 10 días a partir de la fecha de lesión, cuya fundamentación se sustenta en que el virus puede aparecer en saliva de 2 a 5 días antes de la aparición de los síntomas en el animal, no relacionándose con el tiempo de incubación de la enfermedad. Esta observación antirrábica puede ser realizada por veterinarios del IZLP o veterinarios de la práctica privada que deberán remitir las certificaciones de la observación al IZLP.
Medidas de prevención ante un accidente potencialmente rábico: Observaciones antirrábicas en caninos y felinos en la Ciudad Autónoma de Buenos Aires.
Toda persona lesionada en el ámbito de la Ciudad Autónoma de Buenos Aires, por un canino, felino u otro animal doméstico o silvestre, debe dirigirse al Instituto de Zoonosis Luis Pasteur sito en Av. Díaz Vélez 4821 para dejar asentado la denuncia sanitaria correspondiente. En el sector Caso Causa, de la División Coordinación Operativa, se registra la denuncia sanitaria de mordedura, bajo un número de Caso Causa. Las personas lesionadas son derivadas al Servicio de Profilaxis de Rabia del Hospital General
de Agudos Dr. Carlos Durand (HGACD) para la atención médica y aplicación de protocolo post-exposición de vacuna antirrábica (VAR) en caso de que correspondiera, según evaluación del médico actuante. A partir de la mencionada denuncia, el profesional veterinario inicia la observación antirrábica del animal agresor.
Al realizar una observación antirrábica es importante considerar los siguientes conceptos:
Período de incubación: es el período entre la exposición al virus y la aparición de síntomas y signos. En perros, gatos y hurones domésticos es de unos días a 24 meses, con un promedio de 30 a 60 días. En mamíferos silvestres se desconoce el comportamiento de los virus.
Período de contagio: es el período en el cual el animal secreta el virus en saliva y es capaz de transmitirlo a través de la mordedura. Se considera que en los caninos y felinos el virus puede aparecer en la saliva de 2 a 5 días antes de que el animal presente signos. Debido a esto, y ante la gravedad de la enfermedad, el animal es observado durante 10 días a partir de la lesión, duplicándose de esta manera el tiempo máximo de aparición en saliva sin presentar signos.
Fecha de lesión: corresponde a la fecha en la que el animal produjo la lesión por la cual está siendo observado.
Fecha de inicio: corresponde a la fecha en la que el profesional veterinario comienza a realizar las observaciones antirrábicas
NO
DEBE APLICARSE
Fecha de alta: 10 días a partir de la fecha de lesión , independientemente de la fecha de inicio de las observaciones por parte del profesional.
Período de observación: el mismo se extiende durante 10 días a partir de la fecha de lesión , independientemente de la fecha de inicio de las observaciones por parte del profesional.
En este período el animal debe observarse cada 48 hs. Las observaciones deben realizarse en el domicilio del animal, ya que durante este período el mismo debe estar en aislamiento en su domicilio o en centro de zoonosis.
En caso de que el animal vuelva a lesionar durante el período de observación, deberá realizarse una nueva denuncia en el IZLP. En este caso la fecha de alta será a los 10 días, a partir de la nueva fecha de lesión.
La observación antirrábica debe realizarse siempre que una persona sea lesionada, independientemente del estado vacunal del animal agresor.
LA VACUNA ANTIRRÁBICA DURANTE EL PERÍODO DE OBSERVACIÓN
El certificado de observación antirrábica debe ser remitido a IZLP en persona por el profesional o por el propietario del animal. Se sugiere que lo haga el profesional ya que, en caso de haber incurrido en algún error puede corregirse en el momento. El certificado de inicio debe remitirse personalmente dentro de las 48 hs de realizado. Si bien los certificados intermedios pueden enviarse cada 48 hs por vía digital (WhatsApp), los mismos deben ser remitidos en forma física junto con el certificado de alta, el cual debe ser enviado dentro de las 24 hs de haber sido emitido. En caso de demora se dará aviso al HGACD de que el animal no finalizó la observación antirrábica para que se proceda con la profilaxis antirrábica del lesionado según criterio médico.
Asimismo, de no concluirse la observación antirrábica, ya sea por que el animal fallezca o no se ubique para realizar el alta, el profesional a cargo deberá enviar el certificado URGENTE incluido dentro del talonario de observaciones, informando dicha situación. En caso de muerte del animal durante el periodo de observación antirrábica, el cadáver debe ser remitido al IZLP para su análisis y diagnóstico de rabia.
Autores:
Vet. Jimena Vidal
Jefa de Sección Acciones Programadas.
División de Acciones Comunitarias para la Salud.
Instituto de Zoonosis Luis Pasteur zoonosispasteur@gmail.com
Vet. María Inés Ardiles
División Acciones comunitarias para la salud.
Instituto de Zoonosis Luis Pasteur zoonosispasteur@gmail.com
Vet. Christian Javier Durán
División Coordinación Operativa
Instituto de Zoonosis Luis Pasteur casocausaizlp@gmail.com / cduran@buenosaires.gob.ar
1. · Guía para la Prevención, Vigilancia y Control de la Rabia en Argentina. Ministerio de Salud de la Nación, 2018.
2. · Ley Nacional Antirrábica Nº 22953/83
3. · Ordenanza 41831/87. Digesto Jurídico de la Ciudad de Buenos Aires.
4. · OPS/OMS. www.paho.org/es/temas/rabia
“Centros de Rescate de fauna silvestre como sitios clave en la alerta temprana
para la salud global del ecosistema”
(MEDICINA DE LA CONSERVACIÓN TERCERA PARTE)
Los servicios veterinarios deben ser centinelas de la salud del ecosistema, detectando precozmente no solo la presencia de enfermedades emergentes como las reemergentes, sino todos aquellos factores y noxas que propenden a un desequilibrio sanitario directa o secundariamente.
El surgimiento de algunas de estas enfermedades, se las ha relacionado con el impacto de las actividades humanas; por ejemplo: la fragmentación, reducción y destrucción de hábitats; el crecimiento, dispersión y migración de poblaciones humanas; la expansión de la frontera agropecuaria sumado a los agro-tóxicos; el comercio de especies silves tres; las especies invasoras; el ecoturismo; entre otras actividades antropo génicas con gran impacto a escala mundial, aunado al cambio climático.
Luego de la pandemia las enfermedades de los animales silvestres suscitan al menos desde lo discursivo cada vez mayor preocupación a nivel mundial, pero prima en general una visión antropocéntrica es decir todo aquello que tiene como actores principales o la salud pública humana o lo relacionado con la producción de alimentos de origen animal que no solo puedan afectar a la población del país sino principalmente el mercado exterior.
De allí que la vigilancia pasiva que se realiza solo incluye las enfermedades zoonóticas prevalentes, aquellas con impacto productivo y las exóticas en particular las fronterizas.
En muchas ocasiones los intereses económicos y políticos son contrapuestos a los sanitarios, pero esa relación está cambiando con la globalización, ya que aquellos que manejan el primer mundo al conocer la influencia de la fauna silvestre en los agrosistemas y la salud pública, por lo menos han dictado normas que las hacen cumplir cuando afectan sus propios intereses.
Hoy lo observamos con la influenza aviar, donde la Organización Mundial de Sanidad Animal (OMSA) ha creado un nuevo estatus zoosanitario, como el de país libre de influenza aviar altamente patógena en las granjas avícolas,
a pesar que exista circulación del virus y alta mortalidad. Sustentando dicha disposición en garantizar las medidas de bioseguridad en los establecimientos avícolas como las medidas de aislamiento de producirse un brote. https://www. woah.org/app/uploads/2023/08/2023-08argentina-hpai-selfd-sp.pdf
Desde febrero del 2023 se han presentado casos en las aves de traspatio y silvestres en nuestro país. A esto se suma en octubre del 2023 nuevos casos de A (H5) en lobos ( Otaria flavescens y Arctocephalus australis) y elefantes marinos ( Mirounga leonina ) donde el virus circulante produjo estragos en estos mamíferos marinos en particular diezmando hasta el 90 % de la población de crías de elefantes marinos. Esta deliberada exclusión tiene como único sustento, los intereses económicos para la comercialización y exportación de los productos avícolas.
Si realmente los funcionarios que aseveran comulgar con los principios de Una Salud, deberían revalidarlos con sus actos, dejando bien claro que la prioridad es la sanidad ambiental y todos los otros factores deben estar subordinados, en especial los referidos a los intereses económicos.
Partimos del concepto que la vigilancia
epidemiológica es uno de los pilares de la medicina de la conservación; de allí que nosotros propendemos desde hace años la instalación de observatorios de vigilancia ecoepidemiológica en los centros de rescate de fauna silvestre en particular aquellos que se encuentran ubicados en áreas naturales protegidas urbanas.
Hoy hablar de vigilancia epidemiológica como la salud del ecosistema en una reserva natural urbana (RNU), por lo menos en la Argentina es inusual o meramente declamativo, de allí que estemos impulsando un cambio de paradigma donde estos observatorios permanentes propendan a la salud del ecosistema.
Generalmente las investigaciones que se realizan en RNU están relacionadas con los relevamientos de flora y fauna y en menor medida estudios sobre la evolución de los ambientes e intentos de recreación y restauración de los mismos. Desde fines de la década de los 90, nos empeñamos en la creación de un Centro de Rescate de Fauna Silvestre (CRFS), en la Reserva Ecológica Costanera Sur (RECS), pero las ONgs
ambientalistas que integraban el Consejo de Gestión de la misma, se opusieron con firmeza; demorando más de una década su reconocimiento oficial. Igualmente, en la actualidad son escasos los Centros de Rescate en RNU.
En un principio planteamos la posibilidad de que las reservas naturales urbanas incluyan dentro de sus funciones un servicio de atención veterinaria para la fauna silvestre, constituyéndose (según la infraestructura que posean) en un lugar referente para la conservación de las especies en las regiones de su influencia. Además, estos organismos serían de vital importancia para la restauración y/o recreación de ambientes naturales (reintroducciones o reconstituciones de especies animales). Considerando que era viable instrumentar estos CRFS (con diferentes niveles de complejidad), especialmente en reservas cuya su función primordial no es la conservación de zonas prístinas o poco alteradas, sino que la amplia mayoría de estas reservas urbanas se encuentran ubicadas en zonas muy antropizadas.
Por lo tanto, el impacto ambiental que surja de la implementación de estos centros será una herramienta para morigerar las agresiones que genera la ciudad al ambiente natural.
Cada reserva implementará su CRFS, según la problemática de la región, ahora solo vamos a presentar los objetivos generales del proyecto presentado para la RECS.
1. Abordar la problemática ciudadana y regional de la fauna silvestre.
2. Desarrollar la potencialidad de la RECS en cuanto a sus funciones dentro de la estrategia mundial de la conservación.
3. Dar alojamiento y atención veterinaria.
4. Recibir ejemplares incautados por las autoridades judiciales y la Direcciones de Fauna
5. Investigación sobre el comportamiento y colonización de nuevos territorios por la fauna silvestre.
6. Formación de estudiantes y profesionales en el manejo, y todo lo referente a la información biológica y médica de la población faunística.
7. Educación ambiental: divulgación del conocimiento científico, crear conciencia conservacionista en la comunidad.
8. Conservación de especies autóctonas en peligro (al aumentar la diversidad genética de la población).
9. Participación de la comunidad en la formación de grupos de colaboradores para las tareas de rehabilitación y un registro de adopción, como una red de rehabilitadores.
10. Rehabilitar es lograr capacitar a un animal para que pueda ocupar su lugar en el nicho ecológico, según el rol que le corresponda por evolución, en el ecosistema, presentando un estado sanitario óptimo. Sabemos que la rehabilitación de fauna para su posterior liberación es algo complejo y por muchos cuestionada.
La rehabilitación de fauna para su liberación, propende:
a. Aumentar el tamaño de las poblaciones en peligro de extinción.
b. Repoblar áreas donde la especie es escasa o ha desaparecido.
c. Introducción de controles y marcadores biológicos de los ecosistemas (ya sea en esta reserva como en otras áreas protegidas).
d. Fortalecer la biodiversidad aumenta la resiliencia ecológica
11. Recuperación de fauna para su adaptación al cautiverio (animales no aptos para la vida silvestre) no sólo es una herramienta importante para la conservación, sino que brinda a los animales silvestres una atención biológica y veterinaria que mejora su calidad de vida si su destino final es el cautiverio. También la eutanasia es una alternativa válida que debe ser brindada cuando no es posible la rehabilitación para su liberación o cautiverio.
12. Lazareto para la fauna ingresada a la ciudad, tanto del exterior como del interior del país.
13. Aportar el componente animal para el repoblamiento con especies que han disminuido su número en áreas naturales de la región.
14. Receptor de animales: Decomisados o incautados, abandonados en la vía pública, liberados en la Reserva (clandestinamente), donados por particulares (recientemente capturados y las mascotas), derivados de Bioterios, Zoológicos, Reservas (animales discapacitados o inadaptados al cautiverio), traumatizados por hechos vandálicos o caza, perdidos por alteraciones climáticas, agotados (migraciones) varados en el río, accidentados por el tránsito, huérfanos (abandonados por sus padres, caídos del nido, tareas de poda, sustraídos por humanos), contaminación ya sea los empetrolados o intoxicados (botulismo), derivados del consultorio externo, etc., .
En otra oportunidad nos abocaremos a la crónica de 25 años, pugnando por hacer realidad este proyecto, al cabo de todos esos años, pocos objetivos se han logrado y en los que hemos avanzado muy lejos estamos de cubrir las expectativas. Pero en lugar de resignarnos, podemos decir subimos la apuesta al sumar un nuevo objetivo, la vigilancia epidemiológica.
Es así que desde el año 2012 con la participación activa y permanente del Instituto de Zoonosis Luis Pasteur, en la RECS, hemos demostrado a través de numerosas líneas de investigación que se han traducido en gran cantidad de trabajos científicos, que la vigilancia ecoepidemiologica en las RNU, no solo es una realidad, sino que sienta un importante precedente.
Ventajas que presentan las reservas naturales urbanas para la vigilancia ecoepidemiològica
Estas reservas son ideales porque nos permiten el muestreo en áreas silvestres sin salir de las ciudades, neutralizando muchos de los escollos que implica la vigilancia activa en la naturaleza.
En ambientes naturales se presentan gran cantidad de inconvenientes de tipo operativo, a esto debemos sumarle que los brotes generalmente pasan desapercibidos son breves y se puede perder la oportunidad de encontrar el animal enfermo o el cadáver ya que son rápidamente predados o consumidos por los carroñeros.
Estudios indican que el 75% de paseriformes desaparecen antes de las 24 horas.
En las reservas al haber más control la probabilidad de obtención del material y percibir los cambios es mucho mayor.
Lamentablemente a pesar de los reiterados pedidos a quienes administran la Reserva Ecológica Costanera Sur (RECS) es excepcional
el ingreso de animales muertos, al centro de rescate.
También facilita la captura de palomas y roedores en las ciudades, debido a los inconvenientes que se genera la colocación de trampas en la vía pública.
Una de las grandes ventajas es la proximidad con los laboratorios donde se procesan las muestras. Son lugares ideales para el entrenamiento de profesionales en todo lo relacionado al muestreo y procesamiento del material.
Otra de las premisas es ser fuente de material biológico más allá de los proyectos de investigación establecidos, la red receptores no debe ser restrictiva.
Además de profundizar estos fundamentos teóricos, vamos a esbozar nuestra experiencia de 25 años en el rescate de fauna urbana
(silvestre como doméstica) en la RECS que es el área natural protegida de mayor superficie en la ciudad de Buenos Aires.
Estamos impulsando un cambio de paradigma, consideramos que las RNU, como los grandes parques, y el Ecoparque, se conviertan en territorio donde el Instituto de Zoonosis Luis Pasteur (IZLP), cumpla funciones de vigilancia, entiéndase que no solo sean un espacio para el muestreo sino con la posibilidad de sumar observatorios de acción permanente en la RECS y el Ecoparque.
Es decir, ser un instrumento de vigilancia epidemiológica activa, y como contralor imparcial de la sanidad animal (las necropsias y pruebas diagnósticas deben estar a cargo de la autoridad sanitaria)

Muestreo del IZLP en la Reserva Ecológica Costanera Sur en busca del virus de la encefalitis de San Luis el trabajo determino un 7,2 % de las aves resultaron seropositivas.
Un poco de Historia
Si bien formalmente la creación del Centro de Rescate de Fauna Silvestre (CRFS) se produce bajo la gestión del Lic. Claudio Bertonatti en 2011; su existencia podemos rastrearla desde 1998 hasta el 2008, en dicho período ingresaron al servicio veterinario 2.891 ejemplares (a pesar que el ingreso se vio coartado en el año 2001 como durante el 2008 y prácticamente nulo durante los años 2002 y 2003).
En esa primera etapa, aunque en forma precaria intentamos cumplir con ciertas funciones de vigilancia epidemiológica para mantener la tan ponderada salud del ecosistema.
Es así que durante los brotes de botulismo (1999, 2000, 2001 y 2004) recurrimos al Instituto Malbran, determinando la presencia de la toxina “C”, que produjo gran mortandad, principalmente en gallaretas.

Para el caso de la liberación de un Halcón Peregrino (migra a los EEUU) se recurrió a SENASA para la detección del virus del Nilo.
Toda vez que se han presentado ejemplares del orden Charadiformes (gaviotas) con sintomatología nerviosa se remitieron muestras a SENASA para la búsqueda de Influenza Aviar tipo A; virus del Nilo o New Castle, pero nunca recibidos los respectivos informes.
En definitiva, durante esa primera etapa hemos inventariado una rica y vasta experiencia e intentamos fijar los basamentos de un centro de recuperación de fauna, y algunas acciones relacionadas con el monitoreo de la salud del ecosistema.
La segunda etapa comienza en el 2011 que es simultanea propuesta de creación del observatorio de vigilancia epidemiológico mediante un convenio con el IZLP, que aún espera su concreción.
El objetivo de firmar ese convenio no solo es oficializar lo que ya se viene realizando desde hace doce años, sino para darle continuidad.
Durante esta segunda etapa estuvimos abocados a la toma de muestras de algunos patógenos zoonóticos y enfermedades vectoriales, puntualmente hemos efectuado cultivos o antibiogramas por casos clínicos (generalmente en los casos de putrefacción del peto y caparazón en tortugas acuatizas) y cuando el IZLP realizaba castraciones en terreno se efectuaron simultáneamente relevamientos de brucelosis y leptospirosis en los perros de la zona (Rodrigo Bueno, Puerto Madero y RECS).
Queda pendiente incluir la comprobación de exposición a contaminantes ambientales o directamente tóxicos (peces, reptiles y aves), y que la vigilancia sea sistemática.
Desde 2011 hasta el 31 de diciembre del 2023 han ingresado al Centro de Rescate 5.420
Brote de botulismo en la Reserva Ecológica Costanera Sur 2004
ejemplares, principalmente aves; pero también reptiles y mamíferos.
Pero la cantidad de ejemplares ingresados por año es muy variable, por ejemplo, en el año 2011 se registraron 56 ejemplares, y desde el 2014 al 2018 se registraron 1770 ejemplares, con un promedio anual de 354 con un mínimo de 165 y un máximo de 501.
Para el quinquenio 2019/23 ingresaron 3578 ejemplares con un promedio anual 715, con un mínimo de 432 y un máximo 920 ejemplares.
Analizar el porqué de estas cifras merece otro capítulo, pero lo que rescatamos para este trabajo es en primer lugar señalar el incremento en el ingreso de ejemplares a través de los años, que implica una población mayor para muestrear.
Otro punto no menor es que los ejemplares no solo proceden de la ciudad de Buenos Aires, sino que abarca los tres cordones del AMBA y en algunos casos hasta ciudades del interior de la provincia.
Por lo tanto, el área bajo vigilancia epidemiológica trasciende los límites de la ciudad y eso se refleja por ejemplo en las notificaciones de casos positivos de psitacosis que el IZLP brinda a los otros centros de zoonosis de la provincia de Buenos Aires.
Muestreo del Instituto de Zoonosis Luis Pasteur, de colilargos para la vigilancia del hanta virus 2014
Enfermedad Agente etiológico Vector Reservorio
Hantavirus (*)
Virus Andes genotipo Lechiguana Oligoryzomys flavescens
Encefalitis San Luis (+) Flavivirus Culex paseriformes, columbiformes
Leptospirosis (+) Leptospira roedores, caninos
Psitacosis u ornitosis (x)
Rickettsiosis (*) Ehrlichiosis (*) Borreliosis (*)
Chlamydia psittaci Chamydia spp aves tortugas acuáticas
Rickettsia Borrelia
Ixoides auritulus Amblyoma aureolatum Amblyoma triste Rhipicephalus sanguineus aves, roedores, perros
Influenza aviar (*) Virus H5 N1 aves
Rabia (+) Var 4 Var 6 Tadarida brasiliensis
Leishmaniosis (*) Leishmania Lutzomia longipalpis
Enterobacterias(x)
Escherichia, Proteus, Salmonella etc. tortugas acuáticas lagartos overos
Brucelosis (+) Brucella canis Perros
Botulismo (+)
(x) Permanente
(*) Periódica
(+) Ocasionalmente
Clostridium botulinum tipo C Barro y agua de lagunas 46% positivas (2013)

Muestreo rutinario de Clamidias, en el Centro de Rescate de la Costanera Sur
Actividades a profundizar y formalizar
1. Determinar que enfermedades pueden ser monitoreadas en la RECS (en el cuadro figuran aquellas con las que se ha trabajado, pero se puede ampliar)
2. Diseño y aplicación de métodos de captura (insectos (flebótomos, piojos, mosquitos), arácnidos (garrapatas, arañas y escorpiones) aves, reptiles, y dentro de los mamíferos: roedores, murciélagos, comadrejas etc.).
3. Protocolos de obtención y remisión de muestras, ya sea en ejemplares vivos como en muertos. (las necropsias son una fuente inestimable de información)
4. Las capturas pueden secundariamente aportar datos para el relevamiento de poblaciones silvestres, donde por ejemplo se han declarado los primeros registros para esta región de las siguientes especies : Scapteromys aquaticus (rata acuática) y Cryptonanus chacoensis (comadreja enana) durante en el muestreo de roedores (Aristegui 2014 a) y en el muestreo de garrapatas Amblyomma aureolatum y A.triste , nuevos reportes para su distribución (Cicuttin y col 2013 a)
5. El CRFS en su momento fue un espacio entrenamiento del personal del IZLP, como de enseñanza tanto teórica como práctica donde tanto los residentes de Salud Pública Veterinaria del IZLP como los estudiantes de la facultad de veterinaria de la UBA que realizaban las prácticas profesionales supervisadas (PPS). Sería conveniente concretar las gestiones para retomar dichas prácticas.
Es indispensable el entrenamiento en todo lo referente a la bioseguridad para cuando se producen los brotes estar preparados, habituados al uso de los equipos y con los materiales aptos.
6. Incluir formalmente a los naturalistas que efectúan relevamientos en la RECS, como fuente de información no solo para el seguimiento de los ejemplares liberados, sino todo lo referente a migraciones, fauna exótica, animales domésticos y capacitarlos en la observación en todo aquello relacionado al comportamiento como síntomas que denotan circunstancias que pueden estar relacionadas con enfermedades.
La vigilancia en la RECS no solo ha podido determinar la presencia de hanta virus, como de cuatro especies de garrapatas de importancia para la salud pública, sino brindar acciones para la prevención.
Todas las aves ingresadas al CRFS desde el 2013 se les toma muestra para clamidias, permitiendo realizar las notificaciones con el correspondiente estudio de foco.
Durante el año 2023 se presentaron 16 casos positivos, el 56% corresponden a rapaces (4 ejemplares de gavilanes mixtos ( Parabuteo unicinctus ), el 19% paseriformes y uno solo a psitácidos (catita o cotorra común Myiopsitta monachus ), estos datos nos alertan sobre la necesidad de siempre tomar las medidas de bioseguridad cuando estamos en presencia de aves.
Debemos destacar que durante el 2023 se han procesado 333 muestras de las aves ingresadas al CRFS, resultando negativas a influenza aviar.
En septiembre del 2014 se inicia la toma de muestras en tortugas acuáticas, tanto en especies autóctonas como exóticas, en busca de salmonella, debido a que es una de las zoonosis asociadas principalmente a las tortugas acuáticas. Luego de diez años de trabajo, empíricamente podemos afirmar que, si bien los resultados señalan la presencia de varias especies de enterobacterias en la mayoría de las muestras, fue excepcional el hallazgo de salmonella, se iniciará una recopilación sobre todos los datos recabados para su estudio y posterior evaluación.

Toma de muestra para enterobacterias y clamidias en una tortuga de rio ( Hydromedusa tectifera), en el Centro de Rescate Costanera Sur.
Si bien algunos centros de rescate de fauna silvestre incluyen dentro de sus funciones la vigilancia, en realidad son en general declamativas, Se aplica en forma puntual por traslados, liberaciones o cuando por síntomas y/o mortalidad la situación lo amerita se solicitan algunas pruebas diagnósticas, pero no se establecen rutinas de vigilancia activa.
De allí la importancia que tiene la experiencia del IZLP en el CRFS en la Reserva Ecológica Costanera Sur, como las que se producen en el Centro de Recuperación de Especies (Temaiken) y Guira Oga (Misiones), que están marcando el camino correcto.
Autor: MV. Juan Carlos Sassaroli (CENT- CPMV; Instituto de Zoonosis Luis Pasteur Buenos Aires).
