












Lenger oppfølgingstid (>5år) bekrefter signifikant OS fordel med DRd sammenlignet med Rd alene hos pasienter med nydiagnostisert myelomatose hvor HMAS ikke er aktuelt.*1,3
Overall survival (median follow-up 64 months)1
i risiko for død
Adapted from DARZALEX® SC summary of product characteristics.1
*Median oppfølging på 64 måneder1 DRd, DARZALEX® + lenalidomide + dexamethasone; mOS, median overall survival; HR, hazard ratio; CI, confidence interval; HMAS, høydosebehandling med autolog stamcellestøtte. 1. Darzalex SmPC, 11/2023, avsnitt 4.1, 4.8, 5.1. 2. Facon T, Kumar SK, Plesner T et al. Daratumumab, lenalidomide, and dexamethasone versus lenalidomide and dexamethasone alone in newly diagnosed multiple myeloma (MAIA): overall survival results from a randomised, open-label, phase 3 trial Lancet Oncol. 2021;22:1582–1596. 3. Kumar SH, Moreau P, Bahlis NJ et al. Daratumumab Plus Lenalidomide and Dexamethasone (D-Rd) Versus Lenalidomide and Dexamethasone (Rd) Alone in Transplant-Ineligible Patients with Newly Diagnosed Multiple Myeloma (NDMM): Updated Analysis of the Phase 3 Maia Study. Blood (2022) 140 (Supplement 1): 10150–10153. Ingen nye bivirkninger ble observert for DRd etter lenger oppfølgingstid1,3
UTVALGT PRODUKT OG SIKKERHETSINFORMASJON FOR DARZALEX® INTRAVENØS (IV) OG SUBKUTAN (SC)
INDIKASJONER
Myelomatose (Darzalex® IV og SC)
• I kombinasjon med lenalidomid og deksametason eller med bortezomib, melfalan og prednison til behandling av voksne pasienter med nydiagnostisert myelomatose, hvor autolog stamcelletransplantasjon ikke er aktuelt.
• Se SPC for fullstendig oversikt over godkjente indikasjoner.
DOSERING OG ADMINISTRASJONSMÅTE
Gis som intravenøs infusjon eller subkutan injeksjon og skal administreres av helsepersonell med tilgjengelige ressurser for resuscitering. Subkutan formulering er ikke beregnet til intravenøs administrering, og skal kun gis ved subkutan injeksjon med angitt dosering. Det skal gis pre og post infusjonsbehandling/injeksjonsbehandling for å redusere risikoen for infusjonsrelaterte reaksjoner (IRR).
Myelomatose: Anbefalt dose er 16 mg/kg kroppsvekt gitt som IV. infusjon eller 1800 mg oppløsning til s.c. injeksjon gitt over ca. 3–5 minutter. For doseringsplan for daratumumab per indikasjon se SPC. For dose og doseringsplan for legemidler som gis sammen med daratumumab gitt som en i.v. infusjon eller s.c. injeksjon, se SPC og tilhørende preparatomtaler.
KONTRAINDIKASJONER
Overfølsomhet for virkestoffet eller noen av hjelpestoffene.
ADVARSLER OG FORSIKTIGHETSREGLER
Infusjonsrelaterte reaksjoner (IRR): Darzalex® kan forårsake kraftige og/eller alvorlige IRR. Det skal gis pre- og post-infusjonsbehandling/injeksjonsbehandling for å redusere risikoen for IRR, som ble rapportert i kliniske studier hos henholdsvis ca. 50 % av pasientene ved IV og 9 % ved SC. Ved enhver IRR, skal behandlingen avbrytes umiddelbart og symptomer håndteres. Dersom øyesymptomer oppstår, skal DARZALEX® avbrytes og umiddelbar oftalmologisk evaluering foretas før Darzalex® gjenopptas. Interferens med indirekte antiglobulintest (indirekte Coombs test): Darzalex® kan medføre positiv indirekte Coombs test. Pasienter skal typebestemmes og screenes før oppstart. Ved planlagt transfusjon skal blodtransfusjonssenteret gjøres oppmerksom på denne interferensen med indirekte antiglobulintester. Ved akutt transfusjon kan det gis ikke-kryssmatchede ABO/RhD-kompatible erytrocytter i henhold til lokal blodbankpraksis.
Reaktivering av hepatitt B-virus (HBV): Hepatitt B-virusreaktivering er rapportert, og HBV-screening skal foretas hos alle pasienter før oppstart av behandling.
Bivirkninger: De hyppigste bivirkningene uavhengig av grad (≥ 20 % av pasientene) med daratumumab (intravenøs eller subkutan formulering) gitt som monoterapi eller kombinasjonsbehandling var IRR, fatigue, kvalme, diaré, forstoppelse, feber, hoste, nøytropeni, trombocytopeni, anemi, perifert ødem, perifer sensorisk nevropati og øvre luftveisinfeksjon. Alvorlige bivirkninger var pneumoni, bronkitt, øvre luftveisinfeksjon, sepsis, lungeødem, influensa, feber, dehydrering, diaré, atrieflimmer og synkope. For fullstendig oversikt over bivikningene, se SPC
PAKNINGER, PRISER OG REFUSJON
Pakninger og priser: Injeksjonsvæske:15 ml (hettegl.) 72770,60 kr. Konsentrat til infusjonsvæske: 5 ml (hettegl.) 6097,40 kr. 20 ml (hettegl.) 24281,00 kr.
Basert på SPC 02/2024.
Les fullstendig preparatomtale før foreskrivning av Darzalex®
Styret i Norsk indremedisinsk forening:
Trond Vartdal
Leder
Knut Lundin
Nestleder
Cecilie H Nordmo
Styremedlem
Runa Andreassen
Styremedlem
Hamza Nahoui Leder NYI
Stephen Hewitt
(ansvarlig redaktør)
OUS Aker
stehewi@online.no
T: 913 72 199
Ole Kristian H. Furulund (assisterende redaktør)
Stephen Hewitt Redaktør Indremedisineren
Maria Seferowicz Høstmøtetkomitéen
Bjørn Jørgensen Spesialitetskomiteen
Rune Eilertsen Vara
Anita Suntharalingam Vara NYI
Kommuneoverlege i Bærum Maya Bass Akuttmottaket, Bærum sykehus, mctbass@hotmail.com
Fagredaktører:
Bernt Aarli (Lungemedisin)
Haukeland universitetssykehus
Eystein Husebye (Endokrinologi)
Haukeland universitetssykehus
Gunnar Einvik (Lungemedisin) Akershus universitetssykehus/NTNU
Indremedisineren er et fagtidsskrift rettet mot norske leger som arbeider innen fagomådet indremedisin, med dets ulike retninger. Indremedisineren sendes ut til alle medlemmer av Norsk indremedisinsk forening (Nif), som for tiden er ca 3 400, samt til andre med interesse for faget.
Indremedisineren vil presentere
Forsidebilde
Utgivelsesplan
Nr. 3
Annonsepriser 2024
Bakside 23.500,Omslagsside 20.500,-
Helside 19.500,1/2 side 13.000,-
Årsavtale
Tone Svilaas OUS Aker tosvil@ous-hf.no
Trine Finnes (Endokrinologi) Sykehuset Innlandet/OUS
Guri Hagberg (Geriatri) OUS Ullevål
relevant faglig og fagpolitisk stoff fra norske miljøer, samt noe internasjonalt rettet stoff av allmen interesse. Vi ønsker å legge til rette for at terskel og takhøyde gir rom for en allment engasjert indremedisiner å ytre seg. Reproduksjon av materiale fra Indremedisineren må skje etter tillatelse fra redaksjon og forfatter.








Med fire innrykk oppnås min. 20% rabatt.
Annonseformat
Bredde x Høyde 1/1
1/2
Annonsemateriell
mm + 5 mm
Høyoppløste PDF-filer, der fonter og høyoppløste bilder er inkludert.
Layout, produksjon og annonsesalg
Apriil Media AS
E-post: ragnar.madsen@apriil.no www.apriil.no






Disclaimer
• Informasjon, meninger og synspunkter som utgis i Indremedisineren tilhører forfatterne, og ikke nødvendigvis Norsk indremedisinsk forening eller redaksjonen.
• Publisering av artikler, annonser eller annen informasjon, betyr ikke nødvendigvis støtte eller aksept for disse.
• Redaksjonenen og utgiver gjør sitt beste for å sikre at legemiddeldoser og andre kvantiteter presenteres nøyaktig, men vi anbefaler leserne å bruke legemidler i samsvar med Felleskatalogen/Norsk legemiddelhåndbok.
• Indremedisineren og/eller utgiver kan ikke holdes ansvarlig for evt. feil eller konsekvenser som oppstår som følge av bruk av informasjon i tidsskriftet.
• Redaksjonen og utgiver anstrenger seg for ikke å publisere unøyaktige eller misvisende data, men forfatterne må selv ta ansvar for data, uttalelser og meninger som blir utgitt på deres vegne.

Effektiv og
vedvarende LDL-C reduksjon1
I en samlet analyse av fase 3-studiene Orion-9, -10 og -11 ga Leqvio 50,7 % LDL-C reduksjon vs placebo ved dag 510 (95 % KI: -52,9 %, -48,4 %; p<0,0001) og 54 % LDL-C reduksjon som vedvarte fra måned 3 til måned 18 vs placebo (95 % KI: -56 %, -51 %; p<0,0001)
50,7 %
To doser per år etter oppstartsdosering første år
Ferdigfylt sprøyte som administreres av helsepersonell, subkutan injeksjon.
Godt dokumentert sikkerhetsprofil2,3,4,5
Langtidsdata opp til 6 år viser ingen nye sikkerhetssignaler i forhold til funn i forutgående fase 3-studier over 18 måneder.
2x årlig
6 års data
Sikkerhet ved forskrivning av Leqvio:
I de pivotale studiene forekom bivirkninger på injeksjonsstedet hos henholdsvis 8,2 % og 1,8 % av pasientene på inklisiran og placebo. Forsiktighet ved alvorlig nedsatt lever- og/eller nyrefunksjon. Hemodialyse bør ikke utføres i minst 72 timer etter dosering med inklisiran.
INDIKASJON: Leqvio er indisert hos voksne med primær hyperkolesterolemi (heterozygot familiær og ikke-familiær) eller blandet dyslipidemi, som tillegg til diett:
• i kombinasjon med et statin eller statin sammen med andre lipidsenkende behandlinger hos pasienter som ikke oppnår LDL-C-mål med maksimal tolerert dose av et statin, eller
• alene eller i kombinasjon med andre lipidsenkende behandlinger hos pasienter som er statinintolerante, eller der et statin er kontraindisert.
DOSERING: Anbefalt dose er 284 mg inklisiran administrert som en enkelt subkutan injeksjon. Første dose settes initielt, andre dose settes etter 3 måneder og deretter settes det en dose hver 6. måned.
PAKNINGER, PRISER OG REFUSJON: 1 stk. ferdigfylt sprøyte med kanyleskjold, 026109, kr 31 461,20. Reseptgruppe C. Refusjon etter individuell søknad (§3) og i henhold til «Retningslinjer for individuell stønad for Leqvio» fastsatt av Helfo.6 Konsulter alltid Felleskatalogtekst eller SPC for fullstendig sikkerhetsinformasjon før forskrivning
REFERANSER: 1. Wright RS, Ray KK, Raal FJ et al. 2021 JACC Pooled Patient-Level Analysis of Inclisiran Trials in Patients With Familial Hypercholesterolemia or Atherosclerosis. 2. Ray, K. K., Wright, R. S., Kallend, D., et al. Two phase 3 trials of inclisiran in patients with elevated LDL cholesterol. New England Journal of Medicine, 2020, 382.16: 15071519. 3. Raal, F. J., Kallend, D., Ray, K. K., et al. Inclisiran for the treatment of heterozygous familial hypercholesterolemia. New England Journal of Medicine, 2020, 382.16: 1520-1530. 4. Ray KK, Troquay RP, Visseren FL, et al. Long-term efficacy and safety of inclisiran in patients with high cardiovascular risk and elevated LDL cholesterol (ORION-3): results from the 4-year open-label extension of the ORION-1 trial. The Lancet Diabetes & Endocrinology. 2023 Jan 5. 5. Wright, R. S., Koenig, W., Landmesser, U., et al (2023). Safety and tolerability of inclisiran for treatment of hypercholesterolemia in 7 clinical trials. Journal of the American College of Cardiology, 82(24), 2251-2261. 6. https://www.helsedirektoratet.no/rundskriv/kapittel-5-stonad-ved-helsetjenester/vedlegg-1-til--5-14-legemiddellisten/virkestoffer/inklisiran, lest 30.01.2024.
Skann QR-koden for å registrere ditt samtykke og motta elektronisk informasjon fra Novartis
Denne våren har «alle» snakket om «breddekompetanse», «generalistkompetanse», «breddespesialiteter». Initiativet kommer fra Helse- og omsorgsdepartementet (HOD) og er sendt videre til Helsedirektoratet og til de regionale helseforetakene (RHF). RHF’ene har i sin tur sendt videre til sykehusene, og alle sykehusene sitter nå i juni og skal svare ut hvordan de arbeider med oversikt over eksisterende spesialister og leger i spesialisering i bredde spesialitetene indremedisin og generell kirurgi. Dette er oversikter som kommer til å bli viktige for planleggingen for fremtidens sykehusdrift.
Spesialiststrukturen blir stadig mer spesialisert. Særlig etter 2017, med 10 indremedisinske hovedspesialiteter og 8 kirurgiske. Samtidig dukker det stadig opp ønsker om nye spesialiteter, med palliativ medisin i førersetet, men også med ønsker fra miljøer for smertebehandling og for legevaktsmedisin. Det er relativt bred enighet om at ved økt spesialisering/ spissing må det samtidig legges til rette for breddespesialiteter, altså de som skal «eie» pasienten, og holde trådene samlet. I primærhelsetjenesten er dette allmennmedisinerne. Men hvem skal det være i sykehusene? Dette ble tatt opp til diskusjon på Legeforeningens Landsstyremøte i slutten av mai. Norsk kirurgisk forening og Norsk indremedisinsk forening fremmet en resolusjon på bakgrunn av bekymring for at de to breddespesialitetene gradvis bygges ned, både hva gjelder rekruttering av nye spesialister og organisering av sengeposter i sykehusene. Forslaget til resolusjon ble oversendt sentralstyret, som av landsstyret fikk mandat til å jobbe videre med saken.
Det var en bred og god diskusjon på landsstyremøtet. Innleder fra Norsk indremedisinsk forening var Maria
Seferowicz fra styret, og Knut Lundin hadde også innlegg. En av innlederne var Professor Jan C. Frich, direktør på Diakonhjemmets sykehus. Han understreket behovet for mer breddekompetanse også i spesialisthelsetjenesten. Han lanserte også begrepet «spesialisert breddekompetanse», som beskrivende for det behovet man etterspør. Tidligere i vår har både de regionale helseforetakene og Helsedirektoratet arrangert workshop’er, debatter og «rådslag» for å belyse temaet. Norsk indremedisinsk forening har vært representert på de fleste av disse arenaene. Som tidligere beskrevet her, er det innenfor dagens spesialist forskrift i prinsippet 3 måter å lage en solid breddekompetanse. Enten ved å 1) øke antallet spesialister og utdanningsstillinger i breddespesialitetene indremedisin og generell kirurgi, eller 2) legge til rette for at legene kan ha to spesialiteter, for eksempel spesialiteten indre medisin og en «organspesialitet» eller 3) sterkt styrke utdanningen i felles-delene («LIS2») i indremedisin og kirurgi. Og kanskje mest sannsynlig en kombinasjon av disse tre.
Et resultat av den pågående diskusjonen, er at det trolig kommer til å bli behov for revisjon av læringsmålsplanene. Dette gjelder både LIS 2 og LIS3 – i begge de to breddespesialitetene indremedisin og generell kirurgi. Begge ble betydelig begrenset på grunn av tidsnød like før endret spesialiststruktur i 2017. Ingen av de to fikk lage nye og tilpassede læringsmål, men kun kopiere kompetansemål fra de øvrige hovedspesialitetene (de 9 indremedisinske og de 7 kirurgiske). Det har ikke vært optimalt for noen. Revisjon av læringsmålsplaner er uansett et viktig arbeid den kommende tiden. I denne revisjonen håper vi at fagmiljøene vil samarbeide konstruktivt for å lage oppdaterte løsninger tilpasset norsk spesialisthelsetjeneste.
Avslutningsvis vil jeg minne om årets høstmøte. Det finner sted som vanlig torsdag og fredag i uke 42, altså 17. og 18. oktober på Hotel Bristol. Dette er en utmerket arena for å vedlikeholde sin egen spesialiserte breddekompetanse, hygge seg med kolleger samt nyte Bristols herlige lunsj-buffet. Det faglige programmet er over samme lest som tidligere, med innlegg i et bredt spekter av indremedisinen. Hele programmet finner dere i dette nummeret av Indremedisineren.
Årets høstmøte har innført kasuistikk-konkurranse, noe som pleier å være en god anledning til å diskutere spennende faglige problemstillinger. Konkurransen er åpen for både leger i spesialisering og spesialister, både fra sykehus og spesialist-praksis. Premien i denne konkurransen er at vinneren får dekket utgifter til å reise til ACP-kongressen (Am College of Physicians), enten i New Orleans i 2025 eller San Francisco i 2026. Det er vel verdt å sende inn kasuistikk, altså. Det blir også sosial mingling like i etterkant av høstmøtets første dag, torsdag. Der blir det både utdeling av priser og kulturelt innslag.
Og med det, ønsker jeg alle medlemmer og andre lesere en riktig god sommer!
Hilsen
Trond Vartdal

Retningslinjer for antibiotikabehandling i sykehus anbefaler at DIFICLIR (fidaksomicin) vurderes til behandling av Clostridioides difficile-infeksjon (CDI) hos pasienter med høy risiko for residiv
Faktorer som kan øke risiko for residiv er1:
• Immunsvikt
• Tidligere CDI
• Sykehusopphold siste 3 måneder
• Protonpumpehemmer
• Høy alder
Vennligst se retningslinjer for fullstendig behandlingsanbefaling
Elektronisk søknadsløsning for individuell refusjon til legemidler på blåresept
Utvalgt produkt- og sikkerhetsinformasjon DIFICLIR (fidaksomicin) 200 mg tabletter
Indikasjoner: For behandling av Clostridioides difficile-infeksjoner (CDI), også kjent som C. difficile-assosiert diaré (CDAD), hos voksne og pediatriske pasienter med en kroppsvekt på minst 12,5 kg. Det skal tas hensyn til offisielle retningslinjer for korrekt bruk av antibakterielle midler. Vanligste bivirkninger: Vanlige: Forstoppelse, kvalme, oppkast. Vanligste alvorlige bivirkninger: Overfølsomhetsreaksjoner inkl. alvorlig angioødem. Interaksjoner: Forsiktighet utvises ved samtidig bruk av potente P-gp-hemmere. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Forsiktighetsregler: Fidaksomicin bør brukes med forsiktighet ved kjent allergi mot makrolider. Hvis det oppstår en alvorlig allergisk reaksjon, skal legemidlet seponeres og egnede tiltak igangsettes. Bør brukes med forsiktighet ved pseudomembranøs kolitt eller fulminant eller livstruende CDI og ved nedsatt lever- og nyrefunksjon. Graviditet, amming og fertilitet: Graviditet: Det anbefales å unngå bruk under graviditet. Amming: Det må tas en beslutning om amming skal opphøre eller behandling avstås fra, basert på nytte-/risikovurdering. Fertilitet: Dyrestudier indikerer ingen effekt på fertilitet. Dosering: Tabletter: Standard dosering: Voksne og barn ≥12,5 kg: Anbefalt dose er 200 mg (1 tablett) administrert 2 ganger daglig (1 tablett hver 12. time) i 10 dager. Utvidet pulsdosering: Voksne: 200 mg tabletter administreres to ganger daglig for dag 1–5 (ingen tablett på dag 6) og deretter én gang daglig annenhver dag for dag 7–25. Hvis en dose blir glemt, skal den glemte dosen tas så snart som mulig, men hvis det snart er tid for neste dose, skal tabletten hoppes helt over. Administrering: Kan tas med eller uten mat. Svelges hele sammen med et glass vann. Pakninger og priser: 20 stk. (blister) kr 18 099,90. Reseptgruppe C. Basert på SPC godkjent av DMP/EMA: 01.12.2023. PM-DT-NO-00020.
For utfyllende informasjon om dosering, forsiktighetsregler, interaksjoner og bivirkninger – se felleskatalogen no.
Referanse: 1. https://www.helsedirektoratet.no/retningslinjer/antibiotika-i-sykehus/infeksjoner-i-abdomen#clostridioides-difficile-infeksjon. Sist faglig oppdatert 01.03.2022.
Tillotts Pharma AB | Gustavslundsv. 135, 167 51 Bromma, Sverige | Tel: +46 8-704 77 40 | nordicinfo@tillotts.com
Vi er takknemlige for å kunne presentere et nytt nummer av Indremedisineren. Det er et spredt utvalg artikler som anses meget relevante for norske indremedisinere. Mye skjer i faget innen de ulike spesialitetene. I dette fascineres vi stadig over hvordan de ulike fagområdene knyttes sammen, og viktigheten av å se helheten.
Vilde Stefansson Christiansen og Marianne Øksnes tar for seg steroidutløst binyrebarksvikt. Steroidbehandling er vanlig i behandlingen av flere sykdommer, og man må ikke glemme binyrebarksvikt som en potensielt livstruende komplikasjon. Forfatterne går gjennom utredning og viktige overveielser og fallgruver. Det er flere grunner til gradvis nedtrapping av dosen etter behandling over noe tid.
Enteropati med intestinal totteatrofi forårsakes oftest av cøliaki. Diagnostikken er ofte enkel, men når noe ikke stemmer, må man tenke på andre årsaker. Elisabeth Sofie Meisfjord, Kristin Hammersbøen Bjørlykke, Lars Gustav Lyckander og Knut E. A. Lundin skriver om medikamentindusert enteropati, og illustrerer diagnosen og differensialdiagnostikk til ikke-cøliakisk enteropati med to kasuistikker.

Bjørn Moum og Stefan Lindgren omtaler jernmangel og jernmangelanemi, særlig ved kronisk sykdom. Også jernmangel kan gi symptomer, før anemi utvikles. Forekomsten av jernmangel er relativt hyppig også i vår befolkning, og kjennskap til risikogruppene hjelper i diagnostikken. Mer krevende er det ved samtidig sykdom. Forfatterne deler av sin viktige kunnskap, bygd opp over mange års praksis.
Etablerte og nye metoder for langtidsregistering av hjerterytme, gjør at man kan oppdage flere tilfeller av uoppdaget atrieflimmer. Edvard Liljedahl Sandberg beskriver flere av disse metodene samtidig som han peker på at fortsatt er uklart hvor ofte og hvor lenge pasienter må ha atrieflimmer før behandling bør initieres. En pilotstudie har vist at selvtesting av atrieflimmer i en digital setting er mulig, og den pågående NORSCREEN-studien vil forhåpentligvis bidra til en bedre forståelse av om oppdagelse av atrieflimmer i en slik digital setting med påfølgende behandling kan forebygge komplikasjoner.
Peter Hatlen og Nora Møller undersøkte spirometriferdighetene blant legestudenter og norske sykehusleger gjennom en spørreunder-

søkelse. Flertallet identifiserte nedsatt lungefunksjon. Studien viste interessante forskjeller mellom kategoriene, og ikke overaskende bedret ferdighetene seg under LISperioden. I tråd med resultatene, trenger vi kontinuerlig oppdatering innen spirometri, og spirometri bør være et sentralt kunnskapsmål i indremedisinsk utdanning.
Vi takker våre bidragsytere for deres innsats. Det er prisverdig hvordan velvilligheten holder seg til å bidra. Forhåpentlig gir en artikkel i Indremedisineren verdi også for forfatterne. Vårt tidsskrift har forhåpentlig etablert seg og blitt et relevant forum. Vi er takknemlige for å høre at bladet leses, og vi noterer at det er adskillige treff på artiklene som også ligger ute på nettet.
Vi i redaksjonen ønsker våre lesere en riktig god sommer!
Med vennlig hilsen









17. og 18. oktober samles vi på Hotel Bristol i Oslo.
Sett i lys av den politiske situasjonen i Europa og resten av verden, har vi invitert en lege fra CBRN-senteret til å snakke om Norges beredskap i 2024. Vi vil også diskutere fremtiden for indremedisinerne i norsk helsevesen og bioteknologiske fremskritt. Vi ser blant annet på screening for asymptomatisk atrieflimmer, hyponatremi, akutte GI-blødninger, infeksjoner hos IV-rusbrukere, sjeldne tilstander som inflammatoriske lungesykdommer og et nytt syndrom som indremedisinere bør kjenne til. Hemodynamisk overvåkning og pasienters psykiske helse er også på agendaen.
Osteoporose blir diskutert i et formiddagssymposium med flere fagfelt, og vi får høre om behandling i livets siste faser fra en foredragsholder fra Sahlgrenska Sykehus.

Kasuistikkonkurranse: I år introduserer vi en kasuistikkonkurranse med en premie som dekker kongressdeltakelse (inntil 25.000 NOK) på ACP i New Orleans 2025 eller San Francisco 2026. De fire beste
Mingling torsdag: I år arrangerer vi en uformell mingling torsdag kl. 16.00 med drikke og fingermat. Her får vi høre:
• Nytt fra NIF: Status, utfordringer og fremtid
• Kulturelt innslag
• Prisutdeling til heldige indremedisinere
• Resultater av kasuistikkonkurransen
Vi har begrenset antall plasser, så meld dere på tidlig. Gratis for medlemmer i Norsk indremedisinsk forening, inkludert lunsj begge dager. Bindende påmelding sikrer plass og riktig matbestilling. NIF dekker reise- og oppholdskostnader for inntil 15 deltakere. Kontakt Trond Vartdal på tvartdal@ous-hf.no for mer informasjon.
Nyt sommeren, og vi sees i oktober!
kasuistikkene vil bli presentert under høstmøtet, og vinneren kåres på torsdagens mingling. Send inn abstract på ca. 300 ord til hostmotet@indremedisineren.no innen 10.09.24.
vennlig hilsen, Høstmøtekomiteen ved
Soares, Cecilie Nordmo og Maria Seferowicz
Praktiske detaljer og påmelding
- deltagelse på Indremedisinsk høstmøte er gratis
- det vil bli servert lunch og pausemat begge dager
- av hensyn til matbestillingen ber vi om påmelding innen 15. september på: webpress.no/events/norsk-indremedisinsk-forening/ indremedisinernes-hostmote-2024/pamelding/
Tid Aktivitet/Tema
08.45–09.00 VELKOMMEN
09.00–09.40 Interstitielle lungesykdommer: Hva en generell indremedisiner må vite Michael Durheim, OUS
09.40–10.30 Osteoperosebehandling:
1. Optimalisering av utreding, behandling og oppfølging av osteoporose - Hvem, hva og hvor? (20 min)
Lene Solberg, ortoped, OUS
2. Individuelt tilpasset osteoporosebehandling (20 min)
Susanna Valland, endokrinolog, AHUS
Foredraget er støttet av Amgen
10.30–11.00 PAUSE
11.00–11.30 Indremedisinseren som generalist: Rolle og samarbeid i helsepyramiden
Øystein Evjen Olsen
11.30–12.30 LUNSJ
12.30–13.10 Forhåndssamtaler Maria Tarranger, Sahlgrenska
13.10–13.50 Let så skal du finne: Screening for AF
Jarle Jortveit, Sykehuset Sørlandet Foredraget er støttet av Pfizer
13.50–14.05 PAUSE
14.05–14.45 Beredskap i Norge anno 2024 CBRN-senteret

14.45–15.30 Hyponatremi
Renathe Rinsmo, UNN
16.00– MINGLING MED LITT GODT I GLASSET!
Fredag
Tid Aktivitet/Tema
08.30–09.30 Workshop 1: Praktisk bruk av ECG247 Workshop 2: Ekkokardiografi ved atrieflimmer Jarle Jortveit og Daniela Melichova Workshops er støttet av Pfizer
09.00–09.30 ÅRSMØTE INDREMEDISINSK FORENING
09.30–10.10 Bioteknologi i nær fremtid Eirik Tranvåg, lege bioteknologinemda
10.10–10.40 Vexas Syndrom Ø. Midtvedt, OUS
10.40–11.00 PAUSE
11.00–11.30 Infeksjoner hos pas som injiserer rusmidler Olav Daalgaard, AHUS
11.30–12.30 LUNSJ
12.30–14.00 Emosjonelt ustabile pasienter Øyvind Urnes med pasient
14.00–14.20 PAUSE
14.20–15.00 Hemodynamisk overvåkning for indremed Eirik Qvigstad, OUS
15.00–15.40 Akutte GI-blødninger Anders Egeland, Bærum
Med forbehold om endringer
Fagområde
Lungemedisin
Endo/revma/orto




Samfunnsmed

Hematologi/ geriatri
Kardiologi

Akuttmedisin
Nefrologi


Fagområde
Kardiologi


Revmatologi
Infeksjon
Psykiatri/ indremed
Kardiologi/ intensiv med
Gastromedisin


Pr. 17. juni – det er fortsatt ledige plasser!
Kontakt: ragnar.madsen@apriil.no Mob: 92848402
Glukokortikoider har en potent antiinflammatorisk og immundempende virkning, og brukes i behandling av en rekke sykdommer. Medikamentet har mange bivirkninger, som særlig gjør seg gjeldende ved lengre tids behandling og/eller i høye doser. Glukokortikoidbehandling er også en vanlig årsak til binyrebarksvikt, der presis diagnostikk kan være utfordrende.


Innledning
Mange forbinder binyrebarksvikt med Addisons sykdom, også kalt primær binyrebarksvikt. Dette er en sjelden autoimmun sykdom der begge binyrene ødelegges, og det oppstår mangel på hormonene kortisol, aldosteron og binyreandrogener. Mangel på kortisol kan også oppstå ved sykdom i hypofyseområdet.
Bortfall av adrenocorticotropt hormon (ACTH) fra hypofysen gir manglende binyrestimulering og derved lavere endogen kortisolproduksjon, mens produksjon av aldosteron og binyre androgener opprettholdes. Slik sekundær binyrebarksvikt, som følge av hypofysesvikt er vanligere enn Addisons sykdom og innebærer oftest mangel på flere hypofysehormoner. Den vanligste årsaken til isolert kortisolmangel er langvarig behandling med glukokortikoider grunnet andre sykdommer. Denne formen for tertiær binyrebarksvikt er også blitt kalt iatrogen binyrebarksvikt, men begrepet steroidutløst binyrebarksvikt er nå vanligere å bruke.
Behandling med glukokortikoider i suprafysiologiske doser vil ha en negativ feedback på hypotalamus’ og hypofysens produksjon av corticotropin-releasing hormon (CRH) og ACTH, som igjen vil medføre manglende binyrestimulering og redusert endogen produksjon av kortisol, se figur 1. Dette er en fysiologisk reaksjon som ved kortvarig behandling kan reverseres raskt, men ved langvarig manglende ACTH-stimulering vil binyrene kunne atrofiere og hypotalamushypofyse-binyreaksen får vansker med å opprettholde en adekvat kortisolproduksjon. Kliniske konsekvenser av steroidutløst binyrebarksvikt kan oppstå i
forbindelse med nedtrapping til lavdosebehandling eller ved seponering av glukokortikoider, og inkluderer både kroniske symptomer på kortisolmangel og/eller akutt binyrekrise som følge av manglende kortisolrespons i en stresssituasjon (1). Partiell binyrebarksvikt kan også forekomme, altså at egenproduksjonen av kortisol er svekket, men høy nok til at pasienten er asymptomatisk og klarer seg uten substitusjonsbehandling så lenge en stressituasjon ikke oppstår. Dersom pasienten kommer i en stressituasjon (interkurrent sykdom, kirurgi, traume) og ikke kan øke kortisolproduksjonen ytterligere, kan likevel en binyrekrise oppstå (2). Det er fortsatt usikkerhet både rundt diagnostikk og risiko for affiserte pasienter.
Risiko ved steroidindusert binyrebarksvikt
Glukokortikoider har en potent antiinflammatorisk og immunosuppressiv effekt og brukes derfor i behandlingen av en lang rekke sykdommer. En review-artikkel fant en forekomst av steroidutløst binyrebarksvikt på 37% (3), og femten prosent av pasientene hadde fortsatt steroidutløst binyrebarksvikt tre år etter seponering. En dansk metaanalyse inkluderte over 3700 pasienter i 74 studier og fant at forekomsten av binyrebarksvikt rundt tidspunkt for seponering av glukokortikoidbehandling var rundt 50% etter oral og intra artikulær behandling, ca 8% ved inhalasjonsbehandling og ca 4% ved intranasal eller dermal behandling (4). Forekomsten økte med økende dose og varighet av behandlingen, og forfatterne konkluderte med at man ikke trygt kan utelukke binyrebarksvikt ved noen form for GC-behandling, uavhengig av administrasjonsform, dose eller behandlingsvarighet.
For affiserte pasienter er risiko ved steroidindusert binyrebarksvikt i stor grad knyttet til forekomst av binyrekrise. Som fysiologisk respons på en stress-situasjon vil økt produksjon av CRH og ACTH gi en kraftig økning av kortisolproduksjonen, og kortisol kalles derfor også for et stresshormon. Inadekvat kortisolrespons ved stress kan utløse en akutt binyrekrise, som kan være livstruende med en mortalitetsrate på 0,5 per 100 pasientår (5). Forekomsten av binyrekriser blant pasienter med primær eller sekundær binyrebarksvikt er funnet å være mellom 3 til 11 per 100 personår (6). Det finnes ikke gode data på hyppigheten av binyrekriser ved steroidutløst binyrebarksvikt, og rapportert insidens varierer. Selvrapportert forekomst av binyrekrise var noe lavere hos pasienter med steroidindusert binyrebarksvikt enn hos pasienter med primær eller sekundær binyrebarksvikt (7). En nederlandsk studie fant en relativt høy insidens på 15 binyrekriser per 100 personår ved steroidutløst binyresvikt, men her var materialet lite (8). Samme studie fant at den viktigste risikofaktoren for utvikling av binyrekrise uansett etiologi var komorbiditet, som er vanligere hos pasienter med steroidutløst binyrebarksvikt. Langtidsbruk av glukokortikoider er i seg selv assosiert med økt mortalitet. En britisk kohort-studie som inkluderte 70 638 pasienter på langvarig glukokortikoidbehandling sammenlignet mortalitet blant pasienter som utviklet binyrebarksvikt med dem som ikke utviklet dette og fant ingen forskjell (9), men mortaliteten økte bratt de
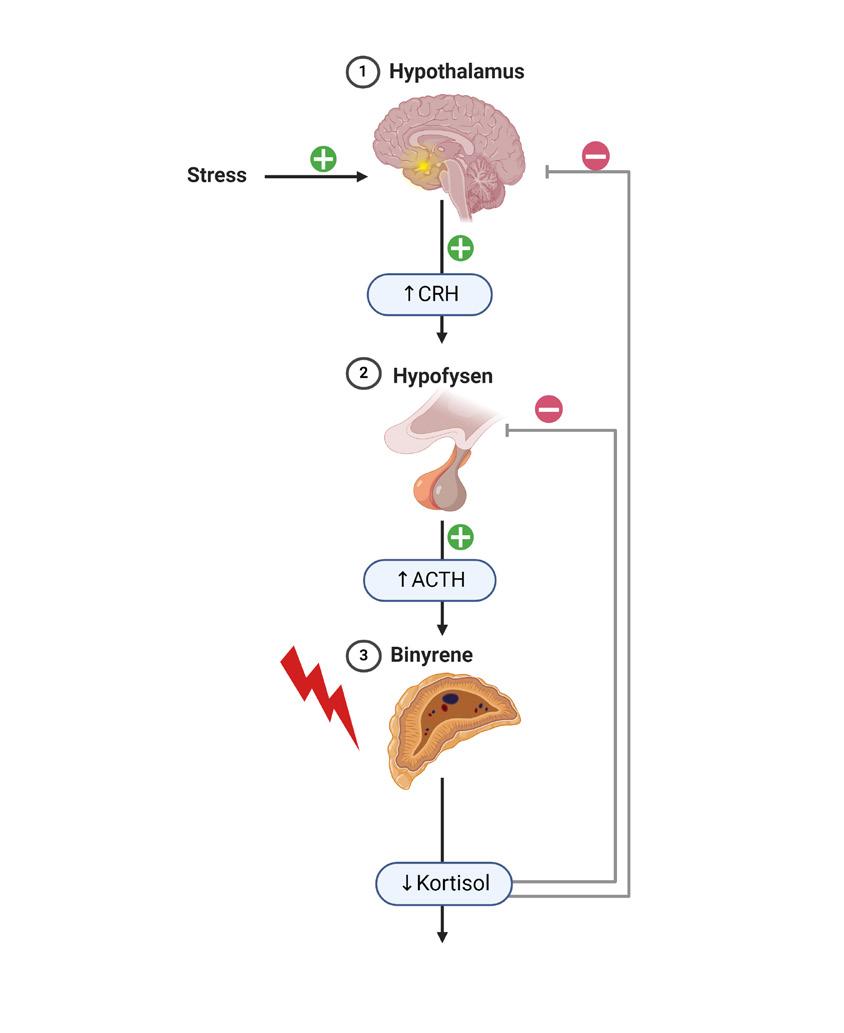
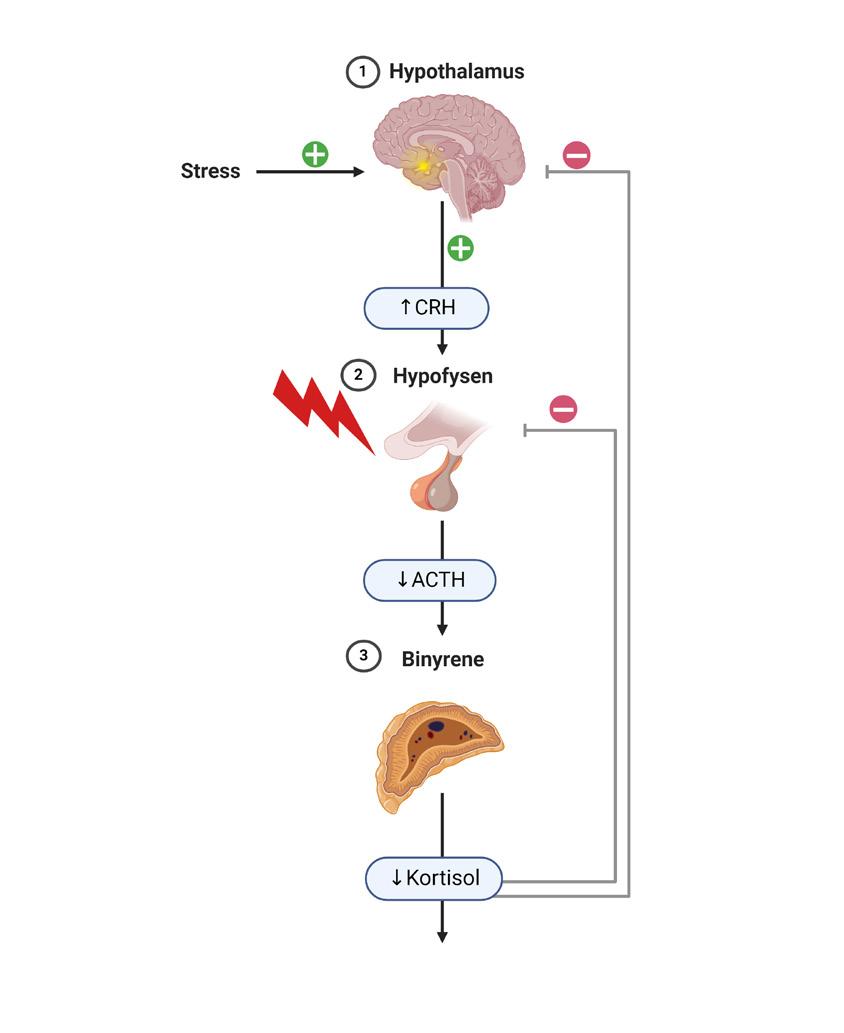
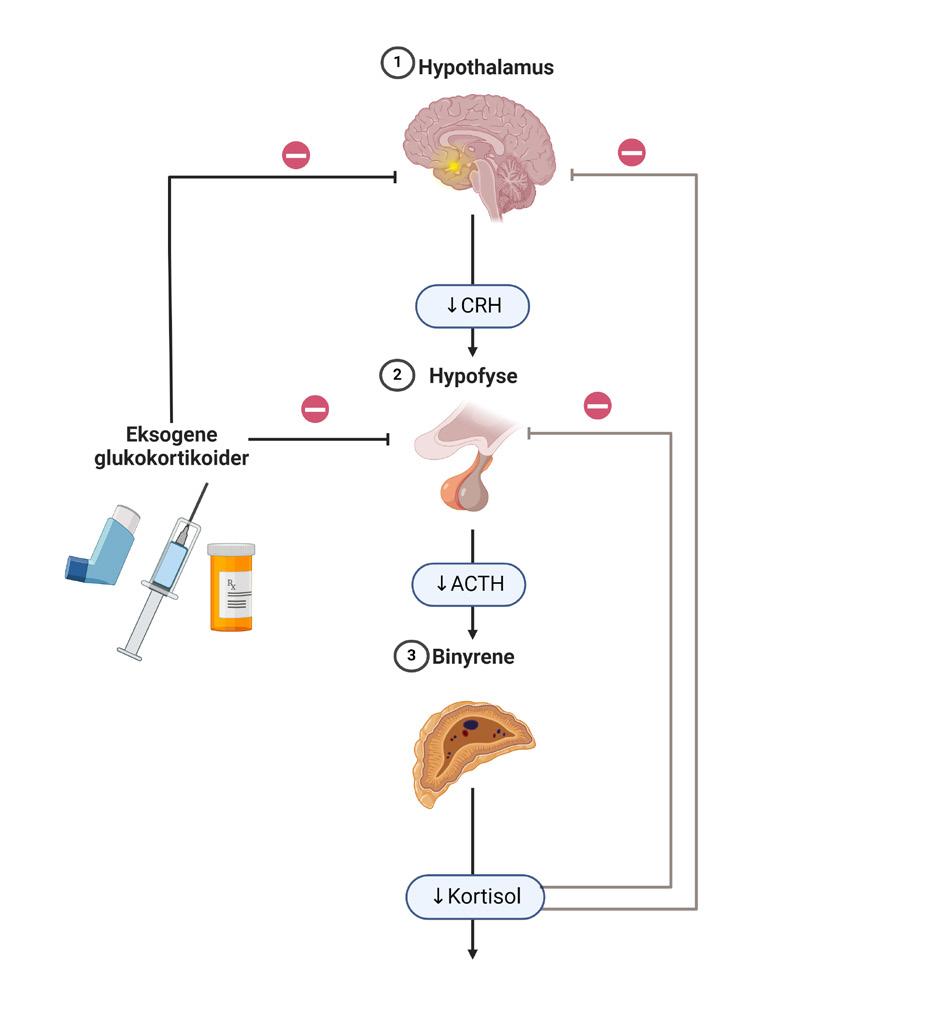
Figur 1. Fysiologi ved a) primær binyrebarksvikt, b) sekundær binyrebarksvikt, og c) steroidindusert binyrebarksvikt.
Figur laget i BioRender. a) b) c)
første to måneder etter seponering av glukokortikoidbehandling.
Diagnostiske overveielser og fallgruver
Binyrebarksvikt kan gi generelle og diffuse symptomer og funn som fatigue, anoreksi, vekttap, kvalme, oppkast, muskel/ledd-smerter, hyponatremi og hypotensjon. Ved steroidutløst binyrebarksvikt sees ikke hyperpigmentering fordi ACTH er lav eller normal, og sjeldnere hypovolemi da mineralkortikoidproduksjonen er bevart. Langtidsbruk av glukokortikoider kan føre til iatrogent Cushings syndrom med måneansikt, tynn hud og striae. Cushingoide trekk kan paradoksalt nok gi mistanke om binyrebarksvikt ettersom høye doser over lengre tid er assosiert med både bivirkninger av hyperkortisolisme og økt risiko for binyrebarksvikt (10).
Plagsomme generelle symptomer under nedtrapping av steroider er vanlig og kan ha flere årsaker. Symptomer som skyldes forverring av grunnsykdommen kan i noen tilfeller være vanskelig å skille fra symptomer på binyrebarksvikt, for eksempel muskelsmerter og fatigue ved oppbluss av polymyalgia rheumatica. Bivirkninger av høydosebehandling med gluko -
kortikoider kan også gi differensialdiagnostiske vansker, som for eksempel nedstemthet og fatigue, men slike bivirkninger inntrer oftest tidligere i forløpet enn binyrebarksvikt. Tilstanden «glucocorticoid withdrawal syndrome» kan også forekomme under nedtrapping av glukokortikoider, tilsvarende som etter behandling av endogent Cushing syndrom. Fenomenet er lite beskrevet i litteraturen, gir relativt like symptomer som ved binyrebarksvikt, men skiller seg ved at symptomene kan vise seg ved suprafysiologiske glukokortikoid-doser, samt at HPAaksen er normal ved testing (11, 12).
Tidspunkt for debut av symptomer under nedtrapping av glukokortikoider kan altså være til hjelp i diagnostikken. Symptomer på binyrebarksvikt vil først vise seg når de eksogene steroid-dosene blir lavere enn kroppens daglige kortisolbehov. Normalt vil friske binyrer produsere rundt 5,7 mg/m2/d med kortisol i perioder uten stress (13), som tilsvarer cirka 10 mg per dag. Vanlig substitusjonsdose ved komplett binyrebarksvikt er rundt 20 mg hydrokortison per dag, som tilsvarer 25 mg cortison actetat eller ca 5 mg prednisolon se tabell 1 (10, 14).
Binyrebarksvikt er derfor en mindre sannsynlig forklaring på symptomer
som oppstår under behandling med GC i doser høyere enn dette.
Ved mistanke om steroidutløst binyrebarksvikt er det dessuten viktig å ha klart for seg at det er forskjell mellom forbigående fysiologisk suppresjon av kortisol grunnet pågående behandling med eksogene glukokortikoider i høy dose, og reell kortisolmangel grunnet binyrebarksvikt. Dersom man tar prøver under pågående behandling med høydose glukokortikoider (for eksempel 20 mg Prednisolon peroralt) vil både ACTH og kortisol måles lave selv om det ikke foreligger binyrebarksvikt. I slike tilfeller bør diagnostisk prøvetaking utsettes til dosen er trappet ned til fysiologiske nivåer, tilsvarende for eksempel Prednisolon 5 mg daglig. Prøvetaking bør i alle tilfeller gjøres medikamentfastende om morgenen for å unngå overdiagnostikk. En metaanalyse viste at forekomsten av binyrebarksvikt hos astma-pasienter på behandling med inhalasjonssteroider falt fra 11% til 6,6% dersom man bare inkluderte studier der man målte ACTH og kortisol minst 24 timer etter siste dose (4).
Glukokortikoider
Korttidsvirkende
En annen feilkilde er lokalbehandling med glukokortikoider, det være seg dosert nasalt, som inhalasjoner, dermalt eller intra-artikulært. Dette avdekkes ikke alltid i medikamentanamnesen, eller kan undervurderes med hensyn til systemiske effekter som gir fysiologisk suppresjon av endogen kortisolproduksjon. En grundig medikamentanamnese er derfor viktig differensialdiagnostisk.
Hvem skal testes og hvordan?
En dansk studie fant at den årlige prevalensen for oral bruk av glukokortikoider i befolkningen var 3%, og prevalensen var enda høyere hos eldre (15). Prevalensen for årlig bruk av lokale steroider var opp mot 10%. Dette betyr at dersom vi råder til testing av alle som skal seponere glukokortikoider vil det utgjøre en betydelig ekstra kostnad for helsevesenet, og foreløpig finnes det heller ingen «gullstandard» diagnostisk test eller screeningprøve slik at risikoen for både falsk positiv og falsk negativ test øker. Nytten av testing må derfor vurderes opp mot risiko hos den enkelte.
Presis diagnostikk er vanskelig fordi normalområdet for morgenkortisol er bredt (138-690 nmol/L) og det ikke finnes noen sikker grenseverdi der man kan utelukke binyrebarksvikt. Kortisolproduksjonen hos friske har en distinkt døgnrytme med høyeste nivåer tidlig om morgenen, og i tillegg en kortere ultradianrytme med pulser hver time (16), som gir opphav til stor interindividuell og intraindividuell variasjon. Medikamentfastende
morgenkortisol er likevel den enkleste og beste screeningprøve vi har, så lenge en er klar over at en unormal døgnrytme og pågående behandling med glukokortikoider vil påvirke resultatet. Verdier målt med LCMS/ MS under 100 nmol/L tilsier høy sannsynlighet for binyrebarksvikt, og verdier over 300 nmol/L lav sannsynlighet for binyrebarksvikt (17, 18).
Nytten av å måle ACTH er mer usikker. Verdier i referanseområdet eller like over kan gi støtte for diagnosen hos en pasient med lave kortisolnivåer, mens ikke målbare lave ACTH nivåer kan sees ved fortsatt fysiologisk suppresjon av hypofysefunksjonen og kan bety systemiske effekter av pågående eller nylig administrert medikament.
Ved gråsone-verdier av kortisol kan en pragmatisk løsning være å forlenge behandlingen med fysiologisk dose glukokortikoid og måle medikamentfastende morgenkortisol på ny etter noen uker til måneder. Dersom medikamentfastende morgenkortisol da er normalisert har binyrebarksvikten vært forbigående, og steroidbehandlingen kan trappes videre ned mot seponering. Alternativt bør man gå videre med synacthentest (19). Her måles kortisol før og 30 og 60 min etter intravenøs tilførsel av syntetisk ACTH. Lave verdier tyder på sviktende kortisolproduksjon fra binyrebarken (20, 21). En patologisk test regnes som pålitelig, mens det foreligger noe risiko for falsk negativ test tidlig i forløpet. Dersom
egenproduksjonen av ACTH fortsatt er for lav til å gi en fysiologisk økning av kortisolproduksjonen under stress, er det usikkert om en normal synacthentest utelukker fare for binyrekrise under stress.
Behandling og oppfølgning Gradvis nedtrapping av glukokortikoid-behandling tilrådes av flere grunner. Man ønsker å unngå oppbluss av pasientens grunnsykdom, unngå symptomer på withdrawal syndrome og å la binyrene få tid til å gjenvinne egenproduksjonen av kortisol. Med tanke på å unngå symptomatisk binyrebarksvikt er det årvåkenhet særlig ved nedtrapping av dose fra nær fysiologisk nivå som er relevant, altså doser som tilsvarer for eksempel Prednisolon 5 mg. Samtidig bør ikke glukokortikoidbehandling forlenges unødig. For noen pasienter vil langsom nedtrapping av steroider gjøre at HPA-aksen normaliseres slik at man etter hvert kan seponere glukokortikoider. Andre pasienter må stå på glukokortikoider livslangt (11).
Ved påvist steroidindusert binyrebarksvikt må pasientene behandles med glukokortikoider som ved annen binyrebarksvikt. Man ønsker å unngå symptomer på binyrebarksvikt samtidig som man unngår overbehandling med steroider. Cortisone acetat tabletter 25 mg per dag delt i to doser anbefales, på grunn av kort halveringstid som reduserer risiko for bivirkninger og samtidig hemmer hypofysens binyrestimulering minst slik at binyrenes egenproduksjon
potensielt kan økes på sikt. Pasienten bør informeres om risiko for binyrekrise i stress-situasjoner som f.eks. operasjon, infeksjon eller større ulykke, og rådes til å doble dosen med Cortison eller Prednisolon i slike situasjoner. Ved oppkast og/eller diare der tablettene ikke absorberes bør de oppsøke lege for å få Solu-Cortef og saltvann intravenøst. Ved binyrekriser skal de ha samme behandling som andre pasienter med binyrebarksvikt, og bør også utstyres med Norsk steroid-kort (22).
Også pågående behandling med lavdose glukokortikoider gir sårbarhet for kriser fordi behandlingen ofte ikke dekker det ekstra behovet kroppen får ved stress. Disse pasientene bør derfor informeres om risiko for binyrekrise, og tilrådes å øke dosen i stress-situasjoner, til doser tilsvarende minimum 50 mg cortison eller 10 mg Prednisolon per dag (23) .
Konklusjon
Økt oppmerksomhet om risiko for utvikling av binyrebarksvikt hos pasienter som bruker langvarig
glukokortikoidbehandling er viktig for å forebygge akutte kriser. God informasjon til pasient, pårørerende og fastlege er essensielt for å kunne fange opp symptomer på binyrebarksvikt. God diagnostikk er viktig, men vanskelig. Samtidig er det også viktig at tilstanden ikke overdiagnostiseres og overbehandles, slik at behandling med glukokortikoider forlenges unødig og frekvensen av bivirkninger inkludert binyrebarksvikt øker.
Det er behov for mer kunnskap om mortalitet og forekomst av binyrekrise hos pasienter med steroid-utløst binyrebarksvikt. Vi vet heller ikke nok om hvor mange som vil få permanent binyrebarksvikt, og hos hvem og når i tidsforløpet vi kan forvente normalisering av binyrebarkfunksjonen. I påvente av internasjonale guidelines, vises det til nasjonal veileder i endokrinologi som har et kapittel om glukokortikoidutløst binyrebarksvikt (24). Et pragmatisk forslag til praktisk utredning av steroidutløst binyrebarksvikt er skissert under.
• Testing for binyrebarksvikt bør gjøres først når prednisolon skal seponeres og steroid-dosen er trappet ned til Prednisolon ≤ 5mg (tilsvarer daglig behov ved binyrebarksvikt)
• Medikamentfastende morgenkortisol kan brukes som screeningprøve
- S-kortisol <100nmol/L – høy sannsynlighet for binyrebarksvikt, synacthentest lite nyttig. Behandling med Prednisolon 5 mg eller Cortison 12,5 mg x 2 (morgen og middag) er helt nødvendig. Pasienten må øke dosen i stress-situasjoner
- S-kortisol >300nmol/L – lav sannsynlighet for binyrebarksvikt, synacthentest lite nyttig. Prednisolon kan trappes ned til seponering
- Kortisol gråsone 100-300 nmol/L- forleng dosering av Prednisolon 5 mg eller bytt til Cortison 12,5 mg x 2 daglig, og informer pasienten om å øke dose i stress-situasjoner.
- Dersom første kortisol var < 300nmol/L : Revurder medikamentfastende morgenkortisol etter minst 6-12 uker med tanke på normalisering.
• Ved usikkerhet eller fortsatt lave verdier kan man gå videre med synacthen-test (endokrin poliklinikk)
- En patologisk test regnes som pålitelig, mens det er noe risiko for falsk negativ test tidlig i forløpet.
• Ved kroniske symptomer; tenk på flere mulige årsaker og utred før en setter pas på livslang steroidbehandling
• Ved mistanke om binyrekrise; behandle først og utrede etterpå
Referanser
1. Arlt W, Allolio B. Adrenal insufficiency. Lancet. 2003;361(9372):1881-93.
2. Dinsen S, Baslund B, Klose M, Rasmussen AK, Friis-Hansen L, Hilsted L, et al. Why glucocorticoid withdrawal may sometimes be as dangerous as the treatment itself. Eur J Intern Med. 2013;24(8):714-20.
3. Joseph RM, Hunter AL, Ray DW, Dixon WG. Systemic glucocorticoid therapy and adrenal insufficiency in adults: A systematic review. Semin Arthritis Rheum. 2016;46(1):133-41.
4. Broersen LH, Pereira AM, Jorgensen JO, Dekkers OM. Adrenal Insufficiency in Corticosteroids Use: Systematic Review and Meta-Analysis. J Clin Endocrinol Metab. 2015;100(6):2171-80.
5. Hahner S, Spinnler C, Fassnacht M, Burger-Stritt S, Lang K, Milovanovic D, et al. High incidence of adrenal crisis in educated patients with chronic adrenal insufficiency: a prospective study. J Clin Endocrinol Metab. 2015;100(2):407-16.
6. Husebye ES, Pearce SH, Krone NP, Kämpe O. Adrenal insufficiency. Lancet. 2021;397(10274):613-29.
7. Li D, Genere N, Behnken E, Xhikola M, Abbondanza T, Vaidya A, et al. Determinants of Self-reported Health Outcomes in Adrenal Insufficiency: A Multisite Survey Study. J Clin Endocrinol Metab. 2021;106(3):e1408-e19.
8. Smans LC, Van der Valk ES, Hermus AR, Zelissen PM. Incidence of adrenal crisis in patients with adrenal insufficiency. Clin Endocrinol (Oxf). 2016;84(1):17-22.
9. Mebrahtu TF, Morgan AW, Keeley A, Baxter PD, Stewart PM, Pujades-Rodriguez M. Dose Dependency of Iatrogenic Glucocorticoid Excess and Adrenal Insufficiency and Mortality: A Cohort Study in England. J Clin Endocrinol Metab. 2019;104(9):3757-67.
10. Paragliola RM, Papi G, Pontecorvi A, Corsello SM. Treatment with Synthetic Glucocorticoids and the Hypothalamus-Pituitary-Adrenal Axis. Int J Mol Sci. 2017;18(10).
11. Baker EH. Is there a safe and effective way to wean patients off long-term glucocorticoids? Br J Clin Pharmacol. 2020.
12. Theiler-Schwetz V, Prete A. Glucocorticoid withdrawal syndrome: what to expect and how to manage. Curr Opin Endocrinol Diabetes Obes. 2023;30(3):167-74.
13. Esteban NV, Loughlin T, Yergey AL, Zawadzki JK, Booth JD, Winterer JC, et al. Daily cortisol production rate in man determined by stable isotope dilution/mass spectrometry. J Clin Endocrinol Metab. 1991;72(1):39-45.
14. Nicolaides NC. Glucocorticoid Therapy and Adrenal suppression. Endotext2018.
15. Laugesen K, Jørgensen JOL, Petersen I, Sørensen HT. Fifteen-year nationwide trends in systemic glucocorticoid drug use in Denmark. Eur J Endocrinol. 2019;181(3):267-73.
16. Lightman SL, Conway-Campbell BL. The crucial role of pulsatile activity of the HPA axis for continuous dynamic equilibration. Nat Rev Neurosci. 2010;11(10):710-8.
17. Sagar R, Mackie S, A WM, Stewart P, Abbas A. Evaluating tertiary adrenal insufficiency in rheumatology patients on long-term systemic glucocorticoid treatment. Clin Endocrinol (Oxf). 2021;94(3):361-70.
18. Woods CP, Argese N, Chapman M, Boot C, Webster R, Dabhi V, et al. Adrenal suppression in patients taking inhaled glucocorticoids is highly prevalent and management can be guided by morning cortisol. Eur J Endocrinol. 2015;173(5):633-42.
19. Ospina NS, Al Nofal A, Bancos I, Javed A, Benkhadra K, Kapoor E, et al. ACTH Stimulation Tests for the Diagnosis of Adrenal Insufficiency: Systematic Review and Meta-Analysis. J Clin Endocrinol Metab. 2016;101(2):427-34.
20. Ueland GA, Methlie P, Oksnes M, Thordarson HB, Sagen J, Kellmann R, et al. The Short Cosyntropin Test Revisited: New Normal Reference Range Using LC-MS/MS. J Clin Endocrinol Metab. 2018;103(4):1696-703.
21. Sherlock M, Stewart PM. The Short Synacthen Test and Its Utility in Assessing Recovery of Adrenal Function in Patients With Central Adrenal Insufficiency. J Clin Endocrinol Metab. 2019;104(1):17-20.
22. Husebye ES, Erichsen MM, Myhre A-G, Bratke H, Jørgensen AP, Dahlqvist P, et al. Nytt steroidkort ved binyrebarksvikt. Tidsskrift for Den norske legeforening. 2012.
23. Baker BY, Lin L, Kim CJ, Raza J, Smith CP, Miller WL, et al. Nonclassic congenital lipoid adrenal hyperplasia: a new disorder of the steroidogenic acute regulatory protein with very late presentation and normal male genitalia. J Clin Endocrinol Metab. 2006;91(12):4781-5.
24. Tazmini K, Grytaas M, Jørgensen AP, Øksnes M, Husebye ES, Nellemann B. Nasjonal veileder i endokrinologi. Glukokortikoidindusert (iatrogen) binyrebarksvikt: Norsk Endokrinologisk Forening; 2022 [updated 08.03.2022. Available from: https:// metodebok.no/index.

S ikkerhetsinformasjon1:
• Som med andre antitrombotiske midler må Xarelto brukes med forsiktighet hos de med økt blødningsrisiko
• Vær oppmerksom på pasienter med nedsatt nyrefunksjon
• Skal ikke brukes ved kreatininclearance <15 ml/min
• Xarelto er ikke anbefalt hos de med kunstige hjerteklaffer
• Vanligste rapporterte bivirkninger på Xarelto er blødningskomplikasjoner
• Bruk anbefales ikke hos pasienter med tidligere trombose diagnostisert med antifosfolipidsyndrom, særlig pasienter som er trippel-positive (for lupus antikoagulant, antikardiolipin antistoffer, og anti-beta 2-glykoprotein I antistoffer), da behandling kan være assosiert med økt forekomst av tilbakevendende trombotiske hendelser. Samtidig behandling med alle andre antikoagulanter er kontraindisert, unntatt ved bytte av antikoagulasjonsbehandling eller når ufraksjonert heparin administreres for å holde sentralt vene- eller arteriekateter åpent
• Se felleskatalogteksten før forskrivning av Xarelto, merk spesielt kontraindikasjoner, forsiktighetsregler, interaksjoner og bivirkninger
NOAK, non-vitamin K-antagonist oral antikoagulant

Referanser: 1. Xarelto® (rivaroksaban) preparatomtale, 07/2023
Bayer AS, pb 193, 1325 Lysaker, tlf: 23 13 05 00
Xarelto (Rivaroksaban), antitrombotisk middel, ATC-nr B01 AF01. Tabletter 15 mg og 20 mg. Indikasjon: Forebygging av slag og systemisk emboli hos voksne med ikkeklaffeassosiert atrieflimmer med én eller flere risikofaktorer, slik som kongestiv hjertesvikt, hypertensjon, alder ≥ 75 år, diabetes mellitus, tidligere slag eller forbigående iskemisk anfall. Dosering: Anbefalt dose er 20 mg 1 gang daglig. Behandling bør pågå over lengre tid forutsatt at fordeler ved forebygging av slag og systemisk emboli er større enn blødningsrisiko. Glemt dose: Skal tas umiddelbart, og neste dag fortsetter man med 1 daglig dose. Dobbel dose skal ikke tas i løpet av én og samme dag som erstatning for glemt dose. For pasienter med moderat/alvorlig nedsatt nyrefunksjon (CrCl15–49 ml/min) er anbefalt dose 15 mg 1 gang daglig. 15 og 20 mg tabletter skal tas sammen med mat. Behandling med rivaroksaban kan inititeres eller fortsettes ved behov for konvertering. For alle pasienter bør det før konvertering innhentes en bekreftelse på at rivaroksaban er tatt i henhold til forskrivning. Beslutning om initiering og varighet av behandling skal ta hensyn til gjeldende retningslinjer for antikoagulasjonsbehandling. Pasienter med ikke-valvulær atrieflimmer som gjennomgår PCI med innsetting av stent: Data vedrørende sikkerhet er tilgjengelig. Begrenset erfaring med redusert dose på 15 mg 1 gang daglig (eller 10 mg 1 gang daglig ved moderat nedsatt nyrefunksjon, CrCl30–49 ml/min) i tillegg til P2Y12-hemmer i ≤ 12 måneder. Bivirkninger: Kan forbindes med økt risiko for skjult eller synlig blødning fra vev/ organer, noe som kan føre til posthemoragisk anemi. Symptomer og alvorlighetsgrad (inkl. dødelig utgang) varierer ut fra lokalisering, grad eller omfang av blødningen og/eller anemien. Blødningsrisiko kan være økt hos visse pasientgrupper, f.eks. ved ukontrollert alvorlig arteriell hypertensjon og/ eller ved samtidig behandling med andre legemidler som påvirker hemostasen. Menstruasjonsblødninger kan øke og/eller bli forlenget. Blødningskomplikasjoner kan manifesteres som svakhet, blekhet, svimmelhet, hodepine eller uforklarlig hevelse, dyspné og uforklarlig sjokk. Symptomer på hjerteiskemi som brystsmerter eller angina pectoris kan oppstå som en konsekvens av anemi. Komplikasjoner sekundært til alvorlig blødning, som kompartmentsyndrom og nyresvikt pga. hypoperfusjon, kan oppstå. Det må derfor tas hensyn til muligheten for blødning ved evaluering av tilstanden til enhver antikoagulert pasient. Vanlige (≥ 1/100 til < 1/10): Blod/lymfe: Anemi (inkl. respektive laboratorieparametre). Gastrointestinale: Diaré, dyspepsi, forstoppelse1, gastrointestinal blødning (inkl. rektalblødning), gastrointestinale/abdominale smerter, gingival blødning, kvalme, oppkast1. Generelle: Feber1, nedsatt generell styrke og energi (inkl. fatigue, asteni), perifert ødem. Hud: Ekkymose, kutan/subkutan blødning, pruritus (inkl. mindre vanlige tilfeller av generalisert pruritus), utslett. Kar: Hematom,


hypotensjon. Lever/galle: Transaminasestigning. Luftveier: Epistakse, hemoptyse. Muskelskjelettsystemet: Smerte i ekstremitet1. Nevrologiske: Hodepine, svimmelhet. Nyre/urinveier: Blødninger i urogenitaltractus (inkl. hematuri og menoragi)2, nedsatt nyrefunksjon (inkl. økt kreatinin i blod, økt karbamid i blod). Skader/komplikasjoner: Blødning etter inngrep (inkl. postoperativ anemi og sårblødning), kontusjon, sårsekresjon1. Øye: Øyeblødning (inkl. konjunktivalblødning). Mindre vanlige (≥ 1/1000 til < 1/100): Blod/lymfe: Trombocytopeni, trombocytose (inkl. økt blodplatetall) 1. Gastrointestinale: Munntørrhet. Generelle: Malaise. Hjerte: Takykardi. Hud: Urticaria. Immunsystemet: Allergisk dermatitt, allergisk reaksjon, allergisk ødem, angioødem. Lever/galle: Nedsatt leverfunksjon, økt alkalisk fosfatase1, økt bilirubin, økt γ-GT1. Muskel-skjelettsystemet: Hemartrose. Nevrologiske: Cerebral og intrakraniell blødning, synkope. Undersøkelser: Amylaseøkning1, lipaseøkning, økt laktatdehydrogenase1 Sjeldne (≥ 1/10 000 til < 1/1000): Generelle: Lokalt ødem1. Lever/galle: Gulsott, hepatitt (inkl. hepatocellulær skade), kolestase, økt konjugert bilirubin (med eller uten samtidig økt ALAT). Muskel-skjelettsystemet: Muskelblødning. Skader/komplikasjoner: Vaskulær pseudoaneurisme (sett med frekvens mindre vanlig ved forebygging av aterotrombotiske hendelser etter perkutan koronarintervensjon). Svært sjeldne (< 1/10 000): Hud: DRESS, Stevens-Johnsons syndrom/toksisk epidermal nekrolyse. Immunsystemet: Anafylaktisk reaksjon (inkl. anafylaktisk sjokk). Luftveier: Eosinofil pneumoni. Ukjent frekvens: Muskelskjelettsystemet: Kompartmentsyndrom sekundært til blødning.Nyre/urinveier: Antikoagulantrelatert nefropati. Nyresvikt/akutt nyresvikt sekundært til blødning som er tilstrekkelig til å forårsake hypoperfusjon. For beskrivelse av enkelte bivirkninger, se Forsiktighetsregler og SPC. 1. Sett ved forebygging av VTE hos voksne som gjennomgår elektiv hofte eller kneprotesekirurgi. 2. Menoragi er svært vanlig ved behandling av DVT, LE og forebygging av tilbakefall hos kvinner < 55 år. Forsiktighetsregler: Pasienter med kunstige klaffer: Skal ikke brukes som tromboseprofylakse ved nylig utført kateterbasert implantasjon av aortaklaffer (TAVR). Bruk anbefales ikke til pasienter med kunstige hjerteklaffer pga. manglende data. Brukes med forsiktighet ved alvorlig nedsatt nyrefunksjon, pga. økt blødningsrisiko. Bruk ved CrCl<15 ml/min anbefales ikke. Blødningsrisiko: Pasienten skal observeres nøye for tegn på blødning. Brukes med forsiktighet ved økt blødningsrisiko. Administrering skal avbrytes ved alvorlig blødning. Ved blødning kan doseutsettelse eller seponering vurderes. Behandling tilpasses individuelt ut fra alvorlighetsgrad og lokalisering av blødning. Egnet symptomatisk behandling kan brukes ved behov, f.eks. mekanisk kompresjon (f.eks. ved alvorlig epistaksis), kirurgiske prosedyrer

for blødningskontroll, væskebehandling og hemodynamisk støtte, blodprodukter (pakkede røde blodceller eller ferskfrosset plasma, avhengig av anemi eller koagulopati) eller blodplater. Dersom blødningen ikke kan kontrolleres bør administrering av enten et spesifikt reverseringsmiddel for FXa-hemmere (andeksanet alfa), eller en reverserende prokoagulant f.eks. protrombinkomplekskonsentrat (PCC), aktivert protrombinkomplekskonsentrat (APCC) eller rekombinant faktor VIIa (r-FVIIa), vurderes. Interaksjoner: Samtidig behandling med sterke hemmere av CYP3A4 eller P-gp anbefales ikke. Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Aktiv klinisk signifikant blødning. Samtidig bruk av sterke CYP3A4induktorer kan gi redusert plasmakonsentrasjon av rivaroksaban, og samtidig bruk bør derfor unngås med mindre pasienten overvåkes nøye for symptomer på trombose. Samtidig administrering med dronedaron bør unngås pga. begrensede data.Forsiktighet skal utvises ved samtidig behandling med andre antikoagulanter, pga. økt blødningsrisiko (se også Kontraindikasjoner). Forsiktighet skal utvises ved samtidig bruk av legemidler som påvirker hemostasen; NSAID, ASA, platehemmere eller SSRI og SNRI. Lesjoner/tilstander, dersom dette anses å være en betydelig risiko for alvorlig blødning. Samtidig behandling med alle andre antikoagulanter, unntatt ved bytte av antikoagulasjonsbehandling eller når ufraksjonert heparin administreres for å holde sentralt vene- eller arteriekateter åpent. Leversykdom assosiert med koagulopati og klinisk relevant blødningsrisiko, inkl. cirrhosepasienter med Child-Pugh B og C. Graviditet og amming. Pakninger og priser: 15 mg: 28 stk. (blister) kr 733,80. 98 stk. (blister) kr 2477,70. 100 × 1 stk. (endose) kr 2527,50. 20 mg: 28 stk. (blister) kr 733,80. 98 stk. (blister) kr 2477,70. 100 × 1 stk. (endose) kr 2527,50. Refusjon: 15 og 20 mg: Refusjonsberettiget bruk: Forebygging av slag og systemisk emboli hos voksne pasienter med ikke-klaffeassosiert atrieflimmer med en eller flere risikofaktorer, slik som kongestiv hjertesvikt, hypertensjon, alder f.o.m 75 år, diabetes mellitus, tidligere slag eller forbigående iskemisk anfall. Refusjonskode: ICPC: K78, K93, K94; ICD: I26, I48, I80, I82. Vilkår: Ingen spesifisert. Basert på Xarelto SPC godkjent av SLV/EMA 07/2023. Bayer AS, Postboks 193, 1325 Lysaker. Tlf: 23 13 05 00. Reseptgruppe C. For ytterligere informasjon se www.felleskatalogen.no.
MA-XAR-NO-0106-6, AUG 2023
PP-XAR-NO-1054-1, MAI 2024

Elisabeth Sofie Meisfjord

Kristin Hammersbøen Bjørlykke

Lars Gustav Lyckander

Håkon Seierstad

Knut E. A. Lundin
Enteropati med intestinal totteatrofi forårsakes oftest av cøliaki. Ikke-cøliakisk enteropati kan være en diagnostisk utfordring. Dette illustreres med to kasuistikker med medikamentindusert enteropati ved bruk av olmesartan.
Elisabeth Sofie Meisfjord, medisinstudent, Universitetet i Oslo.
Kristin Hammersbøen Bjørlykke, overlege PhD, Gastromedisinsk avdeling, Akershus Universitetssykehus. Lars Gustav Lyckander, overlege, Avdeling for patologi, Oslo Universitetssykehus, Rikshospitalet. Håkon Seierstad, overlege, Spesialist i fordøyelsessykdommer og indremedisin, Sykehuset Innlandet Hamar. Knut E. A. Lundin, utdanningsleder, professor, dr. med. Institutt for klinisk medisin, Det medisinske fakultet, UiO Overlege, Seksjon for gastromedisin, Avdeling for Transplantasjonsmedisin, KIT, OUS Rikshospitalet.
Introduksjon
Det er godt kjent at cøliaki er den vanligste årsaken til enteropati med totteatrofi i tynntarm. Diagnosen cøliaki stilles på bakgrunn av funn på duodenalbiopsier og positive serumprøver (1). I diagnostikken vektlegges også god respons på glutenfri diett. Diagnostikken er ofte enkel - men når noe ikke stemmer, må man tenke på andre årsaker. Ikke-cøliakisk enteropati er en heterogen sykdomsgruppe, som blant annet rommer medikamentindusert enteropati (2). Tilstanden kan bli svært alvorlig for pasientene, men behandlingen er heldigvis effektiv.
NSAIDs og immunsupprimerende medikamenter har lenge vært kjent for å kunne gi mild enteropati. I 2012 ble det for første gang beskrevet en mulig sammenheng mellom angiotensin II-reseptorblokkeren (ARB) olmesartan og alvorlig ikkecøliakisk enteropati, og flere tilfeller har blitt rapportert siden (3, 4). Virkestoffet olmesartanmedoksomil er et prodrug som omdannes til olmesartan, og brukes på indikasjonene essensiell hypertensjon hos voksne, samt hypertensjon hos barn i alderen 6-18 år. I Felleskatalogen er «sprueliknende enteropati» oppført som en svært sjelden bivirkning av olmesartanmedoksomil i preparatomtalen (5). Tilstanden
kjennetegnes av alvorlig diaré, vekttap og totteatrofi (4).
En internasjonal konsensusartikkel fra 2022 hevdet at medikamentindusert enteropati er enkelt å skille fra såkalt seronegativ cøliaki (2). Vårt inntrykk er at enteropati forårsaket av ARB-er ikke er godt nok kjent i Norge, og vi ønsker derfor å rette oppmerksomheten mot denne alvorlige medikamentbivirkningen ved hjelp av to kasuistikker fra to forskjellige sykehus i Helse Sør-Øst. Begge pasientene har samtykket til publisering og avgitt skriftlig samtykke til oppslag i journal og etterundersøkelse av vevsprøver.
Kasuistikk 1
En kvinne i 60-årene ble innlagt på lokalsykehus med magesmerter, løs og hyppig avføring med vond lukt, samt et ufrivillig vekttap på 3-4 kg over de siste månedene.
Av tidligere sykdommer hadde hun diabetes type 1 med retinopati, hypertensjon og claudicatio intermittens. Av faste medisiner brukte hun bumetanid 1 mg x 1, atenolol 50 mg x 1, olmesartanmedoksomil/ hydroklortiazid 20 mg/12,5 mg x 2, acetylsalisylsyre 160 mg x 1, simvastatin 20 mg x 1, lerkanidipin 20 mg x 1 og insulin glargin uten angitt dose.
Forløp og utredning
Gjennom et halvt år hadde pasienten flere innleggelser med vedvarende vanntynn diaré og ytterligere vekttap. Iskemisk kolitt ble vurdert etter funn på koloskopi og på bakgrunn av hennes karsykdom. Koloskopi to måneder senere viste normal kolonslimhinne.
Det ble da også tatt biopsier fra terminale ileum, som viste moderat totteatrofi og kronisk betennelse. Duodenalbiopsi viste totteatrofi og økt antall intraepiteliale lymfocytter (bilde 1 og 2) tilsvarende cøliaki Marsh grad 3b. Anti-TG2 var negativ og hun hadde normal total IgA. MR av tynntarm viste normale forhold.
Etter 4 måneder var det totale vekttapet på 15 kg, og pasienten hadde begynt å miste håret. Til nå hadde hun blitt behandlet med væske intravenøst, loperamid, fordøyelsesenzymer og D-vitamintilskudd i uvanlig store doser, uten at dette resulterte i betydelig bedring.
Vurdering
Differensialdiagnosene som ble drøftet var iskemisk kolitt, cøliaki, autonom nevropati grunnet langvarig diabetes type 1, eksokrin pankreassvikt, Crohns sykdom og tynntarmslymfom. Cøliaki ble sett på som lite sannsynlig basert på negativ serologi og negativ HLA-typing for DQ2 og
DQ8. Det ble tatt flowcytometri fra duodenum og benmargsbiopsi med tanke på tynntarmslymfom, uten å finne holdepunkter for malignitet.
To måneder senere ble pasienten vurdert på universitetssykehus. På dette tidspunktet hadde hun ikke lenger diaré og magesmerter, men fremdeles vedvarende lav vekt og hårtap. Enteroskopi var uten funn av forklarende patologi. Biopsi viste igjen en tynntarmslimhinne med totteatrofi og økt antall intraepiteliale lymfocytter, og nå i tillegg krypthyperplasi. PCR for Tropheryma whipplei var negativ.
Endelig diagnose
Medikamentet olmesartanmedoksomil/hydroklortiazid som pasienten hadde vært behandlet med de siste 4 årene, ble så foreslått som mulig årsak til hennes plager. Legemidlet ble seponert.
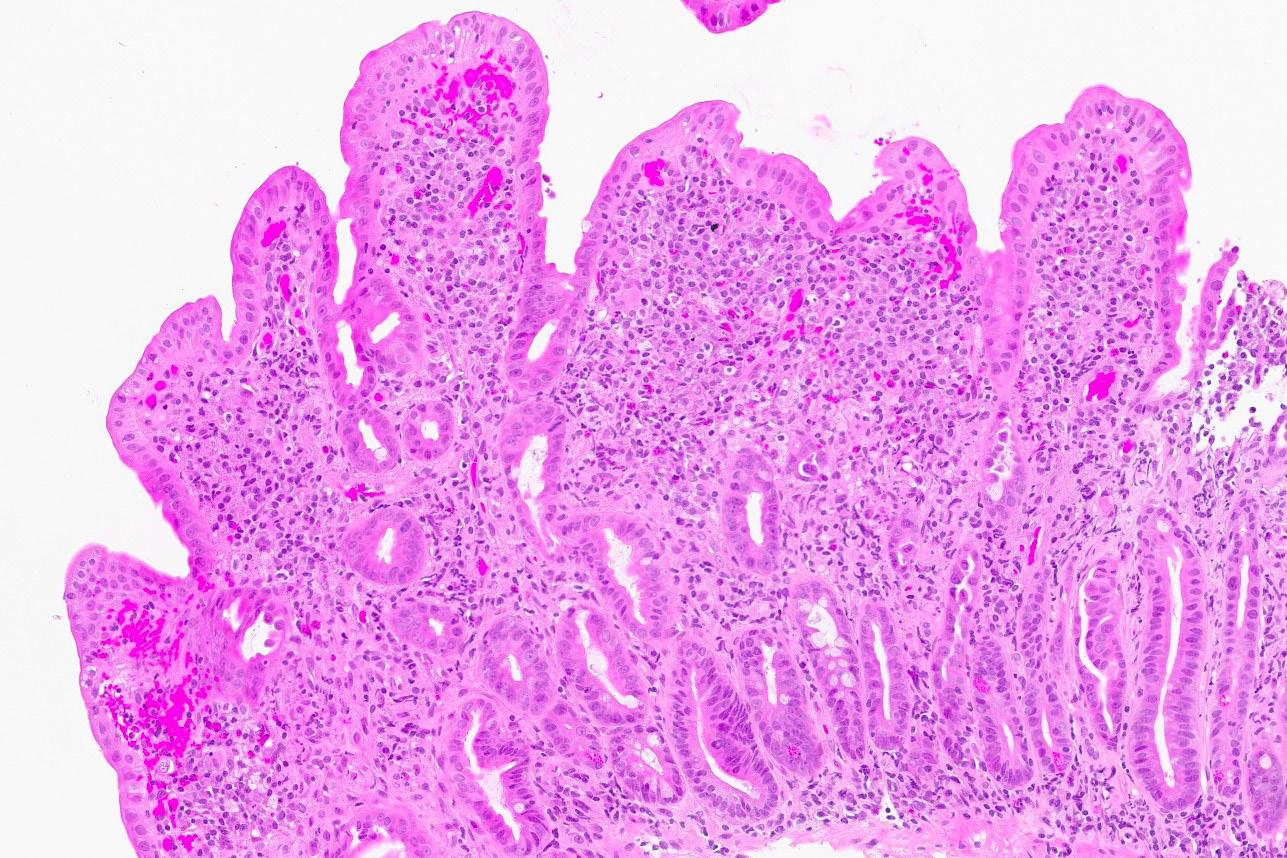
To måneder senere hadde pasienten lagt på seg 5 kg, og hadde mer normalisert avføring. Magesmertene var borte, og håret hadde begynt å komme tilbake. Kontollbiopsi fra duodenum et år senere viste normalisering av slimhinnen med kun mindre områder med ombygget tottearkitektur og gastrisk metaplasi (bilde 3). Vekten var stabil, og hun hadde ingen abdominale plager.
Samtale med pasienten
Pasienten beskriver perioden med sykdom som svært alvorlig. Både hun selv og hennes pårørende var redde for at hun ikke skulle klare seg. Hun husker best den forferdelige vonde lukta, konstant løping på toalettet og at hun var veldig sliten. I dag lever pasienten helt uten plager fra mage og tarm. Hun har de siste årene hatt et hjerneslag uten sekveler, og har leddplager i hendene. Ellers føler hun seg i god form.
Kasuistikk 1
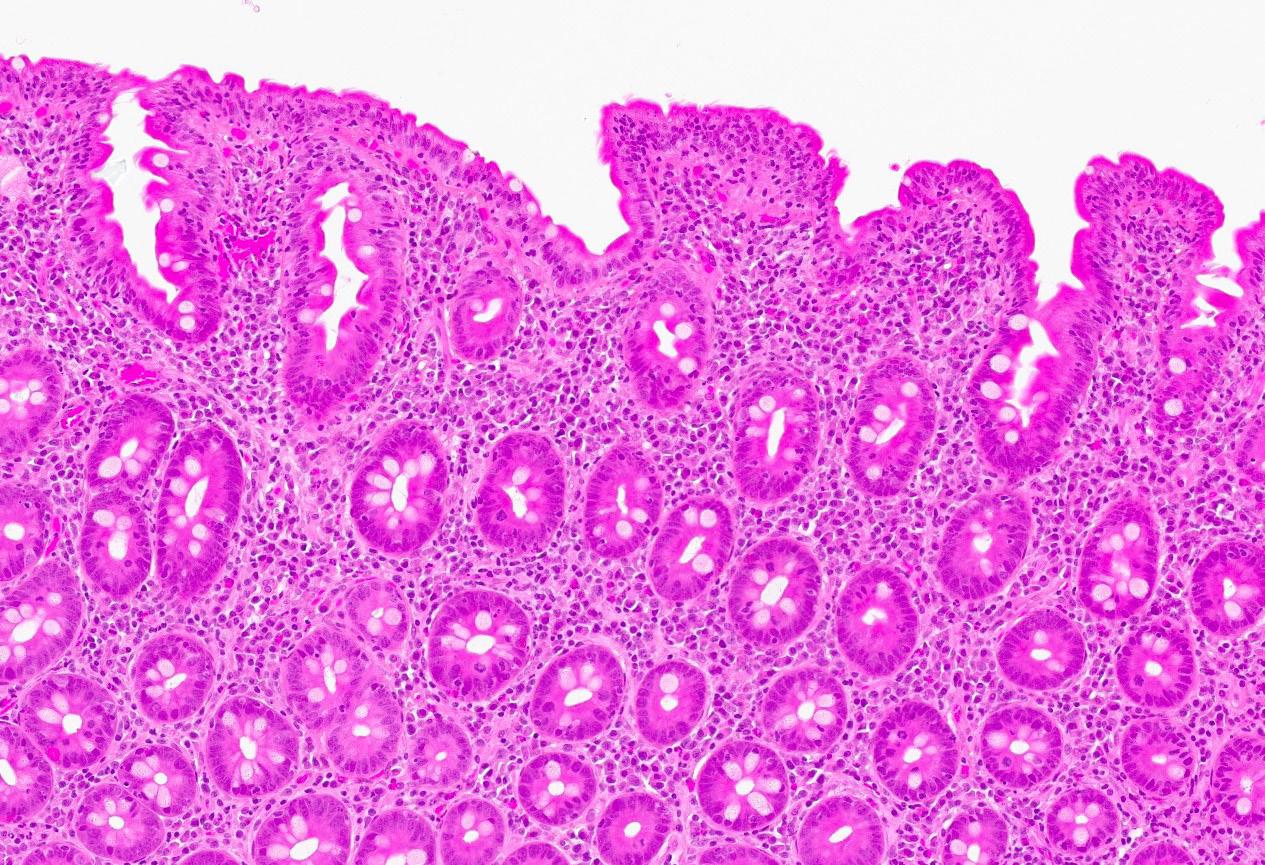
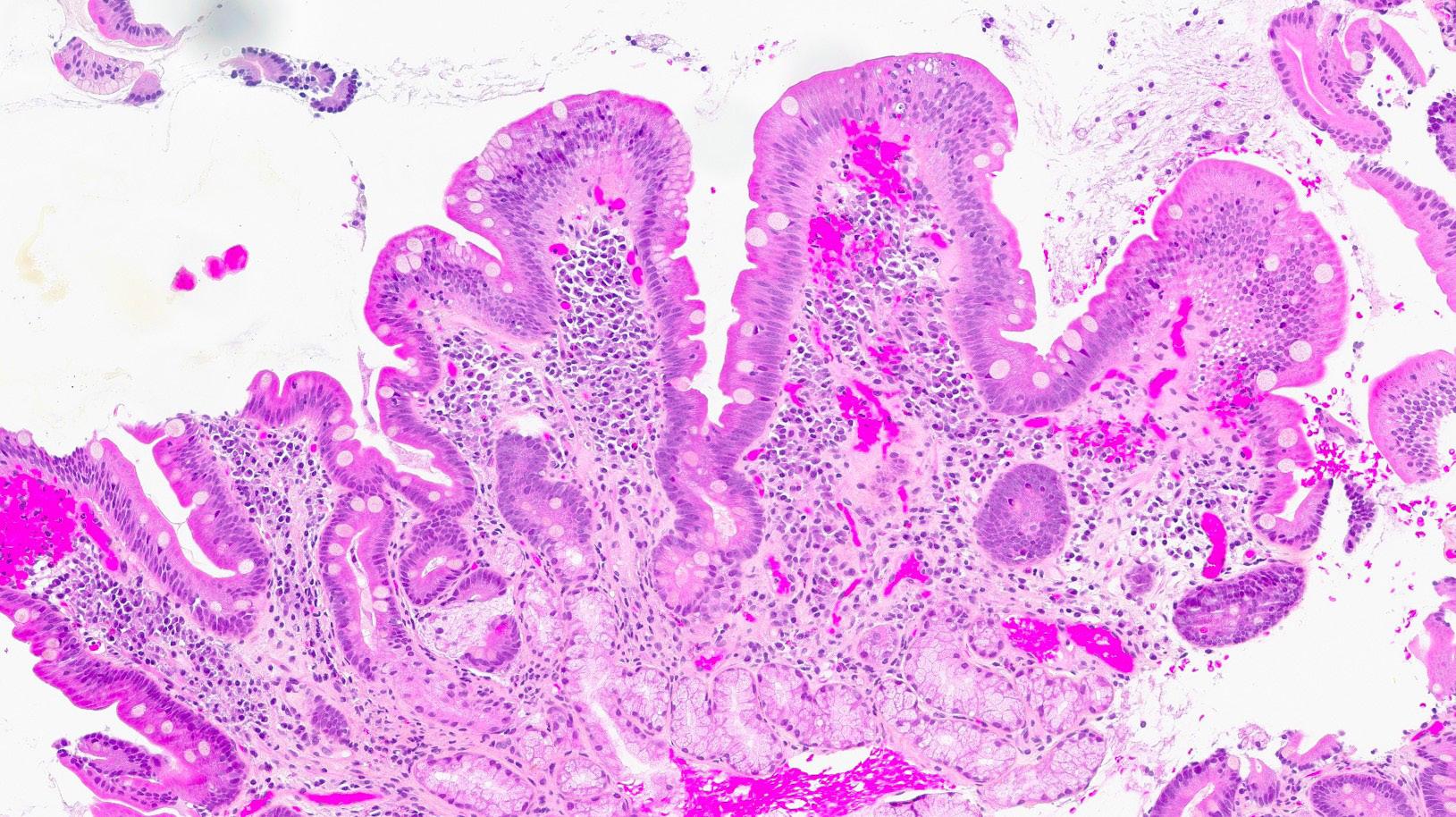
Bilde 1: (HES, 120x) Fra syk fase. Biopsi fra duodenum med uttalt totteatrofi, nærmest flat slimhinne. Blandet betennelsesinfiltrat i lamina propria (lymfocytter, plasmaceller, nøytrofile og eosinofile granulocytter) og økt antall lymfocytter i overflateepitelet.
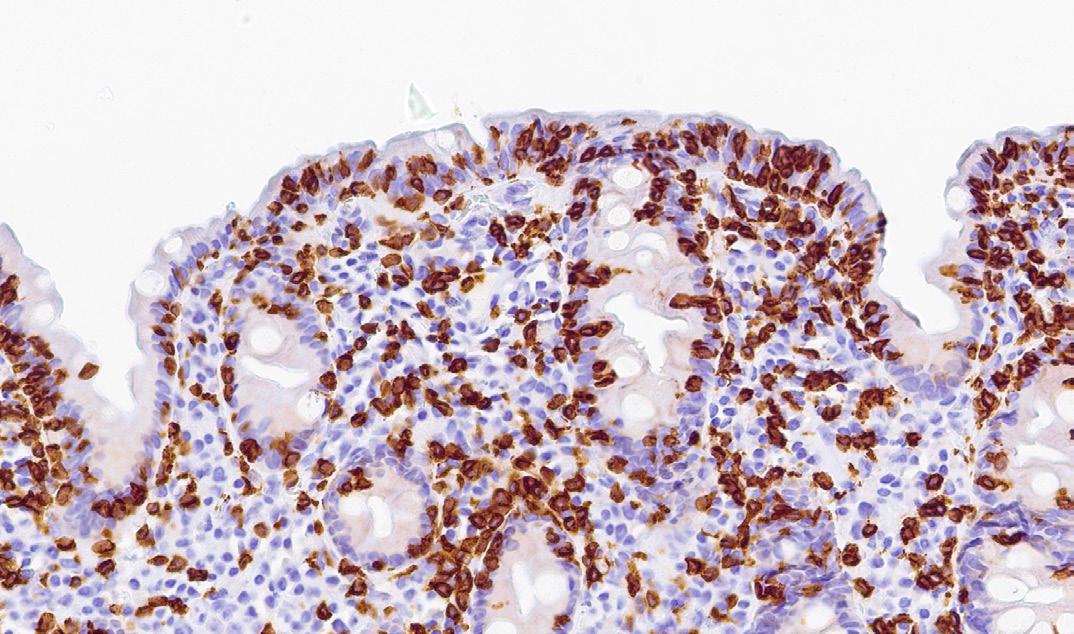
Bilde 2: (CD3, 300x) Fra syk fase. Immunhistokjemisk undersøkelse viser betydelig økt antall CD3-positive T-lymfocytter i overflateepitelet.
Bilde 3: (HES, 120x) Etter seponering. Biopsi fra duodenum (artefaktpreget med «hakk») med tilnærmet normale funn. Et mindre fokus gastrisk metaplasi i overflateepitelet (nede til høyre).
Kasuistikk 2
En mann i slutten av 60-årene ble innlagt på sykehus med vandig diaré de siste tre ukene og et ufrivillig vekttap på 7 kg.
Av tidligere sykdommer hadde han hyperkolesterolemi, hypertensjon og lavgradig cancer prostata under aktiv overvåkning. Av faste medisiner brukte han olmesartanmedoksomil/ hydroklortiazid 20 mg/12,5 mg x 1, atorvastatin 40 mg x 1 og allopurinol 100 mg x 1 ved behov.
Forløp og utredning
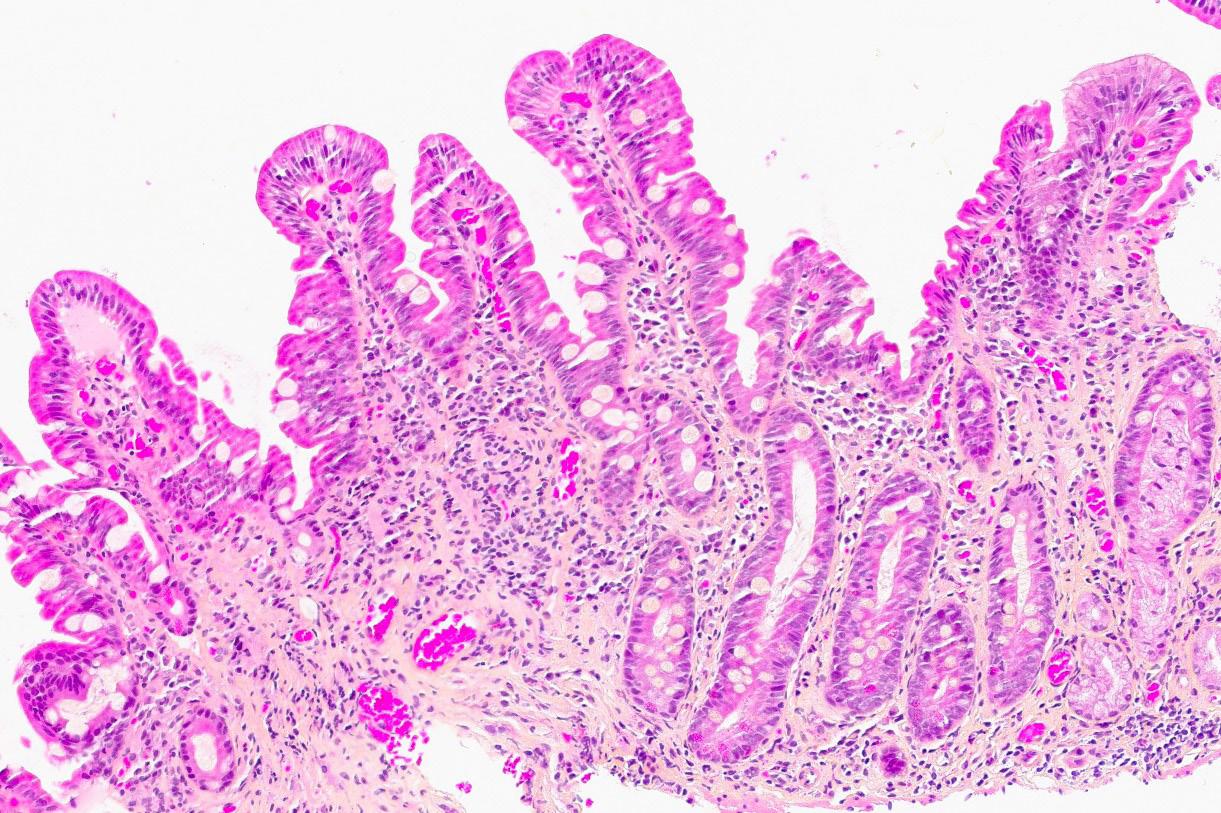
Gjennom 1,5 år var pasienten innlagt 7 ganger med residiverende og etter hvert refraktær diaré. I denne perioden hadde han et totalt vekttap på 23 kg, tilsvarende 30% av kroppsvekten. Første avføringsprøve i forløpet var positiv for PCR adenovirus. Koloskopi viste en hvitlig forandring på ileocøkalklaffen med usikker betydning. Biopsi fra kolon hadde diffuse funn som ble tolket som regenerative forandringer etter adenovirus. Senere koloskopi inkludert kolonbiopsier viste normale forhold.
Gastroskopi avdekket en lett gastroduodenitt og en småknudrete duodenalslimhinne. Duodenalbiopsi tidlig i forløpet viste moderat til uttalt totteatrofi, og det ble ikke vist økt antall intraepiteliale lymfocytter (bilde 4 og 5). Duodenalbiopsier senere i forløpet viste totteatrofi og flekkvis økt antall intraepiteliale lymfocytter, tolket som forenlig med cøliaki. Det ble ikke påvist Giardia lamblia eller Tropheryma whipplei. Kapselendoskopi viste atrofiske slimhinner. Serumprøvene for cøliaki var negative, men pasienten var positiv for HLA DQ-2.5. Pasienten forsøkte glutenfri diett, men ble etter hvert svært dårlig og hadde behov for sondeernæring med parenteralt supplement.
Vurdering
Først ble pasienten vurdert til å ha en postinfeksiøs diaré. Siden plagene vedvarte, vurderte man mikroskopisk kolitt eller Crohns sykdom, men man fant ikke holdepunkter for dette histologisk. Autoimmun enteropati ble også vurdert på bakgrunn av duodenalfunn, men pasienten testet
negativt for antistoffer mot tarmepitelceller. CT tynntarm viste mulig mesenteriell adenitt. Manglende funn av monoklonale, maligne celler avkreftet mistanken om refraktær cøliaki type 2. Refraktær cøliaki type 1 ble arbeidsdiagnosen, men det var klart at det var «noe som ikke stemte».
Pasienten ble periodevis behandlet med budesonid, prednisolon og infliksimab med variabel effekt. Han ble også behandlet med loperamid og opiumsdråper samt fordøyelsesenzymer grunnet mistanke om sekundær pankreasinsuffisiens.
Endelig diagnose Olmesartanindusert enteropati kom etter hvert opp som en mulig diagnose, og olmesartanmedoksomil/hydroklortiazid ble seponert. Pasienten hadde vært behandlet med legemidlet i 3 år.
3 måneder senere var pasienten i betydelig bedring med totalt 16 kg vektoppgang og fast regelmessig avføring. Han tok tilskudd med kaliumsitrat, magnesium, kalsium og vitamin D. Biopsi fra tynntarm viste tarmtotter med reaktive forandringer med regenerasjon og lett redusert høyde, senere retolket som tilnærmet normalt (bilde 6). Man så ingen intraepiteliale lymfocytter, men økt antall plasmaceller i lamina propria, som ved uspesifikk duodenitt. Ved ny kontroll 6 måneder senere hadde pasienten fremdeles regelmessig, normal avføring, tok ingen tilskudd, og hadde gått opp ytterligere 13 kg.
Samtale med pasienten
Pasienten husker perioden med sykdom som dramatisk. Han var helt sengeliggende mot slutten, og trengte 1 måneds rehabiliteringsopphold etter utskrivelse fra sykehus. Før det aktuelle hadde han vært svært sprek, og føler enda ikke han har kommet seg helt tilbake i den formen han var i. Han har i dag ingen plager fra mage og tarm. Siden da har pasienten gjennomgått prostataektomi grunnet sin prostatakreft, men har ellers ingen nye sykdommer.
Diskusjon
Enteropati med intestinal tottatrofi og negativ cøliakiserologi kan være en diagnostisk utfordring slik våre to kasuistikker illustrerer. I 2012 ble den første studien om ARB-indusert enteropati publisert (3). I januar 2024 ble det publisert en systematisk oversikt om samme tema, som så på 183 rapporterte kasuistikker (4). De vanligste symptomene er alvorlig diaré, vekttap og magesmerter. Pasientene kan ha tatt medikamentet i alt fra 1 måned til 14 år før symptomene inntrer. De typiske histologiske funnene på duodenalbiopsi er totteatrofi og økt antall intraepiteliale lymfocytter. Den samme litteraturen viser en viss økt forekomst av HLA-typene HLA-DQ2 og HLA-DQ8 hos denne pasientgruppen sammenlignet med den generelle befolkningen, men ikke på langt nær så definitivt som ved cøliaki. Svært få pasienter med olmesartanindusert enteropati hadde utslag på cøliakiassosierte antistoffer (4). Altså likner sykdommen på cøliaki histologisk og viser en mulig lik HLA-sammenheng, men fraværet av antistoffer og manglende respons på glutenfri diett gjør diagnosen cøliaki lite sannsynlig hos disse pasientene.
Patogenese
Man vet fremdeles svært lite om patogenesen bak ARB-indusert enteropati. En artikkel av Marietta fra 2015 fant at olmesartans påvirkning på tarmepitelet kunne minne om tarmepitelets respons på gluten hos cøliakere (6). Man fant blant annet økt antall CD8+ celler og økt utrykk av IL-15R hos epitelcellene i duodenalbiopsiene hos pasientene som brukte olmesartan.
En klasseeffekt?
Olmesartan er den ARB-en som hyppigst er assosiert med tilstanden. I den systematiske oversikten fra 2024 fant man at olmesartan var involvert i over 90% av kasuistikkene, men det har også blitt rapportert liknende kasuistikker med ARB-ene telmisartan, irbesartan, valsartan, lorsartan, kandesartan og eprosartan (4). Ifølge tall fra reseptregisteret var det 3061 registrerte brukere av virkestoffet olmesartanmedoksomil i Norge i 2020. Ved tilsvarende søk på alle ARB-er finner man totalt 525 800 brukere.
En utypisk legemiddelbivirkning I begge kasuistikkene som ble presentert her var pasientene under utredning for sine plager i flere måneder, uten at medikamentbivirkninger ble grundig vurdert som en mulig årsak. En medvirkende forklaring på dette kan være at pasientene hadde brukt olmesartanmedoksomil i lang tid før symptomene slo inn, noe som ikke er det mest typiske ved legemiddelbivirkninger.
Likevel er det grunn til å tro at manglende kjennskap til ARBindusert enteropati var den viktigste årsaken til den sene diagnostikken hos disse to pasientene.
Konklusjon
Ved funn av et cøliakiliknende bilde histopatologisk, men negativ cøliakiserologi, burde man vurdere om en ARB kan være årsaken, og da særlig hvis pasienten behandles med olmesartan. Prognosen ser heldigvis ut til å være god, da de aller fleste pasienter kommer i full remisjon etter seponering av legemidlet.
Interessekonflikter
Forfatterne oppgir ingen interessekonflikter med relevans for denne publikasjonen.
Kasuistikk 2
Bilde 4: (HES, 100x) Fra syk fase. Biopsi fra duodenum med moderat atrofi av totter. Andre områder viste uttalt totteatrofi. Det ses blandet betennelsesinfiltrat i lamina propria (lymfocytter, plasmaceller, nøytrofile og eosinofile granulocytter) uten sikkert økt antall lymfocytter i overflateepitelet. Fokale degenerative forandringer i kryptepitelet.
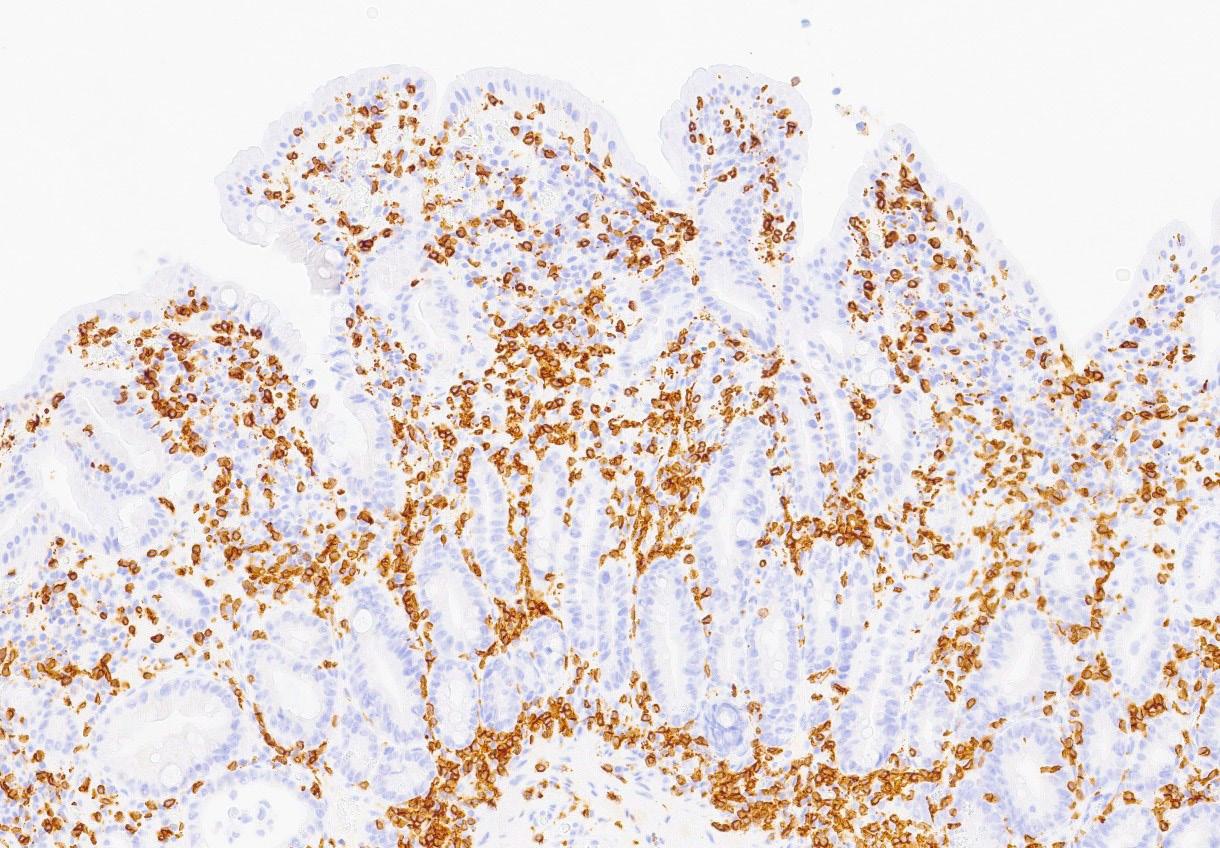
Bilde 5: (CD3, 100x) Fra syk fase. Immunhistokjemisk undersøkelse viser ikke økt antall CD3-positive T-lymfocytter i overflateepitelet.
Referanser
1 Helsebiblioteket. 5.13: Cøliaki 2020 [Available from: https://www.helsebiblioteket.no/innhold/ retningslinjer/pediatri/generell-veileder-i-pediatri/5. mage-tarm-lever-og-ernaering/5.13-coliaki.
2 Schiepatti A, Sanders DS, Baiardi P, Caio G, Ciacci C, Kaukinen K, et al. Nomenclature and diagnosis of seronegative coeliac disease and chronic non-coeliac enteropathies in adults: the Paris consensus. Gut. 2022;71(11):2218-25.
3 Rubio-Tapia A, Herman ML, Ludvigsson JF, Kelly DG, Mangan TF, Wu TT, et al. Severe spruelike enteropathy associated with olmesartan. Mayo Clin Proc. 2012;87(8):732-8.
4 Schiepatti A, Minerba P, Puricelli M, Maimaris S, Arpa G, Biagi F, et al. Systematic review: Clinical phenotypes, histopathological features and prognosis of enteropathy due to angiotensin II receptor blockers. Aliment Pharmacol Ther. 2024.
5 Felleskatalogen. Olmesartan medoxomil Krka 2022 [Available from: https://www.felleskatalogen.no/ medisin/olmesartan-medoxomil-krka-krka-637180.
6 Marietta EV, Nadeau AM, Cartee AK, Singh I, Rishi A, Choung RS, et al. Immunopathogenesis of olmesartan-associated enteropathy. Aliment Pharmacol Ther. 2015;42(11-12):1303-14.
Bilde 6: (HES, 120x) Etter seponering. Biopsi fra duodenum (noe artefaktpreget med «hakk») med tilnærmet normale funn. Et mindre fokus gastrisk metaplasi i overflateepitelet (oppe til venstre).
TRANSTYRETIN AMYLOID KARDIOMYOPATI (ATTR-CM) ER EN UNDERDIAGNOSTISERT ÅRSAK TIL HJERTESVIKT1,2
ATTR-CM behandling med fem års overlevelsesdata 3
Etter 30 måneder reduserte Vyndaqel risiko vs. placebo for 4,‡:
Død uansett årsak


Kardiovaskulære sykehusinnleggelser


HR: 0,70 (95 % KI: 0,51-0,96)



Relativ risikoratio: 0,68 (95 % CI 0,56-0,81)
Etter fem år var relativ risikoreduksjon for død uansett årsak 41 % (HR: 0,59 (95% KI: 0,44-0,79))3

www.pfi.sr/behandle
Se Einar Gude sitt foredrag: Hvem skal behandles for ATTR hjerteamyloidose og hvordan?
▼Vyndaqel® (tafamidis) 61 mg er indisert til behandling av villtype eller arvelig transtyretin amyloid kardiomyopati (ATTR-CM). Anbefalt dosering er 1 kapsel 1 gang daglig. Forsiktighet anbefales ved alvorlig nedsatt leverfunksjon. Kan gi interaksjoner ved klinisk relevante konsentrasjoner med BCRP-substrater (f.eks. metotreksat, rosuvastatin, imatinib). Utvalgte bivirkninger: Økte verdier i leverfunksjonsprøver og reduksjon i tyroksin kan forekomme. Pris: Det er fremforhandlet en konfidensiell, kostnadseffektiv pris til norske helseforetak og enkelte private sykehus. Denne er betydelig lavere enn maksimal utsalgspris i apotek, som er kr 195058,40.
Pakning: Myke kapsler, 30 stk. Reseptgruppe: C. Refusjon: H-resept. ICD10: E85
Kriterier for forskrivning på H-resept:
• Oppstart av behandling kan kun gjøres av kardiolog med erfaring i behandling av transtyretin amyloidose (ATTR), ansatt ved universitetssykehus eller annet helseforetak med kardiologisk enhet med kompetanse på behandling for denne pasientgruppen.
• Pasienten må ha en sikkert diagnostisert ATTR kardiomyopati, vanligvis med nukleærmedisinsk påvist amyloid i myokard. Pasienten skal ved oppstart være i NYHAklasse I eller II.
• Pasienten skal ha en forventet gjenstående levetid betydelig over 18 måneder.
• Ved progresjon til vedvarende (minst 6 måneder) NYHA-klasse III, skal beslutning om å fortsette behandlingen tas i samråd med kardiolog med erfaring i behandling av ATTR, ansatt ved universitetssykehus eller annet helseforetak med kardiologisk enhet med kompetanse på behandling for denne pasientgruppen.
• Ved rask progresjon til vedvarende NYHA-klasse III i løpet av 6 måneder etter initiert behandling, bør behandlingen avsluttes.
Før forskrivning, konsulter preparatomtalen på www.legemiddelsok.no
‡Hjertetransplantasjon, kombinert hjerte- og levertransplantasjon og hjertemekanisk hjelpemiddelimplantasjon (CMAD) ble behandlet som likeverdig med død i denne analysen. ATTR-ACT=Tafamidis in Transthyretin Cardiomyopathy Clinical Trial; TTR=Transtyretin; HR=Hazard ratio Referanser: 1. Witteles RM, et al. JACC Heart Fail. 2019;7(8):709-716. 2. Maurer MS, et al. J Am Coll Cardiol. 2016;68(2):161-172. 3. Eliott P, et al. Long-term survival with tafamidis in patients with transthyretin amyloid cardiomyopathy. Circ Heart Fail. 2022;15:4-11. 4. Maurer MS, et al. N Engl J Med. 2018;379(11):1007-1016.
Jern har mange viktige funksjoner knyttet til energiomsetning, mens hemoglobinsyntese alltid har 1.prioritet. Jernmangel kan være forårsaket av økt tap, utilstrekkelig inntak eller absorpsjon fra tarmen og redusert frigjøring fra depoter ved systemisk inflammasjon. Anemi er en sen manifestasjon av jernmangel og vises først når lagrene er tomme. Behandling med peroralt jern er førstevalget når tarmen er frisk og pasienten er fri for betennelse, mens intravenøst jern gir rask, effektiv og sikker behandlingseffekt når peroral behandling ikke virker eller tolereres.
Bjørn Moum, Universitetet i Oslo og Sykehuset Østfold, Kalnes Stefan Lindgren, Lunds universitet og Skånes universitetssjukhus, Sverige.
Jernmangel og anemi som globalt helseproblem
Jernmangel er et betydelig globalt helseproblem som påvirker millioner av mennesker over hele verden. Det er spesielt utbredt i lav- og mellominntektsland, men kan også påvirke befolkningen i høyinntektsland, inkludert Norge.
Hyppigste årsak til anemi globalt i 2021 var jernmangelanemi med prevalens på 422 leveår pr 100.000 personer.1 Mangel på jern kan ha alvorlige konsekvenser for helsen, fordi jern er en essensiell komponent i hemoglobin. Når kroppen ikke får tilstrekkelig jern, svekkes hemoglobinsyntesen, og anemi kan føre til tretthet, svakhet og redusert evne til å utføre daglige oppgaver. Jern har dessuten mange andre funksjoner i kroppen, og jernmangelen får også konsekvenser, i tillegg til dem som er direkte relatert til anemi.
En av de store utfordringene knyttet til jernmangel er tilgangen til næringsrik mat, spesielt for sårbare grupper som gravide kvinner, barn og personer i lavinntektsområder. Økonomiske begrensninger, utilstrekkelig tilgang til variert mat, avtagende kjøttkonsum og kulturelle faktorer kan alle bidra til utbredelsen av jernmangel. 2,3
Forebygging og behandling av jernmangel er viktig for å bedre global helse. Det kan inkludere tiltak mot utsatte grupper som de eldre,
kostholdstilpasninger, beriking av matvarer med jern, og i noen tilfeller jernsubstitusjon. Imidlertid er det viktig å adressere underliggende årsaker til jernmangel, som tilgang til helsetjenester, kunnskap om ernæring og økonomiske forhold4,5
I Norge, som har gode helsetjenester og et variert kosthold, finnes grupper av befolkningen som er utsatt for jernmangel. Det er derfor viktig å være bevisst på problemet, og diagnostisere og implementere tiltak for å forebygge og behandle.
Ved mange kroniske inflammatoriske sykdommer har jernmangelanemi betydning for pasientenes helse og sykdomsforløp. Intravenøs jernbehandling har ofte vist seg å ha positive effekter på livskvalitet så vel som sykdomsforløpet.
Jernets betydning og jernmetabolisme
Jern er det viktigste sporstoffet i organismen 6. I sin uorganiske form kan jern bytte mellom Fe2+ og Fe 3+ , som gir jern unike egenskaper for viktige redoksreaksjoner som å binde oksygen i hemoglobin, aktivere metabolske enzymsystemer og drive energiproduksjon. Fritt Fe2+ kan indusere dannelsen av frie radikaler som fører til skade på lipidmembraner, proteiner og DNA. Derfor må fritt Fe2+ holdes lavt. Flere ulike former for jernbindende proteiner regulerer effektivt jernmetabolismen.
Normalt daglig behov for jern er 1–2 mg. Kroppens jern fordeles til 60 % bundet i hemoglobin, 25 % lagret i ferritin, mens 15 % er bundet i myoglobin, enzymer og transferrin (Figur 1A). Eliminasjonen av jern skjer fremfor alt gjennom nedbrytningen av tarmepitelcellene hvor jern er bundet til ferritin. Tapene øker med systemisk betennelse når en større mengde jern lagres i enterocyttene. Jern gjenbrukes etter ødeleggelse av erytrocytter i kroppens makrofager, og jern transporteres bundet til transferrin for funksjoner i ulike organsystemer. Absorpsjonen av jern styres av proteinet hepcidin, som regulerer erytropoiesens tilgang til jern.
Anemi ved kronisk sykdom
Anemi ved kronisk sykdom, også kalt sekundær anemi, er et resultat av immunaktivering. Immunaktiveringen kan forårsakes av infeksjoner, kroniske betennelsessykdommer, malignitet som ikke medfører benmargsinfiltrasjon og kronisk nyre svikt, særlig ved dialyse. Sikre tall for prevalens finnes imidlertid ikke. Angivelse av prevalens varierer betydelig, fra 8 % til 95 % i ulike studier7 8
Forekomsten av anemi øker med økende alder. Hos eldre er dette den vanligste anemiformen. I en amerikansk studie ble det funnet at rundt 10 % av personer over 65 år hadde anemi. Av disse hadde 17 % jernmangelanemi og 20 %



Røde blodlegemer 2 000 mg


Jerntap 1–2 mg/dag Benmarg
Plasma Transferrin – Fe, 3–4 mg
1–2 mg/dag
Makrofager
Andra celler og vev


Figur 1A: Kroppens jern fordeles til 60 % bundet i hemoglobin, 25 % lagret i ferritin, mens 15 % er bundet i myoglobin, enzymer og transferrin.
anemi ved kronisk sykdom. Bare 6 % hadde anemi forårsaket av vitamin B12- mangel alene mens hos 34 % ble det ikke funnet noen forklaring på anemien9
Anemien kommer som regel snikende over en lengre tidsperiode, og kan være det første tegnet på en underliggende sykdom. Men som oftest preges sykehistorien av den tilgrunnleggende sykdommen, og anemien blir dermed ofte et bifunn. Vanlige årsaker er kronisk inflammasjon eller infeksjon, kreft, nyresykdom og leversykdom. Mekanismene bak anemien ved kronisk sykdom er mange og oftest parallelle. De vanligste årsakene er dårlig ernæring samt dårlig opptak av jern, vitamin B12 og folsyre. Anemi ses også ved nyresvikt på grunn av redusert erytropoietese og ved hjertesvikt pga redusert inntak av jern, nedsatt absorpsjon på grunn av lavgradig betennelse og ødematøs tarm og økt tap (platehemmere og antikoagulantia).
Akutt behandling, f.eks. blodtransfusjon, kan i noen tilfeller være aktuelt for å heve hemoglobinnivået ved faretruende lav verdi. I de tilfeller der anemien skyldes dårlig ernæring, er det viktig at den syke får i seg næringsriktig mat med tilstrekkelige mengder av jern og vitaminer. Jernbehandling skal kun gis når jernmangel er påvist, fordi jerntilskudd ellers kan forverre betennelsestilstander. Ved enkelte sykdommer kan det være nødvendig
med supplerende behandling i form av jern, erytropoietin, vitamintilskudd og eventuelt transfusjon. Anemien vil som oftest bedres raskt når grunnsykdommen bedres.
Jernmangel anemi ved kronisk sykdom Jernmangelanemi ved kronisk sykdom er en tilstand der kroppen ikke har tilstrekkelig mengde jern eller dette ikke er tilgjengelig for erytropoitesen for å produsere hemoglobin.10 Kroniske sykdommer kan derved påvirke jernmetabolismen og føre til funksjonell jernmangel.
Ved kronisk sykdom kan inflamma sjon føre til økt produksjon av peptidet hepcidin i leveren. Dette har blant annet vært knyttet til produksjonen av proinflammatoriske cytokiner, spesielt IL-6. Økt hepcidinnivå hemmer både opptak av jern i tarmen og frigjøring av jern fra makrofager. Begge deler skjer ved at jerneksportproteinet ferroportin i enterocytt- og makrofagmembranen, under påvirkning av hepcidin, brytes ned. Det kan resultere i redusert tilgjengelighet av jern selv om det er tilstrekkelig jern i kostholdet og lagerjern. Hovedårsaken til utviklingen av anemi i forløpet av kroniske tilstander (f.eks. kronisk nyresykdom, revmatoid artritt) er derfor overdreven inflammatorisk aktivering11,12
Blødning fra tarmen kan være et resultat av skade på tarmslimhinnen ved kroniske sykdommer, og kan også bidra til jernmangel.
Jernmangel er spesielt hyppig hos overvektige pasienter på grunn av økte sirkulerende nivåer av akuttfase-reaktanter ved adipositasassosiert inflammasjon. Det induserer redusert jernabsorpsjon korrelert med hemming av duodenalt ferroportinekspresjon parallelt med økte konsentrasjoner av hepcidin. Betennelse hos overvektige personer er derfor nært knyttet til jernmangelanemi. Overvektige personer får ofte redusert inflammatorisk respons etter fedmekirurgi ledsaget av redusert nivå av hepcidin og derfor forbedret jernabsorpsjon. Imidlertid kan gastrisk bypass-operasjon og sleevegastrektomi indusere malabsorpsjon i tynntarm og fremkalle jernmangel13
Behandlingen av jernmangelanemi ved kronisk sykdom fokuserer ofte på å håndtere den underliggende årsaken til jernmangelen, dvs. behandle den kroniske sykdommen. Jerntilskudd er ofte nødvendig for å kompensere for jernmangel. Imidlertid er det viktig å tilpasse behandlingen til den underliggende sykdommen. Siden inflammasjon via hepcidin blokkerer jernabsorbsjonen fra tarmen og frigjøring fra jernlagrene, kan intravenøs behandling derfor være førstevalget.
Det er viktig å rådføre seg med helsepersonell, som gastroenterolog eller hematolog, for en nøyaktig diagnose og behandlingsplan basert på individuelle behov og symptomer.
Jernmangel
Absolutt jernmangel Funksjonell jernmangel
Stadie 0 Stadie 1 Stadie 2 Stadie 3

Transportjern







Jern i lagrene kan ikke utnyttes


Fatigue ved jernmangel og jernmangelanemi
Både sammenhengen med så vel som betydningen av jernmangel ved kronisk fatigue er omdiskutert, men de negative konsekvensene av anemi er udiskutable, inkludert kronisk tretthet, kognitiv svikt, nedsatt fysisk funksjon, svekket utvikling og dårlig helserelatert livskvalitet14
Jernmangel uten anemi er svært vanlig i land med gode helsetjenester med en prevalens som varierer fra 16 % til 23 % hos premenopausale kvinner. I andre områder, som i Midtøsten, er det så mange som 58% av kvinnene i alderen 18–50 år med isolert jernmangel15
Jernmangel uten anemi er vist å kunne resultere i fatigue, kognitiv svikt og dårlig fysisk utholdenhet, og behandling bedrer tilstanden16,17,18 At det er en glidende overgang fra jernmangel til jernmangelanemi gir utfordringer, da disse symptomene er uspesifikke og sammenhengen med isolert jernmangel derfor kan være vanskelig å fastslå. Derfor er også kriterier for hva som bør behandles langt fra avklart.
Det er som nevnt viktig å fastslå årsaken til jernmangelen før behandling påbegynnes, fordi underliggende årsaker bør kartlegges og behandles for å forhindre tilbakefall. Samtidig bør behandlingen tilpasses individuelle behov og toleranse for å unngå bivirkninger.
Personer med jernmangel uten anemi som bør behandles inkluderer de som har lavt ferritin eller lav transferrinmetning (TSAT, markør for jerntilgjengelighet). Dette kan omfatte personer med symptomer på jernmangel, selv om de ikke oppfyller kriteriene for anemi.
Gravide kvinner er en spesiell gruppe som ofte behandles for jernmangel selv før utvikling av anemi, da det er viktig for fosterets utvikling. Totalt er behovet minst doblet i forhold til perioden før svangerskapet. Personer med kroniske sykdommer som cøliaki, inflammatoriske tarmsykdommer eller nyresykdom kan også ha nytte av jernbehandling, selv om de ikke har utviklet anemi. Dette kan innebære bruk av jerntilskudd eller endringer i kostholdet for å inkludere mer jernrik mat. Det er sjelden behov for intravenøs behandling19
Diagnostikk av jernmangel og jernmangelanemi
Diagnostisering av jernmangel og jernmangelanemi er utfordrende, og biokjemiske tester kan ikke entydig skille disse fra anemi ved kronisk sykdom (Figur 1B). Under normale omstendigheter er ferritin-nivået en sensitiv markør for jernstatus, men da ferritin er en akuttfasereaktant som stiger ved inflammasjon, kompliseres diagnostikken.
Proinflammatoriske cytokiner utløser også en økning i hepcidin, som begrenser opptaket av jern i kosten.
Pasienter med aktiv kronisk inflammasjonssykdom kan dermed ha begrenset tilgjengelighet av jern til tross for normale eller høye nivåer av ferritin. Standardterskelen for jernmangel (ferritin <30 μg/l) (Tabell 1) gjelder derfor ikke, og TSAT bør inkluderes. Ferritin <100 μg/l eller TSAT <20 % kan betraktes som diagnostisk for jernmangel ved systemisk inflammasjon. Hvis ferritin er 100-300 μg/l, kreves TSAT <20 % for å bekrefte jernmangel. Rutinemessig overvåking av ferritin og TSAT i risikogruppene anbefales derfor. P-jern alene har svært liten verdi i diagnostikken. Løselig transferrinreseptor (sTfR) påvirkes ikke av kronisk eller akutt inflammasjon og har derfor høy sensitivitet og spesifisitet ved diagnostikk av jernmangelanemi. Det er viktig å huske på at jernmangel ikke kan utelukkes selv ved normalt hemoglobinnivå (Hb), fordi anemi er en senkomplikasjon til jernmangel20
Behandling av jernmangel og jernmangelanemi
Oralt jerntilskudd er trygt, rimelig og enkelt å administrere til friske personer og de gastrointestinale bivirkninger er typiske og velkjente. Utfordringene er imidlertid mange bivirkninger, og behandlingen må fortsette i opptil seks måneder for å normalisere Hb og fylle opp jernlagrene. Oralt tilført jern kan øke tarmbetennelsen ved kronisk inflammatorisk tarmsykdom og bidra til sykdomsforverring. Dessuten vil systemisk inflammasjon (som ved aktiv sykdom, da med CRP økning)
Tabell 1 Diagnostiske kriterier for jernmangelanemi
Plasmamarkører
Hemoglobin
Ferritin*
Diagnostisk for jernmangelanemi
< 13,0 g/dl for menn
< 12,0 g/dl for kvinner
< 11,0 g/dl for gravide
< 30 ug/l uten inflammasjon (CRP** normal)
< 100 ug/l med inflammasjon (CRP** forhøyet)
Transferrin*** Økt
Total jernbindingskapasitet Økt
Transferrinmetning (TSAT) < 20 %
MCV Lav
sTfR**** Høy
Det er viktig å understreke at de hemoglobinnivåene som angis er nedre grenser i henhold til WHO, og at friske menn og kvinner vanligvis befinner seg i området 13-15 g/dl.
*Akuttfaseprotein som kan være økt ved betennelsestilstander
**CRP : C-reaktive protein ***Akuttfase protein som kan være normal eller økt ved inflammasjon **** sTfR: Løselig transferrinreseptor
gi økt hepcidin blokkering for peroral jernabsorbsjon.
Ferrimaltol (Ferracru®), et nytt ikke-salt oral jernformulering, er sammensatt av stabilt jern (III) kompleksbundet med et sukkerderivat, tri-maltol. Pga. jernets sukkerbinding reduseres dannelsen av fritt jern og dermed øker biotilgjengeligheten. Videre skal ferrimaltol ha mindre effekt på tarm mikrobiomet. Ifølge Felleskatalogen bør preparatet ikke anbefales ved kronisk inflammatorisk tarmsykdom med oppbluss eller ved hemoglobin <9,5 g/dl hos denne pasientgruppen.
Intravenøst jern er en rask og sikker måte å normalisere Hb og fylle opp jernlagrene på. Det virker også uavhengig av samtidig systemisk inflammasjon. Preparatene som brukes i Norge, jernkarboksymaltose og jernderisomaltose, er begge like effektive i så henseende. Jernsukrose og lavmolekylært jerndextran brukes, men i svært liten grad.
Referanser
1 GBD 2021 Anaemia Collaborators. Prevalence, years lived with disability, and trends in anaemia burden by severity and cause, 1990-2021: findings from the Global Burden of Disease Study 2021. Lancet Haematol 2023;10(9):e713-e734
2 Denic S & Agarwal MM. Nutritional iron deficiency: an evolutionary perspective. Nutrition. 2007;23(7-8):603-614
3 Stoltzfus R. Defining iron-deficiency anemia in public health terms: a time for reflection. J Nutr. 2001;131(2S-2): 565S-567S
4 Fougère B, Puisieux F, Chevalet P, et al. Prevalence of iron deficiency in patients admitted to a geriatric unit: a multicenter cross-sectional study. BMC Geriatr. 2024;24(1):112
5 Cappellini MD & Motta I. Anemia in Clinical Practice-Definition and Classification: Does Hemoglobin Change With Aging? Semin Hematol. 2015;52(4):261-269
6 Winter WE, Bazydlo LA & Harris NS. The molecular biology of human iron metabolism. Lab Med. 2014;45(2):92-102
7 Weiss G. Iron metabolism in the anemia of chronic disease. Biochim Biophys Acta. 2009;1790(7):682 -693
8 Weiss G & Goodnough LT. Anemia of chronic disease. N Eng J Med. 2005;352(10):1011-1023
9 Guralnik JM, Eisenstaedt RS, Ferrucci L, et al. Prevalence of anemia in persons 65 years and older in the United States:
Totalt behov for jern beregnes ut fra ferritin, Hb og pasientens vekt. Det er ikke noen grunn til å gi doser mindre enn 1 gram til voksne. Risikoen for overbehandling er svært liten, mens underhandling er vanlig. Seks til åtte uker etter at totaldosen er gitt, må effekten vurderes ved måling av ferritin og Hb. Deretter bør pasientens Hb og jernlagre overvåkes jevnlig i forhold til den bakenforliggende sykdom og ny behandling bør gis før jernmangelen eller anemien oppstår igjen. Alle preparatene er trygge, og hyppigheten av alvorlige allergiske bivirkninger er svært lav (1/250 000 gitte doser)21
Imidlertid opplever omtrent 1 % av pasientene en eller annen type bivirkning etter hver dose. Det absolutte flertallet av disse er av ikke-allergisk type, oppstår umiddelbart etter start av infusjonen og er raskt forbigående når behandlingen stoppes. Deretter kan infusjonen gjenopptas med en lavere infusjonshastighet 22. Det er viktig at både
evidence for a high rate of unexplained anemia. Blood. 2004;104(8):2263 - 2268
10 Pasricha SR, Tye-Din J, Muckenthaler MU, et al. Iron deficiency. Lancet. 2021;397(10270):233-248
11 Raj DS. Role of interleukin-6 in the anemia of chronic disease. Semin Arthritis Rheum. 2009;38(5):382-388
12 Nemeth E, Rivera S, Gabayan V, et al. IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin. J Clin Invest. 2004;113(9):1271-1276
13 Bjørklund G, Peana M, Pivina L, et al. Iron Deficiency in Obesity and after Bariatric Surgery. Biomolecules. 2021;11(5):613
14 Tang GH & Sholzberg M. Iron deficiency anemia among women: An issue of health equity. Blood Rev. 2023:101159. doi: 10.1016/j. blre.2023.101159
15 Abuaisha M, Itani H, El Masri R, et al. Prevalence of Iron Deficiency (ID) without anemia in the general population presenting to primary care clinics: a cross-sectional study. Postgrad Med. 2020;132(3):282–287
16 Verdon F, Burnand B, Stubi CL, et al. Iron supplementation for unexplained fatigue in non-anaemic women: double blind randomised placebo controlled trial. BMJ. 2003;326(7399):1124 doi:10.1136/bmj.326.7399.1124
17 Scott SP & Murray-Kolb, LE. Iron Status Is Associated with
pasienter og behandlerne er godt informert om de vanlige bivirkningene og deres ufarlige natur. Jernløsningene skal ikke fortynnes i mer saltvann enn angitt, fordi fritt jern som årsaken til bivirkningene da øker. Jernkarboksymaltose kan forårsake hypofosfatemi, som bør bemerkes spesielt etter gjentatte doser 23
Konklusjon
• Jern har mange viktige funksjoner knyttet til energiomsetning, og jernmangel har derfor flere konsekvenser for helserelatert livskvalitet. Imidlertid er hemoglobinsyntese alltid prioritert.
• Jernmangel kan være forårsaket av økt tap, utilstrekkelig inntak, utilstrekkelig absorpsjon fra tarmen eller hepcidin-blokkering av absorpsjon og frigjøring fra depoter ved systemisk inflammasjon.
• Anemi er en sen manifestasjon av jernmangel og vises først når lagrene er tomme. Diagnosen er basert på Hb, ferritin og TSAT. Om nødvendig kan sTfR lette diagnostikken, spesielt ved inflammasjonsrelatert jernmangel når ferritin-nivået er vanskelig å vurdere.
• Behandling med oralt jern er førstevalget når tarmen er frisk og pasienten er fri for betennelse. Utfordringen er imidlertid mange bivirkninger, og behandlingen må fortsette i opptil seks måneder for å normalisere Hb og fylle opp jernlagrene. Når oral jernbehandling ikke virker eller tolereres, gir intravenøst jern en rask, effektiv og sikker behandlingseffekt.
• Ved parenteral administrasjon må resultatet av behandling kontrolleres etter at beregnet dose er gitt og deretter fortløpende, for å hindre tilbakefall av jernmangel.
Performance on Executive Functioning Tasks in Nonanemic Young Women. J Nutr. 2016;146(1):30–37
18 Bruner AB, Joffe A, Duggan AK, et al. Randomised study of cognitive effects of iron supplementation in non-anaemic irondeficient adolescent girls. Lancet.1996;348(9033):992–926.
19 Simic S, Karczewski M, Klapdor S, et al. Effectiveness of low-dose iron treatment in non-anaemic iron-deficient women: a prospective open-label single-arm trial. Swiss Med Wkly. 2023;153:40079
20 Gordon H, Burisch J, Ellul P, et al. ECCO Guidelines on Extraintestinal Manifestations in Inflammatory Bowel Disease. J Crohns Colitis. 2024;18(1):1-37.
21 Girelli D, Ugolini S, Busti F, et al. Modern iron replacement therapy: clinical and pathophysiological insights. Int J Hematol. 2018;107(1):16-30
22 Richards T, Breymann C, Brookes MJ, et al. Questions and answers on iron deficiency treatment selection and the use of intravenous iron in routine clinical practise. Ann Med. 2021;53(1):274-285
23 Wolf M, Rubin J, Achebe M, et al. Effects of Iron Isomaltoside vs Ferric Carboxymaltose on Hypophosphatemia in IronDeficiency Anaemia: Two Randomized Clinical Trials. JAMA 2020;323(5):432-443
Natriumzirkoniumsyklosilikat pulver til mikstur, suspensjon
2430ahyperkalemi1
korreksjonsfase
ZIRKONIUMSYKLOSILIKAT)
10 g x 3 / dag*


5 g x 1 / dag*
er oppnådd vedlikeholdsfase
* Hvis pasienten glemmer en dose, bør neste dose tas til planlagt tid

5 g x 1 / dag* med mulighet for justering på dager uten dialyse Anbefalt startdose:

LOKELMA - KALIUMBINDER INDISERT FOR BEHANDLING AV HYPERKALEMI HOS VOKSNE 2,3
Utvalgt sikkerhetsinformasjon: De vanligste bivirkningene er hypokalemi (4,1%) og ødemrelaterte hendelser (5,7%). Serumkaliumnivå bør monitoreres ved klinisk indikasjon også etter endring av legemidler som påvirker serumkaliumkonsentrasjonen (eks. ved RAASi eller diuretika) og etter at Lokelma-dosen er titrert. Monitoreringshyppighet vil avhenge av bl.a. andre legemidler, progresjon av kronisk nyresykdom og kaliuminntak i kosten. Ved alvorlig hypokalemi skal Lokelma seponeres og pasienten revurderes. Bruk under graviditet bør unngås.
LOKELMA (NATRIUMZIRKONIUMSYKLOSILIKAT) – VIKTIG
Indikasjon: Behandling av hyperkalemi hos voksne.
Dosering: Korrigeringsfase: Anbefalt startdose er 10 g 3 ganger daglig. Når normokalemi er oppnådd bør vedlikeholdsdosering følges. Hvis normokalemi ikke oppnås etter 72 timer med behandling, bør andre behandlingsstrategier vurderes. Vedlikeholdsfase: Når normokalemi er oppnådd, skal den laveste effektive dose fastsettes. Anbefalt startdose 5 g 1 gang daglig. Ved behov kan dosen titreres opp til 10 g en gang daglig, eller ned til 5 g annenhver dag. Vedlikeholdsdosen bør ikke overskride 10g en gang daglig. Kronisk hemodialyse: Lokelma skal kun gis på dager uten dialyse. Anbefalt startdose er 5 g en gang daglig. For å etablere normokalemi kan dosen titreres ukentlig opp eller ned, basert på predialytisk serum-kaliumnivå etter et langt interdialytisk intervall/LIDI. Dosen kan justeres med en ukes intervall, i trinn på 5 g, opp til en dose på 15 g en gang daglig på dager uten dialyse. Det anbefales å overvåke serum-kaliumnivå ukentlig under dosejustering. Administrering: Doseposens innhold blandes med ca. 45 ml vann, og væsken drikkes mens den ennå er uklar.
Refusjon: H-resept
Refusjonsberettiget bruk: Der det er utarbeidet nasjonale handlingsprogrammer/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. Vilkår: 216 Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist. Lokelma inngår i RHF anbefalinger til vedlikeholdsbehandling av hyperkalemi hos pasienter med kronisk nyresvikt eller hjertesvikt.
For legemidlene under skal denne rangeringen legges til grunn for de ulike doseringene:
1. valg: Natriumzirkoniumsiklosilikat (Lokelma, AZ) 5 g daglig / 10 g daglig
2. valg: Patiromersorbitekskalsium (Veltassa, Vifor) 8,4 g daglig / 16,8 g daglig
Der det foreligger en rangering, skal førstevalg benyttes i oppstart og medisinsk begrunnet endring av behandling. Vedtaket gjelder i perioden 01.01.2024 - 31.05.2026. Pakninger og priser: 5 g 30 stk. (dosepose) kr. 3264,20; 10 g 30 stk. (dosepose) kr. 6492,10. Reseptgruppe C.
For fullstendig informasjon, les FK-tekst eller godkjent SPC på www.felleskatalogen.no for Lokelma. NO-11602-12-23-CVRM
Atrieflimmer utgjør en stadig større klinisk utfordring som kan føre til alvorlige helsekomplikasjoner og store årlige helseutgifter. Ny teknologi muliggjør tilnærmet kontinuerlig overvåking av sin egen hjerterytme uansett hvor man befinner seg. Denne tilgjengeligheten kan betydelig øke antall diagnostiserte tilfeller av atrieflimmer. Likevel, for å fullt ut realisere potensialet i disse fremskrittene, er det nødvendig å sikre adekvat oppfølging og behandling.

Introduksjon
Hjerterytmeforstyrrelser er en vanlig klinisk problemstilling og atrieflimmer (AF) er den vanligste blant disse. Forekomsten øker med alderen og forventes tredoblet de kommende tiårene.1-3 AF øker risikoen for flere alvorlige helsekomplikasjoner, inkludert økt risiko for tidlig død, hjertesvikt og kognitiv svikt, og forårsaker opptil en tredjedel av alle hjerneslag. 2,4,5 AF er også en hyppig årsak til sykehusinnleggelser. Estimater fra Sverige
anslår at den årlige AF-assosierte samfunnskostnaden utgjør 7,3 milliarder svenske kroner.6 Evidensbasert behandling kan redusere risikoen for nevnte komplikasjoner, og derfor fremstår tidlig oppdagelse av AF som teoretisk mulig og verdifull.7 Screening er anbefalt av europeiske retningslinjer (ESC), men hvem som skal screenes og den best egnende måten å gjøre dette på er foreløpig uavklart.8
Deteksjon og diagnostikk av atrieflimmer:
Påvisning av udiagnostisert atrieflimmer (AF) kan være utfordrende. Dette skyldes delvis at opp til to tredjedeler av de med AF enten er asymptomatiske eller kun opplever milde og diffuse symptomer.9 For å fastslå en korrekt diagnose og starte behandling kreves EKG dokumentasjon, enten som et standard 12-avlednings EKG eller en EKGstripe med en minimumslengde på 30 sekunder.8 I tillegg manifesterer AF seg over et bredt spektrum, fra sporadiske og kortvarige anfall til vedvarende og langvarige episoder.4 For å dokumentere anfallsvis AF og hos personer uten symptomer er det utviklet en rekke metoder for langtidsregistrering av hjerterytmen.
Etablerte metoder for langtidsregistrering:
Holter-systemet er en veletablert metode for langtids EKG-registrering, som brukes av kardiologer både på sykehus og i privat praksis (Figur 1). Systemet krever endel helse -
personell ressurser, spesialisert programvare for å analysere dataene, kan begrense pasientens daglige aktiviteter og har en begrenset varighet på overvåkingen.10, 11 For lengre over våkingsperioder kan en implanter bar loop-recorder (ILR) være et alternativ. ILR kan overvåke hjertet i flere år, men krever et mindre kirurgisk inngrep og er kostbart. Andre alternativer inkluderer automatiserte opptak som R-test, og brukerinitierte opptak som tommelfinger-EKG.
Nye metoder for langtidsregistrering:
Teknologisk utvikling har ført til introduksjon av en rekke «devicer» for langtidsovervåkning av puls og hjertets elektriske signaler. Pulsklokker er blitt særlig populære i forbrukermarkedet. Disse klokkene utfører pulsmålinger på håndleddet og kan gi indikasjoner på eventuelle uregelmessigheter i hjerterytmen ved hjelp av PPG-teknologi (photoplethysmography). PPG er en optisk metode som detekterer variasjoner i blodvolumet i mikrovaskulaturen og som gjenspeiler pulsformer.12 Imidlertid kreves det et EKG opptak for å fastslå nøyaktig diagnose.8 Enkelte modeller av pulsklokker inkluderer EKG-funksjonalitet, men dette forutsetter at brukeren er i ro og aktiverer funksjonen ved å plassere en finger på enheten for å skape pålitelige EKG-data. Plasterbaserte EKG-systemer (1-kanals EKG), som forbrukeren selv kan håndtere utenfor sykehus kan være et alternativ til
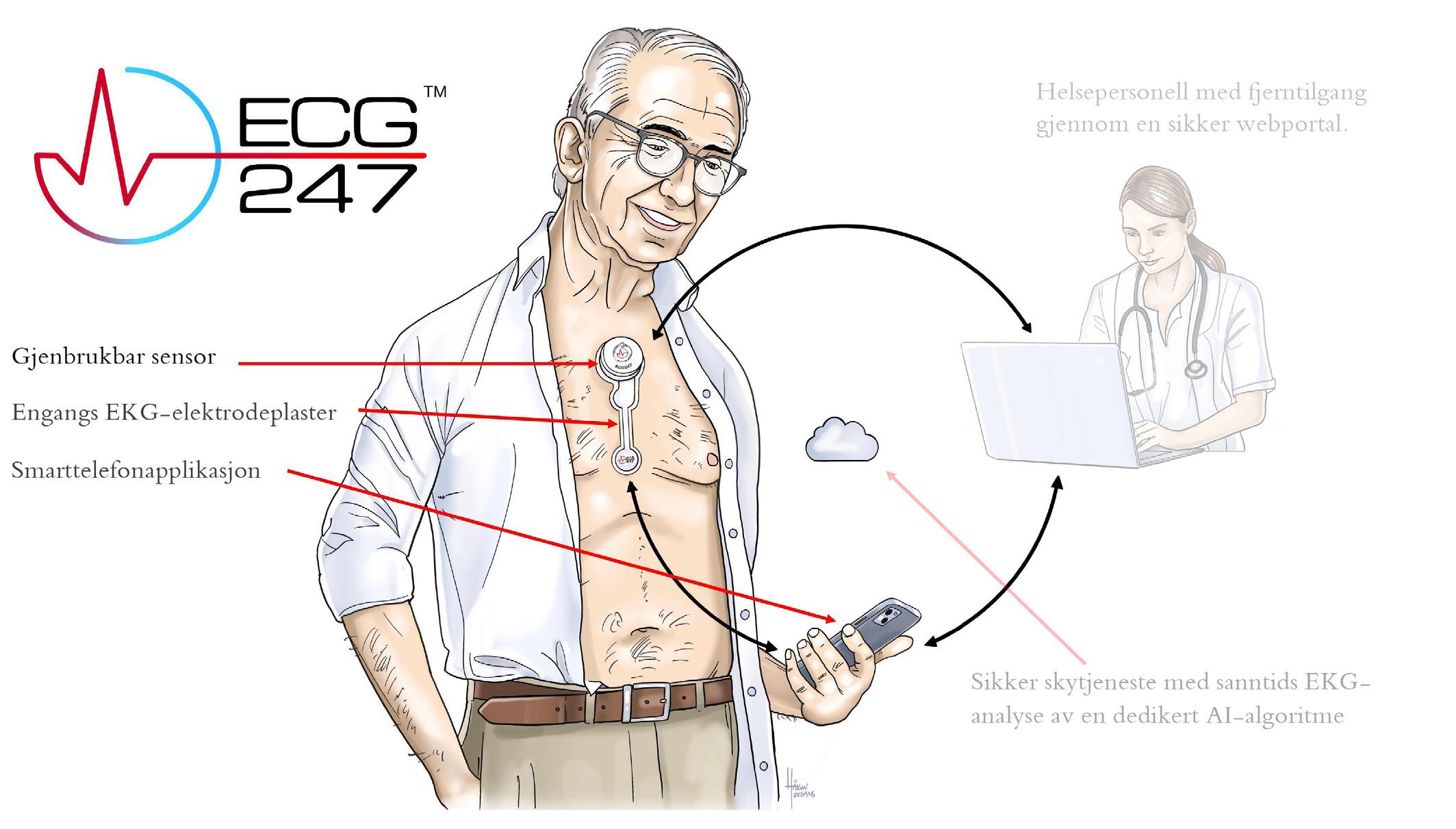
Holter-overvåking og tilsvarende teknologi. ECG247 hjertesensor (Appsens AS, Lillesand, www.ecg247. com) er en innovativ norsk løsning for langvarig, kontinuerlig undersøkelse av arytmier. Systemet inkluderer et engangs elektrodeplaster, en gjenbrukbar sensor, en mobilapplikasjon og sikker skybasert lagring som tilbyr automatisk EKG-analyse tilgjengelig via en nettleser (Figur 2). Systemet er validert mot Holter og godkjent som medisinsk utstyr i henhold til europeiske standarder.13 Selv om 1-kanals EKG kan være mer utsatt for støy og gi opptak av lavere kvalitet enn flerkanals systemer, påvirker dette sjelden tolkningen av arytmier med smale QRS-komplekser som AF. Imidlertid kan tolkningen av bredkomplekse arytmier være utfordrende, da opptak med flere elektroder gir en bedre oversikt over endringer i hjertets elektriske akse og QRS-morfologi.
Utfordringer ved langvarig hjerterytmeovervåking: Langvarig EKG-overvåkning har vist å avdekke flere episoder av atrieflimmer AF enn kortvarige og
tilfeldige overvåkninger.14, 15 En av utfordringene med langvarig og kontinuerlig hjerterytmeovervåking er deteksjon av subklinisk atrieflimmer (SCAF), definert som kortvarige (minutter til timer) og symptomfrie episoder.16, 17 Da det fortsatt er fortsatt uklart hvor ofte og hvor lenge pasienter må oppleve AF før behandling bør initieres. Imidlertid spiller risikoen for hjerneslag, evaluert gjennom CHA 2DS2-VASc-skåren, en viktig rolle i beslutningen om å starte behandling ved påvist AF. Selv om risikoen for hjerneslag ved kortvarige AF-episoder er lavere enn ved mer langvarige episoder, er den fortsatt signifikant.18, 19 Nylige studier forsøkte å besvare denne viktige problemstillingen. NOAH-AFNET 6-studien fant at edoksaban ikke reduserte risikoen for kardiovaskulær død eller hjerne slag betydelig, men økte risikoen for alvorlige blødninger. 20 ARTESIA-studien viste derimot at apiksaban indikerte en viss reduksjon i risikoen for slag sammenlignet med aspirin, uten å øke forekomsten av dødelige eller intrakraniale blødninger. 21
Norsk studie om screening for atrieflimmer:
Konseptet med screening bygger på at det finnes en betydelig gruppe med uoppdaget AF. 22 I «The Norwegian Atrial Fibrillation Self-Screening pilot” studien var formålet å undersøke om selv-testing for uoppdaget AF i en heldigital setting er gjennomførbart. 23 Studien ble gjennomført ved at potensielle deltakere ble invitert til å besøke en studienettside for å gjennomgå en inngangstest. Testen vurderte kandidatenes egnethet basert på eksklusjonskriterier (kjent atrieflimmer eller mangel på smarttelefon) og inklusjonskriterier (alder ≥65 år med minst én tilleggsrisikofaktor som kvinnelig kjønn, høyt blodtrykk, hjerte svikt, diabetes, tidligere hjerneslag eller hjerteinfarkt, eller ≥75 år). Kvalifiserte deltakere gav sitt digitale samtykke ved bruk av BankID, hvorpå ECG247-hjertesensor ble sendt hjem til dem. Deltakerne håndterte sensoren og koblet den til sin smarttelefon. Sensoren og tilhørende app kommuniserte med hverandre via blåtann, og EKGdataene ble direkte overført til
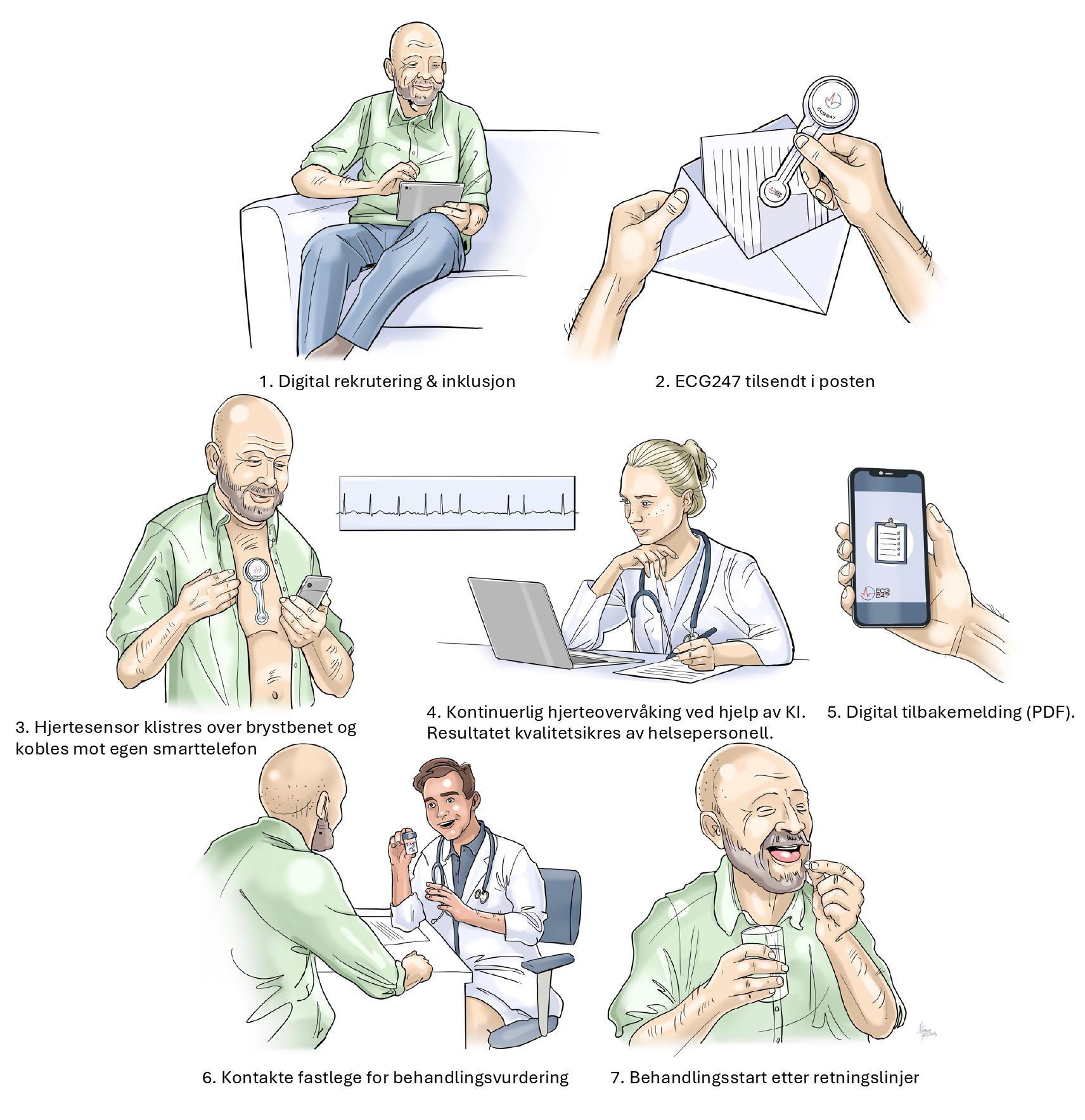
en sikker skytjeneste tilgjengelig for forsker teamet. I tillegg selvrapporterte deltakerne via digitale spørreskjema om sine egne karakteristika, symptomer, medisinbruk og tidligere sykdomshistorie. Etter endt test mottok alle deltakere en digital rapport av opptaket sitt samt en vurdering i appen. Deltakere med påvist AF mottok i tillegg en telefonsamtale for ytterligere forklaring og anbefaling om å oppsøke sin fastlege for vurdering (Figur 3).
The Norwegian Self-Screening for Atrial Fibrillation pilot studie: resultater 2118 personer fra hele Norge ble inkludert, hvorav 87% (1848 personer) fullførte selv-screeningen feilfritt (Figur 4). 23 Gjennomsnittsalderen var 70 år og de fleste deltakerne var kvinner (75%). Nyoppdaget atrieflimmer (AF) ble påvist hos 41 delta-
kere. Av 41 deltakere som ble invitert til en oppfølgingsstudie for å evaluere hvor mange som oppsøkte sin fastlege og startet slagforebyggende behandling, valgte 39 å delta. 24 Alle 39 oppsøkte sin fastlege som anbefalt, hvorav 34 startet på slagforebyggende behandling. De 5 som ikke startet behandling var hovedsakelig yngre kvinner uten signifikante risikofaktorer for hjerneslag vurdert iht CHA2DS2-VASc-skåren.8 I slike tilfeller anbefaler retningslinjene individuell vurdering. Pilotstudien var ikke designet for å vurdere langtidseffekten av intervensjonen.
Atrieflimmer screening: mulig, men varierende resultater så langt To store skandinaviske, randomiserte studier undersøkte effekten av antikoagulasjonsbehandling ved nyoppdaget AF identifisert gjennom screening. I den svenske STROKE-
STOP-studien benyttet deltakerne tommelfinger-EKG to ganger daglig i 14 dager, og AF ble avdekket hos 3 % av deltakerne. I intervensjonsgruppen ble det observert en reduksjon på 8 % i antall hjerneslag og en reduksjon på 4 % i det kombinerte primærendepunktet, som inkluderte hjerneslag, systemisk emboli, blødning som krevde sykehusinnleggelse, og totaldødelighet. 27 I den danske LOOP-studien førte kontinuerlig overvåking med implanter bar loop- recorder (ILR) over fire år til at deteksjonen av AF ble tredoblet sammenlignet mot kontrollgruppen (31,8 % mot 12,2 %). Gruppen som ble screenet hadde en 20 % lavere risiko for slag, men resultatene var ikke statistisk signifikante (hazard ratio 0,80; 95 % konfidensintervall 0,61–1,05; p=0,11). 28 Resultatene fremhever behovet for ytterligere forskning for å finne den mest effektive strategien for screening og behandling av AF.
NORSCREEN studien:
Basert på pilotstudien, har The Norwegian Atrial Fibrillation Self-Screening (NORSCREEN) studien blitt tildelt 19,7 millioner norske kroner fra KLINBEFORSK. Studiens hovedmål er å evaluere om digital selvscreening for AF ved hjelp av kontinuerlig EKG-monitorering (ECG247) i 3-7 dager for personer over 65 år med minst en risikofaktor for hjerneslag kan redusere antall hjerneslag i screeninggruppen sammenlignet med en kontrollgruppe. Totalt 20 000 deltakere vil bli rekruttert via Helse Norge (www. helsenorge.no), og de vil bli fulgt over en periode på opptil fem år gjennom norske helseregistre. Mer informasjon er tilgjengelig på norscreen.org
Konklusjon/oppsummering: Atrieflimmer (AF) er og forventes å bli en økende utfordring i nær fremtid. Mange har tilstanden uten å være klar over det, og risikoen for hjerneslag er den samme hos individer med både symptomatisk og asymptomatisk AF. Screening anbefales og kan avdekke opptil ti ganger flere tilfeller av AF. Sentrale spørsmål som gjenstår er hvilken screeningmetode som bør velges, varigheten av slikscreening,
hvem som bør screenes og hvor mye AF skal være til stede før behandling initieres. De varierende resultatene fra store randomiserte screeningstudier understreker behovet for videre forskning for å evaluere effekten av screening og forebyggende behandling. Pilotstudien demonstrerte at selvtesting for AF i en digital setting er gjennomførbart. Den pågående NORSCREENstudien vil forhåpentligvis bidra til en dypere forståelse om deteksjon av AF med påfølgende behandling i en digital setting kan forebygge komplikasjoner.
Oppgitte interessekonflikter. Forfatter har personlig mottatt foredragshonorarer fra Pfizer og AstraZeneca.
Sørlandet sykehus/AFstudien ( piloten) mottok forskningsmidler fra Pfizer, Bristol Myers Squibb, Boehringer og the Norwegian Atrial Fibrillation Research Network (afib. no).
Figur 4: Geografisk fordeling av studiedeltakere. (Rød markør: studiesenter. Svarte markører: >5 deltakere). Bilde hentet fra ‘Digital recruitment and compliance to treatment recommendations in the Norwegian Atrial Fibrillation self-screening pilot study’, opprinnelig publisert av Edvard Liljedahl Sandberg et al. i ‘European Heart Journal - Digital Health’, under en Creative Commons Attribution-NonCommercial License. Tilgjengelig på: https://academic.oup.com/ehjdh/advance-article/doi/10.1093/ehjdh/ztae026/7642966.
Referanser
1. Linz D, Gawalko M, Betz K, et al. Atrial fibrillation: epidemiology, screening and digital health. Lancet Reg Health Eur 2024; 37: 100786. 2024/02/16. DOI: 10.1016/j.lanepe.2023.100786.
2. Ball J, Carrington MJ, McMurray JJ, et al. Atrial fibrillation: profile and burden of an evolving epidemic in the 21st century. Int J Cardiol 2013; 167: 1807-1824. 2013/02/06. DOI: 10.1016/j.ijcard.2012.12.093.
3. Friberg L, Hammar N, Pettersson H, et al. Increased mortality in paroxysmal atrial fibrillation: report from the Stockholm Cohort-Study of Atrial Fibrillation (SCAF). Eur Heart J 2007; 28: 2346-2353. 2007/08/03. DOI: 10.1093/eurheartj/ehm308.
4. Choi SE, Sagris D, Hill A, et al. Atrial fibrillation and stroke. Expert Rev Cardiovasc Ther 2023; 21: 35-56. 2022/12/21. DOI: 10.1080/14779072.2023.2160319.
5. Flimmerrapporten 2021, https://www.hjart-lung.se/ contentassets/52ea624828e14653b107fc1e77611307/ hjartlung_flimmerrapporten-2021.pdf (2021, 2021).
6. Freedman B, Potpara TS and Lip GY. Stroke prevention in atrial fibrillation. Lancet 2016; 388: 806-817. 2016/08/26. DOI: 10.1016/s0140-6736(16)31257-0.
7. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021; 42: 373-498. 2020/08/30. DOI: 10.1093/eurheartj/ehaa612.
8. Streur M. Atrial Fibrillation Symptom Perception. J Nurse Pract 2019; 15: 60-64. 2019/07/30. DOI: 10.1016/j.nurpra.2018.08.015.
9. Barrett PM, Komatireddy R, Haaser S, et al. Comparison of 24-hour Holter monitoring with 14-day novel
adhesive patch electrocardiographic monitoring. The American journal of medicine 2014; 127: 95. e11-95. e17.
10. Fensli R, Pedersen P, Gundersen T, et al. Sensor acceptance model–measuring patient acceptance of wearable sensors. Methods of information in medicine 2008; 47: 89-95.
11. Sijerčić A and Tahirović E. PhotoplethysmographyBased Smart Devices for Detection of Atrial Fibrillation. Tex Heart Inst J 2022; 49 2022/10/28. DOI: 10.14503/thij-21-7564.
12. Sandberg EL, Grenne BL, Berge T, et al. Diagnostic Accuracy and Usability of the ECG247 Smart Heart Sensor Compared to Conventional Holter Technology. J Healthc Eng 2021; 2021: 5230947. 2021/11/13. DOI: 10.1155/2021/5230947.
13. Elbadawi A, Sedhom R, Gad M, et al. Screening for atrial fibrillation in the elderly: A network metaanalysis of randomized trials. European Journal of Internal Medicine 2022; 105: 38-45. DOI: https://doi. org/10.1016/j.ejim.2022.07.015.
14. Grond M, Jauss M, Hamann G, et al. Improved detection of silent atrial fibrillation using 72-hour Holter ECG in patients with ischemic stroke: a prospective multicenter cohort study. Stroke 2013; 44: 3357-3364. 2013/10/17. DOI: 10.1161/strokeaha.113.001884.
15. Friend SH, Ginsburg GS and Picard RW. Wearable Digital Health Technology. New England Journal of Medicine 2023; 389: 2100-2101. DOI: 10.1056/NEJMe2303219.
16. Ihle-Hansen H, Hagberg G, Ihle-Hansen H, et al. What Do We Really Know About the Effect of Prolonged Heart Rhythm Monitoring After Stroke? Stroke 2024 2024/03/08. DOI: 10.1161/strokeaha.123.045843.
17. Healey JS, Connolly SJ, Gold MR, et al. Subclinical Atrial Fibrillation and the Risk of Stroke. New England Journal of Medicine 2012; 366: 120-129. DOI: 10.1056/ NEJMoa1105575.
18. Glotzer TV, Daoud EG, Wyse DG, et al. The relationship between daily atrial tachyarrhythmia burden from implantable device diagnostics and stroke risk: the TRENDS study. Circ Arrhythm Electrophysiol 2009; 2: 474-480. 2009/10/22. DOI: 10.1161/circep.109.849638.
19. Kirchhof P, Toennis T, Goette A, et al. Anticoagulation with Edoxaban in Patients with Atrial High-Rate Episodes. New England Journal of Medicine 2023; 389: 1167-1179. DOI: 10.1056/NEJMoa2303062.
20. Healey JS, Lopes RD, Granger CB, et al. Apixaban for Stroke Prevention in Subclinical Atrial Fibrillation. N Engl J Med 2024; 390: 107-117. 2023/11/12. DOI: 10.1056/NEJMoa2310234.
21. Jones NR, Taylor CJ, Hobbs FDR, et al. Screening for atrial fibrillation: a call for evidence. European Heart Journal 2019; 41: 1075-1085. DOI: 10.1093/eurheartj/ ehz834.
22. Sandberg EL, Halvorsen S, Berge T, et al. Fully digital self-screening for atrial fibrillation with patch electrocardiogram. Europace 2023; 25 2023/03/23. DOI: 10.1093/europace/euad075.
23. Sandberg EL, Halvorsen S, Berge T, et al. Digital recruitment and compliance to treatment recommendations in the Norwegian Atrial Fibrillation self-screening pilot study. European Heart Journal - Digital Health 2024. DOI: 10.1093/ehjdh/ztae026.
24. Svennberg E, Friberg L, Frykman V, et al. Clinical outcomes in systematic screening for atrial fibrillation (STROKESTOP): a multicentre, parallel group, unmasked, randomised controlled trial. Lancet 2021; 398: 1498-1506. 2021/09/02. DOI: 10.1016/s01406736(21)01637-8.
25. Svendsen JH, Diederichsen SZ, Højberg S, et al. Implantable loop recorder detection of atrial fibrillation to prevent stroke (The LOOP Study): a randomised controlled trial. Lancet 2021; 398: 1507-1516. 2021/09/02. DOI: 10.1016/s0140-6736(21)01698-6.




Spirometri blir brukt i ulik grad av spesialister innen indremedisin. Denne studien viser at kunnskap om fortolkning av spirometri er varierende. Enkle læringsmetoder kan trolig øke kompetanse og bidra til bedre pasientsikkerhet. Mange av deltakerne hadde også en interesse i å utvide sin kunnskap om spirometri.
Peter Hatlen. PhD. Overlege, spesialist i indremedisin og lungemedisin. Utdanningsansvarlig overlege og leder av utdanningsutvalget innen lungemedisin ved Klinikk for lunge- og arbeidsmedisin, St Olavs hospital – Lungemedisinsk avdeling. Prinsesse Kristinas gate 3, 7030 Trondheim
Nora Møller. 5. års medisinstudent. Jagiellonian University Medical College. ul. św Łazarza 16. 31-530 Kraków. Polen
Bakgrunn
Spirometri brukes i utredning og oppfølging av pasienter med dyspne og kjent lungesykdommer som f.eks. astma eller KOLS. Kunnskapen om ferdighetene i spirometritolkning er begrenset blant norske leger. Studier blant allmennleger i Norge, Storbritannia og Sverige viser at det er delvis begrenset kunnskap om fortolkning av spirometriresultater 1 2 I en norsk studie fra 2020 identifiserte mindre enn 50% av allmennleger spirometriparametere korrekt for å diagnostisere KOLS 3
Opplæring i tolkning av spirometri anses som effektivt og lite tidskrevende, og anbefales i ulike studier 4-6. Forskjellige læringsmetoder er beskrevet i litteraturen 7-11
Blant sykehusleger finnes det begrenset forskning om kunnskapsnivået. En italiensk studie fant at 31% av legene gjorde tolkningsfeil, og 20% klarte ikke å identifisere en blandet ventilasjonsdefekt 12. En studie med 1262 medisinstudenter fra Frankrike viste at bare 5% følte seg trygge på tolkning av spirometri 5
Målet med denne studien er å kartlegge kunnskap om spirometri og utviklingen av kunnskapen over tid blant norske sykehusleger innen Indremedisin.
I mangel av studier blant norske medisinstudenter om spirometri, har vi også inkludert en kartlegging av kunnskapsnivået hos disse.
Materialer og metoder: En spørreskjemaundersøkelse ble gjennomført ved 10 ulike sykehus i Norge fra 1. august til 30. november i 2023. Spørreskjemaet, utarbeidet av hovedforfatteren, ble sendt per mail til klinikkledelsen ved Universitetet i Tromsø (UiT), Nordlandsykehuset, Helse Fonna – Haugesund Sjukehus, Sykehuset Østfold, Sørlandet sykehus HF Kristiansand, Sykehuset Namsos, Sykehuset Levanger, Ålesund sjukehus, Molde sjukehus og Orkdal sykehus med ønske om videre distribusjon. Videre ble spørre skjemaet lagt ut på to lukkede facebook-grupper for leger i Norge.
Spørreskjemaet (se Ramme 1) bestod av totalt 14 spørsmål, 7 demografiske spørsmål (alder, kjønn, kvalifikasjon, stilling, erfaring) og 7 spørsmål for evaluering av ferdighetsnivået; hvilken spirometriverdi som brukes for diagnostisering for KOLS (FEV1/ FVC kvotient < 70 %), hvordan referanseverdiene er definert i henhold til GOLD klassifikasjon fra 2023 13 og gradering av KOLS med hjelp av FEV1. Videre var det inkludert tre forskjellige spirometriutskrifter som skulle teste om deltageren kunne identifisere en obstruktiv spirometri, en signifikant reversibilitetstest og en restriktiv spirometri. Vi har valgt allikevel å bruke GOLD sin klassifikasjon, som tilsvarer den tidligere klassifikasjon i Norge fram til 2022, siden vi tror at vi fortsatt befinner oss i en «overgangsperiode» når det gjelder den nye klassifikasjonen. For å teste om deltagerne har kjennskap til de nye referanseområdene og kriteriene innen diagnostiseringen
av KOLS utgitt av Helsedirektoratet i 202214 ble det inkludert et spørsmål om man har hørt om z-score.
Kunnskapen om spirometri ble målt med hjelp av poeng (0 – 7), med ett poeng for hvert riktig svar. Deltakerne ble kategorisert i fire grupper: dårlig kunnskap (0-1 poeng), under middels kunnskap (2-3 poeng), over middels kunnskap (4-5 poeng) og god kunnskap (6-7 poeng).
Statistisk analyse: χ²-testen ble brukt til å analysere gruppeforskjeller, og logistisk regresjonsmodell for vurdering av mulige konfundere. Alle resultater ble rapportert med en 95% konfidensintervall (KI), og p-verdier under 0,05 ble betraktet som statistisk signifikante. Tosidige tester ble brukt for alle statistiske prosedyrer. Statistiske analyser ble utført ved hjelp av SPSS.
Resultater:
Studiepopulasjon
Til sammen svarte 1138 personer på spørreskjemaet. Av disse ble 195 ekskludert, enten på grunn av at disse ikke var ansatt i spesialisthelsetjenesten eller de var spesialist / under spesialisering i en annen spesialitet enn indremedisin eller kirurgi. Totalt ble 943 deltagere (leger og medisinstudenter) inkludert i studien.
Det var flere kvinnelige leger som svarte på undersøkelsen, og majoriteten av deltakerne kom fra Midt- og Sør-Norge. Videre detaljer sees i tabell 1.
Forespørsel om deltakelse i en spørreundersøkelse i forbindelse med et prosjekt som ønske å kartlegge kunnskap om spirometri blant sykehusleger i Norge.
Jeg er LIS1
LIS2
LIS3
Spesialist
Medisinstudent
Kjønn
Kvinne
Mann Vil ikke oppgi
Alder
20-30
31-40
41-50
>50

I hvilket HF jobber du/studerer du?
Helse Sørøst
Helse Vest
Helse Midt
Helse Nord
Jeg jobber som Lege privat Lege i spesialisthelsetjenesten Jeg er medisinstudent med/uten lisens
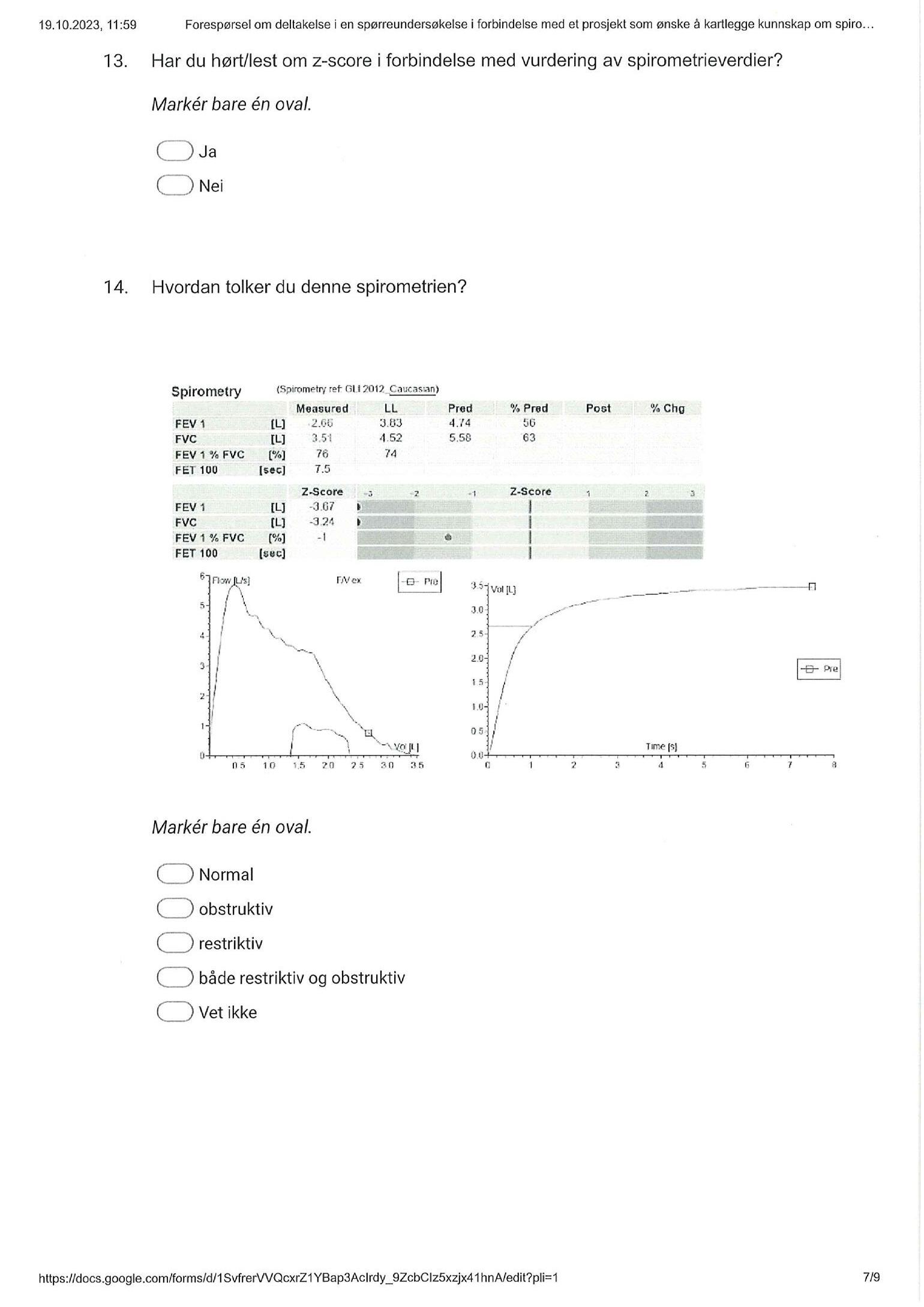
Jeg jobber innen et medisinsk fag et kirurgisk fag annet medisinstudent
Hvilke av følgende parameter brukes for diagnostisering av KOLS?
FVC
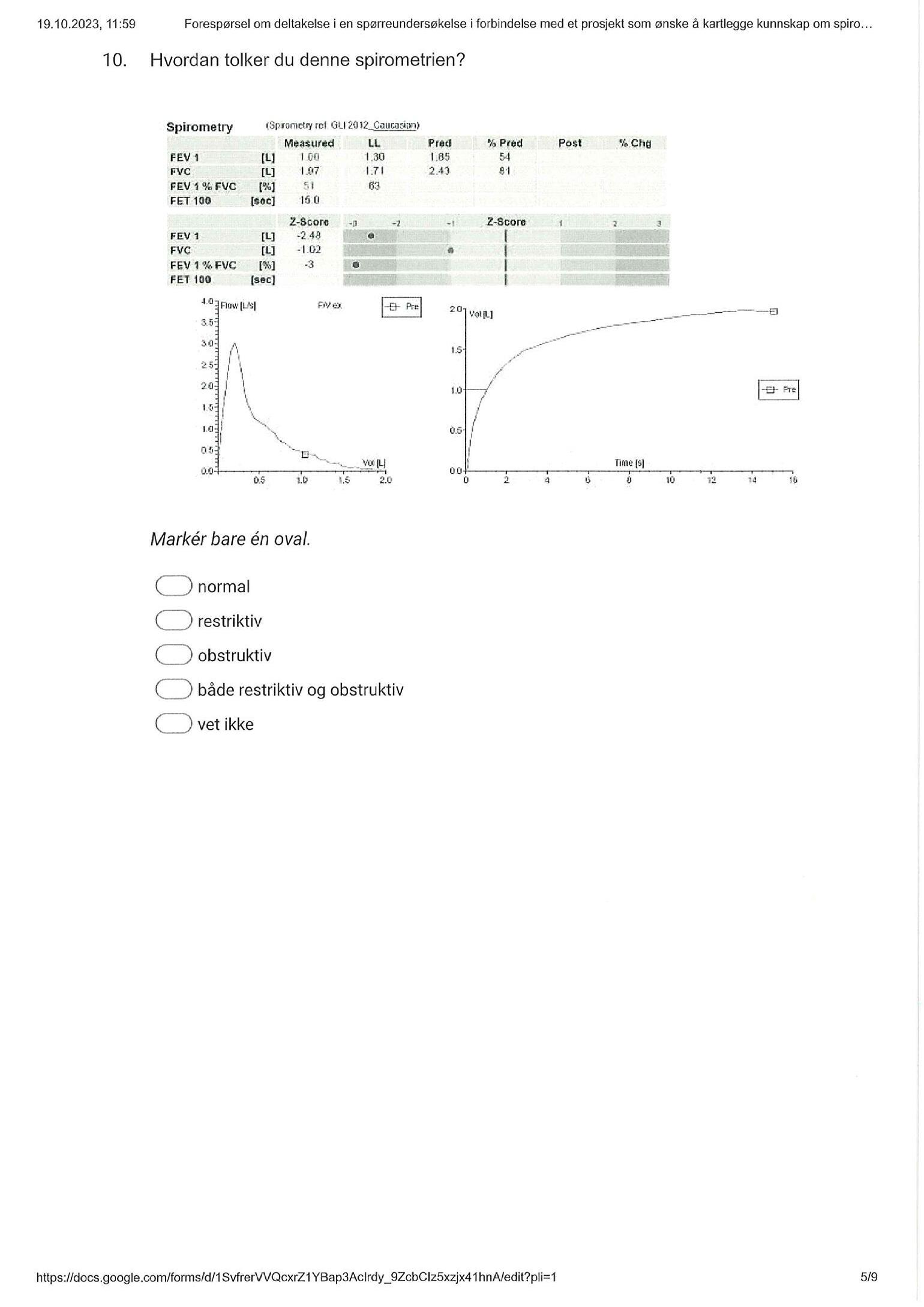
FEV1
FEV1/FVC kvotient
KCO eller DLCO Vet ikke
Etter «gamle metoden» hva er nedre referanse for FEV1, FVC og FEV1/FVC? 80% av forventet verdi for FEV1, FVC og FEV1/FVC 70% av forventet verdi for FEV1, FVC og FEV1/FVC 80% av forventet verdi for FEV1 og FVC og 70% av forventet verdi for FEV1 /FVC Vet ikke
9. Hvilken verdi brukes til gradering av KOLS?
F FVC
F FEV1
F FEV1/FVC kvotient
F KCO og eller DLCO
F Vet ikke
10. Hvordan tolker du denne spirometrien? (Figur 01)
F Normal
F Restriktiv
F Obstruktiv
F Både restriktiv og obstruktiv
F Vet ikke
11. Hvordan tolker du denne spirometrien? (Figur 02)
F det foreligger en signifikant endring i verdiene
F det foreligger en endring av verdier men den er ikke signifikant
F jeg er usikker hva dette er
12. Signifikant respons på bronkodilator (signifikant reversibilitet) er definert som:
F endring av FEV1 om 10% eller mer
F endring av milliliter FEV1 om 200 ml eller mer
F endring av FEV1 om 10% eller mer og endring av milliliter FEV1 om 200 ml eller mer
F vet ikke
13. Har du hørt/lest om z-score i forbindelse med vurdering av spirometrieverdier?
F Ja
F Nei
14. Hvordan tolker du denne spirometrien? (Figur 03)
F Normal
F Restriktiv
F Obstruktiv
F Både restriktiv og obstruktiv
F Vet ikke
15. Hva mener du selv?
F jeg kan tolke spirometri
F jeg har behov for opplæring innen spirometri og trenger økt kunnskap innen tolkning av spirometri
F spirometri er ikke viktig for min jobb som lege
TABELL
N %
Kjønn Kvinne 598 63
Mann 330 35
Ikke angitt 15 2
Utdanning Student 131 14
Lege 812 86
Spes. grad Student 131 14
LIS* 1 102 10
LIS 2 142 16
LIS 3 311 33
Ferdig spesialist 257 27
Alder 20-30 291 31
31-40 427 45
41-50 183 19
> 50 42 5
Fagretning Kirurgi 203 22
Medisin 609 65
Student 131 13
Region Helse Nord 116 12
Helse Midt 364 38
Helse Vest 128 14
Helse Sør Øst 335 36
*LIS Lege i spesialisering
Spirometri:
Definisjon av KOLS med hjelp av spirometri FEV1/ FVC% < 70
av KOLS
Definisjon av significant reversibilitet
Kunnskap om referanseverdier FEV1, FVC, and FEV1/FVC%
Korrekt interpretasjon av obstruktiv luftveisinnskrenkning
Korrekt interpretasjon av signifikant reversibilitet
(N 536)
(N 855)
(N
FEV, Forced expiratory volume; FVC, Forced vital capacity; KOLS, Kronisk obstruktiv lungesykdom;
Vi fant at 70-80% av studiepopulasjonen brukte FEV1/FVC% < 70 som diagnostisk kriterium for KOLS, som er i henhold til GOLD sin referanseverdi fra 2023. Men kun 35-45% graderte KOLS etter referanseverdiene for forsert ekspirasjonsvolum ved ett sekund (FEV1), forsert vitalkapasitet (FVC) og FEV1/FVC-kvotient (FEV1/FVC%). Tabell 2
Medisinstudenter hadde generelt et høyt kunnskapsnivå. Sammenlignet med leger innen indremedisin viste medisinstudenter nesten like høyt kunnskapsnivå i 4 av 6 spørsmål. Innen gradering av KOLS og tolking av signifikant reversibilitet fant vi bedre kunnskap blant leger innen indremedisin.
Leger innen kirurgiske fag hadde generelt lavere kunnskap.
Samlet oppnådde 72% av sykehuslegene en poengsum på 4 eller mer (bedre enn middels kunnskap). Andelen blant studentene var 69% og blant indremedisinerne 79%. Majoriteten hadde 4-5 riktige svar (Figur 1). Kun 6 % av indremedisinske leger svarte riktig på alle spørsmål, ingen av medisinstudentene fikk maks poengtall på 7. Innen kirurgiske fag var andelen med minst 4 riktige svar 52%.
Utvikling av kunnskap, selvrapportert kunnskap og læring Kunnskapen om spirometri økte signifikant under spesialisering i indremedisin (p < 0,001, 95% CI 0,064-0,235). Etter endt spesialisering hadde kunnskapsnivået en fallende trend blant spesialister innen indremedisin. På grunnen av studiedesignet er det ikke mulig å se hvilke subspesialiteter dette gjelder. Kunnskapen hos leger innen kirurgi hadde allerede fallende tendens gjennom spesialiseringen. Se figur 2.
Blant sykehuslegene totalt, rapporterte 273 (34%) av respondentene gode ferdigheter innen tolkning av spirometri. Andelen under spesialisering i indremedisin viste en økende tendens jo lenger legene var kommet i utdanningsløpet, 9% av LIS1, 33% av LIS2 og 52% av LIS3 mente å ha god kunnskap.
Den målte kunnskapen med spørreskjema viste tilsvarende signifikant økning i spesialiseringsløpet innen indremedisin, med god kunnskap (6 eller 7 riktige svar) hos henholdsvis 17%, 29% og 39% for første, andre og tredje år (p > 0,001). Etter avsluttet spesialisering, viste imidlertid kun 38% god kunnskap i spirometri.
Over halvparten av respondentene viste interesse for mer opplæring i spirometri (44% av kirurgene, 48% av indremedisinerne og 90% av medisinstudentene). Interessen for økt opplæring var fallende gjennom utdanningsforløpet, 84% av LIS1 ønsket mer opplæring, 65% av LIS2 og 39% av LIS3. Samtidig økte andelen for LIS i indremedisin, som anga å ikke ha behov for spirometri: 7% av LIS1, 2% av LIS2 og 9% av LIS3.
Vi fant en klar korrelasjon mellom legenes selvrapporterte kunnskap om spirometri og deres prestasjon i spørre skjemaet. Deltakere som ønsket opplæring, scoret 4,2, mens de som vurderte egen kunnskap som god, scoret 5,2 (p < 0,001).
Diskusjon: Spørreskjemaet viste at kunnskapen om spirometri blant sykehusleger generelt i Norge ofte er mangelfull, og omtrent på samme nivå som hos allmennpraktiserende leger. Ikke overraskende viste leger i indre medisinske spesialiteter bedre kunnskap i tolking av spirometri enn leger i kirurgiske fag. Et klart flertall (80%) av leger innen indre medisinske spesialiteter kunne diagnostisere KOLS med hjelp av spirometri. Imidlertid kunne kun 70% klassifisere alvorlighetsgraden korrekt med hjelp av FEV1, og kun
47% var kjent med normalverdiene for FEV1, FVC og FEV1/FVC kvotient i diagnostikken.
Kunnskapen om spirometri viste en stigning blant leger i spesialisering innen indremedisin. Samtidig rapporterte en økende andel LIS innen indremedisin økende kompetanse i tolkning av spirometri etter lengre perioder med spesialisering.
Dette er den første studien som inkluderer medisinstudenter og sammenligner disse med praktiserende sykehusleger. Medisinstudenter og indremedisinere viste det høyeste kunnskapsnivået om spirometri i vår populasjon. Det er tydelig at LIS innen indremedisin anser spirometri som et viktig verktøy. Flertallet anså opplæring i spirometri som nødvendig og uttrykte interesse for mer av dette. Vi så størst interesse tidlig i utdanning: fra 90% hos medisinstudentene til 39% ved LIS3.
I mange år har man brukt FEV1/FVC kvotient < 70% som definisjon for KOLS. Alvorlighetsgraden ble vurdert ut fra FEV1 i prosent av forventet. Global Initiative for Obstructive Lung Disease (GOLD) bruker fortsatt i retningslinjene sine FEV1/FVC kvotient som diagnostisk kriterium for KOLS og FEV1 til gradering av KOLS. I Norge har man endret de diagnostiske kriteriene i 2022 og Helsedirektoratet anbefaler nå nedre normalgrense (LLN) som cut off verdi.
Vi har valgt allikevel å bruke GOLD sin klassifikasjon, som tilsvarer den tidligere klassifikasjon i Norge fram til 2022. Mange er fortsatt ikke klar over at det finnes en ny klassifikasjon, og sykehusmiljøet og ikke minst primærhelsetjenesten er fremdeles i en overgangsperiode mellom definisjon på 0,7 og en individualisert grense. Vi tenker at bruken av de nye nasjonale faglige råd eventuelt har kunnet påvirke resultatene på en uheldig måte siden det er fortsatt rundt 30% av LIS innen indremedisin som ikke har hørt eller lest om z-score, det vil si som ikke er klar over at det finnes en ny klassifikasjon.
Våre resultater samsvarer med resultater fra primærhelsetjenesten. Rothnie fant at 72% av allmennlegene brukte FEV1/FVC% for
Utviklingen av kunnskap gjennom spesialiseringsperioden for indremedisiner og kirurger
1:
av kompetanse
FIGUR 2: Utviklingen av kunnskap gjennom spesialiseringsperioden for indremedisinere og kirurger.
KOLS-diagnose, mens 77% av legene i vår studie brukte riktig kvotient 1 Tollånes’ fant at 49% av norske allmennleger ikke kjente til referanseverdiene for enkelte spirometriparametere, mens 57% av sykehuslegene i denne studien ikke kunne definere disse normalverdiene 3. Andelen av allmennleger og sykehusleger som ikke brukte FEV1% for gradering av KOLS var omtrent likt, 50% og 60% henholdsvis.
Vår studie, sammen med andre, understreker nødvendigheten av å opprettholde og forbedre spirometrikunnskapen blant leger i spesialisthelsetjenesten. Det er en samlet enighet blant forskere om at opplæring og kontinuerlig utdanning er avgjørende på dette området, som også vil styrke pasientsikkerheten.
Sterkheter og svakheter:
Etter vår kjennskap, er denne studien den første norske studien og den største studien innen dette feltet.
Videre inkluderer studien deltakere fra både store og små sykehus, samt fra alle regioner i Norge. Dessverre har vi ikke muligheten til å sammenligne kunnskap ved store og små sykehus, siden det ikke ble registrert hvor den enkelte legen jobbet. En ytterligere styrke er data om kunnskapen i forskjellige perioder av utdanningen som gjør det mulig å studere trenden gjennom utdanningsløpet, og vi har inkludert medisinstudenter i undersøkelsen. På grunn av spørreundersøkelsens nettbaserte natur, er det umulig å fastslå det nøyaktige antallet personer som mottok spørreskjemaet og hvor mange som besvarte skjemaet, og dermed svarprosenten.
Videre kan vi ikke utelukke at noen deltakere svarte på spørreskjemaet flere ganger, noe som potensielt kan påvirke resultatene. Muligheten for utvalgsbias er til stede, da kun personer med spesiell interessert i spirometri kan ha valgt å delta. Imidlertid merker vi oss at resultatene våre er nokså like annen internasjonal forskning. *
Som skrevet tidligere har vi valgt å benytte GOLD sin definisjon for KOLS, samt gradering av sykdom-
Referanser
1. Rothnie KJ, Chandan JS, Goss HG, Mullerova H, Quint JK. Validity and interpretation of spirometric recordings to diagnose COPD in UK primary care. Int J Chron Obstruct Pulmon Dis. 2017;12:1663-1668. doi:10.2147/COPD.S133891
2. Sandelowsky H, Natalishvili N, Krakau I, Modin S, Stallberg B, Nager A. COPD management by Swedish general practitioners - baseline results of the PRIMAIR study. Scand J Prim Health Care. Mar 2018;36(1):5-13. doi:10.1080/02813432.2018.1426148
3. Tollanes MC, Sjaastad GE, Aarli BB, Sandberg S. Spirometry in chronic obstructive pulmonary disease in Norwegian general practice. BMC Fam Pract. Nov 18 2020;21(1):235. doi:10.1186/s12875-020-01310-x
4. Kuziemski K, Slominski W, Specjalski K, Jassem E, Kalicka R, Slominski JM. [Accuracy of spirometry performed by general practitioners and pulmonologists in Pomeranian Region in the “Prevention of COPD” NHS program]. Pneumonol Alergol Pol 2009;77(4):380-6. Ocena poprawnosci wykonania badania spirometrycznego przez lekarzy podstawowej opieki zdrowotnej oraz pneumonologow w ramach ogolnopolskiego programu Narodowego Funduszu Zdrowia: “Profilaktyka POChP”.
men. Vi tror at, om vi ville ha brukt Helsedirektorat sin definisjon, ville resultatene blitt med stor sannsynlighet blitt påvirket i en negativ retning.
Erratum: Etter distribusjon av spørre skjemaet oppdaget vi at det finnes flere riktige svar på spørsmål 14. Både obstruktiv, restriktiv og obstruktiv og restriktiv er riktige svar. Vi har derfor valgt å regne alle disse svarene som korrekte, med unntak av «normal» og «vet ikke».
5. Morin C, Buffel C, Lorenzo A. [Need for the training of GPs to perform spirometry: a study of French GP trainees]. Rev Mal Respir. May 2014;31(5):404-11. Besoins de formation a la spirometrie des internes de medecine generale francais : etat des lieux. doi:10.1016/j.rmr.2013.07.010
6. Roberts NJ, Smith SF, Partridge MR. Why is spirometry underused in the diagnosis of the breathless patient: a qualitative study. BMC Pulm Med. Jun 16 2011;11:37. doi:10.1186/1471-2466-11-37
7. Barreiro TJ, Perillo I. An approach to interpreting spirometry. Am Fam Physician. Mar 1 2004;69(5):110714.
8. Sinclair P, Kable A, Levett-Jones T. The effectiveness of internet-based e-learning on clinician behavior and patient outcomes: a systematic review protocol. JBI Database System Rev Implement Rep. Jan 2015;13(1):52-64. doi:10.11124/jbisrir-2015-1919
9. Parsons R, Schembri D, Hancock K, et al. Effects of the Spirometry Learning Module on the knowledge, confidence, and experience of spirometry operators. NPJ Prim Care Respir Med. Aug 9 2019;29(1):30. doi:10.1038/s41533-019-0143-9
10. Ferrante G, Licari A, Cilluffo G, et al. Impact of a
Konklusjon: Kunnskapsnivået om spirometri blant norske sykehusleger er varierende, og det foreligger et behov for å øke denne kunnskapen. Et flertall av legene er klar over disse manglene, og omtrent halvparten av legene ønsker å øke sin egen kunnskap, helt uavhengig av spesialiteten. Adekvat kunnskap kan oppnås med enkle grep som ikke er tidskrevende og kostbare.
supervised training course on spirometry competency for primary care pediatricians. J Asthma. Oct 2021;58(10):1292-1297. doi:10.1080/02770903.2020.17 81888
11. Ayuk A, Ndukwu C, Uwaezuoke S, Ekop E. Spirometry practice and the impact of a phase 1 training workshop among health workers in southern Nigeria: a cross-sectional study. BMC Pulm Med. Oct 6 2020;20(1):258. doi:10.1186/s12890-020-01291-8
12. Claudio Sorino NS, Annarosa Maspero, Vincenzo Bellia. Physician’s mistakes in the interpretation of spirometry. presented at: European Respiratory Society Annual Congress 2012; 2012; 13. Global Initiative for Chronic Obstructive Lung Disease I. 2023 Pocket Guide. Accessed 2023, 2023. https:// goldcopd.org/wp-content/uploads/2023/03/POCKETGUIDE-GOLD-2023-ver-1.2-17Feb2023_WMV.pdf
14. Helsedirektoratet. KOLS - diagnostisering og behandling. 2022. https://www.helsedirektoratet.no/ retningslinjer/kols/diagnose-utredning-og-vurderingav-alvorlighetsgrad#behandlende-lege-bor-stillediagnosen-kols-hos-pasienter-som-har-kroniskeluftveissymptomer-og-har-en-postbronkodilatoriskratio-fev1-fvc-under-nedre-normalgrense-lnn-vedminst-to-malinger-i-stabil-fase
Indikasjon: Tezspire er indiser t som tillegg til vedlikeholdsbehandling hos voksne og ungdom i alderen 12 år og eldre med alvorlig astma som er utilstrekkelig kontroller t til tross for høye doser inhalasjonskor tikosteroider i tillegg til et annet legemiddel for vedlikeholdsbehandling. Dosering: Anbefalt dose: 210 mg s.c. hver 4. uke. Tezspire er til langtidsbehandling. Minst 1 gang årlig bør det vurderes om behandlingen skal for tsette, baser t på nivået av astmakontroll. Ved glemt dose, skal denne administreres så for t som mulig. Deretter kan doseringen gjenopptas på neste planlagte administrasjonsdag. Dersom det allerede er tid for neste dose, skal den administreres som planlagt. Dobbel dose skal ikke administreres. Behandling skal initieres av lege med erfaring med diagnostisering og behandling av alvorlig astma. Vanlige bivirkninger: Faryngitt, utslett, ar tralgi, reaksjon på injeksjonsstedet. Forsiktighetsregler: Skal ikke brukes til å behandle akutte astmaeksaserbasjoner. Astmarelater te symptomer eller eksaserbasjoner kan oppstå. Pasienten bør instrueres om å oppsøke lege hvis astmaen forblir ukontroller t eller forverres. Brå seponering av kor tikosteroider etter behandlingsoppstar t anbefales ikke. Eventuell dosereduksjon av kor tikosteroid bør skje gradvis under legeoppsyn. Overfølsomhetsreaksjon/anafylaksi kan oppstå innen noen timer, men også noen dager, etter administrering. Anamnese med anafylaksi (ikke relater t til Tezspire ) kan være en risikofaktor Pasienter skal overvåkes i passende tid etter administrering. Alvorlige infeksjoner bør behandles før oppstar t av behandling. Ved utvikling av alvorlig infeksjon under behandling, bør behandlingen seponeres inntil denne er over. Pasienten skal informeres om å oppsøke øyeblikkelig legehjelp ved tegn/symptomer på kardiovaskulær hendelse. Ved utvikling av alvorlig kardiovaskulær hendelse bør behandlingen seponeres inntil den akutte hendelsen er stabiliser t. Helmintinfeksjon bør behandles før behandlingsoppstar t. Hvis pasienten smittes under behandling og ikke responderer på antihelmintika, skal Tezspire seponeres til infeksjonen går over Levende, svekkede vaksiner skal unngås. Graviditet og amming: Bruk under graviditet bør unngås med mindre forventet nytte for den gravide oppveier mulig risiko for fosteret. Risiko for nyfødte som ammes de første dagene etter fødsel kan ikke utelukkes. Baser t på fordel av amming for barnet/fordel av behandling for mor må det tas en beslutning om Tezspire skal avsluttes/avstås fra i denne perioden. Pakninger og priser: Injeksjonsvæske, oppløsning i ferdigfylt penn (210 mg): 1 stk: kr. : 15 053,40 Injeksjonsvæske, oppløsning i ferdigfylt sprøyte (210 mg): 1 stk. kr. : 15 053,40
Reseptgruppe: C. Refusjon: H-resept.
Refusjonsberettiget bruk: Der det er utarbeidet nasjonale handlingsprogrammet/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. Vilkår: 216 Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist. Anbud alvorlig astma. Behandlingen kan tas i bruk fra oppstar t av neste avtaleperiode, tentativt 01.09.2024.
Beslutning i Beslutningsforum for nye metoder (18.03.2024) Tezepelumab (Tezspire) innføres som tillegg til vedlikeholdsbehandling ved alvorlig astma til et annet legemiddel for vedlikeholdsbehandling. For fullstendig informasjon, les TEZSPIRE SPC på www felleskatalogen.no NO-12027-03-2024-TEZ
Tezspire er indisert som tillegg til vedlikeholdsbehandling hos voksne og ungdom i alderen 12 år og eldre med alvorlig astma som er utilstrekkelig kontrollert til tross for høye doser inhalasjonskortikosteroider i tillegg til et annet legemiddel for vedlikeholdsbehandling1
Utvalgt sikkerhetsinformasjon:
Vanlige bivirkninger er faryngitt, utslett, artralgi, reaksjon på injeksjonsstedet1
Skal ikke brukes til å behandle akutte astmaeksaserbasjoner1

TEZSPIRE (tezepelumab) er det første og eneste astmalegemiddelet som blokkerer TSLP* høyt oppe i tvers av fenotyper og uavhengig av biomarkørnivå 2,3,4,5,6**
Vil du lære mer om nytt angrepspunkt for behandling av alvorlig astma?
*TSLP =Tymisk stromalt lymfopoietin f.eks.
Referanser
1. Tezspire SPC 4.1, 5.1, 4.8, 4.4. 2.Corren J, Parnes JR, Wang L et al. Tezepelumab in Adults with Uncontrolled Asthma. N Engl J Med 2017;377:936-46. 3. Menzies-Gow A, Corren J, Bourdin A et al. Tezepelumab in Adults and Adolescents with Severe, Uncontrolled Asthma Supplementary information. N Engl J Med 2021;384:1800-9. 4. Menzies-Gow A, Wechsler ME, Brightling CE. Unmet need in severe, uncontrolled asthma: can anti-TSLP therapy with tezepelumab provide a valuable new treatment option? Respir Res 2020;21:268. 5. Brusselle Guy, Koppelman GH. Biologic Therapies for Severe Asthma. N Engl J Med 2022;386:157-71. 6. Gauvreau GM, Sehmi R, Ambrose CS et al. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert Opin Ther Targets. 2020;24:777–92.

Torsdag 6. mars startet ECIM (22nd European Congress of Internal Medicine), som fant sted i Istanbul, Tyrkia. I løpet av 4 dager fikk vi del i et bredt spekter av faglig og sosialt innhold.
Jostein Holen Ibsen, Inga Morgenlie, Marianne Tønnessen og Anne Gulsvik
European Federation of Internal Medicine (EFIM) ble opprettet i 1996 og har i en årrekke arrangert gode faglige kongresser for Indremedisinere. ECIM 2024 bød på et bredt og sterkt faglig innhold, og i år var det over 2000 deltagere fra hele Europa til stede. Istanbul som var årets vertskapsby bød på både kultur, god mat og fantastisk stemning.
Den offisielle åpningen av kongressen var 6. mars, noen timer etter EFIMs generalforsamling. President professor Gomes Huelgas fremhevet de mange aktivitetene rettet mot fremme av praksis og utdanning innen indremedisin i Europa. Flere
land ble inkludert i organisasjonen, som nå består av 43 nasjonale foreninger. Fra UEMS etableres snart European Board of Internal Medicine, som vil tilby en felles eksamen for å sikre en enhetlig indremedisinsk spesialitet på tvers av de europeiske land. Redaktør professor Agnelli rapporterte at European Journal of Internal Medicine nå har økt sin impact factor ytterligere til 8,0. Webportalen EFIM Academy opplevde økende aktivitet, spesielt fra Storbritannia, deres podkaster ble trukket positivt frem. ESIM Winter School ble som kjent arrangert i Sverige, med god norsk deltakelse. Hellas vant arrangementet av
sommer skolen for 2025-27, som vil finne sted i Alexandropoulos.
Det var ingen mangel på betydningsfulle faglige innlegg under kongressen. Innledningen “What is new in Acute medicine», og da spesielt Nick Smallwood sitt innlegg om «Enhanced care – Enabling the Acute Physician to deliver Great Care» viste oss viktigheten av dedikerte medisinske overvåkningsenheter. Modellen vi har i Norge vekket interesse blant deltagerne og vi ble oppmerksomme på hvor unik og «norsk» denne løsningen er. Medisinsk overvåkning dekker noen av de utfordringene Smallwood pekte på, ved å fylle gapet mellom



ressurskrevende, generelle intensivenheter og ordinær sengepost uten overvåkningsmuligheter.
Flere andre viktige temaer ble tatt opp. I “Joint session - Highlights of the 2023 ESH Hypertension Guidelines” ble European Society of Hypertension sine behandlingsretningslinjer fra 2023 oppsummert. Det legges spesiell vekt på korrekt blodtrykksmåling, vurdering av kardiovaskulær risiko, gunstige livsstilsintervensjoner og spesifikk farmakoterapi. Retningslinjene angir at blodtrykk <130/80 mm Hg er best for å redusere risikoen for kardiovaskulære hendelser hos voksne med høy risiko og man viste til bruk av SCORE. I Europa er terskelen for intervensjon fortsatt blodtrykk>140/90 mmHg, og vi har aldersbaserte behandlingsmål, i motsetning til i USA (ACC/AHA) der grensen er >130/80 for alle. I Norge må vi ha i mente at Norske helsemyndigheter anbefaler å bruke NOR-
RISK2 fremfor SCORE, da NORRISK er basert på norske data. Mange med hypertensjon grad 1 (Blodtrykk 140159/90-99 mmHg), vil ut fra NORRISK2 ikke anbefales medikamentell behandling. Ved hypertensjon grad 2 (160-179/100-109 mmHg) anbefales i utgangspunktet medikamentell behandling til alle. Ved innleggelse i sykehus bør indremedisineren være oppmerksom på at blodtrykket vil være annerledes enn i habitualtilstand, og vi bør derfor vurdere å anbefale rask blodtrykkskontroll hos fastlege eller 24-timers blodtrykksregistrering, fremfor igangsetting av intervensjon ifm. innleggelse.
Innenfor hjertesviktbehandling gjorde foredragsholderne rede for at behandling av jernmangel hos pasienter med HFrEF og HFmrEF med symptomer, inngår med sterkere anbefaling i de nyeste behandlingsanbefalingene (Klasse IA anbefaling), da dette er vist å redusere symptom-
byrde og øke livskvalitet for begge disse gruppene og å redusere sykehusinnleggelser for pasienter med HFrEF. I retningslinjene viser man til ferritinverdier <100, men det er senere diskutert i en nyere leder i Eur Heart J at det er transferrinmetning < 20 % er en bedre markør for jernmangel enn ferritin <100 og foreslås som styringsparameter for å tilby jerninfusjon hos hjertesviktpasienter med HFrEF.
I “Plenary session - What is new in Diabetes treatment” ble det presentert at fedmekirurgi kan være et aktuelt behandlingsalternativ for aktuelle pasientgrupper. Randomiserte kliniske studier av fedmekirurgi har vært begrenset i størrelse, type kirurgisk inngrep og oppfølgingstid. Man har derfor villet studere og fastslå langsiktig glykemisk kontroll og sikkerhet ved fedmekirurgi sammenlignet med medisinsk- og livsstils behandling


av overvektige pasienter med type 2 diabetes. Etter 7 til 12 års oppfølging hadde individer som ble randomisert til fedmekirurgi en signifikant bedre glykemisk kontroll, mindre bruk av diabetesmedikamenter og høyere remisjonsrater for diabetes enn gruppen som bare ble behandlet med medikamenter og livsstils intervensjon. Indremedisinere bør derfor vite at kirurgisk behandling også kan være et aktuelt behandlingsalternativ for denne pasientgruppen, også i Norge.
Økende omtale og bruk av Vitamin D tilskudd var tema i “Controversies Debates Vitamin D supplementation”. Det var bred enighet om at alvorlig vitamin D mangel (serum 25-hydroksyvitamin D konsentrasjon) <30 mmol/l bør korrigeres og de fleste anbefaler verdier >50 mmol/l for god benhelse hos eldre. Randomiserte kliniske studier har ikke vist at tilskudd av vitamin D alene hos individer med verdier >50 mmol/l har gitt noen helsegevinst for noen grupper. Verdier mellom 30 og 50 mmol/l er i stadig diskusjon.
Man kan ikke komme fra noen kongress i dag uten å snakke om
AI og det kraftige inntrykk i både helsetjenester og samfunnet i sin helhet. Første felles sesjonen snakket Kirurgen Julio Mayol om temaet. Sesjonen gled fort over om hvordan AI allerede i dag endrer hverdagen og fremtiden for leger på både godt og vondt.
“Acute medical care in frail patients at home” presenterte erfaringer fra et prosjekt om hjemme-sykehus fremfor sykehusinnleggelser i Malmø. Dette bekreftet en fersk Cochrane analyse av 20 randomiserte kontrollerte studier med totalt 3100 deltakere der hjemme-sykehusbehandling sannsynligvis resulterer i liten eller ingen forskjell i pasientens selvrapporterte helsetilstand, men tilfredshet med mottatt helsehjelp kan være bedret ved hjemme-sykehusbehandling. En mangel var derimot at få studier rapporterte effekten på omsorgspersoner. Hjemmesykehusbehandling var forbundet med behov for kortere oppholdsvarighet enn behandling ved konvensjonelle innleggelser.
Det norske delegatet var også aktive deltakere under kongressen. Overlege Stephen Hewitt bidro som leder i sesjonen “Internal Medicine
in the future hospital” og ble senere offisielt anerkjent som Fellow of EFIM, en æresbevisning som tildeles leger som har utmerket seg for sitt bidrag til fremskritt innenfor Indremedisin. Senere presenterte Jostein Ibsen sitt bidrag under en av sesjonene “Diagnosis and follow-up of celiac disease – a contemporary patient material”. Her fortalte han om den gode prognosen hos cøliakere etter oppfølgning og diskuterte Anti-DG IgG plass i diagnostisering og definisjon av seronegativ cøliaki.
Tiden utenom kongressen gikk minst like raskt som konferansen og ble brukt til å knytte nye viktige kontakter i det indremedisinske felleskapet, samt å utforske Istanbul! Det norske følget besto av Stephen Hewitt, Anne Gulsvik, Inga Dalseth Morgenlie, Vahid Mokhtari, Marianne Tønnessen og Jostein Ibsen, er svært hyggelig gjeng. Fra oss som deltok på kongressen kan vi ikke annet enn å anbefale på det varmeste å delta på neste års kongress i Firenze 5.-8. mars 2025.
Leading Experts from EMEA Answer Procedure-Related FAQs.
There’s nothing quite as effective as learning from experts in their respective fields. With our new Lung-Term Learning initiative, we want to further elevate the standard of care by creating a pulmonology community and broaden our offer for education beyond our medical expert trainings.
We would like to invite you to watch our “Lung-Term Learning” videos, where renowned experts will be sharing procedure-and education-related tips and tricks on how to further improve procedural outcomes and to help in our efforts to further elevate the standard of care in lung cancer diagnosis and staging.
Check out the first episode of our FAQ series and stay tuned for upcoming videos.
Visit www.olympus.eu/pulmonology or scan the QR code for more information.
#LoveForLungs

Årets Endokrinologiske vintermøte gikk av stabelen i Tromsø 6.-8. mars, på Scandic Ishavshotell. Det ble dessverre verken nordlys, midnattssol eller hvalsafari denne gang, men til gjengjeld fikk vi et flott faglig program og ikke minst god tid til å sosialisere oss med både gamle og nye bekjentskap.
Sondre Meling og Trine Finnes. Norsk endokrinologisk forening


Veilederen
Også i år hadde en gruppe endokrinologer satt av en dag før Vintermøtet til å oppdatere vår etter hvert veletablerte nasjonale veileder i endokrinologi. Veilederen er nå i likhet med mange andre oppslagsverk tilgjengelig på Metodebok. no, og er blitt et viktig verktøy for å kunne gi råd til kolleger i og utenfor faget, og bidrar dermed til felles forståelse og utøvelse av faget til pasientenes beste. Det ble jobbet i fire grupper. Innen hypofyse og binyrefeltet undergikk akromegalikapittelet en revisjon som blant annet innebærer at ekko-cor kun gjøres på indikasjon og at alle anbefales koloskopi kun én gang med mindre det er funn som krever oppfølging. Videre var det med bakgrunn i medikament-tilgjengelighet og nyere
anbefalinger nødvendig å revidere prolaktinom-kapitelet. Anbefaling om bromokriptin ved stor tumor ble tatt bort. Videre fremgår det at kabergolin kan brukes i svanger skapet. Interesserte vil også se at det er gjort noen endringer i andre hypofysekapitler. Den største og viktigste endringen i gonade-seksjonen i 2024 er et nytt kapitel om kjønnsinkongruens. Kapitelet anbefales lest av alle som involveres i behandling av pasientgruppen. Her gis både praktiske råd om blodprøvetaking og føringer for oppfølging i primærhelsetjenesten. Videre er det tilkommet et nytt kapittel om utredning og oppfølging av brukere av anabole steroider som gjør det enkelt å komme i gang med utredningen og å tolke prøvesvarene. Rådene om behandling er enkle og kortfattede. Innen tyreoida-feltet
er det kommet et nytt kapittel om Myksødemkoma, og flere sentrale kapitler har gjennomgått opprydning og revisjon. Vi håper dermed på enda større bruker vennlighet og fortsatt mye bruk av disse populære kapitlene. For osteoporose/ kalsium delen har man gjort en endring i kapittel-inndelingen, slik at kapittelet ”Hypokalsemi profylakse ved paratyreoidea kirurgi» er blitt et avsnitt under ”Primær hyperparatyreoidisme”. Veilederen har fortsatt eget kapittel om hypoparatyreoidisme og hypokalsemi, og vi føler oss trygge å at de som trenger det finner frem. I hypoparatyroidisme-kapittelet finner man også råd om hvordan man skal forholde seg til at Natpar (paratyroideahormon til subcutantbruk) blir borte fra markedet. Nytt kapittel av året er ”Pagets sykdom

(osteitis deformans)”. Tilstanden er relativt sjelden, men den diagnostiseres gjerne i forbindelse med annen utredning, og vi forventer at mange utenfor endokrinologien også vil ha glede av dette kapittelet. Innen diabetes og metabolisme er det også gjort mindre endringer i flere kapitler. Den største revisjonen ble gjort i det relativt nye fedmekapittelet. Vi håper nå at tekst og oppbygning er mer gjenkjennelig fra oppbygging av andre kapitler og at det blir et nyttig dokument for alle som er interesserte i hva som er gjeldende anbefalinger for utredning og behandling ved fedme.
Vintermøtet
Det faglige programmet på selve vinter møtet rommet alt fra internasjonale kapasiteter til nasjonale kjendiser. På diabetesfronten fikk vi besøk av EASD 2023 Rising Star, Lærke Smidt Gasbjerg fra København, som fortalte oss om siste nytt innenfor diabetes, fedme og tarmhormoner. En av de aller fremste innenfor kongenital adrenal hyper plasi, Henrik Falhammar fra
Karolinska holdt et ypperlig oversiktsforedrag på feltet, mens Terhi Piltonen fra Finland fulgte opp om nye guidlelines innenfor PCOS. Falhammar imponerte forøvrig også med å ankomme vintermøtet kvelden før start, og deltok gjennom hele møtet, og så ut til å stortrives. I endokrinologien som i mange andre fag, er samarbeid med andre disipliner påkrevd for å kunne gi pasientene god og riktig behandling. I år fikk vi høre innlegg både fra gastroenterolog, endokrin kirurg, og oftalmolog. Det ble lagt frem imponerende 14 case reports og frie foredrag, og nok en gang gratulerer NEF Marianne Grytaas fra Bergen med prisen for årets foredrag, denne gang med tema endoskopisk utralydveiledet radiofrekvensablasjon av binyrene. Vi fikk også presentert årets PhDer i endokrinologien som viser vår store bredde, fra hyperparatyroidisme og frakturer, til DNA metylering og nevropati i tarmen. På siste dag var programmet felles med våre venner barneendokrinologene. Dette er blitt en tradisjon som vi håper å kunne fortsette med til gjensidig
nytte og glede både for pasienter og behandlere.
Det sosiale programmet inkluderte besøk og middag på Full Steam, et samisk museum/spisested for sjøfart og samisk kultur. Der fikk vi servert et såpass langt personlig innlegg fra vår vert at arrangør Ragnar J. til slutt var redd maten skulle bli kald, men ingen fare, vi fikk servert nydelig lokal, og akkurat passe varm sjømat.
Festmiddagen dagen etter inkluderte både taler, diktlesning og allsang i tillegg til god mat og drikke. I år ønsker vi først og fremst å fremheve professor Kåre Birkelands tilbakeblikk i anledningen foreningens 75 års-jubileum.
NEF ønsker å takke spesielt Guri Grimnes og Ragnar Joakimsen i den lokale arrangementskomiteen for et ypperlig arrangement og gjestfrihet, og vi ser allerede frem til neste års møte som foregår i samme region, nærmere bestemt Sommarøy.

Norsk Endokrinologisk forening (NEF) besluttet ved årsmøtet i 2021 å styrke foreningens faglige forankring ved å opprette interessegrupper innenfor hypofyse og binyre, diabetes, fedme og metabolisme, osteoporose og kalsium, tyreoidea og reproduktiv endokrinologi. Gruppene består av mellom 4 og 6 medlemmer og det er ønskelig at alle Helseregioner er representert. Interessegruppen for Diabetes, fedme og metabolisme er en gruppe som allerede har hatt mange saker på bordet.
Sondre Meling. Norsk endokrinologisk forening
Gruppen ledes av Sondre Meling ved Stavanger Universitetssykehus, og består i tillegg av Kåre Birkeland, Oslo Universitetssykehus, Tore J. Berg, Oslo Universitetssykehus, Kristian Løvås, Haukeland Universitets sykehus, Dag Hofsø, Sykehuset i Vestfold og Sverre Christiansen, St. Olavs Hospital, Trondheim. Interessegruppen for diabetes, fedme og metabolisme har bidratt flittig med kloke innspill til ny folkehelsemelding, insulin på bytteliste og endringer i refusjonsregler for medikamenter brukt ved diabetes type 2. De har også bidratt til rekruttering av fagpersoner til metodevurderinger i Direktorat for medisinske produkter (tidligere Statens Legemiddelverk), fagpersoner til vurdering i «Nye metoder», arbeidsgrupper for utarbeidelser av kliniske retningslinjer i andre relevante fagspesialiteter, samt kandidater til å vurdere søknader til fond og legater. Ingen faglige spørsmål eller forslag er for små eller store til å diskuteres i gruppen, og de har gitt uttalelser og råd om alt fra regeltolkninger for førerkort til gravide med svangerskapsdiabetes som bruker insulin, til om det kan være aktuelt å opprette et nasjonalt kompetansesenter for diabetes og behandlingshjelpemidler. I forbin -
delse med det årlige vintermøte i NEF kommer interesse gruppen med forslag til tema og foredragsholdere innenfor området diabetes, fedme og metabolisme. Gruppens mandat innebærer i tillegg å bidra med innspill til faglig program i videre- og etterutdanningskurs, inkludert Indremedisinsk høstmøte og forslag til fagartikler og forfattere til Indremedisineren. I arbeidet med nasjonal veileder i endokrinologi har interessegruppen en viktig rolle som forslagsstiller til relevante kapitler og som høringsinstans før nye kapitler og større revisjoner publiseres. Gruppen har sammen med styret i NEF også deltatt i møte med Diabetesforbundet med mål om å styrke brukerinvolvering og dialog med pasientorganisasjonene. Til sist har gruppen selv satt seg et overordnet mål om å til enhver tid holde hverandre oppdatert på fagområdet, bidra til kunnskapsformidling blant kolleger og jobbe for at endokrinologer på sykehus blir mer synlige i den daglige behandling av diabetes på sykehus.
Det meste av kontakt og diskusjon i gruppa foregår fortløpende per epost, men gruppa har også hatt fysiske og digitale møter for å behandle større saker.
Tilbakemeldinger fra styret understreker viktigheten av interessegrupper innenfor Norsk endokrinologisk forening. Å kunne diskutere problemstillinger med og fordele saker til en gruppe med spisskompetanse før man gir tilbakemeldinger til myndigheter og andre organisasjoner er en nødvendighet i vårt høyspesialiserte helsevesen.

Utvalgte indikasjoner1
Revmatoid artritt: Voksne med revmatoid artritt (RA) i kombinasjon med metotreksat hos de som ikke oppnår tilstrekkelig effekt med metotreksat alene.
Autoinflammatoriske periodiske febersyndromer hos voksne, ungdom, barn og spedbarn (≥8 måneder med kroppsvekt ≥10 kg): Cryopyrinassosierte periodiske syndromer (CAPS) inkl. NOMID/CINCA , MWS og FCAS. Familiær middelhavsfeber (FMF), hvis hensiktsmessig i kombinasjon med kolkisin.
Stills sykdom: systemisk juvenil idiopatisk artritt (sJIA) og Stills sykdom i voksen alder (AOSD), med aktive systemiske trekk av moderat til høy sykdomsaktivitet, eller ved fortsatt sykdomsaktivitet etter behandling med NSAID eller glukokortikoider. Kan gis som monoterapi eller i kombinasjon med andre antiinflammatoriske legemidler og DMARD.
Dosering og administrering1
RA: Voksne inkl. eldre: Anbefalt dose er 100 mg 1 gang daglig
CAPS: Voksne inkl. eldre, ungdom og barn ≥8 måneder og ≥10 kg: Anbefalt startdose 1-2 mg/kg dag. FMF og Stills sykdom: Anbefalt dose 100 mg/dag ved kroppsvekt ≥50 kg. Ved kroppsvekt <50 kg justeres dosen etter kroppsvekt, med startdose 1-2 mg/kg/dag. Hos barn med utilstrekkelig respons kan dosen økes opptil 4 mg/kg/dag.
Kineret skal gis subkutant i daglige injeksjoner.
Utvalgte advarsler og forsiktighetsregler1
Skal ikke initieres ved nøytropeni.
Skal ikke initieres ved aktive infeksjoner.
Samtidig behandling med TNF-α-antagonister anbefales ikke pga. økt risiko for alvorlige infeksjoner.
Legemiddelreaksjon med eosinofili og systemiske symptomer . (DRESS) er rapportert i sjeldne tilfeller, hovedsakelig hos SJIA pasienter.
Varenummer: 418642 Styrke: 100mg/0,67 ml
Pakning: 7 x 0,67 ml (ferdigfylt sptøyte)
Pris (AUP): 2685,20 Refusjon: H-resept, R.gr.: C
Rabattert pris- Kineret er med på LIS-anbud 2306b TNFBIO
Swedish Orphan Biovitrum AS Dronning Eufemias gate 16, 0191 Oslo Tlf.: 66 82 34 00 mail.no@sobi.com www.sobi.com/norway
Utvalgte bivirkninger1
Svært vanlige: Reaksjon på injeksjonsstedet
Hodepine
Vanlige: Nøytropeni
Trombocytopeni
Alvorlige infeksjoner
For fullstendig oversikt over bivirkninger og forsiktighetsregler: se godkjent SPC på www.felleskatalogen.no
For mer informasjon om Kineret: scan QR-koden / www.kineret.no


Denne våren har jeg vært involvert i et prosjekt i regi av Helsedirektoratet, etter en erkjennelse av at vi er kommet i en kritisk situasjon når det gjelder generalistkompetansen på norske sykehus. Dette gjelder både innen indremedisin og kirurgi.
Paal Naalsund, leder NFG
Den nye spesialistforskriften, og spesialiseringsmodellen, har i stor grad dreid spesialiseringen på sykehus i en betydelig «smalere» og spisset retning. Grenspesialitetene innen generell indremedisin og kirurgi har blitt til hovedspesialiteter. Det har blitt etablert en egen spesialitet i indremedisin, og generell kirurgi, men et fåtall har tatt denne utdannelsen siden den nye spesialistforskriften trådte i kraft.
Dette har flere årsaker. Den «nye» spesialiteten generell indremedisin har blitt en svært krevende spesialitet, hvor man nærmest skal mestre alle de øvrige indremedisinske spesialitetene. På de større sykehusene, som har dekket sine nye hovedspesialiteter, blir en slik spesialitet lite hensiktsmessig. På mellomstore og mindre sykehus, hvor man må mestre flere områder innen medisinen, er dette mer relevant, men dimensjoneringen av spesialiteten blir allikevel for krevende. I tillegg er det relativt få rene indremedisinske avdelinger, og nyopprettede stillinger for spesialister i indremedisin. Dette motiverer ikke våre unge leger til å spesialisere seg innen faget!
Som geriater, og leder for NFG, ble jeg spurt om å være med i programkomiteen, som skulle komme med innspill for et planlagt rådslag om generalistkompetanse. Den fulle tittelen på rådslaget var: «Rådslag om generalistkompetanse, spesialitets-struktur og innhold i spesialistutdanningen i indremedisinske og kirurgiske fag». Representanter fra indremedisin, og akutt- og mot-
taksmedisin, var i tillegg representert fra de fagmedisinske foreningene. Generell kirurgi var også godt representert. I programkomiteen for øvrig deltok en større gruppe fra Helsedirektoratet, samt fra foretakene og RegUt.
Selve Rådslaget ble holdt på Gardermoen 25. og 26. april, med ca 60 deltagere, hvor også deltagerne i programkomiteen i hovedsak deltok. Det var primært lagt opp til gruppearbeid begge dagene, etter noen korte innlegg på formiddagene.
Til slutt var det en relativt kort oppsummering og plenumssamling på slutten av begge dagene. Det hele ble ledet av en energisk Marie Thoresen fra HDir.
Gruppeinndelingen var 4 indremedisinske grupper, og 4 kirurgiske grupper. Det ble gjennomført en problembeskrivelse og årsaksanalyse, som hadde mange elementer. Spesialistutdanningen og læringsmålene i den indremedisinske spesialiteten, samt rekrutteringen til faget ble drøftet. Hva må vi gjøre fremover i fremtiden, og aktuelle tiltak.
Det ble brukt mye tid på å diskutere. og etter hvert enes, om en definisjon for generalistkompetanse innen hhv kirurgi og medisin. Definisjonen for indremedisin ble: Spesialisert breddekompetanse i indremedisin er å ha kunnskaper og ferdigheter på legespesialistnivå i spesialisthelsetjenesten. Dette omhandler spisskompetanse i helhetlig ivaretakelse av
pasienter, utredning, diagnostisering, håndtering, behandling og forebygging av akutte og kroniske sykdommer, tilstander og symp tomer hos pasienter på tvers av det indremedisinske fagfeltet og gjennom hele pasientforløp. Begrepet inkluderer kompetanse i vurdering av pasientens funksjons nivå, både fysisk, psykisk og kognitivt, også før aktuell sykdom. Spesialisert breddekompetanse inkluderer også spisskompetanse innen prioritering og behandlingsbegrensning, samt spisskompetanse på samhandling internt i spesialisthelsetjenesten og eksternt med samarbeidspartnere i kommunale helse- og omsorgs tjenester. Spesialisten på området er spesielt kompetent på helhetlig pasienttilnærming, klinisk resonnering og komplekse/ sammensatte kliniske problemstillinger.
Jeg var med i en gruppe med flere fra den fagmedisinske foreningen i indremedisin og fra foreningens spesialitetskomite. Jeg formidlet der at det savnes at man i større grad har en oversikt over hvor mange i foreningen som jobber i indremedisinske stillinger, og hvor mange definerte indremedisinske avdelinger og senger det er i Norge. En slik oversikt har vi skaffet oss i geriatrien, og det har vært svært nyttig! Norsk Indremedisinsk forening har en stor medlemsmasse, men av disse jobber mange i andre fag. En del av oss valgte å fortsette i foreningen, også etter at indremedisin ble en egen spesialitet.
Hvordan skal vi klare å gjenopprette en robust generalistkompetanse på våre sykehus?
Svært mange pasienter har mer enn en sykdom, mange har kroniske sykdomstilstander, og mange har sykdommer og tilstander som krever behandling innen flere fag. Dette gjelder ikke minst en voksende eldre generasjon, men også yngre pasienter kan ha sammensatte og kompliserte sykdomsbilder. Da trengs det noen med en kompetanse som kan se helheten, og de ulike sykdommer og tilstander i sammenheng. Slik det er i dag, så blir ofte behandlingen fragmentert, hvor pasienten blir behandlet av flere spesialiteter, som i liten grad samarbeider med hverandre.
Vi må tenke bredt og kreativt, flere fag må bidra:
• Det indremedisinske faget må formidle til andre fag viktigheten av breddekompetanse, basert på
kunnskap innen alle medisinske disipliner, og en kompetanse som går på tvers av spesialitetene. Man må videre se nærmere på spesialistutdanningen, slik at den er bedre tilpasset den viktige rollen indremedisineren bør ha på både større og mindre sykehus
• Den nye spesialiteten akutt- og mottaksmedisin har en naturlig plass med tanke på generalistkompetanse i den akutte og primære vurderingen av både den eldre og den yngre pasienten. De har også en sentral rolle i forhold til generell kirurgi. I tillegg til akutt diagnostikk og behandling, har de en viktig rolle i å definere hvilken avdeling og spesialitet som kan gi mest hensiktsmessig videre behandling. Ikke sjelden er det da behov for generalist-kompetanse. Et tett samarbeid med indremedisinen og geriatrien, vil bidra til å legge til rette for dette.
• Geriatrien er spesialisert generalistkompetanse for den eldre pasienten. Mange eldre som innlegges på sykehus med akutt sykdom og funksjonssvikt, har ofte et bakteppe av flere kroniske sykdommer, og allerede redusert funksjon. Vi ønsker å samarbeide ytterligere aktivt med de ovennevnte spesialiteter, hvor vi sammen best kan se helheten og sykdomsbildet i sammenheng. Vi er en «lavthengende frukt», da vi allerede er etablert med egne enheter på de fleste sykehus. For at vi skal bidra ytterligere i forhold til utfordringene vi har i forhold til generalistkompetanse, må vi styrkes med flere senger og stillinger!
Med en bred hilsen fra Paal Naalsund-leder NFG.
(Dette er skrevet med den geriatriske hatten på, og med et indremedisinsk hjerte!)
The Early Registration with the discounted fee is open until 15 July 2024.
After that Regular Registration is available from 16 July 2024.


Tenk på det!
ATTR-CM er en dødelig sykdom som det er lett å overse.
Den er også lett å diagnostisere – bare du tenker på det!
Referanser:
LV veggtykkelse ≥ 12 mm
Tenk på transtyretin amyloid kardiomyopati (ATTR-CM) når du ser: 1,2
Venstre ventrikkel (LV) veggtykkelse ≥ 12 mm
Hjertesvikt
Pasient ≥ 65* år
Les mer på www.kardialamyloidose.no

Se Rune Mo sitt foredrag “Hvem skal utredes for ATTR hjerteamyloidose og hvordan?” www.pfi.sr/utred
* Menn ≥65 år eller kvinner ≥ 70 år. 3
1. Dorbala S, Ando Y, Bokhari S, et al. J Nucl Cardiol. 2019;26(6):2065-2123.
Addendum: J Nucl Cardiol. Published online July 1, 2021.
2. Garcia-Pavia P, Rapezzi C, Adler Y, et al. Eur Heart J. 2021;42(16):1554-1568.
3. Witteles RM, Bokhari S, Damy T, et al. JACC Heart Fail. 2019;7(8):709-716.