
GENIE
Dit leermiddel is onderdeel van de lesmethode GENIE Chemie van Uitgeverij VAN IN. Het is ontwikkeld met de intentie dat iedere leerling zich herkent en thuis voelt in beeld en tekst. Heb je op- of aanmerkingen, dan kun je contact opnemen met Uitgeverij VAN IN.
Fotokopieerapparaten zijn algemeen verspreid en vele mensen maken er haast onnadenkend gebruik van voor allerlei doeleinden. Jammer genoeg ontstaan boeken niet met hetzelfde gemak als kopieën. Boeken samenstellen kost veel inzet, tijd en geld. De vergoeding van de auteurs en van iedereen die bij het maken en verhandelen van boeken betrokken is, komt voort uit de verkoop van die boeken.
In België beschermt de auteurswet de rechten van deze mensen. Wanneer u van boeken of van gedeelten eruit zonder toestemming kopieën maakt, buiten de uitdrukkelijk bij wet bepaalde uitzonderingen, ontneemt u hun dus een stuk van die vergoeding. Daarom vragen auteurs en uitgevers u beschermde teksten niet zonder schriftelijke toestemming te kopiëren buiten de uitdrukkelijk bij wet bepaalde uitzonderingen. Verdere informatie over kopieerrechten en de wetgeving met betrekking tot reproductie vindt u op www.reprobel.be.
Ook voor het digitale lesmateriaal gelden deze voorwaarden. De licentie die toegang verleent tot dat materiaal is persoonlijk. Bij vermoeden van misbruik kan die gedeactiveerd worden. Meer informatie over de gebruiksvoorwaarden leest u op www.ididdit.be.
© Uitgeverij VAN IN, Wommelgem, 2025. Alle rechten voorbehouden. Tekst- en datamining (TDM) niet toegestaan.
De uitgever heeft ernaar gestreefd de relevante auteursrechten te regelen volgens de wettelijke bepalingen. Wie desondanks meent zekere rechten te kunnen doen gelden, wordt verzocht zich tot de uitgever te wenden.
Credits p. 31 Fast and Furious © Shutterstock/Steve Lagreca, p. 32 Archeologen © Getty Images/DPA/AFP/Andreas Arnold, p. 40 Ontstopper © Shutterstock/RVillalon, p. 87 Mijngas © Shutterstock/Sunshine Seeds, p. 89 Benzinepomp © Shutterstock/DarSzach, p. 99 Jupiler © Shutterstock/defotoberg, p. 104 Festival © Shutterstock/Christian Bertrand
©VANIN
Eerste druk 2025
ISBN 978-94-647-0797-7
Vormgeving en ontwerp cover: Shtick
Tekeningen: Geert Verlinde, Tim Boers (Studio B) D/2025/0078/126
Zetwerk: Barbara Vermeersch Art. 608543/01 NUR 126
INHOUD
THEMA 01:
ANORGANISCHE STOFKLASSEN
` HOOFDSTUK 1:
Verdere indeling van de materie 10
1 Organische en anorganische stoffen 10
2 Het oxidatiegetal 13
2.1 Het oxidatiegetal en de neutraliteitsregel 13
2.2 Het oxidatiegetal gebruiken om een formule te vormen 15
2.3 Het oxidatiegetal uit een formule berekenen 16
3 Indeling en naamgeving van de anorganische stoffen 17
3.1 Anorganische stoffen indelen op basis van analoge chemische eigenschappen 17
3.2 Van formule naar stofklasse 18
3.3 Van naam naar stofklasse 19
` HOOFDSTUK 2:
De oxiden 25
1 Wat is een oxide? 25
2 De metaaloxiden 26
2.1 Metalen met slechts 1 mogelijk oxidatiegetal 26
2.2 Metalen met meerdere mogelijke oxidatiegetallen 27
3 De niet-metaaloxiden 29
4 Gebruik en toepassingen van oxiden 30
5 Reactiepatronen 33
5.1 Vorming metaaloxiden 33
5.2 Vorming niet-metaaloxiden 34
` HOOFDSTUK 3:
1 Wat is een hydroxide? 37
2 Formule- en naamvorming 38
2.1 Metalen met slechts 1 mogelijk oxidatiegetal 38
` HOOFDSTUK 4:
1 Wat is een zuur?
Binaire zuren
Ternaire zuren
4 Gebruik en toepassingen van zuren
5 Reactiepatronen
` HOOFDSTUK 5:
Zuurtegraad van een oplossing
1 pH en de zuurtegraad van een oplossing
2 pH bepalen
pH-indicatoren
` HOOFDSTUK 6: De zouten
1 Wat is een zout?
2 Formule- en naamvorming
2.1 Algemene formule
2.2 Metalen met slechts 1 mogelijk oxidatiegetal 58
2.3 Metalen met meerdere mogelijke oxidatiegetallen 60
3 Gebruik en toepassingen van zouten 61
4 Reactiepatroon 63
©VANIN
2.2 Metalen met meerdere mogelijk oxidatiegetallen 39
3 Gebruik en toepassingen van hydroxiden 40
4 Reactiepatroon 41
THEMA 02:
ORGANISCHE STOFKLASSEN
` HOOFDSTUK 1:
Organische chemie of koolstofchemie 70
1 Bindingsmogelijkheden van het koolstofatoom 70
2 Notatiemogelijkheden van een organische stof 73
2.1 De brutoformule 73
2.2 De uitgebreide en beknopte structuurformule 73
3 De stofklassen 76
` HOOFDSTUK 2: Alkanen 81
1 Formule en systematische naam 81
2 Fysische eigenschappen, voorkomen en toepassingen uit het dagelijks leven 85
2.1 Fysische eigenschappen 85
2.2 Voorkomen en toepassingen uit het dagelijks leven 86
THEMA 03: CHEMISCH REKENEN
` HOOFDSTUK 1:
Atoommassa, molecuulmassa, formulemassa 94
1 Atoommassa 94
2 Molecuulmassa 96
3 Formulemassa 97
` HOOFDSTUK 2:
De mol en het getal van Avogadro 99
1 De mol als eenheid en de molaire massa 99
2 Omrekeningen gram / mol / aantal deeltjes 105
` HOOFDSTUK 3:
Concentratie van een oplossing 111
1 Wat is een concentratie van een oplossing? 111
2 Massaconcentratie 113
3 Molaire concentratie of stofhoeveelheidsconcentratie 114 Oplossingen verdunnen en indampen
` HOOFDSTUK 4:
Chemisch rekenen met gassen 118
1 Het molaire gasvolume (onder normomstandigheden) 118
THEMA 04: POLARITEIT EN OPLOSBAARHEID
` HOOFDSTUK 1:
Polaire en apolaire bindingen en moleculen 126
1 Het dipoolkarakter van water 126
2 De elektronegativiteit (verdieping) 128
3 Polariteit van de binding (verdieping) 130
4 Polariteit van moleculen (verdieping) 132
` HOOFDSTUK 2:
Eigenschappen van polaire en apolaire moleculen 137
1 Kook- en smelttemperatuur 137
2 Oplosbaarheid 138
3 Geleidbaarheid van een waterige oplossing 143
4 Verband tussen zuurtegraad en concentratie protonen 146
THEMA 05: REACTIESOORTEN
` HOOFDSTUK 1:
Soorten chemische reacties 158
1 Ionuitwisselingsreactie versus redoxreactie 158
2 Classificatie ionuitwisselingsreacties aan de hand van waarnemingen 160
` HOOFDSTUK 2:
Ionuitwisselingsreacties van dichtbij bekeken 165
1 Algemene notatie 165
1.1 Visuele weergave 165
1.2 Weergave met behulp van reactievergelijkingen 167
2 Neerslagreacties 168
2.1 Oplosbaarheid in water: gebruik van de oplosbaarheidstabel 168
2.2 Neerslagreacties opstellen 171
3 Neutralisatiereacties 173
Gasontwikkelingsreacties (verdieping)
Redoxreacties van dichtbij bekeken (verdieping)
Als er binnen een bepaalde paragraaf verdieping is, dan duiden we dat aan met een oranje lijn.
WERKEN MET GENIE
GENIE is een hybride leermiddel. Het bestaat uit een leerschrift én een digitaal aanbod op iDiddit.
Dit overzicht geeft je inzicht in welke onderdelen je waar kunt terugvinden.
GENIE Chemie bestaat uit 5 thema’s. Elk thema is op dezelfde manier opgebouwd.
1 CHECK IN
2 HOOFDSTUKKEN + VERKEN
3 AAN DE SLAG
4 SYNTHESE
5 CHECK IT OUT
De CHECK IN, VERKEN en CHECK IT OUT vind je uitsluitend online.

Op iDiddit vind je alle informatie die ook in je boek terug te vinden is: alle teksten, illustraties en opdrachten. Je kunt dus kiezen hoe je met GENIE aan de slag gaat.
Op iDiddit vind je ook:
• begrippenlijsten;
• instructiefilmpjes;
• vademecum;
• adaptieve oefenreeksen;
• STEM-projecten;
• kennisclips;
• labo’s.
TIP: op iDiddit kun je ook je eigen



De CHECK IN laat je kennismaken met het onderwerp en eindigt met een probleem of een vraag die je enkel op iDiddit vindt.
Kennis vatten we samen in de rode kenniskaders. Handig zijn de verwijzingen naar de AAN DE SLAG-oefeningen waarmee je zelf kunt nagaan of je de leerinhouden begrepen hebt.
Via de AAN DE SLAG kun je individueel de leerstof van het hoofdstuk inoefenen. Je leerkracht beslist of je de oefeningen pas op het einde van het thema maakt of tijdens de lessen.
Je vindt het misschien raar dat de groep van organische verbindingen veel uitgebreider is dan die van de anorganische verbindingen. Voor de organische verbindingen kun je maar gebruikmaken van een zeer beperkt aantal elementen, terwijl je voor de anorganische verbindingen gebruik kunt maken van ongeveer alle elementen uit het PSE. Je kunt dit gemakkelijk inzien door gebruik te maken van legoblokjes. Om de organische verbindingen te vormen, kun je kiezen uit ongeveer 10 kleuren. Om de anorganische verbindingen te maken, mag je gebruikmaken van 92 verschillende kleuren legoblokjes. Hoe komt het dan dat je veel meer verschillende bouwwerken kunt maken met slechts zo’n beperkt aantal kleuren van blokjes? Je kunt misschien maar kiezen uit 10 kleuren, maar je kunt wel heel veel blokjes in eenzelfde bouwwerk steken. Voor de anorganische verbindingen, mag een bouwwerk (formule-eenheid of molecule) slechts uit een zeer beperkt aantal blokjes bestaan. Daarom is de groep van de anorganische verbindingen minder uitgebreid.
De indeling in organische en anorganische stoffen is niet altijd even gemakkelijk. Zo zul je bijvoorbeeld CO waarschijnlijk bij de organische verbindingen indelen. Het is immers afkomstig van de levende natuur – we ademen het uit – en de formule bevat ook het element koolstof.
Toch zul je ontdekken dat de stof tot de anorganische stoffen behoort. Naast CO zijn er nog moleculen die, ook al bevatten ze het element koolstof, toch niet tot de organische verbindingen behoren. We gaan later verder in op die uitzonderingen.
Het is niet omdat organische stoffen afkomstig zijn van levende organismen, dat er in een levend organisme geen
In de thema’s: - vind je verschillende manieren om een SYNTHESE te maken: mindmap, schema, Cornell … - vind je een checklist die je laat reflecteren over de leerstof. Je gaat na welke leerdoelen je al dan niet onder de knie hebt. - denk je bewust na over je leerproces, interesses en vaardigheden.
©VANIN
Anorganische stoffen (minerale verbindingen) Organische stoffen (koolstofverbindingen) afkomstig van de levenloze natuur afkomstig van de levende of afgestorven natuur uitgebreide keuze uit atoomsoorten: 92 elementen van het PSE beperkte keuze uit atoomsoorten: steeds C, vaak H, maar vaak ook N, O, S of X (halogenen) beperkt aantal atomen per verbinding aantal atomen per molecule kan gaan van heel weinig (5) tot enorm veel (>100 000) totale verzameling verbindingen is beperkt totale verzameling verbindingen is zeer uitgebreid atoombindingen, ionbindingen, metaalbindingenvoornamelijk atoombindingen ` Maak oefening 1 t/m 4 op p. 22-23.
VOLGEND HOOFDSTUK
VERKEN
Wetenschap maakt deel uit van jouw leefwereld, al weet je het soms niet. In de verkenfase zul je merken dat je best al wat kennis hebt uit het dagelijks leven over het onderwerp dat in een hoofdstuk aan bod komt. We activeren je voorkennis bij de start van elk hoofdstuk op iDiddit.
→ A B (controleren of je x en y niet kan vereenvoudigen = delen door eenzelfde getal)
Metaal heeft 1 mogelijk oxidatiegetal: systematische naam: Grieks telwoord + metaal + Grieks telwoord + uitgang verkorte systematische naam (KISS-principe): metaal + uitgang
Metaal heeft meerdere mogelijke oxidatiegetallen: systematische naam: Grieks telwoord + metaal + Grieks telwoord + uitgang
Atoomverbindingen: systematische naam: Grieks telwoord + niet-metaal + Grieks telwoord + oxide
Schema 1: indeling van anorganische stoffen op basis van een gegeven formule, zie p. 18 Schema 2: indeling van anorganische stoffen op basis van een naam, zie p. 20 Hoofdstuk 2: De oxiden oxiden MO (metaaloxide) of nMO (niet-metaaloxide) functionele groep:
In elke CHECK IT OUT pas je de vergaarde kennis en vaardigheden toe om terug te koppelen naar de vraag uit de CHECK IN.
LABO
Ga zelf op onderzoek! Op iDiddit staan een aantal labo’s om experimenten uit te voeren.
Mijn lesmateriaal
Het onlineleerplatform bij GENIE Chemie 4
Hier vind je alle inhouden uit het leerschrift, maar ook meer, zoals filmpjes, demovideo’s, extra oefeningen ...
Extra materiaal
Bij bepaalde stukken theorie of oefeningen kun je extra materiaal openen. Dat kan een bijkomend videofragment zijn, een extra bron of een leestekst. Kortom, dit is materiaal dat je helpt om de leerstof onder de knie te krijgen.
Adaptieve oefeningen
Met adaptieve oefeningen kun je de leerstof inoefenen op jouw niveau. Hier kun je vrij oefenen.
Opdrachten
Hier vind je de opdrachten die de leerkracht voor jou heeft klaargezet.
Evalueren
Hier kan de leerkracht toetsen voor jou klaarzetten.
Resultaten
Wil je weten hoever je al staat met oefenen, opdrachten en toetsen? Hier vind je een helder overzicht van al je resultaten.
Notities
Heb je aantekeningen gemaakt bij een bepaalde inhoud?
Via je notities kun je ze makkelijk terug oproepen.
Meer weten?
Ga naar www.ididdit.be
Ga zelf op onderzoek! Doorheen de thema’s vind je de verwijzing naar de labo’s op iDiddit.
Dit icoon geeft aan dat er aanvullend lesmateriaal of een extra opdracht op iDiddit staat.
Soms is het handig dat je extra lesinformatie of een videofragment zelf kunt bekijken of beluisteren op je smartphone. Als je dit icoon ziet, open dan de VAN IN Plus-app en scan de pagina.
ANORGANISCHE STOFKLASSEN 01 THEMA
In de straten van Londen werd door het ESEF (European Science and Environment Forum) een enquête uitgevoerd. Aan toevallige voorbijgangers werd de volgende stelling voorgelegd:
‘De industrie maakt vaak gebruik van diwaterstofmonoxide. Die chemische stof is het hoofdbestanddeel van zure regen, draagt bij tot erosie en verlaagt het remvermogen van een auto. De stof beïnvloedt ook de gezondheid van de mens: in gastoestand kan ze ernstige brandwonden veroorzaken, in de longen kan ze leiden tot de dood en ze wordt ook teruggevonden in kankercellen. Vind jij dat dat product aan een strikte reglementering zou moeten worden onderworpen of misschien zelfs verboden zou moeten worden door de Europese Unie?’
Wat denk je dat de meeste mensen hebben geantwoord? Ontdek het via het extra materiaal op .

` Zit er een logica in de naamgeving van stoffen?
` Kan een chemicus over de taalgrenzen heen duidelijk maken over welke stof die het heeft?
We zoeken het uit! ?
Verdere indeling van de materie
LEERDOELEN
Je kunt al:
L zuivere stoffen en mengsels van elkaar onderscheiden;
L zuivere stoffen verder indelen in enkelvoudige en samengestelde stoffen;
L ionvorming van metalen en niet-metalen noteren.
Je leert nu:
L de samengestelde stoffen verder indelen in anorganische en organische samengestelde stoffen;
L het begrip ‘oxidatiegetal’ toelichten en het oxidatiegetal bepalen;
L formules opstellen aan de hand van het oxidatiegetal;
L de anorganische stoffen indelen in hun stofklasse.
Vorig schooljaar lag de focus op de enkelvoudige stoffen. We zijn gestart met het onderzoeken van de materie. We hebben de materie ingedeeld in mengsels en zuivere stoffen. De zuivere stoffen konden nog verder ingedeeld worden in samengestelde stoffen en enkelvoudige stoffen.
Dit jaar gaan we dieper in op de samengestelde stoffen.
1 Organische en anorganische stoffen
Alle stoffen die afkomstig zijn van de levende natuur worden ingedeeld bij de organische stoffen. Vetten, eiwitten, suiker … behoren allemaal tot de organische stoffen. Maar ook alle aardolieproducten behoren tot de organische stoffen. Ze ontstaan uit afgestorven organismen die onder hoge druk en een hoge temperatuur in fossiele brandstoffen omgezet worden, zoals steenkool, aardolie of aardgas.
Voorbeelden van organische stoffen zijn eiwitten in vlees en aardgas.


Afb. 1 Eiwitten in vlees zijn organische stoffen
Afb. 2 Aardgas is een organische stof
Een andere, betere naam voor organische stoffen is koolstofverbindingen, want dat hebben al die stoffen gemeenschappelijk: ze bevatten allemaal het element koolstof. Maar de indeling ‘organische en anorganische stoffen’ is zodanig ingeburgerd dat die nog steeds wordt gebruikt.
Een andere naam voor anorganische stoffen is minerale verbindingen. Die stoffen zijn afkomstig van de levenloze natuur. Denk maar aan bijvoorbeeld mineralen en gesteenten.
WEETJE
Vroeger ging men ervan uit dat organische stoffen niet in een laboratorium konden worden gemaakt. In 1828 werd dat idee ontkracht: toen werd ureum, een stof aanwezig in urine, gemaakt vertrekkende van alleen maar anorganische stoffen. En er zijn zelfs een heleboel stoffen die, omwille van hun chemische structuur, tot de organische stoffen behoren, maar zelfs niet door levende organismen worden gemaakt. Dat zijn de kunststoffen.
De onderstaande tabel geeft de eigenschappen van de anorganische en de organische stoffen weer:
Anorganische stoffen (minerale verbindingen)
Organische stoffen (koolstofverbindingen) afkomstig van de levenloze natuur afkomstig van de levende of afgestorven natuur uitgebreide keuze uit atoomsoorten: 92 elementen van het PSE
beperkte keuze uit atoomsoorten: steeds C, vaak H, maar vaak ook N, O, S of X (halogenen) beperkt aantal atomen per verbinding aantal atomen per molecule kan gaan van heel weinig (5) tot enorm veel (>100 000) totale verzameling verbindingen is beperkt totale verzameling verbindingen is zeer uitgebreid atoombindingen, ionbindingen, metaalbindingenvoornamelijk atoombindingen
Tabel 1 Eigenschappen van anorganische en organische stoffen
OPDRACHT 1
Duid alle anorganische stoffen aan.




De formule-eenheid
geeft de samenstelling weer van de kleinste eenheid waaruit het ionrooster is opgebouwd.
ORGANISCH
ANORGANISCH
DNAsuikerkeukenzoutzilver
methaanethanoldiamantkoolstofdioxide
Afb. 3 Organische en anorganische stoffen
WEETJE
anorganische samenstelling 6 % organische samenstelling 24 % water 70 %
Afb. 4 Ons lichaam bestaat voor 70 % uit water.
Je vindt het misschien raar dat de groep van organische verbindingen veel uitgebreider is dan die van de anorganische verbindingen. Voor de organische verbindingen kun je maar gebruikmaken van een zeer beperkt aantal elementen, terwijl je voor de anorganische verbindingen gebruik kunt maken van ongeveer alle elementen uit het PSE. Je kunt dit gemakkelijk inzien door gebruik te maken van legoblokjes. Om de organische verbindingen te vormen, kun je kiezen uit ongeveer 10 kleuren. Om de anorganische verbindingen te maken, mag je gebruikmaken van 92 verschillende kleuren legoblokjes.
Hoe komt het dan dat je veel meer verschillende bouwwerken kunt maken met slechts zo’n beperkt aantal kleuren van blokjes? Je kunt misschien maar kiezen uit 10 kleuren, maar je kunt wel heel veel blokjes in eenzelfde bouwwerk steken. Voor de anorganische verbindingen, mag een bouwwerk (formule-eenheid of molecule) slechts uit een zeer beperkt aantal blokjes bestaan. Daarom is de groep van de anorganische verbindingen minder uitgebreid.
De indeling in organische en anorganische stoffen is niet altijd even gemakkelijk. Zo zul je bijvoorbeeld CO2 waarschijnlijk bij de organische verbindingen indelen. Het is immers afkomstig van de levende natuur – we ademen het uit – en de formule bevat ook het element koolstof. Toch zul je ontdekken dat de stof tot de anorganische stoffen behoort. Naast CO2 zijn er nog moleculen die, ook al bevatten ze het element koolstof, toch niet tot de organische verbindingen behoren. We gaan later verder in op die uitzonderingen.
©VANIN
Het is niet omdat organische stoffen afkomstig zijn van levende organismen, dat er in een levend organisme geen anorganische stoffen aanwezig zijn. Zoals je kunt zien op afbeelding 4, bestaat het menselijk lichaam zelfs voor het grootste deel uit anorganische stoffen: water is namelijk een anorganische stof.
Anorganische stoffen (minerale verbindingen)
Organische stoffen (koolstofverbindingen)
afkomstig van de levenloze natuur afkomstig van de levende of afgestorven natuur uitgebreide keuze uit atoomsoorten: 92 elementen van het PSE
beperkte keuze uit atoomsoorten: steeds C, vaak H, maar vaak ook N, O, S of X (halogenen) beperkt aantal atomen per verbinding aantal atomen per molecule kan gaan van heel weinig (5) tot enorm veel (>100 000) totale verzameling verbindingen is beperkt totale verzameling verbindingen is zeer uitgebreid atoombindingen, ionbindingen, metaalbindingenvoornamelijk atoombindingen
` Maak oefening 1 t/m 4 op p. 22-23.
2 Het oxidatiegetal
Op vind je meer info over chemische bindingen in het vademecum.
2.1 Het oxidatiegetal en de neutraliteitsregel
Om voor samengestelde stoffen gemakkelijk de formule van een atoombinding te vormen, is het gemakkelijk om met het begrip oxidatiegetal (OG) te werken: Het oxidatiegetal is het aantal elektronen dat een atoom zou opnemen of afstaan bij overgang naar de ionaire vorm.
Voor de ionbinding komt het oxidatiegetal overeen met de lading van het ion Voor de elementen in een atoombinding komt dat overeen met de lading die het element zou krijgen, wanneer we zouden doen alsof het een ionbinding zou zijn. Het niet-metaal met de hoogste elektronegatieve waarde (het sterkste niet-metaalkarakter), zal een negatief oxidatiegetal krijgen en het andere niet-metaal een positief oxidatiegetal. We gaan er in thema 05 nog dieper op in.
Het oxidatiegetal wordt genoteerd door een Romeins cijfer voorafgegaan door de juiste lading:
een + wanneer het element elektronen wil afstaan een – wanneer het element elektronen wil opnemen
Bij de atomen van een enkelvoudige stof is het OG van elk element = 0.
Bv. Fe: OG = 0
O2: OG = 0
Bij monoatomische ionen is het OG van het ion = de relatieve ionlading.
Bv. Na+: OG = +I
Ca2+: OG = +II
OPDRACHT 2
PERIODIEK SYSTEEM VAN DE ELEMENTEN
Vul de ontbrekende woorden in.
1 Een oxidatiegetal van +II betekent dat het element 2 wil bij de overgang naar de ionaire vorm.
Zo is het oxidatiegetal van beryllium in een samengestelde stof +II.
2 Een oxidatiegetal van -II betekent dat het element 2 wil bij overgang naar de ionaire vorm.
Zo is het oxidatiegetal van zuurstof in een samengestelde stof (meestal) -II.
Verschillende elementen hebben slechts één mogelijk oxidatiegetal verschillend van nul.
Alle elementen uit groep Ia hebben in een samengestelde stof een oxidatiegetal van +I. Al deze elementen hebben immers 1 elektron op de buitenste schil. Met andere woorden, ze willen dat elektron afstaan om de edelgasconfiguratie te bekomen. Analoog hebben alle elementen uit groep IIa in een samengestelde stof een oxidatiegetal van +II
In peroxiden heeft zuurstof een oxidatiegetal van -I: daar wordt in de derde graad verder op ingegaan.
Bij de niet-metalen heeft fluor in een samengestelde stof één mogelijk oxidatiegetal, namelijk -I. Fluor wil 1 elektron opnemen om de edelgasconfiguratie te bereiken. Zuurstof heeft meestal een oxidatiegetal van -II, want het wil 2 elektronen opnemen om de edelgasconfiguratie te bereiken. Edelgassen bezitten logischerwijze een oxidatiegetal van nul: ze willen geen elektronen opnemen of afgeven omdat ze de edelgasconfiguratie al bezitten.
Voor de elementen met meerdere mogelijke oxidatiegetallen mag je een tabel gebruiken (tabel 2). Je vindt die tabel ook op de achterkant van je PSE. De verklaring voor de oxidatiegetallen zie je pas in het 5de jaar.
Symbool element Mogelijke oxidatiegetallen
Symbool element Mogelijke oxidatiegetallen
©VANIN
2 Oxidatiegetallen
Voor de a-groepen IVa tot en met VIIa is het hoogst mogelijke oxidatiegetal gelijk aan het groepsnummer. Het laagst mogelijke oxidatiegetal is gelijk aan het groepsnummer -8.
OPDRACHT 3
Vul aan.
Chloor behoort tot de groep
Het hoogst mogelijke oxidatiegetal is gelijk aan + groepsnummer, dus .
Dat betekent dat chloor dan elektron(en) wil .
Op die manier bekomt chloor de edelgasconfiguratie van .
Het laagst mogelijke oxidatiegetal is gelijk aan het groepsnummer – 8, dus
Dat betekent dat chloor dan elektron(en) wil
Op die manier bekomt chloor de edelgasconfiguratie van .
Het is van essentieel belang dat je voor het werken met oxidatiegetallen ook de neutraliteitsregel toepast. Op die manier kun je vlot de formule van een atoombinding vormen. Volgens de neutraliteitsregel is de som van de lading van de positieve en negatieve ionen gelijk.
Tabel
OPDRACHT 4
2.2 Het oxidatiegetal gebruiken om een formule te vormen
Bij het zelf vormen van een formule moet je er altijd rekening mee houden dat de som van de oxidatiegetallen nul is. Het aantal elektronen dat wordt afgestaan, moet gelijk zijn aan het aantal elektronen dat wordt opgenomen Dat kun je doen door het kleinste gemene veelvoud te nemen van het aantal uitgewisselde elektronen. Een andere, zeer handige manier is door het toepassen van de kruisregel: het oxidatiegetal van het ene element noteer je (zonder ladingsteken) als index bij het andere element en omgekeerd. Nadien controleer je of je beide indexen nog kunt vereenvoudigen.
Vorm de formule met behulp van het oxidatiegetal.
1 Bekijk in het voorbeeld hoe je de formule tussen chloor (met OG = +III) en zuurstof vormt.
Cl: +III = 3 elektronen afstaan
O: -II = 2 elektronen opnemen
Het kleinste gemene veelvoud van 3 en 2 is 6.
Cl moet je 2 keer nemen
O moet je 3 keer nemen Cl2O3
Of via de kruisregel:
Cl O +III -II en Cl2 O3 +III -II
Dat kun je vereenvoudigen tot Cl2O3
2 Vorm de formule tussen chroom (met OG = +VI) en zwavel (met OG = -II).
Cr: OG = +VI =
S: OG = -II =
Het kleinste gemene veelvoud van en is:
Of via de kruisregel:
Dat kun je vereenvoudigen tot:
OPDRACHT 5
Bepaal het oxidatiegetal.
2.3 Het oxidatiegetal uit een formule berekenen
Wanneer je een chemische formule krijgt, dan kun je altijd het oxidatiegetal van een element met meerdere mogelijke oxidatiegetallen bepalen, uitgaande van de gekende oxidatiegetallen. De som van de oxidatiegetallen is namelijk nul of voor een ion gelijk aan de lading van het ion.
1 Bekijk eerst in het voorbeeld hoe je het oxidatiegetal van zwavel in SO3 bepaalt.
OG(S) + 3 ∙ OG(O) = 0
x + 3 ∙ (-II) = 0
x = +VI
2 Bepaal nu zelf het oxidatiegetal van stikstof in HNO2.
Het oxidatiegetal (OG) is het aantal elektronen dat een atoom opneemt of afstaat bij overgang naar de ionaire vorm. Volgende oxidatiegetallen moet je vanbuiten kennen:
Groep Ia: +I
Groep II a: +II
Groep IIIa: +III
Fluor (F): -I
Zuurstof (O): meestal -II
Edelgassen: oxidatiegetal is altijd 0.
Voor de elementen in groep IVa tot en met VIIa (zie ook tabel 2 op p. 14):
• hoogst mogelijke oxidatiegetal = +groepsnummer
• laagst mogelijke oxidatiegetal = groepsnummer -8
Neutraliteitsregel: de som van de lading van de positieve en negatieve ionen is gelijk.
` Maak oefening 5 en 6 op p. 23.
3 Indeling en naamgeving van de anorganische stoffen
3.1 Anorganische stoffen indelen op basis van analoge chemische eigenschappen
Je weet nu dat we stoffen kunnen indelen in anorganische stoffen (minerale verbindingen) en organische stoffen (koolstofverbindingen). In dit thema zul je ook leren hoe de moleculevorming en naamgeving gebeurt bij anorganische samengestelde stoffen. In thema 02 leer je alles over de organische stoffen.
©VANIN
OPDRACHT 6
ONDERZOEK
Onderzoek nu zelf hoe je anorganische stoffen kunt indelen op basis van analoge chemische eigenschappen.
Ga naar en voer het labo uit.
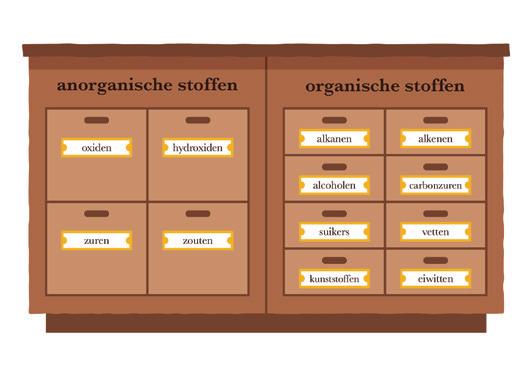
Verbindingen vertonen analoge chemische eigenschappen door de aanwezigheid van eenzelfde atoom of atoomgroep: de chemische functie of functionele groep. Dat laat toe de verbindingen te ordenen in chemische verbindingsklassen of stofklassen. De anorganische samengestelde stoffen worden onderverdeeld in 4 stofklassen: de oxiden, de hydroxiden, de zuren en de zouten. In de volgende tabel vind je de basisstructuur van elke stofklasse.
Stofklasse Oxiden HydroxidenZurenZouten functionele groep O OH H geen functionele groep algemene formule MO of nMO MOH HZ MZ uitgang naam-oxide-hydroxide-ide -aat -ide -aat
M = metaal, nM = niet-metaal, O = zuurstof, H = waterstof, Z = zuurrest (zie verder bij de zuren) = nM of nMO
Tabel 3 Overzicht opbouw anorganische stofklassen
Opmerkingen:
Stoffen waarvan de formule bestaat uit slechts 2 elementen noemen we binaire stoffen. Stoffen die bestaan uit 3 elementen noemen we ternaire verbindingen. Zouten die het ammoniumion NH4+ bevatten worden zeer specifiek ook ammoniumzouten genoemd.
3.2 Van formule naar stofklasse
Indien je een formule van een samengestelde stof krijgt, dan kun je op basis van de algemene formule de stof in de juiste stofklasse indelen. Het volgende schema kan je helpen om dat efficiënt aan te pakken:
Bestaat de formule uit 2 elementen en eindigt het op 'O'?
Het is een oxide
Begint de formule met een metaal of NH4+ en eindigt het op 'OH'?
Het is een hydroxide
Begint de formule met 'H'?
Het is een zuur
Eindigt de formule op 'O'?
Het is een zout
Eindigt de formule op 'O'?
Het is een binair zuur
Schema 1 Indeling van anorganische stoffen op basis van een gegeven formule
Het is een ternair zuur
Het is een binair zout
Het is een ternair zout
OPDRACHT 7
Gebruik schema 1 om de volgende formules in de juiste stofklasse in te delen.
Formule
Cl2O3
AlCl3
Mg(OH)2
Stofklasse Algemene formule
Groep 1
Ionverbindingen waarbij het metaal slechts één mogelijk oxidatiegetal heeft
Er zijn 2 manieren op de naam weer te geven:
Voor de systematische naam noteer je het Griekse telwoord voor de index die bij het eerste element staat, vervolgens de naam van het eerste element, dan het Griekse telwoord voor de index die bij het laatste deel van de formule staat, en tot slot de juiste uitgang.
We hanteren echter meestal het KISS-principe: keep it short and simple. Er is hier immers geen vergissing mogelijk, omdat het metaal altijd maar 1 mogelijk OG heeft. Als gevolg daarvan noteren we de telwoorden niet en houden we de naam zo beknopt mogelijk: de naam van het metaal + de juiste uitgang afhankelijk van de stofklasse. We spreken dan van de verkorte systematische naam
Na2O natriumoxide (of dinatriumoxide)
Al2O3 aluminiumoxide (of dialuminiumtrioxide)
Zowel natrium als aluminium hebben slechts 1 mogelijk oxidatiegetal in een samengestelde stof. Met behulp van de kennis van de oxidatiegetallen en de neutraliteitsregel, kun je gemakkelijk zelf de formule opstellen, daarom bevat de naam alleen de essentiële onderdelen.
Groep 2
Ionverbindingen waarbij het metaal meerdere mogelijke oxidatiegetallen heeft
Er zijn 2 manieren om de naam weer te geven:
Voor de systematische naam noteer je het Griekse telwoord voor de index die bij het eerste element staat, vervolgens de naam van het eerste element, dan het Griekse telwoord voor de index die bij het laatste deel van de formule staat en tot slot de juiste uitgang.
Voor de stocknotatie noteer je de naam van het metaal, achter dat metaal schrijf je tussen haakjes de waarde van het oxidatiegetal en je eindigt met de juiste uitgang.
Groep 3
De atoomverbinding tussen niet-metalen
©VANIN
FeO ijzer(mon)oxide (of ijzer(II)oxide)
Fe2O3 diijzertrioxide (of ijzer(III)oxide)
Van ijzer bestaan er 2 mogelijke oxiden. Om verwarring te vermijden, moet er extra informatie in de naam aanwezig zijn: met de naam 'ijzeroxide' kun je de formule FeO vormen, maar niet de formule Fe2O3
Voor de naam wordt ook hier de systematische naam gebruikt: je noteert het Griekse telwoord voor de index die bij het eerste element staat, vervolgens de naam van het eerste element, dan het Griekse telwoord voor de index die bij het laatste deel van de formule staat en tot slot de juiste uitgang.
CO koolstof(mon)oxide CO2 koolstofdioxide
Ook hier zijn er verschillende oxiden van koolstof mogelijk. Er is een zeer groot verschil tussen die 2 stoffen. Omdat het echt belangrijk is dat er geen twijfel bestaat, wordt het Griekse telwoord 'mono' vaak expliciet geschreven.
Griekse telwoorden: mono (wordt meestal niet geschreven) – di – tri – tetra – penta – hexa – hepta
WEETJE
Je hebt al het schema gezien waarmee je op basis van een gegeven formule de stof kunt indelen in de juiste stofklasse. Het volgende schema helpt je om op basis van een gegeven naam de stof in te delen in de juiste stofklasse:
Eindigt de naam op 'hydroxide'?
Het is een hydroxide
Eindigt de naam op 'oxide'?
Het is een oxide
Eindigt de naam op -ide of is het zoutzuur?
Het is een binair zuur
Eindigt de naam op 'zuur' of begint de naam met 'waterstof'?
is een zuur
Eindigt de naam NIET op -ide of is het GEEN zoutzuur?
Het is een ternair zuur
Schema 2 Indeling van anorganische stoffen op basis van een naam
Het is een zout
Het is een binair zout Eindigt de naam op -ide?
Het is een ternair zout Eindigt de naam NIET op -ide?
OPDRACHT 8
Gebruik schema 2 om de volgende stoffen in de juiste stofklasse in te delen.
a dichloorheptaoxide
b ammoniumhydroxide
c zwavelzuur
d koperoxide
e natriumoxide
f calciumnitraat
g natriumchloride
h waterstofsulfide
i waterstofnitraat
j koolstofdioxide
Het
De functionele groep is een atoomgroep die bepaalt dat verbindingen analoge chemische eigenschappen vertonen. Op basis van die functionele groep kunnen we anorganische samengestelde stoffen onderverdelen in 4 stofklassen:
ANORGANISCHE STOFKLASSEN
oxiden: MO of nMO
hydroxiden: MOH zuren: HZ zouten: MZ
Naamgeving van anorganische samengestelde stoffen:
Voor metalen met slechts 1 mogelijk oxidatiegetal ga je als volgt te werk om de naam te geven:
• systematische naam: je maakt gebruik van de Griekse voorvoegsels om de indexen weer te geven:
Grieks telwoord + naam van het metaal + Grieks telwoord + juiste uitgang (oxide, hydroxide ...)
afhankelijk van de stofklasse
• verkorte systematische naam: naam van het metaal + juiste uitgang
Bij metalen met meerdere mogelijke oxidatiegetallen is het belangrijk dat er in de naam extra informatie wordt gegeven:
systematische naam: je maakt gebruik van de Griekse voorvoegsels om de indexen weer te geven:
Grieks telwoord + naam van het metaal + Grieks telwoord + juiste uitgang
Voor atoombindingen maak je altijd gebruik van de Griekse voorvoegsels om de systematische naam te vormen:
Grieks telwoord + naam van het eerste niet-metaal + Grieks telwoord + juiste uitgang
` Maak oefening 7 t/m 10 op p. 23-24.
Horen de volgende uitspraken alleen bij anorganische stoffen (A), alleen bij organische stoffen (O) of bij zowel de anorganische als de organische stoffen (A + O)?
a kan het element Ca bevatten
b aardolie behoort tot deze groep stoffen
c maakt gebruik van zeer veel verschillende atoomsoorten
d de totale verzameling van moleculen is zeer uitgebreid
Zijn de volgende stoffen organisch of anorganisch?
Op afbeelding a zie je een skeletnotatie, waarbij elk hoekpunt een C-atoom (met bijbehorende H-atomen) voorstelt.



haar stenen olijfolie
Zijn de volgende stellingen over organische en anorganische stoffen juist of fout? Indien fout, verbeter alleen het onderlijnde deel.
a Maïsolie behoort tot de anorganische stoffen, want het is afkomstig van de dode natuur.
b De verzameling van de minerale verbindingen is zeer uitgebreid en bevat moleculen met een grote keuze uit atoomsoorten.
Behoren de volgende stoffen tot de organische of anorganische stoffen?
OrganischAnorganisch
kunststof
vliegtuigbrandstof
Bepaal het oxidatiegetal van het vetgedrukte element in de volgende moleculen/ionen:
a H3PO4
b NH4OH
c ClO3-
d Fe3+
Noteer de juiste formule-eenheid in de volgende tabel:
Cl: -I O: -II
S: -II
Al: +III
Na: +I
Ca: +II
Behoren volgende formules tot de oxiden (MO of nMO), hydroxiden (MOH), zuren (HZ) of zouten (MZ)?
a CO
b H2CO3
c KOH
d KCl
e HI
f Al(OH)3
g Na2O
h (NH4)3PO4
Noteer de juiste stofklasse achter de volgende formules/namen. Wees zo specifiek mogelijk: bij oxiden maak je een onderscheid tussen metaal- en niet-metaaloxiden, bij zuren en zouten maak je een onderscheid tussen binair en ternair.
a AlPO4
b Na2O
c H2CO3
d Cl2O
e Fe(OH)2
Verbind de formules met de juiste naam.
f salpeterigzuur
g calciumhydroxide
h zwavelzuur
i koper(I)hydroxide
j ijzer(II)oxide
KOH ⦁ ⦁ chloorzuur
K2O
HClO3
HCl
KCl
kaliumchloride
kaliumoxide (of dikaliumoxide)
waterstofchloride
kaliumhydroxide
Zijn de volgende stoffen metaaloxiden (MO), niet-metaaloxiden (nMO) of behoren ze tot een andere stofklasse (/)?
a aluminiumhydroxide
b dibroomtrioxide
c waterstofcarbonaat
` Meer oefenen? Ga naar .
LEERDOELEN
Je kunt al:
L anorganische stoffen indelen in de juiste stofklasse op basis van een gegeven naam of formule;
L een formule opstellen met behulp van oxidatiegetallen;
L de algemene formule van een oxide schrijven.
Je leert nu:
L de oxiden verder indelen in metaaloxiden en niet-metaaloxiden;
L de eigenschappen en toepassingen van oxiden;
L de formule van oxiden opstellen;
L de naam van oxiden opstellen;
L via welke chemische reactie je een oxide kunt vormen.
1 Wat is een oxide?
lithiumoxide zilveroxide looddioxide Li2O SO3
Je hebt misschien al weleens gehoord over oxideren en ook vorig jaar maakte je al kennis met het gevarenlogo voor oxiderende stoffen. Wanneer ijzer roest, ontstaat er een oxide. De gevormde stof is een zeer brosse verbinding: het heeft andere eigenschappen dan het oorspronkelijke metaal.
Wanneer een element een binding aangaat met zuurstof, ontstaat er een oxide. Concreet kun je dat doen door een stof te verbranden.
Oxiden zijn binaire verbindingen en zijn dus opgebouwd uit 2 atoomsoorten: een metaal of niet-metaal enerzijds en zuurstof anderzijds, waarbij zuurstof altijd als laatste wordt geschreven. We spreken respectievelijk dan ook over metaaloxiden en niet-metaaloxiden. Aangezien alle oxiden het element zuurstof gemeenschappelijk hebben, is zuurstof de functionele groep
De oxiden kunnen nog verder worden ingedeeld: metaaloxiden: MO niet-metaaloxiden nMO
De metaaloxiden zijn ionverbindingen aangezien ze opgebouwd zijn uit een metaal en een niet-metaal terwijl de niet-metaaloxiden atoomverbindingen zijn, want ze zijn opgebouwd uit 2 niet-metalen.
2 De metaaloxiden
TIP
Bij de kruisregel plaats je de lading van het eerste element als index bij het tweede element en omgekeerd en vereenvoudig je indien mogelijk de indexen.
2.1 Metalen met slechts 1 mogelijk oxidatiegetal
Die metalen kunnen slechts 1 oxide vormen. Van zodra je weet over welk metaal het gaat, kun je gemakkelijk zelf door middel van de neutraliteitsregel of kruisregel de formule vormen. Het is dus niet nodig om het aantal ionen van elke soort in de naam te vermelden (met behulp van Griekse telwoorden). Het mag uiteraard altijd!
De verkorte systematische naam bevat dan alleen de naam van het metaalion met als uitgang ‘oxide’.
VOORBEELD FORMULE EN NAAM VAN EEN METAAL MET 1 OXIDATIEGETAL
1 De naam en formule van het oxide van natrium (Na) natrium: +I want in groep Ia zuurstof: -II
Omwille van de neutraliteitsregel heb je 2 natriumionen nodig en 1 oxide-ion: Na2O
Of je gebruikt de kruisregel:
©VANIN
TIP
ʻDialuminiumtrioxideʼ zou hier ook correct zijn.
-II
Hierdoor bekom je: Na2O1 → Na2O
De waarde 1 mag je weglaten. Als je nog kunt vereenvoudigen, dan doe je dat ook. De formule-eenheid is dus Na2O en de naam natriumoxide. Dinatriumoxide is uiteraard ook correct, maar de Griekse telwoorden worden vaak weggelaten als er geen verwarring mogelijk is (= KISSprincipe).
2 De formule van aluminiumoxide Uit de naam halen we al dat de formule Al en O bevat. Aluminium heeft slechts 1 mogelijk oxidatiegetal, daarom moeten we de neutraliteitsregel of kruisregel toepassen om de formule te vormen. aluminium: +III want groep IIIa zuurstof: -II
Al O 2 3
+III -II
Hierdoor bekom je als formule-eenheid voor aluminiumoxide: Al2O3 Je ziet dus dat je moet opletten wanneer de naam gegeven is voor metalen met slechts 1 mogelijk oxidatiegetal. Uit de naam aluminiumoxide kun je namelijk niet gemakkelijk de formule Al2O3 afleiden.
OPDRACHT 9
Oefen de formule en naam van een metaal met 1 oxidatiegetal.
1 Vorm de naam en formule-eenheid via de kruisregel van het oxide van magnesium.
2 Wat is de juiste formule van lithiumoxide (of dilithiumoxide)?
2.2 Metalen met meerdere mogelijke oxidatiegetallen
Hier zijn er meerdere oxiden mogelijk. Het is dus belangrijk dat er in de naam extra informatie wordt gegeven om te weten over welk oxide het juist gaat:
Ofwel wordt de systematische naam gebruikt: hierbij wordt het aantal ionen van elke soort weergegeven met behulp van Griekse telwoorden.
Dus: Grieks telwoord + metaal + Grieks telwoord + oxide
Ofwel wordt er gebruikgemaakt van de stocknotatie waarbij het oxidatiegetal van het metaal tussen haakjes achter de naam van het metaal wordt genoteerd, zonder plus- of minteken.
Dus: metaal + (oxidatiegetal) + oxide
OPDRACHT 1 0
Oefen de formule en naam van metalen met meerdere mogelijke oxidatiegetallen.
1 Bepaal de formule van alle mogelijke oxiden van ijzer (Fe).
Kruisregel
Formule-eenheid
2 Wat is het oxidatiegetal van koper in dikoperoxide?
a Vorm eerst de formule-eenheid:
b Bereken het oxidatiegetal van koper in die stof:
3 Vorm de formule-eenheid via de kruisregel en geef de systematische naam van lood(II)oxide.
3 De niet-metaaloxiden
Niet-metaaloxiden zijn atoomverbindingen die in veel verschillende verhoudingen kunnen binden. Je zult dus altijd een systematische naam krijgen, met Griekse telwoorden die aangeven hoeveel keer je elk atoom moet nemen: Grieks telwoord + niet-metaal + Grieks telwoord + oxide
OPDRACHT 11
Noteer de naam en formule van alle oxiden van chloor (Cl).
Kruisregel
Formule
Systematische naam
Oxiden zijn binaire verbindingen: ze zijn opgebouwd uit een metaal of een niet-metaal en zuurstof.
Er bestaan 2 soorten oxiden:
• metaaloxiden: MO
• niet-metaaloxiden: nMO
De functionele groep is zuurstof.
Metaaloxiden:
→ metalen met slechts 1 mogelijk oxidatiegetal:
• formule: lading opzoeken in het PSE + kruisregel toepassen
• systematische naam: Grieks telwoord + metaal + Grieks telwoord + oxide
• verkorte systematische naam: metaal + oxide
→ metalen met meerdere mogelijke oxidatiegetallen:
• formule: meerdere mogelijkheden, er moet dus informatie over het oxidatiegetal gegeven worden
• systematische naam: Grieks telwoord + metaal + Grieks telwoord + oxide
Niet-metaaloxiden:
• formule: meerdere mogelijkheden, er moet dus informatie over het oxidatiegetal gegeven worden
• systematische naam: Grieks telwoord + niet-metaal + Grieks telwoord + oxide
` Maak oefening 1 t/m 6 op p. 35.
4 Gebruik en toepassingen van oxiden
ontdekplaat: anorganische stofklassen
Je staat er waarschijnlijk niet altijd bij stil, maar je wordt omringd door oxiden. Ontdek de belangrijkste toepassingen van oxiden via de ontdekplaat.
Eén van de meest gekende oxiden is ongetwijfeld koolstofdioxide of koolzuurgas CO2. Het is een zeer belangrijk broeikasgas, dat ontstaat bij de volledige verbranding van fossiele brandstoffen. Verder wordt het ook gebruikt in drank met prik. Je hebt thuis misschien een toestel om zelf spuitwater of limonade te maken. Dat is gevuld met koolstofdioxide onder hoge druk.
©VANIN


Maar dat gas zit ook in sommige brandblusapparaten. Aangezien koolstofdioxide een hogere dichtheid heeft dan lucht, stijgt het gas niet en zorgt het ervoor dat er geen zuurstofgas meer aan het vuur kan waardoor het vuur dooft.
Wanneer koolstofdioxide zodanig wordt afgekoeld dat het vast wordt, wordt het droogijs genoemd. Dat wordt vooral als koelmiddel gebruikt, maar ook als ‘showeffect’ bij optredens, bepaalde cocktails … Pas toch op met die stof. Zoals gezegd: koolstofdioxide heeft een hogere dichtheid dan lucht, dus bij heel grote hoeveelheden kun je sterven door zuurstofgebrek.
Wanneer fossiele brandstoffen verbrand worden in zuurstof-arme omstandigheden, bijvoorbeeld wanneer een schoorsteen onvoldoende lucht en dus ook zuurstofgas doorlaat, ontstaat het zeer giftige koolstofmonoxide CO. Aangezien dat een kleurloos en geurloos gas is, wordt het vaak de stille sluipdoder genoemd. Spijtig genoeg sterven er in België nog jaarlijks veel mensen aan een CO-vergiftiging.
Afb. 7 Koolstofdioxide ontstaat bij heel wat verbrandingsprocessen
Afb. 8 zoolstofdioxide als droogijs
Afb 9 Een schoorsteen moet geregeld worden gereinigd.
Een ander gasvormig oxide dat je misschien kent, is distikstofoxide N2O of lachgas. Die stof wordt onder andere gebruikt in slagroompatronen en om het vermogen van een motor op te drijven (denk maar aan de filmreeks ‘Fast and Furious’).



©VANIN
Vroeger werd lachgas als verdovingsmiddel gebruikt, maar de laatste jaren wordt het vooral misbruikt: het wordt nu als drug gebruikt en is zeer gevaarlijk. Daarom is de verkoop van lachgas sinds 5 maart 2021 verboden aan minderjarigen. Bekijk de ‘Rij ballonvrij’-campagne in Nederland over de gevaren van lachgas.
Wanneer je kijkt op de ingrediëntenlijst van voedingsstoffen, dan zie je vaak E-nummers staan. Zo verwijst E220 naar zwaveldioxide SO2. Het wordt vaak toegevoegd aan bijvoorbeeld rozijnen of gedroogde abrikozen.
Gedroogde abrikozen
Ingrediënten: Abrikozen, antioxidant: zwaveldioxide (E220)
Gemiddelde voedingswaarde
Afb. 10 Slagroomspuit Afb. 11 Nitrofles om het vermogen van wagens op te drijven
Afb. 12 Snelle auto’s in Fast and Furious
Afb. 13 Zwaveldioxide in gedroogde abrikozen


WEETJE
Een vast metaaloxide dat spijtig genoeg heel gemakkelijk wordt gevormd, is diijzertrioxide of roest Fe2O3. Van zodra er lucht en water aan een nietbeschermd ijzeren voorwerp kan, begint het ijzer te roesten. Het metaal verliest zijn eigenschappen zoals sterkte en plooibaarheid en de stof wordt zeer bros en verpulvert gemakkelijk.
©VANIN
Een ander vast oxide dat vaak wordt gebruikt, is calciumoxide of ongebluste kalk CaO. Vroeger werd het gebruikt om de lijnen op een voetbalveld te tekenen (nu is het verboden). Maar het werd ook toegepast om het ontbindingsproces van stoffelijke resten te versnellen.
In de stad Mainz in het westen van Duitsland hebben archeologen na jaren onderzoek het deksel gelicht van een 1 000 jaar oude sarcofaag. In de grafkist vonden ze de bijna volledig vergane resten van een persoon aan, mogelijk een geestelijke uit de 11de eeuw. De wetenschappers vermoeden dat de overledene allicht met ongebluste kalk werd bedekt om het ontbindingsproces te versnellen.
Bron: hln.be, 08/06/2019
Formule

Systematische naamTriviale naam Toepassing/eigenschap
CO2 koolstofdioxide koolzuurgas • brandblusapparaat • drank met prik
N2O distikstofoxide lachgas anesthesie
Fe2O3 diijzertrioxide roest roesten van ijzer
SO2 zwaveldioxide bewaarmiddel CO koolstofmonoxide ontstaat bij slechte verbranding en is zeer giftig
CaO calciumoxide ongebluste kalk
` Maak oefening 7 op p. 35.
Afb. 14 Roest is een vast metaaloxide
Afb. 15 Kalklijnen op een voetbalveld
5 Reactiepatronen
5.1 Vorming metaaloxiden
OPDRACHT 12
Je leerkracht onderzoekt welke stof er ontstaat bij de verbranding van een metaal.
Werkwijze
Je leerkracht neemt een stukje magnesiumlint vast met een tang en steekt het in brand. Vervolgens voegt je leerkracht er een beetje water met universeel-indicatoroplossing aan toe.
Waarnemingen
Besluit
Het reactiepatroon geeft algemeen weer wat voor soort stoffen of stofklassen reageren en welke stoffen of stofklassen worden gevormd. Het bevat geen concrete stoffen op zuurstofgas, water … na. De coëfficiënten moeten dus niet worden aangepast.
reactiepatroon: metaal + zuurstofgas → metaaloxide M + O2 → MO
De reactievergelijking bevat wel concrete stoffen. Hierbij moeten natuurlijk de coëfficiënten in orde worden gebracht:
reactievergelijking: 2 Mg + O2 → 2 MgO
OPDRACHT 13
DEMO
Je leerkracht onderzoekt welke stof er ontstaat bij de verbranding van een niet metaal.
Werkwijze
Je leerkracht neemt een oude glazen pot met plastieken deksel en steekt een verbrandingslepel door het deksel door de achterzijde van de verbrandingslepel even te verwarmen.
Vervolgens wordt een bodempje water met universeel-indicatoroplossing toegevoegd in de glazen pot.
Je leerkracht vult de verbrandingslepel met zwavel, steekt de zwavel aan en brengt de brandende zwavel boven het vloeistofoppervlak. De pot wordt gesloten.
Waarnemingen
Besluit
reactiepatroon: niet-metaal + zuurstofgas → niet-metaaloxide nM + O2 → nMO
reactievergelijking: S8 + 8 O2 → 8 SO2
Het reactiepatroon geeft algemeen weer wat voor soort stoffen of stofklassen reageren en welke stoffen of stofklassen worden gevormd.
reactiepatroon vorming metaaloxiden: metalen + zuurstofgas → metaaloxiden M + O2 → MO
reactiepatroon vorming niet-metaaloxiden: niet-metalen + zuurstofgas → niet-metaaloxiden nM + O2 → nMO
` Maak oefening 8 en 9 op p. 36.
Van het element zwavel bestaan meerdere oxiden. Omcirkel de formules die je met behulp van de tabel met oxidatiegetallen kunt vormen.
a SO b SO2 c S2O
Vorm de formule van het oxide van de volgende elementen. Als een bepaald element meerdere mogelijke oxidatiegetallen heeft, schrijf je alle opties.
a aluminium
b cadmium
Noteer de juiste naam naast de formules van de vorige oefening.
Van volgende stoffen is ofwel de systematische naam, de stocknotatie of de formule gegeven. Schrijf telkens de andere naam/namen en/of formule. Indien er van een bepaalde stof geen stocknotatie bestaat, leg je uit waarom niet.
a kaliumoxide
b lood(IV)oxide
c koolstofmonoxide
d kopermonoxide
e Br2O3
Schrijf de juiste formule van alle oxiden die bij de ingrediënten hieronder vermeld worden. magnesiumoxide; Vulstof: Hydroxypropylmethylcellulose (E464);
Bevochtigingsmiddel: Sorbitol; Antiklontermiddel: Magnesiumstearaat (E470b); Kleurstof: E171; Verdikkings-middel: Siliciumdioxide. 1 capsule bevat 450 mg MAGNESIUM ELEMENT (120% Referentie inname).
Behoren de volgende stoffen tot de metaaloxiden (MO) of de niet-metaaloxiden (nMO)?
a lachgas
b roest
Schrijf het reactiepatroon voor de vorming van:
a een niet-metaaloxide:
b een metaaloxide:
c ongebluste kalk
d koolzuurgas
Hoort bij de volgende reacties reactiepatroon a of b (uit de vorige oefening)?
a P4 + 5 O2 → 2 P2O5
b 4 Al + 3 O2 → 2 Al2O3
c 2 C + O2 → 2 CO
d de reactie beschreven in volgende tekst: Alkalimetalen zijn zo zacht dat je ze met een mes kunt snijden. Natrium reageert zo snel met zuurstofgas in de lucht dat het oppervlak al na enkele minuten dof wordt.

Noteer de verbrandingsreactie (reactie met O2) van calcium. ` Meer oefenen? Ga naar .
De hydroxiden
©VANIN
LEERDOELEN
Je kunt al:
L anorganische stoffen indelen in de juiste stofklasse op basis van een gegeven naam of formule;

L een formule opstellen met behulp van oxidatiegetallen;
L de naam en formule van oxiden opstellen;
L de algemene formule van een hydroxide schrijven.
Je leert nu:
L de eigenschappen en toepassingen van hydroxiden;
L de formule van hydroxiden opstellen;
L de naam van hydroxiden opstellen;
L via welke chemische reactie je een hydroxide kunt vormen.
1 Wat is een hydroxide?
In dit hoofdstuk gaan we dieper in op de hydroxiden. In hoofdstuk 1 heb je met deze stofklasse al kennisgemaakt.
Een hydroxide is een verbinding van een metaal met 1 of meerdere hydroxidegroepen (OH--groepen). Het zijn dus allemaal ionverbindingen. De functionele groep is het hydroxide-ion: OH-. De lading van het hydroxideion is -I, aangezien zuurstof een oxidatiegetal van -II heeft en waterstof een oxidatiegetal van +I. De algemene formule van een hydroxide is dus MOH. Er komt nooit een andere index dan 1 voor bij het metaal.
In de plaats van een metaalion kan ook het ammoniumion (NH4+) gebonden worden.
WEETJE
Ook al zijn hydroxiden ionverbindingen, toch is er ook een atoombinding aanwezig. De binding tussen het metaal en zuurstof is een binding tussen een metaal en een niet-metaal, en bijgevolg een ionbinding. Maar zuurstof is ook gebonden met waterstof. Dat zijn 2 niet-metalen en die vormen dus samen een atoombinding.
2 Formule- en naamvorming
OPDRACHT 14
2.1 Metalen met slechts 1 mogelijk oxidatiegetal
De formule- en naamvorming verloopt analoog aan die van de metaaloxiden.
Voor hydroxiden met het ammoniumion of met een metaalion dat slechts 1 mogelijk oxidatiegetal heeft, ga je het oxidatiegetal aflezen uit het PSE en vorm je de formule door de kruisregel toe te passen. De naamgeving is als volgt:
systematische naam: metaal (of ammonium) + Grieks telwoord + hydroxide verkorte systematische naam (volgens KISS-principe): metaal (of ammonium) + hydroxide
Oefen de naam en formule van hydroxiden.
1 Vorm de naam en de formule-eenheid via de kruisregel van het hydroxide van magnesium.
2 Vorm de naam en de formule-eenheid via de kruisregel van het hydroxide van ammonium.
OPDRACHT 15
2.2 Metalen met meerdere mogelijke oxidatiegetallen
Net zoals bij de oxiden kun je voor eenzelfde metaal meerdere mogelijke formules van het hydroxide vormen. De stof kan met behulp van de systematische naam (of met de stocknotatie) genoteerd worden.
Oefen de naam en formule van hydroxiden.
1 Vul de volgende tabel voor de hydroxiden van koper aan.
Kruisregel
Formule-eenheid
Systematische naam
Stocknotatie
2 Wat zijn de formule en de stocknotatie van loodtetrahydroxide?
a Vorm eerst de formule-eenheid:
b Bepaal het oxidatiegetal van lood in deze stof:
c Noteer de stocknotatie:
Hydroxiden zijn ionverbindingen tussen een metaalion en het hydroxide-ion.
Het hydroxide-ion is de functionele groep en heeft een oxidatiegetal van -I: OH-
NH4+ = ammoniumion
Indien het metaal slechts 1 mogelijk oxidatiegetal heeft:
• formule: oxidatiegetal opzoeken in het PSE + kruisregel toepassen
• systematische naam: metaal (of ammonium) + Grieks telwoord + hydroxide
• verkorte systematische naam: metaal (of ammonium) + hydroxide
Wanneer het metaal meerdere mogelijke oxidatiegetallen heeft:
• formule: meerdere mogelijkheden, er moet dus informatie over het oxidatiegetal gegeven worden
• systematische naam: metaal + Grieks telwoord + hydroxide
` Maak oefening 1 t/m 4 op p. 42.
3 Gebruik en toepassingen van hydroxiden


OPDRACHT 16
In het dagelijks leven worden veel hydroxiden gebruikt bij het poetsen. Zo is natriumhydroxide of bijtende soda NaOH een zeer sterke ontstopper. Een oplossing van natriumhydroxide lost namelijk haren en zeepresten op. Wanneer je die stof gebruikt, moet je extra voorzichtig zijn. Het is namelijk een zeer corrosieve stof en ze kan dus brandwonden veroorzaken.
Een speciaal geval is ammoniak NH3. Wanneer je NH3 oplost in water, ontstaat er ammoniumhydroxide NH4OH. In thema 04 gaan we dieper in op dat oplosproces. Die oplossing wordt vooral gebruikt voor zijn ontvettende eigenschappen om bijvoorbeeld ramen te poetsen. De stof staat bekend voor zijn zeer indringende geur. Maar let op, het kan je slijmvliezen irriteren. Dezelfde doordringende geur kun je in stallen ruiken. Ammoniak komt namelijk ook in mest voor.
Tijdens de labo’s zul je geregeld gebruikmaken van calciumhydroxide of gebluste kalk of kalkwater Ca(OH)2. De oplossing kan gebruikt worden om koolstofdioxide aan te tonen. Let op: het water dat thuis uit de kraan loopt, is kalkrijk water maar het is geen kalkwater!
Je leerkracht onderzoekt wat er gebeurt wanneer je koolstofdioxide aan kalkwater toevoegt.
Werkwijze
Je leerkracht maakt een oplossing van kalkwater.
Dat doe je door calciumoxide in water op te lossen. Vervolgens schenkt je leerkracht ongeveer 2 mL van die oplossing in een proefbuis en blaast voorzichtig met een rietje in de oplossing.
Waarnemingen
Wanneer je kalkwater met koolstofdioxide mengt,
Besluit
Je kunt kalkwater gebruiken om koolstofdioxide aan te tonen.
©VANIN
Formule Systematische naam Triviale naam Toepassing/eigenschap
Ca(OH)2 calciumhydroxide gebluste kalk indicator voor koolstofdioxide
NaOH natriumhydroxide bijtende soda ontstopper
NH4OH ammoniumhydroxide / ontvetter
` Maak oefening 5 op p. 42.
Afb. 16 In ontstopper zit natriumhydroxide
Afb. 17 Ammoniak werkt ontvettend
DEMO
kalkwater
4 Reactiepatroon
Bij het experiment met kalkwater hebben we zelf kalkwater gemaakt door calciumoxide in water op te lossen: reactiepatroon: metaaloxide + water → hydroxide MO + H2O → MOH
reactievergelijking:
CaO + H2O → Ca(OH)2
OPDRACHT 17
Je leerkracht onderzoekt welke stof er ontstaat als je een metaaloxide oplost in water.
Onderzoeksvraag
Welke stof ontstaat er wanneer je een metaaloxide in water oplost?
Werkwijze
Je leerkracht doet het gevormde magnesiumoxide van de proef bij de oxiden in een bekerglas met een beetje water en een paar druppels universeel-indicatoroplossing.
Waarnemingen
Besluit
Doordat er bij de reactie van een metaaloxide met water een hydroxide gevormd wordt, noemt men de metaaloxiden ook wel basevormende oxiden (zie ook hoofdstuk 5). Dat geldt wel alleen voor oxiden uit groep IA en IIA.
Reactiepatroon voor de vorming van hydroxiden:
metaaloxide + water → hydroxide MO + H2O → MOH
Metaaloxiden zijn basevormende oxiden.
` Maak oefening 6 op p. 42.
DEMO
Vorm de formule van de hydroxiden van Mn.
Ook al heeft chloor een mogelijk oxidatiegetal van +VII en kun je door de kruisregel correct toe te passen de formule Cl(OH)7 bekomen, toch is dat geen juiste formule voor een hydroxide. Leg uit waarom niet.
Van de volgende stoffen is ofwel de systematische naam, de stocknotatie of de formule gegeven. Noteer telkens de andere naam/namen en/of formule. Als er van een bepaalde stof geen stocknotatie bestaat, leg je uit waarom niet.
a ijzer(III)hydroxide
b CuOH
c KOH
d aluminiumhydroxide
e ammoniumhydroxide
Vul de tabel aan:
Formule
Systematische naam
zinkdihydroxide of zinkhydroxide
kobaltdihydroxide
Mn(OH)7
Verklaar waarom Ca(OH)2 ook wel gebluste kalk genoemd wordt.
Omcirkel alle basevormende oxiden.
a SO2
b NaOH
c K2O
d CO2
e koolstofdioxide
f zwaveltrioxide
g dinatriumoxide of natriumoxide
h natriumhydroxide

De zuren
LEERDOELEN
Je kunt al:
L anorganische stoffen indelen in de juiste stofklasse op basis van een gegeven naam of formule;
L een formule opstellen met behulp van oxidatiegetallen;
L de naam en formule van oxiden en hydroxiden opstellen.
Je leert nu:
L de naam geven, wanneer de formule van een zuur opgegeven is, en omgekeerd;
L de zuren verder indelen in binaire en ternaire zuren;
L de eigenschappen en toepassingen van zuren;
L de formule van binaire en ternaire zuren;
L de naam van binaire en ternaire zuren;
L via welke chemische reactie je een binair en ternair zuur kunt vormen.
1 Wat is een zuur?





Je hebt misschien al wel eens iets zuur gegeten: een schijfje citroen of een zuur snoepje. Tijdens de lessen chemie mag je natuurlijk niet proeven, daarom hebben we tijdens het practicum andere manieren geleerd om te bepalen of een stof tot de zuren behoort of niet. In dit hoofdstuk gaan we verder in op deze stofklasse.
Een zuur is opgebouwd uit een waterstofatoom en een zuurrest. Het waterstofatoom is de functionele groep. De zuurrest kan een niet-metaal zijn of een niet-metaal en één of meerdere zuurstofatomen. De algemene formule van een zuur is HZ
Aangezien alle zuren een vaste formule hebben, moet de index bij het waterstofatoom nooit vermeld worden in de naam. Afhankelijk van de samenstelling van de zuurrest, kunnen de zuren in 2 groepen ingedeeld worden:
1 Zuren waarbij de zuurrest enkel uit een niet-metaal bestaat, zijn de binaire zuren (ze bestaan uit 2 atoomsoorten). De algemene formule van een binair zuur is HnM
2 Dat in tegenstelling tot de ternaire zuren, waarbij de zuurrest naast een niet-metaal ook nog zuurstof bevat. De algemene formule voor een ternair zuur is HnMO.
Zowel de binaire als de ternaire zuren zijn alleen opgebouwd uit niet-metalen. Het zijn dus allemaal atoombindingen.
2 Binaire zuren
OPDRACHT 18
Een binair zuur is opgebouwd uit 2 atoomsoorten: het waterstofatoom en een niet-metaal HZ of HnM is de algemene formule voor een binair zuur.
Alle niet-metalen bezitten hun laagst mogelijke oxidatiegetal in de binaire zuren. Op die manier kun je zeer gemakkelijk de formule van de binaire zuren afleiden.
Bepaal de formule van het binaire zuur met zwavel.
©VANIN
Van 1 binair zuur moet je ook de triviale naam kennen. De triviale naam van waterstofchloride is zoutzuur
De naam ‘diwaterstofsulfide’ is dus niet fout, maar het kan korter (aangezien waterstof maar 1 OG heeft).
De naam van de binaire zuren is als volgt: De systematische naam: Grieks telwoord + waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ʻideʼ. Omdat de formule voor zuren vastligt (waterstof heeft immers altijd OG = +I), kan de naam ook verkort worden genoteerd als: waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ʻideʼ.
De zuurrest is heel belangrijk voor de vorming van zouten. Je bekomt die door de waterstofionen (H+) uit de formule van het zuur te verwijderen. Per waterstofion dat je uit de formule haalt, krijgt de zuurrest een lading van -1.
Voorbeeld:
HCl -1 H+ → Cl-
H2S -2 H+ → S2-
De naam voor de zuurrest is volledig analoog aan de naam van het zuur zelf, alleen worden de waterstoffen niet meer vermeld, omdat die eraf gehaald zijn. De naam van de zuurrest wordt gevormd door de verkorte Latijnse naam van het niet-metaal + uitgang ‘-ide’. De extra uitgang ‘-ion’ wijst erop dat het over een geladen deeltje gaat en dat het geen volledige verbinding is: er is nog een positief deel nodig om de formule compleet te maken.
Het is belangrijk om de zuurrest te kennen: Brutoformule Systematische naamZuurrest Naam zuurrest
HF waterstoffluorideF- fluoride-ion
HCl waterstofchloride Cl- chloride-ion
HBr waterstofbromideBr- bromide-ion
HI waterstofjodideI- jodide-ion
H2S waterstofsulfideS2- sulfide-ion
Tabel 4 Binaire zuren en zuurresten
3 Ternaire zuren
De naam zegt het zelf: de ternaire zuren zijn opgebouwd uit 3 atoomsoorten. Naast waterstof en een niet-metaal is er ook altijd minstens 1 zuurstofatoom aanwezig: HnMO is de algemene formule voor een ternair zuur. Ook hier is de functionele groep het waterstofatoom.
©VANIN
Ook de namen ‘diwaterstofcarbonaat’ (H2CO3), ‘triwaterstoffosfaat’ (H3PO4) en ‘diwaterstofsulfaat’ (H2SO4) zijn correct.
De ternaire zuren kun je indelen in de stamzuren, die het vaakst voorkomen, en de afgeleide zuren
Het aantal waterstof- en zuurstofatomen in de formule kun je niet afleiden uit het PSE of uit de naam. Je moet de formule van de zuren dus zeer goed uit het hoofd leren!
In het stamzuur is het oxidatiegetal van het specifieke niet-metaal gelijk aan het groepsnummer, met uitzondering van de halogenen: daar is het niet +VII, maar +V.
VOORBEELD
H2CO3 HClO3 OG(C) = +IV OG(Cl) = +V
De naam voor de stamzuren is analoog aan die van de binaire zuren, alleen is de uitgang niet -ide, maar -aat. Ook hier kun je werken met de systematische naam: Grieks telwoord + waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ʻaatʼ
Maar omdat de formule voor zuren vastligt, kan de naam ook verkort worden genoteerd als: waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ʻaatʼ.
De meeste ternaire zuren hebben ook een triviale naam.
De zuurrest vorm je analoog aan die van de binaire zuren. Je haalt een of meer waterstofionen uit de formule. Per waterstofion krijgt de zuurrest een lading van -1. In de naam laat je ‘waterstof’ weg, maar voeg je ‘ion’ toe om aan te geven dat het een geladen deeltje is.
Ook hier is het heel belangrijk om de zuurrest te kennen: die hebben we nog nodig om de zouten te vormen:
Brutoformule Systematische naamTriviale naamZuurrest Naam zuurrest
H2CO3 waterstofcarbonaat koolzuur CO32- carbonaation HNO3 waterstofnitraat salpeterzuurNO3- nitraation
H3PO4 waterstoffosfaat fosforzuurPO43- fosfaation
H2SO4 waterstofsulfaat zwavelzuurSO42- sulfaation
HClO3 waterstofchloraat chloorzuur ClO3- chloraation
HBrO3 waterstofbromaat broomzuur BrO3- bromaation
HIO3 waterstofjodaat joodzuur IO3- jodaation
Tabel 5 Ternaire zuren en zuurresten
Een binair zuur: bestaat uit 2 atoomsoorten: het waterstofatoom en een niet-metaal.
Het oxidatiegetal van het niet-metaal is zo laag mogelijk, namelijk groepsnummer -8.
Om de naam te vormen zijn, er 2 opties:
• systematische naam: Grieks telwoord + waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ʻideʼ
• verkorte systematische naam (volgens het KISS-principe): waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ʻideʼ
De triviale naam van waterstofchloride is zoutzuur
Je kunt de zuurrest vormen door één of meerdere waterstofionen uit de formule van het zuur te verwijderen. Per waterstofion dat je verwijdert, krijgt de zuurrest een lading van 1-.
De te kennen binaire zuren en zuurresten zijn:
Brutoformule
Systematische naam
HF waterstoffluoride
HCl waterstofchloride
HBr waterstofbromide
HI waterstofjodide
H2S waterstofsulfide
Zuurrest Naam zuurrest
F- fluoride-ion
Cl- chloride-ion
- bromide-ion
jodide-ion
sulfide-ion
Een ternair zuur: bevat, naast waterstof en een niet-metaal, ook altijd minstens 1 zuurstofatoom.
Om de naam van een stamzuur te vormen, zijn er 2 opties:
• de systematische naam: Grieks telwoord + waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ʻaatʼ
• de verkorte systematischen naam (volgens het KISS-principe): waterstof + verkorte Latijnse naam van het niet-metaal + uitgang ʻaatʼ
De te kennen stamzuren en hun zuurresten zijn:
Brutoformule
Systematische naam Triviale naamZuurrest Naam zuurrest
H2CO3 waterstofcarbonaat koolzuur CO32- carbonaation
HNO3 waterstofnitraat salpeterzuurNO3- nitraation
H3PO4 waterstoffosfaat fosforzuurPO43- fosfaation
H2SO4 waterstofsulfaat zwavelzuurSO42- sulfaation
HClO3 waterstofchloraat chloorzuur ClO3- chloraation
HBrO3 waterstofbromaat broomzuur BrO3- bromaation
HIO3 waterstofjodaat joodzuur IO3- jodaation
` Maak oefening 1 en 2 op p. 50.
4 Gebruik en toepassingen van zuren
ontdekplaat: anorganische stofklassen
ʻDiwaterstofsulfideʼ is ook correct.
Het zuur dat aanwezig is in je maag, is zoutzuur of waterstofchloride HCl Het helpt bij de vertering van voedingsstoffen. Zoutzuur is vrij corrosief. Dat kun je gewaarworden wanneer je regelmatig moet overgeven of wanneer de klep tussen je slokdarm en je maag niet meer goed werkt. Je maag is door onder andere een slijmvlieslaag beschermd tegen die zure brij, maar je slokdarm kan er serieus door aangetast worden.
Bij vulkaanuitbarstingen komt waterstofsulfide of H2S vrij. Mogelijk heb je die zeer specifieke geur ook al waargenomen bij rotte eieren of stinkbommen.
WEETJE
©VANIN
gezonde maag re ux
Afb. 18 Zoutzuur in de maag helpt bij de vertering. Reflux is een aandoening waarbij de zure maaginhoud terugvloeit in de slokdarm.

Afb. 19 Giftige zoutzuurdampen bij een vulkaanuitbarsting
Bij de vulkaanuitbarsting op La Palma in 2021 werd de bevolking gewaarschuwd voor giftige zoutzuurdampen. Als lava, met een temperatuur van 1 000 °C, in contact komt met zout water, dan kunnen er giftige dampen ontstaan. De chemische reactie resulteert dan in een zoutzuurhoudende gaswolk. Dat fenomeen is gekend als ‘laze’, een samentrekking tussen ‘lava’ en ‘haze’ (nevel). De giftige dampen kunnen ademhalings- en huidproblemen veroorzaken.
Bron: standaard.be, 29/09/2021
Onder de ternaire zuren is koolzuur of waterstofcarbonaat (H2CO3) ongetwijfeld het zuur dat het meest gekend is. Het is het zuur dat gevormd wordt wanneer koolstofdioxide in water wordt opgelost.
Maar ook van zwavelzuur of waterstofsulfaat (H2SO4) heb je waarschijnlijk al gehoord. Het is aanwezig in een autobatterij, maar komt spijtig genoeg vooral in het nieuws omwille van zijn corrosieve eigenschappen. De krant bericht soms over mensen die verminkt werden door een zwavelzuuraanval. Het is een sterk hygroscopische stof. Dat wil zeggen dat zwavelzuur water heel hard aantrekt. Zo hard dat het al het vocht uit je cellen trekt met zware brandwonden tot gevolg.

20 In spuitwater zit

Afb.
koolzuur
Afb 21 Zwavelzuur veroorzaakt ernstige brandwonden
ʻTriwaterstoffosfaatʼ is ook correct.
Wil je weten wat er gebeurt nadat je cola gedronken hebt? Op vind je een artikel terug.
VEILIGHEIDSVOORSCHRIFT !
Wanneer je in een labo toch water met zwavelzuur moet mengen, dan moet je eerst water nemen en daar voorzichtig zwavelzuur op gieten. Je kunt het heel gemakkelijk onthouden aan de hand van het volgende ezelsbruggetje: ‘zwavelzuur mag nooit gedoopt worden’.
water geconcentreerd
©VANIN
Afb. 22 Zwavelzuur mag nooit gedoopt worden. GEN4_CHE_LB_KOV_T1_H4_Overgieten.ai
Cola is de enige frisdrank die niet alleen koolzuur, maar ook fosforzuur of waterstoffosfaat (H3PO4) bevat.

Afb. 23 4 foto’s van dezelfde wijsheidstand: linksboven in zijn oorspronkelijke staat, rechtsboven na onderdompeling in cola gedurende één dag, linksonder na een week en rechtsonder na een maand. Het fosforzuur in cola tast het tandemail aan en de kleurstoffen zorgen ervoor dat de wortel bruin wordt.
Formule Systematische naamTriviale naam Toepassing H3PO4 waterstoffosfaatfosforzuur aanwezig in cola H2CO3 waterstofcarbonaatkoolzuur frisdrank HCl waterstofchloride zoutzuur maag H2SO4 waterstofsulfaatzwavelzuur autobatterij wil nooit gedoopt worden
` Maak oefening 3 en 4 op p. 50.
5 Reactiepatronen
Een binair zuur kun je vormen door een niet-metaal met waterstofgas te laten reageren.
reactiepatroon: niet-metaal + waterstofgas → binair zuur nM + H2 → HnM
reactievergelijking: Cl2 + H2 → 2 HCl
Ternaire zuren kun je vormen door een niet-metaaloxide met water te laten reageren: Daarom noemen ze niet-metaaloxiden zuurvormende oxiden.
reactiepatroon:
niet-metaaloxide + water → ternair zuur nMO + H2O → HnMO
reactievergelijking: CO2 + H2O → H2CO3
Reactiepatronen voor de vorming van zuren:
niet-metaal + waterstofgas → binair zuur nM + H2 → HnM
niet-metaaloxide + water → ternair zuur nMO + H2O → HnMO
→ Niet-metaaloxiden zijn zuurvormende oxiden.
` Maak oefening 5, 6 en 7 op p. 50-51.
Zijn de volgende formules binaire (B) of ternaire (T) zuren?
a HI
b HIO3
c HBrO
d H2S e waterstofchloride f waterstofbromaat g fosforzuur
Noem één overeenkomst en één verschil tussen een binair en een ternair zuur.
Vul de tabel aan.
Formule
Systematische naam
Triviale naam H2SO4 zoutzuur fosforzuur
Welke formule hoort bij welke toepassing of eigenschap?
1 H3PO4 2 HCl 3 H2CO3 4 H2S
A aanwezig in spuitwater B geur van rotte eieren C aanwezig in de maag D aanwezig in cola




Vervolledig de volgende reactiepatronen.
a niet-metaaloxide + →
b + waterstofgas →
Welk reactiepatroon uit de vorige oefening hoort bij de volgende reacties: a of b?
a P2O5 + 3 H2O → 2 H3PO4
b I2 + H2 → 2 HI
c de onderlijnde reactie in het volgende artikel:
Na oxidatie van zwaveldioxidegas (uitstootgas van verbrandingsprocessen) ontstaat SO3. Wanneer SO3 in de vochtige lucht komt, ontstaat zure regen.
Horen de stellingen, namen of formules bij binaire of ternaire zuren of bij beide? Voor nieuwe namen/ formules, mag je ervan uitgaan dat ze juist zijn.
H is de functionele groep
H3PO4 kan gevormd worden uit de reactie van een niet-metaal met waterstofgas
` Meer oefenen? Ga naar .
Formule
Binair zuurTernair zuur Beide
Zuurtegraad van een oplossing
©VANIN
LEERDOELEN
Je kunt al:
L anorganische stoffen indelen in de juiste stofklasse op basis van een gegeven naam of formule;
L een formule opstellen met behulp van oxidatiegetallen;
L de naam en formule van oxiden en hydroxiden opstellen;
L de naam geven, wanneer de formule van een zuur opgegeven is, en omgekeerd.
Je leert nu:
L het begrip zuurtegraad en pH van een oplossing bespreken in voorbeelden;
L het verband leggen tussen zuur, basisch en neutraal en de pH of zuurtegraad van een oplossing;
L indicatoren gebruiken om te bepalen welke stoffen tot eenzelfde stofklasse behoren;
L de manier waarop je de pH of de zuurtegraad van een oplossing experimenteel kunt bepalen.
We hebben in hoofdstuk 1 gebruikgemaakt van indicatoren om de anorganische stoffen in te delen in hun stofklasse. In dit hoofdstuk gaan we verder in op die indicatoren.
ontdekplaat: zuurtegraad
De pH-schaal gaat van 0 tot 14. Hoe lager de pH, hoe zuurder een oplossing is. Een oplossing met een hoge pH noemen we een basische oplossing. De tegenhanger van zuur in de lessen chemie is dus niet zoet of zout, maar basisch! Een oplossing met een pH-waarde van 7 is een neutrale oplossing: deze oplossing is dus niet zuur, maar ook niet basisch. Let op: de zuurtegraad en de pH zijn dus tegengesteld: hoe zuurder een oplossing is, hoe hoger de zuurtegraad, hoe lager de pH.
Vroeger werd de zuurtegraad van een oplossing bepaald door de stof te proeven. Een oplossing met een lage pH smaakt ook zuur en een oplossing met een hoge pH smaakt eerder zeepachtig. Vorig jaar leerde je al dat het in een labo verboden is om te proeven van een oplossing. Het is in eerste instantie gevaarlijk, maar het is ook nog eens zeer onnauwkeurig. De pH van cola is bijvoorbeeld 2,4 en toch zou je niet zeggen dat cola zuur is. Dat komt natuurlijk door de enorme hoeveelheid suiker of zoetstoffen die eraan worden toegevoegd.

©VANIN
OPDRACHT 19
Waarom is proeven niet geschikt om te bepalen of een stof zuur of basisch is?
Geef 2 argumenten.
OPDRACHT 20
ONDERZOEK
Onderzoek nu zelf of een oplossing zuur, basisch of neutraal is.
Ga naar en voer het labo uit.
WEETJE
Lightfrisdranken zijn voor erosie van je tanden even slecht als gewone frisdranken, omdat ze evenveel zuur bevatten. Voor het ontstaan van gaatjes zijn ze wel minder schadelijk. Hoe zuur mag een frisdrank dan zijn?
Al bij een pH-waarde minder dan 5,5 in de mondholte kan het tandglazuur oplossen. Hoe zuurder de drank, hoe erosiever voor het gebit. Een frisdrank met een pH van minder dan 4 kan eroderend werken op het tandglazuur.
Afb 25 Cola heeft een pH van 2,4. Een frisdrank met een pH van <4 kan eroderend werken op het tandglazuur.
bepalen


2.1 pH-indicatoren
Een gemakkelijke manier om te bepalen of een oplossing zuur of basisch is, is met behulp van pH-indicatoren. Die stoffen komen vaak voor in de natuur en hebben een andere kleur afhankelijk van de zuurtegraad van de oplossing Een pH-indicator die je gemakkelijk zelf kunt maken, is rodekoolsap. Hiervoor leg je een paar stukjes rodekool in kokend water of plet je ze met behulp van een stamper met een beetje water in een mortier. Het water zal heel snel blauwpaars kleuren. Wanneer je aan een oplossing van rodekoolsap een paar druppels citroensap (een zuur) toevoegt, verandert de kleur naar rood. Wanneer je aan een oplossing van rodekoolsap een paar druppels natriumhydroxideoplossing (een base) toevoegt, verandert de kleur naar groengeel. De resultaten van experimenten met andere indicatoren vind je in de volgende tabel:
pH-Indicator
©VANIN
Kleur in zuur midden
Kleur in neutraal midden
Kleur in basisch midden rodekoolsap rood blauwpaars groengeel methyloranje rood geel geel lakmoes rood roodblauw blauw fenolftaleïne kleurloos kleurloos fuchsia broomthymolblauw geel groen blauw
Maar ook in het dagelijks leven kom je dat effect tegen. Wanneer je rodekool maakt, wordt er vaak een scheutje azijn toegevoegd aan de paarse rodekool. Hierdoor krijgt het gerecht een mooie rode kleur. Maar ook een hortensia krijgt een andere kleur afhankelijk van de zuurtegraad van de grond. Zo is het perfect mogelijk dat een roze hortensia na een aantal jaren blauwe bloemen geeft, wanneer de grond te zuur geworden is.
Ook al zijn die indicatoren heel gemakkelijk te gebruiken, het nadeel is dat je soms geen onderscheid kunt maken tussen bijvoorbeeld 2 zure oplossingen: een oplossing met pH-waarde 1 en met pH-waarde 2 geeft eenzelfde kleur. Dat kun je vrij eenvoudig oplossen door een mengsel te maken van verschillende indicatoren. Zo kun je gebruikmaken van pH-strips om de zuurtegraad van een zwembad te controleren. Dat is filtreerpapier dat in een oplossing van universeel indicator is ondergedompeld. Je kunt de universeelindicatoroplossing ook gewoon als vloeistof gebruiken en de kleur van de bekomen oplossing vergelijken met een kleurenschaal.
Afb. 26 Een hortensia verandert van kleur door de zuurtegraad van de grond.
Afb. 27 Met een universeel-indicatoroplossing kan de pH van een oplossing bepaald worden.
2.2 pH-meter
Voor sommige toepassingen (vooral in het labo) is het belangrijk om de pH-waarde heel exact te kennen. Je kunt dat gemakkelijk meten met een pH-meter. Je steekt dan een elektrode in de oplossing en kunt snel en nauwkeurig de pH-waarde aflezen.
Hoe zuurder een oplossing, hoe groter de zuurtegraad en hoe lager de pH van de oplossing.
De pH-schaal gaat van 0 tot 14:
• Een oplossing met pH < 7 is een zure oplossing.
• Een oplossing met pH = 7 is een neutrale oplossing.
• Een oplossing met pH > 7 is een basische oplossing.
Je kunt de pH bepalen met behulp van pH-indicatoren: dat zijn stoffen die een andere kleur vertonen afhankelijk van de pH van de oplossing.
Een pH-meter is een digitale en zeer nauwkeurige manier om de pH van een oplossing te bepalen.
` Maak oefening 1 t/m 4 op p. 56.
Je voegt aan de volgende oplossingen lakmoes toe. Welke kleur kun je waarnemen? Maak gebruik van de tabel op p. 54.
a een oplossing met een pH-waarde 2
b een oplossing waarin HCl is opgelost
c een oplossing waarin ongebluste kalk is opgelost
Bepaal bij elk van de volgende pH-waarden of de oplossing zuur, basisch of neutraal is. Noteer ook de juiste kleur na het toevoegen van de opgegeven indicator. Gebruik de tabel op p. 54.
a 7 + rodekoolsap
b 4 + lakmoes
c 12 + fenolftaleïne
d 2 + broomthymolblauw
Zijn de volgende stellingen juist of fout? Indien fout, verbeter dan het onderlijnde deel.
a In de chemie is het tegengestelde van zuur zoet.
b Een oplossing met een pH-waarde 2 is zuurder dan een oplossing met een pH-waarde 3.
Omcirkel telkens het juiste antwoord. Gebruik de tabel op p. 54.
a de meest zure oplossing: rood met methyloranje / geel met methyloranje
b de oplossing met de hoogste pH: fuchsia met fenolftaleïne / kleurloos met fenolftaleïne
c KOH + lakmoes: blauwe kleur / rode kleur
d blazen in een oplossing van broomthymolblauw: blauwe kleur / gele kleur
` Meer oefenen? Ga naar
De zouten
LEERDOELEN
Je kunt al:
L anorganische stoffen indelen in de juiste stofklasse op basis van een gegeven naam of formule;

L een formule opstellen met behulp van oxidatiegetallen;
L de naam en formule van oxiden en hydroxiden opstellen;
L de naam geven, wanneer de formule van een zuur opgegeven is, en omgekeerd;
L de algemene formule van een zout schrijven.
Je leert nu:
L de zouten verder indelen in binaire en ternaire zouten;
L de eigenschappen en toepassingen van zouten;
L de formule van zouten opstellen;
L de naam van zouten opstellen;
L via welke chemische reactie je een zout kunt vormen.
1 Wat is een zout?
Wanneer je in het dagelijks leven praat over zout, bedoel je natuurlijk keukenzout. Voor een chemicus is zout een volledige stofklasse. Er zijn dus verschillende stoffen die tot de zouten behoren.
Een zout is een ionverbinding die opgebouwd is uit een positief ion (metaalion of het ammoniumion) en een zuurrestion. De algemene formule van een zout is MZ. Afhankelijk van de zuurrest kun je de zouten verder indelen in binaire zouten MnM en ternaire zouten MnMO.

Afb. 29 Zouten zijn niet altijd witte, vaste stoffen, maar kunnen in verschillende kleuren voorkomen.
2 Formule- en naamvorming
OPDRACHT 21
2.1 Algemene formule
De algemene formule van een zout is MZ
Afhankelijk van de zuurrest heb je te maken met een binair of een ternair zout. Als de zuurrest alleen uit een niet-metaal bestaat, dan is het een binair zout: MnM. Bevat de zuurrest ook nog een of meerdere zuurstofatomen, dan is het een ternair zout: MnMO
Voor de vorming van de formule van de zouten heb je de formule van de zuurresten nodig (zie p. 44).
Net zoals bij de oxiden en de hydroxiden moet je ook hier een onderscheid maken tussen metalen met slechts één mogelijk oxidatiegetal en metalen met meerdere mogelijke oxidatiegetallen. Het oxidatiegetal van de zuurrest ligt vast, aangezien die afgeleid is van de formule van het zuur.
2.2 Metalen met slechts 1 mogelijk oxidatiegetal
Voor metalen met slechts 1 mogelijk oxidatiegetal (of met ammonium) is de naamgeving analoog als bij de metaaloxiden en de hydroxiden: systematische naam: Grieks telwoord + metaal (of ammonium) + Grieks telwoord + zuurrest verkorte systematische naam (volgens het KISS-principe): metaal (of ammonium) + zuurrest
Oefen de naam en formule van zouten.
1 Vorm de naam en formule-eenheid via de kruisregel van het zout tussen calcium en de jodide-zuurrest.
OPDRACHT 21 (VERVOLG)
2 Is dat een voorbeeld van een binair of een ternair zout?
3 Vorm de naam en formule-eenheid via de kruisregel van het zout tussen aluminium en de sulfaat-zuurrest.
4 Is het een binair of een ternair zout?
OPDRACHT 22
Vul aan.
2.3 Metalen met meerdere mogelijke oxidatiegetallen
Ook hier is de naamgeving analoog aan de naamgeving van de metaaloxide en de hydroxiden. Ofwel maak je gebruik van de systematische naam (met Griekse telwoorden), ofwel hanteer je de stocknotatie (verdieping).
1 Noteer de formule van alle zouten tussen ijzer en de sulfide-zuurrest.
Kruisregel
Formule-eenheid
→ Dat zijn allebei voorbeelden van
2 Wat is de formule-eenheid van looddinitraat?
3 Wat is de formule van dikopercarbonaat?
Wat is het oxidatiegetal van koper in die stof?
Wat is de stocknotatie?
Vorm eerst de formule-eenheid:
Bepaal het oxidatiegetal van koper in deze stof:
Noteer de stocknotatie:
Zouten zijn ionverbindingen: opgebouwd uit een metaal (of ammonium) en een zuurrest (die bestaat uit een niet-metaal al dan niet gecombineerd met 1 of meerdere zuurstofatomen)
algemene formule: MZ
2 soorten:
• binair zout (MnM): zuurrest bevat enkel een niet-metaal, de naam eindigt op -ide
• ternair zout (MnMO): zuurrest bevat een niet-metaal en zuurstof, de naam eindigt niet op -ide een metaal met slechts 1 mogelijk oxidatiegetal:
• formule: oxidatiegetal opzoeken in het PSE + kruisregel toepassen
• systematische naam: Grieks telwoord + metaal (of ammonium) + Grieks telwoord + zuurrest
• verkorte systematische naam (volgens het KISS-principe): metaal (of ammonium) + zuurrest een metaal met meerdere mogelijke oxidatiegetallen:
• formule: meerdere mogelijkheden, er moet dus informatie over het oxidatiegetal gegeven worden
• systematische naam: Grieks telwoord + metaal + Grieks telwoord + zuurrest
` Maak oefening 1 en 2 op p. 64.
3 Gebruik en toepassingen van zouten
ontdekplaat: anorganische stofklassen
©VANIN
ʻCalciumdichlorideʼ is ook correct.


Het bekendste zout is natuurlijk keukenzout of natriumchloride NaCl Dat wordt vooral als smaakmaker en bewaarmiddel gebruikt. In de winter wordt het ook gebruikt om op een glad wegdek te strooien. Het is niet aan te raden om strooizout in je eten te gebruiken. Er is namelijk een anti-klontermiddel aan toegevoegd.
Bij heel lage temperaturen (in Noorwegen, Zweden ...) wordt vaak calciumchloride CaCl2 als strooizout gebruikt.
Afb 30 Natriumchloride is het bekendste zout.
Afb 31 Strooizout bevat calciumchloride.
ʻDinatriumcarbonaatʼ is ook correct.



Van de ternaire zouten heb je ongetwijfeld calciumcarbonaat CaCO3 in huis. Marmer, maar ook eierschalen en mosselschelpen, bestaan uit dat zout. Als je weet dat je een eischaal kunt oplossen met een zuur, dan besef je ongetwijfeld onmiddellijk waarom het niet zo interessant is om een marmeren werkblad in de keuken te laten installeren.
©VANIN
Verder kun je een aantal zouten in de badkamer tegenkomen. Wratten kun je verwijderen door ze te laten bevriezen, maar je kunt hier ook zilvernitraat AgNO3 voor gebruiken. En in tandpasta zit heel vaak natriumfluoride NaF, dat zorgt voor sterker glazuur.
De kans is ook groot dat je soda of badzout of natriumcarbonaat Na2CO3 in huis hebt. Dat wordt vaak aan water toegevoegd als waterverzachter of waterontharder. Verwar het zeker niet met baksoda of bijtende soda. Baksoda is aanwezig in bakpoeder, en bijtende soda wordt als ontstopper gebruikt.
Formule Systematische naam Triviale naam Toepassing/ voorkomen
NaF natriumfluoride / tandpasta
AgNO3 zilvernitraat / wratten verwijderen
NaCl natriumchloride keukenzout smaak, bewaarmiddel
CaCO3 calciumcarbonaat / marmer, eierschaal
Na2CO3 natriumcarbonaatsoda of badzout waterverzachter
CaCl2 calciumchloride/ strooizout
` Maak oefening 3 op p. 64.
Afb. 32 Eierschalen bestaan uit calciumcarbonaat.
Afb. 33 In de meeste tandpasta's zit natriumfluoride.
Afb. 34 Met natriumcarbonaat kun je water ontharden.
4 Reactiepatroon
reactiepatroon:
zuur + hydroxide → zout + water
HZ + MOH → MZ + H2O
reactievergelijking:
HCl + NaOH → NaCl + H2O
OPDRACHT 24
Je leerkracht onderzoekt welke stof er ontstaat bij de reactie van een zuur en een hydroxide.
Werkwijze
Je leerkracht voegt 2 mL zoutzuur toe aan een proefbuis. Nadien voegt die enkele druppels universeelindicatoroplossing toe aan de oplossing en bepaalt de pH van de oplossing. Vervolgens voegt je leerkracht druppelsgewijs natriumhydroxideoplossing toe en bepaalt ook regelmatig de pH. Wanneer de pH 7 is geworden, stopt je leerkracht met het toevoegen van natriumhydroxideoplossing. Vervolgens plaatst je leerkracht het bekerglas op een draadnet en dampt die de oplossing uit.
Waarnemingen
Besluit
Je kunt een zout vormen door een zuur met een hydroxide te laten reageren. Hierbij verandert de zuurtegraad of de pH. We noemen die reactie ook een neutralisatiereactie
Reactiepatroon zout:
zuur + hydroxide → zout + water
HZ + MOH → MZ + H2O
DEMO
Noteer de formule en de naam van de gevraagde zouten.
a kalium en sulfidezuurrest
b aluminium en carbonaatzuurrest
c alle zouten van ijzer en de ternaire stamzuurrest
met chloor
Vorm de formule van de volgende zouten:
a aluminium en de zuurrest van zoutzuur
b ijzer (OG = +II) en de zuurrest van fosforzuur
c koper (OG = +I) en sulfidezuurrest
d chroom (OG = +VI) en salpeterzuurrest
Verbind de juiste formule met de gegeven gebruiksnamen.
1 badzout ⦁ ⦁ a NaF
2 keukenzout ⦁ ⦁ b CaCl2
⦁ c NaOH
⦁ d Na2CO3
⦁ e NaCl
` Meer oefenen? Ga naar
KERNBEGRIPPEN
ANORGANISCHE STOFFEN
NOTITIES
Hoofdstuk 1: Verdere indeling van de materie oxidatiegetal (OG)
het aantal elektronen dat een atoom in een verbinding zou opnemen of afstaan bij overgang naar de ionaire vorm.
De volgende elementen hebben in een verbinding een vast oxidatiegetal:
Groep Ia: +I
Groep IIa: +II
Groep IIIa: +III
Zuurstof: meestal -II
Fluor: -I
In een verbinding is de som van de oxidatiegetallen gelijk aan nul.
©VANIN
kruisregel
naamgeving
Je kunt met behulp van de oxidatiegetallen en de kruisregel gemakkelijk de formule van een samengestelde stof vinden:
Hoofdstuk 2: De oxiden oxiden MO (metaaloxide) of nMO (niet-metaaloxide) functionele groep: O2M + O2 → MO nM + O2 → nMO A B +X -Y
→ A y B x (controleren of je x en y niet kan vereenvoudigen = delen door eenzelfde getal)
Metaal heeft 1 mogelijk oxidatiegetal: systematische naam: Grieks telwoord + metaal + Grieks telwoord + uitgang verkorte systematische naam (KISS-principe): metaal + uitgang
Metaal heeft meerdere mogelijke oxidatiegetallen: systematische naam: Grieks telwoord + metaal + Grieks telwoord + uitgang
Atoomverbindingen: systematische naam: Grieks telwoord + niet-metaal + Grieks telwoord + oxide
Schema 1: indeling van anorganische stoffen op basis van een gegeven formule, zie p. 18
Schema 2: indeling van anorganische stoffen op basis van een naam, zie p. 20
KERNBEGRIPPEN
hydroxiden
ANORGANISCHE STOFFEN
NOTITIES
Hoofdstuk 3: De hydroxiden
©VANIN
zuren
pH zuurtegraad
zouten
M = metaal + O2
MO = metaaloxide + H2O
MOH = hydroxide
MOH
functionele groep: OH-
MO + H2O → MOH
MO = basevormend oxide
Hoofdstuk 4: De zuren
HnM (binair zuur) of HnMO (ternair zuur)
functionele groep: H+
nM + H2 → HnM
nMO + H2O → HnMO
nMO = zuurvormend oxide
Hoofdstuk 5: Zuurtegraad van een oplossing
pH: 0-7 = zuur
7 = neutraal
7-14 = base
Hoe lager de pH, hoe zuurder de oplossing
Hoofdstuk 6: De zouten
Algemeen: MZ
MnM (binair zout) of MnMO (ternair zout)
HZ + MOH → MZ + H2O
Tijdens de reactie verandert de pH. Die reactie wordt ook een neutralisatiereactie genoemd.
nM = niet-metaal + O2
nMO = niet-metaaloxide + H2O
HZ (= HnMO)
MZ + H2O
MnMO = ternair zout, ontstaat met HZ = ternair zuur HnMO
MnM = binair zout, ontstaat met HZ = binair zuur HnM
JANOG OEFENEN
1 Begripskennis
Ik ken het begrip organische en anorganische stoffen.
Ik ken de betekenis van het begrip oxidatiegetal en de waarde van het oxidatiegetal van elementen met slechts één oxidatiegetal.
Ik ken de algemene formule van de oxiden, hydroxiden, zuren en zouten.
Ik ken de functionele groep van de oxiden, hydroxiden en zuren.
Ik ken de indeling in metaaloxiden en niet-metaaloxiden.
Ik ken de indeling in binair en ternair bij zuren en zouten.
Ik ken toepassingen van een aantal oxiden, hydroxiden, zuren en zouten.
Ik ken reactiepatronen voor het vormen van oxiden, hydroxiden, zuren en zouten.
Ik ken de begrippen pH-schaal, zuur, basisch en neutraal.
Ik ken manieren om de pH van een oplossing te bepalen: pH-meter, pH-indicator.
2 Onderzoeksvaardigheden
Ik kan stoffen indelen in organische en anorganische stoffen.
Ik kan formules vormen via het oxidatiegetal en de kruisregel.
Ik kan het oxidatiegetal van een element bepalen in een gegeven formule.
Ik kan stoffen indelen in de juiste stofklasse op basis van een gegeven naam of formule.
Ik kan formules van oxiden, hydroxiden en zouten vormen
Ik kan de naam van oxiden, hydroxiden, zuren en zouten omzetten naar een formule en omgekeerd.
Ik kan het verband tussen de pH-schaal, de begrippen zuur – basisch – neutraal en de kleur van een pH-indicator toelichten.
Ik kan reactiepatronen in concrete reactievergelijkingen herkennen
` Je kunt deze checklist ook op invullen.
ORGANISCHE STOFKLASSEN 02 THEMA
Het kan gebeuren: je picknickt in het park en plots heb je een branderig gevoel aan je been. Wat blijkt nu? Je zit bovenop een mierennest. De kleine diertjes verdedigen zich met behulp van een zuur. Weet je welk zuur dat is? Het is zeker geen zoutzuur (HCl) of salpeterzuur (HNO3). Het is een organisch zuur. Zoek eens op het internet over welke stof het gaat.

` Hoe kun je specifieke stofklassen van organische stoffen herkennen?
` Hoe vorm je de systematische naam en chemische formule van die stoffen?
` Wat zijn enkele eigenschappen en toepassingen van een aantal van die organische stoffen?
We zoeken het uit!
























LEERDOELEN
Je kunt al:
L organische stoffen onderscheiden van anorganische stoffen;
L anorganische stoffen onderverdelen in oxiden, hydroxiden, zuren en zouten.
Je leert nu:
L organische stoffen classificeren in alkanen, alkenen, alcoholen of carbonzuren op basis van een gegeven formule of naam;
L de structuurformule, brutoformule en skeletnotatie van een organische stof herkennen, weergeven, in elkaar omzetten en interpreteren.


Organische chemie of koolstofchemie







































Je kent ondertussen het verschil tussen een anorganische en een organische stof. De term koolstofverbindingen wordt gebruikt als synoniem voor organische stoffen. Zo spreekt men ook over koolstofchemie in plaats van over organische chemie, omdat organische stoffen minstens één koolstofatoom bevatten. De binding(en) die dat atoom aangaat, bepaalt tot welke stofklasse een organische stof behoort.
Omwille van de verscheidene bindingsmogelijkheden van het koolstofatoom, bestaan er meer dan tien stofklassen in de organische chemie. Voordat we enkele van die stofklassen bespreken, bekijken we eerst de bindingsmogelijkheden van het koolstofatoom.
In dit hoofdstuk bestuderen we hoe een organische stof wordt voorgesteld. Naast de brutoformule worden organische stoffen ook nog op andere manieren voorgesteld.
1 Bindingsmogelijkheden van het koolstofatoom
Het koolstofatoom speelt een centrale rol binnen de organische chemie. Het atoom komt voor in elke verbinding en zal steeds omgeven worden door één of meerdere atomen, zoals H, O, N …



OPDRACHT 1
Vul aan.
1 Teken in de volgende tabel de lewisstructuur van een C-atoom en geef ook de elektronenconfiguratie weer.

OPDRACHT 1 (VERVOLG)
2 Hoeveel valentie-elektronen heeft het C-atoom?
3 Hoeveel atoombindingen moet een alleenstaand C-atoom aangaan om een edelgasconfiguratie te verkrijgen?
4 Met hoeveel waterstofatomen moet een alleenstaand C-atoom een binding aangaan?
5 Schrijf de brutoformule van de meest eenvoudige C-H-verbinding (H’s achteraan!):
©VANIN
6 elektronen
6 protonen
6 neutronen
Organische stoffen worden gekenmerkt door de aanwezigheid van minstens 1 koolstofatoom. Een koolstofatoom heeft 4 vrije valentie-elektronen en gaat 4 bindingen aan om de octetstructuur te bereiken.
Bekijk enkele formules van organische stoffen:
Het valt op dat elk koolstofatoom 4 bindingen aangaat, maar dat wil niet zeggen dat het 4 bindingspartners nodig heeft! Zo zie je in de derde en vijfde voorstelling dat een atoom meerdere (dubbele of drievoudige) bindingen kan aangaan met een ander atoom waardoor er minder waterstofatomen nodig zijn om de edelgasconfiguratie te bereiken.
Wanneer het koolstofatoom 4 bindingspartners heeft en dus 4 enkelvoudige bindingen, dan spreekt men van verzadigde verbindingen. Als het koolstofatoom een binding vormt met 2 of 3 andere atomen, dan zijn er meervoudige bindingen aanwezig (dubbele of drievoudige) en spreken we van onverzadigde verbindingen
Wanneer de C-atomen alleen binden met andere C-atomen en met H-atomen, dan noemen we die stoffen koolwaterstoffen. Ook hier wordt dan het onderscheid gemaakt tussen verzadigde en onverzadigde koolwaterstoffen.
OPDRACHT 2
Bekijk de onderstaande organische verbindingen.
Zijn deze verbindingen verzadigd of onverzadigd? Duid aan.
Organische verbinding Verzadigd of onverzadigd?
CC HH HH verzadigd onverzadigd
CCH HHHH HHHH H
CH3 – CH2 – CH3
©VANIN
verzadigd onverzadigd
verzadigd onverzadigd
CH3 – CH2 – CH = CH – CH2 – CH3 verzadigd onverzadigd
I
Zoals je weet, heeft het koolstofatoom 4 valentie-elektronen. Om de octetstructuur te bereiken, zal het atoom dus met nog 4 extra elektronen moeten binden. Dat kan op een aantal manieren: het koolstofatoom kan zich binden aan 4, 3 of 2 atomen.
Binding met 4 atomen Binding met 3 atomen Binding met 2 atomen
Koolstof kan een atoombinding aangaan met 4 atomen, die elk 1 ongepaard elektron bezitten. Zowel waterstof als de halogenen zijn niet-metaalatomen met 1 ongepaard elektron.
We bekijken de molecule methaan (CH4):
lewisstructuur:
Koolstof kan de octetstructuur ook bereiken door slechts aan 3 atomen te binden. Omdat het C-atoom 4 ongepaarde elektronen heeft, moet het dan een dubbele binding aangaan met 1 atoom.
We bekijken de molecule etheen (C2H4):
lewisstructuur:
Als het koolstofatoom slechts aan 2 atomen bindt, dan kan het de octetstructuur bereiken door 2 dubbele bindingen aan te gaan of een enkelvoudige en een drievoudige binding aan te gaan.
We bekijken de molecule ethyn (C2H2):
lewisstructuur:
Het koolstofatoom zal de 4 bindingen met waterstofatomen rondom zich in de ruimte maximaal spreiden. Hierdoor ontstaat een 3D-molecule, een tetraëder met hoeken tussen de C-H-bindingen die 109° bedragen.
ruimtelijke structuur:
Er is een dubbele binding tussen de 2 koolstofatomen. De bindingen van het koolstofatoom vormen nu een trigonale structuur: de bindingen liggen in een vlak met onderlinge bindingshoeken van 120°
De molecule heeft een lineaire structuur, wat betekent dat de bindingshoeken 180° bedragen.
ruimtelijke structuur:
WEETJE
In een organische stof zal het koolstofatoom altijd 4 atoombindingen aangaan met andere atomen. Dat kunnen andere koolstofatomen zijn, maar evengoed atomen van andere elementen (H, Cl, O …). Een koolstofatoom heeft dus altijd 4 bindingen, maar niet noodzakelijk 4 bindingspartners. Organische verbindingen die alleen bestaan uit C-atomen en H-atomen, worden ook wel koolwaterstoffen genoemd.
Verzadigde koolstofverbindingen zijn organische stoffen waarbij elk koolstofatoom steeds 4 bindingspartners heeft.
Onverzadigde koolstofverbindingen zijn organische stoffen waarbij sommige koolstofatomen 2 of 3 verschillende bindingspartners hebben.
` Maak oefening 1 op p. 79.
©VANIN
2 Notatiemogelijkheden van een organische stof
2.1 De brutoformule
Een organische stof bestaat dus uit koolstofatomen die steeds 4 bindingen aangaan. Vaak ontstaat er een binding met een waterstofatoom. Organische stoffen worden op meerdere manieren weergegeven.
Eén manier ken je al vanuit thema 01: de brutoformule. De brutoformule van een organische stof geeft de aanwezige elementen weer en het aantal van elk element met een index. De index 1 wordt niet genoteerd. In de organische chemie worden de elementen bovendien als volgt gerangschikt: eerst C, dan H en ten slotte de overige elementen alfabetisch.
VOORBEELD BRUTOFORMULE
CH4 C2H6 C2H4 C3H8O
2.2 De uitgebreide en beknopte structuurformule
Over de manier waarop de atomen met elkaar verbonden zijn, krijg je geen informatie in de brutoformule. Hiervoor werken we met de structuurformule
In die formule wordt het aantal atomen van elke soort weergegeven. Ze worden rond elk koolstofatoom apart geordend waardoor de bindingen tussen de koolstofatomen zichtbaar zijn. De structuurformule is dus een tweedimensionale weergave van de structuur van een molecule waarbij de bindingen worden weergegeven tussen de verschillende koolstofatomen. De bindingen met waterstof worden, na een goede beheersing van het schrijven van een structuurformule, vaak weggelaten. We spreken dan van de beknopte structuurformule. Wanneer de C-H-bindingen wel nog worden getoond, spreekt men over een uitgebreide structuurformule.
OPDRACHT 3
VOORBEELD STRUCTUURFORMULE
Brutoformule Uitgebreide structuurformule
Beknopte structuurformule
Merk op dat in het laatste voorbeeld het lijkt alsof het zuurstofatoom gebonden is aan 1 van de 2 waterstofatomen rond het koolstofatoom. Maar het is gebonden aan het koolstofatoom zelf.
Vul de volgende koolstofverbindingen met waterstofatomen aan zodat elk C-atoom een edelgasconfiguratie krijgt.
Het eerste voorbeeld is al gegeven.
Je noteert op die manier zowel de beknopte structuurformule als de brutoformule van de verbindingen.
Aantal gebonden C-atomen
Structuurformule van de verbinding
Brutoformule van de verbinding
Wanneer er in een structuurformule een atoomgroep, bijvoorbeeld CH2, vaak voorkomt, dan kan het als volgt verkort worden weergegeven:
TIP
Bij de organische stoffen maakt men ten slotte ook nog gebruik van een derde notatie: de skeletnotatie of zaagtandstructuur. De skeletnotatie toont enkel het skelet van een organische molecule, die heeft 2 onderdelen: de atoombinding(en) tussen de koolstofatomen; de atoombinding(en) tussen de koolstofatomen en andere (niet-waterstof)atomen.
Brutoformule Uitgebreide structuurformule Skeletnotatie
C3H6 CH2 = CH – CH3
C4H10 CH3 – CH2 – CH2 – CH3
C2H6O CH3 – CH2 – OH
Een organische stof kan op verschillende manieren voorgesteld worden:
Brutoformule Uitgebreide structuurformuleBeknopte structuurformule = een lineaire weergave van de aanwezige elementen, met een index die het aantal per element weergeeft.
Volgorde: C – H – andere elementen in alfabetische volgorde
bv.
C3H8 C2H6O
` Maak oefening 2 en 3 op p. 79.
= een tweedimensionale weergave van de structuur van een molecule waarbij alle bindingen worden weergegeven.
= een tweedimensionale weergave van de structuur van een molecule waarbij de bindingen worden weergegeven tussen de verschillende koolstofatomen. De C-H-bindingen worden niet weergegeven.
3 De stofklassen
Bij de anorganische stoffen hebben we 4 stofklassen beschreven. Door de verschillende bindingsmogelijkheden van het koolstofatoom bestaan er meer dan 10 stofklassen in de organische chemie. Elk van die stofklassen wordt gekenmerkt door een specifieke binding of een functionele groep Die functionele groep is een kenmerkende groep van atomen.
We bekijken nu enkele van die stofklassen, en beperken ons voorlopig tot het herkennen van die stofklassen.
©VANIN
OPDRACHT 4
Zie jij overeenkomsten?
1 Bekijk enkele structuurformules, skeletnotaties en namen van de 5 stofklassen bij de organische stoffen:

Hoofdbestanddeel van aardgas.
Ook wel moerasgas genoemd.

Brandstof voor snijbranders of lassen.
Grondstof voor plastics.
Ook wel acetyleen genoemd.

Brandstof voor fonduestellen. Oplosmiddel voor lijmen, verven en vetten.
Zeer giftige, kleurloze vloeistof.
ethaanzuur
CH3COOH n-butaan

Wordt gebruikt als bewaarmiddel, maar ook om mayonaise en vinaigrettes te maken.
Ook wel azijnzuur of ijsazijn genoemd.
CH3-CH2-CH2-CH3

In gasvuurtjes en om huizen te verwarmen.
methaanzuur H-COOH

Zit in de haren van brandnetels en wordt door mieren ingespoten als ze je bijten.
Ook wel mierenzuur genoemd.
OPDRACHT 4 (VERVOLG)
propaan
CH3-CH2-CH3
In gasvuurtjes en om huizen te verwarmen.
ethanol
propeen n-octaan


Grondstof voor polypropeen (PP).Ideale brandstof voor verbrandingsmotoren.
CH3-CH2-OH n-hexaan CH3-(CH2)4-CH3

Drankalcohol.
Ook gebruikt als ontsmettingsmiddel of biobrandstof.

Wordt gebruikt als oplosmiddel voor verschillende stoffen, waaronder oliën, wassen en waxen, en wordt daarom vaak gebruikt in de cosmetische en farmaceutische industrie.

Hormoon in planten dat zorgt voor rijping van de vruchten. Grondstof voor polyetheen (PE).
2 Probeer, eventueel in overleg met je buur, alle voorbeelden in 4 groepen onder te brengen. Welke kenmerken ga je hiervoor gebruiken?
3 Kijk nu naar de indeling van enkele andere werkgroepjes en vul jouw indeling verder aan.
Zo komen we tot de volgende onderverdeling in 5 stofklassen:
1 alkaan → enkelvoudige bindingen tussen de C-atomen alleen maar C- en H-atomen aanwezig = verzadigde koolwaterstof
2 alkeen → dubbele binding tussen 1 paar C-atomen alleen maar C- en H-atomen aanwezig = onverzadigde koolwaterstof
3 alkyn → drievoudige binding tussen 1 paar C-atomen alleen maar C- en H-atomen aanwezig = onverzadigde koolwaterstof
4 alcohol → enkelvoudige bindingen tussen de C-atomen hydroxylfunctie (-OH groep) in de molecule
5 carbonzuur → enkelvoudige bindingen tussen de C-atomen carboxylfunctie (-COOH groep) in de molecule
©VANIN
Opgelet! Verwar de hydroxylfunctie niet met hydroxide. Het gaat allebei wel over de OH-groep, maar bij hydroxiden is er een ion gebonden via ionbinding. Bij de hydroxylfunctie zal de OH-groep via atoombinding aan de koolstof vastzitten.
Stofklasse Systematische naam
alkanen -aan
alkenen-een
Structuurformule
alleen C/H-atomen alleen maar enkelvoudige bindingen
alleen C/H-atomen dubbele binding aanwezig
alkynen -yn alleen C/H-atomen drievoudige binding aanwezig
alcoholen-ol
carbonzuren-zuur
C/H/O-atomen
OH als functionele groep aanwezig
C/H/O-atomen
COOH als functionele groep aanwezig
` Maak oefening 4 t/m 7 op p. 79-80.
Dit schooljaar beperken we ons tot 1 stofklasse: de alkanen. De kennis die je dit jaar verzamelt, vormt de basis voor het volgende jaar waarin je meer stofklassen zult leren en waarin je binnen 1 stofklasse het aantal stoffen uitgebreider zult bespreken.
2 3 4
Lees de volgende stellingen. Vermeld of ze juist (J) of fout (F) zijn. Verbeter de onderlijnde tekst indien fout.
a In een organische verbinding heeft elk koolstofatoom vier bindingspartners.
b Bij een organische stof wordt tussen een C- en H-atoom steeds een enkelvoudige binding gevormd.
c CH2 – CH2 – CH2 – CH2 is een juiste weergave van een organische verbinding met alleen enkelvoudig gebonden C- en H-atomen.
d CH2 = CH – CH2 – CH3 is een juiste weergave van een organische verbinding met enkel C- en H-atomen en één dubbele binding.
Noteer de brutoformule van de onderstaande stoffen.
Structuurformule van de verbinding
a CH3 – CH2 – CH3
b CH3 – (CH2)4 – CH3
c CH3 – CH2 – CH2OH
d CH2 = CH – CH2 – CH3
e CH3 – CH2 – CH2 – CH = CH – CH3
Brutoformule van deverbinding
Geef de brutoformule of structuurformule van de onderstaande stoffen. Vraag a werd al ingevuld als voorbeeld.
Brutoformule van de verbinding
Structuurformule van de verbinding
a C5H12 CH3 – CH2 – CH2 – CH2 – CH3
b C6H12
c CH3 – CH2 – CH = CH – (CH2)3 – CH3
Binnen de organische verbindingen komen de stofklassen alkanen en alkenen voor. Waarin verschillen die 2 stofklassen van elkaar?
Plaats de onderstaande koolstofverbindingen in de juiste stofklasse (alkaan, alkeen, alkyn, alcohol of carbonzuur).
Koolstofverbinding (systematische naam, structuurformule of skeletnotatie)
a hexaan
b CH2 = CH – CH2 – CH3 c nonaanzuur
d e CCO HHHH HHHH HH f methanol
g hept-3-yn
Stofklasse
Plaats de volgende stoffen in de juiste kolom en vermeld elke keer de stofklasse waartoe de stof behoort:
– CH3OH – NaOH – NH4OH – HCOOH – C3H8 – H2CO3 – Al(OH)3
Anorganische stoffen
Organische stoffen Stoffen Stofklasse Stoffen Stofklasse
Beoordeel de stellingen. Vermeld of ze juist (J) of fout (F) zijn.
Een organische stof bestaat alleen uit C- en H-atomen.
Een organische stof bevat alleen enkelvoudige bindingen.
Een organische stof bevat alleen atoombindingen.
Een organische stof behoort tot de levenloze materie.
Een organische stof bevat minstens één C-atoom.
CO2
Alkanen
©VANIN
LEERDOELEN
Je kunt al:
L organische stoffen onderverdelen in alkanen, alkenen, alcoholen en carbonzuren op basis van hun systematische naam of structuurformule.
Je leert nu:
L het belang, het voorkomen en de toepassingen van alkanen in het dagelijks leven en de industrie bespreken.

Een stofklasse die we uitgebreider bekijken, zijn de alkanen. Die moleculen bevatten alleen koolstof- en waterstofatomen. We geven ze daarom dan ook vaak de naam koolwaterstoffen. Tussen de koolstofatomen komt telkens maar één binding voor; we spreken van een enkelvoudige atoombinding. Hierdoor heeft elk koolstofatoom een maximaal aantal waterstofatomen en kunnen er geen extra atomen opgenomen worden in de molecule. We noemen alkanen daarom ook verzadigde koolwaterstofverbindingen
Stofklasse Typisch kenmerk alkanen enkelvoudige bindingen tussen de C-atomen‘C-C’
Centraal in de molecule staat de koolstofketen, de stam van de molecule. De lengte van die stam bepaalt de naam van de molecule. Dit jaar bespreken we enkel de onvertakte alkanen: er komen geen zijketens voor in de moleculen.
Hoe wordt de systematische naam van een specifiek alkaan juist gevormd?
De stam ‘alk-‘ verwijst naar het specifieke aantal C-atomen in de molecule. Het achtervoegsel ‘-aan’ verwijst naar het feit dat er alleen maar enkelvoudige bindingen tussen alle C-atomen bestaan.
1 Formule en systematische naam
De eerste 3 alkanen onthoud je misschien met het ezelsbruggetje ‘MEP’. Vanaf het vijfde alkaan herken je de Griekse telwoorden. Om de namen van die moleculen te onthouden, bestaat er ook een geheugensteuntje. De eerste letters van de alkanen keren terug in de volgende zin: ‘Mama en papa bakken pannenkoeken, heel heerlijk of niet dan?’
WEETJE
De ‘n’ in de naam voor de onvertakte alkanen staat voor ‘normal’, maar je kunt het misschien beter onthouden als ‘niet-vertakt’.
Het is dus belangrijk dat je de stammen goed kent, want ze vormen de basis voor het grote aantal moleculen dat je de volgende jaren zult leren kennen.
Aantal C-atomen StamAantal C-atomen Stam
©VANIN
Vanaf 4 koolstofatomen kan met dezelfde bouwstenen ook een vertakt alkaan gevormd worden, bv. C4H10
CH3 – CH2 – CH2 – CH3 CH3 – CH – CH3 CH3
Vanaf butaan wordt de alkaannaam daarom ook als een verzamelnaam gezien. Wanneer men het specifiek over het lineair molecule heeft, dan plaatst men ‘n-’ voor de naam. De systematische naam van CH3 – CH2 – CH2 – CH3 wordt dan n-butaan, omdat het onvertakt is.
VOORBEELD SYSTEMATISCHE NAAM ONVERTAKTE ALKANEN
We formuleren de systematische naam van enkele (onvertakte) alkanen vanuit de gegeven structuurformule.
1 CH4
stam = 1 koolstofatoom: METH
Het C-atoom heeft 4 bindingspartners en is dus verzadigd met achtervoegsel AAN.
De systematische naam van dat molecule is methaan.
2 CH3 – CH2 – CH2 – CH2 – CH3
stam = 5 koolstofatomen: PENT
Elk C-atoom heeft 4 bindingspartners en is dus verzadigd met achtervoegsel AAN.
Het is een onvertakt alkaan met meer dan 4 C-atomen, dus met ‘n’ voor de naam.
De systematische naam van dat molecule is n-pentaan
OPDRACHT 5
Formuleer nu zelf de systematische naam vanuit de gegeven structuurformule.
Voorstelling
CH3 – CH2 – CH2 – CH3
CH3 – (CH2)4 – CH3
Systematische naam
©VANIN
Hoe worden de brutoformule en structuurformule van een specifiek (onvertakt) alkaan gevormd?
Bij het opstellen van de structuurformule van een alkaan overloop je best het volgende stappenplan:
Stap 1: Schrijf het aantal C-atomen.
Stap 2: Plaats een enkelvoudige binding tussen de C-atomen.
Stap 3: Vul de formule aan met H-atomen totdat elk C-atoom 4 bindingen heeft.
VOORBEELD STRUCTUURFORMULE n-HEPTAAN
Stap 1: Schrijf het aantal C-atomen. De stam is HEPT, wat wil zeggen 7 C-atomen + afkorting ‘n’ dus een onvertakt alkaan.
C C C C C C C
Stap 2: Plaats tussen alle koolstofatomen een enkelvoudige binding.
C – C – C – C – C – C – C
Stap 3: Vul de formule aan met H-atomen tot elk C-atoom 4 bindingspartners heeft.
Uitgebreide structuurformule:
Beknopte structuurformule: CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3 of CH3-(CH2)5-CH3 Brutoformule: C7H16
OPDRACHT 6
Stel nu zelf de structuurformule en brutoformule op van de onderstaande onvertakte alkanen.
Systematische naam
Structuurformule
Brutoformule n-nonaan
propaan
©VANIN
Uit de bovenstaande voorbeelden blijkt dat in de brutoformule van een alkaan het aantal waterstofatomen steeds gelijk is aan tweemaal het aantal koolstofatomen plus 2. Dat leidt tot de volgende algemene brutoformule voor de alkanen:
C nH2n+2 (met n = natuurlijk getal)
ORGANISCHE STOFFEN onvertakt vertakt
Naamgeving
stam = aantal C-atomen + achtervoegsel ‘aan’
vanaf 4 C-atomen met symbool ‘n’ vooraan
Formulevorming brutoformule:
C nH2n+2
structuurformule: Zie stappenplan p. 83
ALKANEN
2 Fysische eigenschappen, voorkomen en toepassingen uit het dagelijks leven
2.1 Fysische eigenschappen
©VANIN
Paraffine, het hoofdbestanddeel van kaarsen, is een mengsel van n-alkanen met 17 tot 57 koolstofatomen.
Alkanen komen in groot aantal voor in de natuur. Wanneer we de kook- en smelttemperatuur bekijken op de onderstaande grafiek, wordt duidelijk dat korte alkanen zoals methaan (CH4), ethaan (CH3 – CH3), propaan (CH3 – CH2 – CH3) en butaan (CH3 – CH2 – CH2 – CH3) gasvormig zijn bij kamertemperatuur. Naarmate de molecule langer wordt, stijgt het kookpunt van het alkaan. Alkanen met 5 tot 16 C-atomen zijn vloeibaar bij kamertemperatuur en alkanen met 17 of meer C-atomen zijn vast bij kamertemperatuur. Die laatste noemen we de hogere alkanen of paraffinen
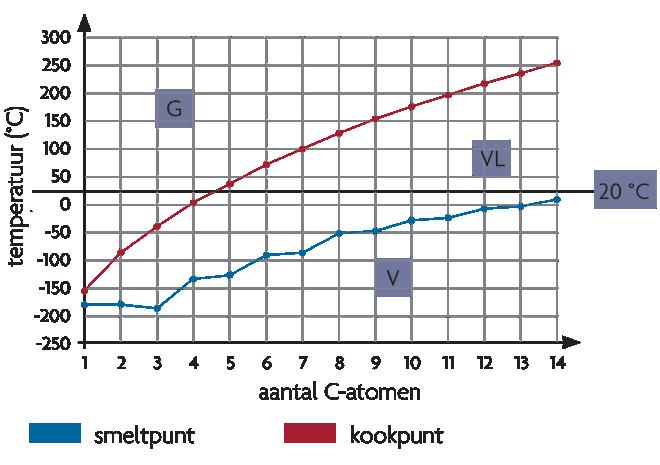
Alkanen zijn goed brandbaar. Methaan (aardgas) wordt als brandstof gebruikt voor het verwarmen van onze huizen en het koken van eten op een gasvuur.
Kortere alkanen zijn bovendien licht ontvlambaar. Daarom moet je thuis altijd goed controleren of je de gasaansluiting van je gasfornuis goed hebt afgesloten wanneer je klaar bent met koken.

De wereldindustrie steunt voor haar energievoorziening grotendeels op alkaanmengsels, zoals petroleum en aardgas. Die grondstoffen vormen ook de basis van de petrochemie, waaruit allerlei producten ontstaan die niet meer uit het moderne leven zijn weg te denken.
WEETJE
Afb. 36 Kook- en smelttemperatuur van alkanen
GEN4_CHE_KOV_LB_T2_H2_pentaan.ai
2.2 Voorkomen en toepassingen uit het dagelijks
leven
Methaan
ontdekplaat: organische stofklassen
GEN4_CHE_KOV_LB_T2_H2_methaan.ai
Methaan is het voornaamste bestanddeel van aardgas en wordt soms aangetroffen samen met aardolie en andere fossiele brandstoffen. Methaangas ontstaat wanneer bacteriën onder anaerobe omstandigheden (= omgeving zonder zuurstofgas) afgestorven organismen afbreken. Omdat anaerobe omstandigheden vooral in moerasbodems voorkomen, wordt methaan vaak moerasgas genoemd. Het gas ontstaat ook bij de verwerking van o.a. tuinafval. Door die gassen over generatoren te sturen, wordt elektrische energie opgewekt. Methaan wordt daarom ook vaak een biogas genoemd.
Veel gezinnen gebruiken aardgas als brandstof voor het verwarmen van hun woning. Gasleidingen komen dan ook overal in Vlaanderen voor. Methaan is echter geur- en kleurloos. Om een gaslek tijdig op te merken, voegen gasleveranciers daarom sterk geurende organische stoffen toe.
De verbrandingsreactie van methaan verloopt dan als volgt (bij volledige verbranding):
CH4 + 2 O2 → CO2 + 2 H2O
De grootste methaanvoorraad bevindt zich echter nog in de aarde. Belangrijke methaanrijke moerasgebieden zijn te vinden in het hoge noorden van Europa, Siberië en Amerika. In die gebieden is de bodem permanent bevroren: op enige diepte bevindt zich ijs. Dat heet permafrost. Alleen de bovenste decimeters van de bodem ontdooien elke zomer. Omdat het water niet weg kan zakken door het ijs in de bodem, wordt het vooral in vlakke gebieden nat met veel moerasvorming tot gevolg. Er wordt nu gevreesd dat de temperatuurstijging op aarde zal zorgen voor het ontdooien van de permafrost. Dat zou kunnen leiden tot het vrijkomen van grote hoeveelheden methaan en een verdere toename van het broeikaseffect.
©VANIN

Afb. 37 Een molecule methaan
3D-beeld methaan
Afb. 38 Moerasgebieden bevatten methaan.
Spoken op het kerkhof – gevaren in de ondergrond

Lang geleden, toen er nog echt donkere nachten waren, werd een late bezoeker van het kerkhof soms opgeschrikt door blauwe dwaallichtjes. Dat was methaan dat uit de aarde opsteeg, gemengd met een geringe hoeveelheid fosfine (PH3). Wanneer dat mengsel in contact kwam met de lucht, ontvlamde het spontaan.
Ook het gevreesde mijngas, dat – gemengd met lucht – in steenkoolmijnen ernstige ontploffingen (‘grauwvuur’) kon veroorzaken, bevatte methaan. Aangezien het gas kleur- en geurloos is, moesten mijnwerkers uiterst waakzaam zijn voor explosies. Om die reden namen mijnwerkers vaak een kanarie in een kooi mee in de schachten. Wanneer er mijngas aanwezig was, stierf de kanarie voordat er groot gevaar voor de mijnwerkers optrad. Op die manier konden de mijnwerkers zichzelf op tijd in veiligheid brengen.
B©VANIN
Aardgas bevat naast methaan ook nog andere koolwaterstoffen. De tweede belangrijkste organische fractie is ethaan, hoewel het beduidend minder in aardgas voorkomt dan methaan.
Aangezien ook ethaan als brandstof wordt gebruikt, schrijven we ook hiervoor de verbrandingsreactie:
2 C2H6 + 7 O2 → 4 CO2 + 6 H2O
Ethaan is een belangrijke grondstof voor de productie van andere organische stoffen zoals etheen, ethanol en ethaanzuur.
Afb. 39 Mijngas kan ontploffingen veroorzaken.
Ethaan
Afb. 40 Een molecule ethaan
3D-beeld ethaan
Propaan en n-butaan
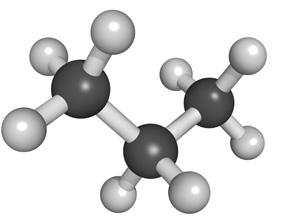

Propaan en n-butaan zijn gasvormige alkanen, die gebruikt worden om bijvoorbeeld huizen te verwarmen of om fornuizen aan te steken in de keuken. De gassen worden als vloeistoffen onder druk in de handel gebracht onder de benamingen propagas en butagas. Beide gassen worden in een school ook vaak gebruik als mobiele opstelling bij het gebruik van een bunsenbrander. Ook voor propaan en n-butaan schrijven we een (volledige) verbrandingsreactie:
C3H8 + 5 O2 → 3 CO2 + 4 H2O
2 C4H10 + 13 O2 → 8 CO2 + 10 H2O

©VANIN
Als je houdt van kamperen, dan heb je zeker al eens gekookt op een gasvuurtje. De bekende blauwe bussen zijn gevuld met butaan. Het gas staat onder verhoogde druk, waardoor het vloeibaar is. Wanneer zo’n bus wordt opengedraaid, ontsnapt eerst het n-butaangas dat zich boven de vloeistof bevindt. Vervolgens verdampt een gedeelte van het vloeibare n-butaan. Die omzetting kan pas voldoende snel gebeuren als de temperatuur van het samengeperste n-butaan hoger ligt dan het kookpunt: -0,5 °C. Om die reden is butaan niet bruikbaar bij vriesweer. Bergbeklimmers en wintersporters gebruiken daarom propaan als campinggas. Het kookpunt van propaan is -42 °C en dat geeft dus geen problemen bij lage temperaturen.

3D-beeld n-butaan
3D-beeld propaan
Afb. 41 Een molecule propaan
Afb. 42 Een molecule n-butaan
Afb. 43 Propaantank
Afb. 44 Koken met butaangas
3D-beeld methaan
n-octaan
Benzine bevat ongeveer 300 verschillende koolstofverbindingen, waarvan de meeste alkanen zijn, onder andere octaan. Octaan is een ideale brandstof voor verbrandingsmotoren: hoe hoger het octaangehalte, hoe beter. De verbrandingsreactie noteren we als volgt:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O
©VANIN
WEETJE

Octaangehalte versus octaangetal aan de benzinepomp Er is een verschil tussen het octaangehalte en het octaangetal. Het octaangehalte duidt op de hoeveelheid octaan in benzine. Het octaangetal is een maat voor de klopvastheid van de brandstof (de mate waarin die brandstof in een brandstofluchtmengsel kan worden samengeperst zonder tot zelfontbranding te komen). De cijfers 95 of 98 die je op de benzinepomp aantreft, geven het octaangetal weer.
n-alkaan
Toepassing methaan brandstof om woningen te verwarmen ethaan brandstof om woningen te verwarmen grondstof voor productie etheen, ethanol, ethaanzuur ...
propaan brandstof om woningen te verwarmen in gasflessen voor campingvuurtjes en kookfornuis
n-butaan brandstof om woningen te verwarmen in gasflessen voor campingvuurtjes en kookfornuis
Die 4 kleinste n-alkanen komen voor in ruwe aardolie, zijn gasvormig bij kamertemperatuur en licht ontvlambaar. Methaan vind je daarnaast ook in aardgas en in permafrost.
n-pentaan tot n-decaan zijn ook terug te vinden in ruwe aardolie, maar zijn vloeibaar bij kamertemperatuur. n-octaan wordt gebruikt als brandstof voor benzinemotoren.
` Maak oefening 1 en 2 op p. 90.
Koppel de juiste alkanen aan de juiste toepassing(en) of het juiste voorkomen.
1 ethaan • •a komt voor in de permafrost van Siberië
2 propaan • •b grondstof voor ethanol (drankalchohol)
3 methaan • •c campinggas
Vul de tabel met toepassingen van organische stoffen verder aan.
Organische stof
Structuurformule Systematische naam
CH3 n-butaan
CH4 methaan
` Meer oefenen? Ga naar .
Toepassing
ORGANISCHE STOFKLASSEN
bindingsmogelijkheden C-atoom: 4 bindingen, niet noodzakelijk 4 bindingspartners soorten formules: brutoformule, (beknopte) structuurformule, skeletnotatie telwoorden stam naamgeving (indicatie voor het aantal C-atomen):
1 - 2 - 3 - 4 - 5 - 6 - 7 - 8 - 9 - 10 meth-eth-prop-but-pent-hex-hept-oct-non-dec
ALKANEN
©VANIN
bestaan enkel uit C-en H-atomen enkelvoudige bindingen naamgeving en formulevorming alkanen:
• ALK = stam (aantal C-atomen)
• AAN (= alleen maar enkelvoudige bindingen tussen de C-atomen)
n-alkaan
Toepassing
methaan brandstof om woningen te verwarmen
ethaan brandstof om woningen te verwarmen grondstof voor productie etheen, ethanol, ethaanzuur …
propaan brandstof om woningen te verwarmen in gasflessen voor campingvuurtjes en kookfornuis
n-butaan
brandstof om woningen te verwarmen in gasflessen voor campingvuurtjes en kookfornuis
Die 4 kleinste n-alkanen komen voor in ruwe aardolie, zijn gasvormig bij kamertemperatuur en licht ontvlambaar. Methaan vind je daarnaast ook in aardgas en in de permafrost.
n-pentaan tot n-decaan zijn ook terug te vinden in ruwe aardolie, maar zijn vloeibaar bij kamertemperatuur.
n-octaan wordt gebruikt als brandstof voor benzinemotoren.
bestaan enkel uit C- en H-atomen
bevat enkelvoudige bindingen
bestaan enkel uit C- en H-atomen
bevat een dubbele binding
Kenmerken
bestaan enkel uit C- en H-atomen
bevat een drievoudige binding
bestaan uit C-, H- en O-atomen
bestaan uit C-, H- en O-atomen
bevat een OH-groep
bevat een COOH-groep
JANOG OEFENEN
1 Begripskennis
Ik kan verzadigde en onverzadigde koolstofverbindingen definiëren en van elkaar onderscheiden
Ik ken het begrip koolwaterstoffen.
Ik kan de brutoformule van een organische stof geven op basis van een naam of structuurformule.
Ik kan de beknopte en uitgebreide structuurformule van een organische stof geven op basis van een naam.
Ik kan de skeletnotatie of zaagtandstructuur van een organische stof geven op basis van een naam of structuurformule.
Ik kan organische stoffen indelen als alkanen, alkenen, alkynen, alcoholen of carbonzuren.
Ik ken eigenschappen, voorkomen en toepassingen van alkanen.
2 Onderzoeksvaardigheden
Ik kan organische stoffen classificeren als alkanen, alkenen, alkynen, alcoholen of carbonzuren op basis van een gegeven formule.
Ik kan organische stoffen classificeren als alkanen, alkenen, alkynen, alcoholen of carbonzuren op basis van een naam.
Ik kan van de laagste 10 n-alkanen de naam vormen als de formule gegeven is.
Ik kan van de laagste 10 n-alkanen de formule vormen als de naam gegeven is.
` Je kunt deze checklist ook op invullen.
CHEMISCH REKENEN 03 THEMA
Om zelf mayonaise te maken, is het belangrijk om de juiste hoeveelheden van de ingrediënten te gebruiken: 1 eierdooier, 1 eetlepel mosterd, een snuifje zout … Eenheden zoals een ‘snuifje’ of een ‘eetlepel’ zullen we echter in de chemielessen niet gebruiken. In de keuken kun je nog spelen met de hoeveelheden van ingrediënten, in de chemie is dat niet zo. Reagentia moeten in zeer nauwkeurige hoeveelheden worden samengevoegd.

citroensap
` Hoe kun je te weten komen welke hoeveelheden van stoffen met elkaar reageren?
` En hoe ga je die stofhoeveelheden afwegen? De massa van atomen is immers veel te klein.
We zoeken het uit!
Atoommassa, molecuulmassa, formulemassa
©VANIN
LEERDOELEN
Je kunt al:
L de massa van een atoom berekenen uit de hoeveelheid protonen (Z) en neutronen (N), uitgedrukt in unit.
Je leert nu:
L het verband aantonen tussen de relatieve en absolute massa van atomen;
L de molecuulmassa van een molecuulverbinding of de formulemassa van een ionverbinding uit de atoommassa’s berekenen.
1 Atoommassa
Het atoom is het kleinste deeltje dat nog alle eigenschappen van het element bezit. Niet-metalen binden via atoombinding tot moleculen, tot zuren en niet-metaaloxiden bijvoorbeeld. Metalen en niet-metalen binden onderling via een ionbinding. De metaaloxiden, de hydroxiden en de zouten binden op die manier, zoals je in thema 01 al hebt geleerd.
Je weet al dat het gecombineerde atoommodel van Bohr-Rutherford een atoom beschrijft met een kern, bestaande uit neutronen en protonen, en schillen met elektronen rond die kern.
Atomen van hetzelfde element hebben altijd hetzelfde aantal protonen en elektronen, maar kunnen een verschillend aantal neutronen bevatten.
De relatieve atoommassa A r van een element is de verhouding tussen de absolute atoommassa en de eenheidsmassa (u).
Afb. 45 Het schillenmodel van Bohr-Rutherford elektronenschillen
Een proton heeft een massa van 1,6726231 · 10-27 kg, net iets minder dan de massa van een neutron. De massa van een elektron is verwaarloosbaar klein: slechts 1 2 000 van de massa van een proton. Om het rekenen wat te vereenvoudigen, werd de unit (u) als eenheid gedefinieerd:
protonen en neutronen
3D-beeld atoom
De unit is de standaard om massa aan te duiden op atomair of moleculair niveau. Het werd gedefinieerd als 1 12 de van de massa van het 12C-isotoop en bedraagt 1,66 · 10−27 kg.
Bij benadering kunnen we de unit gelijkstellen aan de massa van een proton of aan die van een neutron.
Vorig jaar leerde je al dat het volstaat om de massa van het aantal protonen en neutronen van een atoom samen te tellen om het massagetal te berekenen:
De massa van het atoom (massagetal A) is de som van het aantal protonen (Z) en van het aantal neutronen (N).
A (massagetal) = Z (aantal protonen) + N (aantal neutronen)
VOORBEELD ABSOLUTE ATOOMMASSA BEREKENEN
We berekenen de absolute atoommassa, uitgedrukt in unit, van een magnesiumatoom met 12 neutronen: 24Mg heeft 12 protonen (Z) en dus 12 (A-Z) neutronen. De massa is dus:
A = Z + N = 24 u
Omgerekend naar kg is dat dan: A a(Mg) = 24 u · 1,66 · 10−27 kg u = 40 · 10-27 kg
Zo’n kleine massa is onmeetbaar voor om het even welk instrument. Daar moeten we een oplossing voor vinden.
Bovendien kunnen atomen van hetzelfde chemische element, dus met hetzelfde aantal protonen, een verschillend aantal neutronen in de kern hebben. Zo zullen niet alle magnesiumatomen 12 neutronen in de kern hebben. We spreken in dat geval over isotopen. Als er meerdere isotopen bestaan van eenzelfde element, dan kunnen we de atoommassa van een element niet zomaar gelijkstellen aan die van één bepaalde isotoop. We moeten de atoommassa van een element dan bepalen door rekening te houden met het procentueel voorkomen van elke isotoop. We spreken dan over de gemiddelde relatieve atoommassa. We ronden in berekeningen de gemiddelde relatieve atoommassa <A r > steeds af op 1 cijfer na de komma.
De gemiddelde relatieve atoommassa is het ‘gewogen gemiddelde’ van alle relatieve atoommassa’s van de voorkomende isotopen. In het PSE wordt bij elk element <A r > vermeld.
atoomnummer (Z) elektronegatieve waarde (EN)
2
Molecuulmassa
Je weet nu hoe de massa van een atoom wordt berekend, maar hoe bereken je de massa van een molecule die uit verschillende soorten atomen bestaat? Vergelijk het met een zak snoepjes: om de totale massa van de snoepjes te berekenen zul je de massa van elk soort snoepje moeten kennen en het aantal snoepjes per soort.
Ook moleculen bestaan uit een welbepaalde combinatie van meerdere atomen. Die atomen kunnen tot verschillende elementen behoren. Om de gemiddelde massa van een molecule of de molecuulmassa te berekenen, volstaat het de som te nemen van de gemiddelde atoommassa's van alle atomen in de molecule.
VOORBEELD MOLECUULMASSA BEREKENEN
De molecuulmassa van 1 molecule zwavelzuur (H2SO4) bestaat uit:
—2 waterstofatomen
—1 zwavelatoom
—4 zuurstofatomen m(H2SO4) = (2 · 1,0 u) + (1 · 32,1 u) + (4 · 16,0 u) = 98,1 u
Uitgedrukt in kg is dat: m = 98,1 · 1 u · 1,66 · 10−27 kg u = 1,63 · 10-25 kg
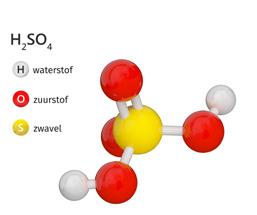
©VANIN
OPDRACHT 1
Bereken de massa (in kilogram) van 1 molecule salpeterzuur (HNO ).
Gegeven: HNO3
Gevraagd: m(HNO3)
Oplossing:
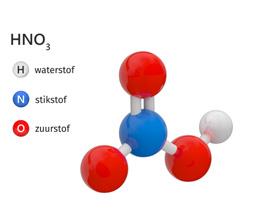
Afb. 47 Zwavelzuur
Afb. 48 Salpeterzuur
3
Formulemassa
In een verbinding opgebouwd uit metalen en niet-metalen worden de gevormde ionen samengehouden door een ionbinding. Die stof noemen we een ionverbinding. Voor ionverbindingen kunnen we dezelfde methode toepassen, alleen gebruiken we nu de formule-eenheid: de steeds wederkerende eenheid uit het ionrooster.
Zouten vormen bijvoorbeeld geen aparte moleculen. We spreken hier dan ook beter over de formule-eenheidsmassa of kortweg de formulemassa. Die wordt bepaald door de som van de gemiddelde massa’s van de ionen die we uit die formule-eenheid nemen. De berekening van de formulemassa verloopt analoog aan die van de molecuulmassa. We maken geen onderscheid tussen de massa van een ion en een atoom. Het verschil tussen beide is namelijk maar een aantal elektronen meer of minder, en elektronen hebben een verwaarloosbare massa.
VOORBEELD FORMULE-EENHEID NATRIUMSULFAAT (Na2SO4)
m(Na2SO4) = (2 · 23,0 u) + (1 · 32,1 u) + (4 · 16,0 u) = 142,1 u
Uitgedrukt in kg is dat:
m = 142,1 u · 1,66 · 10−27 kg u = 2,36 · 10-25 kg
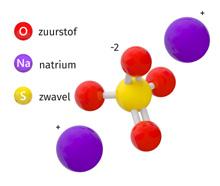
OPDRACHT 2
Bereken de massa van 1 formule-eenheid magnesiumcarbonaat (MgCO3) in unit en in kilogram.
Gegeven: MgCO3
Gevraagd: m(MgCO3) met eenheid u en kg
Oplossing:
©VANIN
massagetal (A) = som van het aantal protonen en neutronen gemiddelde relatieve atoommassa (<Ar>) = gewogen gemiddelde van de atoommassa's van de voorkomende isotopen molecuulmassa = som van de atoommassa's van de samenstellende atomen formulemassa = som van de massa's van de ionen in de formule-eenheid
` Maak oefening 1, 2 en 3 op p. 98.
Afb. 49 Natriumsulfaat
Bereken de molecuul- of formulemassa van de verbindingen (in unit).
a CaSO4:
b NaNO3:
c MgF2:
d Fe2O3:
e Ag2S:
Bereken de molecuul- of formulemassa van de moleculen. Noteer de waarden op 1 decimaal nauwkeurig (in unit).
a O2:
b S8:
c H2:
d MgO:
e SiCl4:
f H2SO4:
g Al(IO3)3:
Bereken de molecuul- of formulemassa van de onderstaande chemische stoffen. Noteer de waarden op 1 decimaal nauwkeurig (in unit).
a CaCO3:
b SiI4:
c Be(OH)2:
d Al2(HPO4)3: ` Meer oefenen? Ga naar .
De mol en het getal van Avogadro
LEERDOELEN
Je kunt al:
L de atoommassa, molecuulmassa en formulemassa berekenen, uitgedrukt in unit.
Je leert nu:
L uitleggen met voorbeelden wat een mol materie is met behulp van de constante van Avogadro;
L op basis van een gegeven formule, uit een gegeven massa de stofhoeveelheid in mol berekenen en omgekeerd;
L het verband tussen stofhoeveelheid en molaire massa toepassen.
OPDRACHT 3
6,02 · 1023 atomen in 12 gram koolstof
De massa van een molecule of formule-eenheid is onmeetbaar klein. Er moet dus worden overgegaan naar een veelvoud moleculen of formuleeenheden, zodat we de massa wel kunnen afmeten met dagdagelijkse meetapparatuur. Geen enkel meetinstrument is immers in staat om, met zo’n precisie, zo’n kleine massa te meten. We moeten op een of andere manier naar de eenheid gram kunnen overstappen.
Vul de laatste kolom van de tabel aan met het juiste aantal eenheden.
Voorwerp Verzamelnaam Aantal deeltjes



een paar schoenen een dozijn eieren een bak bier
1 De mol als eenheid en de molaire massa
OPDRACHT 3 (VERVOLG)
Voorwerp


Mol komt van het Latijnse woord moles, dat ‘stapel’ of ‘hoop’ betekent.
Verzamelnaam
een riem papier in de chemie:
1 mol keukenzout
6,02 · 1023
Aantal deeltjes
De mol is de hoeveelheid materie die evenveel deeltjes bevat (atomen, moleculen …) als er atomen zijn in 12 gram van het 12C-isotoop. Talloze experimenten tonen aan dat 1 mol = 6,02 · 1023 deeltjes. Dat aantal is beter gekend als het getal van Avogadro (NA), vernoemd naar de Italiaanse fysicus Amadeo Avogadro.
Welke soort materie je ook wilt afmeten, het gaat telkens over hetzelfde aantal deeltjes. Het aantal mol slaat dus op het aantal deeltjes van een stof. Dat kunnen erg zware atomen zijn (zoals uranium) maar ook erg lichte atomen (zoals waterstof). We gebruiken het symbool ‘n’ om het aantal mol (de stofhoeveelheid) aan te duiden, maar de getalwaarde van de constante van Avogadro heeft nog een groter voordeel. Dat wordt zo dadelijk duidelijk.
Een hoeveelheid van een stof kunnen we dus op meerdere manieren omschrijven:
via de massa van die stof (m), uitgedrukt in gram (g) via het aantal deeltjes van die stof (N), uitgedrukt in het aantal moleculen, atomen, formule-eenheden … via de stofhoeveelheid (n), uitgedrukt in mol
Let op: De hoeveelheid mol gaat over een gigantisch groot aantal deeltjes! Zoals je weet, maken 6 nullen een miljoen, 1 000 miljoen is een miljard. Verder is 1 000 miljard een biljoen, 1 000 biljoen is een biljard en 1 000 biljard is een triljoen. 1 000 triljoen is dan weer een triljard. We komen dus aan 602 triljard deeltjes in 1 mol.
106 = 1 000 000
109 = 1 000 000 000
1012 = 1 000 000 000 000
1015 = 1 000 000 000 000 000 1018 = 1 000 000 000 000 000 000 1021 = 1 000 000 000 000 000 000 000
OPDRACHT 4
Schrijf nu zelf het getal van Avogadro voluit met het juiste aantal nullen.
WEETJE


Als je 1 mol papier, hoe dun de vellen ook zijn, opeenstapelt, kun je 80 keer de afstand tussen de aarde en de maan (384 400 km) overbruggen, heen én terug.
Als je 1 mol donuts verdeelt over het aardoppervlak, wordt de aarde bedekt met een mantel donuts van 8 km hoog.


Als je 1 mol basketballen bezit, kun je er een nieuwe planeet mee vormen, even groot als de aarde.
Als je 1 mol euromunten krijgt op de dag van je geboorte en je elke seconde van je leven 1 miljoen munten uitgeeft, dan heb je op je sterfdatum nog steeds 99,99 % van je kapitaal in bezit.
Nu we weten hoeveel deeltjes een mol omvat, kunnen we steeds de omzettingen tussen het aantal mol (n) en het aantal deeltjes (N) makkelijk maken door gebruik te maken van de formule:
aantal deeltjes = aantal mol · aantal deeltjes mol
N = n NA
Let wel goed op dat het aantal deeltjes en de stofhoeveelheid in mol over hetzelfde gaat!
VOORBEELDVRAAGSTUK
Hoeveel atomen zuurstof zitten er in 3,00 mol CO2 ?
Gegeven: n(CO2) = 3,00 mol
Gevraagd: N(O)
Oplossing:
Uit de stofhoeveelheid CO2 die gegeven is in mol, berekenen we het aantal deeltjes (moleculen) CO2
N(CO2) = n · NA = 3,00 mol · 6,02 · 1023 moleculen mol = 1,81 · 1024 moleculen CO2
Maar elke molecule CO2 bevat 2 atomen zuurstof. Het aantal atomen zuurstof in 3 mol CO2 of in 1,81 · 1024 moleculen CO2 is dus gelijk aan 1,81 · 1024 · 2 = 3,62 · 1024 Er zitten dus 3,62 · 1024 atomen zuurstof in 3 mol CO2
Vergelijk met een zak kersensnoepjes: Je kunt enerzijds het aantal snoepjes berekenen, maar er kan ook gevraagd worden naar het aantal kersen, dan moet je de hoeveelheid snoepjes nog met 2 vermenigvuldigen.

OPDRACHT 5
Bereken hoeveel atomen stikstof er in 2,00 mol distikstofpentaoxide (N2O5) zitten.
Gegeven: n(N2O5) = 2,00 mol
Gevraagd: N(N)
Oplossing:
TIP
Afb. 50 Koolstofdioxide
Bij berekeningen ronden we tussenresultaten niet af: we rekenen steeds verder met de exacte uitkomst van een vorige bewerking. Zorg er wel voor dat je uiteindelijke resultaat de juiste hoeveelheid beduidende cijfers heeft!
De getalwaarde 6,02 · 1023 , of 1 mol, is zeer precies berekend:
de massa van 1 12 van het 12C-atoom = 1 unit
· 12
de massa van 1 12C-atoom= 12 unit
· NA
de massa van 1 mol 12C-atomen= 6,02 · 1023 · 12 unit
1 unit = 1,66 · 10−27 kg
de massa van 1 mol 12C-atomen
6,02 · 1023 · 12 · 1,66 · 10−27 kg u = 12 · 10-3 kg = 12 g
Op het eerste gezicht is dat een ingewikkelde berekening om te komen tot een zeer bruikbare conclusie: De massa van 1 mol deeltjes is gelijk aan de getalwaarde van de massa van een atoom, molecule of formule-eenheid, met de eenheid gram in plaats van unit. De massa van 1 mol deeltjes noemen we in het kort ook wel de molaire massa (M).
VOORBEELD MOLECUULMASSA OMZETTING IN MOLMASSA
1 molecule fosforzuur (H3PO4) heeft een massa van 98,0 unit
· NA
1 mol fosforzuur heeft een massa van 98,0 g
Stofhoeveelheid n Massa m
1 mol Zn 65,4 g
1 mol Fe 55,8 g
1 mol CuSO4 = m(Cu) + m(S) + 4 · m(O) = 63,6 g + 32,1 g + 4 · 16,0 g
1 mol MgCl2 = m(Mg) + 2 · m(Cl) = 24,3 g + 2 · 35,5 g
De mol is een eenheid, een verzameling van NA of 6,02 · 1023 deeltjes. Als we het getal samen met zijn eenheid beschouwen, spreken we over de constante van Avogadro: 6,02 · 1023 deeltjes mol
Stofhoeveelheid SymboolEenheid deeltjesaantal N deeltjes massa m g molhoeveelheid of stofhoeveelheid n mol constante van Avogadro NA deeltjes mol
De molaire massa: —De grootheid krijgt het symbool M —De eenheid voor de molaire massa is g mol . —De numerieke waarde van de molaire massa van een atoom is steeds dezelfde als die van de atoommassa, maar de eenheid unit kan gewoon vervangen worden door g mol .
©VANIN
Je vraagt je misschien af hoe Avogadro aan dat getal 6,02 · 1023 is gekomen. Is hij beginnen tellen? Nee, Avogadro kwam tot die waarde door de dichtheid van een stof, de relatieve atoommassa van de bindende elementen en de grootte van de eenheidscel in het ionrooster te vergelijken. Met de huidige nauwkeurigste meetapparatuur kan het getal van Avogadro nu al tot 8 cijfers na de komma bepaald worden: de meest nauwkeurig gemeten waarde is 6,02214179 · 1023.














Je kunt het vergelijken met de schatting van het aantal toeschouwers op een plein waar een evenement plaatsvindt. Als je weet hoe groot het plein is en hoe dicht de toeschouwers bij elkaar staan, kun je bij benadering bepalen hoeveel volk er aanwezig is. Gelukkig zijn atomen in een kristal ordelijker gerangschikt dan toeschouwers op een plein en kunnen wetenschappers daarom precieze berekeningen uitvoeren. Naargelang de bron (de politie of de organisator) lopen de schattingen over het aantal toeschouwers soms ver uiteen. Het aantal atomen per mol is echter altijd NA!
Afb. 52 Toeschouwers op een festival
Afb. 51 Ionrooster
WEETJE
2
Omrekeningen gram / mol / aantal deeltjes
Als we dezelfde methode gebruiken als bij de berekening van de massa (in unit) van 1 molecule of formule-eenheid, kunnen we ook de molaire massa van stoffen berekenen door de som te nemen van de molaire massa’s van de opbouwende atomen in een molecule. Bij ionverbindingen wordt met 1 mol van de stof 1 mol formule-eenheden bedoeld, want die stoffen vormen geen aparte moleculen. De werkwijze om te komen tot de molaire massa M van een formule-eenheid is identiek. We berekenen de molaire massa M opnieuw door de som te nemen van de molaire massa’s van de opbouwende ionen in een formule-eenheid.
VOORBEELDVRAAGSTUKKEN
1 Wat is de molaire massa van 1,0 mol chloorgas (Cl2)?
Gegeven: n(Cl2) = 1,0 mol
Gevraagd: M(Cl2)
Oplossing:
1 mol Cl2-moleculen bevat 2 mol Cl-atomen.
M(Cl2) = 2 · 35,5 g mol = 71,0 g mol
2 Wat is de molaire massa van 1,0 mol calciumchloride (CaCl2)?
Gegeven: n(CaCl2) = 1,0 mol
Gevraagd: M(CaCl2)
Oplossing:
1 mol formule-eenheden CaCl2 bestaat uit 1 mol Ca2+-ionen en 2 mol Cl--ionen. Herinner je je dat de massa van elektronen verwaarloosbaar is? De massa van ionen en atomen kunnen we dus aan elkaar gelijkstellen.
M(CaCl2) = 1 · 40,1 g mol M(Ca) + 2 · 35,5 g mol M(Cl) = 111,1 g mol
OPDRACHT 6
Bereken de molaire massa van perchloorzuur (HClO4).
Gegeven: HClO4
Gevraagd: M(HClO4)
Oplossing:
Afb. 53 Chloorgas
Afb. 54 Calciumchloride
Er wordt niet altijd naar de molaire massa gevraagd. Soms gaat het over een grotere stofhoeveelheid dan 1 mol. Het volstaat dan natuurlijk om het aantal mol (n) te vermenigvuldigen met de molaire massa (M)
m = n · M
m = massa (g)
n = stofhoeveelheid (mol)
M = molaire massa ( g mol )
©VANIN
VOORBEELDVRAAGSTUK
Wat is de massa van 3,00 mol zwavelzuur (H2SO4)?
Gegeven: n(H2SO4) = 3,00 mol
Gevraagd: m(H2SO4)
Oplossing:
1 mol H2SO4 bevat:
—2 mol H-atomen
—1 mol S-atomen
—4 mol O-atomen
a We berekenen de molaire massa van H2SO4:
M(H2SO4) = 2 · M(H) + 1 · M(S) + 4 · M(O)
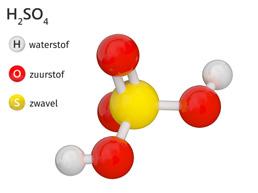
= 2 · 1,00 g mol + 1 · 32,1 g mol + 4 · 16,0 g mol = 98,1 g mol
b Nu we de molaire massa (M) van H2SO4 berekend hebben, kunnen we ook de massa (m) van 3,0 mol berekenen door gebruik te maken van de formule m = n · M → m(H2SO4) = 3,00 mol · 98,1 g mol = 294 g
OPDRACHT 7
Bereken de massa van 2,5 mol magnesiumsulfaat (MgS04).
Gegeven: n(MgSO4) = 2,5 mol
Gevraagd: m(MgSO4)
Oplossing:
Afb. 55 Zwavelzuur
We kunnen nu dus een gegeven stofhoeveelheid in mol omzetten naar zowel een aantal deeltjes van die stof, als naar de massa in gram van die stof. Als we echter een aantal deeltjes van een stof willen omzetten naar een aantal gram, dan zullen we altijd eerst de eenheid mol moeten omrekenen!
aantal deeltjes (N) → stofhoeveelheid (n) → massa (m) of massa (m) → stofhoeveelheid (n) → aantal deeltjes (N)
©VANIN
VOORBEELDVRAAGSTUK
Hoeveel atomen zuurstof zitten er in 426,0 gram
difosforpentaoxide (P2O5)?
Gegeven: m(P2O5) = 426,0 g
Gevraagd: N(O)
Oplossing:
fosfor P zuurstof O
a We berekenen de molaire massa van P2O5:
M(P2O5) = 2 · M(P) + 5 · M(O)
= 2 · 31,0 g mol + 5 · 16,0 g mol = 142,0 g mol










b We zetten de gegeven stofhoeveelheid (massa m, in gram) nu om naar het aantal mol door het te delen door de molaire massa van P2O5:
n = m M
n(P2O5) = 426,0 g 142,0 g mol = 3,000 mol
c Die molhoeveelheid (n) zetten we vervolgens om naar het aantal moleculen P2O5 door het te vermenigvuldigen met NA:
N = n · NA
N(P2O5) = 3,000 mol P2O5 · 6,02 · 1023 moleculen mol = 1,806 · 1024 moleculen
Er zitten 1,806 · 1024 moleculen P2O5 in 426,0 g P2O5. Er zitten 5 atomen zuurstof in 1 molecule P2O5. Het aantal atomen zuurstof zal dus 5 keer zo groot zijn:
N(O) = 1,806 · 1024 moleculen P2O5 · 5 atomen O molecule = 9,030 · 1024 atomen O
Afb. 56 Difosforpentaoxide
OPDRACHT 8
Bereken de massa in gram van 2,408 ∙ 1024 moleculen stikstofgas (N2).
Gegeven: N(N2) = 2,408 ∙ 1024 moleculen
Gevraagd: m(N2)
Oplossing:
Door vermenigvuldiging van de molaire massa (M, in g mol) met de stofhoeveelheid (n, in mol) krijgen we de totale massa (m, in gram).
Door de totale massa te delen door de molaire massa, krijgen we de stofhoeveelheid.
Als we van mol naar het aantal deeltjes willen overschakelen, vermenigvuldigen we de stofhoeveelheid met NA. Als we het aantal deeltjes willen omzetten in mol, delen we door NA
N = n · NA
delen door het getal van Avogadro (deeltjes/mol) aantal deeltjes N aantal gram m n = N NA n = m M aantal mol n
delen door molaire massa (g/mol)
vermenigvuldigen met molaire massa (g/mol) m = n · M
` Maak oefening 1 t/m 11 op p. 109-110.
vermenigvuldigen met het getal van Avogadro (deeltjes/mol)
Wat bevat het grootste aantal moleculen: 1 mol stikstofgas of 1 mol zuurstofgas?
Bevat een mol stikstofgas evenveel atomen als moleculen?
Hoeveel mol vertegenwoordigt 6,00 g zuurstofgas?
Wat is de massa van 0,1 mol waterstofgas?
Hoeveel moleculen bevat 3,55 g chloorgas?
Hoeveel mol vertegenwoordigt 3,4 g ammoniak (NH3)?
Van de volgende stoffen is telkens een gegeven bekend:
a HNO3: N = 2,41 · 1024 moleculen
b K2SO3: n = 1,5 mol
c NaCl: n = 3,2 mol
d H2O: m = 1 000,0 g
e C3H8: m = 176,0 g
Bereken van elke stof de ontbrekende grootheden: molaire massa (M), stofhoeveelheid (n), aantal deeltjes (N), massa (m).
Formule M( g mol ) n(mol) N(aantal deeltjes) m(g)
a HNO3 2,41 · 1024 b K2SO3 1,5 c
Bereken de massa van 0,200 mol stikstofgas.
Bereken de massa van 5,00 mol calciumsulfaat.
Hoeveel kaliumionen zijn aanwezig in 19,55 g kaliummetaal?
Hoeveel mol vertegenwoordigen 3,01 · 1024 elektronen? ` Meer oefenen? Ga naar .
Concentratie
van een oplossing
©VANIN
LEERDOELEN
Je kunt al:
L stofhoeveelheden omzetten naar de gevraagde eenheid en stoichiometrische hoeveelheden bepalen voor vaste stoffen.
Je leert nu:
L de verhoudingen en evenredigheden tussen massa’s, volumes en stofhoeveelheden gebruiken en molaire grootheden en concentraties beschrijven.
Alcoholgel wordt veel gebruikt voor het ontsmetten van de handen Om voldoende werkzaam te zijn, moet de hoeveelheid alcohol die wordt opgelost in de gel, een voldoende hoge concentratie hebben.
In een labo gaan we vaak stoffen oplossen in een oplosmiddel (meestal water), omdat ze dan beter reageren. Maar het aantal gram van de oplossing geeft niet de nodige informatie over de stofhoeveelheid van het opgeloste reagens. We moeten weten hoeveel mol of gram van de opgeloste stof er in de oplossing zit. In ons voorbeeld van de alcoholgel is de hoeveelheid alcohol (opgeloste stof) belangrijk, niet zozeer de hoeveelheid alcoholgel (oplossing). We willen weten hoeveel alcohol er in de alcoholgel zit, dus wat de concentratie aan alcohol is.
1 Wat is een concentratie van een oplossing?
Een oplossing is een hoeveelheid opgeloste stof in een hoeveelheid oplosmiddel. Neem het voorbeeld van een tas koffie waarin een klontje suiker wordt gebracht:
Het oplosmiddel is hier de koffie.
De opgeloste stof is de suiker.
De oplossing bestaat uit gesuikerde koffie.
Je weet natuurlijk al dat de koffie zoeter zal smaken naargelang je er 1, 2 of 3 klontjes suiker in oplost. Het is dus belangrijk om de concentratie van de oplossing goed te kennen. Als we de concentratie van de opgeloste stof willen kennen, dan moeten we de hoeveelheid van de opgeloste stof en de hoeveelheid oplossing kennen. Suiker, net als vele andere stoffen, kan in verschillende hoeveelheden opgelost worden in water. Niet alle stoffen zijn trouwens even goed oplosbaar in water. Daar komen we later op terug.

Afb. 57 Gesuikerde koffie is een oplossing.
De maximale oplosbaarheid kan sterk verschillen van stof tot stof. Ook voor stoffen die wel oplossen in water is de hoeveelheid stof die kan opgelost worden, niet onbeperkt. Vanaf een bepaalde concentratie treedt verzadiging op: extra toegevoegd zout zal dan niet meer oplossen maar bezinken in de oplossing.
OPDRACHT 9
Concentratie van oplossingen
©VANIN
Werkwijze
Je leerkracht maakt vier oplossingen van koper(II)sulfaat. Die oplossingen herkennen we aan de blauwe kleur.
1 gram CuSO4 wordt opgelost tot een volume van 0,05 L oplossing
1 gram CuSO4 wordt opgelost tot een volume van 0,1 L oplossing
2 gram CuSO4 wordt opgelost tot een volume van 0,05 L oplossing
2 gram CuSO4 wordt opgelost tot een volume van 0,1 L oplossing
bekerglas 1: 1 gram CuSO4 wordt opgelost tot een volume van 0,05 L oplossing
bekerglas 2: 1 gram CuSO4 wordt opgelost tot een volume van 0,1 L oplossing
bekerglas 3: 2 gram CuSO4 wordt opgelost tot een volume van 0,05 L oplossing
bekerglas 4: 2 gram CuSO4 wordt opgelost tot een volume van 0,1 L oplossing
Waarnemingen
Je merkt aan de helderblauwe kleur van de oplossing hoe geconcentreerd de oplossing is (hoe donkerder blauw, hoe hoger de concentratie CuSO4). Merk op dat de inhoud van bekerglas 1 en 4 dezelfde kleur hebben. Dat komt doordat voor die bekers de verhouding van de hoeveelheid opgeloste stof tot de hoeveelheid oplossing, de concentratie dus, gelijk is:
1 g CuSO4 0,5 L = 2 g CuSO4 1 L
Er zijn verschillende manieren om de concentratie van een oplossing uit te drukken, afhankelijk van in welke eenheid de hoeveelheid opgeloste stof wordt uitgedrukt. Zo kunnen we onze hoeveelheid CuSO4 uit het voorbeeld uitdrukken in gram of in mol. We spreken dan respectievelijk over de massaconcentratie (γ) en de molaire concentratie of stofhoeveelheidsconcentratie (c).
De verhouding tussen de hoeveelheid opgeloste stof (stofhoeveelheid n of massa m) en de hoeveelheid oplossing (V) noemen we de concentratie van de oplossing.
γ = m V met eenheid g L of c = n V met eenheid mol L
DEMO
2 Massaconcentratie
De SI-eenheid voor massaconcentratie is kg m3, maar doorgaans wordt er in het labo gebruiktgemaakt van de eenheid g L
Het begrip mol is natuurlijk niet bij iedereen bekend. Daarom staat voornamelijk op voedingswaren de hoeveelheid opgeloste stof vaak aangeduid in een aantal gram. Als we de hoeveelheid opgeloste stof in gram uitdrukken en de hoeveelheid oplossing in liter, bekomen we voor de concentratie een eenheid van g L , we spreken dan over de massaconcentratie. Zo zit in 1 glas cola van 250 mL maar liefst 27 gram suiker. De concentratie suiker is dus 27 g 250 mL of 108 g L .
VOORBEELDVRAAGSTUK

©VANIN
Bereken hoeveel kaliumchloride (KCl) je moet afwegen als je 3,5 liter oplossing wil maken met een concentratie van 60 g L .
Gegeven: V(oplossing) = 3,5 L
γ(KCl) = 60 g L
Gevraagd: m(KCl)
Oplossing:
γ = m V en dus m = γ · V m = 60 g L · 3,5 L = 21 · 10 g
Let op dat je bij vloeistoffen de dichtheid niet verwart met de massaconcentratie. Dichtheid heeft niets te maken met de concentratie van de opgeloste stof.
DICHTHEID MASSACONCENTRATIE
ρ = massa oplossing volume oplossing
γ = massa opgeloste stof volume oplossing
De verwarring tussen beide gebeurt omdat beide grootheden dezelfde eenheid kunnen hebben.
TIP
Afb. 58 Een glas cola bevat veel suiker.
OPDRACHT 10
Hoeveel gram keukenzout (NaCl) moet je afwegen om 200 mL oplossing te maken met een concentratie van 18 g L ?
Gegeven: γ(NaCl) = 18 g L
V = 200 mL = 0,200 L
Gevraagd: m(NaCl)
Oplossing:
3
Molaire concentratie of stofhoeveelheidsconcentratie
De SI-eenheid voor molaire concentratie is mol m3 , maar doorgaans wordt er in het labo gebruiktgemaakt van de eenheid mol L .
Chemici zullen de stofhoeveelheid altijd aanduiden met de eenheid mol. We zullen in het labo de concentratie van de oplossing daarom ook uitdrukken in het aantal mol opgeloste stof per liter oplossing: de molaire concentratie, stofhoeveelheidsconcentratie of molariteit van de oplossing
molaire concentratie = aantal mol opgeloste stof aantal liter oplossing
formule: c = n V
eenheid molaire concentratie: mol L of M
Opmerkingen
M is het symbool voor de eenheid van molaire concentratie. M is het symbool voor de grootheid molaire massa.
VOORBEELDVRAAGSTUK
We berekenen de molaire concentratie van suiker in cola. Uit het vorige voorbeeld weet je al dat een glas van 250 mL 27 gram suiker bevat.
Gegeven: V(oplossing) = 250 mL = 0,250 L m(suiker) = 27 g
Gevraagd: c
Oplossing: c = n(suiker) V(oplossing) en n (suiker) = m(suiker) M(suiker)
→ c = m(suiker) M(suiker) · V(oplossing) met M(suiker) = M(C12H22O11)
©VANIN
OPDRACHT 11
Een kok voegde 1,00 kg keukenzout toe bij de bereiding van 50 L soep in een grootkeuken. Bereken de molaire concentratie aan keukenzout.
Gegeven: m(NaCl) = 1,00 · 103 g
V = 50 L
Gevraagd: c(NaCl)
Oplossing:

OPDRACHT 12
Onderzoek nu zelf hoe je oplossingen maakt.
Ga naar en voer het labo uit.
ONDERZOEK aantal mol n
delen door molaire massa (g/mol)
oplossingen (c, V) aantal gram m n = N NA n = m M c = n V n = c · V
vermenigvuldigen met molaire massa (g/mol) m = n · M
N = n · NA
vermenigvuldigen met het getal van Avogadro (deeltjes/mol) delen door het getal van Avogadro (deeltjes/mol) aantal deeltjes N
De molaire concentratie of stofhoeveelheidsconcentratie c wordt berekend door de stofhoeveelheid uitgedrukt in mol (n) te delen door het volume oplosmiddel, uitgedrukt in L. c = n V
Om massaconcentratie om te zetten in molaire concentratie, moet de massa omgerekend worden naar aantal mol.
` Maak oefening 1 en 2 op p. 117.
VERDIEPING
Ga naar als je meer wilt ontdekken over oplossingen verdunnen en indampen.
Hoeveel gram natriumchloride moet je oplossen in water om 3,00 L van een oplossing van 2,00 mol L te bereiden?
Gegeven:
Gevraagd:
Oplossing:
200 mL van een natriumhydroxideoplossing bevat 2,00 g natriumhydroxide. Wat is de molaire concentratie (of stofhoeveelheidsconcentratie) van die oplossing?
Gegeven:
Gevraagd:
Oplossing:
` Meer oefenen? Ga naar .
Chemisch rekenen met gassen
©VANIN
LEERDOELEN
Je kunt al:
L stofhoeveelheden omzetten naar de gevraagde eenheid en stoichiometrische hoeveelheden bepalen voor vaste stoffen en vloeibare oplossingen.
Je leert nu:
L het verband gebruiken tussen de toestandsgrootheden druk, volume en absolute temperatuur om de toestand van een ideaal gas en de veranderingen ervan te beschrijven.

Bij sommige reacties reageren of ontstaan gassen. De massa van een gas is moeilijk te bepalen. We kunnen wel het volume van een gas meten, maar dat gasvolume is dan weer afhankelijk van de heersende temperatuur en druk. Hier zullen we rekening mee moeten houden bij de omzetting van de stofhoeveelheid naar de eenheid mol.
Uit het deeltjesmodel weet je al dat gassen bij een bepaalde druk en temperatuur een groter volume innemen per stofhoeveelheid dan vloeistoffen of vaste stoffen.
1 Het molaire gasvolume (onder normomstandigheden)
Ook het volume gas zullen we moeten omzetten naar een stofhoeveelheid, uitgedrukt in mol. Een gelijke molhoeveelheid van verschillende gassen neemt bij een gelijke druk en temperatuur hetzelfde volume in. Als we het volume van 1 mol gas kennen, het molaire gasvolume V m, (eenheid L mol), dan kunnen we het aantal mol gas berekenen door het volume gas te delen door het molaire gasvolume: n = V V m
Als we de stofhoeveelheid (aantal mol n) van een gas kennen, dan kunnen we door het omvormen van de formule ook het volume berekenen dat dat gas inneemt, zie afbeelding 59 op de volgende pagina.
V = n · V m
59 Molair gasvolume
We beschouwen een gas onder normomstandigheden (n.o.). We spreken over normomstandigheden als de temperatuur i = 0 °C en de druk p = 1 013 hPa. Het molaire gasvolume is dan steeds 22,4 L mol. Als we dat getal onthouden, is het eenvoudig om vraagstukken op te lossen waarbij de reactie onder normomstandigheden plaatsvindt. We kunnen dan schakelen tussen het volume van het gas en het aantal mol door gebruik te maken van dat molaire gasvolume: V m = 22,4 L mol waarbij n = V V m = V 22,4 L mol
VOORBEELDVRAAGSTUK
Bereken het volume van 15,0 g waterstofgas onder normomstandigheden.
Gegeven: m(H2) = 15,0 g n.o.
Gevraagd: V(H2)
Oplossing: n(H2) = m(H2) M(H2) = 15,0 g 2,0 g mol = 7,5 mol n.o. : V m = 22,4 L mol V = n · V m V(H2) = 7,5 mol ·
OPDRACHT 13
Bereken het volume van 25,0 g koolstofdioxidegas onder normomstandigheden.
Gegeven: m(CO2) = 25,0 g n.o.
Gevraagd: V(CO2)
Oplossing:
Gassen met een gelijke molhoeveelheid nemen bij een gelijke druk en temperatuur hetzelfde volume in: V = n · V m
delen door molaire massa (g/mol)
vermenigvuldigen met molaire massa (g/mol) m
` Maak oefening 1, 2 en 3 op p. 121.
oplossingen (c, V) gassen (V, Vm )
N = n · NA
vermenigvuldigen met het getal van Avogadro (deeltjes/mol)
delen door het getal van Avogadro (deeltjes/mol) aantal deeltjes N
Bereken het volume van 15,0 g waterstofgas onder normomstandigheden.
Gegeven:
Gevraagd:
Oplossing:
Bereken het volume van 25,0 g koolstofdioxidegas onder normomstandigheden.
Gegeven:
Gevraagd:
Oplossing:
Welk volume nemen 8,0 · 1026 moleculen stikstofgas in onder normomstandigheden?
Wat is de totale massa van die moleculen?
Gegeven:
Gevraagd:
Oplossing:
Meer oefenen? Ga naar .
CHEMISCH REKENEN
KERNBEGRIPPEN
KERNVRAGEN
©VANIN
NOTITIES
Hoofdstuk 1: Atoommassa, molecuulmassa, formulemassa gemiddelde relatieve atoommassa <A r > = het gewogen gemiddelde van alle relatieve atoommassa’s van de voorkomde isotopen
molecuulmassa = de massa van een molecule de relatieve massa van een molecule = de som van alle relatieve atoommassa's in de molecule
formulemassa = de relatieve massa van een formuleeenheid = de som van alle relatieve atoommassa's van de formule
stofhoeveelheid = uitdrukking voor de hoeveelheid van een stof, dat kan in aantal deeltjes, aantal gram of aantal mol.
A (massagetal) = Z (aantal protonen) + N (aantal neutronen)
GrootheidSymboolEenheid aantal deeltjes N deeltjes massa m g stofhoeveelheid n mol
Hoofdstuk 2: De mol en het getal van Avogadro constante van Avogadro = een grootheid
symbool: NA
eenheid: deeltjes mol
NA = de constante van Avogadro= 6,02 · 1023 deeltjes mol
Voordeel: 1 unit · NA= 1 g!
molaire massa = molecuulmassa of formulemassa, aangevuld met de eenheid g mol
Hoofdstuk 3: Concentratie van een oplossing
een oplossing = een hoeveelheid opgeloste stof in een hoeveelheid oplosmiddel
concentratie = de verhouding opgeloste stof per hoeveelheid oplossing ten opzichte van het totale volume van de oplossing
massaconcentratie γ = m V (eenheid: g L )
molaire concentratie of stofhoeveelheidsconcentratie c = n V (eenheid: mol L )
CHEMISCH REKENEN
KERNBEGRIPPEN
KERNVRAGEN
Hoofdstuk 4: Chemisch rekenen met gassen gasvolume onder normomstandigheden
i = 0 °C
NOTITIES
p = 1 013 hPa → molair gasvolume = 22,4 L mol
Gassen met een gelijke molhoeveelheid nemen bij een gelijke druk en temperatuur hetzelfde volume in.
V = n · V m
oplossingen (c, V)
delen door molaire massa (g/mol)
vermenigvuldigen met molaire massa (g/mol) m = n · M
= V V m
N = n · NA vermenigvuldigen met het getal van Avogadro (deeltjes/mol)
aantal deeltjes N
delen door het getal van Avogadro (deeltjes/mol)
bij n.o. Vm = 22,4 L bij n.o. 1 mol = 22,4 L
(V, Vm )
1 Begripskennis
Ik kan het verband aantonen tussen de relatieve en absolute massa van atomen.
Ik kan uitleggen met voorbeelden wat een mol materie is met behulp van de constante van Avogadro.
Ik kan het verband tussen stofhoeveelheid en molaire massa toepassen.
2 Onderzoeksvaardigheden
Ik kan het verband leggen tussen mol, molaire massa en molaire concentratie.
Ik kan op basis van een gegeven formule, uit een gegeven massa de stofhoeveelheid in mol berekenen en omgekeerd.
Ik kan de molecuulmassa van een molecuulverbinding of de formulemassa van een ionverbinding uit de atoommassa’s berekenen.
Ik kan de verhoudingen en evenredigheden tussen massa’s, volumes en stofhoeveelheden gebruiken en molaire grootheden en concentraties beschrijven
Ik kan het verband tussen stofhoeveelheid, molaire concentratie en massaconcentratie toepassen.
` Je kunt deze checklist ook op invullen.
JANOG OEFENEN
POLARITEIT EN OPLOSBAARHEID 04 THEMA
Eenden, pinguïns en heel wat andere vogels vertoeven een groot deel van hun leven op het water. Maar toch worden ze niet nat. Dat kun je mooi zien tijdens een regenbui: de waterdruppels glijden van hen af. Dat verschijnsel komt ook bij planten voor: ’s morgens of na een regenbui zie je overal druppels liggen op de bladeren. Als je de plant aanraakt, dan vallen ze er zo van af. Helaas heeft papier die eigenschap niet: het wordt meteen drijfnat.

` Hoe komt het dat de veren van sommige vogels geen water opnemen en papier wel?
` Hoe komt het dat waterdruppels gemakkelijk van een plant rollen?
` Kunnen we voorspellen welke stoffen water opnemen en welke niet?
` Kunnen we voorspellen welke stoffen in elkaar oplossen?
We zoeken het uit!
Polaire en apolaire bindingen en moleculen
LEERDOELEN
Je kunt al:
L uitleggen dat de binding tussen 2 niet-metalen een atoombinding is;

L de lewisstructuur van een molecule tekenen.
Je leert nu:
L dat er polaire en apolaire moleculen bestaan;
L het verschil tussen een polaire en een apolaire molecule bepalen.
1 Het dipoolkarakter van water
Een molecule is opgebouwd uit een bepaald aantal niet-metaalatomen, al dan niet van dezelfde soort. Die atomen zijn met elkaar verbonden door gemeenschappelijke elektronenparen. De symbolen van die atomen worden weergegeven in de formule en het aantal van elke soort wordt weergegeven door de index.
Ongeveer 70 % van het aardoppervlak is bedekt met water. Organismen bestaan bovendien voor een groot gedeelte uit water. Zonder water is er geen leven. Ook tijdens de chemielessen gebeuren heel wat experimenten in een waterige oplossing. Het is daarom belangrijk om even te kijken wat water zo speciaal maakt.
OPDRACHT 1
Invloed van een geladen staaf op een straal water en n-pentaan
Werkwijze
1 Je leerkracht vult een buret met n-pentaan (C5H12) en plaatst er een beker onder. Je leerkracht brengt negatieve ladingen aan op een kunststof lat of staaf door er met een wollen of zijden doek over te wrijven.
2 De leerkracht opent het kraantje en houdt de negatief geladen staaf naast de straal n-pentaan die uit de buret loopt.
3 Door papier te wrijven over een glazen staaf, ontstaat er een glasstaaf die positief geladen is. De leerkracht opent het kraantje en houdt de positief geladen staaf naast de straal n-pentaan die uit de buret loopt.
4 Je leerkracht brengt daarna achtereenvolgens een negatieve en een positieve staaf naast een waterstraal die uit een andere buret stroomt.
DEMO
OPDRACHT 1 (VERVOLG)
Waarnemingen
1 Teken op afbeelding 60 wat je ziet.
2 Vervolledig de waarnemingen.
Omcirkel het juiste antwoord.
Straal n-pentaan:
—negatief geladen staaf: de straal n-pentaan wordt NIET / WEL aangetrokken door de negatieve geladen staaf
—positief geladen staaf: de straal n-pentaan wordt NIET / WEL aangetrokken door de positief geladen staaf
Waterstraal:
—negatief geladen staaf: de waterstraal wordt NIET / WEL aangetrokken door de negatieve geladen staaf
—positief geladen staaf: de waterstraal wordt NIET / WEL aangetrokken door de positief geladen staaf
©VANIN
Tegengestelde ladingen trekken elkaar aan!
Of zoals het Engelse spreekwoord luidt: opposites attract

Water (H2O) is een molecule opgebouwd uit 2 waterstofatomen (H) en een zuurstofatoom (O). Watermoleculen zijn neutraal, wat wil zeggen dat een waterdeeltje niet negatief of positief geladen is. Toch worden watermoleculen aangetrokken door zowel negatieve als positieve ladingen. Dat kan worden verklaard doordat water zowel een positief geladen als een negatief geladen zijde of pool heeft:
—Als een positieve lading in de buurt wordt gebracht van een straal water, worden de negatieve zijden van alle watermoleculen aangetrokken. Hierdoor buigt de waterstraal zich naar de positieve lading.
—Als een negatieve lading in de buurt van een waterstraal wordt gebracht, dan trekt die de positieve zijde van alle watermoleculen aan, waardoor de straal ook naar de negatieve lading afgebogen wordt.
Omdat water gekenmerkt wordt door een negatieve pool en een positieve pool, is water een voorbeeld van een polaire molecule of een dipoolmolecule.
n-pentaan (C5H12) wordt niet aangetrokken door een positieve of negatieve lading, omdat ze geen positieve of negatieve zijde heeft. n-pentaan is dus een voorbeeld van een apolaire molecule
—Een molecule die zowel een positief geladen als een negatief geladen pool heeft, wordt een polaire molecule of een dipoolmolecule genoemd.
—Moleculen die geen positieve en negatieve pool hebben, worden apolaire moleculen genoemd.
Afb. 60 Invloed van een geladen staaf op n-pentaan en een straal water
buret gevuld
buret gevuld met n-pentaan geladen staaf
Afb 61 Watermoleculen zijn neutraal: ze zijn niet positief of negatief geladen.
TIP
Afb. 62 n-pentaan is een apolaire molecule.
2 De elektronegativiteit (verdieping)
TIP
De EN-waarde vind je terug op het PSE.
12 1,2
Of een molecule polair of apolair is, hangt af van de structuur van de molecule en de mate waarin de atomen in de molecule geneigd zijn om elektronen naar zich toe te trekken.
Sommige elementen (zoals metalen) staan liever elektronen af terwijl anderen (zoals niet-metalen) liever elektronen opnemen. Dat hangt af van een aantal eigenschappen zoals de grootte van de positieve kernlading, het aantal elektronen en de schikking van de elektronen op de schillen. Die factoren leiden tot een grotere of minder grote aantrekkingskracht op andere elektronen: de elektronegatieve waarde van een atoom.
De elektronegatieve waarde of de elektronegativiteit (EN) drukt uit in welke mate een element geneigd is om elektronen naar zich toe te trekken. De elektronegatieve waarde ligt tussen 0,7 en 4 en is een onbenoemd getal: ze heeft geen eenheid. Hoe groter de elektronegatieve waarde van een element, hoe sterker de neiging van een element om elektronen aan te trekken.
OPDRACHT 1
Zoek de EN-waarde op in je PSE en onderzoek het verband tussen de EN van een element en de plaats van een element op het PSE.
1 Vul de tabel aan met het element met de hoogste en laagste EN.
Element EN element met hoogste EN element met laagste EN
2 Zoek de EN op van de volgende elementen en orden ze volgens stijgende elektronegatieve waarde.
Br – O – N – W – At – Er
Element EN
OPDRACHT 2 (VERVOLG)
3 Bestudeer de EN-waarde van de verschillende elementen in eenzelfde groep. Wat stel je vast?
4 Bestudeer de EN-waarde van de verschillende elementen in eenzelfde periode. Wat stel je vast?
©VANIN
5 Noteer in de pijlen of de EN in de aangegeven richting stijgt of daalt op het PSE.
H Li Be Na Mg
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg
Fr Ra Ac Rf Db Sg Bh Hs Mt Ds Rg Cn
B C N O F Ne
Al- Si P S Cl- Ar
Ga Ge As Se Br Kr
In Sn Sb Te I Xe
TlNh Pb FlBi Mc Po Lv At Ts Rn Og
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lu Lr He
6 Bij sommige elementen op het periodieke systeem staat geen EN. Welke elementen zijn dat?
7 Verklaar waarom erbij die elementen geen EN-waarde staat.
8 Waar op het PSE staan dus de meest elektronegatieve elementen?
De elektronegatieve waarde of de elektronegativiteit (EN) is een onbenoemd getal dat weergeeft in welke mate een element geneigd is om elektronen naar zich toe te trekken.
` Maak oefening 1 en 2 op p. 135.
3 Polariteit van de binding (verdieping)
OPDRACHT 3
Beantwoord de vragen.
1 Zoek de EN op van elk element in deze stoffen.
EN(H) = EN(H) = EN(S) = EN(C) = EN(S) =
2 Bereken het verschil in EN (ΔEN) van de atomen die door een atoombinding met elkaar zijn verbonden.
∆EN = ∆EN =
3 Welke van de atomen die met elkaar zijn verbonden door een atoombinding, trekt het hardst aan het gemeenschappelijk elektronenpaar?
OPDRACHT 4
Wanneer 2 atomen met eenzelfde EN gebonden zijn door middel van een atoombinding, dan trekken beide atomen even hard aan de elektronen van de atoombinding. Het gemeenschappelijk elektronenpaar bevindt zich dan perfect tussen de 2 atoomkernen. Zo’n atoombinding noemen we een apolaire atoombinding
Het verschil tussen de EN van beide atomen (grootste EN – kleinste EN) duiden we aan met ΔEN
Onderzoek de eigenschappen van de atoombinding in HCl.
Waterstofchloride heeft als formule HCl. Het waterstofatoom is verbonden door een covalente binding met het chlooratoom.
1 Zoek de EN op van elk element in die en schrijf ze boven elk element.
EN(H) = EN(Cl) =
2 Bereken het verschil in EN van de elementen die met elkaar verbonden zijn door een atoombinding.
∆EN =
3 Welk element trekt het hardst aan de gemeenschappelijke elektronen van de atoombinding?
4 Zijn de elektronen positief of negatief geladen?
Afb. 63 Apolaire covalente binding
5 Vul aan:
Als de gemeenschappelijke elektronen van de atoombinding verschuiven in de richting van het element met de EN, dan wordt dat element gedeeltelijk geladen.

Als 2 atomen die verbonden zijn door een atoombinding, een verschillende elektronegatieve waarde hebben, dan zal het atoom met de hoogste EN het hardst aan de elektronen van de atoombinding trekken. Hierdoor zal het bindend elektronenpaar zich niet perfect in het midden tussen de 2 kernen bevinden, maar verschuiven naar het element met de hoogste elektronegativiteit. Een dergelijke atoombinding noemen we een polaire atoombinding
Doordat de elektronen van de atoombinding nu dichter bij het atoom met de hoogste EN liggen, wordt dat atoom gedeeltelijk negatief geladen. Maar omdat de elektronen van de atoombinding nog steeds gedeeld worden met het andere atoom, spreekt men van een negatieve deellading of een partieel negatieve lading. Die negatieve lading wordt aangeduid met het symbool δ-
Doordat de elektronen van de atoombinding nu het verst van het atoom met de laagste EN liggen, wordt dat atoom gedeeltelijk positief geladen. Omdat de elektronen van de atoombinding nog steeds gedeeld worden met het andere atoom, spreekt men van een positieve deellading of een partieel positieve lading. Die positieve lading wordt aangeduid met het symbool en δ+.
De grootte van de positieve en negatieve deelladingen rond een atoombinding neemt toe naarmate het verschil in EN van de atomen groter wordt.
EN(H) = 2,1EN(Cl) = 3,0 δ+ δ-
CI CICI H HH
Afb. 65 Door het verschil in EN tussen het element waterstof en chloor, verschuiven de elektronen van de atoombinding in de richting van het element chloor. Daardoor krijgt het element waterstof een partieel positieve lading en het element chloor een partieel negatieve lading.
Opgelet! De waarde ΔEN tussen de 2 elementen moet voldoende groot zijn om een polaire binding te hebben. Pas als het verschil in EN groter is dan 0,5 wordt van een polaire binding gesproken.
ΔEN < 0,5 → apolair
ΔEN > 0,5 → polair
Afb. 64 Polaire covalente binding
De waarde ΔEN geeft het verschil aan tussen de EN van de 2 atomen waartussen een atoombinding zich bevindt. Als ΔEN < 0,5, dan bevindt het bindend elektronenpaar van de atoombinding zich in het midden tussen de 2 kernen en spreken we van een apolaire covalente binding of een apolaire atoombinding
In een molecule ontstaat tussen 2 atomen een polaire atoombinding als ΔEN > 0,5. Het bindend elektronenpaar bevindt zich dan niet perfect tussen beide atoomkernen. Door de verschuiving van het bindend elektronenpaar, krijgt het atoom met de hoogste EN een negatieve deellading (δ-) en het atoom met de laagste EN een positieve deellading (δ+)
` Maak oefening 3 en 4 op p. 136.
4 Polariteit van moleculen (verdieping)
Als in een molecule enkel apolaire atoombindingen voorkomen, dan zijn er geen partiële ladingen aanwezig. De molecule bevat bijgevolg ook geen negatieve en positieve pool. Een molecule met alleen maar apolaire bindingen zal daarom altijd een apolaire molecule zijn.
Om na te gaan of een molecule een dipool is of niet, volg je het volgende schema:
Polaire bindingen aanwezig (ΔEN > 0,5)?
Apolaire molecule
Valt centrum positieve deelladingen samen met centrum negatieve deelladingen?
Let op: een molecule is pas een dipoolmolecule wanneer ze aan
2 voorwaarden voldoet:
1 Er moeten polaire bindingen aanwezig zijn.
2 De ladingscentra van de positieve en negatieve deelladingen mogen niet samenvallen.
Schema 3 Polaire of apolaire moleculen
VOORBEELD WATER (H2O)
De polaire molecule water
Water is opgebouwd uit 2 waterstofatomen en een zuurstofatoom. Net zoals andere moleculen heeft water een bepaalde ruimtelijke, driedimensionele structuur. De 3 atomen bevinden zich niet op een rechte lijn, maar de molecule is ‘geknikt’. De hoek tussen beide waterstofatomen bedraagt 104,5°.
©VANIN
EN (H) = 2,1
EN (O) = 3,5
Het zuurstofatoom heeft een hogere EN dan waterstof en trekt dus harder aan het gemeenschappelijk elektronenpaar van de atoombinding dan het waterstofatoom. Beide bindende elektronenparen verschuiven bijgevolg in de richting van het zuurstofatoom. Het zuurstofatoom krijgt hier tweemaal een negatieve deellading (2δ-), elk waterstofatoom krijgt een positieve deellading (δ+).
Doordat het centrum van de positieve deelladingen en het centrum van de negatieve deelladingen niet samenvallen, heeft de molecule een positieve en negatieve zijde. Water is dus een polaire molecule of dipool.
VOORBEELD KOOLSTOFDIOXIDE (CO2)
De apolaire molecule koolstofdioxide
Koolstofdioxide bestaat uit een koolstofatoom dat gebonden is aan 2 zuurstofatomen. Koolstof heeft de lineaire structuur (zie thema 02) en de 3 atomen bevinden zich op een rechte lijn. Omdat zuurstof een hogere EN (3,5) heeft dan koolstof (2,5) worden de gemeenschappelijke elektronenparen van de atoombindingen naar de zuurstofatomen toe getrokken. Alle atoombindingen zijn dus polair. Doordat de elektronen van de atoombindingen dichter bij zuurstof zitten dan bij koolstof, zijn de zuurstofatomen partieel negatief geladen en het koolstofatoom partieel positief.
De centra van de positieve deelladingen en negatieve deelladingen, of ladingswolken, vallen samen. Hoewel er dus polaire atoombindingen aanwezig zijn, is de molecule apolair
Afb. 68 Koolstofdioxide bevat polaire bindingen waardoor partiële ladingen ontstaan (blauw=positief, rood=negatief), maar de molecule is apolair omdat het centrum van de positieve ladingen samenvalt met het centrum van de negatieve ladingen.
Afb. 67 In een molecule water valt het centrum van de negatieve ladingen (rood) niet samen met het centrum van de positieve ladingen (blauw).
Afb. 66 De 3 atomen van de molecule water liggen niet op een rechte lijn. De molecule is geknikt.
Dipolen of polaire moleculen zijn neutrale moleculen met zowel een positief als een negatief geladen zijde. Die positief en negatief geladen zijden zijn een gevolg van de aanwezigheid van polaire atoombindingen én de ruimtelijke structuur van de molecule.
Als de molecule is opgebouwd uit 2 atomen die verbonden zijn door een polaire atoombinding, dan ontstaat er een molecule met aan de ene zijde een positieve (partiële) lading en aan de andere zijde een negatieve (partiële) lading: een dipool of polaire molecule.
In een molecule die 2 of meerdere polaire atoombindingen bevat, zullen meerdere atomen een positieve en/of negatieve partiële ladingen hebben. Valt het centrum van de negatieve deelladingen niet samen met het centrum van de positieve deelladingen, dan heeft de molecule een positieve en negatieve zijde en is ze een dipool. Vallen de centra van de positieve en negatieve deelladingen wél samen, dan is de molecule apolair omdat er geen positieve en negatieve pool aanwezig is.
Als een atoom elektronen van meerdere bindingen sterker naar zich toetrekt, dan noteren we een getal voor δ.- Een atoom dat, door zijn grotere EN-waarde, bijvoorbeeld de elektronen van 2 gebonden atomen naar zich toetrekt, zal zo een deellading 2δ- hebben. TIP
Afb. 69 Zoutzuur (HCl) is een polaire molecule. Ze heeft een positieve zijde (blauw) en een negatieve zijde (rood). H δ + δ
Cl
Ga op zoek naar de EN in je PSE.
a Zoek in het periodiek systeem op welk element de hoogste EN heeft.
b En welk(e) element(en) heeft de laagste EN?
c Orden de volgende elementen volgens stijgende EN:
Al – B – Ge – Ra
Vul de tabel aan.
a Orden de elementen volgens stijgende EN en noteer de EN ernaast in de tabel hieronder:
Al – Ca – Cl – F – H – K – Li – O – P
b Schrijf bij elk element of het een metaal of een niet-metaal is.
c Wat stel je vast als je de EN van metalen vergelijkt met dat van de niet-metalen?
Duid aan of de atoombinding tussen de volgende elementen polair of apolair is.
Elementen
C & H
H & S
C & O
O & N
S & O
P & H
Atoombinding
apolair polair
apolair polair
apolair polair
apolair polair
apolair polair
apolair polair
Met welk element uit de 7de groep kan koolstof een apolaire atoombinding vormen?
` Meer oefenen? Ga naar .
Eigenschappen van polaire en apolaire moleculen
LEERDOELEN
Je kunt al:
L bepalen of een atoombinding polair of apolair is.
Je leert nu:
L polaire en apolaire stoffen op basis van hun oplosbaarheid in water onderscheiden;
L het verband leggen tussen bindingstype en oplosbaarheid in water;
L de eigenschappen van een molecule afleiden uit het oplosgedrag in water;
L de geleidbaarheid van oplossingen verklaren;
L het verband geven tussen de zuurtegraad en de concentratie aan H3O+ in een oplossing.
1 Kook- en smelttemperatuur

Vorig jaar zijn de 3 aggregatietoestanden al aan bod gekomen. In een vaste stof zitten deeltjes op elkaar gestapeld, vaak op een zeer regelmatige manier in een rooster. Wanneer een vaste stof smelt, krijgen de deeltjes een hogere bewegingsvrijheid en rollen ze over elkaar. Als een vloeistof de kooktemperatuur bereikt, dan komen de deeltjes volledig los van elkaar en krijgen ze een nog grotere bewegingsvrijheid: ze gedragen zich nu als een gas. De aggregatietoestand van een stof bij een bepaalde temperatuur is deels een gevolg van de aantrekkingskrachten tussen de deeltjes waaruit ze is opgebouwd.
In de onderstaande tabel staan, per rij, telkens 2 stoffen met een gelijkaardige molaire massa (M). We vergelijken, per rij, het smelt-en kookpunt van die stoffen.
Tabel 6 De molaire massa en het smelt-en kookpunt van enkele stoffen
Als je het smelt- en kookpunt van 2 stoffen met dezelfde molaire massa vergelijkt, blijkt dat polaire moleculen een hoger smelt- en kookpunt hebben dan apolaire moleculen. Dat komt doordat polaire moleculen elkaar onderling aantrekken (de positieve pool trekt de negatieve pool van een andere molecule aan, en omgekeerd), waardoor het meer energie kost om ze een grotere bewegingsvrijheid te geven dan apolaire moleculen, die elkaar onderling nauwelijks aantrekken.
Het smelt- en kookpunt van polaire moleculen ligt hoger dan dat van apolaire moleculen met dezelfde molaire massa.
2 Oplosbaarheid
OPDRACHT 5
Oplosbaarheid van di-jood en glucose
Werkwijze
1 De leerkracht vult drie reageerbuizen voor 1/3 met water en drie reageerbuizen voor 1/3 met pentaan. Di-jood is een apolaire stof.
2 De leerkracht laat een stukje di-jood vallen in een proefbuis met water en een proefbuis met pentaan.
3 De leerkracht voegt vervolgens wat glucose (een stof opgebouwd uit polaire moleculen) toe aan een proefbuis met water en een proefbuis met pentaan.
4 In de laatste proefbuis met water en proefbuis met pentaan voegt de leerkracht enkele kristallen toe van de ionverbinding kopersulfaat (CuSO4).
Waarnemingen
De apolaire molecule I2 lost op in een apolair oplosmiddel zoals pentaan, maar niet in een polair oplosmiddel zoals water. Polaire moleculen zoals glucose lossen op in polaire oplosmiddelen zoals water, en niet in apolaire oplosmiddelen.
We zien dat apolaire stoffen oplossen in apolaire oplosmiddelen, en polaire stoffen in polaire oplosmiddelen. Of met andere woorden: soort zoekt soort. Dat gedrag van de stoffen kun je verklaren op basis van de eigenschappen van de molecule. Je weet al dat tegengestelde elektrische ladingen elkaar aantrekken. Wanneer een stof opgebouwd uit polaire moleculen in water terechtkomt, wordt hun negatieve pool aangetrokken door de positieve pool van water en omgekeerd. De deeltjes kunnen zich op die manier tussen de moleculen water plaatsen.
©VANIN
Afb 71 Polaire moleculen lossen op in polaire oplosmiddelen, omdat tegengesteld geladen polen van oplosmiddel en opgeloste stof elkaar aantrekken.
In een apolair oplosmiddel trekken de deeltjes van de polaire stof elkaar alleen onderling aan, waardoor ze niet tussen de moleculen van het oplosmiddel komen te zitten.
Afb. 72 Omdat de dipoolinteracties sterker zijn dan de Londonkrachten tussen apolaire oplosmiddelen, lossen polaire moleculen niet op in apolaire oplosmiddelen zoals n-pentaan.
Apolaire moleculen lossen op in apolaire oplosmiddelen omdat ze geen positieve en negatieve zijde hebben. Zij kunnen zich gemakkelijk begeven tussen de moleculen van een apolair oplosmiddel, die elkaar onderling ook nauwelijks aantrekken. Apolaire moleculen kunnen zich niet plaatsen tussen moleculen van water, omdat die polaire moleculen elkaar hard aantrekken.
Afb. 73 Door de sterke onderlinge aantrekking van de watermoleculen kunnen apolaire moleculen er niet tussen.
OPDRACHT 6
Omgekeerd kun je die eigenschap gebruiken om na te gaan of een molecule polair of apolair is: als een stof oplost in water, is ze opgebouwd uit polaire moleculen; als een stof oplost in een apolair oplosmiddel, is ze opgebouwd uit apolaire moleculen.
Ionverbindingen lossen op in een polair oplosmiddel zoals water. Dat is het gevolg van watermoleculen die zich met hun positieve en negatieve zijde rond respectievelijk negatieve en positieve ionen schikken en een watermantel vormen, waardoor de ionen loskomen uit hun ionrooster. Dat loskomen van de ionen uit hun rooster in water wordt dissociatie genoemd.
Bekijk de video over het oplossen van een zout.
Formuleer in verschillende stappen het oplosproces van een ionverbinding.
De ionen zijn al aanwezig en zitten met ionkrachten stevig vast in het ionrooster. Als het zout oplost, dan komen de ionen los uit het rooster en dissocieert het zout.
1 Watermoleculen richten zich met hun positieve pool naar .
2 Andere watermoleculen richten zich met hun negatieve pool naar .
3 Als de watermoleculen de ionen kunnen lostrekken, komen en valt het kristal uiteen.
4 Doordat de ionen zich omgeven met een , ontstaan er gehydrateerde . Dat verschijnsel heet
Ionverbindingen zijn al opgebouwd uit ionen voordat ze oplossen in water. Het oplosproces in water is een .
De dissociatie van een zout kun je voorstellen door de dissociatievergelijking. Die vergelijking wordt opgesteld door links van de reactiepijl de formuleeenheid van de ionverbinding te noteren en rechts van de reactiepijl de soorten ionen. Het aantal van de verschillende ionen in de formule-eenheid, schrijven we als coëfficiënt in de vergelijking. Boven de reactiepijl schrijven we H2O, omdat het die molecule is die het ionrooster dissocieert.
De aggregatietoestand wordt in de reactie-vergelijking als subscript bij de verschillende deeltjes gemeld. Daarbij gebruiken we de volgende notaties: (s) of (v): vaste toestand (l) of (vl): vloeibare toestand (g): gasvormige toestand (aq): gehydrateerd ion, opgelost in water
OPDRACHT 7
Noteer de dissociatievergelijking van het onderstaande zout.
Bij a is de vergelijking al gegeven als voorbeeld.
a aluminiumchloride: AlCl3 (s) Al3+(aq) + 3 Cl-(aq)
b natriumhydroxide:
De oplosbaarheid van een moleculaire verbinding hangt af van de aard van de verbinding en het oplosmiddel: —Polaire moleculen lossen op in polaire oplosmiddelen. —Apolaire moleculen lossen op in apolaire oplosmiddelen.
Door interactie tussen de watermoleculen en de ionen van een zout komen de ionen los uit het ionrooster. Dat verschijnsel noemen we dissociatie. Het wordt voorgesteld door een dissociatievergelijking.
` Maak oefening 1 t/m 4 op p. 149.
TIP

Zijn je handen vettig van een afgevallen fietsketting?
Dat krijg je niet schoon met water. Vetten zijn apolair en je weet inmiddels dat apolaire stoffen niet oplossen in water. Vuil dat bestaat uit apolaire stoffen, spoel je niet zomaar weg met water, dus heb je zeep of een detergent nodig.
Een molecule zeep of detergent is opgebouwd uit een lang, apolair staartdeel en een polaire/geladen kop:
kop
Afb. 74 De lange staart van een zeepmolecule bestaat uit C- en H-atomen en is apolair. De kop van de molecule is opgebouwd uit een -COO- groep en lost op in water.
Wanneer zeep wordt opgelost in water, zullen de apolaire staarten van de zeepmoleculen oplossen in het vet. De polaire kopjes van de zeepmoleculen blijven buiten het apolaire vuil zitten (zie afbeelding 75). Wanneer je de handen gaat spoelen met water, trekken de watermoleculen aan de polaire koppen. Zo komt het deeltje vuil los.
Apolaire staarten lossen op in vet. De polaire/geladen kopjes blijven opgelost in water en helpen om het apolaire vuil los te maken van het oppervlak.
apolaire staart
zeepmolecule polaire/ geladen kop
Afb. 75 De werking van zeep vet oppervlak
3 Geleidbaarheid van een waterige oplossing
OPDRACHT 8
De leerkracht test de geleidbaarheid van oplossingen in water met een opstelling.
zuiver water vaste suiker
oplossing van suiker in water zuiver azijnzuur
oplossing van azijnzuur in water vast keukenzout oplossing van keukenzout in water
©VANIN
In de fysica heb je wellicht al gezien dat een elektrische stroom een verplaatsing is van geladen deeltjes. Vorig jaar leerde je bij enkelvoudige stoffen dat de metalen en grafiet (C) de elektrische stroom geleiden. Zuiver water geleidt de elektrische stroom niet, omdat de moleculen water ongeladen zijn. Suikermoleculen zijn polaire moleculen, omdat ze oplossen in water. Omdat de suikermoleculen elektrisch neutraal zijn, geleidt de suikeroplossing de elektrische stroom niet. Net als suiker bestaan zuren zoals azijnzuur en zoutzuur uit ongeladen moleculen. Daarom geleidt zuiver azijnzuur de elektrische stroom niet. Maar een oplossing van azijnzuur blijkt de elektrische stroom wel te geleiden. Dat betekent dat er in een oplossing van azijnzuur in water elektrisch geladen deeltjes of ionen zijn ontstaan. Het verschijnsel waarbij er ionen ontstaan uit moleculen, heet ionisatie.
Als een zuur oplost in water, trekt de negatieve pool van de watermolecule zo hard aan de waterstof van het zuur dat het gescheiden wordt van beide elektronen van de atoombinding. Op die manier wordt de zuurmolecule gesplitst in een proton of positief waterstofion (H+) en een negatief geladen zuurrestion. Het waterstofion wordt gebonden op een watermolecule en vormt zo een hydroxoniumion (H3O+).
DEMO
OPDRACHT 9
Formuleer in verschillende stappen de ionisatie van een zuur. H 2 O H Z
1 De ionen zijn nog in de molecuulstructuur van het zuur voordat het in water oplost.
2 De zuurmolecule met een polaire atoombinding wordt omgeven door .
3 De watermoleculen trekken met hun negatieve zijde een proton (H+) van het zuur aan. Beide elektronen van de atoombinding .
4 Het proton wordt gebonden op waardoor ontstaan.
Het zuur valt uiteen in een en een . We spreken van .
OPDRACHT 10
Stel de ionisatievergelijkingen voor.
Zoutzuur heeft als formule HCl.
Als je zoutzuur oplost in water, dan wordt de atoombinding tussen waterstof en chloor verbroken.
OCI H HH +
1 Teken de deeltjes die ontstaan door reactie tussen de zuurmolecule en de watermolecule.
2 Benoem de deeltjes die ontstaan door die reactie.
3 Schrijf de ionisatievergelijking van zoutzuur.
Als een zuur meerdere waterstofatomen bevat, kunnen elk van de waterstofatomen als protonen van het zuur verwijderd worden. De negatieve lading van het zuurrestion is gelijk aan het aantal protonen dat werd afgesplitst van het zuur. TIP
De ionisatie van een zuur kun je voorstellen door de ionisatievergelijking. Die vergelijking wordt opgesteld door links van de reactiepijl de formule van water en het zuur te schrijven en rechts van de reactiepijl de ionen die ontstaan. Dat zal altijd H3O+ zijn en een zuurrest, die een H+ minder heeft dan het zuur.
Bijvoorbeeld: HNO3 + H2O → NO3- + H3O+
Ionverbindingen zijn opgebouwd uit elektrisch geladen deeltjes: positieve en negatieve ionen. Vaste zouten geleiden de elektrische stroom niet, omdat de ionen vastzitten op punten in een rooster. Ze kunnen dus niet bewegen. Eerder zag je dat (sommige) ionverbindingen oplossen in water: door dissociatie komen de positieve en negatieve ionen los, waardoor ze zich kunnen verplaatsen door het oplosmiddel. Dat verklaart waarom een oplossing van een zout de elektrische stroom geleidt.
Stoffen die in oplossing de elektrische stroom geleiden, zoals zuren en oplosbare ionverbindingen, noemen we elektrolyten. Stoffen die wel oplossen, maar geen ionen vormen, zoals suiker, geven geen aanleiding tot een oplossing die de elektrische stroom geleidt. Dergelijke stoffen noemen we niet-elektrolyten.
©VANIN
Elektrolyten zijn stoffen waarvan een oplossing de elektrische stroom wel geleidt. Zuren zijn elektrolyten, want ze ioniseren: tijdens het oplossen ontstaan er ionen (zuurrest en H3O+) uit de neutrale moleculen. Oplosbare ionverbindingen zijn elektrolyten omdat ze dissociëren: de ionen komen los uit het ionrooster.
Stoffen waarvan een oplossing de elektrische stroom niet geleidt, zijn niet-elektrolyten.
` Maak oefening 5 t/m 9 op p. 149-151.
In de chemie betekent ‘oplossen’ dat twee stoffen een homogeen mengsel vormen. Als oplosmiddel wordt meestal water gebruikt.
Het oplossen van een stof in water kan betekenen dat: aanwezige ionen loskomen uit het ionrooster (dissociëren), zoals een oplossing van een ionverbinding; moleculen van de opgeloste stof onveranderd mengen met de moleculen van het oplosmiddel, zoals een oplossing van suiker in water; moleculen worden gesplitst in ionen (ioniseren), zoals een oplossing van een zuur.
TIP
4 Verband tussen zuurtegraad en concentratie protonen
Je zag al dat dipoolmoleculen elkaar onderling aantrekken. Nu en dan zullen watermoleculen, net zoals zuren, ioniseren. Als een watermolecule stuk wordt getrokken, ontstaat zowel een hydroxoniumion (H3O+) als een hydroxide-ion (OH-). We noemen dat de auto-ionisatie van water.
©VANIN
TIP
Als je de concentratie van een stof wilt geven in mol L , dan plaats je de stof tussen vierkante haakjes. [H3O+] betekent ʻde concentratie van H3O+ʼ.
OPDRACHT 11
ONDERZOEK
Nauwkeurige metingen tonen aan dat in 1 L zuiver water, zich 10-7 mol H3O+- en 10-7 mol OH--ionen bevinden.
In zuiver water geldt: concentratie H3O+ = concentratie OH[H3O+] = [OH-]
Een oplossing waar de concentratie aan H3O+ gelijk is aan de concentratie aan OH-, noemen we een neutrale oplossing.
Onderzoek het verband tussen de zuurtegraad en de hoeveelheid van bepaalde ionen.
Benodigdheden
Materiaal
1 beker
digitale pH-meter
Werkwijze
Stoffen
een paar druppels azijn natriumhydroxide (0,1 mol L )
1 Neem een beker en vul die met gedemineraliseerd water.
VEILIGHEIDSVOORSCHRIFT !
Check steeds goed de veiligheidsmaatregelen en gevaren van alle stoffen en materialen.
2 Meet de pH met de digitale pH-meter en noteer je waarneming.
3 Voeg enkele druppels azijn toe aan het water en meet de pH opnieuw.
4 Voeg een extra hoeveelheid azijn toe en meet de pH opnieuw.
5 Maak de beker leeg en spoel het grondig.
6 Spoel de elektroden van de digitale pH-meter af.
7 Vul de beker met gedemineraliseerd water.
8 Voeg enkele druppels van de NaOH-oplossing toe, roer en lees de pH opnieuw af.
9 Voeg nog enkele druppels van de NaOH-oplossing toe, roer en lees de pH van de oplossing opnieuw af.
OPDRACHT 11 (VERVOLG)
Waarnemingen
ONDERZOEK
a pH van gedemineraliseerd water:
b pH van een oplossing met azijnzuur:
c pH van een oplossing met meer azijnzuur:
d pH van een oplossing met NaOH:
e pH van een oplossing met meer NaOH:
Verwerking
—In een neutrale oplossing zijn naast watermoleculen positieve en negatieve aanwezig.
—Wanneer zuren oplossen in water, ze in een negatief en een positief . Als een zuur oplost in water, verhoogt de concentratie aan HYDROXONIUMIONEN / HYDROXIDE-IONEN in de oplossing. De pH van een dergelijke oplossing wordt dan
—Wanneer hydroxiden oplossen in water, ze in positieve en negatieve . Hierdoor verhoogt de concentratie aan HYDROXONIUMIONEN / HYDROXIDE-IONEN in de oplossing. De pH van een dergelijke oplossing wordt dan
Besluit
—Een oplossing met meer hydroxoniumionen dan een neutrale oplossing heeft een pH KLEINER / GROTER dan 7.
—Een oplossing met meer hydroxide-ionen dan een neutrale oplossing heeft een pH KLEINER / GROTER dan 7.
©VANIN
WEETJE
Naast de pH is er ook de pOH. De pOH geeft weer hoe basisch de oplossing is. Ze kan worden berekend volgens de formule:
[OH ] = 10-pOH
In zuiver water is ook de pOH gelijk aan 7.
Als de concentratie aan H3O+ stijgt (en groter wordt dan de concentratie aan OH-), ontstaat een zure oplossing. Als de concentratie aan OH- stijgt (en groter wordt dan de concentratie aan H3O+), ontstaat een basische of alkalische oplossing.
De zuurtegraad of de pH geeft weer hoe zuur een oplossing is en hangt af van de concentratie aan H3O+ -en OH--ionen. De zuurtegraad wordt berekend op basis van de concentratie aan H3O+ in de oplossing volgens:
[H3O+] = 10-pH
Omdat de concentratie aan [H3O+] in zuiver water gelijk is aan 10-7 mol L , is de pH van zuiver water gelijk aan 7.
In oplossingen blijkt er steeds een verband te bestaan tussen de concentratie aan hydroxide-ionen en het aantal hydroxoniumionen, namelijk:
[H3O+] · [OH ] = 10-14 mol2 L2
Dat betekent dat de concentratie hydroxoniumionen stijgt als de concentratie aan hydroxide-ionen daalt en omgekeerd.
Als zuren oplossen in water, dan ioniseert het zuur waardoor de concentratie aan H3O+ stijgt. Als de concentratie aan hydroxoniumionen groter wordt dan 10-7 mol L , wordt de pH kleiner dan 7.
0 1 pH
H 3 O+ (mol/L) concentratie aan
maagzuur1 10–1 citroenzuur2 10–2
cola3 10–3
tomaten
koffie5 10–5
urine6 10–6
gedestilleerd water7 10–7
menselijk bloed8 10–8
oplossing van bakpoeder9 10–9
broccoli10 10–10
zeep
bleekmiddel 11 10–11 12 10–12
neutraal meer basisch meer zuur 4 10–4
schoonmaakproduct oven13 10–13 14 10–14
Afb. 77 Het verband tussen de concentratie van protonen en de pH
WEETJE
Omdat de concentratie van de hydroxoniumionen van de meeste oplossingen tussen 1 (= 100) en 10-14 mol L ligt, ligt de pH van de meeste oplossingen tussen 0 en 14. Wanneer de concentratie aan hydroxoniumionen groter is dan 1 mol L , zal de pH kleiner zijn dan 0.
Als ze kleiner is dan 10-14 mol L , dan zal de pH groter zijn dan 14. Die oplossingen zijn extreem zuur of alkalisch, en dus zeer gevaarlijk.
©VANIN
—De zuurtegraad of pH hangt af van de concentratie aan H3O+ en OH-.
—In een neutrale oplossing, zoals zuiver water, is de concentratie van beide ionen gelijk aan elkaar.
—Zure oplossingen hebben een pH < 7 omdat [H3O+] > [OH-].
—Basische oplossingen hebben een pH > 7 omdat [H3O+] < [OH-].
` Maak oefening 10 op p. 152.
Geef de dissociatievergelijking van de volgende ionverbindingen.
a natriumfluoride
b Mg(NO3)2
c aluminiumsulfide
d kaliumcarbonaat
e K2SO4
Je gooit enkele kristallen keukenzout (NaCl) in een proefbuis met water en enkele kristallen in een oplossing met n-pentaan (apolair oplosmiddel). Je controleert of beide oplossingen de stroom geleiden. Wat zal het resultaat zijn en hoe kun je het resultaat verklaren?
Je giet een kleine hoeveelheid water en een kleine hoeveelheid maïsolie (apolair) in een reageerbuis. Maïsolie heeft een kleinere massadichtheid dan water. Je laat een druppel inkt vallen in de proefbuis. Het water kleurt blauw, de maïsolie niet. Is inkt een mengsel opgebouwd uit polaire of apolaire moleculen?
Kun je een pan waarin je spek hebt gebakken proper maken met alleen maar water? Verklaar je antwoord.
Schrijf de ionisatievergelijking van de volgende stoffen: a ammoniak (NH3)
b waterstofjodide
c zwavelzuur
d fosforzuur
e water (auto-ionisatie)
Geef van de volgende stoffen de splitsing in ionen.
Stof (naam)
magnesiumnitraat
bariumhydroxide
natriumcarbonaat kaliumfosfaat
aluminiumnitraat kaliumhydroxide
lithiumnitraat
kopersulfaat ijzerdihydroxide zilverchloride
Dissociatievergelijking
Ondergaan de volgende stoffen in water een dissociatie- of een ionisatieproces? Plaats een kruisje in de juiste kolom.
Stof (naam)
magnesiumchloridezout
kaliumchloraat zout
waterstofsulfaatzuur
Stofklasse
kaliumhydroxidehydroxide
magnesiumcarbonaatzout
waterstofnitraat zuur
natriumnitraat zout
calciumfosfaat zout
waterstofcarbonaatzuur
waterstofchloridezuur
Dissociatie
Ionisatie
Zijn de volgende stoffen een elektrolyt of een niet-elektrolyt? Plaats een kruisje in de juiste kolom. Geef ook telkens de stofklasse en de chemische formule.
Stof (naam) ElektrolytNiet-elektrolytStofklasse Chemische formule
koolstofdioxide
magnesiumchloride
distikstofpentaoxide
waterstofnitraat
zinkdichloride
ijzerdibromide
kaliumsulfaat
zuurstofgas
waterstofsulfide
koperchloride
Welke uitspraken gelden voor de volgende stoffen? Duid telkens met een kruisje de juiste antwoorden aan.
Natriumchloride
Waterstofchloride
Het is een ionverbinding, die oplost in water.
Het is een atoomverbinding, die oplost in water.
Als het in oplossing splitst in ionen, is dat een dissociatieproces.
Als het in oplossing splitst in ionen, is dat een ionisatieproces.
Het is een ionverbinding, die oplost in water.
Het is een atoomverbinding, die oplost in water.
Als het in oplossing splitst in ionen, is dat een dissociatieproces.
Als het in oplossing splitst in ionen, is dat een ionisatieproces.
Natriumhydroxide
Het is een ionverbinding, die oplost in water.
Het is een atoomverbinding, die oplost in water.
Als het in oplossing splitst in ionen, is dat een dissociatieproces.
Als het in oplossing splitst in ionen, is dat een ionisatieproces.
Je meet de pH-waarde van 3 vloeistoffen in een maatbeker. De pH van de vloeistof in de eerste maatbeker bedraagt 5, van de vloeistof in de tweede maatbeker 7 en van de derde maatbeker 11,4.
In welke maatbeker:
a bevinden zich hydroxoniumionen?
b bevinden zich hydroxide-ionen?
c is de concentratie hydroxoniumionen groter dan 107 mol L ?
d is de concentratie aan hydroxide-ionen kleiner dan 107 mol L ?
` Meer oefenen? Ga naar .
KERNBEGRIPPEN
KERNVRAGEN
POLARITEIT EN OPLOSBAARHEID
NOTITIES
Hoofdstuk 1: Polaire en apolaire bindingen en moleculen
Een molecule die zowel een positief geladen als een negatief geladen pool heeft, wordt een polaire molecule of een dipoolmolecule genoemd.
Moleculen die geen positieve en negatieve pool hebben, worden apolaire moleculen genoemd. Water is een polaire molecule.
Polaire stoffen lossen op in polaire oplosmiddelen, en apolaire stoffen in apolaire oplosmiddelen.
Hoofdstuk 2: Eigenschappen van polaire en apolaire moleculen
Eigenschappen zoals het kookpunt en smeltpunt van een stof hangen af van de massa van de moleculen en de intermoleculaire krachten:
dissociatie: het verbreken van ionbindingen bij oplossen
hydratatie: ionen worden omringd door watermoleculen
dissociatievergelijking: vergelijking die de dissociatie voorstelt
elektrolyt: stof die in opgeloste toestand de elektrische stroom geleidt
ionisatie: een molecule die oplost wordt stukgetrokken in ionen.
ionisatievergelijking: vergelijking die ionisatie van een molecule voorstelt.
—Bij dissociatie van een zout komen de positieve en negatieve ionen vrij. De ionen worden hierbij gehydrateerd = ze worden omringd door watermoleculen.
—Sommige ionverbindingen zijn goed oplosbaar in water, andere zijn slecht oplosbaar. Zo dissociëren sommige zouten bijna niet: ze zijn slecht oplosbaar.
—De dissociatie kan voorgesteld worden door een dissociatievergelijking.
—Omdat in een oplossing van een ionverbinding ionen aanwezig zijn, zijn ionverbindingen elektrolyten.
—Als een zuur ioniseert in water, dan ontstaat er een hydroxoniumion (H3O+) en een negatieve zuurrest (Z-).
—Als ammoniak (NH3) ioniseert in water, dan ontstaat ammonium (NH4+) en hydroxide (OH-).
—Stoffen die ioniseren in water, zijn elektrolyten.
—De ionisatie kan voorgesteld worden door een ionisatievergelijking.
—Sommige moleculen lossen op in water maar ioniseren niet. Dat zijn niet-elektrolyten.
KERNBEGRIPPEN
KERNVRAGEN
POLARITEIT EN OPLOSBAARHEID
NOTITIES
Hoofdstuk 2: Eigenschappen van polaire en apolaire moleculen zuurtegraad of pH: maat voor de concentratie aan hydroxoniumionen in een oplossing
—De zuurtegraad houdt verband met de concentratie aan hydroxoniumionen in een oplossing:
• neutrale oplossing:
pH = 7
[H3O+] = [OH-] = 10-7 mol L
• zure oplossing
pH < 7
[H3O+] > 10-7 mol L
• basische oplossing
pH > 7
[H3O+] < 10-7 mol L
JANOG OEFENEN
1 Begripskennis
—Ik kan beschrijven wat een polaire en apolaire atoombinding is.
—Ik kan beschrijven wat een polaire en apolaire molecule is.
—Ik kan uitleggen hoe het proces van dissociatie, ionisatie en hydratatie gebeurt.
—Ik kan aangeven wat elektrolyten en niet-elektrolyten zijn.
—Ik kan de oplosbaarheid van zouten, polaire en apolaire stoffen in polaire en apolaire oplosmiddelen toelichten.
—Ik kan het verschil aangeven tussen zure, neutrale, basische oplossing in termen van de concentratie aan H3O+-ionen en OH--ionen.
2 Onderzoeksvaardigheden
—Ik kan de dissociatie van een ionverbinding en ionisatie van een molecule voorstellen door middel van een dissociatie- of ionisatievergelijking.
—Ik kan beschrijven hoe de ionisatie van zuren verloopt.
—Ik kan verklaren waarom oplossingen van zouten en zuren de stroom geleiden.
` Je kunt deze checklist ook op invullen.
REACTIESOORTEN 05 THEMA
Bosbranden komen regelmatig in het nieuws. Vaak zijn ze moeilijk onder controle te krijgen. Je weet ondertussen al dat een verbranding een chemische reactie is tussen bijvoorbeeld een koolstofverbinding en zuurstofgas, waarbij een van de eindproducten koolstofdioxide is. Maar over welke soort chemische reactie gaat het hier specifiek?

` Kunnen we chemische reacties nog verder onderverdelen?
` Hoe noteren we die chemische reacties?
` Welke specifieke kenmerken hebben die soorten chemische reacties?
We zoeken het uit!
Soorten chemische reacties
LEERDOELEN
Je kunt al:
L het oxidatiegetal van een element bepalen;

L het onderscheid maken tussen een chemisch en een fysisch proces;
L ionisatie- en dissociatievergelijkingen van stoffen in water schrijven;
L zuur-base-indicatoren gebruiken;
L een zure, basische en neutrale oplossing van elkaar onderscheiden.
Je leert nu:
L een chemische reactie classificeren als redoxreactie of ionuitwisselingsreactie;
L een chemische reactie classificeren als een neerslag-, gasontwikkelings- of neutralisatiereactie.
Je kent ondertussen het verschil tussen chemische en fysische reacties. Een chemisch proces (of een chemische reactie) is een reactie waarbij na de reactie andere stoffen worden gevormd. Een fysisch proces is een proces waarbij de beginstoffen achteraf opnieuw terug te vinden zijn. In de lessen fysica ga je verder onderzoeken hoe zo’n fysisch proces werkt. In dit hoofdstuk leer je hoe je chemische reacties nog verder kunt onderverdelen.
We kunnen chemische reacties nog verder onderverdelen.
Een mogelijke, veel gebruikte onderverdeling is de verdeling op basis van een verandering van de oxidatiegetallen van de elementen. We bekijken dit even aan de hand van enkele chemische reacties, waarbij we de oxidatiegetallen van de elementen in de stoffen bepalen:
De reactie tussen bakpoeder en zoutzuur

+ HCl → H2O + CO2 + NaCl
OPDRACHT 1

Het roesten van ijzeren nagels 2
4 Fe + 3 O2 + 6 H2O → 4 Fe(OH)3
OG: 0 0 +I -II +III -II +I

De verbranding van methaan 3
CH4 + O2 → CO2 + H2O
OG: -IV +I 0 +IV -II +I -II
De vorming van stalagtieten en stalagmieten
4

Ca(HCO3)2 → CaCO3 + H2CO3
OG: +II +I +IV -II +II +IV -II +I +IV -II
Als we reactie 2 en 3 bekijken, dan zien we dat sommige elementen van oxidatiegetal veranderen. Zo is in reactie 2 het oxidatiegetal van ijzer voor de reactie nul, terwijl het na de reactie gelijk is aan +III. Het element zuurstof heeft een oxidatiegetal 0 voor de reactie, maar een oxidatiegetal –II na de reactie. We noemen dat soort chemische reacties redoxreacties. Bij een redoxreactie hoeven niet alle elementen van een oxidatiegetal te veranderen. Zo wijzigt het OG van het element H in reactie 2 niet.
Bij reactie 1 en 4 zien we dat het oxidatiegetal van elk van de elementen, voor en na de reactie, niet verandert. Zo is het oxidatiegetal van natrium in de stof NaHCO3 en in de stof NaCl gelijk aan +I. En dat geldt voor alle elementen in deze reacties. Er worden echter wel nieuwe (andere) stoffen gevormd. We noemen dat ionuitwisselingsreacties
Bekijk volgende chemische reacties.
a Bepaal in kolom 1 de oxidatiegetallen van alle elementen in de reactievergelijking.
b Noteer in kolom 2 of het hier gaat om een ionuitwisselingsreactie of redoxreactie.
Reactievergelijking
2 Fe + O2 + 2 H2O → 2 Fe(OH)2
OG: ionuitwisselingsreactie redoxreactie
CaCl2 + Na2CO3 → 2 NaCl + CaCO3
OG: ionuitwisselingsreactie redoxreactie
2 Classificatie ionuitwisselingsreacties aan de hand van waarnemingen
OPDRACHT 2
ONDERZOEK
Onderzoek nu zelf enkele ionuitwisselingsreacties.
Ga naar en voer het labo uit.
©VANIN
WEETJE
Subscripts bij stoffen in reacties:
(aq) = opgelost in water
(v) of (s) = vast
(vl) of (l) = vloeibaar
(g) = gasvormig
Binnen de ionuitwisselingsreacties kunnen we nog een verder onderscheid maken op basis van de eigenschappen van de gevormde producten:
1 Een neerslagreactie kun je herkennen aan de vorming van een neerslag (een slecht oplosbare stof) op de bodem van je proefbuis. In een chemische reactie wordt dat voorgesteld met een pijl naar beneden (↓) achter de chemische formule van de stof die neerslaat. In een reactievergelijking kan het ook aangeduid worden met de subscripts (v) of (s) bij de stof.
2 Een gasontwikkelingsreactie kun je herkennen aan het ontsnappen van gasbelletjes uit de proefbuis. In een chemische reactie wordt dat voorgesteld met een pijl naar boven (↑) achter de chemische formule van de stof die ontsnapt. In een reactievergelijking kan het ook aangeduid worden met het subscript (g) bij de stof.
3 Een neutralisatiereactie is een reactie tussen een zuur en een base waarbij water gevormd wordt.
Opmerkingen:
Sommige chemische reacties kunnen ook een combinatie van de bovenstaande reacties vertonen en bijvoorbeeld zowel een neerslag vormen als een neutralisatiereactie zijn. We komen hier in het volgende hoofdstuk op terug.
—Ook bij redoxreacties kunnen er gassen gevormd worden. Op die manier zou je deze redoxreacties dus ook kunnen indelen bij de gasontwikkelingsreacties. Dit toont nogmaals aan dat chemie niet helemaal zwart-wit is.
—Een reactie tussen een zuur en een base kan leiden tot een neutrale oplossing (pH = 7). De term neutralisatie verwijst echter naar de H+-ionen die samen met de OH--ionen water vormen en niet naar een neutrale pH
VOORBEELD CLASSIFICEREN VAN IONUITWISSELINGSREACTIES
1 De reactie tussen zoutzuur en zilvernitraat in waterig midden:
HCl (aq) + AgNO3 (aq) → HNO3 (aq) + AgCl (s)
De afkorting (aq) bij de stoffen toont aan dat de stoffen goed oplossen in water (en de componenten dus vrije ionen vormen in water).
©VANIN
De afkorting (s) bij de stof zilverchloride toont aan dat de stof onder zijn vaste vorm voorkomt in water. Dat wil zeggen dat dit een neerslag vormt.
Een andere manier van noteren is als volgt:
HCl + AgNO3 → HNO3 + AgCl ↓
Dit is een voorbeeld van een neerslagreactie
2 De reactie tussen zoutzuur en bakpoeder in waterig midden:
HCl (aq) + NaHCO3 (aq) → H2O + CO2 (g) + NaCl (aq)
Het subscript (aq) achter de stoffen toont aan dat de stoffen goed oplossen in water (en de componenten dus vrije ionen vormen in water).
Bij de stof H2O (water) staat geen subscript, aangezien dit het oplosmiddel zelf is.
Het subscript (g) bij de stof koolstofdioxide toont aan dat deze stof als een gas voorkomt, en dus zal ontsnappen uit de oplossing.
Een andere manier van noteren is als volgt:
HCl + NaHCO3 → H2O + CO2 ↑ + NaCl
Dit is een voorbeeld van een gasontwikkelingsreactie
3 De reactie tussen zoutzuur en natriumhydroxide in waterig midden:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O
Het subscript (aq) achter de stoffen toont opnieuw aan dat de stoffen goed oplossen in water (en de componenten dus vrije ionen vormen in water).
Daarnaast zien we dat er, door de reactie tussen een zuur (HCl) en een base (NaOH) water wordt gevormd.
Een andere manier van noteren is als volgt: HCl + NaOH → NaCl + H2O
Dit is een voorbeeld van een neutralisatiereactie
OPDRACHT 3
Bekijk de onderstaande voorstellingen van ionuitwisselingsreacties.
Classificeer de ionuitwisselingsreacties als neerslagreactie, gasontwikkelingsreactie en/of neutralisatiereactie.
Voorstelling ionuitwisselingsreactie Neerslagreactie, gasontwikkelingsreactie of neutralisatiereactie?
1

2
3
4
zuur basischwater + zout
neerslagreactie
gasontwikkelingsreactie
neutralisatiereactie
neerslagreactie
gasontwikkelingsreactie
neutralisatiereactie
neerslagreactie
gasontwikkelingsreactie
neutralisatiereactie
neerslagreactie
gasontwikkelingsreactie
neutralisatiereactie fysisch proces chemische reactie andere stoffen gevormd na reactie
neerslagreactie
na reactie: slecht oplosbare stof gevormd die naar de bodem zakt
↓ of indicatie (s) of (v) achter de stof in de reactievergelijking
ionuitwisselingsreactie
OG elementen verandert niet
` Maak oefening 1 en 2 op p. 163-164.
gasontwikkelingsreactie
na reactie: gas gevormd dat uit de oplossing ontsnapt ↑ of indicatie (g) achter de stof in de reactievergelijking
OG bepaalde elementen verandert na reactie
neutralisatiereactie reactie tussen zuur en base waarbij water gevormd wordt redoxreactie
Na2SO4 + BaCl2 → BaSO4 ↓ + 2 NaCl
CaCO3 (s) + 2 HCl (aq) → CO2 (g) + CaCl2 (aq) + H2O
Gaat het om een ionuitwisselingsreactie of een redoxreactie?
Tip: controleer aan de hand van de oxidatiegetallen.
a SO3 + H2O → H2SO4
b Cl2 + H2S → 2 HCl + S
c NaOH + HCl → H2O + NaCl
d 4 Fe + 3 O2 → 2 Fe2O3
e 2 CuS + 3 O2 → 2 CuO + 2 SO2
f H2CO3 → H2O + CO2
g 2 H2 + O2 → 2 H2O
h AgNO3 + NaCl → AgCl + NaNO3
i H+ + OH- → H2O
j 2 Al2O3 → 4 Al + 3 O2
Welke soort ionuitwisselingsreactie wordt hier voorgesteld?
een neerslagreactie – een neutralisatiereactie
a Grotvorming: stalagmieten en stalactieten worden gevormd door de aanwezigheid van Ca2+- en CO32-ionen in het insijpelende regenwater.
b De reactie tussen looddinitraat en kaliumjodide in waterig midden.
2 KI (aq) + Pb(NO3)2 (aq) → PbI2 (s) + 2 KNO3 (aq):

c Het opsporen van chloride-ionen in water door de toevoeging van zilvernitraat.
2 AgNO3 + CaCl2 → 2 AgCl ↓+ Ca(NO3)2:
d Een oplossing van gebluste kalk (calciumhydroxide) en waterstofnitraat worden samengevoegd. Wat neerslag of gasvorming betreft, is er niets waarneembaar.
Ca(OH)2 + 2 HNO3 → 2 H2O + Ca(NO3)2:


` Meer oefenen? Ga naar .
Ionuitwisselingsreacties van dichtbij bekeken
©VANIN
LEERDOELEN
Je kunt al:
L het onderscheid maken tussen een neerslagreactie, gasontwikkelingsreactie en/of neutralisatiereactie aan de hand van reactievergelijkingen of waarnemingen;

L ionisatie- en dissociatievergelijkingen van stoffen in water noteren;
L zuur-base-indicatoren gebruiken;
L een zure, basische en neutrale oplossing van elkaar onderscheiden.
Je leert nu:
L chemische reacties classificeren als neerslag-, gasontwikkelings- of neutralisatiereactie;
L met een oplosbaarheidstabel voorspellen of een combinatie van stoffen leidt tot een onoplosbare stof;
L de vergelijking van een neerslagreactie opstellen;
L de vergelijking van een gasontwikkelingsreactie opstellen;
L de vergelijking van een neutralisatiereactie opstellen.
1 Algemene notatie
In het eerste hoofdstuk heb je de ionuitwisselingsreacties leren herkennen. We maakten een onderscheid tussen gasontwikkelingsreacties, neerslagreacties en neutralisatiereacties. Maar kunnen we deze 3 soorten reacties ook zelf voorspellen en uitschrijven?
1.1 Visuele weergave
De verschillende ionuitwisselingsreacties kunnen we voorstellen door middel van een visuele weergave. Als we waterige oplossingen van 2 elektrolyten AB en CD samenvoegen, dan brengen we vier ionen samen in eenzelfde reactievat: A+, B-, C+ en D-. In dit reactievat kunnen de negatieve ionen van de ene stof een verbinding maken met de positieve ionen van de andere stof (en omgekeerd). Bekijk op de volgende pagina de interacties die kunnen optreden.
1 Neerslagreacties
De nieuwe combinatie is een stof die weinig oplost in water. We merken een troebeling die na een tijdje naar de bodem zakt, bezinkt en een neerslag vormt.
©VANIN
Afb. 78 Visuele weergave neerslagreactie
2 Gasontwikkelingsreacties
De nieuwe combinatie is een gas dat weinig oplost in water. We merken gasbelletjes op die uit de oplossing opstijgen.
Afb. 79 Visuele weergave gasontwikkelingsreactie
3 Neutralisatiereacties
Bij het samenvoegen van een zuur (pH < 7) en een base (pH > 7) combineren de waterstofionen (H+) van het zuur met de hydroxide-ionen (OH-) van het hydroxide tot water (H2O).
Afb. 80 Visuele weergave neutraliteitsreactie
Opmerkingen:
—Het is ook mogelijk dat alle ionen een nieuwe combinatie aangaan. In dat geval gebeuren er gelijktijdig 2 chemische reacties.
—Het kan ook zijn dat er geen chemische reactie optreedt. De stoffen worden dan alleen gemengd, wat een fysisch proces is. Er ontstaat geen nieuwe combinatie tussen de tegengesteld geladen ionen (alle ionen blijven gedissocieerd in de oplossing).
Afb. 81 Visuele weergave fysisch proces
Hoe weet je of een stof slecht oplost in water? Dat leer je in het volgende onderdeel. TIP
1.2 Weergave met behulp van reactievergelijkingen
Ionuitwisselingsreacties kunnen, naast een visuele weergave, ook in 3 soorten reactievergelijkingen weergegeven worden:
1 de stoffenreactievergelijking (SR) = reactievergelijking waarbij alle stoffen als formule worden weergegeven in de reactie
2 de ionenreactievergelijking (IR) = reactievergelijking waarbij alle stoffen die dissociëren of ioniseren ook als ionen worden weergegeven in de reactie
3 de essentiële reactievergelijking (ER) = reactievergelijking waarbij alleen de ionen die een nieuwe stof vormen, behouden blijven.
Om de correcte reactievergelijkingen van een ionuitwisselingsreactie te noteren, doorloop je best het volgende stappenplan:
STAP 1: Noteer de dissociatie/ionisatievergelijkingen van de reagentia.
©VANIN
STAP 2: Combineer de vrije ionen tot nieuwe verbindingen. Zorg dat de wet van behoud van atomen gerespecteerd wordt en denk aan de kruisregel bij de vorming van hydroxiden en zouten (zie thema 01). Noteer welke reactieproducten slecht oplosbaar zijn (neerslag of gas) en noteer in de vergelijking met een ↓ (neerslag) of ↑ (gas). Je noteerde nu de stoffenreactievergelijking (SR).
STAP 3: De vrije ionen die aanleiding geven tot de neerslag, het gas of water, zijn de componenten die als stof behouden blijven in de ionenreactievergelijking. De andere vrije ionen blijven onder hun ion-vorm in de vergelijking staan. Je noteerde nu de ionenreactievergelijking (IR)
STAP 4: Vereenvoudig de ionenreactievergelijking en behoud alleen de onderdelen die aanleiding geven tot de neerslag, het gas of de vorming van water. Dit is de essentiële reactievergelijking (ER)
Opmerkingen in verband met de essentiële reactievergelijking:
—In het geval van een neerslagreactie zijn het de ionen die de neerslag vormen. In het geval van de gasontwikkelingsreactie zijn het de ionen die het gas vormen. En bij een neutralisatiereactie is de essentiële reactievergelijking altijd dezelfde: het zijn altijd H+- en OH--ionen die samen combineren tot de vorming van water.
—Als er tijdens een chemische reactie geen neerslag, gas of water gevormd wordt, dan zal er ook geen essentiële reactie optreden.
—Zoals eerder vermeld, kunnen er tegelijkertijd 2 ionuitwisselingsreacties plaatsvinden. Je noteert dan ook beide essentiële reactievergelijkingen afzonderlijk.
2 Neerslagreacties
2.1 Oplosbaarheid in water: gebruik van de oplosbaarheidstabel
Wanneer we kijken naar reacties met stoffen in water, is het belangrijk om te weten welke stoffen effectief vrije ionen vormen in water en welke stoffen slecht oplosbaar zijn (en dus geen vrije ionen zullen vormen). Een globale indeling voor oplosbaarheid is:
goed oplosbaar: > 10 g L matig oplosbaar: 1 - 10 g L
slecht oplosbaar: < 1 g L
De oplosbaarheid van stoffen kan worden beïnvloed door externe factoren zoals temperatuur. De oplosbaarheid van vaste stoffen is groter bij een hogere temperatuur. Voor gassen geldt het tegenovergestelde. Aangezien een hogere temperatuur ervoor zorgt dat de moleculen sneller bewegen, betekent dat dat ze makkelijker uit de oplossing kunnen ontsnappen.
Tabel 7 geeft een overzicht van de oplosbaarheid van verbindingen in water. Deze tabel werd via experimentele vaststellingen opgesteld en mag je altijd gebruiken.
Verbindingen Goed oplosbaar
Slecht oplosbaar verbindingen met Na+ verbindingen met K+ verbindingen met NH4+ alle alle alle-
Zouten van:
nitraat (NO3-) bromide (Br-) chloride (Cl-) jodide (I-) sulfaat (SO42-) sulfiet (SO32-) sulfide (S2-) fosfaat (PO43-) carbonaat (CO32-) alle alle, behalve → alle, behalve → alle, behalve → alle, behalve →
Na+, K+, NH4+
Na+, K+, NH4+, Mg2+, Ba2+, Ca2+
Na+, K+, NH4+
Na+, K+, NH4+ -
Ag+, (Hg+, Pb2+: matig)
Ag+, (Hg+, Pb2+: matig)
Ag+, (Hg+, Hg2+ en Pb2+: matig)
Ba2+, (Pb2+, Ca2+: matig)
Fe2+, Zn2+, Cu2+, Ca2+, Pb2+, Hg+, Ag+, (Mg2+: matig) alle andere alle andere alle andere
hydroxide (OH-) groep IA, beperkter voor groep IIA andere groepen
Tabel 7 Oplosbaarheidstabel
OPDRACHT 4
Bepaal de oplosbaarheid van een zout.
1 Is magnesiumsulfaat goed oplosbaar in water of zal het een neerslag vormen? Bekijk het voorbeeld.
Symbolische voorstelling: MgSO4
MgSO4 is een combinatie van de ionen Mg2+ en SO42Wanneer we de oplosbaarheidstabel bekijken, zien we dat deze combinatie een goed oplosbaar zout is.
2 Zijn deze zouten goed oplosbaar in water? Vul de tabel aan.
Symbolische voorstelling Systematische naam Oplosbaar in water (ja/neen)?
AgCl
ja nee
ammoniumsulfide ja nee
OPDRACHT 5
Noteer de reactievergelijkingen van de ionuitwisselingsreactie.
De reactie tussen zoutzuur (HCl) en zilvernitraat (AgNO3) zorgt voor de vorming van het zuur waterstofnitraat (HNO3) en de neerslag zilverchloride (AgCl). Volg het stappenplan.
STAP 1
We bekijken eerst de reagentia: HCl is een zuur, dus spreken we van een ionisatievergelijking
AgNO3 als zout dissocieert in ionen volgens de dissociatievergelijking.
STAP 2
We bekijken de reactieproducten: H+ kan reageren met NO3- ter vorming van het zuur HNO3
Ag+ vormt met Cl- het slecht oplosbaar zout AgCl. We noteren het dus als een neerslag in de stoffenreactievergelijking.
STAP 3
We gaven aan dat het zuur HNO3 werd gevormd. Zuren ioniseren echter in water, waardoor de ionen H+ en NO3- als vrije ionen naast elkaar blijven bestaan.
We noteren dat dan in een ionenreactievergelijking.
STAP 4
Vereenvoudigen we de ionenreactievergelijking, dan bekomen we de essentiële reactievergelijking
In de ionenreactievergelijking zien we dat alleen de ionen Ag+ en Cl- tot een nieuwe stof reageren.
Opmerking: Je ziet dat je de ER gemakkelijk kan afleiden uit de IR door de gelijke ionen links en rechts van de reactiepijl te schrappen.
IR: H+ + Cl- + Ag+ + NO3- → H+ + NO3- + AgCl ↓ ↓
ER: Ag+ + Cl- → AgCl ↓
2.2 Neerslagreacties opstellen
Bij het samenvoegen van oplossingen kunnen positieve en negatieve ionen nieuwe verbindingen vormen. Die reactie noemen we een ionenuitwisselingsreactie. Die nieuwe verbindingen kunnen een slecht oplosbaar zout vormen. In dat geval ontstaat er een neerslag. De reactie noemen we dan een neerslagreactie. Er kunnen tegelijkertijd ook 2 nieuwe slecht oplosbare zouten gevormd worden. Met behulp van het stappenplan en de oplosbaarheidstabel kunnen we de bijbehorende vergelijkingen opstellen.
©VANIN
Dankzij de typische kleur van bepaalde neerslagen worden neerslagreacties gebruikt om de aanwezigheid van bepaalde ionen aan te tonen.
De neerslagreactie op afbeelding 82 laat bijvoorbeeld toe om Pb2+-ionen in bodemstalen te identificeren door toevoeging van een KI-oplossing. Omgekeerd kan door middel van een Pb(NO3)2-oplossing de aanwezigheid van I– worden aangetoond. De aanwezigheid van Pb2+-ionen in bodemstalen of in je drinkwater is niet gewenst: in het oude Rome stierven de rijken vaak eerder dan de arme inwoners. Toch hadden rijke Romeinen veel meer nutsvoorzieningen, terwijl de armen op elkaar gepakt in kazernes woonden. Wat bleek nu? De rijke Romeinen gebruikten loden buizen om het drinkwater in hun woningen binnen te brengen. Velen stierven dan ook een pijnlijke dood door loodvergiftiging.
WEETJE
Afb. 82 Typische gele kleur van PbI2
OPDRACHT 6
Noteer de reactievergelijkingen van de ionuitwisselingsreactie.
Als een oplossing van looddinitraat wordt samengevoegd met een kaliumjodide-oplossing, dan ontstaat er een gele neerslag. Volg het stappenplan om aan te tonen welke stof die neerslag vormt.
STAP 1 Noteer de dissociatie/ionisatievergelijkingen van de reagentia
Beide reagentia zijn zouten, dus we noteren de dissociatievergelijking van beide stoffen:
Dissociatievergelijking kaliumjodide:
Dissociatievergelijking looddinitraat:
STAP 2 Noteer de stoffenreactievergelijking
We bekijken de reactieproducten: K+ kan reageren met NO3- ter vorming van het goed oplosbare zout KNO3. In de oplosbaarheidstabel zien we immers dat alle zouten met K+ goed oplosbaar zijn.
Pb2+ vormt met I- het slecht oplosbaar zout PbI2 (zoals we zien in de oplosbaarheidstabel). We noteren dat dus als een neerslag in de stoffenreactievergelijking. Daarnaast houden we ook rekening met de wet van behoud van atomen.
STAP 3 Noteer de ionenreactievergelijking
We gaven aan dat het goed oplosbare zout KNO3 werd gevormd, dat wil zeggen dat de ionen K+ en NO3- als vrije ionen naast elkaar blijven bestaan.
De ionenreactievergelijking ziet er dan als volgt uit:
STAP 4 Noteer de essentiële reactievergelijking
Vereenvoudigen we de ionenreactievergelijking, dan bekomen we de essentiële reactievergelijking.
In de ionenreactievergelijking zien we dat alleen de ionen Pb2+ en I- tot een nieuwe stof reageren, waardoor de essentiële reactievergelijking van deze reactie als volgt wordt genoteerd:
3 Neutralisatiereacties
ontdekplaat:
Het tweede type van ionuitwisselingsreacties zijn de neutralisatiereacties: een reactie tussen een zuur en een base waarbij water gevormd wordt.
In het woord neutralisatiereactie herken je het begrip neutraal, dat je al eerder tegenkwam in thema 01 toen je het begrip pH leerde kennen. In thema 04 leerde je ook dat de pH-waarde afhankelijk is van de hoeveelheid H+- en OH--ionen in de oplossing
Gedestilleerd water wordt een neutrale oplossing genoemd, omdat de hoeveelheid H+- en OH--ionen aan elkaar gelijk is (pH = 7). Wanneer we H+-ionen toevoegen aan het water, krijgen we een zure oplossing. Het toevoegen van OH--ionen leidt tot een basische of alkalische oplossing
Een neutralisatiereactie is dan ook een reactie tussen een zuur (H+-ionen) en een base (OH--ionen), waarbij de H+-ionen en OH--ionen elkaar neutraliseren door de vorming van water. Daarom wordt de reactie vaak ook een zuur-basereactie genoemd
Om de correcte reactievergelijkingen van een neutralisatiereactie te noteren, gebruiken we opnieuw hetzelfde stappenplan. Maar bij een neutralisatiereactie is de essentiële reactievergelijking steeds dezelfde: het zijn namelijk steeds H+- en OH- -ionen die samen combineren tot de vorming van water
OPDRACHT 7
Weiden, grasvelden of akkers die te zuur zijn, kunnen worden behandeld met basisch reagerende stoffen zoals gebluste kalk. Die gebluste kalk neutraliseert de H+-ionen die aanwezig zijn in de zure bodem. We bekijken een eenvoudig voorbeeld met zwavelzuur als bron van H+-ionen.
Volg het stappenplan om de reactievergelijkingen van de ionuitwisselingsreactie te noteren.
STAP 1 Noteer de dissociatie/ionisatievergelijkingen van de reagentia
Gebluste kalk (als hydroxide) gaat dissociëren in water, terwijl zwavelzuur zal ioniseren in water. Dat geeft de volgende reactievergelijkingen:
dissociatie gebluste kalk ionisatie zwavelzuur
STAP 2 Geef de stoffenreactievergelijking
We bekijken de reactieproducten:
Ca2+ kan reageren met SO42- ter vorming van het matig oplosbare zout CaSO4 (zie oplosbaarheidstabel).
H+ en OH- vormen samen water.
We kunnen nu de stoffenreactievergelijking noteren.
STAP 3 Geef de ionenreactievergelijking
We gaven aan dat het matig oplosbare zout CaSO4 werd gevormd.
We kunnen nu de ionenreactievergelijking noteren.
STAP 4.
We vereenvoudigen ten slotte de ionenreactievergelijking en behouden dan de essentiële reactievergelijking van de neutralisatiereactie:
SR:
IR:
Daarnaast zien we ook de essentiële reactievergelijking van de neerslagreactie: ER: ER:
OPDRACHT 8 DOORDENKER
Verklaar het onderstaande fenomeen.
Intensief gebruikte akkers worden vaak te basisch (alkalisch). Als remedie strooit men er zuurreagerende meststoffen op zoals difosforpentaoxide. Dat difosforpentaoxide reageert eerst met het water in de bodem en vervolgens met de aanwezige hydroxiden.
a Allereerst reageert het oxide met water. Volgens welk reactiepatroon zal dat gebeuren?
reactiepatroon:

b Geef de reactievergelijking tussen difosforpentaoxide en water.
reactievergelijking:
c Noteer nu de ionisatievergelijking van dat eindproduct, alsook de dissociatievergelijking van kaliumhydroxide. Dat is een veelvoorkomend hydroxide in bemeste bodems.
ionisatievergelijking:
dissociatievergelijking KOH-oplossing:
d Geef de stoffenreactievergelijking van die reactie.
SR:
e Geef de ionenreactievergelijking van die reactie.
IR:
f Geef de essentiële reactievergelijking van die reactie.
ER:
g Is de reactie tussen H3PO4 en KOH ook een neerslagreactie? Motiveer je antwoord.
WEETJE

Om te voorkomen dat het industrieel afvalwater met een (te) hoge of (te) lage pH zou geloosd of hergebruikt worden, wordt het geneutraliseerd Bij dat neutraliseren wordt, in tegenstelling tot wat je zou denken, het water niet noodzakelijk op een pH = 7 gebracht, maar meestal op een pH tussen 6,5 en 9,5
In de industrie is het belangrijk om het afvalwater te neutraliseren om corrosie en andere chemische reacties, die plaatsvinden bij een hoge of een erg lage pH, te vermijden. Gassen die bij zo’n ongewenste reacties kunnen vrijkomen, zijn ammoniak (NH3) en het zeer giftige blauwzuur (waterstofcyanide = HCN).
Te lage pH
©VANIN
Te hoge pH
stoffen die afvalwater neutraliseren
Ionuitwisselingsreacties worden steeds volgens hetzelfde stappenplan uitgeschreven (zie p. 167).
neerslagreacties → De nieuw gevormde stof is slecht oplosbaar in water. → Gebruik de oplosbaarheidstabel op p. 169.
neutralisatiereacties → H+-ionen en OH--ionen vormen samen H2O. → De essentiële reactievergelijking is altijd: H++ OH- → H2O.
` Maak oefening 1, 2 en 3 op p. 177-179.
VERDIEPING
Ga naar als je meer wilt ontdekken over gasontwikkelingsreacties en redoxreacties.
NaOH, Ca(OH)2 H2SO4, HCl
Zijn de volgende stoffen goed of slecht oplosbaar in water? Vul de naam of formule aan en gebruik je oplosbaarheidstabel.
Naam
a BaSO4
b zilvernitraat
c magnesiumbromide
d HgI2
e kaliumfosfaat
f ammoniumsulfaat
Formule Goed of slecht oplosbaar?
Vervolledig de volgende neerslagreacties. Geef hiervoor eerst de ionisatie/dissociatievergelijking van beide stoffen: de stoffenreactievergelijking, de ionenreactievergelijking en de essentiële reactievergelijking.
a Fe(NO3)3 + KOH
b CaCl2 + Na3PO4
c CuSO4 + (NH4)2S
d KBr + AgNO3
©VANIN
e Na3PO4 + MgSO4
Vervolledig de volgende neutralisatiereacties. Geef hiervoor eerst de ionisatie/dissociatievergelijking van beide stoffen: de stoffenreactievergelijking, de ionenreactievergelijking en de essentiële reactievergelijking.
a HNO3 + KOH
b H3PO4 + LiOH
c NH4OH + H2S
d NaOH + H2SO4
e KOH + HBr
` Meer oefenen? Ga naar .
KERNBEGRIPPEN
KERNVRAGEN
REACTIESOORTEN
Hoofdstuk 1: Soorten chemische reacties
redoxreactie = reactie waarbij OG van atoomsoorten verandert
ionuitwisselingsreactie = reactie waarbij OG van atoomsoorten niet verandert: 3 soorten:
NOTITIES
Bepalen OG → zie thema 01
1 Neerslag: Er is neerslag op de bodem te zien.
2 Gasontwikkeling: Gasbelletjes ontsnappen uit de oplossing.
3 Neutralisatie: Een zuur en base reageren samen en vormen een zout en water.
Hoofdstuk 2: Ionuitwisselingsreacties van dichtbij bekeken
notatie ionuitwisselingsreactie via: stoffenreactievergelijking
ionenreactievergelijking
essentiële reactievergelijking
neerslagreacties
neutralisatiereacties
Zie stappenplan p. 167.
Neerslag aangeduid met ↓ Gebruik de oplosbaarheidstabel op p. 169.
zuur + base → zout + water
ER is steeds H++ OH- → H2O
JANOG OEFENEN
1 Begripskennis
Ik kan de volgende begrippen uitleggen: ionuitwisselingsreactie redoxreactie neerslag gasontwikkeling neutralisatie stoffenreactievergelijking, ionenreactievergelijking en essentiële reactievergelijking oplosbaarheid in water oxidator, reductor, oxidatie, reductie, elektronenbalans
2 Onderzoeksvaardigheden
Ik kan het oxidatiegetal van elementen in enkelvoudige stoffen en verbindingen bepalen.
Ik kan ionuitwisselingsreacties onderscheiden van redoxreacties op basis van oxidatiegetallen.
Ik kan ionuitwisselingsreacties classificeren als neerslagreactie, gasontwikkelingsreactie en/of neutralisatiereactie op basis van waarnemingen of reactievergelijkingen.
Ik kan gebruikmaken van de oplosbaarheidstabel om te voorspellen of stoffen oplossen in water.
Ik kan de stoffenreactievergelijking, ionenreactievergelijking en essentiële reactievergelijking van neerslagreacties schrijven
Ik kan de stoffenreactievergelijking, ionenreactievergelijking en essentiële reactievergelijking van neutralisatiereacties schrijven.
` Je kunt deze checklist ook op invullen.
