GESTIONE DEL PERCORSO CHIRURGICO IMPLANTARE NEI PAZIENTI CON MALATTIE SISTEMICHE
Marco MOZZATI

Federica RUSSO Renato POL
Giuliana MUZIO

Marco MOZZATI

Federica RUSSO Renato POL
Giuliana MUZIO
In soggetti sani, gli impianti dentali garantiscono una soluzione terapeutica comune per risolvere i problemi legati alla stabilità, alla ritenzione delle protesi e per sostituire i denti. Non è sempre scontato che questa terapia sia fattibile e predicibile anche nei pazienti con patologie sistemiche, o quanto queste condizioni alterate possano aumentare il rischio di fallimento implantare o di sviluppare più facilmente perimplantite.
È importante valutare il reale rischio nel singolo paziente e adottare le misure preventive specifiche per ridurre al minimo le complicanze. Nei pazienti con patologie sistemiche o in trattamento polifarmacologico, la sopravvivenza implantare può essere inferiore e il rischio di perimplantatite maggiore.
Il trattamento implanto-protesico è associato a indiscussi benefici funzionali, nonché a un miglioramento nella qualità della vita correlata alla salute orale. Pertanto, la terapia implanto-protesica per la sostituzione dei denti deve obbligatoriamente prendere in considerazione il quadro clinico-sistemico del paziente e mirare al raggiungimento del massimo beneficio.
Questo rende importante conoscere e adottare le misure preventive, i trattamenti chirurgici più idonei, le soluzioni protesiche più congeniali alle condizioni dei pazienti e la gestione corretta dei follow-up.
Il testo descriverà il percorso di presa in carico del paziente con patologie sistemiche, dalle prime fasi di ragionamento clinico-teorico alle fasi di implementazione, con tutte le sequenze operative che sono implicate nel percorso terapeutico.
Lo scopo è di indirizzare il professionista verso la scelta del piano di trattamento implantoprotesico più appropriato, in modo da offrire un percorso terapeutico personalizzato, che riduca al minimo i rischi a esso correlati e che fornisca la maggiore predicibilità di successo.
La mission è sempre il bene del paziente e la riuscita dell’intervento riabilitativo passa anche, e soprattutto, attraverso la minimizzazione delle complicanze potenzialmente correlate alla sua condizione. Prima di intraprendere un percorso implantoprotesico di un paziente con patologie sistemiche, è indispensabile procedere all’analisi di una serie di parametri di rischio; quelli sui quali è sicuramente imprescindibile soffermarsi sono essenzialmente quattro.
Il primo parametro prende in analisi il rischio emotivo e comprende tutte quelle possibili complicanze legate a uno stato emotivo alterato che potrebbero compromettere la compliance del paziente, sia durante l’atto chirurgico, sia nelle fasi di protesizzazione e mantenimento seguenti.
Il secondo parametro prende in analisi il rischio fisico-sistemico: questo parametro comprende le patologie di cui il paziente è portatore e le terapie, in atto e pregresse, che possano compromettere l’andamento del percorso o richiedere dei protocolli operativi specifici. A titolo squisitamente esemplificativo, per meglio spiegare questo fondamentale punto, si nomina il caso tipico della paziente che assume i bifosfonati orali per trattare una osteoporosi secondaria alla menopausa.
Il terzo parametro da considerare nel percorso è certamente quello relativo al rischio di guarigione, strettamente correlato al predecessore fisico-sistemico. Molte patologie o terapie, infatti, possono compromettere la tendenza biologica alla riparazione e al superamento dello stress biologico che provochiamo, per esempio, con una incisione chirurgica.
Il quarto parametro è, infine, relativo al rischio odontoiatrico e prende in considerazione quegli specifici problemi legati ad aspetti funzionali ed estetici che, a seconda del grado di alterazione, incidono più o meno sulla valutazione globale del rischio odontoiatrico.
Il linguaggio che si adotta con il paziente incornicia sempre le sue esperienze, soprattutto quelle negative, per cui si deve stare attenti a pronunciare frasi come:
“La complicanza è rara, ma imprevedibile”
“La guarigione sarà indolore, ma lunga”
“L’anestesia le toglierà il dolore, ma fa male”
Esse, molto probabilmente genereranno sensazioni negative; meglio utilizzare concetti con risvolti positivi come:
“La complicanza è imprevedibile, ma rara”
“La guarigione sarà lunga, ma indolore”
“L’anestesia fa male, ma le toglierà il dolore”
Se si volessero tirare delle conclusioni sul primo colloquio con il paziente è possibile sintetizzare il percorso in:
Ascoltare con attenzione le sue esigenze e problematiche.
Valutare, attraverso i segnali emessi, il suo stato d’animo per identificare l’eventuale presenza di ansia o altre emozioni negative.
Valutare le sue richieste e i suoi obiettivi.
Rispondere adeguatamente a tutte le sue domande.
Dialogare con il paziente per spiegare la sua situazione clinica.
Spiegare bene al paziente perché c’è la necessità di eseguire eventuali approfondimenti diagnostici.
Far comprendere al paziente l’importanza di valutare il suo stato di salute generale.
Valutare con il paziente i possibili piani terapeutici e discutere con lui i vantaggi e gli svantaggi di ognuno.
L’odontoiatra deve imparare a gestire il paziente complesso nel proprio ambulatorio, adattando il piano di trattamento riabilitativo al grado di rischio operatorio; per poterlo fare, deve prima procedere a una attenta valutazione del rischio assoluto, così da poter ideare e proporre un piano di trattamento adeguato e personalizzato.
Gli obiettivi preposti sono il soddisfacimento dei bisogni del paziente e la riuscita dell’intervento riabilitativo; quest’ultima passa anche e soprattutto attraverso la minimizzazione delle possibili complicanze correlate alla sua condizione. Nessun paziente è uguale al precedente e ognuno possiede delle singolarità importanti che devono essere valutate, analizzate e comprese come potenziali criticità.
Seguendo questo percorso mentale di analisi sarà possibile imparare a classificare i pazienti non più solo per le problematiche orali stomatologiche, ma per tutto l’insieme di fattori che ci porteranno a stimare il reale rischio assoluto di trattamento e, in funzione di questo, a redigere un corretto percorso terapeutico.
Quello del professionista dovrà prima di tutto essere un percorso mentale decisionale, che ci conduca prima a individuare il grado di rischio e solo dopo a scegliere il trattamento odontoiatrico che meglio si adatta alla specifica situazione clinica sistemica. Si deve imparare a costruire nella mente un albero decisionale che, attraverso l’analisi di molteplici dati, condurrà prima a fare una diagnosi e successivamente un piano di trattamento. (Tabella 1 )
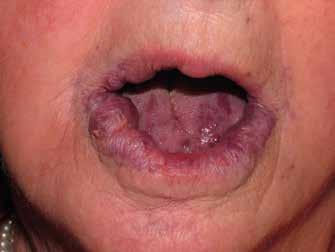
Deve prevedere sia l’osservazione sia la palpazione di tutte le mucose orali, partendo da labbra, lingua, guance, per arrivare alla valutazione del tessuto gengivale dei fornici, del palato e la gengiva aderente. Se ne devono valutare colore (fig. 11 ittero mucoso), fragilità, consistenza e presenza di ulcere o tumefazioni.
L’esame clinico rappresenta sicuramente la fase di analisi più complessa in quanto i parametri da valutare sono molti e possono interessare tutte le specialità odontoiatriche. Sono da valutare lo stato di salute della dentatura residua, la presenza o meno di manufatti protesici, il rapporto intermascellare,
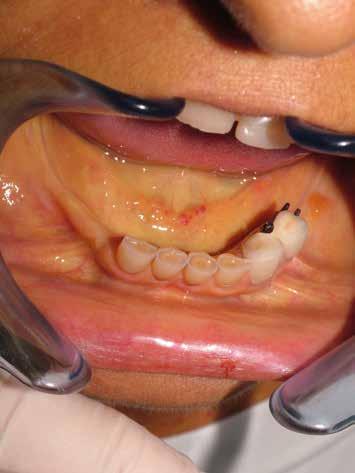
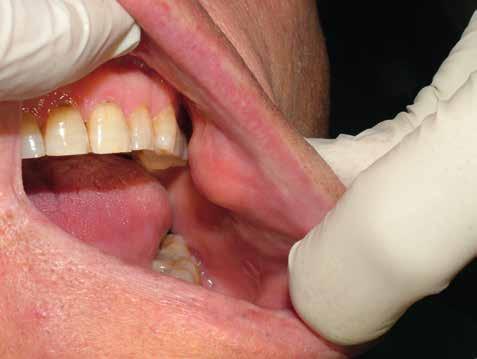
lo stato di igiene orale, la condizione dei tessuti parodontali, le abrasioni dello smalto che ci indirizzino verso la diagnosi di parafunzioni come il bruxismo, la limitazione nell’apertura della bocca o la presenza di deviazioni per disordini temporo-mandibolari. (Figg. 16-21)
della dentatura: deve essere eseguita a partire dal controllo del parodonto fino all’integrità della corona, in modo da avere sempre una visione di salute orale generale. Una grande importanza deve essere data al rapporto intermascellare. Una buona riabilitazione protesica deve essere indirizzata alla funzionalizzazione, pertanto è utile conoscere quanto i piani occlusali siano alterati sia in senso verticale che orizzontale.
1 Durante l’atto di preparazione del sito osseo, il trauma meccanico danneggia i vasi sanguigni con conseguente emorragia, attivazione dell’emostasi e formazione del coagulo.
2 Lo stress chirurgico sull’osso causa un’ischemia locale che interessa i margini fratturati.
3 La necrosi cellulare che ne consegue induce il processo infiammatorio per l’eliminazione dei detriti cellulari e ossei. I mediatori chimici del processo infiammatorio stimolano anche l’angiogenesi e il reclutamento delle cellule responsabili della fase proliferativa.
4 Dal terzo giorno, grazie all’aumento della permeabilità dei vasi, si ha migrazione e colonizzazione da parte delle cellule mesenchimali indifferenziate.
5 Nei giorni seguenti si ha differenziazione cellulare (granulociti e macrofagi accorrono per eliminare detriti cellulari e ossei in necrosi) e organizzazione del tessuto perimplantare.
6 Un mese dopo l’inserimento implantare, si può notare una quantità di tessuto osseo neoformato attorno alla fixture
7 Tre mesi dopo la chirurgia è possibile notare un aumento dell’osso presente all’interfaccia con l’impianto e la presenza, tra le filettature, di osso corticale.
TABELLA 11: Fasi della guarigione nel tessuto periimplantare
Dunque, ciò che cambia nel processo di osteointegrazione rispetto ad altri tipi di guarigione è la fase di rimodellamento; essa si presenta rispettando lo stesso ordine cronologico, ma deve sempre garantire il mantenimento del contatto osso/impianto. Ciò significa che all’azione osteoclastica (rimodellamento osseo) deve sempre far seguito un pressoché contemporaneo compenso da parte degli osteoblasti (deposito di osso nuovo sulle superfici dell’impianto).
Quest’ultima fase subisce condizionamenti di tipo ormonale, biologico o meccanico, che possono verificarsi in uno specifico momento della vita del paziente, anche senza alcun tipo di avvisaglia.
In generale, il processo di guarigione può essere ostacolato da una moltitudine di variabili tale che si è deciso di dedicarvi spazio nel terzo Capitolo del testo.
Per rischio odontoiatrico si intende quella o quelle condizioni che possono modificare negativamente l’outcome delle procedure terapeutiche chirurgiche e implantari e provocare difficoltà alla guarigione con disagi anche grandi per il paziente, ovvero causare il fallimento della prestazione, il prolungamento della condizione di malattia e il peggioramento delle condizioni di salute.
Ragionando sulle variabili che possono influire sul rischio odontoiatrico, si è deciso di nominarne principalmente tre: l’abitudine al fumo, l’abuso di alcol e la parodontopatia.
Il fumo rappresenta uno dei fattori di rischio sia per la malattia parodontale sia per la salute degli impianti dentali. Il problema del vizio del fumo è assai complesso, se si tiene in considerazione che, nel 2022, quasi un italiano su quattro (il 24,2% della popolazione) è un fumatore. A questo già rilevante numero, vanno aggiunti gli ex fumatori che sono circa il 14,9% della popolazione italiana. (ISS 2022 - «Comunicato Stampa N°39/2022 - Fumo: in Italia circa 800mila fumatori in più rispetto al 2019. Triplicato il consumo di sigarette a tabacco riscaldato» s.d.)
Nonostante non sia necessario specificarlo, la rilevanza del “problema fumo”, nell’ambito della valutazione del rischio odontoiatrico, è supportata da una vasta letteratura scientifica. Il dibattito scientifico si è a lungo soffermato sul quali fossero effettivamente gli effetti visibili della dannosità del fumo, inteso sia in quanto tale (aumento ciclico della temperatura nel cavo orale), sia da un punto di vista chimico (danno chimico da nicotina sulle mucose), sia in quanto dipendenza organica (con relativa difficoltà nella collaborazione del paziente nello smettere o ridurre il consumo di sigarette).
In uno studio prospettico del 2002, Ataoglu et al hanno mostrato un aumento significativo dei parametri clinici dell’infiammazione perimplantare nei soggetti fumatori rispetto a quelli non fumatori.
(
Ataogluet al. 2002)
Anche Attard e Zarb, nel 2002, in uno studio retrospettivo di 16-18 anni di follow-up, hanno segnalato che i pazienti fumatori avevano un rischio significativamente più elevato di sviluppare complicazioni dei tessuti molli peri-implantari rispetto ai non fumatori. (Attard e Zarb 2002)
Il concetto del fumo come fattore di rischio di salute implantare è ripreso nel 2006 e nel 2008 rispettivamente anche da Roos-Jansåker et al. e da Fransson et al., i quali hanno associato al fumo proprio una percentuale significativamente maggiore di mucosite peri-implantare, perdita d’osso marginale e perimplantite. (Roos-Jansåker et al. 2006; Fransson, Wennström, e Berglundh 2008)
Più recentemente, nel 2020, Windael et al. hanno dimostrato che il rischio di sviluppare complicanze nei fumatori sia, a 10 anni, superiore di 2,6 volte;
analogamente i fumatori mostrano un rischio 5,64 volte maggiore di presentare perdita dell’impianto. (Windael et al. 2020)
Il motivo per cui il fumo influenza negativamente il successo dell’impianto è correlato principalmente all’effetto dello stesso su processi quali osteogenesi e angiogenesi. È stato, infatti, dimostrato che l’esposizione alla nicotina inibisce l’angiogenesi, portando vasocostrizione e compromettendo, di conseguenza, la guarigione durante il processo di osteointegrazione. La vasocostrizione dovuta alla nicotina, inoltre, si accompagna ad alterazione dell’architettura microvascolare della gengiva, con soppressione dei segni clinici dell’infiammazione; ne sono prove il punteggio di sanguinamento ridotto e l’indice gengivale, che risulta inferiore nei fumatori rispetto ai non fumatori, facendo apparire meno grave lo stato di compromissione dei tessuti peridentali e perimplantari. (Apatzidou 2022)
Oltre a rappresentare un rischio sui processi di angiogenesi e osteointegrazione, fumo e nicotina hanno dimostrato di avere un ruolo anche sui processi che concorrono al mantenimento in situ dell’impianto. Uno studio del 2015 ha, infatti, indagato l’impatto del fumo sul microbioma perimplantare: il risultato dello studio è stato che, nei fumatori, si è rilevata una flora microbica più ricca di agenti patogeni rispetto ai non fumatori. I dati a supporto dello stesso studio dimostravano come, anche in condizioni di salute perimplantare, il fumo modifichi sostanzialmente il microbioma, favorendo l’insediamento di patogeni nell’ambiente perimplantare. (Tsigarida et al. 2015)
In uno studio recente di Nazeer et al. sulla valutazione degli effetti del fumo sull’osteointegrazione, il successo dell’impianto è stato considerevolmente maggiore nei non fumatori rispetto ai fumatori e il tasso di fallimento dell’impianto è stato maggiore nei fumatori, con una frequenza pari al doppio, così come il riassorbimento osseo perimplantare a 9 mesi. (Nazeer et al. 2020). Il tasso di insuccesso è risultato essere significativamente più elevato negli individui che hanno fumato > 20 sigarette/giorno per un periodo di 10 anni.
Come è facile immaginare, la conclusione che deriva dall’analisi di questi studi è che l’effetto negativo del fumo può cessare solo con la sua interruzione e che questa è una raccomandazione forte per il raggiungimento di un outcome positivo anche a
distanza di tempo. Sebbene l’opinione comune sia che bisognerebbe suggerire ai pazienti di smettere di fumare del tutto, sappiamo che il paziente fumatore va aiutato nel percorso con strategie che oggi, diversamente dal passato, ci vengono in aiuto.
Le raccomandazioni iniziali di Bain e Moy, del 1993, indicavano che un paziente dovesse smettere di fumare almeno una settimana prima dell’intervento e non fumare per i due mesi successivi. Questo perché, dopo una settimana, il corpo comincia a ridurre adesione piastrinica e viscosità ematica, che sono invece aumentati nei soggetti fumatori attivi; in breve tempo il corpo elimina anche le problematiche legate agli effetti della nicotina sulle mucose. La sospensione per i due mesi successivi, gioverebbe invece per il mancato impedimento all’attività osteoblastica e osteointegrativa. (Bain e Moy 1993)
È ovviamente opinione condivisa che tutti i pazienti dovrebbero smettere di fumare, ma è noto anche che modificare una dipendenza può rivelarsi un’impresa. Chi fuma sa che è necessaria una forte motivazione personale al cambiamento, poiché l’imposizione verbale non ha sostanzialmente peso sull’intenzionalità. Questa motivazione potrebbe risiedere nella necessità di riabilitare la bocca per ritrovare i benefici della salute orale, della psiche e della socialità che, in mancanza di denti, spesso ne risente. Non di meno, non si può tralasciare che il fumo influisce anche su tutti i processi di omeostasi e sul potenziale di guarigione e che, come provato da Apatzidou nel 2022, influisce negativamente sull’esito degli approcci terapeutici parodontali non chirurgici.
In una metanalisi del 2021, comprendente 292 pubblicazioni, sono stati presi in considerazione e valutati i percorsi implantari su 35.511 pazienti fumatori e 114.597 pazienti non fumatori. Dall’analisi è emerso che la popolazione fumatrice ha il 140,2% di rischio in più di incorrere in un fallimento implantare rispetto alla popolazione non fumatrice. (Mustapha, Salame, e Chrcanovic 2021)
Dato che la grande possibilità di complicanze implantari determinate dal consumo di sigarette si scontra con la probabilità di far desistere facilmente un fumatore dal vizio del fumo, è importante notare che, in presenza di un paziente che ammetta di consumare più di 10 sigarette al giorno, si è obbligati a informarlo che la riabilitazione protesica
necessita di un monitoraggio nel tempo più stretto e continuo.
L’alcol è tra le sostanze psicoattive più usate in Europa e il suo consumo è considerato il quinto fattore di rischio per il carico di malattia globale.
L’alcool ha effetti sistemici ampi e dannosi e influenza non solo il sistema nervoso centrale, ma anche il tratto gastrointestinale, il sistema immunitario, il fegato e il sistema cardiovascolare. (Mukherjee 2013) L’alcool inibisce anche l’attività degli osteoclasti, riduce la qualità ossea e ritarda la riparazione delle fratture. (De Deco et al. 2015) Il consumo di alcol è un fattore di rischio per l’osteoporosi, con riduzione dell’area corticale e del volume delle trabecole ossee. (Dai et al. 2000)
Un’analisi caso-controllo del 2012, ha rilevato che i fallimenti implantari sono correlati con la tipologia di bevitori raggruppati sulla base della quantità di alcool assunta. (Alissa e Oliver 2012)
I pazienti con consumo di alcol routinario ed eccessivo possono essere a più alto rischio di fallimento dell’impianto. (Sampson 1998) Questi pazienti hanno dimostrato di mostrare una guarigione ritardata dopo l’induzione di una ferita chirurgica a causa di carenze indotte dall’alcol nel sistema del complemento (parte del sistema immunitario), soppressione dei linfociti T e compromissione della mobilità, dell’adesione e delle capacità fagocitiche del sistema immunitario innato. (Friedlander et al. 2003)
La malattia parodontale rappresenta una delle patologie con la maggior prevalenza tra quelle che si sviluppano a carico della cavità orale. Infatti, nei paesi industrializzati una percentuale che varia tra il 20 e il 50% degli adulti soffre di questa forma di malattia infiammatoria cronica.
L’insorgenza della patologia è dovuta a un’alterazione dell’omeostasi tra i batteri della flora residente nella cavità orale e le difese dell’ospite. Tale alterazione esita nella distruzione del tessuto molle che circonda il dente, dell’osso e dei legamenti e causa mobilità e perdita degli elementi dentali.
Le specie batteriche maggiormente associate alla patogenesi della malattia parodontale sono:
Porphyromonas Gingivalis
Streptococcus Sanguis
Actinomyces Viscosus
Tannerella Forsythia
Fusobacterium Nucleatum
Treponema Denticola
Tra i prodotti batterici, il lipopolisaccaride (LPS), un costituente della membrana esterna dei batteri GRAM-, è probabilmente il fattore in maggior misura responsabile dell’induzione del processo infiammatorio e della risposta immunitaria che portano, attraverso la liberazione massiva di mediatori mo-
lecolari (enzimi proteolitici, radicali liberi), al danno tessutale.
La comparsa e la progressione della malattia parodontale dipendono da numerosi fattori di diversa natura, genetici, epigenetici, ambientali e voluttuari.
La patogenesi multifattoriale della malattia parodontale contribuisce all’elevata variabilità dei quadri clinici e ha reso necessaria una recente revisione di quelli che sono i criteri di classificazione.
Sono state proposte due classificazioni: una che si basa sulla gravità, la complessità, l’estensione e la distribuzione e definisce 4 stadi di malattia (Tabella 12); l’altra che fa riferimento alle caratteristiche biologiche della malattia e delinea 3 gradi di possibile progressione (lenta, moderata, rapida) (Tabella 13).
Si definisce anemia una condizione caratterizzata dalla riduzione della concentrazione dell’emoglobina (Hb) nei globuli rossi. L’anemia è certamente una delle condizioni patologiche più diffuse nel mondo, sia nei paesi sviluppati, sia in quelli in via di sviluppo.
La diminuzione della concentrazione di Hb può essere dovuta a diverse cause che, in ultima analisi, o ne aumentano la perdita, a seguito della distruzione dei globuli rossi, o ne diminuiscono la sintesi. Tra queste ultime, la carenza di ferro (sideropenia) è sicuramente tra le più frequenti. Dal punto di vista clinico questa anemia può causare, oltre alle problematiche inerenti il processo di guarigione e di osteointegrazione, anche bruciori alla lingua, glossite atrofica e cheilosi.
Nel bacino Mediterraneo hanno una prevalenza significativa le talassemie, note anche come anemia mediterranea. Si tratta di una forma di anemia a eziologia genetica che comporta la riduzione o la mancata sintesi delle catene α o β della Hb. Per questo si distinguono α e β talassemie che hanno gravità diversa a seconda del numero dei geni (2 per catene β e 4 per le α) che presentano mutazioni o delezioni. Nelle talassemie la condizione di anemia è dovuta sia al deficit di sintesi di Hb e alla distruzione nel midollo osseo dei precursori degli eritrociti, sia a un’aumentata distruzione dei globuli rossi a livello della milza (emocateresi extravasale) a seguito delle alterazioni morfologiche e funzionali che essi presentano.
Di particolare rilevanza sono anche le anemie associate a malattie di tipo infettivo, infiammatorio cronico e oncologico, in particolare artrite reumatoide, polimialgia reumatica e neoplasie con sindromi paraneoplastiche. Queste anemie sono tra le più frequenti nei paesi industrializzati e possono essere distinte da quella sideropenica perché non rispondono alla terapia marziale.
A differenza delle anemie descritte precedentemente che sono microcitiche, quelle conseguenti alla carenza di acido folico e vitamina B12 sono macrocitiche. In questi casi l’aumento di volume dei precursori degli eritrociti (megaloblasti) è dovuto al fatto che le carenze succitate impediscono la duplicazione del DNA, e quindi la proliferazione, ma non la trascrizione e la traduzione. Per questo la
cellula aumenta di volume senza potersi dividere. La più classica delle anemie megaloblastiche è l’anemia perniciosa.
Come detto precedentemente, le anemie possono essere anche la conseguenza di una perdita dei globuli rossi per emorragia o emolisi. Quest’ultima, a sua volta può essere dovuta ad un difetto intrinseco o estrinseco dei globuli rossi e verificarsi in sede extravascolare o intravascolare, condizione questa che può portare a significative manifestazioni cliniche.
La diagnosi delle anemie emolitiche si basa sull’aumento in circolo della bilirubina non coniugata (o indiretta) e sulla presenza dei reticolociti (forma ancora non completamente matura degli eritrociti). In generale, il paziente anemico non può essere sottoposto a interventi di implanto-protesi fino a quando i valori di Hb non siano normalizzati o abbiano raggiunto un livello di sicurezza per il paziente stesso. Questo perché è stata riportata in letteratura una correlazione diretta tra anemia, alterazioni a livello del microcircolo e deficit di guarigione. In particolare, alcuni studi hanno evidenziato che la riduzione della Hb aumenta il rischio di cronicizzazione delle ferite e di amputazione nei soggetti diabetici. (Yammine, Hayek, e Assi 2021)
Le malattie autoimmuni sono la conseguenza di una rottura della tolleranza immunitaria che comporta l’attivazione del sistema immunitario nei confronti di componenti self. Queste patologie sono dovute all’intervento sia della risposta cellulo-mediata (linfociti T), che di quella mediata da anticorpi e possono essere di tipo localizzato o sistemico. Sulla base di questo meccanismo patogenetico, i pazienti con patologie autoimmuni sono spesso sottoposti a cicli di trattamento con farmaci immunosoppressori
Tra le patologie autoimmuni troviamo alcune malattie del tessuto connettivo, anche chiamate malattie reumatiche o collagenopatie. Anche le malattie reumatiche di natura autoimmune hanno andamento evolutivo cronico a carico dell’apparato locomotore e dei tessuti connettivi di tutto l’organismo. Secondo l’OMS le malattie reumatiche sono la prima causa di dolore e disabilità in Europa e da sole rappresentano la metà delle patologie croni-
che ad alto potenziale invalidante. In Italia si stima che ne soffra circa 1% della popolazione, con una maggiore prevalenza tra le donne. Se non adeguatamente diagnosticate e controllate, comportano progressiva limitazione e perdita di autosufficienza con conseguente compromissione della qualità di vita ed elevati costi sociali.
I disordini autoimmuni rappresentano una categoria di malattie per le quali è difficile programmare un percorso terapeutico, soprattutto per la maniera subdola con cui insorgono le complicanze a essi associate.
Il paziente con patologia autoimmune, infatti, presenta una risposta infiammatoria alterata dai farmaci che assume per il mantenimento in fase di latenza della patologia, ed è, inoltre, in una situazione di immunosoppressione da farmaci.
Il trattamento farmacologico di queste patologie ha lo scopo di ridurre e controllare il più possibile i sintomi del dolore e l’infiammazione articolare, riducendo la perdita di funzione e la distruzione articolare e, di conseguenza, la disabilità. Vengono utilizzate diverse categorie di farmaci: FANS, tra cui i salicilati, DMARD (Disease Modyfing Anti-Rheumatic Drugs), corticosteroidi, immunosoppressori e farmaci biologici. L’efficacia dell’impiego di questi ultimi nel trattamento delle malattie reumatiche è stata dimostrata in diversi studi scientifici. (Burmester et al. 2013)
I farmaci biologici hanno rappresentato un avanzamento molto importante nella terapia di molti quadri di reumatismi infiammatori autoimmuni, comportando un miglioramento dei sintomi, il ritardo nella progressione della malattia e un incremento dello stato funzionale e della qualità di vita. I pazienti che sono trattati con questi farmaci avvertono generalmente un rapido miglioramento dei sintomi legati alla malattia (dolore e gonfiore articolare). I farmaci biologici impiegati nel trattamento reumatologico sono: Infliximab (Remicade), Abatacept (Orencia), Rituximab (Mabthera), Tocili-
zumab (Roactemra) somministarti per via endovenosa. Adalimumab (Humira), Etanercept (Enbrel), Anakinra (Kineret), Certolizumab (Cimzia), somministrati per via sottocutanea.
Il trattamento cronico a cui questi soggetti sono sottoposti ha profonde ripercussioni sulla loro capacità di guarigione.
I farmaci antinfiammatori e, soprattutto gli immunosoppressori, aumentano il rischio di sovrainfezione e diminuiscono la sintesi del collagene con conseguente prolungamento della fase proliferativa, condizione questa che può anche determinare la cronicizzazione della ferita
La definizione “patologia infiammatoria dell’intestino” (in inglese “IBD”, Inflammatory Bowel Disease) include due tipi di infiammazione cronica: l’enterite regionale (Morbo di Crohn o colite granulomatosa, MC) e la colite ulcerosa (CU)
Queste affezioni presentano un decorso clinico caratterizzato da periodi di riacutizzazione e remissione dei sintomi. Il numero di malati in Italia può essere stimato tra 150.000 e 200.000 casi, con un’incidenza annua di circa 10.000 nuovi casi.
Sia la colite ulcerosa che il Morbo di Crohn possono manifestarsi a qualsiasi età, ma l’incidenza più elevata è tra i 20 e i 40 anni per la prima e tra i 15 e i 35 per la seconda.
Il trattamento delle IBD è volto a ridurre l’aspetto infiammatorio e a sopprimere le reazioni immunitarie per favorire la remissione, con lo scopo ultimo di prevenire le complicanze e migliorare la qualità di vita del paziente. La terapia per questi soggetti è composta da vari farmaci tra cui amminosalicilati, corticosteroidi, antibiotici, immunosoppressori e farmaci biologici ed è la stessa utilizzata per le patologie autoimmuni riportata precedentemente. (Spina et al. 2013) (Siddiqui MA 2005; 65 (15): 21792208) o (Burmester 2013; Ford et al. 2011)
SEQUENZE DI TRATTAMENTO PER GESTIRE LE CRITICITÀ IN PAZIENTI CON COMPROMISSIONE SISTEMICA
Come spiegato nell’ambito della valutazione dei rischi del paziente complesso, è importante dedicare allo stato emotivo la stessa attenzione che viene prestata a quello fisico-sistemico, poiché entrambi rappresentano delle variabili che possono potenzialmente compromettere l’esito della procedura.
La procedura di controllo farmacologico dell’ansia può essere definita in modi diversi. Si può parlare di ansiolisi, di controllo farmacologico dell’ansia o di sedazione cosciente. Per quanto riguarda l’ambito odontoiatrico, è preferibile non utilizzare quest’ultima definizione quando si interagisce con i pazienti, perché la terminologia viene spesso fraintesa.
Molto spesso i pazienti tendono, erroneamente, ad associare il termine sedazione (spesso impropriamente utilizzato anche dai medici odontoiatri) con quello di anestesia generale, o narcosi, che viene invece effettuato esclusivamente nelle sale operatorie ospedaliere da medici specialisti in Anestesia e Rianimazione. Per questo, è importante scegliere con cura le parole e parlare di ansiolisi o di trattamenti eseguiti sotto controllo farmacologico dell’ansia
In generale, i benefici che derivano dall’eseguire l’attività chirurgica su un soggetto sotto controllo farmacologico dell’ansia sono:
Poter mettere in atto procedure anche più invasive in pazienti ansiosi, fobici o che la richieda-
no espressamente e offrire loro, quindi, un setting di cura più confortevole.
Sottoporre i pazienti complessi a procedure chirurgiche in un contesto di maggior sicurezza, sia per il paziente, sia per il chirurgo, e con un miglior controllo del dolore.
La somministrazione del trattamento di ansiolisi può essere praticata dall’odontoiatra sedazionista, dopo specifica formazione. («Direttiva 78/687/CEE del Consiglio, del 25 luglio 1978, concernente il coordinamento delle disposizioni legislative, regolamentari e amministrative per le attività di dentista» s.d.)
Le competenze specifiche richieste a tale figura fanno riferimento alla conoscenza della farmacologia (farmacodinamica e farmacocinetica delle molecole utilizzate, nonché di tutti gli antidoti), all’abilità tecnica (es. rilevazione parametri vitali, reperimento degli accessi venosi periferici), e, soprattutto, alla completa abilità gestionale dell’eventuale evento avverso, indipendentemente che sia legato alla procedura o ad altra motivazione.
La formazione avanzata di rianimazione cardiopolmonare (ALS - Advanced Life Support o BLSDBasic Life Support early Defibrillation) è imprescindibile per l’odontoiatra, così come la formazione di base per gli assistenti che lavorano con lui (BLSBasic Life Support).
La scelta del farmaco e della posologia da somministrare per ottenere il livello voluto di ansiolisi non è una decisione arbitraria dell’operatore, ma deve tener conto di numerosi fattori:
Il risultato della valutazione MDAS (Modified Dental Anxiety Scale).
Il tipo di procedura che deve essere eseguita.
Il livello di sedazione che si vuole raggiungere.
Il rischio emotivo del paziente (ansia/fobia).
Il rischio fisico sistemico del paziente.
L’ansiolisi farmacologica può essere somministrata come associazione di benzodiazepine per via orale e endovenosa. Questo protocollo, unito a un’efficace anestesia locale, rappresenta la chiave per una pratica clinica sicura e soddisfacente, sia per il paziente sia per l’operatore, purché venga eseguita correttamente, sia adatta al caso particolare e l’analgesia ottenuta sia completa e duratura.
Le regole fondamentali per una corretta esecuzione sono:
L’ansiolisi non deve mai procurare la perdita di coscienza, per consentire il normale continuum operativo del chirurgo.
Nel paziente devono essere mantenuti i riflessi di protezione delle vie aeree (tosse e deglutizione), fondamentali per la prevenzione di eventi avversi come l’ab ingestis
L’odontoiatra utilizza soprattutto farmaci ad azione ansiolitica, modulando il dosaggio in base alle necessità del singolo paziente, che deve comunicare in tempo reale all’odontoiatra il raggiungimento del proprio stato di benessere emotivo. È importante che anche il consenso informato sia chiaro e comprensibile. Esso va fornito in anticipo al paziente, come tutti i consensi informati, e deve riportare le informazioni circa la tecnica che è stata scelta e viene proposta, le alternative disponibili, i rischi e i benefici associati alla pratica.
Il digiuno non è necessario per gli interventi odontoiatrici minori effettuati in ansiolisi, a condizione che durante la procedura venga sempre mantenuto il contatto verbale.
Diversamente, quando è necessario intervenire in maniera più invasiva e per un tempo più lungo, il digiuno pre-operatorio è indicato e deve essere eseguito secondo la regola “NPO 2-4-6” (Nihil per os, nulla per bocca, digiuno minimo di 2 ore per liquidi chiari, 4 ore per latte, 6 ore per cibi solidi).
I requisiti imprescindibili per poter procedere ad ansiolisi in autonomia sono:
Consenso e collaborazione del paziente.
Abilità nel reperire un accesso venoso o collaboratore infermiere.
Conoscenza dei farmaci ad azione ansiolitica e dei loro antidoti.
Conoscenza delle tecniche di titolazione e dei tempi di somministrazione dei farmaci.
Possesso della certificazione per la “formazione di soccorso avanzato per la gestione delle emergenze” (ALS o BLSD) e competenza nell’applicare il protocollo di soccorso.
Nell’ambito dell’attività chirurgica si è affermata la convinzione che, per innalzare la qualità della gestione dei percorsi assistenziali e chirurgici, sia necessaria la presenza nel team di un infermiere che prenda in carico il paziente nelle fasi pre-chirurgica (del paziente e del contesto, rilevazione parametri vitali, pre-medicazione per ansiolisi, incannulamento venoso per somministrazione di farmaci, prelievo venoso per produzione emocomponenti), intra-operatoria (secondo operatore di chirurgia e/o gestione della somministrazione dei farmaci intra-operatori), post-operatoria (controllo delle condizioni del paziente e assistenza post operatoria fino alla dimissione).
Oramai si ritiene che un team di chirurgia dovrebbe essere composto da medico, infermiere e assistente alla poltrona e che tutti dovrebbero essere formati sulla rianimazione cardiopolmonare, in base alla figura che rivestono (medico e infermiere in possesso di ALS o BLSD e assistente in possesso di BLS). Il team può avvalersi della collaborazione di un anestesista per i casi più complessi.
Ovviamente, tutti i membri del team devono avere conoscenze specifiche e approfondite sulle tecniche di ansiolisi
Per ottenere una buona ansiolisi, la procedura deve essere effettuata secondo un ordine preciso per rendere tutti i passaggi il meno traumatici possibile. È necessario che il paziente assuma il farmaco per os circa trenta minuti prima del presunto inizio dell’incannulamento venoso.
Il protocollo d’intervento si basa sulle linee guida pubblicate, sui manuali specialistici e sull’esperienza personale.
La riduzione dei fattori di stress deve diventare la priorità nella chirurgia odontoiatrica.
In primis l’impiego di tecniche chirurgiche minimamente invasive, per esempio la corretta esecuzione del lembo da disegnare in funzione dell’anatomia del sito da operare, può aiutare a raggiungere l’obiettivo. La modalità mini-invasiva, associata a un’adeguata sequenza operatoria, aumenta significativamente le probabilità di ottenere la guarigione ottimale dei tessuti, anche nei casi complicati da patologie sistemiche o da terapie farmacologiche associate.
Non solo la chirurgia, ma anche la successiva riabilitazione protesica va scelta in funzione dell’invasività minore che meglio si adatti al paziente complesso. Strategicamente, è utile ridurre al minimo indispensabile il numero degli impianti per ancorare le protesi, così come scegliere impianti il cui posizionamento riduca al minimo la preparazione chirurgica intraossea, come impianti corti e impianti stretti. Qualora sia possibile non si devono associare al posizionamento degli impianti tecniche di rigenerativa ossea che utilizzino materiali eterologhi o chirurgie particolarmente invasive.
Nell’ottica di ridurre al minimo lo stress biologico sui tessuti è evidente che si deve ragionare sull’atto chirurgico in sé, per garantire che la guarigione sia soddisfacente e il più rapida possibile. Per raggiungere questo obiettivo è necessario rispettare alcune regole fondamentali che permettono di eseguire l’intervento con un’invasività minima, senza però interferire con la qualità del risultato.
In questo Capitolo saranno prese in considerazioni tre sequenze chirurgiche, che possono essere condotte insieme o separatamente, il cui denominatore comune deve essere la “chirurgia delicata”:
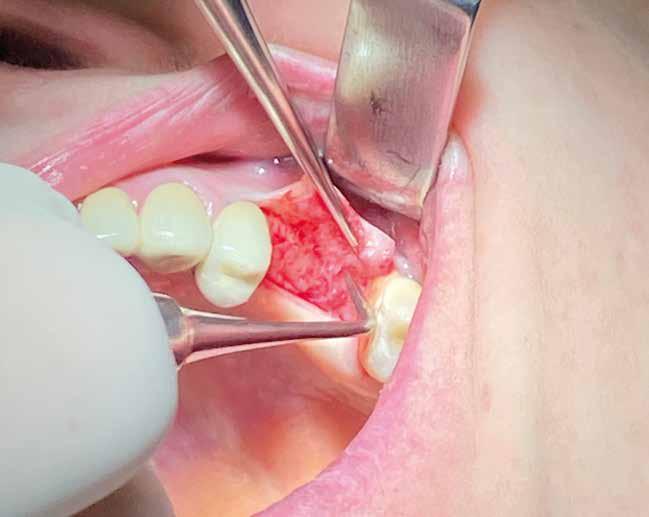
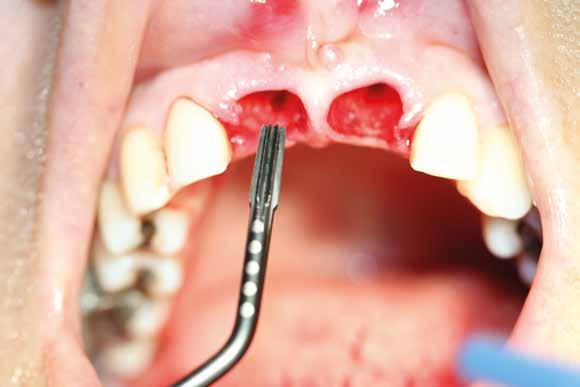
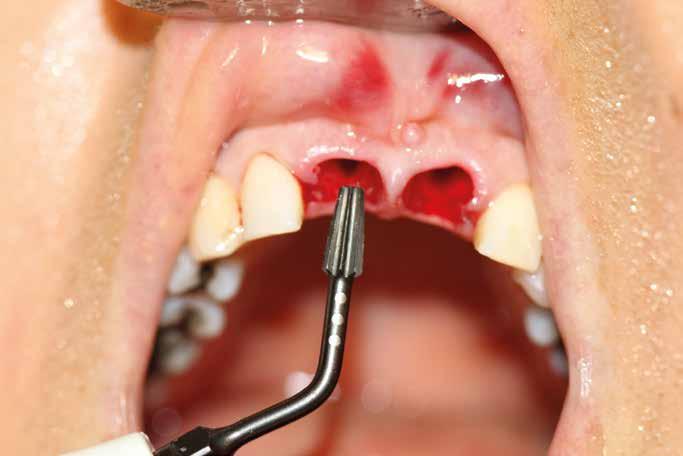
1. Accessi chirurgici (Figg. 1,2)
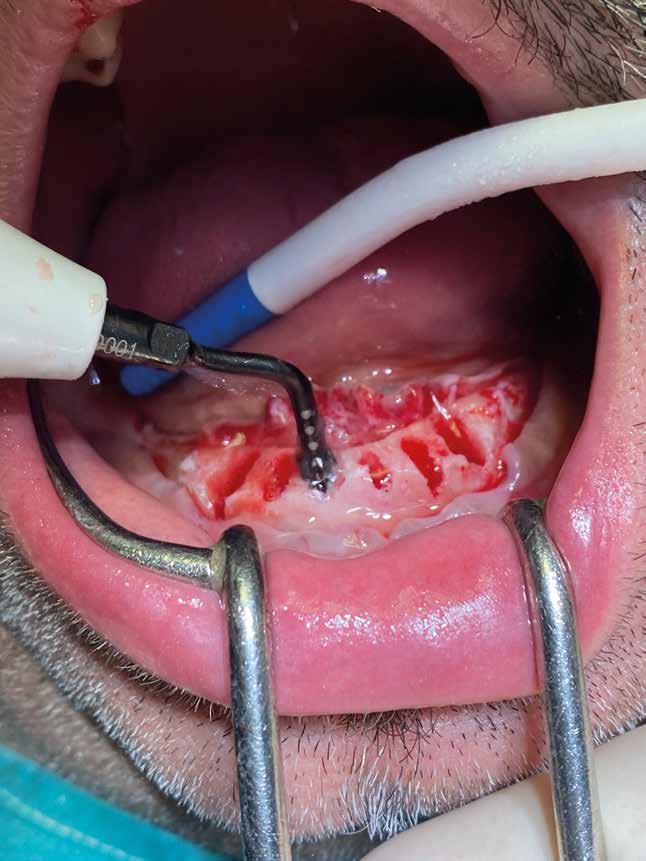
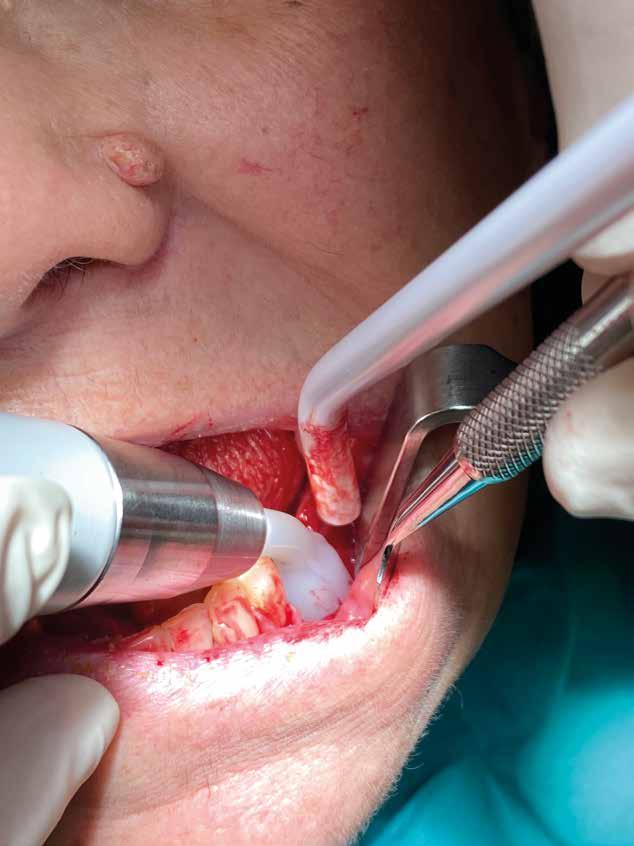
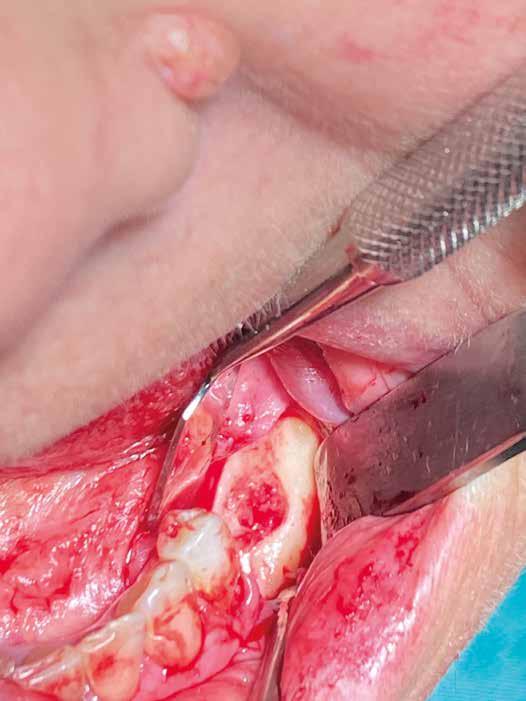
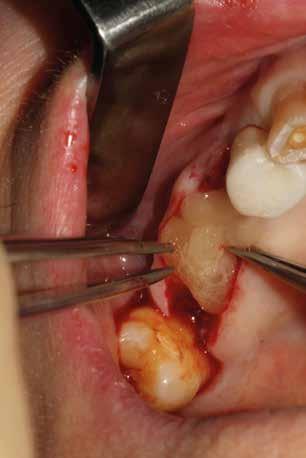
2. Estrazione dentaria (Figg. 3-6)
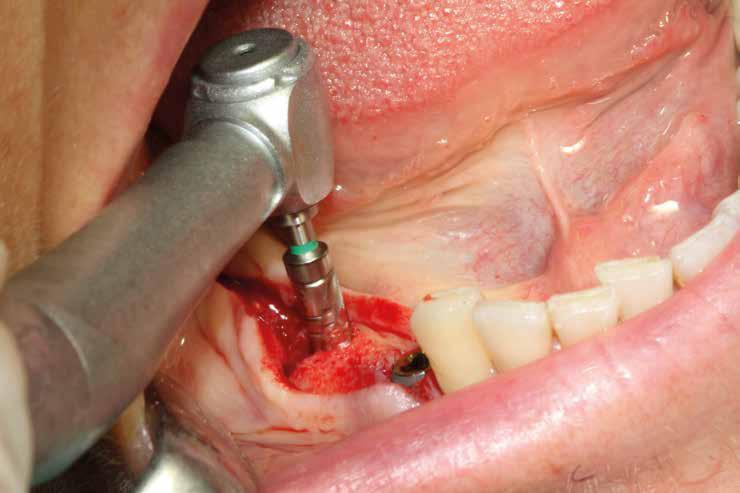
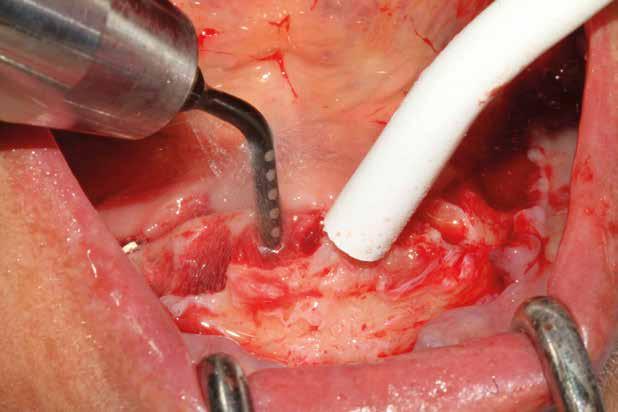
3. Preparazione del sito implantare (Figg. 7,8)
Dovendo intervenire sui tessuti molli per raggiungere l’osso sottostante, il chirurgo deve sempre scegliere il lembo più adeguato; un concetto fondamentale è che esso:
Abbia la dimensione idonea per permettere un’adeguata visuale del sito di intervento.
Sia il più integro possibile, ossia non presenti incisioni frastagliate, compressioni o danneggiamenti derivanti dalla fase di scollamento.
Sia disegnato nel rispetto della sede anatomica. È necessario porre estrema attenzione ai tessuti gengivali prossimi ai denti attigui al sito chirurgico, nonché alle strutture nobili circostanti.
Le incisioni di scarico devono essere progettate nel rispetto della vascolarizzazione dei tessuti, cosa che permette di avere una rivascolarizzazione più rapida della zona operata e, di conseguenza, una minor sofferenza dei tessuti in neoformazione. Se i tessuti periferici alla zona di intervento sono meno compromessi (poco ipossici e non frastagliati), è più semplice garantire un sigillo della ferita corretto.
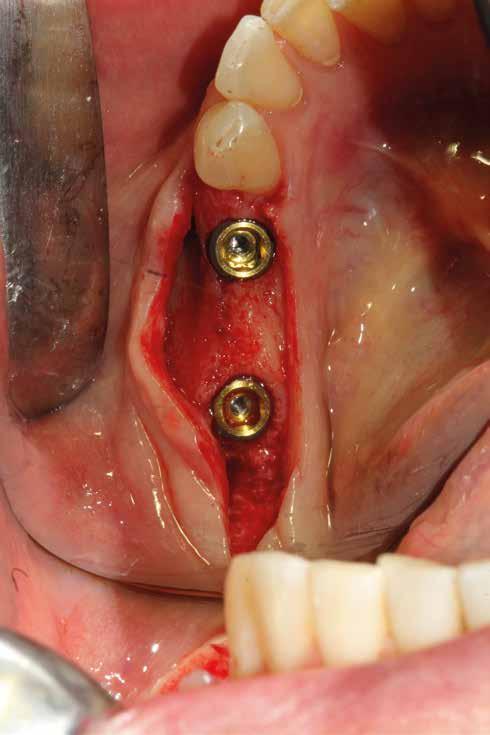
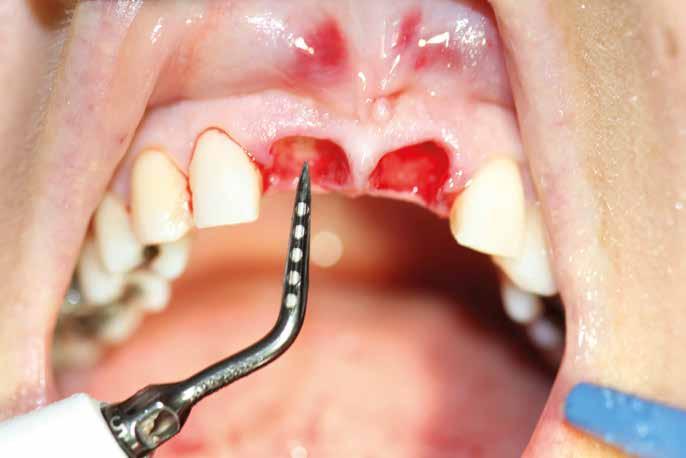
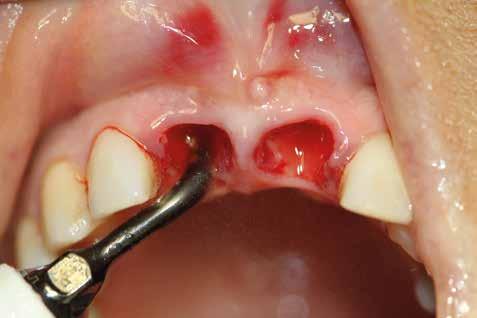
In ultimo, ha grande importanza anche il momento della sutura, la scelta dell’ago, del filo e la tecnica di legatura dei nodi (fatti alla giusta distanza gli uni dagli altri e con la giusta tensione); la riuscita dell’intervento dipende anche dalla qualità con cui vengono riavvicinati i lembi in modo da non ischemizzarne o danneggiarne i bordi. (Figg. 9-14)
Esempio chirurgico di accesso tra 2 elementi dentari con conformazione della cresta alveolare ampia. Incisione del lembo in cre sta senza scarichi laterali con sollevamento di 2 lembi, palatale e vestibolare; si può notare come quest’ultimo non si estenda oltre
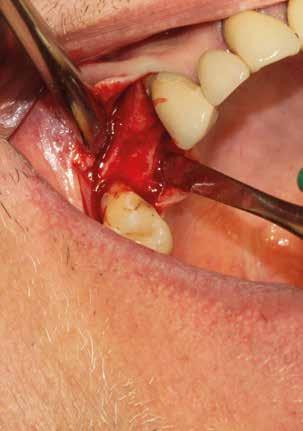
Estrazione di 3 elementi dentari complicata da frattura coronale di 2.4 e presenza di 2 corone protesiche unite su denti pluriradicolati. L’approccio deve prevedere la rimozione delle corone protesiche e la separazione delle radici, semplificando le manovre di estrazione e consentendo di risparmiare i tessuti molli pericoronali e prevenire la frattura
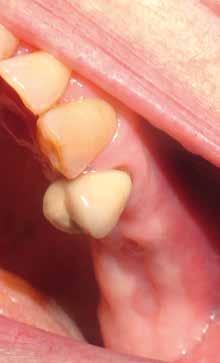
Il rispetto dei tessuti molli consente di ridurre i tempi di guarigione, sebbene a siti più ampi corrisponda un tempo di ripristino o maggiore. Il mantenimento delle corticali vestibolari, palatine e l’assenza di alveolite post-estrattiva riducono l’atrofia ossea.
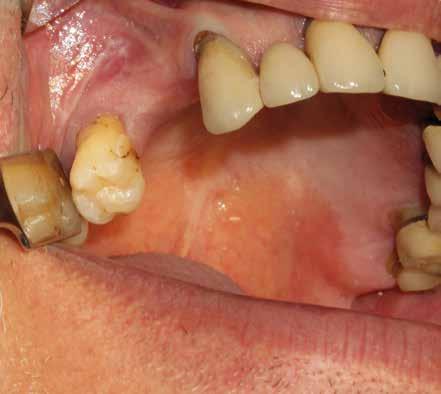
Un ridotto scollamento dei tessuti molli riduce edema e dolore post operatorio, mentre la preparazione del sito implantare a bassi giri con irrigazione limita il trauma del tessuto osseo.
Una incisione lineare netta si estende coinvolgendo minimamente il dente mesiale e maggiormente in direzione distale, consente di evitare l’esecuzione di incisioni di scarico che provocano una interruzione della vascolarizzazione maggiore, senza ridurre la visibilità del campo operatorio.
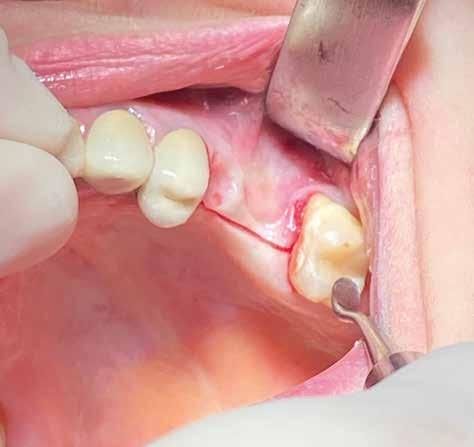
Disegno del lembo d’accesso con spostamento della incisione crestale sul versante palatino. Lo scollamento della porzione vestibolare deve avvenire con uno scollatore di piccole dimensioni e l’ausilio di una pinza chirurgica
La microvibrazione degli inserti ultrasonici non presenta la tendenza allo scivolamento tipica delle frese rotanti consentendo di mantenere con maggiore semplicità e precisione l’orientamento del tunnel implantare, soprattutto quando si prepara all’interno dei un alveolo post-estrattivo agendo su una superficie liscia e inclinata. Nelle immagini è possibile vedere una serie di situazioni in cui
Una pulizia approfondita e delicata può essere effettuata con il piezo-clean anche su piani ossei coinvolti dalla chirurgia resettiva. Lo strumento crea una zona circoscritta di applicazione di ultrasuoni amplificando l’azione di detersione dei residui di tessuto necrotico, di microorganismi patogeni e di vasocostrizione, che migliora la visibilità del sito.
PROTOCOLLI DI TRATTAMENTO
IMPLANTO-PROTESICI PER IL PAZIENTE COMPLESSO
1. Presenta sempre un rischio fisico-sistemico, più o meno grave.
2. Presenta sempre rischio a carico della guarigione, più o meno grave.
3. Può non essere fobico, ma il paziente fobico deve sempre essere trattato come complesso.
4. Può non presentare rischio odontoiatrico.
Per quanto si sia cercato di trovare una collocazione univoca a ciascuna patologia, la loro espressione sui soggetti è troppo variabile per poterle inserire in un’unica categoria. È quindi indispensabile, come per molte altre azioni che fanno parte dell’assistenza al paziente complesso, valutare il singolo caso per poter lavorare in massima sicurezza.
Questa divisione in due gruppi di rischio, medio e alto, indirizza gli operatori verso il percorso terapeutico meno invasivo, che inizia con la scelta del piano di trattamento implanto-protesico, continua con la progettazione dell’intervento e si conclude con la gestione dei follow-up. Maggiore è il rischio e più minuziose devono essere le attenzioni verso il percorso e verso il paziente.
Sono stati precedentemente elencati gli strumenti di cui l’odontoiatra dispone per limitare lo stress indotto durante le sedute operatorie (tecniche chirurgiche incluse) e le strategie che si possono adottare per stimolare la riparazione dei tessuti. È un errore comune quello di pensare che per ottenere il risultato migliore sia sufficiente applicare sempre tutte le metodiche a disposizione.
Il paziente complesso deve essere riabilitato con percorsi terapeutici semplici, che prevedano il minor numero possibile di sedute operatorie (compattando le prestazioni in sedute più lunghe) e il ricorso a protocolli meno invasivi per i tessuti orali.
Nella routine operatoria si è abituati a decidere quali protocolli operativi usare in funzione del rischio (o dei rischi) che presenta il paziente. Questo metodico lavoro di programmazione e implementazione del piano di trattamento può funzionare solo se sono state stabilite delle priorità e se non vengono dimenticate le regole base:
1. Danneggiare il meno possibile, rispettando i tessuti.
2. Eliminare minuziosamente i residui necrotici, per ristabilire equilibrio nel cavo orale.
3. Stabilizzare il coagulo, in modo che funga sia da barriera meccanica sia da stimolatore biologico per tutte le fasi riparative.
4. Abbreviare i tempi tra un follow-up post-chirurgico e l’altro, per intercettare precocemente le possibili complicanze.
In virtù dell’argomento di questo testo, cioè la riabilitazione implanto-protesica in pazienti complessi, è indispensabile avere chiaro il vero obiettivo finale, che è garantire al paziente un recupero della funzione masticatoria ed una buona estetica, educandolo affinché capisca che il mantenimento nel tempo dipenderà dalla costanza nell’igiene domiciliare e dai follow-up di controllo.
Una volta valutato il rischio assoluto, si deve riflettere principalmente sulla sequenza operatoria e riabilitativa da scegliere; ogni tecnica che, nel corso del tempo, la scienza ha messo a disposizione con lo scopo di raggiungere il miglior risultato possibile, va attualizzata sul singolo paziente perché, pur rientrando in una categoria di rischio, egli conserva sempre la sua unicità. (Tabella 6.1,6.2)
È assolutamente necessario ricordare che il paziente complesso:
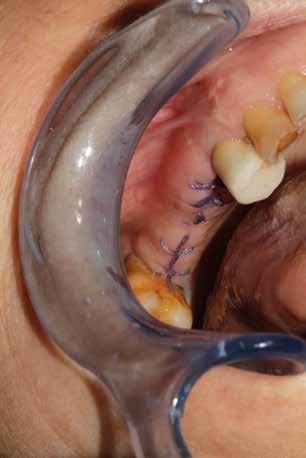
Per ottenere una buona guarigione in tempi fisiologici è importante iniziare l’intervento chirurgico nell’ottica del massimo rispetto dei tessuti. Questo obiettivo può essere raggiunto minimizzando l’estensione dell’incisione ed esercitando una divaricazione dei lembi sufficiente a garantire visuale libera al chirurgo. Per la preparazione del sito implantare utilizzare la fresatura a bassi giri garantisce un minor impatto stressante sul tessuto osseo. Per aiutare la riparazione sono fondamentali due fattori: l’impiego degli emocomponenti e una buona tecnica di sutura. Questo percorso consente di ottenere un sigillo di qualità già a 7 giorni dall’intervento.
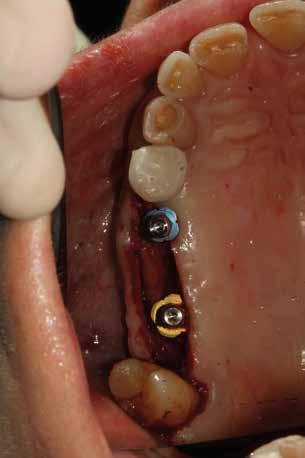
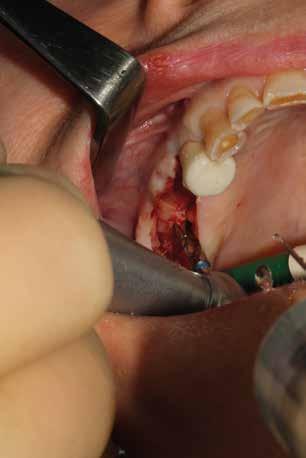
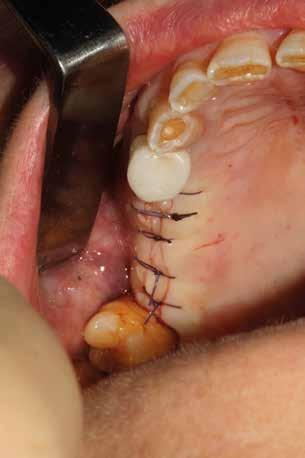
Riabilitazione implantoprotesica in paziente con rischio assoluto alto
Molto spesso i pazienti sono consci di avere una situazione orale ben lungi dall’essere accettabile. Problemi di salute, propria o di familiari, difficoltà economiche o spese prioritarie da sostenere possono influire in maniera significativa sulla possibilità di curarsi, soprattutto in campo odontoiatrico.
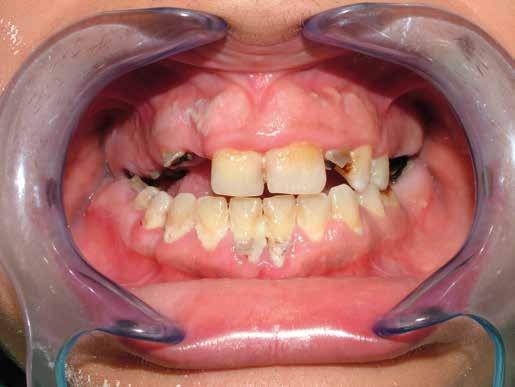
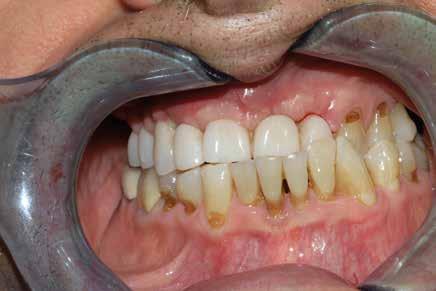
Il paziente del seguente caso, già visitato nel 2019, è poi tornato nel 2021 per una rivalutazione. Già durante la prima visita era stata rilevata una situazione di compromissione generale, sia dal punto di vista igienico, sia funzionale.
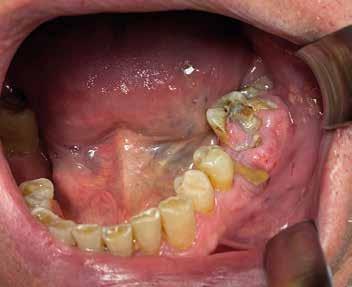
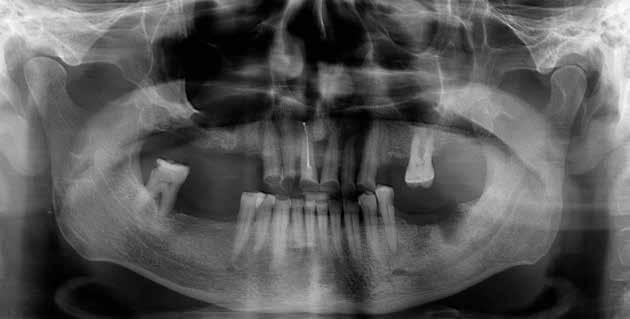
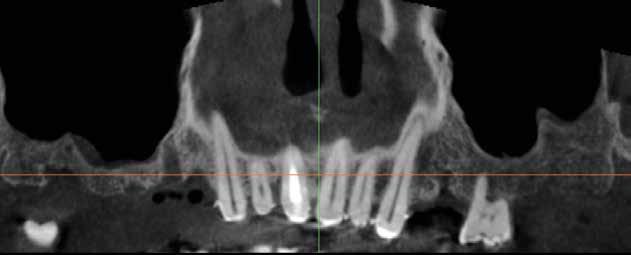
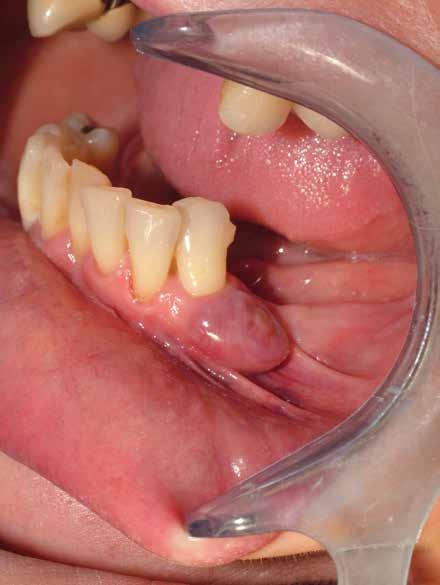
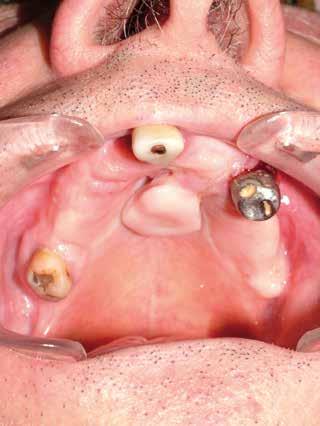
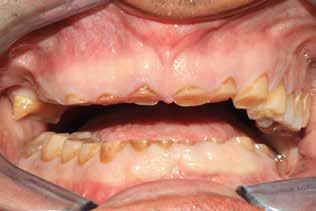
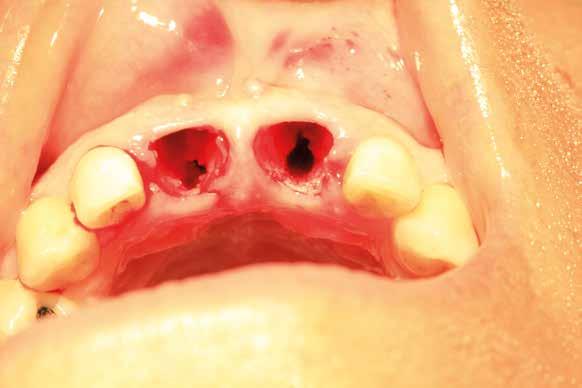
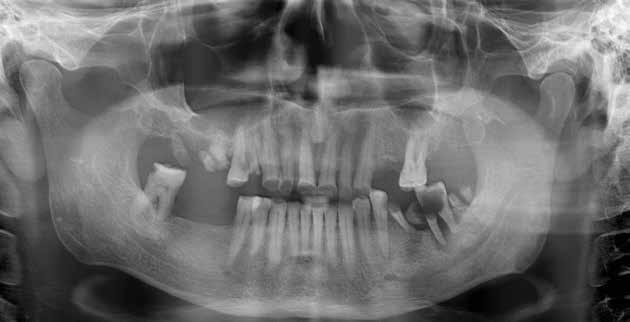
Alla visita di rivalutazione è emerso un ulteriore peggioramento della situazione, confermata anche dall’esame radiografico, con parodontopatia, sanguinamento al sondaggio, infiammazione diffusa, alitosi, difetto parodontale verticale mesiale a 2.3, residui radicolari 1.4, 1.6, 1.7, 3.6, 3.8 e carie destruenti di 1.5, 2.6, 3.5, 3.7 (con lesione endoperio) e 4.7 con estrusione e carie (Figg. 1, 2)
Il paziente, un uomo di 67 anni, ha confermato l’anamnesi precedente, ossia di essere portatore di
molteplici patologie: sindrome metabolica in discreto compenso farmacologico (riferita assunzione di metformina 500 mg, enalapril, acido acetilsalicilico, atorvastatina) e in terapia sostitutiva con levotiroxina perché operato di tiroidectomia totale per un tumore in giovane età; deambulazione autonoma con aiuto del bastone per via di un intervento al ginocchio abbastanza recente (riferito 6 mesi prima intervento di protesi totale di ginocchio).
Spesso è importante ascoltare i pazienti mentre descrivono la loro vita di tutti i giorni, perché si possono scoprire dati importanti che il paziente sottostima. In questo caso, è stato fondamentale chiedere al paziente se avesse problemi a dormire o assumesse terapie specifiche per agevolare il sonno, per venire a conoscenza che da tempo soffre di apnee notturne per le quali indossa la CPAP. È stato spiegato al paziente che una riabilitazione protesica corretta avrebbe migliorato anche la situazione delle apnee.
Si è consigliato di procedere per gradi, con bonifica di tutti gli elementi malati e irrecuperabili e successivamente sostituire gli elementi mancanti o con protesi rimovibili o con una protesi fissa sostenuta da impianti (Fig. 3).
La proposta che il paziente ha accettato è stata poi quella, previa bonifica di tutti gli elementi irrecuperabili, di riabilitare con impianti prima il 1° e 4° quadrante e in seguito il 2° e 3° e procedere poi alla protesi definitiva in un’unica soluzione.
Prima di procedere con gli interventi si è richiesto degli ematochimici di routine, per controllare soprattutto la glicemia, l’emoglobina glicata, la coagulazione, la vitamina D e i sali minerali.
Al controllo ematologico è emersa una emoglobina glicosilata molto superiore la percentuale accettabile a procedere (il valore era 9,3%) e deficit di D-25OH che è stato risolto con una terapia di ripristino con colecalciferolo 25000 U.I. Data la stretta correlazione tra emoglobina glicata e affezioni orali, è ormai routine seguire un percorso che porta alla bonifica della bocca e contestualmente, che aiuta il paziente anche con il controllo della glicemia. In prima battuta comunque, abbiamo sottoposto il paziente a una seduta orale. Per via del suo stato di salute (abbiamo stabilito per lui un rischio alto) durante ogni seduta invasiva abbiamo sempre monitorato il paziente con rilevazioni multiple dei parametri e reperendo un accesso venoso pe-
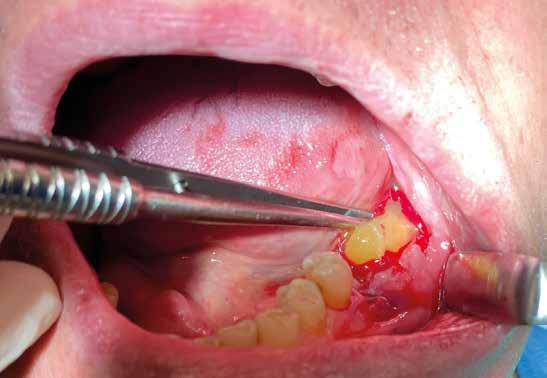
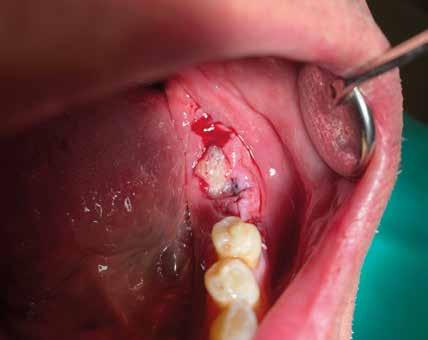
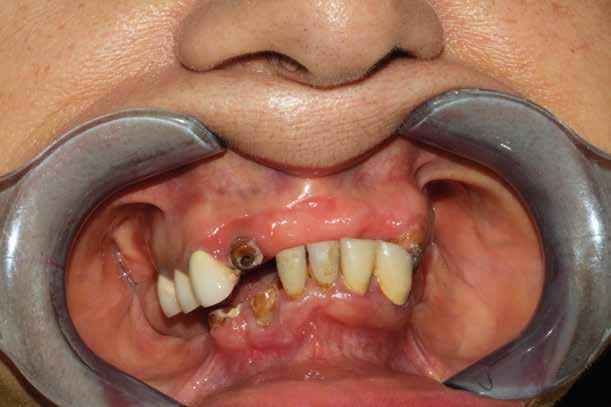
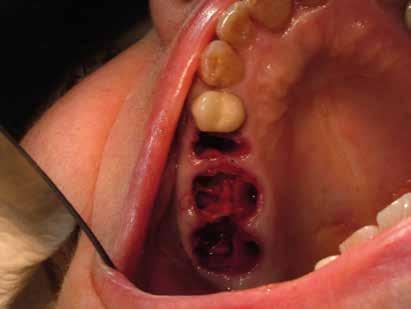
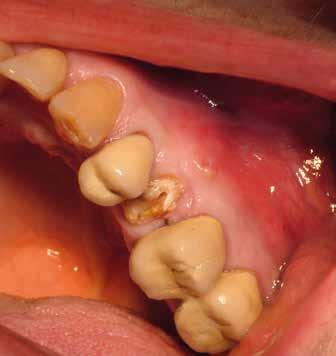
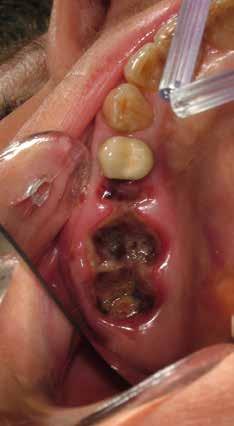
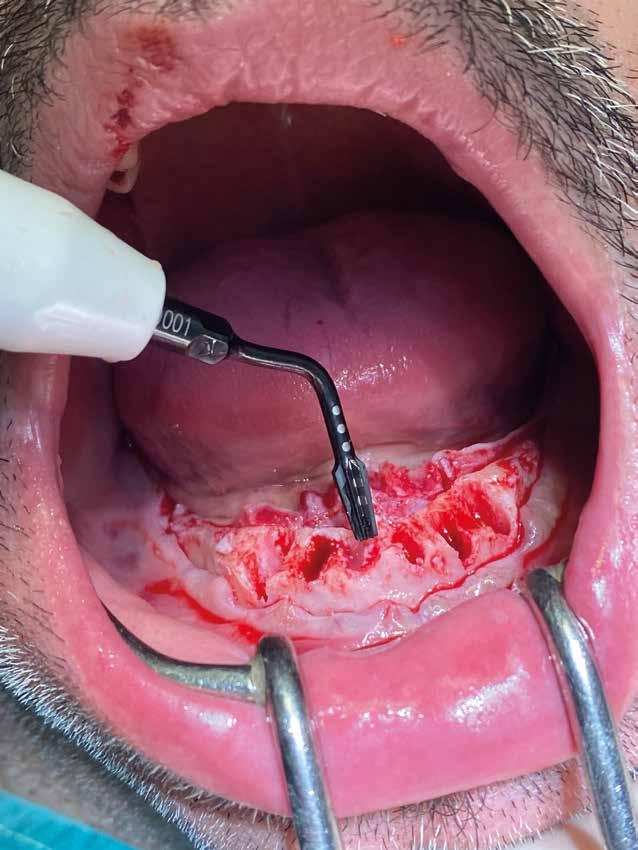
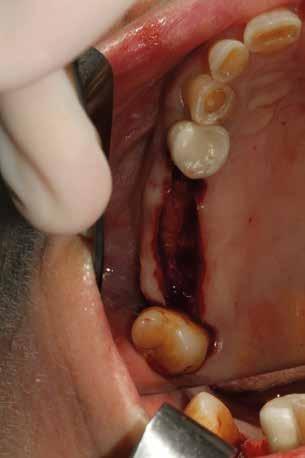
riferico. Si è eseguito la maggior parte delle estrazioni in un’unica seduta operatoria, a esclusione degli elementi 2.6 e 4.7 che sono stati mantenuti perché presentavano mobilità ma non segni di focolai infettivi attivi e che si è deciso di estrarre in un secondo momento. Il follow-up post estrattivo ha consentito anche di valutare la risposta tissutale e la guarigione degli alveoli. Non è stata sospesa la terapia con l’acido acetilsalicilico. Il PRGF è stato importante per evitare alveoliti che avrebbero rallentato la guarigione (Figg. 4-6).
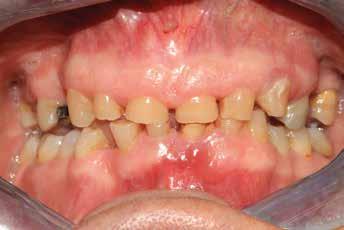
Dopo tre mesi dalla prima fase estrattiva sono stati ripetuti gli esami ematochimici dai quali l’emoglobina glicata del paziente è scesa a 7.2%. Abbiamo pertanto avviato con lo studio pre-implantare che prevede la ceratura diagnostica e gli esami radiologici più avanzati per scegliere i giusti impianti e la loro sede corretta.
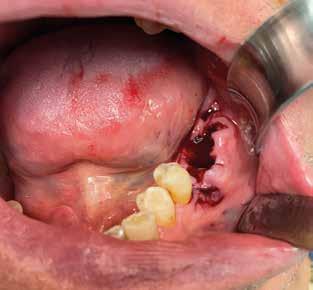
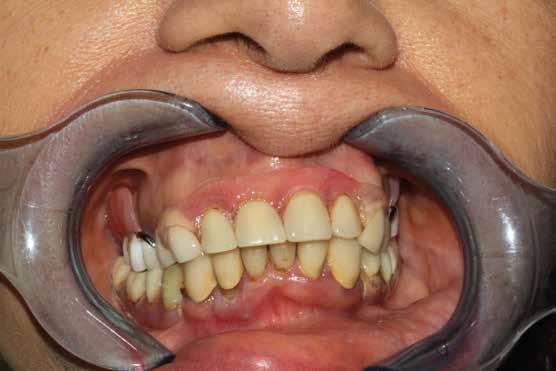
L’esame CBCT ha rivelato un quantitativo di osseo sufficiente a procedere con l’intervento implantare, anche se erano ancora visibili le zone delle estrazioni; inoltre ha evidenziato una lesione osteolitica a carico del 3.5 che abbiamo dunque deciso di estrarre (Figg. 7-20).