Nietypowi podejrzani: 5 luk w Twoim programie badań środowiskowych


Rewolucja czy zwykła ewolucja? Cytometria przepływowa a weryfikacja procesów mycia i dezynfekcji w zakładach produkcji żywności.


Impedancyjna cytometria przepływowa i jej zastosowanie w monitorowaniu

Wydanie 15 Publikacja Romer Labs®
środowiska produkcyjnego. 6.0 µm 5.5 µm 5.0 µm 4.5 µm 4.0 µm 3.5 µm 3.0 µm 2.5 µm 2.0 µm 6.0 µm 5.5 µm 5.0 µm 4.5 µm 4.0 µm 3.5 µm 3.0 µm 2.5 µm 2.0 µm
Spot On to publikacja Romer Labs




Division Holding GmbH, rozpowszechniana bezpłatnie.

ISSN: 2414-2042



Osoba redagująca:

Joshua Davis
Współautorzy:
Cristian Ilea, Florin Soptica, Stefan Widmann
Oprawa gra�iczna:
GraphX DSM Austria
Badania:
Kurt Brunner
Wydawca:
Romer Labs Division Holding GmbH









Erber Campus 1
3131 Getzersdorf, Austria
Tel: +43 2782 803 0 www.romerlabs.com
©Copyright 2023, Romer Labs®



Wszelkie prawa zastrzeżone. Żadnej część niniejszej publikacji nie wolno powielać w jakiejkolwiek formie materialnej w celach komercyjnych bez pisemnej zgody właściciela praw autorskich.
Wszystkie zamieszczone poniżej zdjęcia są własnością Romer Labs lub zostały wykorzystane na podstawie licencji.
Firma Romer Labs jest częścią DSM.
Spis treści
Nietypowi podejrzani:

5 luk w Twoim programie badań środowiskowych

Nawet najlepiej przygotowane programy monitorowania procesów mycia i dezynfekcji mają swoje słabe punkty. Stefan Widmann przygląda się bliżej pięciu najbardziej prawdopodobnym - a zarazem najbardziej niebezpiecznym - lukom w programie monitorowania środowiska produkcyjnego.
Autor: Stefan Widmann, Kierownik Zespołu Badań i Rozwoju, Romer Labs
4-9
Rewolucja czy zwykła ewolucja?
Cytometria przepływowa a weryfikacja procesów mycia i dezynfekcji w zakładach produkcji żywności.
Producenci żywności muszą dbać o to, aby ich środowisko przetwarzania było czyste i wolne od mikroorganizmów chorobotwórczych. Ale jak to się obecnie odbywa i jaki jest potencjał cytometrii przepływowej w kontekście wery�ikacji programów mycia i dezynfekcji?
Autor: Cristian Ilea, Dyrektor ds. marketingu i zarządzania produktami, Romer Labs
Impedancyjna cytometria przepływowa i jej zastosowanie w monitorowaniu środowiska przetwarzania żywności
Co to jest cytometria przepływowa, jak działa i jakie zastosowanie może mieć w monitorowaniu środowiska przetwórstwa spożywczego? Na te i inne pytania odpowiadają Florin Soptica i Stefan Widmann.
Autorzy: Florin Soptica, Kierownik Produktu, Romer Labs i Stefan Widmann, Kierownik Zespołu Badań i Rozwoju, Romer Labs
14-15
2
6.0 µm 5.5 µm 5.0 µm 4.5 µm 4.0 µm 3.5 µm 3.0 µm 2.5 µm 2.0 µm 6.0 µm 5.5 µm 5.0 µm 4.5 µm 4.0 µm 3.5 µm 3.0 µm 2.5 µm 2.0 µm
10-13
Artykuł wstępny

Wypełnianie luk w programie badań środowiskowych za pomocą cytometrii przepływowej.

Obecność bakterii w zakładach produkujących żywność i napoje może wpływać na trwałość i jakość artykułów spożywczych. Z kolei obecność patogenów może nawet doprowadzić do zatruć pokarmowych. Z tego właśnie powodu mycie i dezynfekcja mają zasadnicze znaczenie dla zapewnienia bezpieczeństwa żywności oraz ochrony reputacji i firmy.
Jednak walka z czymś, czego nie widać, nie zawsze jest łatwa i prosta. Kontrola wizualna może pomóc, ale sama w sobie nie wystarczy. Tradycyjne metody mikrobiologiczne często nie pozwalają na przeprowadzenie działań prewencyjnych, ponieważ na wyniki badań laboratoryjnych trzeba czekać wiele dni. Z kolei testy ATP, choć proste i szybkie, określają jedynie ilość pozostałości biologicznych, które nie są miarodajnym wskaźnikiem skuteczności przeprowadzonego procesu dezynfekcji. Mimo tych wszystkich ograniczeń, wciąż wymagana jest umiejętność szybkiego podejmowania świadomych i trafnych decyzji.
W tym wydaniu magazynu Spot On skupimy się na impedancyjnej cytometrii przepływowej oraz na tym, w jaki sposób może ona zapewnić producentom żywności możliwość natychmiastowej weryfikacji przeprowadzonego procesu mycia i dezynfekcji. Rozpocznę od omówienia 5 najbardziej uporczywych luk w każdym programie badań środowiskowych i szczegółowo przeanalizuję, dlaczego tradycyjne metody badawcze mogą nie wychwycić, na przykład, bakterii żywych, ale niehodowlanych lub psychrotroficznych - i dlaczego stanowi to pewien problem.

Mój kolega, Cristian Ilea, będzie kontynuował rozważania na temat impedancyjnej cytometrii przepływowej i nowego cytometru przepływowego CytoQuant®. Dzięki CytoQuant® producenci żywności mogą uzyskać natychmiastowy wgląd w stężenie bakterii i pozostałości cząstek stałych obecnych w środowisku produkcyjnym. Rzut oka na wewnętrzne działanie CytoQuant® i jego zdolność do ilościowego oznaczania bakterii i pozostałości właściwie od razu uzupełni to zagadnienie.

W ostatecznym rozrachunku stawka jest zbyt duża - bezpieczeństwo konsumentów i reputacja firmy - aby producenci żywności musieli czekać przez wiele dni na uzyskanie istotnych informacji o przeprowadzonym programie mycia i dezynfekcji. To właśnie zmotywowało nas do zbadania cytometrii przepływowej i ostatecznie do opracowania CytoQuant®.
Mam nadzieję, że ten numer Spot On przypadnie Wam do gustu.
 Stefan Widmann
Stefan Widmann
Publikacja Romer Labs ® 3
Kierownik Zespołu Badań i Rozwoju, Romer Labs



4 Spot On wydanie 15 6.0 µm 5.5 µm 5.0 µm 4.5 µm 4.0 µm 3.5 µm 3.0 µm 2.5 µm 2.0 µm
Nietypowi podejrzani: 5 luk w Twoim programie badań środowiskowych
Nawet najlepiej przygotowane programy monitorowania procesów mycia i dezynfekcji mają swoje słabe punkty. Stefan Widmann bierze pod lupę pięć najbardziej prawdopodobnych - a zarazem najbardziej niebezpiecznych - luk w programie monitorowania środowiska i wyjaśnia, czym one są, dlaczego należy się nimi przejmować i co można w tej kwestii zrobić.
Publikacja Romer Labs ® 5
Autor: Stefan Widmann, Kierownik Zespołu Badań i Rozwoju, Romer Labs
6.0 µm 5.5 µm 5.0 µm 4.5 µm 4.0 µm 3.5 µm 3.0 µm 2.5 µm 2.0 µm
Co prawda nie znamy jeszcze wszystkich gatunków bakterii, które mogą stać się VBNC (viable but not culturable), czyli żywe, ale nienadające się do hodowli, ale wiemy, że niektóre z nich faktycznie to robią; wśród nich są organizmy wskaźnikowe, fałszerze i patogeny.
#1


Mikroorganizmy żywe, ale nienadające się do hodowli (VBNC)
Przez długi czas mikrobiolodzy zakładali, że wszystkie bakterie, które nie rosną w normalnych kulturach, są martwe. Późniejsze badania wykazały, że istnieje jeszcze trzeci stan, poza zdolnością do hodowli i śmiercią: zdolny do życia, ale nienadający się do hodowli (VBNC). Ogólnie rzecz biorąc, bakterie w stanie VBNC nie namnażają się, ale nadal są żywe, o czym świadczy ich aktywność metaboliczna. Dla nas najbardziej istotny jest fakt, że po reanimacji mogą one stać się kulturami i w ten sposób rozmnażać się w żywności. Co więcej, niektóre bakterie chorobotwórcze nie rozwijają się bez żywiciela i wystarczy tylko, że przetrwają w żywności do momentu jej spożycia, aby wywołać chorobę.
Istnieje wiele powodów, dla których bakterie mogą przejść w stan VBNC; głodzenie, inkubacja poza zakresem temperatur optymalnych dla wzrostu, podwyższone stężenie osmotyczne, stężenie tlenu czy wystawienie na działanie białego światła - to tylko niektóre z nich. O tym, co dokładnie powoduje, że bakterie przechodzą w ten stan, decydują konkretne cechy danego szczepu bakterii.
Dlaczego miałoby Cię to obchodzić?
Niektóre z bakterii, które potrafią przejść w stan VBNC, stanowią zagrożenie dla produkcji żywności. Chociaż nie znamy jeszcze wszystkich gatunków bakterii, które mogą stać się VBNC, znamy kilka, które to robią; zaliczają się do nich organizmy wskaźnikowe (takie jak Klebsiella aerogenes i Klebsiella pneumoniae), fałszerze (takie jak Lactobacillus plantarum i Lactococcus lactis) i patogeny (takie jak Salmonella Typhimurium, Campylobacter coli lub Listeria monocytogenes).
Po ich zidentyfikowaniu musimy teraz zadać sobie pytanie, czy bakterie te mogą powrócić do stanu pełnej zdolności hodowlanej i potencjalnie patogennej? Mikrobiolodzy przez długi czas nie mieli jasności w tej kwestii, ponieważ trudno jest w pełni oddzielić bakterie VBNC od tych, które można
hodować. Naukowcy rozwiązali ten problem, częściowo stosując podejście statystyczne: rozcieńczają duże ilości bakterii VBNC do tego stopnia, że pozostanie jakichkolwiek bakterii nadających się do hodowli jest praktycznie niemożliwe. Bakterie są następnie liczone po określonym czasie. Jeżeli obserwuje się wysoki stopień wzrostu, jedynym możliwym wnioskiem jest to, że bakterie nie są już w stanie VBNC i nadają się do hodowli. Kolejnym następstwem jest fakt, że jeśli uda im się powrócić do stanu umożliwiającego hodowlę, mogą również ponownie stać się patogenne. Istnieją przykłady na to, że właśnie takie zjawisko prowadzi do wybuchu epidemii. Dla przykładu - obecność VBNC
E. coli O157 podejrzewano przy epidemii w Japonii w 1997 r., ponieważ całkowita liczba E. coli była nieznaczna, a szczepy Shiga-toksyczne, takie jak O157, mogły wywołać chorobę w bardzo małej liczbie.
#2
Bakterie beztlenowe i mikroaerofile
Bakterie beztlenowe lub - w szerszym rozumieniu - mikroorganizmy beztlenowe można podzielić na trzy grupy: anaeroby obligatoryjne (bezwzględne beztlenowce), anaeroby tolerujące warunki atmosferyczne i anaeroby fakultatywne (względne beztlenowce). Jak wskazują ich nazwy, każde z nich ma specjalne wymagania względem powietrza, a dokładniej tlenu, który je otacza. Obligatoryjne beztlenowce, takie jak Clostridioides difficile, giną wkrótce po wejściu w kontakt z tlenem. Bakterie tolerujące warunki atmosferyczne, takie jak Clostridium botulinum , nie mogą korzystać z tlenu i nie giną, ani nie rosną w jego obecności. Beztlenowce fakultatywne mogą korzystać z tlenu, ale nie potrzebują go do wzrostu, tak jak w przypadku E. coli. Istnieje również grupa bakterii mikroaerofilnych, takich jak Campylobacter, które potrzebują tle-
6 Spot On wydanie 15
nu do wzrostu, choć w znacznie mniejszych ilościach (1 – 2 %) niż w normalnym powietrzu, ale mogą być spowalniane w warunkach tlenowych.
Dlaczego miałoby Cię to obchodzić?
Niektóre bakterie chorobotwórcze mają takie specjalne wymagania dotyczące wzrostu. Obecnie termotolerancyjne gatunki Campylobacter są powodem do niepokoju wśród pracowników służby zdrowia publicznego. Średnio co drugi kurczak jest zakażony bakterią Campylobacter, przez co mięso drobiowe jest jedną z najczęstszych źródeł zatruć pokarmowych.

W UE choroby wywołane przez Campylobacter występują dwa razy częściej niż te spowodowane przez Salmonellę. Jeśli chodzi o grupę beztlenowców, gatunek Clostridia, taki jak C. botulinum, jest odpowiedzialny za chorobę przenoszoną drogą pokarmową, znaną jako botulizm, często przenoszoną przez żywność konserwowaną (tj. ubogą w tlen), w której C. botulinum może się rozwijać i wytwarzać toksyczny dla ludzi związek, czyli botulinę. Inny gatunek Clostridia, jakim jest C. perfringens,, jest najczęstszym źródłem zatruć pokarmowych w USA i Kanadzie, a wywołuje objawy takie jak: skurcze brzucha i biegunka. Ryzyko zakażenia C. perfringens jest szczególnie wysokie w przypadku żywności przechowywanej lub magazynowanej w ciepłych warunkach przez dłuższy czas, co sprzyja ich wzrostowi do liczby zakaźnej (104 jtk/g).
todą płytkową" to termin, którego używamy do opisania obserwacji, że liczba komórek pod mikroskopem jest znacznie wyższa niż odpowiadająca jej liczba "jednostek tworzących kolonię" na płytkach agarowych. Najlepiej zobrazować to zjawisko za pomocą kilku przykładów: chociaż 50 % mikroorganizmów flory jamy ustnej da się wyhodować na płytkach agarowych, to hodowla większości flory przewodu pokarmowego w ogóle nie jest możliwa.
Metody oznaczania liczby drobnoustrojów tlenowych opierają się na bardzo ogólnych podłożach, które nie sprzyjają wzrostowi większości grup bakterii. Technicznie rzecz biorąc, nie jest to część wielkiej anomalii liczebności drobnoustrojów oznaczanych metodą płytkową, ponieważ niektóre bakterie mogą rosnąć na specjalnych płytkach agarowych w specjalnych warunkach (takich jak warunki beztlenowe lub mikroaerofilne).
Dlaczego miałoby Cię to obchodzić?
Metody płytkowe są bardzo czasochłonne, konieczny jest też okres inkubacji, trwający do dziesięciu dni, w zależności od stosowanego protokołu.
Wielka anomalia liczebności drobnoustrojów oznaczanych metodą płytkową
Według niektórych szacunków z obecnym poziomem wiedzy i technikami, jakimi dysponujemy, jesteśmy w stanie wyhodować jedynie 1 % bakterii. "Wielka anomalia liczebności drobnoustrojów oznaczanych me-
Wielka anomalia liczebności drobnoustrojów oznaczanych metodą płytkową nie stanowi dużego problemu w przeprowadzaniu codziennych testów, ponieważ liczba drobnoustrojów tlenowych będąca wskaźnikiem obecności mikroorganizów jest konkretna dla danego środowiska produkcyjnego i zależna od ustalonego poziomu odniesienia. Metody płytkowe są jednak bardzo czasochłonne, konieczny jest też okres inkubacji, trwający do trzech dni, w zależności od stosowanego protokołu. Istnieją metody bezpośrednie, w których etap hodowli w celu policzenia bakterii nie jest wymagany; mikroskopy zapewniają pełny obraz bakterii, ale są mimo wszystko również bardzo czasochłonne. Co prawda metody bezpośrednie, takie jak cytometria przepływowa, są powszechnie stosowane w zakładach uzdatniania wody, ale nie są jednak popularne w przemyśle spożywczym.

Publikacja Romer Labs ® 7
#3
Psychrotro�iczne
gatunki Pseudomonas
są drobnoustrojami najczęściej
odpowiedzialnymi
za psucie się schłodzonego mięsa przechowywanego w warunkach tlenowych.
Bakterie psychrotroficzne
Bakterie psychrotroficzne mogą rozwijać się w temperaturach tak niskich jak 0°C, przy czym optymalna i maksymalna temperatura wzrostu wynosi powyżej 15°C. Sprawia to, że tego typu mikroby są szczególnie problematyczne w przypadku środków spożywczych i napojów, takich jak surowe mięso i mleko, przechowywanych przez dłuższy czas w niskich temperaturach. Najczęściej występujące w żywności psychrotroficzne grupy bakterii to Gram-ujemne rodzaje Pseudomonas, Aeromonas, Achromobacter, Serratia, Alcaligenes, Chromobacterium i Flavobacterium oraz Gram-dodatnie rodzaje, takie jak Bacillus , Clostridium , Corynebacterium , Streptococcus , Lactobacillus i Microbacteria . Wiadomo również, że Listeria monocytogenes i niektóre szczepy Clostridium botulinum mogą rozmnażać się w temperaturach chłodniczych.

Dlaczego miałoby Cię to obchodzić?
Bakterie psychrotroficzne są substancjami fałszującymi i mogą znacząco obniżyć jakość i trwałość żywności. Zakłady produkcyjne i zbiorniki magazynowe z funkcją chłodzenia tworzą korzystne środowisko dla namnażania się tych gatunków bakterii. Dla przykładu, w schłodzonym mleku Pseudomonas fluorescens może wytwarzać zarówno proteazy, jak i lipazy. Z tego też powodu gatunki należące do grupy Pseudomonas uznaje się zazwyczaj za odpowiedzialne za trudności technologiczne, ponieważ wytwarzane przez nie proteazy i lipazy mogą powodować degradację tłuszczu i białek mleka, nadając mleku
szarawy kolor i gorzki smak. Gatunki Pseudomonas są mikroorganizmami najczęściej odpowiedzialnymi za psucie się schłodzonego mięsa przechowywanego w warunkach tlenowych Powszechnie wiadomo, że gatunki Pseudomonas są bardzo wytrzymałe i zdolne do przetrwania trudnych warunków środowiskowych, które hamowałyby wzrost innych mikroorganizmów psujących żywność. W pakowanym próżniowo, chłodzonym surowym mięsie, mikroflora jest w większości przypadków zdominowana przez psychrotroficzne bakterie kwasu mlekowego. Ponadto wzrost liczby patogenów podczas przechowywania w lodówce może prowadzić do poważnych chorób.
Biofilmy
Mikroorganizmy mają zdolność kolonizowania powierzchni poprzez wytwarzanie polimerowej matrycy, w której mogą być obecne różne gatunki drobnoustrojów; jest to tzw. biofilm. Dowody wskazują, że nie tylko określone grupy mikroorganizmów posiadają zdolność do tworzenia i przetrwania w biofilmach. W rzeczywistości zdecydowana większość bakterii jest w stanie uformować biofilmy. Biofilmy mogą zatem składać się z monokultur lub z kilku różnych gatunków mikroorganizmów. Niektórzy badacze sugerują, że złożona struktura mieszanych biofilmów sprawia, że są one bardziej stabilne i odporne na działanie czyszczących środków chemicznych. Początkowa populacja, która przylega do powierzchni, może zmienić jej właściwości, umożliwiając późniejszym gatunkom przyleganie poprzez połączenie typu komórka-komórka (cell-to-cell

8 Spot On wydanie 15
#4
#5
association); w niektórych przypadkach przyłączenie się drugiego gatunku może zwiększyć stabilność populacji biofilmu. Na przykład badania wykazały, że L. monocytogenes chętniej przywiera do stali w obecności bakterii Pseudomonas


Dlaczego miałoby Cię to obchodzić?
Biofilmy, które formują się na urządzeniach do przetwarzania żywności i innych powierzchniach mających kontakt z żywnością, są stałym źródłem zanieczyszczeń, zagrażają ogólnej jakości i bezpieczeństwu produktów żywnościowych i mogą wywoływać choroby przenoszone drogą pokarmową, a także straty finansowe. Wiadomo, że mikroorganizmy powodujące psucie się żywności są odpowiedzialne za prawie jedną trzecią strat w łańcuchach dostaw żywności, co sprawia, że zapobieganie powstawaniu i kontrola nad biofilmem są kwestiami priorytetowymi w przemyśle spożywczym. Mikroorganizmy, które tworzą lub rozwijają się w biofilmach, są bardziej odporne na dezynfekcję, co sprawia, że stanowią problem w wielu gałęziach przemysłu spożywczego. Inne skutki działania biofilmów, takie jak korozja powierzchni metalowych, to kolejny ważny problem w przemyśle spożywczym. W obu przypadkach obecność biofilmów w zakładzie spożywczym stanowi zagrożenie dla zdrowia ludzi. Stopień zagrożenia zależy od samych gatunków bakterii tworzących tę trójwymiarową, żywą strukturę.
Jak wypełnić te luki?
Potencjał cytometrii przepływowej
Producenci żywności na ogół nie mają do dyspozycji zbyt wielu opcji. Te, które zapewniają pewną precyzję, takie jak barwienie żywych komórek w połączeniu z mikroskopem, będą w stanie określić liczbę bakterii VBNC, ale są czasochłonne i wymagają specjalnego sprzętu. Wszystkie grupy bakterii beztlenowych
i mikroaerofilnych - ze znamiennym wyjątkiem beztlenowców fakultatywnych - mogą rozwijać się na klasycznych płytkach agarowych, ale tylko przy ściśle kontrolowanym poziomie tlenu.
Jednak płytki agarowe to nie panaceum. Płytki agarowe są w stanie zliczyć tylko około 1 % znanych gatunków bakterii, a na wyniki trzeba czekać wiele dni - w przypadku bakterii psychrotroficznych nawet do 10 dni. Metody ATP, choć szybkie, nie są w stanie określić ilości bakterii i mają ograniczone zastosowanie w wykrywaniu bakterii w biofilmach; dane kinetyczne ze swobodnie zawieszonych komórek planktonowych nie powinny być stosowane jako punkt odniesienia, ponieważ ilość uwalnianego ATP jest znacznie niższa w przypadku biofilmów. Co więcej, śladowe ilości ATP pochodzące z resztek pokarmowych lub grzybów mogą łatwo przysłonić ATP uwalniany przez bakterie, ponieważ komórki eukariotyczne zawierają 10 milionów razy więcej ATP niż komórki prokariotyczne. W związku z tym urządzenia ATP stosowane do wykrywania biofilmów mają zwykle znacznie wyższą granicę wykrywalności, co oznacza, że nie są tak czułe, jak w przypadku wykrywania swobodnie pływających bakterii.
Każdy z tych pięciu przypadków pokazał, jak trudne może być wykrywanie bakterii i pozostałości na powierzchniach przeznaczonych do produkcji żywności; niedociągnięcia najbardziej powszechnych metod wykrywania, takich jak posiew i test ATP, są zarówno uporczywe, jak i dobrze udokumentowane.
Co mogą zrobić producenci żywności, aby wypełnić luki, które pozostawiają po sobie metody hodowlane i badania ATP? W następnym artykule mój kolega Cristian Ilea omawia potencjał impedancyjnej cytometrii przepływowej i cytometru przepływowego CytoQuant®, nowego rozwiązania, które natychmiastowo zlicza bakterie oraz pozostałości obecne na powierzchniach produkcyjnych.
Śladowe ilości ATP pochodzące z resztek pokarmowych lub grzybów mogą łatwo przysłonić ATP uwalniany przez bakterie, ponieważ komórki eukariotyczne zawierają 10 milionów razy więcej ATP niż komórki prokariotyczne.
Publikacja Romer Labs ® 9





10 Spot On wydanie 15
Rewolucja czy zwykła ewolucja?
Cytometria przepływowa a weryfikacja
mycia
Bezpieczeństwo żywności uzależnione jest w dużej mierze od warunków higienicznych panujących w zakładach produkujących żywność. Wysoki poziom bakterii powodujących psucie się żywności może mieć wpływ na jej trwałość i jakość, natomiast obecność patogenów (takich jak Salmonella i Listeria) może prowadzić do poważnych chorób. Producenci żywności muszą dokładać wszelkich starań, aby ich środowisko przetwarzania było czyste i wolne od mikroorganizmów chorobotwórczych i nie doprowadziło do zanieczyszczenia krzyżowego produktu końcowego. Ale jak to się obecnie odbywa?
Autor: Cristian Ilea, Dyrektor ds. marketingu i zarządzania produktami
Publikacja Romer Labs ® 11
procesów
i dezynfekcji w zakładach produkcji żywności
Producenci żywności potrzebują szybkiej metody, za pomocą której będą w stanie bezpośrednio określić ilość bakterii i cząsteczek różnego rodzaju pozostałości, a także takiej, na którą nie mają wpływu środki dezynfekujące ani temperatura.
Kontrola wizualna
Kontrola wizualna jest warunkiem wstępnym, ale sama w sobie nie jest wystarczająca. Ten sposób weryfikacji poprawności procesu czyszczenia jest subiektywny i niezbyt precyzyjny. Poza tym nawet jeśli na powierzchni nie ma widocznych pozostałości, nie oznacza to, że jest ona nieskazitelna. Kontrola wizualna nie gwarantuje, że wszystkie pozostałości po żywności z poprzedniego cyklu produkcyjnego zostały usunięte lub że środek sanityzujący skutecznie zredukował poziom mikroorganizmów na powierzchni.
Oznaczanie liczby mikroorganizmów za pomocą metod hodowlanych
Są to tradycyjne metody monitorowania higieny środowiska produkcyjnego. Ogólnie rzecz biorąc istnieją dwa sposoby pobierania próbek: metodą kontaktową i metodą wymazów. W przypadku metod kontaktowych, płytki lub szkiełka mikroskopowe są umieszczane na powierzchni, z której mają być pobrane próbki, a następnie są poddawane inkubacji. Pobieranie próbek metodą wymazów odbywa się za pomocą wymazówek lub gąbek, które płucze się w roztworze buforowym, a następnie zaszczepia w sterylnym podłożu i inkubuje. Głównym ograniczeniem tych tradycyjnych metod oznaczania mikroorganizmów jest długi czas oczekiwania na wynik. Ponadto większość gatunków bakterii nie może być hodowana na podłożu agarowym, co jest zjawiskiem znanym jako „wielka anomalia liczebności drobnoustrojów oznaczanych metodą płytkową”.
Wykrywanie ATP
Trójfosforan adenozyny (ATP) to nukleotyd wykorzystywany przez komórki do dostarczania energii. Można go traktować jako molekularną "jednostkę monetarną" energii we wszystkich żywych komórkach. Energia jest przekazywana podczas rozpadu ATP na nukleozyd i wolny fosforan. Hydroliza kowalencyjnych połączeń fosforanów uwalnia energię, która jest wykorzystywana do reakcji. Komercyjne systemy testowe ATP wykorzystują reakcję lucyferyny/lucyferazy, która jest bardzo powszechna w przyrodzie, przy generowaniu światła z energii dostarczanej przez ATP. Im więcej emitowanego światła, tym więcej ATP, co pośrednio może wskazywać na większą ilość pozostałości po żywności lub (potencjalnie) mikroorganizmów. Istnieje jednak jedno ważne zastrzeżenie: ponieważ systemy te opierają się na reakcji enzymatycznej, potencjalne inhibitory lub warunki środowiskowe gorsze niż optymalne mogą powodować uzyskanie błędnych wyników. Temperatura otoczenia może wydłużyć czas reakcji, natomiast światło może utrudniać uzyskanie prawidłowych odczytów. Ponadto środki dezynfekujące mogą zakłócać reakcję, co oznacza, że może nie być rzeczywistej korelacji między żywymi bakteriami obecnymi na powierzchni a wynikami pomiaru ATP. Dlatego też metody oparte na ATP są zwykle stosowane do testowania powierzchni przed zastosowaniem środka dezynfekującego.
Metody ATP mają jeszcze jedną wadę: możliwość ich zastosowania zależy od rodzaju przetwarzanej żywności. Większość pokarmów pozostawia po sobie pozostałości zawierające bardzo duże ilości ATP, przewyższające nawet o kilka rzędów ilości zawarte w komórkach bakteryjnych. W praktyce oznacza to, że systemy ATP nie mogą być stosowane do oceny zanieczyszczenia mikrobiologicznego powierzchni produkcyjnych w większości zakładów przetwórstwa spożywczego. Mimo że za pomocą systemów testowych ATP nie można bezpośrednio policzyć bakterii, są one powszechnie stosowane, ponieważ wyniki są generowane w ciągu kilku sekund, czym nie może pochwalić się żadna z dotychczasowo stosowanych technologii.
Dlaczego więc nie możemy mieć wszystkiego?
Święty Graal w kwestii weryfikacji czystości i dezynfekcji
Producenci żywności potrzebują szybkiej metody, która bezpośrednio określa ilość bakterii oraz cząsteczek różnego rodzaju pozostałości na którą nie mają wpływu środki dezynfekujące i temperatura. Choć wydaje się to nieosiągalne, podstawowa technologia umożliwiająca realizację tego celu istnieje już teraz i jest obecnie w użytku.
Przedstawiamy cytometrię przepływową Cytometria przepływowa (FCM) odnosi się do grupy technik, które wykorzystują sygnały optyczne lub elektryczne do wykrywania i pomiaru pewnych fizycznych lub chemicznych właściwości komórek i cząsteczek zawieszonych w płynie. Prawie 300 badań przeprowadzonych w latach 2000-2018 oceniało FCM jako narzędzie do charakterystyki mikrobiologicznej jakości wody. Badania te były w stanie zilustrować wartość FCM w uzdatnianiu, dystrybucji i ponownym wykorzystaniu wody. Obecnie istnieje szereg badań dokumentujących udane przypadki zastosowania FCM, na tyle wiarygodne, że można zaryzykować stwierdzenie, iż metoda ta mogłaby zostać w sposób racjonalny i realistyczny przyjęta jako rutynowa metoda oceny jakości wody.
Co to wszystko ma wspólnego z oceną skuteczności procedur czyszczenia i dezynfekcji w zakładach produkcji żywności? Metody wcześniej powszechnie stosowane w określaniu jakości wody były często ograniczone przez niską czułość, wysokie wymagania związane z czasem i nakładem pracy, podatność na interferencje ze strony związków hamujących oraz trudności w rozróżnianiu komórek żywotnych i nieżywotnych.
12 Spot On wydanie 15
(Wszystko to brzmi znajomo, prawda?) Ale uwaga: fluorescencyjne cytometry przepływowe to zazwyczaj nieporęczne, drogie urządzenia, a do ich obsługi konieczny jest wysoko wykwalifikowany personel.
Wykorzystanie możliwości cytometrii przepływowej w urządzeniu przenośnym
Aby metoda FCM stała się realnym rozwiązaniem do weryfikacji procesu czyszczenia w zakładach przetwórstwa spożywczego, musi mieć prosty i łatwy w użyciu format przenośny, a jednocześnie na tyle dokładny, aby zapewnić wiarygodną liczbę bakterii i pozostałości w próbkach środowiskowych. Stało się to możliwe dzięki zastosowaniu impedancyjnej cytometrii przepływowej. Impedancyjna cytometria przepływowa to konkretny rodzaj cytometrii przepływowej: zamiast systemów optycznych, takich jak technologia laserowa, impedancyjne cytometry przepływowe wykorzystują prąd zmienny o zmiennej częstotliwości, który umożliwia urządzeniu oddzielne wykrywanie i zliczanie komórek oraz cząsteczek różnego rodzaju pozostałości. Podczas gdy cytometry przepływowe oparte na technologii optycznej są w stanie zliczyć jedynie komórki znakowane barwnikami, cytometry przepływowe impedancyjne mogą wykonać tę samą operację bez konieczności znakowania. W porównaniu z innymi urządzeniami do cytometrii przepływowej są one kompaktowe, przenośne i zasilane bateriami, co umożliwia ich zastosowanie w miejscu pobrania próbki.
W jaki sposób impedancyjne cytometry przepływowe mogą odróżnić komórki bakteryjne od cząsteczek różnego rodzaju pozostałości?
Elektromagnetyczne właściwości bakterii umożliwiają cytometrom przepływowym odróżnienie ich od innych cząsteczek. Cytoplazma i błona komórkowa bakterii zmieniają pole elektryczne w unikalny i możliwy do zidentyfikowania sposób. Podczas gdy prąd elektryczny przepływa przez cząsteczki metaliczne w zasadzie bez przeszkód to cząsteczki nieprzewodzące stawiają opór polu elektrycznemu. Nieuszkodzone komórki bakteryjne przypominają zarówno cząsteczki nieprzewodzące, jak i przewodzące: błona komórkowa uniemożliwia przenikanie prądu o niskich częstotliwościach, co sprawia, że przypominają one cząsteczki nieprzewodzące, natomiast przy wysokich częstotliwościach prąd elektryczny jest w stanie przeniknąć przez błonę. Mikroelektrody w impedancyjnym cytometrze przepływowym generują te pola elektryczne i umożliwiają urządzeniu ilościową ocenę zmian przewodności i oporu w postaci oddzielnych pomiarów dla nieuszkodzonych komórek bakteryjnych oraz cząsteczek różnego rodzaju pozostałości.
Zastosowanie impedancyjnej cytometrii przepływowej w kontekście bezpieczeństwa żywności: przedstawiamy CytoQuant®
Jak wspomniano powyżej, jedną z zalet impedancyjnych cytometrów przepływowych w zestawieniu z innymi rodzajami urządzeń cytometrycznych jest ich przenośność. Lekkie, małe i zasilane bateriami, nadają się do pracy w terenie i w krytycznych punktach kontrolnych, gdzie higiena jest kwestią nadrzędną.
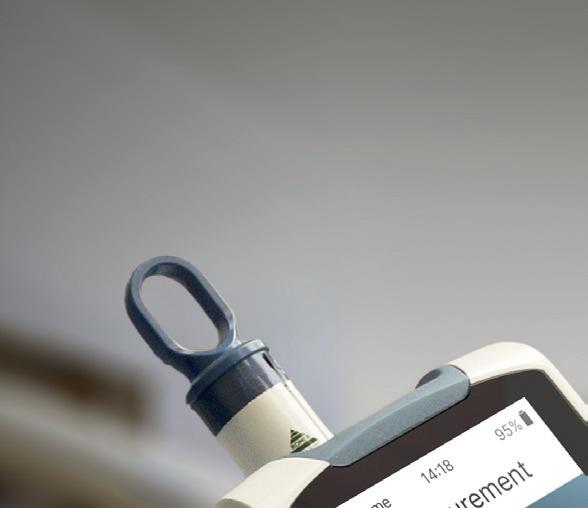
Impedancyjny cytometr przepływowy CytoQuant® przeznaczony jest do stosowania właśnie w takich obszarach, w tym w zakładach produkcji żywności i pomieszczeniach czystych. Impedancyjna cytometria przepływowa przynosi znaczne korzyści producentom żywności, którzy chcą zweryfikować swoje programy stosowane w celu zapewnienia bezpieczeństwa żywności oraz wdrożone procesy mycia i dezynfekcji: szybkie i oddzielne oznaczanie ilościowe bakterii oraz cząsteczek różnych pozostałości (które mogą służyć jako wskaźnik skuteczności czyszczenia), czułość metody oraz wytrzymałość zestawu do pobierania wymazów i samego cytometru. System CytoQuant® jest łatwy w użyciu, ponieważ urządzenie wykonuje całą pracę z wyjątkiem pobierania próbek. Test rozpoczyna się od pobrania wymazu z uprzednio wybranego miejsca (np. 20 x 20 cm). Następnie wymazówka jest umieszczana w fiolce zawierającej opatentowany roztwór przewodzący. Po potrząśnięciu fiolką, w celu zawieszenia bakterii i pozostałości, użytkownik powinien wsunąć ją do urządzenia. Podczas analizy popłuczyn, pobraną próbkę należy umieścić w pustej fiolce, a następnie dodać do niej kilka kropli roztworu elektrolitu. Po wymieszaniu próbki, fiolkę umieszcza się w urządzeniu CytoQuant®. Dwie igły wnikają w dno fiolki, łącząc ciecz z systemem przepływowym w urządzeniu. Następnie, po wprowadzeniu roztworu do układu przepływowego, jest on przepuszczany przez elektrody w mikrofluidalnej kuwecie przepływowej. Po 30 sekundach urządzenie rejestruje oddzielne wyniki dla bakterii oraz cząsteczek i wyświetla je na ekranie.
Rewolucja czy ewolucja?
Mobilny cytometr przepływowy CytoQuant® umożliwia natychmiastową, dokonywaną w miejscu pobrania wymazu, weryfikację procedur mycia i dezynfekcji w zakładach produkcji żywności lub innych obszarach, gdzie higiena ma kluczowe znaczenie. Poprzez bezpośrednie oznaczanie ilościowe bakterii i pozostałości na umytych powierzchniach, bez negatywnego wpływu środków dezynfekcyjnych lub temperatury na wynik, zapewnia znaczące korzyści w porównaniu z urządzeniami ATP, a 30-sekundowy czas pomiaru sprawia, że stanowi on doskonałe uzupełnienie programów higieny opartych na metodach hodowlanych. Biorąc pod uwagę ogromny potencjał impedancyjnej cytometrii przepływowej, może ona w pewnym momencie zacząć być traktowana na równi z metodami hodowlanymi lub nawet je zastąpić, jako standard w weryfikacji procesów czyszczenia. Oznaczałoby to prawdziwą rewolucję w tej dziedzinie.
Impedancyjne cytometry przepływowe wykorzystują prąd zmienny o różnych częstotliwościach, co umożliwia urządzeniu oddzielne wykrywanie i zliczanie komórek oraz cząsteczek stałych.
Publikacja Romer Labs ® 13
Impedancyjna cytometria przepływowa to bardzo wydajny wariant cytometrii przepływowej, ponieważ jest niezawodny i może być stosowany do oceny cech komórek, których pomiar bez użycia znaczników molekularnych, takich jak integralność błony komórkowej, jest niemożliwy.
cytometria przepływowa i jej zastosowanie w monitorowaniu środowiska przetwarzania żywności
Co to jest cytometria przepływowa, jak działa i jakie zastosowanie może mieć w monitorowaniu środowiska przetwórstwa spożywczego? Na te i inne pytania odpowiadają
Florin Soptica i Stefan Widmann.
Czym jest cytometria przepływowa?
Cytometria przepływowa to grupa technik wykorzystujących laser lub pole elektryczne do zliczania komórek zawieszonych w płynie i określania ich właściwości fizycznych lub chemicznych. W optymalnym przypadku przez kanał przepływowy cytometru przepływa tylko jedna komórka naraz, a cytometr wykrywa zmiany długości fali światła lub ładunku elektrycznego w trakcie przepływu każdej komórki lub innej cząsteczki. Ponieważ cytometria przepływowa wymaga na ogół dużych i drogich urządzeń, a także starannych działań przygotowawczych, metoda ta jest tradycyjnie ograniczona do zastosowań laboratoryjnych w takich dziedzinach, jak badania naukowe i medycyna.
Zastosowanie impedancyjnej cytometrii przepływowej do zliczania zarówno komórek, jak i innych cząsteczek
Impedancyjna cytometria przepływowa wywodzi się z technologii, na której bazują liczniki cząsteczek Coulter, które mogą mierzyć i liczyć cząsteczki zawieszone w elektrolitach na podstawie zmian impedancji spowodowanych wypieraniem elektrolitów przez cząsteczki. Dzięki jednoczesnemu pomiarowi wielu częstotliwości dla każdej przechodzącej cząsteczki, impedancyjna cytometria przepływowa może rozróżniać cząsteczki nie
tylko na podstawie ich wielkości, ale także właściwości elektrycznych. Jest to bardzo wydajny wariant cytometrii przepływowej, ponieważ jest niezawodny i może być stosowany do oceny cech komórek, których pomiar bez użycia znaczników molekularnych, takich jak integralność błony komórkowej, jest niemożliwy. Dlatego zamiast lasera w impedancyjnym cytometrze przepływowym stosuje się prąd zmienny, którego zmienne częstotliwości umożliwiają wykrywanie, mierzenie wielkości i oddzielne zliczanie komórek z nieuszkodzoną błoną oraz innych cząsteczek. W porównaniu z innymi urządzeniami do cytometrii przepływowej, impedancyjne cytometry przepływowe mogą być lekkie, przenośne i zasilane bateriami, co umożliwia ich zastosowanie w miejscu pobrania wymazu.
W jaki sposób impedancyjne cytometry przepływowe odróżniają komórki od innych cząsteczek?
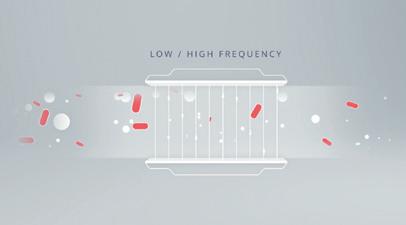
Impedancyjna cytometria przepływowa wykorzystuje unikalne właściwości elektromagnetyczne błony komórkowej i cytoplazmy do odróżniania bakterii od innych cząsteczek. Membrana i cytoplazma komórki wpływają na pole elektryczne w sposób odmienny niż inne cząsteczki w próbce. Przykład z wykorzystaniem cząsteczek metalicznych (przewodzących), cząsteczek nieprzewodzących i nieuszkodzonych komórek w najlepszy sposób ilustruje tę zasadę. Niezależnie od częstotliwości pola elektrycznego, przewodność cząsteczek

Impedancyjna
Autorzy: Florin Soptica, Kierownik Produktu, Romer Labs i Stefan Widmann, Kierownik Zespołu Badań i Rozwoju, Romer Labs
W jaki sposób impedancyjne cytometry przepływowe identyfikują bakterie
Bakterie (na czerwono) i inne cząsteczki przepływają przez kanał przepływowy cytometru.
14 Spot On wydanie 15
Mikroelektrody w kanale przepływowym generują pola elektryczne o wysokich i niskich częstotliwościach.
metalicznych pozwala na jego niezakłócony przepływ. Podobnie w drugą stronę; cząsteczki nieprzewodzące, takie jak polistyren, będą opierać się polu elektrycznemu; prąd będzie poruszać się tylko w cieczy, co prowadzi do wyraźnego przesunięcia objętości skorelowanego z rozmiarem cząsteczek w kanale przepływowym. Nieuszkodzone komórki bakterii są jednak wyjątkowe ze względu na to, że przypominają zarówno cząsteczki przewodzące, jak i nieprzewodzące, w zależności od częstotliwości pola elektrycznego. Przy niskich częstotliwościach, izolacyjna właściwość błony komórkowej uniemożliwia przenikanie pola elektrycznego przez komórkę, co prowadzi do tego samego rodzaju przemieszczenia, jak w przypadku cząsteczek nieprzewodzących. Przy wyższych częstotliwościach możliwe jest jednak częściowe przeniknikanie pola elektrycznego przez membranę; w tym przypadku komórki są podobne do cząsteczek metalicznych. Mikroelektrody w impedancyjnych cytometrach przepływowych generują pola elektryczne zarówno przy niskich, jak i wysokich częstotliwościach, co pozwala urządzeniu wykryć te zmiany w przewodności i oporności oraz przypisać je w postaci precyzyjnej liczby do nieuszkodzonych komórek lub innych cząsteczek. Detektor identyfikuje bakterie jako cel w oparciu o zmienny stopień impedancji lub przewodności przy tych częstotliwościach. Użytkownik otrzymuje wtedy oddzielne zliczenia nieuszkodzonych komórek i innych cząsteczek.
Jak wypada impedancyjna cytometria przepływowa w porównaniu z metodami hodowlanymi?
Tradycyjnym podejściem do monitorowania stanu sanitarnego środowiska przetwarzania żywności są metody hodowlane, a w szczególności stosowanie płytek agarowych.
Metody hodowlane, choć dobrze znane, mają jednak kilka wad związanych z szybkością i zakresem ich stosowania. Metody hodowlane są powolne, potrzeba od jednego do dziesięciu dni, aby bakterie rozwinęły się
w policzalne kolonie. Metody te mierzą wyłącznie te bakterie, które można wyhodować w określonych warunkach danego badania; inna grupa bakterii może wymagać określonego podłoża agarowego lub płynnego, a także określonej temperatury, stopnia oświetlenia lub wilgotności, a to tylko niektóre z wielu różnych zmiennych. Metody hodowlane nie mogą również gwarantować pełnego pomiaru wszystkich bakterii w próbce. "Wielka anomalia liczebności drobnoustrojów oznaczanych metodą płytkową" to problem dobrze znany w mikrobiologii, polegający na tym, że tylko niewielka część bakterii w danej hodowli może być odzyskana przez hodowlę. Bakterie żywe, lecz niedające się hodować (VBNC - viable but non culturable) są żywe, ale z powodu stresu, idiosynkrazji lub nieoptymalnych czynników środowiskowych, nie mogą rosnąć na agarze lub w podłożach płynnych. W niektórych przypadkach można je hodować po reanimacji, co również jest procesem czasochłonnym. Wiadomo, że niektóre bakterie chorobotwórcze, takie jak E. coli O157, przechodzą w stan VBNC wyłącznie po to, aby rozmnażać się na dalszych etapach łańcucha pokarmowego lub u ludzi po spożyciu.
Ponadto bakterie beztlenowe i mikroaerofilne wymagają odpowiednio braku tlenu lub tlenu o stężeniu niższym niż w normalnych warunkach atmosferycznych. Bakterie z tych grup, które można hodować, wymagają specjalnych warunków inkubacji, co zwiększa koszty badań analitycznych.
Impedancyjne cytometry przepływowe zliczają wszystkie bakterie, które przechodzą przez kanał przepływowy, niezależnie od ich stanu (hodowlane, VBNC, niehodowlane, uśpione) czy też wymagań dotyczących hodowli. Takie bezpośrednie, natychmiastowe oznaczenie ilościowe poszerza zakres programu kontroli higieny; bakterie, które nie namnażają się do momentu kontaktu z żywnością lub potencjalnymi żywicielami, mogą być również zliczane za pomocą impedancyjnej cytometrii przepływowej. Umożliwia to także podjęcie natychmiastowych działań zapobiegawczych w sytuacjach, gdy mycie i dezynfekcja nie przebiegają zgodnie z planem.

Impedancyjne cytometry przepływowe zliczają

wszystkie bakterie, które przechodzą przez kanał przepływowy, niezależnie od ich
stanu (hodowlane, VBNC, niehodowlane, uśpione) lub wymagań dotyczących wzrostu.
Unikalny "odcisk palca" bakterii: pole elektryczne może przeniknąć przez błonę komórkową bakterii wyłącznie przy wysokich częstotliwościach. Przy niskich częstotliwościach izolacyjna właściwość membrany zapobiega temu zjawisku.
Publikacja Romer Labs ® 15
Bakterie i inne cząsteczki wpływają na pole elektryczne generowane między elektrodami.
ZOBACZ TO, CZEGO NIE WIDZĄ INNI.
CytoQuant® zapewnia głęboki wgląd w higienę produkcji.








Dzięki natychmiastowemu zliczeniu wszystkich żywych bakterii, możesz mieć pewność, że Twój sprzęt jest czysty – przed rozpoczęciem produkcji.




Dowiedz się więcej na cytoquant.com




Więcej informacji można uzyskać kontaktując się z nami: www.romerlabs.com | solutions.romerlabs@dsm.com











Natychmiastowa weryfikacjaprocesu mycia i dezynfekcji.








































 Stefan Widmann
Stefan Widmann
















































