









Rimanere al passo per la gestione della miopia 4 di Laura Gaspari
Occhio e luce, quando questo rapporto diventa complicato 8 di Laura Gaspari
Ogni diottria conta. Intervista al Dottor Marco Mazza 10 di Laura Gaspari
Topografia corneale 12 di Massimo Camellin, Umberto Camellin
Splash 24
Approfondimenti in collaborazione con le aziende del settore
Board
M. Borgioli
L. Menabuoni
S. Zuccarini
G. Alessio
D. Bacherini
Al. Balestrazzi
A. Malandrini
G. Marchini
A. Galan
L. Mosca
R. Mastropasqua
V. Picardo
R. Protti
M.C. Savastano
Editore
FGE S.r.l
Fabiano Gruppo Editoriale
Redazione: Strada 4 Milano Fiori, Palazzo Q7 20089 Rozzano (MI)
Sede legale: Regione Rivelle, 7 14050 Moasca (AT) Tel. 0141 1706694 - Fax 0141 856013
Pubblicità info@fgeditore.it tel. 0141 1706694
Direttore responsabile
Ferdinando Fabiano f.fabiano@fgeditore.it
In copertina: foto di Wyatte B. su Unsplash
Registrazione presso il Tribunale di Asti N. 02/2024 in data 14 marzo 2024
© Copyright FGE srl È vietata ogni riproduzione totale o parziale di testi e immagini
Copia omaggio
La lotta contro la progressione miopica continua guidata dai dati clinici e le esperienze real world
L’epidemia globale di miopia è da più di un decennio riconosciuta come una delle maggiori urgenze dell’oftalmologia odierna. Un fenomeno che interessa in particolare gli oftalmologi pediatrici, oggi alle prese più che mai con un aumento di casi non solo legato alla crescita della popolazione mondiale, ma ad un cambio delle abitudini di vita del bambino e ad un progressivo cambiamento della miopia dal punto di vista evolutivo. “In passato la fisiologia di un bambino di un anno con cinque diottrie di ipermetropia era considerata normale. Oggi è difficile trovare un bambino della stessa età con un’ipermetropia superiore alle tre diottrie”, osserva Paolo Nucci, Professore dell’Università Statale di Milano. “C’è una sorta di meccanismo epigenetico che ci porta ad
evolverci verso una forma di miopia che non è altro che una più bassa ipermetropia. Per questo è necessario muoversi ad un riconoscimento precoce della miopia ed essere proattivi nel suo trattamento”. Al Congresso AIMO-SISO 2025, durante il Simposio GUIDARE IL FUTURO
DELLA MIOPIA presieduto dal Professor Nucci assieme al Professor Edoardo Midena e alla Professoressa Vincenza Maria Elena Bonfiglio alcuni dei maggiori esperti nazionali e internazionali di oftalmologia pediatrica sono intervenuti per approfondire l’argomento, contribuendo con le ultime novità tecnologiche, le ultime scoperte scientifiche e i più recenti sviluppi terapeutici per il trattamento della progressione miopica.

Secondo l'International Myopia Institute (IMI), la pre-miopia è uno stato refrattivo in cui c’è una refrazione tra +0.75 D e -0.50 D in bambini in cui determinati fattori di rischio possono determinare un futuro sviluppo della miopia sufficiente a giustificare misure di prevenzione. “Citando il CLEERE study, gli occhi destinati a diventare miopi mostrano un pattern di allungamento assiale che precede l’inizio della miopia: un parametro importante su cui concentrarci”, afferma la Dottoressa Paola Valente. “Ritardare l’inizio della miopia significa avere minore probabilità di miopie elevate in futuro. Se noi abbiamo un paziente che inizia la sua miopia in età da scuola media invece che durante la primaria, questo paziente sarà un miope non elevato”, sottolinea Valente. Assieme all’outdoor e alla terapia con atropina a basso dosaggio, le lenti H.A.L.T. (Highly Aspherical Lenslet Target), le lenti Essilor® Stellest®, hanno dimostrato una significativa riduzione dell’allungamento assiale in una popolazione pre-miope, con un maggiore impatto nei pazienti che portavano le lenti per più di 30 ore settimanali.
Proprio le lenti H.A.L.T. sono considerate tra le terapie funzionali per la prevenzione e il trattamento della progressione miopica nel nuovo aggiornamento del Myopia Consensus Statement redatto dal WSPOS. “Queste lenti hanno dimostrato un’efficacia nel rallentamento della progressione miopica di 0.8D e fino a 0.35mm di allungamento assiale in due anni di utilizzo”, osserva il Dottor Matteo Scaramuzzi. Il Consensus sottolinea che il 90% dei bambini che portano queste lenti hanno una crescita del bulbo oculare paragonabile ai bambini di pari età non miopi. “Questo tipo di trattamento non mostra un effetto rebound quando viene cessato, a differenza di altri trattamenti come l’atropina”, commenta Scaramuzzi. Grazie alla loro dimostrata efficacia, le lenti H.A.L.T. hanno ottenuto l’approvazione FDA il 25 settembre 2025, grazie ad uno studio multicentrico randomizzato a doppio cieco di sei anni condotto su 135 pazienti in nove siti statunitensi. “Questa è un’informazione importante, in quanto evidenzia la presenza di uno studio rigoroso necessario all’approvazione. Si tratta del primo metodo di rallentamento della progressione miopica a ricevere questa valutazione”, osserva. “Lo studio non solo è assolutamente confermativo, ma indica nelle conclusioni che prima si inizia il trattamento, più queste lenti sono efficaci”. Secondo il Professor Aldo Vagge, l’obiettivo del controllo della miopia non è l’arresto della crescita dell’occhio, ma il controllo di tale crescita entro di parame-
?
tri percentili di lunghezza assiale adeguati all’età. “I percentili sono estremamente predittivi, oltre che necessari per standardizzare il trattamento. Un paziente che si inserisce in un percentile a 6 anni ha una probabilità elevatissima di conservare lo stesso percentile fino all’età di 9 anni”, spiega Vagge. “Sappiamo anche di fatto che la lunghezza assiale aumenta in chi supera il 50° percentile. Se inoltre il paziente supera 15 percentili, in letteratura questo è associato ad una probabilità elevata, l’85.7%, di sviluppare la miopia”. In un caso clinico presentato dal Professor Vagge, un paziente di 10 anni con lunghezza assiale OD di 23.10 mm e OS di 23.05 mm, collocatosi sotto il cinquantesimo percentile, dopo un anno di follow up si presenta con un aumento di più di dieci percentili indicando una crescita eccessiva dell’occhio. Dopo sei mesi di trattamento con lenti H.A.L.T. il paziente riporta una crescita dei percentili sotto i 10, denotando un’efficacia del trattamento.
Secondo il Professor Raffaele Parrozzani, la terapia con lenti H.A.L.T. può influire positivamente anche nei pazienti affetti da miopia del prematuro secondaria a ROP. Citando i risultati del suo studio, “le lenti H.A.L.T. funzionano indipendentemente dal tipo di storia clinica del piccolo paziente e di patologie che ha sviluppato nei primi mesi di vita, agendo sulla progressione miopica indipendentemente dalla sua prematurità o meno,” osserva. “Queste lenti possono essere usate come un tool medico, usato anche per pazienti specifici e con particolari forme di miopia.” Per capire il meccanismo d’azione della lente H.A.L.T. è necessario comprendere la teoria del defocus miopico. Secondo la Dottoressa Elena Gusson, diverse modulazioni della luce non focalizzata davanti alla retina portano a un’efficacia diversa nel contrastare l’allungamento assiale. Le lenti H.A.L.T. presentano microlenti asferiche, disposte in anelli concentrici, che diventano sempre più positive man mano che si procede verso la periferia, creando un vero e proprio scudo di defocus miopico davanti alla retina, uno scudo protettivo che rimane equidistante in ogni punto della retina”, spiega Gusson. “L’effetto di queste lenti è dose-dipendente: maggiore sarà il volume del defocus, lo spessore dello scudo, maggiore sarà l’efficacia.” Le lenti H.A.L.T. tuttavia non sono ancora al plateau della curva di efficacia, sostiene Gusson. “Con la prossima generazione di lenti H.A.L.T. MAX, possiamo aumentare l’asfericità delle lenti ed aumentare il loro potere, portandoci al plateau, massimizzando di conseguenza l’efficacia del defocus miopico”, conclude.
Tutti i partecipanti verranno omaggiati di un percorso FAD
SEGRETERIA SCIENTIFICA
Anna D’Ambrosio
Silvano Abati
Giovanni Giacomelli
Roberto Volpe
SEGRETERIA ORGANIZZATIVA
Fabiano Gruppo Editoriale
Reg. Rivelle 7/F - 14050 Moasca AT Tel. 0141 170 6694 - Fax 0141 856 013 a.manassero@fgeditore.it






La fotofobia non è un sintomo da sottovalutare, ma da comprendere e quantificare per dare ai pazienti trattamenti specifici e all’avanguardia
La luce è essenziale per la vista, ma può trasformarsi in un fastidio intenso, fino a diventare dolorosa. È il caso della fotofobia e della fotoallodinia, condizioni spesso considerate marginali ma altamente debilitanti per i pazienti. Proprio la fotofobia è stata al centro del lunch symposium “Stili di vita, luce e occhio”, tenutosi il 7 novembre al primo congresso AIMO-SISO 2025 a Roma. Gli esperti hanno sottolineato come si tratti di un sintomo molto più comune di quanto si creda, ancora poco riconosciuto e capace di manifestarsi con diversa intensità in numerose patologie oculari e sistemiche. La fotofobia è uno dei sintomi lamentati dai pazienti con malattia da occhio secco, come ha ricordato il Professor Stefano Barabino, dell’Università degli Studi di Milano. Quando il film lacrimale è instabile, i raggi luminosi vengono diffratti sulla retina, provocando disturbi visivi, tra cui la fotofobia. “Se parlate con i vostri pazienti, vi riferiranno che provano dolore, fastidio, fotofobia e che le immagini addirittura spariscono, proprio perché c’è fotofobia”, ha spiegato. Tra le cause principali dell’alterazione del film lacrimale, oltre l’invecchiamento, troviamo il digital eye strain per i più giovani che stanno molto tempo davanti al videoterminale: la riduzione dell’ammiccamento, che favorisce la distribuzione del film lacrimale e un corretto metabolismo epiteliale, porta a infiammazione, aumento dell’osmolarità, irregolarità del film lacrimale, disturbi visivi e anche fotofobia. Spesso i pazienti con occhio secco riferiscono la fotofobia in modo poco specifico, come ha affermato il Professor Giuseppe Giannaccare dell’Università di Cagliari. Per questo ha voluto studiare quali sono le soglie di sensibilità luminosa nei pazienti con occhio secco, paragonandoli a un gruppo di controllo. Sono stati coinvolti cinquanta pazienti in due centri, uti-
lizzando misurazioni oggettive. “Lo studio ha concluso che le donne hanno soglie più basse e che ci sono delle differenze tra pazienti con occhio secco e soggetti sani e che queste riguardano tutti i tipi di luce, calda, fredda e lampeggiante. Questa alterazione correla con i sintomi del paziente”, ha spiegato il Professor Giannaccare. Al contrario, non sono emerse correlazioni significative con altri parametri oggettivi della superficie oculare. Ciò indica la necessità di studi più approfonditi, ma evidenzia anche un potenziale rilevante per identificare proposte terapeutiche mirate, ad esempio tramite un collirio specifico o una lente che filtri la luce.
La fotofobia spesso compare in pazienti che non danno segni evidenti di infiammazione della superficie oculare, come sostenuto dalla Dottoressa Emanuela Aragona, dell’Istituto Scientifico San Raffaele. “Secondo alcuni dati di letteratura recenti, la fotofobia ha un’attività simile a quella del dolore neuropatico, ovvero parte da forme di sensibilizzazione a livello centrale”. Si ipotizza dunque una sensibilizzazione del talamo posteriore, dove convergono diverse terminazioni, tra cui quelle delle cellule gangliari retiniche fotosensibili, che sono deputate al trasporto dello stimolo luminoso, e i segnali nocicettivi a livello del ganglio trigeminale, quindi delle terminazioni nervose corneali. Un’altra possibile causa è legata al CGRP, il neuropeptide relativo al gene della calcitonina, che viene rilasciato dalle terminazioni trigeminali in seguito all’infiammazione della superficie oculare. Studi preclinici su modello murino hanno suggerito che livelli alterati di CGRP possono aumentare la risposta fotofobica. Ciò suggerisce che la terapia dovrebbe considerare non solo il trattamento della superficie oculare con lacrime artificiali o antinfiammatori, ma anche l’utilizzo di
dispositivi ottici mirati ai meccanismi centrali. Uno dei più grossi problemi risiede nella valutazione oggettiva della fotofobia. Attualmente, infatti, questa si basa su questionari soggettivi non specifici, come l’OSDI e il Neuropathic Pain Symptom modificato per l’occhio secco. “Dal punto di vista oculistico ci aiutano poco, perché non sono associati alle situazioni che i nostri pazienti vivono”, ha commentato la Dottoressa Giulia Coco, ricercatore dell’Università Tor Vergata di Roma. “Non abbiamo una misurazione standardizzata per oggettivare e quantificare la gravità della fotofobia in maniera affidabile”. Recentemente sono stati introdotti nell’ambito della ricerca due moderni dispositivi che permettono una quantificazione più affidabile: l’Ocular Photosensitivity Analyzer del 2018 e il Lumiz 100, utilizzato dal Prof. Giannaccare nello studio citato. Quest’ultimo, in particolare, risulta vantaggioso per la sua portabilità e facilità di utilizzo. Si tratta di un dispositivo a maschera che valuta le soglie di discomfort usando sorgenti LED (luce calda, fredda e lampeggiante). Il paziente ha un pulsante con cui può segnalare la prima percezione di fastidio e poi quello più disturbante. Uno studio su cinquecento soggetti ha dimostrato che la luce lampeggiante ha una soglia sensitiva più bassa; le donne hanno un discomfort maggiore, ma non vi è nessun effetto sulle soglie d’età del paziente. Questi risultati sono stati confermati da un secondo studio.
Se misurate oggettivamente, fotofobia e/o la fotoallodinia nel postoperatorio della cataratta potrebbero diventare un marker di meccanismi neuropatici o di sensibilizzazione centrale, più che un semplice dry eye post-chirurgico, come ha suggerito il Professor Edoardo Villani, dell’Università degli Studi di Milano. “I sintomi che riguardano la superficie oculare

sono uno dei determinanti principali della soddisfazione del paziente post cataratta”, ha commentato. In uno studio preliminare presentato anche ad ARVO e ESCRS, sono stati confrontati pazienti soddisfatti e insoddisfatti con parametri visivi simili. I pazienti insoddisfatti mostravano più sintomi della superficie oculare (77% contro 24%) e le soglie di sensibilità alla luce misurate con Lumiz 100 erano più basse. Questi hanno riportato anche punteggi soggettivi più bassi e si sono osservate delle differenze alla microscopia confocale, suggestive di alterazioni dell’innervazione corneale.
Ci sono casi purtroppo limite, che portano la fotofobia e la fotoallodinia a diventare un problema reale per l’individuo, limitandone fortemente la qualità della vita, come nei casi di cheratocongiuntivite Vernal (VKC). “Indipendente dai segni clinici, un bambino con VKC ha un impatto grave sul suo sviluppo psicosociale”, ha spiegato il Professor Antonio Di Zazzo, del Campus Bio-Medico di Roma. Questi pazienti soffrono spesso di depressione, ansietà e tendono a vivere reclusi, senza contatti con l’esterno. Gestire questa forma limite di fotofobia significa utilizzare trattamenti antinfiammatori, modulatori dei neuromediatori e in alcuni casi lenti che filtrano la luce. Tuttavia, è difficile trattare questi pazienti, ha ricordato Di Zazzo, e le diagnosi e le terapie non sono sempre efficaci perché finora questo problema non è stato considerato come parte integrante della patologia della superficie oculare. Serve quindi un cambiamento nel paradigma, nella comprensione della fotofobia e della fotoallodinia tramite valutazioni oggettive con dispositivi appositamente sviluppati e soluzioni che possono ridurne la sintomatologia come le lenti appositamente sviluppate nella modulazione della luce. “C’è la necessità di quantificare la fotofobia e trattarla”, riassume il Dottor Marco Messina, dell’Università degli Studi di Perugia. “Sia con soluzioni farmacologiche ma anche l’utilizzo di dispositivi come lenti che siano intelligenti alla risposta luminosa può essere dirimente nella gestione di questo importante sintomo”, conclude.
Importante sensibilizzare i professionisti e incentivare la ricerca per sviluppare protocolli diagnostici e terapeutici in grado di fornire nuove soluzioni sempre più integrate e personalizzate. Tecnologia e innovazione sono il motore che può permettere un avanzamento nel restituire una qualità di vita ottimale a un numero sempre più elevato di pazienti che visitiamo nei nostri studi.
Come riconoscere, gestire e prevenire la miopia pediatrica per evitare complicanze oculari nel futuro

Nel panorama della salute visiva pediatrica, la miopia sta rapidamente emergendo come una “epidemia silenziosa” e una nuova sfida per la salute pubblica. I dati globali restituiscono infatti delle proiezioni allarmanti per il futuro: più di 740 milioni di bambini e adolescenti saranno miopi entro il 2050 . In parallelo, stiamo assistendo ad un incremento significativo dei casi di miopia elevata, ossia superiore alle -6 D, condizione associata a un rischio elevato di complicanze oculari gravi quali cataratta, distacco di retina, glaucoma e maculopatia miopica, che costituiscono ubiquitariamente le più importanti cause di disabilità visiva e cecità1 Anche l’età di insorgenza della miopia sta diminuendo in modo costante, e un numero crescente di bambini è affetto da miopia sin dall’età prescolare. Le cause sono da ricercare nei cambiamenti delle abitudini dei più piccoli, che trascorrono sempre più tempo davanti a schermi digitali, svolgono attività prolungate da vicino e sono scarsamente esposti alla luce naturale.
Un intervento precoce nel controllo della progressione miopica non solo ottimizza la funzione visiva nel breve termine, ma riduce anche il rischio di sviluppare future complicanze oculari, contribuendo a preservare la salute visiva dei pazienti pediatrici nel lungo periodo.
Le opzioni di trattamento a disposizione degli oculisti fortunatamente non scarseggiano: tuttavia, quello che serve è un approccio condiviso, sinergico e multidisciplinare tra i professionisti coinvolti (oculisti e pediatri) e i genitori, affinché
tutti insieme si impegnino nel contenere i potenziali danni che la miopia può causare alla vista dei bambini.
Impatto della miopia: prevenzione, gestione e conseguenze socioeconomiche “La miopia pediatrica è in forte aumento”, spiega il Dottor Marco Mazza, Direttore S.C. Oculistica Pediatrica Grande Ospedale Metropolitano Niguarda di Milano. “Nel nostro Paese, le percentuali di prevalenza si aggirano intorno al 20%, ma ci stiamo avvicinando al 30%”. La crescente diffusione della miopia evidenzia la necessità di considerarla non più come un semplice errore refrattivo, ma come una patologia multifattoriale che richiede strategie mirate di gestione, prevenzione e controllo della progressione.
La miopia elevata è associata ad un aumentato rischio di complicanze come distacco di retina, maculopatia miopica, glaucoma e cataratta precoce. “Ogni diottria di aumento della miopia corrisponde a un rischio sei volte più grande di avere queste complicanze rispetto a un paziente non miope. C’è dunque un’evoluzione esponenziale del rischio”, afferma il Dottor Mazza.
Prevenire e rallentare oggi la progressione della miopia nei più piccoli ha un risvolto positivo sul futuro. Riducendo il rischio di miopia elevata e delle complicanze correlate, è possibile prevenire ripercussioni negative sulla salute della popolazione in età scolare e lavorativa, limitando così i potenziali impatti socioeconomici. “È importante
cercare di tenere la miopia sotto controllo, limitandone la progressione”, aggiunge il Dottor Mazza.
Un alleato fondamentale: l’atropina
Le strategie per contrastare questo fenomeno esistono, e sono di diverso tipo. Come spiega il Dottor Mazza, da parte della comunità scientifica, la volontà di trovare trattamenti sempre più efficaci per evitare la progressione della miopia non manca, insieme alla consapevolezza di promuovere una maggiore sensibilizzazione per un cambio dello stile di vita dei pazienti. “Sono disponibili soluzioni ottiche, come le lenti per occhiale a defocus, ma anche lenti a contatto per chi fa sport o ha esigenze particolari. È disponibile anche una terapia farmacologica, a base di atropina diluita a una concentrazione bassissima dello 0,01%”, spiega.
Da molti anni l’atropina ha catturato l’attenzione degli specialisti. “L’atropina è in grado di modulare i processi di crescita oculare, riducendo la progressione della miopia. I meccanismi non sono ancora pienamente chiariti, ma si ritiene che coinvolgano la regolazione delle vie di segnalazione colinergiche e dopaminergiche a livello retinico e sclereale, influenzando il rimodellamento della sclera e la lunghezza assiale dell’occhio”, afferma il Dottor Mazza.
Da molti anni vengono condotti studi sull’atropina e sulla sua efficacia; come ricorda infatti il Dottor Mazza, c’è stata una lunga ricerca per trovare la migliore concentrazione. “Il dosaggio allo 0,01% è considerato la dose più efficace, associata a una minore incidenza di eventi avversi e a un ridotto rischio di rebound, come evidenziato in diversi studi clinici”, puntualizza. Oltre a efficacia e sicurezza, uno dei punti di forza dell’atropina è che può essere utilizzata in sinergia con gli occhiali, massimizzando il beneficio per il paziente.
Tuttavia, i colliri a base di atropina allo 0,01% sono ad oggi disponibili solo in formulazione galenica e questo comporta dei limiti per i pazienti che ne hanno bisogno. “C’è difficoltà nel reperire il farmaco anche in grandi città come Milano perché non tutte le farmacie possono preparare questi colliri. Questo rappresenta un ostacolo alla continuità e all’aderenza terapeutica”, spiega il Dottor Mazza. “Talvolta può capitare che la concentrazione non corrisponda a quella richiesta. Inoltre, la formulazione galenica è meno stabile, con una finestra di validità ed efficacia
più stretta”.
L’utilizzo di formulazioni galeniche è, inoltre, off-label e secondo il Dottor Mazza, la disponibilità di una formulazione industriale standardizzata del collirio a base di atropina a basso disaggio faciliterebbe la reperibilità e sarebbe garanzia della stabilità del principio attivo, favorendo la persistenza terapeutica e l’aderenza del paziente, elementi chiave per contenere la progressione miopica e prevenire complicanze future.
Miopia, consapevolezza e prevenzione
La prevenzione rappresenta un principio fondamentale nella gestione della miopia, rendendo essenziale anche la sensibilizzazione su questa condizione e sulle sue possibili conseguenze. “I trattamenti esistenti vanno coadiuvati con uno stile di vita diverso. I nostri ragazzi dovrebbero passare più tempo all’aria aperta esposti alla luce naturale, che sembra avere lo stesso effetto della dopamina, e limitare l’uso di dispositivi elettronici troppo da vicino”, spiega il Dottor Mazza. È importante educare i bambini sulla corretta postura da mantenere. “Non sono i dispositivi elettronici in sé, ma lo sforzo nella messa a fuoco da vicino. A volte vediamo i bambini fare i compiti con il viso molto vicino al foglio. Genitori e insegnanti sono fondamentali nell’attenzionare questi comportamenti e agire tempestivamente per correggerli”, conclude.
La gestione della miopia rappresenta uno sforzo condiviso: sebbene l’oculista rimanga la figura di riferimento, è fondamentale il contributo di tutte le persone coinvolte nella salute visiva del bambino, dal pediatra ai genitori ed insegnanti, tutti devono essere adeguatamente informati sulle possibili conseguenze di questa patologia.
Bibliografia
1. Liang J, Pu Y, Chen J, et al. Global prevalence, trend and projection of myopia in children and adolescents from 1990 to 2050: a comprehensive systematic review and meta-analysis. Br J Ophthalmol. 2025;109(3):362-371. Published 2025 Feb 24. doi:10.1136/bjo2024-325427
Massimo Camellin
Medico Chirurgo Oculista
Direttore Sanitario di Sekal Microchirurgia Rovigo
Umberto Camellin
Medico Chirurgo in formazione specialistica in Oftalmologia - Università di Messina
Testo tratto dal libro "Appunti di SemeiOTTICA fisiopatologica" (2023)
Segue dalla prima parte apparsa sul n. 3/24
In pratica si tratta di trovare una sfera di riferimento che meglio “fitta” la superficie da analizzare cioè la BestFit Sphere (Keratron). In caso di cornee con alterazioni centrali simmetriche si usa il metodo Vertex-tangent (sfera tangente all’apice), mentre in presenza di deformazioni periferiche asimmetriche è più preciso il metodo Three Points nel quale l’esaminatore posiziona tre punti di intersezione della superficie da analizzare. La sfera di riferimento può quindi essere scelta arbitrariamente ma è comodo che la macchina stessa fornisca la sfera più adeguata al corretto embricamento (Figura 22).
In figura 23 rappresentata schematicamente la ricerca della sfera di Best Fit con il metodo Vertex-tangent. In A la sfera è troppo curva rispetto alla superficie da analizzare, questa quindi risulta tutta al di sopra della sfera di riferimento; in B la sfera di riferimento è troppo piatta e la superficie da analizzare è tutta sotto alla sfera di riferimento. Quella mostrata in C è la sfera di Best-Fit, che meglio si adatta alla superficie da analizzare; alcune parti sono sopra ed altre sono sotto alla sfera di riferimento. È importante notare che nella rappresentazione cromatica dell’astigmatismo congenito con algoritmo altitudinale, il meridiano più curvo, in periferia, è rappresentato da due aree di colore freddo (con sfera di riferimento pari al meridiano più piatto). Esattamente il contrario di ciò che si può osservare nell’analisi con l’algoritmo assiale o tangenziale. Se la sfera con algoritmo altitudinale è pari al meridiano più curvo, ovviamente avremo colori caldi sul meridiano più piatto che risulterà sopra alla sfera di riferimento (Figura 24). Quindi quando i poli (meridiano più curvo) dell’astigmatismo sono al di sotto della sfera

di riferimento, sono rappresentati in blu. La rappresentazione cromatica di un astigmatismo regolare con sfera di Best-Fit avrà quindi due poli verticali al di sotto della sfera (meridiano più curvo) e due orizzontali al di sopra (meridiano più piatto).
Di seguito abbiamo alcuni esempi di patologie corneali caratterizzate dalla presenza di variazioni di curvatura localizzate in periferia, nelle quali l’utilizzo dello Spherical Offset risulta utile alla comprensione della morfologia corneale.
Sfiancamento di una cheratotomia curva inferiore
Questo è un vecchio intervento di correzione dell’astigmatismo effettuato con tecnica incisionale in media periferia (cheratotomie curve). Il progressivo sfiancamento delle incisioni è dovuto ad un cedimento strutturale e comporta un aumento di curvatura in media periferia (ad asse 270° nelle correzioni di astigmatismi secondo regola) con appiattimento verso il centro a partenza dalla media periferia ad asse 270°. Sull’ asse 180°/360° si assiste ad un incurvamento centrale (deformazione secondaria) raccordato allo sfiancamento inferiore (deformazione primaria).
La rappresentazione con algoritmo assiale mostra gli arrotondamenti delle due zone incurvate, asse 230°/320° con l’ectasia ad asse 270°, ma non fornisce informazioni sulla reale morfologia della cornea (figura 25a).
Nella rappresentazione con algoritmo True (figura 25b) le incisioni curve corrispondono alle zone arcuate rosse in media periferia superiore ed inferiore mentre le zone rosse paracentrali inferiori (ore 5 ed
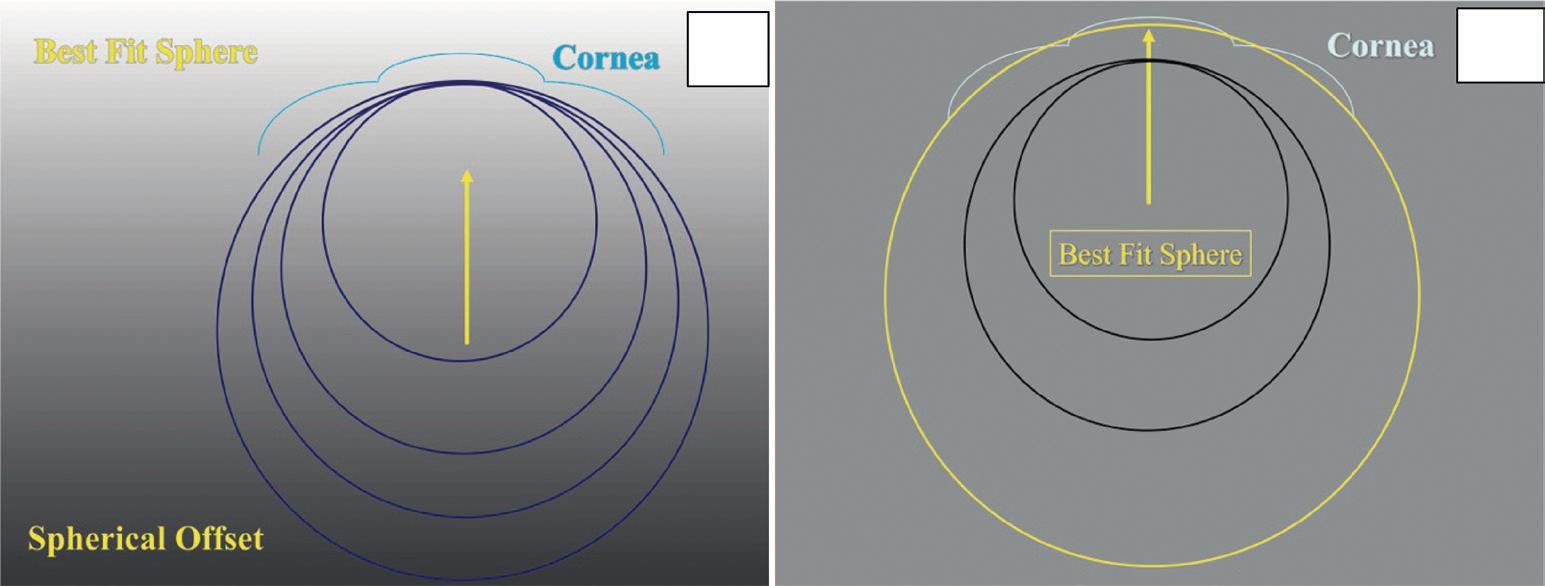
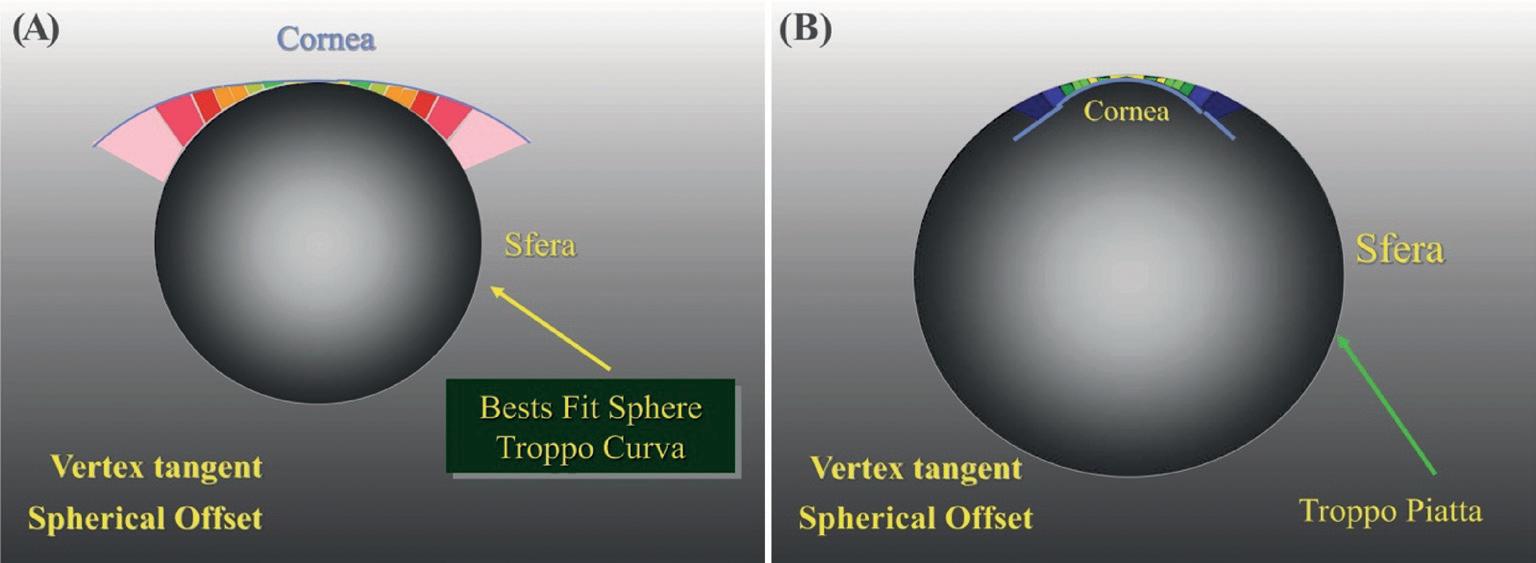

Figura 23. Spherical offset: Best Fit Sphere con metodo Vertex-Tangent.
a): Best Fit Sphere troppo curva. b): Best fit Sphere troppo piatta. c: Best Fit Sphere ideale ad evidenziare la forma in analisi
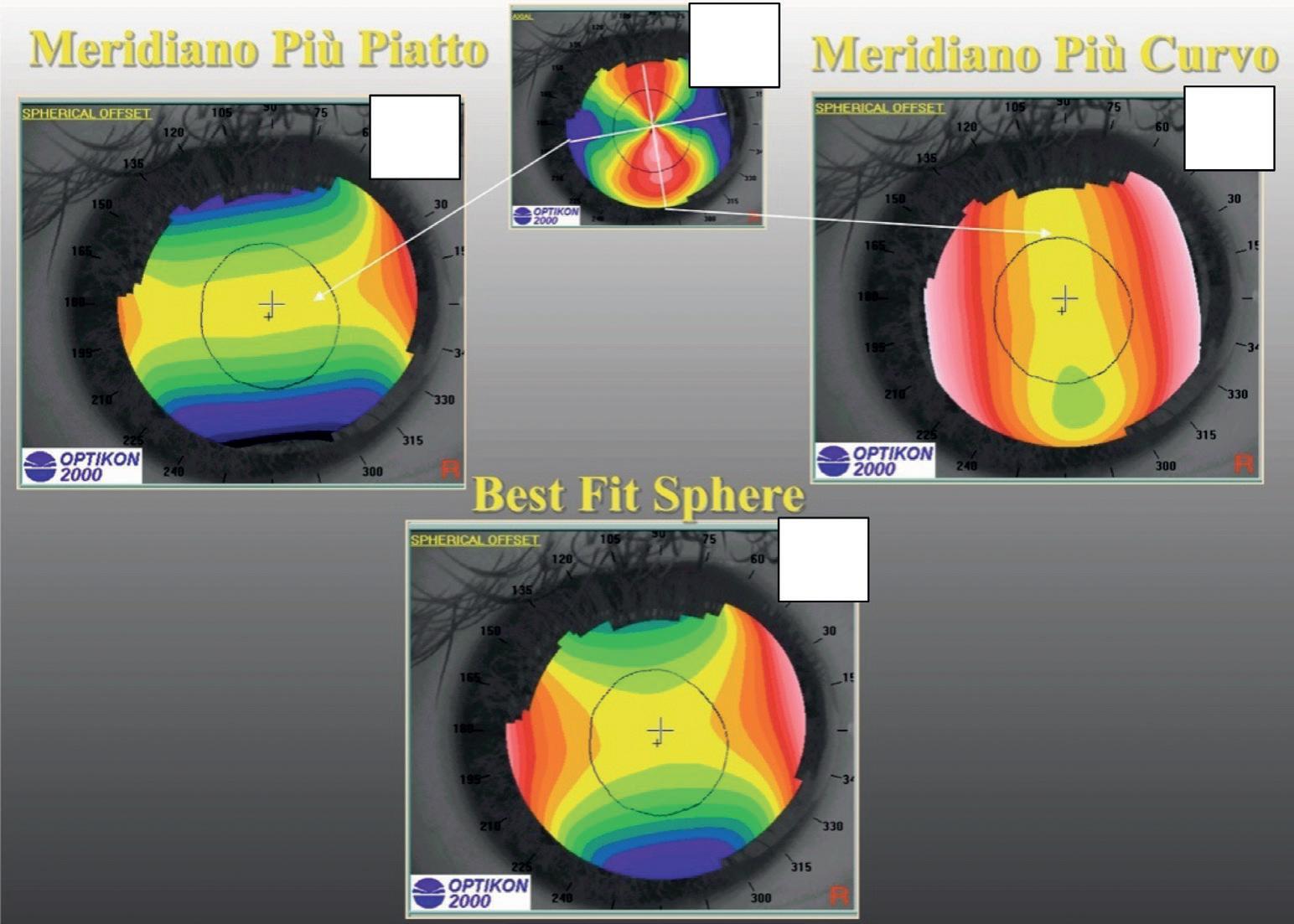
Figura 22. Spherical offset: Best Fit Sphere con vari raggi di curvature (cerchi blu) a). è necessario provare varie sfere fino a trovare il migliore embricamento (cerchio giallo) b). La macchina può anche effettuare queste prove automaticamente
Figura 24. a) Astigmatismo congenito, topografia con clessidra ampia e simmetrica. b) Mappa altitudinale con algoritmo assiale e sfera pari al merdiano più piatto c) sfera pari al meridiano più curvo. d) Rappresentazione cromatica con sfera di Best fit: i due poli dell’astigmatismo (asse più refrattivo) sono al di sotto della sfera di riferimento e sono rappresentati in blu. Le aree di colore rosso (meridiano più piatto) sono al di sopra della sfera di riferimento.
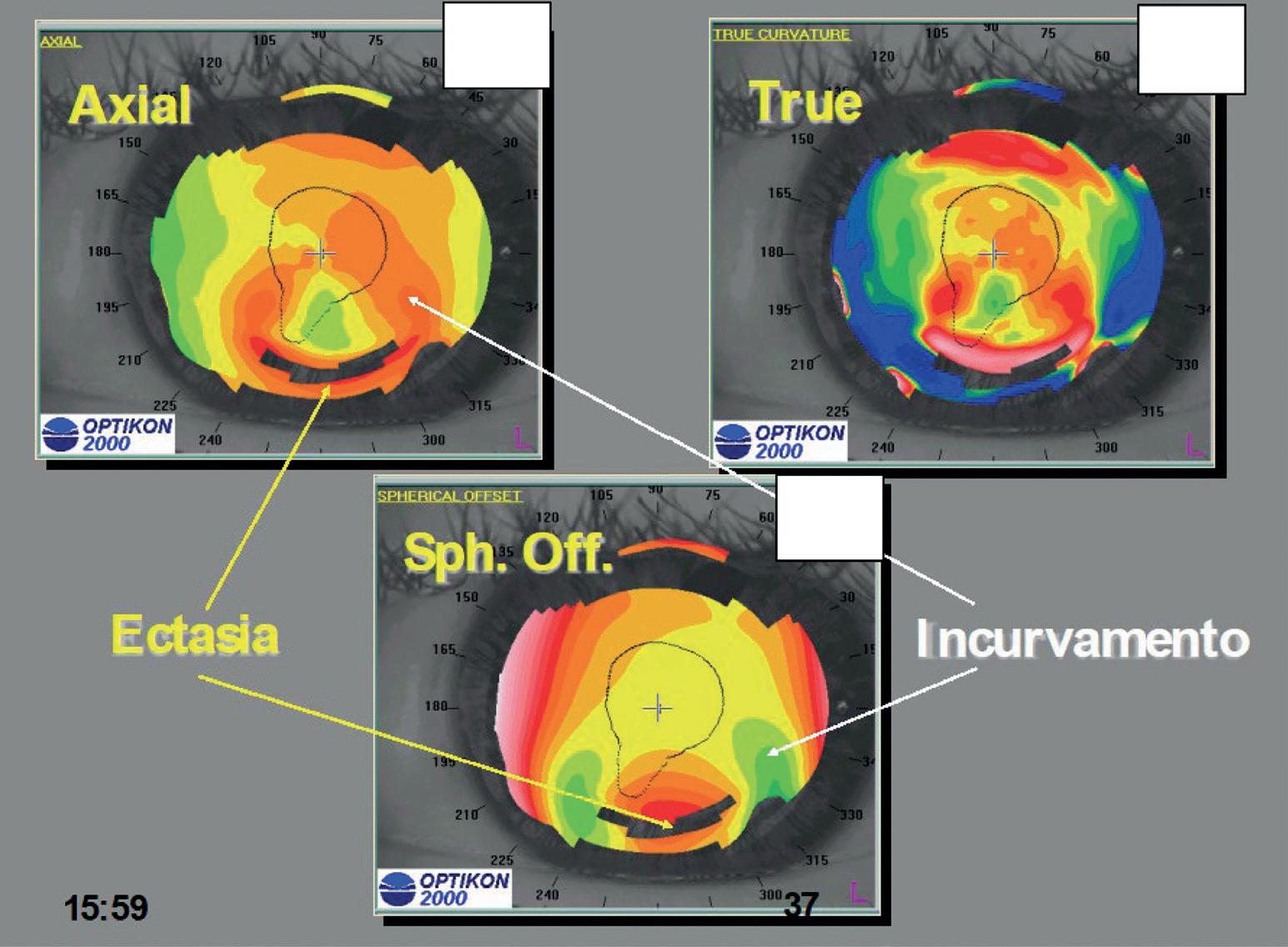
25. Sfiancamento di una cheratotomia curva inferiore. a) Algoritmo Assiale b) Algoritmo True c) Spherical offset. La mappa altitudinale permette di evidenziare l’ectasia inferiore (area rossa) e le due aree di incurvamento secondario (verde) poste ai lati della zona ectasica. Questo aspetto è simile a quello presente in una degenerazione marginale pellucida ed è detto ad occhi di mosca.
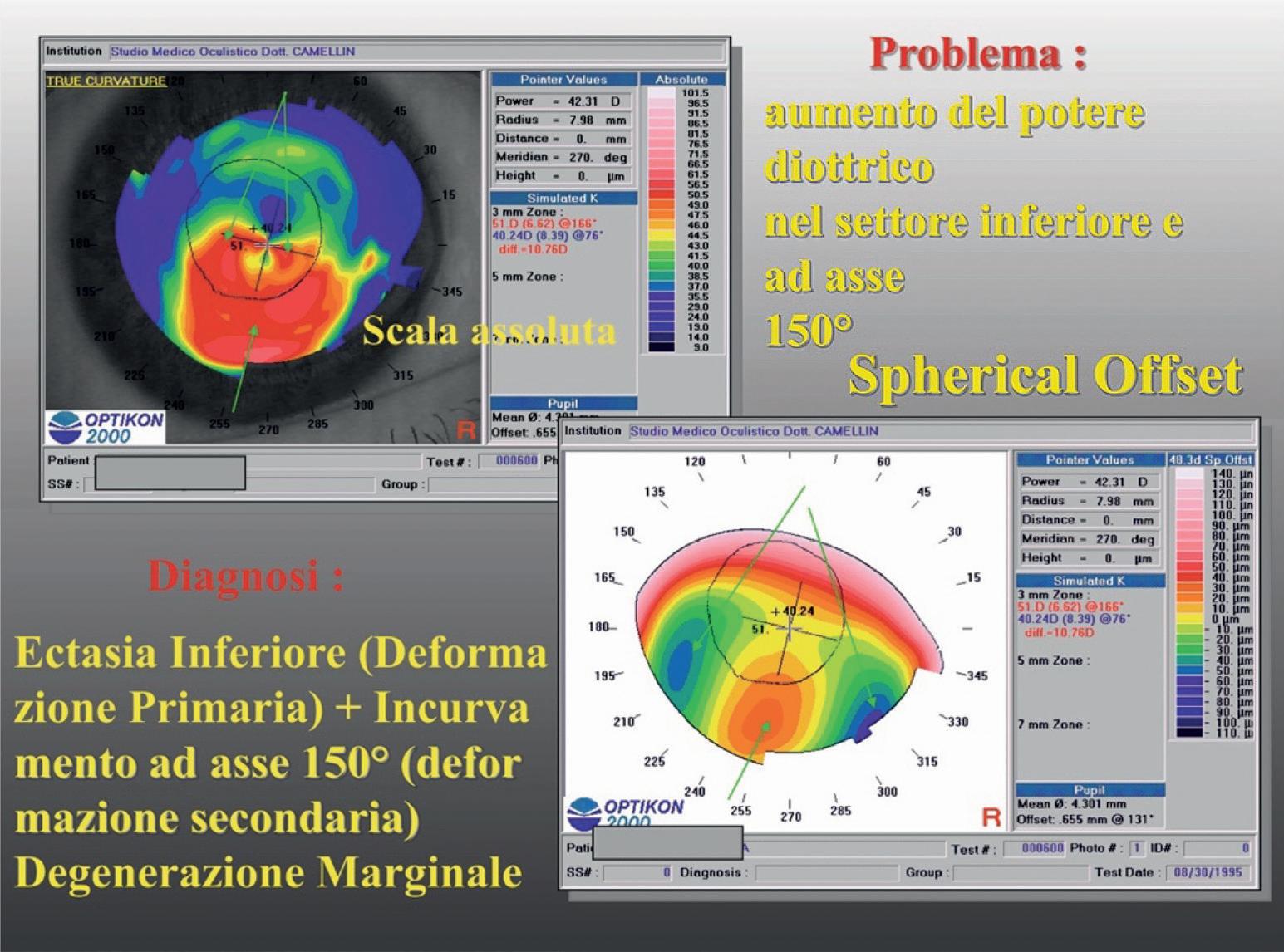
Figura 26. Degenerazione marginale pellucida: Spherical offset. L’analisi con algoritmo altitudinale evidenzia lo sfiancamento localizzato (zona rossa inferiore: deformazione primaria) e l’incurvamento ad asse 150° che corrisponde alla deformazione secondaria.
ore 7) corrispondono ai vettori di incurvamento legati all’ectasia dell’incisione corneale in media periferia ad ore 6. Un esaminatore esperto sarà in grado di distingue-
re la zona ectasica inferiore da quelle incurvate che partono dal centro (aspetto a baffo). La rappresentazione con Spherical Offset mette facilmente in evidenza una bozza rossa periferica inferiore (ore 6) che,
secondo la scala pseudoisocromatica, corrisponde ad una superficie corneale posta al di sopra della sfera di Best Fit e pertanto rappresenta un’ectasia.
Sono inoltre presenti due aree di colore verde poste ai lati della zona ectasica (posizionate perciò al di sotto della sfera di Best-Fit) che corrispondono alle aree di incurvamento secondario.
Degenerazione marginale pellucida
La degenerazione marginale pellucida è una patologia degenerativa della cornea, simile al cheratocono, con una zona di ectasia però molto più periferica (nel settore inferiore) rispetto al cheratocono. Il cedimento strutturale periferico si raccorda verso il centro corneale come nell’incisione curva sfiancata del caso precedente.
La rappresentazione con algoritmo True in scala assoluta mostra l’area di ectasia periferica cui corrisponde un notevole aumento del potere diottrico in tutto il settore inferiore (figura 26).
I raggi di curvatura della zona ectasica e delle zone del raccordo di incurvamento sono molto simili e l’analisi con algoritmo True mostra un’area uniforme diffusa di aumentato potere diottrico.
È solo tramite lo Spherical offset però che è possibile ottenere informazioni sulla reale morfologia corneale ed evidenziare l’ectasia inferiore (deformazione primaria) e le due aree di incurvamento adiacenti (deformazione secondaria).
La rappresentazione cromatica altitudinale di questo sfiancamento localizzato è detta “ad occhi di mosca”.
Topografia corneale nell’occhio astigmatico
L’analisi dell’astigmatismo congenito con fotocheratoscopio computerizzato consente il rilievo dei seguenti parametri:
- Entità (D);
- Asse (°);
- Ampiezza della Clessidra;
- Distanza dei Poli di Incurvamento;
- Posizione della pupilla:
- Centro Pupillare;
- Centro di Fissazione;
- Centro Morfologico.
- Arrotondamento della Clessidra (Eccentricità);
- Simmetria della clessidra;
- Regolarità della clessidra.
L’astigmatismo, topograficamente, ha la forma di una clessidra e quest’ultima è più o meno arrotondata perifericamente in relazione all’asfericità della cornea
(maggiore è l’asfericità e più arrotondata è la clessidra).
Fino a circa 40 anni fa l’unico strumento a disposizione per lo studio dell’astigmatismo era l’oftalmometro. Avevamo per primi in Italia utilizzato il CMS (anni ‘80) successivamente ribattezzato TMS della Tomey e si trattava del primo cheratoscopio computerizzato progettato a livello mondiale. L’Oftalmometro o Cheratometro misura l’entità dell’astigmatismo (cioè la differenza di curvatura tra i due meridiani), gli assi dei due meridiani principali, nonché il loro valore in mm o in diottrie (valore questo estrapolato e quindi non reale). Il fotocheratoscopio computerizzato fornisce oggi al chirurgo refrattivo importanti informazioni di forma e funzione.
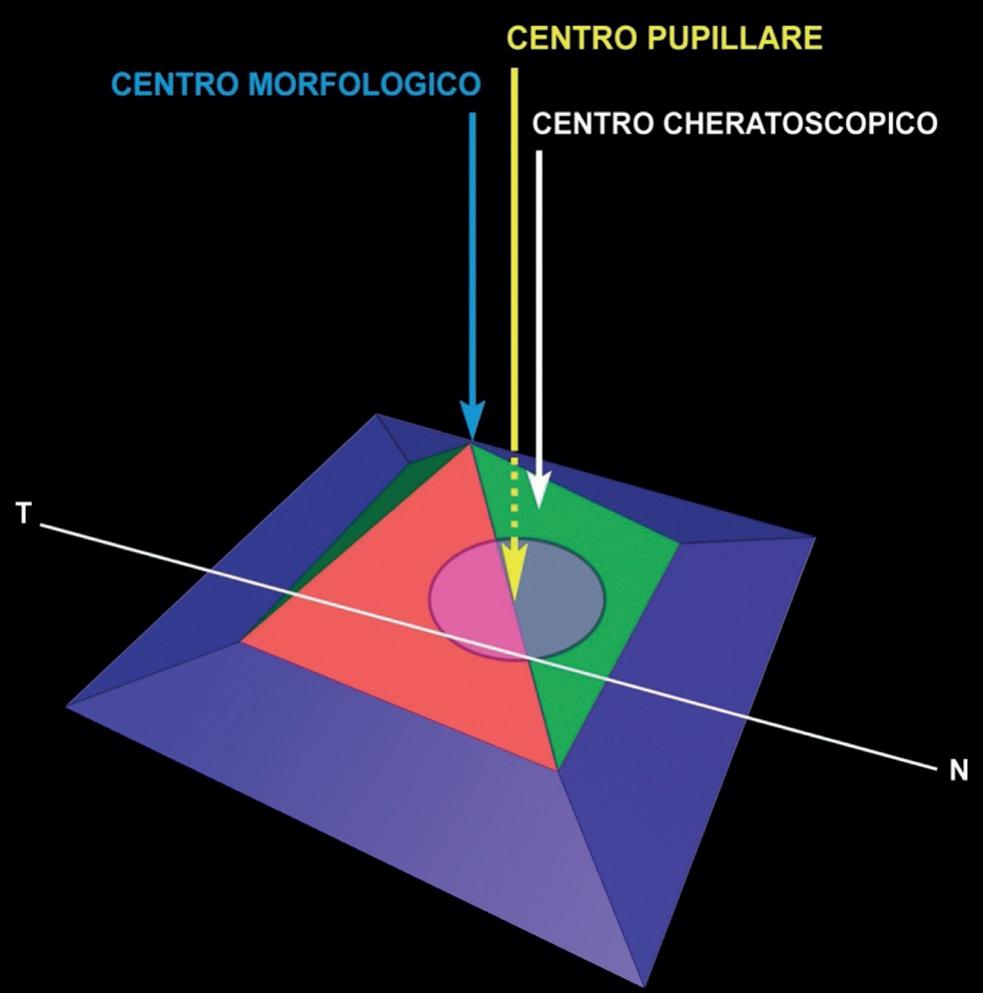
È possibile, infatti, valutare l’ampiezza della clessidra astigmatica e la distanza dei poli di incurvamento. Potremo inoltre analizzare la posizione della pupilla, il centro pupillare, che costituisce il centro delle analisi aberrometriche del sistema di riferimento ed il centro di fissazione del paziente, che molto raramente coincide con il centro pupillare. Questa differenza è presente particolarmente nei pazienti ipermetropi e rappresenta l’angolo Kappa. Il centro morfologico invece corrisponde all’incrocio tra il meridiano più curvo ed il meridiano più piatto.
La rappresentazione topografica dell’astigmatismo congenito può essere più facilmente compresa se si schematizza idealmente l’astigmatismo come una piramide con due lati più inclinati corrispondenti al meridiano più curvo (figura 27).
Questo schema semplificato dell’astigmatismo congenito ricorda la rappresentazione cromatica cheratoscopica con l’aspetto a clessidra.
In periferia la clessidra assume una forma arrotondata perché la cornea non è sferica ma si appiattisce, è cioè una superficie asferica. Questa è la causa dell’arrotondamento della clessidra in periferia. Se la cornea fosse perfettamente sferica, la clessidra non sarebbe arrotondata. Dall’analisi della cheratoscopia possiamo valutare inoltre la presenza di asimmetrie ed eventuali irregolarità.
Asfericità corneale
La cornea normale è dunque asferica (nel suo profilo), cioè presenta un appiattimento periferico. L’asfericità può essere misurata in “e” o in “Q”. Questi valori hanno segno opposto e sono determinati matematicamente. Il valore più usato è Q. Q<-1: la curva è un’iperbole, Q= -1: la curva è una parabola, -1<Q<0: la

curva è un’ellisse prolata, Q=0: la curva è un cerchio, Q>0: la curva è un’ellisse oblata. Una cornea fisiologica normale è “prolata”, cioè più curva al centro e più piatta in periferia (-1<Q<0).
Il valore “e” invece rappresenta l’eccentricità di un’ellisse e varia da 0 ad 1 e rappresenta lo schiacciamento dell’ellisse; il valore 0 corrisponde ad una circonferenza.
In sintesi, i valori usati in ottica per determinare l’asfericità sono:
• egse p>1 allora e=-radq(p-1); se p<=1 allora e=radq(1-p) [radq()=radice quadrata];
• Q = p-1.
Dove “p” è l’asfericità usata nelle equazioni trigonometriche di curve coniche:
z = (-R + √(R2 - p * r2))/p
Dove:
- R= raggio apicale; - r = distanza dal centro
Per una circonferenza i valori sono: - p =1; - e =0; - Q =0.
Una cornea operata di chirurgia refrattiva per la correzione dell’ipermetropia assume una forma iperprolata, in quanto il trattamento porta ad un incurvamento del centro. Una cornea operata di chirurgia refrattiva miopica presenta invece un profilo oblato, risulterà cioè più piatta al centro, e più curva in periferia.
Nella schematizzazione (assimilazione ad una piramide) dell’immagine topografica di una cornea pro-
lata, dovremo raccordare la parte centrale più curva con la periferica più piatta. Parlando di astigmatismo, una piramide a base rettangolare dovrà quindi raccordarsi ad una base quadrata. Ricordiamo inoltre che il centro, presentando una maggiore curvatura, tenderà a raccordarsi con la periferia arrotondandosi. Si ottiene così la costruzione di una clessidra sul meridiano più curvo (figura 28).
La rappresentazione cromatica della clessidra, ovviamente si inverte se si analizza una cornea oblata (Q>0 od e<0), come nel caso di occhi operati di chirurgia miopica o di trapianto di cornea perforante. Anche in questo tipo di astigmatismo si deve raccordare una sezione rettangolare su una base quadrata ma il raccordo, sul meridiano più piatto, creerà una rappresentazione cromatica inversa rispetto alla clessidra di incurvamento. Si ottiene quindi la costruzione di una clessidra sul meridiano più piatto (figura 29).
La Figura 30 mostra lo schema semplificato di un astigmatismo in una cornea asferica prolata e in una cornea sferica. Per dimostrare che l’arrotondamento periferico della clessidra astigmatica in periferia è dovuto all’asfericità corneale, abbiamo effettuato un piccolo esperimento.
Esperimento: una lente a contatto (LAC) rigida, sferica è stata volutamente deformata (compressa in periferia) ed abbiamo indotto così un astigmatismo di circa 5 diottrie per compressione sull’asse 180°. Successivamente è stato eseguito l’esame cheratoscopico sulla LAC (figura 31).
Si può notare che, essendo la lente a contatto sferi-
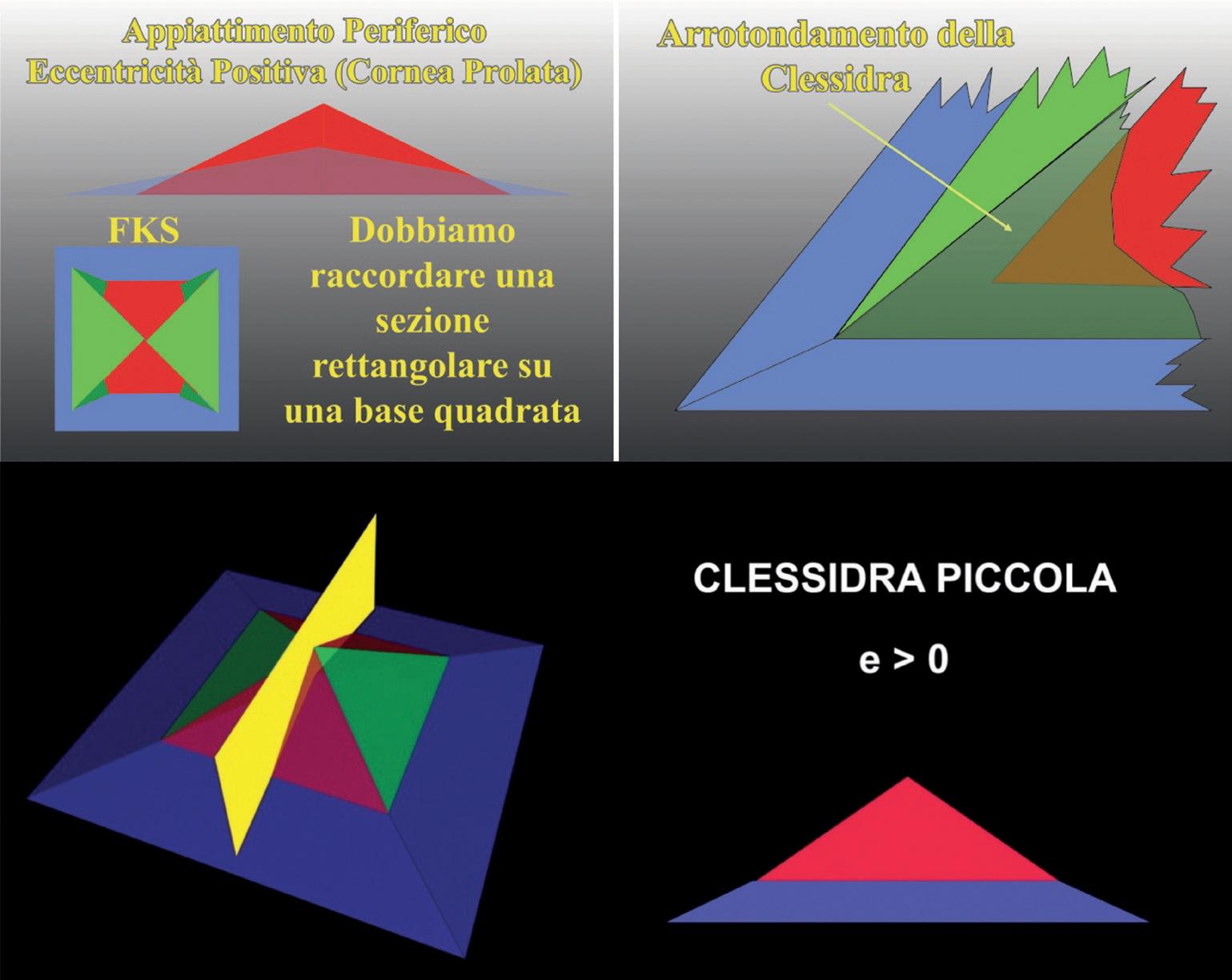
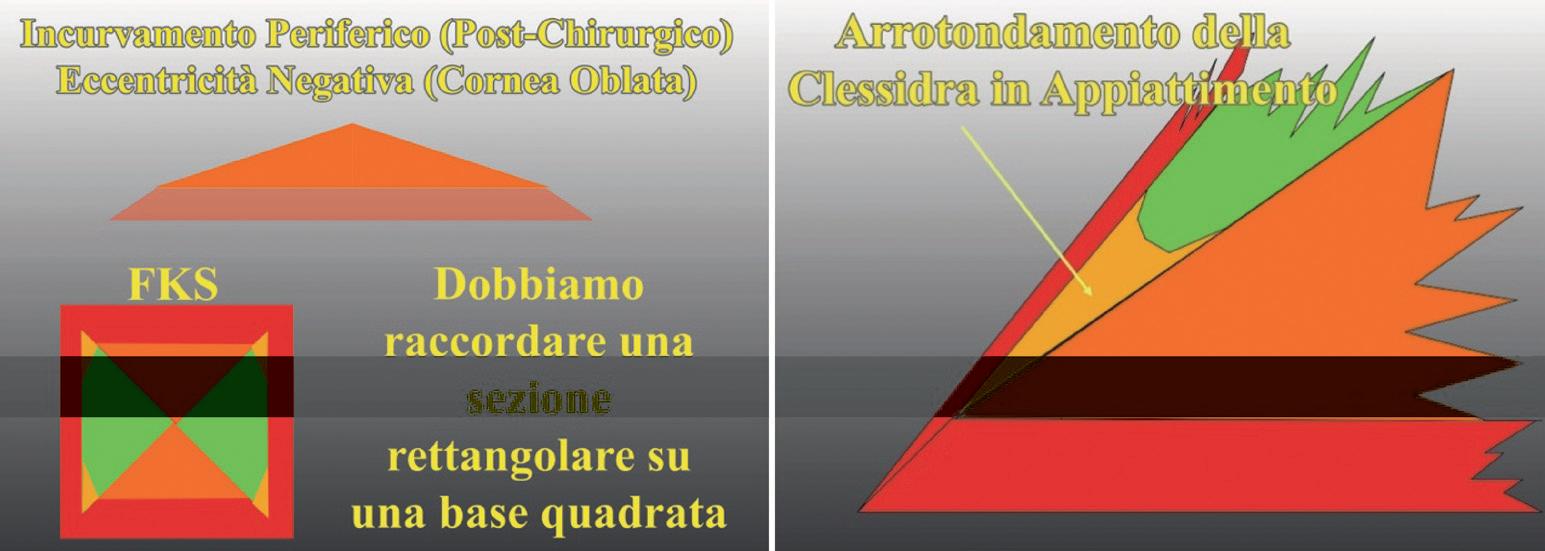

Figura 30. Rappresentazione schematica di astigmatismo in una cornea asferica prolata ed in una cornea sferica
a) Rappresentazione schematica della clessidra in una cornea sferica
b) Rappresentazione schematica in caso di asfericità e = 0.
Figura 28.
Cornea prolata: appiattimento periferico con eccentricità positiva. Clessidra evidente sul meridiano più curvo.
Figura 29.
Cornea oblata: incurvamento periferico (post-chirurgico) con eccentricità e<0 (oppure Q>0). Clessidra evidente sul meridiano più piatto.
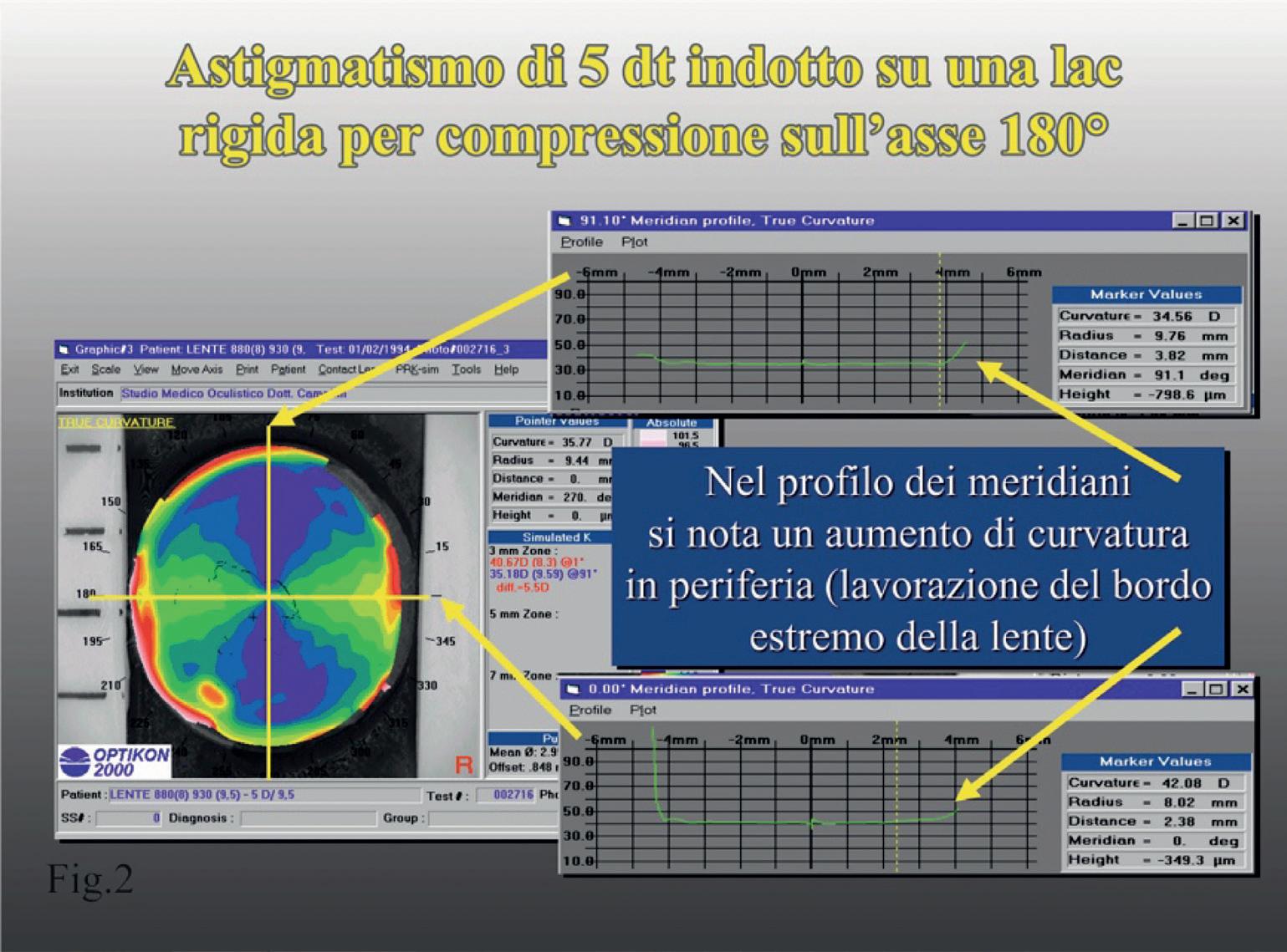
ca, in quanto costruita tale, e non appiattendosi in periferia, non c’è alcuna variazione di curvatura in periferia (i meridiani mostrano la stessa curvatura in ogni punto tranne l’aumento in estrema periferia per la levigatura periferica) e non è presente alcun arrotondamento della clessidra sul meridiano ad asse 180° (in questo caso il più curvo). L’astigmatismo si presenta quindi con due sezioni ortogonali a 90° di
forma triangolare e non è presente l’arrotondamento periferico che si osserva in un occhio normale che ha un profilo asferico. Dall’analisi dell’arrotondamento della clessidra astigmatica si può anche dedurre che, ad un maggiore arrotondamento periferico corrisponde un aumento dell’asfericità corneale, ovvero la cornea si appiattisce maggiormente in periferia.
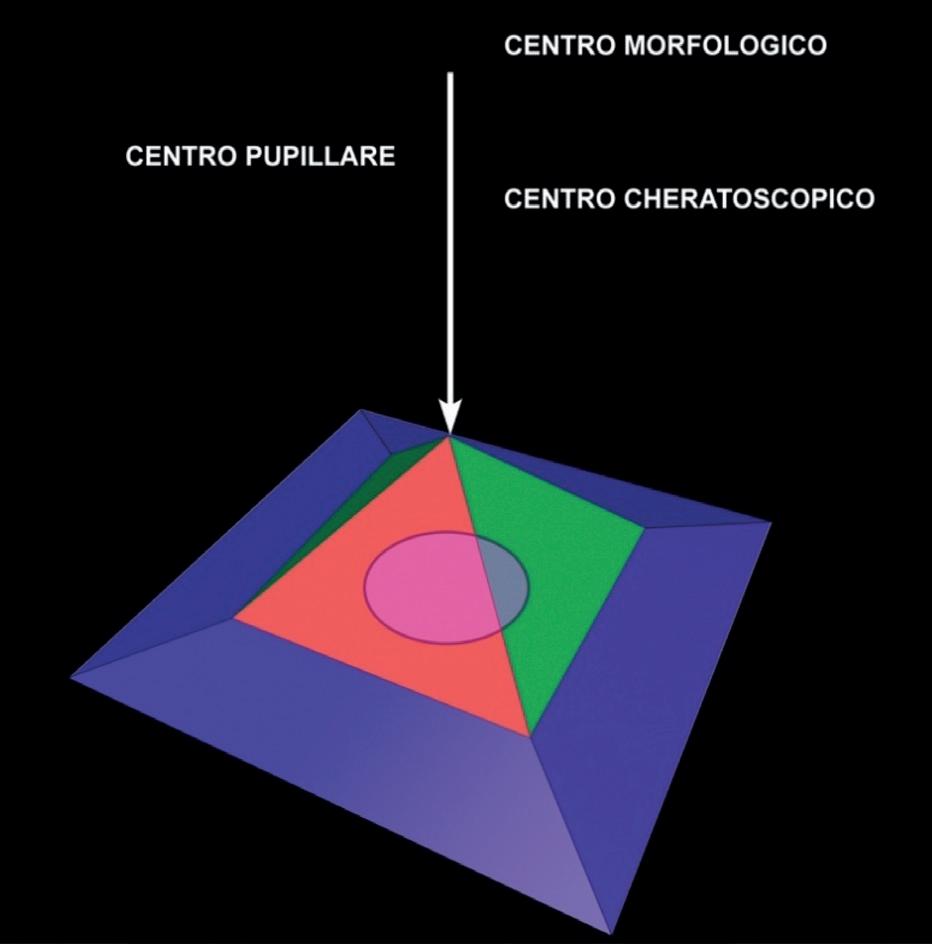
Centri di curvatura
Nello studio topografico dobbiamo analizzare la posizione della pupilla ed i centri di riferimento. Questi sono il centro pupillare, il centro di fissazione ed il centro morfologico che, generalmente, non sono coincidenti.
Il centro pupillare è individuabile sulla mappa come il centro della proiezione della pupilla. Il centro di fis-
sazione o centro cheratoscopico è il centro di analisi e corrisponde al centro degli anelli proiettati sulla cornea, sul quale si basa la ricostruzione topografica. Il centro morfologico corrisponde al punto di incrocio del meridiano più curvo con il meridiano più piatto e corrisponde all’apice fisico della cornea (figura 32).
Centraggio dell’astigmatismo
Il centraggio dell’astigmatismo è fondamentale nella pratica chirurgica. Un trattamento chirurgico decentrato morfologicamente, lascerà un residuo con rotazione dell’asse.
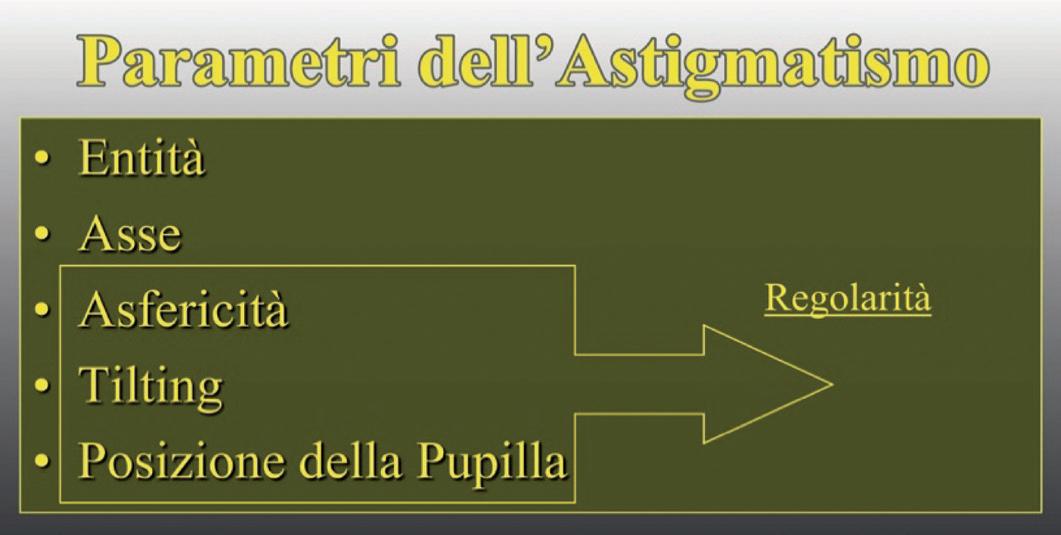
Parametri dell’astigmatismo
I parametri forniti dal cheratoscopio permettono di inquadrare l’astigmatismo e sono entità, asse, asfericità, tilting e posizione della pupilla (tabella 1).
L’entità e l’asse dell’astigmatismo si ricavano anche dall’oftalmometria. La regolarità dell’astigmatismo si deduce dall’analisi di tre parametri: asfericità, tilting e posizione della pupilla.
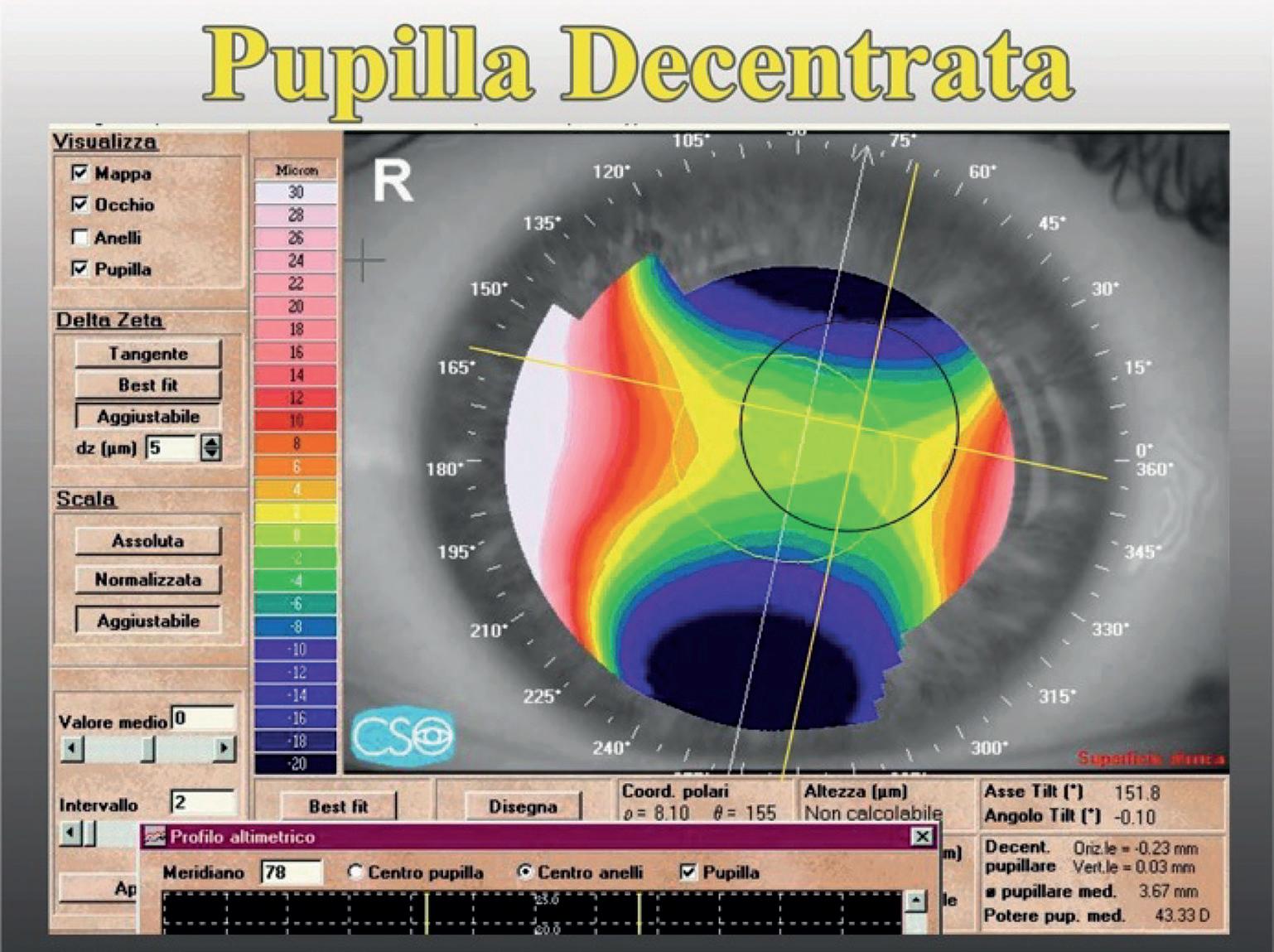
Decentramento pupillare
L’analisi della posizione della pupilla riveste un ruolo fondamentale nella programmazione chirurgica, infatti, in presenza di un decentramento pupillare, deve essere effettuato un trattamento customizzato.
Normalmente le pupille sono lievemente decentrate supero-nasalmente; tale decentramento è più evi-
dente negli occhi ipermetropi e rappresenta l’angolo Kappa (distanza fra centro pupillare e centro di fissazione).
Nel caso di figura 33 è rappresentata la topografia di un astigmatismo ipermetropico con mappa altimetrica. Le zone blu corrispondono ai poli di incurvamento ed è presente un’asimmetria di tali poli (il superiore risulta più accentuato). La circonferenza gialla corrisponde alla pupilla rilevata.
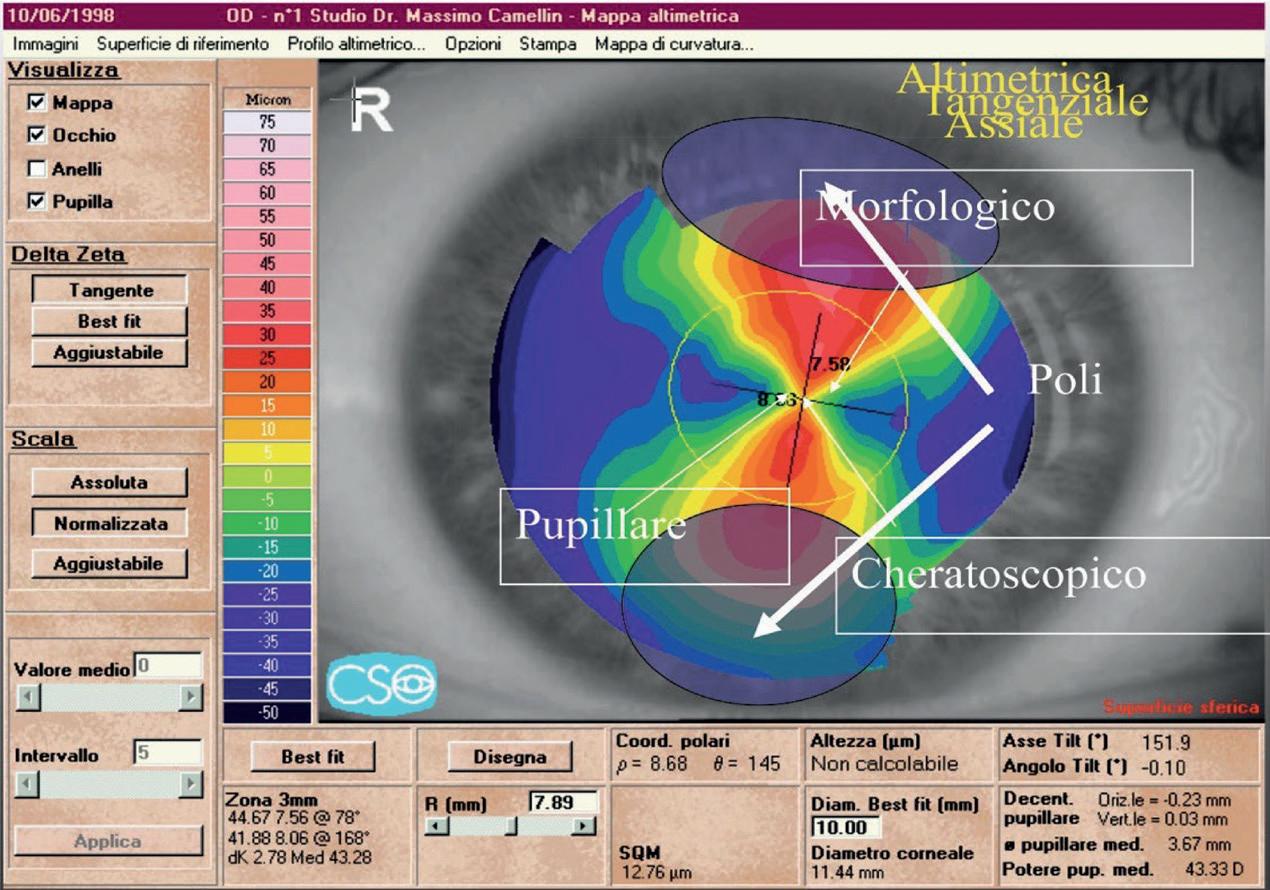
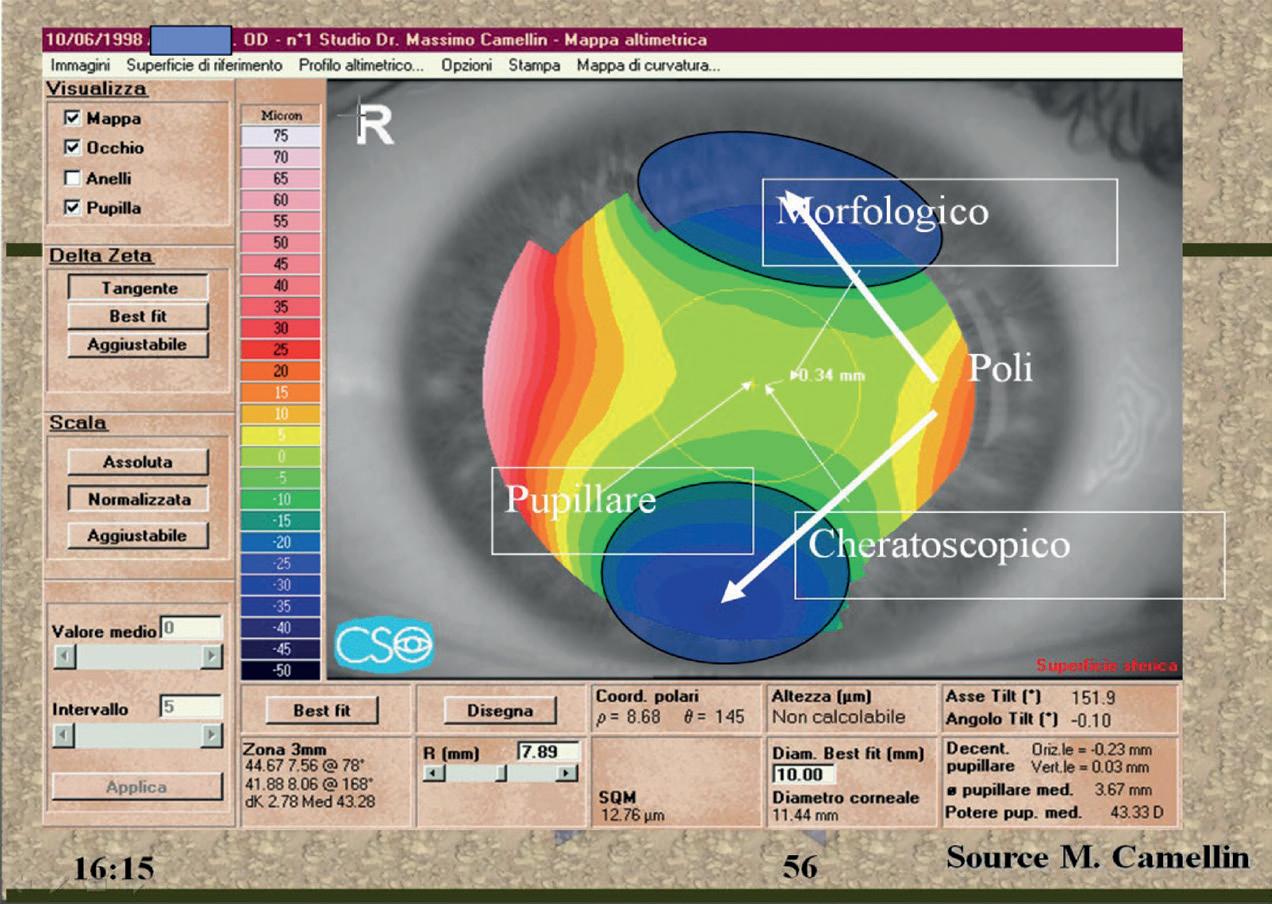
Per analizzare gli effetti del decentramento pupillare è stata ipotizzata (arbitrariamente) una pupilla decentrata supero-nasalmente che corrisponde, nella topografia di figura 33, alla circonferenza di colore nero.
La figura 34 mostra la rappresentazione schematica del caso precedente ed evidenzia come il centro pupillare (dell’ipotetica pupilla decentrata), il centro morfologico ed il centro cheratoscopico non siano coincidenti.
Vediamo adesso un altro caso elaborato con algoritmo tangenziale. I poli di incurvamento sono rappresentati dalle zone rosse della clessidra ed i tre centri sono
chiaramente identificati (figura 35). Il centro morfologico si ricava dalla mappa altimetrica (figura 35 b). Per cercare di comprendere meglio questa analisi osserviamo nuovamente l’astigmatismo ipermetropico della figura 33 nel caso di pupilla centrata (circonferenza pupillare gialla) e di ipotetica pupilla decentrata (circonferenza pupillare nera).
In presenza di pupilla centrata come già detto, il centro pupillare, il centro morfologico ed il centro cheratoscopico sono coincidenti.
Seguirà nei prossimi numeri.
Boswellia e.s. titolato
Quercetina da Sophora japonica L. ( os)
Olivo (Olea europaea L., folium) es. tit. 30%
di cui acido oleanolico
Vitamina D3
Vitamina B12
* Valori Nutritivi di Riferimento ai sensi del Reg. UE 1169/2011



In omaggio il kit essenziale per la gestione della presbiopia
Il kit contiene:
Manuale “La compensazione della presbiopia con lenti progressive: oftalmiche e a contatto”
Opuscolo “Le principali cause di perdita della vista”
Opuscolo “Lenti Progressive: vedere bene, a ogni distanza”
Ricettario
Modulo di accompagnamento al medico oculista
Scopri di più su
www.osservatoriopresbiopia.com info@fgeditore.it

giornale italiano di
approfondimenti in collaborazione con le Aziende del settore
Dal 2019, MYOGA, l’unico design italiano di lente free-form dedicata al controllo della miopia, si è affermata come riferimento nella gestione della progressione miopica. Sviluppata dal Centro Studi di Dai Optical, MYOGA combina precisione ottica e conoscenze cliniche per controllare il defocus periferico, rallentare la progressione della miopia e garantire un elevato comfort visivo.
Con oltre 80.000 soluzioni vendute a livello globale, MYOGA si distingue per affidabilità e versatilità, risultando efficace su diverse prescrizioni e fasce d’età.
Evidenze cliniche
Gli studi scientifici hanno dimostrato come MYOGA raggiunga un alto controllo della progressione miopica, con risultati in linea con i leader di mercato.
• Riduzione della progressione miopica (SER): 63,5% in 12 mesi (Akagün & Altıparmak, 2025)
• Riduzione dell’allungamento assiale (AL): 67,9% in 12 mesi (Akagün & Altıparmak, 2025)

I dati relativi alle riduzioni sono stati calcolati con riferimento al gruppo di controllo.
Questi risultati sono particolarmente rilevanti perché il controllo dell’allungamento assiale, e quindi della crescita del bulbo oculare, è riconosciuto dalla comunità scientifica come un fattore chiave per ridurre il rischio futuro di sviluppare patologie retiniche gravi. Questo è stato sottolineato nei rapporti pubblicati dall’International Myopia Institute (IMI) e dall’Organizzazione Mondiale della Sanità (OMS) nel trattato The Impact of Myopia and High Myopia (2015).
Perché scegliere MYOGA
• Design basato su evidenze cliniche: efficace nel rallentare la progressione miopica
• Controllo dell’allungamento assiale: riduce il rischio di complicanze retiniche future
• Comfort e adattamento visivo ottimizzati
• Affidabilità riconosciuta da professionisti e pazienti in Italia e nel mondo.
MYOGA unisce innovazione, ricerca e risultati comprovati, offrendo agli ottici una soluzione concreta per affrontare una delle sfide più rilevanti della moderna cura della vista.
Bibliografia
– Akagün, N. & Altıparmak, U.E., 2025. Myopi-X lenses vs. low-dose atropine in myopia control: a Turkish retrospective study. Turkish Journal of Ophthalmology, 55(1), pp.1–5. DOI: 10.4274/tjo.galenos.2024.17971.
– Akagün, N. & Altıparmak, U.E., 2024. Combination therapy with Atropine 0.05% and Myopi-X® glasses: Is it effective in myopia control? Turkish Journal of Ophthalmology. DOI: 10.4274/tjo.galenos.2024.17971.



Rodenstock MyCon® con tecnologia HAPD™: per una visione migliore oggi, per il benessere visivo domani
La miopia infantile è in forte aumento in tutto il mondo. Un trend che preoccupa e che trova origine in abitudini visive sempre più “da vicino”: ore su tablet, smartphone, libri, schermi. La domanda che ogni professionista della visione si pone è una: come possiamo agire oggi per proteggere la visione dei nostri piccoli nel lungo periodo?
La risposta di Rodenstock è chiara, concreta, clinica-
mente testata: le lenti MyCon® e MyCon®2, progettate specificamente per il controllo attivo della miopia nei bambini, grazie alla comprovata tecnologia HAPD™ (Horizontal Asymmetrical Peripheral Defocus).
Oltre la correzione: un’azione doppia per contrastare la progressione miopica
A differenza delle lenti monofocali tradizionali, che correggono la visione centrale ma non influiscono sullo sviluppo della miopia, le lenti MyCon® uniscono correzione e controllo.

Grazie al design innovativo con zone periferiche di defocus asimmetrico, la luce viene gestita in modo tale da ridurre lo stimolo all’allungamento del bulbo oculare – uno dei principali responsabili della progressione miopica.
• Visione nitida al centro a favore del comfort visivo del bambino
• Controllo miopico mirato in periferia
• Tecnologia testata e consolidata sul campo.
Un doppio approccio: correzione e controllo
Le lenti monofocali tradizionali, pur correggendo la visione centrale, possono far convergere la luce periferica dietro la retina. In alcuni bambini, questo stimola l’occhio a crescere ulteriormente3, aggravando la miopia.
Le lenti MyCon® si basano su una tecnologia validata da studi a lungo termine. In uno studio clinico europeo, è stata osservata una riduzione media del 40% della progressione miopica nei bambini tra i 6 e i 14 anni4
Dati ancora più recenti, raccolti in Spagna nell’ambito di un programma PMPF (Post-Market Performance Follow-up), confermano e superano questi risultati2:
Riduzione della progressione miopica (SER): tra il 47% e il 64%
Riduzione dell’allungamento assiale: fino al 55%
Campione: 158 bambini – Età: 6-14 anni – Durata: 12 mesi
Una lente pensata per la vita reale dei bambini
Con le lenti MyCon® e MyCon® 2, i giovani portatori possono affrontare ogni momento della giornata con serenità: a scuola, nel tempo libero, all’aperto.
• Design sottile e leggero: estetica gradevole, massima compatibilità con ogni montatura
• Facile adattamento: comfort visivo fin da subito
• Opzioni versatili: disponibili anche fotocromatiche, vista-sole e polarizzate
• Adatte dai 6 ai 14 anni.
In particolare, MyCon® 2 rappresenta un'evoluzione ancora più personalizzata: le lenti vengono calcolate in base a ai parametri della MONTATURA in posizione d'uso so, per prestazioni visive ancora più confortevoli e maggiore libertà nella scelta della montatura.
Perché proporre MyCon® ai genitori oggi? È una soluzione proattiva che va oltre la semplice correzione.
È un investimento nel benessere visivo dei bambini.
È un supporto concreto nella prevenzione di patologie oculari future legate all’allungamento assiale.
Con Rodenstock MyCon®, offri ai tuoi piccoli molto più di una lente: offri loro un futuro benessere visivo più sano.
Bibliografia
1. Brennan, Noel A., et al. “Efficacy in myopia control.” Progress in retinal and eye research 83 (2021): 100923.
2. Rodenstock. Rodenstock MyCon White Paper Compendium. 2025. (https://www.rodenstock-pro.com/com/mycon-whitepaper)
3. Tabernero J, Vazquez D, Seidemann A, Uttenweiler D, Schaeffel F. (2009). Effects of myopic spectacle correction and radial refractive gradient spectacles on peripheral refraction. Vision Res. 2009
4. Tarutta EP, Proskurina OV, Tarasova NA, Milash SV, Markosyan GA. (2019). Long-term results of perifocal defocus spectacle lens correction in children with progressive myopia. Vestn Oftalmol. 2019;135(5):4653
* One optician provided both AL and SER data, the other provided SER data only
Il corpo vitreo è fisiologicamente ricco di antiossidanti, i quali sono fondamentali per preservarne la delicata struttura e quindi la normale trasparenza. Con il tempo e in condizioni patologiche, può però subire danni ossidativi con tre modalità tra loro correlate:
1. Formazione di AGE (prodotti finali di glicazione avanzata).
2. Disfunzione degli ialociti. 3. Foto-ossidazione.
Formazione di AGE
Gli AGE generano legami crociati anomali tra le fibrille di collagene, provocando la dissociazione del collagene stesso dall’acido ialuronico. Tutto questo comporta una destabilizzazione del vitreo.
Gli AGE possono anche attivare uno specifico recettore di membrana, presente su cellule immunitarie e nervose, promuovendo la produzione di agenti ossidanti e infiammatori che vanno ad alterare ulteriormente l’architettura vitreale.

Gli ialociti sono cellule simil-macrofagi, specifiche del corpo vitreo e adatte alle sue esigenze sia in fase di sviluppo che in fase di invecchiamento. Producono collagene e acido ialuronico, e sono molto importanti per la normale trasparenza vitreale.
Tuttavia, in presenza di forte stress ossidativo, possono esprimere alti livelli di ialuronidasi - enzima responsabile della degradazione dell’acido ialuronico - contribuendo così alla liquefazione del gel vitreale.
Il corpo vitreo è quotidianamente esposto a rischio di danno foto-ossidativo: da un lato non può sottrarsi all’arrivo di luce ad alta energia, come quella blu e ultravioletta; dall’altro, essendo il numero degli ialociti relativamente basso, può non avere un ritmo metabolico tale da consumare efficientemente l’ossigeno che vi arriva, il quale può generare così radicali liberi.
VITREOLISINA PLUS presenta una formulazione dall’altissimo potere antiossidante, sviluppata per contrastare specificatamente lo stress ossidativo nel corpo vitreo. Il prodotto si distingue, infatti, per essere stato formulato secondo il fisiologico assetto antiossidante vitreale.
VITREOLISINA PLUS contiene Selenio, Zinco, Vitamina C e Vitamina E; enzimi antiossidanti come Superossido Dismutasi (SOD) e Bromelina; aminoacidi come L-Metionina, L- Serina e N-Acetilcisteina, che aumentano la sintesi endogena del Glutatione; carnosina, che contrasta la formazione degli AGE; acido ialuronico che può stimolare, attraverso l’asse intestino-occhio, la sintesi del suo corrispettivo endogeno.
VITREOLISINA PLUS costituisce un valido sostegno al naturale sistema difensivo del corpo vitreo in tutte le alterazioni vitreali.


Rodenstock MyCon ®
Corregge la miopia e ne rallenta la progressione miopica. Facili da usare, amiche dei bambini.

CREDITI ECM
Presidente
Marcella Nebbioso (Roma)
Vice presidente
Emilia Gallo (Catania)
Segretario scientifico
Maria Rosaria Franco (Lecce)
Consiglieri
Federico Bartolomei (Bologna)
Rocco Di Lorenzo (Palermo)
Luigi Donato (Messina)
Federica Franzone (Torino)
Paolo Giuseppe Limoli (Milano)
Marco Ulisse Morales (Padova)
Erika Rigoni (Latina)
Sergio Zaccaria Scalinci (Bologna)
Lucia Scorolli (Bologna)
Gianfrancesco Villani (Verona)
Enzo Maria Vingolo (Roma)
Tutti i partecipanti verranno omaggiati di un percorso FAD

Segreteria organizzativa Fabiano Gruppo Editoriale
Reg. Rivelle 7/F - 14050 Moasca AT Tel. 0141 170 6694 - Fax 0141 856 013
a.manassero@fgeditore.it


La sua efficacia nel rallentare la progressione miopica è sostenuta da oltre 90 pubblicazioni scientifiche e riconosciuta dai Professionisti della Visione È ideale per tutte le esigenze dei giovani miopi anche in esterni con l’esclusiva versione fotocromatica Chamaleon
Continuiamo ad agire insieme, prendendoci cura del benessere visivo dei giovani con MiYOSMART.
Per informazioni, contatta il tuo Medical Relations Specialist o scrivi a oculisti@hoya.it miyosmart.it - Seguici su: Hoya Lens Italia
Per la lista completa di indicazioni, controindicazioni e avvertenze fare riferimento alle istruzioni per l’uso o ai manuali di istruzioni d’uso dei rispettivi prodotti. Visitate il sito Alcon https://ifu.alcon.com/ per importanti informazioni di prodotto. *When compared with Constellation and Centurion Vision Systems. Based on bench testing. 1. Alcon Data on File, 2024. [REF-24644]; 2. Alcon Data on File, 2024. [REF-24379] 3. Alcon Data on File, 2024. [REF-24576]; 4. Alcon Data on File, 2024 [REF-24615]
©2025 Alcon Inc. 09/25 IT-UVC-2500101


