
14 minute read
JAARPLAN
EENHEIDWEEK LES
LESINHOUD
KWARTAAL 1
1 BASIESE LANDBOUCHEMIE
1 1 Inleiding tot basiese chemie 2 2 Chemiese binding 3 3 Anorganiese en organiese verbindings 4 4 Alkane en alkohole 5 5 Vetsure, biomolekules en lipiede/vette 6 6 Proteïene 7 7 Koolhidrate
2 GRONDKUNDE
8 8 Grondtekstuur 9 9 Grondstruktuur 10 10 Grondkleur en grondporieë
KWARTAAL 2
2 GRONDKUNDE
11 11 Grondlug 12 12 Grondwater 13 13 Grondtemperatuur 14 14 Grondmorfologie 15 15 Grondklassifikasie 16 16 Grondkolloïede en grondsuurheid 17 17 Grondalkaliniteit en -saliniteit
TEIKEN- DATUM
EENHEIDWEEK LES LESINHOUD
2 GRONDKUNDE KWARTAAL 3
18 18 Organiese materiaal: Lewende organiese materiaal 19 19 Organiese materiaal: Nie-lewende organiese materiaal
3 PLANTESTUDIES
20 20 Plantvoeding en fotosintese 21 21 Water en voedingstowwe 22 22 Mineraalvoeding: Makro- en mikroelemente 23 23 Plantvoedingstofopname en -ontleding 24 24 Organiese en anorganiese bemesting
25 25
Organiese bemesting en bemestingspraktyke 26 26 Plantreproduksie: Geslagtelike voortplanting en bestuiwing
27 27 Bevrugting en afspening Sade en vrugset Ontkieming van saad
KWARTAAL 4
3 PLANTESTUDIES
28 28 Plantreproduksie: Ongeslagtelike voortplanting 29 29 Plantverbetering en biotegnologie 30 30 Onkruidbeheer en -bestuur 31 31 Plantsiektes/-plae en beheer
4 OPTIMALE HULPBRONBENUTTING
32 32 Bodemopnames en beplanning 32 33 Waterverbruik en besproeiing
33 34
Gronddreineringsisteme, grondbewerking en gewasrotasie 34 35 Kweekhuis, hidroponika en waterkultuur
TEIKEN- DATUM
1Basiese landbouchemie

Les 1: Inleiding tot basiese chemie
LEERDOELWITTE
Nadat jy hierdie les voltooi het, moet jy die volgende kan doen: 1. Die volgende terminologie definieer: materie, atome, molekules, Periodieke Tabel, isotope, elemente, verbindings en mengsels. 2. Die verskille tussen elemente, verbindings en mengsels identifiseer (met relevante voorbeelde). 3. Die Periodieke Tabel van elemente interpreteer. 4. Tussen sure en basisse kan onderskei. 5. Die algemene struktuur van ’n atoom kan teken en die verskillende deeltjies van ’n atoom en sy funksie ken. 6. Die hooftipes van deeltjies van ’n atoom asook hulle onderskeie ladings identifiseer. 7. Die verwantskap tussen atomiese nommers en die aantal deeltjies in die kern beskryf. 8. Die vorming van ione identifiseer. 9. Die rangskikking van elektrone rondom die kern en die valensie aandui.
Aangepas uit Parker & Hart, Wizard of Id
Landbouchemikusse werk saam met die Departement van Landbou, die Omgewingsbeskermingsagentskap, die Voedsel- en Dwelmadministrasie, of in die privaat sektor. Landbouchemikusse ontwikkel kunsmis, insekdoders en onkruiddoders vir grootskaalse opbrengsproduksie. Hulle moet ook monitor hoe dié produkte gebruik word en wat die impak daarvan op die natuur is. Voedingaanvullings word ontwikkel om die produktiwiteit van vleis- en suiwelkuddes te verhoog. Chemie is deel van alles wat in landbou gedoen word. Dit is dus baie belangrik om landbouchemie goed te verstaan.

INLEIDING
Dié afdeling begin met chemiese ontleding in landbou en lei dan spesifiek na grond. Dit is belangrik om deur die loop van die kwartaal die breër prentjie in gedagte te hou. Elke struktuur word tot in die kleinste detail afgebreek en dan weer saamgestel. Chemie is die studie van materie; die eienskappe, hoe en waarom stowwe kombineer of skei om ander stowwe te vorm; en hoe stowwe met energie reageer.
1. Belangrike terminologie
DEFINIEER
Materie: Materie is enigiets met massa en wat spasie opneem. Materie het dus massa en volume. Atome en molekules bestaan alles uit materie. Atome: Atome is die kleinste boublokke van materie wat nie afgebreek kan word in kleiner deeltjies nie. Alles om ons bestaan uit atome. Molekules: Molekules is ’n natuurlike groep van twee of meer atome wat saamgebind is, en wat sterk genoeg is om as ’n aparte eenheid in ’n chemiese reaksie op te tree. Periodieke Tabel: Die Periodieke Tabel is ’n rangskikking van chemiese elemente in tabelvorm. Elemente word volgens hulle atomiese getal (aantal protone in die kern) en herhalende chemiese eienskappe rangskik. Dit word ook volgens chemiese en fisiese eienskappe rangskik. Isotope: Atome van ’n element met dieselfde aantal protone in die kern, of dieselfde atoomgetal, maar met verskillende hoeveelhede neutrone en dus verskillende relatiewe atomiese massas. Elemente: Elemente bevat slegs een soort atoom en kan dus nie op ’n chemiese wyse afgebreek word in kleiner stowwe nie. ’n Element is ’n suiwer stof. Verbindings: ’n Verbinding word gevorm wanneer twee of meer elemente chemies aan mekaar in ’n vaste verhouding verbind. Mengsels: Suiwer homogene mengsels van stowwe, wat teenwoordig is in dieselfde fase en wat bestaan uit twee of meer stowwe in dieselfde fase. Oplossings: Oplossings kan beskryf word as suiwer homogene mengsels van stowwe wat teenwoordig is in dieselfde fase. Suspensies: Suspensies is heterogene mengsels wat soliede deeltjies bevat wat groot genoeg is vir sedimentasie. Die deeltjies moet gewoonlik groter wees as een mikrometer. Kolloïede: ’n Kolloïed is ’n heterogene mengsel waarin ’n stof verdeel word in baie klein deeltjies (bekend as kolloïede dele) en regdeur ’n tweede stof versprei word. Suiwer stowwe: Dit kan elemente of verbindings wees en kan konstante komposisies hê, wat beteken dat die stowwe dieselfde is, waar ook al dit gevind word.
1.1 Materie
Materie is iets wat massa het en ruimte beslaan. Materie het dus massa en volume. Atome en molekules is saamgestel uit materie.
Ons fisiese wêreld word uit materie gevorm; ons ervaar dit as verskeie soorte materiale wat in die volgende drie fases (ook bekend as die toestand van materie) bestaan: • Vaste stowwe, bv. klip. • ’n Vaste stof het ’n presiese vorm en volume; dit is vormvas. • Vloeistowwe, bv. water. • ’n Vloeistof het ’n bepaalde volume onafhanklik van sy houer, maar het nie ’n spesifieke vorm nie. • Gasse, bv. lug. • ’n Gas (ook bekend as ’n damp) het geen vaste volume of vorm nie, maar pas aan by die volume en vorm van sy houer.
Klassifikasie van materie
Materie word geklassifiseer in terme van die fase en die samestelling daarvan.
VIR DIE NUUSKIERIGES
Boor is ’n belangrike spoorelement vir die groei van gewasse, daarom sal ’n saaiboer wil weet wat die boorvlakke is. Hy sal monsters van regoor die plaas moet neem, ’n chemiese ontleding van al die monsters moet doen, en ’n statistiese ontleding van die data moet doen aangesien die grond heterogeen is, onder ’n mikroskoop én oor die oppervlak van die plaas. Boorvlakke sal dus verskil van saailand tot saailand.
Indien die boer egter die pH van sy swembad wil weet, is net ’n enkele monster nodig omdat hy kan aanvaar dat die swembad homogeen is.
Suiwer stowwe
’n Suiwer stof is materie met ’n vaste samestelling en kenmerkende eienskappe, bv. water en tafelsout (natriumchloried), die primêre komponente van leksout (vir beeste), is suiwer stowwe.
Suiwer stowwe kan geklassifiseer word as elemente of verbindings.

Elemente
• Elemente is suiwer stowwe wat uit slegs een soort atoom bestaan. • Hulle kan nie chemies in eenvoudiger stowwe verdeel word nie. • Die kleinste deeltjie van ’n element wat op sy eie kan bestaan, is ’n atoom. • Al die elemente is volgens hulle eienskappe op die Periodieke Tabel gerangskik. • Voorbeelde: fosfor (P), kalium (K), en suurstof (O2). • Suurstof is ’n diatomiese element (d.w.s. dit bestaan natuurlik uit twee atome wat ’n molekule vorm), maar CO2 (meer as een element) is ’n samestelling.
Wat is ’n diatomiese element?
• Dit is ’n molekule van dieselfde atoom. • Sommige elemente kan nie afsonderlik bestaan nie; selfs wanneer hulle geïsoleerd is van enige ander soort atoom, sal hulle natuurlik kombineer met atome van dieselfde element ten einde stabiel te wees. • Voorbeelde: waterstof (H2), stikstof (N2), suurstof (O2), fluoor (F2), chloor (CI2), broom (Br2) en jodium (I2). • Die elemente is diatomies slegs wanneer dit alleen is, nie wanneer dit chemies gebind is met ander atome nie.
Verbindings
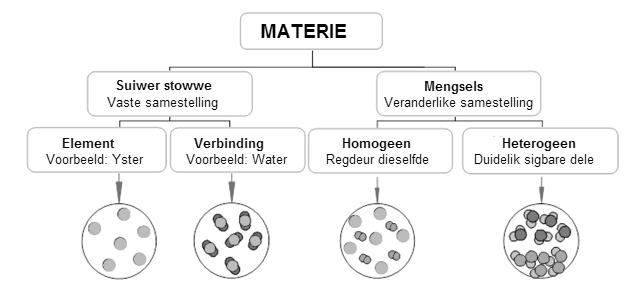
• Verbindings is stowwe wat saamgestel is uit meer as een element, dus meer as een soort atoom. • Dit maak nie saak hoe die verbinding gemaak word nie, dit sal altyd uit dieselfde elemente in dieselfde massaverhouding bestaan. • Voorbeeld: Kunsmis, oftewel kalsiumnitraat of Ca (NO3)2 word as volg voorgestel:
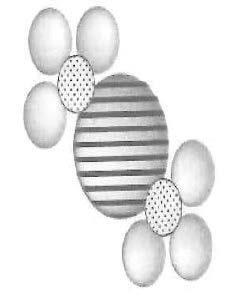
• Hierdie verbinding sal altyd uit 1 Ca (kalsium-ioon), 2 N (stikstof-ione) en 6 O (suurstof-ione) bestaan. • Die kleinste deeltjie van ’n verbinding wat op sy eie kan bestaan, kan ’n molekule of ’n ioon wees. • Verbindings word gevorm wanneer die atome van twee of meer elemente chemies en nie meganies nie, kombineer. Voorbeeld: H2O (watermolekule):

• Verbindings kan ontbind (afgebreek) word in elemente deur eenvoudige chemiese reaksies. Die watermolekule hierbo kan afgebreek word in waterstof en suurstof deur middel van elektrolise. • Ander voorbeelde: natriumchloried (NaCl), kaliumsulfaat (K2SO4) en natriumbikarbonaat (NaCO3).
Mengsels
Meeste van die materie wat ons in landbou teëkom bestaan uit mengsels van verskillende stowwe. Mengsels is kombinasies van twee of meer stowwe waarin elke stof sy eie chemiese identiteit, en dus sy eie eienskappe, behou. • Mengsels is nie suiwer stowwe nie en bestaan uit twee of meer stowwe wat meganies gemeng word. • Komponente is nie in ’n vaste verhouding nie en wissel van monster tot monster. • Die komponente behou hulle eie eienskappe. • Die komponente van ’n mengsel kan geskei word deur meganiese (fisiese) metodes soos filtrasie, diffusie en distillasie. • Mengsels kan homogeen of heterogeen wees. • Voorbeelde: Lug is ’n mengsel van die gasse stikstof, suurstof en koolstofdioksied.
Verskille tussen homogene en heterogene mengsels
HOMOGENE MENGSELS HETEROGENE MENGSELS
Stowwe in die mengsel is in dieselfde fase, bv. lug (N2 (gas), O2 (gas), CO2 (gas)).
Komponente kan nie onderskei word van mekaar nie, bv. soutwater (oplossing van sout in water)
Die mengsels het ’n eenvormige samestelling, bv. koeldrank (konsentraat in water).
Mengsels wat ook oplossings genoem word, bv. Gasagtige oplossing: lug ’n Mengsel van twee of meer gasse. Gas-vloeistofoplossing: sodawater ’n Gas opgelos in water. Vloeistofoplossing: water en metanol ’n Mengsel van twee of meer mengbare vloeistowwe. Vaste oplossing: seewater ’n Vaste stof heeltemal opgelos in ’n vloeistof. Stowwe in die mengsel is in verskillende fases, bv. modder (sand in water) Maklik onderskeibaar, bv. voermengsel (mielies, melassestroop, lusern en sojaboon-oliekoek) Die mengsels het nie ’n eenvormige samestelling nie, bv. voermengsel (droë melassepoeier, lusern en growwe sout) Is nie oplossings nie maar eerder suspensies, bv.: Modder (sand in water) Water en olie Saamgesmelte rots
Heterogene mengsels wat baie belangrik is in landbou, is kolloïde.
Kolloïde los nie op in water om ’n oplossing te vorm nie, maar vorm eerder ’n mengsel met water, bekend as ’n suspensie. Dit is ook bekend as kolloïde dispersies, omdat die stowwe verspreid bly en nie afsak na die bodem van die houer nie. (Sien eenheid 2 les 16.)
Kyk na die volgende YouTube-video:
www.khanacademy.org/science/chemistry/states-of-matter-and-intermolecular-forces/mixtures-andsolutions/v/suspensions-colloids-and-solutions
1.2 Atome
’n Atoom is die basiese eenheid van ’n element en is ’n vorm van materie. Dit kan nie op ’n chemiese wyse verder afgebreek word nie.
EN:
• Enige element wat op die Periodieke Tabel gelys is, bestaan uit atome. • ’n Tipiese atoom bestaan uit protone, neutrone en elektrone. • Die atome van ’n spesifieke element is identies in grootte, massa (behalwe isotope) en chemiese eienskappe. • Die atome van verskillende elemente verskil van mekaar. • Atome kan slegs optree as ’n geheel (onverdeeld) en kan nie geskep of vernietig word nie.
1.3 Molekules
’n Molekuul is die kleinste deeltjie van ’n stof wat die fisiese en chemiese karaktereienskappe van daardie stof vertoon, en is ’n neutrale groepering van twee of meer atome wat saamgebind is. Dit is sterk genoeg om as ’n aparte eenheid in ’n chemiese reaksie op te tree.
Voorbeelde:
Suurstofatoom + suurstofatoom suurstofmolekule:

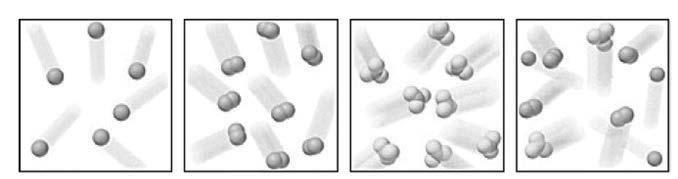
Atome van ’n element, Molekules van ’n Molekules van ’n Mengsel van bv. neon (Ne) element, bv. verbinding, bv. gasse, bv. Ne, O2 suurstof (O2) ammoniak (NH3) en NH3
1.4 Die Periodieke Tabel
Alhoewel voorgangers bestaan, word erkenning in die algemeen aan Dmitri Mendeleev gegee vir die eerste wyd erkende Periodieke Tabel wat in 1869 gepubliseer is. Hy het sy tabel ontwikkel om die periodieke tendense in die samestelling van die elemente wat op daardie stadium bekend was, te illustreer. Die Periodieke Tabel is ’n klassifiseringstelsel vir al die elemente waaruit materie en stowwe bestaan.
Alle elemente van atoomgetalle 1 (waterstof) tot 118 (ununcotium) is ontdek of na bewering gesintetiseer. Sedert 2014 bestaan die Periodieke Tabel uit 114 bevestigde elemente, insluitend elemente 1 (waterstof) tot 112 (copernicium), 114 (flerovium) en 116 (levermorium). ’n Totaal van 94 elemente kom natuurlik voor, terwyl die oorblywende 20 elemente, van americium tot copernicium, flerovium en livermorium, slegs voorkom wanneer dit in ’n laboratorium gesintetiseer word.
Elke element beskik oor ’n unieke naam en atoomgetal verteenwoordigend van die aantal protone in die kern. Ons kan aan elke naam dink as ’n unieke ‘etiket’ wat gebruik word om ’n element te identifiseer. Daar is twee ander unieke etikette wat gebruik kan word om elemente te identifiseer. Dit is die chemiese simbool en massa getal. Ons leer meer hieroor in die volgende afdeling. Elke element beskik oor sekere eienskappe, en ons sal sien dat elemente met dieselfde kenmerke saamgegroepeer kan word. (’n Volkleur-weergawe is op my.Impaq beskikbaar en in Bylae B)
1.5 Isotope
Nie alle atome van ’n element is identies nie – atome van dieselfde element kan ’n verskillende aantal neutrone hê. Dié verskillende weergawes van dieselfde element word isotope genoem. Atome en elemente bestaan uit protone, neutrone en elektrone.
Die kern bestaan uit protone en neutrone – die elektrone omring die kern soos aangedui in die illustrasie hieronder.

http://www.kyrene.org/cms/lib2/AZ01001083/Centricity/Domain/783/AtomicModel%20Timeline%20directions%20.pdf
• Die totaal van die aantal protone en die aantal neutrone is gelykstaande aan die atoommassa. Daarom: Aantal neutrone = atoommassa – atoomgetal. • Isotope is atome met dieselfde atoomgetal, maar verskillende massagetalle. • Isotope word nooit in die Periodieke Tabel geskei nie, dit is altyd saamgegroepeer onder ’n enkele element. • By elemente sonder stabiele isotope word die atoommassa van die mees stabiele isotope, waar sulke massas gewys word, tussen hakies aangedui. • Voorbeeld 1: Die element koolstof (C) beskik oor drie isotope: C-12, C-13 en
C-14

• Die vorm van koolstof wat die meeste voorkom is C-12, met ’n persentasie van 98,9%. • Voorbeeld 2: Die element waterstof (H) het drie isotope: H-1, H-2 en H-3

http://study.com/academy/lesson/what-are-isotopes-definition-types-examples.html
• Die drie isotope van koolstof sowel as die drie isotope van waterstof het almal dieselfde atoomgetal of aantal protone, maar het verskillende atoommassas. • Wanneer daar na die atoommassas van elemente in die Periodieke Tabel gekyk word, sal jy opmerk dat dit selde ’n heelgetal is; koolstof se atoommassa is byvoorbeeld 12,011. Dit is omdat die atoommassa van koolstof gebaseer is op die gemiddelde atoommassas van die isotope en die voorkoms van elke isotoop. • LET WEL: Die atoomgetal kan aan die bo- of onderkant van die simbool in die SLEUTEL van elke element wees, daarom kan die atoommassa (ook bekend as die relatiewe atoommassa) anders om verskyn. (Sien die Periodieke Tabel in Bylae B)
Kyk na die volgende YouTube-video:
http://study.com/academy/lesson/what-are-isotopes-definition-types-examples.html
GEBRUIKE VAN ISOTOPE IN NAVORSING
Kalsiumisotope word gebruik in kliniese voedingnavorsingstudies om die hoeveelheid en en graad van kalsiumabsorbsie in die liggaam te bepaal.
Ca- 42
Isotope Atoomgetal Atoom- massa Aantal protone
Aantal neutrone
20 42 20 22 Ca- 48 20 48 20 28 Ca soos op die Periodieke Tabel 20 40.08 20 20
Magnesiumisotope word ook gebruik in absorbsiestudies sowel as in navorsing oor hartsiektes.
Isotope Atoomgetal Atoom- massa Aantal protone
Aantal neutrone
Mg- 25
12 25 12 13 Mg- 26 12 26 12 14 Mg soos op die Periodieke Tabel 12 24.31 12 12
ELEMENTE VERBINDINGS MENGSELS
Suiwer stowwe Suiwer stowwe Onsuiwer stowwe
Bestaan slegs uit een soort element ’n Chemiese binding van twee of meer soorte elemente
Bestaan slegs uit een soort atoom Bestaan uit dieselfde elemente in dieselfde massaverhouding.
’n Stof wat nie in kleiner stowwe verdeel kan word nie.
’n Stof wat in kleiner deeltjies verdeel kan word Kan nie verdeel word nie Kan slegs op ’n chemiese wyse verdeel word
Atome besit eie unieke eienskappe van elemente Eienskappe van die samestelling verskil van die eienskappe van die elemente
Kleinste deeltjie is of ’n atoom, of ’n diatomiese element (molekule van dieselfde atoom) Kleinste deeltjie is ’n molekule (kovalente binding) of ’n ioon (ioniese binding)
VOORBEELDE
’n Fisiese kombinasie van twee of meer elemente en/ of verbindings Hoeveelheid stowwe in ’n mengsel kan wissel.
’n Stof wat in kleiner deeltjies verdeel kan word Kan op ’n fisiese wyse verdeel word Stowwe in die mengsel behou hulle unieke eienskappe Deeltjies is volgens die samestelling van die mengsel
Magnesium (Mg), koper (Cu), kalium (K), fosfor (P) Water (H2O), Natriumchloried (NaCI), Koolstofdioksied (CO2) Oplossings: Sout opgelos in water Suspensies: sand in water Kolloïede: Inseksproei Emulsies: Smeermiddels


